Acarizax 12 Sq-Hdm
sp. zn. sukls182552/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
VTento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU ACARIZAX 12 SQ-HDM, perorální lyofilizát
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Standardizovaný alergenový extrakt z roztočů domácího prachu Dermatophagoides pteronyssinus a Dermatophagoides farinae, 12 SQ-HDM* na perorální lyofilizát.
Úplný seznam pomocných látek viz bod 6.1.
*[SQ-HDM je jednotka dávky pro ACARIZAX. SQ je metoda standardizace biologické účinnosti, obsahu hlavního alergenu a komplexity alergenového extraktu. HDM je zkratka pro roztoče domácího prachu (house dust mite)]
3. LÉKOVÁ FORMA
Perorální lyofilizát
Bílý až šedobílý kruhový perorální lyofilizát označený na jedné straně negativním reliéfem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek ACARIZAXje indikován k léčbě dospělých pacientů (18-65 let) s klinickou anamnézou a pozitivním testem citlivosti na roztoče domácího prachu (kožní prick test a/nebo specifické IgE) s nejméně jednou z následujících podmínek:
• Středně závažná až závažná alergická rinitida způsobená roztoči domácího prachu přetrvávající i přes léčbu přípravky ulevujícími od příznaků
• Alergické astma vyvolané roztoči domácího prachu, které není dobře kompenzované inhalačními kortikosteroidy a je spojené s mírnou až závažnou alergickou rinitidou způsobenou roztoči domácího prachu. Před zahájením léčby má být stav pacientova astmatu pečlivě vyhodnocen (viz bod 4.3).
4.2 Dávkování a způsob podání
Dávkování
Doporučená denní dávka pro dospělé je jeden perorální lyofilizát 1x denně (12 SQ-HDM).
Nástup klinického efektu lze očekávat 8-14 týdnů po zahájení léčby. Mezinárodní doporučené postupy uvádí délku léčby alergenovou imunoterapií 3 roky k dosažení modifikace onemocnění. Údaje o účinnosti jsou k dispozici pro 18měsíční léčbu přípravkem ACARIZAX u dospělých; nejsou k dispozici údaje pro 3letou léčbu. Pokud nedojde ke zlepšení během prvního roku, není indikace k pokračování léčby přípravkem ACARIZAX.
Pediatrická populace
Klinická účinnost imunoterapie přípravkem ACARIZAX u dětí a dospívajících mladších 18 let nebyla dosud stanovena. ACARIZAX není určen pro děti a dospívající mladší 18 let. V současnosti dostupné údaje o použití u dětí jsou uvedeny v bodě 5.1.
Starší pacienti
Klinická účinnost imunoterapie přípravkem ACARIZAX u pacientů starších 65 let nebyla dosud stanovena. ACARIZAX není určen pro pacienty starší 65 let (viz bod 5.1).
Způsob podání
Léčba přípravkem ACARIZAX má být zahájena lékaři, kteří mají zkušenost s terapií alergických onemocnění.
Doporučuje se podat první dávku perorálního lyofilizátu pod dohledem lékaře a pacient má být poté monitorován nejméně půl hodiny, aby bylo možné konzultovat a případně léčit jakékoli bezprostřední nežádoucí účinky.
ACARIZAX je perorální lyofilizát. Perorální lyofilizát se má vyjmout z blistru suchými prsty ihned po otevření blistru a vložit pod jazyk, kde se rozpustí.
Asi minutu se nemá polykat. Během následných pěti minut se nemá nic jíst ani pít.
Pokud je léčba přípravkem ACARIZAX přerušena po dobu kratší než 7 dní, může pacient znovu v léčbě pokračovat. Pokud je léčba přípravkem ACARIZAX přerušena po dobu delší než 7 dní, doporučuje se před opětovným zahájením léčby kontaktovat lékaře.
4.3 Kontraindikace
Hypersenzitivita na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Pacienti s FEVi < 70 % z předvídané hodnoty (po přiměřené farmakologické léčbě) na počátku léčby. Pacienti se závažnou exacerbací astmatu v posledních 3 měsících.
Pacienti s astmatem, kteří prodělávají akutní infekci respiračního traktu. Zahájení léčby přípravkem ACARIZAX musí být odloženo do doby úplného vyléčení infekce.
Pacienti s aktivním nebo nekompenzovaným autoimunitním onemocněním, imunodefekty, imunodeficiencí, imunosupresí nebo aktivním maligním nádorovým onemocněním.
Pacienti s těžkým akutním zánětem nebo poraněním v dutině ústní (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Astma je známým rizikovým faktorem vzniku těžkých systémových alergických reakcí.
Pacienti mají být poučeni, že přípravek ACARIZAX není určen k léčbě akutní exacerbace astmatu.
V případě akutní exacerbace astmatu mají být podána krátkodobě působící bronchodilatancia. Pokud krátkodobě působící bronchodilatancia nejsou účinná nebo je třeba více inhalací, než obvykle, pacient musí kontaktovat lékaře.
Pacient musí být poučen, že v případě náhlého zhoršení astmatu je třeba ihned vyhledat lékaře. Přípravek ACARIZAX má být zpočátku používán jako doplňková léčba, nikoli jako náhrada stávající léčby astmatu. Po zahájení léčby přípravkem ACARIZAX se nedoporučuje náhlé přerušení preventivní antiastmatické medikace. Snižování dávek medikace má probíhat postupně pod lékařským dohledem podle doporučených postupů pro léčbu astmatu.
Závažné systémové alergické reakce
Léčba musí být přerušena a okamžitě kontaktován lékař v případě závažných systémových alergických reakcí, závažné exacerbace astmatu, angioedému, potíží s polykáním, dýchacích potížích, změn hlasu, hypotenze nebo pocitu plnosti v hrdle. Nástup systémových příznaků může zahrnovat zrudnutí, svědění, pocit tepla, celkový diskomfort a neklid/úzkost.
Lékem první volby závažné systémové alergické reakce je adrenalin. U pacientů léčených tricyklickými antidepresivy, inhibitory monoaminooxidázy (IMAO) a/nebo inhibitory katechol-O-methyltransferázy (COMT) mohou být účinky adrenalinu zesíleny, s možnými fatálními důsledky. Účinky adrenalinu mohou být snížené u pacientů léčených beta-blokátory.
U pacientů se srdečním onemocněním může být riziko systémových alergických reakcí zvýšené. Klinické zkušenosti s léčbou přípravkem ACARIZAX u pacientů se srdečním onemocněním jsou omezené.
Toto je nutno vzít v úvahu před zahájením alergické imunoterapie.
Zahájení léčby přípravkem ACARIZAX má být pečlivě zváženo u pacientů, kteří v minulosti prodělali systémovou alergickou reakci po subkutánním podání imunoterapeutického přípravku s obsahem alergenu roztočů domácího prachu, a k dispozici mají být prostředky k léčbě případných reakcí. Toto je založeno na postmarketingových zkušenostech obdobného přípravku ve formě sublingválních tablet určených k imunoterapii alergie na travní pyly. Tyto zkušenosti naznačují, že riziko závažných systémových reakcí může být zvýšeno u pacientů, u kterých se v minulosti rozvinula závažná systémová alergická reakce po subkutánní imunoterapii travními pyly.
Zánět v ústní dutině
U pacientů se závažným zánětlivým onemocněním v ústní dutině (např. orální lichen planus, ulcerace nebo těžká ústní mykóza), s poraněním v ústní dutině nebo po chirurgickém zákroku v ústech včetně extrakce zubu nebo po ztrátě zubu má být zahájení léčby odloženo a probíhající léčba dočasně přerušena, aby bylo umožněno zhojení v ústní dutině.
Místní alergické reakce
Při léčbě přípravkem ACARIZAX je pacient vystaven alergenu, který způsobuje alergické příznaky. Proto lze očekávat místní alergické projevy v průběhu léčby. Tyto reakce jsou obvykle mírné až středně závažné, ale mohou se vyskytnout závažnější orofaryngeální reakce. Pokud se u pacienta v průběhu léčby objeví významné místní alergické reakce, má být zváženo podání protialergické léčby (např. antihistaminik).
Eozinofilní ezofa.git.id.a.
Byly hlášeny izolované případy eozinofilní ezofagitidy. Pacienti se závažnými nebo perzistujícími gastroesofageálními příznaky jako je dysfagie a dyspepsie musí vyhledat lékaře.
Autoimunitní onemocnění v remisi
K dispozici jsou omezené údaje o alergické imunoterapii u pacientů s autoimunitním onemocněním v remisi. Proto má být ACARIZAX u těchto pacientů předepisován s opatrností.
Potravinová alergie
ACARIZAX může obsahovat stopy rybích bílkovin. Dostupné údaje nenaznačují zvýšené riziko alergických reakcí u pacientů s alergií na ryby.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí u lidí a nebyly dosud zjištěny žádné potenciální lékové interakce. Současná léčba symptomatickými protialergickými léky může zvyšovat míru tolerance pacienta k imunoterapii. Tuto skutečnost je třeba vzít v úvahu při přerušení léčby těmito přípravky.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici žádné údaje o klinických zkušenostech s použitím přípravku ACARIZAX u těhotných žen. Studie na zvířatech nenaznačují zvýšené riziko pro plod. V těhotenství nemá být léčba přípravkem ACARIZAX zahajována. Jestliže během léčby žena otěhotní, může léčba pokračovat po vyhodnocení celkového stavu pacientky (včetně plicních funkcí) a reakcí na předchozí podávání přípravku ACARIZAX. U pacientek s preexistujícím astmatem se během těhotenství doporučuje zvýšený dohled.
Kojení
O používání přípravku ACARIZAX v období kojení nejsou k dispozici klinické údaje. Účinky na kojené děti se nepředpokládají.
Fertilita
Nejsou k dispozici žádné klinické údaje týkající se fertility a užívání přípravku ACARIZAX. V opakovaných testech toxicity na potkanech nebyly pozorovány žádné účinky na reprodukční orgány u obou pohlaví.
4.7 Účinky na schopnost řídit a obsluhovat stroje
ACARIZAX nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Pacienti, kteří budou užívat přípravek ACARIZAX, mohou očekávat zejména mírné až středně závažné místní alergické reakce, které se objevují během prvních dnů léčby a poté v průběhu léčby mizí. (během 1-3 měsíců) (viz bod 4.4).
Ve většině případů lze reakci očekávat do 5 minut po každém jednotlivém podání přípravku ACARIZAX a ústup po několika minutách až hodinách. Mohou se vyskytnout závažnější orofaryngeální alergické reakce (viz bod 4.4).
Byly hlášeny izolované případy závažného akutního zhoršení astmatických příznaků. Pacienti, u kterých jsou rizikové faktory známé, nesmí léčbu přípravkem ACARIZAX zahajovat (viz bod 4.3).
Tabulkový přehled nežádoucích účinků
Následující tabulka nežádoucích účinků vychází z údajů z placebem kontrolovaných klinických studií sledujících užívání přípravku ACARIZAX u dospělých pacientů s alergickou rinitidou vyvolanou roztoči domácího prachu a/nebo s astmatem.
Nežádoucí účinky jsou rozděleny do skupin podle četnosti výskytu, v souladu s databází MedDRA: velmi časté (>1/10), časté (>1/100, <1/10), méně časté (>1/1000, <1/100) a vzácné (>1/10000, <1/1000), velmi vzácné (<1/10000).
|
Třída orgánových systémů |
Četnost |
Nežádoucí účinek |
|
Infekce a infestace |
Velmi časté |
Nazofaryngitida |
|
Časté |
Bronchitida, laryngitida, faryngitida, rinitida, sinusitida | |
|
Poruchy nervového systému |
Méně časté |
závrať, dysgeuzie |
|
Poruchy oka |
Časté |
Svědění očí |
|
Poruchy ucha a labyrintu |
Časté |
Svědění uší |
|
Respirační, hrudní a mediastinální poruchy |
Velmi časté |
Podráždění hrdla |
|
Časté |
Dysfonie, dyspnoe, orofaryngeální bolest, faryngeální otok | |
|
Méně časté |
Laryngeální otok, nosní kongesce, nosní diskomfort, nosní obstrukce, rinorea, kýchání, pocit staženého hrdla | |
|
Gastrointestinální poruchy |
Velmi časté |
Otok v ústech, svědění úst |
|
Časté |
Bolest břicha, průjem, sucho v ústech, dysfagie, dyspepsie, glosodynie, otok rtů, svědění rtů, svědění jazyka, nauzea, ústní diskomfort, orální parestezie, stomatitida, otok jazyka | |
|
Méně časté |
Glositida, vřed v ústech, podráždění jícnu, puchýře na sliznici dutiny ústní, erytém ústní sliznice, zvracení | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
hrudní diskomfort |
|
Méně časté |
Únava, celkový pocit nemoci, pocit cizího tělesa v hrdle | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Popis vybraných nežádoucích účinků
Jestliže se u pacienta objeví v důsledku léčby výrazné nežádoucí účinky, má se zvážit podání antialergik.
U obdobného přípravku k léčbě alergie na travní pyly ve formě sublingválních tablet byly hlášeny systémové alergické reakce a lze předpokládat obdobný efekt. Proto je lékařský dohled při prvním podání perorálního lyofilizátu důležitým opatřením (viz bod 4.2).
V případě akutního zhoršení astmatických příznaků anebo závažných celkových alergických reakcí, angioedému, polykacích potíží, ztíženého dýchání, změn hlasu, hypotenze nebo pocitu plnosti v hrdle se musí ihned kontaktovat lékař. V takových případech se musí léčba přerušit natrvalo, nebo dokud lékař neurčí jinak.
Byly hlášeny izolované případy eozinofilní ezofagitidy (viz bod 4.4.).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www. sukl. cz/nahlasit-nezadouci-ucinek.
Pediatrická populace
ACARIZAX není určen pro pacienty mladší 18 let (viz bod 4.2.). K dispozici jsou pouze omezené údaje o pacientech ve věku 5-17 let a neexistují žádné údaje o léčbě přípravkem ACARIZAX u dětí mladších 5 let.
4.9 Předávkování
Ve studiích fáze I byli dospělí pacienti s alergií na roztoče domácího prachu vystaveni dávce až 32 SQ-HDM.
Pokud jsou užívány dávky vyšší než denní doporučená dávka, zvyšuje se riziko nežádoucích účinků, včetně systémových alergických reakcí nebo závažných místních alergických reakcí. V případě závažných reakcí jako je angioedém, polykací obtíže, ztížené dýchání, změny hlasu nebo pocit plnosti v hrdle je nutné okamžité zhodnocení stavu lékařem. Tyto reakce se musí léčit pomocí příslušné symptomatické medikace.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Extrakty alergenů, domácí prach, roztoči ATC kód: V01AA03
Mechanismus účinku
ACARIZAX je přípravkem alergenové imunoterapie. Alergenová imunoterapie s alergenovými přípravky spočívá v opakovaném podávání alergenů pacientům s alergií, aby došlo k modifikaci imunologické odpovědi na expozici alergenem.
Cílem farmakodynamického účinku alergenové imunoterapie je imunitní soustava. Ale úplný a přesný mechanismu děje vyvolávající klinický účinek není ještě zcela znám. Ukázalo se, že léčba přípravkem ACARIZAX zvyšuje specifické IgG4 na roztoče domácího prachu a navodí celkovou protilátkovou odpověď, tím že kompetují s IgE o vazbu na alergeny roztočů domácího prachu. Tento účinek lze pozorovat již po 4 týdnech léčby.
Účinek přípravku ACARIZAX cílí na příčinu respiračních onemocnění vyvolaných roztoči domácího prachu a klinický efekt byl prokázán jak pro horní tak pro dolní cesty dýchací. Přípravek ACARIZAX poskytuje podpůrnou ochranu, což vede ke zlepšení kontroly onemocnění, vyšší kvalitě života, která se projevuje úlevou od příznaků, nižší potřebou dalších léků a snížením rizika exacerbace onemocnění.
Klinická účinnost u dospělých
Účinnost léčby přípravkem ACARIZAX 12 SQ-HDM u respiračních alergických onemocnění vyvolaných roztoči domácího prachu byla vyhodnocena ve dvou dvojitě zaslepených, randomizovaných, placebem kontrolovaných studiích s různými cílovými parametry a různými populacemi pacientů. Dvě třetiny subjektů byly senzitivní k dalším alergenům kromě alergenů roztočů domácího prachu. Senzitivita pouze k roztočům domácího prachu nebo k roztočům domácího prachu a zároveň dalšímu jednomu nebo více alergenům neměla vliv na výsledky studie.
Byly též prezentovány podporující důkazy ze studie z expoziční alergenové komory a ze studie provedené s nižšími dávkami.
Alergická rinitida
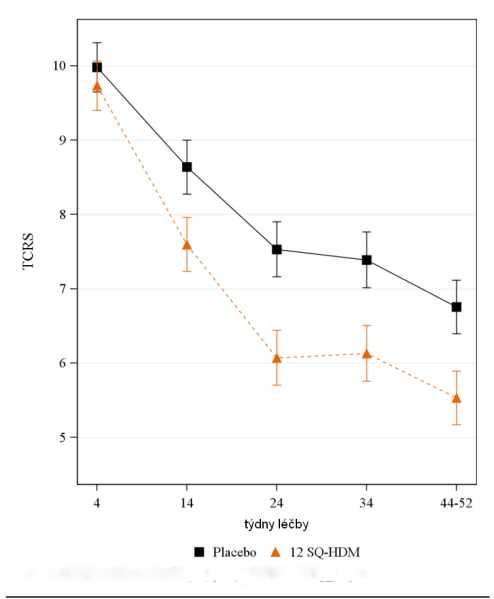
Studie MERIT (MT-06)
• Studie MERIT zahrnovala 992 dospělých, kteří měli středně těžkou až těžkou alergickou rinitidu vyvolanou roztoči domácího prachu a užívali léky proti rinitidě. Subjekty byly randomizovány do skupin užívajících 12 SQ-HDM, 6 SQ-HDM nebo placebo denně po dobu
jednoho roku a všichni měli přístup ke standardní farmakoterapii rinitidy. Během celé studie docházeli na kontrolu ke specialistovi zhruba každé 2 měsíce.
• Primárním cílovým parametrem bylo průměrné denní celkové kombinované skóre rinitidy
(average daily total combined rhinitis score - TCRS) hodnocené v průběhu posledních 8 týdnů léčby.
o TCRS bylo součtem skóre symptomů rinitidy a skóre medikace rinitidy. V rámci skóre symptomů rinitidy se denně vyhodnocovaly 4 nasální symptomy (rýma, ucpaný nos, svědění nosu, kýchání) každý škálou 0-3 (žádné, mírné, středně závažné, závažné symptomy), tj. výsledný rozsah škály byl 0-12. Skóre medikace rinitidy bylo součtem podaných nasálních kortikosteroidů ( 2 body za 1 vstřik, max. 4 vstřiky denně) a perorálních antihistaminik (4 body za 1 tabletu, max.l tableta denně), tj. výsledná škála: 0-12. Tedy TCRS škála byla: 0-24.
• Dalšími předem definovanými klíčovými sekundárními cílovými parametry bylo celkové
kombinované skóre rinokonjuktivitidy a kvalita života s rinokonjuktivitidou (rhinoconjunctivitis quality of life (RQLQ).
• Byly též provedeny post-hoc analýzy dnů s exacerbací rinitidy pro ilustraci klinické relevance
výsledků.
o Exacerbace rinitidy byla definovaná jako den, kdy se subjekt vrátil na tak vysokou úroveň symptomů, která byla vstupním kritériem pro přijetí do studie: skóre symptomů rinitidy buď nejméně 6 anebo nejméně 5, z nichž jeden symptom byl hodnocen jako závažný.
|
výsledky studie MERIT |
12 SQ-HDM |
Placebo |
Účinek léčby | |||||
|
Primární cílový parametr |
N |
Skóre |
N |
Skóre |
Absolutní rozdíl c |
Relativní rozdíl d |
p- hodnota | |
|
Celkové kombinované skóre rinitidy | ||||||||
|
FAS-MI a (upravený průměr) |
318 |
5,71 |
338 |
6,81 |
1,09 [0,35; 1,84] |
- |
0,004 | |
|
FAS b (upravený průměr) |
284 |
5,53 |
298 |
6,76 |
1,22 [0,49;1,96] |
18% |
0,001 | |
|
FAS b (medián) |
284 |
5,88 |
298 |
7,54 |
1,66 |
22% |
- | |
|
Předdefinované klíčové sekundární cílové parametry |
N |
Skóre |
N |
Skóre |
Absolutní rozdíl c |
Relativní rozdíl d |
p- hodnota | |
|
Skóre symptomů rinitidy | ||||||||
|
FAS b (upravený průměr) |
284 |
2,76 |
298 |
3,30 |
0,54 [0,18;0,89] |
16% |
0,003 | |
|
FAS b (medián) |
284 |
2,98 |
298 |
3,98 |
1.00 |
25% |
- | |
|
Skóre medikace rinitidy | ||||||||
|
FAS b (upravený průměr) |
284 |
2,22 |
298 |
2,83 |
0,60 [0,08; 1,13] |
21% |
0,024 | |
|
FAS b (medián) |
284 |
2,83 |
298 |
4,00 |
1,17 |
29% |
- | |
|
Celkové kombinované skóre rinokonjuktivitidy | ||||||||
|
FAS b (upravený průměr) |
241 |
7,91 |
257 |
9,12 |
1,21 [0,13;2,28] |
13% |
0,029 | |
|
FAS b (medián) |
241 |
8,38 |
257 |
10,05 |
1,67 |
20% |
- | |
|
Skóre dle dotazníku kvality života při rinokonjunktivitidě |
(RQLQ(S)) | |||||||
|
FAS b (upravený průměr) |
229 |
1,38 |
240 |
1,58 |
0,19 e [0,02;0,37] |
12% |
0,031 | |
|
FAS b (medián) |
229 |
1,25 |
240 |
1,46 |
0.21 |
14% |
- | |
|
Post-hoc cílové parametry |
N |
Poměr |
N |
Poměr |
Odds ratio f [95% CL] |
p- hodnota | ||
|
Pravděpodobnost výskytu dne s exacerbací rinitidy | ||||||||
|
FAS (přibližně) b |
284 |
5,33% |
298 |
11,14% |
0,45 [0,28;0,72] |
0,001 | ||
|
Pravděpodobnost výskytu dne s exacerbací rinitidy navzdory farmakoterapii | ||||||||
|
FAS (přibližně) b |
284 |
3,43% |
298 |
6,50% |
0,51 [0,32;0,81] |
0,005 | ||
N: počet subjektů v léčené skupině s dostupnými údaji pro analýzu. CL: meze spolehlivosti a FAS-MI: celkový soubor analýzy s vícečetnými imputacemi. Subjekty, které přerušily léčbu během studie před vyhodnocením účinnosti, řadí analýza k placebo skupině. Pro primární analýzu (FAS-MI) byl předem stanoven pouze absolutní rozdíl.
b FAS: celkový soubor analýzy. Veškeré dostupné údaje použité v maximálním rozsahu, tj. subjekty, které poskytly údaje během období vyhodnocování účinnosti. c Absolutní rozdíl: placebo minus 12 SQ-HDM, 95% mez spolehlivosti. d Relativní rozdíl k placebu: placebo minus 12 SQ-HDM děleno placebem.
e Rozdíl mezi 12 SQ-HDM a placebem se primárně odvíjel od rozdílů ve třech oblastech: problémy se spánkem, problémy při běžných denních činnostech a nasální symptomy . f Odds ratio pro exacerbaci rinitidy: 12 SQ-HDM versus placebo.
Podpůrné důkazy- alergická rinitida
V randomizované, dvojitě zaslepené, placebem kontrolované studii fáze II bylo 124 dospělých s alergií na roztoče domácího prachu vystaveno alergenu v expoziční komoře. Před každým vystavením alergenu v komoře prošly subjekty tzv.washed-out periodou veškeré alergické farmakoterapie. Po poslední expozici alergenu ve studii po 24 týdnech léčby s 12 SQ-HDM, 6 SQ-HDM nebo placebem byl průměr skóre symptomů rinitidy 7,45 [6,57;8,33] ve skupině s placebem a 3,83 [2,94;4,72] ve skupině s 12 SQ-HDM, odpovídající absolutnímu rozdílu 3,62 a relativní rozdílu 49% (95% mez spolehlivosti [35%;60%], p<0,001). Rozdíl mezi 12 SQ-HDM a placebem byl také statisticky významný v týdnu 16 (průměr skóre 5,95 a 8,58, rozdíl o 2,62 odpovídající 30%, 95% CI [17%;42%], p<0,001) a v týdnu 8 (průměr skóre 6,51 a 8,48, rozdíl 1,97 odpovídající 20%, 95% CI [7%;33%], p=0,007).
Alergické astma
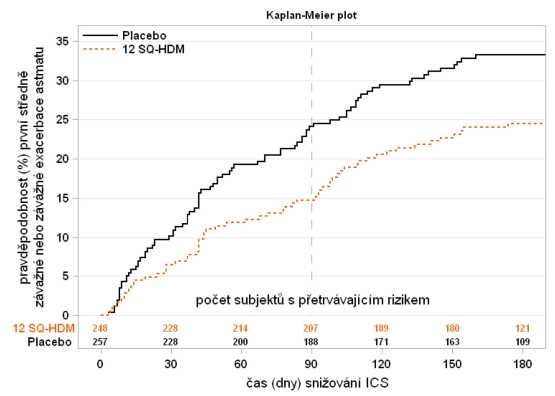
Studie MITRA (MT-04)
Do studie MITRA bylo zařazeno 834 dospělých s alergickým astmatem vyvolaným roztoči domácího prachu, které nebylo kompenzováno při denním užívání inhalačních kortikosteroidů (ICS) v dávce odpovídající 400-1200 pg budesonidu. Před snížením dávek kortikosteroidů byla podávána všem subjektům mimo stávající léčbu ICS a krátkodobými beta-agonisty ještě 7-12 měsíční terapie přípravkem ACARIZAX. Žádná titrační fáze, která by stanovila nejnižší udržovací dávku ICS, před randomizací neproběhla. Účinnost byla posuzována dobou do první středně závažné až závažné exacerbace astmatu po snížení ICS posledních 6 měsíců 13-18 měsíční léčby.
o Definice středně závažné exacerbace astmatu byla splněna, pokud u subjektu došlo k výskytu jednoho nebo více ze 4 následujících kriterií a došlo ke změně terapie:
■ Noční buzení nebo zhoršení symptomů: noční buzení, které vyžadovalo užití krátkodobých |32 agonistů (SABA) po dvě po sobě jdoucí noci nebo zhoršení skóre denních symptomů o >0,75 z původní hodnoty po dva po sobě jdoucí dny.
■ Zvýšená spotřeba SABA: navýšení původně užívaných dávek SABA po dva po sobě jdoucí dny (minimální zvýšení: 4 vdechy/denně).
■ Zhoršení plicních funkcí: >20% snížení PEF z původní hodnoty po nejméně dva po sobě jdoucí rána/večery nebo >20% snížení FEV1 z původní hodnoty.
■ Návštěva lékaře: návštěva pohotovosti / centra studie z důvodu léčby astmatu, která nevyžaduje terapii systémovými kortikosteroidy.
o Závažná exacerbace astmatu byla definována výskytem nejméně jedné situace ze dvou následujících:
■ Nutnost podání systémových kortikosteroidů po > 3 dny
■ Návštěva pohotovosti vyžadující podání systémových kortikosteroidů nebo hospitalizaci po > 12 hodin.
|
výsledky studie MITRA |
12 SQ-HDM |
Placebo |
Účinnost 12 SQ-HDM versus placebo |
p- íodnota | |||
|
N |
n (%) |
N |
n (%) |
Hazard ratio [95% CL] |
Risk reductiona | ||
|
Primární cílový parametr | |||||||
|
Jakákoli exacerbace, středně závažná nebo závažná (FAS-MI) b |
282 |
59 (21%) |
277 |
83 (30%) |
0,69 [0,50;0,96] |
31% |
0,027 |
|
Jakákoli exacerbace, středně závažná nebo závažná (FAS) c |
248 |
59 (24%) |
257 |
83 (32%) |
0,66 [0,47;0,93] |
34% |
0,017 |
|
Předdefinované analýzy komponent primárních cílových parametrů | |||||||
|
Noční buzení nebo zhoršení symptomů c |
248 |
39 (16%) |
257 |
57 (22%) |
0,64 [0,42;0,96] |
36% |
0,031 |
|
Zvýšená spotřeba SABA c |
248 |
18 (7%) |
257 |
32 (12%) |
0,52 [0,29;0,94] |
48% |
0,029 |
|
Zhoršení plicních funkcí c |
248 |
30 (12%) |
257 |
45 (18%) |
0,58 [0,36;0,93] |
42% |
0,022 |
|
Závažná exacerbace c |
248 |
10 (4%) |
257 |
18 (7%) |
0,49 [0,23;1,08] |
51% |
0,076 |
N: počet subjektů léčené skupiny s dostupnými údaji pro analýzu. n (%): počet a procento jedinců léčené skupiny, kteří splňovali kritéria CL: mez spolehlivosti a odhadnuto poměrem by hazard ratio
b FAS-MI: celkový soubor analýzy s vícečetnými imputacemi. Jedinci, kteří přerušili léčbu během studie před vyhodnocením účinnosti, řadí analýza k placebo skupině.
c FAS: celkový soubor analýzy. Veškeré dostupné údaje použité v maximálním rozsahu, tj. subjekty, které poskytly údaje během období vyhodnocování účinnosti.
Byly též provedeny post-hoc analýzy symptomů astmatu a symptomatické léčby užité během posledních 4 týdnů terapie před snížením dávek ICS za účelem prostudování účinku přípravku ACARIZAX jako doplňkové terapie k inhalačním kortikosteroidům. Analýzy se zaměřily na skóre denních a nočních astmatických symptomů, noční buzení a spotřebu SABA. Post-hoc analýzy ukázaly početní rozdíly konzistentně ve prospěch 12 SQ-HDM oproti placebu pro všechny parametry studované v průběhu posledních 4 týdnů léčby před snížením inhalačních kortikosteroidů. Rozdíly byly statisticky významné pouze pro skóre denních symptomů astmatu (p=0,0450) a pravděpodobností žádných nočních buzení (p=0,0409).
Podpůrné důkazy- alergické astma
Do dvojitě zaslepené, randomizované, placebem kontrolované studie fáze II bylo zařazeno 604 subjektů ve věku > 14 let s alergickým astmatem vyvolaným roztoči domácího prachu kontrolovaným inhalačními kortikosteroidy (100-800 pg budesonidu) a s rinitidou vyvolanou roztoči domácího prachu v klinické anamnéze, subjekty byly randomizovány do větví se zhruba roční léčbou s 1, 3 nebo 6 SQ-HDM nebo placebem. Ve 4. týdnu poslední, hodnotící fáze studie byl průměrný rozdíl proti původní hodnotě denní dávky ICS 207,6 pg budesonidu ve skupině s 6 SQ-HDM a 126,3 pg ve skupině s placebem odpovídající absolutnímu rozdílu 81 pg budesonidu denně (95% mez spolehlivosti [27;136], p= 0,004). Relativní průměr a medián snížení spotřeby ICS z původní hodnoty byl 42% a 50% u 6 SQ-HDM a 15% a 25% u placeba. V post-hoc analýze u podskupiny subjektů (N=108) s nižší kontrolou astmatu a spotřebou ICS >400 pg budesonidu byl průměrný rozdíl oproti původní hodnotě v denní dávce ICS 384,4 pg budesonidu ve skupině s 6 SQ-HDM a 57,8 pg ve skupině s placebem, což odpovídá absolutnímu rozdílu 327 pg budesonidu denně mezi 6 SQ-HDM a placebem (95% CI [182;471], p<0,0001, post-hoc analýza).
Pediatrická populace
ACARIZAX není určen pro pacienty mladší 18 let (viz bod 4.2).
K dispozici jsou pouze omezené údaje o bezpečnosti a snášenlivosti u pediatrických pacientů ve věku 5-17 let.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem ACARIZAX u dětí mladších 5 let s respirační alergií vyvolanou roztoči domácího prachu (léčba alergické rinitidy, prevence astmatu, léčba astmatu).
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem ACARIZAX u dětí ve věku 5 let a starších s respirační alergií vyvolanou roztoči domácího prachu (léčba alergické rinitidy, prevence astmatu, léčba astmatu).
Starší populace
ACARIZAX není určen pro pacienty starší 65 let (viz bod 4.2). Existují pouze omezené údaje o bezpečnosti a snášenlivosti u pacientů starších 65 let.
Dlouhodobá léčba
Mezinárodní doporučené postupy léčby zmiňují pro alergickou imunoterapii 3 roky trvající léčbu, aby bylo dosaženo modifikace onemocnění. K dispozici jsou údaje o účinnosti 18měsíční léčby s přípravkem ACARIZAX ze studie MITRA. Dlouhodobá účinnost nebyla stanovena.
5.2 Farmakokinetické vlastnosti
Nebyly provedeny žádné studie farmakokinetického profilu a metabolismu přípravku ACARIZAX. Účinek alergické farmakoterapie je zprostředkován imunologickými mechanizmy, o farmakokinetických vlastnostech jsou k dispozici pouze omezené informace.
Aktivní molekuly extraktu alergenu jsou složeny zejména z proteinů. U sublingválně podávaných přípravku alergické imunoterapie studie ukázaly, že nedochází k žádné pasivní absorpci alergenu orální sliznicí. Zdá se, že alergen je převeden přes orální sliznici dendritickými buňkami, zejména Langerhansovými buňkami. Alergen, který není absorbován tímto způsobem, je hydrolyzován na aminokyseliny a malé polypeptidy v lumen gastrointestinálního traktu. Neexistuje důkaz, který by naznačoval, že alergeny obsažené v přípravku ACARIZAX jsou po sublingválním podání ve významné míře absorbovány do cévního systému.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních toxikologických studií a studií reprodukční toxicity u myší neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Želatina (rybího původu)
Mannitol
Hydroxid sodný (pro úpravu pH)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Al/Al blistr v krabičce. Jeden blistr obsahuje 10 perorálních lyofilizátů.
Velikosti balení: 10, 30 a 90 perorálních lyofilizátů.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
ALK-Abelló A/S B0ge Alle 6-8 2970 H0rsholm Dánsko
8. REGISTRAČNÍ ČÍSLO(A)
59/558/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 2.12.2015
10. DATUM REVIZE TEXTU
2.12.2015
12