Zyprexa Velotab 15 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
ZYPREXA VELOTAB 5 mg tablety dispergovatelné v ústech ZYPREXA VELOTAB 10 mg tablety dispergovatelné v ústech ZYPREXA VELOTAB 15 mg tablety dispergovatelné v ústech ZYPREXA VELOTAB 20 mg tablety dispergovatelné v ústech
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
ZYPREXA VELOTAB 5 mg tablety dispergovatelné v ústech
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 5 mg.
Pomocné látky se známým účinkem: Jedna tableta dispergovatelná v ústech obsahuje 0,60 mg aspartam
0,1125 mg sodná sůl methylparabenu 0,0375 mg sodná sůl propylparabenu
ZYPREXA VELOTAB 10 mg tablety dispergovatelné v ústech
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 10 mg.
Pomocné látky se známým účinkem: Jedna tableta dispergovatelná v ústech obsahuje
0,80 mg aspartam
0,15 mg sodná sůl methylparabenu
0,05 mg sodná sůl propylparabenu
ZYPREXA VELOTAB 15 mg tablety dispergovatelné v ústech
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 15 mg.
Pomocné látky se známým účinkem: Jedna tableta dispergovatelná v ústech obsahuje 1,20 mg aspartam
0,225 mg sodná sůl methylparabenu 0,075 mg sodná sůl propylparabenu
ZYPREXA VELOTAB 20 mg tablety dispergovatelné v ústech
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 20 mg.
Pomocné látky se známým účinkem: Jedna tableta dispergovatelná v ústech obsahuje
1,60 mg aspartam
0,30 mg sodná sůl methylparabenu
0,10 mg sodná sůl propylparabenu
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta dispergovatelná v ústech
Žlutá, kulatá tableta, vymražovaný, rychle dispergovatelný přípravek, který je možno vložit přímo do úst nebo rozpustit ve vodě či jiném vhodném nápoji.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dospělí
Olanzapin je indikován k léčbě schizofrenie.
Olanzapin je účinný při udržení klinického zlepšení během pokračující terapie u pacientů, kteří na začátku léčby odpověděli zlepšením.
Olanzapin je indikován k léčbě středně těžkých až těžkých manických epizod.
Olanzapin je indikovaný k prevenci rcidivy u pacientů s bipolární poruchou, u kterých léčba manické epizody olanzapinem byla účinná (viz bod 5.1).
4.2 Dávkování a způsob podání
Dospělí
Schizofrenie: Doporučená počáteční dávka olanzapinu je 10 mg/den.
Manická epizoda: Počáteční dávka je 15 mg v jedné denní dávce v monoterapii nebo 10 mg denně v kombinaci (viz bod 5.1).
Prevence recidivy bipolární poruchy: Doporučená počáteční dávka je 10 mg/den. U pacientů, kteří byli v manické epizodě léčeni olanzapinem, pokračujte pro prevenci rekurence v terapii stejnou dávkou. Pokud se objeví nová manická, smíšená nebo depresivní epizoda, léčba olanzapinem by měla pokračovat (s optimalizací dávky podle potřeby) s přídatnou terapií příznaků poruchy nálady podle klinické indikace.
Během léčby jak schizofrenie, manických epizod a prevence recidivy bipolární poruchy může být denní dávkování následně přizpůsobeno na základě individuálního klinického stavu v rozmezí 5-20mg/den. Zvýšení na vyšší než doporučenou počáteční dávku je vhodné jen po patřičném opětovném klinickém vyšetření a nemělo by se zpravidla objevit v intervalech kratších než 24 hodin. Olanzapin může být podáván bez ohledu na jídlo, protože absorpce není ovlivňována potravou. Při vysazování olanzapinu by se mělo zvážit postupné snižování dávky.
Tabletu dispergovatelnou v ústech ZYPREXA VELOTAB je třeba vložit do úst, kde se slinami rychle disperguje a dá se snadno spolknout. Odstranit neporušenou dispergovatelnou tabletu z úst je obtížné. Jelikož jsou dispergovatelné tablety velmi křehké, je třeba je užít ihned po otevření blistru. Rovněž je možné je bezprostředně před použitím rozpustit ve sklenici vody nebo jiném vhodném nápoji (pomerančový nebo jablečný džus, mléko nebo káva).
Tableta dispergovatelná v ústech je bioekvivalentní potahované tabletě s podobnou rychlostí a rozsahem vstřebávání léčivé látky. Dávkování a frekvence podávání jsou stejné jako u potahovaných tablet. Tablety dispergovatelné v ústech je možné užívat místo potahovaných tablet olanzapinu.
Zvláštní populace
Starší populacei
U pacientů starších 65 let není běžně nižší počáteční dávka (5 mg/den) nutná, ale měla by být v odůvodněných případech zvážena (viz bod 4.4).
Porucha funkce ledvin a/nebo jater
Je vhodné zvážit nižší počáteční dávku (5 mg) u těchto pacientů. V případě středně závažného poškození jater (cirhóza, Child-Pugh class A nebo B) by počáteční dávka měla být 5 mg a zvyšována by měla být opatrně.
Kuřáci
Nekuřákům ve srovnání s kuřáky není obvykle třeba upravovat počáteční dávku a dávkové rozmezí. Metabolismus olanzapinu může být kouřením indukován. Doporučuje se klinické sledování, a v případě potřeby může být zváženo zvýšení dávky olanzapinu (viz bod 4.5).
Při přítomnosti více než jednoho faktoru, který zpomaluje metabolizmus (ženské pohlaví, vyšší věk, nekuřák) by se mělo zvážit snížení počáteční dávky. Zvyšování dávek by mělo být obezřetné, i když je indikované.
Pokud je pokládáno za nezbytné zvýšení dávky o 2,5 mg, je třeba užít potahované tablety ZYPREXA. (Viz bod 4.5 a 5.2)
Pediatrická populace
Podávání olanzapinu dětem a mladistvím ve věku do 18 let se vzhledem k nedostatečným údajům o bezpečnosti a účinnosti nedoporučuje. V krátkodobých studiích u adolescentních pacientů byly hlášeny vyšší hodnoty přibývání na váze a hladin lipidů a prolaktinu než ve studiích u dospělých (viz bod 4.4, 4.8, 5.1 a 5.2).
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Pacienti se známým rizikem angulárního glaukomu.
4.4 Zvláštní upozornění a opatření pro použití
Při antipsychotické léčbě může trvat několik dní až týdnů, než dojde ke zlepšení klinického stavu pacienta. Po tuto dobu by měl být pacient pod pečlivou kontrolou.
Psychózy a poruchy chování souvisejících s demencí
Olanzapin se nedoporučuje u pacientů s psychózou a/nebo poruchami chování souvisejícími s demencí z důvodu zvýšené incidence mortality a zvýšeného rizika cerebrovaskulárních příhod. V placebem kontrolovaných studiích (v trvání 6-12 týdnů) u starších pacientů (průměrný věk 78 let) s psychózou a poruchami chování souvisejícími s demencí byla u pacientů léčených olanzapinem dvojnásobná incidence úmrtí ve srovnání s pacienty užívajícími placebo (3,5% vs. 1,5% resp.). Vyšší incidence úmrtí nesouvisela s dávkou olanzapinu (průměrná denní dávka 4,4 mg) nebo s délkou léčby. Rizikovými faktory, které se mohou podílet na zvýšené mortalitě u této skupiny pacientů, jsou věk nad 65 let, dysfagie, sedace, malnutrice a dehydratace, plicní onemocnění (např. pneumonie, ev. i s aspirací) nebo současné užívání benzodiazepinů. Vyšší incidence úmrtí u pacientů léčených olanzapinem ve srovnání s pacienty užívajícími placebo byla však na uvedených rizikových faktorech nezávislá.
Ve stejných klinických studiích byly hlášeny cerebrovaskulární nežádoucí příhody (např. iktus, tranzitorní ischemické ataky), včetně úmrtí. U pacientů léčených olanzapinem bylo zaznamenáno trojnásobné zvýšení výskytu cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (1,3% vs. 0,4%, resp.). U všech pacientů léčených olanzapinem nebo placebem, u nichž se cerebrovaskulární příhoda vyskytla, byly přítomny rizikové faktory. K faktorům, které byly zjištěny jako rizikové u pacientů léčených olanzapinem, patřil věk nad 75 let a vaskulární a/nebo smíšená demence. Účinnost olanzapinu v těchto studiích nebyla stanovena.
Parkinsonova choroba
Použití olanzapinu na léčbu psychózy související s podáváním dopaminového agonisty u pacientů s Parkinsonovou chorobou se nedoporučuje. V klinických studiích bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symptomatiky a halucinací (viz bod 4.8 Nežádoucí účinky) a olanzapin nebyl v léčení psychotických příznaků účinnější než placebo. V těchto studiích museli mít pacienti na začátku studie stabilní nejnižší účinnou dávku antiparkinsonika (dopaminový agonista). Toto antiparkinsonikum jim bylo podáváno ve stejné dávce po celou zbývající dobu studie.
Počáteční dávka olanzapinu byla 2,5 mg/den a podle uvážení lékaře mohla být titrována do maximální dávky 15 mg/den.
Neuroleptický maligní syndrom (NMS)
NMS je potenciálně život ohrožující stav spojený s podáváním antipsychotik. Vzácné případy označené jako NMS byly rovněž hlášeny v souvislosti s olanzapinem. Klinické příznaky NMS jsou hyperpyrexie, svalová rigidita, alterovaná psychika a autonomní instabilita (nepravidelný pulz anebo tlak krve, tachykardie, pocení a arytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní renální selhání. Pokud se u pacienta objeví příznaky podezřelé ze spojení s NMS nebo pokud se objeví nevysvětlitelně vysoká horečka i bez dalších klinických známek NMS, musí být všechna antipsychotika včetně olanzapinu vysazena.
Hyperglykémie a diabetes
Méně často byly hlášeny hyperglykémie a/nebo exacerbace diabetu, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.8). V některých případech tomu předcházelo zvýšení tělesné hmotnosti, což mohlo být predispozičním faktorem.
V souladu s používanými pravidly antipsychotické léčby je doporučeno příslušné klinické monitorování, např. měření hladiny glukózy v krvi před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy jednou ročně. U pacientů léčených jakýmikoliv antipsychotickými přípravky, včetně přípravku ZYPREXA VELOTAB, by měly být sledovány známky a příznaky hyperglykémie (jako je polydipsie, polyurie, polyfagie a slabost) a pacienti s diabetem nebo s rizikovými faktory pro rozvoj diabetu by měli být pravidelně monitorováni
s ohledem na zhoršení kontroly hladiny glukózy. Pravidelně by měla být kontrolována tělesná hmotnost, např. před začátkem léčby, 4, 8 a 12 týdnů po záhájení podávání olanzapinu a následně vždy každé tři měsíce.
Změny hladin lipidů
V placebem kontrolovaných klinických studiích byly u pacientů léčených olanzapinem pozorovány nežádoucí změny hladin lipidů (viz bod 4.8). Změny lipidového profilu by měly být ošetřeny podle klinické potřeby, obzvláště u pacientů s dyslipidemií a u pacientů s rizikovými faktory pro rozvoj poruch lipidů. U pacientů léčených jakýmikoliv antipsychotickými přípravky, včetně přípravku ZYPREXA VELOTAB, by v souladu s používanými pravidly antipsychotické léčby měly být pravidelně kontrolovány hladiny lipidů, např. před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy každých 5 let.
Anticholinergní aktivita.
Ačkoliv byla in vitro prokázána anticholinergní aktivita, zkušenosti během klinických studií ukázaly nízkou incidenci souvisejících příhod. Protože klinické zkušenosti s podáváním olanzapinu u pacientů s jiným souběžným onemocněním jsou omezené, doporučuje se zvýšená pozornost, pokud je olanzapin předepisován pacientům s hypertrofií prostaty, paralytickým ileem nebo podobnými stavy.
Jaterní funkce
Často, obzvlášť v počátcích léčby, bylo pozorováno přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz, ALTa AST. U pacientů s vyšší hladinou ALT a/nebo AST se známkami a příznaky poškození jater, se sníženou funkcí jater v anamnéze a u pacientů léčených potenciálně hepatotoxickými přípravky je třeba opatrnosti a dalšího sledování. Je-li u pacientů diagnostikována hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater), je třeba léčbu olanzapinem ukončit.
Neutropenie
Opatrnosti je třeba u pacientů s nižším počtem leukocytů a/nebo neutrofilů z jakýchkoliv příčin, u pacientů užívajících léky způsobující neutropenii, u pacientů s anamnézou polékového útlumu kostní dřeně nebo útlumem kostní dřeně způsobeným souběžným onemocněním, radiační terapií nebo chemoterapií, u pacientů s hypereozinofilií nebo s myeloproliferativní chorobou. Neutropenie byla běžně hlášena při současném podávání olanzapinu a valproátu (viz bod 4.8).
Přerušení léčby
Při náhlém přerušení léčby olanzapinem byly zřídka (> 0,01% a < 0,1%) hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nevolnost nebo zvracení.
QT interval
V klinických studiích bylo u pacientů léčených olanzapinem klinicky významné prodloužení QTc intervalu (korekce QT podle Fridericii [QTcF] > 500 millisekund [ms] kdykoliv po vstupním vyšetření u pacientů se vstupní hodnotou QTcF <5 00 ms) méně časté (0,1% až 1%) bez signifikantních rozdílů v průvodních srdečních příhodách ve srovnání s placebem. Přesto je třeba zvýšené opatrnosti, je-li olanzapin předepisován s léky prodlužujícími QTc interval, obzvlášť
u starších pacientů, u pacientů s vrozeným prodloužením QT intervalu, městnavým srdečním selháním, srdeční hypertrofií, hypokalémií nebo hypomagnesémií.
Tromboembolismus
Časová souvislost léčby olanzapinem a žilního tromboembolismu byla hlášena méně často (> 0,1% a < 1%). Kauzální vztah mezi výskytem žilního tromboembolismu a léčbou olanzapinem nebyl stanoven. Avšak protože u pacientů se schizofrenií jsou často přítomny získané rizikové faktory žilního tromboembolismu, je nutné vzít v úvahu všechny možné rizikové faktory VTE (venous thromboembolism), např. imobilizaci pacientů, a vykonat preventivní opatření.
Obecná CNS aktivita
Vzhledem k primárnímu účinku olanzapinu na centrální nervovou soustavu je třeba opatrnosti při současném užívání s jinými centrálně působícími léky či alkoholem. Protože olanzapin působí in vitro jako dopaminový antagonista, může působit proti účinku přímých a nepřímých agonistů dopaminu.
Křeče
Olanzapin by měl být používán opatrně u pacientů s křečemi v anamnéze, anebo u těch, kteří mají pro křeče dispozice. U pacientů léčených olanzapinem byly křeče hlášeny méně často. Ve většině těchto případů byly hlášeny křeče v anamnéze či jiné rizikové faktory.
Pozdní dyskineze
V ročních nebo kratších srovnávacích studiích byl olanzapin statisticky významně méně často spojen s náhlou dyskinezí. Přesto riziko pozdní dyskineze při dlouhodobém užívání vzrůstá, a proto
u pacienta léčeného olanzapinem se symptomy pozdní dyskineze by se mělo zvážit snížení dávky anebo přerušení podávání. Tyto symptomy se mohou přechodně zhoršit nebo objevit po přerušení léčby.
Posturální hypotenze
V klinických studiích byla zřídka u starších pacientů pozorována posturální hypotenze. U pacientů starších 65 let je doporučeno pravidelně měřit krevní tlak.
Náhlá srdeční smrt
V postmarketingovém sledování olanzapinu byly u pacientů léčených olanzapinem nahlášeny případy náhlé srdeční smrti. V retrospektivní observační kohortové studii bylo riziko předpokládané náhlé srdeční smrti u pacientů léčených olanzapinem přibližně dvojnásobné oproti pacientům, kteří neužívali antipsychotika. V této studii bylo riziko při užívání olanzapinu porovnatelné s rizikem užívání atypických antipsychotik spojených do jedné analýzy.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících. Klinická hodnocení provedená u pacientů ve věkovém rozmezí 13-17 let ukázala různé nežádoucí účinky, včetně nárůstu tělesné hnotnosti, změny metabolických parametrů a zvýšení hladiny prolaktinu (viz body 4.8 a 5.1).
Fenylalanin
ZYPREXA VELOTAB tableta dispergovatelná v ústech obsahuje aspartam, který je zdrojem fenylalaninu. Může být škodlivý pro osoby s fenylketonurií.
Manitol
ZYPREXA VELOTAB tableta dispergovatelná v ústech obsahuje manitol.
Sodná sůl methvlparabenu a sodná sůl propvlparabenu
V ústech dispergovatelné tablety olanzapinu obsahují sodnou sůl methylparabenu a sodnou sůl propylparabenu. O těchto konzervačních látkách je známo, že způsobují kopřivku. Obecně může dojít k opožděné reakci na tyto látky ve formě kontaktních dermatitid, výjimečně se mohou vyskytnout okamžité reakce s bronchospazmem.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí byly provedeny pouze u dospělých.
Možnosti ovlivnění účinku olanzapinu
Vzhledem k tomu, že je olanzapin metabolizován izoenzymem CYP1A2, mohou látky, které specificky tento izoenzym indukují nebo inhibují, ovlivnit farmakokinetiku olanzapinu.
Indukce CYP1A2
Kouření a karbamazepin mohou indukovat metabolizmus olanzapinu, což může vést ke snížení koncentrace olanzapinu. Bylo pozorováno zanedbatelné, případně jen mírné zvýšení clearance olanzapinu. I když je klinický dopad pravděpodobně minimální, doporučuje se klinické monitorování a v nezbytných případech je možné zvážit zvýšení dávek olanzapinu (viz bod 4.2).
Inhibice CYP1A2
Prokázalo se, že fluvoxamin, specifický inhibitor CYP1A2, významně zpomaluje metabolizmus olanzapinu. Průměrné zvýšení maximální koncentrace olanzapinu fluvoxaminem bylo 54% u žen nekuřaček a 77% u mužů kuřáků. Průměrné zvýšení plochy pod křivkou koncentrace léčiva (AUC) bylo 52% u žen a 108% u mužů. U pacientů užívajících fluvoxamin nebo jiný inhibitor CYP1A2, jako např. ciprofloxacin, je třeba uvážit snížení počáteční dávky olanzapinu. Při zahájení léčby inhibitorem CYP1A2 je třeba uvážit snížení dávek olanzapinu.
Snížení biologické dostupnosti
Aktivní uhlí snižuje biologickou dostupnost olanzapinu po perorálním podání o 50 až 60%, proto by se mělo užívat nejméně 2 hodiny před nebo po užití olanzapinu.
Fluoxetin (inhibitor CYP2D6), jednorázové dávky antacida (hliník, hořčík) nebo cimetidinu neměly významný vliv na farmakokinetiku olanzapinu.
Možnosti ovlivnění účinku, jiných léků olanzapinem
Olanzapin může působit proti účinkům přímých a nepřímých agonistů dopaminu.
Olanzapin in vitro neinhibuje hlavní izoenzymy CYP450 (např. 1A2, 2D6, 2C9, 2C19, 3A4). Neočekávají se proto žádné zvláštní interakce, což dokazují i in vivo studie, které neprokázaly inhibici metabolizmu následujících léčivých látek: tricyklická antidepresiva (reprezentující převážně CYP2D6 cestu metabolizace, warfarin (CYP2C9), theofylin (CYP1A2) nebo diazepam (CYP3A4 a 2C19).
Olanzapin nevykazoval interakci se současně podávaným lithiem nebo biperidenem.
Terapeutické monitorování plazmatických hladin valproátu neukázalo, že je při zahájení přídatné medikace olanzapinem nutná úprava dávkování.
Obecná aktivita CNS
Zvýšená opatrnost je zapotřebí u pacientů požívajících alkohol nebo užívajících léčivé přípravky působící tlumivě na CNS.
Současné užívání olanzapinu a léčivých přípravků pro léčbu Parkinsonovy choroby a demence není doporučeno (viz bod 4.4).
QTc interval
Zvýšená opatrnost je zapotřebí u pacientů užívajících současně olanzapin a léčivé přípravky, u kterých je známo, že prodlužují QTc interval (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Neexistují žádné přiměřené a dobře vedené studie u gravidních žen. Pacientky by měly být poučené, aby lékaře informovali o graviditě anebo plánované graviditě během užívání olanzapinu. Avšak kvůli nedostatku zkušeností by olanzapin měl být v graviditě podávaný pouze tehdy, když jeho prospěšnost vyváží potenciální nebezpečí pro plod.
U novorozenců, kteří byli vystaveni antipsychotikům (včetně olanzapinu) během třetího trimestru těhotenství, existuje riziko výskytu nežádoucích účinků zahrnujících extrapyramidové a/nebo abstinenční příznaky, které se mohou po porodu lišit v závažnosti a délce trvání. Byly hlášeny případy agitace, hypertonie, hypotonie, tremoru, somnolence, dechové tísně nebo potíží při kojení. Novorozenci proto musejí být pečlivě sledováni.
Kojení
Ve studii u kojících zdravých žen byl olanzapin vylučován do mateřského mléka. Průměrná expozice dítěte (mg/kg) v stacionárním stavu byla odhadnuta na 1,8% z dávky olanzapinu podaného matce (mg/kg). Pacientky je třeba poučit, aby během užívání olanzapinu nekojily.
Fertilita
Účinky na fertilitu nejsou známy (viz bod 5.3 Preklinické informace).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Jelikož olanzapin může způsobit ospalost a závratě, pacienti by měli být opatrní při obsluze strojů včetně řízení motorových vozidel.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Dospělí
Nejčastěji hlášenými (pozorované u > 1% pacientů) nežádoucími účinky spojenými s užíváním olanzapinu v klinických studiích byla ospalost, přibývání na váze, eozinofilie, zvýšené hladiny prolaktinu, cholesterolu, glukózy a triglyceridů (viz bod 4.4), glykosurie, zvýšená chuť k jídlu, závratě, akatizie, parkinsonismus, leukopenie, neutropenie (viz bod 4.4), dyskineze, ortostatická hypotenze, anticholinergní účinky, přechodné asymtpomatické zvýšení jaterních aminotransferáz (viz bod 4.4), rash, asténie, únava, horečka, artralgie, zvýšené hodnoty alkalické fosfatázy, gamma glutamyltransferázy, kyseliny močové a kreatinfosfokinázy a otok.
Seznam nežádoucích účinků v tabulkovém formátu
Následující tabulka podává seznam nežádoucích účinků a laboratorních nálezů pozorovaných ve spontánních hlášeních a v klinických hodnoceních. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000) a není známo (z dostupných údajů nelze určit).
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Poruchy krve a lymfatického systému | ||||
|
Eozinofilie Leukopenie10 Neutropenie— |
Thrombocytopenie11 | |||
|
Poruchy imunitního systému | ||||
|
Hypersenzitivita11 | ||||
|
Poruchy metabolismu a výživy | ||||
|
Přibývání na váze 1 |
Zvýšené hladiny cholesterolu2,3 Zvýšené hladiny glukózy4 Zvýšené hladiny triglyceridů2,5 Glykosurie Zvýšená chuť k jídlu |
Vznik nebo exacerbace diabetu, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.4) 11 |
Hypotermie12 | |
|
Poruchy nervového systému | ||||
|
Ospalost |
Závratě Akatizie6 Parkinsonismus6 Dyskineze6 |
Křeče, kdy ve většině případů byly hlášeny křeče v anamnéze či jiné rizikové faktory pro vznik křečí11 Dystonie (včetně okulogyrické krize)— Tardivní dyskineze11 Amnézie9 Dysartrie |
Neuroleptický maligní syndrom (viz bod 4.4) 12 Příznaky z '7,12 vysazení | |
|
Srdeční poruchy | ||||
|
Bradykardie Prodloužení QTc intervalu (viz bod 4.4) |
Ventrikulární tachykardie/fibrilace, náhlá smrt (viz bod 4.4) 11 | |||
|
Cévní poruchy | ||||
|
Ortostatická |
Tromboembolismus (včetně pulmonární embolie a hluboké žilní trombózy) (viz bod 4.4) | |||
|
Respirační, hrudní a mediastinální poruchy | ||||
|
Epistaxe9 | ||||
|
Gastrointestinální poruchy | ||||
|
Mírné přechodné anticholinergní účinky včetně obstipace a suché ústní sliznice |
Břišní distenze9 |
Pankreatitida11 | ||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Poruchy jater a žlučových cest | ||||
|
Přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz (ALT, AST) obzvlášť na počátku léčby (viz bod 4.4) |
Hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater)11 | |||
|
Poruchy kůže a podkožní tkáně | ||||
|
Rash |
Fotosenzitivní reakce Alopecie |
Léková reakce s eozinofilií a systémovými příznaky (DRESS) | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||||
|
Artralgie9 |
Rhabdomyolýza | |||
|
Poruchy ledvin a močových cest | ||||
|
Inkontinence moči, retence moči Opožděný začátek močení11 | ||||
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím | ||||
|
Syndrom z vysazení u novorozenců (viz bod 4.6) | ||||
|
Poruchy reprodukčního systému a prsu | ||||
|
Erektilní dysfunkce u mužů Snižení libida u mužů i žen |
Amenorea Zvětšení prsou Galaktorea u žen Gynekomastie/zvětše ní prsou u mužů |
Priapismus12 | ||
|
Celkové poruchy a reakce v místě aplikace | ||||
|
Astenie Únava Otok Horečka10 | ||||
|
Vyšetření | ||||
|
Zvýšené plazmatické hladiny prolaktinu8 |
Zvýšené hodnoty alkalické fosfatázy10 Vysoká hladina kreatinfosfokinázy11 Vysoká hladina gamma glutamyltransferázy10 Vysoká hladina kyseliny močové10 |
Zvýšené hodnoty celkového bilirubinu | ||
'Klinicky významné zvýšení tělesné hmotnosti bylo pozorována napříč všemi základními kategoriemi dle BMI (Body Mass Index). Při krátkodobé léčbě (medián trvání 47 dnů) bylo zvýšení tělesné hmotnosti o > 7% velmi časté (22,2%), o > 15% časté (4,2%) a o > 25% bylo méně časté (0,8%). Při dlouhodobém užívání (nejméně 48 týdnů) bylo u pacientů zvýšení tělesné hmotnosti o > 7%, o > 15% a o >25% velmi časté (64,4%, 31,7%, resp. 12,3%).
2Průměmé zvýšení hodnot lipidů nalačno (celkový cholesterol, LDL cholesterol a triglyceridy) bylo vyšší u pacientů bez prokázané poruchy regulace tuků na začátku léčby.
3Pozorováno pro normální počáteční hladiny nalačno (< 5,17 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 6,2 mmol/l). Změny počátečních hodnot celkového cholesterolu nalačno z hraničních (>
5,17 - < 6,2 mmol/l) na vysoké (> 6,2 mmol/l) byly velmi časté.
4Pozorováno pro normální počáteční hladiny glukózy nalačno (< 5,56 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 7 mmol/l). Změny počátečních hodnot glukózy nalačno z hraničních (> 5,56 - < 7 mmol/l) na vysoké (> 7 mmol/l) byly velmi časté.
5Pozorováno pro normální počáteční hladiny nalačno (< 1,69 mmol/l), které vzrostly na vysoké (> 2,26 mmol/l). Změny počátečních hladin triglyceridů nalačno z hraničních hodnot (> 1,69 mmol/l - < 2,26 mmol/l) na vysoké (> 2,26mmol/l) byly velmi časté.
6V klinických studiích byl výskyt parkinsonismu a dystonie u pacientů léčených olanzapinem číselně vyšší, ale statisticky se signifikantně nelišil od placeba. Parkinsonismus, akathisie a dystonie se vyskytly vzácněji při užívání olanzapinu než při užívání odpovídajících dávek haloperidolu. Vzhledem k nedostatku podrobných informací o akutních a pozdních extrapyramidových příznacích v anamnéze není možné rozhodnout, zda olanzapin způsobuje tardivní dyskinezi a/nebo další pozdní extrapyramidové příznaky méně často.
7Při náhlém přerušení léčby olanzapinem byly hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nevolnost a zvracení.
8V klinických hodnoceních trvajících až 12 týdnů překročily plazmatické koncentrace prolaktinu hormí hranici normálního rozmezí u přibližně 30% pacientů léčených olanzapinem s normální počáteční hladinou prolaktinu. U většiny těchto pacientů bylo zvýšení obvykle mírné a zůstalo pod dvojnásobkem horní hranice normálního rozmezí.
^Nežádoucí účinek zjištěný z klinických studií v integrované databázi olanzapinu.
10 Odhadnuto z naměřených hodnot z klinických studií v integrované databázi olanzapinu.
11 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla
určena s využitím integrované databáze olanzapinu.
12 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla
odhadnuta na horní hranici 95% intervalu spolehlivosti s využitím integrované databáze olanzapinu.
Dlouhodobé užívání (nejméně 48 týdnů)
Procento pacientů, u kterých se projevily nežádoucí účinky - klinicky významný vzestup tělesné hmotnosti, glukózy, celkového/LDL/HDL cholesterolu nebo triglyceridů - se v průběhu času zvyšuje. U dospělých pacientů, kteří dokončili léčbu v délce 9-12 měsíců, se stupeň nárůstu hladiny glukózy v krvi zpomalil přibližně po 6 měsících.
Další informace týkající se specifických populací
V klinických studiích u starších pacientů s demencí byla léčba olanzapinem spojena s vyšší incidencí úmrtí a cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (viz bod4.4). Velmi časté nežádoucí účinky spojené s užíváním olanzapinu u této skupiny pacientů byly abnormální chůze a pády. Často byly pozorované pneumonie, zvýšení tělesné teploty, letargie, erythém, zrakové halucinace a inkontinence moči.
V klinických studiích u pacientů s Parkinsonovou chorobou s psychózou související s podáváním dopaminového agonisty bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symtpomatiky a halucinace.
V jedné klinické studii u pacientů v manické fázi bipolámí poruchy měla léčba valproátem
v kombinaci s olanzapinem za následek 4,1% incidenci neutropenie; potenciálně přispívajícím faktorem by mohly být vysoké plazmatické hladiny valproátu. Současné podání olanzapinu s lithiem nebo valproátem vedlo ke zvýšení výskytu (>10%) tremoru, sucha v ústech, zvýšené chuti k jídlu a přibývání na váze. Poruchy řeči byly také hlášeny často. Při léčbě olanzapinem v kombinaci s lithiem nebo divalproexem došlo v akutní fázi léčby (trvající max. 6 týdnů) ke zvýšení tělesné hmotnosti o >7% u 17,4% pacientů. Dlouhodobá léčba olanzapinem (trvající max. 12 týdnů) pro prevenci recidivy u pacientů s bipolární poruchou byla doprovázena zvýšením tělesné hmotnosti o >7% u 39,9% pacientů.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících mladších 18 let. Ačkoli nebyly provedeny studie navržené pro porovnání dospívajících a dospělých pacientů, data z klinických hodnocení dospívajících byla srovnána s údaji získanými ze studií u dospělých.
Následující tabulka shrnuje nežádoucí účinky hlášené s vyšší četností výskytu u dospívajících pacientů (ve věku 13-17 let) oproti dospělým pacientům, nebo nežádoucí účinky identifikované pouze v průběhu krátkodobých klinických hodnocení u dospívajících pacientů. Klinicky významné zvýšení tělesné hmotnosti (> 7%) se zdá, že se ve srovnání s dospělou populací vyskytuje u dospívajících pacientů s vyšší frekvencí. Velikost váhového přírůstku a procento dospívajících, u kterých došlo ke klinicky významnému nárůstu tělesné hmotnosti, byly vyšší při dlouhodobém užívání (nejméně 24 týdnů) ve srovnání s krátkodobým užíváním.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10).
Poruchy metabolismu a výživy
Velmi časté: Přibývání na váze13, zvýšené hladiny triglyceridů14, zvýšená chuť k jídlu.
Časté: zvýšené hladiny cholesterolu15_
Poruchy nervového systému
Velmi časté: Sedace (zahrnující: hypersomnie, lethargie, ospalost)._
Gastrointestinální poruchy
Časté: Sucho v ústech_
Poruchy jater a žlučových cest
Velmi časté: Zvýšení hladiny jaterních aminotransferáz (ALT/AST; viz bod 4.4)._
Vyšetření
Velmi časté: Snížené hodnoty celkového bilirubinu, zvýšení hodnoty GMT, zvýšení plazmatických hladin prolaktinu1._
13Při krátkodobé léčbě (medián trvání 22 dnů) bylo zvýšení tělesné hmotnosti (kg) o > 7% velmi časté (40,6%), zvýšení tělesné hmotnosti o > 15% bylo časté (7,1%) a zvýšení o > 25% bylo časté (2,5%). Při dlouhodobém užívání (nejméně 24 týdnů) došlo k nárůstu tělesné hmotnosti u 89,4% o > 7%, u 55,3% o > 15% a u 29,1% o > 25% oproti počáteční tělesné hmotnosti.
14 Pozorováno pro normální počáteční hladiny nalačno (< 1,016 mmol/l), které vzrostly na vysoké (> 1,467 mmol/l) a změny počátečních hladin triglyceridů nalačno z hraničních hodnot (> 1,016 mmol/l -< 1,467 mmol/l) na vysoké (> 1,467 mmol/l).
15 Změny počátečních hodnot celkového cholesterolu nalačno, kdy došlo ke zvýšení hladin z normálních (< 4,39 mmol/l) na vysoké (> 5,17 mmol/l), byly pozorovány často. Změny počátečních hodnot celkového cholesterolu nalačno z hraničních (> 4,39 - < 5, 17 mmol/l) na vysoké (> 5,17 mmol/l) byly velmi časté.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Známky a příznaky
Mezi velmi časté příznaky (výskyt>10%) předávkování patří tachykardie, agitovanost/agresivita, dysartrie, různé extrapyramidové příznaky a nižší stupeň vědomí mezi sedací a komatem.
Další zdravotně významné důsledky předávkování zahrnují delirium, křeče, koma, možný neuroleptický maligní syndrom, útlum dýchání, aspirace, hypertenzi nebo hypotenzi, srdeční arytmii (<2% případů předávkování) a zástavu dýchání a srdeční činnosti. Smrtelné případy se vyskytly už po akutním předávkování dávkou 450 mg, ale rovněž bylo popsáno přežití po akutním předávkování dávkou 2 g perorálního olanzapinu.
Léčba
Proti olanzapinu neexistuje žádné specifické antidotum.
Nedoporučuje se vyvolání zvracení. Mohou být indikovány jiné standardní postupy používané při léčbě předávkování (např. výplach žaludku, podání aktivního uhlí). Ukázalo se, že současné podání aktivního uhlí snižuje biologickou dostupnost olanzapinu po perorálním podání o 50-60%.
Podle klinického stavu je potřebné zahájit symptomatickou léčbu a sledování vitálních funkcí, zahrnující léčbu hypotenze, cirkulačního kolapsu a podporu funkce dýchání. Nesmí být používán adrenalin, dopamin nebo jiná P sympatomimetika, protože stimulace P adrenergních receptorů může prohloubit hypotenzi. Sledování kardiovaskulárních parametrů je nezbytné kvůli diagnostice možných poruch srdečního rytmu. Pacient musí být až do zotavení pod stálým lékařským dohledem a musí být sledovány jeho vitální funkce.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, diazepiny, oxazepiny, thiazepiny a oxepiny,
ATC kód: N05AH03
Farmakodynamické účinky
Olanzapin je antipsychotická, antimanická a náladu stabilizující látka, která vykazuje široké farmakologické působení na řadu receptorových systémů.
V preklinických studiích vykazuje olanzapin širokou afinitu k řadě receptorů (Ki<100 nM) pro serotonin 5HT2A/2C, 5HT3, 5HT6, dopamin Dj, D2, D3, D4, D5, cholinergní muskarinové receptory (Mj-M5), aj adrenergní a histaminové Hj receptory. Behaviorální studie na zvířatech prokázaly antagonistické působení olanzapinu na 5HT, dopaminové a cholinergní receptory konzistentní s receptorovým profilem. Olanzapin vykazoval větší in vitro afinitu k serotoninovým 5HT2 receptorům než k dopaminovým D2 a vyšší 5HT2 než D2 aktivitu na in vivo modelech. Elektrofyziologické studie ukázaly, že olanzapin selektivně snižuje aktivitu mezolimbických (A10) dopaminergních neuronů bez výraznějšího účinku na striatální (A9) dráhy ovládající motoriku. Olanzapin oslabuje podmíněnou vyhýbací odpověď v předpovědném textu antipsychotické aktivity v dávkách nižších než j sou ty, které vyvolávají katalepsii, tj. v předpovědném testu motorických nežádoucích účinků. Na rozdíl od typických antipsychotik olanzapin zesilňuje odpověď v “anxiolytickém testu”.
Ve studii pozitronové emisní tomografie (PET) účinku jednorázové dávky (10 mg) u zdravých dobrovolníků obsazoval olanzapin více 5HT2A receptory než dopaminové D2 receptory. Navíc zobrazovací studie jednofotonové emisní počítačové tomografie (SPECT)odhalila, že obsazenost D2 receptorů u schizofrenních pacientů odpovídajících na olanzapin byla nižší než u pacientů odpovídajících na jiná antipsychotika a risperidon, zatímco u pacientů odpovídajících na klozapin byla srovnatelná.
Klinická, účinnost
Ve dvou ze dvou placebo kontrolovaných a dvou ze tří porovnávacích studií s aktivním komparátorems více než 2 900 schizofrenními pacienty s pozitivními i negativními symptomy vykazoval olanzapin statisticky významně větší zlepšení jak u negativních, tak i pozitivních symptomů.
V mezinárodní dvojitě zaslepené srovnávací studii zahrnující 1 481 pacientů se schizofrenií, shizoafektními a příbuznými chorobami s různými stupni přidružených depresivních symptomů (výchozí hodnota 16,6 na Montgomery-Asberg škále) prokázala analýza skóre změn nálady mezi výchozími a konečnými hodnotami statisticky významné zlepšení (p=0,001) ve prospěch olanzapinu (-6,0) oproti haloperidolu (-3,1).
U pacientů s manickou nebo smíšenou epizodou bipolární poruchy vykázal olanzapin ve snížení manických symptomů za 3 týdny vyšší účinnost než placebo a valproát semisodium (divalproex). Olanzapin také vykázal srovnatelnou účinnost s haloperidolem ve smyslu podílu pacientů v symptomatické remisi mánie a deprese po 6 a 12 týdnech. Ve studii u pacientů léčených lithiem nebo valproátem minimálně 2 týdny vedlo přidání olanzapinu v dávce 10 mg (v kombinaci s lithiem nebo valproátem) k větší redukci symptomů mánie než léčba lithiem nebo valproátem v monoterapii za 6 týdnů.
Ve 12-měsíční studii prevence recidivy u pacientů s manickou epizodou, kteří dosáhli remise při léčbě olanzapinem a byli poté randomizováni k užívání olanzapinu nebo placeba, prokázal olanzapin vůči placebu v primárním parametru recidivy bipolární poruchy statisticky významnou superioritu. Olanzapin také vykázal ve srovnání s placebem statisticky významnou výhodu v prevenci recidivy jak manie, tak deprese.
Ve druhé 12-měsíční studii prevence recidivy u pacientů s manickou epizodou, kteří dosáhli remise při léčbě kombinací olanzapinu a lithia a byli poté randomizováni k užívání samotného olanzapinu nebo lithia, byl olanzapin v primárním parametru recidivy bipolární poruchy statisticky noninferiorní vůči lithiu (olanzapin 30,0%, lithium 38,3%; p=0,055).
V 18-měsíční studii s kombinační léčbou u pacientů s manickou nebo smíšenou epizodou, kteří byli stabilizováni při léčbě olanzapinem spolu se stabilizátorem nálady (lithium nebo valproát), nebyla dlouhodobá kombinační léčba olanzapinem spolu s lithiem nebo valproátem statisticky významně superiorní vůči léčbě samotným lithiem nebo valproátem v prodloužení doby do recidivy bipolární poruchy definované podle syndromových (diagnostických) kritérií.
Pediatrická populace
Kontrolovaná data u dospívajících (od 13 do 17 let věku) jsou omezena na krátkodobé studie účinnosti u schizofrenie (6 týdnů) a mánie spojené s bipolární poruchou typu I (3 týdny), zahrnující méně než 200 dospívajících. Olanzapin byl užíván ve flexibilní dávce od 2,5 mg při zahájení léčby až po 20 mg/den. V průběhu léčby olanzapinem došlo u dospívajících k signifikantně vyššímu nárůstu tělesné hmotnosti ve srovnání s dospělými. Velikost změn hladin na lačno celkovém cholesterolu, LDL cholesterolu, triglyceridů a prolaktinu (viz body 4.4 a 4.8) byla u dospívajících větší než u dospělých. Kontrolované údaje o přetrvávání účinku nebo o dlouhodobé bezpečnosti nejsou k dispozici (viz body 4.4 a 4.8). Informace o dlouhodobé bezpečnosti jsou omezeny na nekontrolované údaje z nezaslepených studií.
5.2 Farmakokinetické vlastnosti
Tablety dispergovatelné v ústech jsou bioekvivalentní potahovaným tabletám s podobnou rychlostí a rozsahem vstřebávání léčivé látky. Tablety dispergovatelné v ústech je možné užívat místo potahovaných tablet olanzapinu.
Absorpce
Olanzapin se po perorálním podání dobře vstřebává a dosahuje maximální koncentrace v plazmě za 5 až 8 hodin. Vstřebávání není ovlivněno jídlem. Absolutní perorální biologická dostupnost vztažena k intravenóznímu podání nebyla stanovena.
Distribuce
Při plazmatické koncentraci 7 až 1 000 ng/ml se olanzapin vázal přibližně z 93% na plazmatické bílkoviny. Olanzapin se váže především na albumin a kyselý aj-glykoprotein.
Biotransformace
Olanzapin je metabolizovaný v játrech cestou konjugace a oxidace. V cirkulaci se z metabolitů objeví hlavně 10-N-glukuronid, který neprostupuje hematoencefalickou bariérou. Cytochromy P450-CYP1A2 a P450-CYP2D6 přispívají k tvorbě N-desmethyl a 2-hydroxymethyl metabolitů, vykazujících významně nižší in vivo farmakologickou aktivitu než olanzapin ve studiích na zvířatech. Převážná část farmakologické aktivity je způsobená původním olanzapinem.
Eliminace
Po perorálním podání se průměrný poločas vylučování olanzapinu u zdravých jedinců lišil podle věku a pohlaví.
U zdravých starších jedinců (65 let a více) byl průměrný poločas vylučování prodloužený v porovnání se zdravými jedinci pod 65 let (51,8 h versus 33,8 h) a clearance byla snížena (17,5 versus 18,2 l/h). Farmakokinetická odchylka pozorovaná u starších jedinců je v mezích odchylek normálních jedinců.
U 44 schizofrenických pacientů starších 65 let nebyl při dávkách 5-20 mg/den pozorován zvláštní výskyt nežádoucích účinků.
U žen oproti mužům byl průměrný poločas vylučování poněkud prodloužen (36,7 versus 32,3 h) a clearance byla snížena (18,9 versus 27,3 l/h). Přesto vykazuje olanzapin (5-20mg) srovnatelný bezpečnostní profil u žen (n=467) jako u mužů (n=869).
Porucha funkce ledvin
Renální insuficience u pacientů (creatininová clearance <10 ml/min) ve srovnání se zdravými nezpůsobovala významný rozdíl poločasu eliminace (37,7 versus 32,4 h) nebo clearance (21,2 versus 25,0 l/h). Studie rovnováhy ukázala, že přibližně 57% radioaktivně značeného olanzapinu se objevilo v moči převážně jako metabolity.
Kuřáci
U kuřáků s mírným poškozením jater byl průměrný poločas vylučování prodloužen
(48,8 h versus 39,3 h) a clearance snížena analogicky ke zdravým nekuřákům (18 l/h a 14,1 l/h).
U nekuřáků oproti kuřákům (ženy i muži) byl průměrný poločas vylučování prodloužen (38,6 v. 30,4 h) a clearance snížena (18,6 v. 27,7 l/h).
Plazmatická clearance olanzapinu je nižší u starších než u mladších jedinců, u žen než u mužů a u nekuřáků oproti kuřákům. Závažnost vlivu věku, pohlaví a kouření na clearance a poločas vylučování olanzapinu je malý v porovnání s celkovou variabilitou mezi jednotlivci.
Klinická studie nepopisuje žádné rozdíly farmakokinetických parametrů mezi bělochy, Japonci a Číňany.
Pediatrická populace
Dospívající (od 13 do 17 let věku): Farmakokinetika olanzapinu je podobná u dospívajících i dospělých. V klinických hodnoceních byla u dospívajích průměrná expozice olanzapinu vyšší přibližně o 27%. Demografické rozdíly mezi dospívajícími a dospělými zahrnují nižší průměrnou tělesnou hmotnost a menší počet kuřáků mezi dospívajícími. Tyto faktory možná přispívají k vyšší průměrné expozici u dospívajích.
5.3 Předklinické údaje vztahující se k bezpečnosti
Akutní toxicita (po jednorázové dávce)
Příznaky toxicity po perorálním podání hlodavcům obsahovaly silnou neuroleptickou složku: hypoaktivitu, kóma, třes, klonické křeče, slinění a zpomalení zvyšování hmotnosti. Střední letální dávka u myší byla přibližně 210 mg/kg a u potkanů 175 mg/kg. Psi tolerovali jednorázovou perorální dávku 100 mg/kg s nulovou mortalitou. Mezi klinické příznaky patřil útlum, ataxie, třes, zrychlený puls, dušnost, mióza a anorexie. U opic vyvolala jednorázová perorální dávka až do 100 mg/kg vyčerpanost a vyšší dávky částečné bezvědomí.
Toxicita po opakovaném podávání
Ve studiích, které trvaly u myší až 3 měsíce a u potkanů a psů až 1 rok, se ukázaly jako hlavní účinky deprese CNS, anticholinergní účinky a hematologické poruchy. Na depresi CNS se vyvinula tolerance. Růstové parametry byly při vysokých dávkách sníženy. Reverzibilní účinky spojené se zvýšenou hladinou prolaktinu u potkanů zahrnovaly pokles hmotnosti ovárií a uteru, a morfologické změny vaginálního epitelu a prsní žlázy.
Hematologická toxicita: u všech druhů byly pozorované účinky na hematologické ukazatele včetně na dávce závislého poklesu počtu leukocytů v krvi u myší a nespecifického poklesu leukocytů v krvi u potkanů. Navzdory tomu nebyl dokázaný hematotoxický účinek na kostní dřeň. U několika psů, kterým bylo podáváno 8 až 10 mg/kg/den (celková expozice olanzapinem [plocha pod křivkou] je 12-15krát vyšší než dostává člověk - 12 mg), se vyvinula reverzibilní neutropenie, trombocytopenie nebo anémie u psů s cytopenií nebyly pozorované žádné nepříznivé účinky na progenitorové a proliferující buňky kostní dřeně.
Reprodukční toxicita
Olanzapin nemá žádný teratogenní účinek. U potkaních samců sedace ovlivnila páření. Estrální cykly byly ovlivněné dávkou 1,1 mg/kg (což je 3-násobek maximální dávky pro člověka), a reprodukční parametry byly u potkanů ovlivněné dávkou 3 mg/kg (což je 9-násobek maximální dávky pro člověka). U potomstva potkanů, kterým byl podávaný olanzapin, bylo pozorované opoždění fetálního vývoje a přechodný pokles aktivity.
Mutagenita
Olanzapin se neukázal jako mutanogenní nebo klastogenní v žádném ze standardních testů, které zahrnovaly bakteriální testy mutagenity in vitro a in vivo testy u savců.
Kancerogenita
Na základě výsledků studií na myších a potkanech bylo zjištěno, že olanzapin není kancerogenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
želatina manitol (E421) aspartam (E951)
sodná sůl methylparabenu (E219) sodná sůl propylparabenu (E217)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
6.5 Druh obalu a velikost balení
Hliníkové blistry po 28, 35, 56, 70 nebo 98 tabletách dispergovatelných v ústech v papírové skládačce. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
8. REGISTRAČNÍ ČÍSLO
EU/1/99/125/001
EU/1/99/125/002
EU/1/99/125/003
EU/1/99/125/004
EU/1/99/125/005
EU/1/99/125/006
EU/1/99/125/007
EU/1/99/125/008
EU/1/99/125/009
EU/1/99/125/010
EU/1/99/125/011
EU/1/99/125/012
EU/1/99/125/013
EU/1/99/125/014
EU/1/99/125/015
EU/1/99/125/016
EU/1/99/125/017
EU/1/99/125/018
EU/1/99/125/019
EU/1/99/125/020
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 3. února 2000
Datum posledního prodloužení registrace: 27. září 2006
10. DATUM REVIZE TEXTU DD/MM/RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ /VÝROB CI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců odpovědných za propouštění šarží
Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky.
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
ZYPREXA VELOTAB 5 mg, tablety dispergovatelné v ústech olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 5 mg
Další pomocné látky: želatina, manitol (E421), aspartam (E951), sodná sůl methylparabenu (E219) a sodná sůl propylparabenu (E217).
28 tablet dispergovatelných v ústech 35 tablet dispergovatelných v ústech 56 tablet dispergovatelných v ústech 70 tablet dispergovatelných v ústech 98 tablet dispergovatelných v ústech
Před použitím si přečtěte příbalovou informaci. Perorální podání
1. Oddělte z blistru jednu část.
2. Opatrně odloupněte zadní fólii.
3. Tabletu j emně vytlačte ven.
4. Tabletu si vložte do úst.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
EU/1/99/125/001 28 tablet dispergovatelných v ústech EU/1/99/125/009 35 tablet dispergovatelných v ústech EU/1/99/125/005 56 tablet dispergovatelných v ústech EU/1/99/125/013 70 tablet dispergovatelných v ústech EU/1/99/125/017 98 tablet dispergovatelných v ústech
Výdej léčivého přípravku vázán na lékařský předpis.
ZYPREXA VELOTAB 5 mg
PC: {číslo} SN: {číslo}
ZYPREXA VELOTAB 5 mg TABLETY DISPERGOVATELNÉ V ÚSTECH: FÓLIE BLISTRU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPREXA VELOTAB 5 mg tablety dispergovatelné v ústech olanzapinum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Lilly
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
Lot.:
5. JINÉ
ZYPREXA VELOTAB 10 mg, tablety dispergovatelné v ústech olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 10 mg
Další pomocné látky: želatina, manitol (E421), aspartam (E951), sodná sůl methylparabenu (E219) a sodná sůl propylparabenu (E217).
28 tablet dispergovatelných v ústech 35 tablet dispergovatelných v ústech 56 tablet dispergovatelných v ústech 70 tablet dispergovatelných v ústech 98 tablet dispergovatelných v ústech
Před použitím si přečtěte příbalovou informaci. Perorální podání
1. Oddělte z blistru jednu část.
2. Opatrně odloupněte zadní fólii.
3. Tabletu j emně vytlačte ven.
4. Tabletu si vložte do úst.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
EU/1/99/125/002 28 tablet dispergovatelných v ústech EU/1/99/125/010 35 tablet dispergovatelných v ústech EU/1/99/125/006 56 tablet dispergovatelných v ústech EU/1/99/125/014 70 tablet dispergovatelných v ústech EU/1/99/125/018 98 tablet dispergovatelných v ústech
Výdej léčivého přípravku vázán na lékařský předpis.
ZYPREXA VELOTAB 10 mg
PC: {číslo} SN: {číslo} NN: {číslo}
29
ZYPREXA VELOTAB 10 mg TABLETY DISPERGOVATELNÉ V ÚSTECH: FÓLIE BLISTRU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPREXA VELOTAB 10 mg tablety dispergovatelné v ústech olanzapinum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Lilly
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
Lot.:
5. JINÉ
ZYPREXA VELOTAB 15 mg, tablety dispergovatelné v ústech olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 15 mg
Další pomocné látky: želatina, manitol (E421), aspartam (E951), sodná sůl methylparabenu (E219) a sodná sůl propylparabenu (E217).
28 tablet dispergovatelných v ústech 35 tablet dispergovatelných v ústech 56 tablet dispergovatelných v ústech 70 tablet dispergovatelných v ústech 98 tablet dispergovatelných v ústech
Před použitím si přečtěte příbalovou informaci. Perorální podání
1. Oddělte z blistru jednu část.
2. Opatrně odloupněte zadní fólii.
3. Tabletu j emně vytlačte ven.
4. Tabletu si vložte do úst.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
EU/1/99/125/003 28 tablet dispergovatelných v ústech EU/1/99/125/011 35 tablet dispergovatelných v ústech EU/1/99/125/007 56 tablet dispergovatelných v ústech EU/1/99/125/015 70 tablet dispergovatelných v ústech EU/1/99/125/019 98 tablet dispergovatelných v ústech
Č.šarže
Výdej léčivého přípravku vázán na lékařský předpis.
ZYPREXA VELOTAB 15 mg
PC: {číslo}
SN: {číslo} NN: {číslo}
ZYPREXA VELOTAB 15 mg TABLETY DISPERGOVATELNÉV ÚSTECH: FÓLIE BLISTRU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPREXA VELOTAB 15 mg tablety dispergovatelné v ústech olanzapinum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Lilly
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
Lot.:
5. JINÉ
ZYPREXA VELOTAB 20 mg, tablety dispergovatelné v ústech olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 20mg
Další pomocné látky: želatina, manitol (E421), aspartam (E951), sodná sůl methylparabenu (E219) a sodná sůl propylparabenu (E217).
28 tablet dispergovatelných v ústech 35 tablet dispergovatelných v ústech 56 tablet dispergovatelných v ústech 70 tablet dispergovatelných v ústech 98 tablet dispergovatelných v ústech
Před použitím si přečtěte příbalovou informaci. Perorální podání
1. Oddělte z blistru jednu část.
2. Opatrně odloupněte zadní fólii.
3. Tabletu j emně vytlačte ven.
4. Tabletu si vložte do úst.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
EU/1/99/125/004 28 tablet dispergovatelných v ústech EU/1/99/125/012 35 tablet dispergovatelných v ústech EU/1/99/125/008 56 tablet dispergovatelných v ústech EU/1/99/125/016 70 tablet dispergovatelných v ústech EU/1/99/125/020 98 tablet dispergovatelných v ústech
Výdej léčivého přípravku vázán na lékařský předpis.
ZYPREXA VELOTAB 20 mg
PC: {číslo} SN: {číslo}
ZYPREXA VELOTAB 20 mg TABLETY DISPERGOVATELNÉV ÚSTECH: FÓLIE BLISTRU
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPREXA VELOTAB 20 mg tablety dispergovatelné v ústech olanzapinum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Lilly
3 POUŽITELNOST
EXP
4. ČÍSLO SARZE
Lot.:
5. JINÉ
Příbalová informace: Informace pro uživatele
ZYPREXA VELOTAB 5 mg tablety dispergovatelné v ústech ZYPREXA VELOTAB 10 mg tablety dispergovatelné v ústech ZYPREXA VELOTAB 15 mg tablety dispergovatelné v ústech ZYPREXA VELOTAB 20 mg tablety dispergovatelné v ústech
Olanzapinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se, prosím, svého lékaře nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek ZYPREXA VELOTAB a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ZYPREXA VELOTAB užívat
3. Jak se přípravek ZYPREXA VELOTAB užívá
4. Možné nežádoucí účinky
5. Jak přípravek ZYPREXA VELOTAB uchovávat
6. Obsah baleni a další informace
1. Co je přípravek ZYPREXA VELOTAB a k čemu se používá
ZYPREXA VELOTAB obsahuje účinnou látku olanzapin. ZYPREXA VELOTAB patří do skupiny léků nazývaných antipsychotika a používá se k léčbě následujících stavů:
• Schizofrenie, nemoc, jejímiž příznaky jsou pocity, že slyšíte, vidíte nebo cítíte věci, které
neexistují, chybná přesvědčení, neobvyklá podezřívavost a následující uzavření se. Lidé trpící touto nemocí se rovněž mohou cítit sklíčeně, úzkostně nebo v napětí.
• Střední až těžké manické epizody, stav, jehož příznaky jsou vzrušení a euforie.
Přípravek ZYPREXA VELOTAB předchází rozvoji těchto příznaků u pacientů s bipolární poruchou, u kterých již dříve manická epizoda odpovídala na léčbu olanzapinem.
2. Čemu musíte věnovat pozornost, než začnete přípravek ZYPREXA VELOTAB užívat Neužívejte přípravek ZYPREXA VELOTAB
• jestliže jste alergický/á (přecitlivělý(á) na olanzapin nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6). Přecitlivělost se projeví jako vyrážka, svědění, opuchlý obličej, oteklé rty nebo dušnost. Dojde-li k tomu po užití přípravku ZYPREXA VELOTAB, oznamte to ošetřujícímu lékaři.
• jestliže trpíte očními problémy, jako je určitý typ glaukomu (zvýšený tlak v oku).
Upozornění a opatření
Před užitím přípravku ZYPREXA VELOTAB se poraďte se svým lékařem.
• Užití přípravku ZYPREXA VELOTAB se u starších pacientů s demencí nedoporučuje, protože může mít vážné nežádoucí účinky.
• Léky tohoto typu mohou způsobovat mimovolní pohyby obličeje nebo jazyka. Dojde-li k tomu po podání přípravku ZYPREXA VELOTAB, oznamte to lékaři.
• Velmi zřídka mohou léky tohoto typu způsobovat horečku, zrychlené dýchání, pocení, svalovou ztuhlost a otupělost nebo ospalost. Dojde-li k tomu, oznamte to ihned lékaři.
• U pacientů užívajících přípravek ZYPREXA VELOTAB byl pozorován nárůst tělesné hmotnosti. Vy i váš lékař byste měli vaši váhu pravidelně kontrolovat. V případě potřeby zvažte konzultaci s dietologem nebo pomoc s dietním plánem.
• U pacientů užívajících přípravek ZYPREXA VELOTAB bylo pozorováno zvýšení hladiny cukru a hladiny tuků (triglyceridy a cholesterol) v krvi. Před zahájením užívání přípravku ZYPREXA VELOTAB a pravidelně v průběhu léčby by váš lékař měl provádět krevní testy pro kontrolu hladiny cukru a některých tuků v krvi.
• Oznamte svému lékaři, pokud se u vás nebo u členů vaší rodiny dříve vyskytly krevní sraženiny, protože užívání léčivých přípravků jako je tento, bylo spojeno s tvorbou krevních sraženin.
Trpíte-li některou z následujících chorob, oznamte to co nejdříve ošetřujícímu lékaři.
• Cévní mozková příhoda nebo malá mozková příhoda (přechodné příznaky cévní mozkové příhody)
• Parkinsonova nemoc
• potíže s prostatou
• střevní neprůchodnost (paralytický ileus)
• onemocnění jater nebo ledvin
• krevní onemocnění
• srdeční onemocnění
• cukrovka
• záchvaty
• pokud víte, že v důsledku dlouhotrvajícího těžkého průjmu a zvracení nebo užívání diuretik (tablet na odvodnění), můžete mít nedostatek solí
Pokud trpíte demencí, vy anebo váš opatrovník nebo příbuzný by měl sdělit vašemu lékaři, pokud jste
někdy prodělal cévní mozkovou příhodu anebo malou mozkovou příhodu.
Je-li vám více než 65 let, může lékař jako běžné opatření kontrolovat váš krevní tlak.
Děti a dospívající
Přípravek ZYPREXA VELOTAB není určen pacientům do 18 let.
Další léčivé přípravky a přípravek ZYPREXA VELOTAB
Během léčby přípravkem ZYPREXA VELOTAB užívejte jiné léky pouze se souhlasem vašeho lékaře.
Současné užívání přípravku ZYPREXA VELOTAB s léky proti depresím, úzkosti, nebo s takovými,
které vám pomáhají spát (trankvilizéry), způsobovat otupělost.
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které
možná budete užívat.
Upozorněte svého lékaře, zejména pokud užíváte:
• léky na Parkinsonovu nemoc
• karbamazepin (lék k léčbě epilepsie a stabilizátor nálady), fluvoxamin (antidepresivum) nebo ciprofloxacin (antibiotikum) - může být zapotřebí upravit dávku přípravku ZYPREXA VELOTAB.
Přípravek ZYPREXA VELOTAB s alkoholem
Během léčby přípravkem ZYPREXA VELOTAB byste neměli pít žádný alkohol, kombinace přípravku společně s alkoholem může způsobovat otupělost.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, pokud se domníváte, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Tento lék by vám neměl být podán, když kojíte, jelikož se malé množství přípravku ZYPREXA VELOTAB může dostat do mateřského mléka.
Následující příznaky se mohou objevit u novorozenců, jejichž matky užívaly přípravek ZYPREXA VELOTAB v posledním trimestru (posledních třech měsících těhotenství): třes, svalová ztuhlost a/nebo slabost, ospalost, rozrušení, dýchací potíže a potíže při kojení. Jestliže se u dítěte objeví kterýkoliv z těchto příznaků, obraťte se na svého lékaře.
Řízení dopravních prostředků a obsluha strojů:
Léčba přípravkem ZYPREXA VELOTAB může způsobovat pocit otupělosti. V tomto případě neřiďte motorová vozidla, neobsluhujte stroje a uvědomte svého lékaře.
Přípravek ZYPREXA VELOTAB obsahuje aspartam, manitol, sodnou sůl methylparabenu a sodnou sůl propylparabenu.
Nemocní, kteří nemohou užívat fenylalanin, by si měli uvědomit, že ZYPREXA VELOTAB obsahuje aspartam, který je zdrojem fenylalaninu. Může být škodlivý pro osoby s fenylketonurií.
Nemocní, kteří nemohou užívat manitol, by si měli uvědomit, že ZYPREXA VELOTAB jej obsahuje.
Přípravek ZYPREXA VELOTAB obsahuje sodnou sůl metylparabenu a propylbarabenu, které mohou u některých osob způsobovat alergické reakce. Alergická reakce se může projevit jako vyrážka, svědění nebo dýchací potíže. Může k nim dojít okamžitě nebo po určité době po podání přípravku ZYPREXA VELOTAB.
3. Jak se přípravek ZYPREXA VELOTAB užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem nebo lékárníkem.
Váš lékař určí, kolik tablet přípravku ZYPREXA VELOTAB brát a jak dlouho je užívat. Denní dávka přípravku ZYPREXA VELOTAB se pohybuje mezi 5 mg a 20 mg. Objeví-li se znovu příznaky nemoci, oznamte to lékaři, ale nepřestaňte s užíváním přípravku ZYPREXA VELOTAB, pokud tak lékař nerozhodne.
Tablety přípravku ZYPREXA VELOTAB byste měli užívat jednou denně dle rady svého lékaře. Pokuste se tablety užívat vždy ve stejnou denní dobu, není důležité, zda během jídla či nalačno. Tablety přípravku ZYPREXA VELOTAB jsou určeny k podání ústy.
Tablety ZYPREXA VELOTAB se snadno lámou, proto s nimi zacházejte opatrně. Tablety se nedotýkejte vlhkýma rukama, může se tím snadno porušit.
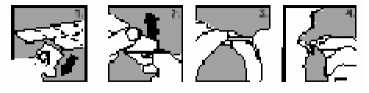
1. Uchopte blistr za okraje a oddělte z něho jednu část odtržením v místě perforace.
2. Opatrně odloupněte zadní fólii.
3. T abletu j emně vytlačte ven.
4. Tabletu si vložte do úst. Rozpustí se přímo v ústech, takže ji můžete snadno spolknout.
Tabletu můžete rovněž vhodit do sklenice plné vody, pomerančového nebo jablečného džusu, mléka nebo kávy a zamíchat. U některých nápojů může dojít ke změně barvy nebo k zakalení. Nápoj ihned vypijte.
Jestliže jste užil(a) více přípravku ZYPREXA VELOTAB, než jste měl(a):
U pacientů, kteří užili větší množství přípravku ZYPREXA VELOTAB než měli, se projevily následující příznaky: zrychlení srdečního tepu, rozčilení/agresivita, problémy s řečí, nezvyklé pohyby (zvláště tváře nebo jazyka), snížená úroveň vnímání. Další známky mohou být: náhlá zmatenost, křeče (epileptické), kóma, kombinace horečky, zrychleného dýchání, pocení, ztuhlosti svalů a ospalosti či spavosti, zpomalení dýchání, aspirace (vdechnutí např. potravy nebo tekutiny), vysoký nebo nízký krevní tlak, abnormální srdeční rytmus. Uvědomte svého lékaře nebo nemocnici ihned, pokud se u vás tyto příznaky objeví. Ukažte lékaři své balení přípravku.
Jestliže jste zapomněl(a) užít přípravek ZYPREXA VELOTAB
Vezměte si lék ihned, jak si to uvědomíte. Neberte si dvě dávky během jednoho dne.
Jestliže jste přestal(a) užívat přípravek ZYPREXA VELOTAB
Nepřestávejte užívat přípravek pouze proto, že se cítíte lépe. Je důležité, abyste přípravek ZYPREXA VELOTAB užíval/a tak dlouho, jak určil váš lékař.
Pokud ukončíte užívání přípravku ZYPREXA VELOTAB náhle, mohou se u vás objevit příznaky jako je pocení, neschopnost spát, třes, úzkost nebo nevolnost a zvracení. Váš lékař vám může navrhnout před ukončením léčby snižovat dávku postupně.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento lék nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Informujte ihned svého lékaře, pokud se u Vás objeví:
• neobvyklé pohyby (častý nežádoucí účinek, který se projevuje až u 1 osoby z 10) obzvlášť obličeje a jazyka.
• krevní sraženiny v žilách (méně častý nežádoucí účinek, který se projevuje až u 1 osoby ze 100) zejména v nohou (příznaky zahrnují otok, bolest a zčervenání nohou), které mohou putovat cévním řečištěm do plic a způsobovat bolest na hrudi a ztížené dýchání. Pokud zaznamenáte jakýkoli z těchto příznaků, ihned vyhledejte lékařskou pomoc.
• kombinace horečky, zrychleného dýchání, pocení, svalové ztuhlosti a otupělosti nebo ospalosti (četnost výskytu tohoto nežádoucího účinku nemůže být z dostupných údajů odhadnuta).
Velmi časté nežádoucí účinky (projevují se u více než 1 osoby z 10) zahrnují přibývání na váze, ospalost a zvýšení hodnot hormonu prolaktinu v krvi. Někteří nemocní mohou na počátku léčby pociťovat závratě nebo mít pocit na omdlení (s pomalou srdeční činností), obzvlášť při vstávání z lehu nebo sedu. Tyto pocity obvykle samy odezní, v opačném případě to oznamte svému lékaři.
Časté nežádoucí účinky (projevují se až u 1 osoby z 10) zahrnují změny hladin některých krvinek, tuků v krvi a na počátku léčby dočasné zvýšení jaterních enzymů, zvýšení hladiny cukrů v krvi a moči, zvýšení hladin kyseliny močové a kreatinfosfokinázy v krvi, pocit zvýšeného hladu, závratě, neklid, třes, neobvyklé pohyby (dyskineze), zácpu, sucho v ústech, vyrážku, slabost, silnou únavu, hromadění vody vedoucí k otokům rukou, kotníků nebo nohou, horečku, bolesti kloubů a sexuální poruchy, jako např. sníženou pohlavní touhu u mužů a žen nebo poruchy erekce u mužů.
Méně časté nežádoucí účinky (projevují se až u 1 osoby ze 100) zahrnují přecitlivělost (např. otok v ústech a krku, svědění, vyrážka), cukrovku nebo zhoršení cukrovky občas spojené s ketoacidózou (ketony v krvi nebo moči) nebo bezvědomím, křeče, obvykle spojené s jejich předchozím výskytem (epilepsie); ztuhlost nebo křeče svalů (včetně očních pohybů), problémy s řečí, pomalou srdeční činnost; přecitlivělost na sluneční světlo; krvácení z nosu, nafouklé břicho, ztrátu paměti nebo zapomnětlivost, neschopnost udržet moč; snížení schopnosti močit; padání vlasů; vynechání nebo prodloužení menstruačního cyklu a změny prsů u mužů a žen, jako např. nenormální tvorba mléka nebo nenormální zvětšení prsů.
Vzácné nežádoucí účinky (projevují se až u losoby z 1000) zahrnují snížení normální tělesné teploty; abnormální srdeční rytmus; náhlé nevysvětlitelné úmrtí; zánět slinivky způsobující silné bolesti břicha, zvýšenou teplotu a nevolnost; jaterní onemocnění projevující se zežloutnutím pokožky a bělma očí; svalové onemocnění projevující se bolestmi nejasného původu a prodlouženou a/nebo bolestivou erekci.
Velmi vzácné nežádoucí účinky zahrnují závažné alergické reakce, jako je léková reakce s eozinofilií a systémovými příznaky (DRESS). DRESS se zpočátku projevuje příznaky podobnými chřipce a vyrážkou v obličeji s následným rozšířením vyrážky, vysokou horečkou, zvětšením lymfatických uzlin, vzestupem hladin jaterních enzymů zjištěných při vyšetření krve a rovněž zvýšením počtu určitého typu bílých krvinek v krvi (eozinofilie).
Během užívání olanzapinu se může u starších pacientů s demencí vyskytnout cévní mozková příhoda, zápal plic, problémy s udržením moči, pády, extrémní únava, zrakové halucinace, zvýšená tělesná teplota, zarudnutí kůže a poruchy chůze. U této skupiny pacientů bylo v několika případech hlášeno úmrtí.
U pacientů s Parkinsonovou chorobou může ZYPREXA VELOTAB zhoršovat její příznaky.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek ZYPREXA VELOTAB uchovávat Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na obalu za zkratkou EXP.
Přípravek ZYPREXA VELOTAB uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek ZYPREXA VELOTAB obsahuje
• Léčivou látkou je olanzapinum. Jedna tableta dispergovatelná v ústech přípravku ZYPREXA VELOTAB obsahuje 5 mg, 10 mg, 15 mg nebo 20 mg léčivé látky. Přesné množství je zobrazeno na vašem balení přípravku ZYPREXA VELOTAB.
• Pomocnými látkami j sou
- želatina, manitol (E421), aspartam (E951), sodná sůl methylparabenu (E219), sodná sůl propylparabenu (E217).
Jak přípravek ZYPREXA VELOTAB vypadá a co obsahuje toto balení
ZYPREXA VELOTAB 5 mg, 10 mg, 15 mg a 20 mg jsou žluté tablety dispergovatelné v ústech. Tableta dispergovatelná v ústech je technický název pro tabletu, která se rozpustí přímo v ústech a může být snadno spolknuta.
Balení přípravku ZYPREXA VELOTAB obsahuje 28, 35, 56, 70 nebo 98 tablet. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko Výrobce
Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgie/Belgique/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32 (0)2 548 84 84
Eb.irapHH
Tn "Enn Hnun HegepnaHg" E.B. - Etnrapnn Ten : + 359 2 491 41 40 Česká republika Eli Lilly ČR, s.r.o.
Tel: + 420 234 664 111 Danmark
Eli Lilly Danmark A/S
Tlf.: + 45 45 26 60 00
Deutschland
Lilly Deutschland GmbH
Tel: + 49 (0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal
Tel: + 372 6817 280
EXláSa
OAPMA2EPB-AIAAY A.E.B.E.
TqX: + 30 210 629 4600
Espana
Lilly S.A.
Tel: + 34 91 663 50 00 France
Lilly France SAS
Tél: + 33 (0) 1 55 49 34 34
Hrvatska
Eli Lilly Hrvatska d.o.o.
Tel: +385 1 2350 999 Ireland
Eli Lilly and Company (Ireland) Limited
Tel: + 353 (0) 1 661 4377
Ísland
Icepharma hf.
Sími: + 354 540 8000 Italia
Eli Lilly Italia S.p.A.
Tel: + 39 055 42571
Kúnpog
Phadisco Ltd
TpX: + 357 22 715000
Lietuva
Eli Lilly Holdings Limited atstovybe Tel: + 370 (5) 2649600 Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32 (0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100 Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500 Nederland
Eli Lilly Nederland B.V.
Tel: + 31(0)30 6025800 Norge
Eli Lilly Norge A.S Tlf: + 47 22 88 18 00 Ósterreich Eli Lilly Ges. m.b.H.
Tel: + 43 (0) 1 711 780 Polska
Eli Lilly Polska Sp. z o.o.
Tel: + 48 (0) 22 440 33 00 Portugal
Lilly Portugal Produtos Farmaceuticos, Lda
Tel: + 351 21 412 66 00
Románia
Eli Lilly Románia S.R.L.
Tel: + 40 21 4023000 Slovenija
Eli Lilly farmacevtska družba, d.o.o Tel: + 386 (0)1 580 00 10 Slovenská republika Eli Lilly Slovakia, s.r.o.
Tel: + 421 220 663 111 Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358 (0)9 8545 250 Sverige
Eli Lilly Sweden AB Tel: + 46 (0)8 7378800
Latvija United Kingdom
Eli Lilly Holdings Limited, parstavnieciba Eli Lilly and Company Limited
Latvija Tel: + 44 (0) 1256 315000
Tel: + 371 67364000
Tato příbalová informace byla naposledy revidována {měsíc RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu
46
Zvýšení plazmatické hladiny prolaktinu bylo hlášeno u 47,4% dospívajících pacientů.