Zypadhera 405 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
ZYPADHERA 210 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna lahvička obsahuje olanzapini embonas monohydricus odpovídající olanzapinum 210 mg. Po rekonstituci jeden ml suspenze obsahuje olanzapinum 150 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem Prášek: žlutý prášek
Rozpouštědlo: čirý, bezbarvý až lehce nažloutlý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Udržovací léčba schizofrenie u dospělých pacientů dostatečně stabilizovaných akutní léčbou perorálním olanzapinem.
4.2 Dávkování a způsob podání
Přípravek ZYPADHERA 210 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem nesmí být zaměněn s olanzapinem 10 mg prášek pro přípravu injekčního roztoku.
Dávkování
Pro stanovení snášenlivosti a odpovědi na léčbu by pacienti měli být před podáním přípravku ZYPADHERA léčeni perorálním olanzapinem.
Pro stanovení první dávky přípravku ZYPADHERA by mělo být u všech pacientů zváženo schéma uvedené v Tabulce 1.
Tabulka 1 Doporučené dávkovací schéma pro převod mezi perorálním olanzapinem a přípravkem ZYPADHERA
|
Cílová dávka perorálního olanzapinu |
Doporučená zahajovací dávka přípravku ZYPADHERA |
Udržovací dávka přípravku ZYPADHERA po 2 měsích léčby |
|
10 mg/den |
210 mg/2 týdny nebo 405 mg/4 týdny |
150 mg/2 týdny nebo 300 mg/4 týdny |
|
15 mg/den |
300 mg/2 týdny |
210 mg/2 týdny nebo 405 mg/4 týdny |
|
20 mg/den |
300 mg/2 týdny |
300 mg/2 týdny |
Úprava dávkování
U pacientů by měly být v průběhu prvního až druhého měsíce léčby pečlivě sledovány známky možného relapsu. Při antipsychotické léčbě může trvat několik dní až týdnů, než dojde ke zlepšení klinického stavu pacienta. Po tuto dobu by měli být pacienti pod pečlivou kontrolou. Dávka může být v průběhu léčby následně upravena na základě individuálního klinického stavu. Po klinickém přehodnocení může být dávka upravena v rozmezí 150 mg až 300 mg každé 2 týdny nebo 300 až 405 mg každé 4 týdny. (Tabulka 1)
Přídavná léčba (suplementace)
Doplnění léčby perorálním olanzapinem nebylo v průběhu dvojitě zaslepených klinických studií povoleno. Pokud je suplementace perorálním olanzapinem klinicky indikována, celková kombinovaná dávka olanzapinu v obou lékových formách by neměla přesáhnout odpovídající maximální dávku perorálního olanzapinu 20 mg/den.
Převedení na jiné léčivé antipsychotické přípravky
Data specificky zaměřená na převedení pacientů z přípravku ZYPADHERA na jiné antipsychotické léčivé přípravky nebyla systematicky shromažďována. Z důvodu pomalého rozpouštění soli olanzapin-embonátu , které způsobuje pomalé kontinuální uvolňování olanzapinu trvající šest až osm měsíců po poslední injekci, je zvláště v průběhu prvních dvou měsíců po ukončení léčby přípravkem ZYPADHERA zapotřebí dohled lékaře v případě, že je klinický důvod k převedení na jiný antipsychotický přípravek.
Zvláštní populace
Starší pacienti
Přípravek ZYPADHERA nebyl systematicky hodnocen u starších pacientů (> 65 let). Přípravek ZYPADHERA se nedoporučuje k léčbě starších pacientů, pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. U pacientů starších 65 let není běžně nižší počáteční dávka (150 mg/4 týdny) nutná, ale měla by být v klinicky odůvodněných případech zvážena (viz bod 4.4). Zahájení léčby přípravkem ZYPADHERA není doporučeno u pacientů starších 75 let (viz bod 4.4).
Pacienti s poruchou funkce ledvin a/nebo jater
U těchto pacientů by přípravek ZYPADHERA neměl být použit, pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. Je vhodné zvážit nižší počáteční dávku (150 mg/4 týdny) u těchto pacientů. V případě středně závažného poškození jater (cirhóza, Child-Pugh class A nebo B) by počáteční dávka měla být 150 mg/4 týdny a zvyšována by měla být opatrně.
Kuřáci
Nekuřákům ve srovnání s kuřáky není třeba upravovat počáteční dávku a dávkové rozmezí. Metabolismus olanzapinu může být kouřením indukován. Je doporučeno monitorovat klinický stav a zvážit zvýšení dávky olanzapinu, pokud to bude považováno za nutné (viz bod 4.5).
Při přítomnosti více než jednoho faktoru, který zpomaluje metabolizmus (ženské pohlaví, vyšší věk, nekuřák) by se mělo zvážit snížení dávky. Zvyšování dávek by mělo být obezřetné, i když je indikované.
Pediatrická populace
Bezpečnost a účinnost přípravku ZYPADHERA u dětí a mladistvích do 18 let nebyla stanovena.
V současnosti dostupné údaje jsou uvedeny v bodech 4,8 a 5.1, ale nelze z nich stanovit doporučení pro dávkování.
Způsob podání
POUZE K INTRAMUSKULÁRNÍMU PODÁNÍ. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ. (Viz bod 4.4)
Přípravek ZYPADHERA by měl být podán pouze hluboko intramuskulárně do gluteálního svalu, zdravotnickým pracovníkem vyškoleným v odpovídající injekční technice, na místě, kde může být zajištěno post-injekční sledování a kde je možné zajistit přístup k odpovídající lékařské péči v případě předávkování.
Po každé injekci by měli být pacienti sledováni na zdravotnickém pracovišti náležitě vyškoleným personálem po dobu nejméně 3 hodin pro zjištění případných známek a příznaků odpovídajících předávkování olanzapinem. Bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování. Při podezření na předávkování by mělo monitorování a důkladný lékařský dohled pokračovat do doby, než vyšetření prokáže odeznění příznaků a známek předávkování (viz bod 4.4.). Podle klinické potřeby se má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
Návod k použití viz bod 6.6.
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Pacienti se známým rizikem angulárního glaukomu.
4.4 Zvláštní upozornění a opatření pro použití
Je nutné věnovat zvýšenou péči odpovídající injekční technice, aby se předešlo neúmyslnému intravaskulárním nebo subkutánnímu podání (viz bod 6.6).
Použití u akutně agitovaných pacientů nebo u pacientů se závážným psychotickým stavem Přípravek ZYPADHERA by neměl být použit k léčbě pacientů se schizofrenií, kteří trpí akutní agitovaností nebo závažným psychotickým stavem, který vyžaduje okamžitou kontrolu příznaků.
Post-injekční syndrom
V klinických studiích před uvedením přípravku na trh byly po aplikaci přípravku ZYPADHERA u pacientů hlášeny reakce představované známkami a symptomy shodnými s příznaky předávkování olanzapinem. K těmto reakcím došlo u přibližně <0,1% injekcí a přibližně u 2% pacientů. U většiny těchto pacientů došlo k rozvoji známek sedace (v rozmezí od mírné sedace až po kóma) a/nebo deliria, (včetně zmatenosti, dezorientace, agitovanosti, úzkosti a dalších kognitivních poruch). Mezi další zaznamenané příznaky patřily extrapyramidové příznaky, dysartrie, ataxie, agresivita, závratě, slabost, hypertenze a křeče. Ve většině případů se prvotní známky a příznaky spojené s touto reakcí objevily v průběhu 1 hodiny po injekci a ve všech případech bylo hlášeno plné zotavení během 24-72 hodin po injekci. K reakcím došlo vzácně (<1 z 1 000 injekcí) mezi 1 a 3 hodinami a velmi vzácně (<1 z 10 000 injekcí) po 3 hodinách. Pacienti by měli být seznámeni s tímto potenciálním rizikem a s nutností zůstat na pozorování na zdravotnickém pracovišti po dobu 3 hodin po každé aplikaci přípravku ZYPADHERA. Od doby registrace přípravku ZYPADHERA jsou postmarketingová hlášení týkající se post-injekčního syndromu obecně v souladu se zkušenostmi získanými z klinických studií.
Pacienti by měli být po každé injekci sledováni na zdravotnickém pracovišti náležitě vyškoleným personálem po dobu nejméně 3 hodin pro zjištění známek a příznaků odpovídajících předávkování olanzapinem.
Bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování. Při podezření na předávkování by mělo monitorování a důkladný lékařský dohled pokračovat do doby, než vyšetření prokáže odeznění příznaků a známek předávkování. Podle klinické potřeby se má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
Pacienti by měli být poučeni, aby po zbytek dne po injekci sledovali případné známky a symptomy předávkování vyplývající z post-injekčního syndromu, aby byli schopni si v případě nutnosti zajistit pomoc, a že by neměli řídit ani obsluhovat nebezpečné stroje (viz bod 4.7).
Pokud je pro zvládnutí post-injekčních nežádoucích účinků nutné podání benzodiazepinů, je doporučeno důkladné vyhodnocení klinického stavu s ohledem na nadměrnou sedaci a kardiorespirační útlum (viz bod 4.5).
Nežádoucí účinky v místě aplikace
Nejčastěji hlášeným nežádoucím účinkem spojeným s místem aplikace byla bolest. Většina těchto nežádoucích účinků byla hlášena jako „mírné“ až „střední“ intenzity. Vyskytne-li se nežádoucí účinek v místě aplikace, měla by být ke zvládnutí této příhody přijata odpovídající opatření (viz bod 4.8).
Psychózy a poruchy chování související s demencí
Olanzapin není doporučen k podávání u pacientů s psychózou a/nebo poruchami chování souvisejícími s demencí z důvodu zvýšené mortality a zvýšeného rizika cerebrovaskulárních příhod. V placebem kontrolovaných studiích (v délce 6-12 týdnů) u starších pacientů (průměrný věk 78 let) s psychózou a/nebo poruchami chování souvisejícími s demencí byla u pacientů léčených perorálním olanzapinem dvojnásobná incidence úmrtí ve srovnání s pacienty užívajícími placebo (3,5% vs. 1,5% resp.). Vyšší incidence úmrtí nesouvisela s dávkou olanzapinu (průměrná denní dávka 4,4 mg) nebo s délkou léčby. Rizikovými faktory, které se mohou podílet na zvýšené mortalitě u této skupiny pacientů, jsou věk nad 65 let, dysfagie, sedace, malnutrice a dehydratace, plicní onemocnění (např. pneumonie, ev. i s aspirací) nebo současné užívání benzodiazepinů. Vyšší incidence úmrtí u pacientů léčených perorálním olanzapinem ve srovnání s pacienty užívajícími placebo byla však na uvedených rizikových faktorech nezávislá.
Ve stejných klinických studiích byly hlášeny cerebrovaskulární nežádoucí účinky (např. iktus, tranzitorní ischemické ataky), včetně úmrtí. U pacientů léčených perorálním olanzapinem bylo zaznamenáno trojnásobné zvýšení výskytu cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (1,3% vs. 0,4%, resp.). U všech pacientů léčených perorálním olanzapinem nebo placebem, u nichž se cerebrovaskulární příhoda vyskytla, byly přítomny rizikové faktory. K faktorům, které byly zjištěny jako rizikové u pacientů léčených olanzapinem, patřil věk nad 75 let a vaskulární a/nebo smíšená demence. Účinnost olanzapinu v těchto studiích nebyla stanovena.
Parkinsonova choroba
Použití olanzapinu k léčbě psychózy související s podáváním dopaminového agonisty u pacientů s Parkinsonovou chorobou se nedoporučuje. V klinických studiích bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symptomatiky a halucinací (viz bod 4.8) a perorální olanzapin nebyl v léčení psychotických příznaků účinnější než placebo. V těchto studiích museli mít pacienti na začátku studie stabilní a nejnižší účinnou dávku antiparkinsonika (dopaminového agonisty). Toto antiparkinsonikum jim bylo podáváno ve stejné dávce po celou zbývající dobu studie. Počáteční dávka perorálního olanzapinu byla 2,5 mg/den a podle uvážení lékaře mohla být titrována do maximální dávky 15 mg/den.
Neuroleptický maligní syndrom (NMS)
NMS je potenciálně život ohrožující stav spojený s podáváním antipsychotik. Vzácné případy označené jako NMS byly rovněž hlášeny v souvislosti s perorálním olanzapinem. Klinické příznaky NMS jsou hyperpyrexie, svalová rigidita, alterovaná psychika a příznaky autonomní instability (nepravidelný pulz anebo tlak krve, tachykardie, pocení a arytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní renální selhání. Pokud se u pacienta objeví příznaky podezřelé ze spojení s NMS nebo pokud se objeví nevysvětlitelně vysoká horečka i bez dalších klinických známek NMS, musí být všechna antipsychotika včetně olanzapinu vysazena.
Hyperglykémie a diabetes
Méně často byly hlášeny hyperglykémie a/nebo rozvoj nebo exacerbace diabetů, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.8). V některých případech tomu předcházelo zvýšení tělesné hmotnosti, což mohlo být predispozičním faktorem. V souladu s používanými pravidly antipsychotické léčby je doporučeno příslušné klinické monitorování, např. měření hladiny glukózy v krvi před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy jednou ročně. U pacientů léčených jakýmikoliv antipsychotickými léčivy, včetně přípravku ZYPADHERA, by měly být sledovány známky a příznaky hyperglykémie (jako je polydipsie, polyurie, polyfagie a slabost) a pacienti s diabetem nebo s rizikovými faktory pro rozvoj diabetu by měli být pravidelně monitorováni s ohledem na zhoršení kontroly hladiny glukózy. Pravidelně by měla být kontrolována tělesná hmotnost, např. před začátkem léčby, 4, 8 a 12 týdnů po záhájení podávání olanzapinu a následně vždy každé tři měsíce.
Změny hladin lipidů
V placebem kontrolovaných klinických studiích byly u pacientů léčených olanzapinem pozorovány nežádoucí změny hladin lipidů (viz bod 4.8). Změny lipidového profilu by měly být ošetřeny podle klinické potřeby, obzvláště u pacientů s dyslipidemií a u pacientů s rizikovými faktory pro rozvoj poruch lipidů. U pacientů léčených jakýmikoliv antipsychotickými léčivy, včetně přípravku ZYPADHERA, by v souladu s používanými pravidly antipsychotické léčby měly být pravidelně kontrolovány hladiny lipidů, např. před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy každých 5 let.
Anticholinergní aktivita.
Ačkoliv byla in vitro prokázána anticholinergní aktivita olanzapinu, zkušenosti během klinických studií ukázaly nízkou incidenci souvisejících příhod. Protože však klinické zkušenosti s podáváním olanzapinu u pacientů s jiným souběžným onemocněním jsou omezené, doporučuje se zvýšená pozornost, pokud je olanzapin předepisován pacientům s hypertrofií prostaty, paralytickým ileem nebo podobnými stavy.
Jaterní funkce
Často, obzvlášť v počátcích léčby, bylo pozorováno přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz, ALT a AST. U pacientů s vyšší hladinou ALT a/nebo AST, se známkami a příznaky poškození jater, s preexistující sníženou funkční rezervou jaterní funkce a u pacientů léčených potenciálně hepatotoxickými přípravky je třeba opatrnosti a dalšího sledování. Je-li u pacientů diagnostikována hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater), je třeba léčbu olanzapinem ukončit.
Neutropenie
Opatrnosti je třeba u pacientů s nižším počtem leukocytů a/nebo neutrofilů z jakýchkoliv příčin, u pacientů užívajících léky způsobující neutropenii, u pacientů s anamnézou polékového útlumu kostní dřeně nebo útlumem kostní dřeně způsobeným souběžným onemocněním, radiační terapií nebo chemoterapií, u pacientů s hypereozinofilií nebo s myeloproliferativní chorobou. Neutropenie byla často hlášena při současném podávání olanzapinu a valproátu (viz bod 4.8).
Přerušení léčby
Při náhlém přerušení léčby perorálním olanzapinem byly vzácně (> 0,01% a < 0,1%) hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nauzea nebo zvracení.
QT interval
V klinických studiích bylo u pacientů léčených perorálním olanzapinem klinicky významné prodloužení QTc intervalu (korekce QT podle Fridericii [QTcF] > 500 millisekund [ms] kdykoliv po vstupním vyšetření u pacientů se vstupní hodnotou QTcF < 500 ms) méně časté (0,1% až 1%), bez signifikantních rozdílů v průvodních srdečních příhodách ve srovnání s placebem. V klinických studiích s olanzapinem práškem pro přípravu roztoku pro injekce nebo s přípravkem ZYPADHERA nebylo podávání olanzapinu spojeno s přetrvávajícím zvýšením absolutního QT nebo QTCc intervalu.
Přesto je třeba zvýšené opatrnosti, je-li olanzapin předepisován s léky prodlužujícími QTc interval, obzvlášť u starších pacientů, u pacientů s vrozeným prodloužením QT intervalu, s městnavým srdečním selháním, se srdeční hypertrofií, s hypokalémií nebo hypomagnezémií.
Tromboembolismus
Časová souvislost léčby olanzapinem a žilního tromboembolismu byla hlášena méně často (> 0,1% a < 1%). Kauzální vztah mezi výskytem žilního tromboembolismu a léčbou olanzapinem nebyl stanoven. Avšak protože u pacientů se schizofrenií jsou často přítomny získané rizikové faktory žilního tromboembolismu, je nutné identifikovat a vzít v úvahu všechny možné rizikové faktory, např. imobilizaci pacientů, a vykonat preventivní opatření.
Obecná CNS aktivita
Vzhledem k primárnímu účinku olanzapinu na centrální nervovou soustavu je třeba opatrnosti při současném užívání s jinými centrálně působícími léky či alkoholem. Protože olanzapin působí in vitro jako dopaminový antagonista, může působit proti účinku přímých a nepřímých agonistů dopaminu.
Křeče
Olanzapin by měl být používán opatrně u pacientů s křečemi v anamnéze, anebo u těch, u kterých se vyskytují faktory snižující křečový práh. U pacientů léčených olanzapinem byly křeče hlášeny méně často. Ve většině těchto případů byly hlášeny křeče v anamnéze či jiné rizikové faktory.
Tardivní dyskineze
V ročních nebo kratších srovnávacích studiích byl perorální olanzapin statisticky významně méně často spojen s nově hlášenou dyskinezí. Přesto riziko pozdní dyskineze při dlouhodobém užívání vzrůstá. Pokud se u pacienta léčeného olanzapinem objeví známky a symptomy pozdní dyskineze, mělo by se zvážit snížení dávky nebo přerušení podávání. Tyto symptomy se mohou přechodně zhoršit nebo se objevit po přerušení léčby.
Posturální hypotenze
V klinických studiích s olanzapinem byla zřídka u starších pacientů pozorována posturální hypotenze. U pacientů starších 65 let je doporučeno pravidelně měřit krevní tlak.
Náhlá srdeční smrt
V postmarketingovém sledování olanzapinu byly u pacientů léčených olanzapinem nahlášeny případy náhlé srdeční smrti. V retrospektivní observační kohortové studii bylo riziko předpokládané náhlé srdeční smrti u pacientů léčených olanzapinem přibližně dvojnásobné oproti pacientům, kteří neužívali antipsychotika. V této studii bylo riziko při užívání olanzapinu porovnatelné s rizikem užívání atypických antipsychotik spojených do jedné analýzy.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících. Klinická hodnocení provedená u pacientů ve věkovém rozmezí 13-17 let ukázala různé nežádoucí účinky, včetně nárůstu tělesné hmotnosti, změny metabolických parametrů a zvýšení hladiny prolaktinu (viz body 4.8 a 5.1).
Použití u starších pacientů (>75let)
O použití přípravku ZYPADHERA u pacientů starších 75 let nejsou k dispozici žádné údaje.
Vzhledem k biochemickým a fyziologickým změnám a vzhledem k redukci svalové hmoty není u této podskupiny pacientů doporučeno tuto lékovou formu nasazovat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí byly provedeny pouze u dospělých.
Zvýšená opatrnost je zapotřebí u pacientů užívajících léčivé přípravky, které mohou indukovat hypotenzi nebo sedaci.
Možné interakce ovlivňující o1a.nza.pin
Vzhledem k tomu, že je olanzapin metabolizován izoenzymem CYP1A2, mohou látky, které specificky tento izoenzym indukují nebo inhibují, ovlivnit farmakokinetiku olanzapinu.
Indukce CYP1A2
Kouření a karbamazepin mohou indukovat metabolizmus olanzapinu, což může vést ke snížení koncentrace olanzapinu. Bylo pozorováno zanedbatelné, případně jen mírné zvýšení clearance olanzapinu. I když je klinický dopad pravděpodobně minimální, doporučuje se klinické monitorování a v nezbytných případech je možné zvážit zvýšení dávek olanzapinu (viz bod 4.2).
Inhibice CYP1A2
Prokázalo se, že fluvoxamin, specifický inhibitor CYP1A2, významně zpomaluje metabolizmus olanzapinu. Průměrné zvýšení maximální koncentrace (Cmax) olanzapinu fluvoxaminem bylo 54 % u žen nekuřaček a 77 % u mužů kuřáků. Průměrné zvýšení plochy pod křivkou koncentrace léčiva (AUC) bylo 52 % u žen a 108 % u mužů. U pacientů užívajících fluvoxamin nebo jiný inhibitor CYP1A2, jako např. ciprofloxacin, je třeba uvážit snížení počáteční dávky olanzapinu. Při zahájení léčby inhibitorem CYP1A2 je třeba uvážit snížení dávek olanzapinu.
Fluoxetin (inhibitor CYP2D6), jednorázové dávky antacida (hliník, hořčík) nebo cimetidinu neměly významný vliv na farmakokinetiku olanzapinu.
Možnosti ovlivnění účinku, jiných léků olanzapinem
Olanzapin může působit proti účinkům přímých a nepřímých agonistů dopaminu.
Olanzapin in vitro neinhibuje hlavní izoenzymy CYP450 ( např. 1A2, 2D6, 2C9, 2C19, 3A4). Neočekávají se proto žádné zvláštní interakce, což dokazují i in vivo studie, které neprokázaly inhibici metabolizmu následujících léčivých látek: tricyklická antidepresiva (reprezentující převážně CYP2D6 cestu metabolizace), warfarin (CYP2C9), theofylin (CYP1A2) nebo diazepam (CYP3A4 a 2C19).
Olanzapin nevykazoval interakci se současně podáváným lithiem nebo biperidenem.
Terapeutické monitorování plazmatických hladin valproátu neukázalo, že by byla při zahájení přídatné medikace olanzapinem nutná úprava dávkování valproátu.
Obecná CNS aktivita
Zvýšená opatrnost je zapotřebí u pacientů konzumujících alkohol nebo užívajících léčivé přípravky působící tlumivě na CNS.
Současné užívání olanzapinu a léčivých přípravků k léčbě Parkinsonovy choroby a demence není doporučeno (viz bod 4.4).
QTc interval
Zvýšená opatrnost je zapotřebí u pacientů užívajících současně olanzapin a léčivé přípravky, o kterých je známo, že prodlužují QTc interval (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Neexistují žádné přiměřené a dobře vedené studie u gravidních žen. Pacientky by měly být poučené, aby lékaře informovaly o graviditě anebo o plánované graviditě během užívání olanzapinu. Kvůli nedostatku zkušeností by olanzapin měl být v graviditě podávaný pouze tehdy, pokud jeho potenciální prospěšnost vyváží potenciální nebezpečí pro plod.
U novorozenců, kteří byli vystaveni antipsychotikům (včetně olanzapinu) během třetího trimestru těhotenství, existuje riziko výskytu nežádoucích účinků zahrnujících extrapyramidové a/nebo abstinenční příznaky, které se mohou po porodu lišit v závažnosti a délce trvání. Byly hlášeny případy agitovanost, hypertonie, hypotonie, tremoru, somnolence, dechové tísně nebo potíží při kojení. Novorozenci proto musejí být pečlivě sledováni.
Kojení
Ve studii perorálního olanzapinu u kojících zdravých žen byl olanzapin vylučován do mateřského mléka. Průměrná expozice dítěte (mg/kg) v rovnovážném stavu byla odhadnuta na 1,8 % z dávky olanzapinu podaného matce (mg/kg). Pacientky je třeba poučit, aby během užívání olanzapinu nekojily.
Fertilita
Účinky na fertilitu nejsou známy (viz bod 5.3 pro preklinické informace).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Jelikož olanzapin může způsobit ospalost a závratě, pacienti by měli být opatrní při obsluze strojů včetně řízení motorových vozidel.
Pacienti by měli být poučeni, aby se vyvarovali řízení nebo obsluhy strojů po zbytek dne, ve kterém obdrželi injekci, z důvodu možného výskytu post-injekčního syndromu vedoucího k příznakům shodným s příznaky předávkování olanzapinem (viz bod 4.4).
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Nežádoucí účinky pozorované u olanzapin-embonátu
Při podávání přípravku ZYPADHERA se vyskytly reakce post-injekčního syndromu vedoucí k symptomům shodným s předávkováním olanzapinem (viz bod 4.2 a 4.4). Klinické známky a symptomy zahrnovaly příznaky sedace (v rozmezí od mírné sedace až po kóma) a/nebo delirium (včetně zmatenosti, dezorientace, agitovanosti, úzkosti a dalších kognitivních poruch). Mezi další zaznamenané příznaky patřily extrapyramidové příznaky, dysartrie, ataxie, agresivita, závratě, slabost, hypertenze a křeče.
Další nežádoucí účinky pozorované u pacientů léčených přípravkem ZYPADHERA byly podobné nežádoucím účinkům pozorovaným u perorálního olanzapinu. V klinických studiích s přípravkem ZYPADHERA byla sedace jediným nežádoucím účinkem hlášeným staticky významně častěji ve skupině přípravku ZYPADHERA oproti skupině placeba (ZYPADHERA 8,2 %, placebo 2,0 %). U všech pacientů léčených přípravkem ZYPADHERA byla sedace hlášena u 4,7 % pacientů.
V klinických studiích s přípravkem ZYPADHERA byl výskyt nežádoucích účinků v místě aplikace přibližně 8 %. Nejčastěji hlášeným nežádoucím účinkem v místě aplikace byla bolest (5 %); některé další nežádoucí účinky v místě podání byly (dle klesající frekvence výskytu): nodulární zatvrdnutí, zarudnutí, nespecifické místní reakce, iritace, otoky, podlitiny, krvácení a anestézie. K těmto reakcím došlo o 0,1 až 1,1 % pacientů.
V přehledu údajů o bezpečnosti z klinických hodnocení a ze spontánních postmarketingových hlášení byl absces v místě vpichu hlášen vzácně (> 1/10000 až < 1/1000).
Nežádoucí účinky pozorované u olanzapinu
Nežádoucí účinky uvedené níže byly pozorovány po podání olanzapinu.
Dospělí
Nejčastěji hlášenými (pozorované u > 1% pacientů) nežádoucími účinky spojenými s užíváním olanzapinu v klinických studiích byla somnolence, zvýšení tělesné hmotnosti, eozinofilie, zvýšené hladiny prolaktinu, cholesterolu, glukózy a triglyceridů (viz bod 4.4), glykosurie, zvýšená chuť k jídlu, závratě, akatizie, parkinsonismus, leukopenie, neutropenie (viz bod 4.4), dyskineze, ortostatická hypotenze, anticholinergní účinky, přechodné asymptomatické zvýšení jaterních aminotransferáz (viz bod 4.4), rash, asténie, únava, horečka, artralgie, zvýšené hodnoty alkalické fosfatázy, gamma glutamyltransferázy, kyseliny močové a kreatinfosfokinázy a otok.
Seznam nežádoucích účinků v tabulkovém formátu
Následující tabulka podává seznam nežádoucích účinků a laboratorních nálezů pozorovaných ve spontánních hlášeních a v klinických hodnoceních. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000) a není známo (z dostupných údajů nelze určit).
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Poruchy krve a lymfatického systému | ||||
|
Eozinofilie Leukopenie10 Neutropenie10 |
Trombocytopenie11 | |||
|
Poruchy imunitního systému | ||||
|
Hypersenzitivita11 | ||||
|
Poruchy metabolismu a výživy | ||||
|
Přibývání na váze1 |
Zvýšené hladiny cholesterolu2,3 Zvýšené hladiny glukózy4 Zvýšené hladiny triglyceridů2,5 Glykosurie Zvýšená chuť k jídlu |
Vznik nebo exacerbace diabetu, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.4) 11 |
Hypotermie12 | |
|
Poruchy nervového systému | ||||
|
Somnolence |
Závratě Akatizie6 Parkinsonismus6 Dyskineze6 |
Křeče, kdy ve většině případů byly hlášeny křeče v anamnéze či jiné rizikové faktory pro vznik křečí11 Dystonie (včetně okulogyrické krize)— Tardivní dyskineze11 Amnézie9 Dysartrie |
Neuroleptický maligní syndrom (viz bod 4.4)02 Příznaky z '7, 12 vysazení — | |
|
Srdeční poruchy | ||||
|
Bradykardie Prodloužení QTc intervalu (viz bod 4.4) |
Ventrikulární tachykardie/fibrilac e, náhlá smrt (viz bod 4.4)11 | |||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Cévní poruchy | ||||
|
Ortostatická |
Tromboembolismus (včetně pulmonární embolie a hluboké žilní trombózy) (viz bod 4.4) | |||
|
Respirační, hrudní a mediastinální poruchy | ||||
|
Epistaxe9 | ||||
|
Gastrointestinalní poruchy | ||||
|
Mírné přechodné anticholinergní účinky včetně obstipace a suché ústní sliznice |
Břišní distenze9 |
Pankreatitida— | ||
|
Poruchy jater a žlučových cest | ||||
|
Přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz (ALT, AST) obzvlášť na počátku léčby (viz bod 4.4) |
Hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození j ater)— | |||
|
Poruchy kůže a pot |
kožní tkáně | |||
|
Rash |
Fotosenzitivní reakce Alopecie | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||||
|
Artralgie9 |
Rhabdomyolýza11 | |||
|
Poruchy ledvin a močových cest | ||||
|
Inkontinence moči, Retence moči Opožděný začátek močení11 | ||||
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím | ||||
|
Syndrom z vysazení u novorozenců (viz bod 4.6) | ||||
|
Poruchy reprodukčního systému a prsu | ||||
|
Erektilní dysfunkce u mužů Snižení libida u mužů i žen |
Amenorea Zvětšení prsou Galaktorea u žen Gynekomastie/zvětše ní prsou u mužů |
Priapismus12 | ||
|
Celkové poruchy a reakce v místě aplikace | ||||
|
Asténie Únava Otok Horečka10 Bolest v místě vpichu |
Absces v místě vpichu | |||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Vyšetření | ||||
|
Zvýšené hodnoty alkalické fosfatázy3 Vysoká hladina kreatinfosfokinázy4 Vysoká hladina gamma |
Zvýšené hodnoty celkového bilirubinu | |||
'Klinicky významné zvýšení tělesné hmotnosti bylo pozorována napříč všemi základními kategoriemi dle BMI (Body Mass Index). Při krátkodobé léčbě (medián trvání 47 dnů) bylo zvýšení tělesné hmotnosti o > 7 % velmi časté (22,2 %), o > 1 5% časté (4,2 %) a o > 25 % bylo méně časté (0,8 %). Zvýšení tělesné hmotnosti o > 7%, o > 15 % a o > 25 % oproti počáteční hodnotám bylo u pacientů s dlouhodobou expozicí (nejméně 48 týdnů) velmi časté (64,4 %, 31,7 %, resp. 12,3 %).
2Průměrné zvýšení hodnot lipidů nalačno (celkový cholesterol, LDL cholesterol a triglyceridy) bylo vyšší u pacientů bez prokázané poruchy regulace tuků na začátku léčby.
3Pozorováno pro normální počáteční hladiny nalačno (< 5,17 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 6,2 mmol/l). Změny počátečních hodnot celkového cholesterolu nalačno z hraničních (>
5,17 až < 6,2 mmol/l) na vysoké (> 6,2 mmol/l) byly velmi časté.
4Pozorováno pro normální počáteční hladiny glukózy nalačno (< 5,56 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 7 mmol/l). Změny počátečních hodnot glukózy nalačno z hraničních (> 5,56 až < 7 mmol/l) na vysoké (> 7 mmol/l) byly velmi časté.
5Pozorováno pro normální počáteční hladiny nalačno (< 1,69 mmol/l), které vzrostly na vysoké (> 2,26 mmol/l). Změny počátečních hladin triglyceridů nalačno z hraničních hodnot (> 1,69 mmol/l až < 2,26 mmol/l) na vysoké (> 2,26 mmol/l) byly velmi časté.
6V klinických studiích byl výskyt parkinsonismu a dystonie u pacientů léčených olanzapinem číselně vyšší, ale statisticky se signifikantně nelišil od placeba. Parkinsonismus, akathisie a dystonie se vyskytly vzácněji při užívání olanzapinu než při užívání odpovídajících dávek haloperidolu. Vzhledem k nedostatku podrobných informací o akutních a pozdních extrapyramidových příznacích v anamnéze není možné rozhodnout, zda olanzapin způsobuje méně tardivní dyskineze a/nebo dalších pozdních extrapyramidových příznaků.
7Při náhlém přerušení léčby olanzapinem byly hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nevolnost a zvracení.
12 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla odhadnuta na horní hranici 95% intervalu spolehlivosti s využitím integrované databáze olanzapinu.
Dlouhodobá expozice (nejméně 48 týdnů)
Procento pacientů, u kterých se projevily nežádoucí klinicky signifikatní změny tělesné hmotnosti, glukózy, celkového/LDL/HDL cholesterolu nebo triglyceridů, se zvyšilo v čase. U dospělých pacientů, kteří ukončili léčbu v délce 9-12 měsíců, se rychlost zvyšování průměrných hodnot glukózy v krvi zpomalila přibližně po 6 měsících.
Další informace týkající se specifických populací
V klinických studiích u starších pacientů s demencí byla léčba olanzapinem spojena s vyšší incidencí úmrtí a cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (viz také 4.4). Velmi časté nežádoucí účinky spojené s užíváním olanzapinu u této skupiny pacientů byly abnormální chůze a pády. Často byly pozorované pneumonie, zvýšení tělesné teploty, letargie, erythém, zrakové halucinace a inkontinence moči.
V klinických studiích u pacientů s Parkinsonovou chorobou s lékově vyvolanou psychózou související s podáváním dopaminového agonisty bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symtpomatiky a halucinace.
V jedné klinické studii u pacientů v manické fázi bipolární poruchy měla léčba valproátem
v kombinaci s olanzapinem za následek 4,1% incidenci neutropenie; potenciálně přispívajícím faktorem mohly být vysoké plazmatické hladiny valproátu. Současné podání olanzapinu s lithiem nebo valproátem vedlo ke zvýšení výskytu (>10 %) tremoru, sucha v ústech, zvýšené chuti k jídlu a zvýšení tělesné hmotnosti. Poruchy řeči byly také hlášeny často. Při léčbě olanzapinem v kombinaci s lithiem nebo divalproexem došlo v akutní fázi léčby (trvající max. 6 týdnů) ke zvýšení tělesné hmotnosti o >7 % u 17,4 % pacientů. Dlouhodobá léčba olanzapinem (trvající až 12 měsíců) pro prevenci rekurence u pacientů s bipolární poruchou byla doprovázena zvýšením tělesné hmotnosti o >7 % u 39,9 % pacientů.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících mladších 18 let. Ačkoli nebyly provedeny studie navržené pro porovnání dospívajících a dospělých pacientů, data z klinických hodnocení dospívajících byla srovnána s údaji získanými ze studií u dospělých.
Následující tabulka shrnuje nežádoucí účinky hlášené s vyšší četností u dospívajících pacientů (ve věku 13-17 let) oproti dospělým pacientům, nebo nežádoucí účinky identifikované pouze v průběhu klinických hodnocení u dospívajících pacientů. Klinicky významné zvýšení tělesné hmotnosti (> 7 %) se zdá, že se vyskytuje u dospívajících pacientů oproti dospělým s vyšší frekvencí. Velikost hmotnostního přírůstku a procento dospívajících pacientů s klinicky signifikantním nárůstem tělesné hmotnosti bylo větší při dlouhodobé expozici (nejméně 24 týdnů) než při krátkodobém používání.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10).
Poruchy metabolismu a výživy
Velmi časté: Zvýšení tělesné hmotnosti13, zvýšené hladiny triglyceridů14, zvýšená chuť k jídlu.
Časté: Zvýšené hladiny cholesterolu15_
Poruchy nervového systému
Velmi časté: Sedace (zahrnující: hypersomnii, letargii, ospalost)._
Gastrointestinální poruchy
Časté: Sucho v ústech_
Poruchy jater a žlučových cest
Velmi časté: Zvýšené hladiny jaterních aminotransferáz (ALT/AST; viz bod 4.4)._
Vyšetření
Velmi časté: Snížené hodnoty celkového bilirubinu, zvýšení hodnoty GMT, zvýšení plazmatických hladin prolaktinu16._
13 Při krátkodobé léčbě (medián trvání 22 dnů) bylo zvýšení tělesné hmotnosti o > 7 % počáteční tělesné hmotnosti (kg) velmi časté (40,6 %), zvýšení tělesné hmotnosti o > 15 % bylo časté (7,1 %) a zvýšení o > 25 % bylo časté (2,5 %). Při dlouhodobé expozici (nejméně 24 týdnů) došlo k nárůstu tělesné hmotnosti u 89,4 % o > 7 %, u 55,3 % o > 15 % a u 29,1 % o > 25 % oproti jejich počáteční tělesné hmotnosti.
14 Pozorováno pro normální počáteční hladiny nalačno (< 1,016 mmol/l), které vzrostly na vysoké (> 1,467 mmol/l) a změny počátečních hladin triglyceridů nalačno z hraničních hodnot na počátku (> 1,016 mmol/l až < 1,467 mmol/l) na vysoké (> 1,467 mmol/l).
15 Změny počátečních hodnot celkového cholesterolu nalačno, kdy došlo ke zvýšení hladin
z normálních na počátku (< 4,39 mmol/l) na vysoké (> 5,17 mmol/l), byly pozorovány často. Změny počátečních hodnot celkového cholesterolu nalačno z hraničních na počátku (> 4,39 až < 5,17 mmol/l) na vysoké (> 5,17 mmol/l) byly velmi časté.
16 Zvýšené plazmatické hladiny prolaktinu byly hlášeny u 47,4 % dospívajících pacientů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Pokud jsou zjištěny známky a příznaky předávkování shodné s post-injekčním syndromem, měla by být přijata odpovídající podpůrná opatření (viz bod 4.4).
Vzhledem k tomu, že předávkování parenterálním přípravkem je méně pravděpodobné než perorálními léčivými přípravky, jsou zde pro referenci uvedeny informace týkající se předávkování perorálním olanzapinem:
Známky a příznaky
Mezi velmi časté příznaky (výskyt > 10 %) předávkování patří tachykardie, agitovanost/agresivita, dysartrie, různé extrapyramidové příznaky a snížená úroveň vědomí, v rozmezí mezi sedací a komatem.
Další zdravotně významné důsledky předávkování zahrnují delirium, křeče, koma, možný neuroleptický maligní syndrom, útlum dýchání, aspiraci, hypertenzi nebo hypotenzi, srdeční arytmie (<2 % případů předávkování) a zástavu dýchání a srdeční činnosti. Smrtelné případy byly hlášeny už
po akutním předávkování perorální dávkou 450 mg, ale rovněž bylo popsáno přežití po akutním předávkování dávkou 2 g perorálního olanzapinu.
Léčba
Proti olanzapinu neexistuje žádné specifické antidotum. Podle klinického stavu je potřebné zahájit symptomatickou léčbu a sledování vitálních funkcí, zahrnující léčbu hypotenze, cirkulačního kolapsu a podporu funkce dýchání. Nesmí být používán adrenalin, dopamin nebo jiná p sympatomimetika, protože stimulace p adrenergních receptorů může prohloubit hypotenzi. Sledování kardiovaskulárních parametrů je nezbytné kvůli diagnostice možných poruch srdečního rytmu. Pacient musí být až do zotavení pod stálým lékařským dohledem a musí být sledovány jeho vitální funkce.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, diazepiny, oxazepiny, thiazepiny a oxepiny,
ATC kód: N05AH03
Farmakodynamické účinky
Olanzapin je antipsychotická, antimanická a náladu stabilizující látka, která vykazuje široké farmakologické působení na řadu receptorových systémů.
V preklinických studiích vykazuje olanzapin širokou afinitu k řadě receptorů (Ki<100 nM) pro serotonin 5HT2A/2C, 5HT3, 5HT6, dopamin Di, D2, D3, D4, D5, cholinergní muskarinové receptory (Mi-M5), a1 adrenergní a histaminové H1 receptory. Behaviorální studie na zvířatech prokázaly antagonistické působení olanzapinu na 5HT, dopaminové a cholinergní receptory konzistentní s receptorovým profilem. Olanzapin vykazoval větší in vitro afinitu k serotoninovým 5HT2 receptorům než k dopaminovým D2 receptorům a vyšší 5HT2 než D2 aktivitu v in vivo modelech. Elektrofyziologické studie ukázaly, že olanzapin selektivně snižuje aktivitu mezolimbických (A10) dopaminergních neuronů bez výraznějšího účinku na striatální (A9) dráhy ovládající motoriku. Olanzapin oslabuje podmíněnou vyhýbací odpověď v předpovědném testu antipsychotické aktivity v dávkách nižších než jsou ty, které vyvolávají katalepsii, t.j. v předpovědném testu motorických nežádoucích účinků. Na rozdíl od některých jiných antipsychotik olanzapin zesilňuje odpověď v “anxiolytickém testu”.
Ve studii pozitronové emisní tomografie (PET) u pacientů léčených přípravkem ZYPADHERA (300 mg/4 týdny) byla na konci 6měsíčního období střední obsazenost D2 receptorů 60% nebo vyšší, což je úroveň shodná s úrovní nacházenou v průběhu léčby perorálním olanzapinem.
Klinická účinnost
Účinnost přípravku ZYPADHERA v léčbě a v udržovací léčbě schizofrenie je shodná s prokázanou účinností perorální formy olanzapinu.
Dvě pivotní studie zahrnovaly celkem 1469 pacientů se schizofrenií:
První 8týdenní placebem kontrolovaná studie byla provedena u dospělých (n=404) pacientů, kteří trpěli akutními psychotickými příznaky. Pacienti byli randomizováni do skupin pro podání injekce přípravku ZYPADHERA 405 mg každé 4 týdny, 300 mg každé 2 týdny, 210 mg každé 2 týdny nebo placebo každé 2 týdny. Doplňková léčba perorálními antipsychotiky nebyla povolena. Celkové skóre škály Positive and Negative Symptom Scores (PANSS) prokázalo signifikatní zlepšení na konci léčebné periody (průměrné změny -22,57, -26,32, -22,49 resp.) oproti počátečním hodnotám (průměrná počáteční celkové skóre PANSS bylo 101) u všech dávek přípravku ZYPADHERA (405 mg každé 4 týdny, 300 mg každé 2 týdny a 210 mg každé 2 týdny) ve srovnání s placebem (průměrná změna -8,51). V průběhu studijních návštěv průměrná změna celkového skóre PANSS od počátku do konce studie ukázala, že od 3. dne došlo u pacientů ve skupinách s dávkou 300 mg/2 týdny a 405 mg/4 týdny ke statisticky významnému snížení celkového skóre PANSS oproti placebu (-8,6, -8,2 a -5,2 resp.). Ve všech třech skupinách, kterým byl podáván přípravek ZYPADHERA, bylo prokázáno statisticky významně větší zlepšení oproti placebu na konci 1. týdne. Tyto výsledky podporují účinnost přípravku ZYPADHERA v průběhu 8 týdnů léčby a terapeutický účinek, který byl pozorován již v 1. týdnu po zahájení léčby přípravkem ZYPADHERA.
Druhá, dlouhodobá klinická studie byla provedena u klinicky stabilizovaných pacientů (n=1065, celkové průměrné skóre PANSS při zahájení bylo od 54,33 až 57,75), kterým byl nejprve podáván perorální olanzapin po dobu 4 až 8 týdnů, a potom byli rozděleni k pokračování v léčbě buď perorálním olanzapinem nebo přípravkem ZYPADHERA po dobu 24 týdnů. Doplňková léčba perorálními antipsychotiky nebyla povolena. Skupiny přípravku ZYPADHERA 150 mg a 300 mg každé 2 týdny (dávky byly sloučeny pro účely analýzy) a 405 mg každé 4 týdny nebyly horší oproti kombinovaným dávkám 10, 15 a 20 mg perorálního olanzapinu (dávky byly sloučeny pro účely analýzy) - měřeno procentem exacerbací symptomů schizofrenie (procenta exacerbací byly 10%, 10% a 7% resp.). Exacerbace byla měřena zhoršením položek pozitivní stupnice BPRS odvozené ze škály PANSS a dle počtu hospitalizací pro zhoršení pozitivních psychotických symptomů. Po 24 týdnech od randomizace nebyla kombinovaná skupina s léčbou 150 mg a 300 mg/2 týdny inferiorní oproti skupině s dávkou 405 mg/4 týdny (procento exacerbací bylo 10 % pro každou skupinu).
Pediatrická populace
Přípravek ZYPADHERA nebyl zkoumán v pediatrické populaci. Kontrolovaná data týkající se účinnosti u dospívajících (od 13 do 17 let věku) jsou omezena na krátkodobá data ze studií perorálního olanzapinu u schizofrenie (6 týdnů) a mánie spojené s bipolární poruchou typu I (3 týdny), zahrnující méně než 200 dospívajících. Perorální olanzapin byl užíván ve flexibilní dávce od 2,5 mg při zahájení léčby až po 20 mg/den. V průběhu léčby perorálním olanzapinem došlo u dospívajících k signifikantně vyššímu nárůstu tělesné hmotnosti ve srovnání s dospělými. Rozsah změn hladin na lačno celkového cholesterolu, LDL cholesterolu, triglyceridů a prolaktinu (viz body 4.4 a 4.8) byl u dospívajících větší než u dospělých. Kontrolované údaje o přetrvávání účinku nebo dlouhodobé bezpečnosti nejsou k dispozici (viz body 4.4 a 4.8). Informace týkající se dlouhodobé bezpečnosti jsou omezeny zejména na nekontrolovaná data z otevřených studií.
5.2 Farmakokinetické vlastnosti
Absorpce
Olanzapin je metabolizovaný v játrech cestou konjugace a oxidace. V cirkulaci se z metabolitů objeví hlavně 10-N-glukuronid. Cytochromy P450-CYP1A2 a P450-CYP2D6 přispívají k tvorbě N-desmethyl a 2-hydroxymethyl metabolitů, vykazujících významně nižší in vivo farmakologickou aktivitu ve studiích na zvířatech než olanzapin. Převážná část farmakologické aktivity je způsobená původním olanzapinem.
Po jednorázové i.m. injekci přípravku ZYPADHERA začne ve svalu ihned pomalé rozpouštění soli olanzapin-embonátu, což zajišťuje pomalé kontinuální uvolňování olanzapinu po dobu více než čtyř týdnů. Uvolňování postupně slábne do ztracena v průběhu osmi až dvanácti týdnů. Při zahájení léčby přípravkem ZYPADHERA není zapotřebí přídavná perorální antipsychotická léčba (suplementace)
(viz bod 4.2).
Z kombinace profilu uvolňování a dávkovacího schématu (i.m. injekce každé dva nebo čtyři týdny) vyplývá trvalá plazmatická koncentrace olanzapinu. Po každé injekci přípravku ZYPADHERA zůstavají plazmatické koncentrace měřitelné po dobu několika měsíců. Poločas eliminace olanzapinu je po podání přípravku ZYPADHERA 30 dnů ve srovnání s 30 hodinami po perorálním podání. Absorpce a eliminace je dokončena přibližně šest až osm měsíců po poslední injekci.
Distribuce
Olanzapin po perorálním podání je rychle distribuován. Při plazmatické koncentraci 7 až 1 000 ng/ml se olanzapin váže přibližně z 93% na plazmatické bílkoviny. V plazmě je olanzapin navázán na albumin a na a1 kyselý glykoprotein.
Po opakované aplikaci i.m. injekce přípravku ZYPADHERA v dávce 150 až 300 mg každé dva týdny se 10. a 90. percentil ustálené plazmatické koncentrace olanzapinu nacházel mezi 4,2 a 73,2 ng/ml. Plazmatické koncentrace olanzapinu pozorované po podání dávek v rozmezí od 150 mg každé 4 týdny do 300 mg každé 2 týdny dokumentují zvyšující se systémovou expozici olanzapinu s rostoucí dávkou přípravku ZYPADHERA. V průběhu prvních třech měsíců léčby přípravkem ZYPADHERA byla pozorována akumulace olanzapinu, která se však již neprojevovala při dlouhodobém podávání (12 měsíců) u pacientů, kterým byla podávána dávka až 300 mg každé dva týdny.
Eliminace
Plazmatická clearence olanzapinu po perorálním podání je nižší u žen (18,9 l/h) oproti mužům (27,3 l/h) a u nekuřáků (18,6 l/h) oproti kuřákům (27,7 l/h). Podobné farmakokinetické rozdíly byly pozorovány mezi muži a ženami a mezi kuřáky a nekuřáky v klinických studiích s přípravkem ZYPADHERA. Nicméně vliv pohlaví nebo kouření na clearance olanzapinu je malý ve srovnání s celkovou variabilitou mezi jednotlivci.
Starší pacienti
Specifické studie použití přípravku u starší populace nebyly provedeny. Přípravek ZYPADHERA se nedoporučuje k léčbě starších pacientů (65 let a více), pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. U zdravých starších jedinců (65 let a více) byl průměrný vylučovací poločas prodloužen v porovnání se zdravými mladšími jedinci (51,8 hod. versus 33,8 hod) a clearance byla snížena (17,5 versus 18,2 l/hod). Farmakokinetická variabilita pozorovaná u starších jedinců je v mezích variability u mladších jedinců.
U 44 schizofrenních pacientů starších 65 let nebyl při dávkách 5-20 mg/den pozorován žádný zvláštní výskyt nežádoucích účinků.
Porucha funkce ledvin
Renální insuficience u pacientů (creatininová clearance <10 ml/min) ve srovnání se zdravými jedinci nezpůsobovala významný rozdíl v průměrném poločasu eliminace (37,7 hod. versus 32,4 hod.) nebo clearance (21,2 versus 25,0 l/hod.). Studie rovnováhy ukázala, že približně 57 % radioaktivně značeného olanzapinu se objevilo v moči převážně jako metabolity. Ačkoli použití přípravku ZYPADHERA nebylo zkoumáno u pacientů s poškozením ledvin, je doporučeno před zahájením léčby přípravkem ZYPADHERA u pacientů s poškozením ledvin nejdříve dosáhnout dobře tolerovaného a účinného dávkovacího režimu při použití perorálního olanzapinu (viz bod 4.2).
Kuřáci
U kuřáků s mírným poškozením funkce jater byl průměrný vylučovací poločas perorálního olanzapinu prodloužen (39,3 hod.) a clearance byla snížena (18 l/hod) analogicky ke zdravým nekuřákům (48,8 hod. a 14,1 l/hod.). Ačkoli použití přípravku ZYPADHERA nebylo zkoumáno u pacientů s poškozením jater, je doporučeno před zahájením léčby přípravkem ZYPADHERA u pacientů s poškozením jater nejdříve dosáhnout dobře tolerovaného a účinného dávkovacího režimu při použití perorálního olanzapinu (viz bod 4.2).
Klinická studie s perorálním olanzapinem nenašla žádné rozdíly farmakokinetických parametrů mezi jedinci bělošské, japonské a čínské populace.
5.3 Předklinické údaje vztahující se k bezpečnosti
Byly provedeny předklinické studie s monohydrátem olanzapin-embonátu vztahující se k bezpečnosti. Hlavní nálezy získané ve studiích toxicity po opakovaném podání (potkan, pes), v 2leté studii kancerogenity provedené na potkanech a ve studiích reprodukční toxicity (potkan, králík) byly
omezeny na nežádoucí účinky v místě podání, pro které nemohla být stanovena žádná hodnota NOAEL. Nebyly identifikovány žádné nové toxické účinky vycházející ze systémové expozice olanzapinu. Nicméně systémové koncentrace použité v těchto studiích byly menší než účinné hladiny v perorálních studiích, proto jsou níže uvedeny pro referenci informace týkající se perorálního olanzapinu.
Akutní toxicita (po jednorázové dávce)
Příznaky toxicity po perorálním podání hlodavcům obsahovaly silnou neuroleptickou složku: hypoaktivitu, kóma, třes, klonické křeče, slinění a zpomalení zvyšování hmotnosti. Střední letální dávka u myší byla přibližně 210 mg/kg a u potkanů 175 mg/kg. Psi tolerovali jednorázovou perorální dávku 100 mg/kg s nulovou mortalitou. Mezi klinické příznaky patřil útlum, ataxie, třes, zrychlený pulz, dušnost, mióza a anorexie. U opic vyvolala jednorázová perorální dávka až do 100 mg/kg vyčerpanost a vyšší dávky částečné bezvědomí.
Toxicita po opakovaném podávání
Ve studiích, které trvaly u myší až 3 měsíce a u potkanů a psů až 1 rok, se ukázaly jako hlavní účinky deprese CNS, anticholinergní účinky a periferní hematologické poruchy. Na depresi CNS se vyvinula tolerance. Růstové parametry byly při vysokých dávkách sníženy. Reverzibilní účinky spojené se zvýšenou hladinou prolaktinu u potkanů zahrnovaly pokles hmotnosti ovárií a uteru a morfologické změny vaginálního epitelu a prsní žlázy.
Hematologická toxicita: U všech druhů byly pozorované účinky na hematologické ukazatele, včetně na dávce závislého poklesu počtu cirkulujících leukocytů v krvi u myší a nespecifického poklesu cirkulujících leukocytů v krvi u potkanů. Navzdory tomu nebyl prokázaný hematotoxický účinek na kostní dřeň. U několika psů, kterým byla podávána dávka 8 až 10 mg/kg/den (celková expozice olanzapinu [AUC] je 12-15krát vyšší než dostává člověk při dávce 12 mg), se vyvinula reverzibilní neutropenie, trombocytopenie nebo anémie. U psů s cytopenií nebyly pozorované žádné nepříznivé účinky na progenitorové a proliferující buňky kostní dřeně.
Reprodukční toxicita
Olanzapin neměl žádný teratogenní účinek. U potkaních samců sedace ovlivnila páření. Estrální cykly byly ovlivněné dávkou 1,1 mg/kg (což je 3násobek maximální dávky pro člověka) a reprodukční parametry byly u potkanů ovlivněné dávkou 3 mg/kg (což je 9násobek maximální dávky pro člověka). U potomstva potkanů, kterým byl podávaný olanzapin, bylo pozorované opoždění fetálního vývoje a přechodný pokles aktivity.
Mutagenita
Olanzapin se neukázal jako mutanogenní nebo klastogenní v žádném ze standardních testů, které zahrnovaly bakteriální testy mutagenity in vitro a in vivo testy u savců.
Kancerogenita
Na základě výsledků studií na myších a potkanech bylo zjištěno, že olanzapin není kancerogenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek
Žádné.
Rozpouštědlo Sodná sůl karmelosy Manitol Polysorbát 80
Voda na injekci
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky
Po rekonstituci v injekční lahvičce: 24 hodin. Pokud není přípravek ihned použit, musí být důkladně protřepán, aby opět vznikla suspenze. Po natažení z injekční lahvičky do stříkačky by suspenze měla být použita okamžitě.
Chemická a fyzikální stabilita suspenze v injekční lahvičce byla prokázána na dobu 24 hodin při teplotě 20-25°C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchování po otevření před použitím j sou odpovědností uživatele a normálně by doba neměla být delší než 24 hodin při 20-25°C.
6.4 Zvláštní opatření pro uchovávání Chraňte před chladem nebo mrazem.
6.5 Druh obalu a velikost balení
210 mg prášek: skleněná lahvička typ I, bromobutylovou zátkou a uzávěrem rezavé barvy. Rozpouštědlo 3 ml: skleněná lahvička typ I, butylovou zátkou a uzávěrem fialové barvy.
Jedna krabička obsahuje jednu lahvičku s práškem a jednu lahvičku s rozpouštědlem, jednu stříkačku Hypodermic 3 ml s přednasazenou bezpečnostní jehlou délky 38 mm a průměru 19 G, jednu bezpečnostní jehlu Hypodermic délky 38 mm a průměru 19 G a dvě bezpečnostní jehly Hypodermic délky 50 mm a průměru 19 G.
6.6 Zvláštní opatření pro likvidaci přípravku
POUZE K HLUBOKÉMU INTRAMUSKULÁRNÍMU GLUTEÁLNÍMU PODÁNÍ. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Rekonstituce
KROK 1: Příprava
Doporučuje se používat rukavice, protože přípravek ZYPADHERA může dráždit pokožku.
Rekonstituujte přípravek ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem pouze pomocí rozpouštědla pro parenterální použití obsaženém v balení, za použití standardních aseptických postupů pro přípravu parenterálních přípravků.
KROK 2: Stanovení potřebného objemu rozpouštědla pro rekonstituci
Následující tabulka udává množství rozpouštědla pro rekonstituci přípravku ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem.
|
ZYPADHERA síla (mg) |
Objem rozpouštedla pro přidání (ml) |
|
210 |
1,3 |
|
300 |
1,8 |
|
405 |
2,3 |
Je důležité si uvědomit, že v lahvičce je rozpouštědla více, než je potřebné k rekonstituci.
KROK 3: Rekonstituce přípravku ZYPADHERA
1. Uvolněte prášek lehkým poklepáním na lahvičku.
2. Rozbalte přibalenou stříkačku Hypodermic s jehlou s ochranným pouzdrem.
Odloupněte fólii blistru a vyndejte soupravu. Lehkým otáčivým pohybem připojte stříkačku (není-li již připojena) ke koncovce typu luer na soupravě. Zatlačením jehly a jejím pootočením ve směru hodinových ručiček zajistíte pevné připojení jehly k soupravě. Potom sundejte z jehly kryt. Nedodržení těchto pokynů může způsobit poranění jehlou.
3. Natáhněte do injekční stříkačky vypočítaný objem rozpouštědla (viz Krok 2).
4. Vstříkněte rozpouštědlo do lahvičky s práškem.
5. Vtáhněte do stříkačky vzduch pro vyrovnání tlaku v lahvičce.
6. Držte injekční lahvičku uzávěrem nahoru a vytáhněte jehlu tak, aby nedošlo k úniku rozpouštědla.
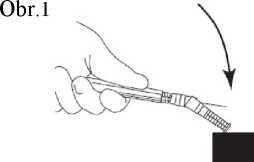
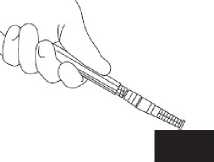
7. Nasaďte na jehlu ochranné pouzdro. Zatlačte jehlu jednou rukou do ochranného pouzdra. Zatlačení jednou rukou proveďte LEHKÝM zatlačením pouzdra proti rovné podložce. JAKMILE JE POUZDO STISKNUTO (obr. 1), JEHLA SPOLEHLIVĚ ZASKOČÍ DOVNITŘ POUZDRA (obr. 2).
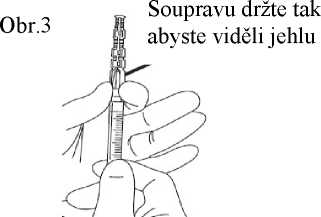
8. Přesvědčte se zrakem, zda je jehla plně zatlačena do ochranného pouzdra. Ochranné pouzdro obsahující jehlu odstraňte ze stříkačky pouze, pokud to vyžaduje zvláštní lékařský postup. Pouzdro odstraňte stisknutím luer koncovky mezi palec a ukazováček. Zbývající prsty udržujte mimo dosah jehly (obr. 3).
Obr.2
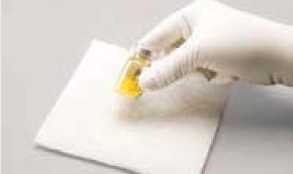
9. Opakovaně a důrazně poklepávejte lahvičkou o tvrdý povrch chráněný podložkou, dokud nepřestane být přítomnost prášku viditelná (viz obrázek A)
Obrázek A: Pro smíchání důkladně poklepejte
10. Zkontrolujte zrakem, zda v lahvičce nejsou shluky částic. Nesuspendovaný prášek vypadá jako žluté suché shluky částic ulpívající na dně lahvičky. Pokud zůstávají shluky částic v lahvičce, může být zapotřebí další poklepání (viz obrázek B).
Nesuspendováno: viditelné shluky Suspendováno: bez shluků Obrázek B: Zkontrolujte, zda v lahvičce není nesuspendovaný prášek a v případě potřeby poklepání
opakujte.
11. Důkladně lahvičku protřepávejte, dokud suspenze nebude mít odpovídající rovnoměrnou barvu a strukturu. Suspendovaný přípravek bude žlutý a neprůhledný (viz obrázek C).
Obrázek C: Důkladně lahvičku protřepejte
Pokud se vytvoří pěna, nechte lahvičku stát, aby se pěna usadila. Pokud není přípravek ihned použit, musí být znovu důkladně protřepán, aby opět vznikla suspenze. Po rekonstituci je přípravek ZYPADHERA v lahvičce stabilní po dobu 24 hodin.
Podání
KROK 1: Aplikace přípravku ZYPADHERA
Tato tabulka uvádí konečný objem suspenze přípravku ZYPADHERA pro aplikaci injekce. Koncentrace suspenze je 150 mg/ml olanzapinu.
|
Dávka (mg) |
Konečný objem pro aplikaci injekce (ml) |
|
150 |
1,0 |
|
210 |
1,4 |
|
300 |
2,0 |
|
405 |
2,7 |
1. Rozhodněte, která jehla bude použita k podání injekce pacientovi. Pro obézní pacienty je pro injekci doporučena jehla délky 50 mm:
• Pokud je pro injekci určena jehla délky 50 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 38 mm jehlu.
• Pokud je pro injekci určena jehla délky 38 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 50 mm jehlu.
2. Pomalu natáhněte zvolené množství. V lahvičce zůstane přebývající množství přípravku.
3. Nasaďte na jehlu ochranné pouzdro a jehlu ze stříkačky odstraňte.
4. Před podáním přípravku nasaďte na stříkačku vybranou bezpečnostní jehlu délky 50 mm nebo 38 mm. Jakmile je suspenze natažena z lahvičky, měla by být okamžitě podána.
5. Zvolte a připravte místo vpichu v hýžďové oblasti. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
6. Po vpíchnutí jehly do svalu několik sekund aspirujte, abyste se ujistil(a), že se neobjeví krev. Pokud se do stříkačky natáhne krev, stříkačku a dávku znehodnoťte a připravte novou dávku. Injekce by se měla aplikovat rovnoměrným nepřerušeným tlakem.
INJEKČNÍ MÍSTO NEMASÍRUJTE.
7. Nasaďte na jehlu ochranné pouzdro (obr. 1 a 2).
8. Injekční lahvičku, stříkačku, použité jehly, jehlu navíc a veškeré nepoužité rozpouštědlo znehodnoťte podle odpovídajících klinických postupů. Injekční lahvička je určena pro jednorázové použití.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/479/001
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENIÍ REGISTRACE
Datum první registrace: 18/11/2008
Datum posledního prodloužení registrace: 26/8/2013
10. DATUM REVIZE TEXTU DD/MM/RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
NÁZEV PŘÍPRAVKU
1.
ZYPADHERA 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna lahvička obsahuje olanzapini embonas monohydricus odpovídající olanzapinum 300 mg. Po rekonstituci jeden ml suspenze obsahuje olanzapinum 150 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro njekční suspenzi s prodlouženým účinkem Prášek: žlutý prášek
Rozpouštědlo: čirý, bezbarvý až lehce nažloutlý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Udržovací léčba schizofrenie u dospělých pacientů dostatečně stabilizovaných akutní léčbou perorálním olanzapinem.
4.2 Dávkování a způsob podání
Přípravek ZYPADHERA 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem nesmí být zaměněn s olanzapinem 10 mg prášek pro přípravu injekčního roztoku.
Dávkování
Pro stanovení snášenlivosti a odpovědi na léčbu by pacienti měli být před podáním přípravku ZYPADHERA léčeni perorálním olanzapinem.
Pro stanovení první dávky přípravku ZYPADHERA by mělo být u všech pacientů zváženo schéma uvedené v Tabulce 1.
Tabulka 1 Doporučené dávkovací schéma pro převod mezi perorálním olanzapinem a přípravkem ZYPADHERA
|
Cílová dávka perorálního olanzapinu |
Doporučená zahajovací dávka přípravku ZYPADHERA |
Udržovací dávka přípravku ZYPADHERA po 2 měsích léčby |
|
10 mg/den |
210 mg/2 týdny nebo 405 mg/4 týdny |
150 mg/2 týdny nebo 300 mg/4 týdny |
|
15 mg/den |
300 mg/2 týdny |
210 mg/2 týdny nebo 405 mg/4 týdny |
|
20 mg/den |
300 mg/2 týdny |
300 mg/2 týdny |
Úprava dávkování
U pacientů by měly být v průběhu prvního až druhého měsíce léčby pečlivě sledovány známky možného relapsu. Při antipsychotické léčbě může trvat několik dní až týdnů, než dojde ke zlepšení klinického stavu pacienta. Po tuto dobu by měli být pacienti pod pečlivou kontrolou. Dávka může být v průběhu léčby následně upravena na základě individuálního klinického stavu. Po klinickém přehodnocení může být dávka upravena v rozmezí 150 mg až 300 mg každé 2 týdny nebo 300 až 405 mg každé 4 týdny. (Tabulka 1)
Přídavná léčba (suplementace)
Doplnění léčby perorálním olanzapinem nebylo v průběhu dvojitě zaslepených klinických studií povoleno. Pokud je suplementace perorálním olanzapinem klinicky indikována, celková kombinovaná dávka olanzapinu v obou lékových formách by neměla přesáhnout odpovídající maximální dávku perorálního olanzapinu 20 mg/den.
Převedení na jiné léčivé antipsychotické přípravky
Data specificky zaměřená na převedení pacientů z přípravku ZYPADHERA na jiné antipsychotické léčivé přípravky nebyla systematicky shromažďována. Z důvodu pomalého rozpouštění soli olanzapin-embonátu, které způsobuje pomalé kontinuální uvolňování olanzapinu trvající šest až osm měsíců po poslední injekci, je zvláště v průběhu prvních dvou měsíců po ukončení léčby přípravkem ZYPADHERA zapotřebí dohled lékaře v případě, že je klinický důvod k převedení na jiný antipsychotický přípravek.
Zvláštní populace
Starší pacienti
Přípravek ZYPADHERA nebyl systematicky hodnocen u starších pacientů (> 65 let). Přípravek ZYPADHERA se nedoporučuje k léčbě starších pacientů, pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. U pacientů starších 65 let není běžně nižší počáteční dávka (150 mg/4 týdny) nutná, ale měla by být v klinicky odůvodněných případech zvážena (viz bod 4.4). Zahájení léčby přípravkem ZYPADHERA není doporučeno u pacientů starších 75 let (viz bod 4.4).
Pacienti s poruchou funkce ledvin a/nebo jater
U těchto pacientů by přípravek ZYPADHERA neměl být použit, pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. Je vhodné zvážit nižší počáteční dávku (150 mg/4 týdny) u těchto pacientů. V případě středně závažného poškození jater (cirhóza, Child-Pugh class A nebo B) by počáteční dávka měla být 150 mg/4 týdny a zvyšována by měla být opatrně.
Kuřáci
Nekuřákům ve srovnání s kuřáky není třeba upravovat počáteční dávku a dávkové rozmezí. Metabolismus olanzapinu může být kouřením indukován. Je doporučeno monitorovat klinický stav a zvážit zvýšení dávky olanzapinu, pokud to bude považováno za nutné (viz bod 4.5).
Při přítomnosti více než jednoho faktoru, který zpomaluje metabolizmus (ženské pohlaví, vyšší věk, nekuřák) by se mělo zvážit snížení dávky. Zvyšování dávek by mělo být obezřetné, i když je indikované.
Pediatrická populace
Bezpečnost a účinnost přípravku ZYPADHERA u dětí a mladistvích do 18 let nebyla stanovena. V současnosti dostupné údaje jsou uvedeny v bodech 4,8 a 5.1, ale nelze z nich stanovit doporučení pro dávkování.
Způsob podání
POUZE K INTRAMUSKULÁRNÍMU PODÁNÍ. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ. (Viz bod 4.4)
Přípravek ZYPADHERA by měl být podán pouze hluboko intramuskulámě do gluteálního svalu, zdravotnickým pracovníkem vyškoleným v odpovídající injekční technice, na pracovišti, kde může být zajištěno post-injekční sledování a kde je možné zajistit přístup k odpovídající lékařské péči v případě předávkování.
Po každé injekci by měli být pacienti sledováni na zdravotnickém pracovišti náležitě vyškoleným personálem po dobu nejméně 3 hodin pro zjištění případných známek a příznaků odpovídajících předávkování olanzapinem. Bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování. Při podezření na předávkování by mělo monitorování a důkladný lékařský dohled pokračovat do doby než vyšetření prokáže odeznění příznaků a známek předávkování (viz bod 4.4.). Podle klinické potřeby se má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
Návod k použití viz bod 6.6.
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Pacienti se známým rizikem angulárního glaukomu.
4.4 Zvláštní upozornění a opatření pro použití
Je nutné věnovat zvýšenou péči odpovídající injekční technice, aby se předešlo neúmyslnému intravaskulárním nebo subkutánnímu podání (viz bod 6.6).
Použití u akutně agitovaných pacientů nebo u pacientů se závážným psychotickým stavem Přípravek ZYPADHERA by neměl být použit k léčbě pacientů se schizofrenií, kteří trpí akutní agitovaností nebo závažným psychotickým stavem, který vyžaduje okamžitou kontrolu příznaků.
Post-injekční syndrom
V klinických studiích před uvedením přípravku na trh byly po aplikaci přípravku ZYPADHERA u pacientů hlášeny reakce představované známkami a symptomy shodnými s příznaky předávkování olanzapinem. K těmto reakcím došlo u přibližně <0,1% injekcí a přibližně u 2% pacientů. U většiny těchto pacientů došlo k rozvoji známek sedace (v rozmezí od mírné sedace až po kóma) a/nebo deliria, (včetně zmatenosti, dezorientace, agitovanosti, úzkosti a dalších kognitivních poruch). Mezi další zaznamenané příznaky patřily extrapyramidové příznaky, dysartrie, ataxie, agresivita, závratě, slabost, hypertenze a křeče. Ve většině případů se prvotní známky a příznaky spojené s touto reakcí objevily v průběhu 1 hodiny po injekci a ve všech případech bylo hlášeno plné zotavení během 24-72 hodin po injekci. K reakcím došlo vzácně (<1 z 1 000 injekcí) mezi 1 a 3 hodinami a velmi vzácně (<1 z 10 000 injekcí) po 3 hodinách. Pacienti by měli být seznámeni s tímto potenciálním rizikem a s nutností zůstat na pozorování na zdravotnickém pracovišti po dobu 3 hodin po každé aplikaci přípravku ZYPADHERA. Od doby registrace přípravku ZYPADHERA jsou post-marketingová hlášení týkající se post-injekčního syndromu obecně v souladu se zkušenostmi získanými z klinických studií.
Pacienti by měli být po každé injekci sledováni na zdravotnickém pracovišti náležitě vyškoleným personálem po dobu nejméně 3 hodin pro zjištění známek a příznaků odpovídajících předávkování olanzapinem.
Bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování. Při podezření na předávkování by mělo monitorování a důkladný lékařský dohled pokračovat do doby, než vyšetření prokáže odeznění příznaků a známek předávkování. Podle klinické potřeby se má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
Pacienti by měli být poučeni, aby po zbytek dne po injekci sledovali případné známky a symptomy předávkování vyplývající z post-injekčního syndromu, aby byli schopni si v případě nutnosti zajistit pomoc, a že by neměli řídit ani obsluhovat nebezpečné stroje (viz bod 4.7).
Pokud je pro zvládnutí post-injekčních nežádoucích účinků nutné podání benzodiazepinů, je doporučeno důkladné vyhodnocení klinického stavu s ohledem na nadměrnou sedaci a kardiorespirační útlum (viz bod 4.5).
Nežádoucí účinky v místě aplikace
Nejčastěji hlášeným nežádoucím účinkem spojeným s místem aplikace byla bolest. Většina těchto nežádoucích účinků byla hlášena jako „mírné“ až „střední“ intenzity. Vyskytne-li se nežádoucí účinek v místě aplikace, měla by být ke zvládnutí této příhody přijata odpovídající opatření (viz bod 4.8).
Psychózy a poruchy chování související s demencí
Olanzapin není doporučen k podávání u pacientů s psychózou a/nebo poruchami chování souvisejícími s demencí z důvodu zvýšené mortality a zvýšeného rizika cerebrovaskulárních příhod. V placebem kontrolovaných studiích (v délce 6-12 týdnů) u starších pacientů (průměrný věk 78 let) s psychózou a/nebo poruchami chování souvisejícími s demencí byla u pacientů léčených perorálním olanzapinem dvojnásobná incidence úmrtí ve srovnání s pacienty užívajícími placebo (3,5% vs. 1,5% resp.). Vyšší incidence úmrtí nesouvisela s dávkou olanzapinu (průměrná denní dávka 4,4 mg) nebo s délkou léčby. Rizikovými faktory, které se mohou podílet na zvýšené mortalitě u této skupiny pacientů, jsou věk nad 65 let, dysfagie, sedace, malnutrice a dehydratace, plicní onemocnění (např. pneumonie, ev. i s aspirací) nebo současné užívání benzodiazepinů. Vyšší incidence úmrtí u pacientů léčených perorálním olanzapinem ve srovnání s pacienty užívajícími placebo byla však na uvedených rizikových faktorech nezávislá.
Ve stejných klinických studiích byly hlášeny cerebrovaskulární nežádoucí účinky (např. iktus, tranzitorní ischemické ataky), včetně úmrtí. U pacientů léčených perorálním olanzapinem bylo zaznamenáno trojnásobné zvýšení výskytu cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (1,3% vs. 0,4%, resp.). U všech pacientů léčených perorálním olanzapinem nebo placebem, u nichž se cerebrovaskulární příhoda vyskytla, byly přítomny rizikové faktory. K faktorům, které byly zjištěny jako rizikové u pacientů léčených olanzapinem, patřil věk nad 75 let a vaskulární a/nebo smíšená demence. Účinnost olanzapinu v těchto studiích nebyla stanovena.
Parkinsonova choroba
Použití olanzapinu k léčbě psychózy související s podáváním dopaminového agonisty u pacientů s Parkinsonovou chorobou se nedoporučuje. V klinických studiích bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symptomatiky a halucinací (viz bod 4.8) a perorální olanzapin nebyl v léčení psychotických příznaků účinnější než placebo. V těchto studiích museli mít pacienti na začátku studie stabilní a nejnižší účinnou dávku antiparkinsonika (dopaminového agonisty). Toto antiparkinsonikum jim bylo podáváno ve stejné dávce po celou zbývající dobu studie. Počáteční dávka perorálního olanzapinu byla 2,5 mg/den a podle uvážení lékaře mohla být titrována do maximální dávky 15 mg/den.
Neuroleptický maligní syndrom (NMS)
NMS je potenciálně život ohrožující stav spojený s podáváním antipsychotik. Vzácné případy označené jako NMS byly rovněž hlášeny v souvislosti s perorálním olanzapinem. Klinické příznaky NMS jsou hyperpyrexie, svalová rigidita, alterovaná psychika a příznaky autonomní instability (nepravidelný pulz anebo tlak krve, tachykardie, pocení a arytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní renální selhání. Pokud se u pacienta objeví příznaky podezřelé ze spojení s NMS nebo pokud se objeví nevysvětlitelně vysoká horečka i bez dalších klinických známek NMS, musí být všechna antipsychotika včetně olanzapinu vysazena.
Hyperglykémie a diabetes
Méně často byly hlášeny hyperglykémie a/nebo rozvoj nebo exacerbace diabetů, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.8). V některých případech tomu předcházelo zvýšení tělesné hmotnosti, což mohlo být predispozičním faktorem. V souladu s používanými pravidly antipsychotické léčby je doporučeno příslušné klinické monitorování, např. měření hladiny glukózy v krvi před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy jednou ročně. U pacientů léčených jakýmikoliv antipsychotickými léčivy, včetně přípravku ZYPADHERA, by měly být sledovány známky a příznaky hyperglykémie (jako je polydipsie, polyurie, polyfagie a slabost) a pacienti s diabetem nebo s rizikovými faktory pro rozvoj diabetu by měli být pravidelně monitorováni s ohledem na zhoršení kontroly hladiny glukózy. Pravidelně by měla být kontrolována tělesná hmotnost, např. před začátkem léčby, 4, 8 a 12 týdnů po záhájení podávání olanzapinu a následně vždy každé tři měsíce.
Změny hladin lipidů
V placebem kontrolovaných klinických studiích byly u pacientů léčených olanzapinem pozorovány nežádoucí změny hladin lipidů (viz bod 4.8). Změny lipidového profilu by měly být ošetřeny podle klinické potřeby, obzvláště u pacientů s dyslipidemií a u pacientů s rizikovými faktory pro rozvoj poruch lipidů. U pacientů léčených jakýmikoliv antipsychotickými léčivy, včetně přípravku ZYPADHERA, by v souladu s používanými pravidly antipsychotické léčby měly být pravidelně kontrolovány hladiny lipidů, např. před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy každých 5 let.
Anticholinergní aktivita.
Ačkoliv byla in vitro prokázána anticholinergní aktivita olanzapinu, zkušenosti během klinických studií ukázaly nízkou incidenci souvisejících příhod. Protože však klinické zkušenosti s podáváním olanzapinu u pacientů s jiným souběžným onemocněním jsou omezené, doporučuje se zvýšená pozornost, pokud je olanzapin předepisován pacientům s hypertrofií prostaty, paralytickým ileem nebo podobnými stavy.
Jaterní funkce
Často, obzvlášť v počátcích léčby, bylo pozorováno přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz, ALT a AST. U pacientů s vyšší hladinou ALT a/nebo AST, se známkami a příznaky poškození jater, s preexistující sníženou funkční rezervou jaterní funkce a u pacientů léčených potenciálně hepatotoxickými přípravky je třeba opatrnosti a dalšího sledování. Je-li u pacientů diagnostikována hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater), je třeba léčbu olanzapinem ukončit.
Neutropenie
Opatrnosti je třeba u pacientů s nižším počtem leukocytů a/nebo neutrofilů z jakýchkoliv příčin, u pacientů užívajících léky způsobující neutropenii, u pacientů s anamnézou polékového útlumu kostní dřeně nebo útlumem kostní dřeně způsobeným souběžným onemocněním, radiační terapií nebo chemoterapií, u pacientů s hypereozinofilií nebo s myeloproliferativní chorobou. Neutropenie byla často hlášena při současném podávání olanzapinu a valproátu (viz bod 4.8).
Přerušení léčby
Při náhlém přerušení léčby perorálním olanzapinem byly vzácně (> 0,01% a < 0,1%) hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nauzea nebo zvracení.
QT interval
V klinických studiích bylo u pacientů léčených perorálním olanzapinem klinicky významné prodloužení QTc intervalu (korekce QT podle Fridericii [QTcF] > 500 millisekund [ms] kdykoliv po vstupním vyšetření u pacientů se vstupní hodnotou QTcF <5 00 ms) méně časté (0,1% až 1%), bez signifikantních rozdílů v průvodních srdečních příhodách ve srovnání s placebem. V klinických studiích s olanzapinem práškem pro přípravu roztoku pro injekce nebo s přípravkem ZYPADHERA nebylo podávání olanzapinu spojeno s přetrvávajícím zvýšením absolutního QT nebo QTCc intervalu.
Přesto je třeba zvýšené opatrnosti, je-li olanzapin předepisován s léky prodlužujícími QTc interval, obzvlášť u starších pacientů, u pacientů s vrozeným prodloužením QT intervalu, s městnavým srdečním selháním, se srdeční hypertrofií, s hypokalémií nebo hypomagnezémií.
Tromboembolismus
Časová souvislost léčby olanzapinem a žilního tromboembolismu byla hlášena méně často (> 0,1% a < 1%) Kauzální vztah mezi výskytem žilního tromboembolismu a léčbou olanzapinem nebyl stanoven. Avšak protože u pacientů se schizofrenií jsou často přítomny získané rizikové faktory žilního tromboembolismu, je nutné identifikovat a vzít v úvahu všechny možné rizikové faktory, např. imobilizaci pacientů, a vykonat preventivní opatření.
Obecná CNS aktivita
Vzhledem k primárnímu účinku olanzapinu na centrální nervovou soustavu je třeba opatrnosti při současném užívání s jinými centrálně působícími léky či alkoholem. Protože olanzapin působí in vitro jako dopaminový antagonista, může působit proti účinku přímých a nepřímých agonistů dopaminu.
Křeče
Olanzapin by měl být používán opatrně u pacientů s křečemi v anamnéze, anebo u těch, u kterých se vyskytují faktory snižující křečový práh. U pacientů léčených olanzapinem byly křeče hlášeny méně často. Ve většině těchto případů byly hlášeny křeče v anamnéze či jiné rizikové faktory.
Tardivní dyskineze
V ročních nebo kratších srovnávacích studiích byl perorální olanzapin statisticky významně méně často spojen s nově hlášenou dyskinezí. Přesto riziko pozdní dyskineze při dlouhodobém užívání vzrůstá. Pokud se u pacienta léčeného olanzapinem objeví známky a symptomy pozdní dyskineze, mělo by se zvážit snížení dávky nebo přerušení podávání. Tyto symptomy se mohou přechodně zhoršit nebo se objevit po přerušení léčby.
Posturální hypotenze
V klinických studiích s olanzapinem byla zřídka u starších pacientů pozorována posturální hypotenze. U pacientů starších 65 let je doporučeno pravidelně měřit krevní tlak.
Náhlá srdeční smrt
V postmarketingovém sledování olanzapinu byly u pacientů léčených olanzapinem nahlášeny případy náhlé srdeční smrti. V retrospektivní observační kohortové studii bylo riziko předpokládané náhlé srdeční smrti u pacientů léčených olanzapinem přibližně dvojnásobné oproti pacientům, kteří neužívali antipsychotika. V této studii bylo riziko při užívání olanzapinu porovnatelné s rizikem užívání atypických antipsychotik spojených do jedné analýzy.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících. Klinická hodnocení provedená u pacientů ve věkovém rozmezí 13-17 let ukázala různé nežádoucí účinky, včetně nárůstu tělesné hmotnosti, změny metabolických parametrů a zvýšení hladiny prolaktinu (viz body 4.8 a 5.1).
Použití u starších pacientů (>75leť)
O použití přípravku ZYPADHERA u pacientů starších 75 let nejsou k dispozici žádné údaje.
Vzhledem k biochemickým a fyziologickým změnám a vzhledem k redukci svalové hmoty není u této podskupiny pacientů doporučeno tuto lékovou formu nasazovat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí byly provedeny pouze u dospělých.
Zvýšená opatrnost je zapotřebí u pacientů užívajících léčivé přípravky, které mohou indukovat hypotenzi nebo sedaci.
Možné interakce ovlivňující o1a.nza.pin
Vzhledem k tomu, že je olanzapin metabolizován izoenzymem CYP1A2, mohou látky, které specificky tento izoenzym indukují nebo inhibují, ovlivnit farmakokinetiku olanzapinu.
Indukce CYP1A2
Kouření a karbamazepin mohou indukovat metabolizmus olanzapinu, což může vést ke snížení koncentrace olanzapinu. Bylo pozorováno zanedbatelné, případně jen mírné zvýšení clearance olanzapinu. I když je klinický dopad pravděpodobně minimální, doporučuje se klinické monitorování a v nezbytných případech je možné zvážit zvýšení dávek olanzapinu (viz bod 4.2).
Inhibice CYP1A2
Prokázalo se, že fluvoxamin, specifický inhibitor CYP1A2, významně zpomaluje metabolizmus olanzapinu. Průměrné zvýšení maximální koncentrace (Cmax) olanzapinu fluvoxaminem bylo 54% u žen nekuřaček a 77% u mužů kuřáků. Průměrné zvýšení plochy pod křivkou koncentrace léčiva (AUC) bylo 52% u žen a 108% u mužů. U pacientů užívajících fluvoxamin nebo jiný inhibitor CYP1A2, jako např. ciprofloxacin, je třeba uvážit snížení počáteční dávky olanzapinu. Při zahájení léčby inhibitorem CYP1A2 je třeba uvážit snížení dávek olanzapinu.
Fluoxetin (inhibitor CYP2D6), jednorázové dávky antacida (hliník, hořčík) nebo cimetidinu neměly významný vliv na farmakokinetiku olanzapinu.
Možnosti ovlivnění účinku, jiných léků olanzapinem
Olanzapin může působit proti účinkům přímých a nepřímých agonistů dopaminu.
Olanzapin in vitro neinhibuje hlavní izoenzymy CYP450 (např. 1A2, 2D6, 2C9, 2C19, 3A4). Neočekávají se proto žádné zvláštní interakce, což dokazují i in vivo studie, které neprokázaly inhibici metabolizmu následujících léčivých látek: tricyklická antidepresiva (reprezentující převážně CYP2D6 cestu metabolizace), warfarin (CYP2C9), theofylin (CYP1A2) nebo diazepam (CYP3A4 a 2C19).
Olanzapin nevykazoval interakci se současně podáváným lithiem nebo biperidenem.
Terapeutické monitorování plazmatických hladin valproátu neukázalo, že by byla při zahájení přídatné medikace olanzapinem nutná úprava dávkování valproátu.
Obecná CNS aktivita
Zvýšená opatrnost je zapotřebí u pacientů konzumujících alkohol nebo užívajících léčivé přípravky působící tlumivě na CNS.
Současné užívání olanzapinu a léčivých přípravků k léčbě Parkinsonovy choroby a demence není doporučeno (viz bod 4.4).
QTc interval
Zvýšená opatrnost je zapotřebí u pacientů užívajících současně olanzapin a léčivé přípravky, o kterých je známo, že prodlužují QTc interval (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Neexistují žádné přiměřené a dobře vedené studie u gravidních žen. Pacientky by měly být poučené, aby lékaře informovaly o graviditě anebo o plánované graviditě během užívání olanzapinu. Kvůli nedostatku zkušeností by olanzapin měl být v graviditě podávaný pouze tehdy, pokud jeho potenciální prospěšnost vyváží potenciální nebezpečí pro plod.
U novorozenců, kteří byli vystaveni antipsychotikům (včetně olanzapinu) během třetího trimestru těhotenství, existuje riziko výskytu nežádoucích účinků zahrnujících extrapyramidové a/nebo abstinenční příznaky, které se mohou po porodu lišit v závažnosti a délce trvání. Byly hlášeny případy agitovanost, hypertonie, hypotonie, tremoru, somnolence, dechové tísně nebo potíží při kojení. Novorozenci proto musejí být pečlivě sledováni.
Kojení
Ve studii perorálního olanzapinu u kojících zdravých žen byl olanzapin vylučován do mateřského mléka. Průměrná expozice dítěte (mg/kg) v rovnovážném stavu byla odhadnuta na 1,8% z dávky olanzapinu podaného matce (mg/kg). Pacientky je třeba poučit, aby během užívání olanzapinu nekojily.
Fertilita
Účinky na fertilitu nejsou známy (viz bod 5.3 pro preklinické informace).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Jelikož olanzapin může způsobit ospalost a závratě, pacienti by měli být opatrní při obsluze strojů včetně řízení motorových vozidel.
Pacienti by měli být poučeni, aby se vyvarovali řízení nebo obsluhy strojů po zbytek dne, ve kterém obdrželi injekci, z důvodu možného výskytu post-injekčního syndromu vedoucího k příznakům shodným s příznaky předávkování olanzapinem (viz bod 4.4).
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Nežádoucí účinky pozorované u olanzapin-embonátu
Při podávání přípravku ZYPADHERA se vyskytly reakce post-injekčního syndromu vedoucí k symptomům shodným s předávkováním olanzapinem (viz bod 4.2 a 4.4). Klinické známky a symptomy zahrnovaly příznaky sedace (v rozmezí od mírné sedace až po kóma) a/nebo delirium (včetně zmatenosti, dezorientace, agitovanosti, úzkosti a dalších kognitivních poruch). Mezi další zaznamenané příznaky patřily extrapyramidové příznaky, dysartrie, ataxie, agresivita, závratě, slabost, hypertenze a křeče.
Další nežádoucí účinky pozorované u pacientů léčených přípravkem ZYPADHERA byly podobné nežádoucím účinkům pozorovaným u perorálního olanzapinu. V klinických studiích s přípravkem ZYPADHERA byla sedace jediným nežádoucím účinkem hlášeným staticky významně častěji ve skupině přípravku ZYPADHERA oproti skupině placeba (ZYPADHERA 8,2%, placebo 2,0%).
U všech pacientů léčených přípravkem ZYPADHERA byla sedace hlášena u 4,7% pacientů.
V klinických studiích s přípravkem ZYPADHERA byl výskyt nežádoucích účinků v místě aplikace přibližně 8%. Nejčastěji hlášeným nežádoucím účinkem v místě aplikace byla bolest (5%); některé další nežádoucí účinky v místě podání byly (dle klesající frekvence výskytu): nodulární zatvrdnutí, zarudnutí, nespecifické místní reakce, iritace, otoky, podlitiny, krvácení a anestézie. K těmto reakcím došlo o 0,1 až 1,1% pacientů.
V přehledu údajů o bezpečnosti z klinických hodnocení a ze spontánních postmarketingových hlášení byl absces v místě vpichu hlášen vzácně (> 1/10000 až < 1/1000).
Nežádoucí účinky pozorované u olanzapinu
Nežádoucí účinky uvedené níže byly pozorovány po podání olanzapinu.
Dospělí
Nejčastěji hlášenými (pozorované u > 1% pacientů) nežádoucími účinky spojenými s užíváním olanzapinu v klinických studiích byla somnolence, zvýšení tělěsné hmotnosti, eozinofilie, zvýšené hladiny prolaktinu, cholesterolu, glukózy a triglyceridů (viz bod 4.4), glykosurie, zvýšená chuť k jídlu, závratě, akatizie, parkinsonismus, leukopenie, neutropenie (viz bod 4.4), dyskineze, ortostatická hypotenze, anticholinergní účinky, přechodné asymptomatické zvýšení jaterních aminotransferáz (viz bod 4.4), rash, asténie, únava, horečka, artralgie, zvýšené hodnoty alkalické fosfatázy, gamma glutamyltransferázy, kyseliny močové a kreatinfosfokinázy a otok.
Seznam nežádoucích účinků v tabulkovém _ formátu
Následující tabulka podává seznam nežádoucích účinků a laboratorních nálezů pozorovaných ve spontánních hlášeních a v klinických hodnoceních. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000) a není známo (z dostupných údajů nelze určit).
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Poruchy krve a lymfatického systému | ||||
|
Eozinofilie Leukopenie— Neutropenie— |
Trombocytopenie11 | |||
|
Poruchy imunitního systému | ||||
|
Hypersenzitivita11 | ||||
|
Poruchy metabolismu a výživy | ||||
|
Přibývání na váze1 |
Zvýšené hladiny cholesterolu2,3 Zvýšené hladiny glukózy4 Zvýšené hladiny triglyceridů2,5 Glykosurie Zvýšená chuť k jídlu |
Vznik nebo exacerbace diabetu, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.4) 11 |
Hypotermie12 | |
|
Poruchy nervového systému | ||||
|
Somnolence |
Závratě Akatizie6 Parkinsonismus6 Dyskineze6 |
Křeče, kdy ve většině případů byly hlášeny křeče v anamnéze či jiné rizikové faktory pro vznik křečí11 Dystonie (včetně okulogyrické krize)— Tardivní dyskineze11 Amnézie9 Dysartrie |
Neuroleptický maligní syndrom (viz bod 4.4)12 Příznaky z '7 12 vysazení | |
|
Srdeční poruchy | ||||
|
Bradykardie Prodloužení QTc intervalu (viz bod 4.4) |
Ventrikulární tachykardie/fibrilac e, náhlá smrt (viz bod 4.4) 11 | |||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Cévní poruchy | ||||
|
Ortostatická |
Tromboembolismus (včetně pulmonární embolie a hluboké žilní trombózy) (viz bod 4.4) | |||
|
Respirační, hrudní a mediastinální poruchy | ||||
|
Epistaxe9 | ||||
|
Gastrointestinalní poruchy | ||||
|
Mírné přechodné anticholinergní účinky včetně obstipace a suché ústní sliznice |
Břišní distenze9 |
Pankreatitida11 | ||
|
Poruchy jater a žlučových cest | ||||
|
Přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz (ALT, AST) obzvlášť na počátku léčby (viz bod 4.4) |
Hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater) 11 | |||
|
Poruchy kůže a podkožní tkáně | ||||
|
Rash |
Fotosenzitivní reakce Alopecie | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||||
|
Artralgie9 |
Rhabdomyolýza11 | |||
|
Poruchy ledvin a močových cest | ||||
|
Inkontinence moči Retence moči Opožděný začátek močení11 | ||||
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím | ||||
|
Syndrom z vysazení u novorozenců (viz bod 4.6) | ||||
|
Poruchy reprodukčního systému a prsu | ||||
|
Erektilní dysfunkce u mužů Snižení libida u mužů i žen |
Amenorea Zvětšení prsou Galaktorea u žen Gynekomastie/zvětše ní prsou u mužů |
Priapismus12 | ||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Celkové poruchy a reakce v místě apli |
cace | |||
|
Asténie Únava Otok Horečka10 Bolest v místě vpichu |
Absces v místě vpichu | |||
|
Vyšetření | ||||
|
Zvýšené plazmatické hladiny prolaktinu8 |
Zvýšené hodnoty alkalické fosfatázy10 Vysoká hladina kreatinfosfokináz 11 y Vysoká hladina gamma glutamyltransferá 10 zy Vysoká hladina kyseliny močové10 |
Zvýšené hodnoty celkového bilirubinu | ||
'Klinicky významné zvýšení tělesné hmotnosti bylo pozorována napříč všemi základními kategoriemi dle BMI (Body Mass Index). Při krátkodobé léčbě (medián trvání 47 dnů) bylo zvýšení tělesné hmotnosti o > 7% velmi časté (22,2%), o > 15% časté (4,2%) a o > 25% bylo méně časté (0,8%). Zvýšení tělesné hmotnosti o > 7%, o > 15% a o > 25% oproti počáteční hodnotám bylo u pacientů s dlouhodobou expozicí (nejméně 48 týdnů) velmi časté (64,4%, 31,7%, resp. 12,3%).
2Průměrné zvýšení hodnot lipidů nalačno (celkový cholesterol, LDL cholesterol a triglyceridy) bylo vyšší u pacientů bez prokázané poruchy regulace tuků na začátku léčby.
3Pozorováno pro normální počáteční hladiny nalačno (< 5,17 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 6,2 mmol/l). Změny počátečních hodnot celkového cholesterolu nalačno z hraničních (>
5,17 až < 6,2 mmol/l) na vysoké (> 6,2 mmol/l) byly velmi časté.
4Pozorováno pro normální počáteční hladiny glukózy nalačno (< 5,56 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 7 mmol/l). Změny počátečních hodnot glukózy nalačno z hraničních (> 5,56 až < 7 mmol/l) na vysoké (> 7 mmol/l) byly velmi časté.
5Pozorováno pro normální počáteční hladiny nalačno (< 1,69 mmol/l), které vzrostly na vysoké (> 2,26 mmol/l). Změny počátečních hladin triglyceridů nalačno z hraničních hodnot (> 1,69 mmol/l až < 2,26 mmol/l) na vysoké (> 2,26 mmol/l) byly velmi časté.
6V klinických studiích byl výskyt parkinsonismu a dystonie u pacientů léčených olanzapinem číselně vyšší, ale statisticky se signifikantně nelišil od placeba. Parkinsonismus, akathisie a dystonie se vyskytly vzácněji při užívání olanzapinu než při užívání odpovídajících dávek haloperidolu. Vzhledem k nedostatku podrobných informací o akutních a pozdních extrapyramidových příznacích v anamnéze není možné rozhodnout, zda olanzapin způsobuje méně tardivní dyskineze a/nebo dalších pozdních extrapyramidových příznaků.
7Při náhlém přerušení léčby olanzapinem byly hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nevolnost a zvracení.
8V klinických hodnoceních trvajících až 12 týdnů překročily plazmatické koncentrace prolaktinu hormí hranici normálního rozmezí u přibližně 30% pacientů léčených olanzapinem s normální počáteční hladinou prolaktinu. U většiny těchto pacientů bylo zvýšení obvykle mírné a zůstalo pod dvojnásobkem horní hranice normálního rozmezí.
9 Nežádoucí účinek zjištěný z klinických studií v integrované databázi olanzapinu.
10 Odhadnuto z naměřených hodnot z klinických studií v integrované databázi olanzapinu.
11 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla určena s využitím integrované databáze olanzapinu.
12 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla odhadnuta na horní hranici 95% intervalu spolehlivosti s využitím integrované databáze olanzapinu.
Dlouhodobá expozice (nejméně 48 týdnů)
Procento pacientů, u kterých se projevily nežádoucí klinicky signifikatní změny tělesné hmotnosti, glukózy, celkového/LDL/HDL cholesterolu nebo triglyceridů, se zvyšilo v čase. U dospělých pacientů, kteří ukončili léčbu v délce 9-12 měsíců, se rychlost zvyšování průměrných hodnot glukózy v krvi zpomalila přibližně po 6 měsících.
Další informace týkající se specifických populací
V klinických studiích u starších pacientů s demencí byla léčba olanzapinem spojena s vyšší incidencí úmrtí a cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (viz také 4.4). Velmi časté nežádoucí účinky spojené s užíváním olanzapinu u této skupiny pacientů byly abnormální chůze a pády. Často byly pozorované pneumonie, zvýšení tělesné teploty, letargie, erythém, zrakové halucinace a inkontinence moči.
V klinických studiích u pacientů s Parkinsonovou chorobou s lékově vyvolanou psychózou související s podáváním dopaminového agonisty bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symtpomatiky a halucinace.
V jedné klinické studii u pacientů v manické fázi bipolární poruchy měla léčba valproátem
v kombinaci s olanzapinem za následek 4,1% incidenci neutropenie; potenciálně přispívajícím faktorem mohly být vysoké plazmatické hladiny valproátu. Současné podání olanzapinu s lithiem nebo valproátem vedlo ke zvýšení výskytu (>10%) tremoru, sucha v ústech, zvýšené chuti k jídlu a zvýšení tělěsné hmotnosti. Poruchy řeči byly také hlášeny často. Při léčbě olanzapinem v kombinaci s lithiem nebo divalproexem došlo v akutní fázi léčby (trvající max. 6 týdnů) ke zvýšení tělesné hmotnosti o >7% u 17,4% pacientů. Dlouhodobá léčba olanzapinem (trvající až 12 měsíců) pro prevenci rekurence u pacientů s bipolární poruchou byla doprovázena zvýšením tělesné hmotnosti o >7% u 39,9% pacientů.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících mladších 18 let. Ačkoli nebyly provedeny studie navržené pro porovnání dospívajících a dospělých pacientů, data z klinických hodnocení dospívajících byla srovnána s údaji získanými ze studií u dospělých.
Následující tabulka shrnuje nežádoucí účinky hlášené s vyšší četností u dospívajících pacientů (ve věku 13-17 let) oproti dospělým pacientům, nebo nežádoucí účinky identifikované pouze v průběhu klinických hodnocení u dospívajících pacientů. Klinicky významné zvýšení tělesné hmotnosti (> 7%) se zdá, že se vyskytuje u dospívajících pacientů oproti dospělým s vyšší frekvencí. Velikost hmotnostního přírůstku a procento dospívajících pacientů s klinicky signifikantním nárůstem tělesné hmotnosti bylo větší při dlouhodobé expozici (nejméně 24 týdnů) než při krátkodobém používání.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10).
Poruchy metabolismu a výživy
Velmi časté: Zvýšení tělesné hmotnosti13, zvýšené hladiny triglyceridů14, zvýšená chuť k jídlu.
Časté: Zvýšené hladiny cholesterolu15_
Poruchy nervového systému
Velmi časté: Sedace (zahrnující: hypersomnii, letargii, ospalost)._
Gastrointestinální poruchy
Časté: Sucho v ústech_
Poruchy jater a žlučových cest
Velmi časté: Zvýšené hladiny jaterních aminotransferáz (ALT/AST; viz bod 4.4)._
Vyšetření
Velmi časté: Snížené hodnoty celkového bilirubinu, zvýšení hodnoty GMT, zvýšení plazmatických hladin prolaktinu16._
13Při krátkodobé léčbě (medián trvání 22 dnů) bylo zvýšení tělesné hmotnosti o > 7% počáteční tělesné hmotnosti (kg) velmi časté (40,6%), zvýšení tělesné hmotnosti o > 15% bylo časté (7,1%) a zvýšení o > 25% bylo časté (2,5%). Při dlouhodobé expozici (nejméně 24 týdnů) došlo k nárůstu tělesné hmotnosti u 89,4% o > 7%, u 55,3% o > 15% a u 29,1% o > 25% oproti jejich počáteční tělesné hmotnosti.
14 Pozorováno pro normální počáteční hladiny nalačno (< 1,016 mmol/l), které vzrostly na vysoké (> 1,467 mmol/l) a změny počátečních hladin triglyceridů nalačno z hraničních hodnot na počátku (> 1,016 mmol/l až < 1,467 mmol/l) na vysoké (> 1,467 mmol/l).
15 Změny počátečních hodnot celkového cholesterolu nalačno, kdy došlo ke zvýšení hladin
z normálních na počátku (< 4,39 mmol/l) na vysoké (> 5,17 mmol/l), byly pozorovány často. Změny počátečních hodnot celkového cholesterolu nalačno z hraničních na počátku (> 4,39 až < 5,17 mmol/l) na vysoké (> 5,17 mmol/l) byly velmi časté.
16Zvýšené plazmatické hladiny prolaktinu byly hlášeny u 47,4% dospívajících pacientů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Pokud jsou zjištěny známky a příznaky předávkování shodné s post-injekčním syndromem, měla by být přijata odpovídající podpůrná opatření (viz bod 4.4).
Vzhledem k tomu, že předávkování parenterálním přípravkem je méně pravděpodobné než perorálními léčivými přípravky, jsou zde pro referenci uvedeny informace týkající se předávkování perorálním olanzapinem:
Známky a příznaky
Mezi velmi časté příznaky (výskyt > 10%) předávkování patří tachykardie, agitovanost/agresivita, dysartrie, různé extrapyramidové příznaky a snížená úroveň vědomí, v rozmezí mezi sedací a komatem.
Další zdravotně významné důsledky předávkování zahrnují delirium, křeče, koma, možný neuroleptický maligní syndrom, útlum dýchání, aspiraci, hypertenzi nebo hypotenzi, srdeční arytmie (<2% případů předávkování) a zástavu dýchání a srdeční činnosti. Smrtelné případy byly hlášeny už po akutním předávkování perorální dávkou 450 mg, ale rovněž bylo popsáno přežití po akutním předávkování dávkou 2 g perorálního olanzapinu.
Léčba
Proti olanzapinu neexistuje žádné specifické antidotum. Podle klinického stavu je potřebné zahájit symptomatickou léčbu a sledování vitálních funkcí, zahrnující léčbu hypotenze, cirkulačního kolapsu a podporu funkce dýchání. Nesmí být používán adrenalin, dopamin nebo jiná p sympatomimetika, protože stimulace p adrenergních receptorů může prohloubit hypotenzi. Sledování kardiovaskulárních parametrů je nezbytné kvůli diagnostice možných poruch srdečního rytmu. Pacient musí být až do zotavení pod stálým lékařským dohledem a musí být sledovány jeho vitální funkce.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, diazepiny, oxazepiny, thiazepiny a oxepiny,
ATC kód: N05AH03
Farmakodynamické účinky
Olanzapin je antipsychotická, antimanická a náladu stabilizující látka, která vykazuje široké farmakologické působení na řadu receptorových systémů.
V preklinických studiích vykazuje olanzapin širokou afinitu k řadě receptorů (Ki<100 nM) pro serotonin 5HT2A/2C, 5HT3, 5HT6, dopamin Dj, D2, D3, D4, D5, cholinergní muskarinové receptory (Mj-M5), aj adrenergní a histaminové Hj receptory. Behaviorální studie na zvířatech prokázaly antagonistické působení olanzapinu na 5HT, dopaminové a cholinergní receptory konzistentní s receptorovým profilem. Olanzapin vykazoval větší in vitro afinitu k serotoninovým 5HT2 receptorům než k dopaminovým D2 receptorům a vyšší 5HT2 než D2 aktivitu v in vivo modelech. Elektrofyziologické studie ukázaly, že olanzapin selektivně snižuje aktivitu mezolimbických (A10) dopaminergních neuronů bez výraznějšího účinku na striatální (A9) dráhy ovládající motoriku. Olanzapin oslabuje podmíněnou vyhýbací odpověď v předpovědném testu antipsychotické aktivity v dávkách nižších než jsou ty, které vyvolávají katalepsii, tj. v předpovědném testu motorických nežádoucích účinků. Na rozdíl od některých jiných antipsychotik olanzapin zesilňuje odpověď v “anxiolytickém testu”.
Ve studii pozitronové emisní tomografie (PET) u pacientů léčených přípravkem ZYPADHERA (300 mg/4 týdny) byla na konci 6 měsíčního období střední obsazenost D2 receptorů 60% nebo vyšší, což je úroveň shodná s úrovní nacházenou v průběhu léčby perorálním olanzapinem.
Klinická, účinnost
Účinnost přípravku ZYPADHERA v léčbě a v udržovací léčbě schizofrenie je shodná s prokázanou účinností perorální formy olanzapinu.
Dvě pivotní studie zahrnovaly celkem 1469 pacientů se schizofrenií:
První 8-týdenní placebem kontrolovaná studie byla provedena u dospělých (n=404) pacientů, kteří trpěli akutními psychotickými příznaky. Pacienti byli randomizováni do skupin pro podání injekce přípravku ZYpAdHERA 405 mg každé 4 týdny, 300 mg každé 2 týdny, 210 mg každé 2 týdny nebo placebo každé 2 týdny. Doplňková léčba perorálními antipsychotiky nebyla povolena. Celkové skóre škály Positive and Negative Symptom Scores (PANSS) prokázalo signifikatní zlepšení na konci léčebné periody (průměrné změny -22,57, -26,32, -22,49 resp.) oproti počátečním hodnotám (průměrná počáteční celkové skóre PANSS bylo 101) u všech dávek přípravku ZYPADHERA (405 mg každé 4 týdny, 300 mg každé 2 týdny a 210 mg každé 2 týdny) ve srovnání s placebem (průměrná změna -8.51). V průběhu studijních návštěv, průměrná změna celkového skóre PANSS od počátku do konce studie ukázala, že od 3. dne došlo u pacientů ve skupinách s dávkou 300 mg/2 týdny a 405 mg/4 týdny ke statisticky významnému snížení celkového skóre PANSS oproti placebu (-8,6, -8,2 a -5,2 resp.). Ve všech třech skupinách, kterým byl podáván přípravek ZYPADHERA bylo prokázáno statisticky významně větší zlepšení oproti placebu na konci 1. týdne. Tyto výsledky podporují účinnost přípravku ZYPADHERA v průběhu 8 týdnů léčby a terapeutický účinek, který byl pozorován již v 1. týdnu po zahájení léčby přípravkem ZYPADHERA.
Druhá, dlouhodobá klinická studie byla provedena u klinicky stabilizovaných pacientů (n=1065, celkové průměrné skóre PANSS při zahájení bylo od 54,33 až 57,75), kterým byl nejprve podáván perorální olanzapin po dobu 4 až 8 týdnů, a potom byli rozděleni k pokračování v léčbě buď perorálním olanzapinem nebo přípravkem ZYPADHERA po dobu 24 týdnů. Doplňková léčba perorálními antipsychotiky nebyla povolena. Skupiny přípravku ZYPADHERA 150 mg a 300 mg každé 2 týdny (dávky byly sloučeny pro účely analýzy) a 405 mg každé 4 týdny nebyly horší oproti kombinovaným dávkám 10, 15 a 20 mg perorálního olanzapinu (dávky byly sloučeny pro účely analýzy) - měřeno procentem exacerbací symptomů schizofrenie (procenta exacerbací byly 10%, 10% a 7% resp.). Exacerbace byla měřena zhoršením položek pozitivní stupnice BPRS odvozené ze škály PANSS a dle počtu hospitalizací pro zhoršení pozitivních psychotických symptomů. Po 24 týdnech od randomizace nebyla kombinovaná skupina s léčbou 150 mg a 300 mg/2 týdny inferiorní oproti skupině s dávkou 405 mg/4 týdny (procento exacerbací bylo 10% pro každou skupinu).
Pediatrická populace
Přípravek ZYPADHERA nebyl zkoumán v pediatrické populaci. Kontrolovaná data týkající se účinnosti u dospívajících (od 13 do 17 let věku) jsou omezena na krátkodobá data ze studií perorálního olanzapinu u schizofrenie (6 týdnů) a mánie spojené s bipolární poruchou typu I (3 týdny), zahrnující méně než 200 dospívajících. Perorální olanzapin byl užíván ve flexibilní dávce od 2,5 mg při zahájení léčby až po 20 mg/den. V průběhu léčby perorálním olanzapinem došlo u dospívajících k signifikantně vyššímu nárůstu tělesné hmotnosti ve srovnání s dospělými. Rozsah změn hladin na lačno celkového cholesterolu, LDL cholesterolu, triglyceridů a prolaktinu (viz body 4.4 a 4.8) byl u dospívajících větší než u dospělých. Kontrolované údaje o přetrvávání účinku nebo dlouhodobé bezpečnosti nejsou k dispozici (viz body 4.4 a 4.8). Informace týkající se dlouhodobé bezpečnosti jsou omezeny zejména na nekontrolovaná data z otevřených studií.
5.2 Farmakokinetické vlastnosti
Absorpce
Olanzapin je metabolizovaný v játrech cestou konjugace a oxidace. V cirkulaci se z metabolitů objeví hlavně 10-N-glukuronid. Cytochromy P450-CYP1A2 a P450-CYP2D6 přispívají k tvorbě N-desmethyl a 2-hydroxymethyl metabolitů, vykazujících významně nižší in vivo farmakologickou aktivitu ve studiích na zvířatech než olanzapin. Převážná část farmakologické aktivity je způsobená původním olanzapinem.
Po jednorázové i.m. injekci přípravku ZYPADHERA začne ve svalu ihned pomalé rozpouštění soli olanzapin-embonátu, což zajišťuje pomalé kontinuální uvolňování olanzapinu po dobu více než čtyř týdnů. Uvolňování postupně slábne do ztracena v průběhu osmi až dvanácti týdnů. Při zahájení léčby přípravkem ZYPADHERA není zapotřebí přídavná perorální antipsychotická léčba (suplementace)
(viz bod 4.2).
Z kombinace profilu uvolňování a dávkovacího schématu (i.m. injekce každé dva nebo čtyři týdny) vyplývá trvalá plazmatická koncentrace olanzapinu. Po každé injekci přípravku ZYPADHERA zůstavají plazmatické koncentrace měřitelné po dobu několika měsíců. Poločas eliminace olanzapinu je po podání přípravku ZYPADHERA 30 dnů ve srovnání s 30 hodinami po perorálním podání. Absorpce a eliminace je dokončena přibližně šest až osm měsíců po poslední injekci.
Distribuce
Olanzapin po perorálním podání je rychle distribuován. Při plazmatické koncentraci 7 až 1 000 ng/ml se olanzapin váže přibližně z 93% na plazmatické bílkoviny. V plazmě je olanzapin navázán na albumin a na a1 kyselý glykoprotein.
Po opakované aplikaci i.m. injekce přípravku ZYPADHERA v dávce 150 až 300 mg každé dva týdny se 10. a 90. percentil ustálené plazmatické koncentrace olanzapinu nacházel mezi 4,2 a 73,2 ng/ml. Plazmatické koncentrace olanzapinu pozorované po podání dávek v rozmezí od 150 mg každé 4 týdny do 300 mg každé 2 týdny dokumentují zvyšující se systémovou expozici olanzapinu s rostoucí dávkou přípravku ZYPADHERA. V průběhu prvních třech měsíců léčby přípravkem ZYPADHERA byla pozorována akumulace olanzapinu, která se však již neprojevovala při dlouhodobém podávání (12 měsíců) u pacientů, kterým byla podávána dávka až 300 mg každé dva týdny.
Eliminace
Plazmatická clearence olanzapinu po perorálním podání je nižší u žen (18,9 l/h) oproti mužům (27,3 l/h) a u nekuřáků (18,6 l/h) oproti kuřákům (27,7 l/h). Podobné farmakokinetické rozdíly byly pozorovány mezi muži a ženami a mezi kuřáky a nekuřáky v klinických studiích s přípravkem ZYPADHERA. Nicméně vliv pohlaví nebo kouření na clearance olanzapinu je malý ve srovnání s celkovou variabilitou mezi jednotlivci.
Starší pacienti
Specifické studie použití přípravku u starší populace nebyly provedeny. Přípravek ZYPADHERA se nedoporučuje k léčbě starších pacientů (65 let a více), pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. U zdravých starších jedinců (65 let a více) byl průměrný vylučovací poločas prodloužen v porovnání se zdravými mladšími jedinci (51,8 hod. versus 33,8 hod) a clearance byla snížena (17,5 versus 18,2 l/hod). Farmakokinetická variabilita pozorovaná u starších jedinců je v mezích variability u mladších jedinců.
U 44 schizofrenních pacientů starších 65 let nebyl při dávkách 5-20 mg/den pozorován žádný zvláštní výskyt nežádoucích účinků.
Porucha funkce ledvin
Renální insuficience u pacientů (creatininová clearance <10 ml/min) ve srovnání se zdravými jedinci nezpůsobovala významný rozdíl v průměrném poločasu eliminace (37,7 hod. versus 32,4 hod.) nebo clearance (21,2 versus 25,0 l/hod.). Studie rovnováhy ukázala, že približně 57% radioaktivně značeného olanzapinu se objevilo v moči převážně jako metabolity. Ačkoli použití přípravku ZYPADHERA nebylo zkoumáno u pacientů s poškozením ledvin, je doporučeno před zahájením léčby přípravkem ZYPADHERA u pacientů s poškozením ledvin nejdříve dosáhnout dobře tolerovaného a účinného dávkovacího režimu při použití perorálního olanzapinu (viz bod 4.2).
Kuřáci
U kuřáků s mírným poškozením funkce jater byl průměrný vylučovací poločas perorálního olanzapinu prodloužen (39,3 hod.) a clearance byla snížena (18 l/hod) analogicky ke zdravým nekuřákům (48,8 hod. a 14,1 l/hod.). Ačkoli použití přípravku ZYPADHERA nebylo zkoumáno u pacientů s poškozením jater, je doporučeno před zahájením léčby přípravkem ZYPADHERA u pacientů s poškozením jater nejdříve dosáhnout dobře tolerovaného a účinného dávkovacího režimu při použití perorálního olanzapinu (viz bod 4.2).
Klinická studie s perorálním olanzapinem nenašla žádné rozdíly farmakokinetických parametrů mezi jedinci bělošské, japonské a čínské populace.
5.3 Předklinické údaje vztahující se k bezpečnosti
Byly provedeny předklinické studie s monohydrátem olanzapin-embonátuvztahující se k bezpečnosti. Hlavní nálezy získané ve studiích toxicity po opakovaném podání (potkan, pes), v 2-leté studii
kancerogenity provedené na potkanech a ve studiích reprodukční toxicity (potkan, králík) byly omezeny na nežádoucí účinky v místě podání, pro které nemohla být stanovena žádná hodnota NOAEL. Nebyly identifikovány žádné nové toxické účinky vycházející ze systémové expozice olanzapinu. Nicméně systémové koncentrace použité v těchto studiích byly menší než účinné hladiny v perorálních studiích, proto jsou níže uvedeny pro referenci informace týkající se perorálního olanzapinu.
Akutní toxicita (po jednorázové dávce)
Příznaky toxicity po perorálním podání hlodavcům obsahovaly silnou neuroleptickou složku: hypoaktivitu, kóma, třes, klonické křeče, slinění a zpomalení zvyšování hmotnosti. Střední letální dávka u myší byla přibližně 210 mg/kg a u potkanů 175 mg/kg. Psi tolerovali jednorázovou perorální dávku 100 mg/kg s nulovou mortalitou. Mezi klinické příznaky patřil útlum, ataxie, třes, zrychlený pulz, dušnost, mióza a anorexie. U opic vyvolala jednorázová perorální dávka až do 100 mg/kg vyčerpanost a vyšší dávky částečné bezvědomí.
Toxicita po opakovaném podávání
Ve studiích, které trvaly u myší až 3 měsíce a u potkanů a psů až 1 rok, se ukázaly jako hlavní účinky deprese CNS, anticholinergní účinky a periferní hematologické poruchy. Na depresi CNS se vyvinula tolerance. Růstové parametry byly při vysokých dávkách sníženy. Reverzibilní účinky spojené se zvýšenou hladinou prolaktinu u potkanů zahrnovaly pokles hmotnosti ovárií a uteru a morfologické změny vaginálního epitelu a prsní žlázy.
Hematologická toxicita: U všech druhů byly pozorované účinky na hematologické ukazatele, včetně na dávce závislého poklesu počtu cirkulujících leukocytů v krvi u myší a nespecifického poklesu cirkulujících leukocytů v krvi u potkanů. Navzdory tomu nebyl prokázaný hematotoxický účinek na kostní dřeň. U několika psů, kterým byla podávána dávka 8 až 10 mg/kg/den (celková expozice olanzapinu [AUC] je 12-15krát vyšší než dostává člověk při dávce 12 mg), se vyvinula reverzibilní neutropenie, trombocytopenie nebo anémie. U psů s cytopenií nebyly pozorované žádné nepříznivé účinky na progenitorové a proliferující buňky kostní dřeně.
Reprodukční toxicita
Olanzapin neměl žádný teratogenní účinek. U potkaních samců sedace ovlivnila páření. Estrální cykly byly ovlivněné dávkou 1,1 mg/kg (což je 3-násobek maximální dávky pro člověka) a reprodukční parametry byly u potkanů ovlivněné dávkou 3 mg/kg (což je 9-násobek maximální dávky pro člověka). U potomstva potkanů, kterým byl podávaný olanzapin, bylo pozorované opoždění fetálního vývoje a přechodný pokles aktivity.
Mutagenita
Olanzapin se neukázal jako mutanogenní nebo klastogenní v žádném ze standardních testů, které zahrnovaly bakteriální testy mutagenity in vitro a in vivo testy u savců.
Kancerogenita
Na základě výsledků studií na myších a potkanech bylo zjištěno, že olanzapin není kancerogenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek
Žádné.
Rozpouštědlo Sodná sůl karmelosy Manitol
Polysorbát 80 Voda na injekci
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky
Po rekonstituci v injekční lahvičce: 24 hodin. Pokud není přípravek ihned použit, musí být důkladně protřepán, aby opět vznikla suspenze. Po natažení z injekční lahvičky do stříkačky by suspenze měla být použita okamžitě.
Chemická a fyzikální stabilita suspenze v injekční lahvičce byla prokázána na dobu 24 hodin při teplotě 20-25°C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchování po otevření před použitím j sou odpovědností uživatele a normálněby doba neměla být delší než 24 hodin při 20-25°C.
6.4 Zvláštní opatření pro uchovávání Chraňte před chladem nebo mrazem.
6.5 Druh obalu a velikost balení
300 mg prášek: skleněná lahvička typ I, bromobutylovou zátkou pertlemi uzávěrem olivové barvy. Rozpouštědlo 3 ml: skleněná lahvička typ I, butylovou zátkou a uzávěremfialové barvy.
Jedna krabička obsahuje jednu lahvičku s práškem a jednu lahvičku s rozpouštědlem, jednu stříkačku Hypodermic 3 ml s přednasazenou bezpečnostní jehlou délky 38 mm a průměru 19 G, jednu bezpečnostní jehlu Hypodermic délky 38 mm a průměru 19 G a dvě bezpečnostní jehly Hypodermic délky 50 mm a průměru 19 G.
6.6 Zvláštní opatření pro likvidaci přípravku
POUZE K HLUBOKÉMU INTRAMUSKULÁRNÍMU GLUTEÁLNÍMU PODÁNÍ. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Rekonstituce
KROK 1: Příprava
Doporučuje se používat rukavice, protože přípravek ZYPADHERA může dráždit pokožku.
Rekonstituujte přípravek ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem pouze pomocí rozpouštědla pro parenterální použití obsaženém v balení, za použití standardních aseptických postupů pro přípravu parenterálních přípravků.
KROK 2: Stanovení potřebného objemu rozpouštědla pro rekonstituci
Následující tabulka udává množství rozpouštědla pro rekonstituci přípravku ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem.
|
ZYPADHERA síla (mg) |
Objem rozpouštedla pro přidání (ml) |
|
210 |
1,3 |
|
300 |
1,8 |
|
405 |
2,3 |
Je důležité si uvědomit, že v lahvičce je rozpouštědla více, než je potřebné k rekonstituci.
KROK 3: Rekonstituce přípravku ZYPADHERA
1. Uvolněte prášek lehkým poklepáním na lahvičku.
2. Rozbalte přibalenou stříkačku Hypodermic s jehlou s ochranným pouzdrem.
Odloupněte fólii blistru a vyndejte soupravu. Lehkým otáčivým pohybem připojte stříkačku (není-li již připojena) ke koncovce typu luer na soupravě. Zatlačením jehly a jejím pootočením ve směru hodinových ručiček zajistíte pevné připojení jehly k soupravě. Potom sundejte z jehly kryt. Nedodržení těchto pokynů může způsobit poranění jehlou.
3. Natáhněte do injekční stříkačky vypočítaný objem rozpouštědla (viz Krok 2).
4. Vstříkněte rozpouštědlo do lahvičky s práškem.
5. Vtáhněte do stříkačky vzduch pro vyrovnání tlaku v lahvičce.
6. Držte injekční lahvičku uzávěrem nahoru a vytáhněte jehlu tak, aby nedošlo k úniku rozpouštědla.
7. Nasaďte na jehlu ochranné pouzdro. Zatlačte jehlu jednou rukou do ochranného pouzdra. Zatlačení jednou rukou proveďte LEHKÝM zatlačením pouzdra proti rovné podložce. JAKMILE JE POUZDO STISKNUTO (obr. 1), JEHLA SPOLEHLIVĚ ZASKOČÍ DOVNITŘ POUZDRA (obr. 2).
8. Přesvědčte se zrakem, zda je jehla plně zatlačena do ochranného pouzdra. Ochranné pouzdro obsahující jehlu odstraňte ze stříkačky pouze, pokud to vyžaduje zvláštní lékařský postup. Pouzdro odstraňte stisknutím luer koncovky mezi palec a ukazováček. Zbývající prsty udržujte mimo dosah jehly (obr. 3).
Obr.2
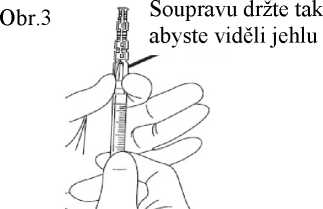
9. Opakovaně a důrazně poklepávejte lahvičkou o tvrdý povrch chráněný podložkou, dokud nepřestane být přítomnost prášku viditelná (viz obrázek A)
*

Obrázek A: Pro smíchání důkladně poklepejte
10. Zkontrolujte zrakem, zda v lahvičce nejsou shluky částic. Nesuspendovaný prášek vypadá jako žluté suché shluky částic ulpívající na dně lahvičky. Pokud zůstávají shluky částic v lahvičce, může být zapotřebí další poklepání (viz obrázek B).
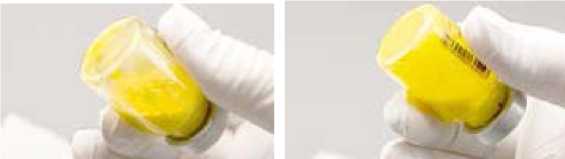
Nesuspendováno: viditelné shluky Suspendováno: bez shluků Obrázek B: Zkontrolujte, zda v lahvičce není nesuspendovaný prášek a v případě potřeby poklepání
opakujte.
11. Důkladně lahvičku protřepávejte, dokud suspenze mít odpovídající rovnoměrnou barvu a strukturu.
Suspendovaný přípravek bude žlutý a neprůhledný (viz obrázek C).
Obrázek C: Důkladně lahvičku protřepejte
Pokud se vytvoří pěna, nechte lahvičku stát, aby se pěna usadila. Pokud není přípravek ihned použit, musí být znovu důkladně protřepán, aby opět vznikla suspenze. Po rekonstituci je přípravek ZYPADHERA v lahvičce stabilní po dobu 24 hodin.
Podání
KROK 1: Aplikace přípravku ZYPADHERA
Tato tabulka uvádí konečný objem suspenze přípravku ZYPADHERA pro aplikaci injekce. Koncentrace suspenze je 150 mg/ml olanzapinu.
|
Dávka (mg) |
Konečný objem pro aplikaci injekce (ml) |
|
150 |
1,0 |
|
210 |
1,4 |
|
300 |
2,0 |
|
405 |
2,7 |
1. Rozhodněte, která jehla bude použita k podání injekce pacientovi. Pro obézní pacienty je pro injekci doporučena jehla délky 50 mm:
• Pokud je pro injekci určena jehla délky 50 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 38 mm jehlu.
• Pokud je pro injekci určena jehla délky 38 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 50 mm jehlu.
2. Pomalu natáhněte zvolené množství. V lahvičce zůstane přebývající množství přípravku.
3. Nasaďte na jehlu ochranné pouzdro a jehlu ze stříkačky odstraňte.
4. Před podáním přípravku nasaďte na stříkačku vybranou bezpečnostní jehlu délky 50 mm nebo 38 mm. Jakmile je suspenze natažena z lahvičky, měla by být okamžitě podána.
5. Zvolte a připravte místo vpichu v hýžďové oblasti. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
6. Po vpíchnutí jehly do svalu několik sekund aspirujte, abyste se ujistil(a), že se neobjeví krev. Pokud se do stříkačky natáhne krev, stříkačku a dávku znehodnoťte a připravte novou dávku. Injekce by se měla aplikovat rovnoměrným nepřerušeným tlakem.
INJEKČNÍ MÍSTO NEMASÍRUJTE.
7. Nasaďte na jehlu ochranné pouzdro (obr. 1 a 2).
8. Injekční lahvičku, stříkačku, použité jehly, jehlu navíc a veškeré nepoužité rozpouštědlo znehodnoťte podle odpovídajících klinických postupů. Injekční lahvička je určena pro jednorázové použití.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/479/002
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENIÍ REGISTRACE
Datum první registrace: 18/11/2008
Datum posledního prodloužení registrace: 26/8/2013
10. DATUM REVIZE TEXTU DD/MM/RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
NÁZEV PŘÍPRAVKU
1.
ZYPADHERA 405 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna lahvička obsahuje olanzapini embonas monohydricus odpovídající olanzapinum 405 mg. Po rekonstituci jeden ml suspenze obsahuje olanzapinuum 150 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem Prášek: žlutý prášek
Rozpouštědlo: čirý, bezbarvý až lehce nažloutlý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Udržovací léčba schizofrenie u dospělých pacientů dostatečně stabilizovaných akutní léčbou perorálním olanzapinem.
4.2 Dávkování a způsob podání
Přípravek ZYPADHERA 405 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem nesmí být zaměněn s olanzapinem 10 mg prášek pro přípravu injekčního roztoku.
Dávkování
Pro stanovení snášenlivosti a odpovědi na léčbu by pacienti měli být před podáním přípravku ZYPADHERA léčeni perorálním olanzapinem.
Pro stanovení první dávky přípravku ZYPADHERA by mělo být u všech pacientů zváženo schéma uvedené v Tabulce 1.
Tabulka 1 Doporučené dávkovací schéma pro převod mezi perorálním olanzapinem a přípravkem ZYPADHERA
|
Cílová dávka perorálního olanzapinu |
Doporučená zahajovací dávka přípravku ZYPADHERA |
Udržovací dávka přípravku ZYPADHERA po 2 měsích léčby |
|
10 mg/den |
210 mg/2 týdny nebo 405 mg/4 týdny |
150 mg/2 týdny nebo 300 mg/4 týdny |
|
15 mg/den |
300 mg/2 týdny |
210 mg/2 týdny nebo 405 mg/4 týdny |
|
20 mg/den |
300 mg/2 týdny |
300 mg/2 týdny |
Úprava dávkování
U pacientů by měly být v průběhu prvního až druhého měsíce léčby pečlivě sledovány známky možného relapsu. Při antipsychotické léčbě může trvat několik dní až týdnů, než dojde ke zlepšení klinického stavu pacienta. Po tuto dobu by měli být pacienti pod pečlivou kontrolou. Dávka může být v průběhu léčby následně upravena na základě individuálního klinického stavu. Po klinickém přehodnocení může být dávka upravena v rozmezí 150 mg až 300 mg každé 2 týdny nebo 300 až 405 mg každé 4 týdny. (Tabulka 1)
Přídavná léčba (suplementace)
Doplnění léčby perorálním olanzapinem nebylo v průběhu dvojitě zaslepených klinických studií povoleno. Pokud je suplementace perorálním olanzapinem klinicky indikována, celková kombinovaná dávka olanzapinu v obou lékových formách by neměla přesáhnout odpovídající maximální dávku perorálního olanzapinu 20 mg/den.
Převedení na jiné léčivé antipsychotické přípravky
Data specificky zaměřená na převedení pacientů z přípravku ZYPADHERA na jiné antipsychotické léčivé přípravky nebyla systematicky shromažďována. Z důvodu pomalého rozpouštění soli olanzapin embonátu, které způsobuje pomalé kontinuální uvolňování olanzapinu trvající šest až osm měsíců po poslední injekci, je zvláště v průběhu prvních dvou měsíců po ukončení léčby přípravkem ZYPADHERA zapotřebí dohled lékaře v případě, že je klinický důvod k převedení na jiný antipsychotický přípravek.
Zvláštní populace
Starší pacienti
Přípravek ZYPADHERA nebyl systematicky hodnocen u starších pacientů (> 65 let). Přípravek ZYPADHERA se nedoporučuje k léčbě starších pacientů, pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. U pacientů starších 65 let není běžně nižší počáteční dávka (150 mg/4 týdny) nutná, ale měla by být v klinicky odůvodněných případech zvážena (viz bod 4.4). Zahájení léčby přípravkem ZYPADHERA není doporučeno u pacientů starších 75 let (viz bod 4.4).
Pacienti s poruchou funkce ledvin a/nebo jater
U těchto pacientů by přípravek ZYPADHERA neměl být použit, pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. Je vhodné zvážit nižší počáteční dávku (150 mg/4 týdny) u těchto pacientů. V případě středně závažného poškození jater (cirhóza, Child-Pugh class A nebo B) by počáteční dávka měla být 150 mg/4 týdny a zvyšována by měla být opatrně.
Kuřáci
Nekuřákům ve srovnání s kuřáky není třeba upravovat počáteční dávku a dávkové rozmezí. Metabolismus olanzapinu může být kouřením indukován. Je doporučeno monitorovat klinický stav a zvážit zvýšení dávky olanzapinu, pokud to bude považováno za nutné (viz bod 4.5).
Při přítomnosti více než jednoho faktoru, který zpomaluje metabolizmus (ženské pohlaví, vyšší věk, nekuřák) by se mělo zvážit snížení dávky. Zvyšování dávek by mělo být obezřetné, i když je indikované.
Pediatrická populace
Bezpečnost a účinnost přípravku ZYPADHERA u dětí a mladistvích do 18 let nebyla stanovena. V současnosti dostupné údaje jsouuvedeny v bodech 4,8 a 5.1, ale nelze z nich stanovit doporučení pro dávkování.
Způsob podání
POUZE K INTRAMUSKULÁRNÍMU PODÁNÍ. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ. (Viz bod 4.4)
Přípravek ZYPADHERA by měl být podán pouze hluboko intramuskulámě do gluteálního svalu, zdravotnickým pracovníkem vyškoleným v odpovídající injekční technice, na pracovišti, kde může být zajištěno post-injekční sledování a kde je možné zajistit přístup k odpovídající lékařské péči v případě předávkování.
Po každé injekci by měli být pacienti sledováni na zdravotnickém pracovišti náležitě vyškoleným personálem po dobu nejméně 3 hodin pro zjištění případných známek a příznaků odpovídajících předávkování olanzapinem. Bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování. Při podezření na předávkování by mělo monitorování a důkladný lékařský dohled pokračovat do doby než vyšetření prokáže odeznění příznaků a známek předávkování (viz bod 4.4.). Podle klinické potřeby se má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
Návod k použití viz bod 6.6.
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Pacienti se známým rizikem angulárního glaukomu.
4.4 Zvláštní upozornění a opatření pro použití
Je nutné věnovat zvýšenou péči odpovídající injekční technice, aby se předešlo neúmyslnému intravaskulárním nebo subkutánnímu podání (viz bod 6.6).
Použití u akutně agitovaných pacientů nebo u pacientů se závážným psychotickým stavem Přípravek ZYPADHERA by neměl být použit k léčbě pacientů se schizofrenií, kteří trpí akutní agitovaností nebo závažným psychotickým stavem, který vyžaduje okamžitou kontrolu příznaků.
Post-injekční syndrom
V klinických studiích před uvedením přípravku na trh byly po aplikaci přípravku ZYPADHERA u pacientů hlášeny reakce představované známkami a symptomy shodnými s příznaky předávkování olanzapinem. K těmto reakcím došlo u přibližně <0,1% injekcí a přibližně u 2% pacientů. U většiny těchto pacientů došlo k rozvoji známek sedace (v rozmezí od mírné sedace až po kóma) a/nebo deliria, (včetně zmatenosti, dezorientace, agitovanosti, úzkosti a dalších kognitivních poruch). Mezi další zaznamenané příznaky patřily extrapyramidové příznaky, dysartrie, ataxie, agresivita, závratě, slabost, hypertenze a křeče. Ve většině případů se prvotní známky a příznaky spojené s touto reakcí objevily v průběhu 1 hodiny po injekci a ve všech případech bylo hlášeno plné zotavení během 24-72 hodin po injekci. K reakcím došlo vzácně (<1 z 1 000 injekcí) mezi 1 a 3 hodinami a velmi vzácně (<1 z 10 000 injekcí) po 3 hodinách. Pacienti by měli být seznámeni s tímto potenciálním rizikem a s nutností zůstat na pozorování na zdravotnickém pracovišti po dobu 3 hodin po každé aplikaci přípravku ZYPADHERA. Od doby registrace přípravku ZYPADHERA jsou post-marketingová hlášení týkající se post-injekčního syndromu obecně v souladu se zkušenostmi získanými z klinických studií.
Pacienti by měli být po každé injekci sledováni na zdravotnickém pracovišti náležitě vyškoleným personálem po dobu nejméně 3 hodin pro zjištění známek a příznaků odpovídajících předávkování olanzapinem.
Bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování. Při podezření na předávkování by mělo monitorování a důkladný lékařský dohled pokračovat do doby než vyšetření prokáže odeznění příznaků a známek předávkování. Podle klinické potřeby se má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
Pacienti by měli být poučeni, aby po zbytek dne po injekci sledovali případné známky a symptomy předávkování vyplývající z post-injekčního syndromu, aby byli schopni si v případě nutnosti zajistit pomoc, a že by neměli řídit ani obsluhovat nebezpečné stroje (viz bod 4.7).
Pokud je pro zvládnutí post-injekčních nežádoucích účinků nutné podání benzodiazepinů, je doporučeno důkladné vyhodnocení klinického stavu s ohledem na nadměrnou sedaci a kardiorespirační útlum (viz bod 4.5).
Nežádoucí účinky v místě aplikace
Nejčastěji hlášeným nežádoucím účinkem spojeným s místem aplikace byla bolest. Většina těchto nežádoucích účinků byla hlášena jako „mírné“ až „střední“ intenzity. Vyskytne-li se nežádoucí účinek v místě aplikace, měla by být ke zvládnutí této příhody přijata odpovídající opatření (viz bod 4.8).
Psychózy a poruchy chování související s demencí
Olanzapin není doporučen k podávání u pacientů s psychózou a/nebo poruchami chování souvisejícími s demencí z důvodu zvýšené mortality a zvýšeného rizika cerebrovaskulárních příhod. V placebem kontrolovaných studiích (v délce 6-12 týdnů) u starších pacientů (průměrný věk 78 let) s psychózou a/nebo poruchami chování souvisejícími s demencí byla u pacientů léčených perorálním olanzapinem dvojnásobná incidence úmrtí ve srovnání s pacienty užívajícími placebo (3,5% vs. 1,5% resp.). Vyšší incidence úmrtí nesouvisela s dávkou olanzapinu (průměrná denní dávka 4,4 mg) nebo s délkou léčby. Rizikovými faktory, které se mohou podílet na zvýšené mortalitě u této skupiny pacientů, jsou věk nad 65 let, dysfagie, sedace, malnutrice a dehydratace, plicní onemocnění (např. pneumonie, ev. i s aspirací) nebo současné užívání benzodiazepinů. Vyšší incidence úmrtí u pacientů léčených perorálním olanzapinem ve srovnání s pacienty užívajícími placebo byla však na uvedených rizikových faktorech nezávislá.
Ve stejných klinických studiích byly hlášeny cerebrovaskulární nežádoucí účinky (např. iktus, tranzitorní ischemické ataky), včetně úmrtí. U pacientů léčených perorálním olanzapinem bylo zaznamenáno trojnásobné zvýšení výskytu cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (1,3% vs. 0,4%, resp.). U všech pacientů léčených perorálním olanzapinem nebo placebem, u nichž se cerebrovaskulární příhoda vyskytla, byly přítomny rizikové faktory. K faktorům, které byly zjištěny jako rizikové u pacientů léčených olanzapinem, patřil věk nad 75 let a vaskulární a/nebo smíšená demence. Účinnost olanzapinu v těchto studiích nebyla stanovena.
Parkinsonova choroba
Použití olanzapinu k léčbě psychózy související s podáváním dopaminového agonisty u pacientů s Parkinsonovou chorobou se nedoporučuje. V klinických studiích bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symptomatiky a halucinací (viz bod 4.8) a perorální olanzapin nebyl v léčení psychotických příznaků účinnější než placebo. V těchto studiích museli mít pacienti na začátku studie stabilní a nejnižší účinnou dávku antiparkinsonika (dopaminového agonisty). Toto antiparkinsonikum jim bylo podáváno ve stejné dávce po celou zbývající dobu studie. Počáteční dávka perorálního olanzapinu byla 2,5 mg/den a podle uvážení lékaře mohla být titrována do maximální dávky 15 mg/den.
Neuroleptický maligní syndrom (NMS)
NMS je potenciálně život ohrožující stav spojený s podáváním antipsychotik. Vzácné případy označené jako NMS byly rovněž hlášeny v souvislosti s perorálním olanzapinem. Klinické příznaky NMS jsou hyperpyrexie, svalová rigidita, alterovaná psychika a příznaky autonomní instability (nepravidelný pulz anebo tlak krve, tachykardie, pocení a arytmie). Další příznaky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rhabdomyolýzu) a akutní renální selhání. Pokud se u pacienta objeví příznaky podezřelé ze spojení s NMS nebo pokud se objeví nevysvětlitelně vysoká horečka i bez dalších klinických známek NMS, musí být všechna antipsychotika včetně olanzapinu vysazena.
Hyperglykémie a diabetes
Méně často byly hlášeny hyperglykémie a/nebo rozvoj nebo exacerbace diabetů, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.8). V některých případech tomu předcházelo zvýšení tělesné hmotnosti, což mohlo být predispozičním faktorem. V souladu s používanými pravidly antipsychotické léčby je doporučeno příslušné klinické monitorování, např. měření hladiny glukózy v krvi před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy jednou ročně. U pacientů léčených jakýmikoliv antipsychotickými léčivy, včetně přípravku ZYPADHERA, by měly být sledovány známky a příznaky hyperglykémie (jako je polydipsie, polyurie, polyfagie a slabost) a pacienti s diabetem nebo s rizikovými faktory pro rozvoj diabetu by měli být pravidelně monitorováni s ohledem na zhoršení kontroly hladiny glukózy. Pravidelně by měla být kontrolována tělesná hmotnost, např. před začátkem léčby, 4, 8 a 12 týdnů po záhájení podávání olanzapinu a následně vždy každé tři měsíce.
Změny hladin lipidů
V placebem kontrolovaných klinických studiích byly u pacientů léčených olanzapinem pozorovány nežádoucí změny hladin lipidů (viz bod 4.8). Změny lipidového profilu by měly být ošetřeny podle klinické potřeby, obzvláště u pacientů s dyslipidemií a u pacientů s rizikovými faktory pro rozvoj poruch lipidů. U pacientů léčených jakýmikoliv antipsychotickými léčivy, včetně přípravku ZYPADHERA, by v souladu s používanými pravidly antipsychotické léčby měly být pravidelně kontrolovány hladiny lipidů, např. před začátkem léčby, 12 týdnů po zahájení podávání olanzapinu a následně vždy každých 5 let.
Anticholinergní aktivita.
Ačkoliv byla in vitro prokázána anticholinergní aktivita olanzapinu, zkušenosti během klinických studií ukázaly nízkou incidenci souvisejících příhod. Protože však klinické zkušenosti s podáváním olanzapinu u pacientů s jiným souběžným onemocněním jsou omezené, doporučuje se zvýšená pozornost, pokud je olanzapin předepisován pacientům s hypertrofií prostaty, paralytickým ileem nebo podobnými stavy.
Jaterní funkce
Často, obzvlášť v počátcích léčby, bylo pozorováno přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz, ALT a AST. U pacientů s vyšší hladinou ALT a/nebo AST, se známkami a příznaky poškození jater, s preexistující sníženou funkční rezervou jaterní funkce a u pacientů léčených potenciálně hepatotoxickými přípravky je třeba opatrnosti a dalšího sledování. Je-li u pacientů diagnostikována hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater), je třeba léčbu olanzapinem ukončit.
Neutropenie
Opatrnosti je třeba u pacientů s nižším počtem leukocytů a/nebo neutrofilů z jakýchkoliv příčin, u pacientů užívajících léky způsobující neutropenii, u pacientů s anamnézou polékového útlumu kostní dřeně nebo útlumem kostní dřeně způsobeným souběžným onemocněním, radiační terapií nebo chemoterapií, u pacientů s hypereozinofilií nebo s myeloproliferativní chorobou. Neutropenie byla často hlášena při současném podávání olanzapinu a valproátu (viz bod 4.8).
Přerušení léčby
Při náhlém přerušení léčby perorálním olanzapinem byly vzácně (> 0,01% a < 0,1%) hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nauzea nebo zvracení.
QT interval
V klinických studiích bylo u pacientů léčených perorálním olanzapinem klinicky významné prodloužení QTc intervalu (korekce QT podle Fridericii [QTcF] > 500 millisekund [ms] kdykoliv po vstupním vyšetření u pacientů se vstupní hodnotou QTcF < 500 ms) méně časté (0,1% až 1%), bez signifikantních rozdílů v průvodních srdečních příhodách ve srovnání s placebem. V klinických studiích s olanzapinem práškem pro přípravu roztoku pro injekce nebo s přípravkem ZYPADHERA nebylo podávání olanzapinu spojeno s přetrvávajícím zvýšením absolutního QT nebo QTCc intervalu.
Přesto je třeba, zvýšené opatrnosti, je-li olanzapin předepisován s léky prodlužujícími QTc interval, obzvlášť u starších pacientů, u pacientů s vrozeným prodloužením QT intervalu, s městnavým srdečním selháním, se srdeční hypertrofií, s hypokalémií nebo hypomagnezémií.
Tromboembolismus
Časová souvislost léčby olanzapinem a žilního tromboembolismu byla hlášena méně často (> 0,1% a < 1%). Kauzální vztah mezi výskytem žilního tromboembolismu a léčbou olanzapinem nebyl stanoven. Avšak protože u pacientů se schizofrenií jsou často přítomny získané rizikové faktory žilního tromboembolismu, je nutné identifikovat a vzít v úvahu všechny možné rizikové faktory, např. imobilizaci pacientů, a vykonat preventivní opatření.
Obecná CNS aktivita
Vzhledem k primárnímu účinku olanzapinu na centrální nervovou soustavu je třeba opatrnosti při současném užívání s jinými centrálně působícími léky či alkoholem. Protože olanzapin působí in vitro jako dopaminový antagonista, může působit proti účinku přímých a nepřímých agonistů dopaminu.
Křeče
Olanzapin by měl být používán opatrně u pacientů s křečemi v anamnéze, anebo u těch, u kterých se vyskytují faktory snižující křečový práh. U pacientů léčených olanzapinem byly křeče hlášeny méně často. Ve většině těchto případů byly hlášeny křeče v anamnéze či jiné rizikové faktory.
Tardivní dyskineze
V ročních nebo kratších srovnávacích studiích byl perorální olanzapin statisticky významně méně často spojen s nově hlášenou dyskinezí. Přesto riziko pozdní dyskineze při dlouhodobém užívání vzrůstá. Pokud se u pacienta léčeného olanzapinem objeví známky a symptomy pozdní dyskineze, mělo by se zvážit snížení dávky nebo přerušení podávání. Tyto symptomy se mohou přechodně zhoršit nebo se objevit po přerušení léčby.
Posturální hypotenze
V klinických studiích s olanzapinem byla zřídka u starších pacientů pozorována posturální hypotenze. U pacientů starších 65 let je doporučeno pravidelně měřit krevní tlak.
Náhlá srdeční smrt
V postmarketingovém sledování olanzapinu byly u pacientů léčených olanzapinem nahlášeny případy náhlé srdeční smrti. V retrospektivní observační kohortové studii bylo riziko předpokládané náhlé srdeční smrti u pacientů léčených olanzapinem přibližně dvojnásobné oproti pacientům, kteří neužívali antipsychotika. V této studii bylo riziko při užívání olanzapinu porovnatelné s rizikem užívání atypických antipsychotik spojených do jedné analýzy.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících. Klinická hodnocení provedená u pacientů ve věkovém rozmezí 13-17 let ukázala různé nežádoucí účinky, včetně nárůstu tělesné hmotnosti, změny metabolických parametrů a zvýšení hladiny prolaktinu (viz body 4.8 a 5.1).
Použití u starších pacientů (>75leť)
O použití přípravku ZYPADHERA u pacientů starších 75 let nejsou k dispozici žádné údaje.
Vzhledem k biochemickým a fyziologickým změnám a vzhledem k redukci svalové hmoty není u této podskupiny pacientů doporučeno tuto lékovou formu nasazovat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí byly provedeny pouze u dospělých.
Zvýšená opatrnost je zapotřebí u pacientů užívajících léčivé přípravky, které mohou indukovat hypotenzi nebo sedaci.
Možné interakce ovlivňující o1a.nza.pin
Vzhledem k tomu, že je olanzapin metabolizován izoenzymem CYP1A2, mohou látky, které specificky tento izoenzym indukují nebo inhibují, ovlivnit farmakokinetiku olanzapinu.
Indukce CYP1A2
Kouření a karbamazepin mohou indukovat metabolizmus olanzapinu, což může vést ke snížení koncentrace olanzapinu. Bylo pozorováno zanedbatelné, případně jen mírné zvýšení clearance olanzapinu. I když je klinický dopad pravděpodobně minimální, doporučuje se klinické monitorování a v nezbytných případech je možné zvážit zvýšení dávek olanzapinu (viz bod 4.2).
Inhibice CYP1A2
Prokázalo se, že fluvoxamin, specifický inhibitor CYP1A2, významně zpomaluje metabolizmus olanzapinu. Průměrné zvýšení maximální koncentrace (Cmax) olanzapinu fluvoxaminem bylo 54% u žen nekuřaček a 77% u mužů kuřáků. Průměrné zvýšení plochy pod křivkou koncentrace léčiva (AUC) bylo 52% u žen a 108% u mužů. U pacientů užívajících fluvoxamin nebo jiný inhibitor CYP1A2, jako např. ciprofloxacin, je třeba uvážit snížení počáteční dávky olanzapinu. Při zahájení léčby inhibitorem CYP1A2 je třeba uvážit snížení dávek olanzapinu.
Fluoxetin (inhibitor CYP2D6), jednorázové dávky antacida (hliník, hořčík) nebo cimetidinu neměly významný vliv na farmakokinetiku olanzapinu.
Možnosti ovlivnění účinku, jiných léků olanzapinem
Olanzapin může působit proti účinkům přímých a nepřímých agonistů dopaminu.
Olanzapin in vitro neinhibuje hlavní izoenzymy CYP450 ( např. 1A2, 2D6, 2C9, 2C19, 3A4). Neočekávají se proto žádné zvláštní interakce, což dokazují i in vivo studie, které neprokázaly inhibici metabolizmu následujících léčivých látek: tricyklická antidepresiva (reprezentující převážně CYP2D6 cestu metabolizace), warfarin (CYP2C9), theofylin (CYP1A2) nebo diazepam (CYP3A4 a 2C19).
Olanzapin nevykazoval interakci se současně podáváným lithiem nebo biperidenem.
Terapeutické monitorování plazmatických hladin valproátu neukázalo, že by byla při zahájení přídatné medikace olanzapinem nutná úprava dávkování valproátu.
Obecná CNS aktivita
Zvýšená opatrnost je zapotřebí u pacientů konzumujících alkohol nebo užívajících léčivé přípravky působící tlumivě na CNS.
Současné užívání olanzapinu a léčivých přípravků k léčbě Parkinsonovy choroby a demence není doporučeno (viz bod 4.4).
QTc interval
Zvýšená opatrnost je zapotřebí u pacientů užívajících současně olanzapin a léčivé přípravky, o kterých je známo, že prodlužují QTc interval (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Neexistují žádné přiměřené a dobře vedené studie u gravidních žen. Pacientky by měly být poučené, aby lékaře informovaly o graviditě anebo o plánované graviditě během užívání olanzapinu. Kvůli nedostatku zkušeností by olanzapin měl být v graviditě podávaný pouze tehdy, pokud jeho potenciální prospěšnost vyváží potenciální nebezpečí pro plod.
U novorozenců, kteří byli vystaveni antipsychotikům (včetně olanzapinu) během třetího trimestru těhotenství, existuje riziko výskytu nežádoucích účinků zahrnujících extrapyramidové a/nebo abstinenční příznaky, které se mohou po porodu lišit v závažnosti a délce trvání. Byly hlášeny případy agitovanost, hypertonie, hypotonie, tremoru, somnolence, dechové tísně nebo potíží při kojení. Novorozenci proto musejí být pečlivě sledováni.
Kojení
Ve studii perorálního olanzapinu u kojících zdravých žen byl olanzapin vylučován do mateřského mléka. Průměrná expozice dítěte (mg/kg) v rovnovážném stavu byla odhadnuta na 1,8% z dávky olanzapinu podaného matce (mg/kg). Pacientky je třeba poučit, aby během užívání olanzapinu nekojily.
Fertilita
Účinky na fertilitu nejsou známy (viz bod 5.3 pro preklinické informace).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Jelikož olanzapin může způsobit ospalost a závratě, pacienti by měli být opatrní při obsluze strojů včetně řízení motorových vozidel.
Pacienti by měli být poučeni, aby se vyvarovali řízení nebo obsluhy strojů po zbytek dne, ve kterém obdrželi injekci, z důvodu možného výskytu post-injekčního syndromu vedoucího k příznakům shodným s příznaky předávkování olanzapinem (viz bod 4.4).
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Nežádoucí účinky pozorované u olanzapin-embonátu
Při podávání přípravku ZYPADHERA se vyskytly reakce post-injekčního syndromu vedoucí k symptomům shodným s předávkováním olanzapinem (viz bod 4.2 a 4.4). Klinické známky a symptomy zahrnovaly příznaky sedace (v rozmezí od mírné sedace až po kóma) a/nebo delirium (včetně zmatenosti, dezorientace, agitovanosti, úzkosti a dalších kognitivních poruch). Mezi další zaznamenané příznaky patřily extrapyramidové příznaky, dysartrie, ataxie, agresivita, závratě, slabost, hypertenze a křeče.
Další nežádoucí účinky pozorované u pacientů léčených přípravkem ZYPADHERA byly podobné nežádoucím účinkům pozorovaným u perorálního olanzapinu. V klinických studiích s přípravkem ZYPADHERA byla sedace jediným nežádoucím účinkem hlášeným staticky významně častěji ve skupině přípravku ZYPADHERA oproti skupině placeba (ZYPADHERA 8,2%, placebo 2,0%). U všech pacientů léčených přípravkem ZYPADHERA byla sedace hlášena u 4,7% pacientů.
V klinických studiích s přípravkem ZYPADHERA byl výskyt nežádoucích účinků v místě aplikace přibližně 8%. Nejčastěji hlášeným nežádoucím účinkem v místě aplikace byla bolest (5%); některé další nežádoucí účinky v místě podání byly (dle klesající frekvence výskytu): nodulární zatvrdnutí, zarudnutí, nespecifické místní reakce, iritace, otoky, podlitiny, krvácení a anestézie. K těmto reakcím došlo o 0,1 až 1,1% pacientů.
V přehledu údajů o bezpečnosti z klinických hodnocení a ze spontánních postmarketingových hlášení byl absces v místě vpichu hlášen vzácně (> 1/10000 až < 1/1000).
Nežádoucí účinky pozorované u olanzapinu
Nežádoucí účinky uvedené níže byly pozorovány po podání olanzapinu.
Dospělí
Nejčastěji hlášenými (pozorované u > 1% pacientů) nežádoucími účinky spojenými s užíváním olanzapinu v klinických studiích byla somnolence, zvýšení tělesné hmotnosti, eozinofilie, zvýšené hladiny prolaktinu, cholesterolu, glukózy a triglyceridů (viz bod 4.4), glykosurie, zvýšená chuť k jídlu, závratě, akatizie, parkinsonismus, leukopenie, neutropenie (viz bod 4.4), dyskineze, ortostatická hypotenze, anticholinergní účinky, přechodné asymptomatické zvýšení jaterních aminotransferáz (viz bod 4.4), rash, asténie, únava, horečka, artralgie, zvýšené hodnoty alkalické fosfatázy, gamma glutamyltransferázy, kyseliny močové a kreatinfosfokinázy a otok.
Seznam nežádoucích účinků v tabulkovém formátu
Následující tabulka podává seznam nežádoucích účinků a laboratorních nálezů pozorovaných ve spontánních hlášeních a v klinických hodnoceních. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000) a není známo (z dostupných údajů nelze určit).
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Poruchy krve a lymfatického systému | ||||
|
Eozinofilie Leukopenie10 Neutropenie— |
T rombocytopenie11 | |||
|
Poruchy imunitního systému | ||||
|
Hypersenzitivita11 | ||||
|
Poruchy metabo |
ismu a výživy | |||
|
Přibývání na váze1 |
Zvýšené hladiny cholesterolu2,3 Zvýšené hladiny glukózy4 Zvýšené hladiny triglyceridů2,5 Glykosurie Zvýšená chuť k jídlu |
Vznik nebo exacerbace diabetu, spojené příležitostně s ketoacidózou nebo komatem, včetně několika fatálních případů (viz bod 4.4) 11 |
Hypotermie12 | |
|
Poruchy nervového systému | ||||
|
Somnolence |
Závratě Akatizie6 Parkinsonismus6 Dyskineze6 |
Křeče, kdy ve většině případů byly hlášeny křeče v anamnéze či jiné rizikové faktory pro vznik křečí11 Dystonie (včetně okulogyrické krize)— Tardivní dyskineze11 Amnézie9 Dysartrie |
Neuroleptický maligní syndrom (viz bod 4.4)12 Příznaky z vysazení7, 12 | |
|
Srdeční poruchy | ||||
|
Bradykardie Prodloužení QTc intervalu (viz bod 4.4) |
Ventrikulární tachykardie/fibrilace, náhlá smrt (viz bod 4.4) 11 | |||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Cévní poruchy | ||||
|
Ortostatická |
Tromboembolismus (včetně pulmonární embolie a hluboké žilní trombózy) (viz bod 4.4) | |||
|
Respirační, hru |
ní a mediastinální poruchy | |||
|
Epistaxe9 | ||||
|
Gastrointestinalní poruchy | ||||
|
Mírné přechodné anticholinergní účinky včetně obstipace a suché ústní sliznice |
Břišní distenze9 |
Pankreatitida11 | ||
|
Poruchy jater a žlučových cest | ||||
|
Přechodné asymptomatické zvýšení hladiny jaterních aminotransferáz (ALT, AST) obzvlášť na počátku léčby (viz bod 4.4) |
Hepatitida (včetně hepatocelulárního, cholestatického nebo kombinovaného poškození jater) 11 | |||
|
Poruchy kůže a |
podkožní tkáně | |||
|
Rash |
Fotosenzitivní reakce Alopecie | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||||
|
Artralgie9 |
Rhabdomyolýza11 | |||
|
Poruchy ledvin a močových cest | ||||
|
Inkontinence moči Retence moči Opožděný začátek močení11 | ||||
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím | ||||
|
Syndrom z vysazení u novorozenců (viz bod 4.6) | ||||
|
Poruchy reprodukčního systému a prsu | ||||
|
Erektilní dysfunkce u mužů Snižení libida u mužů i žen |
Amenorea Zvětšení prsou Galaktorea u žen Gynekomastie/zvětše ní prsou u mužů |
Priapismus12 | ||
|
Celkové poruchy a reakce v místě aplikace | ||||
|
Asténie Únava Otok Horečka10 Bolest v místě vpichu |
Absces v místě vpichu | |||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo |
|
Vyšetření | ||||
|
Zvýšené plazmatické hladiny prolaktinu8 |
Zvýšené hodnoty alkalické fosfatázy10 Vysoká hladina kreatinfosfokináz y11 Vysoká hladina gamma glutamyltransferá zy10 Vysoká hladina kyseliny močové10 |
Zvýšené hodnoty celkového bilirubinu | ||
'Klinicky významné zvýšení tělesné hmotnosti bylo pozorována napříč všemi základními kategoriemi dle BMI (Body Mass Index). Při krátkodobé léčbě (medián trvání 47 dnů) bylo zvýšení tělesné hmotnosti o > 7% velmi časté (22,2%), o > 15% časté (4,2%) a o > 25% bylo méně časté (0,8%). Zvýšení tělesné hmotnosti o > 7%, o > 15% a o > 25% oproti počáteční hodnotám bylo u pacientů s dlouhodobou expozicí (nejméně 48 týdnů) velmi časté (64,4%, 31,7%, resp. 12,3%).
2Průměrné zvýšení hodnot lipidů nalačno (celkový cholesterol, LDL cholesterol a triglyceridy) bylo vyšší u pacientů bez prokázané poruchy regulace tuků na začátku léčby.
3Pozorováno pro normální počáteční hladiny nalačno (< 5,17 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 6,2 mmol/l). Změny počátečních hodnot celkového cholesterolu nalačno z hraničních (>
5,17 až < 6,2 mmol/l) na vysoké (> 6,2 mmol/l) byly velmi časté.
4Pozorováno pro normální počáteční hladiny glukózy nalačno (< 5,56 mmol/l), kdy došlo ke zvýšení hladin na vysoké (> 7 mmol/l). Změny počátečních hodnot glukózy nalačno z hraničních (> 5,56 až < 7 mmol/l) na vysoké (> 7 mmol/l) byly velmi časté.
5Pozorováno pro normální počáteční hladiny nalačno (< 1,69 mmol/l), které vzrostly na vysoké (> 2,26 mmol/l). Změny počátečních hladin triglyceridů nalačno z hraničních hodnot (> 1,69 mmol/l až < 2,26 mmol/l) na vysoké (> 2,26 mmol/l) byly velmi časté.
6V klinických studiích byl výskyt parkinsonismu a dystonie u pacientů léčených olanzapinem číselně vyšší, ale statisticky se signifikantně nelišil od placeba. Parkinsonismus, akathisie a dystonie se vyskytly vzácněji při užívání olanzapinu než při užívání odpovídajících dávek haloperidolu. Vzhledem k nedostatku podrobných informací o akutních a pozdních extrapyramidových příznacích v anamnéze není možné rozhodnout, zda olanzapin způsobuje méně tardivní dyskineze a/nebo dalších pozdních extrapyramidových příznaků.
7Při náhlém přerušení léčby olanzapinem byly hlášeny akutní příznaky jako pocení, nespavost, třes, úzkost, nevolnost a zvracení.
8V klinických hodnoceních trvajících až 12 týdnů překročily plazmatické koncentrace prolaktinu hormí hranici normálního rozmezí u přibližně 30% pacientů léčených olanzapinem s normální počáteční hladinou prolaktinu. U většiny těchto pacientů bylo zvýšení obvykle mírné a zůstalo pod dvojnásobkem horní hranice normálního rozmezí.
9 Nežádoucí účinek zjištěný z klinických studií v integrované databázi olanzapinu.
10 Odhadnuto z naměřených hodnot z klinických studií v integrované databázi olanzapinu.
11 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla
určena s využitím integrované databáze olanzapinu.
12 Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla
odhadnuta na horní hranici 95% intervalu spolehlivosti s využitím integrované databáze olanzapinu.
Dlouhodobá expozice (nejméně 48 týdnů)
Procento pacientů, u kterých se projevily nežádoucí klinicky signifikatní změny tělesné hmotnosti, glukózy, celkového/LDL/HDL cholesterolu nebo triglyceridů, se zvyšilo v čase. U dospělých pacientů, kteří ukončili léčbu v délce 9-12 měsíců, se rychlost zvyšování průměrných hodnot glukózy v krvi zpomalila přibližně po 6 měsících.
Další informace týkající se specifických populací
V klinických studiích u starších pacientů s demencí byla léčba olanzapinem spojena s vyšší incidencí úmrtí a cerebrovaskulárních nežádoucích příhod ve srovnání s placebem (viz také 4.4). Velmi časté nežádoucí účinky spojené s užíváním olanzapinu u této skupiny pacientů byly abnormální chůze a pády. Často byly pozorované pneumonie, zvýšení tělesné teploty, letargie, erythém, zrakové halucinace a inkontinence moči.
V klinických studiích u pacientů s Parkinsonovou chorobou s lékově vyvolanou psychózou související s podáváním dopaminového agonisty bylo velmi často a s vyšší frekvencí než u placeba zaznamenáno zhoršení parkinsonské symtpomatiky a halucinace.
V jedné klinické studii u pacientů v manické fázi bipolární poruchy měla léčba valproátem
v kombinaci s olanzapinem za následek 4,1% incidenci neutropenie; potenciálně přispívajícím faktorem mohly být vysoké plazmatické hladiny valproátu. Současné podání olanzapinu s lithiem nebo valproátem vedlo ke zvýšení výskytu (>10%) tremoru, sucha v ústech, zvýšené chuti k jídlu a zvýšení tělesné hmotnosti. Poruchy řeči byly také hlášeny často. Při léčbě olanzapinem v kombinaci s lithiem nebo divalproexem došlo v akutní fázi léčby (trvající max. 6 týdnů) ke zvýšení tělesné hmotnosti o >7% u 17,4% pacientů. Dlouhodobá léčba olanzapinem (trvající až 12 měsíců) pro prevenci rekurence u pacientů s bipolární poruchou byla doprovázena zvýšením tělesné hmotnosti o >7% u 39,9% pacientů.
Pediatrická populace
Olanzapin není indikován pro použití v léčbě dětí a dospívajících mladších 18 let. Ačkoli nebyly provedeny studie navržené pro porovnání dospívajících a dospělých pacientů, data z klinických hodnocení dospívajících byla srovnána s údaji získanými ze studií u dospělých.
Následující tabulka shrnuje nežádoucí účinky hlášené s vyšší četností u dospívajících pacientů (ve věku 13-17 let) oproti dospělým pacientům, nebo nežádoucí účinky identifikované pouze v průběhu klinických hodnocení u dospívajících pacientů. Klinicky významné zvýšení tělesné hmotnosti (> 7%) se zdá, že se vyskytuje u dospívajících pacientů oproti dospělým s vyšší frekvencí. Velikost hmotnostního přírůstku a procento dospívajících pacientů s klinicky signifikantním nárůstem tělesné hmotnosti bylo větší při dlouhodobé expozici (nejméně 24 týdnů) než při krátkodobém používání.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Ohodnocení četnosti výskytu: velmi časté (> 1/10), časté (> 1/100 až < 1/10).
Poruchy metabolismu a výživy
Velmi časté: Zvýšení tělesné hmotnosti13, zvýšené hladiny triglyceridů14, zvýšená chuť k jídlu.
Časté: Zvýšené hladiny cholesterolu15_
Poruchy nervového systému
Velmi časté: Sedace (zahrnující: hypersomnii, letargii, ospalost)._
Gastrointestinální poruchy
Časté: Sucho v ústech_
Poruchy jater a žlučových cest
Velmi časté: Zvýšené hladiny jaterních aminotransferáz (ALT/AST; viz bod 4.4)._
Vyšetření
Velmi časté: Snížené hodnoty celkového bilirubinu, zvýšení hodnoty GMT, zvýšení plazmatických hladin prolaktinu16._
13Při krátkodobé léčbě (medián trvání 22 dnů) bylo zvýšení tělesné hmotnosti o > 7% počáteční tělesné hmotnosti (kg) velmi časté (40,6%), zvýšení tělesné hmotnosti o > 15% bylo časté (7,1%) a zvýšení o > 25% bylo časté (2,5%). Při dlouhodobé expozici (nejméně 24 týdnů) k nárůstu tělesné hmotnosti u 89,4% o > 7%, u 55,3% o > 15% a u 29,1% o > 25% oproti jejich počáteční tělesné hmotnosti.
14 Pozorováno pro normální počáteční hladiny nalačno (< 1,016 mmol/l), které vzrostly na vysoké (> 1,467 mmol/l) a změny počátečních hladin triglyceridů nalačno z hraničních hodnot na počátku (> 1,016 mmol/l až < 1,467 mmol/l) na vysoké (> 1,467 mmol/l).
15 Změny počátečních hodnot celkového cholesterolu nalačno, kdy došlo ke zvýšení hladin
z normálních na počátku (< 4,39 mmol/l) na vysoké (> 5,17 mmol/l), byly pozorovány často. Změny počátečních hodnot celkového cholesterolu nalačno z hraničních na počátku (> 4,39 až < 5,17 mmol/l) na vysoké (> 5,17 mmol/l) byly velmi časté.
16Zvýšené plazmatické hladiny prolaktinu byly hlášeny u 47,4% dospívajících pacientů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Pokud jsou zjištěny známky a příznaky předávkování shodné s post-injekčním syndromem, měla by být přijata odpovídající podpůrná opatření (viz bod 4.4).
Vzhledem k tomu, že předávkování parenterálním přípravkem je méně pravděpodobné než perorálními léčivými přípravky, jsou zde pro referenci uvedeny informace týkající se předávkování perorálním olanzapinem:
Známky a příznaky
Mezi velmi časté příznaky (výskyt >10%) předávkování patří tachykardie, agitovanost/agresivita, dysartrie, různé extrapyramidové příznaky a snížená úroveň vědomí, v rozmezí mezi sedací a komatem.
Další zdravotně významné důsledky předávkování zahrnují delirium, křeče, koma, možný neuroleptický maligní syndrom, útlum dýchání, aspiraci, hypertenzi nebo hypotenzi, srdeční arytmie (<2% případů předávkování) a zástavu dýchání a srdeční činnosti. Smrtelné případy byly hlášeny už po akutním předávkování perorální dávkou 450 mg, ale rovněž bylo popsáno přežití po akutním předávkování dávkou 2 g perorálního olanzapinu.
Proti olanzapinu neexistuje žádné specifické antidotum. Podle klinického stavu je potřebné zahájit symptomatickou léčbu a sledování vitálních funkcí, zahrnující léčbu hypotenze, cirkulačního kolapsu a podporu funkce dýchání. Nesmí být používán adrenalin, dopamin nebo jiná p sympatomimetika, protože stimulace p adrenergních receptorů může prohloubit hypotenzi. Sledování kardiovaskulárních parametrů je nezbytné kvůli diagnostice možných poruch srdečního rytmu. Pacient musí být až do zotavení pod stálým lékařským dohledem a musí být sledovány jeho vitální funkce.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, diazepiny, oxazepiny, thiazepiny a oxepiny,
ATC kód: N05AH03
Farmakodynamické účinky
Olanzapin je antipsychotická, antimanická a náladu stabilizující látka, která vykazuje široké farmakologické působení na řadu receptorových systémů.
V preklinických studiích vykazuje olanzapin širokou afinitu k řadě receptorů (Ki<100 nM) pro serotonin 5HT2A/2C, 5HT3, 5HT6, dopamin Dj, D2, D3, D4, D5, cholinergní muskarinové receptory (Mj-M5), aj adrenergní a histaminové Hj receptory. Behaviorální studie na zvířatech prokázaly antagonistické působení olanzapinu na 5HT, dopaminové a cholinergní receptory konzistentní s receptorovým profilem. Olanzapin vykazoval větší in vitro afinitu k serotoninovým 5HT2 receptorům než k dopaminovým D2 receptorům a vyšší 5HT2 než D2 aktivitu v in vivo modelech. Elektrofyziologické studie ukázaly, že olanzapin selektivně snižuje aktivitu mezolimbických (A10) dopaminergních neuronů bez výraznějšího účinku na striatální (A9) dráhy ovládající motoriku. Olanzapin oslabuje podmíněnou vyhýbací odpověď v předpovědném testu antipsychotické aktivity v dávkách nižších než jsou ty, které vyvolávají katalepsii, t.j. v předpovědném testu motorických nežádoucích účinků. Na rozdíl od některých jiných antipsychotik olanzapin zesilňuje odpověď v “anxiolytickém testu”.
Ve studii pozitronové emisní tomografie (PET) u pacientů léčených přípravkem ZYPADHERA (300 mg/4 týdny) byla na konci 6 měsíčního období střední obsazenost D2 receptorů 60% nebo vyšší, což je úroveň shodná s úrovní nacházenou v průběhu léčby perorálním olanzapinem.
Klinická, účinnost
Účinnost přípravku ZYPADHERA v léčbě a v udržovací léčbě schizofrenie je shodná s prokázanou účinností perorální formy olanzapinu.
Dvě pivotní studie zahrnovaly celkem 1469 pacientů se schizofrenií:
První 8-týdenní placebem kontrolovaná studie byla provedena u dospělých (n=404) pacientů, kteří trpěli akutními psychotickými příznaky. Pacienti byli randomizováni do skupin pro podání injekce přípravku ZYpAdHERA 405 mg každé 4 týdny, 300 mg každé 2 týdny, 210 mg každé 2 týdny nebo placebo každé 2 týdny. Doplňková léčba perorálními antipsychotiky nebyla povolena. Celkové skóre škály Positive and Negative Symptom Scores (PANSS) prokázalo signifikatní zlepšení na konci léčebné periody (průměrné změny -22,57, -26,32, -22,49 resp.) oproti počátečním hodnotám (průměrná počáteční celkové skóre PANSS bylo 101) u všech dávek přípravku ZYPADHERA (405 mg každé 4 týdny, 300 mg každé 2 týdny a 210 mg každé 2 týdny) ve srovnání s placebem (průměrná změna -8.51). V průběhu studijních návštěv, průměrná změna celkového skóre PANSS od počátku do konce studie ukázala, že od 3. dne došlo u pacientů ve skupinách s dávkou 300 mg/2 týdny a 405 mg/4 týdny ke statisticky významnému snížení celkového skóre PANSS oproti placebu (-8,6, -8,2 a -5,2 resp.). Ve
všech třech skupinách, kterým byl podáván přípravek ZYPADHERA bylo prokázáno statisticky významně větší zlepšení oproti placebu na konci 1. týdne. Tyto výsledky podporují účinnost přípravku ZYPADHERA v průběhu 8 týdnů léčby a terapeutický účinek, který byl pozorován již v 1. týdnu po zahájení léčby přípravkem ZYPADHERA.
Druhá, dlouhodobá klinická studie byla provedena u klinicky stabilizovaných pacientů (n=1065, celkové průměrné skóre PANSS při zahájení bylo od 54,33 až 57,75), kterým byl nejprve podáván perorální olanzapin po dobu 4 až 8 týdnů, a potom byli rozděleni k pokračování v léčbě buď perorálním olanzapinem nebo přípravkem ZYPADHERA po dobu 24 týdnů. Doplňková léčba perorálními antipsychotiky nebyla povolena. Skupiny přípravku ZYPADHERA 150 mg a 300 mg každé 2 týdny (dávky byly sloučeny pro účely analýzy) a 405 mg každé 4 týdny nebyly horší oproti kombinovaným dávkám 10, 15 a 20 mg perorálního olanzapinu (dávky byly sloučeny pro účely analýzy) - měřeno procentem exacerbací symptomů schizofrenie (procenta exacerbací byly 10%, 10% a 7% resp.). Exacerbace byla měřena zhoršením položek pozitivní stupnice BPRS odvozené ze škály PANSS a dle počtu hospitalizací pro zhoršení pozitivních psychotických symptomů. Po 24 týdnech od randomizace nebyla kombinovaná skupina s léčbou 150 mg a 300 mg/2 týdny inferiorní oproti skupině s dávkou 405 mg/4 týdny (procento exacerbací bylo 10% pro každou skupinu).
Pediatrická populace
Přípravek ZYPADHERA nebyl zkoumán v pediatrické populaci. Kontrolovaná data týkající se účinnosti u dospívajících (od 13 do 17 let věku) jsou omezena na krátkodobá data ze studií perorálního olanzapinu u schizofrenie (6 týdnů) a mánie spojené s bipolární poruchou typu I (3 týdny), zahrnující méně než 200 dospívajících. Perorální olanzapin byl užíván ve flexibilní dávce od 2,5 mg při zahájení léčby až po 20 mg/den. V průběhu léčby perorálním olanzapinem došlo u dospívajících k signifikantně vyššímu nárůstu tělesné hmotnosti ve srovnání s dospělými. Rozsah změn hladin na lačno celkového cholesterolu, LDL cholesterolu, triglyceridů a prolaktinu (viz body 4.4 a 4.8) byl u dospívajících větší než u dospělých. Kontrolované údaje o přetrvávání účinku nebo dlouhodobé bezpečnosti nejsou k dispozici (viz body 4.4 a 4.8). Informace týkající se dlouhodobé bezpečnosti jsou omezeny zejména na nekontrolovaná data z otevřených studií.
5.2 Farmakokinetické vlastnosti
Absorpce
Olanzapin je metabolizovaný v játrech cestou konjugace a oxidace. V cirkulaci se z metabolitů objeví hlavně 10-N-glukuronid. Cytochromy P450-CYP1A2 a P450-CYP2D6 přispívají k tvorbě N-desmethyl a 2-hydroxymethyl metabolitů, vykazujících významně nižší in vivo farmakologickou aktivitu ve studiích na zvířatech než olanzapin. Převážná část farmakologické aktivity je způsobená původním olanzapinem.
Po jednorázové i.m. injekci přípravku ZYPADHERA začne ve svalu ihned pomalé rozpouštění soli olanzapin-embonátu, což zajišťuje pomalé kontinuální uvolňování olanzapinu po dobu více než čtyř týdnů. Uvolňování postupně slábne do ztracena v průběhu osmi až dvanácti týdnů. Při zahájení léčby přípravkem ZYPADHERA není zapotřebí přídavná perorální antipsychotická léčba (suplementace)
(viz bod 4.2).
Z kombinace profilu uvolňování a dávkovacího schématu (i.m. injekce každé dva nebo čtyři týdny) vyplývá trvalá plazmatická koncentrace olanzapinu. Po každé injekci přípravku ZYPADHERA zůstavají plazmatické koncentrace měřitelné po dobu několika měsíců. Poločas eliminace olanzapinu je po podání přípravku ZYPADHERA 30 dnů ve srovnání s 30 hodinami po perorálním podání. Absorpce a eliminace je dokončena přibližně šest až osm měsíců po poslední injekci.
Distribuce
Olanzapin po perorálním podání je rychle distribuován. Při plazmatické koncentraci 7 až 1 000 ng/ml se olanzapin váže přibližně z 93% na plazmatické bílkoviny. V plazmě je olanzapin navázán na albumin a na a1 kyselý glykoprotein.
Po opakované aplikaci i.m. injekce přípravku ZYPADHERA v dávce 150 až 300 mg každé dva týdny se 10. a 90. percentil ustálené plazmatické koncentrace olanzapinu nacházel mezi 4,2 a 73,2 ng/ml. Plazmatické koncentrace olanzapinu pozorované po podání dávek v rozmezí od 150 mg každé 4 týdny do 300 mg každé 2 týdny dokumentují zvyšující se systémovou expozici olanzapinu s rostoucí dávkou přípravku ZYPADHERA. V průběhu prvních třech měsíců léčby přípravkem ZYPADHERA byla pozorována akumulace olanzapinu, která se však již neprojevovala při dlouhodobém podávání (12 měsíců) u pacientů, kterým byla podávána dávka až 300 mg každé dva týdny.
Eliminace
Plazmatická clearence olanzapinu po perorálním podání je nižší u žen (18,9 l/h) oproti mužům (27,3 l/h) a u nekuřáků (18,6 l/h) oproti kuřákům (27,7 l/h). Podobné farmakokinetické rozdíly byly pozorovány mezi muži a ženami a mezi kuřáky a nekuřáky v klinických studiích s přípravkem ZYPADHERA. Nicméně vliv pohlaví nebo kouření na clearance olanzapinu je malý ve srovnání s celkovou variabilitou mezi jednotlivci.
Starší pacienti
Specifické studie použití přípravku u starší populace nebyly provedeny. Přípravek ZYPADHERA se nedoporučuje k léčbě starších pacientů (65 let a více), pokud nebylo při použití perorálního olanzapinu dosaženo dobře tolerovaného a účinného dávkovacího režimu. U zdravých starších jedinců (65 let a více) byl průměrný vylučovací poločas prodloužen v porovnání se zdravými mladšími jedinci (51,8 hod. versus 33,8 hod) a clearance byla snížena (17,5 versus 18,2 l/hod). Farmakokinetická variabilita pozorovaná u starších jedinců je v mezích variability u mladších jedinců.
U 44 schizofrenních pacientů starších 65 let nebyl při dávkách 5-20 mg/den pozorován žádný zvláštní výskyt nežádoucích účinků.
Porucha funkce ledvin
Renální insuficience u pacientů (creatininová clearance <10 ml/min) ve srovnání se zdravými jedinci nezpůsobovala významný rozdíl v průměrném poločasu eliminace (37,7 hod. versus 32,4 hod.) nebo clearance (21,2 versus 25,0 l/hod.). Studie rovnováhy ukázala, že približně 57% radioaktivně značeného olanzapinu se objevilo v moči převážně jako metabolity. Ačkoli použití přípravku ZYPADHERA nebylo zkoumáno u pacientů s poškozením ledvin, je doporučeno před zahájením léčby přípravkem ZYPADHERA u pacientů s poškozením ledvin nejdříve dosáhnout dobře tolerovaného a účinného dávkovacího režimu při použití perorálního olanzapinu (viz bod 4.2).
Kuřáci
U kuřáků s mírným poškozením funkce jater byl průměrný vylučovací poločas perorálního olanzapinu prodloužen (39,3 hod.) a clearance byla snížena (18 l/hod) analogicky ke zdravým nekuřákům (48,8 hod. a 14,1 l/hod.). Ačkoli použití přípravku ZYPADHERA nebylo zkoumáno u pacientů s poškozením jater, je doporučeno před zahájením léčby přípravkem ZYPADHERA u pacientů s poškozením jater nejdříve dosáhnout dobře tolerovaného a účinného dávkovacího režimu při použití perorálního olanzapinu (viz bod 4.2).
Klinická studie s perorálním olanzapinem nenašla žádné rozdíly farmakokinetických parametrů mezi jedinci bělošské, japonské a čínské populace.
5.3 Předklinické údaje vztahující se k bezpečnosti
Byly provedeny předklinické studie s monohydrátem olanzapin-embonátu vztahující se k bezpečnosti. Hlavní nálezy získané ve studiích toxicity po opakovaném podání (potkan, pes), v 2-leté studii kancerogenity provedené na potkanech a ve studiích reprodukční toxicity (potkan, králík) byly omezeny na nežádoucí účinky v místě podání, pro které nemohla být stanovena žádná hodnota NOAEL. Nebyly identifikovány žádné nové toxické účinky vycházející ze systémové expozice olanzapinu. Nicméně systémové koncentrace použité v těchto studiích byly menší než účinné hladiny v perorálních studiích, proto jsou níže uvedeny pro referenci informace týkající se perorálního olanzapinu.
Akutní toxicita (po jednorázové dávce)
Příznaky toxicity po perorálním podání hlodavcům obsahovaly silnou neuroleptickou složku: hypoaktivitu, kóma, třes, klonické křeče, slinění a zpomalení zvyšování hmotnosti. Střední letální dávka u myší byla přibližně 210 mg/kg a u potkanů 175 mg/kg. Psi tolerovali jednorázovou perorální dávku 100 mg/kg s nulovou mortalitou. Mezi klinické příznaky patřil útlum, ataxie, třes, zrychlený pulz, dušnost, mióza a anorexie. U opic vyvolala jednorázová perorální dávka až do 100 mg/kg vyčerpanost a vyšší dávky částečné bezvědomí.
Toxicita po opakovaném podávání
Ve studiích, které trvaly u myší až 3 měsíce a u potkanů a psů až 1 rok, se ukázaly jako hlavní účinky deprese CNS, anticholinergní účinky a periferní hematologické poruchy. Na depresi CNS se vyvinula tolerance. Růstové parametry byly při vysokých dávkách sníženy. Reverzibilní účinky spojené se zvýšenou hladinou prolaktinu u potkanů zahrnovaly pokles hmotnosti ovárií a uteru a morfologické změny vaginálního epitelu a prsní žlázy.
Hematologická toxicita: U všech druhů byly pozorované účinky na hematologické ukazatele, včetně na dávce závislého poklesu počtu cirkulujících leukocytů v krvi u myší a nespecifického poklesu cirkulujících leukocytů v krvi u potkanů. Navzdory tomu nebyl prokázaný hematotoxický účinek na kostní dřeň. U několika psů, kterým byla podávána dávka 8 až 10 mg/kg/den (celková expozice olanzapinu [AUC] je 12-15krát vyšší než dostává člověk při dávce 12 mg), se vyvinula reverzibilní neutropenie, trombocytopenie nebo anémie. U psů s cytopenií nebyly pozorované žádné nepříznivé účinky na progenitorové a proliferující buňky kostní dřeně.
Reprodukční toxicita
Olanzapin neměl žádný teratogenní účinek. U potkaních samců sedace ovlivnila páření. Estrální cykly byly ovlivněné dávkou 1,1 mg/kg (což je 3-násobek maximální dávky pro člověka) a reprodukční parametry byly u potkanů ovlivněné dávkou 3 mg/kg (což je 9-násobek maximální dávky pro člověka). U potomstva potkanů, kterým byl podávaný olanzapin, bylo pozorované opoždění fetálního vývoje a přechodný pokles aktivity.
Mutagenita
Olanzapin se neukázal jako mutanogenní nebo klastogenní v žádném ze standardních testů, které zahrnovaly bakteriální testy mutagenity in vitro a in vivo testy u savců.
Kancerogenita
Na základě výsledků studií na myších a potkanech bylo zjištěno, že olanzapin není kancerogenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek
Žádné.
Rozpouštědlo Sodná sůl karmelosy Manitol Polysorbát 80
Voda na injekci
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky
Po rekonstituci v injekční lahvičce: 24 hodin. Pokud není přípravek ihned použit, musí být důkladně protřepán, aby opět vznikla suspenze. Po natažení z injekční lahvičky do stříkačky by suspenze měla být použita okamžitě.
Chemická a fyzikální stabilita suspenze v injekční lahvičce byla prokázána na dobu 24 hodin při teplotě 20-25°C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchování po otevření před použitím j sou odpovědností uživatele a normálníě by doba neměla být delší než 24 hodin při 20-25°C.
6.4 Zvláštní opatření pro uchovávání Chraňte před chladem nebo mrazem.
6.5 Druh obalu a velikost balení
405 mg prášek: skleněná lahvička typ I, bromobutylovou zátkou a uzávěrem modré barvy. Rozpouštědlo 3 ml: skleněná lahvička typ I, butylovouzátkou auzávěremfialové barvy.
Jedna krabička obsahuje jednu lahvičku s práškem a jednu lahvičku s rozpouštědlem, jednu stříkačku Hypodermic 3 ml s přednasazenou bezpečnostní jehlou délky 38 mm a průměru 19 G, jednu bezpečnostní jehlu Hypodermic délky 38 mm a průměru 19 G a dvě bezpečnostní jehly Hypodermic délky 50 mm a průměru 19 G.
6.6 Zvláštní opatření pro likvidaci přípravku
POUZE K HLUBOKÉMU INTRAMUSKULÁRNÍMU GLUTEÁLNÍMU PODÁNÍ. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Rekonstituce
KROK 1: Příprava
Doporučuje se používat rukavice, protože přípravek ZYPADHERA může dráždit pokožku.
Rekonstituujte přípravek ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem pouze pomocí rozpouštědla pro parenterální použití obsaženém v balení, za použití standardních aseptických postupů pro přípravu parenterálních přípravků.
KROK 2: Stanovení potřebného objemu rozpouštědla pro rekonstituci
Následující tabulka udává množství rozpouštědla pro rekonstituci přípravku ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem.
|
ZYPADHERA síla (mg) |
Objem rozpouštedla pro přidání (ml) |
|
210 |
1,3 |
|
300 |
1,8 |
|
405 |
2,3 |
Je důležité si uvědomit, že v lahvičce je rozpouštědla více, než je potřebné k rekonstituci.
KROK 3: Rekonstituce přípravku ZYPADHERA
1. Uvolněte prášek lehkým poklepáním na lahvičku.
2. Rozbalte přibalenou stříkačku Hypodermic s jehlou s ochranným pouzdrem.
Odloupněte fólii blistru a vyndejte soupravu. Lehkým otáčivým pohybem připojte stříkačku (není-li již připojena) ke koncovce typu luer na soupravě. Zatlačením jehly a jejím pootočením ve směru hodinových ručiček zajistíte pevné připojení jehly k soupravě. Potom sundejte z jehly kryt. Nedodržení těchto pokynů může způsobit poranění jehlou.
3. Natáhněte do injekční stříkačky vypočítaný objem rozpouštědla (viz Krok 2).
4. Vstříkněte rozpouštědlo do lahvičky s práškem.
5. Vtáhněte do stříkačky vzduch pro vyrovnání tlaku v lahvičce.
6. Držte injekční lahvičku uzávěrem nahoru a vytáhněte jehlu tak, aby nedošlo k úniku rozpouštědla.
7. Nasaďte na jehlu ochranné pouzdro. Zatlačte jehlu jednou rukou do ochranného pouzdra. Zatlačení jednou rukou proveďte LEHKÝM zatlačením pouzdra proti rovné podložce. JAKMILE JE POUZDO STISKNUTO (obr.1), JEHLA SPOLEHLIVĚ ZASKOČÍ DOVNITŘ POUZDRA (obr. 2).
8. Přesvědčte se zrakem, zda je jehla plně zatlačena do ochranného pouzdra. Ochranné pouzdro obsahující jehlu odstraňte ze stříkačky pouze, pokud to vyžaduje zvláštní lékařský postup. Pouzdro odstraňte stisknutím luer koncovky mezi palec a ukazováček. Zbývající prsty udržujte mimo dosah jehly (obr. 3).

Obr.2


9. Opakovaně a důrazně poklepávejte lahvičkou o tvrdý povrch chráněný podložkou, dokud nepřestane být přítomnost prášku viditelná (viz obrázek A)

Obrázek A: Pro smíchání důkladně poklepejte
10. Zkontrolujte zrakem, zda v lahvičce nejsou shluky částic. Nesuspendovaný prášek vypadá jako žluté suché shluky částic ulpívající na dně lahvičky. Pokud zůstávají shluky částic v lahvičce, může být zapotřebí další poklepání (viz obrázek B).

Nesuspendováno: viditelné shluky Suspendováno: bez shluků Obrázek B: Zkontrolujte, zda v lahvičce není nesuspendovaný prášek a v případě potřeby poklepání
opakujte.
11. Důkladně lahvičku protřepávejte, dokud suspenze nebude mít odpovídající rovnoměrnou barvu a strukturu. Suspendovaný přípravek bude žlutý a neprůhledný (viz obrázek C).

Obrázek C: Důkladně lahvičku protřepejte
Pokud se vytvoří pěna, nechte lahvičku stát, aby se pěna usadila. Pokud není přípravek ihned použit, musí být znovu důkladně protřepán, aby opět vznikla suspenze. Po rekonstituci je přípravek ZYPADHERA v lahvičce stabilní po dobu 24 hodin.
Podání
KROK 1: Aplikace přípravku ZYPADHERA
Tato tabulka uvádí konečný objem suspenze přípravku ZYPADHERA pro aplikaci injekce. Koncentrace suspenze je 150 mg/ml olanzapinu.
|
Dávka (mg) |
Konečný objem pro aplikaci injekce (ml) |
|
150 |
1,0 |
|
210 |
1,4 |
|
300 |
2,0 |
|
405 |
2,7 |
1. Rozhodněte, která jehla bude použita k podání injekce pacientovi. Pro obézní pacienty je pro injekci doporučena jehla délky 50 mm:
• Pokud je pro injekci určena jehla délky 50 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 38 mm jehlu.
• Pokud je pro injekci určena jehla délky 38 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 50 mm jehlu.
2. Pomalu natáhněte zvolené množství. V lahvičce zůstane přebývající množství přípravku.
3. Nasaďte na jehlu ochranné pouzdro a jehlu ze stříkačky odstraňte.
4. Před podáním přípravku nasaďte na stříkačku vybranou bezpečnostní jehlu délky 50 mm nebo 38 mm. Jakmile je suspenze natažena z lahvičky, měla by být okamžitě podána.
5. Zvolte a připravte místo vpichu v hýžďové oblasti. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
6. Po vpíchnutí jehly do svalu několik sekund aspirujte, abyste se ujistil(a), že se neobjeví krev. Pokud se do stříkačky natáhne krev, stříkačku a dávku znehodnoťte a připravte novou dávku. Injekce by se měla aplikovat rovnoměrným nepřerušeným tlakem.
INJEKČNÍ MÍSTO NEMASÍRUJTE.
7. Nasaďte na jehlu ochranné pouzdro (obr. 1 a 2).
8. Injekční lahvičku, stříkačku, použité jehly, jehlu navíc a veškeré nepoužité rozpouštědlo znehodnoťte podle odpovídajících klinických postupů. Injekční lahvička je určena pro jednorázové použití.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/479/003
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENIÍ REGISTRACE
Datum první registrace: 18/11/2008
Datum posledního prodloužení registrace: 26/8/2013
10. DATUM REVIZE TEXTU DD/MM/RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis (Viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik
Edukační program pro odborný zdravotnický personál (HCP, lékaři-zdravotní sestry-lékárníci) se zaměří,
1) Popis post-injekčního syndromu
- Edukace týkající se 2 intramuskulárních forem olanzapinu, včetně rozdílů v balení
- Popis rekonstituce a správné injekční techniky
- Doporučení pro tříhodinové sledování na zdravotnickém pracovišti po aplikaci injekce
- Doporučení, že bezprostředně před opuštěním zdravotnického zařízení by mělo být potvrzeno, že pacient je bdělý, orientovaný a nejeví žádné známky a příznaky předávkování.
- Doporučení, že se podle klinické potřeby má tříhodinové sledování prodloužit u pacientů, kteří vykazují známky nebo příznaky odpovídající předávkování olanzapinem.
- Doporučení poučit pacienty, aby po zbytek dne po injekci neřídili ani neobsluhovali nebezpečné stroje, sledovali případné známky a symptomy post-injekčního syndromu a byli schopni si v případě nutnosti zajistit pomoc
- Popis nejčastějších příznaků hlášených při předávkování olanzapinem, které představují klinické projevy post-injekčního syndromu
- V případě výskytu příhody doporučení pro odpovídající sledování až do doby, než příhoda odezní.
2) Doporučení pro sledování pacienta s ohledem na hladiny glukózy, lipidů a tělesné hmotnosti.
- Podpora povědomí o odpovídajícím sledování metabolických parametrů pomocí distribuce používaných publikovaných pravidel antipsychotické léčby.
Všichni pacienti obdrží kartu pacienta obsahující:
- Popis post-injekčního syndromu
- Doporučení pro tříhodinové sledování na zdravotnickém pracovišti po aplikaci injekce
- Doporučení poučit pacienty, aby po zbytek dne po injekci neřídili ani neobsluhovali nebezpečné stroje, sledovali případné známky a symptomy post-injekčního syndromu a byli schopni si v případě nutnosti zajistit pomoc
- Popis nejčastějších příznaků hlášených při předávkování olanzapinem, které představují klinické projevy post-injekčního syndromu
- V případě výskytu příhody doporučení pro odpovídající sledování až do doby, než příhoda odezní
PŘÍLOHA III
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPADHERA 210 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem. Olanzapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Olanzapini embonas monohydricus odpovídající olanzapinum 210 mg. Po rekonstituci: olanzapinum 150 mg/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Rozpouštědlo obsahuje sodnou sůl karmelózy, manitol, polysorbát 80, vodu pro injekce, kyselinu chlorovodíkovou, hydroxid sodný.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Jedna lahvička prášku pro přípravu injekční suspenze s prodlouženým účinkem. Jedna lahvička rozpouštědla 3 ml.
Jedna stříkačka Hypodermic a bezpečnostní jehla.
Tři bezpečnostní jehly Hypodermic.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Nepodávejte intravenózně nebo subkutánně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP {MM/YYYY}
Injekční lahvička s rekonstituovanou suspenzí: 24 hodin.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem a mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/479/001
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
Vnitřní obal ZYPADHERA 210 mg prášek pro injekční suspenzi s prodlouženým účinkem
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
ZYPADHERA 210 mg prášek pro injekci s prodlouženým uvolňováním
olanzapinum
i.m.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
210 mg
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPADHERA 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem. Olanzapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Olanzapini embonas monohydricus odpovídající olanzapinum 300 mg. Po rekonstituci: olanzapinum 150 mg/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Rozpouštědlo obsahuje sodnou sůl karmelózy, manitol, polysorbát 80, vodu pro injekce, kyselinu chlorovodíkovou, hydroxid sodný.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Jedna lahvička prášku pro přípravu injekční suspenze s prodlouženým účinkem. Jedna lahvička rozpouštědla 3 ml.
Jedna stříkačka Hypodermic a bezpečnostní jehla.
Tři bezpečnostní jehly Hypodermic.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Nepodávejte intravenózně nebo subkutánně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP {MM/YYYY}
Injekční lahvička s rekonstituovanou suspenzí: 24 hodin.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem a mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/479/002
13. ČÍSLO ŠARŽE
Č.šarže
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
Vnitřní obal ZYPADHERA 300 mg prášek pro injekční suspenzi s prodlouženým účinkem.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ_
ZYPADHERA 300 mg prášek pro injekci s prodlouženým uvolňováním
olanzapinum
i.m.
|
2. |
ZPŮSOB PODÁNÍ |
|
Před použitím si přečtěte příbalovou informaci | |
|
3. |
POUŽITELNOST |
|
EXP | |
|
4. |
ČÍSLO ŠARŽE |
|
Lot | |
|
5. |
OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET |
|
300 |
mg |
|
6. |
JINÉ |
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ZYPADHERA 405 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem. Olanzapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Olanzapini embonas monohydricus odpovídající olanzapinum 405 mg. Po rekonstituci: olanzapinum 150 mg/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Rozpouštědlo obsahuje sodnou sůl karmelózy, manitol, polysorbát 80, vodu pro injekce, kyselinu chlorovodíkovou, hydroxid sodný.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Jedna lahvička prášku pro přípravu injekční suspenze. Jedna lahvička rozpouštědla 3 ml.
Jedna stříkačka Hypodermic a bezpečnostní jehla.
Tři bezpečnostní jehly Hypodermic.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Nepodávejte intravenózně nebo subkutánně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP {MM/YYYY}
Injekční lahvička s rekonstituovanou suspenzí: 24 hodin.
Po natažení z injekční lahvičky do stříkačky by suspenze měla být použita okamžitě.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem a mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/479/003
13. ČÍSLO ŠARŽE
Č.šarže
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
Vnitřní obal ZYPADHERA 405 mg prášek pro injekční suspenzi s prodlouženým účinkem.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ_
ZYPADHERA 405 mg prášek pro injekci s prodlouženým uvolňováním
olanzapinum
i.m.
|
2. |
ZPŮSOB PODÁNÍ |
|
Před použitím si přečtěte příbalovou informaci | |
|
3. |
POUŽITELNOST |
|
EXP | |
|
4. |
ČÍSLO ŠARŽE |
|
Lot | |
|
5. |
OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET |
|
405 |
mg |
|
6. |
JINÉ |
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Štítek na lahvičku
Rozpouštědlo pro přípravek ZYPADHERA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro přípravek ZYPADHERA IM
2. ZPŮSOB PODÁNÍ
Před použitím čtěte příbalovou informaci
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
3 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele
ZYPADHERA 210 mg, prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem ZYPADHERA 300 mg, prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem ZYPADHERA 405 mg, prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
Olanzapinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoliv další otázky, zeptejte se svého lékaře nebo lékárníka.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek ZYPADHERA a k čemu se používá
2. Čemu musíte věnovat pozornost, než je vám přípravek ZYPADHERA podán
3. Jak je přípravek ZYPADHERA podáván
4. Možné nežádoucí účinky
5. Jak přípravek ZYPADHERA uchovávat
6. Obsah balení a další informace
1. Co je přípravek ZYPADHERA a k čemu se používá
ZYPADHERA obsahuje léčivou látku olanzapin. Přípravek ZYPADHERA patří do skupiny léků nazývaných antipsychotika a používá se k léčbě schizofrenie - nemoci, jejímiž příznaky jsou pocity, že slyšíte, vidíte nebo vnímáte věci, které neexistují, chybná přesvědčení, neobvyklá podezřívavost a uzavření se do sebe. Lidé trpící touto nemocí se rovněž mohou cítit depresivní, úzkostní nebo v napětí.
ZYPADHERA je určena pro dospělé pacienty, kteří jsou dostatečně stabilizováni v průběhu léčby perorálním (užívaným ústy) olanzapinem.
2. Čemu musíte věnovat pozornost, než je Vám přípravek ZYPADHERA podán Přípravek ZYPADHERA vám nesmí být podán v případě, že:
• jste přecitlivělý(á) (alergický/á) na olanzapin nebo jakoukoli jinou složku tohoto léku (uvedenou v bodě 6). Alergická reakce se může projevit jako vyrážka, svědění, opuchlý obličej, oteklé rty nebo dušnost. Případný výskyt těchto nežádoucích účinků oznamte ošetřujícímu lékaři nebo zdravotní sestře.
• trpíte očními problémy, jako je určitý typ glaukomu (zvýšený tlak v oku).
Upozornění a opatření
Před tím, než Vám bude podán přípravek ZYPADHERA, se poraďte se svým lékařem.
• Méně častá, ale závažná reakce, ke které může dojít po každé aplikaci.
Přípravek ZYPADHERA se může někdy dostat do krevního oběhu příliš rychle. Pokud k tomu dojde, mohou se u vás po aplikaci injekce objevit níže uvedené příznaky. V některých případech mohou tyto příznaky vést k bezvědomí.
zmatenost vznětlivost agresivita potíže s řečí potíže s chůzí křeče
nadměrná ospalost
závratě
dezorientace
zvýšení krevního tlaku slabost
ztuhlost nebo třes svalů
Tyto příznaky obvykle vymizí v průběhu 24 až 72 hodin po aplikaci (podání) injekce. Po každé injekci budete pozorován ve zdravotnickém zařízení pro případ výskytu těchto příznaků nejméně po dobu 3 hodin.
Ačkoli je to nepravděpodobné, mohou se u vás tyto příznaky projevit více než po 3 hodinách po injekci. Pokud k tomu dojde, kontaktujte ihned svého ošetřujícího lékaře nebo zdravotní sestru. Vzhledem k tomuto riziko se také po zbytek dne po aplikaci injekce vyvarujte řízení motorových vozidel a obsluhy strojů.
• Informujte svého lékaře nebo zdravotní sestru, pokud po injekci pocítíte závratě nebo slabost. Do doby, než se budete cítit lépe, budete pravděpodobně potřebovat ležet. Váš ošetřující lékař nebo zdravotní sestra vám také může chtít měřit krevní tlak a puls.
• Užití přípravku ZYPADHERA se u starších pacientů s demencí (zmatenost a ztráta paměti) nedoporučuje, protože může mít závažné nežádoucí účinky.
• Velmi vzácně mohou přípravky tohoto typu způsobovat také nezvyklé pohyby, převážně tváře nebo jazyka, nebo kombinaci horečky, rychlého dýchání, pocení, ztuhlosti svalů a ospalosti nebo spavosti. Pokud k tomu dojde po podání přípravku ZYPADHERA, kontaktujte ihned svého ošetřujícího lékaře nebo zdravotní sestru.
• U pacientů užívajících přípravek ZYPADHERA byl pozorován nárůst tělesné hmotnosti. Vy i váš lékař byste měl(a) vaši váhu pravidelně kontrolovat. V případě potřeby zvažte konzultaci
s dietologem anebo pomoc při sestavení výživového plánu.
• U pacientů užívajících přípravek ZYPADHERA bylo pozorováno zvýšení hladiny cukru a hladiny tuků (triglyceridy a cholesterol) v krvi. Před zahájením užívání přípravku ZYPADHERA a pravidelně v průběhu léčby by váš lékař měl provádět krevní testy pro kontrolu hladiny cukru a některých tuků v krvi.
• Oznamte svému lékaři, pokud se u vás nebo u členů vaší rodiny dříve vyskytly krevní sraženiny, protože užívání léčivých přípravků jako je tento, bylo spojeno s tvorbou krevních sraženin.
Trpíte-li některou z následujících chorob, oznamte to co nejdříve ošetřujícímu lékaři:
• Cévní mozková příhoda nebo malá mozková příhoda (přechodné příznaky cévní mozkové příhody)
• Parkinsonova nemoc
• potíže s prostatou
• střevní neprůchodnost (paralytický ileus)
• onemocnění jater nebo ledvin
• krevní onemocnění
• pokud jste nedávno prodělal (a) srdeční záchvat nebo máte srdeční onemocnění zahrnující syndrom chorého sinu (abnormální srdeční rytmus), nestabilní anginu pectoris nebo máte nízký krevní tlak
• cukrovka
• záchvaty (epileptické)
• pokud víte, že v důsledku dlouhotrvajícího těžkého průjmu a zvracení nebo užívání diuretik (tablet na odvodnění), můžete mít nedostatek solí
Jste-li starší 65 let, může lékař jako běžné opatření kontrolovat váš krevní tlak.
U přípravku ZYPADHERA se nedoporučuje začít s podáváním, pokud je Vám více než 75 let.
Děti a dospívající
Přípravek ZYPADHERA není určen pacientům do 18 let.
Další léčivé přípravky a přípravek ZYPADHERA
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Zvláště upozorněte lékaře, užíváte-li:
• léky na Parkinsonovu nemoc.
• karbamazepin (lék k léčbě epilepsie a stabilizátor nálady), fluvoxamin (antidepresivum) nebo ciprofloxacin (antibiotikum) - může být zapotřebí upravit dávku přípravku ZYPADHERA.
Pokud již užíváte antidepresiva, léky proti úzkosti nebo léky, které vám pomáhají spát (trankvilizéry), můžete být po podání přípravku ZYPADHERA ospalý(á).
Přípravek ZYPADHERA s alkoholem
Během léčby přípravkem ZYPADHERA byste neměli pít žádný alkohol - kombinace přípravku ZYPADHERA s alkoholem může způsobovat otupělost.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
Tento lék by vám neměl být podán, když kojíte, jelikož se malé množství olanzapinu může dostat do mateřského mléka.
Následující příznaky se mohou objevit u novorozenců, jejichž matky užívaly přípravek ZYPADHERA v posledním trimestru (posledních třech měsících těhotenství): třes, svalová ztuhlost a/nebo slabost, ospalost, rozrušení, dýchací potíže a potíže při kojení. Jestliže se u dítěte objeví kterýkoliv z těchto příznaků, obraťte se na svého lékaře.
Řízení dopravních prostředků a obsluha strojů
Zbývající část dne po každé aplikaci injekce neřiďte motorová vozidla a neobsluhujte stroje.
3. Jak je přípravek ZYPADHERA podáván
Váš lékař rozhodne, kolik přípravku ZYPADHERA potřebujete a jak často vám bude injekce aplikována. Přípravek ZYPADHERA se podává v dávkách od 150 mg do 300 mg každé 2 týdny nebo od 300 mg do 405 mg každé 4 týdny.
Přípravek ZYPADHERA je dodáván jako prášek, ze kterého vám lékař nebo sestra připraví suspenzi, která vám bude následně aplikována do hýžďového svalu.
V případě, že je vám podána vyšší dávka přípravku ZYPADHERA než je potřeba:
Tento léčivý přípravek vám bude podáván pod lékařským dohledem. Je tedy nepravděpodobné, že vám bude podána příliš vysoká dávka.
U pacientů, kterým bylo podáno větší množství olanzapinu, se projevily následující příznaky:
• zrychlení srdečního tepu, neklid/agresivita, potíže s řečí, nezvyklé pohyby (zvláště tváře nebo jazyka) a snížená úroveň vědomí.
Další známky mohou být:
• náhlá zmatenost, křeče (epileptické), kóma, kombinace horečky, zrychleného dýchání, pocení, ztuhlosti svalů a ospalosti či spavosti; zpomalené dýchání, aspirace (vdechnutí např. potravy nebo tekutiny), vysoký nebo nízký krevní tlak, abnormální srdeční rytmus.
Kontaktujte ihned svého ošetřujícího lékaře nebo zdravotnické zařízení, pokud zaznamenáte jakýkoli z výše zmíněných příznaků.
Jestliže jste zapomněl(a) na podání injekce přípravku ZYPADHERA
Nepřerušujte vaši léčbu pouze proto, že se cítíte lépe. Je důležité, aby vám byl přípravek ZYPADHERA podáván tak dlouho, jak určil váš lékař.
Pokud zapomenete na podání injekce, kontaktujte svého lékaře a domluvte si aplikaci co nejdříve, jakmile budete moci.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Informujte ihned svého lékaře, pokud se u Vás objeví:
• nadměrná spavost, závratě, zmatenost, dezorientace, potíže s řečí, potíže s chůzí, ztuhlost nebo třes svalů, slabost, vznětlivost, agresivita, úzkost, zvýšení krevního tlaku nebo křeče a může dojít k bezvědomí. Tyto projevy a příznaky se mohou někdy vyskytnout jako následek toho, že se ZYPADHERA dostala do krevního oběhu příliš rychle (častý nežádoucí účinek který se projevuje až u 1 osoby z 10);
• neobvyklé pohyby (častý nežádoucí účinek, který se projevuje až u 1 osoby z 10) obzvlášť obličeje a jazyka;
• krevní sraženiny v žílách (méně častý nežádoucí účinek, který se projevuje až u 1 osoby ze 100) zejména v nohou (příznaky zahrnují otok, bolest a zčervenání nohou), které mohou putovat cévním řečištěm do plic a způsobovat bolest na hrudi a ztížené dýchání. Pokud zaznamenáte jakýkoli z těchto příznaků, ihned vyhledejte lékařskou pomoc;
• kombinace horečky, zrychleného dýchání, pocení, svalové ztuhlosti a otupělosti nebo ospalosti (četnost výskytu tohoto nežádoucího účinku nemůže být z dostupných údajů odhadnuta).
Další časté nežádoucí účinky (projevují se až u 1 osoby z 10) u přípravku ZYPADHERA zahrnují
spavost a bolest v místě aplikace.
Vzácné nežádoucí účinky (projevují se až u 1 osoby z 1000) přípravku ZYPADHERA zahrnují infekci
v místě vpichu.
Následující nežádoucí účinky byly pozorovány u pacientů, kteří užívali olanzapin k vnitřnímu užití (ústy), ale může k nim dojít i po aplikaci přípravku ZYPADHERA.
Další velmi časté nežádoucí účinky (projevují se u více než 1 osoby z 10) zahrnují zvýšení tělesné hmotnosti a zvýšení hodnot hormonu prolaktinu v krvi. Někteří nemocní mohou na počátku léčby pociťovat závratě nebo mít pocit na omdlení (s pomalou srdeční činností), obzvlášť při vstávání z lehu nebo sedu. Tyto pocity obvykle samy odezní, v opačném případě to oznamte svému lékaři.
Další časté nežádoucí účinky (projevují se až u 1 osoby z 10) zahrnují změny hladin některých krvinek, tuků v krvi a na počátku léčby dočasné zvýšení jaterních enzymů, zvýšení hladiny cukrů v krvi a moči, zvýšení hladin kyseliny močové a kreatinfosfokinázy v krvi, pocit zvýšeného hladu, závratě, neklid, třes, neobvyklé pohyby (dyskineze) zácpu, sucho v ústech, vyrážku, slabost, silnou únavu, hromadění vody vedoucí k otokům rukou, kotníků nebo nohou, horečku, bolest kloubů a sexuální poruchy, jako např. sníženou pohlavní touhu u mužů a žen nebo poruchy erekce u mužů.
Další méně časté nežádoucí účinky (projevují se až u 1 osoby ze 100) zahrnují přecitlivělost (např. otok v ústech a krku, svědění, vyrážka), cukrovku nebo zhoršení cukrovky občas spojené s ketoacidózou (ketony v krvi nebo moči) nebo bezvědomím, křeče, obvykle spojené s jejich předchozím výskytem (epilepsie); ztuhlost nebo křeče svalů (včetně očních pohybů), problémy s řečí, pomalou srdeční činnost, přecitlivělost na sluneční světlo, krvácení z nosu, nafouklé břicho, ztrátu paměti nebo zapomnětlivost, neschopnost udržet moč, snížení schopnosti močit, padání vlasů, vynechání nebo prodloužení menstruačního cyklu a změny prsů u mužů a žen, jako např. nenormální tvorba mléka nebo nenormální zvětšení prsů.
Vzácné nežádoucí účinky (projevují se až u 1osoby z 1000) zahrnují snížení normální tělesné teploty, abnormální srdeční rytmus, náhlé nevysvětlitelné úmrtí, zánět slinivky břišní způsobující silné bolesti břicha, zvýšenou teplotu a nevolnost, jaterní onemocnění projevující se zežloutnutím pokožky a bělma očí, svalové onemocnění projevující se bolestmi nejasného původu a prodlouženou a/nebo bolestivou erekci.
Během užívání olanzapinu se může u starších pacientů s demencí vyskytnout cévní mozková příhoda, zápal plic, problémy s udržením moči, pády, extrémní únava, zrakové halucinace, zvýšená tělesná teplota, zarudnutí kůže a poruchy chůze. U této skupiny pacientů bylo v několika případech hlášeno úmrtí.
U pacientů s Parkinsonovou chorobou může perorální olanzapin zhoršovat její příznaky.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek ZYPADHERA uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Injekce nesmí být podána po uplynutí doby použitelnosti, uvedené na obalu. Chraňte před chladem nebo mrazem.
Chemická a fyzikální stabilita suspenze v injekčních lahvičkách byla prokázána na dobu 24 hodin při 20-25 °C. Z mikrobiologického hlediska se má lék použít okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání po otevření před použitím jsou na zodpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při teplotě 20-25 °C. Nepoužívejte tento přípravek, pokud si všimnete změny barvy anebo jiných viditelných změn poškození.
Pokud není přípravek použit ihned po přípravě, musí být důkladně protřepán, aby opět vznikla suspenze. Po natažení z injekční lahvičky do stříkačky by suspenze měla být použita okamžitě.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek ZYPADHERA obsahuje Léčivou látkou je olanzapinum.
ZYPADHERA 210 mg: Jedna lahvička obsahuje olanzapini embonas monohydricus odpovídající 210 mg olanzapinu.
ZYPADHERA 300 mg: Jedna lahvička obsahuje olanzapin embonas monohydricus odpovídající 300 mg olanzapinu.
ZYPADHERA 405 mg: Jedna lahvička obsahuje olanzapin embonas monohydricus odpovídající 405 mg olanzapinu.
Po rekonstituci: 1 ml suspenze obsahuje 150 mg/ml olanzapinu.
Pomocnými látkami rozpouštědla jsou sodná sůl karmelózy, manitol, polysorbát 80, voda na injekci, kyselina chlorovodíková a hydroxid sodný.
Jak přípravek ZYPADHERA vypadá a co obsahuje toto balení
Přípravek ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem je dodáván jako žlutý prášek v průhledné injekční lahvičce. Váš lékař nebo sestra z něho připraví suspenzi pro injekci za pomoci rozpouštědla pro přípravek ZYPADHERA, které se dodává jako bezbarvý až lehce nažloutlý roztok v průhledné skleněné injekční lahvičce.
Přípravek ZYPADHERA je prášek a rozpouštědlo k přípravě injekční suspenze s prodlouženým účinkem. Krabička obsahuje jednu lahvičku s práškem pro injekční suspenzi s prodlouženým účinkem, jednu lahvičku obsahující 3 ml rozpouštědla, jednu injekční stříkačku s přednasazenou bezpečnostní jehlou 19-gauge, 38 mm a tři samostatné bezpečnostní jehly; jedna jehla 19-gauge, 38 mm a dvě jehly 19-gauge, 50 mm.
Držitel rozhodnutí o registraci
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
Výrobce
Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
Eli Lilly Holdings Limited atstovybé Tel: + 370 (5) 2649600 Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32 (0) 2 548 84 84
Belgie/Belgique/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32 (0) 2 548 84 84 Eunrapnu
Tn "Enn ^huh HegepnaHg" E.B. - Etnrapna
Ten: + 359 2 491 41 40
|
Česká republika Eli Lilly CR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark |
Malta |
|
Eli Lilly Danmark A/S |
Charles de Giorgio Ltd. |
|
Tlf: + 45 45 26 60 00 ’ |
Tel: + 356 25600 500 |
|
Deutschland |
Nederland |
|
Lilly Deutschland GmbH Tel: + 49 (0) 6172 273 2222 ’ |
Eli Lilly Nederland B.V. Tel: + 31(0) 30 6025800 |
|
Eesti |
Norge |
|
Eli Lilly Holdings Limited Eesti filiaal Tel: + 372 6817 280 ’ |
Eli Lilly Norge A.S Tlf: + 47 22 88 18 00 |
|
EXlába |
Osterreich |
|
OAPMAIEPB-AIAAY A.E.B.E. Tr|^: + 30 210 629 4600 ’ |
Eli Lilly Ges. m.b.H. Tel: + 43 (0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34 91 663 50 00 ’ |
Polska Eli Lilly Polska Sp. z o.o. Tel: + 48 (0) 22 440 33 00 |
|
France ] |
Portugal |
|
Lilly France SAS |
Lilly Portugal Produtos Farmaceuticos, Lda |
|
Tél: + 33 (0) 1 55 49 34 34 ’ |
Tel: + 351 21 412 66 00 |
|
Hrvatska |
Románia |
|
Eli Lilly Hrvatska d.o.o. |
Eli Lilly Románia S.R.L. |
|
Tel: +385 1 2350 999 ' |
Tel: + 40 21 4023000 |
|
Ireland ! |
Slovenija |
|
Eli Lilly and Company (Ireland) Limited |
Eli Lilly farmacevtska družba, d.o.o. |
|
Tel: + 353 (0) 1 661 4377 r |
Tel: + 386 (0) 1 580 00 10 |
|
Island Icepharma hf. ] Sími: + 354 540 8000 ’ |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia |
Suomi/Finland |
|
Eli Lilly Italia S.p.A. Tel: + 39 055 42571 : |
Oy Eli Lilly Finland Ab Puh/Tel: + 358 (0) 9 8545 250 |
|
Kónpoq |
Sverige |
|
Phadisco Ltd |
Eli Lilly Sweden AB |
|
Tp^: + 357 22 715000 ’ |
Tel: + 46 (0) 8 7378800 |
|
Latvija |
United Kingdom |
|
Eli Lilly Holdings Limited, párstávnieciba Latvija Tel: + 371 67364000 ’ |
Eli Lilly and Company Limited Tel: +44 (0) 1256 315000 |
Tato příbalová informace byla naposledy revidována {měsíc/RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
(Perforace umožňující odtržení pokynů pro zdravotnické pracovníky)
POKYNY PRO ZDRAVOTNICKÉ PRACOVNÍKY
POKYNY PRO REKONSTITUCI A PODÁNÍ
ZYPADHERA olanzapinum prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
POUZE K INTRAMUSKULÁRNÍMU GLUTEÁLNÍMU PODÁNÍ.
NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ.
Rekonstituce KROK 1: Příprava
Balení obsahuje:
• Lahvička s přípravkem ZYPADHERA prášek pro přípravu injekční suspenze s prodlouženým účinkem
• Lahvička s rozpouštědlem přípravku ZYPADHERA
• Jedna stříkačka Hypodermic s bezpečnostní jehlou (souprava Hypodermic Needle-Pro)
• Jedna bezpečnostní jehla Hypodermic 19-gauge, 38 mm
• Dvě bezpečnostní jehly Hypodermic 19-gauge, 50 mm
• Příbalová informace
• Karta s pokyny pro rekonstituci a podání (tato informace)
• Bezpečnostní informace a pokyny pro použití soupravy Hypodermic

Doporučuje se používat rukavice, protože přípravek ZYPADHERA může dráždit pokožku.
Rekonstituujte přípravek ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem pouze pomocí rozpouštědla pro parenterální použití obsaženém v balení, za použití standardních aseptických postupů pro přípravu parenterálních přípravků.
KROK 2: Stanovení potřebného objemu rozpouštědla pro rekonstituci
Následující tabulka udává množství rozpouštědla pro rekonstituci přípravku ZYPADHERA prášek pro injekční suspenzi s prodlouženým účinkem.
|
ZYPADHERA síla (mg) |
Objem rozpouštedla pro přidání (ml) |
|
210 |
1,3 |
|
300 |
1,8 |
|
405 |
2,3 |
Je důležité si uvědomit, že v lahvičce je rozpouštědla více, než je potřebné k rekonstituci.
KROK 3: Rekonstituce přípravku ZYPADHERA
1. Uvolněte prášek lehkým poklepáním na lahvičku.
2. Rozbalte přibalenou stříkačku Hypodermic s jehlou s ochranným pouzdrem.
Odloupněte fólii blistru a vyndejte soupravu. Lehkým otáčivým pohybem připojte stříkačku (není-li již připojena) ke koncovce typu luer na soupravě. Zatlačením jehly a jejím pootočením ve směru hodinových ručiček zajistíte pevné připojení jehly k soupravě. Potom sundejte z jehly kryt. Nedodržení těchto pokynů může způsobit poranění jehlou.
3. Natáhněte do injekční stříkačky vypočítaný objem rozpouštědla (viz Krok 2).
4. Vstříkněte rozpouštědlo do lahvičky s práškem.
5. Vtáhněte do stříkačky vzduch pro vyrovnání tlaku v lahvičce.
6. Držte injekční lahvičku uzávěrem nahoru a vytáhněte jehlu tak, aby nedošlo k úniku rozpouštědla.
7. Nasaďte na jehlu ochranné pouzdro. Zatlačte jehlu jednou rukou do ochranného pouzdra. Zatlačení jednou rukou proveďte LEHKÝM zatlačením pouzdra proti rovné podložce. JAKMILE JE POUZDO STISKNUTO (obr.1), JEHLA SPOLEHLIVĚ ZASKOČÍ DOVNITŘ POUZDRA (obr. 2).
8. Přesvědčte se zrakem, zda je jehla plně zatlačena do ochranného pouzdra. Ochranné pouzdro obsahující jehlu odstraňte ze stříkačky pouze, pokud to vyžaduje zvláštní lékařský postup. Pouzdro odstraňte stisknutím luer koncovky mezi palec a ukazováček. Zbývající prsty udržujte mimo dosah jehly (obr.3).

Obr.2


9. Opakovaně a důrazně poklepávejte lahvičkou o tvrdý povrch chráněný podložkou, dokud nepřestane být přítomnost prášku viditelná (viz obrázek A)

Obrázek A: Pro smíchání důkladně poklepejte
10. Zkontrolujte zrakem. Zda v lahvičce nejsou shluky částic. Nesuspendovaný prášek vypadá jako světle žluté suché shluky částic ulpívající na dně lahvičky. Pokud zůstávají shluky částic v lahvičce, může být zapotřebí další poklepání (viz obrázek B).
Nesuspendováno: viditelné shluky Suspendováno: bez shluků Obrázek B: Zkontrolujte, zda v lahvičce není nesuspendovaný prášek a v případě potřeby poklepání
opakujte.
11. Důkladně lahvičku protřepávejte, dokud suspenze nebude mít odpovídající rovnoměrnou barvu a strukturu. Suspendovaný přípravek bude žlutý a neprůhledný (viz obrázek C).


Obrázek C: Důkladně lahvičku protřepejte
Pokud se vytvoří pěna, nechte lahvičku stát, aby se pěna usadila. Pokud není přípravek ihned použit, musí být znovu důkladně protřepán, aby opět vznikla suspenze. Po rekonstituci je přípravek ZYPADHERA v lahvičce stabilní po dobu 24 hodin.
Podání
KROK 1: Aplikace přípravku ZYPADHERA
Tato tabulka uvádí konečný objem suspenze přípravku ZYPADHERA pro aplikaci injekce. Koncentrace suspenze je 150 mg/ml olanzapinu.
|
Dávka (mg) |
Konečný objem pro aplikaci injekce (ml) |
|
150 |
1,0 |
|
210 |
1,4 |
|
300 |
2,0 |
|
405 |
2,7 |
1. Rozhodněte, která jehla bude použita k podání injekce pacientovi. Pro obézní pacienty je pro injekci doporučena jehla délky 50 mm:
• Pokud je pro injekci určena jehla délky 50 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 38 mm jehlu.
• Pokud je pro injekci určena jehla délky 38 mm, nasaďte na stříkačku pro natáhnutí požadovaného objemu suspenze 50 mm jehlu.
2. Pomalu natáhněte zvolené množství. V lahvičce zůstane přebývající množství přípravku.
3. Nasaďte na jehlu ochranné pouzdro a jehlu ze stříkačky odstraňte.
4. Před podáním přípravku nasaďte na stříkačku vybranou bezpečnostní jehlu délky 50 mm nebo 38 mm. Jakmile je suspenze natažena z lahvičky, měla by být okamžitě podána.
5. Zvolte a připravte místo vpichu v hýžďové oblasti. NEPODÁVEJTE INTRAVENÓZNĚ NEBO SUBKUTÁNNĚ (do žíly nebo pod kůži).
6. Po vpíchnutí jehly do svalu několik sekund aspirujte (nasajte), abyste se ujistil(a), že se neobjeví krev. Pokud se do stříkačky natáhne krev, stříkačku a dávku znehodnoťte a připravte novou dávku. Injekce by se měla aplikovat rovnoměrným nepřerušeným tlakem.
INJEKČNÍ MÍSTO NEMASÍRUJTE.
7. Nasaďte na jehlu ochranné pouzdro (obr. 1 a 2).
8. Injekční lahvičku, stříkačku, použité jehly, jehlu navíc a veškeré nepoužité rozpouštědlo znehodnoťte podle odpovídajících klinických postupů. Injekční lahvička je určena pro jednorázové použití.
91
V klinických hodnoceních trvajících až 12 týdnů překročily plazmatické koncentrace prolaktinu hormí hranici normálního rozmezí u přibližně 30 % pacientů léčených olanzapinem s normální počáteční hladinou prolaktinu. U většiny těchto pacientů bylo zvýšení obvykle mírné a zůstalo pod dvojnásobkem horní hranice normálního rozmezí.
Nežádoucí účinek zjištěný z klinických studií v integrované databázi olanzapinu.
Odhadnuto z naměřených hodnot z klinických studií v integrované databázi olanzapinu.
Nežádoucí účinek zjištěný ze spontánních postmarketingových hlášení, jehož četnost výskytu byla
určena s využitím integrované databáze olanzapinu.