Zyclara 3,75%
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Zyclara 3,75% krém
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden sáček obsahuje imiquimodum 9,375 mg ve 250 mg krému (3,75 %). Jeden gram krému obsahuje 37,5 mg imiquimodum.
Pomocné látky se známým účinkem: methylparaben (E218) 2,0 mg/g krému propylparaben (E216) 0,2 mg/g krému cetylalkohol 22,0 mg/g krému stearylalkohol 31,0 mg/g krému
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Krém
Bílý až nažloutlý krém s homogenním vzhledem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Zyclara je indikován k topické léčbě klinicky typické, nehyperkeratotické, nehypertrofické viditelné či hmatatelné aktinické keratózy (AK) v oblasti obličeje nebo kštice u imunokompetentních dospělých pacientů v případě, že jiné možnosti topické léčby jsou kontraindikovány nebo méně vhodné.
4.2 Dávkování a způsob podání
Léčba má být zahájena a monitorována lékařem.
Dávkování
Zyclara (při jedné aplikaci: až 2 sáčky, 250 mg imichimodu v jednom sáčku) se aplikuje jednou denně před ulehnutím ke spánku na kůži na postižené místo (oblast) během dvou cyklů léčby v délce 2 týdnů, které jsou odděleny obdobím 2 týdnů bez léčby, nebo dle pokynů lékaře.
Léčenou oblastí je celý obličej či kštice.
Lokální kožní reakce v léčené oblasti jsou částečně očekávány a jsou běžné vzhledem k mechanismu účinku (viz bod 4.4). Vyžaduje-li to míra obtíží pacienta nebo závažnost lokální kožní reakce, je možné udělat v léčbě několikadenní přestávku. Dvoutýdenní cyklus léčby by však v žádném případě neměl být prodlužován z důvodu vynechané dávky nebo přerušení léčby.
Během léčby může dojít k přechodnému zvýšení počtu aktinických keratóz vzhledem k pravděpodobné schopnosti imichimodu odhalit a léčit subklinické léze. Odpověď na léčbu nelze adekvátně vyhodnotit do vymizení lokálních kožních reakcí. Pacienti by měli pokračovat v předepsané léčbě. Léčba by měla pokračovat po celý cyklus léčby i v případě, že se aktinická keratóza jeví jako vymizelá.
Klinický výsledek léčby musí být stanoven po regeneraci léčené kůže, asi za 8 týdnů po ukončení léčby, a dále ve vhodných intervalech dle klinického úsudku. Léze, které na léčbu kompletně neodpovídají po 8 týdnech druhého cyklu léčby, by měly být znovu pečlivě vyšetřeny a měla by být přehodnocena léčba.
Pediatričtí pacienti
Bezpečnost a účinnost imichimodu u aktinické keratózy u dětí a dospívajících do 18 let nebyla stanovena. Údaje nejsou k dispozici.
Způsob použití
Přípravek Zyclara je určen pouze k vnějšímu použití. Je třeba zabránit jeho kontaktu s očima, rty a nosními dírkami.
Léčená oblast se nesmí obvazovat či jinak zakrývat.
Předepisující lékař by měl pacientovi ukázat správnou aplikační techniku, aby se maximalizovat přínos léčby přípravkem Zyclara.
Zyclara se aplikuje jednou denně před ulehnutím ke spánku na kůži v postiženém místě (oblasti) a ponechává se na kůži přibližně 8 hodin. Během této doby se pacient nemá sprchovat ani koupat. Před aplikací krému s imichimodem se postižená oblast omyje vodou s použitím jemného mýdla a důkladně osuší. Přípravek Zyclara se nanáší v tenké vrstvě pokrývající celou léčenou oblast a vtírá do postiženého místa, dokud se zcela nevstřebá. Na léčené místo (celý obličej či kštice, nikoli však obojí) je možno denně nanést až 2 sáčky přípravku Zyclara. Částečně spotřebované sáčky je třeba vyhodit, nesmí se znovu použít. Přípravek Zyclara se ponechá na kůži asi 8 hodin; o uplynutí této doby je nezbytné krém odstranit omytím léčené oblasti a rukou vodou s použitím jemného mýdla.
Před i po aplikaci krému je třeba si pečlivě umýt ruce.
Vynechaná dávka
V případě vynechání dávky by měl pacient počkat s aplikací až do dalšího večera, a poté pokračovat v pravidelném dávkování. Krém se nesmí aplikovat vícekrát než jednou denně. Žádný cyklus léčby nesmí být prodloužen z důvodu vynechané dávky nebo přerušení léčby.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Všeobecné pokyny pro léčbu
Jsou-li léze AK klinicky atypické nebo vzbuzují-li podezření z malignity, je nutno provést biopsii k určení vhodné léčby.
Imichimod nebyl hodnocen v léčbě aktinické keratózy očních víček, vnitřku nosních dírek a zvukovodů a rtů na vnitřní straně od nachové linie, proto je třeba zabránit kontaktu s očima, rty a nosními dírkami.
Terapie krémem s imichimodem se nedoporučuje dříve, než se kůže zotaví po předchozí léčbě jiným přípravkem či chirurgickém zákroku. Aplikace na poškozenou kůži by mohla vést ke zvýšení systémové absorpce imichimodu, a tím ke zvýšení rizika nežádoucích účinků (viz body 4.8 a 4.9).
Vzhledem z možnosti zvýšené náchylnosti ke spáleninám od slunce se doporučuje používání ochranných opalovacích krému a pacienti by měli během léčby přípravkem Zyclara omezit expozici či zcela se vyhýbat přirozenému či umělému slunečnímu záření (solária či léčba UVA/B). Léčenou kožní oblast je třeba chránit před sluncem.
Nejsou k dispozici údaje o použití imichimodu 3,75% k léčbě aktinické keratózy v jiných anatomických oblastech, než je obličej a kštice.
Imichimod se nedoporučuje pro léčbu lézí AK s výraznou hyperkeratózou nebo hypertrofií, s jakou se setkáváme u cornu cutaneum.
Lokální kožní reakce
Postižená kůže se nejspíše bude během léčby a až do zhojení viditelně lišit od normální kůže. Lokální kožní reakce jsou časté, ale v průběhu další léčby se snižuje jejich intenzita nebo zcela odezní po ukončení léčby krémem s imichimodem. Vzácně se mohou objevit těžké lokální zánětlivé reakce včetně mokvání kůže či erozí, a to pouze po několika aplikacích krému s imichimodem.
Existuje souvislost mezi počtem případů úplného vymizení a intenzitou lokálních kožních reakcí (např. erytému). Tyto lokální kožní reakce mohou souviset se stimulací lokální imunitní odpovědi. Kromě toho může imichimod vyvolat exacerbaci zánětlivých onemocnění kůže. Vyžaduje-li to míra obtíží pacienta nebo závažnost lokální kožní reakce, je možné udělat v léčbě několikadenní přestávku. Po zmírnění kožní reakce je třeba v léčbě krémem s imichimodem pokračovat. Intenzita lokálních kožních reakcí bývá nižší ve druhém cyklu než v prvním cyklu léčby přípravkem Zyclara.
Systémové reakce
Intenzivní lokální kožní reakce mohou být doprovázeny projevy a příznaky připomínajícími chřipku včetně únavy, nevolnosti, horečky, bolesti svalů, bolesti kloubů a zimnice. Je možno zvážit přerušení léčby nebo úpravu dávky (viz bod 4.8).
Imichimod by měl být používán s opatrností u pacientů se sníženou hematologickou rezervou (viz bod 4.8).
Zvláštní populace pacientů
V klinických hodnoceních nebyly shromažďovány údaje týkající se pacientů s poškozením srdce, jater či ledvin. U těchto pacientů je tudíž zapotřebí opatrnost.
Použití u pacientů se sníženou imunitou a/nebo u pacientů s autoimunitními chorobami Bezpečnost a účinnost přípravku Zyclara u pacientů se sníženou imunitou (např. pacienti po transplantaci orgánu) a/nebo u pacientů s autoimunitními chorobami nebyla stanovena. Proto by měl být imichimod u těchto pacientů používán s opatrností (viz bod 4.5). Je třeba pečlivě zvážit přínos léčby imichimodem u těchto pacientů vůči rizikům spojených buď s možností odmítnutí orgánu či reakce hostitele proti štěpu nebo možností zhoršení autoimunitního onemocnění.
Opakovaná léčba
Nejsou k dispozici žádné údaje o opakované léčbě aktinické keratózy, která vymizela po jednom až dvou cyklech léčby krémem s imichimodem a následně recidivovala.
Pomocné látky
Stearylalkohol a cetylalkohol mohou vyvolat lokální kožní reakce (např. kontaktní dermatitidu). Metylparaben (E218) a propylparaben (E216) mohou vyvolat alergické reakce (někdy i pozdní).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné studie interakcí nebyly provedeny. To se týká také imunosupresiv. Interakce se systémovými léky by měly být omezené vzhledem k minimálnímu kožnímu vstřebávání imichimodu z krému.
Vzhledem k imunostimulačním vlastnostem je třeba opatrnosti při podávání krému s imichimodem pacientům, kteří užívají imunosupresivní léky (viz bod 4.4).
Přípravek Zyclara se nesmí podávat souběžně na stejnou léčenou oblast s jinými krémy s imichimodem, neboť se jedná o stejnou léčivou látkou (imichimod), tudíž by se mohlo zvýšit riziko a závažnost lokálních kožních reakcí.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici klinické údaje o podávání imichimodu během těhotenství. Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na průběh těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj (viz bod 5.3).
Při předepisování přípravku Zyclara těhotným ženám je nutno postupovat opatrně. Přípravek Zyclara by měl být v těhotenství používán pouze v případě, že potenciální přínos ospravedlňuje možné riziko pro plod.
Kojení
Nelze podat žádné specifické doporučení, zda lze přípravek používat u kojících žen či nikoli.
Fertilita
Nejsou k dispozici žádné údaje, potenciální riziko pro člověka není známo.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Zyclara pravděpodobně nemá žádný nebo má zanedbatelný vlivna schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí profilu bezpečnosti:
Níže uvedené údaje odráží expozici přípravku Zyclara či vehikulu u 319 subjektů zařazených do dvou dvojitě zaslepených studií. Pacienti používali až dva sáčky přípravku Zyclara 3,75% krém nebo vehikula denně na kůži v postižené oblasti (buď celý obličej, nebo kštice, ne však obojí) po dobu dvou 2týdenních cyklů oddělených dvoutýdenní přestávkou bez léčby.
Většina pacientů používajících přípravek Zyclara k léčbě AK zaznamenala lokální kožní reakce (nejčastěji erytém, strupovitost a exfoliaci/suchá kůže v místě aplikace). Pouze 11 % (17/160) pacientů v klinických studiích přípravku Zyclara vyžadovalo přestávku (přerušení) v léčbě kvůli lokálním kožním reakcím. U pacientů léčených imichimodem byly hlášeny některé systémové nežádoucí účinky včetně bolesti hlavy a únavy.
Tabulkový seznam nežádoucích účinků:
Údaje v následující tabulce odráží
- expozici přípravku Zyclara či vehikulu ve výše uvedených studiích (četnosti velmi časté a méně časté a s vyšší četností než u vehikula)
- zkušeností s 5% krémem s imichimodem
Četnosti jsou definovány následovně:
Velmi časté (> 1/10);
Časté (> 1/100 až < 1/10);
Méně časté (> 1/1000 až < 1/100);
Vzácné (> 1/10000 až < 1/1000);
Velmi vzácné (<1/10000) a není známo (z dostupných údajů nelze určit)
|
Systémová třída orgánů |
Četnost |
Nežádoucí účinky |
|
Infekční a parazitární onemocnění |
Časté |
Herpes simplex |
|
Méně časté |
Infekce | |
|
Puchýře | ||
|
Neznámá frekvence |
Kožní infekce |
|
Poruchy krve a lymfatického systému |
Časté |
Lymfadenopatie |
|
Neznámá frekvence |
Snížení hemoglobinu | |
|
Snížení počtu leukocytů | ||
|
Snížení počtu neutrofilů | ||
|
Snížení počtu trombocytů | ||
|
Poruchy imunitního systému |
Vzácné |
Exacerbace autoimunitního onemocnění |
|
Poruchy metabolismu a výživy |
Časté | |
|
Zvýšení hladiny glukózy v krvi | ||
|
Psychiatrické poruchy |
Časté |
Insomnie |
|
Méně časté | ||
|
Poruchy nervového systému |
Časté | |
|
Závrať | ||
|
Poruchy oka |
Méně časté |
Podráždění spojivek |
|
Otok očních víček | ||
|
Respirační, hrudní a mediastinální poruchy |
Méně časté |
Ucpaný nos |
|
Bolest v hltanu a jícnu | ||
|
Poruchy jater a žlučových cest |
Neznámá frekvence |
Zvýšená hladina jaterních enzymů |
|
Gastrointestinální poruchy |
Časté | |
|
Méně časté |
Sucho v ústech | |
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Erytém |
|
Strupovitost | ||
|
Exfoliace kůže | ||
|
Otok kůže | ||
|
Kožní vřed | ||
|
Kožní hypopigmentace | ||
|
Časté | ||
|
Méně časté |
Otok obličeje | |
|
Vzácné |
Dermatologické reakce ve vzdáleném místě | |
|
Neznámá frekvence |
Alopecie | |
|
Erythema multiforme | ||
|
Stevens-Johnsonův syndrom | ||
|
Kožní lupus erythematosus | ||
|
Kožní hyperpigmentace | ||
|
Poruchy pohybového systému a pojivové tkáně |
Časté |
Myalgie |
|
Artralgie | ||
|
Méně časté |
Bolest v zádech | |
|
Bolest v končetinách | ||
|
Celkové poruchy a lokální reakce v místě podání |
Velmi časté |
Erytém v místě aplikace a |
|
Strupovitost v místě aplikace | ||
|
Olupování kůže v místě aplikace | ||
|
Suchost kůže v místě aplikace | ||
|
Otok v místě aplikace | ||
|
Vřed v místě aplikace | ||
|
Mokvání v místě aplikace | ||
|
Časté |
Reakce v místě aplikace | |
|
Svědění v místě aplikace | ||
|
Bolest v místě aplikace | ||
|
Otok v místě aplikace |
Méně časté
Pálení v místě aplikace
Podráždění v místě aplikace
Vyrážka v místě aplikace
Únava
Onemocnění připomínající chřipku
Bolest
Dermatitida v místě aplikace
Krvácení v místě aplikace
Pupínky v místě aplikace
Parestézie v místě aplikace
Hyperestézie v místě aplikace
Zánět v místě aplikace
Jizva v místě aplikace
Rozpad kůže v místě aplikace
Puchýřky v místě aplikace
Pocit tepla v místě aplikace
Asténie
Letargie
Nepříjemné pocity
Zánět
Popis vybraných nežádoucích účinků
Poruchy krve
Nálezy klinických studií s 5% krémem s imichimodem zahrnují též snížení hemoglobinu, bílých krvinek a absolutní pokles neutrofilů a destiček. U pacientů s normální hematologickou rezervou nejsou tyto změny považovány za klinicky významné. Pacienti se sníženými hematologickými hodnotami nebyli v klinických studiích zkoumáni. Po uvedení na trh byly hlášeny poklesy v hematologických parametrech, které vyžadovaly klinickou intervenci.
Kožní infekce
Během léčby imichimodem byly hlášeny kožní infekce. Aačkoli neměly závažné důsledky, vždy je třeba uvažovat o možnosti infekce na poškozené kůži.
Hypopigmentace a hyperpigmentace
Byly hlášeny případy lokalizované hypopigmentace a hyperpigmentace po užívání 5% krému s imichimodem. Další sledování ukazuje, že tyto barevné kožní změny mohou být u některých pacientů trvalé.
Dermatologické reakce ve vzdáleném místě
Vzácné případy dermatologických reakcí ve vzdáleném místě včetně erythema multiforme byly hlášeny v klinických studiích s 5% krémem s imichimodem.
Alopecie
Klinické studie hodnotící použití 5% krému s imichimodem k léčbě aktinické keratózy zjistily 0,4% výskyt (5/1214) alopecie v léčeném místě nebo okolní oblasti.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Při topické aplikaci je systémové předávkování imichimodem z krému nepravděpodobné vzhledem k minimálnímu vstřebávání kůží. Ve studiích u králíků byla zjištěna dermální letální dávka vyšší než 5 g/kg. Trvalé dermální předávkování imichimodem v krému by mohlo vést k těžkým lokálním kožním reakcím.
Po náhodném požití jednorázové dávky 200 mg imichimodu, odpovídající obsahu přibližně 21 sáčků, může dojít k žaludeční nevolnosti, zvracení, bolesti hlavy, bolestem ve svalech a horečce. Klinicky nejzávažnější nežádoucí příhodou po perorálním požití mnoha dávek s celkovým obsahem >200 mg imichimodu byla hypotenze, která se upravila po perorálním nebo nitrožilním podání tekutin.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antibiotika a chemoterapeutika pro dermatologické použití, virostatika: ATC kód: D06BB10
Farmakodynamické účinky
Imichimod modifikuje imunitní odpověď. Je základní látkou imidazolinové skupiny. Studie vazebné saturace ukazují na existenci membránových receptorů pro imichimod na příslušných imunitních buňkách, nazývají se toll-like receptory 7 a 8. Imichimod vyvolává uvolnění interferonu alfa (IFN-a) a dalších cytokinů z řady lidských a zvířecích buněk (např. lidských monocytů/makrofágů a keratinocytů). Topická in vivo aplikace krému s imichimodem na kůži myší vedla ke zvýšení koncentrací IFN a tumor-nekrotizujícího faktoru (TNF) v porovnání s kůží neléčených myší. Druhy indukovaných cytokinů se liší podle tkáňového původu buňky. Dále bylo uvolnění cytokinů indukováno po dermální aplikaci a perorálním podávání imichimodu u různých laboratorních zvířat a ve studiích u lidí. Ve zvířecích modelech je imichimod účinný proti virovým infekcím a působí jako protinádorová látka zejména prostřednictvím indukce uvolnění interferonu alfa a dalších cytokinů.
Zvýšené systémové hladiny alfa-interferonu a dalších cytokinů po topické aplikaci imichimodu byly pozorovány i v údajích získaných u lidí.
Klinická účinnost a bezpečnost:
Účinnost přípravku Zyclara byla hodnocena ve dvou dvojitě zaslepených, randomizovaných, vehikulem kontrolovaných klinických studiích. Pacienti měli 5 - 20 typických viditelných či hmatatelných lézí AK v oblasti překračující 25 cm2 na obličeji nebo ve kštici. 319 pacientů s AK bylo léčeno až 2 sáčky 3,75% krému s imichimodem jednou denně, nebo odpovídajícím krémem s vehikulem, během dvou 2týdenních cyklů léčby oddělených dvěma týdny bez léčby. Souhrnně v obou studiích dosáhlo celkové procento vyléčení celého obličeje či kštice při léčbě 3,75% krému s imichimodem 35,6 % (57/160 pacientů, IS 28,2%, 43,6 %), u vehikula 6,3% (10/159 pacientů, IS 3,1%, 11,3%) na návštěvě po ukončení 8týdenní léčby. Nebyly zaznamenány žádné rozdíly v bezpečnosti či účinnosti mezi pacienty staršími než 65 let a mladšími pacienty. Karcinom z dlaždicových buněk byl pozorován u 1,3 % (2/160) pacientů léčených imichimodem a u 0,6%
(1/159) pacientů léčených vehikulem. Tento rozdíl nebyl statisticky významný.
Při následném sledování, kdy iniciálně vyléčení pacienti po léčbě imichimodem byly dále sledování po dobu 14 měsíců bez další léčby AK prokázalo 40,5% pacientů trvalé kompletní vyčištění celé léčené oblasti (buď obličej, nebo kštice). Dlouhodobější údaje o vyléčení nejsou k dispozici.
Pediatrická populace
Aktinická keratóza je stav, který obvykle není v pediatrické populaci zaznamenáván, a studie nebyly prováděny.
5.2 Farmakokinetické vlastnosti
Absorpce
U lidí se vstřebalo kůží méně než 0,9 % topicky aplikované jediné dávky radioizotopicky značeného imichimodu.
Systémová expozice (perkutánní průnik) byla vypočtena ze záchytu uhlíku 14C z [14C] imichimodu v moči a stolici.
Během farmakokinetické studie 3,75% krému s imichimodem po aplikaci 2 sáčků jednou denně (18,75 mg imichimodu denně) po dobu až tří týdnů na celý obličej a/nebo kštici (přibližně 200 cm2) byla pozorována nízká systémová absorpce imichimodu u pacientů s AK. Rovnovážných hladin bylo dosaženo za 2 týdny a doba do dosažení vrcholové koncentrace (Tmax) se pohybovala mezi 6 a 9 hodinami po poslední aplikaci.
Distribuce
Průměrná vrcholová sérová koncentrace imichimodu na konci studie činila 0,323 ng/ml. Biotransformace
Perorálně podaný imichimod je rychle a rozsáhle metabolizován na dva hlavní metabolity.
Eliminace
Malé množství léku, absorbované do systémové cirkulace, se rychle vyloučilo močí a stolicí s průměrným poměrem přibližně 3 : 1.
Zdánlivý poločas po topickém podání 3,75% krému s imichimodem ve farmakokinetické studii byl vypočten na přibližně 29 hodin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje, získané na základě konvenčních studií bezpečnosti, mutagenicity a teratogenicity, neodhalily žádné zvláštní riziko pro člověka.
Ve čtyřměsíční studii dermální toxicity u potkana bylo pozorováno výrazné snížení tělesné hmotnosti a zvýšení váhy sleziny při dávkách 0,5 mg/kg a 2,5 mg/kg, zatímco ve čtyřměsíční dermální studii u myši žádné podobné účinky zjištěny nebyly. U obou druhů bylo pozorováno lokální podráždění kůže, zejména při vyšších dávkách.
V osmnáctiměsíční studii kancerogenity u myší při dermálním podávání tři dny v týdnu nebyla zjištěna indukce nádorů v místě aplikace. Avšak výskyt hepatocelulárních nádorů byl u léčených zvířat vyšší než u kontrolních zvířat. Výskyt dobře odpovídá spektru spontánních nádorů známému u myší vzhledem k věku. Proto jsou tato zjištění považována za náhodná. Vzhledem k tomu, že imichimod má nízkou systémovou absorpci lidskou kůží a není mutagenní, je u člověka riziko ze systémové expozice pravděpodobně nízké.
Další informace poskytla dvouletá perorální studie kancerogenity u potkanů, neprokazující nádory v žádné lokalizaci.
Krém s imichimodem byl hodnocen v biologické studii na fotokancerogenitu u albinotických holých myší, vystavených simulovanému slunečnímu ultrafialovému záření (UVR). Zvířata, jimž byl krém s imichimodem aplikován třikrát týdně, byla vystavena záření 5 dnů v týdnu po 40 týdnů. Myši pak byly dále chovány ještě 12 týdnů. Byl zjištěn časnější a početnější výskyt nádorů ve skupině myší, kterým byl aplikován krém s vehikulem, než v kontrolní skupině s nízkým UVR. Význam tohoto nálezu pro člověka není jasný. Topické podávání krému s imichimodem nevedla při žádné z dávek k nárůstu nádorů ve srovnání se skupinou s krémem s vehikulem.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
kyselina isostearová benzylalkohol cetylalkohol stearylalkohol bílá vazelína polysorbát 60 sorbitan-stearát glycerol
methylparaben (E218) propylparaben (E216) xanthanová klovatina čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
30 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Sáček nelze po otevření znovu použít.
6.5 Druh obalu a velikost balení
Krabičky s 14, 28, 56 sáčky z polyesterové/nízkodensitní polyetylenové/aluminiové folie k jednorázovému použití s obsahem 250 mg krému.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Meda AB Pipers vag 2A 170 73 Solna Švédsko
8. REGISTRAČNÍ ČÍSLO/a
EU/1/12/783/001-003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23/08/2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské lékové agentury http://www.ema.europa.eu
PŘÍLOHA II
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Název a adresa výrobců odpovědného za propouštění šarží
3M Health Care Limited
Derby Road
Loughborough
Leicester
LE11 5SF
Velká Británie
MEDA Pharma GmbH & Co. KG BenzstraBe 1 61352 Bad Homburg Německo
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Léčivý přípravek je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Zyclara 3,75% krém imiquimodum
Jeden sáček obsahuje 9,375 mg imichimodu ve 250 mg krému (3,75%). Jeden gram krému obsahuje imiquimodum 37,5 mg.
Pomocné látky: kyselina isostearová, benzylalkohol, cetylalkohol, stearylalkohol, bílá vazelína, polysorbát 60, sorbitanstearát, glycerol, methylparaben(E218), propylparaben (E216), xanthanová klovatina, čištěná voda
Před použitím si přečtěte příbalovou informaci.
Krém 14 sáčků 28 sáčků 56 sáčků
Před použitím si přečtěte příbalovou informaci. Kožní podání
Uchovávejte mimo dohled a dosah dětí.
Pouze k jednorázovému použití. Všechen krém zbylý v sáčku zlikvidujte.
Exp
Uchovávejte při teplotě do 25 °C
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Meda AB Box 906 170 09 Solna Švédsko
12. REGISTRAČNÍ ČÍSLO/a
EU/1/12/783/001 14 sachets EU/1/12/783/002 28 sachets EU/1/12/783/003 56 sachets
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15 NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
Zyclara
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU TEXT NA SÁČCÍCH
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Zyclara 3,75% krém Imiquimodum Kožní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Exp.
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST
250 mg
6. JINÉ
Zyclara 3,75% krém imiquimodum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4
Co naleznete v této příbalové informaci
1. Co je Zyclara a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Zyclara používat
3. Jak se přípravek Zyclara používá
4. Možné nežádoucí účinky
5 Jak přípravek Zyclara uchovávat
6. Obsah balení a další informace
1. Co je Zyclara a k čemu se používá
Přípravek Zyclara 3,75% krém obsahuje léčivou látku imichimod.
Tento lék se předepisuje k léčbě aktinické keratózy u dospělých.
Tento lék působí na celý Váš imunitní systém za vzniku přírodních látek, které tělu pomáhají překonat aktinickou keratózu.
Jako aktinická keratóza se označují ložiska zhrubělé kůže u lidí, kteří byli během celého svého života ve velké míře vystaveni slunečnímu záření. Některá ložiska mohou mít barvu kůže, jiná jsou šedavá, růžová, červená nebo hnědá. Mohou být plochá a šupinatá nebo vyvýšená, zhrubělá, tvrdá a s bradavičnatým povrchem.
Tento lék by se měl používat pouze na plochá ložiska aktinické keratózy na obličeji a v oblasti kštice, pokud ošetřující lékař rozhodne, že je to pro vás nejvhodnější léčba.
2. Čemu musíte věnovat pozornost, než začnete přípravek Zyclara používat Nepoužívejte přípravek Zyclara
- jestliže j ste alergický/á na imichimod (léčivou látku) nebo na kteroukoliv jinou složku přípravku (viz bod 6).
Upozornění a opatření
Před použitím přípravku Zyclara se poraďte se svým lékařem nebo lékarníkem:
• jestliže jste v minulosti již užíval(a) tento lék či jiné podobné přípravky s jiným množstvím léčivé látky
• jestliže máte problémy s imunitním systémem nebo užíváte léky potlačující funkci imunitního systému (např. po transplantaci orgánu)
• jestliže máte nenormální počet krevních buněk
Všeobecné pokyny během léčby
• Jestliže j ste nedávno prodělal(a) chirurgickou či lékovou léčbu, před použitím tohoto léku nechte léčenou oblast zhojit.
• Zabraňte kontaktu krému s očima, rty a nosními dírkami. V případě, že nedopatřením dojde ke kontaktu, omyjte krém vodou.
• Krém používejte pouze zevně (na kůži obličeje či kštice)
• Nikdy nepoužívejte více krému, než Vám předepsal lékař.
• Po nanesení tohoto léku nepřikládejte na postižená místa žádné obvazy ani jiné krytí.
• Působí-li kožní reakce v místě léčby značné potíže, smyjte krém vodou s použitím jemného mýdla. Jakmile problém ustoupí, můžete opět začít krém používat. Krém nesmí být podáván víckrát než jednou denně.
• Během léčby tímto lékem nepoužívejte horské slunce či solárium, a co nejvíce se vyhýbejte slunečnímu světlu. Při pobytu venku používejte opalovací krémy a noste oblečení, které Vás ochrání před sluncem, a klobouky s širokým okrajem.
Lokální kožní reakce
Během používání přípravku Zyclara můžete, stejně jako většina pacientů, zaznamenat lokální kožní reakce v důsledku způsobu působení přípravku na kůži. Tyto reakce mohou být projevem, že lék působí, jak by měl.
Během používání přípravku Zyclara a do doby zhojení je pravděpodobné, že se léčená oblast bude vzhledově lišit od normální kůže. Je také možné, že se dočasně zhorší stávající zánět.
Tento lék též může vyvolat chřipkové příznaky (včetně únavy, nevolnosti, horečky, bolesti svalů a kloubů a zimnice) před nebo při výskytu místních kožních reakcí.
Odpověď na léčbu není možno správně vyhodnotit, dokud nevymizí místní kožní reakce. Musíte pokračovat v předepsané léčbě.
Tento lék může odhalit a léčit aktinickou keratózu, která dosud nebyla viditelná nebo jste ji necítil(a), a ta následně vymizí. Měl(a) byste pokračovat v aplikaci během celého cyklu léčby i pokud se zdá, že všechna aktinická keratóza vymizela.
Děti a dospívající
Tento lék by neměl být podáván dětem do 18 let, neboť bezpečnost a účinnost u pacientů mladších než 18 let nebyla stanovena. Nejsou k dispozici údaje týkající se použití imichimodu u dětí a dospívajících.
Další léčivé přípravky a přípravek Zyclara
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) včetně léků volně prodejných bez lékařského předpisu.
Těhotenství a kojení:
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat
Kojení
Nelze udělit doporučení týkající se toho, jestli je či není možno přípravek používat u kojících matek. Řízení dopravních prostředků a obsluha strojů
Tento lék pravděpodobně nemá žádný nebo má zanedbatelný vliv na řízení a obsluhu strojů. Přípravek Zyclara obsahuje metylparaben, propylparaben, cetylalkohol a stearylalkohol
Metylparaben (E218) a propylparaben (E216) mohou způsobit alergické reakce (v některých případech oddálené).
Cetylalkohol a stearylalkohol mohou způsobit lokální kožní alergické reakce (např. kontaktní dermatitidu).
3. Jak se přípravek Zyclara používá
Vždy používejte přípravek Zyclara přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem. Nepoužívejte tento lék, dokud Vám lékař neukáže, jak jej správně používat.
Tento lék se používá pouze k léčbě aktinické keratózy na obličeji a kštici.Dávkování Nanášejte přípravek Zyclara na postižené místo jednou denně před ulehnutím ke spánku.
Nejvyšší denní dávka je 2 sáčky (500 mg = 2 sáčky, každý obsahující 250 mg).
Přípravek Zyclara by neměl být používán na oblastech větších než je celý obličej nebo kštice.
Návod k použití přípravu Zyclara
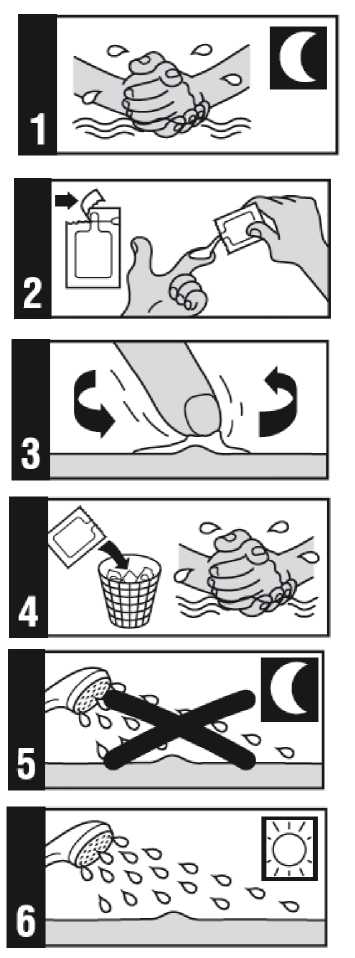
1. Před ulehnutím ke spánku si vodou a jemným mýdlem umyjte ruce a léčenou oblast. Ruce si důkladně osušte a léčenou oblast nechte oschnout.
2. Těsně před použitím otevřete nový sáček přípravku Zyclara a vytlačte trochu krému na špičku prstu. Při jedné aplikaci použijte nejvýše 2 sáčky.
3. Naneste tenkou vrstvu krému Zyclara na postiženou oblast. Krém jemně vetřete do kůže, až se zcela vsákne. Zabraňte kontaktu s očima, rty a nosními dírkami.
4. Po nanesení krému otevřený sáček vyhoďte. Umyjte si ruce vodou a mýdlem.
5. Přípravek Zyclara ponechejte na kůži asi 8 hodin. Během této doby se nesprchujte ani nekoupejte. Nezakrývejte léčenou oblast obvazem či jiným krytím.
6. Po přibližně 8 hodinách omyjte oblast ošetřenou přípravkem Zyclara vodou a jemným mýdlem.
Délka léčby
Léčba začíná každodenním nanášením po dobu dvou týdnů, po nichž následuje dvoutýdenní přestávka bez léčby, a poté se krém znovu nanáší po dobu dvou týdnů.
Jestliže jste použil(a) více krému Zyclara, než jste měl(a):
Pokud jste nanesl(a) příliš krému, smyjte nadbytečný krém vodou s pomocí jemného mýdla. Po odeznění kožní reakce můžete pokračovat v léčbě v doporučeném rozvrhu. Krém se nesmí nanášet vícekrát než jednou denně.
V případě náhodného požití tohoto léku se, prosím, obraťte na svého lékaře.
Jestliže jste zapomněl(a) použít krém Zyclara
Pokud jste vynechal(a) dávku, naneste krém až další večer, a pak pokračujte ve svém pravidelném režimu. Krém se nesmí nanášet víckrát než jednou denně. Jednotlivé cykly léčby nesmí trvat déle než dva týdny, a to i v případě, že jste vynechal(a) dávky.
Jestliže přestanete používat krém Zyclara
Dříve, než přestanete používat krém Zyclara, poraďte se s lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se, prosím, svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento lék nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud při používání tohoto léku zaznamenáte některý z těchto závažných nežádoucích účinků, ihned vyhledejte lékařskou pomoc:
Závažné kožní reakce s kožními ložisky či skvrnami na kůži, které začínají jako malé červené plošky a později vypadají jako terčíky, případně doprovázené příznaky jako je svědění, horečka, celkový pocit nemoci, bolest v kloubech, problémy s viděním, pálení, bolesti nebo svědění v očích a vředy v ústech. Při výskytu těchto příznaků přestaňte tento lék používat a ihned informujte lékaře.
U některých jednotlivců bylo zaznamenáno snížení počtu krvinek. Toto snížení může způsobit vyšší náchylnost k infekcím, tvorbu modřin a zvýšenou únavu. Pokud zaznamenáte některý z těchto příznaků, informujte o tom svého lékaře.
Pokud zaznamenáte hnis či jiný projev infekce, poraďte se s lékařem.
Mnohé nežádoucí účinky tohoto léku jsou způsobeny jeho místním působením na kůži. Místní kožní reakce mohou být projevem toho, že lék působí tak, jak by měl. Pokud vaše kůže reaguje velmi silně nebo pro vás začne být používání tohoto léku nepříjemné, přestaňte krém nanášet a umyjte oblast jemným mýdlem a vodou. Pak kontaktujte lékaře či lékárníka. Ten vám může doporučit, abyste na několik dnů přestal(a) tento lék používat (tj. uděláte si krátkou přestávku v léčbě).
Zaznamenány byly následující nežádoucí účinky:
Velmi časté (vyskytují se u více než 1 pacienta z 10)
- zčervenání kůže, tvorba strupů, olupování kůže, mokvání, suchát kůže, otok kůže, kožní vřed a snížení pigmentace (zbarvení) kůže v místě aplikace.
Časté (vyskytují se až u 1 pacienta z 10)
- Další reakce v místě aplikace, např. zánět kůže, svědění, bolest, pálení, podráždění a vyrážka
- Otok uzlin
- Bolest hlavy
- Závrať
- Ztráta chuti k jídlu
- Nevolnost
- Průjem
- Zvracení
- Chřipkové příznaky
- Horečka
- Bolest
- Bolest svalů a kloubů
- Bolest na hrudi
- Nespavost
- Únava
- Virová infekce (herpes simplex)
- Zvýšení hladiny glukózy v krvi
Méně časté (vyskytují se až u 1 ze 100 pacientů)
- Změny v místě aplikace, např. krvácení, malé zduřelé oblasti na kůži, zánět, mravenčení, zvýšená citlivost na dotyk, tvorba jizev, pocit tepla,popraskaná kůže, puchýřky či hnisavé puchýřky
- Slabost
- Třes
- Nedostatek energie (letargie)
- Nepříjemné pocity
- Otok v obličeji
- Bolest v zádech
- Bolest končetin
- Ucpaný nos
- Bolest v krku
- Podráždění oka
- Otok očních víček
- Deprese
- Podrážděnost
- Sucho v ústech
Vzácné (vyskytují se až u 1 z 1000 pacientů)
- Vzplanutí autoimunitního onemocnění (autoimunitní onemocnění je nemoc v důsledku nenormální odpovědi imunitního systému)
- kožní reakce v oblasti vzdálené od místa aplikace
Četnost není známa (četnost není možno určit z dostupných údajů)
- Změny barvy kůže.
U některých pacientů došlo ke změně barvy kůže v oblasti nanášení krému Zyclara. Ačkoli došlo ke zlepšení těchto změn v průběhu času, u některých pacientů mohou být trvalé.
- Vypadávání vlasů.
U malého počtu pacientů došlo k vypadávání vlasů v místě léčby či okolních oblastech.
- Zvýšení j aterních enzymů.
Byly hlášeny případy zvýšení hladiny jaterních enzymů.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové
informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Zyclara uchovávat
Uchovávejte přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti vyznačené na krabičce a štítku za zkratkou EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 25 °C
Sáčky již otevřené nelze znovu použít.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Další informace Co Zyclara obsahuje
- Léčivou látkou je imiquimodum. Jeden sáček obsahuje 9,375 mg imichimodu ve 250 mg krému (100 mg krému obsahuje 3,75 mg imichimodu).
- Pomocné látky jsou kyselina isostearová, benzylalkohol, cetylalkohol, stearylalkohol, bílá vazelína, polysorbát 60, sorbitan-stearát, glycerol, methylparaben (E218), propylparaben (E216), xanthanová klovatina, čištěná voda.
Jak Zyclara vypadá a co obsahuje toto balení
- Jeden sáček Zyclara 3,75% krému obsahuje 250 mg bílého až nažloutlého krému homogenního vzhledu.
- Jedna krabička obsahuje 14, 28 nebo 56 sáčků z polyesterové/nízkodensitní polyetylenové/aluminiové folie k jednorázovému použití. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Meda AB Pipers vág 2A 170 73 Solna Švédsko
Výrobce
3M Health Care Limited
Derby Road
Loughborough
Leicestershire
LE11 5SF, Velká Británie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien Meda Pharma S.A./N.V. Chaussée de la Hulpe 166 Terhulpsesteenweg 1170 Brussels Tél/Tel: +32 (0)2 5 04 08 11 |
Luxembourg/Luxemburg Meda Pharma S.A./N.V. Chaussée de la Hulpe 166 Terhulpsesteenweg B-1170 Brussels Belgique / Belgien Tél/Tel: +32 (0)2 5 04 08 11 |
|
Btarapna MEDA Pharmaceuticals Switzerland GmbH npegcTaBHTeacTBO 3a Etarapna OgpHH 71-75 1303 Co$Ha Tea: +359 2 4177977 |
Magyarország MEDA PHARMA Hungary Kereskedelmi Kft. 1139 Budapest Váci ut 91 Tel: +36 1 236 3410 |
|
Česká republika MEDA Pharma s.r.o. Kodaňská 1441 / 46 100 10 Praha 10 Tel: +420 234 064 203 |
Malta Alfred Gera and Sons Ltd. 10,Triq il -Masgar Qormi QRM3217 Tel: +356 21 446205 |
|
Danmark Meda AS Solvang 8 3450 Allerad Tlf: +45 44 52 88 88 |
Nederland MEDA Pharma B.V. Krijgsman 20 1186 DM Amstelveen Tel: +31 (0)20 751 65 00 |
|
Deutschland MEDA Pharma GmbH & Co. KG BenzstraEe 1 61352 Bad Homburg Tel: +49 (0) 6172 888 01 |
Norge Meda A/S Askerveien 61 1384 Asker Tlf: +47 66 75 33 00 |
|
Eesti Meda Pharma SIA Parda tn 4 10151 Tallinn Tel: +372 62 61 025 |
Osterreich MEDA Pharma GmbH Guglgasse 15 1110 Wien Tel: + 43 (0)1 86 390 0 |
|
EkXáda MEDA Pharmaceuticals A.E. Eupwavíag, 3 GR-15231 XaMvSpi-AiTiKp Tr|^: +30 210 6 77 5690 |
Polska Meda Pharmaceuticals Sp.z.o.o. ul. Domaniewska 39A 02-672 Warszawa Tel: +48 22 697 7100 |
|
Espaňa Meda Pharma S.L. Avenida de Castilla, 2 Parque Empresarial San Fernando Edificio Berlín 28830 San Fernando de Henares (Madrid) Tel: +34 91 669 93 00 |
Portugal MEDA Pharma - Produtos Farmaceuticos, S.A. Rua do Centro Cultural, 13 1749-066 Lisboa Tel: +351 21 842 0300 |
|
France MEDA Pharma 42 rue Washington 75008 Paris Tél: +33 (0)1 56 64 10 70 |
Románia MEDA Pharmaceuticals Switzerland Gmbh Reprezentanta Romania Calea Floreasca 141-143, et4 014467 Bucuresti Tel.: +40 21 230 90 30 |
|
Hrvatska Medical Intertrade d.o.o. Dr. Franje Tudmana 3 10431 Sveta Nedelja Tel: +385 1 3374 010 |
Slovenija MEDA Pharmaceuticals Switzerland GmbH, Podružnica Ljubljana Cesta 24. junija 23 Ljubljana Tel: +386 59 096 951 |
|
Ireland Meda Health Sales Ireland Ltd., Unit 34 / 35, Block A, Dunboyne Business Park, Dunboyne, Co Meath, Ireland Tel: +353 1 802 66 24 |
Slovenská republika MEDA Pharma spol. s. r.o. Trnavská cesta 50 821 02 Bratislava Tel: +421 2 4914 0172 |
|
Island Meda AB Box 906 170 09 Solna Sví^jóó Sími: +46 8 630 1900 |
Suomi/Finland Meda Oy Vaisalantie 4/Vaisalavágen 4 FIN-02130 Espoo/Esbo Puh/Tel: +358 20 720 9550 |
|
Italia Meda Pharma S.p.A. Via Felice Casati, 20 20124 Milano Tel: +39 039 73901 |
Sverige Meda AB Box 906 170 09 Solna Tel: +46 (0)8 630 1900 |
|
Knnpoq Xp.r. nana^o'í'Zou AxS As©9. Ki^kí^ 35, 2234 Aaxom T r|V +357 22 49 03 05 Latvija SIA Meda Pharma Vienibas gatve 109 Riga LV-1058 Talr: +371 67616137 Lietuva Meda Pharma SIA Ukmergés Street 369A LT-12142 Vilnius Tel. + 370 52059367 |
United Kingdom Meda Pharmaceuticals Ltd. Skyway House Parsonage Road Takeley Bishops Stortford CM22 6PU Tel.: + 44 845 460 0000 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
28