Zutectra 500 Iu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Zutectra 500 IU injekční roztok v předplněné injekční stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna 1 ml předplněná injekční stříkačka obsahuje 500 IU immunoglobulinum humanum hepatitidis B
Lidský protein 150 mg/ml, z čehož je nejméně 96 % IgG, s obsahem protilátek proti povrchovému antigenu viru hepatitidy B (HBs) 500 IU/ml.
Rozdělení podtříd IgG: IgG1: 59 %
IgG2: 35 %
IgG3: 3 %
IgG4: 3 %
Obsah IgA maximálně 6 000 mikrogramů/ml. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce).
Roztok je čirý a bledožlutý nebo světlehnědý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Prevence reinfekce virem hepatitidy B (HBV) u dospělých pacientů HBsAg a HBV-DNA negativních nejméně 1 týden po transplantaci jater kvůli jaternímu selhání indukovanému hepatitidou B. Negativní stav HBV-DNA musí být potvrzen během posledních tří měsíců před OLT. Pacienti by měli být HBsAg negativní před zahájením léčby.
Pokud je to na místě, doporučuje se zvážit souběžné používání adekvátních virostatik jakožto standardní profylaxe reinfekce hepatitidou B.
4.2 Dávkování a způsob podání
Dávkování
U HBV-DNA negativních dospělých nejpozději jeden týden po transplantaci jater je třeba podat subkutánní injekce přípravku Zutectra jednou týdně nebo jednou za dva týdny v závislosti na bezpečných sérových hladinách anti-HBs na konci dávkovacího intervalu.
Před zahájením subkutánní léčby přípravkem Zutectra je zapotřebí stabilizovat vhodné sérové hladiny anti-HBs intravenózním imunoglobulinem hepatitidy B na hladiny v rozmezí 300-500 IU/l nebo vyšší, aby se zajistilo odpovídající pokrytí anti-HBs během přechodu z intravenózního na subkutánní dávkování. U HBsAg a HBV-DNA negativních pacientů se musí udržovat hladiny protilátek >100 IU/l. Dávkování přípravku lze individuálně stanovit a upravit od 500 IU až na 1000 IU (ve výjimečných případech až na 1500 IU) v subkutánních injekcích týdně nebo jednou za dva týdny v závislosti na koncentraci anti-HBs v séru a podle uvážení ošetřujícího lékaře . Hladiny protilátek se musí udržovat >100 IU/l.
U pacientů je třeba pravidelně sledovat sérové hladiny protilátek anti-HBs. Sérové hladiny protilátek anti-HBs se musí měřit alespoň každé 2-4 týdny a podle uvážení ošetřujícího lékaře nejméně po dobu půl roku.
Pediatrická populace
Pro podávání immunoglobulinum hepatitidis B u dětí mladších než 18 let není žádná relevantní indikace.
Způsob podání
Pouze pro subkutánní podání.
Opatření, která je nutno učinit před zacházením s léčivým přípravkem nebo před jeho podáním Podání injekce léčivého přípravku pacientem nebo ošetřující osobou v domácí léčbě vyžaduje školení prováděné lékařem, který má zkušenosti s vedením pacientů k domácí léčbě. Pacient nebo ošetřující osoba bude poučena o injekčních technikách, vedení léčebného deníku a opatřeních, která musí být přijata v případě závažných nežádoucích účinků. Je vyžadováno dostatečně dlouhé období domácí léčby pod dozorem, kdy je dosaženo stabilních spodních sérových hladin anti-HBs > 100 IU/l při pevném režimu dávkování: plánované termíny sledování hladin protilátek anti-HBs antibody levels (viz výše) se musí dodržovat. Pacient nebo ošetřující osoba musí dále přesně dodržovat injekční techniku stejně tak jako režim dávkování, aby se zajistilo, že spodní sérové hladiny anti-HBs budou > 100 IU/l i při delších intervalech mezi kontrolami koncentrace.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na lidské imunoglobuliny.
Přípravek Zutectra se nesmí podávat intravaskulárně.
4.4 Zvláštní upozornění a opatření pro použití
Dbejte na to, aby přípravek Zutectra nebyl podáván do krevní cévy kvůli riziku šoku.
Jestliže je příjemce nosičem HBsAg, nepřináší podávání tohoto léčivého přípravku žádný prospěch. Nejsou k dispozici žádné údaje o účinnosti poexpoziční profylaxe.
Přecitlivělost
Pravé reakce přecitlivělosti jsou vzácné.
Přípravek Zutectra obsahuje malé množství IgA. U osob s nedostatkem IgA existuje možnost vzniku protilátek proti IgA a po podání krevních složek obsahujících IgA u nich mohou nastat anafylaktické reakce. Lékař proto musí zvážit prospěch léčby přípravkem Zutectra proti potenciálnímu riziku hypersenzitivních reakcí.
Ve vzácných případech může lidský imunoglobulin proti hepatitidě B navodit pokles krevního tlaku s anafylaktickou reakcí, dokonce i u pacientů, kteří předchozí léčbu lidským imunoglobulinem tolerovali.
Případným komplikacím lze často předejít tím, že se ujistíme, že pacienti:
- nejsou citliví na normální lidský imunoglobulin, a sice počáteční pomalou aplikací léčivého přípravku;
- jsou v průběhu aplikace pečlivě sledováni ohledně výskytu jakýchkoli příznaků. Zejména
pacienti, kteří nikdy nedostávali normální lidský imunoglobulin, pacienti převedení z jiného přípravku, nebo pokud byl dlouhý časový interval od předchozí injekce, by měli být monitorováni během první injekce a první hodinu po první injekci s cílem odhalit potenciální nežádoucími projevy. Všichni ostatní pacienti by měli být sledováni nejméně po dobu 20 minut po podání.
Podezření na výskyt reakce alergického nebo anafylaktického typu vyžaduje okamžité přerušení aplikace. V případě šoku je nutné zajistit jeho standardní léčbu.
Interference se sérologickým vyšetřením
Po injekci normálního lidského imunoglobulinu může přechodný vzestup různých pasivně přenesených protilátek v krvi pacienta způsobit falešnou pozitivitu sérologických testů.
Pasivní přenos protilátek proti antigenům erytrocytů, například A, B, D, může narušovat některé sérologické testy na protilátky červených krvinek, např. přímý antiglobulinový test (DAT, přímý Coombsův test).
Přenos infekčních agens
Standardní opatření k zabránění přenosu infekce v důsledku použití léčivých přípravků připravených z lidské krve či plazmy spočívají v pečlivé volbě dárců, screeningu jednotlivých dárcovských odběrů a shromážděné plazmy s ohledem na specifické markery infekce a začlenění účinných výrobních kroků pro inaktivaci/odstranění virů. Přesto však nelze při podání léčivých přípravků připravených z lidské krve či plazmy zcela vyloučit možnost přenosu infekčních agens. To se vztahuje i na dosud neznámé nebo nově se objevující viry a jiné patogeny.
Přijatá opatření jsou považována za účinná pro viry s obalem, jako jsou virus lidské imunodeficience (HIV), virus hepatitidy B (HBV), virus hepatitidy C(HCV) a pro neobalený virus hepatitidy A. Přijatá opatření mohou mít omezenou účinnost proti virům bez obalu, jako je například parvovirus B19.
Existují uklidňující klinické zkušenosti, které naznačují, že s imunoglobuliny nedochází k přenosu hepatitidy A nebo parvoviru B19, přičemž lze předpokládat, že obsah protilátek v přípravku významně přispívá k virové bezpečnosti.
Důrazně se doporučuje, aby při každém podání přípravku Zutectra pacientovi bylo zaznamenáno jméno a číslo šarže léčivého přípravku, aby byla zachována spojitost mezi pacientem a šarží léčivého přípravku. Toto doporučení se rovněž vztahuje na dokumentaci v deníku léčby během samopodání léčivého přípravku v domácím léčení.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Oslabené živé virové vakcíny
Podání imunoglobulinu může narušovat rozvoj imunitní odpovědi na oslabené živé virové vakcíny, například na vakcíny proti zarděnkám, příušnicím, spalničkám a planým neštovicím po dobu 3 měsíců. Mezi podáním tohoto léčivého přípravku a vakcinací oslabenou živou virovou vakcínou má uplynout období nejméně 3 měsíců.
Lidský imunoglobulin proti hepatitidě B je zapotřebí podávat tři až čtyři týdny po vakcinaci takovouto oslabenou živou vakcínou; v případě, že je podávání lidského imunoglobulinu proti hepatitidě B v průběhu tří až čtyř týdnů po vakcinaci zásadně důležité, pak je nezbytné provést opakovanou vakcinaci za tři měsíce od podání lidského imunoglobulinu proti hepatitidě B.
4.6 Fertilita, těhotenství a kojení
Bezpečnost tohoto léčivého přípravku pro použití v humánním těhotenství nebyla v kontrolovaných klinických hodnoceních stanovena, a proto by měl být těhotným ženám podáván s opatrností. Na základě klinických zkušeností s podáváním imunoglobulinů nelze očekávat žádné nepříznivé ovlivnění průběhu těhotenství nebo plodu a novorozence.
Kojení
Bezpečnost tohoto léčivého přípravku pro použití během kojení nebyla v kontrolovaných klinických studiích stanovena, a proto by měl být kojícím matkám podáván s opatrností.
Fertilita
Nebyly provedeny žádné studie fertility (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Immunoglobulinum hepatitidis B nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Většina nežádoucích účinků léčiva (NÚL) byla mírná až středně závažná. V ojedinělých případech mohou humánní normální imunoglobuliny způsobit anafylaktický šok.
Seznam nežádoucích účinků uspořádaný do tabulky
Následující nežádoucí účinky byly hlášeny v souvislosti s 4 810 subkutánními aplikacemi přípravku Zutectra během čtyř ukončených klinických studií a 1 006 aplikacemi během neintervenční postmarketingové studie (post marketing safety study, PASS).
NÚL hlášené v těchto čtyřech hodnoceních jsou shrnuty a zařazeny do kategorií v souladu s třídami orgánových systémů podle databáze MedDRA a frekvence výskytu v následující tabulce. Frekvence na jednu injekci byla hodnocena pomocí následujících kritérií: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
Účinky byly seskupeny podle tříd orgánových systémů s příslušnými medicínskými názvy.
|
Třídy orgánových systémů MedDRA |
Nežádoucí účinky |
Frekvence |
|
Infekce a infestace |
Zánět nosohltanu |
Vzácné* |
|
Poruchy imunitního systému |
Hypersenzitivita |
Vzácné* |
|
Poruchy nervového systému |
Méně časté | |
|
Srdeční poruchy |
Bušení srdce, srdeční dyskomfort |
Vzácné* |
|
Cévní poruchy |
Hypertenze |
Vzácné* |
|
Respirační, hrudní a mediastinální poruchy |
Bolest v ústech a hltanu |
Vzácné* |
|
Gastrointestinální poruchy |
Bolest v nadbřišku |
Méně časté |
|
Poruchy kůže a podkožní tkáně |
Vzácné* | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Svalové křeče |
Vzácné* |
|
Celkové poruchy a reakce v místě |
Reakce v místě vpichu injekce |
Časté |
|
aplikace |
Únava, vyčerpanost |
Vzácné |
|
* hlášení jednotlivých případů | ||
Popis vybraných nežádoucích účinků
Reakce v místě vpichu injekce zahrnují účinky, jako je bolest, kopřivka, hematom a erytém.
Nežádoucí účinky pozorované po podání ostatních humánních imunoglobulinových přípravků
Při podání normálních imunoglobulinů může občas dojít k výskytu nežádoucích účinků, jako jsou např. zimnice, bolest hlavy, horečka, zvracení, alergické reakce, nauzea, bolesti kloubů, nízký krevní tlak a chronické bolesti zad.
Vzácně mohou normální lidské imunoglobuliny vyvolat náhlý pokles krevního tlaku a v jednotlivých případech anafylaktický šok, a to i v případech, kdy se při předchozím podání u pacienta nevyskytly žádné známky přecitlivělosti.
Lokální reakce v místě vpichu
Otok, bolestivost, zarudnutí, indurace, lokální zvýšení teploty, svědění, modřiny a vyrážka.
Informace o bezpečnosti v souvislosti s přenosnými agens viz bod 4.4.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Následky předávkování nejsou známy.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunitní séra a imunoglobuliny, specifické imunoglobuliny, ATC kód: J06BB04
Immunoglobulinum hepatitidis B obsahuje hlavně imunoglobulin G (IgG) s vysokým obsahem specifických protilátek proti povrchovému antigenu viru hepatitidy B (HBs).
Klinická účinnost a bezpečnost
Do otevřeného, prospektivního klinického hodnocení s jedním léčebným ramenem bylo zařazeno 23 příjemců jaterních transplantátů, kterým byl profylakticky podáván intravenózní imunoglobulin proti hepatitidě B, a kteří byli následně převedeni na subkutánně podávaný přípravek Zutectra. Týdenní subkutánní dávka byla 500 IU u pacientů o tělesné hmotnosti <75 kg (zvýšení dávky na 1000 IU bylo povoleno, pokud to bylo z lékařského hlediska nutné k udržení bezpečné hladiny >100 IU) a 1000 IU u pacientů o tělesné hmotnosti >75 kg. 2 pacienti dostali vyšší a 2 pacienti dostali nižší dávku, než bylo doporučeno v dávkovacím schématu dle hmotnosti. Během 18 až 24 týdnů hodnoceného období se u všech pacientů podařilo udržet dolní hladiny anti-HBs v séru 100 IU/l a vyšší (primární cíl účinnosti). Bezpečnostní rozpětí >100 IU/l je obecně přijímanou hladinou účinné prevence proti opakované infekci HBV u ohrožených pacientů s transplantovanými játry. U žádného pacienta nedošlo k reinfekci HBV. Pro většinu pacientů bylo samopodání přijatelné.
Průměrná plazmatická hladina anti-HBs před změnou léčby byla 393±139 IU/l. Všichni pacienti užívali antivirotika.
Při použití Clopperovy-Pearsonovy metody byl v ITT populaci podíl selhání po 18 týdnech 0 % (95 % interval spolehlivosti: [0, 14,8 %]). Podíl selhání 0 % byl rovněž zjištěn u volitelné prodloužené fáze (týden 24), (95 % interval spolehlivosti: [0, 20,6 %]).
Cílem otevřené, prospektivní, jednoramenné klinické studie bylo zkoumání proveditelnosti podávání přípravku Zutectra v domácích podmínkách (včetně dodržování léčby a pokynů ze strany pacientů) a účinnosti a bezpečnosti jeho subkutánního podávání v populaci stabilních pacientů během dlouhodobé profylaxe proti opětovné infekci u 66 pacientů s transplantovanými játry. Všichni pacienti účastnící se této studie museli projít fází nácviku v délce min. 29 dnů a přípravek si mohli začít aplikovat sami v domácích podmínkách nejdříve 36. den. S výjimkou 6 pacientů, kteří ze studie odešli před 36. dnem, podstoupili všichni pacienti kompletní léčbu v nemocnici a doma. Žádný pacient ze studie neodešel předčasně z důvodu nezvládnutí samostatného podávání přípravku doma. Během 48 týdnů fáze léčby byly naměřeny konstantní sérové koncentrace protilátek HBs >100 IU/l u všech pacientů při všech vyšetřeních s průměrnými hodnotami 312,0 ± 103,5 IU/l na konci fáze léčby. Během této studie bylo celkem 53/66 pacientů (80,3 %) léčeno antivirovými léky a 13 pacientů dostávalo pouze přípravek Zutectra jako monoterapii. Během 48týdenního období léčby nebyl hlášen žádný případ reinfekce hepatitidou B a žádný pacient nebyl testován jako HBsAg pozitivní. Nebyly hlášeny žádné závažné nežádoucí příhody související s hodnoceným přípravkem. Během studie nebyl zaznamenán žádný případ úmrtí.
Cílem otevřené, prospektivní, jednoramenné klinické studie bylo zkoumání účinnosti a bezpečnosti přípravku Zutectra jako prevence proti opětovné infekci virem hepatitidy B (HBV) v době > jeden týden po ortotopické transplantaci jater u HBsAg a HBV-DNA negativních pacientů. V době transplantace bylo 21 pacientů (42,9 %) testováno jako HDV pozitivních. Pacienti s pozitivním testem HIV nebo HCV byli z účasti na studii vyřazeni. 49 pacientů dostávalo subkutánní injekci 500 IU (1 ml) nebo 1 000 IU (2 ml) (ve výjimečných případech až 1 500 IU) přípravku Zutectra jednou týdně nebo jednou za dva týdny v závislosti na bezpečných sérových hladinách anti-HBs na konci dávkovacího intervalu. Individuální délka léčby jednoho pacienta byla plánována až na 24 týdnů po transplantaci. Během 6měsíčního trvání studie nedošlo k žádnému selhání léčby. Sérové koncentrace HBs protilátek vyšší než minimální bezpečnostní hladina >100 IU/l na konci dávkového intervalu byly naměřeny u všech pacientů ve všech časových intervalech nezávisle na způsobu podání (zkoušejícím, ošetřující osobou nebo samoinjekce), dávkovacím režimu (500 IU, 1 000 IU, 1 500 IU) nebo intervalech léčby. Nebyl hlášen žádný klinický příznak reinfekce hepatitidou B a žádný pacient nebyl během studie testován jako HBsAg nebo HBV-DNA pozitivní, což potvrzuje, že podání přípravku Zutectra jako součást kombinované léčby HBV virostatickou terapií 8-18 dnů po ortotopické transplantaci jater poskytuje účinnou ochranu proti viru hepatitidy B. Byla hlášena jedna nezávažná nežádoucí příhoda související s přípravkem Zutectra (hematom v místě vpichu injekce). Během studie nebyl zaznamenán žádný případ úmrtí.
Do neintervenční postautorizační studie bezpečnosti (PASS 978) bylo zařazeno 61 dospělých pacientů >6 měsíců po transplantaci jater podstoupené z důvodu selhání jater v důsledku hepatitidy B. Cílem studie bylo zhodnotit míru dodržování léčby a pokynů ze strany pacientů v případě samostatného subkutánního podávání přípravku Zutectra jako samoléčby v domácích podmínkách v rámci prevence opětovné infekce hepatitidou B. Pacienti měli přípravek užívat Zutectra v souladu s informacemi a dávkováním uvedenými v souhrnu údajů o přípravku. Dodržování léčby hodnocené podle hladiny anti-HBs v séru bylo prokázáno u 57 (z 61) pacientů (93 %). Na závěrečné kontrolní návštěvě nebyla zjištěna žádná hodnota anti-HBs nižší než 100 IU/l, průměrná hodnota anti-HBs v séru byla 254,3 IU/l. Během této studie užívalo celkem 42 pacientů z 61 (68,9 %) antivirové léky a 19 pacientů pouze přípravek Zutectra jako monoterapii. Během celé doby pozorování nebylo zaznamenáno žádné
selhání léčby definované jako pozitivní nález HBV-DNA a HBsAg. Nebyla pozorována ani žádná reinfekce. Nebyl hlášen žádný závažný nežádoucí účinek. Během studie nebyl zaznamenán žádný případ úmrtí.
5.2 Farmakokinetické vlastnosti
Distribuce
Přípravek Zutectra se pomalu absorbuje do krevního oběhu příjemce a dosahuje maxima se zpožděním 2 až 7 dnů.
Biotransformace
IgG a komplexy IgG se rozkládají v retikuloendoteliální soustavě.
Eliminace
Přípravek Zutectra má poločas přibližně 3 až 4 týdny. Tento poločas se může lišit u jednotlivých pacientů.
5.3 Předklinické údaje vztahující se k bezpečnosti
Imunoglobuliny jsou normálními složkami lidského organismu, proto nemá testování toxicity u heterologních druhů význam.
V hodnocení lokální snášenlivosti prováděném na králících nebyla prokázána žádná forma podráždění, které by mohlo být dáno do souvislosti s přípravkem Zutectra.
Žádná jiná neklinická hodnocení nebyla provedena.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Glycin
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
Do roztoku Zutectra se nesmí přidávat žádné další přípravky, protože jakákoliv změna koncentrace elektrolytu nebo pH může vést k precipitaci či denaturaci proteinů.
6.3 Doba použitelnosti
2 roky.
Roztok by měl být podán bezprostředně po otevření injekční stříkačky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte a převážejte chlazené (2 °C-8 °C).
Chraňte před mrazem.
Uchovávejte vnitřní obal v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Jeden ml roztoku v předplněné injekční stříkačce (sklo typu I) se zátkou (bromobutyl) a ochranným víčkem hrotu stříkačky (bromobutylová pryž).
Velikost balení - pět injekčních stříkaček v blistru.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Před použitím by měl léčivý přípravek mít pokojovou teplotu (přibližně 23 °C-27 °C).
Barva roztoku se může pohybovat od bezbarvé přes bledožlutou až po světlehnědou.
Roztoky, které jsou zakalené nebo obsahují usazeniny, by se neměly používat.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Biotest Pharma GmbH Landsteinerstrasse 5 D-63303 Dreieich Německo
Tel: + 49 6103 801-0
Fax: + 49 6103 801-150 / + 49 6103 801-727
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/09/600/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
30.listopadu 2009/16.září 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Biotest AG Landsteinerstr. 5 D-63303 Dreieich Německo
Název a adresa výrobce odpovědného za propouštění šarží
Biotest Pharma GmbH Landsteinerstrasse 5 D-63303 Dreieich Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ Výdej léčivého přípravku je vázán na lékařský předpis.
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
12
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Zutectra 500 IU injekční roztok v předplněné injekční stříkačce Humánní imunoglobulin proti hepatitidě B
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 ml obsahuje:
Humánní protein 150 mg, z čehož je nejméně 96 % IgG, s obsahem protilátek proti povrchovému antigenu viru hepatitidy B (HBs) 500 IU.
Rozdělení podtříd IgG:
59 % IgG1, 35 % IgG2, 3 % IgG3, 3 % IgG4 Obsah IgA < 6 000 mikrogramů/ml
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: glycin, voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
5 předplněných injekčních stříkaček.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Pouze pro subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
Roztok je třeba podávat ihned po otevření injekční stříkačky.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte a převážejte chlazené (2 °C-8 °C).
Chraňte před mrazem.
Uchovávejte vnitřní obal v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Biotest Pharma GmbH Landsteinerstr. 5 D-63303 Dreieich Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/600/001
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Zutectra 500 IU
minimální údaje uvadene na blistrech nebo stripech
BLISTR
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Zutectra 500 IU injekce
Humánní imunoglobulin proti hepatitidě B
Subkutánní podání
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Biotest Pharma GmbH
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Zutectra 500 IU injekce
Humánní imunoglobulin proti hepatitidě B
Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
500 IU
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Zutectra 500 IU injekční roztok v předplněné injekční stříkačce
Humánní imunoglobulin proti hepatitidě B
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoliv další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Zutectra a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Zutectra používat
3. Jak se přípravek Zutectra používá
4. Možné nežádoucí účinky
5. Jak přípravek Zutectra uchovávat
6. Obsah balení a další informace
7. Jak si sám nebo prostřednictvím ošetřující osoby aplikovat přípravek Zutectra
1. Co je přípravek Zutectra a k čemu se používá Co je Zutectra
Přípravek Zutectra obsahuje protilátky proti viru hepatitidy B. Jedná se o tělu vlastní obranné látky, které, vás mají ochránit proti hepatitidě B. Hepatitida B je zánět jater způsobený virem hepatitidy B.
K čemu se přípravek Zutectra používá
Přípravek Zutectra se používá k prevenci opakované infekce hepatitidou B u dospělých, kteří před nejméně 1 týdnem podstoupili transplantaci jater, neboť u nich došlo k selhání jater způsobenému hepatitidou B.
2. Čemu musíte věnovat pozornost, než začnete přípravek Zutectra používat Nepoužívejte přípravek Zutectra
- jestliže jste alergický(á) na humánní imunoglobulin nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Alergická reakce může zahrnovat náhlou dýchavičnost, obtíže s dýcháním, rychlý srdeční puls, otok očních víček, obličeje, rtů, hrdla nebo jazyku, vyrážku či svědění.
Přípravek Zutectra je určen pouze pro subkutánní injekční podání (pod kůži). Injekce do žíly nebo cévy může způsobit alergický šok.
Upozornění a opatření
Informujte, prosím, svého lékaře nebo zdravotníka před léčbou,
- pokud vám bylo sděleno, že máte v krvi protilátky proti imunoglobulinům typu IgA. Je to velmi vzácné a může to vést k alergickým reakcím.
Můžete být alergický/á na imunoglobuliny (protilátky), aniž byste to věděl/a, i když jste snášel/a předchozí léčbu humánními imunoglobuliny. Alergické reakce, jako například náhlý pokles krevního tlaku nebo šok, mohou nastat, zejména nemáte-li dostatek imunoglobulinů typu IgA v krvi.
Během první injekce přípravku Zutectra a krátce poté budete pečlivě sledováni, aby se
zdravotnický personál ujistil, že se u vás neobjeví žádná reakce. Pokud budete mít alergickou reakci na přípravek Zutectra, podávání injekce bude okamžitě zastaveno. Prosím, informujte neprodleně svého lékaře nebo zdravotníka, pokud si povšimnete jakýchkoli reakcí v době, kdy vám bude injekčně podáván přípravek Zutectra.
Pokud jste HBs antigen pozitivní, přípravek Zutectra nebudete dostávat, protože z podávání tohoto přípravku vám neplyne žádný prospěch. Lékař vám toto bude schopen vysvětlit.
Pro vaši vlastní bezpečnost budou pravidelně sledovány hladiny vašich protilátek.
Možné interference s krevními testy
Přípravek Zutectra by mohl ovlivnit výsledky některých krevních testů (sérologické testy). Informujte, prosím, svého lékaře před jakýmkoliv krevním testem o léčbě přípravkem Zutectra.
Informace o výchozím materiálu přípravku Zutectra a možnosti přenosu infekčních agens:
Výchozím materiálem neboli to, z čeho se přípravek Zutectra vyrábí, je lidská krevní plazma (tedy tekutá část krve).
Když se léčiva vyrábí z lidské krve či plazmy, přijímají se určitá opatření, aby nedošlo k přenosu infekcí na pacienty. Mezi ně patří
- pečlivý výběr dárců krve a plazmy, aby bylo zajištěno, že rizika přenesení infekcí budou vyloučena a
- testování každého dárcovství a směsí plazmy na příznaky přítomnosti viru/infekcí.
Výrobci těchto léčiv do zpracování krve či plazmy rovněž zahrnují kroky, které dokáží inaktivovat či odstranit viry. Navzdory těmto opatřením nelze, jsou-li pacientům podávány léčivé přípravky připravené z lidské krve či plazmy, zcela vyloučit možnost přenosu infekce. To se vztahuje i na jakékoliv dosud neznámé nebo nově se vyskytující viry a jiné typy infekcí.
Přijatá opatření se považují za účinná proti opouzdřeným virům, jako jsou virus lidské imunodeficience (HIV), virus hepatitidy B a virus hepatitidy C a pro neopouzdřený virus hepatitidy A. Přijatá opatření mohou mít omezenou účinnost proti neopouzdřeným virům, jako je například parvovirus B19 (původce tzv. páté nemoci).
Při léčbě imunoglobuliny podobnými přípravku Zutectra nebyly pozorovány infekce hepatitidou A nebo parvovirem B19 možná z toho důvodu, že protilátky proti těmto infekcím, obsažené v tomto přípravku, mají ochranný účinek.
Důrazně se doporučuje, aby při každém podání přípravku Zutectra (jak při nemocničním, tak domácím léčení) pacientovi byl zaznamenán název a číslo šarže přípravku, aby se zachoval záznam o použitých šaržích.
Další léčivé přípravky a přípravek Zutectra
Informujte svého lékaře nebo zdravotníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Očkování
Přípravek Zutectra může snižovat účinnost některých vakcín (proti spalničkám, zarděnkám,
příušnicím, planým neštovicím) po dobu až 3 měsíců.
Možná budete muset čekat nejméně 3 měsíce od poslední injekce přípravku Zutectra, než budete moci podstoupit očkování živými oslabenými vakcínami.
Informujte, prosím, svého lékaře před očkováním o léčbě přípravkem Zutectra.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Přípravek Zutectra nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
3. Jak se přípravek Zutectra používá
Přípravek Zutectra je určen k subkutánnímu podání (pod kůži). Obsah jedné injekční stříkačky je určen pouze k jednorázovému použití. Neaplikujte do cévy.
Ve většině případů vám bude injekci aplikovat lékař nebo zdravotní sestra. Pokud však máte dostatečné hladiny protilátek a pevně stanovený režim dávkování, můžete se vy nebo váš partner nebo vaše ošetřující osoba vyškolit v podávání injekce doma (viz dále).
Pro dokumentování Vašich injekcí přípravku Zutectra vám důrazně doporučujeme používat deník léčby. Váš lékař vám vysvětlí, jak jej používat.
Dávkování přípravku lze individuálně stanovit a upravit od 500 IU až na 1000 IU (ve výjimečných případech až na 1 500 IU) týdně nebo jednou za dva týdny. Dávka bude záviset na vašem zdravotním stavu. Lékař bude pravidelně sledovat váš stav a bude vás informovat o tom v jaké dávce a jak často budete přípravek Zutectra používat.
Podávání injekcí pacientem samotným nebo ošetřující osobou
Pokud jste byl(a) vyškolen(a) a v tom, jak přípravek Zutectra injekčně podávat, můžete si jej aplikovat sám(a), bez pomoci lékaře. Jestliže si podáváte přípravek Zutectra sami, přečtěte si, prosím, důkladně pokyny v bodě „Jak si sám nebo prostřednictvím ošetřující osoby aplikovat přípravek Zutectra“.
Před použitím by měl přípravek Zutectra mít pokojovou teplotu (přibližně 23 °C-27 °C).
Jestliže jste užil(a) více přípravku Zutectra, než jste měl(a)
Následky předávkování nejsou známy, pokud jste však použili více než předepsanou dávku přípravku Zutectra, ihned se obraťte na svého lékaře nebo lékárníka a požádejte o radu.
Jestliže jste zapomněl(a) užít přípravek Zutectra
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou injekci. Další postup v dávkování proberte se svým lékařem. Lékař vás bude informovat o tom, v jaké dávce a jak často budete přípravek Zutectra užívat.
Dbejte na to, abyste používali přípravek Zutectra tak, jak byl předepsán a podle pokynů Vašeho lékaře, aby se zabránilo riziku opakované infekce hepatitidou B.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Většina nežádoucích účinků byla mírná až středně závažná. Ve velmi vzácných případech mohou normální humánní imunoglobuliny způsobit závažné alergické reakce.
Jestliže si všimnete kteréhokoli z následujících projevů, ihned zastavte podávání injekce a obraťte se na svého lékaře:
- vyrážka,
- svědění,
- sípavost,
- dýchací obtíže,
- otok v oblasti očních víček, obličeje, rtů, krku nebo jazyka,
- nízký krevní tlak, rychlý puls.
Může se jednat o alergickou reakci nebo závažnou alergickou reakci (anafylaktický šok).
V případě jakýchkoli nežádoucích účinků po injekci se poraďte svým lékařem.
U přípravku Zutectra byly hlášeny následující nežádoucí účinky:
Časté (mohou postihnout až 1 pacienta z 10):
- reakce v místě vpichu: bolest, kopřivka v místě vpichu injekce, hematom (nahromadění krve v tkáni pod kůží), zarudnutí kůže.
Méně časté (mohou postihnout až 1 pacienta ze 100):
- bolest hlavy
- bolest v nadbřišku (od hrudníku po pupek)
Následující případy byly hlášeny pouze jednou:
- vyčerpanost (únava)
- vysoký krevní tlak (hypertenze)
- zánět nosohltanu (nasofaryngitida)
- alergické reakce (hypersenzitivita)
- bušení srdce (palpitace), srdeční dyskomfort
- svědění (pruritus), vyrážka
- svalové křeče
- bolest v ústech a krku
U jiných přípravků s lidským imunoglobulinem byly dále hlášeny následující příznaky:
- zimnice
- bolest hlavy
- závrať
- horečka
- zvracení
- mírné alergické reakce
- nevolnost (nucení ke zvracení)
- bolesti kloubů
- nízký krevní tlak
- chronická bolest v dolní části zad
V místě vpichu se mohou vyskytnout následující lokální reakce: otok, bolestivost, zarudnutí, zatvrdnutí, lokální zvýšení teploty, svědění, modřina a vyrážka.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, zdravotníkovi nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému
hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Zutectra uchovávat
- Uchovávejte tento přípravek mimo dohled a dosah dětí.
- Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a štítku injekční stříkačky za slovy Použitelné do:, resp. EXP. Doba použitelnosti se vztahuje
k poslednímu dni uvedeného měsíce.
- Uchovávejte a převážejte chlazené (2 °C-8 °C).
- Chraňte před mrazem.
- Uchovávejte vnitřní obal v krabičce, aby byl přípravek chráněn před světlem.
- Roztok je zapotřebí podávat bezprostředně po otevření injekční stříkačky.
- Nepoužívejte přípravek Zutectra, jestliže si všimnete, že je roztok zakalený nebo obsahuje částice.
- Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Jakmile dokončíte injekci, odložte neprodleně všechny jehly, injekční stříkačky a prázdné skleněné obaly do nádoby určené pro ostré předměty, která vám byla dodána.
6. Obsah balení a další informace
Co přípravek Zutectra obsahuje
- Léčivou látkou přípravku je immunoglobulinum humanum hepatitidis B 500 IU/ml.
- Přípravek Zutectra obsahuje 150 mg/ml humánního plazmatického proteinu, z něhož je přinejmenším 96 % imunoglobulinu G. Maximální obsah imunoglobulinu A (IgA) je
6 000 mikrogramů/ml.
- Pomocným látkami jsou glycin a voda na injekci.
Jak přípravek Zutectra vypadá a co obsahuje toto balení
Přípravek Zutectra je dodáván ve formě injekčního roztoku v předplněných injekčních stříkačkách (500 IU/ml - balení 5 v blistru). Barva roztoku se může pohybovat od bezbarvé přes bledožlutou nebo světlehnědou.
Jedna předplněná injekční stříkačka s 1 ml přípravku Zutectra obsahuje 500 IU. Přípravek Zutectra je dodáván v balení obsahujícím 5 předplněných injekčních stříkaček, každá v blistrovém obalu.
Držitel rozhodnutí o registraci a výrobce
Biotest Pharma GmbH Landsteinerstrasse 5 D-63303 Dreieich Německo
Tel: + 49 6103 801-0
Fax: + 49 6103 801-150 / -727
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
Infarama bvba Costermansstede 1 B-1850 Grimbergen Tél/Tel: + 32 22709522
Lietuva
Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0
BtnrapHH
AHTHCEH Epara Cenuguc EtnrapHa OOfl Yn. „CBeTH HBaH Pracku” 33-35 Co$Ha 1606 Ten.: + 359 2 953 1224
Česká republika Reg-Pharm spol.s.r.o.
Fialková 45 CZ-10600 Praha 10 Tel: + 420 2 7265 4004
Danmark
Unimedic Pharma AB Box 6216
SE-102 34 Stockholm Tlf:+ 46 10 130 99 80
Deutschland
Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0
Eesti
Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0
EXlába Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tqk: + 49 6103 801-0
Espaňa
Biotest Medical, S.L.U.
C/ Frederic Mompou, 5 - 6° 3a A ES-08960 Sant Just Desvern Barcelona
Tel: +34 935 952 661
France
Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tél: 00800 98832872
Hrvatska
Medical Intertrade d.o.o.
Dr. Franje Tudjmana 3 HR-10431 Sveta Nedelja
Luxembourg/Luxemburg
Biotest AG Landsteinerstr. 5 D-63303 Dreieich Tél/Tel: + 49 6103 801-0
Magyarország
Biotest Hungaria Kft. Torbágy u. 15/A H-2045 Torokbálint Tel.: + 36 23 511 311
Malta
Rodel Ltd 55, Ravina Triq ir-Russett MT-Kappara SGN 4432 Tel: + 356 27 386221
Nederland
Infarama bvba Costermansstede 1 B-1850 Grimbergen Tel: + 32 22709522
Norge
Unimedic Pharma AB Box 6216
SE-102 34 Stockholm Tlf:+ 46 10 130 99 80
Osterreich
Biotest Austria GmbH Einsiedlergasse 58 A-1050 Wien Tel: + 43 1 545 15 61-0
Polska
Nobipharm Sp. Z.o.o. ul Rydygiera 8 PL-01-793 Warszawa Tel.: + 48 22 8322638
Portugal
SPCare Especialidades Farmaceuticas, Lda Rua Luciano Cordeiro, n° 123, 1° dto. PT-1050 139 Lisboa Tel: + 351 21 193 14 20
Románia
Besmax Pharmaceutical Distribution S.R.L. 61A Drumul Plaiul Sarului Street, Room 5 013982 Bucharest, District 1 - RO
Ireland
Aquilant Pharmaceuticals
United Drug House, Magna Drive, Magna
Business Park,
Citywest Road IRL-Dublin 24 Tel: + 353 1 404 8344
Island
Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Sími: + 49 6103 801-0
Italia
Biotest Italia S.r.l.
Via Leonardo da Vinci 43 I-20090 Trezzano sul Naviglio Tel: + 39 02 4844 2951
Kúrcpog
AKHI nANAOQTOY & YIOI ATA r. KPANIAIQTH T. 0. 22578 1522 AEYKQIIA K Y n P O I
TnU + 357 22 611 038
Latvija
Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0
Slovenija
Blood Transfusion Centre of Slovenia (BTC) Slajmerjeva 6 SI-1000 Ljubljana Tel: + 386 1 54 38 100
Slovenská republika
Reg-Pharm spol.s.r.o. Fialková 45 CZ-10600 Praha 10 Tel: + 420 2 7265 4004
Suomi/Finland
Unimedic Pharma AB Box 6216
SE-102 34 Stockholm Puh/Tel: + 46 10 130 99 80
Sverige
Unimedic Pharma AB Box 6216
SE-102 34 Stockholm Tel: + 46 10 130 99 80
United Kingdom Biotest (UK) Ltd.
First Floor, Park Point, 17 High Street, Longbridge
Birmingham B31 2UQ -UK Tel: + 44 121 733 3393
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
7. Jak si sám nebo prostřednictvím ošetřující osoby aplikovat přípravek Zutectra
Smyslem následujících pokynů je vysvětlit, jak aplikovat přípravek Zutectra. Přečtěte si, prosím, podrobně tyto pokyny a postupujte podle nich krok za krokem. Lékař(ka) nebo jeho(její) asistent vás naučí, jak při podání postupovat.
Nepokoušejte se si sami aplikovat injekci přípravku Zutectra, dokud nebudete mít jistotu, že rozumíte přípravě injekčního roztoku a víte, jak injekci podat.
Obecné informace:
- Injekční stříkačky a odpadní nádobu na použité stříkačky a jehly uchovávejte mimo dosah dětí;
pokud možno pod zámkem.
- Snažte se aplikovat injekci vždy ve stejnou denní dobu. Snáze si to zapamatujete.
- Dávku vždy dvakrát zkontrolujte.
- Před podáním je třeba nechat roztok ohřát na pokojovou teplotu.
- Každou injekční stříkačku otevřete pouze v případě, že jste na injekci připraveni. Injekci byste měli aplikovat bezprostředně po otevření injekční stříkačky.
- Barva roztoku se může pohybovat od bezbarvé přes bledožlutou až po světlehnědou. Nepoužívejte roztoky, které jsou zakalené nebo obsahují částice.
- Tento léčivý přípravek nesmí být mísen s žádnými jinými léčivými přípravky.
Před injekcí:
1. Umyjte si ruce. Je důležité, aby vaše ruce a používané předměty byly co nejčistší.
2. Předem si připravte vše, co budete potřebovat. Najděte si čisté místo, kam můžete rozložit všechny věci, které budete používat:
- dva tampony napuštěné alkoholem,
- jednu injekční stříkačku s přípravkem Zutectra,
- jednu jehlu vhodnou pro podání injekce pod kůži.
Nezapomeňte prosím, že tampóny napuštěné alkoholem a jehly nejsou obsaženy v balení a budete si je muset opatřit sami.
3. Před přípravou injekce rozhodněte, kam injekci podáte. Přípravek Zutectra byste měli aplikovat do tukové vrstvy mezi kůži a sval (přibližně 8 až 12 mm pod kůži). Nejvhodnějšími místy pro vpich injekce jsou oblasti, kde je kůže volná a měkká, například břicho, paže, stehna či hýždě, a které nejsou v blízkosti kloubů, nervů a kostí.
Důležité: Nevolte místa, kde nahmatáte boule, hrboly, pevné uzlíky nebo která jsou bolestivá, nevolte ani oblasti, kde má kůže změněné zabarvení, prohlubně, strupy nebo je porušená. Tyto obtíže nebo jakékoli další neobvyklé stavy, které naleznete, proberte se svým lékařem či zdravotníkem. Při každé injekci byste měli místo vpichu obměňovat. Pokud jsou některá místa pro vás těžko dosažitelná, možná budete muset požádat ošetřující osobu, aby vám s těmito injekcemi pomohla.
4. Příprava injekční stříkačky Zutectra:
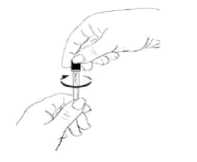
Vyjměte injekční stříkačku z obalu.
Pečlivě zkontrolujte roztok. Mělo by jít o čirou tekutinu neobsahující žádné částice. Má-li roztok jinou než očekávanou barvu, je zakalený nebo obsahuje-li částice, zlikvidujte jej a začněte znovu s novou injekční stříkačkou.
Odstraňte z injekční stříkačky ochranné víčko.
Vyjměte jehlu ze sterilního obalu a nasaďte ji na injekční stříkačku.
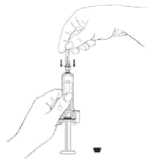
5. Z injekční stříkačky odstraňte všechny vzduchové bubliny
Držte injekční stříkačku tak, aby jehla směřovala směrem vzhůru a poklepejte na injekční stříkačku jemně prsty, dokud se vzduch neshromáždí na hrotu. Opatrně tlačte píst dovnitř, dokud vzduchové bubliny nezmizí.
Injekce
1. Vyberte místo, kam provedete vpich injekce, a zaznamenejte si jej do deníku.
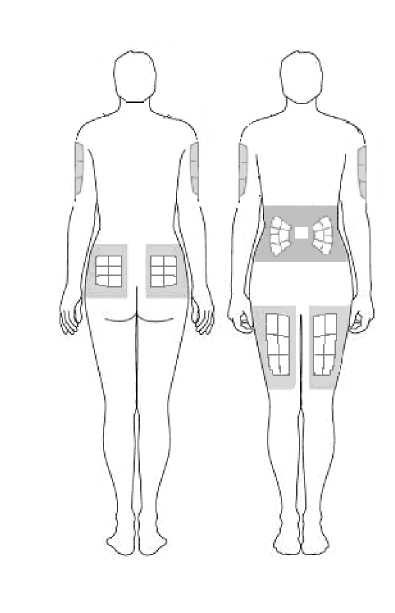
Břicho (žaludek): Nepoužívejte plochu o průměru dva a půl centimetru okolo pupku. Vyhýbejte se oblasti, kde nosíte pásek, protože jeho otírání by mohlo dráždit místo vpichu. Vyhýbejte se jizvám po chirurgických výkonech. Je to pravděpodobně nejsnadnější oblast, kam aplikovat injekci, pokud aplikaci provádíte sami.
Stehna: Používejte střední a vnější plochy, kde můžete tkáň sevřít mezi prsty. Tkáň bude tím tučnější, čím více se budete blížit ke kyčli a čím dále budete od kolena.
Paže: Vhodné je použití zadní strany nadloktí. Při použití tohoto místa je obtížné sevřít tkáň a sami si aplikovat přípravek Zutecra. Pokud se rozhodnete sami aplikovat injekci do paže, pokuste se sevřít tkáň tak, že položíte nadloktí přes zadní stranu židle nebo jej napnete proti stěně. Pokud potřebujete pomoc, je použití tohoto místa mnohem snadnější pro druhou osobu.
Hýždě: Použijte jakékoliv místo, kde můžete sevřít tkáň. Samopodání injekce do tohoto místa je obtížnější. Zkuste se postavit před zrcadlo, abyste vyhledali místo, případně raději požádejte ošetřující osobu, aby vám injekci aplikovala.
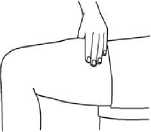
Je důležité, abyste místa vpichu injekce měnili (rotovali). Napomůžete tomu, že kůže zůstane poddajná a léčivo bude absorbováno rovnoměrně. Rotace míst vpichu znamená, že začnete na jednom místě a předtím, než se vrátíte k místu prvního vpichu, využijete všechna ostatní místa. Pak začněte znovu s obměnou. Je užitečné vést si záznam o tom, kam jste provedli vpich své poslední injekce, aby nedošlo k problémům.
Jako příklad uvádíme na následujících obrázcích podání do stehen:
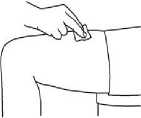
2. Otřete zamýšlené místo vpichu tampónem napuštěným alkoholem. Nechte kůži vyschnout.
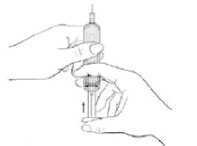
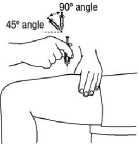
3. Jemně sevřete kůži okolo dezinfikovaného místa vpichu (trochu kůži zdvihněte) a zatlačte jehlu do kůže rychlým, jistým pohybem v úhlu 45 až 90 stupňů. Aplikujte pod kůži, jak vám to předvedl lékař nebo zdravotní sestra.
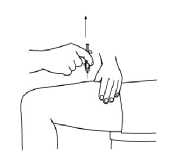
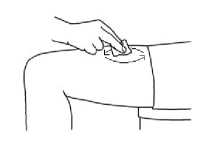
4. Vstříkněte tekutinu jemným tlakem na píst. Dopřejte si dostatek času na vstříknutí celého roztoku, dokud injekční stříkačka není prázdná.
5. Poté jehlu okamžitě vytáhněte a uvolněte sevřenou kůži.
6. Vyčistěte místo vpichu otřením tampónem napuštěným alkoholem kruhovými pohyby.
Likvidace všech použitých předmětů
Jakmile dokončíte injekci, odložte neprodleně všechny jehly, a prázdné skleněné obaly do nádoby určené pro ostré předměty.
29