Zavesca 100 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Zavesca 100 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje miglustatum 100 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Bílé tobolky s černě vytištěným nápisem “OGT 918” na vrchní části a s černě vytištěným nápisem “100” na spodní části tobolky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Zavesca je indikován k perorální léčbě dospělých pacientů s mírnou až střední formou Gaucherovy choroby typu 1. Přípravek Zavesca může být použit pouze k terapii pacientů, pro které není vhodná enzymatická substituční terapie (viz bod 4.4 a 5.1).
Přípravek Zavesca je indikován k léčbě progredujících neurologických projevů u dospělých a dětských pacientů s Niemannovou-Pickovou chorobou typu C (viz body 4.4 a 5.1).
4.2 Dávkování a způsob podání
Terapie musí být vedena lékařem, který má zkušenosti s léčbou Gaucherovy choroby respektive Niemannovy-Pickovy choroby typu C.
Dávkování
Dávkování u Gaucherovy choroby typu 1 Dospělí
Doporučená úvodní dávka pro terapii dospělých pacientů s Gaucherovou chorobou typu 1 je 100 mg třikrát denně.
Kvůli průjmům může být u některých pacientů nutné dočasné snížení dávky na 100 mg jednou nebo dvakrát denně.
Pediatrická populace
Účinnost přípravku Zavesca u dětí a dospívajících ve věku 0-17 let s t Gaucherovou chorobou typu 1 nebyla stanovena. Nejsou k dispozici žádné údaje.
Dávkování u Niemann-Pickovy choroby typu C
Dospělí
Doporučená dávka pro léčbu dospělých pacientů s Niemannovou-Pickovou chorobou typu C je 200
mg třikrát denně.
Pediatrická populace
Doporučená dávka pro léčbu mladistvých pacientů (ve věku 12 let a starší) s Niemannovou-Pickovou chorobou typu C je 200 mg třikrát denně.
Dávkování u pacientů mladších 12 let by se mělo upravit vzhledem k povrchu těla následujícím způsobem:
|
Plocha povrchu těla (m2) |
Doporučená dávka |
|
> 1,25 |
200 mg třikrát denně |
|
> 0,88 - 1,25 |
200 mg dvakrát denně |
|
> 0,73 - 0,88 |
100 mg třikrát denně |
|
> 0,47 - 0,73 |
100 mg dvakrát denně |
|
< 0,47 |
100 mg jednou denně |
U některých pacientů je nutné dočasné snížení dávky vzhledem k průjmu.
Prospěch léčby přípravkem Zavesca pro pacienta je třeba pravidelně vyhodnocovat (viz bod 4.4).
S použitím přípravku Zavesca u pacientů s Niemannovou-Pickovou chorobou typu C mladších 4 let jsou pouze omezené zkušenosti
Zvláštní _ populace
Starší pacienti
Neexistuje žádná zkušenost s použitím přípravku Zavesca u pacientů starších než 70 let.
Poškození ledvin
Farmakokinetické údaje naznačují zvýšenou systémovou expozici miglustatem u pacientů s poškozením ledvin. U pacientů s upravenou clearance kreatininu 50-70 ml/min/1,73 m2, musí být podávání zahájeno dávkou 100 mg dvakrát denně u pacientů s Gaucherovou chorobou typu 1 a dávkou 200 mg dvakrát denně (upravenou vzhledem k tělesnému povrchu v případě pacientů mladších 12 let) u pacientů s Niemannovou-Pickovou chorobou typu C.
U pacientů s upravenou clearance kreatininu 30-50 ml/min/1,73 m2, musí být podávání zahájeno dávkou jednou 100 mg jednou denně u pacientů s Gaucherovou chorobou typu 1 a dávkou 100 mg dvakrát denně (upravenou vzhledem k tělesnému povrchu v případě pacientů mladších 12 let) u pacientů s Niemannovou-Pickovou chorobou typu C.
Užití u pacientů s vážným poškozením ledvin (clearance kreatininu < 30 ml/min/1,73 m2) se nedoporučuje (viz bod 4.4 a 5.2).
Poškození jater
U pacientů s poškozením jater nebyl přípravek Zavesca hodnocen.
Způsob podání
Zavesca se může užívat s jídlem i bez jídla.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Přibližně 37 % pacientů v klinických studiích s Gaucherovou chorobou typu 1 a 58 % pacientů v klinické studii s Niemannovou-Pickovou chorobou typu C udávalo třes během léčby. Tyto třesy byly u typu 1 Gaucherovy choroby popsány jako přehnaný fyziologický třes rukou. Třes obvykle začal během prvního měsíce a v mnoha případech ustoupil v průběhu léčby mezi prvním až třetím měsícem. Snížení dávky může třes zlepšit obvykle během několika dní, ale někdy může být nezbytné přerušení léčby.
Poruchy gastrointestinálního traktu
Gastrointestinální příhody, zejména průjem, byly pozorovány u více než 80% pacientů, ať už na začátku léčby nebo občas v průběhu léčby (viz bod 4.8). Mechanismem je nejpravděpodobněji inhibice střevních disacharidáz, jako je sacharáza-isomaltáza, v gastrointestinálním traktu, což vede ke snížené absorpci disacharidů z potravy. V klinické praxi bylo pozorováno, že miglustatem navozené gastrointestinální příhody reagují na individualizovanou úpravu diety (například na snížení příjmu sacharózy, laktózy a jiných sacharidů), na užívání přípravku Zavesca mezi jídly a/nebo na protiprůjmové léky jako loperamid. U některých pacientů může být nutné dočasné snížení dávky. Pacienti s chronickým průjmem nebo jinými přetrvávajícími gastrointestinálními příhodami, které nereagují na tyto zásahy, by měli být vyšetřeni podle klinické praxe. Přípravek Zavesca nebyl hodnocen u pacientů s anamnézou významného gastrointestinálního onemocnění včetně zánětlivého onemocnění střev.
Vliv na spermatogenezi
Pacienti mužského pohlaví musí během terapie přípravkem Zavesca používat spolehlivé antikoncepční metody. Studie u potkanů ukázaly, že miglustat nepříznivě ovlivňuje spermatogenezu, parametry spermatu a snižuje plodnost (viz. Body 4,6 a 5.3). Do doby než budou k dispozici další informace, musí muži před plánovaným početím přestat užívat přípravek Zavesca a používat spolehlivé antikoncepční metody ještě další tři měsíce po jeho vysazení.
Zvláštní populace
Kvůli omezeným zkušenostem musí být přípravek Zavesca opatrně používán u pacientů s poškozením ledvin nebo jater. Je úzký vztah mezi renální funkcí a clearance miglustatu, přičemž expozice miglustatu je nápadně zvýšena u pacientů se závažným poškozením ledvin (viz bod 5.2). V této době neexistují u těchto pacientů dostatečné klinické zkušenosti, aby mohlo být stanoveno jeho dávkování. Užití přípravku Zavesca u pacientů s vážným poškozením ledvin (clearance kreatininu < 30 ml/min/1,73 m2) se nedoporučuje.
Gaucherova choroba typu 1
Ačkoliv u dosud neléčených pacientů s Gaucherovou chorobou typu 1 nebylo provedeno žádné přímé srovnání s enzymatickou substituční terapií (Enzyme Replacement Therapy - ERT), neexistuje důkaz o tom, že je Zavesca v účinnosti a bezpečnosti prospěšnější než ERT. ERT je standardem péče pro pacienty, kteří vyžadují terapii Gaucherovy choroby typu 1 (viz bod 5.1). Účinnost a bezpečnost přípravku Zavesca nebyla specificky hodnocena u pacientů se závažnou Gaucherovou chorobou.
Vzhledem k vysoké prevalenci nedostatku vitaminu B12 u pacientů s Gaucherovou chorobou typu 1 se doporučují pravidelné kontroly hladiny vitamínu B12.
U pacientů léčených přípravkem Zavesca byly hlášeny případy periferní neuropatie s nebo bez souběžných stavů, j ako j sou nedostatek vitaminu B12 a monoklonální gamapatie. Periferní neuropatie se zdá být častější u pacientů s Gaucherovou chorobou typu 1 ve srovnání s celkovou populací.
Všichni pacienti musí neurologické vyšetření podstoupit před zahájením léčby a dále opakovaně v průběhu léčby.
U pacientů s Gaucherovou chorobou typu 1 se doporučuje sledování počtu krevních destiček.
U pacientů s Gaucherovou chorobou typu 1, kteří přešli z ERT na přípravek Zavesca, bylo pozorováno mírné snížení počtu destiček bez krvácení.
Niemannova-Pickova choroba typu C
Přínos léčby neurologických projevů pacientů s Niemannovou-Pickovou chorobou typu C přípravkem Zavesca by se měl pravidelně vyhodnocovat, například každých 6 měsíců: pokračování léčby by se mělo přehodnotit po uplynutí alespoň jednoho roku léčby přípravkem Zavesca.
U některých pacientů s Niemannovou-Pickovou chorobou typu C léčených přípravkem Zavesca byla pozorována mírná snížení počtu krevních destiček bez souvislosti s krvácením. Z pacientů zahrnutých do klinické studie mělo 40 až 50 % pacientů počty krevních destiček pod spodní mezí normálu výchozích hodnot. U těchto pacientů se doporučuje sledování počtu destiček.
Pediatrická populace
U některých pediatrických pacientů s Niemannovou-Pickovou chorobou typu C byl v časné fázi léčby miglustatem hlášen zpomalený růst, kde počáteční snížený přírůstek tělesné hmotnosti může být doprovázen nebo následován sníženým přírůstkem tělesné výšky. V průběhu léčby přípravkem Zavesca by se měl u pediatrických pacientů a dospívajících monitorovat růst; rovnováha mezi prospěchem a rizikem by se měla u jednotlivých pacientů přehodnotit a mělo by se zvážit další pokračování léčby.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Omezené údaje naznačují, že současné podávání přípravku Zavesca a enzymatické substituce imiglucerázou u pacientů s Gaucherovou chorobou typu 1 může mít za následek snížené působení miglustatu (v malé studii paralelních skupin bylo pozorováno snížení přibližně o 22% Cmax a o 14% AUC ). Tato studie také naznačuje, že přípravek Zavesca nemá žádný nebo pouze omezený vliv na farmakokinetiku imiglucerázy.
4.6 Fertilita, těhotenství a kojení
Dostatečné údaje o podávání miglustatu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu, včetně poruchy děložních kontrakcí (viz bod 5.3). Možné riziko pro člověka není známé. Miglustat prostupuje placentou a nesmí být užíván v těhotenství.
Kojení
Není známo, zda je miglustat vylučován do mateřského mléka. Přípravek Zavesca nesmí být užíván během kojení.
Fertilita
Studie na potkanech prokázaly, že miglustat má nežádoucí účinky na parametry spermatu (motilita a morfologie), čímž snižuje fertilitu (viz body 4.4 a 5.3). Dokud nebudou k dispozici další informace, doporučuje se, aby před snahou o oplodnění muži přípravek Zavesca vysadili a 3 měsíce poté používali spolehlivé způsoby antikoncepce.
Ženy v reprodukčním věku musí používat účinnou antikoncepci. Mužští pacienti musí během užívání přípravku Zavesca používat spolehlivý způsob antikoncepce (viz body 4.4 a 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Zavesca má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Jako častý nežádoucí účinek byla hlášena závrať, a pacienti trpící závratí, nesmí řídit vozidla nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Nejčastějšími nežádoucími účinky, které byly hlášeny v klinických studiích s přípravkem Zavesca, byly průjem, flatulence, bolesti břicha, úbytek tělesné hmotnosti a třes (viz bod 4.4). Nejčastějším závažným nežádoucím účinkem hlášeným při léčbě přípravkem Zavesca v klinických studiích byla periferní neuropatie (viz bod 4.4).
V 11 klinických studiích bylo přípravkem Zavesca léčeno 247 pacientů pro různé indikace při dávkách 50-200 mg třikrát denně, v průměru po dobu 2,1 roku. Z těchto pacientů mělo 132 Gaucherovu chorobu typu 1 a 40 pacientů mělo Niemannovu-Pickovu chorobu typu C. Nežádoucí účinky byly obecně mírné až středně závažné a vyskytovaly se s podobnou frekvencí u všech indikací a testovaných dávek.
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky z klinických studií a ze spontánních hlášení vyskytující se u >1 % pacientů jsou uvedeny v tabulce podle třídy orgánových systémů a četnosti (velmi časté: > 1/10, časté: > 1/100 až < 1/10, méně časté : >1/1000 až <1/100, vzácné: >1/10000 až < 1/1000, velmi vzácné: <1/10000).
V každé skupině četnosti se nežádoucí účinky uvádějí v pořadí klesající závažnosti.
Poruchy krve a lymfatického systému Časté trombocytopenie
Poruchy metabolizmu a výživy
Velmi časté úbytek tělesné hmotnosti, pokles chuti k jídlu
Psychiatrické poruchy
Časté deprese, insomnie, pokles libida
Poruchy nervového systému Velmi časté třes,
Časté periferní neuropatie, ataxie, amnézie, parestézie, hypoestézie, bolest hlavy,
závrať
Gastrointestinální poruchy
Velmi časté průjem, flatulence, bolest břicha,
Časté nauzea, zvracení, břišní distenze/diskomfort, zácpa, dyspepsie
Poruchy pohybového systému a pojivové tkáně Časté svalové křeče, svalová slabost
Celkové poruchy a reakce v místě aplikace
Časté únava, astenie, zimnice a malátnost
Vyšetření
Časté abnormální výsledky studií nervového vedení
Popis vybraných nežádoucích účinků
Úbytek tělesné hmotnosti byl hlášen u 55 % pacientů. Nejvyšší prevalence byla pozorována mezi 6. a 12. měsícem.
Přípravek Zavesca byl studován při indikacích, při kterých některé příhody udávané jako nežádoucí účinky, jako jsou neurologické a neuropsychologické symptomy/známky, kognitivní dysfunkce a trombocytopenie, mohly být též následkem základních stavů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Akutní příznaky předávkování nebyly zjištěny. Přípravek Zavesca byl během klinického hodnocení u HIV pozitivních pacientů podáván v dávkách do 3000 mg/den po dobu až šesti měsíců. Pozorované nežádoucí účinky zahrnovaly granulocytopenii, závratě a parestézie. U podobné skupiny pacientů, kteří dostávali 800 mg/den nebo vyšší dávku, byly pozorovány rovněž leukopenie a neutropenie.
Opatření
V případě předávkování se doporučuje obecná lékařská péče.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Trávicí trakt a metabolizmus, různá léčiva.
ATC kód: A16AX06
Gaucherova choroba typu 1
Gaucherova choroba je vrozená metabolická porucha, způsobená selháním degradace glukosylceramidu, mající za následek lysozomální střádání glukosylceramidu a z toho plynoucí širokou patologií. Miglustat je inhibitorem glukosylceramidsyntázy, enzymu odpovědného za první krok v syntéze většiny glykolipidů. Glukosylceramidsyntáza se inhibuje in vitro miglustatem s IC50 20-37 ^M. Navíc bylo inhibiční působení nelysosomální glykosylceramidázy prokázáno experimentálně in vitro. Toto inhibiční působení na glukosylceramidsyntázu je základním principem léčby Gaucherovy choroby zaměřené na redukci substrátu.
Pilotní studie s přípravkem Zavesca byla provedena u pacientů, kteří nemohli nebo nechtěli přijmout léčbu ERT. Důvody pro nepřijetí ERT zahrnovaly zátěž nitrožilních infuzí a nesnadnost žilního přístupu. Do této dvanáctiměsíční nesrovnávací studie bylo zařazeno dvacet osm pacientů s mírnou až střední Gaucherovou chorobou typu 1, z nichž 22 pacientů studii dokončilo. Ve dvanáctém měsíci činilo průměrné zmenšení objemu jater 12,1% a průměrné zmenšení objemu sleziny 19,0%. Bylo zaznamenáno zvýšení koncentrace hemoglobinu v průměru o 0,26 g/dl a zvýšení počtu destiček v průměru o 8,29 x 109/l. Osmnáct pacientů potom pokračovalo v léčbě přípravkem Zavesca podle dobrovolného, rozšířeného protokolu. Klinický přínos byl u třinácti pacientů hodnocen ve dvacátém čtvrtém a třicátém šestém měsíci. Po třech letech trvající léčby přípravkem Zavesca bylo průměrné zmenšení objemu jater 17,5% a sleziny 29,6%. Průměrné zvýšení počtu destiček dosáhlo 22,2 x 109/l a průměrné zvýšení koncentrace hemoglobinu dosáhlo 0,95 g/dl.
Ve druhé otevřené kontrolované studii bylo 36 pacientů, kteří byli minimálně 2 roky léčeni ERT, randomizováno do tří terapeutických skupin: pokračování s imiglucerázou, imigluceráza v kombinaci s přípravkem Zavesca, anebo převedení na přípravek Zavesca. Tato studie byla prováděna po dobu 6-ti měsíčního randomizovaného porovnávání s následujícím 18-ti měsíčním prodloužením, při kterém všichni pacienti dostávali přípravek Zavesca jako monoterapii. Během prvních 6 měsíců byly objemy jater a sleziny a hladiny hemoglobinu u pacientů, kteří byli převedeni na přípravek Zavesca, nezměněny. U některých pacientů došlo nicméně ke snížení počtu destiček a zvýšení aktivity chitotrioxidázy, což naznačuje, že monoterapie přípravkem Zavesca nemusí udržet kontrolu nad aktivitou onemocnění u všech pacientů. V terapii nadále pokračovalo 29 pacientů. Ve srovnání s hodnotami po 6 měsících zůstalo potlačení choroby po 18 a 24 měsících monoterapie přípravkem Zavesca beze změny (u 20 resp. 6 pacientů). Po přechodu na monoterapii přípravkem Zavesca nedošlo u žádného pacienta ke zhoršení Gaucherovy choroby typu 1.
Ve dvou výše zmíněných studiích byla užita celková denní dávka 300 mg přípravku Zavesca podaná ve třech rozdělených dávkách. Další studie s monoterapií byla provedena u osmnácti pacientů s celkovou denní dávkou 150 mg a výsledky, ve srovnání s celkovou denní dávkou 300 mg, naznačují sníženou účinnost.
Otevřená, nekomparativní dvouletá studie zahrnula 42 pacientů s Gaucherovou chorobou typu 1, kteří byli léčeni nejméně 3 roky ERT a kteří splňovali kritéria stabilní nemoci po dobu nejméně 2 let. Pacienti byli převedeni na monoterapii miglustatem v dávce 100 mg třikrát denně. Výchozí hodnoty objemu jater (primární proměnná měření účinnosti) se do konce léčby nezměnily. Šest pacientů léčbu miglustatem předčasně ukončilo kvůli potenciálnímu zhoršení choroby, jak bylo ve studii definováno. Třináct pacientů ukončilo léčbu kvůli nežádoucí příhodě. Mez začátkem a koncem studie se pozorovaly malé střední hodnoty snížení hemoglobinu [-0,95 g/dl (95% interval spolehlivosti: -1,38, -0,53)] a počtu destiček [-44,1 * 109/l (95% interval spolehlivosti: -57,6, -30,7)]. Dvacet čtyři měsíců léčby miglustatem dokončil dvacet jeden pacient. Z nich 18 bylo na začátku ve stanovených terapeutických cílech ohledně objemu jater a sleziny, hladin hemoglobinu a počtu destiček, přičemž 16 pacientů za 24 měsíců zůstalo v mezích všech těchto terapeutických cílů.
Kostní projevy Gaucherovy choroby typu 1 byly hodnoceny ve 3 otevřených klinických studiích u pacientů léčených miglustatem 100 mg 3x denně po dobu 2 let (n = 72). Ve společné analýze se hodnoty Z-skóre denzity kostního minerálu v lumbální páteři a v krčku femuru zvýšily o více než 0.1 jednotky oproti výchozí hodnotě u 27 (57%) respektive 28 (65%) pacientů, u kterých se prováděla longitudinální měření kostní denzity. Během léčebného období se nevyskytly žádné případy bolesti kostí (kostní krize), avaskulární nekrózy nebo zlomeniny.
Niemannova-Pickova choroba typu C
Niemannova-Pickova choroba typu C je velice vzácnou, invariabilně progredující a případně smrtelnou neurodegenerativní poruchou charakterizovanou poruchou pohybu lipidů uvnitř buňky. Neurologické projevy se uvažují jako sekundární po abnormální akumulaci glykosfingolipidů v neuronových a gliových buňkách.
Údaje potvrzující bezpečnost a účinnost přípravku Zavesca při Niemannově-Pickově chorobě typu C pocházejí z prospektivní otevřené klinické studie a retrospektivního rozboru. Tato klinická studie zahrnovala 29 dospělých a nedospělých pacientů v rámci 12 měsíčního kontrolovaného období s následnou prodlouženou léčbou v průměru na celkovou dobu 3,9 let až 5,6 let. Navíc bylo zahrnuto 12 pediatrických pacientů do nekontrolované dílčí studie trvající v průměru celkem 3,1 let a až 4,4 let. Z těchto pacientů o celkovém počtu 41 zahrnutých do studie bylo 14 pacientů léčeno přípravkem Zavesca po dobu delší než 3 roky. Analýza zahrnovala případy 66 pacientů léčených přípravkem Zavesca mimo tuto klinickou studii po střední dobu trvání 1,5 let. Oba soubory dat zahrnovaly pediatrické, dospívající a dospělé pacienty v rozmezí věku 1 rok až 43 let. Obvyklá dávka přípravku Zavesca u dospělých pacientů byla 200 mg třikrát denně a u pediatrických pacientů byla upravována podle tělesného povrchu.
Celkově tyto údaje ukazují, že léčba přípravkem Zavesca může snižovat progresi klinicky relevantních neurologických symptomů u pacientů s Niemannovou-Pickovou chorobou typu C.
Přínos léčby přípravkem Zavesca týkající se neurologických projevů u pacientů s Niemannovou-Pickovou chorobou typu C by se měl pravidelně hodnotit, například každých 6 měsíců; pokračování terapie by se mělo přehodnotit po období léčby přípravkem Zavesca trvajícím alespoň 1 rok (viz bod 4.4).
5.2 Farmakokinetické vlastnosti
Farmakokinetické parametry miglustatu byly stanoveny u zdravých osob, na malém počtu pacientů s Gaucherovou chorobou typu 1, Fabryho chorobou, u pacientů infikovaných virem HIV a u dospělých, dospívajících a dětí s Niemannovou-Pickovou chorobou typu C nebo s Gaucherovou chorobou typu 3.
Zdá se, že kinetika miglustatu je lineárně závislá na dávce a nezávislá na čase. Miglustat je u zdravých osob rychle absorbován. Maximálních plazmatických koncentrací je dosaženo přibližně za 2 hodiny po podání. Absolutní biologická dostupnost nebyla určena. Souběžné podání potravy snižuje rychlost absorpce (Cmax bylo sníženo o 36% a tmax prodlouženo o 2 hodiny), ale nemá statisticky významný účinek na rozsah absorpce miglustatu (AUC sníženo o 14%).
Distribuční objem miglustatu činí 83 l. Miglustat se neváže na plazmatické bílkoviny. Miglustat se eliminuje hlavně renální exkrecí a množství nezměněného léku vyloučeného močí je 70 - 80 % podané dávky. Clearance po perorálním podání (CL/F) činí 230 ± 39 ml/min. Průměrný biologický poločas je 6-7 hodin.
Po podání jednotlivé dávky 100 mg miglustatu značeného radionuklidem 14 C zdravým dobrovolníkům lze nalézt 83 % podaného radionuklidu v moči a 12 % ve stolici. V moči a stolici bylo zjištěno několik metabolitů. Nejčastějším metabolitem v moči byl glukuronid miglustatu , který představoval 5 % podané dávky. Terminální poločas radioaktivity v krevní plazmě byl 150 h, což ukazovalo na přítomnost jednoho či více metabolitů s velmi dlouhým poločasem. Metabolity, které k tomu přispívaly, nebyly identifikovány, avšak mohou se hromadit a dosahovat koncentrací převyšujících koncentrace miglustatu v ustáleném stavu.
Farmakokinetika miglustatu přípravkem Zavesca u dospělých pacientů s Gaucherovou chorobou typu 1 a pacientů s Niemannovou-Pickovou chorobou typu C je podobná jako u zdravých osob.
Pediatrická populace
Farmakokinetické údaje byly obdrženy u pediatrických pacientů s Gaucherovou chorobou typu 3 ve stáří 3 až 15 let a u pacientů s Niemannovou-Pickovou chorobou typu C ve stáří 5 až 16 let.
Dávkování u dětí 200 mg třikrát denně upravené vzhledem k tělesnému povrchu vedlo k hodnotám Cmax a AUCT, které byly zhruba dvojnásobkem hodnot dosažených po dávkování 100 mg třikrát denně u pacientů s Gaucherovou chorobou typu 1, konzistentně s dávkově lineární farmakokinetikou miglustatu. V ustáleném stavu byla koncentrace miglustatu v mozkomíšním moku 6 pacientů s Gaucherovou chorobou typu 3 31,4-67,2 % koncentrace v krevní plazmě.
Omezené údaje u pacientů s Fabryho chorobou a poškozenou funkcí ledvin ukázaly, že CL/F se snižuje se sníženou funkcí ledvin. Ačkoliv počty jedinců s mírným a středním poškozením ledvin byly velmi malé, údaje svědčí pro snížení CL/F přibližně o 40% u lehkého a o 60% u středního renálního poškození (viz bod 4.2). Údaje pro závažné poškození ledvin jsou omezeny na dva pacienty s clearance kreatininu v rozmezí 18 - 29 ml/min a nemohou být extrapolovány na nižší hodnoty. Tyto údaje u pacientů se závažným poškozením ledvin svědčí pro snížení CL/F nejméně o 70%.
Mimo rozmezí údajů, které jsou k dispozici, nebyly zaznamenány žádné významné vztahy nebo trendy mezi farmakokinetickými parametry miglustatu a demografickými proměnnými (věk, BMI, pohlaví nebo rasa).
K dispozici nejsou žádné farmakokinetické údaje u pacientů s poškozením jater nebo pacientů pokročilejšího věku (> 70 let).
5.3 Předklinické údaje vztahující se k bezpečnosti
Nejdůležitější účinky společné pro všechny druhy byly úbytek hmotnosti a průjem, a při vyšších dávkách poškození gastrointestinální sliznice (eroze a ulcerace). Další účinky pozorované u zvířat při vystavení podobným dávkám nebo mírně vyšším dávkám než vystavení dávkám v klinické praxi, byly: změny lymfatických orgánů u všech testovaných druhů, změny transamináz, vakuolizace štítné žlázy a slinivky břišní, katarakta, nefropatie a změny myokardu u potkanů. Tyto nálezy byly považovány za druhotné při oslabení organizmu.
Podávání miglustatu samcům a samicím potkanů Sprague-Dawley žaludeční sondou po dobu 2 let v dávkách 30, 60 a 180 mg/kg/den mělo za následek zvýšený výskyt hyperplazie testikulárních intersticiálních buněk (Leydigovy buňky) a adenomů u samců potkanů u všech podávaných dávek. Systemová expozice po nejnižší dávce byla nižší nebo srovnatelná s expozicí pozorovanou u lidí (na základě AUC0_W) při dávce doporučené pro použití u lidí. Dávka nevyvolávající žádný efekt (NOEL) nebyla zjištěna a účinek nebyl závislý na dávce. U samců nebo samic potkanů nebyl pozorován nárůst výskytu nádorů v souvislosti s lékem v žádném jiném orgánu. Studie mechanismů ukázaly na mechanismus specifický pro krysy, které jsou všeobecně považovány za málo důležité pro člověka.
Podávání miglustatu samcům a samicím myší CD1 žaludeční sondou po dobu 2 let v dávkách 210, 420 a 840/500 mg/kg/den (snížení dávky po půl roce) mělo za následek zvýšený výskyt zánětlivých a hyperplastických lézí v tlustém střevě u obou pohlaví. Na základě dávkování v mg/kg/den upraveného podle rozdílů ve vylučování stolicí odpovídaly dávky 8, 16 a 33/19násobku nejvyšší doporučené dávky pro lidi (200 mg třikrát denně). Příležitostně se vyskytly karcinomy tlustého střeva u všech dávek, se statisticky významným nárůstem výskytu ve skupině nejvyšší dávky. Relevanci těchto nálezů pro lidi nelze vyloučit. V souvislosti s lékem nebylo zjištěno žádné zvýšení výskytu nádorů v žádném jiném orgánu.
Miglustat nevykázal žádný potenciál pro mutagenní nebo klastogenní účinky ve standardní řadě testů genotoxicity.
Studie toxicity po opakovaném podávání u potkanů ukázaly vliv na semenonosný epitel varlat. Jiné studie odhalily změny parametrů spermatu (pohyblivost a struktura) v souladu s pozorovaným snížením plodnosti. Tyto účinky se objevily při expozici hladinám podobným hladinám u pacientů, avšak vykazovaly reverzibilitu. Miglustat ovlivnil přežívání embryí a plodů u potkanů a králíků, zaznamenány byly poruchy děložních kontrakcí, postimplantační ztráty byly zvýšeny a u králíků se objevil zvýšený výskyt cévních anomálií. Tyto účinky mohou zčásti souviset s toxicitou pro matku.
V jednoroční studii byly pozorovány změny laktace u samic potkanů. Mechanizmus tohoto účinku není znám.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky
sodná sůl karboxymethylškrobu povidon 40 magnesium-stearát
Plášť tobolky
želatina
čištěná voda
oxid titaničitý (E171).
Inkoust na potisk
černý oxid železitý (E172)
šelak
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
5 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 °C.
6.5 Druh obalu a obsah balení
ACLAR/Al blistr. Krabička obsahuje čtyři blistry; každý blistr obsahuje 21 tobolek, celkem 84 tobolek.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky pro likvidaci.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Actelion Registration Ltd Chiswick Tower, 13th Floor 389 Chiswick High Road London W4 4AL Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/02/238/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20 listopadu 2002
Datum posledního prodloužení registrace: 20 listopadu 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Actelion Manufacturing GmbH Emil-Barell-Strasse 7 79639 Grenzach-Wyhlen Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, viz bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí ve stanoveném termínu splní následující opatření:
|
Popis |
Termín splnění |
|
Držitel rozhodnutí bude dále udržovat stávající registr NP-C za účelem dalšího získávání údajů týkajících se bezpečnosti, dlouhodobého průběhu nemoci a klinických výsledků léčby pacientů s nemocí NP-C. Registr NP-C je multicentrická, prospektivní, observační kohortní studie pacientů s diagnostikovanou Niemannovou-Pickovou chorobou typu C (NP-C). |
Roční zprávy budou předkládány s PSURy. |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Zavesca 100 mg tvrdé tobolky Miglustatum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jedna tobolka obsahuje 100 mg miglustatum
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Tvrdá tobolka 84 tobolek
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Actelion Registration Ltd Chiswick Tower, 13th Floor 389 Chiswick High Road London W4 4AL Velká Británie
12 REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/02/238/001 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Zavesca
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTR_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Zavesca 100 mg tvrdé tobolky Miglustatum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Actelion Registration Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Zavesca 100 mg tvrdé tobolky
Miglustatum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se, prosím, svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Zavesca a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Zavesca užívat
3. Jak se přípravek Zavesca užívá
4. Možné nežádoucí účinky
5. Jak přípravek Zavesca uchovávat
6. Obsah balení a další informace
1. Co je přípravek Zavesca a k čemu se používá
Přípravek Zavesca obsahuje účinnou látku miglustat, která patří do skupiny léků, které ovlivňují metabolismus. Používá se k léčení dvou stavů:
• Zavesca se používá k léčení Gaucherovy choroby typu 1 mírné až střední závažnosti u dospělých.
Při Gaucherově chorobě typu 1 se z Vašeho těla neodstraňuje látka, zvaná glukosylceramid. Začíná se ukládat v určitých buňkách imunitního systému organismu. To může mít za následek zvětšení jater a sleziny, krevní změny a onemocnění kostí.
Obvyklý způsob léčby Gaucherovy choroby typu 1 je enzymatická substituční terapie. Přípravek Zavesca se používá pouze tehdy, když léčba enzymatickou substituční terapií není pro pacienta vhodná.
• Zavesca se též používá k léčbě progresivních neurologických symptomů při Niemannově-Pickově chorobě typu C u dospělých a u dětí.
Pokud máte Niemannovu-Pickovu chorobu typu C, narůstají v buňkách Vašeho mozku tuky jako jsou glykosfingolipidy. To může vést k poruchám neurologických funkcí, jako jsou pomalé pohyby očí, rovnováha, polykání, k poruchám paměťi a k záchvatům.
Zavesca působí inhibicí enzymu zvaného glukosylceramidsyntáza, který je odpovědný za první krok při syntéze většiny glykosfingolipidů.
2. Čemu musíte věnovat pozornost, než začnete přípravek Zavesca užívat Neužívejte přípravek Zavesca
- jestliže j ste alergický(á) na léčivou látku miglustat nebo na kteroukoli další složku tohoto
přípravku (uvedenou v bodě 6) .
Upozornění a opatření
Promluvte si se svým lékařem nebo lékárníkem dříve, než začnete užívat přípravek Zavesca
- jestliže trpíte onemocněním ledvin
- jestliže trpíte onemocněním jater
Před léčbou a během léčby přípravkem Zavesca Vám lékař provede následující vyšetření:
- vyšetření nervů na horních a dolních končetinách
- měření hladiny vitaminu B12.
- sledování růstu, pokud jste dítě nebo dospívající s Niemannovou-Pickovou chorobou typu C
- sledování počtu krevních destiček
Důvod, proč se tato vyšetření provádějí je, že někteří pacienti měli během léčby přípravkem Zavesca brnění nebo necitlivost v rukou a nohou nebo pokles tělesné hmotnosti. Vyšetření pomohou lékaři rozhodnout, zda jsou tyto projevy důsledkem Vaší choroby či jiných přítomných stavů nebo projevem nežádoucích účinků přípravku Zavesca (pro další podrobnosti viz bod 4).
Jestliže máte průjem, lékař Vás může požádat o změnu stravy za účelem snížení příjmu laktózy a cukrů, jako je sacharóza (třtinový cukr) nebo neužívat přípravek Zavesca spolu s jídlem nebo dočasně snížit dávku. V některých případech může lékař předepsat protiprůjmové léky jako loperamid. Jestliže průjem nereaguje na tato opatření, nebo jestliže máte jiné břišní potíže, obraťte se na svého lékaře.
V takovém případě může lékař rozhodnout o provedení dalších vyšetření.
Muži musí během léčby přípravkem Zavesca a ještě 3 měsíce po ukončení léčby používat spolehlivou metodu antikoncepční ochrany.
Děti a dospívající
Nepodávejte tento lék dětem a dospívajícím (do 18 let) s Gaucherovy choroby typu 1, protože není známo, zda je tento přípravek účinný.
Další léčivé přípravky a Zavesca
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Sdělte svému lékaři, zda užíváte léky obsahující imiglucerasu, které se někdy užívají současně s přípravkem Zavesca. Mohou snižovat množství přípravku Zavesca ve Vašem těle.
Těhotenství, kojení a fertilita
Pokud jste těhotná nebo plánujete těhotenství, nesmíte užívat přípravek Zavesca. Váš lékař vám může poskytnout více informací. Během užívání přípravku Zavesca musíte používat účinnou antikoncepční metodu. Během užívání přípravku Zavesca nesmíte kojit.
Muži by měli během léčby přípravkem Zavesca a po dobu 3 měsíců po skončení léčby používat spolehlivý způsob antikoncepční ochrany.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů:
Přípravek Zavesca může způsobit závratě. Pokud máte závratě, nesmíte řídit vozidlo ani obsluhovat žádné stroje.
3. Jak se přípravek Zavesca užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
• Při Gaucherově chorobě typu 1: Pro dospělé je obvyklá dávka jedna tobolka (100 mg) třikrát denně (ráno, v poledne a večer). To znamená, že maximální denní dávka jsou tři tobolky
(300 mg).
• Při Niemannově-Pickově chorobě typu C: Pro dospělé a dospívající (starší než 12 let) je obvyklá dávka dvě tobolky (200 mg) třikrát denně (ráno, odpoledne a večer). To znamená denní maximální dávku šesti tobolek (600 mg).
U dětí mladších než 12 let Váš lékař upraví dávku pro léčbu Niemannovy-Pickovy choroby typu C.
Máte-li některý problém se svými ledvinami, můžete dostávat nižší zahajovací dávku. Váš lékař může snížit Vaši dávku, například na jednu tobolku (100 mg) jednou nebo dvakrát denně, pokud trpíte při užívání přípravku Zavesca průjmem (viz oddíl 4). Váš lékař Vám sdělí, jak dlouho potrvá Vaše léčba.
Vyjmutí tobolky:
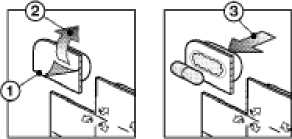
1. Oddělte v místě perforace
2. Stáhněte papír ve směru šipek
3. Protlačte lék fólií
Přípravek Zavesca se může užívat nezávisle na jídle. Tobolka se musí polknout celá a zapít sklenicí vody.
Jestliže jste užil(a) více přípravku Zavesca, než jste měl(a)
Pokud jste užil(a) více tobolek, než Vám řekl Váš lékař, poraďte se ihned se svým lékařem.
Přípravek Zavesca byl v klinických studiích podáván v dávkách desetkrát vyšších, než je doporučená dávka. To způsobilo pokles počtu bílých krvinek a ostatní nežádoucí účinky podobné těm, které jsou popsány v bodě 4.
Jestliže jste zapomněl(a) užít přípravek Zavesca
Další tobolku si vezměte v obvyklou dobu. Nezdvojujte následující dávku, abyste nahradili vynechanou dávku.
Jestliže jste přestal(a) užívat přípravek Zavesca
Neukončujte užívání přípravku Zavesca bez pokynu svého lékaře.
Máte-li jakékoli další otázky, týkající se užívání tohoto léku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Nejzávažnější nežádoucí účinky:
Někteří pacienti měli mravenčení nebo pocity necitlivosti rukou a nohou. To by mohly být známky periferní neuropatie způsobené přípravkem Zavesca nebo následkem přítomných stavů. Pro vyhodnocení těchto stavů provede Váš lékař některé zkoušky před zahájením léčby a během léčby (viz bod 2).
Pokud se u Vás vyskytnou takové účinky, oznamte to, prosím, co nejdříve svému lékaři.
Pokud se u vás vyskytne mírný třes, obvykle třes rukou, oznamte to svému lékaři co nejdříve. Třes často zmizí i bez nutnosti přerušení léčby. Někdy může Váš lékař k zastavení třesu požadovat snížení dávky nebo přerušení léčby přípravkem Zavesca.
Velmi časté účinky - mohou postihnout více než 1 z 10 osob
Nejčastější nežádoucími účinky jsou průjem, flatulence (větry), bolest břicha (žaludku), ztráta tělesné hmotnosti a snížení chuti k jídlu.
Neobávejte se, pokud zaznamenáte na počátku léčby přípravkem Zavesca úbytek tělesné hmotnosti. Ztráty tělesné hmotnosti obvykle ustanou při pokračování v léčbě.
Časté účinky - mohou postihnout až 1 osobu z 10
Časté nežádoucí účinky léčby zahrnují bolest hlavy, závratě, parestezii (mravenčení nebo necitlivost), abnormální koordinaci, hypestézii (sníženou citlivost na dotek), dyspepsii (pálení žáhy), nauzeu (pocit na zvracení), zácpu a zvracení, zduření či obtíže týkající se břicha (žaludku) a trombocytopenii (snížené hladiny krevních destiček). Neurologické příznaky a trombocytopenie by mohly být důsledkem základního onemocnění.
Další možné nežádoucí účinky j sou svalové křeče nebo slabost, únava, zimnice a malátnost, deprese, problémy se spánkem, zapomnětlivost a snížené libido.
Většina pacientů zaznamená jeden nebo více těchto nežádoucích účinků obvykle na počátku léčby nebo občas během léčby. Většina případů má mírný průběh a celkem rychle odezní. Pokud kterýkoliv z těchto účinků způsobí problémy, poraďte se se svým lékařem. Může Vám snížit dávku přípravku Zavesca nebo doporučit jinou léčbu k potlačení nežádoucích účinků.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Zavesca uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30°C.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo do domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Zavesca obsahuje Léčivou látkou je miglustatum 100 mg.
Pomocnými látkami jsou:
sodná sůl karboxymethylškrobu, povidon 40, magnesium-stearát.
želatina,
voda,
oxid titaničitý (E171).
černý oxid železitý (E172), šelak.
Jak přípravek Zavesca vypadá a co obsahuje balení
Přípravek Zavesca jsou bílé 100 mg tvrdé tobolky s černě vytištěným nápisem “OGT 918” na vrchní části a s černě vytištěným nápisem “100” na spodní části tobolky.
Krabička obsahuje čtyři blistry, každý blistr obsahuje 21 tobolek, to je celkem 84 tobolek.
Držitel rozhodnutí o registraci:
Actelion Registration Ltd Chiswick Tower, 13th Floor 389 Chiswick High Road London W4 4AL Velká Británie
Výrobce:
Actelion Manufacturing GmbH Emil-Barell-Strasse 7 79639 Grenzach-Wyhlen Německo
Další informace o tomto léku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
Actelion Pharmaceuticals Belgium N.V. Tél/Tel: +32-(0)15 284 777
Eunrapnu
Actelion Pharmaceuticals Ltd.
Ten.: +420-2 3413 8150
Česká republika
Actelion Pharmaceuticals CZ, s.r.o.
Tel: +420 2 21 968 006
Danmark
Actelion Pharmaceuticals Sverige AB Tlf: +46-(0)8 544 982 50
Deutschland
Actelion Pharmaceuticals Deutschland GmbH Tel: +49-(0)761 45 64 0
Lietuva
UAB ALGOL PHARMA Tel: +370 37 40 86 81
Luxembourg/Luxemburg
Actelion Pharmaceuticals Belgium N.V. Tél/Tel: +32-(0) 15 284 777
Magyarország
Actelion Pharmaceuticals Hungaria Kft. Tel: +36-1-413-3270
Malta
Actelion Pharmaceuticals UK Ltd Tel: +44 208 987 3333
Nederland
Actelion Pharmaceuticals Nederland B.V. Tel: +31 -(0)348 435950
|
Eesti Algol Pharma OU Tel: +372 605 6014 |
Norge Actelion Pharmaceuticals Sverige AB Tlf: +46-(0)8 544 982 50 |
|
EXláSa Actelion Pharmaceuticals EAAág A.E. Tn^: +30-210 675 25 00 |
Osterreich Actelion Pharmaceuticals Austria GmbH Tel: +43-(0)1 505 4527 |
|
Espaňa Actelion Pharmaceuticals Espana S.L. Tel: +34 93 366 43 99 |
Polska Actelion Pharma Polska Sp. z o.o. Tel: +48 (22) 262 31 00 |
|
France Actelion Pharmaceuticals France SAS Tél: +33-(0) 1 58 62 32 32 |
Portugal Actelion Pharmaceuticals Portugal Lda. Tel: +35121 358 6120 |
|
Hrvatska Medis Adria d.o.o Tel: +385 (0)1 2303 446 |
Románia Geneva Romfarm International Tel: + 40 (021) 231 3561 |
|
Ireland Actelion Pharmaceuticals UK Ltd Tel: +44 208 987 3333 |
Slovenija Medis d.o.o. Tel: +386-(0)1 589 69 00 |
|
Ísland Actelion Pharmaceuticals Sverige AB Simi: +46-(0)8 544 982 50 |
Slovenská republika Actelion Pharmaceuticals SK, s.r.o. Tel: +420 2 21 968 006 |
|
Italia Actelion Pharmaceuticals Italia S.r.l. Tel: +39-0542 64 87 40 |
Suomi/Finland Actelion Pharmaceuticals Sverige AB Puh/Tel: +46-(0)8 544 982 50 |
|
Kúnpoq Actelion Pharmaceuticals EAAág A.E. Tn^: +30-210 675 25 00 |
Sverige Actelion Pharmaceuticals Sverige AB Tel: +46-(0)8 544 982 50 |
|
Latvija Algol Pharma SIA Tel: +371 6761 9365 |
United Kingdom Actelion Pharmaceuticals UK Ltd Tel: +44 208 987 3333 |
Tato příbalová informace byla naposledy revidována:
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu. Na těchto stránkách naleznete též odkazy na další webové stránky, týkající se vzácných onemocnění a jejich léčby.
25