Xanax 2 Mg
sp.zn. sukls65144/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
XANAX 0,25 mg XANAX 0,5 mg XANAX 1 mg XANAX 2 mg
tablety
XANAX SR 0,5 mg XANAX SR 1 mg XANAX SR 2 mg
tablety s prodlouženým uvolňováním
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
XANAX: jedna tableta obsahuje alprazolamum 0,25 mg, 0,5 mg, 1 mg nebo 2 mg.
XANAX SR: jedna tableta s prodlouženým uvolňováním obsahuje alprazolamum 0,5 mg, 1 mg nebo 2 mg.
Pomocné látky se známým účinkem: monohydrát laktosy 96 mg (Xanax 0,25 mg, 0,5 mg 1 mg), 192 mg (Xanax 2 mg), 221,7 mg (Xanax SR 0,5 mg, 1 mg, 2 mg)
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta
XANAX 0,25 mg: bílé eliptické oválné tablety s půlicí rýhou na jedné straně a nápisem „Upjohn 29“ na druhé. Půlicí rýha má pouze usnadnit dělení tablety pro snazší polykání, nikoliv její rozdělení na stejné dávky.
XANAX 0,5 mg: růžové eliptické oválné tablety s půlící rýhou na jedné straně a nápisem „Upjohn 55“ na druhé. Půlicí rýha má pouze usnadnit dělení tablety pro snazší polykání, nikoliv její rozdělení na stejné dávky..
XANAX 1 mg: světle fialové eliptické oválné tablety, s půlící rýhou na jedné straně a nápisem „Upjohn 90“ na druhé. Půlicí rýha má pouze usnadnit dělení tablety pro snazší polykání, nikoliv její rozdělení na stejné dávky.
XANAX 2 mg: bílé tablety ve tvaru tobolky s trojitou dělící rýhou na jedné straně a nápisem „U94“, a trojitou dělící rýhou na druhé. Tabletu lze rozdělit na stejné dávky.
Tableta s prodlouženým uvolňováním
XANAX SR 0,5 mg: modré bikonvexní kulaté tablety, na jedné straně označené „P&U 57“
XANAX SR 1 mg: bílé kulaté bikonvexní tablety, na jedné straně označené „P&U 59“
XANAX SR 2 mg: modré tablety ve tvaru pětiúhelníku, na jedné straně označené „P&U 66“
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Xanax je indikován k symptomatické léčbě:
- úzkosti
- panických poruch s agorafobií nebo bez ní.
Přípravek Xanax je indikován pouze v případech, kdy jsou symptomy závažné, omezující nebo způsobují pacientovi nesnesitelné utrpení.
4.2 Dávkování a způsob podání
Dávkování
Optimální dávkování přípravku Xanax je třeba stanovit individuálně, na základě závažnosti příznaků a individuální odpovědi pacienta. Pacientům, kteří vyžadují zvýšené dávky, by dávkování mělo být zvyšováno postupně, aby se zabránilo nežádoucím účinkům. Obecně platí, že pacienti, kteří dříve neužívali psychotropní léky, vyžadují nižší dávku než pacienti, kteří již užívali trankvilizéry, antidepresiva nebo hypnotika. Je doporučeno užít nejnižší účinnou dávku, aby se předešlo vzniku ataxie nebo zvýšené sedace; toto je zvláště důležité u starších nebo oslabených pacientů.
SYMPTOMATICKÁ LÉČBA ÚZKOSTI Xanax tablety
Doporučená zahajovací dávka: v rozmezí 0,25-0,5 mg 3x denně
Doporučená dávka: dávku je možné zvyšovat podle potřeb pacienta až na maximální denní dávku 4 mg, rozdělenou během dne do několika dávek
Xanax SR tablety s prodlouženým uvolňováním
Doporučená zahajovací dávka: 1 mg denně, rozdělené do 1-2 dávek
Doporučená dávka: dávku je možné zvyšovat podle potřeb pacienta až na maximální denní dávku 4 mg, rozdělenou do 1-2 dávek
SYMPTOMATICKÁ LÉČBA PANICKÝCH PORUCH Xanax tablety
Doporučená zahajovací dávka: v rozmezí 0,5-1 mg před spaním
Doporučená dávka: dávku je třeba upravit podle odpovědi pacienta. Dávku je možné zvyšovat nejvýše o 1 mg každé 3-4 dny. Mohou být podány další dávky až do dosažení dávkování 3-4x denně.
Xanax SR tablety s prodlouženým uvolňováním Doporučená zahajovací dávka: 0,5-1 mg denně před spaním
Doporučená dávka: dávku je třeba upravit podle odpovědi pacienta. Dávka má být rozdělena do 1-2 dávek denně. Dávku je možné zvyšovat nejvýše o 1 mg každé 3-4 dny.
V klinických studiích byla průměrná podaná dávka 6±2 mg. Výjimečně byla u několika pacientů nutná dávka 10 mg denně.
LÉČBA STARŠÍCH NEBO OSLABENÝCH PACIENTŮ Xanax tablety
Doporučená zahajovací dávka: 0,25 mg 2-3x denně
Doporučená dávka: dávku je možné postupně upravit v závislosti na toleranci pacienta.
Xanax SR tablety s prodlouženým uvolňováním
Doporučená zahajovací dávka: 0,5-1 mg denně, rozdělené do 1-2 dávek
Doporučená dávka: 0,5-1 mg denně, dávku je možné zvýšit v závislosti na toleranci pacienta.
Obj eví-li se nežádoucí účinky, je nutné zahajovací dávku snížit.
UKONČENÍ LÉČBY
Dávky je nutno snižovat pozvolna. Doporučuje se snižovat denní dávku alprazolamu nejvýše o 0,5 mg každé 3 dny. U některých pacientů musí být snižování dávky ještě pomalejší (viz bod 4.4).
POUŽITÍ PŘÍPRAVKU XANAX SR
U přípravku Xanax SR je uvolňování alprazolamu opožděné. Tablety by neměly být žvýkány ani drceny, měly by být polykány v celku. Při dávkování 1x denně se doporučuje užívat tabletu ráno.
POUŽITÍ PŘÍPRAVKU XANAX 2 MG
Je-li třeba, tablety je možné rozpůlit nebo rozčtvrtit. Umístí se vydutou stranou na tvrdou podložku. Tlakem palce se rozdělí na 2 stejné části s obsahem 1 mg.

Je-li třeba, je možné dále tyto části rozdělit. Opět se umístí vydutou stranou na tvrdou podložku a tlakem palce se rozdělí - na 2 dílky s obsahem 0,5 mg.
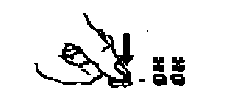
Tímto způsobem získáte následující dílky tablet přípravku Xanax:
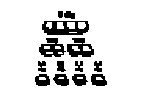
Tyto dílky je možné uchovávat ve speciálně upraveném uzávěru lahvičky, který ale není u všech balení této síly.
Pediatrická populace
Bezpečnost a účinnost alprazolamu u dětí a dospívajících mladších 18 let nebyla stanovena, proto se užití alprazolamu nedoporučuje.
4.3 Kontraindikace
Přípravek Xanax je kontraindikován u pacientů:
• s hypersenzitivitou na benzodiazepiny, léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• s myasthenia gravis
• s těžkou dechovou nedostatečností
• se syndromem spánkové apnoe
• s těžkou j aterní nedostatečností.
4.4 Zvláštní upozornění a opatření pro použití
U léčby pacientů s poruchou ledvinných funkcí nebo mírnou až středně těžkou poruchou jaterních funkcí je nutná opatrnost.
Panické poruchy byly u neléčených pacientů spojeny s velkými primárními nebo sekundárními depresemi a se zvýšeným počtem sebevražd. Proto jsou při podávání vyšších dávek přípravku Xanax nutná stejná opatření, jako při léčbě jinými psychotropními látkami, užívanými k léčbě pacientů trpících depresemi nebo pacientů s myšlenkami na sebevraždu nebo sebevraždu plánujících.
U pacientů s depresivní poruchou nebo úzkostí doprovázenou depresí, nesmí být k léčbě deprese samostatně předepsány benzodiazepiny nebo léky působící stejně jako benzodiazepiny, protože mohou urychlit, nebo zvýšit riziko sebevraždy. Proto musí být alprazolam užíván s opatrností, a rozsah předepisování u pacientů s příznaky depresivní poruchy nebo sebevražednými sklony by měl být minimální.
Bezpečnost a účinnost alprazolamu nebyla zjišťována u dětí a dospívajících mladších 18 let, proto se užití alprazolamu nedoporučuje.
Doporučuje se, aby bylo dodržováno používání nejnižších účinných dávek, zvláště u starších a oslabených pacientů, z důvodu zabránění vzniku ataxie či nadměrné sedace.
Zvláštní obezřetnosti je zapotřebí při předepisování benzodiazepinů pacientům se sklonem k zneužívání alkoholu nebo léků (viz bod Interakce s jinými léčivými přípravky a jiné formy interakce).
Závislost
Používání benzodiazepinů může vést ke vzniku návyku a emocionální/fyzické závislosti k těmto přípravkům. Riziko závislosti se zvyšuje s dávkou a délkou léčby; může být vyšší u pacientů s anamnézou zneužívání alkoholu či léků. Závislost na lécích se může vyskytnout i při doporučených dávkách a/nebo u pacientů bez rizikových faktorů. Zvýšené riziko závislosti na lécích se projevuje i při kombinované léčbě více benzodiazepiny, bez ohledu na anxiolytické nebo hypnotické indikace. Byly také hlášeny případy abúzu.
Příznaky z vysazení
Při rozvoji závislosti by náhlé vysazení léku mohlo vyvolat abstinenční příznaky. Ty mohou zahrnovat bolest hlavy, svalů, extrémní úzkost, napětí, neklid, zmatenost a podrážděnost. V závažných případech se mohou vyskytnout i: derealizace, depersonalizace, hyperakuzie, znecitlivění a brnění končetin, přecitlivělost na světlo, hluk a fyzický kontakt, halucinace, nebo epileptický záchvat.
Rebound úzkosti
Jedná se o přechodný syndrom po ukončení léčby, kdy se příznaky, kvůli kterým byla léčba benzodiazepiny zahájena, mohou objevit v závažnější podobě. Mohou být doprovázeny jinými reakcemi, zahrnujícími změny nálad, úzkost nebo poruchy spánku a neklid. Protože riziko vzniku příznaků z vysazení/rebound fenoménu je vyšší po náhlém ukončení léčby, doporučuje se postupné snižování dávky.
Délka léčby
Léčba by měla být, v závislosti na indikaci, co nejkratší (viz bod Dávkování a způsob podání) a nemá překročit 8-12 týdnů u léčby úzkosti, včetně období snižování dávky. Případnému prodloužení doby léčby musí předcházet vyhodnocení současného stavu pacienta.
Pacienta je vhodné informovat již na začátku léčby o její omezené délce, a přesně vysvětlit, jak bude dávka postupně snižována. Dále je nutné pacienta informovat o možnosti vzniku rebound fenoménu a tím minimalizovat obavy pacienta, pokud by se během ukončování léčby tyto příznaky vyskytly. Zdá se, že v případě benzodiazepinů s okamžitým účinkem, se mohou příznaky z vysazení projevit v rámci dávkovacího intervalu, zvláště při vysokém dávkování. Při použití benzodiazepinů s prodloužených účinkem, je nutné vyvarovat se výměny za benzodiazepiny s okamžitým účinkem, protože by se mohly vyskytnout příznaky z vysazení.
Amnézie
Benzodiazepiny mohou indukovat anterográdní amnézii. Tento stav se objevuje nejčastěji několik hodin po požití přípravku.
Psychiatrické a paradoxní účinky
Během užívání benzodiazepinů byly zaznamenány nežádoucí účinky: neklid, vzrušenost, podrážděnost, agresivita, deluze, zuřivost, noční můry, halucinace, psychózy, nevhodné chování a další poruchy chování. V těchto případech je vhodné vysazení benzodiazepinů. Pravděpodobněji se vyskytují u dětí a starších pacientů.
Tolerance
Po opakovaném užívání benzodiazepinů po dobu několika týdnů může dojít k částečné ztrátě hypnotického účinku.
Starší pacienti
Benzodiazepiny a podobné přípravky se mají u starších osob užívat s opatrností z důvodu rizika sedace a/nebo muskuloskeletární slabosti, která se může projevit pády, což má pro tuto populaci často závažné důsledky.
Tablety obsahují monohydrát laktosy. Pacienti se vzácnými dědičnými problémy s intolerancí galaktosy, nedostatkem laktasy nebo malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Benzodiazepiny mají aditivní účinek, jsou-li užívány současně s alkoholem a dalšími látkami s účinkem na CNS. Současné užívání alkoholu se nedoporučuje.
Alprazolam je nutné používat s opatrností při kombinaci s jinými látkami utlumujícími CNS. V případech souběžného podání s antipsychotiky (neuroleptiky), hypnotiky, anxiolytiky/sedativy, některými antidepresivy, opioidními analgetiky, antiepileptiky, anestetiky a sedativními H1-antihistaminiky může dojít ke zvýšení depresívního účinku. Zvláštní pozornost je nutné věnovat lékům s tlumivým účinkem na respirační funkci, jako jsou opioidy (analgetika, antitusika, substituční léčba), zvláště u starších pacientů. V případě opioidních analgetik může dojít i ke zvýšení euforie, což může vést až k psychické závislosti.
Farmakokinetické interakce mohou vzniknout, pokud je alprazolam podáván současně s léky, které ovlivňují jeho metabolizmus.
Inhibitory CYP3A
Léky, které inhibují určité jaterní enzymy (zejm. cytochrom P4503A4), mohou zvyšovat koncentraci alprazolamu a zesilovat tak jeho účinek. Výsledky několika klinických studií s alprazolamem, in vitro studií s alprazolamem, a klinických studií látek metabolizovaných podobně jako alprazolam poskytují důkaz o různých stupních interakcí a možných interakcích alprazolamu a dalších látek. Podle stupně interakce a typu dostupných údajů byla vytvořena následující doporučení:
• Není doporučeno společné podávání alprazolamu a ketokonazolu, itrakonazolu nebo jiných azolových antimykotik.
• Souběžné podání nefazodonu nebo fluvoxaminu zvyšuje AUC alprazolamu přibližně 2x. Pokud je alprazolam podáván spolu s nefazodonem, fluvoxaminem a cimetidinem, je doporučena opatrnost a případné snížení dávky.
• Při podávání alprazolamu současně s fluoxetinem, propoxyfenem, perorálními kontraceptivy, diltiazemem nebo makrolidovými antibiotiky jako erythromycin, klarithromycin, troleandomycin a telithromycin, je nutná opatrnost.
• Při podávání alprazolamu současně s digoxinem byly hlášeny zvýšené koncentrace digoxinu, zvláště u starších pacientů (starších 65 let). Pacienti užívající alprazolam a digoxin musí být proto sledováni pro možné příznaky toxicity digoxinem.
Induktorv CYP3A
Vzhledem k tomu, že je alprazolam metabolizován přes CYP3A4, induktory tohoto enzymu mohou zvýšit metabolizmus alprazolamu.
Interakce mezi inhibitory HIV-proteázy (např. ritonavir) a alprazolamem jsou složité a závislé na trvání interakce. Krátkodobé nízké dávky ritonaviru způsobily významné snížení clearance alprazolamu, prodloužený poločas a zvýšený klinický účinek. Po delší expozici ritonaviru je ale tato inhibice rušena indukcí CYP3A. Tato interakce vyžaduje úpravu dávky nebo ukončení léčby alprazolamem.
4.6 Fertilita, těhotenství a kojení
Údaje o teratogenitě a účincích na postnatální vývoj a chování po užití benzodiazepinů nejsou konzistentní. Rozsáhlé údaje z kohortových studií indikují, že expozice benzodiazepinu v prvním trimestru nemá za následek zvýšené riziko významných malformací. Nicméně z některých epidemiologických studií vyplývá dvojnásobné riziko rozštěpu rtu (méně než 2/1000 novorozenců).
Při podání benzodiazepinů ve vysokých dávkách, během 2. a 3. trimestru, došlo ke snížení aktivních pohybů plodu a kolísavosti srdečního rytmu plodu.
Pokud je z klinických důvodů nutná léčba v posledním trimestru, i při nízkých dávkách, je možné pozorovat „floppy infant syndrom“, jako je axiální hypotonie nebo potíže se sáním, vedoucí k nízké hmotnosti. Tyto příznaky jsou reverzibilní, ale mohou trvat 1 -3 týdny, v závislosti na poločasu přípravku. Při vysokých dávkách se může u novorozenců objevit dechová deprese nebo apnoe a hypotermie. Navíc mohou být u novorozence několik dnů po narození pozorovány příznaky z vysazení doprovázené hyperexcitabilitou, vzrušeností a třesem, i v případech, kdy „floppy infant syndrom“ nebyl pozorován. Objevení se příznaků z vysazení po narození závisí na poločasu látky.
Alprazolam nesmí být během těhotenství užíván, není-li to vzhledem ke stavu pacientky nezbytné. Je-li alprazolam užíván během těhotenství, nebo pacientka v průběhu léčby otěhotní, musí být poučena o rizicích pro plod.
Je-li přípravek podáván během poslední fáze těhotenství, je nutné se vyvarovat podání vysokých dávek, a u novorozence je nutné monitorovat případný „floppy infant syndrom“ či abstinenční syndrom.
Kojení
Hladiny alprazolamu vylučované do mateřského mléka jsou nízké. Kojení nicméně není v průběhu léčby alprazolamem doporučeno.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost řídit a obsluhovat stroje může být negativně ovlivněna sedací, amnézií, poruchou koncentrace a poruchou funkce svalů. V případě nedostatku spánku může být zvýšena pravděpodobnost zhoršení pozornosti (viz bod Interakce s jinými léčivými přípravky a jiné formy interakce).
4.8 Nežádoucí účinky
Následující nežádoucí účinky byly pozorovány a hlášeny u pacientů užívajících alprazolam v kontrolovaných klinických studiích a na základě zkušeností po uvedení na trh s četností: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1 000 až <1/100); vzácné (>1/10 000 až <1/1 000); velmi vzácné (<1/10 000), není známo (z dostupných dat nelze určit).
|
Třídy orgánových systémů | ||
|
Endokrinní poruchy |
Není známo |
Hyperprolaktinemie* |
|
Poruchy metabolizmu a výživy |
v Časté |
Snížení chuti k jídlu |
|
Psychiatrické poruchy |
Velmi časté | |
|
v Časté |
Zmatenost, dezorientace, snížení libida, úzkost, nespavost, nervozita, zvýšení libida | |
|
Méně časté |
Mánie* (viz bod 4.4), halucinace, zuřivost*, agitovanost* | |
|
Není známo |
Hypománie*, agrese, nepřátelské chování*, abnormální myšlení*, psychomotorická hyperaktivita* | |
|
Poruchy nervového systému |
Velmi časté |
Sedace, ospalost, ataxie, porucha paměti, nezřetelná řeč, závrať, bolest hlavy |
|
v Časté |
Porucha rovnováhy, porucha koordinace, porucha soustředění, točení hlavy, hypersomnie, letargie, třes | |
|
Méně časté |
Amnézie | |
|
Není známo |
Autonomní nerovnováha nervového systému*, dystonie* | |
|
Poruchy oka |
v Časté |
Rozmazané vidění |
|
Gastrointestinální poruchy |
Velmi časté |
Zácpa, sucho v ústech |
|
v Časté | ||
|
Méně časté | ||
|
Poruchy jater a žlučových cest |
Není známo |
Hepatitida*, změna funkce jater*, žloutenka* |
|
Poruchy kůže a podkožní tkáně |
v Časté |
Dermatitida* |
|
Není známo |
Angioedém*, fotosenzitivní reakce* | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Svalová slabost |
|
Poruchy ledvin a močových cest |
Méně časté |
Inkontinence* |
|
Není známo |
Retence moči* | |
|
Poruchy reprodukčního systému a |
v Časté |
Sexuální dysfunkce* |
|
prsu |
Méně časté |
Nepravidelná menstruace* |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava, podrážděnost |
|
Není známo |
Periferní edém* | |
|
Vyšetření |
v Časté |
Snížení tělesné hmotnosti, zvýšení tělesné hmotnosti |
|
Není známo |
Zvýšení nitroočního tlaku* |
*nežádoucí účinky pozorované po uvedení na trh
Užívání přípravku (i v terapeutických dávkách) může vést k rozvoji fyzické závislosti: ukončení léčby může vést ke vzniku abstinenčních příznaků nebo rebound fenoménu.
Může se vyskytnout i psychická závislost. Bylo rovněž hlášeno zneužívání benzodiazepinů (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adrese:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Pokud není alprazolam kombinován s jinými látkami tlumícími CNS (včetně alkoholu), nepředstavuje předávkování, podobně jako u jiných benzodiazepinů, hrozbu.
Při léčbě předávkování u kteréhokoli léčivého přípravku je nutné vzít v úvahu, že mohly být užity i další léky.
Po předávkování perorálními benzodiazepiny je v případě, že je pacient při vědomí, vhodné vyvolat zvracení (během 1 hodiny), v opačném případě se doporučuje výplach žaludku s kontrolou dýchacích cest. Není-li vyprázdnění žaludku vhodné, lze podat aktivní uhlí pro snížení absorpce. Zvláštní pozornost je třeba věnovat respiračním a kardiovaskulárním funkcím.
Předávkování benzodiazepiny je obvykle provázeno několika stupni deprese CNS, od ospalosti po kóma. V lehčích případech zahrnují symptomy ospalost, mentální zmatenost a letargii, ve vážnějších případech až ataxii, hypotonii, hypotenzi, dechovou depresi, vzácně kóma a velmi vzácně úmrtí.
Jako antidotum lze užít flumazenil.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: anxiolytika, alprazolam, ATC kód: N05BA12
Alprazolam obsahuje triazolobenzodiazepin. Benzodiazepiny mají kvalitativně podobné vlastnosti: anxiolytický, hypnosedativní, myorelaxační a antikonvulzivní účinky. V jejich farmakodynamických vlastnostech však existují kvantitativní rozdíly, které tyto látky předurčují k různým typům terapeutických použití.
V současnosti panuje obecná shoda, že účinek benzodiazepinů je výsledkem potenciace nervové inhibice zprostředkované kyselinou gama-aminomáselnou (GABA).
5.2 Farmakokinetické vlastnosti
XANAX tablety
Maximální plazmatické koncentrace je dosaženo za jednu až dvě hodiny po perorálním podání.
XANAX SR tablety s prodlouženým uvolňováním
Po požití přípravku Xanax tablety s prodlouženým uvolňováním nebo Xanax tablety je biologická dostupnost alprazolamu identická, nicméně alprazolam je absorbován mnohem pomaleji z přípravku Xanax tablety s prodlouženým uvolňováním. V důsledku toho je maximální plazmatická koncentrace asi poloviční ve srovnání s maximální plazmatickou koncentrací po podání stejné dávky přípravku Xanax tablety. Maximální plazmatické hladiny alprazolamu jsou dosaženy mezi 5 a 11 hodinami po požití. To je způsobeno faktem, že plazmatická koncentrace alprazolamu je během této doby relativně stálá. Farmakokinetika je lineární až do dávky 10 mg. Poločas rozpadu a koncentrace metabolitů jsou přibližně stejné pro oba typy tablet, což ukazuje, že metabolismus a vylučování obou typů tablet jsou shodné. Po požití přípravku Xanax tablety s prodlouženým uvolňováním každých 12 hodin nebo požití stejné dávky přípravku Xanax tablety rozdělené na 4 podání denně, jsou maximální a minimální koncentrace během ustáleného stavu stejné.
ALPRAZOLAM
Eliminační poločas alprazolamu je mezi 12 až 15 hodinami a je průměrně 16 hodin u starších pacientů. Alprazolam je hlavně oxidován. Hlavními metabolity alprazolamu jsou alfa-hydroxy-alprazolam a benzofenonový derivát alprazolamu. Plazmatické hladiny těchto metabolitů jsou extrémně nízké. Biologická aktivita alfa-hydroxy-alprazolamu je asi poloviční oproti alprazolamu. Jejich poločasy rozpadu se zdánlivě pohybují ve stejném řádu jako poločas rozpadu alprazolamu. Benzofenonový metabolit je téměř inaktivní. Alprazolam a jeho metabolity se převážně vylučují močí. In vitro je 80% alprazolamu vázáno na sérové proteiny.
5.3 Předklinické údaje vztahující se k bezpečnosti
Mutageneze, kancerogeneze, fertilita a oční účinky
Alprazolam nebyl v in vitro Amesově testu mutagenní. Alprazolam nevyvolal chromozomální aberace v in vivo mikrojadérkovém testu u potkanů v nejvyšší dávce až 100 mg/kg, což je 500x více než maximální doporučená dávka u člověka (10 mg/den).
Dvouleté bioeseje alprazolamu u potkanů v dávkách až 30 mg/kg/den (150x vyšší než maximální doporučená dávka pro člověka - 10 mg/den) a myší v dávkách až 10 mg/kg/den (50x vyšší než maximální doporučená dávka pro člověka - 10 mg/den) nepřinesly průkaz o kancerogenních účincích.
Alprazolam nepoškozoval fertilitu u potkanů až do nejvyšší dávky 5 mg/kg/den (25x vyšší než maximální doporučená dávka pro člověka - 10 mg/den).
Podávání alprazolamu potkanům po dobu 2 let v dávkách 3, 10 a 30 mg/kg/den (15-150x vyšší než maximální doporučená dávka pro člověka - 10 mg/den) mělo za následek trend zvýšení incidence katarakty (u samic) a vaskularizace rohovky (u samců), které bylo závislé na dávce. Léze nebyly až do 11. měsíce léčby patrné.
6. FARMACEUTICKÉ INFORMACE
6.1 Seznam pomocných látek XANAX 0,25 mg, 0,5 mg, 1 mg, 2 mg:
Mikrokrystalická celulosa, monohydrát laktosy, magnesium-stearát, kukuřičný škrob, sodná sůl dokusátu s natrium-benzoátem, koloidní bezvodý oxid křemičitý. Tablety 0,5 mg obsahují barvivo hlinitý lak erythrosinu (E127). Tablety 1 mg obsahují barvivo hlinitý lak erythrosinu (E127) a indigokarmín (E132).
XANAX SR 0,5 mg, 1 mg, 2 mg:
Monohydrát laktosy, hypromelosa 2208/4000 a 2208/100, koloidní bezvodý oxid křemičitý, magnesium-stearát. Tablety 0,5 mg a 2 mg obsahují barvivo hlinitý lak indigokarmínu (E132).
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
XANAX: 3 roky
XANAX SR: 2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
XANAX tablety 0,25 mg, 0,5 mg a 1 mg: Al blistr, krabička
Velikost balení: 30 a 100 tablet
XANAX tablety 2 mg: hnědá skleněná lékovka s bezpečnostním LDPE víčkem (víčko může nebo nemusí být opatřeno prostorem pro uložení rozdělených tablet), krabička.
Velikost balení: 50 a 100 tablet
XANAX SR tablety 0,5 mg, 1 mg a 2 mg: Al blistr, krabička
Velikost balení: 30 tablet
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer spol. s r.o., Stroupežnického 17, 150 00 Praha 5, Česká republika
8. REGISTRAČNÍ ČÍSLA
XANAX 0,25 mg: 70/214/85-A/C XANAX 0,5 mg: 70/214/85-B/C XANAX 1 mg: 70/214/85-C/C XANAX 2 mg: 70/214/85-D/C
XANAX SR 0,5 mg: 70/735/95-A/C XANAX SR 1 mg: 70/735/95-B/C XANAX SR 2 mg: 70/735/95-C/C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE XANAX
Datum první registrace: 3. 12. 1985
Datum posledního prodloužení registrace: 25. 4. 2012
XANAX SR
Datum první registrace: 13. 9. 1995
Datum posledního prodloužení registrace: 25. 4. 2012
10. DATUM REVIZE TEXTU
5.4.2016