Vizamyl 400 Mbq/Ml
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
VIZAMYL 400 MBq/ml, injekční roztok.
2. kvalitativní a kvantitativní složení
Jeden ml injekčního roztoku obsahuje 400 MBq flutemetamolum (18F) k referenčnímu datu a hodině.
Aktivita jedné injekční lahvičky k referenčnímu datu a hodině leží v rozmezí od 400 MBq do 4000 MBq, nebo od 400 MBq do 6000 MBq.
Fluor (18F) s poločasem rozpadu přibližně 110 minut se rozpadá na stabilní kyslík (18O) emisí pozitronového záření o energii 634 keV; následuje anihilace za vzniku fotonů o energii 511 keV.
Pomocné látky se známým účinkem:
Jeden ml roztoku obsahuje 55,2 mg ethanolu a 4,1 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
Čirý bezbarvý až nažloutlý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Tento přípravek je určen pouze k diagnostickým účelům.
VIZAMYL je radiofarmakum indikované k pozitronové emisní tomografii (PET) pro zobrazení hustoty P-amyloidních neuritických plaků v mozku dospělých pacientů s kognitivními poruchami, kteří jsou vyšetřováni na Alzheimerovu nemoc (AD) a jiné příčiny kognitivních poruch. VIZAMYL je třeba používat ve spojení s klinickým hodnocením.
Negativní snímek indikuje ojedinělé nebo žádné plaky, což neodpovídá diagnóze AD. Pokud jde o omezení při interpretaci pozitivního snímku, viz body 4.4 a 5.1.
4.2 Dávkování a způsob podání
PET vyšetření s použitím futemetamolu (18F) má indikovat lékař se zkušeností s klinickým vyšetřováním a léčbou neurodegenerativních poruch.
Snímky pořízené za použití přípravku VIZAMYL smí interpretovat pouze pracovník vyškolený v interpretaci PET snímků s futemetamolem (18F). V případě nejisté lokalizace šedé hmoty a rozhraní mezi šedou a bílou hmotou na PET snímku se doporučuje s PET zobrazením zároveň zaznamenat aktuální sken pacienta zobrazený počítačovou tomografií (CT) nebo magnetickou rezonancí (MR) a získat tak kombinovaný snímek PET-CT nebo PET-MR (viz bod 4.4 Interpretace snímků s přípravkem VIZAMYL).
Dávkování
Dospělí
Doporučená aktivita pro dospělého je 185 MBq flutemetamolu (18F) podaného intravenózně (jako bolus injikovaný zhruba 40 sekund). Objem injekce nemá být menší než 1 ml a nemá být větší než 10 ml.
Speciální populace
Nebyly provedeny žádné rozsáhlé studie rozsahu a úpravy dávkování přípravku u zdravé populace ani u zvláštních skupin pacientů. Farmakokinetika flutemetamolu (18F) nebyla u pacientů s poruchou ledvinných nebo jaterních funkcí popsána.
Starší osoby
Žádná úprava dávky kvůli věku není doporučena.
Porucha ledvinných a jaterních funkcí
U pacientů s významnou poruchou ledvinných nebo jaterních funkcí nebyl přípravek VIZAMYL studován. Je třeba důkladně uvážit podávanou aktivitu, protože u těchto pacientů může být zvýšená radiační expozice (viz bod 4.4).
Pediatrická populace
Neexistuje žádné relevantní použití přípravku VIZAMYL u pediatrické populace.
Způsob podání
VIZAMYL je určen k intravenóznímu podání.
Aktivitu flutemetamolu (18F) je nutné změřit bezprostředně před injekcí kalibrovaným měřičem aktivity.
Při injekci přípravku VIZAMYL krátkým intravenózním katetrem (zhruba 12,5 cm nebo kratším) se minimalizuje případná adsorpce léčivé látky na katetr.
VIZAMYL je určen k podání ve více dávkách. Přípravek se nesmí ředit.
Dávka se podává intravenózní injekcí jako bolus po dobu přibližně 40 sekund. Pokud se používá intravenózní linka, následuje po injekci k zajištění dokonalého podání dávky intravenózní proplach 5 ml až 15 ml sterilního injekčního roztoku chloridu sodného o koncentraci 9 mg/ ml (0,9 %).
Injekce flutemetamolu (18F) musí být podána intravenózně, aby se zabránilo ozáření v důsledku lokální extravazace, ale i artefaktům v zobrazení.
Pořízení snímku
Snímky s přípravkem VIZAMYL je třeba začít pořizovat 90 minut po injekci pomocí PET skeneru v 3D režimu s adekvátní korekcí dat. Uložte pacienta na záda tak, aby pacientův mozek (včetně mozečku) byl v jednom zorném poli. Pacientovu hlavu je třeba naklonit tak, aby při uložení hlavy do vhodné podložky rovina přední komisura-zadní komisura (ACPC) svírala pravé úhly s průnikovou osou PET skeneru. Pohyb hlavy lze omezit páskou nebo jiným flexibilním zařízením.
Doporučuje se iterativní rekonstrukce nebo rekonstrukce filtrované zpětné projekce při tloušťce řezu od 2 do 4 mm a velikosti axiální matrice 128 x 128 s velikostí pixelů zhruba 2 mm. Tam, kde se používá filtr k dodatečnému vyhlazení, se doporučuje plná šířka v polovině maxima (FWHM) nanejvýš 5 mm; doporučený filtr FWHM se volí tak, aby byl optimalizován poměr signálu k šumu a současně se zachovala ostrost rekonstruovaného obrazu. Délka snímkování bývá obvykle 20 minut.
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Možnost hypersenzitivity nebo anafylaktických reakcí
Pokud se projeví hypersenzitivita nebo anafylaktická reakce, je třeba podávání přípravku okamžitě ukončit a podle situace zahájit intravenózní léčbu. Aby bylo možno v akutním případě provést okamžitý zákrok, musí být snadno přístupné potřebné léky a zařízení, jako je endotracheální trubice a ventilátor.
Odůvodněnost z hlediska poměru přínosů a rizik
U každého pacienta musí být radiační expozice odůvodněná očekávaným přínosem. Podaná aktivita by měla být v každém případě co nejnižší, ale aby zároveň byla dostatečná k získání potřebných diagnostických informací.
Porucha ledvinných a jaterních funkcí
U těchto pacientů je třeba důkladně zvážit poměr přínosů vůči riziku, protože může dojít ke zvýšené radiační expozici. Flutemetamol (18F) je vylučován zejména hepatobiliárním systémem a u pacientů s poruchou jaterních funkcí existuje možnost zvýšené radiační expozice. Viz bod 4.2.
Pediatrická populace
Informace o použití u dětí naleznete v bodech 4.2 nebo 5.1.
Interpretace snímků s přípravkem VIZAMYL
Snímky pořízené za použití přípravku VIZAMYL smí interpretovat pouze pracovník vyškolený v interpretaci PET snímků s flutemetamolem (18F). Negativní snímek znamená žádnou nebo velmi malou hustotu P-amyloidních neuritických plaků. Pozitivní snímek znamená střední nebo vysokou hustotu. Byly zaznamenány interpretační chyby při odhadování hustoty P-amyloidních neuritických plaků v mozku včetně falešně negativních a falešně pozitivních interpretací.
PET snímky by měly být interpretovány pomocí barevné stupnice Sokoloff, Rainbow nebo Spektrum.. Interpretující pracovník musí porovnat intenzitu signálu šedé hmoty kortexu s maximální intenzitou signálu bílé hmoty. Snímky je nutné prohlížet systematicky (obr. 1), začíná se na úrovni Varolova mostu (p) a následně se postupuje směrem nahoru přes:
- frontální laloky a přední cingulum (f, ac, axiální pohled),
- zadní cingulum a precuneus (pc, sagitální pohled),
- temporo-parietální aspekty, včetně insuly (in, axiální pohled a tp-in, koronální pohled),
- laterální temporální laloky (lt, axiální pohled),
- striatální oblast (s, axiální pohled).
Interpretace snímků se provádí vizuálně porovnáním aktivity v kortikální šedé a sousední bílé hmotě.
- Oblast se považuje za oblast s negativním (normálním) charakterem, pokudje signál indikační látky v kortikálních oblastech nízký (tj. jednoznačně nižší intenzita signálu oproti okolní bílé hmotě a podobná intenzita jako v oblastech mozečku bohatých na šedou hmotu). V oblastech snímků, kde se vyskytuje šedá hmota, nebude signál zcela chybět, protože okraje okolních oblastí bílé hmoty se kvůli efektům částečného objemu (PVE) při PET snímkování „rozpíjejí“ do oblastí šedé hmoty.
- Oblast se považuje za pozitivní (abnormální), pokud je signál indikační látky v k ortikálních oblastech vysoký (tj. přibližně stejně intenzivní nebo intenzivnější než okolní bílá hmota a vyšší než oblasti mozečku bohaté na šedou hmotu).
- Pokud je některá z těchto oblastí zjevně pozitivní (abnormální), je třeba snímek hodnotit jako
pozitivní (abnormální). Jinak se hodnotí jako negativní (normální).
V mnoha oblastech mozku může být přítomna atrofie, která ztěžuje interpretaci snímku, protože úbytek šedé hmoty má za následek sníženou akumulaci indikační látky, kvůli čemuž je těžší rozpoznat pozitivní snímek. Důrazně se doporučuje využít při interpretaci snímku s použitím přípravku VIZAMYL jako pomocné reference také snímky MR nebo CT (jsou-li k dispozici), zvláště při podezření na atrofii.
Obr. 1
Příklady PET snímků s použitím přípravku VIZAMYL - negativní PET snímek s flutemetamolem (18F) (vlevo) a pozitivní snímek (vpravo). Na obrázku je axiální pohled (první řada), sagitální pohled (druhá řada) a koronální pohled (třetí řada).
Positive scan
Negative scan
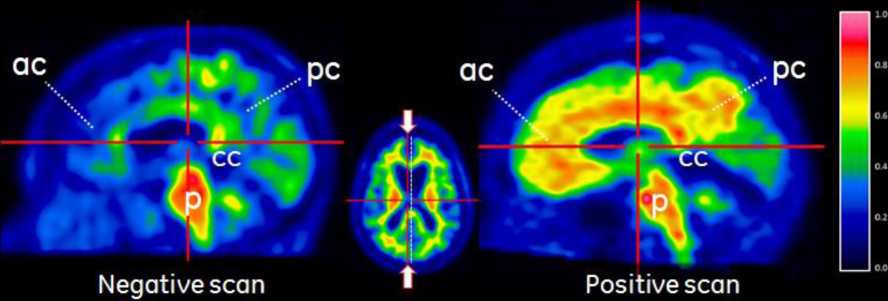
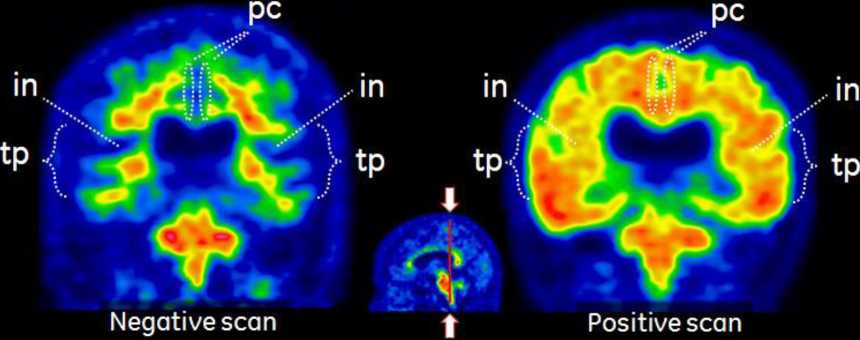
Obrázek 1. Pohled na axiální (a), sagitální (b) a koronální (c) řez negativního (vlevo) a pozitivního (vpravo) skenu s flutemetamolem (18F). Na negativních obrazech je možné pozorovat rozhraní sulků a bílé hmoty gyrů. Rozhraní sulků a bílé hmoty gyrů není rozeznatelné na pozitivních obrazech vpravo. Všimněte si, že intenzita je větší (> 60 % maxima) v oblastech šedé hmoty na pozitivních obrazech v porovnání s negativními obrazy a intenzita vyzařuje k ostře ohraničenému konvexnímu okraji laterálních částí mozku. Negativní obrazy ukazují klesající intenzitu k periferii tkáně. Všimněte si také mediálních oblastí, které vykazují vyšší úrovně intenzity v šedé hmotě na pozitivních obrazech vpravo. Vysvětlivky: Šedá hmota - f frontální a ac přední cingulum, pc zadní cingulum a precuneus, lt laterální temporální, tp temporo-parietální a in insula a s striatum. Bílá hmota - p pons a cc corpus callosum.
Omezení použitelnosti
Pozitivní snímek nepředstavuje nezávislou diagnózu AD ani jiné kognitivní poruchy, protože ukládání neuritických plaků v šedé hmotě se může vyskytovat u asymptomatických starších pacientů i u osob s neurodegenerativními demencemi (Alzheimerova choroba, ale také demence s Lewyho tělísky nebo s Parkinsonovou chorobou).
Pro omezení použitelnosti u pacientů s mírnou kognitivní poruchou (MCI) - viz bod 5.1.
Účinnost flutemetamolu (18F) při prognóze vývoje AD nebo při sledování odpovědi na terapii nebyla stanovena (viz bod 5.1).
Některé snímky se mohou kvůli šumu snímku, atrofii se ztenčeným pásem kortexu nebo rozostření interpretovat obtížně a může docházet i k interpretačním chybám. V případech, kde není jisté, kde se na PET snímku nachází šedá hmota a hranice mezi šedou a bílou hmotou, a kde je k dispozici společně zaznamenaný aktuální CT nebo MR snímek, by měl interpretující pracovník prozkoumat fúzovaný PET-CT nebo PET-MR snímek, aby si ujasnil vztah mezi PET radioaktivitou a anatomií šedé hmoty.
Po výkonu
Během prvních 24 hodin po injekci je třeba omezit úzký kontakt pacienta s malými dětmi a těhotnými ženami.
Zvláštní upozornění
Tento léčivý přípravek obsahuje 7 objemových procent ethanolu (alkoholu), tj. až 552 mg (přibližně 0,7 ml) v jedné dávce. Toto množství může být škodlivé pro osoby závislé na alkoholu. Musí se brát v úvahu u těhotných nebo kojících žen a také u vysoce rizikových skupin, jako jsou pacienti s onemocněním jater nebo s epilepsií.
Tento léčivý přípravek obsahuje v jedné dávce až 1,8 mmol (41 mg) sodíku. To je třeba vzít v úvahu v případě pacientů s dietou s nízkým obsahem sodíku.
Pro bezpečnostní opatření s ohledem na nebezpečí ohrožení životního prostředí - viz bod 6.6.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Na pacientech nebyly provedeny žádné farmakodynamické studie interakcí léků, aby se zjistilo, zda a nakolik může souběžná medikace pozměnit výsledky zobrazování pomocí přípravku VIZAMYL.
Nebyly provedeny ani žádné studie interakcí in vivo.
In vitro vazebné studie neprokázaly žádný vliv jiných běžných léčivých přípravků, které pacienti s AD používají, na vazbu flutemetamolu (18F) na P-amyloidové plaky.
Ženy, které mohou otěhotnět
Pokud se má radiofarmakum podat ženě, která může otěhotnět, je třeba nejprve zjistit, zda není těhotná. Ženu, u které vynechala menstruace, je třeba považovat za těhotnou, dokud se neprokáže opak. V případě nejistoty, zda žena není těhotná (vynechala jí menstruace, doba menstruace je nepravidelná apod.), je třeba pacientce nabídnout jinou metodu, kde se nepoužívá ionizující záření (pokud taková metoda existuje).
U těhotných žen nebyly provedeny žádné studie. Ani na zvířatech nebyly provedeny žádné studie ke zjištění účinků flutemetamolu (18F) na rozmnožování (viz bod 5.3).
Každý výkon za použití radionuklidu, který je provedený u těhotné ženy, je spojen s ozářením plodu. Proto se během těhotenství pacientky smí provádět jen takové zásadní vyšetření, jehož očekávaný přínos vysoce převyšuje rizika, která výkon pro matku a plod představuje.
Kojení
Není známo, zda se při kojení flutemetamol (18F) vylučuje do mateřského mléka. Předtím, než bude kojící matce podáno radiofarmakum, je třeba zvážit možnost odložit podání radionuklidu do doby, kdy žena již nebude kojit, a rozhodnout, které radiofarmakum je s ohledem na vylučování aktivity do mateřského mléka nejvhodnější. Pokud se podání považuje za nezbytné, je třeba kojení na 24 hodin přerušit a již vyloučené mléko zlikvidovat.
Během prvních 24 hodin po injekci je třeba omezit úzký kontakt pacienta s malými dětmi.
Fertilita
Žádné studie zaměřené na fertilitu nebyly provedeny.
4.7 Účinky na schopnost řídit a obsluhovat stroje
VIZAMYL nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
VIZAMYL může ovšem způsobovat přechodné závratě a vertigo. Z tohoto důvodu se doporučuje, aby pacienti po podání přípravku VIZAMYL neřídili dopravní prostředky, neobsluhovali složitější stroje ani se nepodíleli na jiné potenciálně nebezpečné činnosti, dokud tyto účinky zcela nevymizí.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Celkový bezpečnostní profil přípr avku VIZAMYL vychází z dat o jeho podání 831 osobám.
Tabelární seznam nežádoucích účinků
Y
Četnost nežádoucích účinků se označuje takto:
Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000), velmi vzácné (<1/10 000) a není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky seřazeny v pořadí klesající závažnosti.
Nežádoucí účinky jsou uvedeny v tabulce 1 níže:
Tabulka 1 Přehled nežádoucích účinků
|
Třída orgánových systémů |
Časté |
Méně časté |
|
Poruchy imunitního systému |
Anafylaktoidní reakce | |
|
Psychiatrické poruchy |
Úzkost | |
|
Poruchy nervového systému |
Závrať Bolest hlavy Hypestezie Hypotonie |
|
Třída orgánových systémů |
Časté |
Méně časté |
|
Dysgeuzie (poruchy chuti) Třes | ||
|
Poruchy oka |
Otoky očí | |
|
Poruchy ucha a labyrintu | ||
|
Srdeční poruchy |
Palpitace | |
|
Cévní poruchy |
Návaly (zrudnutí) |
Bledost |
|
Respirační, hrudní a mediastinální poruchy |
Dyspnoe Hyperventilace Podráždění hrdla | |
|
Gastrointestinální poruchy |
Nepříjemný pocit v oblasti břicha Diskomfort v dutině ústní | |
|
Poruchy kůže a podkožní tkáně |
Hypestezie v obličeji Pruritus Vyrážka Napětí kůže Otok obličeje | |
|
Poruchy svalové a kosterní soustavy a poruchy pojivové tkáně |
Bolesti zad Svalové napětí Bolesti svalů a kostí | |
|
Poruchy reprodukčního systému a prsu |
Erektilní dysfunkce | |
|
Celkové poruchy a reakce v místě aplikace |
Bolest na hrudi Pocit horka Asténie Únava Pocit nepohody Pocit chladna Bolest v místě infuze Otok Pyrexie | |
|
Vyšetření |
Zvýšený krevní tlak |
Snížená hladina glukózy v krvi Zvýšená hladina laktátdehydrogenázy v krvi Zvýšený počet neutrofílů Zvýšená dechová frekvence |
Expozice ionizujícímu záření může vyvolat nádorové onemocnění a případně dědičné vady. Při podávání maximální doporučené aktivity flutemetamolu (18F) 185 MBq je efektivní dávka přibližně
5,9 mSv. Je málo pravděpodobné, že by k těmto nežádoucím účinkům došlo.
Popis vybraných nežádoucích účinků
Jako symptomy a znaky hypersenzitivity na VIZAMYL nebo některou jeho pomocnou látku (viz bod 6.1) se mohou objevit tyto nežádouc í účinky: otok očí/tváře, bledost, dyspnoe, podráždění hrdla, zvracení, vyrážka, pruritus, napětí kůže, pocit svírání hrudníku (viz také bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Vzhledem k malému množství flutemetamolu (18F) v jedné dávce se neočekává, že by předávkování mělo nějaké farmakologické účinky. V případě radiačního předávkování pacienta je nutné zredukovat absorbovanou dávku (je-li to možné) zvýšením eliminace radionuklidu z organismu častým vyprazdňováním (moč i stolice). Může být užitečné odhadnout účinnou dávku, jež byla aplikována.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: diagnostické radiofarmakum, centrální nervový systém, ATC kód: V09AX04
Mechanismus účinku
Flutemetamol (18F) se váže na P-amyloidní neuritické plaky v mozku.
In vitro se flutemetamol (18F) váže na P-amyloidní neuritické plaky v mozku při zanedbatelném vázání na neurofibrilární klubka. Data naznačují, že flutemetamol (18F) je schopný značit korová a difúzní P-amyloidní ložiska a neuritické plaky. Neexistuje žádný důkaz o tom, že by se flutemetamol (18F) vázal na rozpustné formy Abeta.
In vivo byla u pacientů na konci života hodnocena kvantitativní korelace mezi vychytáváním flutemetamolu (18F) v šedé kortikální hmotě a celkovou P-amyloidní zátěží v pitevních vzorcích za použití antiamyloidní protilátky 4G8, která barví P-amyloid jak v neuritických, tak v difuzních placích In vivo může flutemetamol (18F) detekovat P-amyloidní difuzní plaky, jsou-li časté. In vivo zůstává vazba flutemetamolu (18F) na jiné struktury P-amyloidu nebo jiné mozkové struktury nebo receptory neznámá.
Farmakodynamické účinky
Při nízkých koncentracích, přítomných ve VIZAMYLu nemá flutemetamol (18F) detekovatelnou farmakodynamickou aktivitu.
Vychytávání a distribuce flutemetamolu (18F) v mozku nebyly hodnoceny ve specifické studii zaměřené na hodnocení farmakodynamiky. Ve dvou podobných studiích biodistribuce a ve fázi II klinické studie se průměrné kvantitativní hodnoty vychytávání v zobrazeních PET lišily mezi subjekty pAD a HV ve většině vyšetřovaných oblastí mozku.
Klinická účinnost
Pivotní studie u 68 pacientů na konci života byla zaměřena na stanovení diagnostických možností flutemetamolu (18F) k detekci hustoty kortikálních neuritických plaků. Výsledky získané vyšetřením PET byly porovnány s hustotou neuritického plaku hodnocené (měřené) v osmi předem definovaných řezech mozku při pitvě pacientů. Zahrnuté oblasti histopatologie nebyly striktně omezeny na oblasti podle CERAD. Kognitivní stav pacientů nebyl stanoven. U 68 pacientů byly hodnoc eny 5 lékaři zaslepené PET snímky, u nichž byla, ve většině případů, senzitivita 86 % (95 % CI: 72 % - 95 %) a specificita 92 % (95 % CI: 74 % - 99 %).
Senzitivita a specificita pro odhad depozice flutemetamolu (18F) v P-amyloidních placích byla dále hodnocena v jedné další studii, ve které 5 jiných na počítači vyškolených hodnotitelů posuzovalo zaslepené elektronické nálezy u týchž 68 sledovaných pacientů, u kterých byla v pivotní studii provedena pitva. Byla použita histopatologie z pivotní studie. U většiny hodnotitelů byla senzitivita 93 % (95 % CI: 81 % - 99 %) a specificita 84 % (95 % CI: 64 % - 96 %).
Ve studii, kde k datům pacientů z pivotní studie přibyla data dalších 38 pitvaných pacientů (tj. 106 celkem), byla senzitivita detekce hustoty středně častých P-amyloidních neuritických plaků v primární analýze 91 % (95 % CI: 82 % - 96 %) a specificita 90 % (95 % CI: 74 % - 98 %) na základě většiny
hodnotitelů, tj. shody alespoň 3 z 5 odborníků po vzdělání v hodnocení nálezů na počítači.
V sekundární analýze, která využila standard pravdy založený na oblasti maxima neuritických plaků zahrnutých ve třech neokortikálních oblastech původně doporučených CERAD, byla citlivost 92 %
(95 % CI: 83 % - 97 %) a specificita 88 % (95 % CI: 71 % - 97 %).
V longitudinální studii podstoupilo 232 pacientů s klinicky diagnostikovanou amnestickou mírnou kognitivní poruchou (aMCI) vyšetření PET flutemetamolem (18F). Byli klinicky sledováni po dobu až 36 měsíců pro zhodnocení vztahu mezi zobrazením flutemetamolem (18F) a změnami diagnostického stavu. Z 232 pacientů mělo 98 (42 %) abnormální (pozitivní) skeny. Z 232 zařazených pacientů mělo 224 alespoň nejméně jeden sken přezkoumán nezávislou komisí a byli zahrnuti do analýzy.
V 36měsíčním sledování se rozvinula u 81 (35 %) pacientů klinicky manifestní Alzheimerova choroba. Z 97 pacientů s aMCI, kteří měli pozitivní PET sken a alespoň jedno hodnocení komise, byl u 52 (54 %) klinicky stanoven přechod do klinicky manifestní Alzheimerovy choroby po 36 měsících, ve srovnání s 29 (23 %) ze 127, kteří měli negativní sken a nejméně jedno hodnocení komise. Za 36 měsíců sledování byla senzitivita skenů flutemetamolem (18F) pro predikci konverze z aMCI na AD u 81 pacientů, u nichž došlo ke konverzi, 64 % (95 % CI: 54-75 %), specificita u 143 pacientů, u nichž ke konverzi nedošlo, byla 69 % (95 % CI: 60-76 %). Na základě majoritního posouzení skenů, poměry pravděpodobnosti byly 2,04 pro pozitivitu a 0,52 pro negativitu. Design této studie neumožňuje odhadnout riziko progrese MCI do klinické AD.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem flutemetamolem (18F) u všech podskupin pediatrické populace, protože choroba nebo stav, pro něž je specifický léčivý přípravek určen, nastává pouze u dospělých (viz bod 4.2 pro informace o pediatrickém použití).
5.2 Farmakokinetické vlastnosti
Distribuce
Flutemetamol (18F) se v těle distribuuje během několika minut po injekci. Po 20 minutách zůstává v oběhu zhruba 20 % aktivní látky flutemetamol (18F), po 180 minutách množství klesne na 10 %.
Vychytávání orgány
K maximálnímu vychytávání, zhruba 7%, flutemetamolu (18F) mozkem dochází do dvou minut od podání. Během prvních 90 minut pak dochází k rychlé clearanci z mozku (doporučená doba zahájení snímkování), po jejichž uplynutí je clearance pozvolnější. Nejvíce se aktivita akumuluje v těchto pěti orgánech resp. tkáních: stěna tenkého střeva, játra, stěna močového měchýře, stěna proximální části tlustého střeva a stěna žlučníku.
Kontrolní skupina zdravých osob vykazuje nízké hladiny retence flutemetamolu (18F) v mozkové kůře. K nejvyšší absorpci dochází v mostu a v dalších oblastech bílé hmoty. U pacientů s AD vykazují kortikální oblasti a striatální oblasti výrazně vyšší vychytávání než kortikální oblasti u subjektů z kontrolní skupiny. U pacientů s AD, stejně jako u kontrol, je vysoká retence v mostu a dalších oblastech bílé hmoty.
Biofyzikální základ retence flutemetamolu (18F) v bílé hmotě živého lidského mozku nebyl definitivně vysvětlen. Předpokládá se, že rozpustnost radiofarmaka v lipidovém obsahu mozkových tkání může přispívat k jeho retenci bílou hmotou.
Eliminace a polpčas
Flutemetamol (18F) rychle vymizí z oběhu (přes trávicí trakt a močovými cestami). Po 20 minutách po podání injekce bylo 75 % radioaktivity v plazmě přítomno ve formě polárních metabolitů. Po 180 minutách bylo ve formě polárních metabolitů přítomno 90 % radioaktivity v plazmě. Eliminace flutemetamolu (18F) je zhruba z 37 % renální a z 52 % hepatobiliární. Zdánlivý eliminační poločas je
4,5 hodiny, přičemž radioaktivní poločas flutemetamolu (18F) je 110 minut.
Porucha ledvinných a jaterních funkcí
Farmakokinetika u pacientů s poruchou ledvinných a jaterních funkcí nebyla popsána.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti a toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka.
Flutemetamol (18F) byl v testech genotoxicity u bakterií a savčích buněk in vitro pozitivní, avšak ve třech různých studiích in vivo s dostatečně vysokými dávkami byl negativní. Proto se jakýkoli klinicky relevantní mutagenní potenciál přípravku pokládá za vysoce nepravděpodobný.
Žádné studie kancerogenity ani reprodukční toxicity nebyly s flutemetamolem (18F) provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný Ethanol bezvodý Polysorbát 80
Dihydrát dihydrogenfosforečnanu sodného Dodekahydrát hydrogenfosforečnanu sodného Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
8 hodin od referenčního data a času.
6.4 Zvláštní opatření pro uchovávání
Žádné zvláštní podmínky pro uchovávání se u tohoto léku nevyžadují.
Radiofarmaka je nutné uchovávat v souladu s národními předpisy o radioaktivních látkách.
6.5 Druh obalu a obsah balení
VIZAMYL se dodává v 10ml a 15ml skleněných lahvičkách typu I se zátkou z halobutylového kaučuku a hliníkovou pertlí.
Velikost balení
Jedna vícedávková 10ml injekční lahvička obsahuje 1 až 10 ml roztoku, což k referenčnímu datu a hodině představuje aktivitu 400 až 4000 MBq.
Jedna vícedávková 15ml injekční lahvička obsahuje 1 až 15 ml roztoku, což k referenčnímu datu a hodině představuje aktivitu 400 až 6000 MBq.
Na trhu nemusí být všechny velikosti balení.
V důsledku výrobního postupu jsou některé injekční lahvičky distribuovány s propíchnutými gumovými zátkami.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Odebírání roztoku z injekční lahvičky musí probíhat v aseptických podmínkách. Před otevřením injekční lahvičky je nutné dezinfikovat zátku. Roztok se poté odebírá skrz zátku, k čemuž se používá buď stříkačka na jednu dávku opatřená vhodným ochranným stíněním a jednorázovou sterilní jehlou, anebo schválené automatické aplikační zařízení. Pokud je narušena celistvost injekční lahvičky, nesmí se přípravek použít.
Obecné upozornění
Radiofarmaka smí přijímat, používat a podávat pouze oprávněná osoba ve vymezené klinické situaci. Jejich příjem, uchovávání, používání, převod a likvidace se řídí platnými předpisy a/nebo případně podléhají povolení příslušné úřední organizace.
Radiofarmaka se musejí připravovat postupem splňujícím požadavky jak radiační bezpečnosti, tak farmaceutické kvality. Je třeba přijmout vhodná aseptická opatření.
VIZAMYL je radioaktivní léčivý přípravek emitující pozitrony, které anihilují s elektrony za vzniku gama záření. Při manipulaci s tímto přípravkem je nutné dodržovat bezpečností opatření, aby se minimalizovala radiační expozice pracovníků zdravotnického zařízení i pacientů. Přípravek VIZAMYL smí být používán pouze lékařem nebo pod dohledem lékaře, který je speciálně vyškolen a má zkušenosti s bezpečnou manipulací a používáním radionuklidů, přičemž jeho školení a zkušenosti musejí být schváleny příslušným státním orgánem, jenž má oprávnění povolovat používání radiofarmak. K minimalizaci ozáření močového měchýře je třeba zajistit, aby byl pacient před podáním přípravku VIZAMYL i po něm zavodněn tak, aby se mohl často vyprazdňovat. Veďte pacienta k tomu, aby se pacient vyprázdnil před snímkováním s přípravkem VIZAMYL i po něm a aby se vyprazdňoval často během následujících 24 hodin.
Pokud se v kterémkoli okamžiku přípravy naruší celistvost injekční lahvičky, nesmí se injekční lahvička použít.
Postupy podávání je třeba provádět tak, aby se minimalizovalo riziko kontaminace léčivého přípravku a ozáření osob. Vhodné stínění je povinné.
Podáním radiofarmaka vzniká pro další osoby nebezpečí z vnějšího ozáření nebo z kontaminace rozlitou moč í, zvratky apod. Je třeba přijmout opatření radiační ochrany podle národních předpisů.
Likvidace
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GE Healthcare Limited Amersham Place Little Chalfont Buckinghamshire HP7 9NA Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/941/001
EU/1/14/941/002
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE 22. srpna 2014
10. DATUM REVIZE TEXTU
<{MM.RRRR}>
11. DOZIMETRIE
T abulka 2 níže uvádí dozimetrii vypočtenou pomocí softwaru OLINDA/EXM (Organ Level INternal Dose Assessment/Exponential Modeling). Odhad absorbovaných dávek záření u dospělých po intravenózním podání přípravku VIZAMYL je uveden v tab. 2. Hodnoty byly vypočteny za předpokladu, že si pacient vyprazdňuje močový měchýř v intervalu 3,5 hodin, a za použití biodistribučních dat pomocí softwaru OLINDA/EXM.
Tab. 2 Odhad dávek záření absorbovaných z intravenózní injekce přípravku VIZAMYL _(dospělé osoby)_
|
Orgán/tkáň |
Dávka absorbovaná na podanou aktivitu [mGy/MBq] |
|
Nadledvina |
0,013 |
|
Mozek |
0,011 |
|
Prsa (mammy) |
0,005 |
|
Žlučník |
0,287 |
|
Srdce |
0,014 |
|
Ledviny |
0,031 |
|
Játra |
0,057 |
|
Stěna distální části tlustého střeva |
0,042 |
|
Plíce |
0,016 |
|
Svaly |
0,009 |
|
Osteogenní buňky |
0,011 |
|
Vaječníky |
0,025 |
|
Slinivka |
0,015 |
|
Červená kostní dřeň |
0,013 |
|
Kůže |
0,005 |
|
Tenké střevo |
0,102 |
|
Slezina |
0,015 |
|
Žaludek |
0,012 |
|
Varlata |
0,008 |
|
Brzlík |
0,006 |
|
Štítná žláza |
0,006 |
|
Proximální část tlustého střeva |
0,117 |
|
Močový měchýř |
0,145 |
|
Děloha |
0,025 |
|
Zbývající orgány |
0,012 |
|
Efektivní dávka (mSv/MBq) |
0,032 |
Efektivní dávka pro dospělého vyplývající z podání maximální doporučené aktivity 185 MBq pro dospělého o hmotnosti 70 kg je přibližně 5,9 mSv. Pro podanou aktivitu 185 MBq je typická dávka záření pro cílový orgán (mozek) 2,0 mGy. Pokud je současně v rámci snímkování PET prováděno i snímkování CT, expozice ionizujícímu záření se zvýší o hodnotu, která závisí na nastavení při snímkování CT.
Pro podanou aktivitu 185 MBq jsou typické dávky radiace dodané do kritických orgánů tyto:
53,1 mGy do žlučníku, 26,8 mGy do stěny močového měchýře, 21,6 mGy do stěny proximální části tlustého střeva, 7,8 mGy do stěny distální části tlustého střeva, 18,9 mGy do tenkého střeva a
10,5 mGy do jater.
12. NÁVOD PRO PŘÍPRAVU RADIOFARMAK
Postup přípravy
Před použitím je třeba balení zkontrolovat a měřičem aktivity změřit jeho aktivitu.
Viz zvláštní bezpečnostní opatření při manipulaci v bodu 6.6.
Flutemetamol (18F) se nesmí ředit.
Kontrola kvality
Roztok je třeba před použitím prohlédnout. Smí se použít pouze čirý roztok bez přítomnosti viditelných pevných částeček.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky (viz bod 6.6).
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www. ema. europa. eu.
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
AAA, Troyes
Advanced Accelerator Applications Technopole de l’Aube 14 rue Gustave Eiffel 10430 Rosiěres prěs Troyes Francie
AAA, Forli
Advanced Accelerator Applications S.r.l Via Piero Maroncelli 40/42 47014 Meldola (FO)
Itálie
ITP, Madrid
Instituto Tecnológico PET, SA C/Manuel Bartolome Cossio 10 28040 Madrid Španělsko
S eibers dorf Laboratories, S eibers dorf Seibersdorf Labor GmbH Grundstuck Nr. 482/2 EZ98 KG 2444 Seibersdorf Rakousko
Laboratoires CYCLOPHARMA, Marseille
Technopole de Chateau Gombert
Rue Louis Leprince Ringuet
13013 Marseille
Francie
AAA, Zaragoza
Advanced Accelerator Applications Ibérica S.L.
Polígono Industrial la Cuesta 3, Parcelas 1 y 2 50100 La Almunia de Dona Godina Zaragoza Španěls ko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do šesti měsíců od jeho registrace. Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl.
107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnos ti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik
Před uvedením přípravku na trh v každém z členských států musí mít držitel rozhodnutí o registraci kompetentním národním úřadem schválenou konečnou podobu vzdělávacího programu.
Držitel rozhodnutí o registraci musí zajistit, v návaznosti na jednání a dohodě s národními kompetentními orgány v každém z členských států, kde je VIZAMYL obchodován, že všichni lékaři, u nichž se předpokládá, že budou s přípravkem VIZAMYL zacházet, mají před uvedením a po uvedení přípravku na trh přístup k tréninkovému kurzu, aby byla zajištěna přesná a spolehlivá interpretace PET snímků.
Tréninkový kurz pro odborné pracovníky by měl obsahovat následující klíčové prvky:
• Informac e o amyloidní patologii u Alzheimerovy choroby; relevantní informace o přípravku VIZAMYL, jako je P-amyloidní indikační látka, včetně schválené indikace podle SPC, omezení v použití přípravku VIZAMYL, chyby v interpretaci, bezpečnostní informace a výsledky klinických studií informující o diagnostickém použití přípravku VIZAMYL.
• Přehled kritérií pro čtení PET snímků, včetně způsobu prohlížení snímků, kritéria pro jejich interpretaci a snímky poukazující na binární metodiku čtení.
• Materiál by měl obsahovat příklady PET zobrazení za použití přípravku VIZAMYL se správnou interpretací PET snímků od zkušeného uživatele; PET snímky za použití přípravku VIZAMYL pro sebehodnocení; a nabídku pro každého z účastníků tréninku na postup sebekvalifikace. Vzdělávání by mělo obsahovat dostatečný počet jasně pozitivních a negativních případů, stejně jako případy nejednoznačné. Pokud je to možné, případy by měly být histopatologicky potvrzeny.
Měla by být zajištěna odbornost a kvalifikace lektorů jak v elektronickém, tak i v osobním tréninku.
VIZAMYL 400 MBq/ml, injekční roztok Flutemetamolum (18F)
Jeden ml roztoku obsahuje flutemetamol (18F), jehož aktivita k referenčnímu datu a času je 400 MBq.
Pomocné látky: ethanol bezvodý, polysorbát 80, chlorid sodný, dihydrát dihydrogenfosforečnanu sodného, dodekahydrát hydrogenfosforečnanu sodného, voda na injekci.
Bližší údaje jsou uvedeny v příbalové informaci.
Injekční roztok.
Objem: xx,x ml
Aktivita: 400 MBq/ml v {hh:mm} {časová zóna} dne {dd-mm-rrrr} Aktivita: YYYY MBq v hh:mm {čas. zóna} dd-mm-rrrr
K nitrožilnímu podání.
Vícedávková injekční lahvička
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Radiofarmakum
PuoagjKiiyc Jk ▲
<U£*ŮiKÍIV
u«icw 4b
EXP: {hh:mm} {časové pásmo} dne {dd-mm-rrrr}
Uchovávejte v původním obalu.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Advanced Accelerator Applications S.r.l, 47014 Meldola (FO), Itáli
|
Advanced Accelerator Applications, Technopole de l’Aube,10430 Rosiěres prěs Troyes, Francie | |
|
Seibersdorf Labor GmbH, 2444 Seibersdorf, Rakousko | |
|
Instituto Tecnológico PET, SA, 28040 Madrid, Španělsko | |
|
CYCLOPHARMA, 13013 Marseille, Francie | |
|
Advanced Accelerator Applications. 50100 La Almunia de Dona Godina, Zaragoza, Španělsko | |
EU/1/14/941/001
LOT
Lahvička č: xxx
Výdej léčivého přípravku vázán na lékařský předpis.
Nevyžaduje se - odůvodnění přijato
VIZAMYL 400 MBq/ml, injekční roztok Flutemetamolum (18F)
Jeden ml roztoku obsahuje flutemetamol (18F), jehož aktivita k referenčnímu datu a času je 400 MBq.
Pomocné látky: ethanol bezvodý, polysorbát 80, chlorid sodný, dihydrát dihydrogenfosforečnanu sodného, dodekahydrát hydrogenfosforečnanu sodného, voda na injekci.
Bližší údaje jsou uvedeny v příbalové informaci.
Injekční roztok.
Objem: xx,x mL
Aktivita: 400 MBq/mL v {hh:mm} {časová zóna} dne {dd-mm-rrrr} Aktivita: YYYY MBq {v hh:mm} {čas. zóna} dne {dd-mm-rrrr}
K nitrožilnímu podání.
Vícedávková injekční lahvička
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Radiofarmakum
PuoagjKiiyc Jk ▲
<U£*ŮiKÍIV
ucagjtTir ^
EXP: {hh:mm} {časové pásmo} dne {dd-mm-rrrr}
Uchovávejte v původním obalu.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Advanced Accelerator Applications S.r.l, 47014 Meldola (FO), Itáli
|
Advanced Accelerator Applications, Technopole de l’Aube,10430 Rosiěres prěs Troyes, Francie | |
|
Seibersdorf Labor GmbH, 2444 Seibersdorf, Rakousko | |
|
Instituto Tecnológico PET, SA, 28040 Madrid, Španělsko | |
|
CYCLOPHARMA, 13013 Marseille, Francie | |
|
Advanced Accelerator Applications. 50100 La Almunia de Dona Godina, Zaragoza, Španělsko | |
EU/1/14/941/002
LOT
Lahvička č: xxx
Výdej léčivého přípravku vázán na lékařský předpis.
Nevyžaduje se - odůvodnění přijato
VIZAMYL 400 MBq/ml, injekční roztok Flutemetamolum (18F)
IV
EXP: referenční doba +8 h
LOT
Lahvička č: xxx
xx,x ml YYYY MBq (viz vnější štítek).
Radioaktivní látka.
WGWHVE ▲ A
Ajctóihftv
ucagjcif ^
Advanced Accelerator Applications S.r.l, 47014 Meldola (FO), Itálie
Advanced Accelerator Applications, Technopole de l’Aube,10430 Rosiěres prěs Troyes, Francie
Seibersdorf Labor GmbH, 2444 Seibersdorf, Rakousko
Instituto Tecnológico PET, SA, 28040 Madrid, Španělsko CYCLOPHARMA, 13013 Marseille, Francie
Advanced Accelerator Applications. 50100 La Almunia de Dona Godina, Zaragoza, Španělsko
VIZAMYL 400 MBq/ml, injekční roztok Flutemetamolum (18F)
IV
EXP: referenční doba + 8 h
LOT
Lahvička č: xxx
xx,x ml YYYY MBq (viz vnější štítek).
Radioaktivní látka.
WGWHVE ▲ A
Ajctóihftv
UCiOJClf ^
Advanced Accelerator Applications S.r.l, 47014 Meldola (FO), Itáli
Advanced Accelerator Applications, Technopole de l’Aube,10430 Rosiěres prěs Troyes, Francie
Seibersdorf Labor GmbH, 2444 Seibersdorf, Rakousko
Instituto Tecnológico PET, SA, 28040 Madrid, Španělsko CYCLOPHARMA, 13013 Marseille, Francie
Advanced Accelerator Applications. 50100 La Almunia de Dona Godina, Zaragoza, Španělsko
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
VIZAMYL 400 MBq/ml, injekční roztok
Flutemetamolum (18F)
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře z oboru nukleární medicíny, který dohlíží na Vaše vyšetření.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to lékaři z oboru nukleární medicíny. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je VIZAMYL a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete VIZAMYL používat
3. Jak se VIZAMYL používá
4. Možné nežádoucí účinky
5. Jak VIZAMYL uchovávat
6. Obsah balení a další informace
1. Co je VIZAMYL a k čemu se používá
VIZAMYL obsahuje léčivou látku flutemetamol (18F) a používá se k diagnostice Alzheimerovy nemoci a jiných příčin ztráty paměti.
VIZAMYL se podává dospělým, kteří trpí problémy s pamětí, předtím, než podstoupí snímkování mozku, jemuž se říká pozitronová emisní tomografie (PET). T oto zobrazení může spolu s dalšími testy funkce mozku pomoci lékaři určit, zda máte nebo nemáte v mozku P-amyloidní plaky. P-amyloidní plaky jsou někdy přítomny v mozku lidí s demencí (jako je Alzheimerova choroba).
Výsledky testu byste měli prodiskutovat s lékařem, který si test vyžádal.
VIZAMYL patří do skupiny léků nazývaných „radiofarmaka“. Při jeho použití budete vystaven(a) malým množstvím radioaktivity.
Váš lékař a lékař z oboru nukleární medicíny došli k závěru, že klinický přínos této procedury využívající radiofarmaka vyváží riziko expozice tomuto malému množství záření.
2. Čemu musíte věnovat pozornost, než začnete VIZAMYL používat VIZAMYL nesmí být použit:
- jestliže jste alergický(á) na flutemetamol (18F) nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku VIZAMYL se poraďte se svým lékařem z oboru nukleární medicíny, pokud:
- trpíte problémy s ledvinami,
- trpíte problémy s játry,
- jste těhotná nebo si myslíte, že byste mohla být těhotná,
- kojíte.
Děti a dospívající
VIZAMYL není určen k použití u dětí a mladistvých do 18 let věku.
Další léčivé přípravky a VIZAMYL
Informujte svého lékaře z oboru nukleární medicíny o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, protože tyto léky by mohly narušit snímky získané ze zobrazení mozku.
Těhotenství a kojení
Před podáním přípravku VIZAMYL informujte lékaře z oboru nukleární medicíny, pokud existuje možnost, že byste mohla být těhotná, pokud Vám vynechala menstruace nebo pokud kojíte. Případné pochybnosti konzultujte s lékařem z oboru nukleární medicíny, který dohlíží na postup vyšetření.
Pokud jste těhotná
Lékař z oboru nukleární medicíny podá tento přípravek při těhotenství pouze v případě, že očekávaný přínos převáží rizika.
Pokud kojíte
Nesmíte kojit po dobu 24 hodin po podání injekce. V tomto období odstříkněte a zlikvidujte veškeré své mateřské mléko. Kojení znovu zahajte až po souhlasu lékaře z oboru nukleární medicíny, který dohlíží na proceduru.
Pokud jste těhotná nebo kojíte, domníváte se, že byste mohla být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem z oboru nukleární medicíny dříve, než Vám bude tento přípravek podán.
Řízení dopravních prostředků a obsluha strojů
VIZAMYL může způsobit přechodné závratě a vertigo, které by mohly mít vliv na Vaši schopnost řídit dopravní prostředky nebo obsluhovat stroje. Neměli byste řídit, obsluhovat stroje nebo se zabývat jinými potenciálně nebezpečnými činnostmi, dokud tyto účinky zcela nezmizí.
VIZAMYL obsahuje alkohol (ethanol) a sodík
VIZAMYL obsahuje alkohol (ethanol). V jedné dávce je až 552 mg alkoholu. To je stejné množství jako ve 14 ml piva nebo v 6 ml vína. Toto množství může být škodlivé pro osoby závislé na alkoholu a je třeba je vzít v úvahu u těhotných a kojících žen a u osob s jaterními potížemi nebo s epilepsií. VIZAMYL obsahuje v jedné dávce až 41 mg sodíku. Tyto hodnoty může být třeba vzít v úvahu u osob s dietou s nízkým obsahem sodíku.
3. Jak se VIZAMYL používá
Používání, manipulace a likvidace radiofarmak podléhá přísným zákonům.
VIZAMYL se smí používat pouze ve zvláštních kontrolovaných prostorách. S přípravkem budou zacházet a podají Vám ho odborníci, kteří jsou v jeho bezpečném používání vyškoleni a mají pro tuto činnost kvalifikaci. Poskytnou Vám nezbytné informace o postupu vyšetření.
Dávka
Lékař z oboru nukleární medicíny, který dohlíží na proceduru, rozhodne, jaké množství přípravku VIZAMYL Vám bude podáno. Lékař zvolí nejmenší nezbytné množství.
Obvyklé množství doporučené pro dospělého je 185 MBq. Megabecquerel (MBq) je jednotka, kterou se měří radioaktivita.
Podání přípravku VIZAMYL a vlastní procedura
VIZAMYL Vám bude podán injekcí do žíly (intravenózní injekce) a následně proběhne průplach chloridem sodným, který zajistí podání celé dávky přípravku.
K provedení potřebného snímku dostačuje jedna injekce.
Délka vyšetření
Snímkování mozku obvykle začíná 90 minut od podání přípravku VIZAMYL. Lékař z oboru nukleární medicíny Vás bude informovat o obvyklé délce vyšetření.
Po podání přípravku VIZAMYL
Po dobu 24 hodin po podání injekce se vyhněte blízkému kontaktu s malými dětmi a těhotnými ženami.
Lékař z oboru nukleární medicíny Vás bude informovat, pokud budete muset po podání tohoto přípravku dodržovat nějaká zvláštní preventivní opatření. V případě jakýchkoliv dotazů se obraťte na lékaře z oboru nukleární medicíny.
Jestliže jste obdržel(a) více přípravku VIZAMYL, než jste měl(a)
Předávkování je nepravděpodobné, protože dostanete pouze jednu dávku přípravku VIZAMYL kontrolovanou lékařem z oboru nukleární medicíny.
Pokud by ale přesto k předávkování došlo, měla by Vám být poskytnuta vhodná léčba. Léčba spočívá ve zvýšení výdeje moči a stolice, aby se radioaktivita odstranila z Vašeho organismu.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se, prosím, lékaře z oboru nukleární medicíny, který dohlíží na postup vyšetření.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Tento léčivý přípravek může mít tyto nežádoucí účinky:
Závažné nežádoucí účinky
Jestliže zjistíte kterýkoli z těchto účinků, ihned svého lékaře informujte - možná budete potřebovat okamžité lékařské ošetření:
- Alergické reakce - známkami mohou být otok obličeje nebo očí, bledá, svědící nebo napjatá kůže nebo vyrážka, dechová nedostatečnost, pocit svírání hrudníku, podráždění v krku nebo zvracení. Tyto nežádoucí účinky jsou méně časté a postihují nanejvýš 1 člověka ze 100.
Jestliže u sebe kterýkoli z výše uvedených příznaků zjistíte, informujte ihned svého lékaře.
Dále se vyskytují tyto nežádoucí účinky:
Časté - mohou postihnout až 1 osobu z 10
- zrudnutí,
- zvýšený krevní tlak.
Méně časté - mohou postihnout až 1 osobu ze 100. Mohou se u Vás projevit tyto méně časté nežádoucí účinky:
- bolest hlavy,
- závratě,
- úzkost,
- pocit na zvracení (nauzea),
- nepříjemný pocit na hrudi,
- nízká hladina cukru v krvi (příznak: hlad, bolest hlavy),
- bolesti zad,
pocit horka nebo zimy, zvýšená rychlost dechu, bolest v místě vpichu, bušení srdce (palpitace), bolest ve svalech nebo v kostech, třas (tremor), nateklá až opuchlá kůže, horečka,
zrychlené dýchání (hyperventilace),
změněné vnímání chutí,
pocit závratí (vertigo),
snížený hmat a vnímání,
pocit únavy nebo slabosti,
neschopnost dosáhnout nebo udržet erekci,
porucha trávení, bolest břicha nebo bolest v ústech,
snížený cit a citlivost zejména kůže a obličeje,
krevní testy se zvýšenou hladinou látky zvané laktátdehydrogenáza nebo tzv. neutrofilů v krvi, napětí kůže.
Toto radiofarmakum Vám vpraví do organismu malé množství ionizujícího záření, které představuje velmi malé riziko vzniku rakoviny a vrozených vad (předávání chybných genů).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři z oboru nukleární medicíny. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak VIZAMYL uchovávat
Tento lék nebudete muset uchovávat. Je uchováván pod dohledem odborného pracovníka na vhodném místě. Radiofarmaka se uchovávají v souladu s národními předpisy o radioaktivních látkách.
Dále uvedené informace jsou určeny pouze specialistům.
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí data a doby použitelnosti, které jsou uvedeny na krabičce a lahvičce za ,EXP‘.
Nepoužívejte tento přípravek, pokud si všimnete, že je injekční lahvička poškozená nebo že roztok obsahuje pevné částice nebo se zdá být zbarvený.
6. Obsah balení a další informace
Co VIZAMYL obsahuje
- Léčivou látkou je flutemetamol (18F). Jeden ml roztoku obsahuje flutemetamol (18F), jehož aktivita k referenčnímu času je 400 MBq.
- Dalšími složkami jsou chlorid sodný a bezvodý ethanol, polysorbát 80, dihydrát dihydrogenfosforečnanu sodného, dodekahydrát hydrogenfosforečnanu sodného a voda na injekci.
Jak VIZAMYL vypadá a co obsahuje toto balení
- VIZAMYL je čirý bezbarvý až nažloutlý injekční roztok.
- VIZAMYL se dodává v 10ml nebo 15ml skleněných injekčních lahvičkách. Každá injekční lahvička je uložená v kontejneru.
- Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o re gistraci
GE Healthcare Limited Amersham Place Little Chalfont Buckinghamshire HP7 9NA Velká Británie
|
Výrobci Advanced Accelerator Applications S.r.l. Via Piero Maroncelli 40/42 47014 Meldola (FO) Itálie |
Advanced Accelerator Applications Technopole de l’Aube 14 rue Gustave Eiffel 10430 Rosiěres prěs Troyes Francie |
|
Seibersdorf Labor GmbH Grundstuck Nr. 482/2 EZ98 KG 2444 Seibersdorf Rakousko |
Instituto Tecnológico PET, SA C/Manuel Bartolome Cossio 10 28040 Madrid Španělsko |
|
Laboratoires CYCLOPHARMA, Marseille Technopole de Cháteau Gombert Rue Louis Leprince Ringuet 13013 Marseille Francie |
Advanced Accelerator Applications Ibérica S.L. Polígono Industrial la Cuesta 3, Parcelas 1 y 2 50100 La Almunia de Dona Godina Zaragoza Španělsko |
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien/ Luxembourg/ Luxemburg GE Healthcare BVBA Tél/Tel: +32 (0) 2 719 7311 |
Lietuva GE Healthcare Inc. Tel.: +370 68 723 753 |
|
E^^rapufl GE Healthcare Bulgaria EOOD Tel/Fax.: + 359 2 9712561 |
Magyarország Radizone Diagnost-X Kft. Tel: +36 1 787 5720 |
|
Česká republika M.G.P. spol. s r.o. Tel.: +420 577 212 140 |
Malta Pharma-Cos .Limited Tel: +356 21441 870 |
|
Danmark GE Healthcare A/S Tlf: +45 70 2222 03 |
Nederland GE Healthcare BV. Tel: +31 (0) 40 299 10 00 |
|
Deutschland GE Healthcare Buchler GmbH & Co. KG Tel: +49 (0) 5 307 93 00 |
Norge GE Healthcare AS Tlf: + 47 23 18 50 50 |
Eesti
GE Healthcare Estonia OU Tel: +372 6260 061
Ekká8a
GE Healthcare AE Tq^: +30(2)10 8930600
Espaňa
GE Healthcare Bio-Sciences, S.AU. Tel: +34 91 663 25 00
France
GE Healthcare SAS Tél: +33 1 34 49 54 54
Hrvatska
GE Healthcare d.o.o.
Tel: + 385 1 6170 280
Ireland
GE Healthcare Limited Tel: +44 (0) 1494 544000
Ísland
Icepharma hf.
Sími: + 354 540 8000
Italia
GE Healthcare S.r.l.
Tel: +39 02 26001 111
Kúnpo^
Phadisco Ltd TnA + 357 22 715000
Latvija
GE International Inc.
Tel: +371 780 7086
Osterreich
GE Healthcare Handels GmbH Tel: +43 (0) 1 97272-0
Polska
GE Medical Systems Polska Sp. z o.o. Tel.: +4822 330 83 00
Portugal
Satis - GE Healthcare Tel: + 351 214251352
Románia
S.C. GENERAL ELECTRIC MEDICAL SYSTEMS ROMANIA S.R.L.
Tel. + 40 37 2074527
Slovenija
Biomedics M.B. trgovina d.o.o Tel: + 386 2 4716300
Slovenská republika
MGP, spol. s.r.o.
Tel: +421 2 5465 4841
Suomi/Finland
Oy GE Healthcare Bio-Sciences Ab Puh/Tel: +358 10 39411
Sverige
GE Healthcare AB Tel: + 46 (0)8 559 504 00
United Kingdom
GE Healthcare Limited Tel: +44 (0) 1494 544000
Tato příbalová informace byla naposledy revidována {měsíc RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www. ema. europa. eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Kompletní Souhrn údajů o přípravku VIZAMYL je přiložen jako samostatný dokument do balení přípravku s cílem poskytnout zdravotnickým odborníkům další vědecké a praktické informace o podávání a používání tohoto radiofarmaka.
Seznamte se s obsahem Souhrnu údajů o přípravku {Souhrn údajů o přípravku by měl být v balení}.
32