Vellofent 133 Mikrogramů
Sp.zn.sukls102559/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Vellofent 67 mikrogramů, sublingvální tableta Vellofent 133 mikrogramů, sublingvální tableta Vellofent 267 mikrogramů, sublingvální tableta Vellofent 400 mikrogramů, sublingvální tableta Vellofent 533 mikrogramů, sublingvální tableta Vellofent 800 mikrogramů, sublingvální tableta
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Vellofent 67 mikrogramů, sublingvální tableta:
Jedna tableta obsahuje fentanyli citras 110 mikrogramů, což odpovídá fentanylum 67 mikrogramů. Vellofent 133 mikrogramů, sublingvální tableta:
Jedna tableta obsahuje fentanyli citras 210 mikrogramů, což odpovídá fentanylum 133 mikrogramů. Vellofent 267 mikrogramů, sublingvální tableta:
Jedna tableta obsahuje fentanyli citras 420 mikrogramů, což odpovídá fentanylum 267 mikrogramů. Vellofent 400 mikrogramů, sublingvální tableta:
Jedna tableta obsahuje fentanyli citras 630 mikrogramů, což odpovídá fentanylum 400 mikrogramů. Vellofent 533 mikrogramů, sublingvální tableta:
Jedna tableta obsahuje fentanyli citras 840 mikrogramů, což odpovídá fentanylum 533 mikrogramů.
Vellofent 800 mikrogramů, sublingvální tableta:
Jedna tableta obsahuje fentanyli citras 1 260 mikrogramů, což odpovídá fentanylum 800 mikrogramů
Pomocná látka se známým účinkem:
Jedna tableta obsahuje 0,651 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Sublingvální tableta.
Vellofent 67 mikrogramů, sublingvální tableta:
Bílé, vypouklé, trojúhelníkové tablety vysoké 5,6 mm s černým potiskem „0“ na jedné straně. Vellofent 133 mikrogramů, sublingvální tableta:
Bílé, vypouklé, trojúhelníkové tablety vysoké 5,6 mm s černým potiskem „1“ na jedné straně. Vellofent 267 mikrogramů, sublingvální tableta:
Bílé, vypouklé, trojúhelníkové tablety vysoké 5,6 mm s černým potiskem „2“ na jedné straně. Vellofent 400 mikrogramů, sublingvální tableta:
Bílé, vypouklé, trojúhelníkové tablety vysoké 5,6 mm s černým potiskem „4“na jedné straně. Vellofent 533 mikrogramů, sublingvální tableta:
Bílé, vypouklé, trojúhelníkové tablety vysoké 5,6 mm s černým potiskem „5“ na jedné straně. Vellofent 800 mikrogramů, sublingvální tableta:
Bílé, vypouklé, trojúhelníkové tablety vysoké 5,6 mm s černým potiskem „8“ na jedné straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Vellofent je indikován k léčbě průlomové bolesti (breakthrough pain - BTP) u dospělých s nádorovým onemocněním, kteří již užívají udržovací terapii opioidy pro chronickou bolest při nádorovém onemocnění.
BTP je přechodná exacerbace bolesti, ke které dochází na pozadí jinak kontrolované perzistentní bolesti.
Pacienti užívající udržovací terapii opioidy jsou ti, kteří užívají nejméně 60 mg morfinu perorálně denně, nejméně 25 mikrogramů transdermálního fentanylu za hodinu, nejméně 30 mg oxykodonu denně, nejméně 8 mg hydromorfonu perorálně denně nebo ekvianalgetickou dávku jiného opioidu po dobu jednoho týdne nebo déle.
4.2 Dávkování a způsob podání
Léčbu by měl zahajovat lékař se zkušenostmi s terapií opioidy u pacientů s nádorovým onemocněním a měla by i nadále probíhat pod jeho dohledem. Lékaři by měli vzít v úvahu možnost zneužití fentanylu. Pacienti by měli být poučeni, aby k léčbě průlomové bolesti neužívali dvě různé lékové formy fentanylu zároveň, a aby zlikvidovali jakýkoliv léčivý přípravek obsahující fentanyl, který jim byl předepsán k léčbě BTP, pokud jsou převáděni na léčbu přípravkem Vellofent. Počet tablet a sil přípravku kdykoliv dostupných pacientovi by měl být minimální, aby se předešlo omylům a případnému předávkování.
Přípravek Vellofent se vkládá co nejdále přímo pod jazyk.
Přípravek Vellofent není určen k polykání, ale nechá se kompletně rozpustit v sublingvální oblasti bez kousání nebo cucání. Pacienti by měli být poučeni, aby do úplného rozpuštění sublingvální tablety nic nejedli, ani nepili.
Pokud se tableta zcela nerozpustí do 30 minut, lze nerozpuštěný zbytek spolknout.
U pacientů se suchou sliznicí v ústech lze před aplikací přípravku Vellofent použít vodu ke zvlhčení bukální mukózy.
Tableta by po vyjmutí z blistru již neměla být dále uchovávána, protože nelze garantovat její celistvost a existuje riziko náhodného požití tablety (viz bod 4.4 varování před užitím dětmi).
Pacienti by měli být poučeni, aby přípravek Vellofent uchovávali v uzamčeném prostoru.
Titrace dávky:
Před zahájením titrace dávky přípravku Vellofent u pacientů se předpokládá, že jejich trvalé bolesti jsou kontrolovány udržovacím podáváním opioidů a že obvykle nemají více než 4 epizody průlomové bolesti denně.
Účel titrace dávky je určit optimální udržovací dávku pro pokračující léčbu epizod průlomové bolesti. Tato optimální dávka by měla zabezpečit adekvátní analgezii s akceptovatelnou úrovní nežádoucích účinků.
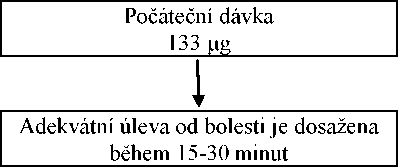
Optimální dávka přípravku Vellofent pro individuálního pacienta se stanovuje vzestupnou titrací. Pro titrační fázi je dostupných několik dávek. Počáteční dávka přípravku Vellofent by měla být 133 mikrogramů, následovat by měla vzestupná titrace dle potřeby v rozsahu dostupných sil přípravku.
Pacienti by měli být do dosažení optimální dávky pečlivě monitorováni.
Převádění z jiných přípravků s fentanylem se kvůli odlišným absorpčním profilům nesmí provádět v poměru 1:1. Při přechodu z jiného přípravku obsahujícího fentanyl je nutná nová titrace dávky přípravku Vellofent.
Následující léčebné schéma je schéma doporučené pro titraci, i když ve všech případech by měl lékař zvážit klinické potřeby pacienta, jeho věk a současné onemocnění.
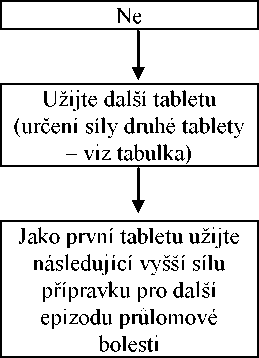
Všichni pacienti musí zahájit léčbu jednou sublingvální tabletou s obsahem 133 mikrogramů. Pokud není adekvátní analgezie dosaženo během 15-30 minut od podání jedné tablety, může být podána dodatečná (druhá) tableta s obsahem 133 mikrogramů. Jestliže léčba epizody průlomové bolesti vyžaduje více než 1 dávkovací jednotku, je třeba zvážit zvýšení dávky na další vyšší dostupnou sílu (viz obrázek níže). Zvyšování dávky by mělo být postupné až do dosažení adekvátní analgezie. Síla dodatečné (druhé) tablety by měla být zvýšena ze 133 na 267 mikrogramů při dávce 533 mikrogramů. Viz tabulka níže. Pro jednu epizodu průlomové bolesti by během titrační fáze neměly být podány více než 2 tablety.
SCHÉMA TITRACE PŘÍPRAVKU VELLOFENT
Ano
Použijte tuto dávku pro další epizody průlomové bolesti
*
|
Síla (mikrogramy) první tablety v episodě průlomové bolesti |
Síla (mikrogramy) dodatečné (druhé) tablety, jež má být podána 15-30 minut po první tabletě, je-li třeba |
|
133 |
133 |
|
267 |
133 |
|
400 |
133 |
|
533 |
267 |
|
800 |
- |
Pokud je adekvátní analgezie dosaženo při vyšší dávce, ale nežádoucí účinky jsou nepřijatelné, pak je možné podat intermediámí dávku (za použití tablety 67 nebo 133 mikrogramů).
Dávky vyšší než 800 mikrogramů nebyly v klinických studiích hodnoceny.
Pro minimalizaci rizika nežádoucích účinků spojených s podáváním opioidů a k určení vhodné dávky je nezbytné, aby byli pacienti během titrace pečlivě monitorováni lékařem.
Udržovací léčba
Jakmile je stanovena vhodná dávka, což může být více než 1 tableta, měl by být pacient udržován na této dávce a spotřeba by měla být limitována maximálně 4 dávkami přípravku Vellofent denně.
Znovu-nastavení dávky
Jestliže se odezva (analgezie nebo nežádoucí účinky) na titrovanou dávku přípravku Vellofent výrazně změní, může být nutné upravit dávkování tak, aby byla udržena optimální dávka.
Pokud přetrvává výskyt více než 4 epizod průlomové bolesti za den, pak je vhodné znovu zvážit dávku dlouhodobě působících opioidů k léčbě trvalé bolesti. Pokud se dlouhodobě působící opioid nebo dávka dlouhodobě působícího opioidu změní, je třeba znovu zhodnotit dávku přípravku Vellofent a, pokud je to nutné, ji znova titrovat, aby byla zajištěna optimální dávka.
Je naprosto nezbytné, aby opětovná titrace dávky jakéhokoliv analgetického přípravku probíhala pod lékařským dohledem.
Vysazení léčby
Pokud u pacienta již nedochází k epizodám akutních atak bolesti, přípravek Vellofent je třeba ihned vysadit. Léčba přetrvávající základní bolesti má být zachována tak, jak je předepsána.
Pokud je potřeba vysadit veškerou léčbu opioidy, musí lékař pacienta pečlivě sledovat a řešit riziko náhlých příznaků z vysazení.
Použití u starších pacientů
Titraci dávky je třeba provádět obzvlášť opatrně a pacienty je třeba pečlivě sledovat, zda se u nich neprojeví známky toxicity fentanylu (viz 4.4).
Použití u pacientů s poruchou funkce ledvin a jater
Během titrace přípravku Vellofent je zapotřebí pacienty s poruchou ledvinných nebo jaterních funkcí pečlivě monitorovat, zda se u nich neprojeví známky toxicity (viz bod 4.4).
Použití u pediatrické populace
Vellofent není určen k použití u dětí a dospívajících do 18 let vzhledem k chybějícím údajům o bezpečnosti a účinnosti (viz také bod 4.4).
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Pacienti bez udržovací léčby opioidy (viz bod 4.1), protože zde existuje zvýšené riziko respirační deprese.
• Souběžné použití inhibitorů monoaminooxidázy (MAO) nebo období 2 týdnů po vysazení léčby inhibitory monoaminooxidázy.
• Závažná respirační deprese nebo závažná obstrukční plicní onemocnění.
• Léčba jiné akutní bolesti než bolesti průlomové.
4.4 Zvláštní upozornění a opatření pro použití
Pacienti a jejich pečovatelé musí být informováni, že Vellofent obsahuje léčivou látku v množství, které může být fatální pro dítě, a proto je nutné uchovávat všechny tablety vždy mimo dosah a dohled dětí.
Pro minimalizaci rizik nežádoucích účinků souvisejících s opioidy a pro stanovení účinné dávky je naprosto nezbytné, aby byli pacienti během titrace pod pečlivým lékařským dohledem.
Je důležité, aby se stabilizovala léčba dlouhodobě působícími opioidy používaná k léčbě perzistentní bolesti pacienta dříve, než bude zahájena terapie přípravkem Vellofent, a aby léčba dlouhodobě působícími opioidy byla zachována i při léčbě přípravkem Vellofent.
Tak, jako u všech opioidů, i zde existuje riziko klinicky významné respirační deprese v souvislosti s užíváním fentanylu. Zvláštní pozornosti je zapotřebí při titraci přípravku Vellofent u pacientů s nezávažným chronickým obstrukčním plicním onemocněním nebo jinými zdravotními obtížemi, které je predisponují k respirační depresi, protože i normální terapeutické dávky přípravku Vellofent mohou dále snižovat respirační úsilí až do bodu respiračního selhání.
Vellofent by měl být podáván s extrémní opatrností pacientům, kteří mohou být extrémně citliví na intrakraniální účinky retence CO2, jako jsou pacienti s prokazatelně zvýšeným intrakraniálním tlakem nebo s poruchou vědomí. U pacientů s poraněním hlavy mohou opioidy zastírat klinický průběh a měly by se používat pouze tehdy, je-li to klinicky oprávněné.
Srdeční onemocnění
Fentanyl může způsobit bradykardii. Fentanyl má být používán s opatrností u pacientů s předchozími nebo stávajícími bradyarytmiemi.
Dále by Vellofent měl být podáván s opatrností pacientům s poruchou renálních či jaterních funkcí. Vliv poruchy funkce jater a ledvin na farmakokinetiku léčivého přípravku nebyl hodnocen, avšak při intravenózním podání se ukázalo, že se clearance fentanylu u poruchy funkce jater a ledvin kvůli změnám v metabolické clearance a plazmatických proteinech změnila. Po podání přípravku Vellofent může zhoršená funkce jater a ledvin zvýšit biologickou dostupnost požitého fentanylu a snížit jeho systémovou clearance, což by mohlo vést ke zvýšení a prodloužení účinku opioidů. Proto je zapotřebí zvláštní opatrnost během titrace u pacientů se středně těžkou nebo těžkou poruchou funkce jater nebo ledvin.
Podávání pacientům s hypovolémií a hypotenzí by mělo být pečlivě zváženo.
Serotoninový syndrom
Opatrnost se doporučuje při současném podávání přípravku Vellofent s léčivými přípravky, které ovlivňují serotoninergní neurotransmiterové systémy.
K vývoji potenciálně život ohrožujícího serotoninového syndromu může dojít při současném užití se serotoninergními léčivými přípravky, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) a s léčivými přípravky, které narušují metabolismus serotoninu (včetně inhibitorů monoaminooxidázy [IMAO]). K tomu může dojít v rámci doporučeného dávkování.
Serotoninový syndrom může zahrnovat změny duševního stavu (např. agitovanost, halucinace, kóma), nestabilitu autonomního systému autonomní nestabilitu (např. tachykardie, kolísání krevního tlaku, hypertermie), neuromuskulární abnormality (např. hyperreflexie, porucha koordinace, rigidita), a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem).
V případě podezření na serotoninový syndrom je nutno ukončit léčbu přípravkem Vellofent.
Účinnost a bezpečnost přípravku Vellofent u pacientů s poraněním ústní dutiny nebo mukozitidou nebyla hodnocena. U těchto pacientů může vzniknout riziko zvýšené systémové expozice léčivu, a proto je nutno věnovat velkou pozornost titraci dávky.
Při opakovaném podávání opioidů, jako je například fentanyl, se může vyvinout tolerance a fyzická a/nebo psychická závislost. Nicméně iatrogenní závislost po terapeutickém použití opioidů je vzácná.
Tento léčivý přípravek obsahuje 0,651 mg sodíku v jedné tabletě. To je třeba zohlednit u pacientů na dietě s kontrolovaným příjmem sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Přípravek Vellofent je kontraindikován u pacientů, kteří užívají nebo během posledních 14 dnů užívali inhibitory monoaminooxidázy (IMAO), protože byla hlášena závažná a nepředvídatelná potenciace opioidních analgetik inhibitory MAO.
Fentanyl je metabolizován isoenzymem CYP3A4 v játrech a střevní sliznici. Inhibitory CYP3A4 jako jsou:
• makrolidová antibiotika (např. erythromycin, klarithromycin, telithromycin),
• azolová antimykotika (např. ketokonazol, itrakonazol, flukonazol),
• některé inhibitory proteáz (např. ritonavir, indinavir, nelfinavir, sachinavir),
• blokátory kalciových kanálů (např. diltiazem nebo verapamil),
• antiemetika (např. aprepitant nebo dronabinol),
• antidepresiva (např. fluoxetin),
• antacida (např. cimetidin)
nebo alkohol, mohou zvýšit biologickou dostupnost požitého fentanylu a mohou snížit jeho
systémovou clearance, což může vést k zesílení či prodloužení opioidních účinků a k potenciálně fatální respirační depresi. Podobné účinky mohou být pozorovány po souběžné konzumaci grapefruitové šťávy, která je známým inhibitorem CYP3A4. Je tedy nutná opatrnost při podávání fentanylu současně s inhibitory CYP3A4. Pacienti léčení přípravkem Vellofent, kteří zahajují léčbu nebo se jim zvyšuje dávka inhibitorů CYP3A4, by měli být dlouhodobě pečlivě sledováni z hlediska projevů toxicity opioidů.
Souběžné použití přípravku Vellofent se silnými induktory CYP3A4 jako jsou:
• barbituráty a jiná sedativa (např. fenobarbital),
• antiepileptika (např. karbamazepin, fenytoin, oxkarbazepin),
• některá antivirotika (např. efavirenz, nevirapin),
• antiflogistika či imunosupresiva (např. glukokortikoidy),
• antidiabetika (např. pioglitazon),
• antibiotika k léčbě tuberkulózy (např. rifabutin, rifampicin),
• psychotropní látky (např. modafinil),
• antidepresiva (např. třezalka tečkovaná),
může vést ke snížení plazmatických koncentrací fentanylu, což může snížit účinnost přípravku Vellofent. Pacienti léčení přípravkem Vellofent, kteří ukončili léčbu nebo jim byla snížena dávka induktorů CYP3A4, by měli být sledováni z hlediska projevů zvýšeného účinku přípravku Vellofent či jeho toxicity a dávka přípravku Vellofent by měla být adekvátně upravena.
Souběžné používání jiných látek tlumících centrální nervový systém včetně jiných opioidů, sedativ nebo hypnotik, celkových anestetik, fenothiazinů, trankvilizérů, myorelaxancií, sedativních antihistaminik a alkoholu může stupňovat depresivní účinky.
Není doporučeno současné užívání parciálních opioidních agonistů/antagonistů (např. buprenorfinu, nalbufinu, pentazocinu). Mají vysokou afinitu k opioidním receptorům s relativně nízkou vlastní aktivitou, a proto působí zčásti antagonisticky proti analgetickému účinku fentanylu a u pacientů se závislostí na opioidech mohou navozovat příznaky z vysazení.
Serotoninergní lékv
Současné podávání fentanylu se serotoninergní látkou, jako je selektivní inhibitor zpětného vychytávání seronotinu (SSRI), nebo inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI) nebo inhibitor monoaminooxidázy (IMAO), může zvýšit riziko serotoninového syndromu, což je potenciálně život ohrožující stav.
4.6 Fertilita, těhotenství a kojení
O použití fentanylu u těhotných žen nejsou k dispozici příslušné údaje. Studie se zvířaty prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známé. Vellofent by neměl být podáván v těhotenství, pokud to není nezbytně nutné.
Po dlouhodobém podávání může fentanyl způsobovat abstinenční příznaky u novorozenců. Nedoporučuje se podávat fentanyl na začátku porodu a během něj (včetně císařského řezu), protože fentanyl prochází placentou a může u plodu nebo u novorozence vyvolat respirační depresi. Pokud je přípravek Vellofent podáván, mělo by být pro dítě snadno dostupné antidotum.
Kojení
Fentanyl přechází do mateřského mléka a u kojeného dítěte může působit sedativně nebo vyvolat respirační depresi. Kojící ženy nemají fentanyl užívat a kojení se má znovu zahájit nejdříve za 5 dní po posledním podání fentanylu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny.
Opioidní analgetika však zhoršují mentální a/nebo fyzickou schopnost požadovanou pro provádění potenciálně nebezpečných úkolů (např. řízení vozidla nebo obsluha stroje). Pacienti by měli být poučeni, aby při používání přípravku Vellofent neřídili a neobsluhovali stroje, pokud budou cítit ospalost, závratě či poruchy vidění a také, aby neřídili či neobsluhovali stroje, dokud nebudou vědět, jak na léčbu reagují.
4.8 Nežádoucí účinky
U přípravku Vellofent lze očekávat typické nežádoucí účinky opioidů. S pokračujícím užíváním léčivého přípravku jejich intenzita často klesá či mizí s tím, jak je pacient titrován na nejvhodnější dávku. Nejzávažnějšími nežádoucími účinky jsou však respirační deprese (potenciálně vedoucí k apnoi a respirační zástavě), oběhová deprese, hypotenze a šok, a tedy by všichni pacienti měli být pečlivě sledováni.
Nejčastěji hlášenými nežádoucími účinky byly nauzea, zvracení, zácpa, bolest hlavy, somnolence/únava a závrať.
Následující nežádoucí účinky byly hlášeny při podávání přípravku Vellofent a/nebo dalších přípravků obsahujících fentanyl během klinických studií a ze zkušeností z období po uvedení přípravku na trh. Vzhledem k souběžné léčbě s opiody během klinických studií a v klinické praxi není možné definitivně oddělit účinky samotného fentanylu.
Níže jmenované nežádoucí účinky jsou uvedeny dle terminologie MedDRA (frekvence výskytu je definována jako: velmi časté >1/10, časté >1/100 až <1/10, méně časté > 1/1 000 až < 1/100, vzácné >1/10 000 až <1/1 000, velmi vzácné <1/10 000, není známo - z dostupných údajů nelze určit):
|
Třídy orgánových |
Velmi časté |
Časté |
Méně časté |
Není známo |
|
systémů podle MedDRA | ||||
|
Poruchy metabolismu a výživy | ||||
|
Psychiatrické poruchy |
zmatenost, anxieta, halucinace, porucha myšlení |
abnormální sny, depersonalizace, deprese, emocionální labilita, euforie | ||
|
Poruchy nervového systému |
somnolence, sedace, závratě |
ztráta vědomí, vertigo, bolest hlavy, myoklonus, změny chuti |
kóma, konvulze, parestezie (včetně hyperestezie/cirkumorální parestezie), porucha chůze/porucha koordinace | |
|
Poruchy oka |
porucha vidění (rozmazané, dvojité) | |||
|
Cévní poruchy |
zrudnutí a návaly horka | |||
|
Respirační, hrudní a mediastinální poruchy | ||||
|
Gastrointestinální poruchy |
zácpa |
zvracení, sucho v ústech, bolest břicha, dyspepsie, |
ileus, flatulence, břišní distenze, zubní kazy |
vypadávání zubů, ústup dásní, průjem |
|
Poruchy kůže a podkožní tkáně |
pruritus, pocení | |||
|
Poruchy ledvin a močových cest |
zadržování moči | |||
|
Celkové poruchy a reakce v místě aplikace |
astenie |
periferní edém, pyrexie, syndrom z vysazení* | ||
|
Poranění, otravy a procedurální komplikace |
náhodná poranění (například pád) |
* u transmukózního fentanylu byly pozorovány příznaky z vysazení opioidů jako nauzea, zvracení, průjem, úzkost, zimnice, třes a pocení
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Předpokládá se, že příznaky předávkování fentanylem budou svojí povahou podobné příznakům intravenózně podávaného fentanylu a jiných opioidů a jsou zesílenými farmakologickými účinky.
Nejzávažnějšími a nejvýznamnějšími účinky jsou změna mentálního stavu, ztráta vědomí, kóma, kardiorespirační zástava, respirační deprese, respirační tíseň a respirační selhání s fatálním zakončením.
Bezprostřední léčba předávkování opioidy zahrnuje vyjmutí přípravku Vellofent z ústní dutiny, pokud je stále ještě v ústech, zajištění dýchacích cest pacienta, fyzickou a verbální stimulaci pacienta, zhodnocení úrovně vědomí, stavu ventilace a oběhu a asistovanou ventilaci (podporu dýchání), je-li to nutné.
K léčbě předávkování (náhodné požití) u osoby dříve neléčené opioidy je nutné získat intravenózní přístup a podávat podle klinické indikace naloxon nebo jiné antagonisty opioidů. Doba trvání respirační deprese po předávkování může být delší než účinky působení antagonisty opioidů (např. poločas naloxonu se pohybuje v rozmezí 30 až 81 minut) a může být nezbytné opakované podání. Podrobnosti o takovém použití naleznete v Souhrnu údajů o přípravku příslušného antagonisty opioidů.
K léčbě předávkování u pacientů udržovaných na opioidech je zapotřebí získat intravenózní přístup. V některých případech může být zaručeným způsobem léčby uvážlivé používání naloxonu nebo jiného antagonisty opioidů, ale je to spojeno s rizikem vyvolání akutního abstinenčního syndromu.
Pokud se objeví závažná nebo přetrvávající hypotenze, měla by být zvážena hypovolémie a zajištěn přívod parenterálních tekutin v přiměřeném množství.
Při použití fentanylu či jiných opioidů byla hlášena svalová ztuhlost narušující respiraci. V tomto případě může být nutná endotracheální intubace, asistovaná ventilace, podání antagonistů opioidů a také podání myorelaxancií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: deriváty fenylpiperidinu.
ATC kód: N02AB03.
Fentanyl je opioidní analgetikum, které převážně interaguje s opioidním p-receptorem. Primárními terapeutickými účinky jsou analgezie a sedace. Sekundárními farmakologickými účinky jsou respirační deprese, bradykardie, hypotermie, zácpa, mióza, fyzická závislost a euforie.
Analgetické účinky fentanylu souvisí sjeho hladinou v plazmě. Obecně lze říci, že účinné koncentrace a koncentrace, kdy se projevuje toxicita, se zvyšují se zvyšující se tolerancí na opioidy. Rychlost vzniku tolerance je u jednotlivců široce variabilní. Proto by měly být dávky přípravku Vellofent individuálně titrovány, aby byl dosažen žádaný efekt (viz bod 4.2).
Účinnost a bezpečnost přípravku Vellofent byla hodnocena ve dvojitě zaslepené randomizované, placebem kontrolované zkřížené studii u 91 dospělých onkologických pacientů léčených opioidy s 1 -4 epizodami průlomové bolesti (BTP - breakthrough pain) za den. Primárním cílem (endpoint) byl součet rozdílů v intenzitě bolesti 30 minut po podání dávky (SPID30 - sum of pain intensity difference), který byl statisticky významný ve srovnání s placebem (p < 0,0001).
Součet rozdílů v intenzitě bolesti od 6 minut po podání dávky až do 60 minut byl také významný ve srovnání s placebem (p = 0,02 po 6 minutách a p < 0,0001 po 60 minutách) (viz obrázek níže).
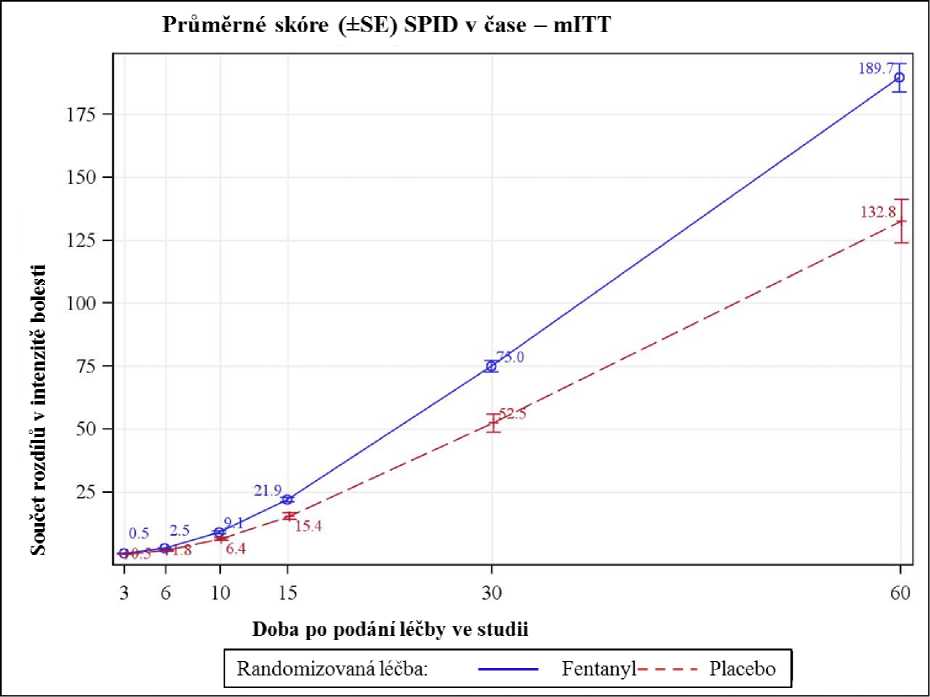
Vyšší účinnost Vellofentu oproti placebu podpořily výsledky sekundárních endpointů:
- průměrný rozdíl v intenzitě bolesti (PID - pain intensity difference) byl významně vyšší u BTP epizod léčených fentanylem ve srovnání s epizodami léčenými placebem v době od 6 minut po podání dávky až do 60 minut (p = 0,003 a p < 0,0001) (viz obrázek níže),
Průměrné skóre (±SE) PID v čase - itiITT
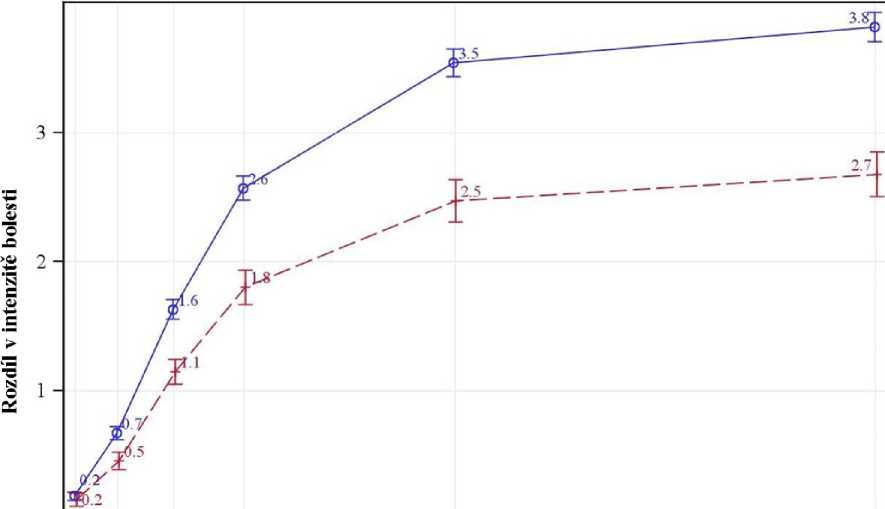
T
3 6 10 15 30 60
Doba po podání léčby ve studii
|
1 • , . , .. |
1 ni 1 |
|
Kandomizovana léčba. |
i cntanyl — ~ ■ 1'Iaccbo |
- průměrná úleva od bolesti (PR - pain relief) byla významně vyšší u BTP epizod léčených fentanylem ve srovnání s epizodami léčenými placebem od 6 minut po podání dávky až do 60 minut (p = 0,002 a p < 0,0001),
- epizody BTP léčené Vellofentem si vyžádaly užití záchranné léčby významně méně často než epizody léčené placebem,
- bylo hlášeno významné zlepšení ve skóre bolesti (> 33% a > 50% snížení) u BTP léčené Vellofentem po 15 a 30 minutách.
Všichni agonisté opioidního p-receptoru včetně fentanylu vyvolávají respirační depresi závislou na dávce. Riziko respirační deprese je nižší u pacientů na chronické terapii opioidy, u nichž se rozvine tolerance vůči respirační depresi a dalším účinkům opioidů.
Ačkoli opioidy obecně zvyšují tonus hladkého svalstva močových cest, celkový účinek může být různý, v některých případech vyvolává nucení na močení, jindy zase problémy s močením.
Opioidy zvyšují tonus a snižují hnací kontrakce gastrointestinálního hladkého svalstva, což vede k prodloužení doby průchodu gastrointestinálním traktem a může být příčinou konstipačního účinku fentanylu.
5.2 Farmakokinetické vlastnosti
Fentanyl je vysoce lipofilní a může se velmi rychle absorbovat ústní sliznicí a pomaleji konvenční gastrointestinální cestou. Perorálně podaný fentanyl podléhá ve velké míře metabolismu prvního průchodu v játrech a střevnímu metabolismu a jeho metabolity se nepodílejí na terapeutickém účinku fentanylu.
Přípravek Vellofent je vyroben za použití technologie, která umožňuje rychlé uvolňování fentanylu a zvyšuje rychlost a míru vstřebávání fentanylu mukózou dutiny ústní. Absolutní biologická dostupnost přípravku Vellofent nebyla stanovena, ale odhaduje se na asi 70 %.
Absorpce
Střední maximální plasmatické koncentrace se pohybují v rozmezí 360 až 2 070 pg/ml (po podání 133 - 800 pg) a jsou dosaženy během 50 až 90 minut.
Distribuce
Fentanyl je vysoce lipofilní a je dobře distribuován mimo vaskulární systém s velkým zdánlivým distribučním objemem. Po sublingválním podání přípravku Vellofent je fentanyl rychle distribuován do stavu rovnováhy fentanylu mezi plazmou a vysoce perfundovanými tkáněmi (mozek, srdce a plíce). Následně je fentanyl re-distribuován do hlubších tkání (svaly a tuk) a do plasmy.
Vazba fentanylu na plazmatické proteiny činí 80 až 85 %. Hlavním vazebným proteinem je alfa-1-kyselý glykoprotein, ale do určité míry přispívá jak albumin, tak lipoproteiny. S acidózou roste volná frakce fentanylu.
Biotransformace a eliminace
Fentanyl je metabolizován v játrech a ve střevní sliznici na norfentanyl prostřednictvím cytochromu P450, izoformy CYP3A4. Norfentanyl nebyl ve studiích se zvířaty farmakologicky aktivní. Více než 90 % podané dávky fentanylu je eliminováno biotransformací na N-dealkylované a hydroxylované neaktivní metabolity.
Po intravenózním podání fentanylu je močí bez změny vylučováno méně než 7 % podané dávky a pouze asi 1 % se vylučuje nezměněné stolicí. Metabolity se vylučují hlavně močí, zatímco exkrece stolicí je méně důležitá.
Terminální eliminační fáze fentanylu je výsledkem redistribuce mezi plasmou a hlubokými tkáněmi. Po podání přípravku Vellofent je terminální eliminační poločas asi 12 hodin.
Linearita/nelinearita
Byla prokázána proporcionalita dávky od 133 mikrogramů do 800 mikrogramů.
Porucha funkce ledvin/jater
Porucha funkce jater nebo ledvin může vést ke zvýšení sérových koncentrací. Starší, kachektičtí nebo celkově oslabení pacienti mohou mít nižší clearance fentanylu, což může prodloužit terminální poločas účinné látky (viz body 4.2 a 4.4).
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a karcinogenity neodhalily žádné zvláštní riziko pro člověka. Studie embryo-fetální vývojové toxicity provedené na potkanech a králících nezjistily žádné malformace či vývojové odchylky způsobené látkou podávanou v období organogeneze.
Ve studii fertility a časného embryonálního vývoje u potkanů byl při vysokých dávkách (300 pg/kg/den, s.c.) zaznamenán účinek zprostředkovaný samcem, který je konzistentní se sedativními účinky fentanylu ve studiích na zvířatech.
Ve studiích prenatálního a postnatálního vývoje u potkanů byla míra přežití potomstva signifikantně snížena při dávkách, které vedly k závažné toxicitě pro matku. Dalšími nálezy u mláďat F1 generace při dávkách toxických pro matku byly opožděný fyzický vývoj a opožděný vývoj senzorických funkcí, reflexů a chování. Tyto účinky by mohly představovat buď nepřímé účinky změny mateřské péče a/nebo snížené míry kojení nebo přímý účinek fentanylu na mláďata.
Studie karcinogenity (26týdenní dermální alternativní biologické zkoušky na Tg.AC transgenních myších, dvouletá studie subkutánní karcinogenity u potkanů) s fentanylem neodhalily žádné nálezy svědčící o onkogenním potenciálu. Hodnocení snímků mozku ze studie kancerogenity u potkanů odhalilo mozkové léze u zvířat, kterým byly podávány vysoké dávky fentanyl-citrátu. Význam těchto nálezů pro člověka není známý.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Hydrogenfosforečnan vápenatý
Mikrokrystalická celulosa
Hydrogenfosforečnan sodný
Hypromelosa
Makrogol
Magnesium-stearát
Maltodextrin
Oxid titaničitý (E171)
Triacetin
Inkoust potisku - černý inkoust [šelak, černý oxid železitý (E172)]
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
Uchovávejte v původním blistru, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Odlupovací dětský bezpečnostní blistr:
- Polyamid-Al-PVC/Al blistr, krabička
- Polyamid-Al-PVC/Al-PET blistr, krabička Velikost balení: 3, 4, 15 nebo 30 sublingválních tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Sublingvální tablety obsahující léčivou látku se nesmí vyhazovat do domácího odpadu. Zbylý materiál musí být bezpečně zlikvidován. Pacienti/pečovatelé by měli být poučeni, že veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Angelini Pharma Česká republika s.r.o.Páteřní 7, 635 00 Brno, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
Vellofent 67 mikrogramů: 65/123/13-C Vellofent 133 mikrogramů: 65/124/13-C Vellofent 267 mikrogramů: 65/125/13-C Vellofent 400 mikrogramů: 65/126/13-C Vellofent 533 mikrogramů: 65/127/13-C Vellofent 800 mikrogramů: 65/128/13-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 10.4.2013
10. DATUM REVIZE TEXTU
31.8.2015
14