Valganciclovir Aurobindo 450 Mg Potahované Tablety
sp. zn. sukls108365/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Valganciclovir Aurobindo 450 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ"
Jedna potahovanátableta obsahuje valgancicloviri hydrochloridum 496,36 mg, což odpovídá valganciclovirum 450 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Oválné, bikonvexní potahované tablety růžové barvys vyraženým ‘H’ na jedné a ‘96’ na druhé straně. Velikost je 16,8 mm x7,9 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutickéindikace
Valganciclovir Aurobindo je určen pro indukční a udržovací léčbu cytomegalovirové (CMV) retinitidy u pacientů se syndromem získaného imunodeficitu (AIDS).
Valganciclovir Aurobindo je indikován k prevenci CMV onemocnění u CMVnegativních příjemců orgánových transplantátů od CMV pozitivních dárců.
4.2 Dávkování a způsobpodání
Dávkování
Pozor - je nezbytně nutné přísně dodržovat doporučené dávkování, aby se předešlo předávkování (viz body 4.4 a 4.9).
Valganciklovir se po perorálním podání rychle a extenzivně metabolizuje na ganciklovir. Perorální valganciklovir v dávce 900 mg podávaný dvakrát denně je léčebně stejně účinný jako intravenózně podávaný ganciklovir v dávce 5mg/kg dvakrát denně.
Standardní dávkování u dospělých
Indukční léčba u CMV retinitidy:
U pacientů s aktivní CMV retinitidou je doporučena dávka 900 mg valgancikloviru (2 tablety přípravku Valganciclovir Aurobindo 450 mg) dvakrát denně po dobu 21 dní, podávaných dle možností společně s jídlem. Prodloužení indukční léčby může zvyšovat riziko poškození kostní dřeně (viz bod 4.4).
Udržovací léčba u CMV retinitidy:
Po předcházející indukční léčbě nebo u pacientů se stabilizovanou CMV retinitidou je doporučena perorální udržovací dávka 900 mg valgancikloviru (dvě tablety přípravku Valganciclovir Aurobindo 450 mg) jednou denně, podávaných dle možností společně s jídlem. U pacientů se zhoršující se retinitidou je možno indukční léčbu zopakovat, je však třeba vzít v úvahu možnou lékovou rezistenci viru.
Prevence CMV onemocnění u příjemců transplantovaných solidních orgánů:
U pacientů po transplantaci ledviny se doporučuje dávka 900 mg (2 tablety přípravku Valganciclovir Aurobindo 450 mg) jednou denně, zahájená do 10 dnů po transplantaci a podávaná do 100 dnů po transplantaci.Profylaktická léčba může pokračovat do 200 dnů po transplantaci (viz body 4.4, 4.8 a 5.1).
U pacientů, kteří jsou příjemci transplantovaných solidních orgánů (kromě ledviny) se doporučuje dávka 900 mg (dvě tablety přípravku Valganciclovir Aurobindo 450 mg) jednou denně, zahájená do 10 dnů po transplantaci a podávaná do 100 dnů po transplantaci.
Kdykoli to je možné, mají být tablety podávány s jídlem.
Pokyny ke zvláštnímu dávkování
Pacienti s poruchou funkce ledvin:
Je třeba pečlivě sledovat hodnoty kreatininu v séru a clearance kreatininu. Úprava dávkování je doporučena na základě clearance kreatininu dle následující tabulky (viz body 4.4 a 5.2). Odhadovaná clearance kreatininu (ml/min) může být vypočtena ze sérového kreatininu podle následujícího vzorce:
(140 - věk [roky]) x (tělesná hmotnost [kg])
U mužů = ..........................................................
(72) x (0,011x kreatinin v séru [pmol/l])
U žen = 0,85 x hodnota pro muže
|
CrCl (ml/min) |
Indukční dávka valgancikloviru |
Udržovací/preventivní dávka valgancikloviru |
|
>60 |
900 mg (2 tablety) dvakrát denně |
900 mg (2 tablety) jednou denně |
|
40 - 59 |
450 mg (1 tableta) dvakrát denně |
450 mg (1 tableta) jednou denně |
|
25 - 39 |
450 mg (1 tableta) jednou denně |
450 mg (1 tableta) jednou za dva dny |
|
10 - 24 |
450 mg (1 tableta) jednou za dva dny |
450 mg (1 tableta) dvakrát týdně |
|
<10 |
nedoporučuje se |
nedoporučuje se |
Pacienti podstupující hemodialýzu:
U hemodialyzovaných pacientů (CrCl < 10 ml/min) nelze vydat doporučení pro dávkování. U těchto pacientů se valganciklovir nemá používat (viz body 4.4 a 5.2).
Pacienti s poruchou funkce jater:
Bezpečnost a účinnost valgancikloviru u pacientů s poruchou funkce jater dosud nebyla studována (viz bod 5.2).
Pediatrická populace :
V odpovídajících kontrolovaných klinických studiích nebyla bezpečnost a účinnost valgancikloviru u pediatrických pacientů stanovena V současné době dostupné údaje jsou popsány v bodech 4.8, 5.1 a 5.2, ale na jejich základě nelze učinit doporučení pro dávkování.
Starší pacienti:
Bezpečnost a účinnost valgancikloviru u této skupiny pacientů dosud nebyla stanovena.
Pacienti s těžkou leukopenií, neutropenií, anémií, trombocytopenií a pancytopenií:
Před zahájením léčby si přečtěte bod 4.4.
Pokud se během léčby přípravkem Valganciclovir Aurobindo objeví významné odchylky v počtu krevních buněk, je třeba zvážit léčbu hematopoetickými růstovými faktory a/nebo přerušení léčby (viz bod 4.4).
Způsobpodání:
Valganciklovir se podává perorálně a pokud možno současně s jídlem (viz bod 5.2).
Opatření, která je nutno učinit před zacházením s léčivým přípravkem nebo před jeho podáním Tablety se nemají půlit ani drtit.Vzhledem k tomu, že valganciklovir je považován u lidí za potenciální teratogen a karcinogen, je třeba věnovat velkou pozornost manipulaci s poškozenými tabletami (viz bod 4.4). Zabraňte přímému kontaktu poškozených či rozdrcených tablet s kůží či sliznicemi. V případě takového kontaktu se důkladně umyjte mýdlem a vodou, důkladně vypláchněte oči sterilní vodou nebo alespoň čistou vodou, není-li sterilní voda k dispozici.
4.3 Kontraindikace
Přípravek Valganciclovir Aurobindo je kontraindikován u pacientů s hypersenzitivitou na valganciklovir, ganciklovir nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Vzhledem k podobné chemické struktuře valgancikloviru, acikloviru a valacikloviru není vyloučena zkřížená hypersenzitivita mezi těmito léčivy. Proto je přípravek Valganciclovir Aurobindo kontraindikován u pacientů s hypersenzitivitou na aciklovir a valaciklovir.
Přípravek Valganciclovir Aurobindo je kontraindikován v době kojení (viz bod 4.6).
4.4 Zvláštníupozornění a opatření pro použití
Před zahájením léčby valganciklovirem je třeba poučit pacienty o možných rizicích pro plod. Při studiích na zvířatech byla u gancikloviru prokázána mutagenita, teratogenita, aspermatogenicita, karcinogenita a potlačení ženské fertility. Valganciklovir proto má být u člověka považován za potenciální teratogen a karcinogen, který může způsobit vrozené defekty a maligní onemocnění (viz bod 5.3).Je též pravděpodobné, že valganciklovir způsobuje přechodnou či trvalou inhibici spermatogeneze.Ženám ve fertilním věku musí být během léčby doporučeno používání účinné antikoncepce.Mužům musí být během léčby doporučeno používání bariérové antikoncepce a ještě nejméně 90 dní po jejím skončení, pokud není jisté, že partnerka nemůže otěhotnět (viz body 4.6, 4.8 a 5.3).
Z dlouhodobého hlediska je používání valgancikloviru spojeno s možným rizikem kancerogenity a reprodukční toxicity.
U pacientů léčených valganciklovirem (a ganciklovirem) byla pozorována těžká leukopenie, neutropenie, anémie, trombocytopenie, pancytopenie, útlum kostní dřeně a aplastická anémie. Léčba proto nemá být zahajována u pacientů, kteří mají absolutní počet neutrofilů nižší než 500 buněk/pl nebo počet trombocytů nižší než 25 000/pl, nebo pokud je hladina hemoglobinu nižší než 8 g/dl (viz body 4.2 a 4.8).
Při rozšíření profylaktické léčby na více než 100 dnů je třeba vzít v úvahu možné riziko rozvoje leukopenie a neutropenie (viz body 4.2, 4.8 a 5.1).
U pacientů s již existující hematologickou cytopenií nebo s anamnézou polékové hematologické cytopenie a u pacientů, kteří j sou současně léčeni radioterapií, má být podávání valgancikloviruindikováno uvážlivě.
Během léčby se doporučuje sledovat kompletní krevní obraz včetně počtu trombocytů.Častější monitorování hematologických parametrů se doporučuje u pacientů s poruchami funkce ledvin.U pacientů, u kterých došlo k rozvoji těžké leukopenie, neutropenie, anémie a/nebo trombocytopenie, je doporučeno zvážit léčbu hematopoetickými růstovými faktory a/nebo přerušení léčby (viz body 4.2).
Biologická dostupnost gancikloviru po jedné dávce 900 mg valgancikloviru je přibližně 60 % ve srovnání s přibližně 6% dostupností po podání 1000 mg perorálního gancikloviru (ve formě tobolek). Nadměrná expozice gancikloviru může být spojena s život ohrožujícími nežádoucími účinky. Z tohoto důvodu se doporučuje důsledně dodržovat doporučené dávkování při zahájení léčby, při přechodu z indukční na udržovací léčbu a u pacientů, kteří přecházejí z perorálního podávání gancikloviru na valganciklovir, neboť valganciklovir nelze nahradit ganciklovirem v tobolkách v poměru jedna ku jedné. Pacienty, kteří přecházejí z léčby ganciklovirem v tobolkách, je třeba upozornit na riziko předávkování, pokud budou užívat více tablet přípravku Valganciclovir Aurobindo, než jim bylo předepsáno (viz body 4.2 a 4.9).
U pacientů s poruchou funkce ledvin je nutnédávkování upravovat podle hodnot clearance kreatininu (viz body 4.2 a 5.2).
Valganciklovir Aurobindo se nemá podávat hemodialyzovaným pacientům (viz body 4.2 a 5.2).
U pacientů léčených současně imipenem/cilastatinem a ganciklovirem byly hlášeny křeče.Valganciklovir proto nemá být podáván současně s imipenem/cilastatinem, pokud přínos léčby nepřevažuje možná rizika (viz bod 4.5).
U pacientů léčených valganciklovirem a (a) didanosinem, (b) léčivy se známým myelosupresivním účinkem (např. zidovudin) nebo (c) látkami, které ovlivňují funkci ledvin, je třeba pečlivě sledovat příznaky zvýšené toxicity (viz bod 4.5).
V kontrolovaných klinických studiích, které hodnotily valganciklovir v profylaxi CMV onemocnění při transplantacích, nebyli zařazeni pacienti po transplantaci plic a střev, jak je uvedeno v bodě 5.1. Proto jsou zkušenosti u této skupiny pacientů omezené.
4.5 Interakce s jinýmiléčivýmipřípravky a jinéformyinterakce
Lékové interakce s valganciklovirem
Specifické in vivo studie lékových interakcí s valganciklovirem dosud nebyly provedeny. Vzhledem k tomu, že se valganciklovir rychle a extenzivně metabolizuje na ganciklovir, předpokládá se, že lékové interakce s ganciklovirem budou stejné i pro valganciklovir.
Lékové interakce s ganciklovirem
Imipenem/cilastatin
U pacientů, kteří byli léčeni současně ganciklovirem a imipenem/cilastatinem, byly hlášeny křeče. Tato léčiva se nemají podávat současně, pokud přínos léčby nepřeváží možná rizika (viz bod 4.4).
Probenecid
Probenecid podávaný současně s perorálním ganciklovirem vede ke statisticky významnému snížení renální clearance gancikloviru (20 %), a tím ke statisticky významnému zvýšení expozice (40 %).Tyto změny jsou způsobeny mechanismem interakce zahrnujícím kompetici o renální tubulární sekreci.Proto mají být pacienti, kteří užívají současně probenecid a valganciklovir, pečlivě sledováni pro možné toxické účinky gancikloviru.
Účinky gancikloviru na jiné léčivé přípravky
Zidovudin
Pokud je zidovudin podáván společně s perorálním ganciklovirem, může dojít k malému (17 %), ale statisticky významnému zvýšení AUC zidovudinu.Byl pozorován též trend ke snížení koncentrace gancikloviru, pokud byl podáván se zidovudinem, ale tento trend nedosáhl statistické významnosti.
Jak zidovudin, tak i ganciklovir mohou vyvolat neutropenii a anémii, někteří pacienti nesnášejí současnou léčbu oběma přípravky v plné dávce (viz bod 4.4).
Didanosin
Bylo pozorováno, že plazmatické koncentrace didanosinu jsou trvale zvýšené při současném podávání s ganciklovirem (v perorální i intravenózní lékové formě). Při perorální dávce gancikloviru 3 g a 6 g/den bylo pozorováno zvýšení AUC didanosinu v rozmezí od 84 do 124 %, podobně po intravenózní dávce 5 mg a 10 mg/kg/den bylo pozorováno zvýšení AUC didanosinu v rozmezí od 38 do 67 %. Nebyl pozorován žádný signifikantní účinek na koncentraci gancikloviru. U pacientů je proto třeba pečlivě sledovat možný výskyt projevů toxicity didanosinu (viz bod 4.4).
Mofetil-mykofenolát
Na základě výsledků studie s jednorázovým podáním doporučené dávky perorálního mofetil-mykofenolátu (MMF) a intravenózního gancikloviru při známém vlivu poruchy funkce ledvin na farmakokinetiku MMF a gancikloviru lze předpokládat, že současné podávání těchto dvou léčivých látek (které mají schopnost soutěžit o renální tubulární sekreci) povede ke zvýšení koncentrace fenolového glukuronidu mykofenolové kyseliny (MPAG) a gancikloviru. Nepředpokládá se žádnázávažná alterace farmakokinetiky mykofenolové kyseliny (MPA), a tak není potřeba upravovat dávky MMF. U pacientů s poruchou funkce ledvin, kterým je podáván současně MMF s ganciklovirem, je třeba dodržovat doporučení pro dávkování gancikloviru a tito pacienti mají být pečlivě monitorováni. Vzhledem k tomu, že jak MMF, tak ganciklovir mohou vyvolat neutropenii a leukopenii, mají být pacienti pečlivě sledováni z důvodu zvýšené toxicity.
Zalcitabin
Žádné klinicky významné farmakokinetické změny byly pozorovány po současném podávání gancikloviru a zalcitabinu.Valganciklovir i zalcitabin mají potenciál způsobit periferní neuropatie a pacienti mají býts ohledem na tyto skutečnostisledováni.
Stavudin
Žádné klinicky signifikantní interakce při současném podávání gancikloviru a stavudinu nebyly pozorovány.
Trimethoprim
Žádné klinicky signifikantní farmakokinetické interakce při současném podávání perorálního gancikloviru a trimethoprimu nebyly pozorovány.Existuje však určitá možnost zesílení toxicity, neboť je u obou léčiv znám jejich myelosupresivní účinek; proto je současné podávání obou léků možné, jen pokud přínos léčby vyváží její možná rizika.
Další antiretrovirová léčiva
V klinicky relevantních koncentracích je nepravděpodobná existence synergického či antagonistického účinku na inhibici HIV v přítomnosti gancikloviru či na CMV v přítomnosti různých antiretrovirových léčiv. Metabolické interakce, například s inhibitory proteáz a nenukleosidovými inhibitory reverzní transkriptázy (NNRTI), nejsou pravděpodobné z důvodu neúčasti enzymů systému P450 v metabolizmu valgancikloviru i gancikloviru.
Další možné lékové interakce
Toxicita může být vyšší v případě, že je valganciklovir podáván současně či bezprostředně před či po podání jiných léků, které inhibují replikaci rychle se dělících buněčných populací, jak je tomu v kostní
dřeni, varlatech a v germinálních vrstvách kůže a sliznice trávicího ústrojí. Příklady těchto druhů léků jsou: dapson, pentamidin, flucytosin, vinkristin, vinblastin, adriamycin, amfotericin B, kombinace trimethoprim/sulfonamid, nukleosidová analoga a hydroxyurea.
Protože je ganciklovir vylučován ledvinami (viz bod 5.2), může být toxicita vyšší při současném podávání valgancikloviru s léčivy, která mohou snižovat renální clearance gancikloviru, a tak zvyšovat jeho expozici. Renální clearance gancikloviru může být inhibována dvěma mechanismy: (a) nefrotoxicitou, způsobenou látkami jako například cidofovir či foskarnet, a (b) kompetitivní inhibicí aktivní tubulární sekrece v ledvinách, například ostatními nukleosidovými analogy.
Současné podávání valgancikloviru s těmito přípravky je proto zapotřebí pečlivě zvažovat a přistoupit k němu jen pokud možný přínos léčby vyváží její možná rizika (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici žádné informace o podávání valgancikloviru těhotným ženám. Aktivní metabolit valgancikloviru, ganciklovir, přechází volně přes lidskou placentu. Na základě farmakologického mechanismu účinku gancikloviru a reprodukční toxicity pozorované ve studiích na zvířatech (viz bod 5.3) existuje u člověka teoretické riziko teratogenity.
Valganciklovir nemá být podáván v těhotenství, pokud možný pozitivní efekt léčby matky nepřeváží možná rizika teratogenního postižení dítěte.
Kojení
Není známo, zda se ganciklovir vylučuje do mateřského mléka, je však třeba vzít v úvahu, že případnýpřechodgancikloviru do mateřského mléka může způsobit závažné nežádoucí účinky u kojených dětí. Proto musí být kojení ukončeno (viz bod 4.3).
Fertilita
Ženám ve fertilním věku musí být doporučeno používat v průběhu léčby účinnou antikoncepci. Mužům musí být doporučeno používání bariérové antikoncepce v průběhu léčby přípravkem Valganciklovir a ještě nejméně 90 dní po jejím ukončení, pokud není jisté, že partnerka nemůže otěhotnět (viz bod 5.3).
4.7 Účinkynaschopnostříditaobsluhovatstroje
Nebyly provedeny žádné studie hodnotící vliv přípravku na schopnost řídit dopravní prostředky a obsluhovat stroje.
U pacientů léčených valganciklovirem a/nebo ganciklovirem byly pozorovány křeče, sedace, závratě, ataxie a/nebo zmatenost. Pokud se vyskytnou, mohou tyto účinky ovlivnit činnosti vyžadující pozornost, včetně schopnosti řídit a obsluhovat stroje.
4.8 Nežádoucíúčinky
Valganciklovir je proléčivo gancikloviru, které se po perorálním podání rychle a extenzivně metabolizuje na ganciklovir. Nežádoucí účinky, jejichž spojitost s léčbou ganciklovirem je známá, je možno očekávat i po valgancikloviru. Všechny nežádoucí účinky, které byly v klinických studiích pozorovány po valgancikloviru, byly pozorovány již dříve i po gancikloviru. Nejčastěji hlášenými nežádoucími účinky po podání valgancikloviru u dospělých jsou neutropenie, anémie a průjem.
Valganciklovir je v porovnání s intravenózní formou gancikloviru spojen s vyšším rizikem průjmu. Kromě toho je podání valgancikloviru spojeno s vyšším rizikem neutropenie a leukopenie než při perorálním podání gancikloviru.
Těžká neutropenie (absolutní počet neutrofilů nižší než 500/gl) se vyskytuje častěji u pacientů s CMV retinitidou léčených valganciklovirem než u příjemců transplantovaného orgánu léčených valganciklovirem.
Četnost výskytu nežádoucích účinků hlášených v klinických studiích, které hodnotily valganciklovir, perorální ganciklovir nebo intravenózní ganciklovir, je uvedena v následující tabulce. Uváděné nežádoucí účinky se týkají klinických studií u pacientů s AIDS, kteří dostávali indukční nebo udržovací léčbu pro CMV retinitidu, nebo u pacientů po transplantaci jater, ledvin nebo srdce, kteří dostávali profylaxi CMV onemocnění. Označení (závažný) v závorce v této tabulce vyjadřuje skutečnost, že daný nežádoucí účinek byl u pacientů hlášen jak v mírné/střední intenzitě, tak i v závažné/život ohrožující intenzitě v uvedené četnosti výskytu.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů (MedDRA) |
Velmi časté (>1/10) |
Časté (>1/100 až<1/10) |
Méně časté (>1/1000 až<1/100) |
Vzácné (1/10 000 až<1/1 000) |
|
Infekce a infestace |
Orální kandidóza, sepse (bakteriemie, viremie),celulitida, infekce močových cest | |||
|
Poruchy krve a lymfatického systému |
(Závažná) neutropenie, |
Závažná anémie, (závažná) trombocytopenie, (závažná) leukopenie, (závažná) pancytopenie |
Útlum kostní dřeně |
Aplastická |
|
Poruchy imunitního systému |
Anafylaktická reakce | |||
|
Poruchy metabolismu a výživy |
Pokles chuti k jídlu, anorexie | |||
|
Psychiatrické poruchy |
Agitovanost, psychotická porucha, halucinace | |||
|
Poruchy nervového systému |
Bolest hlavy, insomnie, dysgeuzie, hypestézie, parestézie, periferní neuropatie, závrať, křeče | |||
|
Poruchy oka |
Edém makuly, odchlípení sítnice, zákal sklivce, bolest oka |
Poruchy vidění, konjunktivitida | ||
|
Poruchy ucha a labyrintu |
Bolest ucha |
Hluchota | ||
|
Srdeční poruchy | ||||
|
Cévní poruchy | ||||
|
Respirační, hrudní a mediastinální poruchy | ||||
|
Gastrointestinální poruchy |
Nauzea, zvracení, bolest břicha, bolest v horní části břicha, dyspepsie, |
Břišní distenze, ulcerace v ústech, pankreatitida |
|
zácpa, flatulence, dysfagie | ||||
|
Poruchy jater a žlučových cest |
(Závažná) porucha jaterní funkce, zvýšení alkalické fosfatázy v krvi, zvýšení aspartátaminotransferázy |
Zvýšení alaninaminotransferázy | ||
|
Poruchy kůže a podkožní tkáně |
Dermatitida, noční pocení, pruritus |
Alopecie, kopřivka, suchá kůže | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolest zad, myalgie, artralgie, svalové spasmy | |||
|
Poruchy ledvin a močových cest |
Snížená clearance kreatininu, porucha funkce ledvin |
Hematurie, selhání ledvin | ||
|
Poruchy reprodukčního systému a prsu |
Mužská infertilita | |||
|
Celkové poruchy a reakce v místě aplikace |
Únava, horečka, třesavka, bolest, bolest na hrudi, malátnost, astenie | |||
|
Vyšetření |
Snížení tělesné hmotnosti, zvýšení hladiny kreatininu v krvi |
Závažná trombocytopenie může být spojena s potenciálně život ohrožujícím krvácením. Pediatrická populace
K dispozici jsou pouze velmi omezené údaje týkající se expozice pediatrických pacientů valgancikloviru (viz rovněž body 5.1 a 5.2). V následující tabulce je uvedeno shrnutí všech nežádoucích příhod, které byly zaznamenány u více než 10 % (velmi často) z celkového počtu léčených pediatrických pacientů:
|
Tělesný systém |
Velmi časté nežádoucí účinky hlášené v klinických studiích |
|
Poruchy krve a lymfatického systému |
Anémie, neutropenie |
|
Cévní poruchy |
Hypertenze |
|
Respirační, hrudní a mediastinální poruchy |
Infekce horních cest dýchacích |
|
Gastrointestinální poruchy | |
|
Celkové poruchy a reakce v místě aplikace |
Pyrexie, rejekce transplantátu |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv,
Šrobárova 48,
100 41 Praha 10,
webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Zkušenosti s předávkováním valganciklovirem
U jednoho dospělého pacienta došlo po několika dnech podávání více než desetinásobku dávky, která se doporučuje s ohledem na stupeň poruchy funkce ledvin (snížená clearance kreatininu), k fatálnímu selhání kostní dřeně (aplázie dřeně).
Předpokládá se, že předávkování valganciklovirem může též mít za následek zvýšení renální toxicity (viz body 4.2 a 4.4).
U pacientů, u kterých došlo k předávkování valganciklovirem, jsou vhodnými metodami snížení plazmatických koncentrací léku hemodialýza a hydratace (viz bod 5.2).
Zkušenosti s předávkováním intravenózním ganciklovirem
Hlášení o předávkování intravenózním ganciklovirem byla získána v klinických studiích a během post-marketingového sledování. V některých případech nebyly pozorovány žádné nežádoucí účinky.
U většiny pacientů však došlo k výskytu jednoho či více nežádoucích účinků, které jsou uvedeny níže:
- Hematologická toxicita: pancytopenie, útlum kostní dřeně, aplazie kostní dřeně, leukopenie, neutropenie,granulocytopenie
- Hepatotoxicita: hepatitida, porucha jaterních funkcí
- Nefrotoxicita: zhoršení hematurie u pacientů s předchozím postižením ledvin, akutní renální selhání, zvýšení kreatininu
- Gastrointestinální toxicita: bolest břicha, průjem, zvracení
- Neurotoxicita: generalizovaný třes, křeče
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamickévlastnosti
Farmakoterapeutická skupina: antivirotika pro systémovou aplikaci, nukleosidy a nukleotidy, kromě inhibitorů reverzní transkriptázy ATC kód: J05AB14
Mechanismus účinku
Valganciklovir je L-valyl ester (proléčivo) gancikloviru. Po perorálním podání je působením střevních a jaterních esteráz rychle a extenzivně metabolizován na ganciklovir. Ganciklovir je syntetický analog 2’-deoxyguanosinu, který inhibuje replikaci herpetických virů in vitro i in vivo. Z lidských herpetických virů jsou citlivé vůči gancikloviru: lidský cytomegalovirus (HCMV), virus herpes simplex typ 1 a typ 2 (HSV-1 a HSV-2), lidský virus herpes typ 6, 7 a 8 (HHV-6, HHV-7, HHV-8), virus Epstein-Barrové (EBV), varicella zoster virus (VZV) a virus hepatitidy B (HBV).
V buňkách infikovaných CMV virem je ganciklovir nejprve fosforylován na ganciklovirmonofosfát prostřednictvím virové proteinkinázy pUL97. Následnou fosforylací, která je zprostředkována buněčnými kinázami, vzniká ganciklovir-trifosfát, který je pak pomalu intracelulárně metabolizován. Metabolizmus trifosfátu se objevuje u buněk infikovaných viry typu HSV a HCMV s poločasem 18 hodin (v rozmezí 6-24 hodin) po vymizení extracelulárního gancikloviru. Protože je fosforylace z velké části závislá na virové kináze, dochází k fosforylaci gancikloviru přednostně v buňkách infikovaných virem.
Předpokládá se, že virostatický účinek gancikloviru je výsledkem inhibice syntézy virové DNA, která probíhá jako: (a) kompetitivní inhibice inkorporace deoxyguanosin-trifosfátu do DNA účinkem virové DNA polymerázy a (b) inkorporace ganciklovir-trifosfátu do virové DNA s následnou terminací nebo (velmi omezeně) další elongací virové DNA.
Protivirová aktivita
Protivirová aktivita, měřená in vitro jako IC50 gancikloviru proti CMV, se pohybuje v rozmezí 0,08 (0,02 ^g/ml) do 14 (3,5 ^g/ml).
Klinický byl protivirový účinek přípravku valganciklovirem prokázán v léčbě nově diagnostikované CMV retinitidy u pacientů s AIDS. Vylučování CMV do moče se u pacientů vstupujících do studie snížilo ze 46 % (32/69) na 7 % (4/55) u pacientů po čtyřtýdenní léčbě přípravkem valganciklovirem.
Klinická, účinnost Léčba CMV retinitidy:
Pacienti s nově diagnostikovanou CMV retinitidou byli v jedné studii randomizováni do skupiny s indukční terapií valganciklovirem 900 mg (2x denně) nebo do skupiny s intravenózní léčbou ganciklovirem v dávce 5 mg/kg (2x denně). Podíl pacientů s fotograficky posuzovanou progresí CMV retinitidy po 4 týdnech léčby byl v obou skupinách srovnatelný, 7/70 pacientů ve skupině léčené intravenózním ganciklovirem a 7/71 pacientů ve skupině léčené valganciklovirem.
Po indukční fázi terapie dostávali všichni pacienti v této studii udržovací léčbu valganciklovirem v dávce 900 mg jednou denně. Střední interval (medián) doby od randomizace k progresi CMV retinitidy ve skupině dostávající indukční i udržovací léčbu valganciklovirem činil 226 (160) dní, zatímco ve skupině dostávající indukční léčbu intravenózním ganciklovirem a následně udržovací léčbu valganciklovirem činil 219 (125) dní.
Prevence cytomegalovirového onemocnění u pacientů po transplantaci:
V dvojitě zaslepené, dvojitě maskované („double-dummy“) klinické studii s klinicky aktivním srovnávacím lékem byli sledováni pacienti po transplantaci srdce, jater a ledviny (pacienti po transplantaci plic a střev nebyli do této studie zařazeni) s vysokým rizikem rozvoje CMV onemocnění (D+/R-). Pacienti dostávali buď valganciklovir (900 mg jednou denně) nebo perorální ganciklovir (1000 mg třikrát denně), a to od 10. dne po transplantaci do 100. dne po transplantaci. Četnost výskytu CMV onemocnění (CMV syndrom a onemocnění s invazí do tkání) během prvních 6 měsíců po transplantaci byla 12,1 % ve skupině léčené valganciklovirem (n = 239) ve srovnání s 15,2 % ve skupině léčené perorálním ganciklovirem (n = 125). Velká většina případů se objevila po vysazení profylaxe (více než 100 dní po transplantaci), přičemž ve skupině léčené valganciklovirem se v průměru onemocnění CMV objevovalo později než ve skupině léčené perorálním ganciklovirem. Četnost výskytu akutní rejekce orgánu během prvních 6 měsíců byla 29,7 % u pacientů randomizovaných k léčbě valganciklovirem oproti 36,0 % ve skupině léčené perorálním ganciklovirem, úplná ztráta transplantovaného štěpu se v obou léčebných skupinách vyskytla stejně často (0,8 %).
Dvojitě zaslepená, placebem kontrolovaná studie hodnotící účinnost a bezpečnost rozšířené profylaktické léčby onemocnění CMV valganciklovirem v období od 100 do 200 dnů po transplantaci byla vedena u 326 pacientů po transplantaci ledviny s vysokým rizikem onemocnění CMV (D+/R-). Pacienti byli do 10 dnů po transplantaci randomizováni v poměru 1:1 do skupin léčených valganciklovirem ve formě tablet (900 mg jednou denně) buď do dne 200 po transplantaci, nebo do dne 100 po transplantaci s následným podáváním placeba po dobu dalších 100 dnů.
Podíl pacientů, u kterých se projevilo onemocnění CMV v průběhu prvních 12 měsíců po transplantaci, je shrnut v tabulce níže.
Procento pacientů po transplantaci ledviny s onemocněním CMV1, ITT populace ve 12 měsícíchA
|
Valganciklovir 900 mg jednou denně 100 dnů (N = 163) |
Valganciklovir 900 mg jednou denně 200 dnů (N = 155) |
Rozdíl mezi léčebnými skupinami | |
|
Pacienti s potvrzeným nebo předpokládaným |
71 (43,6 %) [35,8 % ; 51,5 %] |
36 (23,2 %) [16,8 % ; 30,7 %] |
20,3 % [9,9 % ; 30,8 %] |
1 Onemocnění CMV je definováno buď jako CMV syndrom nebo jako tkáňové invazivní CMV onemocnění. 2Potvrzené onemocnění CMV je klinicky potvrzený případ onemocnění CMV. Onemocnění CMV se předpokládá v případě, kdy nebylo provedeno vyšetření v 52. týdnu a kdy nebylo onemocnění CMV dříve potvrzeno.
|
onemocněním CMV2 | |||
|
Pacienti s potvrzeným onemocněním CMV |
60 (36,8 %) [29,4 % ; 44,7 %] |
25 (16,1 %) [10,7 % ; 22,9 %] |
20,7 % [10,9 % ; 30,4 %] |
A Výsledky zaznamenané do 24 měsíců odpovídaly výsledkům zaznamenaným do 12 měsíců: Potvrzené nebo předpokládané onemocnění CMV tvořilo 48,5 % v léčebném rameni se 100 dny léčby oproti 34,2 % v léčebném rameni se 200 dny léčby; rozdíl mezi léčebnými skupinami tvořil 14,3 % [3,2 %; 25,3 %].
Onemocnění CMV se objevilo u významně menšího počtu vysoce rizikových pacientů po transplantaci ledviny po podávání profylaktické léčby valganciklovirem do dne 200 po transplantaci v porovnání s pacienty, kteří dostávali profylaktickou léčbu přípravkem valganciklovirem pouze do dne 100 po transplantaci.
Procento přežití štěpu a stejně tak i incidence biopsie prokazující akutní rejekci bylo podobné v obou léčebných skupinách. Procento přežití štěpu 12 měsíců po transplantaci bylo 98,2 % (160/163) při režimu se 100 dny léčby a 98,1 % (152/155) při režimu s 200 dny léčby. Do 24 měsíců po transplantaci byly hlášeny další čtyři případy ztráty štěpu, všechny ve skupině se 100 dny léčby. Incidence biopsie prokazující akutní rejekci 12 měsíců po transplantaci byla 17,2 % (28/163) ve skupině se 100 dny léčby a 11,0 % (17/155) ve skupině s 200 dny léčby. Ve skupině s 200 dny léčby byl do 24 měsíců po transplantaci hlášen jeden další případ.
Virová rezistence
Po dlouhodobém podávání valgancikloviru se mohou objevit viry rezistentní na ganciklovir. Vznikají mechanismem selektivních mutací v genu pro virovou kinázu (UL97), která je zodpovědná za monofosforylaci gancikloviru a/nebo v genu pro virovou polymerázu (UL54). Viry, které obsahují mutace v genu UL97, jsou rezistentní pouze na ganciklovir, zatímco viry s mutací v genu UL54 jsou rezistentní na ganciklovir a mohou mít zkříženou rezistenci i vůči dalším antivirotikům, která rovněž působí na virovou polymerázu.
Léčba CMV retinitidy:
Genotypová analýza CMV v polymorfonukleárních leukocytech (PMN) izolovaných od 148 pacientů s CMV retinitidou, zahrnutých v jedné klinické studii, prokázala po 3, 6, 12 a 18 měsících léčby valganciklovirem mutace v genu UL97 u 2,2 %, 6,5 %, 12,8 % a 15,3 % pacientů v uvedeném pořadí.
Prevence cytomegalovirového onemocnění u pacientů po transplantaci:
Srovnávací studie s aktivním komparátorem
Rezistence byla hodnocena analýzou genotypu CMV ve vzorcích polymorfonukleárů odebraných i) stý den (konec profylaxe hodnoceným lékem) a ii) v případech podezření na CMV onemocnění až do doby 6 měsíců od transplantace. Od 245 pacientů randomizovaných k léčbě valganciklovirem bylo stý den k dispozici 198 vzorků a nebyly zjištěny žádné mutace rezistentní vůči gancikloviru. Oproti tomu ve srovnávací skupině léčené perorálním ganciklovirem byly zachyceny 2 ganciklovir-rezistentní mutace ve 103 testovaných vzorcích (1,9 %).
Ze skupiny 245 pacientů randomizovaných k léčbě valganciklovirem byly vyšetřeny vzorky od 50 pacientů s podezřením na CMV onemocnění a nebyly zjištěny žádné rezistentní mutace. Ze 127 pacientů randomizovaných do srovnávací skupiny léčené ganciklovirem bylo vyšetřeno 29 vzorků od pacientů s podezřením na CMV onemocnění a byly zachyceny dvě rezistentní mutace, což představuje incidenci rezistence 6,9 %.
Studie hodnotící rozšířenou profylaktickou léčbu od 100 do 200 dnů po transplantaci
Genotypová analýza byla provedená s geny UL54 a UL97 odvozenými z viru extrahovaného od 72 pacientů, kteří splňovali kritéria analýzy rezistence: pacienti, u kterých byla prokázána pozitivní virová nálož (> 600 kopií/ml) na konci profylaktické léčby a/nebo pacienti, u kterých bylo onemocnění CMV potvrzené do 12 měsíců (52 týdnů) po transplantaci. V každé léčebné skupině byli tři pacienti, kteří měli prokázanou mutaci rezistence na ganciklovir.
Pediatrická populace
Farmakokinetická studie fáze II hodnotící bezpečnost u pediatrických pacientů po transplantaci solidního orgánu (ve věku 4 měsíce až 16 let, n = 63), kteří byli léčeni valganciklovirem jednou denně po dobu až 100 dnů podle dávkovacího algoritmu, vedla k podobným expozicím jako u dospělých (viz bod 5.2). Následné sledování po léčbě trvalo 12 týdnů. Sérologický status CMV D/R v úvodu léčby byl D+/R- ve 40 %, D+/R+ ve 38 %, D-/R+ v 19 % a D-/R- ve 3 % případů. Přítomnost viru CMV byla hlášena u 7 pacientů.Pozorované nežádoucí účinky byly podobného charakteru jako nežádoucí účinky u dospělých (viz bod 4.8). Tyto údaje jsou příliš omezené, aby na jejich základě bylo možné udělat závěry týkající se účinnosti nebo doporučení pro dávkování u pediatrických pacientů.
Farmakokinetika a bezpečnost jednorázové dávky valgancikloviru (dávkové rozmezí 14-16-20 mg/kg/dávku) byly hodnoceny u 24 novorozenců (ve věku 8-34 dnů) se symptomatickým kongenitálním onemocněním CMV (viz bod 5.2). Novorozenci podstoupili 6týdenní antivirovou léčbu, kde 19 z 24 pacientů dostávalo perorální léčbu valganciklovirem po dobu až 4 týdnů a zbývající 2 týdny pak tito pacienti dostávali ganciklovir intravenózně. Zbývajících 5 pacientů dostávalo ganciklovir intravenózně během většiny studijního období.Tato léčebná indikace se v současné době pro valganciklovir nedoporučuje. Design studie a získané výsledky jsou příliš omezené, aby umožnily stanovit odpovídající závěry týkající se účinnosti a bezpečnosti valgancikloviru.
5.2 Farmakokinetickévlastnosti
Farmakokinetické vlastnosti valgancikloviru byly vyhodnocovány u HIV- a CMV-séropozitivních pacientů, pacientů s AIDS a CMV retinitidou a u pacientů po transplantaci orgánů.
Absorpce
Valganciklovir je proléčivem gancikloviru. Je dobře vstřebatelný z trávicího ústrojí a rychle a extenzivně se metabolizuje ve střevní stěně a v játrech na ganciklovir. Systémová expozice vůči valgancikloviru je přechodná a nízká.Absolutní biologická dostupnost gancikloviru z valgancikloviru byla přibližně 60 % ve všech sledovaných skupinách pacientů, výsledná expozice gancikloviru je podobná jako po intravenózním podání (viz tabulka níže).Pro srovnání, biologická dostupnost gancikloviru po perorálním podání dávky 1000 mg gancikloviru (v tobolkách) je 6-8 %.
Valganciklovir u HIV pozitivních, CMV pozitivních pacientů:
Systémová expozice u HIV pozitivních CMV pozitivních pacientů při podávání gancikloviru a valgancikloviru dvakrát denně po dobu jednoho týdne je následující:
|
Parametr |
Ganciklovir(5 mg/kg, i.v.) n = 18 |
Valganciklovir (900 mg, p.o.) n = 25 | |
|
Ganciklovir |
Valganciklovir | ||
|
AUC(0 - 12 h) (gg.h/ml) |
28,6 ± 9,0 |
32,8 ± 10,1 |
0,37 ± 0,22 |
|
Cmax (gg/ml) |
10,4 ± 4,9 |
6,7 ± 2,1 |
0,18 ± 0,06 |
Účinnost gancikloviru dle prodloužení doby do progrese CMV retinitidy koreluje se systémovou expozicí (AUC).
Valganciklovir u pacientů po transplantaci orgánů:
Systémová expozice gancikloviru v ustáleném stavu u pacientů po transplantaci orgánu je při každodenním perorálním podávání gancikloviru a valgancikloviru následující:
|
Parametr |
Ganciklovir (1000 mg třikrát denně) n = 82 |
Valganciklovir (900 mg jednou denně) n = 161 |
|
Ganciklovir | ||
|
AUC(0 - 12 h) (gg.h/ml) |
28,0 ± 10,9 |
46,3 ± 15,2 |
|
Cmax (gg/ml) |
1,4 ± 0,5 |
5,3 ± 1,5 |
Systémová expozice gancikloviru byla u pacientů po transplantaci srdce, ledvin a jater po perorálním podání valgancikloviru v dávkách podle dávkovacího algoritmu renální funkce obdobná.
Účinek potravy:
Proporcionalita dávky vzhledem k AUC gancikloviru po podání valgancikloviru v rozmezí dávky od 450 do 2625 mg byla prokázána pouze při příjmu potravy. Pokud byl valganciklovir podáván s jídlem v doporučené dávce 900 mg, byly pozorovány vyšší hodnoty střední AUC gancikloviru (přibližně 30 %), i střední hodnoty Cmax gancikloviru (přibližně 14 %) než nalačno.Pokud je valganciklovir podáván s jídlem, klesají také inter-individuální rozdíly v expozici gancikloviru.V klinických studiích byl valganciklovir podáván pouze současně s jídlem.Proto je doporučováno podávat valganciklovir s jídlem (viz bod 4.2).
Distribuce
Vzhledem k rychlé konverzi valgancikloviru na ganciklovir nebyla stanovena vazba valgancikloviru na bílkoviny. Vazba gancikloviru na plazmatické bílkoviny je 1-2 % při plazmatických koncentracích látky od 0,5 až 51 gg/ml. Distribuční objem gancikloviru v ustáleném stavu (Vd) po intravenózním podání je 0,680 ± 0,161 l/kg (n=114).
Biotransformace
Valganciklovir se rychle a extenzivně metabolizuje na ganciklovir; nebyly zjištěny žádné jiné metabolity. Po perorálním podání (jedné dávky 1000 mg) radioaktivně značeného gancikloviru netvořilo množství metabolitu více než 1-2 % z celkové radioaktivity naměřené ve stolici a v moči.
Eliminace
Po podání valgancikloviru je stejně jako u gancikloviru hlavní cestou eliminace valgancikloviru renální exkrece glomerulární filtrací a aktivní tubulární sekrecí. Renální clearance tvoří 81,5 % ± 22 % (n=70) systémové clearance gancikloviru. Poločas gancikloviru z valgancikloviru je u HIV a CMV seropozitivních pacientů 4,1 ± 0,9 hodin.
Farmakokinetika. ve zvláštních klinických situacích
Pacienti s poruchou funkce ledvin
Snižující se funkce ledvin vede ke snížení clearance gancikloviru z valgancikloviru s odpovídajícím prodloužením terminálního poločasu.Proto je u pacientů s poruchou funkce ledvin nutná úprava dávkování (viz body 4.2 a 4.4).
Pacienti podstupující hemodialýzu
Pro pacienty léčené hemodialýzou nelze doporučit žádné dávkovací schéma pro valganciklovir ve formě 450 mg potahovaných tablet. Důvodem je skutečnost, že pro tyto pacienty je zapotřebí individuální dávky nižší, než je 450 mg tableta. Proto se valganciklovir ve formě potahovaných tabletnemá těmto pacientům podávat (viz body 4.2 a 4.4).
Pacienti s poruchou funkce jater
Bezpečnost a účinnost tablet valgancikloviru nebyla u pacientů s poruchou funkce jater studována. Vzhledem k tomu, že je ganciklovir eliminován ledvinami, neměla by porucha funkce jater farmakokinetiku gancikloviru ovlivnit, a proto není doporučováno žádné zvláštní dávkování.
Pediatrická populace
Ve farmakokinetické studii fáze II hodnotící bezpečnost u pediatrických pacientů po transplantaci solidního orgánu (ve věku 4 měsíce až 16 let, n = 63) se valganciklovir podával jednou denně po dobu až 100 dnů. Farmakokinetické parametry byly podobné u všech typů orgánů a pro všechna věková rozmezí a byly srovnatelné s dospělými. Modelování famakokinetiky populace prokázalo, že biologická dostupnost byla přibližně 60 %. Clearance byla pozitivně ovlivněna jak tělesným povrchem, tak renálními funkcemi. U pacientů s clearance kreatininu 70,4 ml/min byla průměrná celková clearance 5,3 l/h (88,3 ml/min).
Následující tabulka ukazuje průměrné hodnoty Cmax, t/2 a AUC včetně standardních odchylek u příslušných pediatrických věkových skupin ve srovnání s údaji od dospělých pacientů:
|
PK parametr |
Dospělí* |
Pediatričtí pacienti | ||
|
> 18 let (n=160) |
< 2 let (n=17) |
> 2 - < 12 let (n=21) |
> 12 let (n=25) | |
|
AUC0-24h ( pg.h/ml) |
46,3 ± 15,2 |
64,3 ± 29,2 |
59,2 ± 15,1 |
50,3 ± 15,0 |
|
Cmax (pg/ml) |
5,3 ± 1,5 |
10,3 ± 3,3 |
9,4 ± 2,7 |
8,0 ± 2,4 |
|
Clearance (l/h) |
12,7 ± 4,5 |
2,5 ± 2,4 |
4,5 ± 2,9 |
6,4 ± 2,9 |
|
11/2 (h) |
6,5 ± 1,4 |
3,1 ±1,4 |
4,1 ± 1,3 |
5,5 ± 1,1 |
* Výňatek z hlášení ze studie PV 16000
Dávkování valgancikloviru jednou denně bylo založeno na velikosti tělesného povrchu (BSA) a clearance kreatininu (CrCl) odvozené z modifikovaného Schwartzova vzorce a bylo vypočítáno za použití následující rovnice:
Pediatrická dávka (mg) = 7 x BSA x CrCl (vypočítaná za použití modifikovaného Schwartzova vzorce), kde :
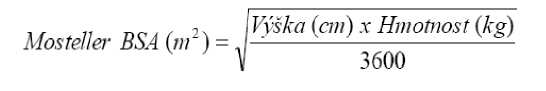
kx Výška (cm)
Schwartz Clearance kreatininu (ml/min/1,73m3) = ...............................-
Sérový kreatinin (mg/dl)
kde k = 0,45 u pacientů ve věku < 2 roky, 0,55 pro chlapce ve věku 2 až < 13 let a dívky ve věku 2 až 16 let a 0,7 pro chlapce ve věku 13 až 16 let.
Dávka nemá překročit dávku pro dospělé 900 mg. Pokud při výpočtu clearance kreatininu podle Schwartze překročí výsledné hodnoty 150 ml/min/1,73 m2, pak se v rovnici použije maximální hodnota 150 ml/min/1,73 m2. Je třeba poznamenat, že dávkovací algoritmus u pediatrických pacientů byl vyvinut pouze na základě farmakokinetických údajů a nebyl ověřen ve studiích účinnosti a bezpečnosti (viz bod 5.1).
Farmakokinetika gancikloviru byla rovněž hodnocena u 24 novorozenců ve věku 8 až 34 dnů se symptomatickým kongenitálním onemocněním CMV. Všichni pacienti dostávali ganciklovir intravenózně v dávce 6 mg/kg dvakrát denně. Pacienti byli poté léčeni perorálním valganciklovirem, kdy se dávky valgancikloviru ve formě prášku pro přípravu perorálního roztoku pohybovaly v rozmezí 14 mg/kg až 20 mg/kg dvakrát denně. Valganciklovir prášek pro přípravu perorálního roztoku v dávce 16 mg/kg dvakrát denně poskytuje u novorozenců srovnatelnou expozici gancikloviru jako ganciklovir v dávce 6 mg/kg podaný intravenózně dvakrát denně a rovněž se dosahuje podobné expozice gancikloviru, jako je účinná intravenózní dávka u dospělých, tedy 5 mg/kg. Následující tabulka ukazuje průměrné hodnoty AUC, Cmax a t/ včetně standardních odchylek ve srovnání s údaji od dospělých pacientů:
|
PK Parametr |
Dospělí |
Novorozenci | |
|
5 mg/kg GAN Jednorázová dávka (n=8) |
6 mg/kg GAN Dvakrát denně (n=19) |
16 mg/kg VAL Dvakrát denně (n=19) | |
|
AUC0-» (mg.h/l) |
25,4 ± 4,32 |
- |
- |
|
AUC:2h (mg.h/l) |
- |
38,2 5 ± 42,7 |
30,1 ± 15,1 |
|
Cmax (Mg/ml) |
9,03 ± 1,26 |
12,9 ± 21,5 |
5,44 ± 4,04 |
|
t1/2 (h) |
3,32 ± 0,47 |
2,52 ± 0,55 |
2,98 ± 1,26 |
GAN = Ganciklovir, i.v.
VAL = Valganciklovir, perorálně
Farmakokinetické modelování prokázalo, že u novorozenců byla typická hodnota clearance (l/h) 0,146 x tělesná hmotnost1,68, distribuční objem (l) 1,15 x tělesná hmotnost a biologická dostupnost gancikloviru 54%. Tyto údaje jsou příliš omezené, než aby umožnily udělat závěry týkající se účinnosti nebo doporučení pro dávkování u pediatrických pacientů s kongenitální infekcí CMV.
5.3 PředkHnickéúdajevztahujíri se k bezpečnosti
Valganciklovir je proléčivo gancikloviru, a proto je možno účinky pozorované u gancikloviru vztáhnout i na používání valgancikloviru. Toxicita valgancikloviru v předklinických studiích bezpečnosti byla stejná jako u gancikloviru a byla způsobena expozicí gancikloviru v hladinách obdobných či nižších než jaké jsou dosahovány při indukčních dávkách u lidí.
Mezi ireverzibilní toxické účinky patří toxicita vůči gonádám (ztráta testikulárních buněk) a nefrotoxicita (uremie, buněčná degenerace), mezi reverzibilní patří myelotoxicita (anémie, neutropenie, lymfocytopenie) a gastrointestinální toxicita (nekróza slizničních buněk).
V dalších studiích s ganciklovirem byla prokázána mutagenita, kancerogenita, teratogenita, embryotoxicita, aspermatogenita (tj. zhoršuje samčí fertilitu) a snížení fertilityu žen.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznampomocnýchlátek
Jádro tablety
mikrokrystalická celulóza, (101 a102) krospovidon typ B povidon K30 magnesium-stearát
Potahová vrstva hypromelóza2910/3 a 2910/6 oxid titaničitý (E171) makrogol 400 polysorbát 80
červený oxid železitý (E172)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Dobapoužitelnosti
2 roky
6.4 Zvláštníopatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druhobalu a obsahbalení
Valganciclovir Aurobindo potahované tablety jsou k dispozici v PA/Al/PVC/Al blistrech a HDPE lahvičkách spolypropylenovýmuzávěrema výplní z vaty.
Velikost balení:
Blistr : 10, 60 a 100 potahovaných tablet.
HDPE lahvička: 60 a1000 potahovaných tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍO REGISTRACI
Aurobindo Pharma (Malta) Limited Vault 14, Level 2, Valletta Waterfront Floriana FRN 1913 Malta
8. REGISTRAČNÍČÍSLO
42/018/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
25.3.2015