Ultibro Breezhaler 85 Mikrogramů/43 Mikrogramů
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Ultibro Breezhaler 85 mikrogramů/43 mikrogramů, prášek k inhalaci v tvrdé tobolce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje indacateroli maleas 143 mikrogramů, odpovídající indacaterolum 110 mikrogramů a glycopyrronii bromidum 63 mikrogramů, odpovídající glycopyrronium 50 mikrogramů.
Jedna uvolněná dávka (dávka, která opouští ústí inhalátoru) obsahuje 110 mikrogramů indacateroli maleas, což odpovídá indacaterolum 85 mikrogramů a 54 pg mikrogramů glycopyrronii bromidum, což odpovídá 43 pg mikrogramům glycopyrronium.
Pomocná látka/Pomocné látky se známým účinkem:
Jedna tobolka obsahuje 23,5 mg laktosy (jako monohydrátu).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce
Tobolky s průhledným žlutým víčkem a průhledným tělem obsahující bílý až téměř bílý prášek, s kódem přípravku ..IGP1 10.50" vytištěným modře pod dvěma modrými proužky na těle tobolky a logem společnosti (Ú)) vytištěným černě na víčku.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Ultibro Breezhaler je indikován jako udržovací bronchodilatační léčba k úlevě od příznaků u dospělých pacientů s chronickou obstrukční plicní nemocí (CHOPN).
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka je inhalace obsahu jedné tobolky jednou denně s použitím inhalátoru Ultibro Breezhaler.
Léčba přípravkem Ultibro Breezhaler by měla být podávána každý den ve stejnou dobu. Pokud dojde k vynechání dávky, další dávka by měla být použita co nejdříve týž den. Pacienti by měli být poučeni, aby nepoužívali více než jednu dávku denně.
Zvláštní populace
Starší populace
Ultibro Breezhaler může být podáván v doporučené dávce starším pacientům (75 let a více).
Porucha funkce ledvin
Ultibro Breezhaler může být podáván v doporučené dávce pacientům s lehkou až středně těžkou poruchou funkce ledvin. U pacientů s těžkou poruchou funkce ledvin nebo s onemocněním ledvin v konečném stadiu vyžadujícím dialýzu, by měl být podáván pouze tehdy, pokud očekávaný přínos převáží potenciální riziko léčby (viz body 4.4 a 5.2).
Porucha funkce jater
Ultibro Breezhaler může být podáván v doporučené dávce pacientům s lehkou a středně těžkou poruchou funkce jater. Údaje o použití přípravku Ultibro Breezhaler u pacientů s těžkou poruchou funkce jater nejsou k dispozici, proto by měl být přípravek u těchto pacientů používán s opatrností (viz bod 5.2).
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Ultibro Breezhaler u pediatrické populace (ve věku do 18 let) v indikaci CHOPN. Bezpečnost a účinnost přípravku Ultibro Breezhaler u dětí nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Pouze k inhalačnímu podání. Tobolky se nesmí polykat.
Tobolky musí být podány pouze s použitím inhalátoru Ultibro Breezhaler (viz bod 6.6).
Pacienty je třeba poučit, jak přípravek správně používat. Pacientů, kteří nepozorují zlepšené dýchání, je nutno se zeptat, zda přípravek nepolykají namísto inhalace.
Návod k použití tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Přípravek Ultibro Breezhaler nesmí být používán souběžně s léčivými přípravky s obsahem beta-adrenergních agonistů s dlouhodobým účinkem nebo s léčivými přípravky s obsahem muskarinových antagonistů s dlouhodobým účinkem, což jsou farmakoterapeutické skupiny, do nichž patří složky přípravku Ultibro Breezhaler (viz bod 4.5).
Přípravek Ultibro Breezhaler se nemá používat k léčbě astmatu kvůli absenci údajů v této indikaci.
Použití dlouhodobě působících beta2-adrenergních agonistů k léčbě astmatu může zvyšovat riziko závažných nežádoucích účinků spojených s astmatem, včetně úmrtí spojených s astmatem.
Není určen pro akutní použití
Přípravek Ultibro Breezhaler není určen k léčbě akutních epizod bronchospasmu.
Hypersensitivita
Po podání indakaterolu nebo glykopyrronia, které jsou složkami přípravku Ultibro Breezhaler, byly hlášeny okamžité reakce z přecitlivělosti. Pokud se objeví příznaky svědčící o alergických reakcích, zejména angioedém (obtíže při dýchání nebo polykání, otoky jazyka, rtů a tváře), kopřivka nebo kožní vyrážka, je nutné okamžitě přerušit léčbu a zahájit alternativní léčbu.
Paradoxní bronchospasmus
V klinických studiích s přípravkem Ultibro Breezhaler nebyl zaznamenán paradoxní bronchospasmus. Nicméně paradoxní bronchospasmus byl pozorován u jiných typů inhalační léčby a tento stav může být život ohrožující. Proto pokud dojde k paradoxnímu bronchospasmu, musí být léčba okamžitě přerušena a nahrazena jinou léčbou.
Anticholinergní účinky vztahující se ke glykopyrroniu
Glaukom s uzavřeným úhlem
Údaje o použití u pacientů s glaukomem s uzavřeným úhlem nejsou k dispozici, proto musí být přípravek Ultibro Breezhaler u těchto pacientů používán s opatrností.
Pacienti by měli být informováni o příznacích akutního glaukomu s uzavřeným úhlem a měli by být poučeni, aby přestali používat Ultibro Breezhaler, jakmile se objeví jakékoli příznaky tohoto onemocnění.
Retence moči
Údaje o použití u pacientů s retencí moči nejsou k dispozici, proto musí být přípravek Ultibro Breezhaler u těchto pacientů používán s opatrností.
Pacienti s těžkou poruchou funkce ledvin
Průměrná celková systémová expozice (AUClast) glykopyrronia stoupla u pacientů s lehkou a středně těžkou poruchou funkce ledvin až na 1,4násobek a u pacientů s těžkou poruchou funkce ledvin a onemocněním ledvin v konečném stadiu až na 2,2násobek. Přípravek Ultibro Breezhaler by měl být u pacientů s těžkou poruchou funkce ledvin (odhadovaná rychlost glomerulární filtrace méně než 30 ml/min/1,73 m2) a u pacientů s onemocněním ledvin v konečném stadiu vyžadujícím dialýzu podáván pouze tehdy, pokud očekávaný přínos převáží potenciální riziko léčby (viz bod 5.2). Tito pacienti by měli být pečlivě sledováni s ohledem na výskyt potenciálních nežádoucích účinků.
Kardiovaskulární účinky
Při podávání přípravku Ultibro Breezhaler je nutná opatrnost u pacientů s kardiovaskulárními poruchami (onemocnění koronárních tepen, akutní infarkt myokardu, srdeční arytmie, hypertenze).
Beta2-adrenergní agonisté mohou vyvolat klinicky významné kardiovaskulární účinky měřitelné jako zrychlený puls, zvýšený krevní tlak a/nebo jiné příznaky. Pokud se takové účinky objeví při podávání tohoto léčivého přípravku, může být nutné léčbu přerušit. Kromě toho byly hlášeny změny elektrokardiogramu (EKG) vyvolané beta-adrenergními agonisty, jako jsou oploštění vlny T, prodloužení QT intervalu a deprese úseku ST, i když klinický význam těchto pozorování není znám. Proto je nutné používat dlouhodobě působící beta2-adrenergní agonisty s opatrností u pacientů se známým nebo předpokládaným prodloužením QT intervalu nebo u pacientů léčených léčivými přípravky ovlivňujícími QT interval
Pacienti s nestabilní ischemickou chorobou srdeční, levostranným srdečním selháním, infarktem myokardu v anamnéze, arytmií (kromě chronické stabilní fibrilace síní), syndromem prodlouženého QT intervalu v anamnéze nebo pacienti, jejichž QTc interval (použita metoda podle Fridericii) byl prodloužen (>450 ms) byli vyloučeni z klinických studií, a proto nejsou zkušenosti s touto skupinou pacientů. Přípravek Ultibro Breezhaler by měl být u těchto skupin pacientů podáván s opatrností.
Hypokalémie
Beta2-adrenergní agonisté mohou u některých pacientů způsobit významnou hypokalemii, která je schopna vyvolat nežádoucí kardiovaskulární účinky. Pokles sérového draslíku je obvykle přechodný, nevyžadující jeho suplementaci. U pacientů s těžkou CHOPN může být hypokalémie potencována hypoxií a současnou léčbou, což může zvýšit náchylnost k srdečním arytmiím (viz bod 4.5).
Klinicky významné projevy hypokalémie nebyly v klinických studiích s přípravkem Ultibro Breezhaler v doporučené terapeutické dávce pozorovány (viz bod 5.1).
Hyperglykémie
Inhalace vysokých dávek beta2-adrenergních agonistů může zvýšit hladiny glukózy v plazmě. U diabetických pacientů je nutné po zahájení léčby přípravkem Ultibro Breezhaler mnohem bedlivěji monitorovat glukózu v plazmě.
Během klinických studií zaznamenalo při podání doporučené dávky více pacientů s přípravkem Ultibro Breezhaler klinicky pozorovatelné změny glykémie (4,1 %) v porovnání s placebem (2,3 %). Přípravek Ultibro Breezhaler nebyl studován u pacientů se špatně kontrolovaným diabetes mellitus
Celkové poruchy
Přípravek Ultibro Breezhaler musí být podáván s opatrností pacientům s konvulzívními poruchami nebo thyreotoxikózou a u pacientů s neobvyklou odpovědí na beta2-adrenergní agonisty.
Pomocné látky
Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli používat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podání perorálně inhalovaného indakaterolu a glykopyrronia v rovnovážném stavu obou složek přípravku neovlivňovalo farmakokinetiku ani jedné složky.
Specifické interakční studie přípravku Ultibro Breezhaler nebyly provedeny. Informace o možných interakcích je založena na interakčním potenciálu každé z obou složek.
Souběžné podávání se nedoporučuje
Beta-adrenergní blokátory
Beta-adrenergní blokátory mohou zeslabovat nebo antagonizovat účinek beta2-adrenergních agonistů. Proto nesmí být přípravek Ultibro Breezhaler podáván společně s beta2-adrenergními blokátory (včetně očních kapek), pokud pro jejich podání nejsou závažné důvody. Kde je to zapotřebí, je nutné dát přednost kardioselektivním beta-adrenergním blokátorům, ačkoliv i ty je nutno podávat s opatrností.
Anticholinergika
Souběžné podání přípravku Ultibro Breezhaler s jinými léčivými přípravky s obsahem anticholinergik nebylo studováno a proto se nedoporučuje (viz bod 4.4).
Sympatomimetika
Souběžné podávání jiných sympatomimetik (samotných nebo jako součást kombinované léčby) může potencovat nežádoucí účinky indakaterolu (viz bod 4.4).
Při souběžném podávání je nutná opatrnost
Hypokalemická léčba
Souběžná hypokalemická léčba metylxanthinovými deriváty, steroidy nebo diuretiky nešetřícími draslík může potencovat možný hypokalemický účinek beta2-adrenergních agonistů, je tedy nutná opatrnost (viz bod 4.4).
Při souběžném podávání je nutno vzít v úvahu Interakce založené na metabolizmu nebo transportu
Inhibice klíčových součástí eliminace indakaterolu, CYP3A4 a P-glykoproteinu (P-gp), zvyšuje systémovou expozici indakaterolu až na dvojnásobek. Velikost nárůstu expozice díky interakcím nevyvolává obavy ohledně bezpečnosti vzhledem k poznatkům o bezpečnosti získaných během klinických studií s indakaterolem v délce až jeden rok a s dávkami činícími až dvojnásobek maximální doporučené dávky indakaterolu.
Cimetidin nebo jiné inhibitory transportu organických kationtů
V klinické studii se zdravými dobrovolníky zvýšilo podávání cimetidinu, inhibitoru transportu organických kationtů, který pravděpodobně přispívá k renální exkreci glykopyrronia, celkovou expozici (AUC) glykopyrroniu o 22 % a snížilo renální clearance o 23 %. Vzhledem k velikosti těchto změn se nepředpokládá žádná klinicky významná léková interakce při podání glykopyrronia souběžně s cimetidinem nebo jinými inhibitory transportu organických kationtů.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání přípravku Ultibro Breezhaler těhotným ženám nejsou k dispozici. Studie na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky při klinicky relevantních expozicích (viz bod 5.3).
Indakaterol může zpomalovat porod díky relaxačnímu účinku na hladkou svalovinu dělohy. Proto má být přípravek Ultibro Breezhaler během těhotenství používán pouze tehdy, pokud předpokládaný přínos pro pacientku převáží potenciální riziko pro plod.
Kojení
Není známo, zda se indakaterol, glykopyrronium a jejich metabolity vylučují do lidského mateřského mléka. Dostupné farmakokinetické/toxikologické údaje prokázaly vylučování indakaterolu, glykopyrronia a jejich metabolitů do mateřského mléka potkanů. Použití přípravku Ultibro Breezhaler by u kojících žen mělo být zvažováno pouze tehdy, pokud je očekávaný přínos pro pacientku větší než možné riziko pro dítě (viz bod 5.3).
Fertilita
Reprodukční studie a další data u zvířat nenaznačují ovlivnění fertility u mužského ani ženského pohlaví.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Tento přípravek nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Nicméně, výskyt závratí může ovlivnit schopnost řídit nebo obsluhovat stroje (viz bod 4.8).
4.8 Nežádoucí účinky
Uvedený bezpečnostní profil je založen na zkušenostech s přípravkem Ultibro Breezhaler a jeho jednotlivými složkami.
Souhrn bezpečnostního profilu
Údaje o bezpečnosti přípravku Ultibro Breezhaler se odvíjí od expozice až 15 měsíců v doporučené terapeutické dávce.
U přípravku Ultibro Breezhaler se projevily podobné nežádoucí účinky jako u jednotlivých složek. Protože obsahuje indakaterol a glykopyrronium, stejný typ a závažnost nežádoucích účinků spojených s jednotlivými složkami lze očekávat u kombinace.
Bezpečnostní profil je charakterizován typickými anticholinergními a beta-adrenergními příznaky se vztahem k jednotlivým složkám této kombinace. Další nejčastější nežádoucí účinky se vztahem k přípravku (hlášené u nejméně 3 % pacientů léčených přípravkem Ultibro Breezhaler a četnější než u placeba) byly kašel a orofaryngeální bolest (včetně podráždění hrdla).
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky zjištěné během prvních šesti měsíců v klinických studiích a z postmarketingových zdrojů jsou seřazeny podle systémově-orgánové klasifikace MedDRA (Tabulka 1). V každé systémově-orgánové třídě jsou nežádoucí účinky řazeny podle četnosti tak, že nejčastější nežádoucí účinek je na prvním místě. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Četnost přiřazená ke každému nežádoucímu účinku je založena na následujících kategoriích: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10000 až <1/1000), velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit).
Tabulka 1 Nežádoucí účinky
|
Nežádoucí účinky |
Frekvence výskytu |
|
Infekce a infestace Infekce horních cest dýchacích2 |
Velmi časté |
|
Nazofaryngitida2 |
Časté |
|
Infekce močových cest2 |
Časté |
|
Sinusitida2 |
Časté |
|
Rinitida2 |
Časté |
|
Poruchy imunitního systému Hypersenzitivita2 |
Méně časté |
|
Angioedém2,4 |
Méně časté |
|
Poruchy metabolismu a výživy Diabetes mellitus a hyperglykémie2 |
Méně časté |
|
Psychiatrické poruchy |
Méně časté |
|
Poruchy nervového systému Závratě2 |
Časté |
|
Časté | |
|
Parestézie2 |
Méně časté |
|
Poruchy oka Glaukom1 |
Méně časté |
|
Srdeční poruchy Ischemická choroba srdeční2 |
Méně časté |
|
Fibrilace síní2 |
Méně časté |
|
Méně časté | |
|
Palpitace2 |
Méně časté |
|
Respirační, hrudní a mediastinální poruchy |
Časté |
|
Orofaryngeální bolest včetně podráždění hrdla2 |
Časté |
|
Paradoxní bronchospasmus3 |
Méně časté |
|
Epistaxe2 |
Méně časté |
|
Gastrointestinální poruchy |
Časté |
|
Zubní kazy2 |
Časté |
|
Gastroenteritida3 |
Časté |
|
Sucho v ústech2 |
Méně časté |
2Nežádoucí účinek pozorovaný u přípravku Ultibro Breezhaler a nejméně u jedné ze složek. 3Nežádoucí účinek pozorovaný u nejméně jedné ze složek, nikoliv však u přípravku Ultibro Breezhaler; kategorie četností podle bodu 4.8 Souhrnu údajů o přípravku jednotlivých složek.
|
Poruchy kůže a podkožní tkáně Pruritus/vyrážka2 |
Méně časté |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Muskuloskeletární bolest2 |
Časté |
|
Svalové křeče2 |
Méně časté |
|
Myalgie2 |
Méně časté |
|
Bolest končetin3 |
Méně časté |
|
Poruchy ledvin a močových cest Obstrukce močového měchýře a retence moči2 |
Méně časté |
|
Celkové poruchy a reakce v místě aplikace Pyrexie1 |
Časté |
|
Časté | |
|
Periferní edém2 |
Méně časté |
|
Únava2 |
Méně časté |
'Nežádoucí účinek pozorovaný u přípravku Ultibro Breezhaler, nikoliv však u jednotlivých složek.
4Hlášení získaná po uvedení na trh; četnosti výskytu jsou však vypočteny na základě údajů z klinických studií.
Popis vybraných nežádoucích účinků Kašel byl častý, avšak obvykle mírný.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Informace o klinicky relevantním předávkování přípravkem Ultibro Breezhaler nejsou k dispozici.
Předávkování může vést k zesíleným projevům typickým pro beta2-adrenergní stimulanty, tj. Tachykardie, třes, palpitace, bolest hlavy, nauzea, zvracení, ospalost, komorové arytmie, metabolická acidóza, hypokalemie a hyperglykemie nebo může vyvolat anticholinergní účinky jako zvýšený nitrooční tlak (působící bolest, poruchy zraku nebo zrudnutí oka), zácpu nebo obtížné vyprazdňování. Indikována je podpůrná a symptomatická léčba. Ve vážných případech je nutná hospitalizace pacienta. Při léčbě beta2-adrenergních účinků j e možné zvážit podání kardioselektivních betablokátorů, vždy však pod dohledem lékaře a s extrémní opatrností, protože užití beta-adrenergních blokátorů může vyvolat bronchospazmus.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest, adrenergika v kombinaci s anticholinergiky, ATC kód: R03AL04
Mechanismus účinku
Ultibro Breezhaler
Pokud jsou indakaterol a glykopyrronium podávány souběžně jako přípravek Ultibro Breezhaler, vykazují aditivní účinek díky jejich rozdílnému mechanizmu účinku cílenému na různé receptory a cesty k dosažení relaxace hladké svaloviny. Vzhledem k rozdílné hustotě beta2-adrenoceptorů a M3-receptorů v centrálních a periferních dýchacích cestách, beta2-agonisté by měli být účinnější při relaxaci periferních dýchacích cest, zatímco anticholinergní složka může být účinnější u centrálních dýchacích cest. Proto může být pro bronchodilataci periferních i centrálních dýchacích cest v plicích člověka prospěšná kombinace beta2-adrenergních agonistů a muskarinových antagonistů.
Indakaterol
Indakaterol je dlouhodobě působící beta2-adrenergní agonista k podávání jednou denně. Farmakologické účinky beta2-adrenergních agonistů, včetně indakaterolu, se alespoň zčásti připisují stimulaci nitrobuněčné adenylcyklázy, enzymu, který katalyzuje konverzi adenosin trifosfátu (ATP) na cyklický 3’, 5’-adenosin monofosfát (cyklický AMP). Zvýšené hladiny cyklického AMP působí relaxaci bronchiální hladké svaloviny. In vitro studie ukázaly, že indakaterol vykazuje vícenásobně větší agonistickou aktivitu vůči beta2-receptorům v porovnání s beta1-receptory a beta3-receptory.
Při inhalaci působí indakaterol lokálně v plicích jako bronchodilatátor. Indakaterol je částečný agonista beta2-adrenergních receptorů u člověka účinkující v nanomolárním množství.
Ačkoliv jsou beta2-adrenergní receptory predominantní v bronchiální hladké svalovině a beta1-adrenergní receptory jsou predominantní v lidském srdci, beta2-adrenergní receptory se vyskytují i v lidském srdci a představují 10-50 % celkového množství adrenergních receptorů. Jejich přítomnost zvyšuje pravděpodobnost, že i vysoce selektivní beta2-adrenergní agonisté mohou působit na srdce.
Glykopyrronium
Glykopyrronium je inhalační dlouhodobě působící antagonista muskarinových receptorů (anticholinergikum) určený pro udržovací bronchodilatační léčbu CHOPN podávanou jednou denně. Parasympatická inervace je hlavní bronchokonstrikční nervový systém v dýchacích cestách a cholinergní tonus představuje klíčovou reverzibilní složku obstrukce dýchacích cest u CHOPN. Glykopyrronium blokuje bronchokonstrikční účinek acetylcholinu na buňky hladkých svalů dýchacích cest, a tím dochází k dilataci dýchacích cest.
Glykopyrronium-bromid je antagonista muskarinových receptorů s vysokou afinitou. Při studiích s ligandy značenými radionuklidy byla prokázána více než 4násobná selektivita pro lidský M3 receptor v porovnání s lidským M2 receptorem.
Farmakodynamické účinky
Kombinace indakaterolu a glykopyrronia v přípravku Ultibro Breezhaler vykázala rychlý nástup účinku během 5 minut po podání dávky. Účinek zůstává konstantní během celého 24hodinového dávkovacího intervalu.
Průměrný bronchodilatační účinek odvozený od sériového měření FEV1 během 24 hodin byl 320 ml po 26 týdnech léčby. Účinek u přípravku Ultibro Breezhaler byl signifikantně větší v porovnání se samotným indakaterolem, glykopyrroniem nebo tiotropiem (rozdíl 110 ml pro každé porovnání).
V porovnání s placebem nebo jednotlivými složkami v monoterapii nebyla u přípravku Ultibro Breezhaler pozorována tachyfylaxe.
Účinek na srdeční rytmus
Účinek na srdeční rytmus byl sledován u zdravých dobrovolníků po jednorázovém podání čtyřnásobku doporučené terapeutické dávky přípravku Ultibro Breezhaler podávané ve čtyřech dávkovacích krocích vždy po jedné hodině a porovnáván s účinkem placeba, indakaterolu, glykopyrronia a salmeterolu.
Největší nárůst srdečního rytmu v čase v porovnání s placebem +5,69 tepů za minutu (90% CI [2,71; 8,66]), největší pokles byl -2,51 tepů za minutu (90% CI [-5,48; 0,47]). Celkový účinek na srdeční rytmus v čase neukázal konzistentní farmakodynamický účinek přípravku Ultibro Breezhaler.
Byl zkoumán srdeční rytrmus pacientů s CHOPN při supraterapeutických dávkách. Nebyl prokázán relevantní účinek přípravku Ultibro Breezhaler na průměrný srdeční rytmus během 24 hodin a srdeční rytmus hodnocený po 30 minutách, 4 hodinách a 24 hodinách.
QT interval
Není známo, že by složky přípravku Ultibro Breezhaler měly v klinických dávkách potenciál prodlužovat QT interval. Studie s průběžným měřením QT (TQT) na zdravých dobrovolnících s vysokými dávkami inhalovaného indakaterolu (až dvojnásobek maximální doporučené terapeutické dávky) neprokázala klinicky významný vliv na QT interval. Podobně nebylo u glykopyrronia pozorováno prodloužení QT intervalu v TQT studii po inhalaci osminásobku doporučené terapeutické dávky.
Účinek přípravku Ultibro Breezhaler na QTc interval byl zkoumán u zdravých dobrovolníků po inhalaci přípravku Ultibro Breezhaler až do 4násobku doporučené terapeutické dávky ve čtyřech dávkovacích krocích v odstupu jedné hodiny. Největší nárůst v čase v porovnání s placebem byl 4,62 ms (90% CI 0,40; 8,85 ms), největší pokles v čase byl -2,71 ms (90% CI -6,97; 1,54 ms), což naznačuje, že přípravek Ultibro Breezhaler nemá relevantní vliv na QT interval, jak by mohlo být očekáváno dle vlastností jeho jednotlivých složek.
U pacientů s CHOPN byl při použití supraterapeutických dávek mezi 116 mikrogramů/86 mikrogramů a 464 mikrogramů/86 mikrogramů přípravku Ultibro Breezhaler vyšší podíl pacientů s nárůstem QTcF v porovnání se základními hodnotami mezi 30 ms a 60 ms (v rozmezí od 16,0 % do 21,6 % vs. 1,9 % u placeba), neobjevil se však nárůst QTcF >60 ms nad základní hodnoty. Nejvyšší dávkovací hladina 464 mikrogramů /86 mikrogramů přípravku Ultibro Breezhaler rovněž vykázala vyšší podíl absolutních hodnot QTcF >450 ms (12,2 % vs. 5,7 % u placeba).
Sérový draslík a glukóza v krvi
U zdravých dobrovolníků byl po podání 4násobku doporučené terapeutické dávky přípravku Ultibro Breezhaler vliv na sérový draslík velmi malý (maximální rozdíl -0,14 mmol/l při porovnání s placebem). Maximální účinek na glukózu v krvi činil 0,67 mmol/l.
Klinická účinnost a bezpečnost
Vývojový program fáze III přípravku Ultibro Breezhaler zahrnoval pět studií s více než 5000 zařazených pacientů: 1) 26týdenní studii s placebem a aktivním komparátorem (indakaterol jednou denně, glykopyrronium jednou denně, open-label tiotropium jednou denně); 2) 26týdenní studie s aktivním komparátorem (flutikason/salmeterol dvakrát denně); 3) 64týdenní studii s aktivním komparátorem (glykopyrronium jednou denně, open-label tiotropium jednou denně); 4) 52týdenní placebem kontrolovaná studie a 5) 3týdenní studii tolerance zátěže s placebem a aktivním komparátorem (tiotropium jednou denně).
Ve čtyřech z těchto studií byli zařazení pacienti s klinickou diagnózou středně těžké až těžké CHOPN. V 64týdenní studii byli zařazení pacienti s těžkou až velmi těžkou CHOPN.
Účinky na plicní funkce
Ultibro Breezhaler vykázal klinicky významé zlepšení funkce plic (měřeno jako usilovně vydechnutý objem za 1 sekundu, FEVi) v řadě klinických studií. Ve studiích fáze III byl pozorován bronchodilatační účinek během 5 minut po první dávce a přetrval během 24hodinového dávkovacího intervalu od podání první dávky. Bronchodilatační účinek se v čase nesnižoval.
Rozsah účinku závisel na stupni reverzibility omezení průchodnosti dýchacích cest před zahájením léčby (testované podáním krátkodobě bronchodilatačně působícího muskarinového antagonisty a krátkodobě bronchodilatačně působícího beta2-agonisty): Pacienti s nejnižším stupněm reversibility na začátku léčby (<5%) obceně vykazovali nižší bronchodilatační odezvu než pacienti s vyšším stupněm reverzibility na začátku léčby (>5%). Po 26 týdnech (primární cílový parametr) zvyšoval přípravek Ultibro Breezhaler nejnižší (trough) FEVi o 80 ml u pacientů (Ultibro Breezhaler n=82; placebo n=42) s nejnižším stupněm reverzibility (<5%) (p=0,053) a o 220 ml u pacientů (Ultibro Breezhaler n=392, placebo n=190) s vyšším stupněm reverzibility na začátku léčby (>5%) v porovnání s placebem
(p<0,001).
Prebronchodilatační trough a vrcholové FEVi:
Přípravek Ultibro Breezhaler zvyšoval prebronchodilatační trough FEV1 po podání dávky o 200 ml v porovnání s placebem po 26 týdnech jako primární cílový parametr (p<0,001) a vykázal statisticky významné zvýšení v porovnání s rameny s monoterapií každou složkou (indakaterol a glykopyrronium) i s ramenem s tiotropiem, jak je uvedeno v tabulce níže.
Prebronchodilatační trough FEVi po podání dávky (průměr nejmenších čtverců) v den 1 a týdnu 26 (primární cílový parametr)
|
Rozdíl v léčbě |
Den 1 |
Týden 26 |
|
Ultibro Breezhaler - placebo Ultibro Breezhaler - indakaterol Ultibro Breezhaler - glykopyrronium Ultibro Breezhaler - tiotropium |
190 ml (p<0,001) 80 ml (p<0,001) 80 ml (p<0,001) 80 ml (p<0,001) |
200 ml (p<0,001) 70 ml (p<0,001) 90 ml (p<0,001) 80 ml (p<0,001) |
Průměrné FEV1 před podáním dávky (průměr hodnot naměřených 45 a 15 minut před podáním ranní dávky studijní medikace) bylo statisticky významné ve prospěch přípravku Ultibro Breezhaler v týdnu 26 v porovnání s kombinací flutikazon/salmeterol (100 ml, p<0,001), v týdnu 52 v porovnání s placebem (189 ml, p<0,001) a při všech návštěvách do týdne 64 v porovnání s glykopyrroniem (70-80 ml, p <0,001) a tiotropiem (60-70 ml, p <0,001). V týdnu 26 vykázal přípravek Ultibro Breezhaler statisticky významné zlepšení vrcholového FEV1 v porovnání s placebem během prvních 4 hodin po podání dávky (330 ml) ( p<0,001).
FEV1 AUC:
Přípravek Ultibro Breezhaler zvyšoval FEV1 AUC0-12 po podání dávky (primární cílový parametr) o 140 ml po 26 týdnech (p<0,001) v porovnání s kombinací flutikazon/salmeterol.
Výsledky léčby příznaků Dušnost:
Přípravek Ultibro Breezhaler statisticky významně snižoval dušnost hodnocenou prostřednictvím přechodného indexu dušnosti (TDI); což bylo demonstrováno statisticky významným zlepšením TDI skóre v týdnu 26 v porovnání s placebem (1,09; p<0,001), tiotropiem (0,51; p=0,007) a kombinací flutikazon/salmeterol (0,76; p=0,003). Zlepšení v porovnání s indakaterolem a glykopyrroniem bylo 0,26, respektive 0,21.
Statisticky významně vyšší procento pacientů léčených přípravkem Ultibro Breezhaler odpovědělo zlepšením o 1 bod TDI skóre nebo vyšším v týdnu 26 v porovnání s placebem (681 % a 57,5 %; p=0,004). Vyšší podíl pacientů demonstroval klinicky významnou odpověď v týdnu 26 s přípravkem Ultibro Breezhaler v porovnání s tiotropiem (68,1 % Ultibro Breezhaler versus 59,2 % tiotropium; p=0,016) a kombinací flutikazon/salmeterol (65,1 % Ultibro Breezhaler versus 55,5 % flutikazon/salmeterol; p=0,088).
Kvalita života vztažená k zdravotnímu stavu:
Přípravek Ultibro Breezhaler rovněž vykázal statisticky významný vliv na kvalitu života vztaženou k zdravotnímu stavu měřenou pomocí St. George’s Respiratory Questionnaire (SGRQ), jak naznačuje snížení SGRQ celkového skóre v týdnu 26 v porovnání s placebem (-3,01; p=0,002) a tiotropiem (-2,13; p=0,009) a snížení v porovnání s indakterolem a glykopyrroniem činilo -1,09 resp. -1,18.
V týdnu 64 bylo snížení v porovnání s tiotropiem statisticky významné (průměrný rozdíl nejmenších čtverců -2,69; p<0,001).
Vyšší procento pacientů léčených přípravkem Ultibro Breezhaler odpovědělo klinicky významným zlepšením SGRQ skóre (definovaným jako pokles o nejméně 4 jednotky základních hodnot) v týdnu 26 v porovnání s placebem (63,7 % a 56,6 %; p=0,088) a tiotropiem (63,7 % Ultibro Breezhaler vs. 56,4 % tiotropium; p=0,047), a v týdnu 64 v porovnání s glykopyrroniem a tiotropiem (57,3 % Ultibro Breezhaler versus 51,8 % glykopyrronium; p=0,055; versus 50,8 % tiotropium; p=0,051).
Denní aktivity
Přípravek Ultibro Breezhaler vykázal statisticky významně vyšší zlepšení procenta “dní se schopností vykonávat běžné denní aktivity” po 26 týdnech (8,45 %; p<0,001) v porovnání s tiotropiem. V týdnu 64 přípravek Ultibro Breezhaler vykázal zlepšení v absolutních číslech oproti glykopyrroniu (1,95 %; p=0,175) a statisticky významné zlepšení v porovnání s tiotropiem (4,96 %; p=0,001).
Exacerbace CHOPN
V 64týdenní studii srovnávající přípravek Ultibro Breezhaler (n=729), glykopyrronium (n=739) a tiotropium (n=737) přípravek Ultibro Breezhaler snižoval roční četnost středně těžkých nebo těžkých exacerbací CHOPN o 12 % v porovnání s glykopyrroniem (p=0,038) a o 10 % v porovnání s tiotropiem (p=0,096). Počet středně těžkých nebo těžkých exacerbací CHOPN na pacienta a rok během léčebné periody byl 0,94 u přípravku Ultibro Breezhaler (812 příhod), 1,07 u glykopyrronia (900 příhod) a 1,06 u tiotropia (898 příhod). Přípravek Ultibro Breezhaler rovněž statisticky významně snižoval roční počet všech exacerbací CHOPN (lehkých, středně těžkých nebo těžkých) o 15 %
v porovnání s glykopyrroniem (p=0,001) a o 14 % v porovnání s tiotropiem (p=0,002). Počet všech exacerbací CHOPN na pacienta a rok byl 3,34 u přípravku Ultibro Breezhaler (2893 příhod), 3,92 u glykopyrronia (3294 příhod) a 3,89 u tiotropia (3301 příhod).
V 26týdenní studii srovnávající přípravek Ultibro Breezhaler (n=258) a kombinaci flutikazon/salmeterol (n=264) byl počet středně těžkých nebo těžkých exacerbací CHOPN na pacienta a rok 0,15 versus 0,18 (18 příhod oproti 22 příhodám) (p=0,512) a počet všech exacerbací CHOPN na pacienta a rok (mírných, středně těžkých nebo těžkých) byl 0,72 versus 0,94 (86 příhod oproti
113 příhodám) (p=0,098).
Použití záchranné medikace
Během 26 týdnů přípravek Ultibro Breezhaler statisticky významně snižoval použití záchranné medikace (salbutamol) o 0,96 inhalace denně (p<0,001) v porovnání s placebem, 0,54 inhalace denně (p <0,001) v porovnání s tiotropiem a 0,39 inhalace denně (p=0,019) v porovnání s kombinací flutikazon/salmeterol. Po 64 týdnech činila tato redukce 0,76 inhalace denně (p<0,001) v porovnání s tiotropiem.
Tolerance zátěže
Přípravek Ultibro Breezhaler podávaný ráno snižoval dynamickou hyperinflaci a od první dávky prodlužoval možnou dobu zátěže. První den léčby se významně zlepšila inspirační kapacita při zátěži (250 ml; p<0,001) v porovnání s placebem. Po třech týdnech léčby bylo zlepšení inspirační kapacity u přípravku Ultibro Breezhaler větší (320 ml; p<0,001) a doba tolerance zátěže vzrostla (59,5 sekund; p=0,006) v porovnání s placebem.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Ultibro Breezhaler u všech podskupin pediatrické populace s chronickou obstrukční plicní nemocí (CHOPN) (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Ultibro Breezhaler
Po inhalaci přípravku Ultibro Breezhaler činil medián doby k dosažení vrcholových plazmatických koncentrací indakaterolu a glykopyrronia přibližně 15 minut, respektive 5 minut.
Na základě in vitro dat o účinnosti se předpokládá, že dávka indakaterolu uvolněná do plic je podobná u přípravku Ultibro Breezhaler a indakaterolu v monoterapii. Expozice indakaterolu v ustáleném stavu po inhalaci přípravku Ultibro Breezhaler byla buď podobná nebo mírně nižší než systémová expozice po inhalačním podání indakaterolu v monoterapii.
Po inhalaci přípravku Ultibro Breezhaler byla absolutní biologická dostupnost indakaterolu stanovena na 61-85 % uvolněné dávky a u glykopyrronia činila přibližně 47 % uvolněné dávky.
Expozice glykopyrroniu v rovnovážném stavu po inhalaci přípravku Ultibro Breezhaler byla podobná systémové expozici po inhalačním podání glykopyrronia v monoterapii.
Indakaterol
Rovnovážných koncentrací indakaterolu bylo dosaženo během 12 až 15 dnů po podávání jednou denně. Průměrná míra akumulace indakaterolu, tj. AUC během 24hodinového dávkovacího intervalu v den 14 nebo den 15 v porovnání se dnem 1, byla v rozmezí 2,9-3,8 pro jednou denně inhalované dávky mezi 60 mikrogramy a 480 mikrogramy (uvolněná dávka).
Glykopyrronium
U pacientů s CHOPN byl farmakokinetický rovnovážný stav glykopyrronia dosažen během jednoho týdne od začátku léčby. Průměrné maximální (peak) a minimální (trough) plazmatické koncentrace glykopyrronia v rovnovážném stavu při doporučeném dávkování jednou denně byly 166 pikogramů/ml resp. 8 pikogramů/ml. Expozice glykopyrroniu v rovnovážném stavu (AUC během 24hodinového dávkovacího intervalu) byla přibližně 1,4krát až 1,7krát vyšší než po první dávce.
Distribuce
Indakaterol
Po intravenózní infuzi byl distribuční objem indakaterolu během terminální fáze eliminace 2557 litrů, což naznačuje značnou distribuci. Vazba na lidské sérové a plazmatické bílkoviny in vitro byla přibližně 95 %.
Glykopyrronium
Za rovnovážného stavu byl po intravenózním podání distribuční objem glykopyrronia 83 litrů a distribuční objem v terminální fázi byl 376 litrů. Zdánlivý distribuční objem v terminální fázi po inhalaci byl téměř 20násobně větší, což odráží mnohem pomalejší eliminaci po inhalaci. Vazba glykopyrronia na lidské plazmatické bílkoviny byla in vitro 38 % až 41 % při koncentracích 1 až 10 nanogramů/ml.
Biotransformace
Indakaterol
Po perorálním podání indakaterolu lidem ve studii ADME (absorpce, distribuce, metabolismus, exkrece) byl nezměněný indakaterol hlavní složkou v séru, tvořil přibližně třetinu celkové AUC0-24 léku. Nejvýznamnějším metabolitem v séru byl hydroxylovaný derivát. Dalšími významnými metabolity byly fenolické O-glukuronidy indakaterolu a hydroxylovaný indakaterol. Diastereomer hydroxylovaného derivátu, N-glukuronidu indakaterolu, a C- a N-dealkylované produkty byly dalšími nalezenými metabolity.
In vitro je UGT1A1 izoforma hlavním prvkem metabolické eliminace of indakaterolu. Jak bylo nicméně prokázáno v klinické studii v populacích s rozdílnými UGT1A1 genotypy, systémová expozice indakaterolu není významně ovlivněna genotypem UGT1A1.
Oxidativní metabolity byly nalezeny při inkubaci s rekombinantním CYP1A1, CYP2D6 a CYP3A4. CYP3A4 je považován za hlavní izoenzym zodpovědný za hydroxylaci indakaterolu. In vitro zkoušky dále prokázaly, že indakaterol je substrátem efluxní pumpy P-gp s nízkou afinitou.
Glykopyrronium
Metabolické studie in vitro ukázaly shodné metabolické cesty glykopyrronium-bromidu u zvířat a lidí. Hydroxylací vzniká řada mono- a bis-hydroxylovaných metabolitů a přímá hydrolýza vede ke vzniku derivátu karboxylové kyseliny (M9). In vivo je M9 tvořen z té frakce dávky, která byla po inhalaci glykopyrronium-bromidu spolknuta. Glukuronidové a/nebo sulfátové konjugáty glykopyrronia byly detekovány v lidské moči po opakované inhalaci a představují přibližně 3 % podané dávky.
K oxidativní biotransformaci glykopyrronia přispívá několik CYP izoenzymů. Proto není pravděpodobné, že by inhibice nebo indukce metabolismu glykopyrronia vedla k významné změně v systémové expozici léčivé látce.
Inhibiční studie in vitro prokázaly, že glykopyrronium-bromid nemá významný potenciál inhibovat CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 nebo CYP3A4/5, efluxní transportéry MDR1, MRP2 nebo MXR a přenašeče organických kationtů OCT1 nebo OCT2. Indukční studie enzymů in vitro nenaznačovaly klinicky významnou indukci zkoumaných izoenzymů cytochromu P450 nebo UGT1A1 a transportérů MDR1 a MRP2 glykopyrronium-bromidem.
Eliminace
Indakaterol
V klinických studiích, které zahrnovaly sběr moči, bylo množství indakaterolu vyloučeného
v nezměněné formě močí obecně nižší než 2,5 % uvolněné dávky. Renální clearance indakaterolu byla v průměru mezi 0,46 a 1,20 l/hod. Při porovnání se sérovou clearance indakaterolu 23,3 l/hod je zřejmé, že renální clearance hraje v eliminaci systémově dostupného indakaterolu pouze malou roli (přibližně 2 až 5 % systémové clearance).
V lidské ADME studii indakaterol podávaný perorálně byl stolicí vylučován převážně jako nezměněná mateřská látka (54 % dávky) a v menším rozsahu jako hydroxylované metabolity indakaterolu (23 % dávky).
Sérové koncentrace indakaterolu klesaly vícefázově s průměrným terminálním poločasem v rozmezí od 45,5 do 126 hodin. Efektivní poločas vypočtený z akumulace indakaterolu po opakovaných dávkách byl v rozmezí od 40 do 52 hodin, což je ve shodě s pozorovaným ustáleným stavem po přibližně 12-15 dnech.
Glykopyrronium
Po intravenózním podání [3H]-značeného glykopyrronium-bromidu dosáhla průměrná exkrece radioaktivity močí za 48 hodin 85 % podané dávky. Dalších 5 % podané dávky bylo zjištěno ve žluči.
Renální eliminace mateřské látky představuje přibližně 60 až 70 % celkové clearance systémově dostupného glykopyrronia, zatímco ostatní cesty eliminace představují přibližně 30 až 40 %. Biliární vylučování sice k mimorenální exkreci přispívá, ale větší část mimorenální eliminace je pravděpodobně důsledkem metabolismu.
Průměrná renální clearance glykopyrronia po inhalaci se pohybovala v rozsahu 17,4
až 24,4 litrů/hodinu. Aktivní tubulární sekrece přispívá k renální eliminaci glykopyrronia. Až 23 %
podané dávky bylo detekováno v moči v podobě mateřské látky.
Pokles plazmatických koncentrací glykopyrronia má multifázický charakter. Průměrný terminální eliminační poločas byl mnohem delší po inhalaci (33 až 57 hodin) než po intravenózním (6,2 hodiny) a perorálním (2,8 hodiny) podání. Charakter eliminace naznačuje prodlouženou plicní absorpci a/nebo transfer glykopyrronia do systémové cirkulace během 24 hodin i déle po inhalaci.
Linearita/nelinearita
Indakaterol
Systémová expozice indakaterolu se zvyšuje proporcionálně se zvyšující se (uvolněnou) dávkou (120 mikrogramů - 480 mikrogramů).
Glykopyrronium
U pacientů s CHOPN se ve farmakokinetickém rovnovážném stavu zvyšovala systémová expozice a celková exkrece glykopyrronia močí přibližně lineárně v rozmezí dávek 44 až 176 mikrogramů.
Zvláštní populace
Ultibro Breezhaler
Populační farmakokinetická analýza dat u pacientů s CHOPN po inhalaci přípravku Ultibro Breezhaler neprokázala klinicky relevantní vliv věku, pohlaví a tělesné hmotnosti (netukové tělesné hmotnosti) na systémovou expozici indakaterolu a glykopyrronia. Netuková tělesná hmotnost (LBW, lean body weight) (která je funkcí tělesné hmotnosti a výšky) byla identifikována jako proměnná. Byla pozorována negativní korelace mezi systémovou expozicí a netukovou tělesnou hmotností (nebo tělesnou hmotností), nicméně vzhledem k rozsahu změny nebo prediktivní přesnosti netukové tělesné hmotnosti není doporučena úprava dávky.
Stav kouření a hodnota FEV1 před léčbou neměly patrný vliv na systémovou expozici indakaterolu a glykopyrronia po inhalaci přípravku Ultibro Breezhaler.
Indakaterol
Farmakokinetická analýza populace neprokázala klinicky relevantní vliv věku (dospělí do 88 let), pohlaví, tělesné hmotnosti (32-168 kg) nebo rasy na farmakokinetiku indakaterolu. Nenaznačila jakékoliv rozdíly mezi etnickými podskupinami této populace.
Glykopyrronium
Populační farmakokinetická analýza dat u pacientů s CHOPN zjistila, že tělesná hmotnost a věk jsou faktory přispívající k interindividuální variabilitě systémové expozice. Glykopyrronium v doporučené dávce může být bezpečně podáván ve všech věkových a hmotnostních skupinách.
Pohlaví, kouření a vstupní FEVi nemělo vliv na systémovou expozici.
Pacienti s poruchou funkce jater Ultibro Breezhaler:
Na základě klinických farmakokinetických charakteristik jednotlivých složek v monoterapii mohou přípravek Ultibro Breezhaler v doporučené dávce používat pacienti s lehkou nebo středně těžkou poruchou funkce jater. Údaje o subjektech s těžkou poruchou funkce jater nejsou k dispozici.
Indakaterol:
Pacienti s lehkou nebo středně těžkou poruchou funkce jater nevykazovali relevantní změny Cmax nebo AUC indakaterolu, ani se nelišila vazba na bílkoviny mezi subjekty s lehkou nebo středně těžkou poruchou funkce jater a zdravými kontrolními subjekty. Studie u subjektů s těžkou poruchou funkce jater nebyly provedeny.
Glykopyrronium:
U pacientů s poruchou funkce jater nebyly provedeny klinické studie. Glykopyrronium je odstraňováno ze systémové cirkulace zejména renální exkrecí. Alterace jaterního metabolismu glykopyrronia pravděpodobně nevede ke klinicky významnému vzestupu systémové expozice.
Pacienti s poruchou funkce ledvin Ultibro Breezhaler:
Na základě klinických farmakokinetických charakteristik jednotlivých složek v monoterapii mohou přípravek Ultibro Breezhaler v doporučené dávce používat pacienti s lehkou nebo středně těžkou poruchou funkce ledvin. Pacienti s těžkou poruchou funkce ledvin nebo v konečné fázi choroby ledvin vyžadující dialýzu smí používat přípravek Ultibro Breezhaler pouze tehdy, pokud očekávaný prospěch vyváží možné riziko.
Indakaterol:
Vzhledem k velmi nízkému příspěvku vylučování ledvinami k celkové eliminaci z těla nebyly studie u subjektů s poruchou funkce ledvin provedeny.
Glykopyrronium:
Porucha funkce ledvin ovlivňuje systémovou expozici glykopyrronium-bromidu. Průměrná celková systémová expozice (AUClast) stoupla až 1,4násobně u pacientů s lehkou a středně těžkou poruchou funkce ledvin a u pacientů s těžkou poruchou funkce ledvin a onemocněním ledvin v konečném stadiu až 2,2násobně. U pacientů s CHOPN a lehkou nebo středně těžkou poruchou funkce ledvin (odhadovaná glomerulární filtrace, eGFR >30 ml/min/1,73 m2) může být glykopyrronium-bromid užíván v doporučené dávce.
Etnicita
Ultibro Breezhaler:
Nebyly zjištěny výrazné rozdíly mezi celkovou systémovou expozicí (AUC) obou složek u japonských a bělošských subjektů. Pro další rasy a etnika nejsou k dispozici dostatečná farmakokinetická data.
Indakaterol:
Nebyly pozorovány rozdíly mezi etnickými podskupinami. Pro černošskou populaci jsou k dispozici pouze omezené zkušenosti s léčbou.
Glykopyrronium:
Nebyly zjištěny větší rozdíly mezi celkovou systémovou expozicí (AUC) u subjektů bílé rasy a japonského etnika. Pro další rasy a etnika nejsou k dispozici dostatečná farmakokinetická data.
5.3 Předklinické údaje vztahující se k bezpečnosti
Ultibro Breezhaler
Předklinické studie zahrnovaly in vitro a in vivo farmakologické hodnocení bezpečnosti, inhalační studie toxicity po opakovaných dávkách u potkanů a psů a inhalační studii embryo-fetálního vývoje u potkanů.
Zvýšená srdeční frekvence byla pozorována u psů po všech dávkách přípravku Ultibro Breezhaler a u všech jeho složek v monoterapii. Vliv na srdeční frekvenci u přípravku Ultibro Breezhaler byl vyšší rozsahem i dobou trvání v porovnání se změnami pozorovanými pro každou ze složek samostatně, což je v souladu s aditivní odpovědí. Bylo též pozorováno zkrácení elektrokardiografických intervalů a snížení systolického a diastolického krevního tlaku. Indakaterol podávaný psům samostatně nebo v přípravku Ultibro Breezhaler byl spojen s podobným výskytem a závažností myokardiálních lézí. Systémové expozice (AUC) obou složek přípravku v dávce nevyvolávající pozorovatelné nežádoucí účinky (no-observed-adverse-effect level - NOAEL) pro myokardiální léze byly 64- a 59násobně vyšší než u člověka.
Během studie embryo-fetálního vývoje u potkanů nebyl při žádné dávce přípravku Ultibro Breezhaler pozorován vliv na embryo nebo plod. Systémové expozice (AUC) indakaterolu a glykopyrronia v dávce nevyvolávající pozorovatelné nežádoucí účinky (no-observed-adverse-effect level - NOAEL) byly 79- a 126násobně vyšší než u člověka.
Indakaterol
Účinky na kardiovaskulární systém, které lze přičíst beta2-agonistickým vlastnostem indakaterolu, zahrnovaly tachykardii, arytmie a léze myokardu u psů. Mírné podráždění dutiny nosní a hrtanu bylo pozorováno u hlodavců. Všechny tyto nálezy se objevily po expozicích dostatečně vyšších, než jsou předpokládané expozice u člověka.
Ačkoliv indakaterol neovlivňoval celkovou reprodukční výkonnost ve fertilitní studii u potkanů, bylo v před- a povývojových studiích u potkanů pozorováno snížení počtu březích potomků první generace při expozici 14krát vyšší než u lidí léčených přípravkem Ultibro Breezhaler. Indakaterol a jeho metabolity rychle přecházely do mléka laktujících potkanů. Indakaterol nebyl embryotoxický nebo teratogenní u potkanů nebo králíků.
Studie genotoxicity neprokázaly mutagenní nebo klastogenní potenciál. Karcinogenita byla posuzována v dvouleté studii na potkanech a šestiměsíční studii na transgenních myších. Zvýšený výskyt benigního ovariálního leiomyomu a místní hyperplazie hladké svaloviny ovarií u potkanů byl v souladu s podobnými nálezy hlášenými u jiných beta2-adrenergních agonistů. U myší nebyla karcinogenita prokázána. Systémová expozice (AUC) u myší a potkanů na hladinách bez pozorovaných nežádoucích účinků byla v těchto studiích nejméně 7krát, respektive 49krát vyšší než u člověka léčeného indakaterolem jednou denně maximální doporučenou terapeutickou dávkou.
Glykopyrronium
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
Účinky, které lze přičíst antimuskarinovým účinkům glykopyrronium-bromidu zahrnovaly mírný až střední vzestup srdeční frekvence u psů, opacity čočky u potkanů a reverzibilní změny spojené se sníženou sekrecí žláz u potkanů a psů. Mírná podrážděnost a adaptivní změny respiračního traktu byly pozorovány u potkanů. Všechny tyto nálezy byly pozorovány při expozicích významně vyšších, než jsou ty očekávané u člověka.
Glykopyrronium nemělo po inhalačním podání teratogenní účinek u potkanů nebo králíků. Fertilita a prenatální a postnatální vývoj nebyly u potkanů ovlivněny. Glykopyrronium-bromid a jeho metabolity neprocházely významně přes placentární bariéru březích myší, králíků a psů. Glykopyrronium-bromid (včetně jeho metabolitů) byl vylučován do mateřského mléka potkanů a dosahoval až 10násobně vyšších koncentrací v mateřském mléce než v krvi samic.
Studie genotoxicity neodhalily žádný mutagenní ani klastogenní účinek glykopyrronium-bromidu. Studie kancerogenního potenciálu u transgenních myší při perorálním podání a u potkanů při inhalačním podání neprokázaly kancerogenní účinek při systémové expozici (AUC) přibližně 53násobně vyšší u myší a přibližně 75násobně vyšší u potkanů než při maximální doporučené dávce jednou denně u člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky Monohydrát laktosy Magnesium-stearát
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
Každý inhalátor je třeba zlikvidovat po 30 dnech používání.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Tobolky musí být uchovávány v původním blistru, aby byly chráněny před vlhkostí, a vyjímají se teprve bezprostředně před použitím.
6.5 Druh obalu a obsah balení
Ultibro Breezhaler je jednodávkový inhalátor. Tělo inhalátoru a víčko jsou vyrobeny z akrylonitril-butadien-styrenu, tlačítka jsou vyrobena z metylmetakrylát-akrylonitril-butadien-styrenu. Jehly a pružiny jsou vyrobeny z nerezavějící oceli. Jeden blistr obsahuje buď 6 nebo 10 tvrdých tobolek.
PA/Al/PVC - Al perforovaný jednodávkový blistr.
Jednotlivé balení, které obsahuje 6x1, 10x1, 12x1 nebo 30x1 tvrdých tobolek, spolu s jedním inhalátorem.
Multipack, který obsahuje 90 (3 balení po 30x1) tvrdých tobolek a 3 inhalátory. Multipack, který obsahuje 96 (4 balení po 24x1) tvrdých tobolek a 4 inhalátory. Multipack, který obsahuje 150 (15 balení po 10x1) tvrdých tobolek a 15 inhalátorů. Multipack, který obsahuje 150 (25 balení po 6x1) tvrdých tobolek a 25 inhalátorů.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Pro každé balení použijte přiložený nový inhalátor. Každý inhalátor je třeba zlikvidovat po 30 dnech používání.
Návod a způsob použití Jak používat inhalátor
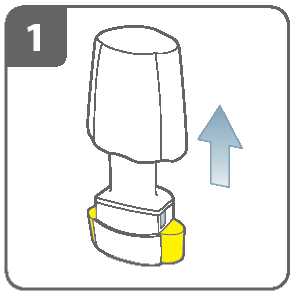
Sejměte víčko.
Otevřete inhalátor:
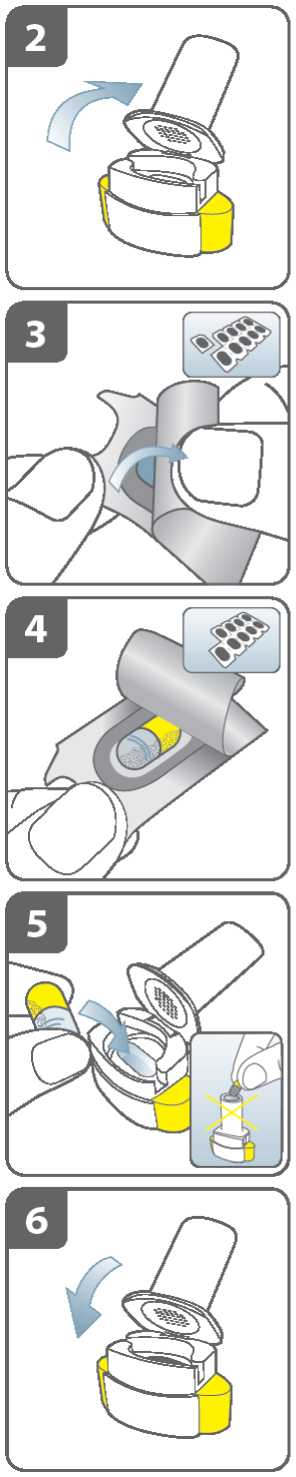
Držte pevně tělo inhalátoru a odklopte náustek. Tím inhalátor otevřete.
Připravte tobolku:
Odtrhněte podél perforace z karty blistru jeden blistr obsahující tobolku.
Vezměte tento blistr a ze zadní strany stáhněte ochrannou fólii, abyste odkryl(a) tobolku.
Neprotlačujte tobolku skrz krycí fólii.
Vyjměte tobolku:
Tobolky by měly být vždy uchovávány v blistru a vyjmuty až bezprostředně před použitím. Suchýma rukama vyjměte tobolku z blistru. Tobolku nepolykejte.
Vložte tobolku:
Vložte tobolku do komůrky pro tobolky.
Nikdy nevkládejte tobolku přímo do náustku.
Uzavřete inhalátor:
Uzavřete inhalátor, dokud neuslyšíte „cvaknutí“
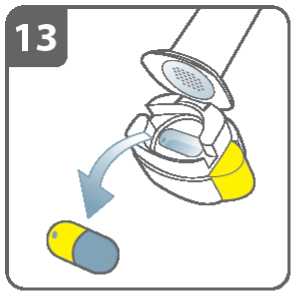
Propíchněte tobolku:
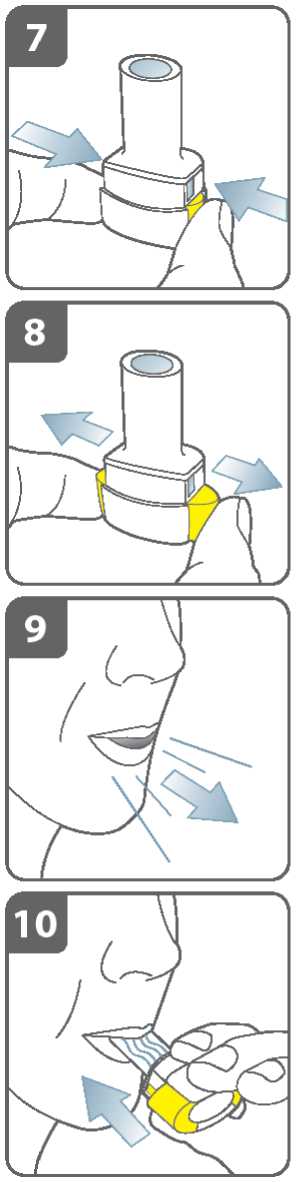
• Držte inhalátor ve vzpřímené poloze s náustkem nahoru.
• Propíchněte tobolku současným pevným stiskem obou postranních tlačítek.
Udělejte to pouze jednou.
• Při propichování tobolky byste měl(a) slyšet „cvaknutí“
Uvolněte zcela postranní tlačítka.
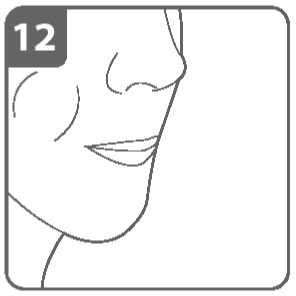
Vydechněte:
Před vložením náustku do úst zhluboka vydechněte.
Do náustku nefoukejte.
Inhalujte lék:
K vdechnutí léku hluboko do dýchacích cest:
• Držte inhalátor tak jako na obrázku. Postranní tlačítka by měla směřovat vlevo a vpravo. Postranní tlačítka nemačkejte.
• Vložte náustek do úst a pevně kolem něho stiskněte rty.
• Vdechujte rychle, ale stejně silně a co nejhlouběji můžete. Nemačkejte postranní tlačítka.
Poznámka:
Jak vdechujete přes inhalátor, tobolka se v komůrce otáčí kolem dokola a měl(a) byste slyšet hrčení. Pocítíte sladkou příchuť jak lék vstupuje do Vašich plic.
Pokud neslyšíte hrčení:
Tobolka se mohla v komůrce vzpříčit. Pokud k tomu dojde:
• Otevřete inhalátor a opatrně uvolněte
tobolku poklepáváním na tělo inhalátoru. Nemačkejte postranní tlačítka.
• Opakujte kroky 9 a 10 a znovu inhalujte lék.
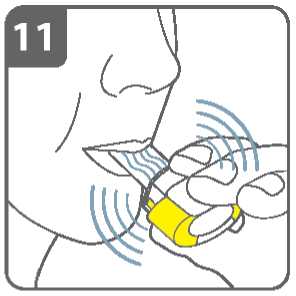
Zadržte dech:
Poté, co jste inhaloval(a) lék:
• Zadržte dech na nejméně 5-10 sekund nebo co nejdéle je to pro Vás pohodlné
a současně vyjměte náustek z úst.
• Potom vydechněte.
• Otevřete inhalátor a zjistěte, zda nějaký
prášek nezůstal v tobolce.
Pokud v tobolce zůstal nějaký prášek:
• Uzavřete inhalátor.
• Opakujte kroky 9 až 12.
Většina lidí je schopna vyprázdnit tobolku jednou nebo dvěma inhalacemi.
Doplňující informace
Občas mohou některé osoby záhy po inhalaci krátce kašlat. Pokud k tomu dojde, není se čeho obávat. Pokud je tobolka prázdná, přijal(a) jste dostatek léku.
Poté co ukončíte podávání Vaší denní dávky přípravku Ultibro Breezhaler:
• Odklopte opět náustek a vyjměte prázdnou tobolku jejím vyklepnutím z komůrky. Prázdnou tobolku odložte do domovního odpadu.
• Uzavřete inhalátor a nasaďte víčko.
Neuchovávejte neporušené tobolky v inhalátoru.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/13/862/001-008
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
19.09.2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Novartis Pharma GmbH Roonstrasse 25 90429 Norimberk Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace. Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Povinost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření:
|
Popis |
Termín splnění |
|
Mnohonárodnostní databáze kohortové studie ke zhodnocení bezpečnostních údajů specifikovaných v RMP v souvislosti s kombinací indakaterol/glykopyrronium-bromid v Evropě. |
- Předložení protokolu: 3 měsíce po rozhodnutí EU Komise - Závěrečná zpráva: Q4 2018 |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Ultibro Breezhaler 85 mikrogramů/43 mikrogramů, prášek k inhalaci v tvrdé tobolce Indacaterolum/Glycopyrronium
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje indacaterolum 110 mikrogramů a glycopyrronium 50 mikrogramů. Množství inhalovaného indakaterolu a glykopyrronia je 85 mikrogramů (odpovídá indacateroli maleas 110 mikrogramů) a 43 mikrogramů (odpovídá glycopyrronii bromidum 54 mikrogramů).
3. SEZNAM POMOCNÝCH LÁTEK
Také obsahuje: laktosu a magnesium-stearát. Další informace najdete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci v tvrdé tobolce
6 x 1 tobolka + 1 inhalátor 10x1 tobolka + 1 inhalátor 12 x 1 tobolka + 1 inhalátor 30 x 1 tobolka + 1 inhalátor
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Používejte pouze inhalátor, který je součástí balení. Tobolky nepolykejte.
Zde otevřít.
Před použitím si přečtěte příbalovou informaci. Inhalační podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
8. POUŽITELNOST
Použitelné do:
Každý inhalátor je třeba zlikvidovat po 30 dnech používání.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C.
Uchovávejte tobolky v původním blistru, aby byl přípravek chráněn před vlhkostí a nevyjímejte dříve, než bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/862/001
EU/1/13/862/007
EU/1/13/862/002
EU/1/13/862/003
6 tobolek + 1 inhalátor 10 tobolek + 1 inhalátor 12 tobolek + 1 inhalátor 30 tobolek + 1 inhalátor
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Ultibro Breezhaler 85 mikrogramů/43 mikrogramů, prášek k inhalaci v tvrdé tobolce Indacaterolum/Glycopyrronium
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje indacaterolum 110 mikrogramů a glycopyrronium 50 mikrogramů. Množství inhalovaného indakaterolu a glykopyrronia je 85 mikrogramů (odpovídá indacateroli maleas 110 mikrogramů) a 43 mikrogramů (odpovídá glycopyrronii bromidum 54 mikrogramů).
3. SEZNAM POMOCNÝCH LÁTEK
Také obsahuje: laktosu a magnesium-stearát. Další informace najdete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci v tvrdé tobolce
Multipack: 90 (3 balení po 30 x 1) tvrdých tobolek + 3 inhalátory. Multipack: 96 (4 balení po 24 x 1) tvrdých tobolek + 4 inhalátory. Multipack: 150 (15 balení po 10 x 1) tvrdých tobolek + 15 inhalátorů. Multipack: 150 (25 balení po 6 x 1) tvrdých tobolek + 25 inhalátorů.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Používejte pouze inhalátor, který je součástí balení. Tobolky nepolykejte.
Před použitím si přečtěte příbalovou informaci. Inhalační podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
8. POUŽITELNOST
Použitelné do:
Každý inhalátor je třeba zlikvidovat po 30 dnech používání.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C.
Uchovávejte tobolky v původním blistru, aby byl přípravek chráněn před vlhkostí a nevyjímejte dříve, než bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/862/004
EU/1/13/862/005
EU/1/13/862/008
EU/1/13/862/006
Multipack skládající se ze 3 balení (30 tobolek + 1 inhalátor) Multipack skládající se ze 4 balení (24 tobolek + 1 inhalátor) Multipack skládající se z 15 balení (10 tobolek + 1 inhalátor) Multipack skládající se z 25 balení (6 tobolek + 1 inhalátor)
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Ultibro Breezhaler 85 mikrogramů/43 mikrogramů, prášek k inhalaci v tvrdé tobolce Indacaterolum/Glycopyrronium
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje indacaterolum 110 mikrogramů a glycopyrronium 50 mikrogramů. Množství inhalovaného indakaterolu a glykopyrronia je 85 mikrogramů (odpovídá indacateroli maleas 110 mikrogramů) a 43 mikrogramů (odpovídá glycopyrronii bromidum 54 mikrogramů).
3. SEZNAM POMOCNÝCH LÁTEK
Také obsahuje: laktosu a magnesium-stearát. Další informace najdete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci v tvrdé tobolce
30 x 1 tobolka + 1 inhalátor. Součást multipacku. Nesmí být prodáváno samostatně. 24 x 1 tobolka + 1 inhalátor. Součást multipacku. Nesmí být prodáváno samostatně. 10x1 tobolka + 1 inhalátor. Součást multipacku. Nesmí být prodáváno samostatně.
6 x 1 tobolka + 1 inhalátor. Součást multipacku. Nesmí být prodáváno samostatně.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Používejte pouze inhalátor, který je součástí balení. Tobolky nepolykejte.
Zde otevřít.
Před použitím si přečtěte příbalovou informaci. Inhalační podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
8. POUŽITELNOST
Použitelné do:
Každý inhalátor je třeba zlikvidovat po 30 dnech používání.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C.
Uchovávejte tobolky v původním blistru, aby byl přípravek chráněn před vlhkostí a nevyjímejte dříve, než bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/862/004
EU/1/13/862/005
EU/1/13/862/008
EU/1/13/862/006
Multipack skládající se ze 3 balení (30 tobolek + 1 inhalátor) Multipack skládající se ze 4 balení (24 tobolek + 1 inhalátor) Multipack skládající se z 15 balení (10 tobolek + 1 inhalátor) Multipack skládající se z 25 balení (6 tobolek + 1 inhalátor)
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
VNITŘNÍ VÍČKO JEDNOTLIVÉHO BALENÍ A VNITŘNÍHO OBALU MULTIPACKU
1. JINÉ
Neprotlačujte tobolku skrz krycí fólii.
(1) Odtrhněte podél perforací, (2) potom stáhněte ochrannou fólii ze zadní strany a (3) vyjměte tobolku.
Tobolky nepolykejte.
Před použitím si přečtěte příbalovou informaci.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTRY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Ultibro Breezhaler 85 mcg/43 mcg prášek k inhalaci Indacaterolum/Glycopyrronium
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Pouze inhalační podání
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Ultibro Breezhaler 85 mikrogramů/43 mikrogramů, prášek k inhalaci v tvrdé tobolce
Indacaterolum/Glycopyrronium
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Ultibro Breezhaler a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Ultibro Breezhaler používat
3. Jak se přípravek Ultibro Breezhaler používá
4. Možné nežádoucí účinky
5. Jak přípravek Ultibro Breezhaler uchovávat
6. Obsah balení a další informace
1. Co je přípravek Ultibro Breezhaler a k čemu se používá Co je přípravek Ultibro Breezhaler
Tento lék obsahuje dvě léčivé látky nazývané indakaterol a glykopyrronium. Tyto látky patří do skupiny léků nazývaných bronchodilatancia.
K čemu se přípravek Ultibro Breezhaler používá
Tento lék se používá k usnadnění dýchání u dospělých pacientů, kteří mají dechové obtíže při plicním onemocnění zvaném chronická obstrukční plicní nemoc (CHOPN). Při CHOPN dochází ke stažení svalů kolem průdušek a to zhoršuje dýchání. Tento lék odstraňuje stažení těchto svalů a usnadňuje proudění vzduchu do a ven z plic.
Pokud užíváte tento lék jednou denně, pomáhá zmenšovat vliv CHOPN na Váš každodenní život.
2. Čemu musíte věnovat pozornost, než začnete přípravek Ultibro Breezhaler používat Nepoužívejte Ultibro Breezhaler
- jestliže jste alergický(á) na indakaterol nebo glykopyrronium nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku Ultibro Breezhaler se poraďte se svým lékařem, lékarníkem nebo zdravotní sestrou, pokud se Vás týká cokoliv z následujícího:
- pokud máte astma - v takovém případě nesmíte tento přípravek používat.
- pokud máte problémy se srdcem.
- pokud máte epilepsii.
- pokud máte problémy se štítnou žlázou (thyreotoxikózu).
- pokud máte cukrovku.
- pokud užíváte jakékoli léky k léčbě plicní choroby, které obsahují léčivou látku podobnou (stejnou skupinu) té v přípravku Ultibro Breezhaler (viz bod “Další léčivé přípravky a přípravek Ultibro Breezhaler“).
- máte onemocnění ledvin.
- trpíte závažnými j aterními problémy.
- máte oční onemocnění nazývané zelený zákal (glaukom) s uzavřeným úhlem.
- máte problémy s močením.
Pokud se Vás týká cokoliv ze shora uvedeného (nebo pokud si nejste jistý/á), poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou dříve, než začnete používat tento přípravek.
Během léčby přípravkem Ultibro Breezhaler
- Přestaňte používat tento přípravek a neprodleně informujte lékaře, pokud pocítíte cokoliv z následujícího:
- bolest nebo nepříjemný pocit v oku, přechodně rozmazané vidění, světelný kruh okolo zdrojů světla nebo duhové vidění ve spojení se zarudnutím očí - to mohou být příznaky akutního záchvatu glaukomu s uzavřeným úhlem.
- obtížné dýchaní nebo polykání, otok jazyka, rtů nebo tváře, kožní vyrážka, svědění a kopřivka (může se jednat o příznaky alergické reakce).
- tíseň na hrudi, kašel, sípání nebo dušnost bezprostředně po použití tohoto léku - může se jednat o příznaky stavu zvaného paradoxní bronchospasmus.
- Neprodleně informujte lékaře, pokud se příznaky CHOPN jako dušnost, sípání, kašel nelepší nebo zhoršují.
Přípravek Ultibro Breezhaler se používá jako udržovací léčba CHOPN. Nepoužívejte tento lék jako léčbu náhlého záchvatu dušnosti nebo sípání.
Děti a dospívající
Nepodávejte tento přípravek dětem nebo dospívajícím mladším 18 let.
Další léčivé přípravky a přípravek Ultibro Breezhaler
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Informujte prosím lékaře nebo lékárníka, zvláště pokud užíváte:
- jakékoli léky, které mohou být podobné přípravku Ultibro Breezhaler (obsahují podobné léčivé látky).
- léky nazývané betablokátory užívané na vysoký krevní tlak nebo jiné potíže se srdcem (jako je propranolol) nebo oční chorobu zvanou glaukom (jako je timolol).
- léky snižující množství draslíku v krvi. Ty zahrnují:
- kortikosteroidy (např. prednisolon),
- diuretika (tablety na odvodnění) užívané na vysoký krevní tlak (jako je hydrochlorothiazid),
- léky na potíže s dýcháním (j ako j e teofylin).
- léky určené k léčbě deprese (např. tricyklická antidepresiva, inhibitory monoaminooxidázy).
Těhotenství a kojení
Nejsou k dispozici žádná data o používání tohoto léku u těhotných žen a není známo, zda léčivé látky tohoto léku přecházejí do mateřského mléka.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat. Pokud Vám to lékař nenařídil, neměla byste přípravek Ultibro Breezhaler používat.
Řízení dopravních prostředků a obsluha strojů
Je nepravděpodobné, že by tento lék ovlivňoval Vaši schopnost řídit nebo obsluhovat stroje. Tento přípravek však může vyvolat závratě (viz oddíl 4 “Možné nežádoucí účinky”). Pokud se Vám při užívání tohoto přípravku točí hlava, neřiďte ani neobsluhujte stroje.
Přípravek Ultibro Breezhaler obsahuje laktosu
Tento lék obsahuje laktosu (23,5 mg v jedné tobolce). Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete tento léčivý přípravek používat.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
3. Jak se přípravek Ultibro Breezhaler užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Jak se přípravek Ultibro Breezhaler dávkuje
Obvyklá dávka přípravku je inhalace obsahu 1 tobolky jednou denně.
Tento lék je třeba inhalovat pouze jednou denně, protože jeho účinek trvá 24 hodin. Nepřekračujte dávku doporučenou lékařem.
Starší pacienti (ve věku 75 let a starší)
Pokud je Vám 75 let a více, můžete používat tento lék ve stejné dávce jako ostatní dospělí.
Kdy se přípravek Ultibro Breezhaler inhaluje
Užívejte tento lék každý den vždy ve stejnou dobu. To Vám také usnadní vzpomenout si, když je třeba lék užít.
Tento lék můžete inhalovat kdykoli před i po jídle nebo pití.
Jak přípravek Ultibro Breezhaler inhalovat
- V tomto balení najdete inhalátor a tobolky (v blistrech), které obsahují lék ve formě prášku
k inhalaci. Tobolky používejte pouze s inhalátorem obsaženým v tomto balení (inhalátor Ultibro Breezhaler). Tobolky musí až do doby použití zůstat v blistru.
- Pro vyjmutí tobolky stáhněte krycí fólii z blistru - neprotlačujte tobolku přes krycí fólii.
- Když načínáte nové balení, použijte nový inhalátor Ultibro Breezhaler obsažený v balení.
- Po 30 dnech používání vyhoďte každý inhalátor do odpadu.
- Tobolky nepolykejte.
- Přečtěte si prosím návod na konci této příbalové informace, který obsahuje další informace o použití inhalátoru.
Jestliže jste použil(a) více přípravku Ultibro Breezhaler, než jste měl(a)
Pokud jste inhaloval(a) více tohoto léku nebo pokud někdo jiný užil omylem Vaše tobolky, informujte neprodleně lékaře nebo navštivte nejbližší lékařskou pohotovostní službu. Vezměte s sebou balení přípravku Ultibro Breezhaler. Může být nutný lékařský dohled.
Jestliže jste zapomněl(a) užít přípravek Ultibro Breezhaler
Pokud zapomenete inhalovat dávku v obvyklou dobu, inhalujte ji co nejdříve v ten samý den. Následující dávku potom inhalujte příští den jako obvykle. Neinhalujte více než jednu dávku ve stejný den.
Jak dlouho používat přípravek Ultibro Breezhaler
- Užívejte tento lék tak dlouho, jak Vám doporučí Váš lékař.
- CHOPN je chronické onemocnění a Vy musíte tento lék používat každý den, a ne pouze tehdy, když máte dechové obtíže nebo jiné příznaky CHOPN.
Máte-li jakékoli otázky, týkající se délky trvání léčby tímto lékem, zeptejte se svého lékaře nebo lékárníka
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Některé nežádoucí účinky mohou být závažné:
Méně časté (mohou postihnout až 1 osobu ze 100)
• nesnesitelná bolest na hrudi se zvýšeným pocením - může se jednat o závažný problém se srdcem (ischemická choroba srdeční).
• obtížné dýchání nebo polykání, otoky jazyka, rtů nebo tváří, kopřivka, kožní vyrážka - může se jednat o příznaky alergické reakce.
• otok zejména jazyka, rtů, tváře nebo hrdla (možný příznak angioedému)
• obtížné dýchání se sípáním nebo kašlem.
• pocit únavy nebo silné žízně, zvýšená chuť k jídlu bez nárůstu tělesné hmotnosti a silnější močení než obvykle - může se jednat o příznaky vysoké hladiny krevního cukru (hyperglykémie).
• Bolest oka nebo nepříjemný pocit v oblasti oka, přechodně rozmazané vidění, světelný kruh okolo zdrojů světla nebo duhové vidění ve spojení se zarudlýma očima - může se jednat o příznaky glaukomu.
• nepravidelný srdeční rytmus.
Pokud se u Vás objeví kterýkoliv z těchto závažných nežádoucích účinků, ihned to sdělte svému
lékaři.
Další nežádoucí účinky mohou zahrnovat:
Velmi časté (mohou postihnout více než 1 osobu z 10)
• ucpaný nos, kýchání, kašel, bolest hlavy s nebo bez horečky - může se jednat o příznaky infekce horných cest dýchacích.
Časté (mohou postihnout až 1 osobu z 10)
• kombinace bolesti v krku a výtoku z nosu - může se jednat o příznaky nazopharyngitidy.
• bolestivé nebo časté močení - může se jednat o příznaky zánětu močových cest nazývaného cystitida.
• pocit tlaku nebo bolesti ve tváři nebo na čele - může se jednat o příznaky zánětu vedlejších nosních dutin zvaného sinusitida.
• výtok z nosu nebo ucpaný nos.
• závratě.
• bolest hlavy.
• kašel.
• bolest krku.
• nevolnost, nechutenství.
• zubní kaz.
• bolest svalů, vaziva, šlach, kloubů a kostí.
• horečka.
• bolest na hrudi.
• průjem nebo bolesti žaludku.
Méně časté
• spánkové potíže.
• palčivá bolest nebo necitlivost.
• rychlý srdeční puls.
• palpitace - příznak abnormálního srdečního rytmu.
• krvácení z nosu.
• sucho v ústech.
• svědění nebo vyrážka.
• svalové křeče.
• bolest nebo citlivost svalů.
• bolest rukou a nohou.
• obtížné nebo bolestivé močení - může se jednat o příznaky obstrukce (ztížení odtoku) močového měchýře nebo zadržování moči.
• otoky rukou, kotníků a nohou.
• únava.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Ultibro Breezhaler uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a blistru za „Použitelné do:“/„EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 25 °C.
Uchovávejte tobolky v původním blistru, aby byl přípravek chráněn před vlhkostí a nevyjímejte dříve, než bezprostředně před použitím.
Každý inhalátor je třeba zlikvidovat po 30 dnech používání.
Nepoužívejte tento přípravek, pokud si všimnete, že je balení poškozeno nebo vykazuje známky nepovolené manipulace.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Ultibro Breezhaler obsahuje
- Léčivými látkami jsou indacaterolum (jako maleinát) a glycopyrronii bromidum. Jedna uvolněná dávka (dávka, která opouští ústí inhalátoru) odpovídá indacaterolum 85 mikrogramů (odpovídá indacateroli maleas 110 mikrogramů) a glycopyrronium 43 mikrogramů (odpovídající glycopyrronii bromidum 54 mikrogramů).
- Dalšími složkami prášku k inhalaci jsou monohydrát laktosy a magnesium-stearát.
Jak přípravek Ultibro Breezhaler vypadá a co obsahuje toto balení
V tomto balení najdete zařízení zvané inhalátor spolu s tobolkami v blistrech. Jeden blistr obsahuje buď 6 nebo 10 tvrdých tobolek.
Tobolky mají průhledné žluté víčko a průhledné tělo. Obsahují bílý až téměř bílý prášek s kódem přípravku ..IGP1 10.50" vytištěným modře pod dvěma modrými proužky na těle tobolky a logem společnosti (&) vytištěným černě na víčku.
Dostupné jsou následující velikosti balení:
Jednotlivé balení, které obsahuje 6x1, 10x1, 12x1 nebo 30x1 tvrdých tobolek, spolu s jedním inhalátorem.
Multipack (vícedávkové balení), který obsahuje 90 (3 balení po 30x1) tvrdých tobolek a 3 inhalátory. Multipack, který obsahuje 96 (4 balení po 24x1) tvrdých tobolek a 4 inhalátory.
Multipack, který obsahuje 150 (15 balení po 10x1) tvrdých tobolek a 15 inhalátorů.
Multipack, který obsahuje 150 (25 balení po 6x1) tvrdých tobolek a 25 inhalátorů.
Na trhu ve Vaší zemi nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
Výrobce
Novartis Pharma GmbH RoonstraBe 25 D-90429 Nuremberg Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Btarapna Novartis Pharma Services Inc. Tea: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 111 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXXáSa Novartis (Hellas) A.E.B.E. Tqk: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Island Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
Italia
Novartis Farma S.p.A.
Tel: +39 02 96 54 1
Kúrcpog
Novartis Pharma Services Inc. Tni: +357 22 690 690
Latvija
Novartis Pharma Services Inc. Tel: +371 67 887 070
Suomi/Finland
Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
United Kingdom
Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Návod k použití inhalátoru Ultibro Breezhaler
Přečtěte si prosím pečlivě následující instrukce, abyste věděl(a), jak používat tento lék.
• Používejte výhradně inhalátor Ultibro Breezhaler obsažený v tomto balení. Neužívejte tobolky přípravku Ultibro Breezhaler s žádným jiným inhalátorem a nepoužívejte inhalátor Ultibro Breezhaler k podání žádných jiných léků v tobolkách.
• Při vyjímání tobolek z blistru neprotlačujte tobolky skrz krycí fólii.
• Když načínáte nové balení, použijte vždy nový inhalátor Ultibro Breezhaler obsažený v balení.
• Každý inhalátor je třeba zlikvidovat po 30 dnech používání. Poraďte se s lékárníkem, jak zlikvidovat léky a inhalátory, které již nepotřebujete.
• Tobolky nepolykejte. Prášek v tobolkách je určen k inhalaci.
Vaše balení přípravku Ultibro Breezhaler
Každé balení přípravku Ultibro Breezhaler obsahuje:
- Jeden inhalátor Ultibro Breezhaler
- Jeden nebo více blistrů, jeden obsahující buď 6 nebo 10 tobolek přípravku Ultibro Breezhaler k použití v inhalátoru.
Víčko
Inhalátor
Náustek
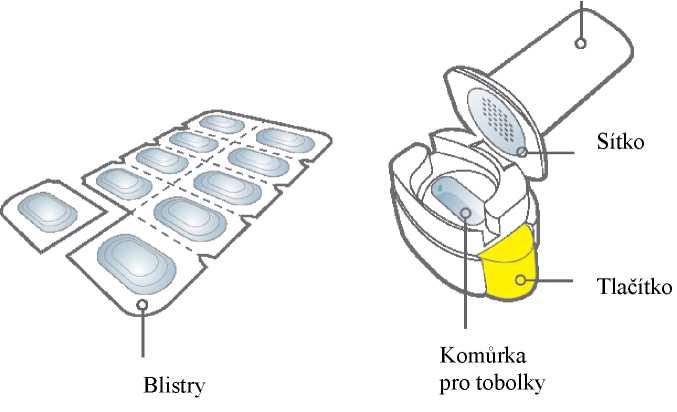
Karta s blistry
Tělo inhalátoru
Jak používat inhalátor
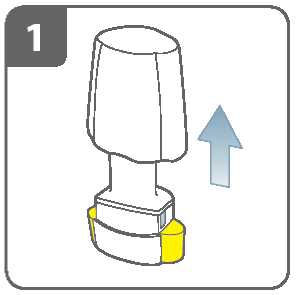
Otevřete inhalátor:
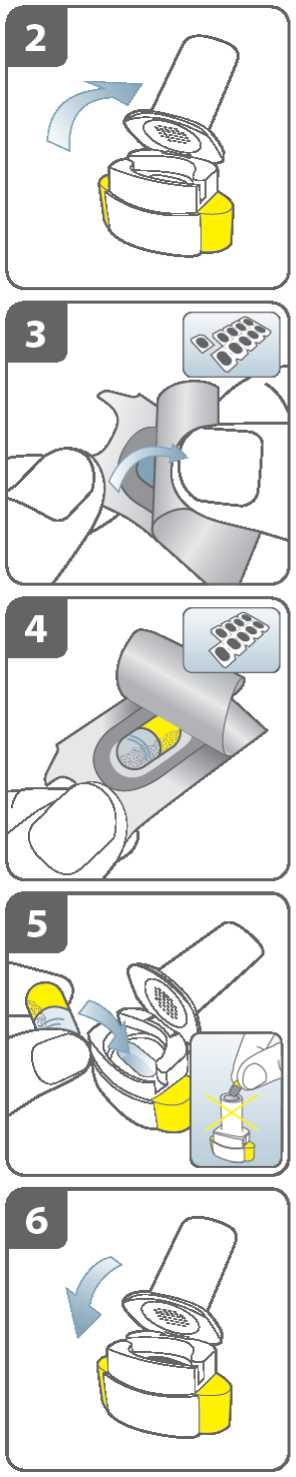
Držte pevně tělo inhalátoru a odklopte náustek. Tím inhalátor otevřete.
Připravte tobolku:
Odtrhněte podél perforace z karty blistru jeden blistr obsahující tobolku.
Vezměte tento blistr a ze zadní strany stáhněte ochrannou fólii, abyste odkryl(a) tobolku.
Neprotlačujte tobolku skrz krycí fólii.
Vyjměte tobolku:
Tobolky by měly být vždy uchovávány v blistru a vyjmuty až bezprostředně před použitím. Suchýma rukama vyjměte tobolku z blistru. Tobolku nepolykejte.
Vložte tobolku:
Vložte tobolku do komůrky pro tobolky.
Nikdy nevkládejte tobolku přímo do náustku.
Uzavřete inhalátor:
Uzavřete inhalátor, dokud neuslyšíte „cvaknutí“
Propíchněte tobolku:
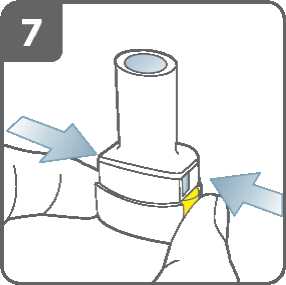
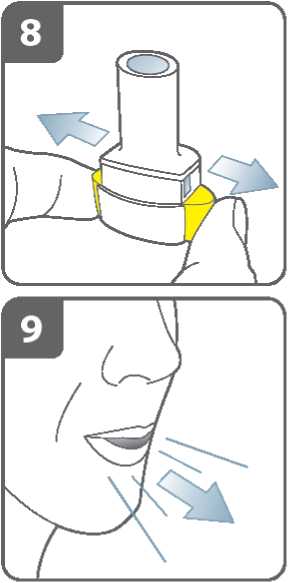
c
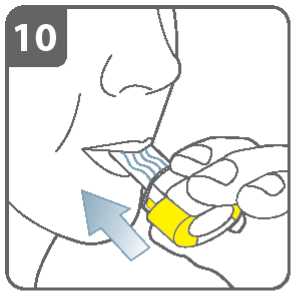
• Držte inhalátor ve vzpřímené poloze s náustkem nahoru.
• Propíchněte tobolku současným pevným stiskem obou postranních tlačítek.
Udělejte to pouze jednou.
• Při propichování tobolky byste měl(a) slyšet „cvaknutí“
Uvolněte zcela postranní tlačítka.
Vydechněte:
Před vložením náustku do úst zhluboka vydechněte.
Do náustku nefoukejte.
Inhalujte lék:
K vdechnutí léku hluboko do dýchacích cest:
• Držte inhalátor tak jako na obrázku. Postranní tlačítka by měla směřovat vlevo a vpravo. Postranní tlačítka nemačkejte.
• Vložte náustek do úst a pevně kolem něho stiskněte rty.
• Vdechujte rychle, ale stejně silně a co nejhlouběji můžete. Nemačkejte postranní tlačítka.
Poznámka:
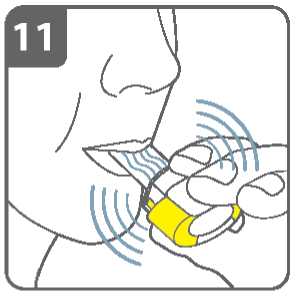
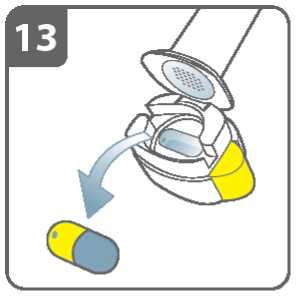
Jak vdechujete přes inhalátor, tobolka se v komůrce otáčí kolem dokola a měl(a) byste slyšet hrčení. Pocítíte sladkou příchuť jak lék vstupuje do Vašich plic.
Pokud neslyšíte hrčení:
Tobolka se mohla v komůrce vzpříčit. Pokud k tomu dojde:
• Otevřete inhalátor a opatrně uvolněte tobolku poklepáváním na tělo inhalátoru. Nemačkejte postranní tlačítka.
• Opakujte kroky 9 a 10 a znovu inhalujte lék.
Zadržte dech:
Poté, co jste inhaloval(a) lék:
• Zadržte dech na nejméně 5-10 sekund nebo co nejdéle je to pro Vás pohodlné
a současně vyjměte náustek z úst.
• Potom vydechněte.
• Otevřete inhalátor a zjistěte, zda nějaký prášek nezůstal v tobolce.
Pokud v tobolce zůstal nějaký prášek:
• Uzavřete inhalátor.
• Opakujte kroky 9 až 12.
Většina lidí je schopna vyprázdnit tobolku jednou nebo dvěma inhalacemi.
Doplňující informace
Občas mohou některé osoby záhy po inhalaci krátce kašlat. Pokud k tomu dojde, není se čeho obávat. Pokud je tobolka prázdná, přijal(a) jste dostatek léku.
Poté co ukončíte podávání Vaší denní dávky přípravku Ultibro Breezhaler:
• Odklopte opět náustek a vyjměte prázdnou tobolku jejím vyklepnutím z komůrky. Prázdnou tobolku odložte do domovního odpadu.
• Uzavřete inhalátor a nasaďte víčko.
Neuchovávejte neporušené tobolky v inhalátoru.
Doplňující informace
Občas mohou velmi malé úlomky tobolky projít přes sítko a dostat se do úst. Pokud k tomu dojde, můžete tyto úlomky cítit na jazyku. Spolknutí nebo inhalace těchto úlomků nepoškozuje zdraví. Možnost roztříštění tobolky se zvyšuje, pokud je tobolka propíchnuta více než jednou (krok 7).
Jak čistit Váš inhalátor
Nikdy nemyjte inhalátor vodou. Pokud chcete inhalátor vyčistit, otřete náustek zevnitř i zvenku čistým, suchým, nežmolkujícím kouskem látky, abyste odstranil(a) zbytky prášku. Uchovávejte inhalátor v suchu.
48