Trinovum
sp.zn. sukls126926/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
TRINOVUM
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
7 bílých tablet:
7 světle oranžových tablet:
7 oranžových tablet:
norethisteronum 0,50 mg
ethinylestradiolum 0,035 mg v 1 tabletě
norethisteronum 0,75 mg
ethinylestradiolum 0,035 mg v 1 tabletě
norethisteronum 1,0 mg
ethinylestradiolum 0,035 mg v 1 tabletě
Přípravek obsahuje laktosu, oranžovou žluť (E110) Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta
Popis přípravku
Bílé tablety, na obou stranách vyraženo „C 535“.
Světle oranžové tablety, na obou stranách vyraženo „C 735“.
Oranžové tablety, na obou stranách vyraženo „C 135“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Třífázová perorální estrogen-gestagenní antikoncepce
4.2 Dávkování a způsob podání Účinnost perorální antikoncepce
Při správném užívání, bez vynechání tablety, je pravděpodobnost otěhotnění nižší než 1 % (výskyt méně než jedné gravidity za rok na 100 žen užívajících přípravek prvním rokem). Aktuální procento selhání v případě opomenutí dosahuje 5 % v prvním roce užívání. Pravděpodobnost otěhotnění se zvyšuje s každou zapomenutou tabletou během menstruačního cyklu.
Dospělí
K zajištění spolehlivého antikoncepčního účinku přípravku TRINOVUM je nutné tablety užívat přesně dle doporučení, vždy ve stejnou denní dobu, např. před spaním.
Možné způsoby zahájení:
1. den menstruace: Užívá se jedna tableta denně 21 po sobě jdoucích dní, počínaje jednou bílou tabletou po 7 dní, dále se užívá jedna světle oranžová tableta po 7 dní a dále jedna oranžová tableta po 7 dní. Po užití poslední oranžové tablety následuje 7 dní, kdy se neužívají žádné tablety. Během této periody bez medikace lze očekávat krvácení, obvykle počínaje 2. - 4. dnem po poslední tabletě. Po této sedmidenní pauze by měl pokračovat další cyklus (počínaje bílými tabletami) i v případě, že krvácení dosud neskončilo.
V počátku cyklické léčby by mělo užívání začít první den menstruačního cyklu jednou tabletou denně v tutéž denní dobu po 21 dní.
5. den menstruace: Lepší snášenlivosti a nižšího výskytu nepravidelného krvácení lze docílit zahájením užívání tablet pátým dnem menstruačního krvácení. Další užívání pak sleduje výše popsané schéma. V tomto případě je po dobu prvních sedmi dní nutná ještě i jiná ochrana před početím.
Neděle následující po 1. dnu menstruace: Ke zvýšení pohodlí žen užívajících antikoncepci (lehce zapamatovatelný rytmus užívání, absence krvácení během víkendů) lze využít schéma tzv. „nedělního startu“. V tomto případě začne žena v prvním antikoncepčním cyklu užívat tablety první neděli po začátku menstruačního krvácení (začne-li krvácení v neděli, začíná užívat týž den). Další užívání pak sleduje výše popsané schéma s tím, že první tableta každého dalšího blistru připadá vždy na neděli. Při tomto způsobu užívání musí žena rovněž používat prvních sedm dní jinou antikoncepční metodu.
Pediatrická populace
Bezpečnost a účinnost přípravku TRINOVUM byla stanovena u žen reprodukčního věku. Předpokládá se, že bezpečnost a účinnost je totožná u postpubertálních adolescentních dívek ve věku 16 let a starších. Užívání tohoto přípravku není indikováno před docílením menarché.
Starší ženy
Tento přípravek není určen ženám v post-menopauze.
Přechod z jiného hormonálního antikoncepčního přípravku
Při přechodu užívání z jiného, odlišného antikoncepčního přípravku začne žena užívat TRINOVUM první den, který následuje po užití poslední tablety předchozího antikoncepčního přípravku. Odstup od zahájení užívání přípravku TRINOVUM nesmí v žádném případě přesáhnout 7 dní. V případě, že mezi užitím poslední tablety předchozího cyklu a první tablety nového cyklu uplyne více než 7 dní, je zapotřebí používat aditivní spolehlivou nehormonální antikoncepci do doby, než bude žena užívat tablety bez přerušení po 7 dní. Pokud dojde k pohlavnímu styku během těchto dní bez medikace, měla by být vzata v úvahu možnost otěhotnění.
Při převádění z přípravku obsahujícího pouze perorální gestagen by mělo být užívání přípravku TRINOVUM zahájeno první den po užití poslední tablety. Po úvodních 7 dní by však měla být použita ještě doplňující antikoncepční metoda.
Lékař je povinen upozornit na doporučení týkající se přechodu z jiného způsobu hormonální antikoncepce (např. transdermální antikoncepce, injekce atd.), která jsou obsažena v příbalové informaci.
Užívání po porodu
Pokud žena nekojí, je možno zahájit užívání perorální antikoncepce nejdříve 3 týdny po porodu (viz bod Tromboembolické a jiné vaskulární poruchy a 4.6 Těhotenství a kojení).
Užívání po umělém nebo spontánním přerušení těhotenství
Po nekomplikovaném umělém přerušení těhotenství nebo revizi dutiny děložní pro spontánní potrat do 20. týdne těhotenství je možno zahájit užívání ihned, v den zákroku nebo další den po provedení zákroku. Žádná podpůrná antikoncepční opatření nejsou zapotřebí, je však vždy nutné poučit ženu o doporučeních týkajících se sexuální abstinence vzhledem k provedenému zákroku. Je však zapotřebí vzít v úvahu, že po 10 dnech od umělého nebo spontánního přerušení těhotenství může dojít k ovulaci.
Po indukovaném nebo spontánním potratu ve 20. týdnu nebo po 20. týdnu těhotenství je možno zahájit užívání hormonální antikoncepce buď 21. dne po zákroku nebo první den první spontánní menstruace před 21. dnem. Prvních 7 dní prvního cyklu musí být používán ještě i další, nehormonální způsob antikoncepce.
Ve výjimečných, lékařsky odůvodněných případech lze TRINOVUM užívat v prvním týdnu po přerušení v druhém trimestru s přihlédnutím k možnému riziku tromboembolických příhod v období bezprostředně po zákroku (viz bod Tromboembolické a jiné vaskulární poruchy).
Pokyny při vynechání tablet
V případě vynechání jedné tablety (s nejvíce 24hodinovým odstupem mezi užíváním tablet), je zapotřebí tabletu užít co nejdříve si žena vzpomene. Příští tabletu užije v obvyklou dobu, i když to znamená užít obě tablety v jeden den.
V případě vynechání dvou tablet v prvním nebo druhém týdnu, užije žena dvě tablety, jakmile si vzpomene a dvě tablety příští den. Dále pokračuje v obvyklém užívání jedné tablety denně, avšak než bude užívat tablety nepřetržitě po 7 dní, je nezbytné používat ještě jinou spolehlivou nehormonální metodu antikoncepce.
V případě vynechání dvou tablet ve třetím týdnu, zlikviduje žena zbytek tablet v balení a týž den začne užívat další balení, avšak než bude užívat tablety nepřetržitě po 7 dní, je nezbytné používat ještě jinou spolehlivou nehormonální metodu antikoncepce.
V případě vynechání tří tablet kdykoli během prvních tří týdnů, zlikviduje žena zbytek tablet v balení a týž den začne užívat další balení, avšak než bude užívat tablety nepřetržitě po 7 dní, je nezbytné používat ještě jinou spolehlivou nehormonální metodu antikoncepce.
Intermenstruální krvácení nebo špinění
V případě intermenstruálního krvácení nebo špinění může užívání tablet pokračovat. Toto krvácení obvykle spontánně odezní po třetím cyklu, s možnými individuálními odchylkami. Pokud intermenstruální krvácení přetrvává, je zapotřebí konzultovat lékaře.
V případě, že se nedostaví pseudomenstruační krvácení, může užívání tablet pokračovat. Pokud byly tablety užívány správně, nemusí absence krvácení nutně znamenat graviditu. Přesto však by měla být možnost gravidity vyloučena.
Zvracení/průjem
Pokud se dostaví zvracení do 3 hodin po užití tablety nebo úporný průjem trvající déle než 24 hodin, nemusí být antikoncepční účinnost adekvátní, a než bude žena užívat tablety nepřetržitě po 7 dní, je nezbytné používat ještě jinou nehormonální metodu antikoncepce. Pokud zvracení a/nebo průjem přetrvávají, je zapotřebí konzultovat lékaře, protože antikoncepční účinnost může být zpochybněna.
4.3 Kontraindikace
• Tromboflebitida nebo tromboembolické poruchy.
• Hluboká žilní tromboflebitida nebo tromboembolická příhoda v anamnéze.
• Známé příznaky trombofilie.
• Cerebrovaskulární nebo koronární postižení.
• Migréna s fokální aurou.
• Diagnostikovaný nebo suspektní karcinom prsu.
• Komplikovaná srdeční chlopenní vada.
• Trvalé hodnoty systolického tlaku > 160 mmHg nebo hodnoty diastolického tlaku >100 mmHg.
• Diabetes s vaskulárními změnami.
• Karcinom endometria nebo jiný diagnostikovaný nebo suspektní estrogen-dependentní tumor.
• Neobjasněná abnormální krvácení z genitálního traktu.
• Cholestatická žloutenka v těhotenství nebo při předchozím užívání perorální antikoncepce.
• Akutní nebo chronické hepatocelulámí onemocnění s abnormálními jatemími funkcemi.
• Adenom nebo karcinom j ater.
• Potvrzená nebo suspektní gravidita.
• Hypersenzitivita na léčivou látku nebo kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Perorální antikoncepční přípravky nechrání proti HIV infekcím (AIDS) nebo jiným pohlavně přenosným chorobám.
Před zahájením a pravidelně v průběhu užívání hormonální antikoncepce se doporučuje podrobné lékařské vyšetření. Je zapotřebí odebrat kompletní osobní a rodinnou anamnézu. Opakovaná intermenstruální krvácení nebo neočekávané vaginální krvácení vyžadují další zhodnocení.
Kouření a věk
Kouření zvyšuje riziko závažných kardiovaskulárních komplikací během užívání hormonální antikoncepce. Toto riziko se zvyšuje s věkem, zvláště u žen ve věku nad 35 let a s počtem vykouřených cigaret. Z toho důvodu by ženy neměly užívat kombinovanou hormonální antikoncepci, včetně přípravku TRINOVUM, pokud kouří a jsou ve věku nad 35 let.
Známé poruchy a stavy
Při hodnocení rizika a prospěchu perorální antikoncepce by si měl být lékař vědom stavů, při nichž může být zvýšeno riziko komplikací spojených s užíváním perorální hormonální antikoncepce:
• Stavy, které vedou ke zvýšenému riziku rozvoje žilních tromboembolických komplikací, např. dlouhodobá imobilizace nebo rozsáhlé chirurgické výkony.
• Rizikové faktory arteriálních onemocnění např. kouření, hyperlipidemie, hypertenze (trvalé hodnoty systolického tlaku > 140 mmHg nebo hodnoty diastolického tlaku > 90 mmHg) a obezita.
• Diabetes mellitus.
• Těžké deprese, i v anamnéze.
• Kouření. Riziko kardiovaskulárních komplikací se zvyšuje s věkem a počtem vykouřených cigaret.
Tromboembolizace a jiné vaskulární poruchy
Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilní tromboembolizace (VTE) ve srovnání s jejím neužíváním. Riziko je nejvyšší během prvního roku užívání. Riziko je nižší než riziko žilního tromboembolismu spojeného s těhotenstvím, které se odhaduje na 60 případů na 100 000 těhotenství. Žilní tromboembolismus je fatální v 1 - 2 % případů. Epidemiologické studie naznačují, že incidence žilního tromboembolismu u uživatelek perorální antikoncepce s nízkou dávkou estrogenů (< 50 pg ethinylestradiolu) se pohybuje mezi 20 až 40 případy na 100 000 žen/rok, ale toto odhadnuté riziko kolísá dle typu gestagenu. Incidence žilního tromboembolismu u žen, které neužívají perorální antikoncepci je 5 až 10 případů na 100 000 žen/rok. Riziko tromboembolických chorob v souvislosti s perorální antikoncepcí se vrátí k výchozímu stavu po ukončení užívání kombinované hormonální antikoncepce (CHC). Riziko VTE je vyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko se zvyšuje, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
Při užívání perorální antikoncepce bylo hlášeno dvoj až čtyřnásobné relativní riziko pooperačních tromboembolických komplikací. Relativní riziko žilní trombózy je u predisponovaných žen oproti ženám bez těchto dispozic dvojnásobné. V případě delší plánované imobilizace (např. při plánovaných operacích) je vhodné vysadit antikoncepci čtyři týdny před výkonem a obnovit za dva týdny po plné mobilizaci.
Vzhledem ke zvýšenému riziku rozvoje tromboembolizace bezprostředně v období po porodu by perorální antikoncepce neměla být zahájena dříve než 3 týdny po porodu u žen, které nekojí. Po indukovaném nebo spontánním potratu ve 20. týdnu nebo po 20. týdnu těhotenství je možno zahájit užívání hormonální antikoncepce buď 21. den po zákroku nebo první den první spontánní menstruace před 21. dnem.
Relativní riziko arteriální trombózy (např. mrtvice, infarktu myokardu) je zvýšeno za přítomnosti dalších predisponujících faktorů, k nimž patří kouření cigaret, hypertenze, hyperlipidemie, obezita, diabetes, preeklamptická toxemie v anamnéze, valvulární srdeční vada, arteriální fibrilace a vyšší věk. Perorální antikoncepce obsahující 50 nebo více mikrogramů estrogenu je spojována s těmito závažnými vaskulárními komplikacemi. Riziko vaskulárních onemocnění může být sníženo u perorální antikoncepce obsahující nižší dávky estrogenů a gestagen, třebaže to nebylo nezvratně prokázáno.
Riziko závažných kardiovaskulárních nežádoucích účinků se zvyšuje s věkem a při silném kouření. Toto riziko se výrazně projevuje ve věku nad 35 let u žen, které kouří. Ženy užívající hormonální antikoncepci by měly být důrazně vyzvány, aby nekouřily.
U některých žen užívajících hormonální antikoncepci bylo hlášeno zvýšení krevního tlaku. Ze studií s perorální antikoncepcí obsahující 50 a více mikrogramů estrogenu vyplývá, že zvýšení je pravděpodobnější u starších žen a při prodlouženém užívání. U mnoha žen se zvýšený krevní tlak navrací po ukončení užívání perorální antikoncepce k normálu. Neexistuje rozdíl ve výskytu hypertenze mezi ženami, které antikoncepci dříve užívaly a nikdy neužívaly.
Ženám trpícím hypertenzí (trvalé hodnoty systolického tlaku 140 - 159 mmHg nebo trvalé hodnoty diastolického tlaku 90 - 99 mmHg) by měl být před zahájením užívání krevní tlak korigován.
Pokud dojde běhěm léčby k významnému zvýšení krevního tlaku (při hodnotách systolického tlaku > 140 mmHg nebo hodnotách diastolického tlaku > 90 mmHg) by mělo být užívání perorální antikoncepce ukončeno. Obecně, pokud se objeví hypertenze během léčby hormonálními kontraceptivy je třeba ženu převést na nehormonální antikoncepci. Pokud nejsou vhodná jiná kontraceptiva, je možné pokračovat v užívání hormonální antikoncepce společně s anithypertenzní léčbou. V průběhu léčby hormonální antikoncepcí je doporučeno monitorování krevního tlaku.
V souvislosti s užíváním perorální antikoncepce byly hlášeny klinické případy retinální trombózy.
V případě neobjasněné přechodné, částečné nebo úplné ztráty vidění; objevení se rozostřeného vidění nebo diplopie; papiloedému nebo retinálních vaskulárních lézí je zapotřebí užívání perorální antikoncepce ukončit, neprodleně stanovit diagnózu a zahájit vhodnou léčbu.
Jaterní choroby
Po onemocnění hepatitidou a od normalizace jaterních testů je před užíváním perorální antikoncepce zapotřebí odstupu nejméně tří měsíců.
Výskyt benigních a maligních jaterních nádorů (jaterních adenomů a hepatocelulárních karcinomů) je vzácný. Kazuistiky kontrolních studií naznačují, že riziko těchto nádorů se může zvyšovat v souvislosti s užíváním a délkou užívání perorální antikoncepce. Ruptura benigních jaterních adenomů může způsobit úmrtí z důvodu krvácení do dutiny břišní.
Během užívání perorální hormonální antikoncepce bylo hlášeno onemocnění žlučníku včetně cholecystitidy a cholelitiázy.
Karcinom reprodukčních orgánů a prsů
V případě nediagnostikovaného, přetrvávajícího nebo rekurentního abnormálního vaginálního krvácení by měly být podniknuty příslušné kroky k vyloučení malignity.
Otázkou výskytu karcinomu prsu, endometriálního, ovariálního a cervikálního karcinomu u žen užívajících estrogen-gestagenní antikoncepci se zabývalo mnoho epidemiologických studií. Třebaže jsou zprávy protichůdné, většina studií potvrzuje, že užívání perorální antikoncepce není spojeno se všeobecným zvýšením rizika rozvoje karcinomu prsu. V některých studiích bylo hlášeno zvýšené relativní riziko rozvoje karcinomu prsu, zejména v mladším věku. Toto zvýšené relativní riziko souviselo s délkou užívání.
V rámci meta-analýzy 54 epidemiologických studií bylo hlášeno, že u žen, které užívají perorální antikoncepci nebo ji užívaly v posledních 10 letech, bylo zjištěno mírné zvýšení rizika diagnostikovaného karcinomu prsu, přestože i metastazující karcinomy mají tendenci se lokalizovat do prsou. Na základě dosud známých skutečností nelze rozhodnout, zda je zvýšení rizika způsobeno časnější diagnostikou karcinomu u žen užívajících antikoncepci, biologickým účinkem estrogen-gestagenní antikoncepce, nebo kombinací obojího. Z této meta-analýzy rovněž vyplývá, že důležitým faktorem u karcinomu prsu je věk, kdy žena ukončí užívání antikoncepce; čím vyšší věk ukončení užívání, tím vyšší výskyt karcinomu prsu. Délka užívání se jeví méně důležitou.
Možné zvýšení rizika karcinomu prsu by mělo být se ženou prodiskutováno a posouzeno riziko oproti přínosu kombinované perorální antikoncepce.
Z některých studií vyplývá, že užívání perorální antikoncepce souvisí u některých populací se zvýšením rizika cervikální neoplazie, včetně cervikálního karcinomu. Tyto závěry jsou však kontroverzní, protože nálezy mohou být způsobeny rozdíly v sexuálním chování a dalších faktorech.
Metabolické účinky
Perorální antikoncepční přípravky mohou snižovat glukózovou toleranci. Tento účinek vykazuje přímou souvislost s dávkou estrogenu. Aditivně mohou gestageny zvyšovat sekreci inzulinu a vytvářet rezistenci k inzulinu, tento účinek se u různých gestagenů různí. U žen, které netrpí diabetem, se zdá, že perorální antikoncepce hladinu glukózy na lačno neovlivňuje. Vzhledem k prokázaným účinkům by měly být ženy ve stadiu prediabetu a ženy trpící diabetem během užívání perorální antikoncepce pečlivě monitorovány.
Během užívání perorální antikoncepce vykazuje malé množství žen přetrvávající hypertriacylglyceridemii. U žen užívajících perorální antikoncepci byly nalezeny změny v sérových triacylglycerolech a lipoproteinech.
Bolest hlavy
Při prvním záchvatu nebo exacerbaci migrény nebo recidivující, přetrvávající nebo úporné bolesti hlavy je zapotřebí přerušit užívání přípravku a vyšetřit příčinu.
Nepravidelné krvácení
Zejména během prvních tří měsíců může nastat intermenstruální krvácení, špinění nebo absence pseudomenstruačního krvácení.
Krvácení nebo špinění často spontánně odezní a většinou nepředstavuje závažnější problémy. Je zapotřebí vyšetřit organickou příčinu, stanovit diagnózu a v případě nutnosti vyloučit malignitu nebo těhotenství.
U některých žen se může dostavit amenorea nebo oligorea, zvláště při pozitivní anamnéze.
Chloasma
Chloasma se může příležitostně objevit, zejména při chloasma gravidarum v anamnéze. Ženy užívající tento přípravek a inklinující k chloasmatům by se měly vyvarovat slunění nebo ultrafialového záření. Chloasma nemusí být vždy plně reverzibilní.
Přípravek obsahuje laktózu.
Tento léčivý přípravek obsahuje laktózu: pacientky se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným nedostatkem laktázy nebo malabsorpcí glukosy a galaktosy by neměli tento léčivý přípravek užívat.
Oranžová žluť, kterou obsahují oranžové tablety, může způsobit alergické reakce.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Interakce
Změny účinků antikoncepce spojené se souběžným užíváním dalších přípravků
Některé léčivé nebo bylinné přípravky mohou snižovat plazmatické koncentrace antikoncepčních hormonů, čímž se snižuje účinnost hormonální antikoncepce nebo se zvyšuje krvácení z průniku. Pokud žena užívající hormonální antikoncepci užívá takový léčivý nebo bylinný přípravek, měla by být poučena o nutnosti používání další antikoncepce nebo jiné antikoncepční metodě. Snížení plazmatických koncentrací antikoncepčních hormonů byly pozorovány při současném užívání s přípravky, které indukují enzymy metabolizující antikoncepční hormony, včetně CYP3A4, a u některých přípravků, u nichž je mechanismus interakce nejistý. Některé léčivé nebo bylinné přípravky snižující účinek hormonální antikoncepce jsou:
• některá antiepileptika (např. karbamazepin, eslikarbazepin - acetát, felbamát, oxkarbazepin, fenytoin, rufinamid, topiramát)
• (fos)aprepitant
• barbituráty
• bosentan
• colesevelam (viz níže)
• griseofulvin
• některé (kombinace) inhibitory proteázy HIV (např. nelfinavir, ritonavir, ritonavir - inhibitor proteázy)
• některé inhibitory proteázy HCV (např. boceprevir, telaprevir)
• modafinil
• některé nenukleosidové inhibitory reverzní transkriptázy (např. nevirapin)
• rifampicin a rifabutin
• třezalka tečkovaná
Colesevelam
Colesevelam je sekvestrant žlučových kyselin, a pokud byl užívaný v kombinaci společně s perorální antikoncepcí, byl prokázán jako významně zvyšující AUC ethinylestradiolu. Nebyly pozorovány žádné interakce, pokud byla hormonální antikoncepce podána 4 hodiny před colesevelamem.
Zvýšení plazmatických hladin hormonů spojené se souběžným užíváním přípravků
Některé léčivé přípravky a grapefruitový džus mohou zvyšovat hladiny ethinylestradiolu v plazmě, pokud jsou užívány souběžně. Jsou to například:
• acetaminofen
• kyselina askorbová
• inhibitory CYP3A4 (zahrnující itrakonazol, ketokonazol, vorikonazol, flukonazol a grapefruitový džus)
• etorikoxib
• některé inhibitory proteázy HIV (např. atazanavir, indinavir)
• HMG - CoA inhibitory reduktázy (zahrnující atorvastatin a rosuvastatin)
• některé nenukleosidové inhibitory reverzní transkriptázy (např. etravirin)
Změny plazmatických hladin souběžně podávaných léčivých přípravků
Pokud je kombinovaná hormonální antikoncepce užívána souběžně s jinými léčivými přípravky, může také ovlivnit jejich farmakokinetiku.
Léčivé přípravky, u kterých se mohou měnit plazmatické hladiny (díky inhibici CYP):
• cyklosporin
• omeprazol
• prednisolon
• selegilin
• theofyllin
• tizanidin
• vorikonazol
Léčivé přípravky, u kterých se může snižovat plazmatická hladina (díky inhibici glukuronidací)
• acetaminofen
• kyselina klofibrová
• lamotrigin (viz níže)
• morfin
• kyselina salicylová
• temazepam
Lamotrigin
Při současném užívání hormonálních kontraceptiv spolu s lamotriginem, bylo prokázáno významné snížení plazmatických koncentrací lamotriginu, způsobené indukcí lamotriginu glukuronidací. To může snížit regulaci epileptických záchvatů, a proto může být nezbytná úprava dávky lamotriginu.
Lékař má uvážit možnost enzymových změn a konzultovat podrobnější informace lékových interakcí souběžně užívaných léčivých přípravků s hormonálními kontraceptivy a může být nutná úprava dávkování.
Laboratorní vyšetření
Perorální antikoncepcí mohou být ovlivněny některé testy endokrinních a jaterních funkcí a krevních komponent:
• Zvýšení hladin protrombinu a faktorů II, VII, VIII, IX, X, XII a XIII;
snížení antitrombinu 3; zvýšení agregability destiček indukované noradrenalinem.
• Zvýšení vazebného globulinu pro hormony štítné žlázy (TBG) vedoucí ke zvýšení celkového thyreoidního hormonu v cirkulaci, stanovovaného T 4 na koloně nebo radioimunoesejí jako jod vázaný na proteiny (PBI). Absorpce volného T 3 na resině je snížena, reflektující zvýšení TBG, koncentrace volného T 4 není narušena.
• Možné zvýšení ostatních vazebných proteinů v séru.
• Zvýšení vazebných globulinů pro pohlavní hormony vede ke zvýšení hladin hormonálních steroidů v séru; avšak volné nebo biologicky aktivní hladiny jsou buď sníženy, nebo zůstávají nezměněny.
• Lipoprotein o vysoké hustotě (HDL-C) a celkový cholesterol (celkový-C) mohou být zvýšeny, lipoprotein o nízké hustotě (LDL-C) může být zvýšen nebo snížen, zatímco poměr LDL-C/HDL-C může být snížen a triacylglyceroly mohou být nezměněny. Tyto účinky jsou závislé na dávkách estrogenu a gestagenu a druhu gestagenu.
• Glukózová tolerance může být snížena.
• Hladiny sérových folátů mohou být během užívání perorální antikoncepce sníženy. Může to mít klinický význam u žen, které otěhotní krátce po ukončení perorální antikoncepce.
4.6 Fertilita, těhotenství a kojení Těhotenství
TRINOVUM je během těhotenství kontraindikováno.
Z epidemiologických studií vyplývá, že riziko vrozených vad u dětí, narozených ženám, které užívaly perorální antikoncepci před těhotenstvím, není zvýšeno. Většina současných studií rovněž vylučuje teratogenní účinek, zejména z hlediska srdečních anomálií a vad týkajících se redukce končetin, při neúmyslném užívání v časném těhotenství.
Kojení
Antikoncepční steroidy a/nebo jejich metabolity mohou být vylučovány do mateřského mléka. Kombinované antikoncepční přípravky užívané po porodu mohou navíc narušovat laktaci ve smyslu snížení kvantity a kvality mateřského mléka. Pokud je to možné, měly by být kojící matky vyzvány, aby neužívaly TRINOVUM nebo jiné kombinované antikoncepční přípravky, ale používaly jinou formu antikoncepce až do úplného odstavení dítěte.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
Napříč tímto bodem jsou prezentovány nežádoucí účinky. Nežádoucí reakce jsou nežádoucí účinky, které byly považovány za odpovídající s užíváním norethisteronu a ethinylestradiolu na základě komplexního posouzení dostupných informací nežádoucích účinků. Příčinná souvislost s norethisteronem a ethinylestradiolem nemůže být spolehlivě stanovena v jednotlivých případech. Kromě toho jsou klinické testy prováděny za různých podmínek, nežádoucí účinky pozorované v klinických hodnoceních s přípravkem nelze přímo srovnávat s poměry v klinických hodnoceních jiných přípravků a nemusí odrážet poměry pozorované v klinické praxi.
Bezpečnost přípravku TRINOVUM byla hodnocena v 5 klinických studiích (2 randomizovaných aktivně kontrolovaných a 3 byly otevřené, nekontrolované) u 2 542 zdravých žen, které užívaly nejméně jednu dávku přípravku TRINOVUM. Tři z 5 klinických studií byly randomizované, dvojitě zaslepené, aktivně kontrolované, 1 studie byla randomizovaná, dvojitě zaslepená porovnávající 4 rozdílné lékové formy přípravku TRINOVUM a 1 studie byla otevřená nekontrolovaná. V Tabulce 1 jsou zahrnuty všechny nežádoucí účinky >1%, které byly hlášeny během užívání přípravku TRINOVUM v klinických studiích.
|
Tabulka 1 Nežádoucí účinky >1% přípravku TRINOVUM hlášené během | |
|
užívání přípravkem TRINOVUM v 5 klinických studiích | |
|
Třídy orgánových systémů |
% |
|
Nežádoucí účinek |
(N=2,542) |
|
Psychiatrické poruchy | |
|
1,6 | |
|
1,1 | |
|
Poruchy nervového systému | |
|
13,1 | |
|
Závrať |
1,3 |
|
Cévní poruchy | |
|
Hypertenze |
3,5 |
|
Gastrointestinální poruchy | |
|
Abdominální bolest |
3,0 |
|
1,6 | |
|
Abdominální distenze |
1,1 |
|
Poruchy kůže a podkoží | |
|
Akné |
1,3 |
|
Poruchy pohybového systému a pojivové tkáně | |
|
Svalové křeče |
2,2 |
|
1,5 | |
|
Poruchy reprodukčního systému a choroby prsů | |
|
Výtok z děložního hrdla |
5,1 |
|
Vaginální výtok |
3,5 |
|
Eroze děložního hrdla |
3,5 |
|
Amenorea |
3,3 |
|
Menoragie |
2,6 |
|
Citlivost prsů |
2,0 |
|
Bolest prsů |
1,9 |
|
Vulvovaginální pruritus |
1,7 |
|
Pánevní bolest |
1,6 |
Zahrnuty jsou klinické studie 15557-EE-21-3A/3B/3BF, A-2414 (Mexiko), A-2414 (USA), OR/79/1, A-3409.
Dodatečné nežádoucí účinky hlášené <1% u osob léčených přípravkem TRINOVUM (N=2542) jsou uvedeny v Tabulce 2.
Tabulka 2 Nežádoucí účinky <1% přípravku TRINOVUM hlášené během
_užívání přípravkem TRINOVUM v 5 klinických studiích_
Třídy orgánových systémů
Nežádoucí účinek_
Infekce a infestace_
Kandidóza_
Vulvovagiální kandidóza_
Poruchy metabolismu a výživy_
Zadržování tekutin_
Snížení apetitu_
Zvýšení apetitu_
Nemožnost zhubnout_
Psychiatrické poruchy_
Úzkost_
Změny nálady_
Snížení libida_
Poruchy nervového systému_
Tenzní bolest hlavy_
Migréna_
Oční poruchy_
Nesnášenlivost kontaktních čoček_
Gastrointestinální potíže_
Abdominální bolest_
Poruchy kůže a podkoží_
Alopecie_
Chloasma_
Hirsutismus_
Poruchy reprodukčního systému a choroby prsů_
Výtok z genitálií_
Celkové a jinde nezařazené poruchy a lokální reakce po podání_
Periferní edém_
Únava_
Edém_
Abnormální klinické a laboratorní nálezy nezařazené jinde_
Přírůstek hmotnosti_
Úbytek hmotnosti_
Jsou zahrnuta klinická hodnocení 15557-EE-21-3A/3B/3BF, A-2414 (Mexiko), A-2414 (USA), OR/79/1,
A-3409.
Ve 3 studiích s přípravkem TRINOVUM byly hlášeny specifické nežádoucí účinky jmenovitě zvracení (hlášené jako nauzea / zvracení), dysmenorea, metroragie, premenstruační syndrom a krvácení z průniku, které byly stanoveny dle léčebného cyklu (od cyklu k cyklu) na základě použití menstruačního kalendáře / denního schématu. Obecně je poměr nežádoucích účinků vyšší než spontánní případy hlášené pacienty. Vzhledem k tomu, že stejné pacientky mohly přispět k počtu stanovených reakcí více než v 1cyklu, nebylo možné kombinovat údaje pro jednotlivé cykly. Aby se zajistilo, že tyto nežádoucí účinky nebyly z analýzy údajů z klinických hodnocení vyloučeny neoprávněně, bylo rozhodnuto, že četnost těchto nežádoucích účinků bude prezentována z jednotlivých cyklů. Z těchto důvodů nebyly v tabulce 1 a 2 tyto nežádoucí účinky zahrnuty.
V Tabulce 3 jsou zahrnuty všechny nežádoucí účinky >1%, které byly hlášeny v jednom cyklu během užívání přípravku TRINOVUM v klinických studiích. Jelikož všechny klinické studie neshromažďovaly údaje o všech nežádoucích účincích, na četnosti jejich výskytu se podílel počet pacientek odpovídající nežádoucím účinkům od cyklu k cyklu. V prvním cyklu byl počet nežádoucích účinků vyšší. Počet všech nežádoucích účinků od cyklu k cyklu se snižoval v průběhu času s dalšími cykly (čtvrtý nebo šestý cyklus) a některé případy již po čtvrtém cyklu nebyly hlášeny (např. krvácení z průniku).
|
Tabulka 3 Nežádoucí účinky přípravku TRINOVUM hlášené během prvního cyklu užívání přípravku TRINOVUM ve 3 klinických studiích | |
|
Třídy orgánových systémů Nežádoucí účinek |
1. cyklus (%) |
|
Gastrointestinální potíže | |
|
13,1 | |
|
Poruchy reprodukčního systému a choroby prsů | |
|
Metroragie |
40,0 |
|
Dysmenorea |
22,7 |
|
Premenstruační syndrom |
18,9 |
|
Krvácení z průniku |
8,6 |
Případy, které byly stanoveny dle léčebného cyklu (od cyklu k cyklu) na základě použití menstruačního kalendáře / denního schématu.
Zahrnuté studie jsou A-2414 (Mexico), A-2414 (United States), OR/79/1.
N = počet pacientek s údaji dostupnými během prvního cyklu.
Údaje po uvedení přípravku na trh
Nežádoucí účinky identifikované po uvedení přípravku na trh v souvislosti užíváním přípravku TRINOUVM jsou uvedené v tabulce 1. Nežádoucí účinky jsou seřazeny s použitím následující konvence:
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1 000 až <1/100),
Vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 1
Velmi vzácné
Cerebrovaskulární příhoda
|
Oční potíže | |
|
Velmi vzácné |
Trombóza retinálních cév |
Velmi vzácné
Pankreatitida, Trombóza mezentrické tepny
|
Poruchy jater a |
žlučových cest |
|
Velmi vzácné |
Hepatitida, Cholelitiasa, Buddův-Chiariho syndrom |
|
Poruchy kůže a |
podkoží |
|
Velmi vzácné |
Angioedém, Erythema nodosum, Kopřivka, Pruritus, Fotosenzitivní reakce |
Poruchy reprodukčního systému a choroby prsů
Velmi vzácné
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
Po akutním požití vyšších dávek perorální antikoncepce nebyly pozorovány závažné příznaky intoxikace. Předávkování může způsobit nauzeu, zvracení a u mladých dívek děložní krvácení. Neexistuje antidotum a léčba by měla být symptomatická.
Příznivé účinky
Epidemiologickými studiemi byly prokázány příznivé účinky estrogen-gestagenní perorální antikoncepce. V těchto studiích byly využity údaje získané u přípravků obsahujících dávky estrogenů vyšší než 0,035 mg ethinylestradiolu nebo 0,05 mg mestranolu.
Účinky na menstruační cyklus:
- zvýšení pravidelnosti cyklu;
- snížení krevní ztráty a snížení výskytu anemie z nedostatku železa;
- snížení incidence dysmenorey.
Účinky vázané na inhibici ovulace:
- snížení incidence funkčních ovariálních cyst;
- snížení incidence mimoděložního těhotenství.
Ostatní účinky:
- snížení incidence fibroadenomů a fibrocystické dysplazie prsou;
- snížení incidence akutních zánětlivých onemocnění malé pánve;
- snížení incidence karcinomu endometria;
- snížení incidence karcinomu ovaria.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Gestageny a estrogeny, fixní kombinace, norethisteron a estrogen ATC kód: G03AA05
Chemická struktura
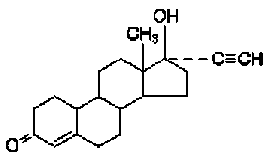
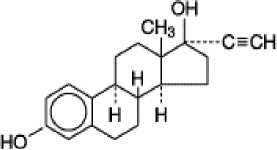
norethisteron ethinylestradiol
5.1 Farmakodynamické vlastnosti
Farmakologické vlastnosti estrogenů a gestagenů obsažených v perorální antikoncepci
jsou dobře známy, přesto však nejsou přesně objasněny jiné mechanismy účinku než suprese ovulace.
Mechanismus účinku
TRINOVUM působí mechanismem suprese gonadotropinu estrogenními i gestagenními účinky ethinylestradiolu a hlavního metabolitu norethisteronu norelgestrominu. Hlavním mechanismem účinku je inhibice ovulace, avšak změny týkající se cervikálního hlenu, tubární motility a endometria mohou rovněž přispívat k účinnosti přípravku.
Receptorové studie a studie týkající se globulinu vázajícího pohlavní hormony (SHBG) a dále studie preklinické i klinické prokázaly, že norethisteron vykazuje vysokou gestagenní aktivitu s minimální vlastní androgenní aktivitou, což demonstruje vysokou selektivitu přípravku TRINOVUM. Norethisteron, v kombinaci s ethinylestradiolem, nezabraňuje estrogeny indukovanému vzestupu SHBG, což vede k nižším sérovým hladinám volného testosteronu ve srovnání s výchozími hodnotami.
Absorpce
Norethisteron i ethinylestradiol se po perorálním podání rychle absorbují. Plazmatické nebo sérové koncentrace ethinylestradiolu dosahují vrcholových hodnot přibližně za 1 - 2 hodiny po podání.
Distribuce
Norethisteron i ethinylestradiol jsou široce distribuovány.
Norethisteron je vázán na albumin (79 - 95 %) a na SHBG. Ethinylestradiol je vázán přibližně z 98 % na albumin.
Metabolismus
Norethisteron i ethinylestradiol jsou metabolizovány mechanismem first-pass metabolismu, především ve střevech, avšak rovněž v játrech. Tím je snížena biologická dostupnost přibližně na 65 - 80 % u norethisteronu a na 40 - 50 % u ethinylestradiolu. Norethisteron i ethinylestradiol jsou postupně metabolizovány. Norethisteron je v cyklu primárně metabolizován redukcí a dále konjugací za tvorby glukuronidových a sulfátových konjugátů. Ethinylestradiol je metabolizován na různé hydroxylované metabolity a jejich glukuronidové a sulfátové konjugáty.
Eliminace
Eliminační poločas norethisteronu se u většiny pacientů pohybuje v rozmezí 5 - 14 hodin, zatímco eliminační poločas ethinylestradiolu se pohybuje obvykle v rozmezí 6 - 20 hodin. Metabolity norethisteronu a ethinylestradiolu jsou eliminovány ledvinami a stolicí.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podrobné studie toxicity byly provedeny jak na jednotlivých složkách přípravku, tak i pro kombinaci obou léčivých látek. Zkoušky u kombinace zahrnují studie toxicity po jednorázovém podání u různých druhů zvířat, studie toxicity po opakovaném podání až do 18 měsíců u myší, 2 let u potkanů, 7 let u psů a 10 let u opic, dále studie reprodukční a vývojové toxicity a genotoxicity. Výsledky ukazují, že akutní perorální LD50 pro norethisteron a ethinylestradiol v poměru 1,0 : 0,035 nebo 0,5 : 0,035 je vyšší než 4 g/kg. V literatuře se uvádí hodnota LD50 pro norethisteron a ethinylestradiol v rozmezích od 0,5 do 5 g/kg. Tato data ukazují na velmi nízkou toxicitu po perorálním podání.
Studie toxicity po opakovaném podání u hlodavců s dávkami přibližně 100 - 200x vyššími, než jsou dávky klinické a při poměru norethisteronu a ethinylestradiolu 20 : 1 nebo 50 : 1 došly k velmi podobným výsledkům s na dávce závislým poklesem tělesné hmotnosti, retardací růstu, hyperplazie jater a gonadální atrofie. Podobné spektrum účinků bylo pozorovánu u potkanů, kterým byla podána stejná dávka samotného norethisteronu nebo norethisteronu společně s ethinylestradiolem v dávkách 50x nižších. Obě látky však, ať již samostatně nebo v kombinaci, měly pozitivní vliv na zdraví potkanů, zvyšovaly přežití, prodlužovaly dobu do vzniku nádoru a snižovaly výskyt a závažnost degenerativních chorob spojených se stárnutím.
Výsledky dlouhodobých studií toxicity po opakovaném podání u psů (5 - 7 let) a opic (10 let) při dávkách 20 - 25x (norethisteron) nebo cca 70x (norethisteron + ethinylestradiol) vyšších než dávka klinická ukazují, že dlouhodobá léčba je dobře snášena a nedošlo ke specifickému průkazu kancerogenity nebo vývoji nádorů. Případné nálezy lze přičíst na dávce závislému farmakologickému účinku steroidů na pohlavní orgány a jaterní biochemické parametry.
Data ze studií na hlodavcích a nehumanoidních primátech ukazují, že kombinovaná perorální antikoncepce je embryoletální, ale nikoli teratogenní. Estrogeny i gestageny byly testovány na genotoxicitu ve velkém počtu in vitro a in vivo testovacích systémů bez záporných výsledků. Tyto hormony neinteragují přímo s DNA, ale mohou za určitých okolností indukovat nespecifická chromozomální poškození.
Závěrem lze shrnout, že norethisteron a ethinylestradiol u laboratorních zvířat vykázaly nízký předklinický účinek, který byl pozorován při dávkách mnohonásobně převyšujících maximální humánní dávky nebo byl důsledkem zveličeného farmakologického účinku v dávkách vyšších než terapeutické a pro klinické použití měl tedy malý význam.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Bílé tablety: laktóza, předbobtnalý kukuřičný škrob, magnesium-stearát.
Světle oranžové a oranžové tablety: laktóza, předbobtnalý kukuřičný škrob, magnesium-stearát, oranžová žluť (E110).
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30° C.
6.5 Druh obalu a velikost balení
PVC/Al fóliový blistr, krabička
Velikost balení 3x 21 tablet
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Janssen-Cilag s.r.o., Praha, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
17/207/91-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
26.6.1991 / 9.7.2014
Tabulka 1 Nežádoucí účinky identifikované po uvedení přípravku na trh
v souvislosti užíváním přípravku TRINOUVM dle frekvence odhadem _dle spontánních hlášení_
Novotvary benigní, maligní a nespecifikované (včetně cyst a polypů)
|
Méně časté |
Změna tvaru prsů |
|
Velmi vzácné |
Nádor prsu, Bulka v prsu, Cervikální karcinom, Cervikální dysplazie, Jaterní maligní neoplasma, Jaterní adenom |
Poruchy imunitního systému
Velmi vzácné Anafylaktické/Anafylaktoidní reakce, Hypersenzitivita
Velmi vzácné Dyslipidemie, Poruchy glukózové tolerance
Infarkt myokardu
Hluboká žilní trombóza
Velmi vzácné
Galaktorea, Zvětšení prsů, Potlačená laktace, Vulvovaginální suchost, Nepravidelná menstruace_
Velmi vzácné
Astenie, Únava
10. DATUM REVIZE TEXTU 29.9.2015
17/17