Triamcinolone Sanofi 55 Mikrogramů/Dávka
Sp.zn.sukls128847/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Triamcinolone sanofi 55 mikrogramů/dávka nosní sprej, suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna lahvička přípravku Triamcinolone sanofi obsahuje 6,5 g nebo 16,5 g suspenze (triamcinoloni acetonidum 3,575 mg nebo 9,075 mg). Jedna aplikovaná dávka obsahuje triamcinoloni acetonidum 55 mikrogramů.
Pomocná látka se známým účinkem: 15 mikrogramů benzalkonium-chloridu/dávka.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Nosní sprej, suspenze.
Neparfémovaná, téměř bílá, tixotropní suspenze mikrokrystalického triamcinolon- acetonidu ve vodném prostředí.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Triamcinolone sanofi je indikován k léčbě příznaků sezónní a celoroční alergické rinitidy.
4.2 Dávkování a způsob podání
Dávkování
Pacienti ve věku 12 let a starší: Doporučená úvodní dávka je 220 mikrogramů tj. 2 vstřiky do každé nosní dírky jednou denně. Po dosažení kontroly příznaků podávat udržovací dávku 110 mikrogramů (1 vstřik do každé nosní dírky jednou denně).
Děti ve věku 6 - 12 let: Doporučená dávka je 110 mikrogramů, tj. 1 vstřik do každé nosní dírky jednou denně. U pacientů s těžšími příznaky může být k dosažení optimálního účinku potřeba dávky 220 mikrogramů. Jakmile je dosaženo kontroly příznaků, je třeba pacienta udržovat na minimální účinné dávce (viz body 4.4 a 5.1).
Zvláštní skupiny pacientů
Pediatrická populace
Vzhledem k nedostatku údajů se podávání tohoto přípravku po dobu delší než 3 měsíce dětem mladším 12 let nedoporučuje.
Způsob podání
Přípravek Triamcinolone sanofi je určen pouze k nosnímu podání.
Před každým použitím je důležité lahvičku mírně protřepat.
Každý vstřik dodá z nosního aplikátoru 55 mikrogramů triamcinolon-acetonidu (testováno in vitro), po počáteční přípravě 5 vstřiky, než je z trysky uvolněna dávka ve formě jemného aerosolu. Nosní sprej přípravku Triamcinolone sanofi zůstane dostatečně přípraven k použití po dobu 2 týdnů. V případě, že není přípravek používán déle než 2 týdny, může být znovu připraven k použití jedním vstřikem.
Tryska má během přípravy spreje směřovat od pacienta.
Po použití spreje:
Opatrně trysku otřete čistým kapesníkem a uzavřete krytem.
V případě, že sprej nefunguje a tryska může být ucpaná, vyčistěte ji následujícím způsobem. NIKDY se nesnažte ucpanou trysku zprůchodnit špendlíkem nebo jiným ostrým předmětem, protože může dojít k poškození mechanismu spreje.
Nosní sprej se má vyčistit alespoň jednou týdně nebo častěji, pokud dojde k ucpání trysky.
NÁVOD NA ČIŠTĚNÍ SPREJE
1. Sejměte kryt a vytáhněte pouze trysku*
2. Kryt spolu s tryskou namočte na několik minut do teplé vody a poté opláchněte tekoucí studenou vodou.
3. Vytřepejte nebo otřete přebytečnou vodu a nechte uschnout.
4. Znovu nasaďte trysku.
5. Stiskněte sprej tak, aby se objevil jemný aerosol a používejte jako obvykle.
* část, která je uvedená na obrázku níže.
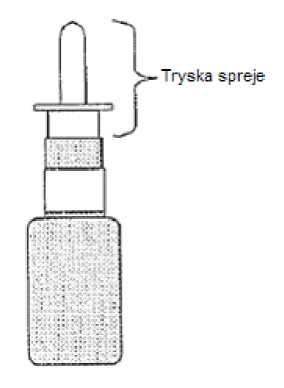
Lahvičku je třeba zlikvidovat po 30 dávkách nebo do jednoho měsíce od zahájení léčby (u 6,5g balení), nebo po 120 dávkách nebo po 2 měsících od zahájení léčby (u 16,5g balení). Nedávejte zbývající suspenzi do jiné lahvičky.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
4.4 Zvláštní upozornění a opatření pro použití
Při jakémkoli podezření na poruchu funkce nadledvin je při převádění pacienta ze systémové léčby kortikosteroidy na přípravek Triamcinolone sanofi nutná opatrnost.
V klinických studiích intranazálního podávání přípravku Triacinolone sanofi vzácně docházelo k rozvoji lokalizovaných infekcí nosu a faryngu kvasinkami Candida albicans. Při výskytu těchto infekcí může být potřebná odpovídající lokální léčba a dočasné přerušení léčby přípravkem Triamcinolone sanofi.
Vzhledem k inhibičnímu působení kortikosteroidů na hojení ran má být přípravek Triamcinolone sanofi používán obezřetně u pacientů s nedávno vzniklými vředy nosní přepážky, operacemi nebo poraněním nosu před jejich zahojením.
Systémové účinky nazálních kortikosteroidů se mohou objevit zejména při dlouhodobém podávání vysokých dávek. Tyto účinky jsou mnohem méně pravděpodobné než u perorálních kortikosteroidů a mohou se lišit u jednotlivých pacientů i u jednotlivých kortikosteroidů. Možné systémové účinky mohou zahrnovat Cushingův syndrom, cushingoidní rysy, poruchu funkce nadledvin, zpomalení růstu u dětí a dospívajících, šedý zákal, glaukom a velmi vzácně řadu psychických poruch a poruch chování včetně psychomotorické hyperaktivity, poruch spánku, úzkosti, deprese nebo agrese (zvláště u dětí).
Léčba vyššími než doporučenými dávkami může mít za následek klinicky významnou adrenální supresi. Při prokázaném užívání vyšších než doporučených dávek se má uvažovat o dodatečném systémovém krytí kortikosteroidy v období zátěže nebo po chirurgickém výkonu.
U pacientů léčených nazálními kortikosteroidy byl zaznamenán vznik glaukomu a/nebo šedého zákalu. Proto je doporučeno důsledně sledovat pacienty se změnami zraku nebo s anamnézou zvýšeného nitroočního tlaku, glaukomu a/nebo šedého zákalu.
Přípravek Triamcinolone sanofi obsahuje benzalkonium-chlorid, který může vyvolat podráždění pokožky.
Pediatrická populace
Vzhledem k nedostatku údajů o použití přípravku Triamcinolone sanofi u dětí do 6 let se podávání v této věkové skupině nedoporučuje.
Bylo hlášeno zpomalení růstu u dětí používajících nazální kortikosteroidy, včetně přípravku Triamcinolone sanofi v povolených dávkách (viz bod 5.1).
Doporučuje se, aby byla pravidelně sledována výška u dětí, které užívají dlouhodobě nazální kortikosteroidy. Léčba má být vedena s cílem snížení dávky nazálních kortikosteroidů na nejnižší možnou dávku, při které je udržována efektivní kontrola symptomů. Navíc je nutno zvážit odeslání pacienta k pediatrovi. Není známo, že by v souvislosti s používáním nazálních kortikosteroidů mohlo dojít k dlouhodobému účinku na zpomalení růstu u dětí včetně ovlivnění jejich konečné výšky v dospělosti.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nejsou známy žádné interakce s jinými léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
Klinické zkušenosti u těhotných žen jsou omezené. Ve studiích na zvířatech se ukazuje, že kortikosteroidy indukují teratogenní účinky. Triamcinolon-acetonid přechází do mateřského mléka. Triamcinolon-acetonid nemá být podáván v těhotenství a při kojení, pokud přínos léčby pro matku nepřevažuje nad potenciálním rizikem pro plod/dítě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Triamcinolone sanofi nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Výskyt nežádoucích účinků během klinických studií s přípravkem Triamcinolone sanofi byl velmi nízký, nejčastěji se nežádoucí účinky objevily v oblasti sliznice nosu a hrdla.
Nežádoucí účinky jsou seřazeny podle frekvence výskytu nežádoucích účinků následovně: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1 000 až <1/100); vzácné (>1/10 000 až <1/1 000); velmi vzácné <1/10 000); není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky prezentovány v pořadí s klesající závažností.
Nejčastější nežádoucí účinky u dospělých a dětí starších 6 let:
Infekce a infestace
Časté: příznaky chřipky, faryngitida, rinitida.
Poruchy imunitního systému
Není známo: hypersenzitivita (včerně vyrážky, kopřivky, svědění a otoku obličeje).
Psychiatrické _ poruchy Není známo: nespavost.
Poruchy nervového systému Časté: bolest hlavy.
Není známo: závrať, změny vnímání chuti a čichu.
Poruchy oka
Není známo: šedý zákal, glaukom, zvýšený nitrooční tlak
Respirační, hrudní a mediastinální _poruchy Časté: bronchitida, epistaxe, kašel.
Vzácné: perforace nosního přepážky.
Není známo: podráždění nosu, suchá sliznice, ucpaný nos, kýchání, dušnost.
Gastrointestinální poruchy Časté: dyspepsie, poruchy zubů.
Není známo: nauzea.
Celkové poruchy a reakce v místě aplikace Není známo: únava.
Vyšetření
Není známo: snížení kortizolu v krvi.
Postmarketingové poznatky
Zpomalení rychlosti růstu u dětí bylo pozorováno během postmarketingové klinické studie s přípravkem Triamcinolone sanofi (viz bod. 5.1).
Systémové účinky nazálních kortikosteroidů se mohou objevit zejména při dlouhodobém podávání vysokých dávek. Zpomalení růstu bylo hlášeno u dětí používajících intranazální kortikosteroidy.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Podobně jako u kteréhokoli nazálního kortikosteroidu vzhledem k celkovému množství léčivé látky je akutní předávkování přípravkem Triamcinolone sanofi nepravděpodobné. V případě, kdy by byl celý obsah lahvičky použit najednou, buď perorálně, nebo nazálně, by se s nejvyšší pravděpodobností neměly projevit klinicky významné systémové nežádoucí účinky. Při perorálním požití přípravku by mohl pacient pociťovat gastrointestinální obtíže.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Dekongesční a jiná nosní léčiva k lokální aplikaci, kortikosteroidy, ATC kód: R01AD11.
Mechanismus účinku
Triamcinolon-acetonid je účinnější derivát triamcinolonu a je přibližně 8krát účinnější než prednison. Ačkoli přesný mechanismus antialergického účinku kortikosteroidů není znám, jsou kortikosteroidy velmi účinné při léčbě alergických onemocnění u lidí.
Farmakodynamické účinky
Přípravek Triamcinolone sanofi nemá bezprostřední vliv na alergické známky a příznaky. Zlepšení některých příznaků pacienta může být zřejmé během prvního dne léčby přípravkem Triamcinolone sanofi a výraznější úlevu lze očekávat během 3 - 4 dnů. Při předčasném vysazení přípravku Triamcinolone sanofi se příznaky nemusí vrátit po několik dnů.
V klinických studiích u dospělých a dětí ve věku 6 a více nebyla při intranazálním podávání přípravku Triamcinolone sanofi v dávkách až 440 mikrogramů denně pozorována žádná suprese osy hypotalamus-hypofýza-nadledviny (HPA).
Byla provedena jednoletá dvojitě zaslepená placebem kontrolovaná studie u 298 léčených pediatrických pacientů (ve věku 3 až 9 let) s cílem posoudit účinek přípravku Triamcinolone sanofi (110 mikrogramů 1x denně) na rychlost růstu pomocí stadiometru. Z primární analýzy hodnotitelných pacientů (134 pacientů používajících přípravek Triamcinolone sanofi a 133 používajících placebo) byla odhadovaná rychlost růstu o 0,45 cm/rok nižší u pacientů užívajících přípravek Tiamcinolone sanofi (95% CI intervalem v rozmezí 0,11 - 0,78 cm/rok) než ve skupině užívající placebo. Rozdíl mezi skupinami se projevil po 2 měsících od zahájení léčby. Během dvou měsíců od ukončení léčby se průměrná rychlost růstu vrátila zpět na výchozí hodnoty (před léčbou).
5.2 Farmakokinetické vlastnosti
Jednotlivá intranazální dávka 220 mikrogramů přípravku Triamcinolone sanofi u zdravých dospělých osob a u dospělých pacientů s alergickou rinitidou prokázala nízkou absorpci triamcinolon-acetonidu. Průměrná nejvyšší plazmatická koncentrace byla přibližně 0,5 ng/ml (rozpětí 0,1 až 1 ng/ml) za 1,5 hodiny po aplikaci. Za 12 hodin byla průměrná plazmatická hladina látky nižší než 0,06 ng/ml a za 24 hodin byla pod detekčním limitem. Průměrný terminální poločas byl 3,1 hodiny.
Proporcionalita dávky byla prokázána u zdravých dobrovolníků i u pacientů po jediné intranazální dávce 110 nebo 220 mikrogramů přípravku Triamcinolone sanofi. Po opakovaných dávkách u dětí měly plazmatické koncentrace léku, AUC, Cmax a Tmax obdobné hodnoty jako u dospělých pacientů.
5.3 Předklinické údaje vztahující se k bezpečnosti
V předklinických studiích byly pozorovány účinky typické pro kortikosteroidy.
Podobně jako jiné kortikosteroidy, vykazoval triamcinolon-acetonid (podaný inhalačně nebo jinou cestou) teratogenní účinky u potkanů a králíků. Teratogenní účinek u potkanů a králíků zahrnoval rozštěp patra a/nebo vnitřní hydrocefalus a defekty axiálního skeletu. U subhumánních primátů byly rovněž zjištěny teratogenní účinky, včetně malformací CNS a lebky.
Z testů in vitro nebyla zjištěna žádná mutagenita.
Studie na hlodavcích neprokázaly žádnou souvislost mezi léčbou triamcinol-acetonidem a kancerogenitou.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Mikrokrystalická celulóza a sodná sůl karmelosy (disperzní celulóza); polysorbát 80; čištěná voda; glukóza;
roztok benzalkonium-chloridu (50% m/v); dihydrát dinatrium-ededátu;
kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH).
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
Doba použitelnosti v neporušeném obalu: 2 roky.
Doba použitelnosti po prvním otevření je 1 měsíc pro 6,5g balení (30 dávek) a 2 měsíce pro 16,5g balení (120 dávek).
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Podmínky uchovávání po prvním otevření tohoto léčivého přípravku najdete v bodě 6.3.
6.5 Druh obalu a obsah balení
Přípravek Triamcinolone sanofi je balen v 20ml HDPE lahvičce s pumpičkou vystřikující odměřené dávky.
Jedna lahvička přípravku Triamcinolone sanofi obsahuje 6,5 g nebo16,5 g suspenze, která poskytuje 30 nebo 120 dávek.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
sanofi-aventis, s.r.o., Evropská 846/176a, 160 00 Praha 6, Česká republika
8. REGISTRAČNÍ ČÍSLO
69/324/15-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 22.7.2015 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
31.5.2016
7/7