Trevicta 525 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
TREVICTA 175 mg suspenze s prodlouženým uvolňováním pro injekci TREVICTA 263 mg suspenze s prodlouženým uvolňováním pro injekci TREVICTA 350 mg suspenze s prodlouženým uvolňováním pro injekci TREVICTA 525 mg suspenze s prodlouženým uvolňováním pro injekci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
175 mg suspenze s prodlouženým uvolňováním pro injekci
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas 273 mg, což odpovídá paliperidonum 175 mg.
263 mg suspenze s prodlouženým uvolňováním pro injekci
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas 410 mg, což odpovídá paliperidonum 263 mg.
350 mg suspenze s prodlouženým uvolňováním pro injekci
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas 546 mg, což odpovídá paliperidonum 350 mg.
525 mg suspenze s prodlouženým uvolňováním pro injekci
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas 819 mg, což odpovídá paliperidonum 525 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Suspenze s prodlouženým uvolňováním pro injekci.
Suspenze má bílou až téměř bílou barvu. Suspenze má pH neutrální (přibližně 7,0).
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek TREVICTA, 3měsíční injekce, je indikován k udržovací léčbě schizofrenie u dospělých pacientů, kteří jsou klinicky stabilní po léčbě 1měsíčním přípravkem s obsahem paliperidon-palmitátu (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Pacienti, kteří jsou adekvátně léčeni 1měsíčním injekčním paliperidon-palmitátem (nejlépe čtyři měsíce nebo déle) a nevyžadují úpravu dávky, mohou být převedeni na přípravek TREVICTA.
Podávání přípravku TREVICTA je nutno zahájit místo další plánované dávky 1měsíčního injekčního paliperidon-palmitátu (± 7 dní). Základem pro dávku přípravku TREVICTA je předchozí dávka
lměsíčního injekčního paliperidon-palmitátu a použije se 3,5krát vyšší dávka, jak je uvedeno v následující tabulce:
Dávky přípravku TREVICTA u pacientů adekvátně léčených lměsíčním injekčním _paliperidon-palmitátem_
|
Pokud poslední dávka 1měsíčního injekčního paliperidon-palmitátu je |
podávání přípravku TREVICTA zahajte následující dávkou |
|
50 mg |
175 mg |
|
75 mg |
263 mg |
|
100 mg |
350 mg |
|
150 mg |
525 mg |
K 25mg dávce 1měsíčního injekčního paliperidon-palmitátu, která nebyla hodnocena, ekvivalentní dávka přípravku TREVICTA neexistuje.
Po počáteční dávce přípravku TREVICTA je nutno tento přípravek podávat intramuskulární injekcí jednou za každé 3 měsíce (± 2 týdny, viz také část Zmeškaná dávka).
V případě potřeby lze úpravu dávky přípravku TREVICTA na základě snášenlivosti a/nebo účinnosti u jednotlivého pacienta provést každé 3 měsíce, a to v rozsahu od 175 do 525 mg. V důsledku dlouhodobého účinku přípravku TREVICTA nemusí být pacientova odpověď na upravenou dávku zjevná několik měsíců (viz bod 5.2). Pokud je pacient nadále symptomatický, je nutno symptomy léčit v souladu s klinickou praxí.
Převedení z jiných antipsychotických přípravků
Přípravek TREVICTA je určen k podávání pouze poté, co byl pacient adekvátně léčen 1měsíčním injekčním paliperidon-palmitátem nejlépe čtyři měsíce nebo déle.
Převedení z přípravku TREVICTA na jiné antipsychotické přípravky
Při vysazování přípravku TREVICTA je nutno mít na zřeteli jeho prodloužené uvolňování.
Převedení z přípravku TREVICTA na 1měsíční injekční paliperidon-palmitát
Při převádění z přípravku TREVICTA na 1měsíční injekční paliperidon-palmitát se 1měsíční injekční paliperidon-palmitát musí podat ve stejnou dobu, ve kterou se měla podat další dávka přípravku TREVICTA, a to za využití 3,5násobně nižší dávky, jak je uvedeno v následující tabulce. Zahajovací dávkování popsané v informacích o přípravku u 1měsíčního injekčního paliperidon-palmitátu není potřeba. V podávání 1měsíčního injekčního paliperidon-palmitátu se pak musí pokračovat v měsíčních intervalech, jak je popsáno v informacích o přípravku k tomuto přípravku.
Dávky 1měsíčního injekčního paliperidon-palmitátu u pacientů převáděných z přípravku
TREVICTA
|
Pokud poslední dávka přípravku TREVICTA je |
podávání 1měsíčního injekčního paliperidon-palmitátu zahajte o 3 měsíce později následující dávkou |
|
175 mg |
50 mg |
|
263 mg |
75 mg |
|
350 mg |
100 mg |
|
525 mg |
150 mg |
Převedení z přípravku TREVICTA na každodenní perorální tablety paliperidonu s prodlouženým uvolňováním
Při převádění z přípravku TREVICTA na perorální tablety paliperidonu s prodlouženým uvolňováním se podávání tablet paliperidonu s prodlouženým uvolňováním musí zahájit 3 měsíce po poslední dávce přípravku TREVICTA a v léčbě tabletami paliperidonu s prodlouženým uvolňováním je třeba pokračovat tak, jak je popsáno v níže uvedené tabulce. Následující tabulka uvádí doporučené režimy konverze dávek, které umožňují pacientům stabilizovaným na různých dávkách přípravku TREVICTA dosáhnout podobné expozice paliperidonu pomocí tablet paliperidonu s prodlouženým uvolňováním.
Dávky tablet paliperidonu s prodlouženým uvolňováním u pacientů přecházejících z _přípravku TREVICTA*_
|
Poslední dávka přípravku TREVICTA (týden 0) |
Počet týdnů od poslední dávky příprav |
ku TREVICTA | |
|
12 až 18 týdnů, včetně |
19 až 24 týdnů, včetně |
25 týdnů a více | |
|
Denní dávka tablet paliperidonu s prodlouženým uvolňováním | |||
|
175 mg |
3 mg |
3 mg |
3 mg |
|
263 mg |
3 mg |
3 mg |
6 mg |
|
350 mg |
3 mg |
6 mg |
9 mg |
|
525 mg |
6 mg |
9 mg |
12 mg |
* Všechny dávky tablet paliperidonu s prodlouženým uvolňováním podávaných jednou denně je nutno individualizovat pro konkrétního pacienta, přičemž se vezmou v úvahu takové proměnné, jako je důvod přechodu, odpověď na předchozí léčbu paliperidonem, závažnost psychotických příznaků a/nebo sklon k nežádoucím účinkům.
Zmeškané dávky
Dávkovací okno
Přípravek TREVICTA je nutno aplikovat jednou za 3 měsíce. Aby se zamezilo zmeškání dávek přípravku TREVICTA, lze injekce pacientům podávat až 2 týdny před nebo po pravidelném 3měsíčním termínu.
Zmeškané dávky
|
Pokud se plánovaná dávka zmešká a od poslední injekce uplynulo |
Postup |
|
> 3% měsíce až 4 měsíce |
Injekci je nutno podat co nejdříve a pak se vrátit k 3měsíčnímu schématu podávání injekcí. |
|
4 měsíce až 9 měsíců |
Použijte doporučený režim znovuzahájení léčby uvedený v následující tabulce. |
|
> 9 měsíců |
Léčbu znovu zahajte lměsíčním injekčním paliperidon-palmitátem, jak je popsáno v informacích o přípravku pro daný přípravek. Přípravek TREVICTA lze pak znovu nasadit poté, co byl pacient adekvátně léčen 1měsíčním injekčním paliperidon-palmitátem nejlépe čtyři měsíce nebo déle. |
Doporučený režim znovuzahájení léčby po zmeškání přípravku TREVICTA o 4 až 9 měsíců
|
Pokud poslední dávka přípravku TREVICTA byla |
Podejte 1měsíční injekční paliperidon-palmitát, dvě dávky s odstupem 1 týdne (do deltového svalu) |
Poté podejte přípravek TREVICTA (do deltového3 nebo gluteálního svalu) | |
|
1. den |
8. den |
1 měsíc po 8. dnu | |
|
175 mg |
50 mg |
50 mg |
175 mg |
|
263 mg |
75 mg |
75 mg |
263 mg |
|
350 mg |
100 mg |
100 mg |
350 mg |
|
525 mg |
100 mg |
100 mg |
525 mg |
Viz také Informace určené lékařům nebo zdravotníkům ohledně volby injekční jehly k podání do deltového svalu podle tělesné hmotnosti.
Zvláštní populace
Starší osoby
Účinnost a bezpečnost u starších osob ve věku > 65 let nebyla stanovena.
Obecně platí, že dávkování přípravku TREVICTA u starších pacientů s normální funkcí ledvin je stejné jako u mladších dospělých pacientů s normální funkcí ledvin. Jelikož starší pacienti mohou mít renální funkce sníženy, ohledně dávkovacích doporučení u pacientů s poruchou funkce ledvin viz část Porucha funkce ledvin dále.
Porucha funkce ledvin
Přípravek TREVICTA nebyl u pacientů s poruchou funkce ledvin systematicky hodnocen (viz bod 5.2). U pacientů s lehkou poruchou funkce ledvin (clearance kreatininu >50 až < 80 ml/min) je nutno dávku upravit a pacienta stabilizovat za pomoci lměsíčního injekčního paliperidon-palmitátu a poté převést na přípravek TREVICTA.
Přípravek TREVICTA se u pacientů se středně těžkou nebo těžkou poruchou funkce ledvin (clearance kreatininu <50 ml/min) nedoporučuje.
Porucha funkce jater
Přípravek TREVICTA nebyl u pacientů s poruchou funkce jater hodnocen. Na základě zkušeností s perorálním paliperidonem není u pacientů s lehkou nebo středně těžkou poruchou funkce jater úprava dávkování potřebná. Jelikož u pacientů s těžkou poruchou funkce jater nebyl paliperidon studován, doporučuje se u takových pacientů opatrnost. (Viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku TREVICTA u dětí a dospívajících do <18 let věku nebyla stanovena. K dispozici nejsou žádné údaje.
Způsob podání
Přípravek TREVICTA je určen pouze k intramuskulárnímu podání. Žádnou jinou cestou se podávat nesmí. Injekci smí podat pouze zdravotnický pracovník, který celou dávku podá v jediné injekci. Je nutno ji injikovat pomalu, hluboko do deltového nebo gluteálního svalu. V případě dyskomfortu v místě vpichu je třeba u dalších injekcí uvažovat o přechodu z gluteálního na deltový sval (a opačně) (viz bod 4.8).
Přípravek TREVICTA se smí podávat pouze pomocí tenkostěnných jehel, které jsou součástí balení přípravku TREVICTA. Jehly z balení lměsíčního injekčního paliperidon-palmitátu ani jiné komerčně dostupné jehly se při podávání přípravku TREVICTA používat nesmějí (viz část Informace určené lékařům nebo zdravotnickým pracovníkům).
Obsah předplněné injekční stříkačky je před podáním třeba vizuálně zkontrolovat na výskyt cizích částic a změnu zbarvení. Injekční stříkačkou je nutno nejméně 15 sekund silně třepat a držet ji přitom špičkou nahoru v ruce s uvolněným zápěstím, čímž se zajistí homogenizace suspenze. Přípravek TREVICTA se musí podat do 5 minut po potřepání. Pokud by před aplikací mělo uplynout více než 5 minut, znovu silně 15 sekund protřepávejte, aby se léčivý přípravek znovu suspendoval. (Viz část Informace určené lékařům nebo zdravotnickým pracovníkům).
Podání do deltového svalu
Jehla k podání přípravku TREVICTA do deltového svalu se určí podle hmotnosti pacienta.
• U pacientů > 90 kg má být použita tenkostěnná jehla o rozměrech 0,72 mm x 38,1 mm (22G 1/ palce).
• U pacientů < 90 kg by měla být použita tenkostěnná jehla o rozměrech 0,72 mm x 25,4 mm (22G 1 palec).
Přípravek se musí podat do středu deltového svalu. Deltové svaly je doporučeno při aplikacích střídat.
Podání do gluteálního svalu
K podání přípravku TREVICTA do gluteálního svalu se použije tenkostěnná jehla 22G 1% palce o rozměrech 0,72 mm x 38,1 mm, a to bez ohledu na tělesnou hmotnost. Přípravek se musí podat do horního vnějšího kvadrantu gluteálního svalu. Gluteální svaly je doporučeno při aplikacích střídat.
Neúplné podání
Aby se zabránilo neúplnému podání přípravku TREVICTA, musí se během 5 minut před podáním injekce předplněnou injekční stříkačkou silně třepat po dobu nejméně 15 sekund pro zajištění homogenizace suspenze (viz část Informace určené lékařům nebo zdravotnickým pracovníkům).
V případě neúplně injikované dávky se dávka zbylá v injekční stříkačce znovu injikovat nesmí a další dávku podat nelze, protože velikost skutečně podané dávky je obtížné odhadnout. Pacienta je nutno pečlivě sledovat a do doby příští plánované 3měsíční injekce přípravku TREVICTA léčit podle klinické potřeby.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Použití u pacientů ve stavu akutní agitovanosti nebo závažné psychózy
Přípravek TREVICTA se nesmí použít k léčbě akutních agitovaných nebo závažně psychotických stavů, kdy je potřebné okamžité zvládnutí příznaků.
Interval QT
Pokud se paliperidon předepisuje pacientům s prokázanou kardiovaskulární nemocí nebo s prodloužením intervalu QT v rodinné anamnéze a při současném podávání s jinými léčivými přípravky, u kterých se má za to, že prodlužují interval QT, je nutná opatrnost.
Neuroleptický maligní syndrom
Při užívání paliperidonu byly hlášeny případy neuroleptického maligního syndromu (NMS) charakterizovaného hypertermií, svalovou rigiditou, autonomní nestabilitou, poruchou vědomí a zvýšením sérové hladiny kreatinfosfokinázy. Další klinické příznaky mohou zahrnovat myoglobinurii (rhabdomyolýzu) a akutní selhání ledvin. Pokud se u pacienta objeví známky nebo příznaky ukazující na NMS, musí se léčba paliperidonem ukončit. Je nutno mít na zřeteli dlouhodobý účinek přípravku TREVICTA.
Tardivní dyskineze
Léčivé přípravky s vlastnostmi antagonistů dopaminových receptorů jsou spojovány s indukcí tardivní dyskineze charakterizované rytmickými mimovolními pohyby, především jazyka a/nebo obličeje. Jestliže se objeví známky a příznaky tardivní dyskineze, musí se zvážit vysazení všech antipsychotik včetně paliperidonu. Je nutno mít na zřeteli dlouhodobý účinek přípravku TREVICTA.
Leukopenie, neutropenie a agranulocytóza
U paliperidonu byly hlášeny případy leukopenie, neutropenie a agranulocytózy. Pacienty s anamnézou klinicky významného nízkého počtu leukocytů nebo leukopenie/neutropenie vyvolané léčivými
přípravky je nutno během počátečních měsíců léčby monitorovat a zvážit ukončení léčby přípravkem TREVICTA při prvních známkách klinicky významného poklesu počtu leukocytů při nepřítomnosti jeho jiných možných příčinných faktorů. U pacientů s klinicky významnou neutropenií je nutno důkladně monitorovat horečku nebo jiné známky a příznaky infekce, a pokud se takové příznaky objeví, je nutno je okamžitě léčit. U pacientů s těžkou neutropenií (absolutní počet neutrofilů < 1x109/l) je nutno léčbu přípravkem TREVICTA ukončit a sledovat počet leukocytů do návratu k normálu. Je nutno mít na zřeteli dlouhodobý účinek přípravku TREVICTA.
Hypersenzitivní reakce
Hypersenzitivní reakce se mohou objevit i u pacientů, kteří dříve tolerovali perorální risperidon nebo perorální paliperidon (viz body 4.1 a 4.8).
Hyperglykemie a diabetes mellitus
Během léčby paliperidonem byly hlášeny případy hyperglykemie, diabetes mellitus a zhoršení preexistujícího diabetu, včetně diabetického kómatu a ketoacidózy. Doporučuje se klinické monitorování podle používaných pokynů pro léčbu antipsychotiky. U pacientů léčených přípravkem TREVICTA je nutno monitorovat příznaky hyperglykemie (jako je polydipsie, polyurie, polyfagie a slabost) a u pacientů s diabetes mellitus je nutno pravidelně monitorovat zhoršení kontroly glukózy.
Zvyšování tělesné hmotnosti
Při používání přípravku TREVICTA bylo hlášeno významné zvyšování tělesné hmotnosti. Tělesnou hmotnost je nutno pravidelně kontrolovat.
Použití u pacientů s prolaktin-dependentními nádory
Studie tkáňových kultur naznačují, že prolaktin může stimulovat buněčný růst nádorů prsu u člověka. Ačkoliv při klinických a epidemiologických hodnoceních nebyla dosud prokázána žádná jasná spojitost s podáváním antipsychotik, doporučuje se u pacientů s příslušnou anamnézou opatrnost. Paliperidon se musí podávat pacientům s možným prolaktin-dependentním nádorovým onemocněním s opatrností.
Ortostatická hypotenze
U některých pacientů může paliperidon vyvolat ortostatickou hypotenzi vzhledem ke své schopnosti blokovat alfa adrenergní receptory. V klinických hodnoceních přípravku TREVICTA hlásilo 0,3 % subjektů nežádoucí účinky související s ortostatickou hypotenzí. U pacientů se známým kardiovaskulárním onemocněním (např. srdečním selháním, infarktem myokardu nebo ischemickou chorobou, poruchami vedení), cerebrovaskulárním onemocněním nebo při stavech, které pacienty predisponují k hypotenzi (např. při dehydrataci a hypovolemii), se musí přípravek TREVICTA podávat s opatrností.
Epileptické záchvaty
Přípravek TREVICTA se musí podávat opatrně u pacientů s epileptickými záchvaty v anamnéze nebo při jiných stavech, kdy je potenciálně snížen křečový práh.
Porucha funkce ledvin
U pacientů s poruchou funkce ledvin jsou plazmatické koncentrace paliperidonu zvýšeny. U pacientů s lehkou poruchou funkce ledvin (clearance kreatininu > 50 ml/min až <80 ml/min) je nutno dávku upravit a pacienta stabilizovat pomocí 1měsíčního injekčního paliperidon-palmitátu, poté převést na přípravek TREVICTA. U pacientů se středně těžkou nebo těžkou poruchou funkce ledvin (clearance kreatininu < 50 ml/min) se přípravek TREVICTA nedoporučuje (viz body 4.2 a 5.2).
Porucha funkce jater
U pacientů s těžkou poruchou funkce jater (Child-Pughova třída C) nejsou údaje k dispozici. Při podávání paliperidonu těmto pacientům se doporučuje zvýšená opatrnost.
Starší pacienti s demencí
Přípravek TREVICTA nebyl u starších pacientů s demencí hodnocen. K léčbě starších pacientů s demencí se přípravek TREVICTA kvůli zvýšenému riziku celkové mortality a cerebrovaskulárních nežádoucích účinků nedoporučuje.
Zkušenost s risperidonem uvedená dále se považuje za platnou i pro paliperidon.
Celková mortalita
Při metaanalýze 17 kontrolovaných klinických hodnocení u starších pacientů s demencí, kteří byli léčeni jinými atypickými antipsychotiky včetně risperidonu, aripiprazolu, olanzapinu a kvetiapinu, bylo ve srovnání s placebem zvýšeno riziko mortality. U pacientů léčených risperidonem byla mortalita 4 % ve srovnání s 3,1 % u pacientů, kteří užívali placebo.
Cerebrovaskulární nežádoucí účinky
Při randomizovaných, placebem kontrolovaných klinických hodnoceních některých atypických antipsychotik včetně risperidonu, aripiprazolu a olanzapinu bylo u populace s demencí pozorováno přibližně trojnásobné zvýšení rizika cerebrovaskulárních nežádoucích účinků. Mechanismus zvýšení tohoto rizika není znám.
Parkinsonova choroba a demence s Lewyho tělísky
Při předepisování přípravku TREVICTA pacientům s Parkinsonovou chorobou nebo demencí s Lewyho tělísky (DLB) musí lékaři posoudit riziko léčby oproti jejímu přínosu, protože u obou skupin může být zvýšeno riziko neuroleptického maligního syndromu a zvýšena citlivost vůči antipsychotikům. Takto zvýšená citlivost se může kromě extrapyramidových příznaků projevovat zmateností, otupělostí a posturální nestabilitou s častými pády.
Priapismus
U antipsychotik (včetně paliperidonu) s alfa-adrenergními blokujícími účinky byla hlášena indukce priapismu. Pacienty je nutno informovat, aby v případě priapismu, který nevymizel během 4 hodin, vyhledali okamžitě lékařskou pomoc.
Regulace tělesné teploty
Antipsychotickým léčivým přípravkům je přisuzováno narušení schopnosti organismu snižovat teplotu tělesného jádra. Při předepisování přípravku TREVICTA musí být věnována odpovídající pozornost pacientům vystaveným podmínkám, které mohou přispívat ke zvýšení teploty tělesného jádra, např. namáhavému cvičení, vystavení vlivu extrémní teploty, současnému užívání léčivých přípravků s anticholinergním účinkem nebo dehydratovaným pacientům.
Žilní trombembolie
U antipsychotik byly hlášeny případy žilní trombembolie (VTE). Vzhledem k tomu, že u pacientů léčených antipsychotiky se často objevují získané rizikové faktory pro VTE, je nutno před zahájením léčby přípravkem TREVICTA a během léčby tímto přípravkem identifikovat všechny možné rizikové faktory VTE a přijmout preventivní opatření.
Antiemetický účinek
V předklinických studiích s paliperidonem byl pozorován antiemetický účinek. Pokud se tento účinek vyskytne u člověka, může maskovat příznaky a projevy předávkování některými léčivými přípravky nebo stavy, jako je intestinální obstrukce, Reyův syndrom a mozkový nádor.
Podání
Dbejte, aby nedošlo k nechtěné injekci přípravku TREVICTA do cévy.
Peroperační syndrom plovoucí duhovky
U pacientů léčených přípravky s alfa 1a-adrenergním antagonistickým účinkem, jako je TREVICTA (viz bod 4.8), byl pozorován během operací katarakty peroperační syndrom plovoucí duhovky (intraoperative floppy iris syndrome = IFIS).
IFIS může zvýšit riziko očních komplikací v průběhu a po operaci. Před operací musí být oční chirurg informován o užívání léčivých přípravků s alfa 1a-adrenergním antagonistickým účinkem v současnosti anebo v minulosti. Potenciální přínos ukončení léčby alfa1-blokátorem před operací katarakty nebyl stanoven a musí být porovnán s rizikem ukončení léčby antipsychotiky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Opatrnost se doporučuje při předepisování přípravku TREVICTA současně s léčivými přípravky, o kterých je známo, že prodlužují QT interval, např. antiarytmiky třídy IA (např. chinidin, disopyramid) a antiarytmiky třídy III (např. amiodaron, sotalol), některými antihistaminiky, některými antibiotiky (např. fluorochinolony), některými jinými antipsychotiky a některými antimalariky (např. meflochin). Tento seznam je informativní a není úplný.
Možný účinek přípravku TREVICTA na jiné léčivé přípravky
Nepředpokládá se, že by paliperidon vyvolával klinicky významné farmakokinetické interakce s léčivými přípravky, které jsou metabolizovány izoenzymy cytochromu P450.
Vzhledem k primárním účinkům paliperidonu na centrální nervový systém (CNS) (viz bod 4.8) se musí TREVICTA předepisovat s opatrností v kombinaci s jinými centrálně působícími léčivými přípravky, např. anxiolytiky, většinou antipsychotik, hypnotiky, opioidy atd. nebo alkoholem.
Paliperidon může antagonizovat účinky levodopy a jiných dopaminových agonistů. Pokud je tato kombinace považována za nezbytnou, především v pozdním stadiu Parkinsonovy choroby, musí se předepisovat nejnižší účinné dávky u každé jednotlivé léčby.
Vzhledem k možnosti indukce ortostatické hypotenze (viz bod 4.4) může být při podávání přípravku TREVICTA spolu s léčivými látkami, které mají tento potenciál, např. jinými antipsychotiky, tricyklickými antidepresivy, pozorován aditivní účinek.
Opatrnost se doporučuje při podávání paliperidonu v kombinaci s jinými léčivými přípravky, o kterých je známo, že snižují křečový práh (např. fenothiaziny nebo butyrofenony, tricyklická antidepresiva nebo SSRI, tramadol, meflochin atd.).
Současné perorální podávání tablet paliperidonu s prodlouženým uvolňováním v ustáleném stavu (12 mg jednou denně) s tabletami heminatrium-valproátu s prodlouženým uvolňováním (500 mg až 2 000 mg jednou denně) neprokázalo vliv na farmakokinetiku valproátu v ustáleném stavu.
Studie interakcí mezi přípravkem TREVICTA a lithiem nebyly provedeny. Výskyt farmakokinetické interakce však není pravděpodobný.
Možný účinek jiných léčivých přípravků na přípravek TREVICTA
Studie in vitro naznačují, že CYP2D6 a CYP3A4 mohou zasahovat v minimálním rozsahu do metabolismu paliperidonu, neexistují však in vitro ani in vivo náznaky, že by tyto izoenzymy hrály významnou roli v metabolismu paliperidonu. Současné perorální podávání paliperidonu s paroxetinem, silným inhibitorem CYP2D6, nevykázalo žádný klinicky významný účinek na farmakokinetiku paliperidonu.
Společné perorální podávání paliperidonu s prodlouženým uvolňováním jednou denně s karbamazepinem 200 mg dvakrát denně způsobilo pokles průměrné hodnoty Cmax v rovnovážném stavu a AUC paliperidonu přibližně o 37 %. Tento pokles je do velké míry způsoben 35% vzestupem renální clearance paliperidonu, pravděpodobně v důsledku indukce renálního P-gp karbamazepinem. Malý pokles množství nezměněné léčivé látky vyloučené močí naznačuje, že během společného podávání s karbamazepinem došlo pouze k malému ovlivnění metabolismu prostřednictvím CYP nebo biologické dostupnosti paliperidonu. Větší pokles koncentrací paliperidonu v plazmě by se mohl objevit s vyššími dávkami karbamazepinu. Při zahájení léčby karbamazepinem je nutno přehodnotit dávkování přípravku TREVICTA a je-li to nutné, zvýšit dávku. Naopak, při ukončení podávání karbamazepinu je nutno přehodnotit dávkování přípravku TREVICTA a dávku případně snížit. Je nutno mít na zřeteli dlouhodobý účinek přípravku TREVICTA.
Společné perorální podání jedné dávky paliperidonu v tabletách s prodlouženým uvolňováním 12 mg s tabletami heminatrium-valproátu s prodlouženým uvolňováním (dvě 500mg tablety jednou denně) způsobilo zvýšení hodnot Cmax a AUC paliperidonu přibližně o 50 %, pravděpodobně v důsledku zvýšené perorální absorpce. Vzhledem k tomu, že nebyl pozorován účinek na systémovou clearance, neočekává se klinicky významná interakce mezi tabletami heminatrium-valproátu s prodlouženým uvolňováním a intramuskulárním injekčním podáním přípravku TREVICTA. Tato interakce nebyla u přípravku TREVICTA studována.
Současné podávání přípravku TREVICTA s risperidonem nebo perorálním paliperidonem
Protože je paliperidon hlavní aktivní metabolit risperidonu, vyžaduje dlouhodobé současné podávání přípravku TREVICTA s risperidonem nebo perorálním paliperidonem opatrnost. Údaje o bezpečnosti týkající se současného podávání přípravku TREVICTA s dalšími antipsychotiky jsou omezené.
4.6 Fertilita, těhotenství a kojení
O užívání paliperidonu v průběhu těhotenství nejsou k dispozici dostatečné údaje. Nitrosvalově podávaný paliperidon-palmitát a perorálně podávaný paliperidon nebyly při studiích na zvířatech teratogenní, ale byly pozorovány jiné typy reprodukční toxicity (viz bod 5.3). U novorozenců, kteří byli vystaveni paliperidonu během třetího trimestru těhotenství, existuje riziko výskytu nežádoucích účinků včetně extrapyramidových příznaků a/nebo příznaků z vysazení. Tyto příznaky se mohou lišit v délce trvání i v závažnosti. Byly hlášeny případy agitovanosti, hypertonie, hypotonie, tremoru, somnolence, respirační tísně nebo poruch příjmu potravy. Proto by novorozenci měli být pečlivě sledováni.
Jelikož byl paliperidon v plasmě detekován až 18 měsíců po jediné dávce přípravku TREVICTA, je nutno mít dlouhodobé účinky tohoto přípravku na zřeteli, protože maternální expozice přípravkem TREVICTA před těhotenstvím a během něj by mohla u novorozence vést k nežádoucím účinkům.
Kojení
Paliperidon je vylučován do mateřského mléka v takové míře, že při podávání terapeutických dávek kojícím matkám je účinek na kojence pravděpodobný. Jelikož byl paliperidon v plasmě detekován až 18 měsíců po jediné dávce přípravku TREVICTA, je nutno mít dlouhodobé účinky tohoto přípravku
na zřeteli, protože kojenci mohou být ohroženi dokonce i podáním přípravku TREVICTA dlouho před kojením. Během kojení se přípravek TREVICTA nemá používat.
Fertilita
Při neklinických studiích nebyly pozorovány žádné relevantní účinky.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Paliperidon může mít malý nebo mírný vliv na schopnost řídit a obsluhovat stroje vzhledem k možnému vlivu na nervový systém a zrak, jako je například sedace, somnolence, synkopa, rozmazané vidění (viz bod 4.8). Z tohoto důvodu je nutné pacientům doporučit, aby neřídili ani neobsluhovali stroje, dokud nebude jejich individuální citlivost na přípravek TREVICTA známa.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Nejčastěji pozorovanými nežádoucími účinky, které byly hlášeny u > 5 % pacientů ve dvou dvojitě zaslepených, kontrolovaných klinických studiích přípravku TREVICTA, byly zvýšení tělesné hmotnosti, infekce horních cest dýchacích, úzkost, bolest hlavy, insomnie a reakce v místě vpichu.
Seznam nežádoucích účinků v tabulce
Dále jsou uvedeny všechny nežádoucí účinky, které byly hlášeny u paliperidonu, podle frekvence stanovené na základě klinických hodnocení s přípravkem TREVICTA a s lměsíčním injekčním paliperidon-palmitátem. Používají se následující označení a četnosti: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000), velmi vzácné (< 1/10 000) a není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů |
Nežádoucí účinek | ||||
|
Frekvence | |||||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známoa | |
|
Infekce a infestace |
infekce horních cest dýchacích, infekce močových cest, chřipka |
pneumonie, bronchitida, infekce dýchacích cest, sinusitida, cystitida, infekce ucha, tonsilitida, onychomykóza, celulitida |
infekce oka, akarodermatitida, subkutánní absces | ||
|
Poruchy krve a lymfatického systému |
snížení počtu leukocytů, trombocytopenie, anemie |
neutropenie, zvýšení počtu eosinofilů |
agranulocytóza | ||
|
Poruchy imunitního systému |
hypersenzitivita |
anafylaktická reakce | |||
|
Endokrinní poruchy |
hyperprolaktinemieb |
nepřiměřená sekrece antidiuretického hormonu, přítomnost glukózy v moči | |||
|
Poruchy metabolismu a výživy |
hyperglykemie, zvýšení tělesné hmotnosti, snížení tělesné hmotnosti |
diabetes mellitus, hyperinsulinemie, zvýšení chuti k jídlu, anorexie, snížení |
diabetická ketoacidóza, hypoglykemie, polydipsie |
intoxikace vodou | |
|
chuti k jídlu, zvýšení hladiny triglyceridů v krvi, zvýšení hladiny cholesterolu v krvi | |||||
|
Psychiatrické poruchy |
insomnied |
poruchy spánku, snížení libida, nervozita, noční můry |
mánie, stav zmatenosti, otupělost, anorgasmie | ||
|
Poruchy nervového systému |
parkinsonismusc akatizec, sedace/ somnolence, dystoniec, závrať, dyskinezec, tremor, bolest hlavy |
tardivní dyskineze, synkopa, psychomotorická hyperaktivita, posturální závrať, porucha pozornosti, dysartrie, dysgeuzie, hypestezie, parestezie |
neuroleptický maligní syndrom, cerebrální ischemie, neodpovídání na podněty, ztráta vědomí, snížená úroveň vědomí, konvulzed, porucha rovnováhy |
diabetické koma, abnormální koordinace, titubace hlavy | |
|
Poruchy oka |
rozmazané vidění, konjunktivitida, suché oko |
glaukom, porucha hybnosti očí, protáčení očí, fotofobie, zvýšení tvorby slz, překrvení oka |
syndrom plovoucí duhovky | ||
|
Poruchy ucha a labyrintu |
vertigo, tinitus, bolest ucha | ||||
|
Srdeční poruchy |
bradykardie, |
atrioventrikulární blokáda, porucha vedení vzruchu, prodloužení QT na EKG, syndrom posturální ortostatické tachykardie, abnormální EKG, palpitace |
atriální fibrilace, sinusová arytmie | ||
|
Cévní poruchy |
hypertenze |
ortostatická |
žilní trombóza, návaly |
plicní embolie, ischemie | |
|
Respirační, hrudní a mediastinální poruchy |
kašel, nosní kongesce |
faryngolaryngeální bolest, epistaxe |
syndrom spánkové apnoe, plicní kongesce, kongesce dýchacích cest, sípání |
hyperventilace, aspirační chropy, dysfonie | |
|
Gastrointestinální poruchy |
bolest břicha, zvracení, nauzea, zácpa, průjem, dyspepsie, bolest zubů |
břišní diskomfort, gastroenteritida, sucho v ústech, flatulence |
pankreatitida, otok jazyka, inkontinence stolice, fekalom, dysfagie, cheilitida |
intestinální obstrukce, ileus | |
|
Poruchy jater a žlučových cest |
zvýšení transamináz |
zvýšení gamaglutamyl-transferázy, zvýšení hladin jaterních enzymů | |||
|
Poruchy kůže a podkožní tkáně |
kopřivka, pruritus, alopecie, ekzém, suchá kůže, erytém, akné |
poléková vyrážka, hyperkeratóza, lupy |
angioedém, změna zbarvení pokožky, seboroická |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
muskuloskeletální bolest, bolest zad, artralgie |
zvýšení hladiny kreatinfosfokinázy v krvi, svalové spasmy, ztuhlost kloubů, svalová slabost, bolest šíje |
otok kloubů |
rhabdomyolýza, abnormální držení těla | |
|
Poruchy ledvin a močových cest |
inkontinence moči, polakisurie, dysurie |
retence moči | |||
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím |
syndrom z vysazení u novorozenců (viz bod 4.6) | ||||
|
Poruchy reprodukčního systému a prsu |
amenorea |
erektilní dysfunkce, porucha ejakulace, opožděná menstruace, porucha menstruaced, gynekomastie, galaktorea, sexuální dysfunkce, bolest prsů |
prsní diskomfort, pocit plnosti prsů, zvětšení prsů, vaginální výtok |
priapismus | |
|
Celkové poruchy a reakce v místě aplikace |
pyrexie, astenie, únava, reakce v místě vpichu |
otok obličeje, otokd, abnormální chůze, bolest na hrudi, hrudní diskomfort, malátnost, indurace |
hypotermie, zimnice, zvýšení tělesné teploty, žízeň, abstinenční příznaky, absces v místě vpichu, celulitida v místě vpichu, cysta v místě vpichu, hematom v místě vpichu |
snížení tělesné teploty, nekróza v místě vpichu, vřed v místě vpichu | |
|
Poranění, otravy a procedurální komplikace |
pád |
Četnost nežádoucích účinků hlášených po uvedení přípravku na trh nelze určit, protože jsou odvozeny ze spontánních hlášení. Proto je četnost nežádoucích účinků kvalifikována jako „není známo”.
Viz „hyperprolaktinemie“ níže.
Viz „Extrapyramidové příznaky“ níže.
c
d
Insomnie zahrnuje: problémy s usínáním, střední insomnie; Konvulze zahrnují: konvulze, konvulze typu grand mal; Menstruační obtíže zahrnují: menstruační poruchu, opožděnou menstruaci, nepravidelnou menstruaci, oligomenorheu; Otok zahrnuje: generalizovaný edém, edém, periferní edém, hydrostatický intersticiální edém
Nežádoucí účinky pozorované u lékových forem s risperidonem
Paliperidon je aktivním metabolitem risperidonu, proto se profily nežádoucích účinků obou látek (včetně perorálních a injekčních lékových forem) prolínají.
Popis vybraných nežádoucích účinků
Anafylaktická reakce
Vzácně byly po uvedení na trh po injekci 1měsíčního injekčního paliperidon-palmitátu u pacientů, kteří dříve tolerovali perorální risperidon nebo perorální paliperidon, hlášeny případy anafylaktické reakce (viz bod 4.4).
Reakce v místě vpichu
V klinických hodnoceních přípravku TREVICTA 5,3 % subjektů hlásilo nežádoucí účinky v místě vpichu. Žádná z těchto příhod nebyla závažná ani nevedla k vysazení přípravku. Na základě hodnocení zkoušejících byly indurace, zarudnutí a otok nepřítomny nebo mírné při > 95 % vyšetření. Subjekty samotnými hodnocená bolest v místě vpichu založená na vizuální analogové stupnici byla mírná a v čase se její intenzita snižovala.
Extrapyramidové symptomy (EPS)
V klinických hodnoceních přípravku TREVICTA byla akatisie hlášena u 3,9 %, dyskineze u 0,8 %, dystonie u 0,9 %, parkinsonismus u 3,6 % a tremor u 1,4 % subjektů.
EPS zahrnuje souhrnnou analýzu z následujících termínů: parkinsonismus (zahrnuje extrapyramidovou poruchu, extrapyramidové symptomy, fenomén „on“ a „off", Parkinsonovu chorobu, parkinsonskou krizi, hypersekreci slin, muskuloskeletální ztuhlost, parkinsonismus, slinění, rigiditu „ozubeného kola“, bradykinezi, hypokinezi, ztuhlost obličeje, svalové napětí, akinezi, ztuhlost šíje, svalovou rigiditu, parkinsonickou chůzi, abnormální glabelární reflex, parkinsonický klidový tremor); akatizie (zahrnuje akatizii, neklid, hyperkinezi a syndrom neklidných nohou); dyskineze (dyskineze, chorea, porucha hybnosti, svalové záškuby, choreoatetóza, atetóza a myoklonus); dystonie (zahrnuje dystonii, cervikální spasmy, emprostotonus, okulogyrickou krizi, oromandibulární dystonii, risus sardonicus, tetanii, hypertonii, tortikolis, mimovolní svalové kontrakce, svalové kontraktury, blefarospasmus, okulogyraci, paralýzu jazyka, faciální spasmus, laryngospasmus, myotonii, opistotonus, orofaryngeální spasmus, pleurototonus, spasmus jazyka a trismus) a tremor.
Zvýšení tělesné hmotnosti
V dlouhodobé randomizované studii vysazení přípravku bylo u 10 % subjektů ve skupině léčené přípravkem TREVICTA a u 1 % subjektů ve skupině s placebem hlášeno abnormální zvýšení tělesné hmotnosti o > 7 % od výchozího bodu dvojitě zaslepené části do cílového bodu dvojitě zaslepené části. Naproti tomu byla abnormální snížení tělesné hmotnosti (> 7 %) od výchozího bodu dvojitě zaslepené části do cílového bodu dvojitě zaslepené části hlášeno u 1 % subjektů ze skupiny léčené přípravkem TREVICTA a u 8 % subjektů s placebem. Střední hodnota změny tělesné hmotnosti od výchozího bodu dvojitě zaslepené části do cílového bodu dvojitě zaslepené části byla +0,94 kg ve skupině léčené přípravkem TREVICTA a -1,28 kg ve skupině léčené placebem.
Hyperprolaktinemie
V průběhu dvojitě zaslepené fáze dlouhodobé randomizované studie vysazení přípravku bylo ve skupině léčené přípravkem TREVICTA zaznamenáno zvýšení prolaktinu nad referenční rozmezí (> 13,13 ng/ml u mužů a > 26,72 ng/ml u žen) u vyššího procenta mužů a žen (9 % vs. 3 %), než ve skupině s placebem (5 % vs. 1 %). Ve skupině léčené přípravkem TREVICTA byla střední hodnota změny od výchozího bodu dvojitě zaslepené části do cílového bodu dvojitě zaslepené části
+2,90 ng/ml u mužů (vs. -10,26 ng/ml ve skupině léčené placebem) a +7,48 ng/ml u žen (vs.
-32,93 ng/ml ve skupině léčené placebem). U jedné ženy (2,4 %) ve skupině léčené přípravkem TREVICTA se vyskytl nežádoucí účinek amenorea, zatímco u žen ve skupině léčené placebem se nevyskytl žádný s prolaktinem potenciálně související nežádoucí účinek. U mužů z ani jedné skupiny nebyl žádný s prolaktinem potenciálně související nežádoucí účinek zaznamenán.
Skupinové účinky
Během léčby antipsychotiky se mohou vyskytnout prodloužení intervalu QT, komorové arytmie (fibrilace komor, komorová tachykardie), náhlé neobjasněné úmrtí, srdeční zástava a torsade de pointes.
U antipsychotik byly hlášeny případy žilní trombembolie, včetně plicní embolie a případů hluboké žilní trombózy.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Obecně jsou očekávané známky a příznaky důsledkem vystupňování známých farmakologických účinků paliperidonu, tj. ospalost a sedace, tachykardie a hypotenze, prodloužení intervalu QT a extrapyramidové příznaky. Torsade de pointes a fibrilace komor byly hlášeny u pacienta při předávkování perorálně podávaným paliperidonem. V případě akutního předávkování je nutné vzít v úvahu možnost zahrnutí více léčivých přípravků.
Léčba
Při stanovování potřeb léčby a uzdravení je zapotřebí přihlížet k prodlouženému uvolňování léčivého přípravku a k dlouhému poločasu vylučování paliperidonu. Specifické antidotum paliperidonu není k dispozici. Je nutno provádět celková podpůrná opatření, tj. zajištění a udržování průchodnosti dýchacích cest a zajištění odpovídající oxygenace a ventilace.
Okamžitě je třeba zahájit monitorování srdečních funkcí, včetně kontinuálního sledování elektrokardiogramu z důvodu možných arytmií. Hypotenze a cirkulační kolaps se musí léčit odpovídajícím způsobem, jako je intravenózní podání tekutin a/nebo sympatomimetik. V případě závažných extrapyramidových příznaků se mají podávat anticholinergika. Pečlivé sledování a monitorování musí pokračovat až do pacientova uzdravení.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, jiná antipsychotika, ATC kód: N05AX13 Přípravek TREVICTA obsahuje racemickou směs (+) a (-) paliperidonu.
Mechanismus účinku
Paliperidon je selektivní blokátor monoaminových účinků, jehož farmakologické vlastnosti jsou odlišné od tradičních neuroleptik. Paliperidon se silně váže na serotoninergní 5-HT2 receptory a dopaminergní D2 receptory. Paliperidon také blokuje alfa1-adrenergní receptory a v menším rozsahu rovněž H1-histaminergní a alfa 2-adrenergní receptory. Farmakologická účinnost (+) a (-) enantiomerů paliperidonu je kvalitativně i kvantitativně podobná.
Paliperidon se neváže na cholinergní receptory. Přestože je paliperidon silným D2-antagonistou, o kterých se předpokládá, že zmírňují příznaky schizofrenie, působí méně katalepticky a snižuje motorické funkce v menším rozsahu než tradiční neuroleptika. Dominující centrální serotoninový antagonismus může snížit tendenci paliperidonu vyvolat extrapyramidové nežádoucí účinky.
Klinická, účinnost
Účinnost přípravku TREVICTA při udržovací léčbě schizofrenie u subjektů, které jsou adekvátně léčeny po dobu nejméně 4 měsíců lměsíčním injekčním paliperidon-palmitátem s posledními dvěma dávkami ve stejné lékové síle, byla hodnocena v jedné dlouhodobé, randomizované, dvojitě zaslepené, placebem kontrolované studii vysazení přípravku a v jedné dlouhodobé, aktivním komparátorem kontrolované studii non-inferiority. U obou studií bylo primární kritérium hodnocení založeno na výskytu relapsů.
V dlouhodobé randomizované studii vysazení přípravku bylo 506 dospělých subjektů, které splňovaly kritéria DSM-IV pro schizofrenii, zařazeno do otevřené přechodné fáze a léčeno flexibilními dávkami lměsíčního injekčního paliperidon-palmitátu podávaného do deltového nebo gluteálního svalu
(50 až 150 mg) po dobu 17 týdnů (k úpravám dávky mohlo dojít v 5. a 9. týdnu). Celkem 379 subjektů pak v otevřené stabilizační fázi dostalo jednu dávku přípravku TREVICTA buď do deltového nebo do gluteálního svalu (dávka byla 3,5násobkem poslední dávky 1měsíčního paliperidon-palmitátu). Subjekty považované za klinicky stabilní na konci 12týdenní stabilizační fáze pak byly randomizovány do dvojitě zaslepené fáze s proměnným trváním v poměru 1:1 do skupiny léčené přípravkem TREVICTA nebo placebem (dávka přípravku TREVICTA byla stejná, jako poslední dávka podaná během stabilizační fáze; tato dávka zůstala v průběhu dvojitě zaslepené fáze fixní).
V tomto období bylo 305 symptomaticky stabilních subjektů randomizováno do skupiny pokračující v léčbě přípravkem TREVICTA (n = 160) nebo placebem (n = 145) buď do relapsu, předčasného ukončení nebo do konce studie. Primární proměnnou účinnosti byla doba do prvního relapsu. Předem plánovaná předběžná analýza provedená v okamžiku, kdy bylo randomizováno 283 subjektů a pozorováno 42 příhod relapsu, prokázala v porovnání s placebem statisticky delší dobu do relapsu (p < 0,001) u subjektů léčených přípravkem TREVICTA. K relapsu došlo u dvaceti tří procent (23 %) subjektů ve skupině s placebem a 7,4 % subjektů ve skupině léčené přípravkem TREVICTA. Na základě těchto výsledků účinnosti byla studie ukončena. Poměr rizik byl 3,45 (95% interval spolehlivosti: 1,73, 6,88), což ukazuje na 71% pokles rizika relapsu u přípravku TREVICTA v porovnání s placebem. Kaplan-Meierova křivka doby do relapsu podle léčebných skupin je uvedena na obrázku 1. Rovněž je zobrazena doba do relapsu u skupiny léčené placebem (medián 274 dní), která byla významně kratší, než u skupiny léčené přípravkem TREVICTA (medián nemohl být stanoven v důsledku nízkého procenta subjektů s relapsem [7,4 %]).
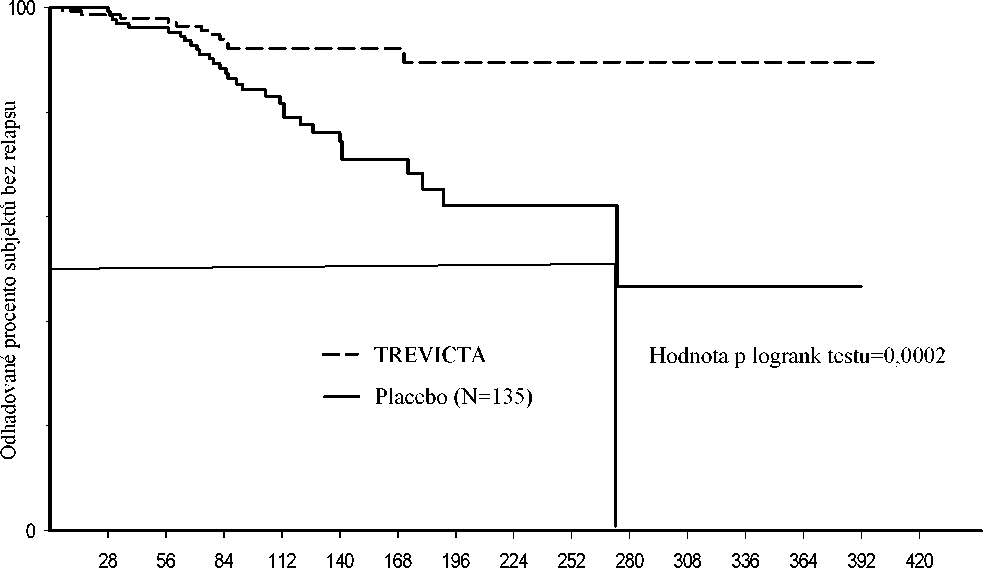
Doba (dny) od randomizace
Obrázek 1: Kaplan-Meierova křivka doby do relapsu - předběžná analýza
Ve studii non-inferiority bylo 1 429 akutně nemocných subjektů (výchozí střední hodnota celkového skóre PANSS: 85,7), které splňovaly kritéria DSM-IV pro schizofrenii, zařazeno do otevřené fáze a léčeno 1měsíčním injekčním paliperidon-palmitátem po dobu 17 týdnů. Dávku bylo možno upravit (tj. 50 mg, 75 mg, 100 mg nebo 150 mg) v 5. a 9. týdnu a místem injekce mohl být deltový sval nebo gluteální sval. Ze subjektů, které ve 14. a 17. týdnu splňovaly randomizační kritéria, bylo 1016 randomizováno v poměru 1:1 do skupiny pokračující v měsíčních injekcích 1měsíčního injekčního paliperidon-palmitátu nebo do skupiny, která na dobu 48 týdnů přešla na přípravek TREVICTA s 3,5násobkem dávky 1měsíčního injekčního paliperidon-palmitátu v 9. a 13. týdnu. Subjekty
dostávaly přípravek TREVICTA jednou každé 3 měsíce a v ostatních měsících dostávaly injekční placebovou medikaci k uchování zaslepení. Primárním kritériem hodnocení použitým ve studii bylo procento subjektů, které podle Kaplan-Meierova 48týdenního odhadu na konci 48týdenní dvojitě zaslepené fáze nemělo relaps (TREVICTA: 91,2 %, lměsíční injekční paliperidon-palmitát: 90,0 %). Medián doby do relapsu nemohl být v ani jedné skupině kvůli nízkému procentu subjektů s recidivou stanoven. Rozdíl (95% interval spolehlivosti) mezi léčebnými skupinami byl 1,2 % (-2,7 %, 5,1 %), čímž se splňuje kritérium non-inferiority založené na rozpětí -10 %. Léčebná skupina s přípravkem TREVICTA tedy nebyla horší než lměsíční injekční paliperidon-palmitát. Zlepšení ve fůngování, měřeno na stupnici Personál and Sociál Performance (PSP), které bylo pozorováno v průběhu otevřené stabilizační fáze, bylo v průběhu dvojitě zaslepené fáze u obou léčebných skupin uchováno.
100
Odhadované procento subjektů bez relapsu
80 -
60 -
40 -
20 -
TREVICTA (N=458)
1měsíční injekční paliperidon-palmitát (N=490)
336
28 56 84 112 140 168 196 224 252 280 308
Doba (dny) od randomizace
Obrázek 2: Kaplan-Meierova křivka doby do relapsu porovnávající přípravek TREVICTA a 1měsíční
injekční paliperidon-palmitát
Výsledky účinnosti byly v obou studiích u všech populačních podskupin (pohlaví, věk a rasa) shodné. Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem TREVICTA u všech podskupin pediatrické populace u schizofrenie. Informace o použití u dětí viz bod 4.2.
5.2 Farmakokinetické vlastnosti
Absorpce a distribuce
V důsledku mimořádně nízké rozpustnosti ve vodě se 3měsíční léková forma paliperidon-palmitátu po intramuskulární injekci rozpouští pomalu, než se hydrolyzuje na paliperidon a absorbuje do systémového oběhu. Uvolňování léčivé látky začíná už 1. den a trvá až 18 měsíců.
Údaje uvedené v tomto odstavci jsou založeny na populační farmakokinetické analýze. Po jediné intramuskulární dávce přípravku TREVICTA se plasmatické koncentrace paliperidonu postupně zvyšují, přičemž maximálních plasmatických koncentrací se dosáhne s mediánem Tmax za 30 až 33 dní. Po intramuskulární injekci přípravku TREVICTA v dávkách 175 až 525 mg do deltového svalu bylo v porovnání s injekcí do svalu gluteálního pozorováno v průměru o 11 až 12 % vyšší Cmax. Profil uvolňování a dávkovací režim přípravku TREVICTA vede k prodlouženým terapeutickým koncentracím. Celková expozice paliperidonu po podání přípravku TREVICTA byla v rozmezí dávek 175 až 525 mg na dávce závislá a přibližně na dávce závislá, pokud jde o Cmax. Střední hodnota poměru maximum:minimum v rovnovážném stavu u dávky přípravku TREVICTA byla 1,6 po podání do gluteálního svalu a 1,7 po podání do deltového svalu.
Vazba racemického paliperidonu na plasmatické proteiny je 74 %.
Po podání přípravku TREVICTA se (+) a (-) enantiomery paliperidonu přeměňují jeden na druhý, přičemž se dosáhne poměru AUC (+) k (-) přibližně 1,7 až 1,8.
Biotransformace a eliminace
Ve studii perorálního 14C-paliperidonu s okamžitým uvolňováním bylo týden po podání jedné perorální dávky 1 mg 14C-paliperidonu s okamžitým uvolňováním vyloučeno 59 % podané dávky v nezměněné formě do moče, což ukazuje nato, že paliperidon není výrazně metabolizován játry. Přibližně 80 % z podané radioaktivity bylo nalezeno v moči a 11 % ve stolici. In vivo byly identifikovány čtyři způsoby metabolizace, ale žádný neznamenal více než 10 % z podané dávky: dealkylace, hydroxylace, dehydrogenace a štěpení benzisoxazolu. I když studie in vitro naznačovaly úlohu CYP2D6 a CYP3A4 v metabolismu paliperidonu, nebyly získány žádné důkazy in vivo, že se tyto izoenzymy významně podílejí na metabolismu paliperidonu. Populační farmakokinetické analýzy neprokázaly znatelný rozdíl zjevné clearance perorálně podaného paliperidonu mezi rychlými a pomalými metabolizátory substrátů CYP2D6. Ve studiích in vitro s lidskými jaterními mikrozomy bylo prokázáno, že paliperidon neinhibuje významným způsobem metabolismus léčiv, která jsou metabolizována izoenzymy cytochromu P450, zahrnujícími CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 a CYP3A5.
Studie in vitro prokázaly, že paliperidon je substrátem P-glykoproteinu a ve vysokých koncentracích je jeho slabým inhibitorem. Údaje in vivo nejsou k dispozici a klinický význam není znám.
Na základě analýzy populační farmakokinetiky se medián zdánlivého biologického poločasu paliperidonu po podání přípravku TREVICTA v dávkovém rozmezí 175 až 525 mg pohyboval od 84 do 95 dní po podání injekce do deltového svalu a od 118 do 139 dní po podání injekce do gluteálního svalu.
Porovnání dlouhodobě působícího 3měsíčního injekčního paliperidon-palmitátu s jinými lékovými formami paliperidonu
Přípravek TREVICTA je koncipován tak, aby dodával paliperidon po dobu 3 měsíců, zatímco 1měsíční injekční paliperidon-palmitát se podává jednou měsíčně. Přípravek TREVICTA, pokud se podává v dávkách 3,5krát vyšších, než jsou odpovídající dávky 1měsíčního injekčního paliperidon-palmitátu (viz bod 4.2), vede k expozicím paliperidonu podobným expozicím dosahovaným pomocí odpovídajících měsíčních dávek 1měsíčního injekčního paliperidon-palmitátu a odpovídajících dávek paliperidonu v tabletách s prodlouženým uvolňováním podávaných jednou denně. Rozmezí expozic u přípravku TREVICTA spadá do rozmezí expozic u schválených dávkových sil paliperidonu v tabletách s prodlouženým uvolňováním.
Porucha funkce jater
Paliperidon není v játrech významně metabolizován. Ačkoliv přípravek TREVICTA studován u pacientů s poruchou funkce jater nebyl, u pacientů s lehkou nebo středně těžkou poruchou funkce jater není úprava dávkování požadována. Ve studii perorálního paliperidonu u subjektů se středně těžkou poruchou funkce jater (Child-Pughova třída B) byly plasmatické koncentrace volného paliperidonu podobné jako u zdravých jedinců. U pacientů s těžkou poruchou funkce jater nebyl paliperidon studován.
Porucha funkce ledvin
Přípravek TREVICTA nebyl u pacientů s poruchou funkce ledvin systematicky studován. U pacientů s různými stupni funkce ledvin byla studována eliminace jednorázové perorální dávky paliperidonu ve formě 3mg tablety s prodlouženým uvolňováním. Vylučování paliperidonu klesalo se snižující se odhadovanou hodnotou clearance kreatininu. Celková clearance paliperidonu byla snížena průměrně o 32 % u pacientů s lehkou poruchou funkce ledvin (CrCl = 50 až <80 ml/min), o 64 % u středně těžké poruchy funkce ledvin (CrCl = 30 až <50 ml/min) a o 71 % u těžké poruchy funkce ledvin (CrCl = 10 až < 30 ml/min), což odpovídá průměrně 1,5-, 2,6-, resp. 4,8násobnému zvýšení expozice (AUCinf) ve srovnání se zdravými jedinci.
Starší pacienti
Populační farmakokinetická analýza žádný důkaz rozdílů ve farmakokinetice souvisejících s věkem nepřinesla.
Index tělesné hmotnosti (BMI)/tělesná hmotnost
U pacientů s nadváhou a u obézních pacientů byla pozorována nižší hodnota Cmax. Při zdánlivém rovnovážném stavu přípravku TREVICTA byly minimální koncentrace u normálních pacientů, u pacientů s nadváhou a u obézních pacientů podobné.
Rasa
Populační farmakokinetická analýza žádný důkaz rozdílů ve farmakokinetice souvisejících s rasou nepřinesla.
Pohlaví
Populační farmakokinetická analýza žádný důkaz rozdílů ve farmakokinetice souvisejících s pohlavím nepřinesla.
Vliv kouření
Na základě studií in vitro s lidskými jaterními enzymy nebyl paliperidon substrátem pro CYP1A2; kouření by proto nemělo mít na farmakokinetiku paliperidonu vliv. Vliv kouření na farmakokinetiku paliperidonu nebyl u přípravku TREVICTA hodnocen. Populační farmakokinetická analýza založená na údajích získaných pro perorálně podávané tablety s prodlouženým uvolňováním prokázala mírné snížení expozice paliperidonu u kuřáků v porovnání s nekuřáky. Není pravděpodobné, že by tento rozdíl byl klinicky významný.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie toxicity po opakovaném intramuskulárním injekčním podání paliperidon-palmitátu (1měsíční léková forma) a perorálním podání paliperidonu laboratorním potkanům a psům prokázaly hlavně farmakologické účinky, jako je sedace, a účinky zprostředkované prolaktinem na mléčnou žlázu a genitálie. U laboratorních zvířat, kterým byl podán paliperidon-palmitát, byla v místě vpichu intramuskulární injekce pozorována zánětlivá reakce. Příležitostně došlo k tvorbě abscesu.
Ve studiích reprodukční toxicity s perorálně podávaným risperidonem u laboratorních potkanů, který je u potkanů a člověka rychle metabolizován na paliperidon, bylo pozorováno snížení porodní hmotnosti a přežití mláďat. Při intramuskulárním podávání paliperidon-palmitátu březím potkanům až do nejvyšší dávky (160 mg/kg/den), což odpovídá 2,2násobku hladiny expozice u člověka při nejvyšší doporučené dávce 525 mg, nebyla pozorována embryotoxicita ani malformace. Ostatní antagonisté dopaminu, pokud jsou podávány březím zvířatům, měly negativní účinky na učení a motorický vývoj mláďat.
Paliperidon-palmitát ani paliperidon nebyly genotoxické. Ve studiích kancerogenity po perorálním podání risperidonu laboratorním potkanům a myším bylo pozorováno zvýšení adenomů hypofýzy (myši), endokrinních adenomů pankreatu (laboratorní potkani) a adenomů mléčné žlázy (oba zvířecí druhy). Kancerogenní potenciál intramuskulárně podávaného paliperidon-palmitátu byl hodnocen na potkanech. U samic potkanů došlo při dávce 10, 30 a 60 mg/kg/měsíc ke statisticky významnému zvýšení adenokarcinomů mléčné žlázy. U samců potkanů se prokázalo statisticky významné zvýšení adenomů a karcinomů mléčné žlázy při dávce 30 a 60 mg/kg/měsíc, což odpovídá 0,6- resp. 1,2násobku úrovně expozice při nejvyšší dávce 525 mg doporučené pro člověka. Tyto nádory mohou souviset s prodlouženým dopaminovým D2 antagonismem a hyperprolaktinemií. Význam nálezů těchto nádorů u hlodavců není z hlediska rizika pro člověka znám.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Polysorbát 20 Makrogol 4000
Monohydrát kyseliny citronové Monohydrát dihydrogenfosforečnanu sodného Hydroxid sodný (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Předplněná injekční stříkačka (cyklický olefinový kopolymer) s pístem, zábranou zpětného posuvu a krytkou špičky (brombutylová pryž), s tenkostěnnou bezpečnostní jehlou 22G 1/ palce (0,72 mm x 38,1 mm) a tenkostěnnou bezpečnostní jehlou 22G 1 palec (0,72 mm x 25,4 mm).
Velikosti balení:
Balení obsahuje 1 předplněnou injekční stříkačku a 2 jehly.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Úplný návod k použití a pokyny pro zacházení s přípravkem TREVICTA jsou uvedeny v příbalové informaci (viz Informace určené lékařům nebo zdravotníkům).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Belgie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/971/007
EU/1/14/971/008
EU/1/14/971/009
EU/1/14/971/010
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 5. prosince 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Janssen Pharmaceutica N.V.
Turnhoutseweg 30 B-2340 Beerse Belgie
B. PODMÍNKY REGISTRACE
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU PAPÍROVÁ KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
TREVICTA 175 mg suspenze s prodlouženým uvolňováním pro injekci paliperidonum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas odpovídající paliperidonum 175 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: polysorbát 20, makrogol 4000, monohydrát kyseliny citronové, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný, voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Suspenze s prodlouženým uvolňováním pro injekci
1 předplněná injekční stříkačka
2 jehly
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání
Podávejte jednou za 3 měsíce
3
MĚSÍCE

Injekční stříkačkou silně třepejte nejméně 15 sekund
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/971/007
13. ČÍSLO ŠARŽE
Č. šarže
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
trevicta 175 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU PŘEDPLNĚNÁ INJEKČNÍ STŘÍKAČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
TREVICTA 175 mg injekce
paliperidonum
i.m.
2. ZPŮSOB PODÁNÍ

Silně protřepat
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
175 mg
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU PAPÍROVÁ KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
TREVICTA 263 mg suspenze s prodlouženým uvolňováním pro injekci paliperidonum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas odpovídající 263 mg paliperidonum.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: polysorbát 20, polyethylenglykol 4000, monohydrát kyseliny citronové, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný, voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Suspenze s prodlouženým uvolňováním pro injekci
1 předplněná injekční stříkačka
2 jehly
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání
Podávejte jednou za 3 měsíce
3
MĚSÍCE

Injekční stříkačkou silně třepejte nejméně 15 sekund
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/971/008
13. ČÍSLO ŠARŽE
Č. šarže
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
trevicta 263 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU PŘEDPLNĚNÁ INJEKČNÍ STŘÍKAČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
TREVICTA 263 mg injekce
paliperidonum
i.m.
2. ZPŮSOB PODÁNÍ

Silně protřepat
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
263 mg
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU PAPÍROVÁ KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
TREVICTA 350 mg suspenze s prodlouženým uvolňováním pro injekci paliperidonum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas odpovídající 350 mg paliperidonum.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: polysorbát 20, polyethylenglykol 4000, monohydrát kyseliny citronové, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný, voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Suspenze s prodlouženým uvolňováním pro injekci
1 předplněná injekční stříkačka
2 jehly
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání
Podávejte jednou za 3 měsíce
3
MĚSÍCE

Injekční stříkačkou silně třepejte nejméně 15 sekund
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/971/009
13. ČÍSLO ŠARŽE
Č. šarže
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
trevicta 350 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU PŘEDPLNĚNÁ INJEKČNÍ STŘÍKAČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
TREVICTA 350 mg injekce
paliperidonum
i.m.
2. ZPŮSOB PODÁNÍ

Silně protřepat
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
350 mg
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU PAPÍROVÁ KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
TREVICTA 525 mg suspenze s prodlouženým uvolňováním pro injekci paliperidonum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje paliperidoni palmitas odpovídající 525 mg paliperidonum.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: polysorbát 20, polyethylenglykol 4000, monohydrát kyseliny citronové, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný, voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Suspenze s prodlouženým uvolňováním pro injekci
1 předplněná injekční stříkačka
2 jehly
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání
Podávejte jednou za 3 měsíce
3
MĚSÍCE

Injekční stříkačkou silně třepejte nejméně 15 sekund
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/971/010
13. ČÍSLO ŠARŽE
Č. šarže
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
trevicta 525 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU PŘEDPLNĚNÁ INJEKČNÍ STŘÍKAČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
TREVICTA 525 mg injekce
paliperidonum
i.m.
2. ZPŮSOB PODÁNÍ
Silně protřepat
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
525 mg
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
TREVICTA 175 mg suspenze s prodlouženým uvolňováním pro injekci TREVICTA 263 mg suspenze s prodlouženým uvolňováním pro injekci TREVICTA 350 mg suspenze s prodlouženým uvolňováním pro injekci TREVICTA 525 mg suspenze s prodlouženým uvolňováním pro injekci
Paliperidonum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je TREVICTA a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek TREVICTA používat
3. Jak se TREVICTA používá
4. Možné nežádoucí účinky
5. Jak přípravek TREVICTA uchovávat
6. Obsah balení a další informace
1. Co je TREVICTA a k čemu se používá
TREVICTA obsahuje léčivou látku paliperidon, která patří do skupiny antipsychotických léků a používá se jako udržovací léčba příznaků schizofrenie u dospělých pacientů.
Pokud jste dobře reagoval(a) na léčbu injekčním paliperidon-palmitátem podávaným jednou měsíčně, může lékař zahájit léčbu přípravkem TREVICTA.
Schizofrenie je onemocnění s „pozitivními“ a „negativními“ příznaky. Pozitivní znamená přebytek příznaků, které normálně nejsou přítomny. Osoba se schizofrenií může například slyšet hlasy nebo vidět věci, které neexistují (označují se jako halucinace), může věřit věcem, které nejsou skutečné (označují se jako bludy), nebo může být neobvykle podezíravá. Negativní znamená absenci chování nebo pocitů, které jsou normálně přítomny. Osoba se schizofrenií se může například zdát staženou do sebe, může být emočně oploštěná nebo může mít potíže s jasným a logickým vyjadřováním. Lidé s tímto onemocněním mohou také pociťovat depresi, úzkost, provinilost nebo napětí.
TREVICTA může pomoci zmírnit příznaky Vašeho onemocnění a snížit pravděpodobnost, že se vrátí.
2. Čemu musíte věnovat pozornost, než začnete přípravek TREVICTA používat Nepoužívejte přípravek TREVICTA
- jestliže jste alergický(á) na paliperidon nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže jste alergický(á) na jiné antipsychotikum včetně risperidonu.
Upozornění a opatření
Před použitím přípravku TREVICTA se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou.
Tento přípravek nebyl studován u starších pacientů s demencí. U starších pacientů s demencí, kteří jsou léčeni podobnými léčivými přípravky, může však být zvýšené riziko cévní mozkové příhody nebo úmrtí (viz bod 4).
Všechny léky mají nežádoucí účinky. Některé nežádoucí účinky tohoto přípravku mohou zhoršovat příznaky jiných onemocnění. Proto je důležité, abyste se svým lékařem prodiskutoval(a) jakýkoli z následujících stavů, které se mohou potenciálně zhoršit při léčbě tímto přípravkem:
- jestliže máte Parkinsonovu chorobu
- jestliže u Vás bylo v minulosti zjištěno onemocnění, jehož příznaky jsou vysoká teplota a svalová ztuhlost (rovněž označované jako neuroleptický maligní syndrom)
- jestliže jste u sebe někdy zaznamenal(a) mimovolní škubavé pohyby v obličeji, jazyka nebo v jiných částech těla (tardivní dyskineze)
- jestliže víte, že jste měl(a) v minulosti nízkou hladinu bílých krvinek v krvi (což mohlo, ale nemuselo, být způsobeno jinými léčivými přípravky)
- jestliže máte diabetes (cukrovku) nebo jste k němu náchylný(á)
- jestliže jste měl(a) nádorové onemocnění prsu nebo nádor hypofýzy (podvěsek mozkový)
- jestliže kvůli srdečnímu onemocnění nebo léčbě srdečního onemocnění máte sklon k nízkému krevnímu tlaku
- jestliže máte nízký krevní tlak po náhlém postavení se nebo posazení se
- jestliže máte nebo jste měl(a) záchvaty křečí
- jestliže máte potíže s ledvinami
- jestliže máte potíže s játry
- jestliže u Vás dochází k prodloužené a/nebo bolestivé erekci
- jestliže máte obtíže s regulací tělesné teploty nebo s přehříváním
- jestliže máte neobvykle vysokou hladinu hormonu prolaktinu v krvi nebo máte nádor, který je pravděpodobně závislý na prolaktinu
- jestliže se u Vás nebo u někoho z Vaší rodiny již někdy vyskytly potíže s krevními sraženinami, protože antipsychotika jsou spojována s jejich tvorbou
Jestliže se Vás týká kterýkoli z výše uvedených stavů, informujte o tom svého lékaře, aby Vám případně mohl upravit dávkování nebo po nějakou dobu více sledovat Váš zdravotní stav.
Vzhledem k tomu, že u pacientů léčených tímto přípravkem byly velmi vzácně pozorovány nebezpečně nízké počty určitého typu bílých krvinek, které jsou třeba pro boj s infekcí, v krvi, může Vám lékař kontrolovat počet bílých krvinek.
I když jste dříve snášel(a) perorální (užívaný ústy) paliperidon nebo risperidon, po podání injekce přípravku TREVICTA se může vzácně objevit alergická reakce. Vyhledejte okamžitě lékařskou pomoc, pokud se u Vás objeví vyrážka, otok hrdla, svědění nebo problémy s dýcháním, protože to mohou být příznaky závažné alergické reakce.
Tento přípravek může způsobovat nárůst tělesné hmotnosti. Významný nárůst tělesné hmotnosti může negativně ovlivnit Váš zdravotní stav. Lékař by tedy měl pravidelně kontrolovat Vaši tělesnou hmotnost.
Vzhledem k tomu, že u pacientů léčených tímto přípravkem byla pozorována cukrovka (diabetes mellitus) nebo její zhoršení, měl by Vám lékař kontrolovat známky vysoké hladiny cukru v krvi.
U pacientů s již existující cukrovkou je nutno kontrolovat hladiny glukózy v krvi pravidelně.
Vzhledem k tomu, že tento přípravek může omezovat nucení ke zvracení, existuje možnost, že může zakrýt normální tělesnou reakci při požití toxických látek nebo jiné zdravotní potíže.
Během oční operace šedého očního zákalu (katarakty) se zornice (černý kruh ve středu oka) nemusí zvětšovat podle potřeby. Také se může v průběhu operace objevit vlající duhovka (barevné části oka), což může vést k poškození oka. Pokud plánujete podstoupit operaci oka, ujistěte se, že jste řekl(a) svému očnímu lékaři, že používáte tento přípravek.
Děti a dospívající
Tento přípravek nesmějí používat děti a dospívající do 18 let věku. Není známo, zda je u těchto pacientů bezpečný a účinný.
Další léčivé přípravky a TREVICTA
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Používání tohoto přípravku s karbamazepinem (lék k léčbě epilepsie a stabilizaci nálady) může vyžadovat úpravu dávky tohoto přípravku.
Vzhledem k tomu, že tento přípravek účinkuje především v mozku, může vzájemné ovlivňování s jinými léky, které rovněž působí v mozku, způsobit vystupňování nežádoucích účinků, jako je ospalost nebo jiné účinky na činnost mozku podobně jako jiné psychiatrické přípravky, opioidy, antihistaminika nebo léky na spaní.
Vzhledem k tomu, že tento přípravek může snižovat krevní tlak, je zapotřebí postupovat opatrně při jeho používání spolu s jinými léky, které snižují krevní tlak.
Tento přípravek může snižovat účinek léků proti Parkinsonově chorobě a syndromu neklidných nohou (např. levodopa).
Tento přípravek může způsobovat poruchy v elektrokardiogramu (EKG) projevující se dlouhou dobou, kterou potřebuje elektrický impuls k průchodu určitou částí srdce (označuje se termínem „prodloužení intervalu QT“). Mezi další léky, které vykazují tento účinek, patří některé léky užívané k léčbě srdečního rytmu nebo infekce a další antipsychotika.
Pokud máte nebo jste měl(a) záchvaty křečí, může tento přípravek zvyšovat možnost jejich vzniku. Mezi další léky, které vykazují tento účinek, patří některé léky užívané k léčbě deprese nebo infekce a další antipsychotika.
TREVICTA s alkoholem
Vyvarujte se pití alkoholu.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat. Tento přípravek nesmíte používat během těhotenství, pokud jste se o tom neporadila se svým lékařem. U novorozenců, jejichž matky užívaly paliperidon v posledním trimestru (poslední tři měsíce těhotenství), se mohou vyskytnout tyto příznaky: třes, svalová ztuhlost a/nebo slabost, spavost, neklid, problémy s dýcháním a potíže s příjmem potravy. Pokud se u Vašeho dítěte objeví kterýkoliv z těchto příznaků, kontaktujte lékaře.
Tento přípravek může přejít z matky na dítě prostřednictvím mateřského mléka a může ohrozit dítě. Pokud používáte tento přípravek, neměla byste kojit.
Řízení dopravních prostředků a obsluha strojů
Během léčby tímto přípravkem se mohou vyskytnout závratě, extrémní únava a zrakové obtíže (viz bod 4). Je zapotřebí s tím počítat při činnostech, které vyžadují plnou pozornost, např. při řízení dopravních prostředků nebo obsluze strojů.
Důležité informace o některých složkách přípravku TREVICTA
Tento léčivý přípravek obsahuje při obvyklém dávkovacím rozmezí méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
Jak se TREVICTA používá
3.
Tento přípravek podává lékař nebo jiný zdravotnický pracovník. Lékař Vám sdělí, kdy máte dostat další injekci. Je důležité, abyste nezmeškal(a) naplánovanou dávku. Pokud nejste schopen(a) dodržet termín návštěvy lékaře, co nejdříve mu zavolejte a dohodněte si nový termín.
Injekci přípravku TREVICTA budete každé 3 měsíce dostávat do horní části paže nebo hýždí.
V závislosti na příznacích může lékař při další plánované injekci buď zvýšit, nebo snížit množství léčivého přípravku.
Pacienti s problémy s ledvinami
Pokud máte problémy s ledvinami, Váš lékař stanoví správnou dávku přípravku TREVICTA na základě dávky 1měsíčního injekčního paliperidon-palmitátu, kterou jste dostával(a). Pokud máte středně těžkou nebo těžkou poruchu funkce ledvin, neměl by se tento přípravek používat.
Starší osoby
Pokud máte sníženou funkci ledvin, lékař Vám stanoví dávku tohoto léku.
Jestliže jste použil(a) více přípravku TREVICTA, než jste měl(a)
Tento lék Vám bude podáván pod lékařským dohledem, a proto je podání příliš velkého množství nepravděpodobné.
U pacientů, kterým bylo podáno příliš mnoho paliperidonu, se mohou objevit následující příznaky: ospalost nebo útlum, zrychlený srdeční tep, nízký krevní tlak, abnormální nálezy na elektrokardiogramu (záznam elektrické aktivity srdce) nebo pomalé či abnormální pohyby obličeje, těla nebo horních či dolních končetin.
Jestliže jste přestal(a) používat přípravek TREVICTA
Pokud nebudete injekce dostávat, mohou se příznaky schizofrenie zhoršit. Tento lék nesmíte přestat používat, ledaže by Vám k tomu dal pokyn Váš lékař.
Máte-li jakékoli další otázky týkající se používání tohoto léčivého přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Okamžitě oznamte svému lékaři, pokud:
• se u Vás objeví krevní sraženiny v žilách, zvláště dolních končetin (příznaky zahrnují otok, bolest a zarudnutí dolní končetiny), které mohou putovat žilním řečištěm do plic a zapříčinit bolest na hrudi a dýchací potíže.
• u Vás dojde k náhlé změně duševního stavu nebo se objeví náhlá slabost nebo necitlivost obličeje, paží nebo nohou, zejména pouze na jedné straně, nebo nezřetelná řeč, i když jen na krátký okamžik. Může se jednat o příznaky cévní mozkové příhody.
• se objeví horečka, ztuhlost svalů, pocení nebo snížená úroveň vědomí (onemocnění zvané „neuroleptický maligní syndrom“). Může být nutná okamžitá léčba.
• jste muž a máte prodlouženou nebo bolestivou erekci. To se nazývá priapismus. Může být nutná okamžitá léčba.
• se objeví záškuby v obličeji, jazyka nebo jiných částí těla, které nemůžete ovládat (tardivní dyskineze).
• se u Vás objeví závažná alergická reakce projevující se horečkou, otokem úst, obličeje, rtů nebo jazyka, dušností, svěděním, kožní vyrážkou a někdy poklesem krevního tlaku (představující „anafylaktickou reakci“). Dokonce i když jste dříve snášel(a) perorální (užívaný ústy) risperidon
nebo perorální paliperidon, mohou se u Vás vzácně objevit alergické reakce po podání injekce paliperidonu.
• se u Vás plánuje operace oka, zcela určitě svého očního lékaře informujte, že užíváte tento lék. Během operace oka kvůli zákalu čočky (katarakta) se může během zákroku objevit vlající duhovka (barevná část oka) (tento jev je znám jako „syndrom plovoucí duhovky”), což může vést k poškození oka.
• víte, že máte v krvi nebezpečně nízký počet určitého typu bílých krvinek, potřebných k boji s infekcí
Mohou se vyskytnout následující nežádoucí účinky:
Velmi časté nežádoucí účinky: mohou postihnout více než 1 z 10 osob
• obtíže s usínáním nebo se spánkem.
Časté nežádoucí účinky: mohou postihnout až 1 z 10 osob
• příznaky nachlazení, infekce močových cest, příznaky podobné chřipce
• vysoké hladiny cukru v krvi, nárůst tělesné hmotnosti, snížení tělesné hmotnosti
• podrážděnost, deprese, úzkost
• pocit neklidu
• parkinsonismus: pomalé pohyby s třesem, ztuhlost a šouravá chůze
• třes
• dystonie: pomalé nebo prodloužené mimovolní stahy svalů. I když může postihnout jakoukoli část těla (a může vést k neobvyklému držení těla), dystonie často postihuje svaly v obličeji, včetně nenormálních pohybů očí, úst, jazyka nebo čelisti
• točení hlavy, pocit ospalosti nebo snížené bdělosti, bolest hlavy
• pomalý tlukot srdce, rychlý tlukot srdce
• vysoký krevní tlak
• kašel, ucpaný nos
• bolest břicha, zvracení, pocit na zvracení, zácpa, průjem, špatné zažívání, bolest zubů
• zvýšení hodnot jaterních transamináz v krvi
• vyrážka
• bolest kostí nebo svalů, bolest zad, bolest kloubů
• vynechávání menstruace
• horečka, slabost, únava
• reakce v místě vpichu včetně svědění, bolesti nebo otoku.
Méně časté nežádoucí účinky: mohou postihnout až 1 ze 100 osob
• zápal plic, zánět průdušek (bronchitida), infekce dýchacích cest, infekce vedlejších nosních dutin, infekce močového měchýře, infekce ucha, zánět mandlí, plísňové infekce nehtů, infekce kůže
• snížení počtu bílých krvinek, snížení počtu krevních destiček (krvinky, které napomáhají zastavit krvácení)
• anémie (chudokrevnost)
• alergická reakce
• TREVICTA může zvyšovat hladiny hormonu zvaného „prolaktin“, což se projeví při rozborech krve (což může nebo nemusí to vést k objevení se příznaků). Vyskytnou-li se příznaky zvýšené hladiny prolaktinu, mohou zahrnovat: (u mužů) otok prsů, problémy s dosažením nebo udržením erekce nebo jiné sexuální poruchy; (u žen) nepříjemný pocit v prsech, výtok mléka
z prsů, vynechávání menstruace nebo jiné problémy s menstruací
• diabetes (cukrovka) nebo jeho zhoršení, zvýšení hladiny insulinu (hormon, který kontroluje hladiny cukru v krvi) v krvi, zvýšení chuti k jídlu, ztráta chuti k jídlu vedoucí k podvýživě a nízké tělesné hmotnosti, snížení chuti k jídlu, vysoké hladiny triglyceridů (tuku) v krvi, zvýšení cholesterolu v krvi
• poruchy spánku, snížení sexuální touhy, nervozita, noční můry
• mdloba, neustálá potřeba pohybovat některou částí těla, závrať po postavení se, porucha pozornosti, problémy s řečí, ztráta vnímání chuti nebo nenormální vnímání chuti, snížená citlivost kůže na bolest a dotek, brnění, mravenčení nebo necitlivost kůže
• rozmazané vidění, infekce oka nebo zčervenání očí, suché oko
• pocit točení hlavy (závrať), zvonění v uších, bolest ucha
• přerušení vedení vzruchu mezi horní a dolní částí srdce, abnormální elektrická vodivost v srdci, prodloužení QT intervalu srdce, rychlý tlukot srdce po postavení se, abnormální záznam elektrické vodivosti v srdci (na elektrokardiogramu neboli EKG), chvějivý nebo bušivý pocit
v hrudi (palpitace)
• nízký krevní tlak, nízký krevní tlak po postavení se (vzhledem k tomu mohou někteří lidé používající přípravek TREVICTA cítit mdlobu, závrať nebo mohou po náhlém postavení se nebo posazení se omdlít)
• dušnost, bolest v krku, krvácení z nosu
• nepříjemné pocity v břiše, infekce žaludku nebo střev, sucho v ústech, nadměrné nadýmání nebo plynatost
• zvýšení GGT (jaterní enzym zvaný gamaglutamyltransferáza) v krvi, zvýšení hladiny jaterních enzymů v krvi
• kopřivka, svědění, vypadávání vlasů, ekzém, suchá kůže, zarudnutí kůže, akné
• zvýšení CPK (kreatinfosfokinázy) v krvi, což je enzym, který se někdy uvolňuje při rozpadu svalů, svalové stahy, ztuhlost kloubů, svalová slabost, bolest šíje
• inkontinence (únik) moči, časté močení, bolest při močení
• potíže s dosahováním a udržováním erekce (erektilní dysfunkce), porucha ejakulace, vynechávání menstruace nebo jiné problémy s menstruací (u žen), zvětšení prsů u mužů, výtok mléka z prsů, sexuální dysfunkce, bolest prsů
• otok obličeje, úst, očí nebo rtů, otok těla, horních nebo dolních končetin, změna způsobu chůze, bolest na hrudi, nepříjemné pocity na hrudi, pocit nemoci, ztvrdnutí kůže
• pád.
Vzácné nežádoucí účinky: mohou postihnout až 1 z 1 000 osob
• infekce oka, svrab, podkožní vřed
• snížení počtu typu bílých krvinek, které pomáhají chránit proti infekci, zvýšení počtu eosinofilů (typ bílých krvinek) v krvi
• nepřiměřené vylučování hormonu, který kontroluje objem moči, cukr v moči
• život ohrožující komplikace nekontrolované cukrovky, nízký krevní cukr, nadměrný příjem tekutin
• povznesená nálada (mánie), zmatenost, nedostatek emocí, neschopnost dosáhnout orgasmu
• glaukom (zvýšení nitroočního tlaku), problémy s pohyby očí, protáčení očí
• přecitlivělost očí na světlo, zvýšená tvorba slz, zarudnutí očí
• fibrilace síní (abnormální srdeční rytmus), nepravidelný tlukot srdce
• problémy s dýcháním ve spánku (spánková apnoe), překrvení plic, překrvení dýchacích cest
• sípání
• zánět slinivky břišní, otok jazyka, nemožnost udržet stolici, velmi tvrdá stolice, obtíže s polykáním, rozpraskané rty
• kožní vyrážka související s lékem, zesílení kůže, lupy
• otok kloubů
• neschopnost se vymočit;
• nepříjemné pocity v prsech, zvětšení prsních žláz, zvětšení prsů, vaginální výtok
• velmi nízká tělesná teplota, zimnice, zvýšení tělesné teploty, pocit žízně, abstinenční příznaky, nahromadění hnisu způsobené infekcí v místě vpichu, hluboká kožní infekce, cysta v místě vpichu, modřiny v místě vpichu.
Není známo: četnost nelze z dostupných údajů určit
• závažná alergická reakce vyznačující se horečkou, otokem úst, obličeje, rtů nebo jazyka, dušností, svěděním, kožní vyrážkou a někdy poklesem krevního tlaku
• nebezpečně nadměrný příjem tekutin
• kóma v důsledku nekontrolované cukrovky, abnormální koordinace pohybů, třes hlavy
• rychlý, mělký dech, zápal plic vyvolaný vdechnutím jídla, praskavé zvuky v plicích, porucha hlasu
• blokáda střev, zastavení pohybu střev, což vyvolá blokádu
• zežloutnutí kůže a očí (žloutenka)
• závažná alergická reakce s otokem, která může postihnout hrdlo a vést k potížím s dechem, změna barvy kůže, šupinatá kůže v kštici nebo na těle
• rozpad svalových vláken a bolest svalů (rhabdomyolýza), abnormální držení těla
• novorozenci narození matkám používajícím přípravek TREVICTA během těhotenství mohou mít nežádoucí účinky léčiva a/nebo příznaky z vysazení, jako je podrážděnost, pomalé nebo prodloužené svalové stahy, třes, ospalost, problémy s dýcháním a potíže s příjmem potravy
• pokles tělesné teploty, mrtvé kožní buňky v místě vpichu, vřed v místě vpichu.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek TREVICTA uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co TREVICTA obsahuje
Léčivou látkou je paliperidonum
Jedna předplněná injekční stříkačka přípravku TREVICTA 175 mg obsahuje paliperidoni palmitas 273 mg.
Jedna předplněná injekční stříkačka přípravku TREVICTA 263 mg obsahuje paliperidoni palmitas 410 mg.
Jedna předplněná injekční stříkačka přípravku TREVICTA 350 mg obsahuje paliperidoni palmitas 546 mg.
Jedna předplněná injekční stříkačka přípravku TREVICTA 525 mg obsahuje paliperidoni palmitas 819 mg.
Pomocnými látkami jsou: polysorbát 20 makrogol 4000
monohydrát kyseliny citronové monohydrát dihydrogenfosforečnanu sodného hydroxid sodný (k úpravě pH) voda na injekci
Jak TREVICTA vypadá a co obsahuje toto balení
TREVICTA je bílá až téměř bílá suspenze s prodlouženým uvolňováním pro injekci v předplněné injekční stříkačce, kterou lékař nebo sestra před injekčním podáním silně protřepe, aby se suspenze promísila.
Balení obsahuje 1 předplněnou injekční stříkačku a 2 jehly.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Belgie
Výrobce
Janssen Pharmaceutica N.V.
Turnhoutseweg 30 B-2340 Beerse Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
Janssen-Cilag NV Tel/Tél: +32 14 64 94 11
Bt^rapuu
"fl^OHCBH & fl^OHCtH Etnrapna” EOOfl Ten.:+359 2 489 9400
Česká republika JANSSEN-CILAG s.r.o.
Tel:+420 227 012 227
Danmark
JANSSEN-CILAG A/S Tlf: +45 45 94 82 82
Deutschland
JANSSEN-CILAG GmbH Tel: +49 2137-955-955
Eesti
UAB “JOHNSON & JOHNSON” Eesti filiaal Tel.: + 372 617 7410
EXláha
JANSSEN-CILAG Oap^aKeuxiKq A.E.B.E T^: +30 210 80 90 000
Espaňa
JANSSEN-CILAG, S.A.
Tel: +34 91 722 81 00
Lietuva
UAB “JOHNSON & JOHNSON”Tel: +370 5 278 68 88
Luxembourg/Luxemburg
Janssen-Cilag NV Tél/Tel: +32 14 64 94 11
Magyarország JANSSEN-CILAG Kft.
Tel.:+36 1 884 2858
Malta
AM MANGION LTD Tel: +356 2397 6000
Nederland
JANSSEN-CILAG B.V.
Tel: +31 13 583 73 73
Norge
JANSSEN-CILAG AS Tlf: + 47 24 12 65 00
Osterreich
Janssen-Cilag Pharma GmbH Tel: +43 1 610 300
Polska
JANSSEN-CILAG Polska Sp. z o.o.
Tel.: + 48 22 -237 6000
France
JANSSEN-CILAG
Tel: 0800 25 50 75 / + 33 1 55 00 40 03 Hrvatska
Johnson & Johnson S.E. d.o.o.
Tel: +385 1 6610 700
Ireland
JANSSEN-CILAG Ltd.
Tel: +44 1494 567 444
Ísland
JANSSEN-CILAG C/o Vistor hf Sími: +354 535 7000
Italia
Janssen-Cilag SpA Tel: +39 02/2510.1
Kúnpoq
BapváPag Xax^nnavay^g AxS T^: +357 22 207 700
Latvija
UAB “JOHNSON & JOHNSON” filiale Latvija Tel: +371 6789 3561
Portugal
JANSSEN-CILAG FARMACEUTICA, LDA Tel: +351 21 43 68 835
Románia
Johnson & Johnson Románia SRL Tel: +40 21 207 1800
Slovenija
Johnson & Johnson d.o.o.
Tel: + 386 1401 18 30
Slovenská republika
Johnson & Johnson s.r.o.
Tel: +421 232 408 400
Suomi/Finland
JANSSEN-CILAG OY Puh/Tel: +358 207 531 300
Sverige
JANSSEN-CILAG AB Tel: +46 8 626 50 00
United Kingdom
JANSSEN-CILAG Ltd. Tel: +44 1494 567 444
Tato příbalová informace byla naposledy revidována MM/RRRR.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
Informace určené lékařům nebo zdravotnickým pracovníkům
Následující informace je určena pouze pro lékaře a zdravotnické pracovníky a lékař nebo zdravotnický pracovník si ji musí přečíst zároveň s plnou informací o přípravku (souhrnem údajů o přípravku).
Podávejte jednou za 3 měsíce
3
MĚSÍCE

Injekční stříkačkou silně třepejte nejméně 15 sekund
Pouze k intramuskulární injekci. Nepodávejte žádnou jinou cestou.
Upozornění
Před použitím si přečtěte celé pokyny. U přípravku TREVICTA je nutné k úspěšnému podání věnovat pozornost tomuto podrobnému návodu k použití.
Přípravek TREVICTA musí zdravotnický pracovník podat jako jedinou injekci. Dávku NEDĚLTE do několika injekcí.
Přípravek TREVICTA je určen pouze k intramuskulárnímu podání. Injikujte jej pomalu, hluboko do svalu a dbejte na to, aby nedošlo k injekci do cévy.
Dávkování
Přípravek TREVICTA se musí podávat jednou za každé 3 měsíce.
Příprava
Odlepte nálepku s tabulkou a nalepte ji do pacientovy dokumentace.
Přípravek TREVICTA vyžaduje delší a silnější protřepávání, než 1měsíční injekční paliperidon-palmitát. Injekční stříkačkou silně třepejte, přičemž špička injekční stříkačky směřuje vzhůru, a to nejméně 15 sekund během 5 minut před podáním (viz krok 2).
Volba tenkostěnné jehly
Tenkostěnné bezpečnostní jehly jsou navrženy k použití s přípravkem TREVICTA. Je důležité, abyste používali pouze jehly poskytnuté v balení přípravku TREVICTA.
Obsah balení
Obsah balení
Předplněná Tenkostěnné
■ • i v ^ a v _ r
injekční bezpečnostní
|
stříkačka |
jehly |
|
Spička inj. stříkačky Růžový nástavec 22Gx1" |
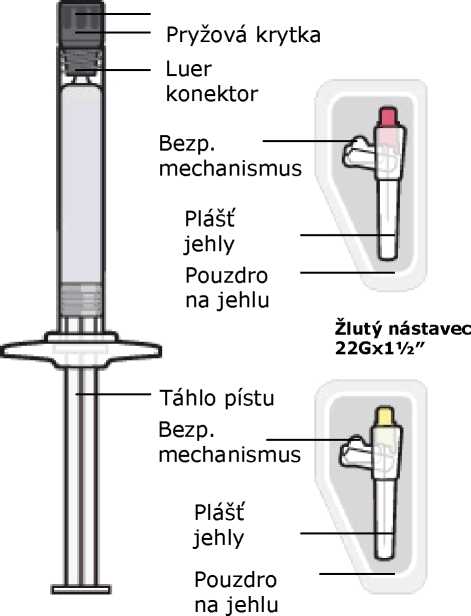
Zvolte jehlu
1
Jehla se určí podle místa injekce a hmotnosti pacienta.
Pn podání do deltového svalu
Pokud pacient váží: Méně než 90 kg
růžový nástavec
Pn podání do gluteálního svalu
22Gx1
Bez ohledu na hmotnost pacienta:
žlutý nástavec

90 kg nebo více
žlutý nástavec


Nepoužitou jehlu ihned zlikvidujte do schválené nádoby na ostré předměty. Jehlu neuchovávejte k dalšímu použití.
V_)
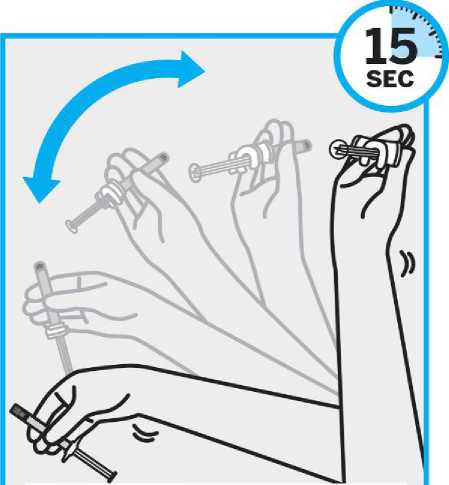
SILNĚ TŘEPEJTE nejméně 15 sekund
Držíc(e) injekční stříkačku špičkou nahoru, SILNĚ TŘEPEJTE při uvolněném zápěstí nejméně 15 sekund, čímž se zajistí homogenizace suspenze.
POZNÁMKA: tento přípravek vyžaduje delší a silnější třepání než 1měsíční injekce paliperidon-palmitátu.

Ihned po protřepání přistupte k dalšímu kroku. Pokud před injekcí uplyne více než 5 minut, znovu nejméně 15 sekund silně protřepávejte držíc(e) injekční stříkačku špičkou nahoru, aby se přípravek resuspendoval.
V_)
Po nejméně 15sekundovém třepání injekční stříkačkou kontrolním okénkem zkontrolujte vzhled suspenze.
Suspenze musí vypadat jednolitě a musí mít mléčně bílou barvu.
Rovněž jsou normálně vidět malé vzduchové bubliny.
Otevřete pouzdro jehly a sejměte krytku
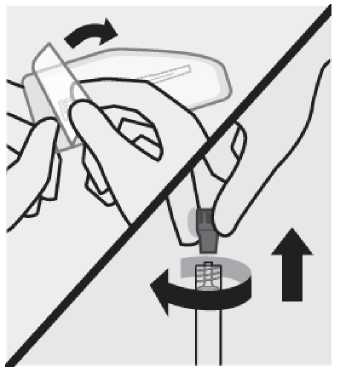
Napřed otevřete pouzdro tak, že z poloviny odloupnete krycí fólii. Položte na čistý povrch. Poté, držíc(e) injekční stříkačku špičkou vzhůru, pryžovou krytkou otočte a stáhněte ji.
Blistr jehly do poloviny sloupněte. Poté pevně přes pouzdro uchopte plášť jehly, jak je ukázáno na obrázku.
Uchopte pouzdro jehly
Jehlu nasaďte
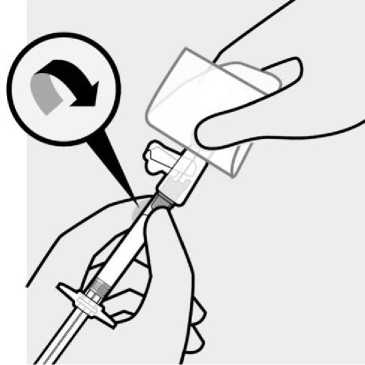
Druhou rukou držte injekční stříkačku za konektor typu luer a nasaďte ji na bezpečnostní jehlu jemným otáčivým pohybem ve směru hodinových ručiček.
Plášť jehly nesnímejte, dokud nebude jehla na injekční stříkačku bezpečně nasazena.
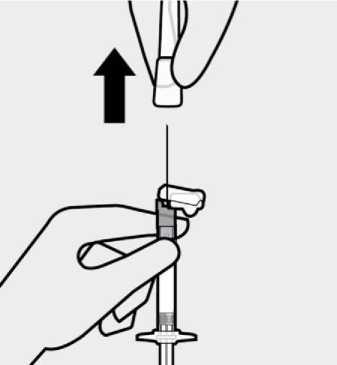
Plášť z jehly sejměte
Přímým pohybem plášť z jehly stáhněte.
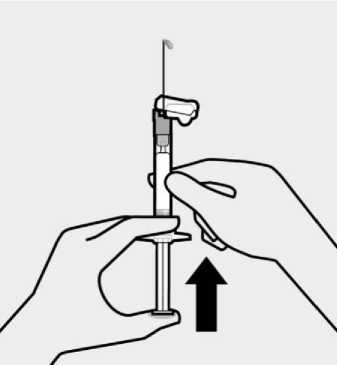
Injekční stříkačku držte špičkou vzhůru a jemně na ni poklepávejte, aby se bubliny dostaly nahoru. Pomalu a opatrně stlačujte píst, aby se vzduch vytlačil.
Pláštěm neotáčejte, protože by tím mohlo dojít k uvolnění jehly z injekční stříkačky. Odstraňte vzduchové bubliny
3 Injikujte
r
Injikujte dávku
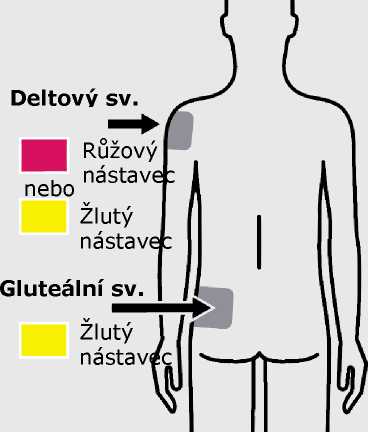
Pomalu intramuskulámě injikujte celý obsah injekční stříkačky, hluboko do zvoleného deltového nebo gluteálního svalu.
Nepodávejte žádnou jinou cestou.
Po injekci
Zajistěte jehlu
Po dokončení injekce pomocí palce nebo o rovný povrch jehlu zajistěte bezpečnostním mechanismem. Jehla je zajištěna poté, co se ozve „cvaknutí“.

Injekční stříkačku a nepoužitou jehlu zlikvidujte do schválené nádoby na ostré předměty.

Tenkostěnné jehly jsou navrženy specificky k použití přípravku TREVICTA. Nepoužité jehly se musí zlikvidovat a nesmějí se uchovávat k dalšímu použití.
\_)
60