Tobi Podhaler 28 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje tobramycinum 28 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce
Průhledné bezbarvé tobolky obsahující bílý až téměř bílý prášek, s modře vytištěným “NVR AVCI” na jedné části tobolky a s modře vytištěným logem společnosti Novartis na druhé části tobolky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek TOBI Podhaler je indikován k léčbě chronických plicních infekcí vyvolaných Pseudomonas aeruginosa při cystické fibróze u dospělých a dětí ve věku 6 let a starších.
Ohledně údajů v různých věkových skupinách viz body 4.4 a 5.1.
Je nutné mít na paměti oficiální doporučení o použití antibakteriálních látek.
4.2 Dávkování a způsob podání
Dávkování
Dávka přípravku TOBI Podhaler je stejná pro všechny pacienty v rámci schváleného věkového rozmezí, bez ohledu na věk nebo tělesnou hmotnost. Doporučená dávka j e 112 mg tobramycinu (4x tobolka 28 mg), dvakrát denně po dobu 28 dnů. Přípravek TOBI Podhaler se používá ve střídavých cyklech 28 dní léčby následovaných 28 dny bez léčby. Interval mezi dvěma inhalacemi (každá 4 tobolky) se má co nejvíce blížit 12 hodinám a nemá být kratší než 6 hodin.
Zapomenuté dávky
V případě zapomenuté dávky, kdy do další dávky zbývá více než 6 hodin, pacient musí použít dávku co nejdříve. V opačném případě musí pacient vyčkat na další dávku a neinhalovat více tobolek, aby nahradil vynechanou dávku.
Trvání léčby
Léčba přípravkem TOBI Podhaler má pokračovat v cyklech tak dlouho, dokud je dle názoru lékaře léčba přípravkem TOBI Podhaler pro pacienty klinickým přínosem. Pokud je zjevné, že dochází ke klinickému zhoršení stavu plicních funkcí, je třeba zvážit přidání dodatečné nebo alternativní léčby pseudomonádové infekce. Viz též informace o klinickém prospěchu a snášenlivosti v bodech 4.4, 4.8 a 5.1.
Starší pacienti (>65 let)
Vzhledem k nedostatečným údajům o této populaci nelze podpořit doporučení pro nebo proti úpravě dávky.
Porucha funkce ledvin
Tobramycin je primárně vylučován v nezměněné formě močí a funkční stav ledvin ovlivňuje expozici tobramycinu. Pacienti s hladinou sérového kreatininu 2 mg/dl nebo více dusíkem močoviny v krvi (BUN) 40 mg/dl nebo více nebyli zařazeni do klinických studií a v této populaci neexistují údaje, které by podpořily doporučení pro nebo proti úpravě dávky přípravku TOBI Podhaler. Obezřetnost je nutná při předepisování přípravku TOBI Podhaler pacientům se známou nebo předpokládánou ledvinnou dysfunkcí.
Údaje o nefrotoxicitě viz bod 4.4.
Porucha funkce jater
U pacientů s poruchou funkce jater nebyly provedeny klinické studie. Protože se tobramycin nemetabolizuje, neočekává se vliv poruchy funkce jater na expozici tobramycinu.
Pacienti po orgánové transplantaci
Odpovídající údaje o pacientech po orgánové transplantaci léčených přípravkem TOBI Podhaler nejsou k dispozici. U pacientů po orgánové transplantaci nelze vydat doporučení pro nebo proti úpravě dávky.
Pediatričtí pacienti
Bezpečnost a účinnost přípravku TOBI Podhaler u dětí ve věku do 6 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Inhalační podání.
Přípravek TOBI Podhaler se podává inhalací s použitím inhalátoru Podhaler (podrobný návod k použití viz bod 6.6). Přípravek nesmí být podán jinou cestou nebo s použitím jiného inhalátoru.
Pečovatel musí být nápomocen dětem zahajujícím léčbu přípravkem TOBI Podhaler, zejména těm ve věku 10 let a mladším, a musí na ně i nadále dohlížet, dokud nejsou schopny použí vat inhalátor Podhaler správně samy bez pomoci.
Tobolky přípravku TOBI Podhaler se nesmí polykat. Každá tobolka přípravku TOBI Podhaler se inhaluje nadvakrát se zadržením dechu a zkontroluje se, zda je prázdná.
Pokud pacienti používají více různých inhalačních léčivých přípravků a podrobují se fyzikální léčbě dýchacích cest, doporučuje se podávat přípravek TOBI Podhaler jako poslední.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku a na kterýkoliv aminoglykosid nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Ototoxicita
Ototoxicita, která se manifestuje jako auditomí toxicita (nedoslýchavost) a vestibulámí toxicita, byla popsána po parenterálním podání aminoglykosidů. Vestibulámí toxicita se může projevit vertigem, ataxií nebo závratí. Tinitus může být varovným příznakem ototoxicity a proto nástup tohoto příznaku vyžaduje opatrnost.
Nedoslýchavost a tinitus byly v klinických studiích hlášeny u pacientů léčených přípravkem TOBI Podhaler (viz bod 4.8). Při předepisování přípravku TOBI Podhaler pacientům se známou nebo předpokládanou auditorní nebo vestibulámí dysfunkcí je nutná obezřetnost.
U pacientů s jakoukoli známkou auditorní dysfunkce nebo u predisponovaných rizikových pacientů, může být nezbytné zvážit audiologické vyšetření před zahájením léčby přípravkem TOBI Podhaler.
Pokud si pacient v průběhu léčby přípravkem TOBI Podhaler stěžuje na tinitus nebo nedoslýchavost, má lékař zvážit jeho odeslání na audiologické vyšetření.
Viz též níže “Monitorování sérových koncentrací tobramycinu”
Nefrotoxicita
Při léčbě parenterálními aminoglykosidy byla hlášena nefrotoxicita. V klinických studiích s přípravkem TOBI Podhaler nefrotoxicita pozorována nebyla. Při předepisování přípravku TOBI Podhaler pacientům se známou nebo suspektní poruchou funkce ledvin je nutná zvýšená opatrnost. Je nutné vyšetřit základní renální funkce. Hladiny močoviny a kreatininu je třeba vyšetřit vždy po šesti dokončených cyklech léčby přípravkem TOBI Podhaler.
Viz též bod 4.2 a “Monitorování sérových koncentrací tobramycinu”níže.
Monitorování sérových koncentrací tobramycinu
U pacientů se známou nebo suspektní poruchou sluchu nebo funkce ledvin mají být monitorovány sérové koncentrace tobramycinu. Pokud se u pacientů léčených přípravkem TOBI Podhaler objeví ototoxicita nebo nefrotoxicita, je třeba léčbu tobramycinem přerušit do té doby, než sérová koncentrace léku klesne pod 2 pg/ml.
Toxicita tobramycinu se objevuje při sérových koncentracích nad 12 pg/ml. Pokud koncentrace přesáhne tuto hranici, je nutné léčbu přerušit.
Sérovou koncentraci tobramycinu je nutné monitorovat pouze validovanými metodami. Odběr krve z prstu se nedoporučuje kvůli riziku kontaminace vzorku.
Bronchospasmus
Při inhalaci léků může dojít k bronchospasmu a jeho výskyt byl hlášen při léčbě přípravkem TOBI Podhaler v klinických studiích. Bronchospasmus má být léčen v souladu s běžnými medicínskými postupy.
První dávka přípravku TOBI Podhaler má být aplikována pod dohledem a po podání bronchodilatancia, pokud je součástí aktuálně prováděné léčby pacienta. Před a po inhalaci přípravku TOBI Podhaler je třeba provést měření FEV1.
Pokud jsou u pacienta zjištěny známky bronchospasmu vyvolaného léčbou, musí lékař důkladně vyhodnotit, zda prospěch z pokračování v léčbě přípravkem TOBI Podhaler vyváží riziko pro pacienta. Pokud je podezření na alergickou reakcí, je nutno přípravek TOBI Podhaler vysadit.
Výskyt kašle byl hlášen při léčbě přípravkem TOBI Podhaler v klinických studiích. Podle údajů z klinické studie byla inhalace prášku přípravku TOBI Podhaler spojena s vyšším výskytem kašle v porovnání s tobramycinem ve formě roztoku k rozprašování (TOBI). Kašel neměl souvislost s bronchospasmem. Při léčbě přípravkem TOBI Podhaler se může u dětí do 13 let věku v porovnání se staršími subjekty kašel objevit častěji.
Pokud kašel vyvolaný léčbou přípravkem TOBI Podhaler přetrvává, má lékař zvážit, zda nepoužít jako alternativní léčbu schválený roztok k rozprašování s obsahem tobramycinu. Pokud kašel zůstane beze změny, je nutné zvážit nasazení jiného antibiotika.
Hemoptýza
Hemoptýza je komplikací cystické fibrózy a je častější u dospělých. Pacienti s hemoptýzou (> 60 ml) byli z klinických studií vyloučeni, takže údaje o použití přípravku TOBI Podhaler u těchto pacientů nejsou k dispozici. To je třeba zvážit před předepsáním přípravku TOBI Podhaler, vzhledem k tomu, že prášek k inhalaci TOBI Podhaler byl spojen s vyšší četností výskytu kašle (viz výše). Užití přípravku TOBI Podhaler u pacientů s klinicky významnou hemoptýzou je možné nebo smí pokračovat pouze tehdy, pokud přínos léčby převýší riziko indukce dalšího krvácení.
Jiná opatření
Pacienti léčení současně parenterálními aminoglykosidy (nebo jinými léky ovlivňujícími renální exkreci, např. diuretiky) mají být klinicky vhodným způsobem monitorováni s ohledem na riziko kumulativní toxicity. To zahrnuje monitorování sérových hladin tobramycinu. U predisponovaných pacientů, u nichž v důsledku předcházející déle trvající systémové léčby aminoglykosidy existuje zvýšené riziko, je vhodné provést před zahájením léčby přípravkem TOBI Podhaler vyšetření ledvin a audiologické vyšetření.
Viz též výše “Monitorování sérových koncentrací tobramycinu”
Opatrnosti je zapotřebí při předepisování přípravku TOBI Podhaler pacientům se známými nebo suspektními neuromuskulárními poruchami jako jsou myasthenia gravis nebo Parkinsonova choroba. Aminoglykosidy mohou zhoršit svalovou slabost díky potenciálnímu kurareformnímu účinku na neuromuskulární funkce.
Vývoj P. aeruginosa rezistentní na antibiotika a superinfekce ostatními patogeny představují potenciální rizika spojená s léčbou antibiotiky. V klinických studiích bylo u některých pacientů léčených přípravkem TOBI Podhaler ve vyšetřených izolátech zjištěno zvýšení minimálních inhibičních koncentrací (MIC) pro P. aeruginosa. Pozorované zvýšení MIC bylo v obdobích bez léčby ve většině případů reverzibilní.
Teoreticky existuje riziko, že se u pacientů léčených přípravkem TOBI Podhaler mohou časem vyvinout izoláty P. aeruginosa rezistentní na intravenózní tobramycin (viz též bod 5.1). Vývoj rezistence během inhalační terapie tobramycinem by mohl limitovat léčebné možnosti během akutních exacerbací; to má být sledováno.
Údaje o různých věkových skupinách
V 6měsíční (3 léčebné cykly) studii přípravku TOBI Podhaler v porovnání s roztokem tobramycinu k rozprašování, která zahrnovala většinou dospělé pacienty již léčené tobramycinem s chronickou plicní infekcí P. aeruginosa, bylo potlačení hustoty P. aeruginosa ve sputu podobné napříč věkovými skupinami v obou ramenech; nicméně zvýšení hodnoty FEV1 ze základní hodnoty bylo v obou ramenech větší v mladších věkových skupinách (6 - < 20) než v podskupině dospělých (20 let a starších). Viz také bod 5.1 - profil odpovědi přípravku TOBI Podhaler v porovnání s tobramycinem ve formě roztoku k rozprašování. Dospělí pacienti měli tendenci přerušit léčbu přípravkem TOBI Podhaler mnohem častěji z důvodu snášenlivosti než u roztoku k rozprašování. Viz též bod 4.8.
Pokud je zřejmé klinické zhoršení stavu plic, je nutné zvážit další nebo alternativní antipseudomonádovou terapii.
Pozorovaný přínos pro plicní funkci a potlačení P. aeruginosa je nutno hodnotit v kontextu tolerance přípravku TOBI Podhaler pacientem.
Bezpečnost a účinnost nebyla sledována u pacientů s usilovným výdechovým objemem za 1 sekundu (FEV1) < 25 % nebo > 75 očekávaných hodnot nebo u pacientů s kolonizací Burkholderia cepacia.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
S přípravkem TOBI Podhaler nebyly provedeny žádné studie interakcí. Na základě interakčního profilu tobramycinu po intravenózním podání a po inhalaci ve formě aerosolu se nedoporučuje současné a/nebo následné podání přípravku TOBI Podhaler s jinými léčivými přípravky s nefrotoxickým nebo ototoxickým potenciálem.
Současné podání přípravku TOBI Podhaler s diuretiky (jako jsou kyselina etakrynová, furosemid, močovina nebo intravenózní mannitol) se nedoporučuje. Tyto sloučeniny mohou zvýšit toxicitu aminoglykosidů ovlivňováním koncentrací antibiotik v séru a tkáni.
Viz též informaci o předchozím a současném použití systémových aminoglykosidů a diuretik v bodě 4.4.
Mezi další léčivé přípravky, u nichž bylo hlášeno zvýšení potenciální toxicity parenterálně podávaných aminoglykosidů patří:
- amfotericin B, cefalotin, cyklosporin, takrolimus, polymyxiny (riziko zvýšené nefrotoxicity);
- sloučeniny platiny (riziko zvýšené nefrotoxicity a ototoxicity);
- anticholinesterázy, botulotoxin (neuromuskulární účinky).
V klinických studiích pacienti léčení přípravkem TOBI Podhaler pokračovali v používání alfa dornázy, bronchodilatancií, inhalačních kortikosteroidů a makrolidů. Lékové interakce s těmito léky nebyly pozorovány.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici dostatečné údaje o použití tobramycinu ve formě inhalací u těhotných žen. Studie provedené s tobramycinem u zvířat nesvědčí pro teratogenní účinky (viz bod 5.3). Aminoglykosidy však mohou způsobit poškození plodu (např. vrozenou hluchotu), pokud jsou u těhotné ženy při léčbě dosaženy vysoké systémové koncentrace. Systémová expozice po inhalaci přípravku TOBI Podhaler je velmi nízká, nicméně nemá být přípravek TOBI Podhaler používán během těhotenství, pokud to není bezpodmínečně nutné, tj. jen pokud prospěch pro matku vyváží riziko pro plod. Pacientky, které používají přípravek TOBI Podhaler během těhotenství nebo které otěhotní v průběhu léčby přípravkem TOBI Podhaler, je nutno informovat o možném riziku pro plod.
Kojení
Po systémovém podání je tobramycin vylučován do lidského mateřského mléka. Množst ví tobramycinu vyloučeného do lidského mateřského mléka po inhalačním podání není známo, předpokládá se však, že je velice nízké vzhledem k nízké systémové expozici. Vzhledem k možnosti ototoxického a nefrotoxického účinku tobramycinu u kojenců je třeba rozhodnout, zda ukončit kojení nebo přerušit léčbu přípravkem TOBI Podhaler, při zvážení významu léčby pro matku.
Fertilita
Po subkutáním podání nebyl v pokuse na zvířatech pozorován vliv na mužskou nebo ženskou fertilitu (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
TOBI Podhaler nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky v základní, aktivním komparátorem kontrolované studii bezpečnosti přípravku TOBI Podhaler v porovnání s roztokem tobramycinu k rozprašování, byly u pacientů s cystickou fibrózou a infekcí P. aeruginosa kašel, produktivní kašel, horečka, dyspnoe, orofaryngeální bolest, dysfonie a hemoptýza.
V placebem kontrolované studii s přípravkem TOBI Podhaler byly nežádoucí účinky, u nichž byla hlášena četnost výskytu u přípravku TOBI Podhaler vyšší než u placeba, faryngolaryngealní bolest, dysgeuzie a dysfonie.
Převážná část nežádoucích účinků hlášených u přípravku TOBI Podhaler byla mírná nebo střední intenzity a míra závažnosti se nelišila mezi cykly nebo mezi celou studií a cykly s léčbou.
Seznam nežádoucích účinků v tabulce
Nežádoucí účinky v tabulce 1 jsou uváděny podle systému orgánových tříd MedDRA. V každé třídě jsou nežádoucí účinky řazeny podle četnosti výskytu, nejčetnější nežádoucí účinky nejdříve. V každé skupině četnosti jsou nežádoucí účinky řazeny podle klesající závažnosti. Navíc je pro každý nežádoucí účinek uvedena odpovídající kategorie četnosti podle následující konvence (CIOMS III): velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10000 až < 1/1000); velmi vzácné (< 1/10000), není známo (z dostupných údajů nelze určit).
Četnosti výskytu v tabulce 1 jsou založeny na počtu hlášení z aktivním komparátorem kontrolované studie.
|
Nežádoucí účinky |
Kategorie četnosti |
|
Poruchy ucha a labyrintu Hypakuze |
Časté |
|
Tinitus |
Časté |
|
Cévní poruchy Hemoptýza |
Velmi časté |
|
Epistaxe |
Časté |
|
Respirační, hrudní a mediastinální poruchy |
Velmi časté |
|
Dysfonie |
Velmi časté |
|
Velmi časté | |
|
Velmi časté | |
|
Sípání |
Časté |
|
Chrůpky |
Časté |
|
Hrudní diskomfort |
Časté |
|
Nazální kongesce |
Časté |
|
Bronchospasmus |
Časté |
|
Časté | |
|
Změna barvy sputa |
Není známo |
|
Gastrointestinální poruchy Orofarnygeální bolest |
Velmi časté |
|
Časté | |
|
Časté | |
|
Podráždění krku |
Časté |
|
Časté | |
|
Dysgeuzie |
Časté |
|
Poruchy kůže a podkožní tkáně |
Časté |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Muskuloskeletální bolest na hrudi |
Časté |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
|
Není známo |
Popis vybraných nežádoucích účinků
Kašel byl nejčastěji hlášeným nežádoucím účinkem v obou klinických studiích. Nicméně v žádné z obou klinických studií nebyla pozorována souvislost mezi bronchospasmem a epizodami kašle.
V aktivním komparátorem kontrolované studii bylo audiometrické vyšetření provedeno ve vybraných centrech a zahrnovalo zhruba čtvrtinu všech subjektů ve studii. U čtyř pacientů ze skupiny léčené přípravkem TOBI Podhaler se objevilo významné zhoršení sluchu, které bylo přechodné u tří pacientů a přetrvalo v jednom případě.
V aktivním komparátorem kontrolované otevřené studii měli pacienti ve věku 20 let a starší tendenci přerušit léčbu přípravkem TOBI Podhaler mnohem častěji než u roztoku k rozprašování; přerušení léčby kvůli nežádoucím účinkům činilo zhruba polovinu všech přerušení u každé lékové formy. U dětí do 13 let věku bylo přerušení léčby četnější v rameni s TOBI roztokem k rozprašování, zatímco u pacientů ve věku 13 až 19 let byla četnost přerušení u obou lékových forem podobná.
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nežádoucí účinky specificky spojené s předávkováním přípravkem TOBI Podhaler nebyly identifikovány. Maximální tolerovaná dávka přípravku TOBI Podhaler nebyla stanovena. Při monitorování předávkování mohou pomoci sérové koncentrace tobramycinu. V případě známek akutní toxicity se doporučuje okamžité vysazení přípravku TOBI Podhaler a sledování renálních funkcí.
V případě náhodného perorálního požití tobolek přípravku je toxicita nepravděpodobná, protože tobramycin se špatně vstřebává z neporušeného trávicího traktu. Při odstraňování tobramycinu z těla může pomoci hemodialýza.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antibakteriální léčiva pro systémovou aplikaci, aminoglykosidová antibiotika, ATC kód: J01GB01
Mechanismus účinku
Tobramycin je aminoglykosidové antibiotikum produkované Streptomyces tenebrarius. Působí primárně prostřednictvím narušení proteosyntézy, což vede k poškození permeability buněčné membrány, postupnému narušení buněčného obalu a nakonec ke smrti buňky. Působí baktericidně ve stejné nebo mírně vyšší koncentraci než je inhibiční koncentrace.
Hraniční hodnoty citlivosti
Stanovené hraniční hodnoty citlivosti pro parenterální podání tobramycinu jsou nevhodné při podání přípravku ve formě aerosolu.
Sputum pacientů s cystickou fibrózou inhibuje místní biologickou aktivitu inhalovaného aminoglykosidu. Je proto nutné, aby koncentrace tobramycinu ve sputu byly po inhalaci přibližně 10x vyšší než minimální inhibiční koncentrace (MIC) nebo vyšší pro potlačení růstu P. aeruginosa. V aktivním komparátorem kontrolované studii mělo nejméně 89 % pacientů izoláty P. aeruginosa s MIC nejméně 15x nižší než průměrná koncentrace ve sputu po podané dávce, jak před zahájením léčby, tak na konci třetího aktivního léčebného cyklu.
Citlivost
V nepřítomnosti konvenčních limitů citlivosti pro inhalační podání je při definování organismů citlivých nebo necitlivých na tobramycin nutná obezřetnost.
Klinický význam změn MICs tobramycinu pro P. aeruginosa při léčbě pacientů s cystickou fibrózou nebyl jasně stanoven. Klinické studie s inhalovaným roztokem tobramycinu (TOBI) ukázaly u testovaných izolátů P. aeruginosa malý nárůst minimální inhibiční koncentrace tobramycinu, amikacinu a gentamicinu. V otevřených extenzích studií mělo každých dalších 6 měsíců léčby za následek postupný nárůst s rozsahem podobným tomu, jaký byl pozorován během 6 měsíců u studií kontrolovaných placebem.
Rezistence na tobramycin zahrnuje různé mechanismy. Hlavními mechanismy rezistence jsou vylučování léku a jeho inaktivace modifikací enzymů. Unikátní charakteristika chronických infekcí P. aeruginosa u pacientů s CF, jako jsou anaerobní podmínky a vysoká frekvence genetických mutací, mohou být též důležitými faktory pro sníženou citlivost P. aeruginosa u pacientů s CF.
Na podkladě in vitro údajů a/nebo zkušeností z klinických studií lze očekávat, že organizmy spojované s plicními infekcemi u cystické fibrózy (CF) budou reagovat na léčbu přípravkem TOBI následovně:
|
Citlivé |
Pseudomonas aeruginosa Haemophilus influenzae Staphylococcus aureus |
|
Necitlivé |
Burkholderia cepacia Stenotrophomonas maltophilia Alcaligenes xylosoxidans |
Klinické zkušenosti
Klinický vývojový program přípravku TOBI Podhaler fáze III se skládal ze dvou studií s 612 léčenými pacienty s klinickou diagnózou CF, potvrzenou kvantitativním testem chloridových iontů v potu po pilokarpinové iontoforéze nebo dobře charakterizovanou, nemoc působící mutací v genu transmembránového regulátoru cystické fibrózy (CFTR) nebo abnormálním rozdílem transepiteliálního potenciálu (TEPD) nosní sliznice charakteristickým pro CF.
V placebem kontrolované studii byli zařazeni pacienti ve věku 6 - < 22 let s hodnotami FEVi mezi
25 % a 84 % očekávaných normálních hodnot pro jejich věkovou skupinu, pohlaví a výšku založených na kritériích dle Knudsona. V aktivním komparátorem kontrolovaných studiích byli všichni pacienti ve věku > 6 let (rozmezí 6-66 let) s FEV1 mezi 24 % a 76 % očekávaných hodnot. Všichni pacienti byli navíc infikováni P. aeruginosa, což bylo demonstrováno pozitivní kultivací ze sputa nebo krku (nebo bronchoalveolární laváží) během 6 měsíců před screeningem, a rovněž kultivací ze sputa odebraného během první návštěvy.
V randomizované, dvojitě zaslepené, placebem kontrolované multicentrické studii, byl podáván přípravek TOBI Podhaler v dávce 112 mg (4 tobolky 28 mg) dvakrát denně, tři cykly s 28 dny léčby a 28 dny bez léčby (celková doba léčby 24 týdnů). Pacienti randomizovaní do placebo skupiny dostávali placebo během prvního léčebného cyklu a přípravek TOBI Podhaler v následných dvou cyklech. Pacienti v této studii nebyli exponováni inhalovanému tobramycinu nejméně 4 měsíce před zahájením studie.
Přípravek TOBI Podhaler signifikantně zlepšil plicní funkci v porovnání s placebem, jak bylo demonstrováno relativním nárůstem očekávaných hodnot FEV1 v procentech o zhruba 13% po 28 dnech léčby. Zlepšení plicní funkce během prvního léčebného cyklu zůstalo zachováno během dvou následujících cyklů léčby přípravkem TOBI Podhaler.
Když byli pacienti v placebo skupině převedeni z placeba na přípravek TOBI Podhaler na začátku druhého léčebného cyklu, dostavilo se obdobné zlepšení v procentech očekávaného FEV1 oproti hodnotám před léčbou. Léčba přípravkem TOBI Podhaler po dobu 28 dní statisticky významně snížila hustotu P. aeruginosa ve sputu (průměrný rozdíl proti placebu přibližně 2,70 log10 kolonie formujících jednotek/CFUs).
V druhé, multicentrické studii, byli pacienti léčeni buď přípravkem TOBI Podhaler (112 mg) nebo tobramycinem 300 mg/5 ml, roztok k rozprašování (TOBI), podávanými dvakrát denně po tři cykly. Většinu pacientů představovali tobramycinem již dříve léčení dospělí s chronickou plicní infekcí P.
aeruginosa.
Léčba jak přípravkem TOBI Podhaler, tak tobramycinem 300 mg/5 ml roztok k rozprašování (TOBI), vedla ke dni 28 třetího léčebného cyklu k relativnímu zvýšení v procentech očekávané hodnoty FEV1 ze základních hodnot o 5,8 %, respektive 4,7 %. Zlepšení v procentech očekávané hodnoty FEV1 bylo číselně větší ve skupině s přípravkem TOBI Podhaler a bylo statisticky non-inferiomí TOBI roztoku k rozprašování. Ačkoli byl rozsah zlepšení plicních funkcí v této studii menší, vysvětlením je předchozí expozice této pacientské populace léčbě inhalovaným tobramycinem. Více než polovina pacientů ve skupinách léčených přípravkem TOBI Podhaler a TOBI roztokem k rozprašování dostala nové (další) - antipseudomonádové antibiotikum (64,9 % a 54,5 %, rozdíl byl zejména v užití perorálního ciprofloxacinu). Podíl pacientů vyžadujících hospitalizaci kvůli respiračním příhodám činil 24,4 % u přípravku TOBI Podhaler a 22,0 % u TOBI roztoku k rozprašování.
Byly pozorovány rozdíly v odpovědi FEV1 v závislosti na věku. U pacientů ve věku < 20 let byl vzestup v procentech očekávané FEV1 nad počáteční hodnotu větší: 11,3 % pro přípravek TOBI Podhaler a 6,9 % pro roztok k rozprašování po třech cyklech. Byla pozorována numericky nižší odpověď u pacientů ve věku > 20 let: změna od počátečních hodnot FEV1 pozorovaná u pacientů ve věku > 20 byla menší (0,3 % u přípravku TOBI Podhaler a 0,9 % u TOBI roztoku k rozprašování).
Kromě toho bylo zlepšení o 6 % očekávané FEV1 dosaženo přibližně u 30 % dospělých pacientů léčených přípravkem TOBI Podhaler v porovnání s 36 % dospělých pacientů léčených TOBI roztokem k rozprašování.
Léčba přípravkem TOBI Podhaler po dobu 28 dní vedla ke statisticky významné redukci hustoty P. aeruginosa ve sputu (-1.61 log10 CFUs), stejně jako roztok k rozprašování (-0.77 log10 CFUs).
Potlačení hustoty P. aeruginosa ve sputu bylo podobné napříč věkovými skupinami v obou léčebných ramenech. V obou studiích byl pozorován trend k znovuobnovení hustoty P. aeruginosa po 28 dnech bez léčby, který byl revezibilní po dalších 28 dnech léčby.
V aktivním komparátorem kontrolované studii bylo podání dávky přípravku TOBI Podhaler rychlej ší s průměrným rozdílem přibližně 14 minut (6 minut oproti 20 minutám s roztokem pro rozprašování). Pacienty hlášená jednoduchost použití a celková spokojenost s léčbou (získané prostřednictvím dotazníku sledujícího výsledky hlášené samotnými pacienty) byly v každém cyklu konzistentně vyšší u přípravku TOBI Podhaler v porovnání s roztokem tobramycinu k rozprašování.
Výsledky týkající se bezpečnosti viz bod 4.8.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem TOBI Podhaler u všech podskupin pediatrické populace v léčbě plicních infekcí/kolonizací vyvolaných pseudomonas aeruginosa u pacientů s cystickou fibrózou (informace o použití u dětí viz bod 4.2).
Absorpce
Očekává se, že systémová expozice tobramycinu po inhalaci přípravku TOBI Podhaler pochází primárně z inhalované části léčivého přípravku, protože tobramycin se po perorálním podání neabsorbuje ve znatelném množství.
Sérové koncentrace
Po inhalaci jednotlivé dávky 112 mg (4 tobolky 28 mg) přípravku TOBI Podhaler u pacientů s cystickou fibrózou, byla maximální koncentrace (Cmax) tobramycinu v séru 1,02 ± 0,53 gg/ml (průměr ± směrodatná odchylka) a medián doby potřebné k dosažení maximální koncentrace (Tmax) byl jedna hodina. Pro srovnání, po inhalaci jednotlivé dávky tobramycinu 300 mg/5 ml, roztok k rozprašování (TOBI), bylo Cmax 1,04 ± 0,58 gg/ml a medián Tmax jedna hodina. Rozsah systémové expozice (AUC) byl rovněž podobný pro dávku 112 mg přípravku TOBI Podhaler a dávku 300 mg tobramycinu roztoku k rozprašování přípravku. Na konci 4týdenního dávkovacího cyklu přípravku TOBI Podhaler (112 mg dvakrát denně), byla maximální sérová koncentrace tobramycinu 1 hodinu po podání 1,99 ± 0,59 gg/ml.
Koncentrace ve sputu
Po inhalaci jednotlivé dávky 112 mg (4 tobolky 28 mg) přípravku TOBI Podhaler u pacientů s cystickou fibrózou, byla Cmax tobramycinu ve sputu 1047 ± 1080 gg/g (průměr ± směrodatná odchylka). Pro srovnání, po inhalaci jednotlivé dávky 300 mg tobramycinu, roztok k rozprašování (TOBI), byla Cmax ve sputu 737,3 ± 1028,4 gg/g. Variabilita farmakokinetických parametrů byla větší ve sputu než v séru.
Distribuce
Populační farmakokinetická analýza přípravku TOBI Podhaler u pacientů s cystickou fibrózou stanovila zdánlivý distribuční objem tobramycinu v centrálním kompartmentu na 84,1 litru u typického pacienta s CF. Zatímco objem se měnil s “body mass” indexem (BMI) a funkcí plic (jako procento očekávané FEVi), na modelu založené simulace ukázaly, že špičkové (Cmax) a minimální (Ctrough) koncentrace nebyly znatelně ovlivněny změnami BMI nebo plicní funkce.
Biotransformace
Tobramycin se nemetabolizuje a je primárně vylučován v nezměněné formě močí. Eliminace
Tobramycin je eliminován ze systémové cirkulace primárně glomerulární filtrací nezměněné látky. Zdánlivý terminální poločas tobramycinu v séru po inhalaci jednotlivé dávky112 mg přípravku TOBI Podhaler byl u pacientů s cystickou fibrózou přibližně 3 hodiny a byl konzistentní s poločasem tobramycinu po inhalaci tobramycinu 300 mg/5 ml, roztok k rozprašování (TOBI).
Populační farmakokinetická analýza přípravku TOBI Podhaler u pacientů s cystickou fibrózou ve věku od 6 do 66 let stanovila zdánlivou sérovou clearance tobramycinu na 14 litrů/h. Tato analýza neprokázala rozdíly ve farmakokinetice vztažené k pohlaví nebo věku.
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a reprodukční toxicity odhalily, že hlavní riziko pro člověka představuje renální toxicita a ototoxicita. Obecně byla toxicita pozorována při vyšších systémových hladinách tobramycinu než lze dosáhnout inhalací doporučené klinické dávky.
Studie karcinogenicity s inhalovaným tobramycinem nezvýšily četnost výskytu kteréhokoliv druhu tumorů. V baterii testů genotoxicity nevykázal tobramycin genotoxický potenciál.
Nebyly provedeny žádné studie reprodukční toxicity tobramycinu podávaného v inhalační formě. Nicméně, podkožní podání tobramycinu během organogeneze nebylo teratogenní ani embryotoxické. Vysoké dávky toxické pro samice králíků (nefrotoxicita) vedly ke spontánním potratům a úmrtí. Na základě dostupných údajů získaných u zvířat není možno riziko toxického působení (například ototoxicitu) při expozici prenatálně dosahovaným koncentracím vyloučit.
Subkutánní podání tobramycinu neovlivňovalo páření ani nepůsobilo poruchy fertility samců nebo samic potkanů.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky
Distearoylfosfatidylcholin Chlorid vápenatý Kyselina sírová (k úpravě pH)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
Zlikvidujte inhalátor Podhaler a jeho obal 1 týden po prvním použití.
6.4 Zvláštní opatření pro uchovávání
Tobolky přípravku TOBI Podhaler musí být vždy uchovávány v blistru, aby byly chráněny před vlhkostí a vyjmuty z blistru pouze bezprostředně před použitím.
6.5 Druh obalu a obsah balení
Tvrdé tobolky jsou dodávány v PVC/PA/Al/PVC- PET/Al blistrech.
Inhalátor Podhaler a jeho pouzdro jsou vyrobeny z plastických materiálů (polypropylen).
Přípravek TOBI Podhaler se dodává v měsíčních baleních s obsahem 4 týdenních balení a náhradním inhalátorem Podhaler v pouzdru. Jedno týdenní balení obsahuje 56 tobolek 28 mg (7 blistrů s 8 tobolkami v každém blistru) a inhalátor Podhaler v pouzdru.
Velikosti balení:
56 tobolek a 1 inhalátor
224 (4 x 56) tobolek a 5 inhalátorů (měsíční vícečetné balení)
448 (8 x 56) tobolek a 10 inhalátorů (2 měsíční vícečetná balení zabalená ve fólii)
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
V inhalátoru Podhaler smí být použity pouze tobolky přípravku TOBI Podhaler. Nesmí být použit jiný inhalátor.
Tobolky přípravku TOBI Podhaler musí být vždy uchovávány v blistru a vyjmuty pouze bezprostředně před použitím. Jeden inhalátor Podhaler a jeho pouzdro se používají sedm dní a poté jsou vyřazeny a nahrazeny novými. Pokud inhalátor Podhaler nepoužíváte, uchovávejte ho v jeho dobře uzavřeném pouzdru.
Stručný návod k použití je uveden níže, podrobnější návod je uveden v příbalové informaci.
1. Umyjte si a osušte ruce.
2. Těsně před použitím vyjměte inhalátor Podhaler z jeho pouzdra. Inhalátor zběžně prohlédněte, abyste se ujistil(a), že není poškozen nebo znečištěn.
3. Držte tělo inhalátoru, odšroubujte a sejměte náústek. Odložte náústek stranou na čistou a suchou plochu.
4. Oddělte ranní a večerní dávku z blistru.
5. Stáhněte fólii z blistru, odhalte jednu tobolku přípravku TOBI Podhaler a vyjměte ji z blistru.
6. Okamžitě vložte tobolku do komory inhalátoru. Nasaďte náústek a pevně ho našroubujte do zastavení. Příliš neutahujte.
7. Abyste propíchl(a) tobolku, držte inhalátor s náústkem směřujícím dolů, stiskněte pevně palcem tlačítko na doraz a tlačítko povolte.
8. Vydechněte směrem od inhalátoru.
9. Přitiskněte ústa těsně k náústku. Hluboce inhalujte prášek j ednou nepřerušovanou inhalací.
10. Vyjměte inhalátor z úst, zadržte dech na zhruba 5 vteřin, potom normálně vydechněte směrem od inhalátoru.
11. Po několika normálních výdeších směrem od inhalátoru, proveďte druhou inhalaci ze stejné tobolky.
12. Odšroubuj te náústek a vyj měte tobolku z komory.
13. Prohlédněte použitou tobolku. Má být propíchnutá a prázdná.
• Pokud je tobolka propíchnutá, ale stále obsahuje nějaký prášek, vložte ji zpět do inhalátoru a proveďte další dvě inhalace z tobolky. Tobolku opět prohlédněte.
• Pokud se tobolka zdá být nepropíchnutá, vložte ji zpět do inhalátoru, stiskněte tlačítko pevně nadoraz a proveďte další dvě inhalace z tobolky. Pokud je i poté tobolka stále plná a zdá se být nepropíchnutá, nahraďte inhalátor náhradním inhalátorem a zkuste to znova.
14. Zlikvidujte prázdnou tobolku.
15. Opakujte od kroku 5 se zbývajícími třemi tobolkami dávky.
16. Nasaďte náústek a pevně ho našroubujte do zastavení. Po inhalaci celé dávky (4 tobolky), otřete náústek suchou čistou látkou.
17. Vložte inhalátor zpět do pouzdra a pevně uzavřete. Inhalátor nikdy nemyjte vodou.
Viz též bod 4.2.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/10/652/001 -003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. července 2011 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP j e třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce Tobramycinum
Jedna tvrdá tobolka obsahuje tobramycinum 28 mg.
Obsahuje distearoylfosfatidylcholin, chlorid vápenatý a kyselinu sírovou (k úpravě pH).
Prášek k inhalaci v tvrdé tobolce 56 tobolek + 1 inhalátor
Inhalační podání
Před použitím si přečtěte příbalovou informaci.
Pro použití pouze s inhalátorem přiloženým v tomto balení.
Inhalátor uchovávejte vždy v tomto pouzdru.
Tobolky nepolykejte.
4 tobolky = 1 dávka Zde otevřete.
(Bude uvedeno pouze na vnitřní straně horní chlopně krabičky vícečetného balení)
Před použitím si přečtěte příbalovou informaci.
4 tobolky = 1 dávka Neprotlačujte tobolky fólií.
Odtrhněte podle perforace podélně a napříč: viz obrázek (a) a (b).
Poté stáhněte fólii z blistru směrem dozadu a odhalte vždy jednu tobolku, jak je znázorněno na obrázcích (c) a (d). Držte fólii co nejblíže blistru.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a vyjměte pouze bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/10/652/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
TOBI Podhaler
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce Tobramycinum
Jedna tvrdá tobolka obsahuje tobramycinum 28 mg.
Obsahuje distearoylfosfatidylcholin, chlorid vápenatý a kyselinu sírovou (k úpravě pH).
Prášek k inhalaci v tvrdé tobolce 56 tobolek + 1 inhalátor
Součást vícečetného balení. Samostatně neprodejné.
Inhalační podání
Před použitím si přečtěte příbalovou informaci.
Pro použití pouze s inhalátorem přiloženým v tomto balení.
Inhalátor uchovávejte vždy v tomto pouzdru.
Tobolky nepolykejte.
4 tobolky = 1 dávka Zde otevřete.
(Bude uvedeno pouze na vnitřní straně horní chlopně krabičky vícečetného balení)
Před použitím si přečtěte příbalovou informaci.
4 tobolky = 1 dávka Neprotlačujte tobolky fólií.
Odtrhněte podle perforace podélně a napříč: viz obrázek (a) a (b).
Poté stáhněte fólii z blistru směrem dozadu a odhalte vždy jednu tobolku, jak je znázorněno na obrázcích (c) a (d). Držte fólii co nejblíže blistru.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a vyjměte pouze bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/10/652/002 měsíční vícečetné balení
EU/1/10/652/003 2 měsíční vícečetná balení zabalená ve fólii
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
TOBI Podhaler
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce Tobramycinum
Jedna tvrdá tobolka obsahuje tobramycinum 28 mg.
Obsahuje distearoylfosfatidylcholin, chlorid vápenatý a kyselinu sírovou (k úpravě pH).
Prášek k inhalaci v tvrdé tobolce
Vícečetné balení: 224 tobolek (4 jednotlivá balení po 56 tobolkách + 1 inhalátor) + náhradní inhalátor
Inhalační podání
Před použitím si přečtěte příbalovou informaci.
Pro použití pouze s inhalátorem přiloženým v tomto balení.
Inhalátor uchovávejte vždy v tomto pouzdru.
Tobolky nepolykejte.
Zde otevřete.
Uvnitř najdete 1 náhradní inhalátor. Použijte ho, pokud Váš týdenní inhalátor nefunguje správně, je vlhký nebo spadl na zem.
(Bude uvedeno pouze na vnitřní straně krabičky vícečetného balení)
Před použitím si přečtěte příbalovou informaci.
Nepoužívejte žádný indalátor a jeho pouzdro déle než 1 týden.
Vyhoďte prosím inhalátor a jeho pouzdro po 1 týdnu používání.
Pro JEDNU kompletní dávku jsou zapotřebí ČTYŘI tobolky.
4 tobolky = 1 dávka
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a vyjměte pouze bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/10/652/002
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
TOBI Podhaler
MĚSÍČNÍ STŘEDNÍ KRABIČKA VÍCEČETNÉHO BALENÍ ZAHRNUJÍCÍ 2 MĚSÍČNÍ BALENÍ, KAŽDÉ OBSAHUJE 4 TÝDENNÍ BALENÍ (BEZ BLUE BOXU)_
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce Tobramycinum
Jedna tvrdá tobolka obsahuje tobramycinum 28 mg.
Obsahuje distearoylfosfatidylcholin, chlorid vápenatý a kyselinu sírovou (k úpravě pH).
Prášek k inhalaci v tvrdé tobolce 224 tobolek + 5 inhalátorů
Měsíční balení. Součást vícečetného balení. Samostatně neprodejné.
Inhalační podání
Před použitím si přečtěte příbalovou informaci.
Pro použití pouze s inhalátorem přiloženým v tomto balení.
Inhalátor uchovávejte vždy v tomto pouzdru.
Tobolky nepolykejte.
Zde otevřete.
Uvnitř najdete 1 náhradní inhalátor. Použijte ho, pokud Váš týdenní inhalátor nefunguje správně, je vlhký nebo spadl na zem.
(Bude uvedeno pouze na vnitřní straně horní chlopně krabičky vícečetného balení)
Před použitím si přečtěte příbalovou informaci.
Nepoužívejte žádný indalátor a jeho pouzdro déle než 1 týden.
Vyhoďte prosím inhalátor a jeho pouzdro po 1 týdnu používání.
Pro JEDNU kompletní dávku jsou zapotřebí ČTYŘI tobolky.
4 tobolky = 1 dávka
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a vyjměte pouze bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/10/652/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
TOBI Podhaler
ETIKETA VÍCEČETNÉHO BALENÍ ZABALENÉHO VE FOLII ZAHRNUJÍCÍ 2 MĚSÍČNÍ BALENÍ, KAŽDÉ OBSAHUJE 4 TÝDENNÍ BALENÍ (VČETNĚ BLUE BOXU)_
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce Tobramycinum
Jedna tvrdá tobolka obsahuje tobramycinum 28 mg.
Obsahuje distearoylfosfatidylcholin, chlorid vápenatý a kyselinu sírovou (k úpravě pH).
Prášek k inhalaci v tvrdé tobolce
Vícečetné balení: 448 tobolek (2 balení po 224 tobolkách + 5 inhalátorů)
Inhalační podání
Před použitím si přečtěte příbalovou informaci.
Pro použití pouze s inhalátorem přiloženým v tomto balení. Inhalátor uchovávejte vždy v tomto pouzdru.
Tobolky nepolykejte.
Zde otevřete.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a vyjměte pouze bezprostředně před použitím.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/10/652/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
TOBI Podhaler
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce Tobramycinum
Novartis Europharm Limited
EXP
Lot
Pouze k inhalaci. Nepolykejte.
Tobolku použijte bezprostředně po vyjmutí z blistru. Neprotlačujte tobolku fólií.
4 tobolky = 1 dávka
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
TOBI Podhaler 28 mg prášek k inhalaci v tvrdé tobolce
Tobramycinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek TOBI Podhaler a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek TOBI Podhaler používat
3. Jak se přípravek TOBI Podhaler používá
4. Možné nežádoucí účinky
5. Jak přípravek TOBI Podhaler uchovávat
6. Obsah balení a další informace
Návod k použití inhalátoru Podhaler (na druhé straně)
1. Co je přípravek TOBI Podhaler a k čemu se používá Co je přípravek TOBI Podhaler
Přípravek TOBI Podhaler obsahuje léčivou látku tobramycin, která patří mezi antibiotika. Toto antibiotikum patří do třídy zvané aminoglykosidy.
K čemu se přípravek TOBI Podhaler používá
Přípravek TOBI Podhaler se používá u pacientů s cystickou fibrózou ve věku 6 let a starších k léčbě plicních infekcí působených bakterií zvanou Pseudomonas aeruginosa.
Nejlepších výsledků dosáhnete, když budete lék používat podle návodu v této příbalové informaci. Jak přípravek TOBI Podhaler působí
Přípravek TOBI Podhaler je prášek k inhalaci, který je naplněn do tobolek. Když inhalujete přípravek TOBI Podhaler, antibiotikum se může dostat přímo do Vašich plic a bojovat proti bakterii působící zánět a zlepšovat Vaše dýchání.
Co je Pseudomonas aeruginosa
Jedná se o velice běžnou bakterii, která v některém úseku života infikuje plíce téměř každého pacienta s cystickou fibrózou. Někteří lidé neonemocní dříve než v pozdějším věku, zatímco jiní onemocní velice mladí. Jedná se o jednu z nejničivějších bakterií pro osoby s cystickou fibrózou. Pokud není infekce správně léčena, pokračuje poškozování plic, což působí další problémy s dýcháním.
2. Čemu musíte věnovat pozornost, než začnete přípravek TOBI Podhaler používat Nepoužívejte přípravek TOBI Podhaler
• jestliže jste alergický(á) na tobramycin, na jakýkoliv typ aminoglykosidového antibiotika nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud se Vás to týká, nepoužívejte přípravek TOBI Podhaler a informujte lékaře.
Pokud se domníváte, že byste mohl(a) být alergický/á, poraďte se s lékařem.
Upozornění a opatření
Informujte lékaře, pokud se u Vás již někdy dříve vyskytl některý z následujících stavů:
• potíže se sluchem (včetně ušního šelestu a závratí)
• potíže s ledvinami
• neobvykle obtížné dýchání se sípáním nebo kašlem, tlak na prsou
• krev ve sputu (hlenu, který vykašlete)
• svalová slabost, která přetrvává nebo se s časem zhoršuje, příznak, který je obvykle spojován se stavy jako myastenie nebo Parkinsonova choroba.
Pokud se Vás cokoliv z uvedeného týká, informujte lékaře před tím, než začnete přípravek TOBI Podhaler používat.
Pokud je Vám 65 let nebo více, může Váš lékař provést další testy, aby rozhodl, zda je přípravek TOBI Podhaler pro Vás vhodný.
Inhalace léků může způsobit tlak na prsou a sípání, k čemuž může dojít bezprostředně po inhalaci přípravku TOBI Podhaler. Váš lékař bude dohlížet na Vaši první dávku přípravku a zkontroluje Vaše plicní funkce před a po podání. Váš lékař Vás může požádat, abyste před užitím přípravku užil jiné vhodné léky.
Inhalace léků může též vyvolat kašel, k čemuž může dojít i u přípravku TOBI Podhaler. Poraďte se s lékařem, pokud kašel přetrvává a zatěžuje Vás.
Kmeny Pseudomonas se postupně mohou stát rezistentními na léčbu antibiotiky. To znamená, že přípravek TOBI Podhaler nemusí být časem účinný tak dobře, jak by měl. Pokud se toho obáváte, poraďte se s lékařem.
Pokud používáte tobramycin nebo jiná aminoglykosidová antibiotika injek čně, mohou občas tyto léky působit nedoslýchavost, závratě a poškodit ledviny.
Děti
Přípravek TOBI Podhaler nemá být podáván dětem mladším 6 let věku.
Další léčivé přípravky a přípravek TOBI Podhaler
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo které jste v nedávné době užíval(a), a to i o lécích, které jsou dostupné bez lékařského předpisu.
Během používání přípravku TOBI Podhaler neužívejte následující léky:
• Furosemid nebo kyselinu etakrynovou, diuretika (léky zvyšující tvorbu moči)
• Jiné léky s močopudnými vlastnostmi, j ako j sou močovina nebo nitrožilně podávaný mannitol
• Jiné léky, které mohou poškodit Vaše ledviny nebo sluch.
Následující léky mohou zvýšit riziko škodlivých vlivů, které se objevují, pokud jsou Vám tyto léky podány současně s injekcemi tobramycinu nebo jiných aminoglykosidových antibiotik:
• Amfotericin B, cefalotin, polymyxiny (užívané k léčbě mikrobiálních infekcí), cyklosporin, takrolimus (užívané ke snížení aktivity imunitního systému). Tyto léky mohou poškodit ledviny.
• Sloučeniny platiny j ako karboplatina a cisplatina (používané k léčbě některých forem rakoviny). Tyto léky mohou poškodit ledviny nebo sluch.
• Anticholinesterázy jako neostigmin a pyridostigmin (užívané k léčbě svalové slabosti) nebo botulotoxin. Tyto léky mohou vyvolat svalovou slabost nebo ji zhoršit.
Pokud užíváte jeden nebo více shora uvedených léků, poraďte se s lékařem dříve, než začnete používat přípravek TOBI Podhaler.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat.
Není známo, zda inhalace tohoto léku během těhotenství může vyvolat nežádoucí účinky.
Při injekčním podání mohou tobramycin a jiná aminoglykosidová antibiotika poškodit nenarozené dítě, například způsobit hluchotu.
Pokud kojíte, měla byste se poradit s lékařem před tím, než začnete tento přípravek používat.
Řízení dopravních prostředků a obsluha strojů
Přípravek TOBI Podhaler nemá žádný nebo jen zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
3. Jak se přípravek TOBI Podhaler používá
Vždy používejte přípravek TOBI Podhaler přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Pečovatel musí být nápomocen dětem zahajujícím léčbu přípravkem TOBI Podhaler, zejména těm ve věku 10 let a mladším, a musí na ně i nadále dohlížet, dokud nejsou schopny používat inhalátor Podhaler správně samy bez pomoci.
Jaké množství přípravku TOBI Podhaler používat
Inhalujte obsah 4 tobolek dvakrát denně (4 tobolky ráno a 4 tobolky večer), použijte inhalátor Podhaler.
Dávka je stejná pro všechny pacienty ve věku 6 let a starší. Nepřekračujte doporučenou dávku.
Kdy používat přípravek TOBI Podhaler
Používání tobolek ve stejnou dobu každý den Vám pomůže zapamatovat si, kdy je použít. Inhalujte obsah 4 tobolek dvakrát denně, jak je uvedeno dále:
• 4 tobolky ráno s použitím inhalátoru Podhaler.
• 4 tobolky večer s použitím inhalátoru Podhaler.
• Mezi dávkami je nejlepší dodržet odstup co nejblíže 12 hodinám, ale musí to být nejméně 6 hodin.
Pokud používáte více různých inhalačních léků a podrobujete se jiné léčbě cystické fibrózy, použijte přípravek TOBI Podhaler jako poslední. Zkontrolujte prosím pořadí podávaných léků s lékařem.
Jak přípravek TOBI Podhaler používat
• Pouze pro inhalační podání.
• Tobolky nepolykejte.
• Tobolky používejte pouze s inhalátorem obsaženým v tomto balení. Tobolky musí do použití zůstat v blistru.
• Pokud začínáte s novým týdenním balením tobolek, použijte nový inhalátor dodávaný v balení. Každý inhalátor se používá pouze 7 dní.
• Přečtěte si prosím návod na konci této příbalové informace, kde najdete podrobnější informace o použití inhalátoru.
Jak dlouho používat přípravek TOBI Podhaler
Poté, co jste používal(a) přípravek TOBI Podhaler 28 dní, dochází k přerušení na 28 dní, během nichž neinhalujete přípravek TOBI Podhaler. Poté zahájíte další cyklus.
Je důležité, abyste používal(a) přípravek dvakrát každý den během 28 dní s léčbou a dodržoval(a) cyklus 28 dní s léčbou, 28 dní bez léčby.

|
Léčba přípravkemTOBI Podhaler |
Bez léčby přípravkem TOBI Podhaler |
|
Používejte přípravek TOBI Podhaler dvakrát denně, každý den po dobu 28 dní |
Nepoužívejte přípravek TOBI Podhaler po dobu následujících 28 dní |
Pokračujte v používání přípravku TOBI Podhaler podle doporučení lékaře.
Máte-li otázky ohledně délky používání přípravku TOBI Podhaler, zeptejte se lékaře nebo lékárníka. Jestliže jste použil(a) více přípravku TOBI Podhaler, než jste měl(a)
Jestliže jste použil(a) více přípravku TOBI Podhaler, než jste měl(a), informujte co nejdříve lékaře. Jestliže jste spolknul(a) přípravek TOBI Podhaler, nemáte se čeho bát, ale sdělte to co nejdříve lékaři.
Jestliže jste zapomněl(a) použít přípravek TOBI Podhaler
Jestliže jste zapomněl(a) použít přípravek TOBI Podhaler a do Vaší další dávky zbývá nejméně 6 hodin, použijte Vaši dávku co nejdříve můžete. V opačném případě počkejte na Vaši další dávku. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Osoby s cystickou fibrózou mají mnoho příznaků této choroby. Ty se mohou stále ještě objevovat během používání přípravku TOBI Podhaler, neměly by však být četnější nebo závažnější než předtím.
Pokud se Vám zdá, že se při používání přípravku TOBI Podhaler plicní choroba zhoršuje, informujte okamžitě svého lékaře.
Některé nežádoucí účinky mohou být závažné
• Neobvykle obtížné dýchání se sípáním nebo kašlem a tlakem na prsou (časté).
Pokud se Vás to týká, přestaňte používat přípravek TOBI Podhaler a informujte okamžitě svého lékaře.
• Vykašlávání krve (velmi časté)
• Zhoršování sluchu ( ušní šelest je možné varovné znamení nedoslýchavosti), ušní šelest (jako např. syčení) (časté).
Pokud se Vás týká cokoliv se zhora uvedeného, informujte okamžitě svého lékaře.
Další nežádoucí účinky mohou zahrnovat:
Velmi časté (mohou ovlivnit více než 1 z 10 lidí)
• Dušnost
• Kašel, produktivní kašel, změny hlasu (chrapot)
• Bolest v krku
• Horečka
Časté (mohou ovlivnit až 1 z 10 lidí)
• Sípání, chrůpky (praskání)
• Tlak na hrudi, bolest na hrudi svalového nebo kosterního původu
• Pocit ucpaného nosu
• Krvácení z nosu
• Zvracení, pocit na zvracení
• Průjem
• Vyrážka
• Poruchy chuti
• Ztráta hlasu
Není známo (četnost z dostupných údajů nelze určit)
• Malátnost
• Změna zbarvení vykašlávaného hlenu (sputa)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.

Opakujte cyklus
5. Jak přípravek TOBI Podhaler uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce nebo blistru.
• Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Po vyjmutí z blistru musí být tobolka okamžitě použita.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek TOBI Podhaler obsahuje
• Léčivou látkou je tobramycinum. Jedna tobolka obsahuje tobramycinum 28 mg.
• Pomocnými látkami j sou distearoylfosfatidylcholin, chlorid vápenatý, kyselina sírová (k úpravě
pH).
Jak přípravek TOBI Podhaler vypadá a co obsahuje toto balení
Přípravek TOBI Podhaler prášek k inhalaci v tvrdé tobolce obsahuje bílý nebo téměř bílý prášek k inhalaci plněný do průhledných bezbarvých tvrdých tobolek s modrým potiskem“NVR AVCI” na jedné části tobolky a s modrým vytištěným logem Novartis na druhé části tobolky.
Přípravek TOBI Podhaler se dodává v měsíčních baleních s obsahem 4 týdenních balení a s náhradním inhalátorem Podhaler v pouzdru.
Jedno týdenní balení obsahuje 7 blistrů s 8 tobolkami a inhalátor Podhaler v pouzdru.
Jsou dostupné následující velikosti balení:
56 tobolek (prášek k inhalaci v tvrdé tobolce) a 1 inhalátor (týdenní balení)
224 (4 x 56) tobolek (prášek k inhalaci v tvrdé tobolce) a 5 inhalátorů (měsíční vícečetné balení)
448 (8 x 56) tobolek (prášek k inhalaci v tvrdé tobolce) a 10 inhalátorů (2 měsíční vícečetná balení zabalená do fólie)
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
Výrobce
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
Další informace o tomto přípravku získáte u místního zástupce drží tele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Et.irapHH Novartis Pharma Services Inc. Ten.: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 111 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EM,á8a Novartis (Hellas) A.E.B.E. TqX: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A. Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
|
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 |
Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
Kúnpo^
Novartis Pharma Services Inc. T^X: +357 22 690 690
Latvija
Novartis Pharma Services Inc. Tel: +371 67 887 070
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
United Kingdom
Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
NÁVOD K POUŽITÍ INHALÁTORU PODHALER
Přečtěte si prosím pečlivě následující návod týkající se použití a údržby Vašeho inhalátoru Podhaler.
V týdenním balení přípravku TOBI Podhaler najdete
Jedno týdenní balení přípravku TOBI Podhaler obsahuje:
• 1 inhalátor (Podhaler) a jeho pouzdro.
• 7 blistrů (j eden blistr na každý den v týdnu).
• Jeden blistr obsahuje 8 tobolek (odpovídá denní dávce: obsah 4 tobolek se inhaluje ráno a obsah 4 tobolek večer).
Jak inhalovat lék inhalátorem Podhaler
• Použijte pouze inhalátor Podhaler obsažený v tomto balení. Nepoužívejte tobolky přípravku TOBI Podhaler v jiném inhalátoru a nepoužívejte inhalátor Podhaler pro podání jiných léků.
• Když začínáte s novým týdenním balením tobolek, použijte nový inhalátor Podhaler obsažený v tomto balení. Jeden inhalátor Podhaler se používá pouze 7 dní. Zeptejte se lékárníka, jak zlikvidovat již nepotřebné léky a inhalátory.
• Tobolky nepolykejte. Prášek v tobolkách se inhaluje.
• Tobolky musí vždy zůstat v blistru až do jejich použití. Nevyjímejte tobolky z blistru v předstihu.
• Pokud není používán, uchovávejte inhalátor Podhaler v jeho pevně uzavřeném pouzdře.
1
Umyjte si ruce a důkladně je osušte.
2
• Těsně před použitím vyjměte inhalátor Podhaler z jeho pouzdra, podržte základnu a vyšroubujte vrchní část pouzdra proti směru hodinových ručiček.
• Odložte vrchní část pouzdra stranou.
• Inhalátor zběžně prohlédněte, abyste se ujistil(a), že není poškozen nebo znečištěn.
• Postavte inhalátor na základnu.
3.
• Držte tělo inhalátoru a odšroubujte náústek proti směru hodinových ručiček.
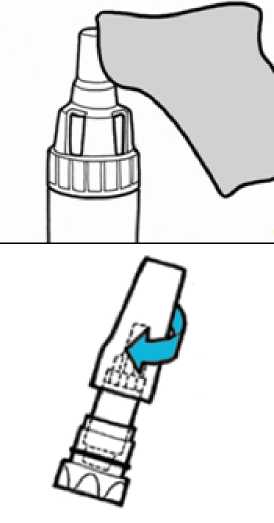
• Odložte náústek stranou na čistou a suchou plochu.
4.
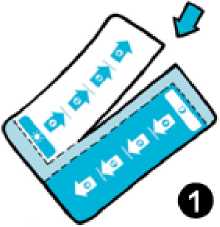
Odtrhněte podle perforace nejdříve podle delší strany blistru a následně podle kratší strany, jak je znázorněno na obrázcích 1 a 2.
5.
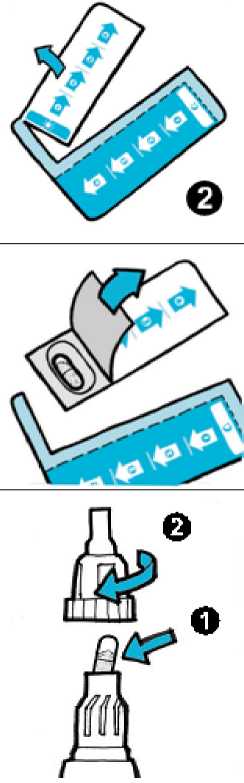
• Stáhněte fólii z blistru a odhalte pouze jednu tobolku.
• Vyjměte tobolku z blistru.
6.
• Vložte tobolku vzpřímeně do inhalační komory (1).
• Nasaďte náústek.
• Náústek pevně našroubujte do zastavení. Příliš neutahujte (2).
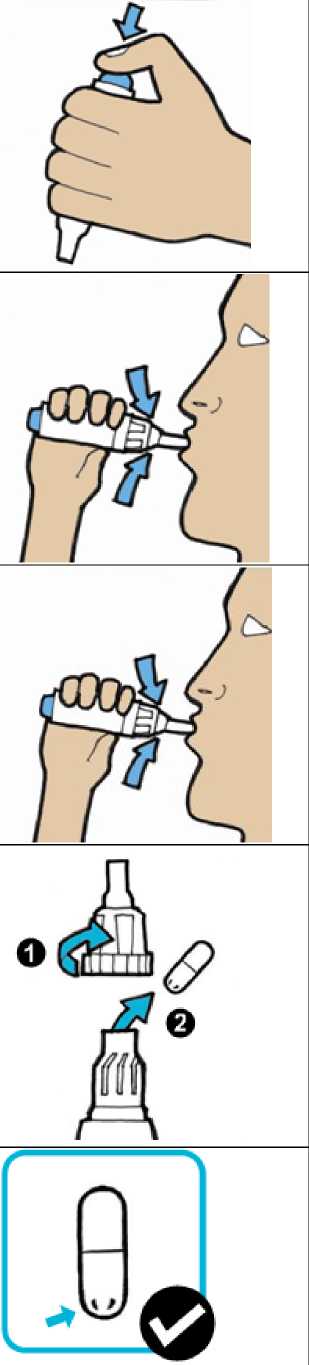
9.
10.
11.
7
8
• Držte inhalátor s náústkem směřujícím dolů.
• Abyste propíchl(a) tobolku, stiskněte pevně palcem modré tlačítko na doraz, potom tlačítko povolte.
• Nyní jste připraveni inhalovat tobolku na 2 oddělené nádechy (kroky 8 a 9).
Inhalujte tobolku - 1. nádech:
Před vložením náústku do úst zhluboka vydechněte směrem od inhalátoru.
Vložte náústek do úst - pevně stiskněte rty.
Inhalujte prášek zhluboka jedním nádechem.
Vyjměte inhalátor z úst a zadržte dech na zhruba 5 vteřin. Potom normálně vydechněte směrem od inhalátoru.
Inhalujte tobolku - 2. nádech:
• Párkrát se normálně nadechněte a vydechněte směrem od inhalátoru.
• Pokud jste připraven(a) na druhý nádech, opakujte krok 8 s použitím stejné tobolky.
Odšroubujte náústek (1) a vyjměte tobolku z komory (2).
Prohlédněte použitou tobolku. Má být propíchnutá a prázdná. Pokud je tobolka prázdná, zlikvidujte ji.
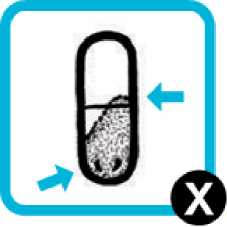
Pokud je tobolka propíchnutá, ale stále obsahuje nějaký prášek:
• Vložte tobolku zpět do komory inhalátoru (krok 6). Vložte ji propíchnutou stranou napřed.
• Nasaďte náústek a opakujte kroky 8, 9 a 10.
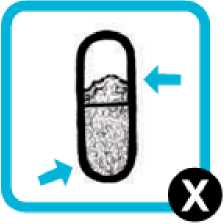
Pokud se tobolka zdá být nepropíchnutá:
• Vložte tobolku zpět do komory inhalátoru (krok 6).
• Nasaďte náústek a opakujte kroky 7, 8 a 9.
• Pokud je i poté tobolka stále plná a zdá se být nepropíchnutá, nahraďte inhalátor náhradním inhalátorem a opakujte 2, 3, 6, 7, 8, 9 a 10.

12.
Použijte další 3 tobolky stejným způsobem.
• Pro všechny zbývající tobolky opakujte kroky 5, 6, 7, 8, 9, 10 a 11.
• Všechny prázdné tobolky zlikvidujte.
13.
• Nasaďte náústek a pevně ho našroubujte do zastavení. Po inhalaci celé dávky (4 tobolky), otřete náústek suchou čistou látkou.
• Inhalátor nemyjte vodou.
14.
• Vložte inhalátor zpět do pouzdra.
• Pouzdro pevně uzavřete otáčením horní části pouzdra do jejího pevného uzavření.
PAMATUJTE:
• Pouze pro inhalační podání.
• Nepolykejte tobolky přípravku TOBI Podhaler.
• Používejte pouze inhalátor obsažený v tomto balení.
• Tobolky přípravku TOBI Podhaler vždy uchovávejte v blistru. Tobolku vyjměte pouze bezprostředně před použitím. Neuchovávejte tobolku v inhalátoru.
• Tobolky přípravku TOBI Podhaler a inhalátor vždy uchovávejte na suchém místě.
• Nikdy nevkládejte tobolku přípravku TOBI Podhaler přímo do náústku inhalátoru.
• Při propichování tobolky vždy držte inhalátor s náústkem směřujícím dolů.
• Nemačkejte propichovací tlačítko více než j ednou.
• Nikdy nefoukejte do náústku inhalátoru.
• Inhalátor Podhaler nikdy nemyjte vodou. Uchovávejte ho v pouzdře na suchém místě.
Doplňující informace
Občas mohou velmi malé úlomky tobolky projít přes sítko a dostat se do úst.
• Pokud k tomu dojde, můžete tyto úlomky cítit na j azyku.
• Spolknutí nebo inhalace těchto úlomků nepoškozuj e zdraví.
• Možnost roztříštění tobolky se zvyšuje, pokud je tobolka náhodně propíchnuta více než jednou nebo pokud nebudete v kroku 7 držet inhalátor s náústkem směřujícím dolů.
44