Thalidomide Celgene 50 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Thalidomide Celgene 50 mg tvrdé tobolky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje thalidomidum 50 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Bílé neprůhledné tobolky s označením „Thalidomide Celgene 50 mg“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Thalidomide Celgene v kombinaci s melfalanem a prednisonem jako léčba první volby pacientů ve věku > 65 let s neléčeným mnohočetným myelomem nebo pacientů neschopných podstoupit vysokodávkovou chemoterapii.
Předepisování a vydávání přípravku Thalidomide Celgene upravuje Program prevence početí pro Thalidomide Celgene (viz bod 4.4).
4.2 Dávkování a způsob podání
Léčbu thalidomidem musí zahájit a monitorovat lékař se zkušenostmi s používáním imunomodulačních nebo chemoterapeutických přípravků, který dokonale rozumí rizikům léčby thalidomidem a požadavkům na její monitorování (viz bod 4.4).
Dávkování
Doporučená dávka:
Doporučená dávka thalidomidu je 200 mg denně, perorálně.
Léčbu lze podávat v maximálním počtu 12 šestitýdenních cyklů (42 dní).
Tabulka 1: Počáteční dávky thalidomidu v kombinaci s melfalanem a prednisonem
|
Věk (roky) |
ANC (/^l) |
Počet trombocytů (/^l) |
Thalidomida,b |
Melfalanc,d,e |
Prednisonf | |
|
< 75 |
> 1 500 |
A |
> 100 000 |
200 mg denně |
0,25 mg/kg denně |
2 mg/kg denně |
|
< 75 |
< 1 500, ale > 1 000 |
NEBO |
< 100 000, ale > 50 000 |
200 mg denně |
0,125 mg/kg denně |
2 mg/kg denně |
|
> 75 |
> 1 500 |
A |
> 100 000 |
100 mg denně |
0,20 mg/kg |
2 mg/kg |
|
denně |
denně | |||||
|
> 75 |
< 1 500, ale > 1 000 |
NEBO |
< 100 000, ale > 50 000 |
100 mg denně |
0,10 mg/kg denně |
2 mg/kg denně |
a Dávkování thalidomidu je jednou denně před spaním 1. až 42. den každého 42denního cyklu.
b Vzhledem k sedativnímu účinku spojenému s thalidomidem, podání před spaním zlepšuje obecně snášenlivost přípravku. c Dávkování melfalanu je jednou denně 1. až 4. den každého 42denního cyklu.
d Dávkování melfalanu: snižte o 50 % u středně těžké renální insuficience (clearance kreatininu: > 30, ale < 50 ml/min) nebo těžké renální insuficience (CrCl: < 30 ml/min).
e Maximální denní dávka melfalanu: 24 mg (pacienti < 75 let) nebo 20 mg (pacienti > 75 let). f Dávkování prednisonu je jednou denně 1. až 4. den každého 42denního cyklu.
U pacientů je třeba sledovat následující ukazatele: tromboembolické příhody, periferní neuropatie, kožní reakce a vyrážky, bradykardie, synkopa, ospalost, neutropenie a trombocytopenie (viz bod 4.4 a 4.8). V případě potřeby je nutno cyklus oddálit nebo dávku snížit nebo léčbu přerušit v závislosti na stupni toxicity podle NCI CTC (Obecná kritéria toxicity podle amerického Národního ústavu pro výzkum rakoviny).
Tromboembolické příhody
Profylaktické podávání antitrombotik má trvat nejméně po dobu prvních 5 měsíců léčby zejména u pacientů s dalšími rizikovými trombotickými faktory. Doporučuje se profylaktické podávání antitrombotik, například nízkomolekulárních heparinů nebo warfarinu. O profylaktickém podávání antitrombotik by mělo být rozhodnuto po pečlivém zhodnocení základních rizikových faktorů u jednotlivých pacientů (viz bod 4.4, 4.5 a 4.8).
Pokud u pacienta dojde k jakékoli tromboembolické příhodě, musí být léčba přerušena a musí být zahájena standardní antikoagulační terapie. Po stabilizaci pacienta pomocí antikoagulační léčby a po zvládnutí všech komplikací tromboembolické příhody lze opět zahájit léčbu thalidomidem původní dávkou v závislosti na posouzení přínosů a rizik. Během léčby thalidomidem musí u pacienta pokračovat antikoagulační léčba.
Neutropenie
Počet a diferenciální rozpočet leukocytů je třeba průběžně sledovat v souladu s doporučeními pro onkologickou léčbu, a to zejména u pacientů, kteří mohou mít sklon k neutropenii. V případě potřeby je nutno cyklus oddálit nebo dávku snížit nebo léčbu přerušit v závislosti na stupni toxicity podle NCI CTC.
Trombocytopenie
Počet trombocytů je třeba průběžně sledovat v souladu s doporučeními pro onkologickou léčbu. V případě potřeby je nutno cyklus oddálit nebo dávku snížit nebo léčbu přerušit v závislosti na stupni toxicity podle NCI CTC.
Periferní neuropatie
Úpravy dávky v případě periferní neuropatie jsou popsány v tabulce 2.
Tabulka 2: Doporučené úpravy dávky při neuropatii související s léčbou přípravkem Thalidomide Celgene v první linii léčby mnohočetného myelomu
|
Závažnost neuropatie |
Úprava dávky a podávání |
|
1. stupeň (parestézie, slabost, případně ztráta reflexů) bez ztráty funkce |
Pacienta trvale sledujte za použití klinických vyšetření. Pokud se symptomy zhorší, zvažte snížení dávky. Po snížení dávky však nutně nemusí dojít ke zlepšení symptomů. |
|
2. stupeň (změněné funkce, ale denní aktivity v běžném životě nenarušeny) |
Snižte dávku nebo přerušte léčbu a pokračujte ve sledování pacienta pomocí klinických a |
|
neurologických vyšetření. Pokud nedojde ke zlepšení nebo pokud se neuropatie nadále zhoršuje, přerušte léčbu. Pokud se neuropatie zlepší na 1. stupeň závažnosti, nebo dojde-li ještě k většímu zlepšení, léčbu lze opět zahájit dávkou za předpokladu příznivého poměru přínosů a rizik. | |
|
3. stupeň (denní aktivity v běžném životě ovlivněny) |
Přerušte léčbu |
|
4. stupeň (invalidizující neuropatie) |
Přerušte léčbu |
Starší populace
Žádné specifické úpravy dávky pro pacienty < 75 let nejsou doporučeny. Pro pacienty > 75 let je doporučena počáteční dávka thalidomidu 100 mg na den. Úvodní dávka melfalanu je u pacientů > 75 let snížena s ohledem na stávající rezervy kostní dřeně a s ohledem na renální funkci. Doporučená počáteční dávka melfalanu je 0,1 až 0,2 mg/kg denně s ohledem na rezervy kostní dřeně, ale dále se snižuje o 50 % při středně těžké renální insuficienci (clearance kreatininu: > 30, ale < 50 ml/min) nebo těžké renální insuficienci (CrCl: < 30 ml/min). Pro pacienty > 75 let je stanovena maximální denní dávka melfalanu 20 mg (viz tabulka 1).
Pacienti s poruchou funkce ledvin nebo jater
Účinky přípravku Thalidomide Celgene u pacientů s poruchou funkce ledvin nebo jater nebyly formálně zkoumány a pro tuto skupinu neexistují specifická dávkovací doporučení. U pacientů se závažným poškozením orgánů by se měly pečlivě sledovat nežádoucí účinky.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Thalidomide Celgene u pediatrické populace v indikaci mnohočetného myelomu.
Způsob podání
Thalidomide Celgene by měl být užíván v jediné dávce před spaním, aby se snížil vliv ospalosti. Tento léčivý přípravek lze užívat s jídlem nebo bez jídla.
4.3 Kontraindikace
- Hypersenzitivita na thalidomid nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
- Těhotné ženy (viz bod 4.6).
- Ženy ve fertilním věku, pokud nejsou splněny všechny podmínky Programu prevence početí pro Thalidomide Celgene (viz bod 4.4 a 4.6).
- Pacienti, kteří nejsou schopni nebo ochotni plnit požadovaná antikoncepční opatření (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Teratogenní účinky
Thalidomid je silný lidský teratogen, který způsobuje časté těžké a život ohrožující vrozené vady. Thalidomid nikdy nesmějí užívat ženy, které jsou těhotné nebo ženy, které by mohly otěhotnět, pokud nejsou splněny všechny podmínky Programu prevence početí pro Thalidomide Celgene Podmínky Programu prevence početí pro Thalidomide Celgene musí splňovat všichni pacienti, tj muži i ženy._
Kritéria pro ženu, která nemůže otěhotnět
Pacientka nebo partnerka pacienta-muže je považována za schopnou otěhotnět, pokud nesplňuje alespoň jedno z následujících kritérií:
• věk > 50 let a přirozená amenorea po dobu > 1 roku*;
• předčasné selhání vaječníků potvrzené gynekologem;
• předchozí oboustranná adnexektomie nebo hysterektomie;
• genotyp XY, Turnerův syndrom, ageneze dělohy.
*Amenorea po protinádorové terapii nevylučuje možnost otěhotnění pacientky.
Poradenství
U žen ve fertilním věku je thalidomid kontraindikován, pokud nejsou splněny všechny následující podmínky:
• Žena si je vědoma teratogenního rizika pro nenarozené dítě.
• Žena chápe nutnost účinné antikoncepce praktikované bez přerušení po 4 týdny před začátkem léčby, v celém průběhu léčby a 4 týdny po ukončení léčby.
• I když má fertilní žena amenoreu, musí používat účinnou antikoncepci.
• Žena musí být schopna dodržovat účinná antikoncepční opatření.
• Žena je informována o potenciálních následcích těhotenství a nutnosti rychle informovat lékaře, pokud hrozí riziko těhotenství, a je si těchto skutečností vědoma.
• Žena chápe nutnost zahájení léčby ihned po vydání thalidomidu, kterému předchází negativní těhotenský test.
• Žena chápe nutnost a je ochotna absolvovat těhotenské testy každé 4 týdny.
• Žena potvrdí, že si je vědoma rizik a nutných bezpečnostních opatření spojených s užíváním thalidomidu.
Protože je thalidomid přítomen ve spermatu, muži užívající thalidomid musí splňovat následující podmínky:
• Být si vědomi teratogenního rizika při pohlavním styku s těhotnou ženou.
• Chápat nutnost používání kondomu, pokud mají pohlavní styk s těhotnou ženou nebo s ženou, která může otěhotnět a která nepoužívá účinnou antikoncepci.
Předepisující lékař musí zajistit, že:
• Pacientka dodržuje podmínky Programu prevence početí pro Thalidomide Celgene.
• Pacient/pacientka potvrdí, že rozumí výše uvedeným podmínkám.
Antikoncepce
Ženy ve fertilním věku musí používat jednu účinnou metodu antikoncepce po dobu 4 týdnů před léčbou, během léčby a 4 týdny po léčbě thalidomidem, a také po dobu případného přerušení léčby, pokud se nezavážou k absolutní nepřerušované pohlavní abstinenci, kterou musí každý měsíc potvrdit. Pokud pacientka nepoužívá účinnou antikoncepci, musí být odkázána pokud možno k vyškolenému zdravotníkovi, který jí s výběrem antikoncepční metody poradí, aby antikoncepce mohla být zahájena.
Vhodné účinné metody antikoncepce jsou například následující:
• podkožní hormonální implantát;
• nitroděložní tělísko uvolňující levonorgestrel;
• postupně se uvolňující depozit medroxyprogesteron-acetátu;
• podvaz vejcovodů;
• pohlavní styk výhradně s mužem po vasektomii, přičemž vasektomie musí být potvrzena dvěma
negativními testy semene;
• antikoncepční tablety inhibující ovulaci obsahující pouze progesteron (tj. desogestrel).
Vzhledem ke zvýšenému riziku žilní tromboembolie u pacientek s mnohočetným myelomem užívajících thalidomid se kombinovaná perorální antikoncepce nedoporučuje (viz také bod 4.5). Pokud pacientka v současnosti používá kombinovanou perorální antikoncepci, je třeba přejít na některou z účinných antikoncepčních metod uvedených výše. Riziko žilní tromboembolie trvá po dobu 4-6 týdnů po ukončení kombinované perorální antikoncepce.
Těhotenské testy
Je třeba zajistit provádění těhotenských testů s minimální citlivostí 25 mIU/ml pod dohledem lékaře u žen, které mohou otěhotnět, jak je uvedeno níže. Tento požadavek se týká také žen v plodném věku, které praktikují úplnou a kontinuální abstinenci.
Před zahájením léčby
Je třeba provést těhotenský test pod lékařským dohledem při návštěvě lékaře, kdy je thalidomid předepsán, nebo ve 3 dnech předcházejících návštěvě u předepisujícího lékaře a zároveň poté, co pacientka nejméně 4 týdny užívala účinnou antikoncepci. Test musí potvrdit, že pacientka není v době zahájení léčby thalidomidem těhotná.
Průběžné sledování a ukončené léčby
Těhotenský test pod lékařským dohledem musí být opakován každé 4 týdny včetně 4 týdnů po ukončení léčby. Tyto těhotenské testy je třeba provést v den předepsání přípravku nebo během 3 dnů před návštěvou předepisujícího lékaře.
Muži
Protože je thalidomid přítomen ve spermatu, všichni pacienti mužského pohlaví musí používat kondom po celou dobu léčby a 1 týden po přerušení a/nebo ukončení léčby, je-li jejich partnerka těhotná nebo ve fertilním věku a nepoužívá účinnou antikoncepci.
Omezení při předepisování a vydávání léčiva
Počet předpisů léčivého přípravku Thalidomide Celgene pro ženy v fertilním věku by měl být omezen na čtyřtýdenní léčbu. K další léčbě je nutný nový lékařský předpis. Je ideální, aby byl ve stejný den proveden těhotenský test a lék předepsán i vydán. Vydání thalidomidu by se mělo provést maximálně do 7 dní od předepsání.
U všech ostatních pacientů má být předpis přípravku Thalidomide Celgene omezen na dvanáctitýdenní léčbu a pokračování v léčbě vyžaduje nový předpis.
Další opatření
Pacienti musí být poučeni, aby tento léčivý přípravek nikdy nedávali jiným osobám a aby všechny nepoužité tobolky vrátili na konci léčby lékárníkovi.
Pacienti nesmí darovat krev ani sperma během léčby a 1 týden po ukončení léčby thalidomidem. Informační materiály
Držitel rozhodnutí o registraci poskytne zdravotnickým pracovníkům informační materiály, aby poradili pacientům, jak zabránit působení thalidomidu na plod, a poskytli jim důležité informace týkající se bezpečnosti. Program prevence početí pro Thalidomide Celgene zdůrazňuje varování před možnými teratogenními účinky thalidomidu, poskytuje rady ohledně antikoncepce před začátkem léčby a poučení o nutnosti provádění těhotenských testů. Lékař musí ženám, které mohou otěhotnět, (a podle potřeby i mužským pacientům) poskytnout úplné informace o potenciálním teratogenním riziku a antikoncepčních opatřeních tak, jak jsou uvedeny v Programu prevence početí pro Thalidomide Celgene.
Amenorea
Použití thalidomidu může být spojeno s poruchami menstruace včetně amenorey. Je třeba však předpokládat, že amenorea v průběhu léčby thalidomidem je důsledkem těhotenství, dokud se lékařsky nepotvrdí, že pacientka není těhotná. Jasný mechanismus, kterým může thalidomid vyvolat amenoreu, není objasněn. Hlášené případy se objevily u mladých žen (před menopauzou) (střední věk 36 let), které byly léčeny přípravkem thalidomid v jiných indikacích, než je léčba mnohočetného myelomu, jejich výskyt byl pozorován do 6 měsíců od započetí léčby a ustoupily po vysazení thalidomidu.
V dokumentovaných případech hlášení s provedeným hormonálním vyšetřením byl případ amenorey spojen se sníženými hladinami estradiolu a zvýšenými hladinami FSH/LH. Pokud bylo provedeno další vyšetření, antiovariální protilátky byly negativní a hladina prolaktinu byla v normálním rozmezí.
Kardiovaskulární poruchy
Infarkt myokardu
Infarkt myokardu (IM) byl hlášen u pacientů užívajících thalidomid, zejména u pacientů se známými rizikovými faktory. Pacienty se známými rizikovými faktory IM, včetně dříve prodělané trombózy, je třeba pozorně sledovat a je nutné učinit taková opatření, aby se pokud možno minimalizovaly veškeré modifikovatelné rizikové faktory (např. kouření, hypertenze a hyperlipidemie).
Žilní a tepenné tromboembolické _příhody
Pacienti léčení thalidomidem mají zvýšené riziko žilní tromboembolie (např. hluboká žilní trombóza a plicní embolie) a tepenné tromboembolie (např. infarkt myokardu a cévní mozková příhoda) (viz bod 4.8). Riziko je pravděpodobně nejvyšší v prvních 5 měsících léčby. Doporučení pro antitrombotickou profylaxi a dávkování antikoagulační léčby jsou obsažena v bodě 4.2.
Tromboembolické příhody v anamnéze nebo současné podávání erytropoetických látek nebo jiných látek, jakými jsou například hormonální substituční terapie, mohou u těchto pacientů také zvýšit riziko výskytu tromboembolie. Tyto látky by se proto u pacientů s mnohočetným myelomem, kteří se léčí thalidomidem v kombinaci s prednisonem a melfalanem, měly používat opatrně. Obzvláště nutné je přerušit podávání erytropoetických látek, pokud jsou zjištěny hladiny hemoglobinu nad 12 g/dl. Je nutné učinit taková opatření, aby se pokud možno minimalizovaly veškeré modifikovatelné rizikové faktory (např. kouření, hypertenze a hyperlipidemie).
Pacientům a lékařům se doporučuje, aby si všímali jakýchkoliv známek nebo symptomů tromboembolismu. Pacienti by měli být poučeni o tom, aby v případě takových příznaků, jakými je dušnost, bolest na hrudi, otoky paží nebo nohou, vyhledali lékařskou pomoc.
Periferní neuropatie
Periferní neuropatie je velmi častý a potenciálně závažný nežádoucí účinek léčby thalidomidem, který může způsobit nevratné poškození (viz bod 4.8). Ve studii fáze 3 byla střední doba do vzniku první neuropatie 42,3 týdnů.
Pokud se u pacienta vyskytne periferní neuropatie, dodržujte dávku a pokyn o úpravě dávky a dávkovacího schematu uvedený v bodě 4.2.
Doporučuje se u pacientů pečlivě sledovat výskyt symptomů neuropatie. Mezi tyto symptomy patří parestézie, dysestézie, neklid, abnormální koordinace nebo slabost.
Před zahájením léčby thalidomidem se doporučuje provést klinické a neurologické vyšetření pacienta a během léčby provádět pravidelné sledování. Při předepisování léčivých přípravků se známou souvislostí s neuropatií pacientům užívajícím thalidomid musí lékař postupovat obezřetně (viz bod 4.5).
Thalidomid také může potenciálně zhoršit existující neuropatii, a proto se nesmí používat u pacientů s klinickými známkami nebo příznaky periferní neuropatie, pokud klinické přínosy této léčby nepřevyšují její rizika.
Synkopa, bradvkardie a atrioventrikulámí blok
U pacientů je třeba sledovat potenciální výskyt synkopy, bradykardie a atrioventrikulárního bloku; může být potřeba snížit dávku nebo přerušit léčbu.
Plicní hypertenze
U pacientů léčených thalidomidem byly hlášeny případy plicní hypertenze, z nichž některé byly fatální. Před zahájením léčby thalidomidem a v jejím průběhu je nutné vyhodnotit stav pacienta z hlediska výskytu známek a příznaků základního kardiopulmonálního onemocnění.
Hematologické poruchy
Neutropenie
Incidence neutropenie 3. a 4. stupně, která byla hlášena jako nežádoucí účinky, byla vyšší u pacientů s mnohočetným myelomem léčených MPT (melfalanem, prednisonem a thalidomidem) než u pacientů léčených MP (melfalanem a prednisonem): 42,7 %, resp. 29,5 % (studie IFM 99-06). Nežádoucí účinky hlášené po uvedení přípravku na trh, jako jsou febrilní neutropenie a pancytopenie, byly hlášeny při léčbě thalidomidem. Pacienty je třeba sledovat a může být nutné cyklus oddálit nebo dávku snížit nebo léčbu přerušit (viz bod 4.2).
Trombocytopenie
Trombocytopenie, včetně nežádoucích účinků 3. a 4. stupně, byla hlášena u pacientů s mnohočetným myelomem léčených MPT. Pacienty je třeba sledovat a může být nutné cyklus oddálit nebo dávku snížit nebo léčbu přerušit (viz bod 4.2). Pacientům a lékařům se doporučuje sledovat možné známky a příznaky krvácení, včetně petechií, epistaxe a gastrointestinálního krvácení, zvláště v případě současně podávané medikace, která je schopna vyvolat krvácení (viz bod 4.8).
Jaterní poruchy
Byly hlášeny jaterní poruchy, především abnormální výsledky vyšetření jaterní funkce. Nebyla zjištěna žádná specifická souvislost mezi hepatocelulárními a cholestatickými abnormalitami; v některých případech se oba typy abnormalit vyskytovaly současně. Většina reakcí se vyskytla během prvních 2 měsíců léčby a po ukončení léčby thalidomidem spontánně odezněla bez další léčby. U pacientů je nutné sledovat jaterní funkce, a to zejména v případě preexistující jaterní poruchy nebo souběžného podávání medikace, která by mohla navodit jaterní dysfunkci (viz bod 4.8).
Kožní reakce
Pokud se u pacienta kdykoli vyskytne toxická kožní reakce (např. Stevens-Johnsonův syndrom), je třeba léčbu ukončit.
Ospalost
Thalidomid často způsobuje ospalost. Pacienti musí být poučeni, aby se vyhnuli situacím, ve kterých může ospalost způsobovat problémy, a aby se poradili s lékařem, než začnou brát léky, o nichž je známo, že způsobují ospalost. Pacienti by měli být sledováni, přičemž může být rovněž nutné snížení dávek.
Pacienti by měli být poučeni o potenciálním zhoršení duševních, případně fyzických schopností nezbytných k provádění nebezpečných úkonů (viz bod 4.7).
Syndrom nádorového rozpadu
U pacientů s vysokým nádorovým zatížením před započetím léčby je riziko vzniku syndromu nádorového rozpadu. Tyto pacienty je třeba pozorně sledovat a přijmout příslušná opatření.
Infekce
Pacienty je třeba sledovat z hlediska možného rozvoje závažných infekcí včetně sepse a septického šoku.
Případy reaktivace viru, včetně závažných případů herpes zoster a nebo reaktivace viru hepatitidy B (HBV), byly hlášeny u pacientů léčených thalidomidem.
Některé případy reaktivace viru herpes zoster vedly k diseminovanému onemocnění herpes zoster. Tento stav vyžadoval dočasné pozastavení léčby thalidomidem a adekvátní antivirovou léčbu.
Některé z případů reaktivace HBV progredovaly do akutního selhání jater a vedly k ukončení léčby thalidomidem. Před zahájením léčby thalidomidem je třeba určit stav viru hepatitidy B. U pacientů, jejichž vyšetření je pozitivní na infekci HBV, se doporučuje konzultace s odborníkem na léčbu hepatitidy B.
Pacienty je třeba pečlivě sledovat z hlediska známek a příznaků virové reaktivace, včetně aktivní infekce HBV v průběhu terapie.
Akutní myeloidní leukemie (AML) a mvelodvsplastické syndromy (MDS)
V probíhající klinické studii bylo u pacientů s dosud neléčeným mnohočetným mylomem, kteří dostávají kombinaci melfalanu, prednisonu a thalidomidu (MPT), pozorováno statisticky významné zvýšení výskytu AML a MDS. Riziko se časem zvyšuje a činilo přibližně 2 % po dvou letech
a přibližně 4 % po třech letech léčby. U pacientů s nově diagnostikovaným mnohočetným myelomem (MM) užívajících lenalidomid bylo také pozorováno zvýšené riziko dalších primárních malignit (SPM).
V rámci invazivních SPM byly případy MDS/AML pozorovány u pacientů užívajících lenalidomid v kombinaci s melfalanem nebo bezprostředně po vysoké dávce melfalanu a autologní transplantaci kmenových buněk.
Před zahájením léčby thalidomidem v kombinaci s melfalanem a prednisonem je nutné vzít v úvahu přínosy dosažené podáváním thalidomidu a riziko AML a MDS. Lékař by měl stav pacienta pečlivě vyhodnotit před léčbou a v jejím průběhu, za použití standardního screeningu nádorů a zahájit léčbu podle indikace.
Pacienti s poruchou funkce ledvin nebo jater
Studie provedené u zdravých jedinců a u pacientů s mnohočetným myelomem naznačují, že thalidomid nijak významně neovlivnuje funkci ledvin nebo jater (viz bod 5.2). U pacientů se zhoršenou funkcí ledvin a jater však formální studie nebyly provedeny, proto by se měly u pacientů s těžkou poruchou funkce ledvin a jater pečlivě sledovat jakékoli nežádoucí účinky.
Alergické reakce
Byly hlášeny případy alergických reakcí/angioedému. Při výskytu kožní vyrážky je nutno léčbu thalidomidem přerušit; opět zahájena může být pouze po náležitém zhodnocení klinického stavu.
Pokud dojde k výskytu angioedému, užívání thalidomidu nesmí být znovu zahájeno.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Thalidomid není metabolizován enzymy cytochromu P450, a proto jsou klinicky významné interakce s léčivými přípravky, které jsou inhibitory nebo induktory tohoto enzymatického systému nepravděpodobné. Neenzymatická hydrolýza thalidomidu, která je hlavním mechanismem jeho clearance, naznačuje, že potenciál pro lékové interakce s thalidomidem je nízký.
Zesílení sedativních účinků jiných léčivých přípravků
Thalidomid má sedativní účinky, a proto může zesilovat sedaci navozenou anxiolytiky, hypnotiky,
antipsychotiky, antihistaminiky Hi, opioidními deriváty, barbituráty a alkoholem. Při podávání thalidomidu v kombinaci s léčivými přípravky způsobujícími ospalost je třeba postupovat opatrně.
Vlivy způsobující bradykardii
V důsledku potenciálu thalidomidu navodit bradykardii je třeba postupovat obezřetně při předepisování léčivých přípravků se stejným farmakodynamickým účinkem, jako jsou léčivé látky, o nichž je známo, že mohou navodit arytmii typu torsade de pointes, například betablokátory nebo inhibitory cholinesterázy.
Léčivé přípravky, o nichž je známo, že vyvolávají periferní neuropatii
Při předepisování léčivých přípravků se známou souvislostí s periferní neuropatií (např. vinkristin a bortezomib) pacientům užívajícím thalidomid je třeba postupovat obezřetně.
Hormonální antikoncepce
Thalidomid nemá interakce s přípravky s hormonálními kontraceptivy. U 10 zdravých žen byla provedena studie farmakokinetických profilů norethindronu a ethinylestradiolu po podání jedné dávky obsahující 1,0 mg norethindron-acetátu a 0,75 mg ethinylestradiolu. Výsledky byly podobné jak při přidání thalidomidu v dávce 200 mg/den až do ustáleného stavu, tak bez tohoto přídavku. Nicméně vzhledem ke zvýšenému riziku žilní tromboembolie se kombinovaná perorální antikoncepce nedoporučuje.
Warfarin
Současné podávání opakovaných dávek 200 mg thalidomidu jednou denně po dobu 4 dní nemělo vliv na hodnotu INR u zdravých dobrovolníků. Nicméně v důsledku zvýšeného rizika trombózy u onkologických pacientů a kvůli zrychlení metabolismu warfarinu působením kortikosteroidů je třeba během léčby kombinací thalidomidu a prednisonu a po dobu jednoho týdne po ukončení této léčby pečlivě sledovat hodnoty INR.
Digoxin
Thalidomid nemá interakce s digoxinem. Současné podávání opakovaných dávek 200 mg thalidomidu nemělo žádný zjevný vliv na farmakokinetiku jedné dávky digoxinu u 18 zdravých dobrovolníků mužského pohlaví. Kromě toho jednorázové podání 0,5 mg digoxinu nemělo žádný zjevný vliv na farmakokinetiku thalidomidu. Není známo, zdali výsledek bude jiný u pacientů s mnohočetným myelomem.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku/antikoncepce u mužů a žen
Ženy ve fertilním věku musí používat jednu účinnou metodu antikoncepce po 4 týdny před léčbou, během léčby a 4 týdny po léčbě thalidomidem (viz bod 4.4). Pokud žena léčená thalidomidem otěhotní, léčbu je nutno okamžitě ukončit a pacientku odeslat k lékaři se specializací nebo praxí v teratologii, který provede odborné vyšetření a poskytne potřebnou radu.
Protože je thalidomid přítomen ve spermatu,všichni pacienti mužského pohlaví musí během pohlavního styku s těhotnou ženou nebo ženou ve fertilním věku, jež nepoužívá účinnou metodu antikoncepce, používat kondom po celou dobu léčby a 1 týden po přerušení a/nebo ukončení léčby. Pokud partnerka muže užívajícího thalidomid otěhotní, měla by být odeslána k lékaři, který se specializuje nebo má zkušenosti s teratologií, za účelem vyšetření a poskytnutí potřebných informací.
Thalidomid je kontraindikován u těhotných žen a u žen ve fertilním věku, pokud nejsou splněny všechny podmínky Programu prevence početí pro Thalidomide Celgene (viz bod 4.3).
Thalidomid je silný lidský teratogen, který způsobuje vysoký výskyt (cca 30 %) těžkých a život ohrožující vrozených vad, jako jsou: ektromelie (amelie, fokomelie, hemimelie) horních a/nebo dolních končetin, mikrocie s abnormalitou vnějšího ústí zvukovodu (uzavřené nebo chybějící), léze středního a vnitřního ucha (méně časté), léze oka (anoftalmie, mikroftalmie), vrozené srdeční onemocnění a abnormality ledvin. Byly také popsány další, méně časté abnormality.
Kojení
Není známo, zda se thalidomid vylučuje do lidského mateřského mléka. Studie na zvířatech ukázaly, že se thalidomid do mléka vylučuje. Kojení by proto během léčby thalidomidem mělo být přerušeno.
Fertilita
Studie na králících nezjistila žádné účinky na fertilitu u samců ani u samic, ačkoliv u samců byla pozorována degenerace varlat.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Thalidomide Celgene má malý nebo mírný vliv na schopnost řídit a obsluhovat stroje. Thalidomid může způsobovat únavu, závratě, ospalost a rozmazané vidění (viz bod 4.8). Pacienti mají být poučeni, že pokud při léčbě thalidomidem pociťují tyto příznaky, nemají řídit, obsluhovat stroje ani provádět nebezpečné úkony.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
U většiny pacientů užívajících thalidomid se dá předpokládat výskyt nežádoucích účinků. Nejčastěji pozorované nežádoucí účinky spojené s užíváním thalidomidu v kombinaci s melfalanem a prednisonem jsou: neutropenie, leukopenie, zácpa, ospalost, parastézie, periferní neuropatie, anémie, lymfopenie, trombocytopenie, závratě, dysestézie, třes a periferní edém.
Kromě nežádoucích účinků uvedených výše byly v jiných klinických studiích thalidomidu v kombinaci s dexamethazonem zjištěny velmi časté nežádoucí účinky zahrnující únavu, dále časté nežádoucí účinky, mezi něž patřily tranzitorní ischemická příhoda, synkopa, vertigo, hypotenze, změny nálady, úzkost, rozmazané vidění, nauzea a dyspepsie, a méně časté nežádoucí účinky, mezi něž patřily cévní mozková příhoda, perforace divertiklu, peritotinida, ortostatická hypotenze a bronchitida.
Ke klinicky významným nežádoucím účinkům spojeným s užíváním thalidomidu v kombinaci s melfalanem a prednisonem anebo dexamethasonem patří: hluboká žilní trombóza a plicní embolie, periferní neuropatie, závažné kožní reakce zahrnující Stevens-Johnsonův syndrom a toxickou epidermální nekrolýzu, synkopa, bradykardie a závratě (viz bod 4.2, 4.4 a 4.5).
Tabulka se seznamem nežádoucích účinků
Tabulka 3 obsahuje pouze ty nežádoucí účinky, u nichž lze přiměřeným způsobem doložit příčinnou vazbu s léčbou léčivým přípravkem. Uvedená četnost je založena na pozorováních provedených během pivotní komparativní klinické studie, která zkoumala účinky thalidomidu v kombinaci s melfalanem a prednisonem u dříve neléčených pacientů trpících mnohočetným myelomem. Kromě nežádoucích účinků uvedených v pivotní studii jsou pod tabulkou 3 uvedeny nežádoucí účinky založené na zkušenostech po uvedení léčivého přípravku na trh.
Četnost je definována takto: velmi časté (>1/10), časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000) a není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 3: Výskyt nežádoucích účinků léčivého přípravku (ADR) při užívání thalidomidu v kombinaci s melfalanem a prednisonem
|
Třída orgánových systémů |
Všechny ADR |
|
Infekce a infestace |
Časté |
|
Poruchy krve a lymfatického systému |
Velmi časté Neutropenie Leukopenie Lymfopenie T rombocytopenie |
|
Psychiatrické poruchy |
Časté Stavy zmatenosti Deprese |
|
Poruchy nervového systému |
Velmi časté Periferní neuropatie* Závratě Parestézie Dysestézie Ospalost Časté Abnormální koordinace |
|
Srdeční poruchy |
Časté Srdeční selhání Bradykardie |
|
Cévní poruchy |
Časté Hluboká žilní trombóza* |
|
Respirační, hrudní a mediastinální poruchy |
Časté Plicní embolie* Plicní intersticiální onemocnění Bronchopneumopatie |
|
Gastrointestinální poruchy |
Velmi časté Zácpa Časté Zvracení Sucho v ústech |
|
Poruchy kůže a podkoží tkáně |
Časté Toxická kožní vyrážka Suchá kůže |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté Periferní edém Časté Pyrexie Astenie |
* viz bod 4.8 Popis vybraných nežádoucích účinků
Další nežádoucí účinky, které souvisely se zkušenostmi po uvedení thalidomidu na trh a nebyly zjištěny v pivotní studii, zahrnují: toxickou epidermální nekrolýzu (viz bod 4.4), obstrukci střeva, hypothyroidismus, sexuální dysfunkci, syndrom nádorového rozpadu (viz bod 4.4), gastrointestinální perforace, alergické reakce (hypersenzitivitu, angioedém/kopřivku) (viz bod 4.4), zhoršení sluchu nebo ztrátu sluchu, selhání ledvin, infarkt myokardu (viz bod 4.4), zhoršení příznaků Parkinsonovy choroby, závažné infekce (např. fatální sepsi včetně septického šoku) (viz bod 4.4), křeče, fibrilaci síní, atrioventrikulární blok (viz bod 4.4), poruchy menstruace včetně amenorey (viz bod 4.4), pankreatitidu, gastrointestinální krvácení (viz bod 4.4), jaterní poruchy (viz bod 4.4), PRES syndrom (posterior reversible encephalopathy syndrome), plicní hypertenzi (viz bod 4.4) a virové infekce, včetně infekce herpes zoster a nebo reaktivace viru hepatitidy B (viz bod 4.4).
Popis vybraných nežádoucích účinků
Poruchy krve a lymfatického systému
Nežádoucí hematologické účinky jsou uvedeny ve srovnání se skupinou léčenou porovnávanými přípravky, protože porovnávané přípravky mají významný vliv na tyto poruchy (tabulka 4).
Tabulka 4: Srovnání hematologických poruch pro kombinace melfalan, prednison (MP) a melfalan, prednison, thalidomid (MPT) ve studii IFM 99-06 (viz bod 5.1)
|
n (% pacientů) | ||
|
MP (n=193) |
MPT (n=124) | |
|
Stupně 3 a 4* | ||
|
Neutropenie |
57 (29,5) |
53 (42,7) |
|
Leukopenie |
32 (16,6) |
32 (25,8) |
|
28 (14,5) |
17 (13,7) | |
|
Lymfopenie |
14 (7,3) |
15 (12,1) |
|
Trombocytopenie |
19 (9,8) |
14 (11,3) |
* Kritéria WHO
Další nežádoucí účinky, které byly získané ze zkušeností po uvedení thalidomidu na trh a nebyly zjištěny v pivotní studii, zahrnují febrilní neutropenii a pancytopenii.
Teratogenita
Existuje extrémně vysoké riziko nitroděložního úmrtí plodu nebo závažných vrozených vad, primárně fokomelie. Thalidomid se v těhotenství nikdy nesmí užívat (viz bod 4.4 a 4.6).
Žilní a tepenné tromboembolické _příhody
U pacientů léčených thalidomidem bylo hlášeno zvýšené riziko žilní tromboembolie (např. hluboká žilní trombóza a plicní embolie) a tepenné tromboembolie (např. infarkt myokardu a cévní mozková příhoda) (viz bod 4.4).
Periferní neuropatie
Periferní neuropatie je velmi běžný a potenciálně závažný nežádoucí účinek léčby thalidomidem, který může způsobit nevratné poškození (viz bod 4.4). Periferní neuropatie se obvykle vyskytuje po dlouhodobém užívání po dobu několika měsíců. Existují však hlášení o výskytu po relativně krátké době užívání. Výskyt neuropatie vedoucí k ukončení léčby, snížení dávky nebo přerušení léčby se zvyšuje s kumulativní dávkou a dobou trvání léčby. Symptomy se mohou projevit nějaký čas po ukončení léčby thalidomidem a mohou ustupovat pomalu nebo vůbec ne.
PRES syndrom (posterior reversible encephalopathy syndrome) / reverzibilní syndrom okcipitální leukoencefalopatie (RPLS, reversible posterior leukoencephalopathy syndrome)
Byly hlášeny případy syndromu PRES/RPLS. Známky a příznaky zahrnovaly poruchu zraku, bolest hlavy, křeče a změněný duševní stav, s přidruženou hypertenzí nebo bez ní. Diagnózu syndromu
PRES/RPLS je nutné potvrdit vyšetřením mozku zobrazovací metodou. U většiny hlášených případů byly rozpoznány rizikové faktory syndromu PRES/RPLS, včetně hypertenze, poruchy funkce ledvin a souběžného užívání vysokých dávek kortikosteroidů a/nebo chemoterapie.
Akutní myeloidní leukemie (AML) a mvelodvsplastické syndromy (MDS)
AML a MDS byly hlášeny v probíhající klinické studii u pacientů s dříve neléčeným mnohočetným myelomem, kteří užívali kombinaci melfalanu, prednisonu a thalidomidu (viz bod 4.4).
Starší populace
Profil nežádoucích účinků hlášený u pacientů > 75 let léčených thalidomidem 100 mg jednou denně byl podobný profilu nežádoucích účinků pozorovanému u pacientů < 75 let léčených thalidomidem 200 mg jednou denně (viz tabulka 3). Nicméně u pacientů ve věku >75 let je potenciální riziko vyšší frekvence závažných nežádoucích účinků.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V literatuře bylo zaznamenáno osmnáct případů předávkování týkajících se dávek do 14,4 g. Nebyly zaznamenány žádné případy úmrtí a všichni předávkovaní pacienti se uzdravili bez následků. Pro předávkování thalidomidem neexistuje žádné specifické antidotum. V případě předávkování je nutno monitorovat vitální známky pacienta a vhodnou podpůrnou léčbou udržovat krevní tlak a dýchání.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: imunosupresivum, jiná imunosupresiva, ATC kód: L04AX02.
Thalidomid má chirální centrum a klinicky se používá jako racemát (+)-(R)- a (-)-(S)-thalidomid. Spektrum aktivity přípravku Thalidomide Celgene není dosud plně charakterizováno.
Mechanismus účinku
Thalidomid má imunomodulační a protizánětlivé účinky a potenciální protinádorové účinky. Údaje ze studií in vitro a z klinických studií naznačují, že imunomodulační, protizánětlivé a protinádorové účinky thalidomidu mohou být spojeny s potlačením nadměrné produkce tumor nekrotizujícího faktoru alfa (TNF- a), se snížením exprese určitých adhezívních molekul zúčastněných v procesu migrace leukocytů a s antiangiogenní aktivitou. Thalidomid je také nebarbiturátové hypnotické sedativum působící v CNS. Nemá antibakteriální účinky.
Klinická účinnost a bezpečnost
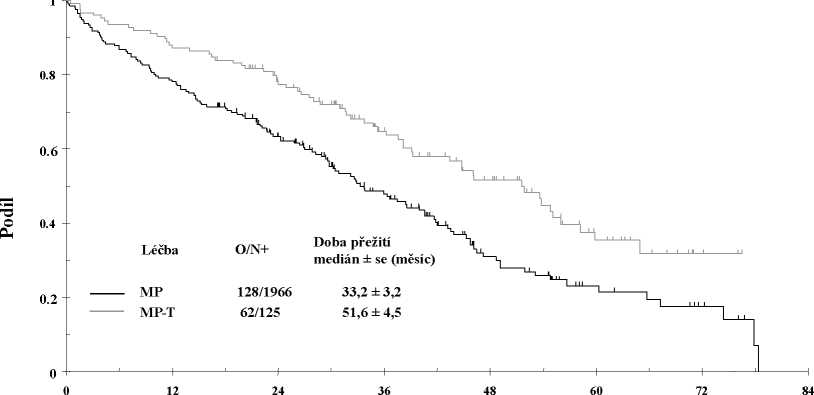
Výsledky randomizované, otevřené, multicentrické studie IFM 99-06 3. fáze s paralelními skupinami ukázaly prospěch v přežití při použití thalidomidu v kombinaci s melfalanem a prednisonem po dobu 12 cyklů po 6 týdnech při léčbě pacientů s čerstvě diagnostikovaným mnohočetným myelomem. Věk pacientů zahrnutých do této studie byl 65-75 let, přičemž 41 % (183 ze 447) pacientů mělo 70 nebo více let. Střední dávka thalidomidu byla 217 mg a více než 40 % pacientů absolvovalo 9 cyklů. Dávkování melfalanu bylo 0,25 mg/kg/den a prednisonu 2 mg/kg/den v 1. až 4. dni každého šestitýdenního cyklu.
Co se týče analýzy subjektů, kteří dokončili studii podle protokolu (per protocol analysis), byla provedena aktualizace pro studii IFM 99-06, jež po dalších 15 měsících poskytla podrobnější údaje. Střední celková doba přežití byla 51,6 ± 4,5 měsíců u supiny MPT a 33,2 ± 3,2 u skupiny MP (97,5% CI 0,42 až 0,84). Tento osmnáctiměsíční rozdíl byl statisticky významný se snížením rizika úmrtí u skupiny MPT o 0,59; 97,5% interval spolehlivosti 0,42-0,84 a hodnotou p <0,001 (viz obr. 1).
Obr. 1: Celkové přežití podle léčby
Doba od randomizace (měsíce)
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s thalidomidem u všech podskupin pediatrické populace s mnohočetným myelomem (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Absorpce thalidomidu po perorálním podání je pomalá. Maximální koncentrace v plazmě je dosaženo za 1-5 hodin po podání. Při podání s jídlem se zpozdila absorpce, ale nezměnil se celkový rozsah absorpce.
Distribuce
Bylo zjištěno, že enantiomer (+)-(R) se váže na plazmatické bílkoviny z 55 % a enantiomer (-)-(S) ze 65 %. Thalidomid je přítomen ve spermatu pacientů mužského pohlaví v koncentracích srovnatelných s koncentrací v plazmě. V důsledku známé teratogenní aktivity tohoto přípravku musí proto v průběhu léčby thalidomidem a 1 týden po jejím ukončení pacienti mužského pohlaví používat kondom, je-li jejich partnerka těhotná nebo ve fertilním věku a nepoužívá vhodnou metodu antikoncepce (viz bod 4.4). Distribuce thalidomidu není významně ovlivněna věkem, pohlavím, funkcí ledvin ani biochemickými hodnotami v krvi.
Biotransformace
Thalidomid je metabolizován téměř výhradně cestou non-enzymatické hydrolýzy. Thalidomid
v nezměněné formě představuje v plazmě 80 % cirkulujících složek. V moči byl nezměněný thalidomid obsažen minimálně (< 3 % dávky). Kromě thalidomidu jsou v plazmě a především v moči přítomny také produkty hydrolýzy N-(o-karboxybenzoyl) glutarimid a ftaloylisoglutamin, které vznikají při neezymatických procesech. Oxidační metabolismus nijak významně nepřispívá k celkovému metabolismu thalidomidu. Metabolismus thalidomidu v játrech, katalyzovaný cytochromem P450, je minimální. Existují in vitro údaje, které naznačují, že prednison může způsobit enzymatickou indukci, jež by mohla snížit celkovou expozici současně používaných léčivých přípravků. Není známo, zdali jsou tato zjištění relevantní pro situaci in vivo.
Eliminace
Průměrný eliminační poločas thalidomidu v plazmě po jednorázovém perorálním podání dávek 50 až 400 mg byl 5,5 až 7,3 hodiny. Po jednorázovém perorálním podání dávky 400 mg thalidomidu s radioaktivním izotopem bylo nalezeno k 8. dni po podání celkem průměrně 93,6 % podané dávky. Většina radioaktivní dávky byla vyloučena během 48 hodin po podání. Většina byla vyloučena močí (> 90 %), zatímco stolicí minimálně.
Mezi tělesnou hmotností a odhadovanou clearance thalidomidu existuje lineární vztah; u pacientů s mnohočetným myelomem s hmotností od 47 do 133 kg se clearence thalidomidu pohybovala v rozmezí 6-12 l/hod., což představuje nárůst clearence thalidomidu o 0,621 l/hod. na 10 kg tělesné hmotnosti.
Linearita/ nelinearita
Při jednorázovém podání je celková expozice AUC úměrná dávce. Nebyla pozorována žádná závislost farmakokinetiky na čase.
Porucha funkce jater a ledvin
Thalidomid je v minimimální míře metabolizován systémem jaterních cytochromů P450 a nezměněný thalidomid není vylučován ledvinami. Měření renální funkce (CLcr) a funkce jater (krevní testy) vykazují minimální vliv funkce ledvin a jater na farmakokinetiku thalidomidu. Nepředpokládá se, že by metabolismus thalidomidu jako takový byl ovlivněn dysfuncí jater nebo ledvin. Údaje od pacientů v terminálním stádiu onemocnění ledvin nenaznačují vliv funkce ledvin na farmakokinetiku thalidomidu. Avšak vzhledem k tomu, že farmakologicky aktivitní metabolity jsou vylučovány močí, doporučuje se, aby u pacientů s těžkou poruchou funkce ledvin byly pečlivě sledovány jakékoli nežádoucí účinky.
5.3 Předklinické údaje vztahující se k bezpečnosti
U psů (samců) bylo rok po podání dávky pozorováno reversibilní ucpání jaterních kanálků (canaliculi) žlučí při expozicích 1,9krát vyšších, než jsou expozice u lidí.
Studie na myších a potkanech zaznamenaly snížení počtu krevních destiček. Zdá se, že snížení počtu krevních destiček u potkanů je spojeno s užíváním thalidomidu a vyskytlo se při 2,4krát vyšších expozicích než je expozice u lidí. Toto snížení nevedlo ke klinickým příznakům.
V roční studii na psech (samicích) bylo zjištěno zvětšení a/nebo modrá diskolorace prsních žláz při expozici rovnající se 1,8násobku lidské expozice a prodloužené období říje (estrus) při expozicích rovnajících 3,6krát vyšších než je expozice u lidí. Relevance těchto nálezů pro člověka není známa.
Vliv thalidomidu na funkci štítné žlázy byl zkoumán na potkanech a psech. U psů nebyl pozorován žádný vliv, ale u potkanů byl zjištěn zjevný pokles celkového a volného T4, závislý na dávce, který měl konzistentnější povahu u samic.
Standardní baterie testů genotoxicity neukázala žádné mutagenní nebo genotoxické účinky při
hodnocení thalidomidu. Nebyly pozorovány žádné známky kancerogenity po expozicích přibližně 15násobku (myši), 13násobku (potkani-samci) a 39násobku (potkani-samice) odhadované klinické AUC při doporučené počáteční dávce.
Studie na laboratorních zvířatech ukázaly rozdíly v citlivosti vůči teratogenním účinkům thalidomidu u různých druhů. Teratogenní účinky thalidomidu u lidí jsou potvrzeny.
Studie na králících nezjistila žádné účinky na fertilitu u samců ani u samic, ačkoliv u samců byla pozorována degenerace varlat.
Studie perinatální a postnatální toxicity prováděná na králících při podávání thalidomidu o dávkách až 500 mg/kg/den měla za následek potraty, zvýšený počet mrtvě narozených mláďat a snížení životaschopnosti mláďat během laktace. Mláďata samic, jimž byl podáván thalidomid, měla vyšší četnost potratů, snížené váhové přírůstky, změny učení a paměti, sníženou plodnost a snížený index březosti.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky Předbobtnalý škrob Magnesium-stearát
Pouzdro tobolky Želatina
Oxid titaničitý (E171)
Potisková barva Šelak
Černý oxid železitý (E172)
Propylenglykol
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
5 let.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Blistr PVC/PCTFE/hliníková fólie, obsahující 14 tobolek Velikost balení: Krabička obsahující 28 tobolek (dva blistry).
6.6 Zvláštní opatření pro likvidaci přípravku
Veškeré nepoužité léčivo vraťte, prosím, po skončení léčby do lékárny.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Celgene Europe Limited 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/443/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 16. dubna 2008
Datum posledního prodloužení registrace: 16. dubna 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese: http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
__ V r r v
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
Penn Pharmaceutical Services Limited
Tafarnaubach Industrial Estate
Tredegar
Gwent
NP22 3AA
Velká Británie
Celgene Europe Limited 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Velká Británie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha 1: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP,
je možné je předložit současně.
• Další opatření k minimalizaci rizik
1. Držitel rozhodnutí o registraci si musí nechat schválit konkrétní body řízeného distribučního systému příslušnými orgány a musí tento program v rámci dané země dodržovat, aby zajistil, že:
o před uvedením přípravku na trh dostanou všichni lékaři, kteří budou předepisovat Thalidomide Celgene, a všichni lékárníci, kteří jej budou vydávat, sdělení adresované zdravotnickým pracovníkům, jak je popsáno níže
o před předepisováním (a, pokud je to relevantní a po domluvě s příslušným orgánem, před vydáváním) bude všem zdravotnickým pracovníkům, kteří budou předepisovat (a vydávat) Thalidomide Celgene, poskytnut informační balík pro zdravotnické pracovníky obsahující: o informační brožury pro zdravotnické pracovníky o informační brožury pro pacienty o průkazky pacientů
o souhrn údajů o přípravku, příbalovou informaci a označení na obalu
2. Držitel rozhodnutí o registraci musí realizovat Program prevence početí (Pregnancy Prevention Program, PPP) v každém členském státě. Podrobnosti PPP musí být odsouhlaseny příslušným orgánem v každém členském státě a zavedeny před uvedením léčivého přípravku na trh.
3. Držitel rozhodnutí o registraci si musí nechat schválit konečné znění textu Sdělení adresované zdravotnickým pracovníkům a informačního balíku pro zdravotnické pracovníky příslušným orgánem v každém členském státě ještě před uvedením léčivého přípravku na trh a zajistí, že materiály budou obsahovat klíčové prvky popsané níže.
4. Držitel rozhodnutí o registraci musí zavést systém průkazek pacientů v každém členském státě.
5. Držitel rozhodnutí o registraci zajistí, aby byly informační materiály poskytnuty a posouzeny národní organizací pacientů, nebo pokud taková organizace neexistuje nebo není schopna účasti, příslušnou skupinou pacientů. Tito pacienti by měli být pokud možno bez předchozí zkušenosti s léčbou thalidomidem. Výsledky uživatelského testování musí být poskytnuty příslušnému národnímu orgánu a konečné materiály ověřeny celonárodně.
6. Držitel rozhodnutí o registraci se před uvedením přípravku na trh musí dohodnout s každým členským státem také na:
o nejvhodnějších strategiích, jak monitorovat používání přípravku mimo schálenou indikaci v rámci území státu.
o sběru podrobných dat zahrnující alespoň demografii pacienta a indikaci za účelem
důkladného monitorování používání přípravku mimo schválenou indikaci v rámci území státu.
o zavedení národních opatření pro hodnocení účinnosti PPP a dodržování PPP.
7. Držitel rozhodnutí o registraci oznámí Evropské lékové agentuře (EMA) a příslušným národním zástupcům pacientů a obětí navrhované datum uvedení přípravku na trh před uvedením na trh v každém členském státě.
8. Držitel rozhodnutí o registraci bude v členských státech, kde se přípravek Thalidomide Celgene používá, distribuovat přímé sdělení zdravotnickým pracovníkům, které bude zdravotnické pracovníky informovat o riziku dalších primárních malignit (SPM) u pacientů léčených přípravkem Thalidomide Celgene, v souladu se svým plánem pro komunikaci.
Klíčové prvky, které budou zahrnuty
Sdělení adresované zdravotnickým pracovníkům
Sdělení adresované zdravotnickým pracovníkům bude obsahovat dvě části:
• Hlavní text tak, jak schválen Výborem pro humánní léčivé přípravky (CHMP)
• Zvláštní národní požadavky schválené příslušnými orgány ohledně:
o Distribuce léčivého přípravku
o Postupů k zajištění provedení veškerých příslušných opatření ještě před vydáním thalidomidu
Informační materiály pro zdravotnické pracovníky
Informační materiály pro zdravotnické pracovníky budou obsahovat následující prvky:
• Brožura pro zdravotnické pracovníky
o Historie a stručná informace o přípravku Thalidomide Celgene a jeho schválené indikaci o Dávkování
o Maximální délka trvání předpisu
■ 4 týdny pro ženy ve fertilním věku
■ 12 týdnů pro muže a ženy, které nejsou ve fertilním věku o Informace o teratogenitě a nutnosti vyhnout se expozici plodu
o Povinnosti zdravotnických pracovníků, kteří hodlají předepisovat nebo vydávat přípravek Thalidomide Celgene zahrnují
■ Nutnost poskytnout pacientům vyčerpávající informace a poradenství
■ Posoudit schopnosti pacientů dodržovat požadavky pro bezpečné užívání thalidomidu
■ Nutnost poskytnout pacientům vhodné informační materiály
■ Nutnost hlásit společnosti Celgene a místním zdravotnickým orgánům (pokud se to na členský stát vztahuje) těhotenství, neuropatii nebo další nežádoucí účinky; prosím, použijte formulář dodaný v “Informačním balíku pro zdravotnické pracovníky”
o Rady ohledně bezpečnosti pro všechny pacienty
■ Popis a léčba žilních a tepenných tromboembolických příhod, kardiovaskulárních příhod a periferní neuropatie
■ Likvidace nepotřebného léku
■ Informace o tom, že během léčby přípravkem Thalidomide Celgene a jeden týden po ukončení léčby se nesmí darovat krev
o Algoritmus pro implementaci Programu prevence početí
■ Má sloužit jako pomůcka ke kategorizaci pacientek a k určení doporučené metody antikoncepce a postupů testování
o Informace o Programu prevence početí pro předepisující osobu
■ Definice ženy ve fertilním věku (women of childbearingpotential, WCPB), a kroky, jež má předepisující lékař učinit, existují-li nejasnosti ohledně schopnosti ženy otěhotnět
■ Informace o tom, co je účinná antikoncepce
■ Rady ohledně bezpečnosti pro WCPB
• Nutnost vyhnout se expozici plodu
• Nutnost vhodné antikoncepce, definice a potřeba vhodné metody antikoncepce
• V případě nutnosti ženy změnit nebo vysadit její obvyklou metodu antikoncepce, je třeba informovat:
- lékaře, který jí antikoncepci předepisuje, že užívá thalidomid
- lékaře, který předepisuje thalidomid, že změnila nebo přestala užívat svou obvyklou metodu antikoncepce
• Požadavky na testování gravidity
o Informace o vhodných testech
o Četnost (před začátkem léčby, každý měsíc během léčby a po ukončení léčby)
• Nutnost okamžitého ukončení používání přípravku Thalidomide Celgene při podezření na těhotenství
• Nutnost okamžitě informovat ošetřujícího lékaře při podezření na těhotenství
■ Rady ohledně bezpečnosti pro muže
• Nutnost vyhnout se expozici plodu
• Nutnost pacientů používat kondom, je-li jejich sexuální partnerka těhotná nebo ve fertilním věku a nepoužívá účinnou antikoncepci, neboť thalidomid je přítomen v spermatu
• Informace o tom, že když partnerka muže otěhotní, musí okamžitě informovat svého ošetřujícího lékaře, a vždy během pohlavního styku používat kondom
• Informace o tom, že nesmí během léčby thalidomidem a týden po jejím ukončení darovat sperma
o Požadavky ohledně nahlášení těhotenství
■ Instrukce, aby používání přípravku Thalidomide Celgene bylo při podezření na těhotenství okamžitě ukončeno
■ Povinnost odeslat pacientku lékaři se specializací nebo praxí v teratologii, který provede odborné vyšetření a poskytne potřebné poradenství
■ Potřeba vyplnit formulář Nahlášení těhotenství dodaného v “Informačním balíku pro zdravotnické pracovníky”
■ Podrobnosti o místním kontaktu pro hlášení jakéhokoliv podezření na těhotenství
• Vstupní a výsledné formuláře Nahlášení těhotenství
• Vyhodnocení po uvedení na trh a vyhodnocení dodržování pokynů PPP (podle potřeby členského státu)
• Formuláře pro nahlášení neuropatie a nežádoucích účinků
• Formuláře o zahájení léčby
o Formuláře o zahájení léčby mají být 3 typů:
■ Pro ženy ve fertilním věku
■ Pro ženy, které nejsou ve fertilním věku
■ Pro muže
o Všechny formuláře o zahájení léčby musí obsahovat následující prvky:
■ Varování o tom, že přípravek může mít teratogenní účinek
■ Datum poskytnutí poradenství
■ Potvrzení o tom, že pacient rozumí pokynům týkající se vzniku rizika v souvislosti s thalidomidem a opatření související s PPP
■ Údaje o pacientovi, podpis a datum
■ Jméno předepisujícího lékaře, podpis a datum
■ Cíl tohoto dokumentu, tj. tak, jak uvedeno v PPP: „ Cílem formuláře
o zahájení léčby je chránit pacienty, případně plody pacientek, tím, že pacienti budou plně informováni a vědomi si rizika teratogenity a dalších nežádoucích účinků spojených s užíváním thalidomidu. Tento formulář nepředstavuje smlouvu a nezprošťuje nikoho povinnosti týkající se bezpečného používání přípravku a prevence expozice plodu.”
o Formuláře o zahájení léčby pro ženy ve fertilním věku by rovněž měly obsahovat:
■ Potvrzení o tom, že lékař projednal s pacientkou následující:
• Nutnost vyhnout se expozici plodu
• Je-li těhotná nebo plánuje-li těhotenství, nesmí Thalidomide Celgene užívat
• Nutnost používat vhodnou metodu antikoncepce bez přerušení po dobu 4 týdnů před zahájením léčby, po celou dobu léčby a 4 týdny po skončení léčby
• Pokud potřebuje změnit nebo vysadit svou obvyklou metodu antikoncepce, měla by informovat:
- lékaře, který jí antikoncepci předepisuje, že užívá thalidomid
- lékaře, který ji předepsal thalidomid, že vysadila nebo změnila svou obvyklou metodu antikoncepce
• Nutnost provádění těhotenských testů, tj. před zahájením léčby, každé 4 týdny během léčby a po jejím skončení
• Nutnost okamžitě vysadit přípravek Thalidomide Celgene při podezření na těhotenství
• Nutnost ihned vyhledat svého lékaře při podezření na těhotenství
• Informace o tom, že přípravek nesmí podávat žádným jiným osobám
• Informace o tom, že nesmí během léčby thalidomidem a týden po jejím ukončení darovat krev
• Informace o tom, že má po skončení léčby vrátit tobolky do lékárny
o Formuláře o zahájení léčby pro ženy, které nejsou ve fertilním věku, by rovněž měly obsahovat:
■ Potvrzení o tom, že lékař projednal s pacientkou následující:
• Informace o tom, že přípravek nesmí podávat žádným jiným osobám
• Informace o tom, že nesmí během léčby thalidomidem a týden po jejím ukončení darovat krev
• Informace o tom, že po skončení léčby má vrátit tobolky do lékárny
o Formuláře o zahájení léčby pro muže mají rovněž obsahovat:
■ Potvrzení o tom, že lékař projednal s pacientem následující:
• Nutnost vyhnout se expozici plodu
• Nutnost pacientů používat kondom, je-li jejich sexuální partnerka těhotná nebo ve fertilním věku a nepoužívá účinnou antikoncepci, neboť thalidomid je přítomen ve spermatu
• Informace o tom, že když partnerka muže otěhotní, musí okamžitě informovat svého ošetřujícího lékaře, a vždy během pohlavního styku používat kondom
• Informace o tom, že nesmí během léčby a jeden týden po skončení léčby thalidomidem darovat krev nebo sperma
• Informace o tom, že přípravek nesmí podávat žádným jiným osobám
• Informace o tom, že po skončení léčby má vrátit tobolky do lékárny
Průkazky pacienta a/nebo podobné pomůcky:
o Ověření o poskytnutí vhodného typu poradenství o Dokumentace o stavu fertlity pacientky
o Zaškrtávací rámeček (nebo podobný systém), který lékař zaškrtne, čímž potvrdí, že pacientka používá vhodnou metodu antikoncepce (jedná-li se o ženu ve fertilním věku) o Ověření o vstupním těhotenském testu provedeném před zahájením léčby (jedná-li se o ženu ve fertilním věku)
o Data provedení těhotenských testů a jejich výsledky Informační brožury pro pacienty:
o Brožury by měly být 3 typů (anebo sjednocené do jedné brožury, kombinující informace pro všechny kategorie pacientů):
■ Brožury pro ženy ve fertilním věku a jejich partnery
■ Brožury pro ženy, které nejsou ve fertilním věku
■ Brožury pro muže
o Všechny brožury musí obsahovat následující prvky:
■ Informaci o tom, že Thalidomide Celgene má teratogenní účinek
■ Informaci o tom, že Thalidomide Celgene může způsobit žilní a tepenný tromboembolismus, kardiovaskulární příhody a neuropatii
■ Popis průkazky pacienta a informace o jej ich používání v příslušném členském státě
■ Národní nebo jiná platná zvláštní opatření pro vydání předepsaného přípravku Thalidomide Celgene
■ Informaci o tom, že Thalidomide Celgene se nesmí dávat jiným osobám
■ Informaci o tom, že pacient nesmí darovat krev
■ Informaci o tom, že pacient má informovat svého lékaře o jakýchkoliv nežádoucích příhodách
■ Informaci o tom, že veškeré nepoužité tobolky mají být po skončení léčby vráceny do lékárny
o Následující informace mají být také poskytnuty v příslušné brožuře:
■ Pro ženy ve fertilním věku
• Nutnost vyhnout se expozici plodu
• Nutnost užívat vhodnou antikoncepci
• Pokud potřebuje změnit nebo vysadit svou obvyklou metodu antikoncepce, musí informovat:
- lékaře, který jí antikoncepci předepisuje, že užívá thalidomid
- lékaře, který ji předepsal thalidomid, že vysadila nebo změnila svou obvyklou metodu antikoncepce
• Nutnost provedení těhotenských testů, tj. před začátkem léčby, každé 4 týdny během léčby a po skončení léčby
• Potřeba okamžitého vysazení přípravku Thalidomide Celgene při podezření na těhotenství
• Potřeba ihned kontaktovat lékaře při podezření na těhotenství
■
Muži
Nutnost vyhnout se expozici plodu
Nutnost pacientů používat kondom, je-li jejich sexuální partnerka těhotná nebo ve fertilním věku a nepoužívá účinnou antikoncepci, neboť thalidomid je přítomen ve spermatu
Informace o tom, že když partnerka muže otěhotní, měl by okamžitě informovat svého ošetřujícího lékaře, a vždy během pohlavního styku používat kondom • Informace o tom, že nesmí během léčby thalidomidem a týden po jejím ukončení darovat sperma
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
KRABIČKA_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Thalidomide Celgene 50 mg tvrdé tobolky Thalidomidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje thalidomidum 50 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
28 tvrdých tobolek
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze podle pokynů svého lékaře.
VÝSTRAHA: Thalidomid způsobuje vrozené vady a úmrtí plodu.
Pacientky musí dodržovat Program prevence početí pro Thalidomide Celgene.
OBAL NEPORUŠUJTE
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Nespotřebovaný léčivý přípravek se musí vrátit lékárníkovi.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Celgene Europe Ltd 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/08/443/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Thalidomide Celgene 50 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH
BLISTRY:_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU_
Thalidomide Celgene 50 mg Thalidomidum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Celgene Europe Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele
Thalidomide Celgene 50 mg tvrdé tobolky
Thalidomidum
UPOZORNĚNÍ
Thalidomid způsobuje vrozené vady a úmrtí plodu. Thalidomide neužívejte, pokud jste těhotná nebo můžete otěhotnět. Musíte dodržovat rady lékaře týkající se antikoncepce.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci.
1. Co je Thalidomide Celgene a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Thalidomide Celgene užívat
3. Jak se Thalidomide Celgene užívá
4. Možné nežádoucí účinky
5. Jak Thalidomide Celgene uchovávat
6. Obsah balení a další informace
1. Co je Thalidomide Celgene a k čemu se používá Co je Thalidomide Celgene
Thalidomide Celgene obsahuje léčivou látku zvanou thalidomid. Tato látka patří ke skupině léků, které ovlivňují funkci Vašeho imunitního systému.
K čemu se Thalidomide Celgene používá
Thalidomide Celgene se používá se dvěma dalšími léky - melfalanem a prednisonem - k léčbě typu rakoviny zvané mnohočetný myelom u dospělých osob ve věku od 65 let. Používá se u lidí, u kterých byl mnohočetný myelom nedávno diagnostikován a kterým k jeho léčbě dosud nebyl předepsán žádný jiný lék, nebo kteří nemohou být léčeni vysokodávkovou chemoterapií, kterou může tělo těžce snášet.
Co je mnohočetný myelom
Mnohočetný myelom je druh rakoviny, který napadá určitý typ bílých krvinek zvaných plazmatické buňky. Tyto buňky se shromažďují v kostní dřeni a nekontrolovaně se dělí. Důsledkem může být poškození kostí a ledvin. Mnohočetný myelom je obvykle nevyléčitelný. Známky a příznaky však lze výrazně snížit nebo je možné na určitou dobu dosáhnout jejich vymizení. Tento jev se nazývá „remise“.
Jak Thalidomide Celgene funguje
Thalidomid Celgene pomáhá imunitnímu systému těla a přímo napadá rakovinu. Účinkuje několika různými způsoby:
■ zastavuje rozvoj rakovinných buněk,
■ zastavuje růst krevních cév v nádoru,
stimuluje část imunitního systému k napadání rakovinných buněk.
2. Čemu musíte věnovat pozornost, než začnete Thalidomide Celgene užívat
Lékař Vám sdělí konkrétní pokyny, zvláště ty, které se týkají vlivu thalidomidu na nenarozené děti (jsou uvedeny v části Program prevence početí pro Thalidomide Celgene).
Od lékaře obdržíte průkazku pro pacienta nebo jiný příslušný dokument. Pozorně si je pročtěte a dodržujte příslušné pokyny.
Pokud těmto pokynům zcela neporozumíte, požádejte, prosím, svého lékaře, aby Vám je znovu vysvětlil, než začnete thalidomid užívat. Viz také další informace v tomto bodu pod názvem „Upozornění a opatření“ a „Těhotenství a kojení“.
Neužívejte Thalidomide Celgene
• jestliže jste těhotná nebo máte podezření, že jste těhotná, nebo těhotenství plánujete, protože Thalidomide Celgene způsobuje vrozené vady a úmrtí plodu,
• jestliže můžete otěhotnět, pakliže nedodržujete veškerá potřebná opatření k prevenci otěhotnění (viz bod 2 „Upozornění a opatření“ a „Těhotenství a kojení“),
• jestliže můžete otěhotnět, váš lékař při každém předepisování zaznamená, že byla přijata nezbytná opatření, a toto potvrzení Vám předá,
• jestliže j ste alergický(á) na thalidomid nebo na kteroukoli další složku tohoto přípravku uvedenou v bodě 6 „Obsah balení a další informace“.
Pokud se na Vás vztahuje některý z výše uvedených bodů, Thalidomide Celgene neužívejte. Pokud si nejste jistý(á), promluvte si se svým lékařem předtím, než začnete Thalidomide Celgene užívat.
Upozornění a opatření
Předtím, než začnete tento lék užívat, se poraďte se svým lékařem, lékarníkem nebo zdravotní sestrou v následujících situacích:
Ženy užívající Thalidomide Celgene
Před začátkem léčby se musíte poradit s lékařem, zda byste mohla otěhotnět, i když si můžete myslet, že je to nepravděpodobné.
Pokud u Vás možnost početí nelze vyloučit:
• Absolvujte těhotenské testy pod dohledem lékaře:
o před zahájením léčby o každé 4 týdny v průběhu léčby o 4 týdny po ukončení léčby
• Musíte používat jednu z účinných metod antikoncepce:
o 4 týdny před zahájením léčby o během léčby
o po dobu 4 týdnů po ukončení léčby Lékař Vám poradí s výběrem vhodné metody antikoncepce.
Pokud u Vás možnost početí nelze vyloučit, lékař zaznamená při každém předpisu, že potřebná opatření, jak byla uvedena výše, byla dodržena, a tuto skutečnost zaznamená do vaší karty pacienta nebo do jakéhokoli jiného odpovídajícího dokumentu.
Muži užívající Thalidomide Celgene
Thalidomid přechází do spermatu, proto se zdržte nechráněného pohlavního styku.
• Vyhněte se početí a jakékoliv expozici během těhotenství. Vždy používejte kondom:
o během léčby o 1 týden po ukončení léčby
• Nesmíte darovat sperma:
o během léčby o 1 týden po ukončení léčby
Všichni pacienti:
Poraďte se se svým lékařem, než začnete Thalidomide Celgene užívat, jestliže
• jste prodělal(a) srdeční záchvat, jestliže se u Vás v minulosti objevila krevní sraženina, nebo jestliže kouříte, máte vysoký krevní tlak nebo vysoké hladiny cholesterolu. Během léčby přípravkem Thalidomide Celgene existuje zvýšené riziko vzniku krevních sraženin v žilách a v tepnách.
• jste měl/a nebo v současnosti máte pomalou srdeční frekvenci (může jít o příznaky bradykardie),
• jste v minulosti měl/a nebo v současnosti máte neuropatii, tj. pociťujete brnění, abnormální koordinaci nebo bolestivost rukou nebo nohou,
• jste zaznamenal/a ospalost,
• máte v celém těle, včetně kostní dřeně, velký celkový počet nádorů. Tento stav by mohl vést
k rozpadu nádorů, což má za následek abnormální hladiny chemických látek v těle a výsledkem může být selhání ledvin (tento stav se nazývá „syndrom nádorového rozpadu“),
• jste zaznamenal/a horečku, zimnici a silný třes, potenciálně také komplikované nízkým krevním tlakem a zmateností (může jít o příznaky závažných infekcí),
• jste při užívání thalidomidu zaznamenal/a alergickou reakci, jako je vyrážka, svědění, otoky, závratě nebo dýchací potíže,
• nerozumíte antikoncepčním doporučením, která Vám dal lékař, nebo pokud nejste schopen/schopna tato doporučení dodržovat,
• máte vysoký krevní tlak, který se ze srdce přenáší do plic,
• máte nebo jste někdy měl(a) virovou infekci, zejména plané neštovice, pásový opar, hepatitidu B (žloutenku typu B), HIV. Máte-li pochybnosti, informujte se u svého lékaře. Léčba thalidomidem může způsobit, že se virus u pacienta, který je jeho nosičem, znovu aktivuje, což vede k návratu infekce.
Během léčby přípravkem Thalidomide Celgene a jeden týden po ukončení léčby nesmíte darovat krev.
Pokud si nejste jist(a), zda se na Vás kterýkoli z výše uvedených bodů vztahuje, promluvte si se svým lékařem předtím, než začnete přípravek Thalidomide Celgene užívat.
Použití u dětí a dospívajících
U dětí a dospívajících mladších 18 let se použití přípravku Thalidomide Celgene nedoporučuje.
Další léčivé přípravky a Thalidomide Celgene
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste v nedávné době užíval(a). To se týká i léků, které jsou dostupné bez lékařského předpisu, včetně bylinných léčivých přípravků.
Informujte svého lékaře, zdravotní sestru nebo lékárníka, jestliže užíváte jakékoli léky, které:
• způsobují ospalost, neboť thalidomid by mohl zvýšit jejich účinnost. Tato kategorie zahrnuje i sedativa (jako jsou anxiolytika, hypnotika, antipsychotika, H1 antihistaminika, deriváty opiátů a barbituráty),
• zpomalují srdeční frekvenci (způsobují bradykardii, například anticholinesterázy a beta blokátory),
• se používají k léčbě potíží a komplikací souvisejících se srdcem (např. digoxin) nebo ke snížení srážlivosti krve (např. warfarin),
• se také používají k léčbě rakoviny,
• se používaj í j ako antikoncepce.
Thalidomide Celgene s jídlem, pitím a alkoholem
Přípravek Thalidomide Celgene lze užívat buď s jídlem nebo bez něj (viz bod 3, “Jak se Thalidomide Celgene užívá”).
V průběhu užívání přípravku Thalidomide Celgene nepijte alkohol. Je to proto, že alkohol vyvolává ospalost a přípravek Thalidomide Celgene může způsobit, že budete ještě více ospalý(á).
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Thalidomide způsobuje závažné vrozené vady nebo úmrtí nenarozeného dítěte.
• Jedna jediná tobolka, kterou užije těhotná žena, může způsobit vznik závažných vrozených vad dítěte
• K těmto vadám mohou patřit zkrácené paže nebo nohy, deformované ruce nebo chodidla, ušní nebo oční vady a problémy s vnitřními orgány
Pokud jste těhotná, nesmíte Thalidomide Celgene užívat. Zároveň nesmí během léčby přípravkem Thalidomide Celgene dojít k početí.
Pokud byste mohla otěhotnět, musíte používat jednu z účinných metod antikoncepce (viz bod 2. „Čemu musíte věnovat pozornost, než začnete Thalidomide Celgene užívat“).
Musíte ukončit léčbu a ihned informovat lékaře, pokud:
• Jste nedostala menstruaci nebo si myslíte, že jste ji nedostala, nebo je-li menstruační krvácení neobvyklé nebo máte-li podezření, že jste těhotná
• Měla jste heterosexuální pohlavní styk bez použití účinné metody antikoncepce
Pokud během léčby thalidomidem otěhotníte, musíte léčbu ukončit a ihned informovat svého lékaře.
Muži užívající přípravek Thalidomide Celgene, kteří mají partnerky, které mohou otěhotnět, viz bod 2 „Zvláštní opatrnosti při použití přípravku Thalidomide Celgene je zapotřebí“. Pokud během léčby thalidomidem Vaše partnerka otěhotní, ihned informujte svého lékaře.
Kojení
Při užívání Thalidomidu Celgene nekojte, neboť není známo, zda thalidomid přechází do lidského mateřského mléka.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředky a neobsluhujte stroje, pokud se u Vás projeví nežádoucí účinky, jako jsou závratě, únava, ospalost nebo rozmazané vidění.
3. Jak se Thalidomide Celgene užívá
Vždy užívejte přípravek Thalidomide Celgene přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Jak a kdy se Thalidomide Celgene užívá
Doporučená dávka je 200 mg (4 tobolky po 50 mg) denně u dospělých ve věku 75 let a mladších, nebo
100 mg (2 tobolky po 50 mg) u dospělých starších 75 let. Dávku přípravku Vám však stanoví lékař; bude sledovat vývoj léčby a může dávku upravit. Lékař Vám sdělí, jak se Thalidomide Celgene užívá a jak dlouho jej budete užívat (viz bod 2. „Čemu musíte věnovat pozornost, než začnete Thalidomide Celgene užívat“).
Thalidomide Celgene se užívá denně v léčebných cyklech, přičemž každý cyklus trvá 6 týdnů, v kombinaci s melfalanem a prednisonem, které se užívají ve dnech 1 až 4 každého šestitýdenního cyklu.
Dávkování tohoto přípravku
• Tento přípravek se užívá ústy (perorálně),
• Tobolky polkněte celé a zapijte je plnou sklenicí vody,
• Nedrťte je nebo nežvýkejte,
• Tobolky užijte v jedné dávce před ulehnutím ke spánku. Tak zabráníte tomu, abyste se cítil(a) ospalý(á) v jinou denní dobu.
Jestliže jste užil(a) více přípravku Thalidomide Celgene, než jste měl(a):
Jestliže jste užil(a) více přípravku Thalidomide Celgene, než jste měl(a), ihned informujte lékaře nebo se dostavte do nemocnice. Pokud je to možné, vezměte s sebou obal léku a tuto příbalovou informaci.
Jestliže jste zapomněl(a) užít Thalidomide Celgene
Pokud jste zapomněl(a) užít Thalidomide Celgene ve svém pravidelném čase a
• od té doby uplynulo méně než 12 hodin: ihned si tobolky vezměte.
• od té doby uplynulo více než 12 hodin: tobolky si neberte. Další tobolky si vezměte ve svém pravidelném čase další den.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Při užívání tohoto léčivého přípravku se mohou objevit následující nežádoucí účinky:
Přestaňte Thalidomide Celgene užívat a ihned vyhledejte svého lékaře, pokud se u Vás projeví následující závažné nežádoucí účinky - můžete potřebovat okamžitou lékařskou pomoc:
• Závažné kožní reakce včetně vyrážek, což je častý nežádoucí účinek a puchýře na kůži a sliznici (Stevens-Johnsonův syndrom a toxická epidermální nekrolýza, což jsou vzácné nežádoucí účinky). Zároveň můžete mít zvýšenou teplotu (horečku).
Pokud se u Vás projeví jakýkoli z následujících závažných nežádoucích účinků, ihned vyhledejte svého lékaře:
• Znecitlivění, brnění, abnormální koordinace nebo bolest rukou nebo chodidel.
Může to být důsledek poškození nervů (zvaný „periferní neuropatie“), což je velmi častý nežádoucí účinek. Může být velmi závažný, bolestivý a způsobovat invaliditu. Pokud pocítíte takové příznaky, vyhledejte ihned svého lékaře, který může rozhodnout o snížení dávky nebo přerušení léčby.
K tomuto nežádoucímu účinku obvykle dochází, pokud užíváte tento přípravek několik měsíců; může k němu však dojít i dříve. Dochází k tomu rovněž nějaký čas po ukončení léčby. Příznaky nemusí odeznít vůbec, nebo mohou odeznívat pomalu.
• Náhlá bolest na hrudi nebo potíže s dýcháním.
Může k tomu dojít v důsledku přítomnosti krevní sraženiny v tepnách, které vedou k plicím (tzv. „plicní embolie“), což je častý nežádoucí účinek. Může k tomu dojít v průběhu léčby nebo po ukončení léčby.
• Bolest nebo otok nohou, zvláště nohou od kolene dolů a lýtek.
Může k tomu dojít v důsledku přítomnosti krevní sraženiny v žilách nohou (hluboká žilní trombóza), což je častý nežádoucí účinek. Může k tomu dojít v průběhu léčby nebo po ukončení léčby.
• Bolest na hrudi vyzařující do paží, krku, čelisti, zad nebo břicha, pocit zvýšeného pocení a pocit obtížného dýchání (dušnosti), nevolnost a zvracení.
Může se jednat o příznaky srdečního záchvatu/infarktu myokardu (k němuž může dojít v důsledku přítomnosti krevní sraženiny v srdečních tepnách).
• Krátkodobé potíže se zrakem nebo s mluvením.
Může se jednat o příznaky mozkové mrtvice (k níž může dojít v důsledku přítomnosti krevní sraženiny v tepně v mozku).
• Horečka, zimnice, bolest v krku, vředy v ústech nebo jakékoli další příznaky infekce.
• Krvácení nebo zhmožděniny bez přítomnosti zranění.
K dalším nežádoucím účinkům patří:
Je důležité upozornit na to, že u malého počtu pacientů s mnohočetným myelomem se mohou vyvinout další typy zhoubného nádorového onemocnění, především zhoubná bujení v krvi, a je možné, že toto riziko zvyšuje léčba přípravkem Thalidomide Celgene. Proto má Váš lékař pečlivě zhodnotit přínosy a rizika, když vám předepisuje přípravek Thalidomide Celgene.
Velmi časté (mohou se projevit u více než 1 osoby z 10)
• zácpa;
• závratě;
• spavost, pocit únavy;
• třes (tremor);
• otok rukou a nohou;
• nízký počet krvinek. To znamená, že je pravděpodobné, že u Vás může dojít k rozvoji infekce. Lékař bude v průběhu léčby Thalidomidem sledovat krevní obraz.
Časté (mohou se projevit nejvýše u 1 osoby z 10)
• poruchy trávení, nevolnost (pocit na zvracení), zvracení, sucho v ústech;
• vyrážka, suchá kůže;
• pocit slabosti, mdloby nebo ztráta rovnováhy, ztráty energie nebo síly, nízký krevní tlak;
• horečka, pocit celkové nevolnosti;
• pocit točení hlavy vyvolávající potíže při vstávání a normálním pohybu;
• rozmazané vidění;
• infekce v hrudníku (pneumonie), onemocnění plic;
• pomalá srdeční frekvence, srdeční selhání;
• deprese, zmatenost, změny nálady, úzkost.
Méně časté (mohou se projevit nejvýše u 1 osoby ze 100)
• zánět a otok průdušnice a průdušek (bronchitida);
• zánět buněčné výstelky žaludeční stěny;
• proděravění části tlustého střeva (tračníku), které může být příčinou infekce.
Po uvedení tohoto přípravku na trh byly hlášeny další nežádoucí účinky. Jsou to:
• nedostatečná činnost štítné žlázy (hypotyreóza);
• obstrukce (neprůchodnost) střeva;
• sexuální dysfunkce (například impotence);
• pokles počtu bílých krvinek (neutropenie) doprovázený horečkou a infekcí;
• závažná infekce krve (sepse) doprovázená horečkou, zimnicí a silným třesem, která se může komplikovat nízkým krevním tlakem a zmateností (septický šok);
• současný pokles počtu červených a bílých krvinek a krevních destiček (pancytopenie);
• syndrom nádorového rozpadu - metabolické komplikace, které se mohou vyskytnout během léčby nádorového onemocnění a někdy i bez léčby. Tyto komplikace jsou způsobeny látkami, které vznikají při odumírání nádorových buněk, a mohou zahrnovat: změny chemického složení krve, vysoké hladiny draslíku, fosforu a kyseliny močové a nízkou hladinu vápníku, což může vést ke změnám funkce ledvin, srdečního rytmu, záchvatům a někdy i k úmrtí;
• alergické reakce jako je lokalizovaná nebo generalizovaná svědivá vyrážka a angioedém (typ alergické reakce, který se může projevit jako kopřivka, vyrážka, otok očí, úst nebo obličeje, potíže s dýcháním nebo svědění);
• snížení sluchu nebo ztráta sluchu;
• křeče;
• onemocnění ledvin (selhání ledvin);
• poškození jater (jaterní porucha) včetně abnormálních výsledků vyšetření jaterní funkce;
• krvácení ze žaludku nebo střev (gastrointestinální krvácení);
• nepravidelnosti srdečního rytmu (srdeční blok nebo fibrilace síní), pocit malátnosti nebo ztráta vědomí;
• zhoršení příznaků Parkinsonovy choroby (např. třes, deprese nebo zmatenost);
• bolest v nadbřišku a/nebo zádech, která může být silná a která přetrvává několik dní, může ji doprovázet pocit na zvracení, zvracení, horečka a rychlý puls - tyto příznaky mohou vzniknout v důsledku zánětu slinivky břišní (pankreatitidy);
• zvýšení krevního tlaku v krevních cévách, které zásobují plíce, což může vést k dušnosti, únavě, závrati, bolesti na hrudi, zrychlenému tepu srdce nebo otokům nohou a kotníků (plicní hypertenze);
• virové infekce včetně infekce herpes zoster (také známého jako pásový opar, virového onemocnění, které způsobuje bolestivou kožní vyrážku s puchýři) a opětovného výskytu infekce hepatitidy B (žloutenky typu B, která může způsobit žloutnutí kůže a očí, tmavě hnědě zbarvenou moč, bolest na pravé straně břicha, horečku a pocit na zvracení nebo zvracení).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Thalidomide Celgene uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a blistrech za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte tento přípravek, pokud si všimnete jakéhokoli poškození nebo známek nežádoucí manipulace.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Po ukončení léčby vraťte všechny nespotřebované tobolky lékárníkovi nebo lékaři. Tato opatření zabrání zneužití léčivého přípravku.
6. Obsah balení a další informace Co Thalidomide Celgene obsahuje:
• Léčivou látkou je thalidomidum. Jedna tobolka obsahuje 50 mg thalidomidu
• Dalšími pomocnými látkami j sou předbobtnalý škrob a magnesium-stearát. Obal tobolky obsahuje želatinu a oxid titaničitý (E171). Potisková barva je složena ze šelaku, černého oxidu železitého (E172) a propylenglykolu
Jak Thalidomide Celgene vypadá a co obsahuje toto balení:
Tvrdé tobolky Thalidomide Celgene jsou bílé, s nápisem „Thalidomide Celgene 50 mg“. Tobolky jsou dodávány v krabičkách; jedna krabička obsahuje 28 tobolek (2 blistry, každý obsahuje 14 tobolek).
Držitel rozhodnutí o registraci a výrobce
Celgene Europe Limited 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Velká Británie
Držitel rozhodnutí o registraci
Celgene Europe Limited 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Velká Británie
Výrobce
Penn Pharmaceutical Services Limited
Tafarnaubach Industrial Estate
Tredegar
Gwent
NP22 3AA
Velká Británie
Celgene Europe Limited 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Velká Británie
Tato příbalová informace byla naposledy revidována Další zdroje informací
Jestliže si přejete získat tyto informace v jiném formátu, kontaktujte prosím držitele rozhodnutí o registraci.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu . Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
PŘÍLOHA IV
VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY V REGISTRACI
Vědecké závěry
S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) thalidomidu dospěl výbor CHMP k těmto vědeckým závěrům:
Na základě důkazů z případů reaktivace viru po léčbě thalidomidem, z nichž některé byly závažné, zejména u pacientů, kteří prodělali infekci herpes zoster nebo infekci virem hepatitidy B (HBV), výbor PRAC usoudil, že existuje potvrzená příčinná souvislost mezi podáváním thalidomidu a reaktivací viru varicella zoster a viru hepatitidy B (HBV). Výbor PRAC doporučuje před zahájením léčby thalidomidem určení stavu viru hepatitidy B. Pacienti, kteří prodělali infekci, mají být v průběhu léčby pečlivě sledováni z hlediska známek a příznaků reaktivace viru, včetně aktivní infekce HBV. Body 4.4 a 4.8 souhrnu údajů o přípravku jsou aktualizovány v souladu s těmito informacemi. Příbalová informace je příslušně aktualizována. Dále má být aktualizován plán řízení rizik (RMP) přidáním reaktivace HBV mezi závažné infekce popsané v důležitých identifikovaných rizicích.
Výbor PRAC vyhodnotil, že na základě důkazů z případů plicní hypertenze, z nichž některé byly fatální, hlášených po léčbě thalidomidem, existuje potvrzená příčinná souvislost mezi podáváním thalidomidu a plicní hypertenzí. Výbor PRAC doporučuje, aby byl stav pacientů před zahájením léčby thalidomidem a v jejím průběhu vyhodnocen z hlediska známek a příznaků základního kardiopulmonálního onemocnění. Z toho důvodu je informace o plicní hypertenzi zahrnuta v bodech 4.4 a 4.8 údajů o přípravku thalidomidu. Příbalová informace je příslušně aktualizována. Dále se vyžaduje následná aktualizace plánu řízení rizik (RMP) přidáním plicní hypertenze mezi důležitá identifikovaná rizika.
Dále má být v souladu s komunikačním plánem distribuován dopis DHPC informující zdravotnické pracovníky o rizicích plicní hypertenze a reaktivace viru souvisejících s léčbou thalidomidem.
Vzhledem k údajům prezentovaným v revidované zprávě PSUR výbor PRAC považuje změny v údajích o přípravku léčivých přípravků obsahujících thalidomid za oprávněné.
Výbor CHMP souhlasí s vědeckými závěry výboru PRAC.
Zdůvodnění změny v registraci
Na základě vědeckých závěrů týkajících se thalidomidu výbor CHMP zastává stanovisko, že poměr přínosů a rizik léčivého přípravku obsahujícího thalidomid zůstává nezměněný, a to pod podmínkou, že v informacích o přípravku budou provedeny navrhované změny.
Výbor CHMP doporučuje změnu v registraci.
43