Temozolomide Accord 250 Mg
1. NÁZEV PŘÍPRAVKU
Temozolomide Accord 5 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje temozolomidum 5 mg.
Pomocné látky se známým účinkem:
Jedna tvrdá tobolka obsahuje 168 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Tvrdé tobolky jsou zelené/bílé tvrdé želatinové tobolky s vyraženým “TMZ” na víčku & ‘5’ na těle tobolky.
Tobolka je přibližně 15 mm dlouhá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Temozolomide Accord je indikován k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
4.2 Dávkování a způsob podání
Temozolomid smí předepisovat výhradně lékař se zkušenostmi s onkologickou léčbou mozkových
nádorů.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Temozolomide Accord je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ) (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofílů(ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- všeobecná kritéria toxicity (CTC - common toxicity criteria) nehematologícké toxicity < stupeň 1 (s výjimkou alopecie, nauzey a zvracení).
Během léčby se má každý týden vyšetřit celkový krevní obraz. Podávání TMZ má být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v tabulce 1.
Tabulka 1. Přerušení nebo ukončení podávání TMZ během souběžné léčby radioterapií a TMZ
|
Toxicita |
TMZ přerušení3 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
>0,5 a < 1,5 x 109 /l |
< 0,5 x 109 /l |
|
Počet trombocytů |
>10 a < 100 x 109 /l |
< 10 x 109 /l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
|
a : Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109/l; počet trombocytů > 100 x 109/l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení). | ||
Monoterapeutická fáze
Čtyři týdny po ukončené souběžné fázi TMZ + RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je > 1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže se dávka nezvýšila v cyklu 2, nemělo by se zvýšení provádět v následných cyklech. Byla-li zvýšena, dávka zůstává na úrovni 200 mg/m2 na den po dobu prvních 5 dnů každého následujícího cyklu, pokud se však neobjeví toxicita. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze by se mělo provádět podle tabulek 2 a 3.
V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka se má redukovat nebo podávání přípravku ukončit podle tabulky 3.
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu
|
Úroveň dávky |
Dávka TMZ (mg/m2 /den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během cyklu 1 |
|
1 |
200 |
Dávka během cyklů 2-6 při absenci toxicity |
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby
|
Toxicita |
Redukce TMZ o 1 úroveň dávky a |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109 /l |
Viz poznámka pod čarou b |
|
Počet trombocytů |
< 50 x 109 /l |
Viz poznámka pod čarou b |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
|
a : Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b : TMZ se ukončí jestliže: | ||
• výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita
• jestliže se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení).
Dospělí_pacienti a děti ve věku 3 let nebo starší s recidivujícím nebo _progresivním maligním gliomem:
Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, je zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní populace
Pediatrická populace
U dětí ve věku 3 let nebo starších by se měl TMZ používat pouze k léčbě recidivujícího nebo progresivního maligního gliomu. Zkušenosti u těchto dětí jsou velmi omezené (viz body 4.4 a 5.1). Bezpečnost a účinnost TMZ u dětí do 3 let nebyla stanovena. Nejsou dostupné žádné údaje.
Pacienti se sníženou funkcí jater nebo ledvin
FarmakokinetikaTMZ je u pacientů s normální jaterní fúnkcí a s mírnou nebo středně těžkou jaterní dysfúnkcí srovnatelná. Údaje o podání TMZ u pacientů s těžkou jaterní nedostatečností (Třída C podle Childovy klasifikace) ani s dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou jaterní dysfunkcí nebo dysfunkcí ledvin jakéhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto pacientům je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že hodnota clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podání
Temozolomide Accord se podává nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, neměla by být další dávka podána tentýž den.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita na dakarbazin (DTIC).
Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jirovecii) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
U pacientů, kteří dostávali souběžně TMZ a radioterapii v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jirovecii (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří jsou souběžně léčeni TMZ a radioterapií během 42denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Všechny pacienty, kteří dostávají TMZ, zvláště pacienty dostávající steroidy, je třeba pečlivě sledovat kvůli výskytu PCP, a to bez ohledu na režim. U pacientů užívajících TMZ, zejména v kombinaci s dexamethasonem nebo jinými steroidy, byly hlášeny případy fatálního respiračního selhání.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatoxicita
Případy jaterního poškození včetně fatálního selhání jater byly hlášeny u pacientů užívajících TMZ (viz bod 4.8).
Před zahájením léčby je třeba provést jaterní testy. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu k fatálnímu selhání jater. U pacientů léčených ve 42denním cyklu je nutno provést jaterní testy v polovině tohoto cyklu.
Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu.
U pacientů se signifikantními abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může objevit několik nebo více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukémie (viz bod 4.8).
Antiemetická léčba
Při užívání TMZ se velmi často vyskytuje nauzea a zvracení.
Před nebo po podání TMZ se může podat antiemetická léčba.
Dospělí pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi se doporučuje během monoterapeutické fáze.
Pacienti s recidivujícím nebo _progresivním maligním gliomem:
Pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4), bude zřejmě nutné podat antiemetika.
Laboratorní parametry
U pacientů léčených TMZ může dojít k myelosupresi, včetně dlouhotrvající pancytopenie, která může vést k aplastické anémii, jež v některých případech skončila fatálně. V některých případech souběžná expozice léčivým přípravkům spojeným s výskytem aplastické anémie, zahrnující karbamazepin, fenytoin a sulfamethoxazol/trimethoprim, hodnocení komplikuje. Před zahájením podávání léku by měly být splněny následující laboratorní parametry:
ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech, dokud nebude ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, měla by být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky jsou 100 mg/ m2, 150 mg/ m2 a 200 mg/ m2. Nejnižší doporučená dávka je 100 mg/ m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku nad 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ by měli být upozorněni na to, aby do 6 měsíců od užití poslední dávky nepočali dítě a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl-triazenoimidazolkarboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a ke zmenšení plochy pod křivkou koncentrace (AuC) o 9 %.
Protože nelze vyloučit, že změna Cmax může být klinicky významná, neměl by se Temozolomide Accord podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že clearance TMZ nebyla ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů a fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, avšak statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Vzhledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku je třeba doporučit používání účinné kontracepce k zabránění otěhotnění během užívání TMZ.
Žádné údaje o podávání léku těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří dostávali dávku 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Temozolomide Accord by neměl být podáván těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení by se proto mělo po dobu léčby TMZ přerušit.
Mužská plodnost
TMZ může mít genotoxické účinky. Proto se mužům léčeným TMZ nedoporučuje, aby do 6 měsíců po užití poslední dávky počali dítě. Naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě TMZ, ještě před zahájením léčby konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
TMZ má malý vliv na schopnost řídit nebo obsluhovat stroje v důsledku únavy a ospalosti (viz bod 4.8.).
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
U pacientů léčených TMZ, ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující po RT v případě nově diagnostikovaného multiformního glioblastomu, nebo ve formě monoterapie u pacientů s recidivujícím nebo progresivním gliomem, byly velmi často hlášené podobné nežádoucí účinky jako: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. Křeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ souběžně s RT nebo také ve formě monoterapie a často u pacientů s recidivujícím gliomem.
Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (tabulky 4 a 5), četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100), vzácné ((> 1/10 000 až < 1/1000 ); velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | ||
|
Třída orgánového |
TMZ + souběžná RTn=288* |
TMZ monoterapie |
|
systému |
n=224 | |
|
Infekce a infestace | ||
|
Časté: |
Infekce, herpes simplex, infekce rány, faryngitida, orální kandidóza |
Infekce, orální kandidóza |
|
Méně časté: |
Herpes simplex, Herpes zoster, symptomy podobné chřipce | |
|
Poruchy krve a lymfatického systému | ||
|
Časté: |
Neutropenie, trombocytopenie, lymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie |
|
Endokrinní poruchy | ||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom |
|
Poruchy metabolismu a výživy | ||
|
Velmi časté: | ||
|
Časté: |
Hyperglykémie, pokles tělesné hmotnosti |
Pokles tělesné hmotnosti |
|
Méně časté: |
Hypokalémie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykémie, zvýšení tělesné hmotnosti |
|
Psychiatrické poruchy | ||
|
Časté: |
Úzkost, emoční labilita, |
Úzkost, deprese, emoční labilita, |
|
somnolence |
somnolence | |
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie |
|
Poruchy nervového systému | ||
|
Velmi časté: |
Konvulze, bolest hlavy | |
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha |
Hemiparéza, afázie, porucha rovnováhy, somnolence, |
|
rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (blíže neurčená), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes | |
|
Méně časté: |
Status epilepticus, extrapyramidová porucha, hemiparéza, ataxie, kognitivní porucha, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (blíže neurčená), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, smyslová porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané vidění, diplopie |
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest očí |
Zmenšená ostrost vidění, bolest očí, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závrať, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (blíže nespecifikovaná), gastroenteritida, hemeroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Velmi časté: |
Vyrážka, alopecie |
Vyrážka, alopecie |
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní reakce, abnormální pigmentace |
Erytém, abnormální pigmentace, zvýšené pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie muskuloskeletální bolest, myalgie |
|
Méně časté: |
Myopatie, bolest zad, muskuloskeletální bolest, myalgie |
Myopatie, bolest zad |
|
Poruchy ledvin a močových cest | ||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence |
|
Méně časté: | ||
|
Poruchy reprodukčního systému a prsu | ||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, kolpitida, bolest prsů |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Velmi časté: |
Únava |
Únava |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, zhoršení stavu, ztuhlost, změna barvy jazyka, parosmie, žízeň |
Astenie, edém obličeje, bolest, zhoršení stavu, ztuhlost, zubní potíže |
|
Vyšetření | ||
|
Časté: |
Zvýšení ALT |
Zvýšení ALT |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšení gama GT, zvýšení AST | |
|
*Pacient, který byl ranč |
omizován pouze do větve RT, dostával TMZ + RT. | |
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupně 3 nebo 4, včetně neutropenických případů. Stupeň 3 nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Recidivující nebo progresivní maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0 - 5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro recidivující nebo progresivní maligní gliom a po uvedení TMZ na trh.
Tabulka 5. Nežádoucí účinky u pacientů s recidivujícím nebo progresivním maligním gliomem
|
Infekce a infestace | |
|
Vzácné: |
Oportunní infekce včetně pneumonie způsobené PCP |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), thrombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anemie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: |
Somnolence, závratě, parestézie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce, včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4 % případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nejnižší hodnotou mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů.
Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nejnižších hodnot neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nejnižších hodnot krevních destiček. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12 % versus 5 %, a trombocytopenií (< 20 x 109/l), 9 % versus 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs. 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs. 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs. 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs. 0 % mužů.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Ačkoliv jsou údaje omezené, tolerance u dětí se očekává podobná jako u dospělých. Bezpečnost TMZ u dětí ve věku do 3 let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení přípravku na trh byly hlášeny další následující závažné nežádoucí účinky
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem, jako je cytomegalovirus, virus hepatitidy B1 |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné |
dlouhotrvající pancytopenie, aplastická anémie1 |
|
Novotvary benigní, maligní a blíže neurčené | |
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), sekundární malignity, včetně myeloidní leukémie |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie / pneumonitida, plicní fibróza, respirační selhání f |
|
Poruchy jater a žlučových cest* | |
|
Časté |
zvýšení jaterních enzymů |
|
Méně časté |
hyperbilirubinémie, cholestáza, hepatitida, poškození jater, selhání jater f |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
*Odhad frekvence výskytu na základě relevantních klinických studií f včetně fatálních případů
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V *.
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími účinky včetně suprese kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí k úmrtí. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby by měla být zajištěna podpůrná léčba.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n=287) nebo RT samotnou (n=286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jirovecii (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1 ,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) je vyšší ve větvi RT + TMZ. Přidání souběžně podávaného TMZ k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival=OS) ve srovnání s RT samotnou (Graf 1).
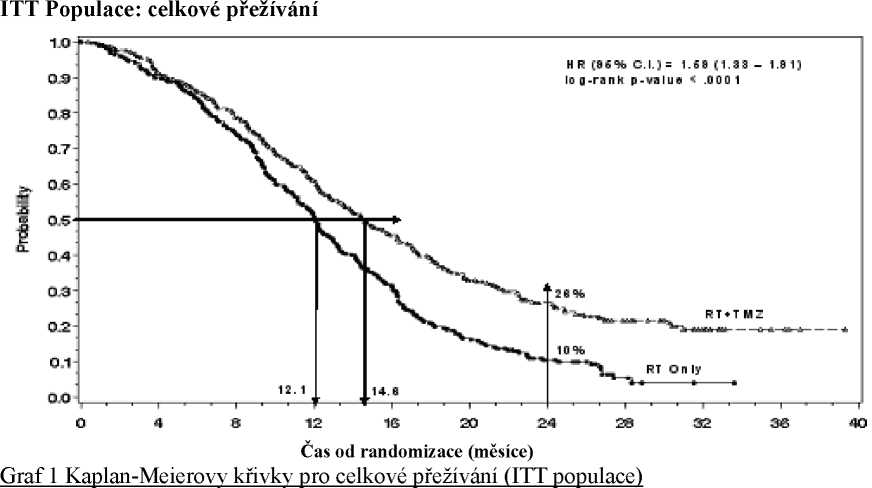
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním stavem (WHO PS=2, n=70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Recidivující nebo progresivní maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní stav [KPS] > 70), u něhož dochází k progresi nebo recidivě po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs. prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (progression-free survival, PFS), hodnocených na základě MRI nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6měsíční
PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl 5,4 měsíce. Objektivní počet terapeutických odpovědí (ORR) na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chí-kvadrát p=0,008) s mediánem PFS 2,89, respektive 1,88 měsíce (log rank p=0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p=0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p=0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS >80.
Údaje o době do zhoršení neurologického stavu, jakož i údaje o době do zhoršení výkonnostního stavu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p= < 0,01 - 0,03).
Recidivující anaplastický astrocytom
V multicentrické, prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PFS u 46 % léčených. Medián PFS činil 5,4 měsíce.
Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43 % částečných odpovědí) pro populaci intent-to-treat (ITT), n=162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu bez známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s recidivujícím gliomem mozkového kmene nebo recidivujícím astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-methyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~ 2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl t1/2 MTIC podobný jako pro TMZ,1,8 hodin.
Absorpce
Po perorálním podání dospělým pacientům se TMZ rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného TMZ byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %) a proto se neočekává, že by interagoval s látkami s vysokou vazebnou afinitou k proteinům.
PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku (CSF). Průnik do CSF byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 /o plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločas(ti/2) je přibližně 1,8 hodin. Hlavní způsob eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů.
Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní populace
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až střední jaterní dysfunkcí stejné jako profily u pacientů s normální funkcí jater.
U pediatrických pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání léku, 23 dnů bez léčby) 3 a 6 cyklů léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulární systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka, a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno 6 cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakanthomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po 3 měsících od zahájení podávání léku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve (Human eripheral Blood Lymphocyte - HPBL) prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky:
Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu typu A Kyselina vinná Kyselina stearová
Obal tobolky:
Želatina
Oxid titaničitý (E171)
Žlutý oxid železitý (E172) Indigokarmín (E132)
Čištěná voda
Potisk:
Šelak
Propylenglykol
Černý oxid železitý (E172)
Hydroxid draselný
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce., aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a velikost balení
Lahvička
uzávěrem a
Lahvičky z hnědého skla třídy III s polypropylenovým dětským bezpečnostním vysoušedlem, obsahující 5 nebo 20 tvrdých tobolek.
Krabička obsahuje jednu lahvičku.
Sáček
Sáček z polyesteru/hliníku/polyethylenu (PET/alu/PE).
Jeden sáček obsahuje 1 tvrdou tobolku.
Balení obsahuje 5 nebo 20 tvrdých tobolek jednotlivě balených v sáčcích.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky se nesmí otevírat. Pokud dojde k poškození tobolky, zabraňte kontaktu jejího práškového obsahu s kůží a sliznicemi. Pokud přijde Temozolomide Accord do styku s kůží nebo sliznicí, je třeba ho neprodleně a řádně smýt mýdlem a vodou.
Pacientům by mělo být doporučeno uchovávat tobolky mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Náhodné požití může být pro děti smrtelné.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
8. REGISTRAČNÍ ČÍSLO (A)
EU/1/10/615/001
EU/1/10/615/002
EU/1/10/615/025
EU/1/10/615/026
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. března 2010
Datum posledního prodloužení registrace: 12. ledna 2015
10. DATUM REVIZE TEXTU
DD.MM.RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/
1. NÁZEV PŘÍPRAVKU
Temozolomide Accord 20 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje temozolomidum 20 mg.
Pomocné látky se známým účinkem:
Jedna tvrdá tobolka obsahuje 14,6 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Tvrdé tobolky jsou žluté/bílé tvrdé želatinové tobolky s vyraženým “TMZ” na víčku & ‘20’ na těle tobolky.
Tobolka je přibližně 11 mm dlouhá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Temozolomide Accord je indikován k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně
s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je
multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
4.2 Dávkování a způsob podání
Temozolomid smí předepisovat výhradně lékař se zkušenostmi s onkologickou léčbou mozkových nádorů.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Temozolomide Accord je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ) (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofilů(ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- všeobecná kritéria toxicity (CTC - common toxicity criteria) nehematologické toxicity < stupeň 1 (s výjimkou alopecie, nauzey a zvracení).
Během léčby se má každý týden vyšetřit celkový krevní obraz. Podávání TMZ má být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v tabulce 1.
Tabulka 1. Přerušení nebo ukončení podávání TMZ během souběžné léčby radioterapií a TMZ
|
Toxicita |
TMZ přerušení3 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
>0,5 a < 1,5 x 109 /l |
< 0,5 x 109 /l |
|
Počet trombocytů |
>10 a < 100 x 109 /l |
< 10 x 109 /l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
|
a : Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109/l; počet trombocytů > 100 x 109/l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení). | ||
Monoterapeutická fáze
Čtyři týdny po ukončené souběžné fázi TMZ + RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka Cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je > 1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže se dávka nezvýšila v cyklu 2, nemělo by se zvýšení provádět v následných cyklech. Byla-li zvýšena, dávka zůstává na úrovni 200 mg/m2 na den po dobu prvních 5 dnů každého následujícího cyklu, pokud se však neobjeví toxicita. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze by se mělo provádět podle tabulek 2 a 3.
V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka se má redukovat nebo podávání přípravku ukončit podle tabulky 3.
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu
|
Úroveň dávky |
Dávka TMZ (mg/m2 /den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během cyklu 1 |
|
1 |
200 |
Dávka během cyklů 2-6 při absenci toxicity |
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby
|
Toxicita |
Redukce TMZ o 1 úroveň dávky a |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109 /l |
Viz poznámka pod čarou b |
|
Počet trombocytů |
< 50 x 109 /l |
Viz poznámka pod čarou b |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
|
a : Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b : TMZ se ukončí jestliže: • výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita • jestliže se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení). | ||
Dospělí pacienti a děti ve věku 3 let nebo starší s recidivujícím nebo progresivním maligním gliomem:
Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, je zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní populace
Pediatrická populace
U dětí ve věku 3 let nebo starších by se měl TMZ používat pouze k léčbě recidivujícího nebo progresivního maligního gliomu. Zkušenosti u těchto dětí jsou velmi omezené (viz body 4.4 a 5.1). Bezpečnost a účinnost TMZ u dětí do 3 let nebyla stanovena. Nejsou dostupné žádné údaje.
Pacienti se sníženou funkcí jater nebo ledvin
Farmakokinetika TMZ je u pacientů s normální jaterní funkcí a s mírnou nebo středně těžkou jaterní dysfunkcí srovnatelná. Údaje o podání TMZ u pacientů s těžkou jaterní nedostatečností (Třída C podle Childovy klasifikace) ani s dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou jaterní dysfunkcí nebo dysfunkcí ledvin jakéhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto pacientům je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že hodnota clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podání
Temozolomide Accord se podává nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, neměla by být další dávka podána tentýž den.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita na dakarbazin (DTIC).
Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jirovecii) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
Pneumonie vyvolaná Pneumocystis jirovecii
U pacientů, kteří dostávali souběžně TMZ a radioterapii v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jirovecii (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří jsou souběžně léčeni TMZ a radioterapií během 42denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Všichny pacienty, kteří dostávají TMZ, zvláště pacienty dostávající steroidy, je třeba pečlivě sledovat kvůli výskytu PCP, a to bez ohledu na režim. U pacientů užívajících TMZ, zejména v kombinaci s dexamethasonem nebo jinými steroidy, byly hlášeny případy fatálního respiračního selhání steroidy.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatoxicita
Případy jaterního poškození včetně fatálního selhání jater byly hlášeny u pacientů užívajících TMZ (viz bod 4.8).
Před zahájením léčby je třeba provést jaterní testy. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu k fatálnímu selhání jater.
U pacientů léčených ve 42denním cyklu je nutno provést jaterní testy v polovině tohoto cyklu.
Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu. U pacientů se signifikantními abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může objevit několik nebo více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukémie (viz bod 4.8).
Antiemetická léčba
Při užívání TMZ se velmi často vyskytuje nauzea a zvracení. Před nebo po podání TMZ se může podat antiemetická léčba.
Dospělí pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi se doporučuje během monoterapeutické fáze.
Pacienti s recidivujícím nebo _progresivním maligním gliomem:
Pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4), bude zřejmě nutné podat antiemetika.
Laboratorní parametry
U pacientů léčených TMZ může dojít k myelosupresi, včetně dlouhotrvající pancytopenie, která může vést k aplastické anémii, jež v některých případech skončila fatálně. V některých případech souběžná expozice léčivým přípravkům spojeným s výskytem aplastické anémie, zahrnující karbamazepin, fenytoin a sulfamethoxazol/trimethoprim, hodnocení komplikuje. Před zahájením podávání léku by měly být splněny následující laboratorní parametry:
ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech, dokud nebude ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, měla by být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky jsou 100 mg/ m2, 150 mg/ m2 a 200 mg/ m2. Nejnižší doporučená dávka je 100 mg/ m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku nad 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ by měli být upozorněni nato, aby do 6 měsíců od užití poslední dávky nepočali dítě a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl-triazenoimidazolkarboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a ke zmenšení plochy pod křivkou koncentrace (AuC) o 9 %.
Protože nelze vyloučit, že změna Cmax může být klinicky významná, neměl by se Temozolomide Accord podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že clearance TMZ nebyla ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů a fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, avšak statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Vzledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese. Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku je třeba doporučit používání účinné kontracepce k zabránění otěhotnění během užívání TMZ.
Žádné údaje o podávání léku těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří dostávali dávku 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Temozolomide Accord by neměl být podáván těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení by se proto mělo po dobu léčby TMZ přerušit.
Mužská plodnost
TMZ může mít genotoxické účinky. Proto se mužům léčeným TMZ nedoporučuje, aby do 6 měsíců po užití poslední dávky počali dítě. Naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě TMZ, ještě před zahájením léčby konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.
TMZ má malý vliv na schopnost řídit nebo obsluhovat stroje v důsledku únavy a ospalosti (viz bod 4.8.).
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
U pacientů léčených TMZ ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující po RT v případě nově diagnostikovaného multiformního glioblastomu nebo ve formě monoterapie u pacientů s recidivujícím nebo progresivním gliomem, byly velmi často hlášené podobné nežádoucí účinky jako: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. Křeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ souběžně s RT nebo také ve formě monoterapie a často u pacientů s recidivujícím gliomem.
Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (tabulky 4 a 5), četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100) , vzácné ((> 1/10 000 až < 1/1000 );velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Nově diagnostikovaný multiformní glioblastom
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | ||
|
Třída orgánového |
TMZ + souběžná RT |
TMZ monoterapie |
|
systému |
n=288* |
n=224 |
|
Infekce a infestace | ||
|
Časté: |
Infekce, herpes simplex, infekce rány, faryngitida, orální kandidóza |
Infekce, orální kandidóza |
|
Méně časté: |
Herpes simplex, Herpes zoster, symptomy podobné chřipce | |
|
Poruchy krve a lymfatického systému | ||
|
Časté: |
Neutropenie, trombocytopenie, ymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie |
|
Endokrinní poruchy | ||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom |
|
Poruchy metabolismu a výživy | ||
|
Velmi časté: | ||
|
Časté: |
Hyperglykémie, pokles tělesné hmotnosti |
Pokles tělesné hmotnosti |
|
Méně časté: |
Hypokalémie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykémie, zvýšení tělesné hmotnosti |
|
Psychiatrické poruchy | ||
|
Časté: |
Úzkost, emoční labilita, |
Úzkost, deprese, emoční labilita, |
|
somnolence |
somnolence | |
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie |
|
Poruchy nervového systému | ||
|
Velmi časté: |
Konvulze, bolest hlavy | |
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
Hemiparéza, afázie, porucha rovnováhy, somnolence, zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (blíže neurčená), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes |
|
Méně časté: |
Status epilepticus, extrapyramidová porucha, hemiparéza, ataxie, kognitivní porucha, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (blíže neurčená), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, smyslová porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané vidění, diplopie |
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest očí |
Zmenšená ostrost vidění, bolest očí, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závrať, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (blíže nespecifikovaná), gastroenteritida, hemeroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní |
Erytém, abnormální pigmentace, |
|
reakce, abnormální pigmentace |
zvýšené pocení | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie muskuloskeletální bolest, myalgie |
|
Méně časté: |
Myopatie, bolest zad, muskuloskeletální bolest, myalgie |
Myopatie, bolest zad |
|
Poruchy ledvin a močových cest | ||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence |
|
Méně časté: | ||
|
Poruchy reprodukčního systému a prsu | ||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, kolpitida, bolest prsů |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Velmi časté: |
Únava |
Únava |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, |
Astenie, edém obličeje, bolest, |
|
zhoršení stavu, ztuhlost, změna |
zhoršení stavu, ztuhlost, zubní | |
|
barvy jazyka, parosmie, žízeň |
potíže | |
|
Vyšetření | ||
|
Časté: |
Zvýšení ALT |
Zvýšení ALT |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšení gama GT, zvýšení AST | |
*Pacient, který byl randomizován pouze do větve RT, dostával TMZ + RT.
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupně 3 nebo 4, včetně neutropenických případů. Stupeň 3 nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Recidivující nebo progresivní maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0 - 5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro recidivující nebo progresivní maligní gliom a po uvedení TMZ na trh.
Tabulka 5. Nežádoucí účinky u pacientů s recidivujícím nebo progresivním maligním gliomem
|
Infekce a infestace | |
|
Vzácné: |
Oportunní infekce včetně pneumonie způsobené PCP |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), thrombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anemie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: Somnolence, závratě, parestézie | |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: Dyspnoe | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce, včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4 % případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nejnižší hodnotou mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů. Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nejnižších hodnot neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nejnižších hodnot krevních destiček. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12 % versus 5 %, a trombocytopenií (< 20 x 109/l), 9 % versus 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs. 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs. 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs. 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs. 0 % mužů.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Ačkoliv jsou údaje omezené, tolerance u dětí se očekává podobná jako u dospělých. Bezpečnost TMZ u dětí ve věku do 3 let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení přípravku na trh byly hlášeny další následující závažné nežádoucí účinky
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem, jako je cytomegalovirus, virus hepatitidy Bf |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné |
dlouhotrvající pancytopenie, aplastická anémief |
|
Novotvary benigní, maligní a blíže neurčené | |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), sekundární malignity, včetně myeloidní leukémie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie / pneumonitida, plicní fibróza, respirační selhání f |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Poruchy jater a žlučových cest* | |
|
Časté: |
zvýšení jaterních enzymů |
|
Méně časté: |
hyperbilirubinémie, cholestáza,hepatitida poškození jater, selhání jater f |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
*Odhad frekvence výskytu na základě relevantních klinických studií f včetně fatálních případů
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného vDodatku V*.
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími účinky včetně suprese kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí k úmrtí. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby by měla být zajištěna podpůrná léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatikastatní alkylační látky, ATC kód: L01A X03 Mechanismus účinku
Temozolomid je triazen, který za fyziologické hodnoty pH prochází rychlou chemickou konverzí na aktivní sloučeninu monomethyl-triazenoimidazol-karboxamid (MTIC). Předpokládá se, že cytotoxické účinky MTIC jsou primárně důsledkem alkylace na O6 pozici guaninu, s následnou alkylací rovněž na pozici N7. Následně vznikající cytotoxické léze jsou vysvětlovány nejspíše aberantní reparací methylovaného aduktu.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n=287) nebo RT samotnou (n=286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jirovecii (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1 ,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) je vyšší ve větvi RT + TMZ. Přidání souběžně podávaného TMZ k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival=OS) ve srovnání s RT samotnou (Graf 1).
ITT Populace: celkové přežívání
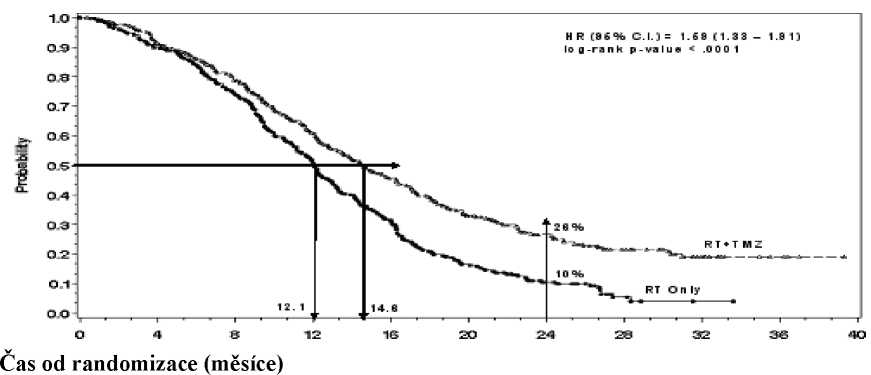
Graf 1 Kaplan-Meierovy křivky pro celkové přežívání (ITT populace)
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním stavem (WHO PS=2, n=70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Recidivující nebo progresivní maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní stav [KPS] > 70), u něhož dochází k progresi nebo recidivě po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs. prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (progression-free survival, PFS), hodnocených na základě MRI nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6 měsíční PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl 5,4 měsíce. Objektivní počet terapeutických odpovědí (ORR) na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chr-kvadrát p=0,008) s mediánem PFS 2,89, respektive 1,88 měsíce (log rank p=0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p=0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p=0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS >80.
Údaje o době do zhoršení neurologického stavu, jakož i údaje o době do zhoršení výkonnostního stavu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p= < 0,01 - 0,03).
Recidivující anaplastický astrocytom
V multicentrické, prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PFS u 46 % léčených. Medián PFS činil 5,4 měsíce.
Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43 % částečných odpovědí) pro populaci intent-to-treat (ITT), n=162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu bez známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s recidivujícím gliomem mozkového kmene nebo recidivujícím astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-methyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~ 2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl ti/2 MTIC podobný jako pro TMZ,1,8 hodin.
Absorpce
Po perorálním podání dospělým pacientům se temozolomid rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného temozolomidu byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %) a proto se neočekává, že by interagoval s látkami s vysokou vazebnou afinitou k proteinům.
PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku (CSF). Průnik do CSF byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 % plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločasit^) je přibližně 1,8 hodin. Hlavní způsob eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů.
Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní populace
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až střední jaterní dysfunkcí stejné jako profily u pacientů s normální funkcí jater.
U pediatrických pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání léku, 23 dnů bez léčby) 3 a 6 cyklů léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulární systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka, a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno 6 cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakanthomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po 3 měsících od zahájení podávání léku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve (Human eripheral Blood Lymphocyte - HPBL) prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky:
Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu typu A Kyselina vinná Kyselina stearová
Obal tobolky:
Želatina
Čištěná voda
Oxid titaničitý (E171)
Žlutý oxid železitý (E172)
Potisk:
Šelak
Propylenglykol
Černý oxid železitý (E172)
Hydroxid draselný
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a velikost balení
Lahvička
Lahvičky z hnědého skla třídy III s polypropylenovým dětským bezpečnostním uzávěrem a vysoušedlem, obsahující 5 nebo 20 tvrdých tobolek.
Krabička obsahuje jednu lahvičku.
Sáček
Sáček z polyesteru/hliníku/polyethylenu (PET/alu/PE).
Jeden sáček obsahuje 1 tvrdou tobolku.
Balení obsahuje 5 nebo 20 tvrdých tobolek jednotlivě balených v sáčcích.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky by neměly být otevřeny. Pokud dojde k poškození tobolky, zabraňte kontaktu jejího práškového obsahu s kůží a sliznicemi. Pokud přijde Temozolomide Accord do styku s kůží nebo sliznicí, je třeba neprodleně a řádně ho smýt mýdlem a vodou.
Pacientům by mělo být doporučeno uchovávat tobolky mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Náhodné požití může být pro děti smrtelné.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
8. REGISTRAČNÍ ČÍSLO (A)
EU/1/10/615/005
EU/1/10/615/006
EU/1/10/615/027
EU/1/10/615/028
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. března 2010
Datum posledního prodloužení registrace: 12. ledna 2015 1
DD.MM:RRRR
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu/
NÁZEV PŘÍPRAVKU
1.
Temozolomide Accord 100 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tvrdá tobolka obsahuje temozolomidum 100 mg.
Pomocné látky se známým účinkem:
Jedna tvrdá100 mg tobolka obsahuje 73 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Tvrdé tobolky jsou růžové/bílé tvrdé želatinové tobolky s vyraženým “TMZ” na víčku & ‘100’ na těle tobolky.
Tobolka je přibližně 15 mm dlouhá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Temozolomide Accord je indikován k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
4.2 Dávkování a způsob podání
Temozolomid smí předepisovat výhradně lékař se zkušenostmi s onkologickou léčbou mozkových
nádorů.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Temozolomide Accord je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ) (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofílů(ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- všeobecná kritéria toxicity (CTC - common toxicity criteria) nehematologícké toxicity < stupeň 1 (s výjimkou alopecie, nevolnosti a zvracení).
Během léčby se má každý týden vyšetřit celkový krevní obraz. Podávání TMZ má být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v tabulce 1.
Z
|
Toxicita |
TMZ přerušení3 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
>0,5 a < 1,5 x 109 /l |
< 0,5 x 109 /l |
|
Počet trombocytů |
>10 a < 100 x 109 /l |
< 10 x 109 /l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
|
a : Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109/l; počet trombocytů > 100 x 109/l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení). | ||
Monoterapeutická fáze
Čtyři týdny po ukončené souběžné fázi TMZ +RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je > 1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže se dávka nezvýšila v cyklu 2, nemělo by se zvýšení provádět v následných cyklech. Byla-li zvýšena dávka, zůstává na úrovni 200 mg/m2 na den po dobu prvních 5 dnů každého následujícího cyklu, pokud se však neobjeví toxicita. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze by se mělo provádět podle tabulek 2 a 3.
V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka se má redukovat nebo podávání přípravku ukončit podle tabulky 3.
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu
|
Úroveň dávky |
Dávka TMZ (mg/m2 /den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během cyklu 1 |
|
1 |
200 |
Dávka během cyklů 2-6 při absenci toxicity |
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby
|
Toxicita |
Redukce TMZ o 1 úroveň dávky a |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109 /l |
Viz poznámka pod čarou b |
|
Počet trombocytů |
< 50 x 109 /l |
Viz poznámka pod čarou b |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
|
a : Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b : TMZ se ukončí jestliže: | ||
• výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita
• jestliže se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení).
Dospělí_pacienti a děti ve věku 3 let nebo starší s recidivujícím nebo _progresivním maligním gliomem:
Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, je zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní populace
Pediatrická populace
U dětí ve věku 3 let nebo starších by se měl TMZ používat pouze k léčbě recidivujícího nebo progresivního maligního gliomu. Zkušenosti u těchto dětí jsou velmi omezené (viz body 4.4 a 5.1). Bezpečnost a účinnost TMZ u dětí do 3 let nebyla stanovena. Nejsou dostupné žádné údaje.
Pacienti se sníženou funkcí jater nebo ledvin
FarmakokinetikaTMZ je u pacientů s normální jaterní fúnkcí a s mírnou nebo středně těžkou jaterní dysfúnkcí srovnatelná. Údaje o podání TMZ u pacientů s těžkou jaterní nedostatečností (Třída C podle Childovy klasifikace) ani s dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou jaterní dysfunkcí nebo dysfunkcí ledvin jakéhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto pacientům je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že hodnota clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podání
Temozolomide Accord se podává nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, neměla by být další dávka podána tentýž den.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita na dakarbazin (DTIC).
Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jirovecii) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
U pacientů, kteří dostávali souběžně léčeni TMZ a radioterapii v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jirovecii (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří jsou souběžně léčeni TMZ a radioterapií během 42 denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Všechny pacienty, kteří dostávají TMZ, zvláště pacienty dostávající steroidy, je třeba pečlivě sledovat kvůli výskytu PCP, a to bez ohledu na režim.
U pacientů užívajících TMZ, zejména v kombinaci s dexamethasonem nebo jinými steroidy, byly hlášeny případy fatálního respiračního selhání.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatoxicita
Případy jaterního poškození včetně fatálního selhání jater byly hlášeny u pacientů užívajících TMZ (viz bod 4.8).
Před zahájením léčby je třeba provést jaterní testy. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu k fatálnímu selhání jater. U pacientů léčených ve 42denním cyklu je nutno provést jaterní testy v polovině tohoto cyklu.
Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu.
U pacientů se signifikantními abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může objevit několik nebo více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukémie (viz bod 4.8).
Antiemetická léčba
Při užívání TMZ se velmi často vyskytuje nauzea a zvracení Před nebo po podání TMZ se může podat antiemetická léčba.
Dospělí pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi se doporučuje během monoterapeutické fáze.
Pacienti s recidivujícím nebo _progresivním maligním gliomem:
Pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4), bude zřejmě nutné podat antiemetika.
Laboratorní parametry
U pacientů léčených TMZ může dojít k myelosupresi, včetně dlouhotrvající pancytopenie, která může vést k aplastické anémii, jež v některých případech skončila fatálně. V některých případech souběžná expozice léčivým přípravkům spojeným s výskytem aplastické anémie, zahrnující karbamazepin, fenytoin a sulfamethoxazol/trimethoprim, hodnocení komplikuje. Před zahájením podávání léku by měly být splněny následující laboratorní parametry:
ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech , dokud nebude ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, měla by být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky jsou 100 mg/ m2, 150 mg/ m2 a 200 mg/ m2. Nejnižší doporučená dávka je 100 mg/ m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku nad 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ by měli být upozorněni na to, aby do 6 měsíců od užití poslední dávky nepočali dítě a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl-triazenoimidazolkarboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a ke zmenšení plochy pod křivkou koncentrace (AUC) o 9 %.
Protože nelze vyloučit, že změna Cmax může být klinicky významná, neměl by se Temozolomide Accord podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že clearance TMZ nebyla ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů a fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, avšak statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Vzhledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku je třeba doporučit používání účinné kontracepce k zabránění otěhotnění během užívání TMZ.
Žádné údaje o podávání léku těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří dostávali dávku 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Temozolomide Accord by neměl být podáván těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení by se proto mělo po dobu léčby TMZ přerušit.
Mužská plodnost
TMZ může mít genotoxické účinky. Proto se mužům léčeným TMZ nedoporučuje, aby do 6 měsíců po užití poslední dávkypočali dítě. Naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě TMZ, aby ještě před zahájením léčby konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.nevratné neplodnosti způsobené léčbou temozolomidem,
4.7 Účinky na schopnost řídit a obsluhovat stroje
TMZ má malý vliv na schopnost řídit nebo obsluhovat stroje v důsledku únavy a ospalosti (viz od 4.8.).
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
U pacientů léčených TMZ ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující po RT v případě nově diagnostikovaného multiformního glioblastomu, nebo ve formě monoterapie u pacientů s recidivujícím nebo progresivním gliomem, byly velmi často hlášené podobné nežádoucí účinky jako: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. Křeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ souběžně s RT nebo také ve formě monoterapie a často u pacientů s recidivujícím gliomem. Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (tabulky 4 a 5), četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100) , vzácné ((> 1/10 000 až < 1/1000 );velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | ||
|
Třída orgánového |
TMZ + souběžná RT |
TMZ monoterapie |
|
systému |
n=288* |
n=224 |
|
Infekce a infestace | ||
|
Časté: |
Infekce, herpes simplex, infekce rány, faryngitida, orální kandidóza |
Infekce, orální kandidóza |
|
Méně časté: |
Herpes simplex, Herpes zoster, symptomy podobné chřipce | |
|
Poruchy krve a lymfatického systému | ||
|
Časté: |
Neutropenie, trombocytopenie, lymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie |
|
Endokrinní poruchy | ||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom |
|
Poruchy metabolismu a výživy | ||
|
Velmi časté: | ||
|
Časté: |
Hyperglykémie, pokles tělesné hmotnosti |
Pokles tělesné hmotnosti |
|
Méně časté: |
Hypokalémie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykémie, zvýšení tělesné hmotnosti |
|
Psychiatrické poruchy | ||
|
Časté: |
Úzkost, emoční labilita, |
Úzkost, deprese, emoční labilita, |
|
somnolence |
somnolence | |
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie |
|
Poruchy nervového systému | ||
|
Velmi časté: |
Konvulze, bolest hlavy | |
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha |
Hemiparéza, afázie, porucha rovnováhy, somnolence, |
|
rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (blíže neurčená), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes | |
|
Méně časté: |
Status epilepticus, extrapyramidová porucha, hemiparéza, ataxie, kognitivní porucha, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (blíže neurčená), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, smyslová porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané |
|
vidění, diplopie | ||
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest očí |
Zmenšená ostrost vidění, bolest očí, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závrať, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (blíže nespecifikovaná), gastroenteritida, hemeroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Velmi časté: |
Vyrážka, alopecie |
Vyrážka, alopecie |
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní reakce, abnormální pigmentace |
Erytém, abnormální pigmentace, zvýšené pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie muskuloskeletální bolest, myalgie |
|
Méně časté: |
Myopatie, bolest v zádech, muskuloskeletální bolest, myalgie |
Myopatie, bolest v zádech |
|
Poruchy ledvin a močových cest | ||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence |
|
Méně časté: | ||
|
Poruchy reprodukčního systému a prsu | ||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, kolpitida, bolest prsů |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Velmi časté: |
Únava |
Únava |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, zhoršení stavu, ztuhlost, změna barvy jazyka, parosmie, žízeň |
Astenie, edém obličeje, bolest, zhoršení stavu, ztuhlost, zubní potíže |
|
Vyšetření | ||
|
Časté: |
Zvýšení ALT |
Zvýšení ALT |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšení gama GT, zvýšení AST | |
*Pacient, který byl randomizován pouze do větve RT, dostával TMZ + RT.
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupně 3 nebo 4, včetně neutropenických případů. Stupeň 3 nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Recidivující nebo progresivní maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0 - 5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro recidivující nebo progresivní maligní gliom a po uvedení TMZ na trh.
Tabulka 5. Nežádoucí účinky u pacientů s recidivujícím nebo progresivním maligním gliomem
|
Infekce a infestace | |
|
Vzácné: |
Oportunní infekce včetně pneumonie způsobené PCP |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), thrombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anemie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: |
Somnolence, závratě, parestézie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce, včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4 % případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nejnižší hodnotou mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů.
Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nejnižších hodnot neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nejnižších hodnot krevních destiček. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12 % versus 5 %, a trombocytopenií (< 20 x 109/l), 9 % versus 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs. 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs. 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs. 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs. 0 % mužů.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Ačkoliv jsou údaje omezené, tolerance u dětí se očekává podobná jako u dospělých. Bezpečnost TMZ u dětí ve věku do 3 let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení přípravku na trh byly hlášeny další následující závažné nežádoucí účinky
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem, jako je cytomegalovirus, virus hepatitidy B1 |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné |
dlouhotrvající pancytopenie, aplastická anémie1 |
|
Novotvary benigní, maligní a blíže neurčené | |
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), sekundární malignity, včetně myeloidní leukémie |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie / pneumonitida, plicní fibróza, respirační selhání f |
|
Poruchy jater a žlučových cest* | |
|
Časté: |
zvýšení jaterních enzymů |
|
Méně časté: |
hyperbilirubinémie, cholestáza,hepatitida, poškození jater, selhání jater f |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
*Odhad frekvence výskytu na základě relevantních klinických studií f včetně fatálních případů
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími účinky včetně suprese kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí k úmrtí. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby by měla být zajištěna podpůrná léčba.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n=287) nebo RT samotnou (n=286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jirovecii (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1 ,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) je vyšší ve větvi RT + TMZ. Přidání souběžně podávaného temozolomidu k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival=OS) ve srovnání s RT samotnou (Graf 1).
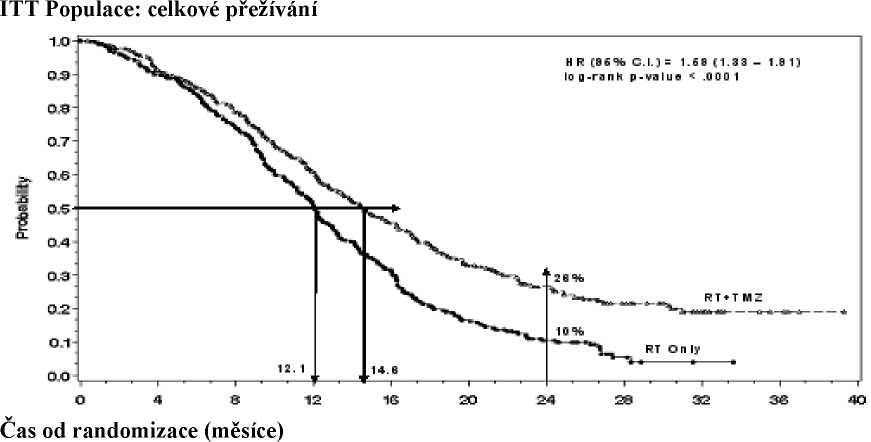
Graf 1 Kaplan-Meierovy křivky pro celkové přežívání (ITT populace)
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním stavem (WHO PS=2, n=70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Recidivující nebo progresivní maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní stav [KPS] > 70), u něhož dochází k progresi nebo recidivě po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs. prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (progression-free survival, PFS), hodnocených na základě MRI nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6 měsíční
PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl 5,4 měsíce. Objektivní počet terapeutických odpovědí (ORR) na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chf-kvadrát p=0,008) s mediánem PFS 2,89, respektive 1,88 měsíce (log rank p=0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p=0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p=0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS >80.
Údaje o době do zhoršení neurologického stavu, jakož i údaje o době do zhoršení výkonnostního stavu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p= < 0,01 - 0,03).
Recidivující anaplastický astrocytom
V multicentrické, prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PFS u 46 % léčených. Medián PFS činil 5,4 měsíce.
Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43 % částečných odpovědí) pro populaci intent-to-treat (ITT), n=162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu bez známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s recidivujícím gliomem mozkového kmene nebo recidivujícím astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-methyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~
2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl t1/2 MTIC podobný jako pro TMZ,1,8 hodin.
Absorpce
Po perorálním podání dospělým pacientům se TMZ rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného TMZ byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %) a proto se neočekává, že by interagoval s látkami s vysokou vazebnou afinitou k proteinům . PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku (CSF). Průnik do CSF byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 % plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločas(ti/2) je přibližně 1,8 hodin. Hlavní způsob eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů.
Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní populace
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až střední jaterní dysfunkcí stejné jako profily u pacientů s normální funkcí jater.
U pediatrických pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání léku, 23 dnů bez léčby) 3 a 6 cyklů léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulární systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka, a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno 6 cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakanthomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po 3 měsících od zahájení podávání léku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve (Human eripheral Blood Lymphocyte - HPBL) prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky:
Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu typu A Kyselina vinná Kyselina stearová
Obal tobolky:
Želatina
Čištěná voda
Oxid titaničitý (E171)
Červený oxid železitý (E172)
Potisk:
Šelak
Propylenglykol
Černý oxid železitý (E172)
Hydroxid draselný
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a velikost balení
Lahvička
uzávěrem a
Lahvičky z hnědého skla třídy III s polypropylenovým dětským bezpečnostním vysoušedlem, obsahující 5 nebo 20 tvrdých tobolek.
Krabička obsahuje jednu lahvičku.
Sáček
Sáček z polyesteru/hliníku/polyethylenu (PET/alu/PE).
Jeden sáček obsahuje 1 tvrdou tobolku.
Balení obsahuje 5 nebo 20 tvrdých tobolek jednotlivě balených v sáčcích.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky by neměly být otevřeny. Pokud dojde k poškození tobolky, zabraňte kontaktu jejího práškového obsahu s kůží a sliznicemi. Pokud přijde Temozolomide Accord do styku s kůží nebo sliznicí, je třeba neprodleně a řádně ho smýt mýdlem a vodou.
Pacientům by mělo být doporučeno uchovávat tobolky mimo dosah a dohled dětí, nejlépe v uzamčené skříni. Náhodné požití může být pro děti smrtelné.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
8. REGISTRAČNÍ ČÍSLO (A)
EU/1/10/615/009
EU/1/10/615/010
EU/1/10/615/029
NÁZEV PŘÍPRAVKU
1.
Temozolomide Accord 140 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje temozolomidum 140 mg.
Pomocné látky se známým účinkem:
Jedna tvrdá tobolka obsahuje 102.2 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Tvrdé tobolky jsou transparentní modré/bílé tvrdé želatinové tobolky s vyraženým “TMZ” na víčku & ‘140’ na těle tobolky.
Tobolka je přibližně 19 mm dlouhá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Temozolomide Accord je indikován k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
4.2 Dávkování a způsob podání
Temozolomid smí předepisovat výhradně lékař se zkušenostmi s onkologickou léčbou mozkových
nádorů.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Temozolomide Accord je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ) (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofílů(ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- všeobecná kritéria toxicity (CTC - common toxicity criteria) nehematologícké toxicity < stupeň 1 (s výjimkou alopecie, nauzey a zvracení).
Během léčby se má každý týden vyšetřit celkový krevní obraz. Podávání TMZ má být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v tabulce 1.
Tabulka 1. Přerušení nebo ukončení podávání TMZ během souběžné léčby radioterapií a TMZ
|
Toxicita |
TMZ přerušení3 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
>0,5 a < 1.5 x 109 /l |
< 0,5 x 109 /l |
|
Počet trombocytů |
>10 a < 100 x 109 /l |
< 10 x 109 /l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
|
a : Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109/l; počet trombocytů > 100 x 109/l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení). | ||
Monoterapeutická fáze
Čtyři týdny po ukončené souběžné fázi TMZ + RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je > 1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže se dávka nezvýšila v cyklu 2, nemělo by se zvýšení provádět v následných cyklech. Byla-li zvýšena dávka, zůstává na úrovni 200 mg/m2 na den po dobu prvních 5 dnů každého následujícího cyklu, pokud se však neobjeví toxicita. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze by se mělo provádět podle tabulek 2 a 3. V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka se má redukovat nebo podávání přípravku ukončit podle tabulky 3.
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu
|
Úroveň dávky |
Dávka TMZ (mg/m2 /den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během cyklu 1 |
|
1 |
200 |
Dávka během cyklů 2-6 při absenci toxicity |
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby
|
Toxicita |
Redukce TMZ o 1 úroveň dávky a |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109 /l |
Viz poznámka pod čarou b |
|
Počet trombocytů |
< 50 x 109 /l |
Viz poznámka pod čarou b |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
|
a : Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b : TMZ se ukončí jestliže: | ||
• výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita
• jestliže se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení).
Dospělí_pacienti a děti ve věku 3 let nebo starší s recidivujícím nebo _progresivním maligním gliomem:
Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, je zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní populace
Pediatrická populace
U dětí ve věku 3 let nebo starších by se měl TMZ používat pouze k léčbě recidivujícího nebo progresivního maligního gliomu. Zkušenosti u těchto dětí jsou velmi omezené (viz body 4.4 a 5.1). Bezpečnost a účinnost TMZ u dětí do 3 let nebyla stanovena. Nejsou dostupné žádné údaje.
Pacienti se sníženou funkcí jater nebo ledvin
FarmakokinetikaTMZ je u pacientů s normální jaterní fúnkcí a s mírnou nebo středně těžkou jaterní dysfúnkcí srovnatelná. Údaje o podání TMZ u pacientů s těžkou jaterní nedostatečností (Třída C podle Childovy klasifikace) ani s dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou jaterní dysfunkcí nebo dysfunkcí ledvin jakéhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto pacientům je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že hodnota clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podání
Temozolomide Accord se podává nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, neměla by být další dávka podána tentýž den.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 61. Hypersenzitivita na dakarbazin (DTIC).
Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jirovecii) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
U pacientů, kteří dostávali souběžně TMZ a radioterapii v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jirovecii (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří jsou souběžně léčeni TMZ a radioterapií během 42denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Všechny pacienty, kteří dostávají TMZ, zvláště pacienty dostávající steroidy, je třeba pečlivě sledovat kvůli výskytu PCP, a to bez ohledu na režim.
U pacientů užívajících TMZ, zejména v kombinaci s dexamethasonem nebo jinými steroidy, byly hlášeny případy fatálního respiračního selhání.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatoxicita
Případy jaterního poškození včetně fatálního selhání jater byly hlášeny u pacientů užívajících TMZ (viz bod 4.8).
Před zahájením léčby je třeba provést jaterní testy. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu k fatálnímu selhání jater. U pacientů léčených ve 42denním cyklu je nutno provést jaterní testy v polovině tohoto cyklu.
Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu.
U pacientů se signifikantními abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může objevit několik nebo více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukémie (viz bod 4.8).
Antiemetická léčba
Při užívání TMZ se velmi často vyskytuje nauzea a zvracení.
Před nebo po podání TMZ se může podat antiemetická léčba.
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi se doporučuje během monoterapeutické fáze.
Pacienti s recidivujícím nebo progresivním maligním gliomem:
Pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4), bude zřejmě nutné podat antiemetika.
Laboratorní parametry
U pacientů léčených TMZ může dojít k myelosupresi, včetně dlouhotrvající pancytopenie, která může vést k aplastické anémii, jež v některých případech skončila fatálně. V některých případech souběžná expozice léčivým přípravkům spojeným s výskytem aplastické anémie, zahrnující karbamazepin, fenytoin a sulfamethoxazol/trimethoprim, hodnocení komplikuje. Před zahájením podávání léku by měly být splněny následující laboratorní parametry:
ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech, dokud nebude ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, měla by být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky jsou 100 mg/ m2, 150 mg/ m2 a 200 mg/ m2. Nejnižší doporučená dávka je 100 mg/ m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku nad 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ by měli být upozorněni na to, aby do 6 měsíců od užití poslední dávky nepočali dítě a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, s deficitem laktázy typu Lapp nebo glukózo-galaktózovou malabsorpcí by proto neměli tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl-triazenoimidazolkarboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a ke zmenšení plochy pod křivkou koncentrace (AUC) o 9 %.
Protože nelze vyloučit, že změna Cmax může být klinicky významná, neměl by se Temozolomide Accord podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že clearance TMZ nebyla ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů a fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, avšak statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Vzhledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese. Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku.
Ženám ve fertilním věku je třeba doporučit používání účinné kontracepce k zabránění otěhotnění během užívání TMZ.
Žádné údaje o podávání léku těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří dostávali dávku 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Temozolomide Accord by neměl být podáván těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení by se proto mělo po dobu léčby TMZ přerušit.
Mužská plodnost
TMZ může mít genotoxické účinky. Proto se mužům léčeným TMZ nedoporučuje, aby do 6 měsíců po užití poslední dávky počali dítě. Naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě TMZ, ještě před zahájením léčby konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Schopnost řízení motorových vozidel a obsluhy strojů může být snížena u pacientů léčených Temozolomidem v důsledku únavy a ospalosti.
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
U pacientů léčených TMZ, ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující po RT v případě nově diagnostikovaného multiformního glioblastomu, nebo ve formě monoterapie u pacientů s recidivujícím nebo progresivním gliomem, byly velmi často hlášené podobné nežádoucí účinky jako: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. Křeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ souběžně s RT nebo také ve formě monoterapie a často u pacientů s recidivujícím gliomem. Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (tabulky 4 a 5), četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100) vzácné ((> 1/10 000 až < 1/1000 );velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | ||
|
Třída orgánového |
TMZ + souběžná RT |
TMZ monoterapie |
|
systému |
n=288* |
n=224 |
|
Infekce a infestace | ||
|
Časté: |
Infekce, herpes simplex, infekce rány, faryngitida, orální kandidóza |
Infekce, orální kandidóza |
|
Méně časté: |
Herpes simplex, Herpes zoster, symptomy podobné chřipce | |
|
Poruchy krve a lymfatického systému | ||
|
Časté: |
Neutropenie, trombocytopenie, lymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie |
|
Endokrinní poruchy | ||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom |
|
Poruchy metabolismu a výživy | ||
|
Velmi časté: | ||
|
Časté: |
Hyperglykémie, pokles tělesné hmotnosti |
Pokles tělesné hmotnosti |
|
Méně časté: |
Hypokalémie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykémie, zvýšení tělesné hmotnosti |
|
Psychiatrické poruchy | ||
|
Časté: |
Úzkost, emoční labilita, |
Úzkost, deprese, emoční labilita, |
|
somnolence |
somnolence | |
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie |
|
Poruchy nervového systému | ||
|
Velmi časté: |
Konvulze, bolest hlavy | |
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha |
Hemiparéza, afázie, porucha rovnováhy, somnolence, |
|
rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (blíže neurčená), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes | |
|
Méně časté: |
Status epilepticus, extrapyramidová porucha, hemiparéza, ataxie, kognitivní porucha, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (blíže neurčená), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, smyslová porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané vidění, diplopie |
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest očí |
Zmenšená ostrost vidění, bolest očí, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závrať, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (blíže nespecifikovaná), gastroenteritida, hemeroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Velmi časté: |
Vyrážka, alopecie |
Vyrážka, alopecie |
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní reakce, abnormální pigmentace |
Erytém, abnormální pigmentace, zvýšené pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie muskuloskeletální bolest, myalgie |
|
Méně časté: |
Myopatie, bolest zad, muskuloskeletální bolest, myalgie |
Myopatie, bolest zad |
|
Poruchy ledvin a močových cest | ||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence |
|
Méně časté: | ||
|
Poruchy reprodukčního systému a prsu | ||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, kolpitida, bolest prsů |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Velmi časté: |
Únava |
Únava |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, zhoršení stavu, ztuhlost, změna barvy jazyka, parosmie, žízeň |
Astenie, edém obličeje, bolest, zhoršení stavu, ztuhlost, zubní potíže |
|
Vyšetření | ||
|
Časté: |
Zvýšení ALT |
Zvýšení ALT |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšení gama GT, zvýšení AST | |
|
*Pacient, který byl ranč |
omizován pouze do větve RT, dostával TMZ + RT. | |
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupně 3 nebo 4, včetně neutropenických případů. Stupeň 3 nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Recidivující nebo progresivní maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0 - 5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro recidivující nebo progresivní maligní gliom a po uvedení TMZ na trh.
Tabulka 5. Nežádoucí účinky u pacientů s recidivujícím nebo progresivním maligním gliomem
|
Infekce a infestace | |
|
Vzácné: |
Oportunní infekce včetně pneumonie způsobené PCP |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), thrombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anemie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: |
Somnolence, závratě, parestézie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce, včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4 % případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nejnižší hodnotou mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů.
Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nejnižších hodnot neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nejnižších hodnot krevních destiček. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12 % versus 5 %, a trombocytopenií (< 20 x 109/l), 9 % versus 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs. 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs. 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs. 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs. 0 % mužů.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Ačkoliv jsou údaje omezené, tolerance u dětí se očekává podobná jako u dospělých. Bezpečnost TMZ u dětí ve věku do 3 let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení přípravku na trh byly hlášeny další následující závažné nežádoucí účinky
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem, jako je cytomegalovirus, virus hepatitidy B1 |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné |
dlouhotrvající pancytopenie, aplastická anémie1 |
|
Novotvary benigní, maligní a blíže neurčené | |
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), sekundární malignity, včetně myeloidní leukémie |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie / pneumonitida, plicní fibróza, respirační selhání f |
|
Poruchy jater a žlučových cest* | |
|
Časté: |
zvýšení jaterních enzymů |
|
Méně časté: |
hyperbilirubinémie, cholestáza,hepatitida poškození jater, selhání jater f |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
*Odhad frekvence výskytu na základě relevantních klinických studií f včetně fatálních případů
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími účinky včetně suprese kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí k úmrtí. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby by měla být zajištěna podpůrná léčba.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n=287) nebo RT samotnou (n=286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jirovecii (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1 ,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) je vyšší ve větvi RT + TMZ. Přidání souběžně podávaného TMZ k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival=OS) ve srovnání s RT samotnou (Graf 1).
ITT Populace: celkové přežívání

Graf 1 Kaplan-Meierovy křivky pro celkové přežívání (ITT populace)
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním stavem (WHO PS=2, n=70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Recidivující nebo progresivní maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní stav [KPS] > 70), u něhož dochází k progresi nebo recidivě po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs. prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (progression-free survival, PFS), hodnocených na základě MRI nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6 měsíční
PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl 5,4 měsíce. Objektivní počet terapeutických odpovědí (ORR) na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chí-kvadrát p=0,008) s mediánem PFS 2,89, respektive 1,88 měsíce (log rank p=0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p=0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p=0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS >80.
Údaje o době do zhoršení neurologického stavu, jakož i údaje o době do zhoršení výkonnostního stavu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p= < 0,01 - 0,03).
Recidivující anaplastický astrocytom
V multicentrické, prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PFS u 46 % léčených. Medián PFS činil 5,4 měsíce.
Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43 % částečných odpovědí) pro populaci intent-to-treat (ITT), n=162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu bez známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s recidivujícím gliomem mozkového kmene nebo recidivujícím astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-methyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~
2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl t1/2 MTIC podobný jako pro TMZ,1,8 hodin.
Absorpce
Po perorálním podání dospělým pacientům se TMZ rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného TMZ byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %) a proto se neočekává, že by interagoval s látkami s vysokou vazebnou afinitou k proteinům.
PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku (CSF). Průnik do CSF byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 % plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločas(ti/2) je přibližně 1,8 hodin. Hlavní způsob eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů.
Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní populace
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až střední jaterní dysfunkcí stejné jako profily u pacientů s normální funkcí jater.
U pediatrických pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání léku, 23 dnů bez léčby) 3 a 6 cyklů léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulární systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka, a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno 6 cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakanthomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po 3 měsících od zahájení podávání léku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve (Human eripheral Blood Lymphocyte - HPBL) prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky:
Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu typu A Kyselina vinná Kyselina stearová
Obal tobolky:
Želatina Čištěná voda
Oxid titaničitý (E171)
Indigokarmín (E132)
Potisk:
Šelak
Propylenglykol
Černý oxid železitý (E172)
Hydroxid draselný
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a velikost balení
Lahvička
uzávěrem a
Lahvičky z hnědého skla třídy III s polypropylenovým dětským bezpečnostním vysoušedlem, obsahující 5 nebo 20 tvrdých tobolek.
Krabička obsahuje jednu lahvičku.
Sáček
Sáček z polyesteru/hliníku/polyethylenu (PET/alu/PE).
Jeden sáček obsahuje 1 tvrdou tobolku.
Balení obsahuje 5 nebo 20 tvrdých tobolek jednotlivě balených v sáčcích.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky by neměly být otevřeny. Pokud dojde k poškození tobolky, zabraňte kontaktu jejího práškového obsahu s kůží a sliznicemi. Pokud přijde Temozolomide Accord do styku s kůží nebo sliznicí, je třeba neprodleně a řádně ho smýt mýdlem a vodou.
Pacientům by mělo být doporučeno uchovávat tobolky mimo dosah a dohled dětí, nejlépe v uzamčené skříni. Náhodné požití může být pro děti smrtelné.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
8. REGISTRAČNÍ ČÍSLO (A)
EU/1/10/615/013
EU/1/10/615/014
EU/1/10/615/031
EU/1/10/615/032
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. března 2010
Datum posledního prodloužení registrace: 12. ledna 2015
10. DATUM REVIZE TEXTU DD.MM.YYYY
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu/
1. NÁZEV PŘÍPRAVKU
Temozolomide Accord 180 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje temozolomidum 180 mg.
Pomocné látky se známým účinkem:
Jedna tvrdá tobolka obsahuje 131.4 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Tvrdé tobolky jsou kaštanové / bílé tvrdé želatinové tobolky s vyraženým “TMZ” na víčku & ‘180’ na těle tobolky.
Tobolka je přibližně 19 mm dlouhá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Temozolomide Accord je indikován k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
4.2 Dávkování a způsob podání
Temozolomid smí předepisovat výhradně lékař se zkušenostmi s onkologickou léčbou mozkových
nádorů.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Temozolomide Accord je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ) (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofílů(ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- všeobecná kritéria toxicity (CTC - common toxicity criteria) nehematologícké toxicity < stupeň 1 (s výjimkou alopecie, nauzey a zvracení).
Během léčby se má každý týden vyšetřit celkový krevní obraz. Podávání TMZ má být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v tabulce 1.
Tabulka 1. Přerušení nebo ukončení podávání TMZ během souběžné léčby radioterapií a TMZ
|
Toxicita |
TMZ přerušení3 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
>0,5 a < 1,5 x 109 /l |
< 0,5 x 109 /l |
|
Počet trombocytů |
>10 a < 100 x 109 /l |
< 10 x 109 /l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
|
a : Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109/l; počet trombocytů > 100 x 109/l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení). | ||
Monoterapeutická fáze
Čtyři týdny po ukončené souběžné fázi TMZ + RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je > 1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže se dávka nezvýšila v cyklu 2, nemělo by zvýšení provádět v následných cyklech. Byla-li zvýšena, dávka zůstává na úrovni 200 mg/m2 na den po dobu prvních 5 dnů každého následujícího cyklu, pokud se však neobjeví toxicita. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze by se mělo provádět podle tabulek 2 a 3.
V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka se má redukovat nebo podávání přípravku ukončit podle tabulky 3.
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu
|
Úroveň dávky |
Dávka TMZ (mg/m2 /den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během cyklu 1 |
|
1 |
200 |
Dávka během cyklů 2-6 při absenci toxicity |
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby
|
Toxicita |
Redukce TMZ o 1 úroveň dávky a |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109 /l |
Viz poznámka pod čarou b |
|
Počet trombocytů |
< 50 x 109 /l |
Viz poznámka pod čarou b |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
|
a : Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b : TMZ se ukončí jestliže: | ||
• výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita
• jestliže se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení).
Dospělí_pacienti a děti ve věku 3 let nebo starší s recidivujícím nebo _progresivním maligním gliomem:
Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, je zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní populace
Pediatrická populace
U dětí ve věku 3 let nebo starších by se měl TMZ používat pouze k léčbě recidivujícího nebo progresivního maligního gliomu. Zkušenosti u těchto dětí jsou velmi omezené (viz body 4.4 a 5.1). Bezpečnost a účinnost TMZ u dětí do 3 let nebyla stanovena. Nejsou dostupné žádné údaje.
Pacienti se sníženou funkcí jater nebo ledvin
FarmakokinetikaTMZ je u pacientů s normální jaterní fúnkcí a s mírnou nebo středně těžkou jaterní dysfúnkcí srovnatelná. Údaje o podání TMZ u pacientů s těžkou jaterní nedostatečností (Třída C podle Childovy klasifikace) ani s dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou jaterní dysfunkcí nebo dysfunkcí ledvin jakéhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto pacientům je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že hodnota clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podání
Temozolomide Accord se podává nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, neměla by být další dávka podána tentýž den.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita na dakarbazin (DTIC).
Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jirovecii) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
U pacientů, kteří dostávali souběžně TMZ a radioterapii v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jirovecii (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří jsou souběžně léčeni TMZ a radioterapií během 42denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Všechny pacienty, kteří dostávají TMZ, zvláště pacienty dostávající steroidy, je třeba pečlivě sledovat kvůli výskytu PCP, a to bez ohledu na režim.
U pacientů užívajících TMZ, zejména v kombinaci s dexamethasonem nebo jinými steroidy, byly hlášeny případy fatálního respiračního selhání.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatoxicita
Případy jaterního poškození včetně fatálního selhání jater byly hlášeny u pacientů užívajících TMZ (viz bod 4.8).
Před zahájením léčby je třeba provést jaterní testy. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu k fatálnímu selhání jater. U pacientů léčených ve 42denním cyklu je nutno provést jaterní testy v polovině tohoto cyklu.
Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu.
U pacientů se signifikantními abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může objevit několik nebo více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukémie (viz bod 4.8).
Antiemetická léčba
Při užívání TMZ se velmi často vyskytuje nauzea a zvracení.
Před nebo po podání TMZ se může podat antiemetická léčba.
Dospělí pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi se doporučuje během monoterapeutické fáze.
Pacienti s recidivujícím nebo _progresivním maligním gliomem:
Pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4), bude zřejmě nutné podat antiemetika.
Laboratorní parametry
U pacientů léčených TMZ může dojít k myelosupresi, včetně dlouhotrvající pancytopenie, která může vést k aplastické anémii, jež v některých případech skončila fatálně. V některých případech souběžná expozice léčivým přípravkům spojeným s výskytem aplastické anémie, zahrnující karbamazepin, fenytoin a sulfamethoxazol/trimethoprim, hodnocení komplikuje. Před zahájením podávání léku by měly být splněny následující laboratorní parametry:
ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech, dokud nebude ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, měla by být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky jsou 100 mg/ m2, 150 mg/ m2 a 200 mg/ m2. Nejnižší doporučená dávka je 100 mg/ m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku nad 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ by měli být upozorněni na to, aby do 6 měsíců od užití poslední dávky nepočali dítě a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl-triazenoimidazolkarboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a ke zmenšení plochy pod křivkou koncentrace (AUC) o 9 %.
Protože nelze vyloučit, že změna Cmax může být klinicky významná, neměl by se Temozolomide Accord podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že clearance TMZ nebyla ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů nebo fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, avšak statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Vzhledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku je třeba doporučit používání účinné kontracepce k zabránění otěhotnění během užívání TMZ.
Žádné údaje o podávání léku těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří dostávali dávku 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Temozolomide Accord by neměl být podáván těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení by se proto mělo po dobu léčby TMZ přerušit.
Mužská plodnost
TMZ může mít genotoxické účinky. Proto se mužům léčeným TMZ nedoporučuje, aby do 6 měsíců po užití poslední dávky počali dítě. Naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě TMZ, ještě před zahájením léčby konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
TMZ má malý vliv na schopnost řídit nebo obsluhovat stroje v důsledku únavy a ospalosti (viz bod 4.8.).
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
U pacientů léčených TMZ ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující po RT v případě nově diagnostikovaného multiformního glioblastomu, nebo ve formě monoterapie u pacientů s recidivujícím nebo progresivním gliomem, byly velmi často hlášené podobné nežádoucí účinky jako: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. Křeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ souběžně s RT nebo také ve formě monoterapie a často u pacientů s recidivujícím gliomem.
Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (tabulky 4 a 5), četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100, vzácné ((> 1/10 000 až < 1/1000 );velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | ||
|
Třída orgánového |
TMZ + souběžná RT |
TMZ monoterapie |
|
systému |
n=288* |
n=224 |
|
Infekce a infestace | ||
|
Časté: |
Infekce, herpes simplex, infekce rány, faryngitida, orální kandidóza |
Infekce, orální kandidóza |
|
Méně časté: |
Herpes simplex, Herpes zoster, symptomy podobné chřipce | |
|
Poruchy krve a lymfatického systému | ||
|
Časté: |
Neutropenie, trombocytopenie, lymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie |
|
Endokrinní poruchy | ||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom |
|
Poruchy metabolismu a výživy | ||
|
Velmi časté: | ||
|
Časté: |
Hyperglykémie, pokles tělesné hmotnosti |
Pokles tělesné hmotnosti |
|
Méně časté: |
Hypokalémie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykémie, zvýšení tělesné hmotnosti |
|
Psychiatrické poruchy | ||
|
Časté: |
Úzkost, emoční labilita, |
Úzkost, deprese, emoční labilita, |
|
somnolence |
somnolence | |
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie |
|
Poruchy nervového systému | ||
|
Velmi časté: |
Konvulze, bolest hlavy | |
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha |
Hemiparéza, afázie, porucha rovnováhy, somnolence, |
|
rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (blíže neurčená), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes | |
|
Méně časté: |
Status epilepticus, extrapyramidová porucha, hemiparéza, ataxie, kognitivní porucha, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (blíže neurčená), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, smyslová porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané vidění, diplopie |
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest očí |
Zmenšená ostrost vidění, bolest očí, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závrať, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (blíže nespecifikovaná), gastroenteritida, hemeroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Velmi časté: |
Vyrážka, alopecie |
Vyrážka, alopecie |
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní reakce, abnormální pigmentace |
Erytém, abnormální pigmentace, zvýšené pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie muskuloskeletální bolest, myalgie |
|
Méně časté: |
Myopatie, bolest zad, muskuloskeletální bolest, myalgie |
Myopatie, bolest zad |
|
Poruchy ledvin a močových cest | ||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence |
|
Méně časté: | ||
|
Poruchy reprodukčního systému a prsu | ||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, kolpitida, bolest prsů |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Velmi časté: |
Únava |
Únava |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, zhoršení stavu, ztuhlost, změna barvy jazyka, parosmie, žízeň |
Astenie, edém obličeje, bolest, zhoršení stavu, ztuhlost, zubní potíže |
|
Vyšetření | ||
|
Časté: |
Zvýšení ALT |
Zvýšení ALT |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšení gama GT, zvýšení AST | |
|
*Pacient, který byl ranč |
omizován pouze do větve RT, dostával TMZ + RT. | |
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupně 3 nebo 4, včetně neutropenických případů. Stupeň 3 nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Recidivující nebo progresivní maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0 - 5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro recidivující nebo progresivní maligní gliom a po uvedení TMZna trh.
Tabulka 5. Nežádoucí účinky u pacientů s recidivujícím nebo progresivním maligním gliomem
|
Infekce a infestace | |
|
Vzácné: |
Oportunní infekce včetně pneumonie způsobené PCP |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), thrombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anemie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: |
Somnolence, závratě, parestézie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce, včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4 % případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nejnižší hodnotou mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů.
Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nejnižších hodnot neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nejnižších hodnot krevních destiček. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12 % versus 5 %, a trombocytopenií (< 20 x 109/l), 9 % versus 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs. 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs. 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs. 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs. 0 % mužů.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Ačkoliv jsou údaje omezené, tolerance u dětí se očekává podobná jako u dospělých. Bezpečnost TMZ u dětí ve věku do 3 let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení přípravku na trh byly hlášeny další následující závažné nežádoucí účinky
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem, jako je cytomegalovirus, virus hepatitidy B1 |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné |
dlouhotrvající pancytopenie, aplastická anémie1 |
|
Novotvary benigní, maligní a blíže neurčené | |
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), sekundární malignity, včetně myeloidní leukémie |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie / pneumonitida, plicní fibróza, respirační selhání f |
|
Poruchy jater a žlučových cest* | |
|
Časté: |
zvýšení jaterních enzymů |
|
Méně časté: |
hyperbilirubinémie, cholestáza,hepatitida poškození jater, selhání jater f |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
*Odhad frekvence výskytu na základě relevantních klinických studií f včetně fatálních případů
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími účinky včetně suprese kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí k úmrtí. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby by měla být zajištěna podpůrná léčba.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n=287) nebo RT samotnou (n=286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jirovecii (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1 ,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) je vyšší ve větvi RT + TMZ. Přidání souběžně podávaného TMZ k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival=OS) ve srovnání s RT samotnou (Graf 1).

Graf 1 Kaplan-Meierovy křivky pro celkové přežívání (ITT populace)
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním stavem (WHO PS=2, n=70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Recidivující nebo progresivní maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní stav [KPS] > 70), u něhož dochází k progresi nebo recidivě po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs. prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (progression-free survival, PFS), hodnocených na základě MRI nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6 měsíční
PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl 5,4 měsíce. Objektivní počet terapeutických odpovědí (ORR) na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chí-kvadrát p=0,008) s mediánem PFS 2,89, respektive 1,88 měsíce (log rank p=0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p=0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p=0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS >80.
Údaje o době do zhoršení neurologického stavu, jakož i údaje o době do zhoršení výkonnostního stavu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p= < 0,01 - 0,03).
Recidivující anaplastický astrocytom
V multicentrické, prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PFS u 46 % léčených. Medián PFS činil 5,4 měsíce.
Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43 % částečných odpovědí) pro populaci intent-to-treat (ITT), n=162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu bez známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s recidivujícím gliomem mozkového kmene nebo recidivujícím astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-methyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~
2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl t1/2 MTIC podobný jako pro TMZ,1,8 hodin.
Absorpce
Po perorálním podání dospělým pacientům se TMZ rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného TMZ byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %) proto se neočekává, že by interagoval s látkami s vysokým proteinovým vázáním.
PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku (CSF). Průnik do CSF byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 % plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločas(ti/2) je přibližně 1,8 hodin. Hlavní způsob eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů.
Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní populace
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až střední jaterní dysfunkcí stejné jako profily u pacientů s normální funkcí jater.
U pediatrických pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání léku, 23 dnů bez léčby) 3 a 6 cyklů léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulární systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka, a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno 6 cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakanthomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po 3 měsících od zahájení podávání léku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve (Human eripheral Blood Lymphocyte - HPBL) prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky:
Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu typu A Kyselina vinná Kyselina stearová
Obal tobolky:
Želatina
Čištěná voda
Oxid titaničitý (E171)
Žlutý oxid železitý (E172)
Červený oxid železitý (E172)
Potisk:
Šelak
Propylenglykol
Černý oxid železitý (E172)
Hydroxid draselný
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a velikost balení
Lahvička
uzávěrem a
Lahvičky z hnědého skla třídy III s polypropylenovým dětským bezpečnostním vysoušedlem, obsahující 5 nebo 20 tvrdých tobolek.
Krabička obsahuje jednu lahvičku.
Sáček
Sáček z polyesteru/hliníku/polyethylenu (PET/alu/PE).
Jeden sáček obsahuje 1 tvrdou tobolku.
Balení obsahuje 5 nebo 20 tvrdých tobolek jednotlivě balených v sáčcích.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky by neměly být otevřeny. Pokud dojde k poškození tobolky, zabraňte kontaktu jejího práškového obsahu s kůží a sliznicemi. Pokud přijde Temozolomide Accord do styku s kůží nebo sliznicí, je třeba neprodleně a řádně ho smýt mýdlem a vodou.
Pacientům by mělo být doporučeno uchovávat tobolky mimo dohled a dohled dětí, nejlépe v uzamčené skříni.Náhodné požití může být pro děti smrtelné.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
8. REGISTRAČNÍ ČÍSLO (A)
EU/1/10/615/017
EU/1/10/615/018
EU/1/10/615/033
NÁZEV PŘÍPRAVKU
1.
Temozolomide Accord 250 mg tvrdé tobolky.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje temozolomidum 250 mg.
Pomocné látky se známým účinkem:
Jedna tvrdá tobolka obsahuje 182.5 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Tobolky jsou bílé/bílé tvrdé želatinové tobolky s vyraženým “TMZ” na víčku & ‘250’ na těle tobolky. Tobolka je přibližně 21 mm dlouhá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Temozolomide Accord je indikován k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
4.2 Dávkování a způsob podání
Temozolomid smí předepisovat výhradně lékař se zkušenostmi s onkologickou léčbou mozkových
nádorů.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí pacienti s nově diagnostikovaným multiformním glioblastomem
Temozolomide Accord je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ) (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofilů(ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- všeobecná kritéria toxicity (CTC - common toxicity criteria) nehematologické toxicity < stupeň 1 (s výjimkou alopecie, nauzey a zvracení).
Během léčby se má každý týden vyšetřit celkový krevní obraz. Podávání TMZ být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v tabulce 1.
Tabulka 1. Přerušení nebo ukončení podávání TMZ během souběžné léčby radioterapií a TMZ
|
Toxicita |
TMZ přerušení3 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
>0,5 a < 1,5 x 109 /l |
< 0,5 x 109 /l |
|
Počet trombocytů |
>10 a < 100 x 109 /l |
< 10 x 109 /l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
|
a : Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109/l; počet trombocytů > 100 x 109/l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení). | ||
Monoterapeutická fáze
Čtyři týdny po ukončené souběžné fázi TMZ + RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je > 1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže se dávka nezvýšila v cyklu 2, nemělo by se zvýšení provádět v následných cyklech. Byla-li zvýšena, dávka zůstává na úrovni 200 mg/m2 na den po dobu prvních 5 dnů každého následujícího cyklu, pokud se však neobjeví toxicita. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze by se mělo provádět podle tabulek 2 a 3. V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka se má redukovat nebo podávání přípravku ukončit podle tabulky 3.
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu
|
Úroveň dávky |
Dávka TMZ (mg/m2 /den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během cyklu 1 |
|
1 |
200 |
Dávka během cyklů 2-6 při absenci toxicity |
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby
|
Toxicita |
Redukce TMZ o 1 úroveň dávky a |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109 /l |
Viz poznámka pod čarou b |
|
Počet trombocytů |
< 50 x 109 /l |
Viz poznámka pod čarou b |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
|
a : Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b : TMZ se ukončí jestliže: • výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita | ||
• jestliže se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení).
Dospělí_pacienti a děti ve věku 3 let nebo starší s recidivujícím nebo _progresivním maligním gliomem:
Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, je zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní populace
Pediatrická populace
U dětí ve věku 3 let nebo starších by se měl TMZ používat pouze k léčbě recidivujícího nebo progresivního maligního gliomu. Zkušenosti u těchto dětí jsou velmi omezené (viz body 4.4 a 5.1). Bezpečnost a účinnost TMZ u dětí do 3 let nebyla stanovena. Nejsou dostupné žádné údaje.
Pacienti se sníženou funkcí jater nebo ledvin
FarmakokinetikaTMZ je u pacientů s normální jaterní funkcí a s mírnou nebo středně těžkou jaterní dysfunkcí srovnatelná. Údaje o podání TMZ u pacientů s těžkou jaterní nedostatečností (Třída C podle Childovy klasifikace) ani s dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou jaterní dysfunkcí nebo dysfunkcí ledvin jakéhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto pacientům je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že hodnota clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podání
Temozolomide Accord se podává nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, neměla by být další dávka podána tentýž den.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita na dakarbazin (DTIC).
Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jirovecii) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
U pacientů, kteří dostávali souběžně TMZ a radioterapii v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jirovecii (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří jsou souběžně léčeni TMZ a radioterapií během 42denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Všechny pacienty, kteří dostávají TMZ, zvláště pacienty dostávající steroidy, je třeba pečlivě sledovat kvůli výskytu PCP, a to bez ohledu na režim.
U pacientů užívajících TMZ, zejména v kombinaci s dexamethasonem nebo jinými steroidy, byly hlášeny případy fatálního respiračního selhání.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatoxicita
Případy jaterního poškození včetně fatálního selhání jater byly hlášeny u pacientů užívajících TMZ (viz bod 4.8).
Před zahájením léčby je třeba provést jaterní testy. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu k fatálnímu selhání jater. U pacientů léčených ve 42denním cyklu je nutno provést jaterní testy v polovině tohoto cyklu.
Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu.
U pacientů se signifikantními abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může objevit několik nebo více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukémie (viz bod 4.8).
Antiemetická léčba
Při užívání TMZ se velmi často vyskytuje nauzea a zvracení.
Před nebo po podání TMZ se může podat antiemetická léčba.
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi se doporučuje během monoterapeutické fáze.
Pacienti s recidivujícím nebo progresivním maligním gliomem:
Pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4), bude zřejmě nutné podat antiemetika.
Laboratorní parametry
U pacientů léčených TMZ může dojít k myelosupresi, včetně dlouhotrvající pancytopenie, která může vést k aplastické anémii, jež v některých případech skončila fatálně. V některých případech souběžná expozice léčivým přípravkům spojeným s výskytem aplastické anémie, zahrnující karbamazepin, fenytoin a sulfamethoxazol/trimethoprim, hodnocení komplikuje. Před zahájením podávání léku by měly být splněny následující laboratorní parametry:
ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech, dokud nebude ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, měla by být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky jsou 100 mg/ m2, 150 mg/ m2 a 200 mg/ m2. Nejnižší doporučená dávka je 100 mg/ m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku nad 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ by měli být upozorněni na to, aby do 6 měsíců od užití poslední dávky nepočali dítě a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl-triazenoimidazolkarboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a ke zmenšení plochy pod křivkou koncentrace (AuC) o 9 %.
Protože nelze vyloučit, že změna Cmax může být klinicky významná, neměl by se Temozolomide Accord podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že clearance TMZ nebyla ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů a fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, avšak statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Vzhledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku.
Ženám ve fertilním věku je třeba doporučit používání účinné kontracepce k zabránění otěhotnění během užívání TMZ.
Žádné údaje o podávání léku těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří dostávali dávku 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Temozolomide Accord by neměl být podáván těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení by se proto mělo po dobu léčby TMZ přerušit.
Mužská plodnost
TMZ může mít genotoxické účinky. Proto se mužům léčeným TMZ nedoporučuje, aby do 6 měsíců po užití poslední dávky počali dítě. Naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě TMZ, ještě před zahájením léčby konzultovat s lékařem možnost kryokonzervace předem odebraných spermií
4.7 Účinky na schopnost řídit a obsluhovat stroje
TMZ má malý vliv na schopnost řídit nebo obsluhovat stroje v důsledku únavy a ospalosti (viz bod 4.8.).
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
U pacientů léčených TMZ ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující p RT v případě nově diagnostikovaného multiformního glioblastomu, nebo ve formě monoterapie u pacientů s recidivujícím nebo progresivním gliomem, byly velmi často hlášené podobné nežádoucí účinky jako: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. řeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ souběžně s RT nebo také ve formě monoterapie a často u pacientů s recidivujícím gliomem.
Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (tabulky 4 a 5), četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100) , vzácné ((> 1/10 000 až < 1/1000 );velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | ||
|
Třída orgánového |
TMZ + souběžná RT |
TMZ monoterapie |
|
systému |
n=288* |
n=224 |
|
Infekce a infestace | ||
|
Časté: |
Infekce, herpes simplex, infekce rány, faryngitida, orální kandidóza |
Infekce, orální kandidóza |
|
Méně časté: |
Herpes simplex, Herpes zoster, symptomy podobné chřipce | |
|
Poruchy krve a lymfatického systému | ||
|
Časté: |
Neutropenie, trombocytopenie, lymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie |
|
Endokrinní poruchy | ||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom |
|
Poruchy metabolismu a výživy | ||
|
Velmi časté: | ||
|
Časté: |
Hyperglykémie, pokles tělesné hmotnosti |
Pokles tělesné hmotnosti |
|
Méně časté: |
Hypokalémie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykémie, zvýšení tělesné hmotnosti |
|
Psychiatrické poruchy | ||
|
Časté: |
Úzkost, emoční labilita, |
Úzkost, deprese, emoční labilita, |
|
somnolence |
somnolence | |
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie |
|
Poruchy nervového systému | ||
|
Velmi časté: |
Konvulze, bolest hlavy | |
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha |
Hemiparéza, afázie, porucha rovnováhy, somnolence, |
|
rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (blíže neurčená), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes | |
|
Méně časté: |
Status epilepticus, extrapyramidová porucha, hemiparéza, ataxie, kognitivní porucha, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (blíže neurčená), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, smyslová porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané vidění, diplopie |
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest očí |
Zmenšená ostrost vidění, bolest očí, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závrať, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (blíže nespecifikovaná), gastroenteritida, hemeroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Velmi časté: |
Vyrážka, alopecie |
Vyrážka, alopecie |
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní reakce, abnormální pigmentace |
Erytém, abnormální pigmentace, zvýšené pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie muskuloskeletální bolest, myalgie |
|
Méně časté: |
Myopatie, bolest zad, muskuloskeletální bolest, myalgie |
Myopatie, bolest zad |
|
Poruchy ledvin a močových cest | ||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence |
|
Méně časté: | ||
|
Poruchy reprodukčního systému a prsu | ||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, kolpitida, bolest prsů |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Velmi časté: |
Únava |
Únava |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, zhoršení stavu, ztuhlost, změna barvy jazyka, parosmie, žízeň |
Astenie, edém obličeje, bolest, zhoršení stavu, ztuhlost, zubní potíže |
|
Vyšetření | ||
|
Časté: |
Zvýšení ALT |
Zvýšení ALT |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšení gama GT, zvýšení AST | |
|
*Pacient, který byl ranč |
omizován pouze do větve RT, dostával TMZ + RT. | |
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupně 3 nebo 4, včetně neutropenických případů. Stupeň 3 nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Recidivující nebo progresivní maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0 - 5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro recidivující nebo progresivní maligní gliom a po uvedení TMZna trh.
Tabulka 5. Nežádoucí účinky u pacientů s recidivujícím nebo progresivním maligním gliomem
|
Infekce a infestace | |
|
Vzácné: |
Oportunní infekce včetně pneumonie způsobené PCP |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), thrombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anemie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: |
Somnolence, závratě, parestézie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce, včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4 % případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nejnižší hodnotou mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů.
Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nejnižších hodnot neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nejnižších hodnot krevních destiček. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12 % versus 5 %, a trombocytopenií (< 20 x 109/l), 9 % versus 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs. 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs. 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs. 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs. 0 % mužů.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Ačkoliv jsou údaje omezené, tolerance u dětí se očekává podobná jako u dospělých. Bezpečnost TMZ u dětí ve věku do 3 let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení přípravku na trh byly hlášeny další následující závažné nežádoucí účinky
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem, jako je cytomegalovirus, virus hepatitidy B1 |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné |
dlouhotrvající pancytopenie, aplastická anémie1 |
|
Novotvary benigní, maligní a blíže neurčené | |
|
Tabulka 6. Souhrn hlášených nežádoucí účinků po uvedení temozolomidu na trh | |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), sekundární malignity, včetně myeloidní leukémie |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie / pneumonitida, plicní fibróza, respirační selhání f |
|
Poruchy jater a žlučových cest* | |
|
Časté: |
zvýšení jaterních enzymů |
|
Méně časté: |
hyperbilirubinémie, cholestáza,hepatitida, poškození jater, selhání jater f |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
*Odhad frekvence výskytu na základě relevantních klinických studií f včetně fatálních případů
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000 a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími účinky včetně suprese kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí k úmrtí. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby by měla být zajištěna podpůrná léčba.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n=287) nebo RT samotnou (n=286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jirovecii (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1 ,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) je vyšší ve větvi RT + TMZ. Přidání souběžně podávaného TMZ k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival=OS) ve srovnání s RT samotnou (Graf 1).
ITT Populace: celkové přežívání

Graf 1 Kaplan-Meierovy křivky pro celkové přežívání (ITT populace)
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním stavem (WHO PS=2, n=70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Recidivující nebo progresivní maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní stav [KPS] > 70), u něhož dochází k progresi nebo recidivě po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs. prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (progression-free survival, PFS), hodnocených na základě MRI nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6 měsíční
PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl 5,4 měsíce. Objektivní počet terapeutických odpovědí (ORR) na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chr-kvadrát p=0,008) s mediánem PFS 2,89, respektive 1,88 měsíce (log rank p=0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p=0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p=0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS >80.
Údaje o době do zhoršení neurologického stavu, jakož i údaje o době do zhoršení výkonnostního stavu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p= < 0,01 - 0,03).
Recidivující anaplastický astrocytom
V multicentrické, prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PFS u 46 % léčených. Medián PFS činil 5,4 měsíce.
Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43 % částečných odpovědí) pro populaci intent-to-treat (ITT), n=162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu bez známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s recidivujícím gliomem mozkového kmene nebo recidivujícím astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-methyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~
2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl t1/2 MTIC podobný jako pro TMZ,1,8 hodin.
Absorpce
Po perorálním podání dospělým pacientům se TMZ rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného TMZ byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %) a proto se neočekává, že by interagoval s látkami s vysokou vazebnou afinitou k proteinům.
PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku (CSF). Průnik do CSF byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 % plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločas(ti/2) je přibližně 1,8 hodin. Hlavní způsob eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů.
Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní populace
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až střední jaterní dysfunkcí stejné jako profily u pacientů s normální funkcí jater.
U pediatrických pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání léku, 23 dnů bez léčby) 3 a 6 cyklů léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulární systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka, a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno 6 cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakanthomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po 3 měsících od zahájení podávání léku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve (Human eripheral Blood Lymphocyte - HPBL) prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky:
Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu typu A Kyselina vinná Kyselina stearová
Obal tobolky:
Želatina
Čištěná voda
Oxid titaničitý (E171)
Potisk:
Šelak
Propylenglykol
Černý oxid železitý (E172)
Hydroxid draselný
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a velikost balení
Lahvička
uzávěrem a
Lahvičky z hnědého skla třídy III s polypropylenovým dětským bezpečnostním vysoušedlem, obsahující 5 nebo 20 tvrdých tobolek.
Krabička obsahuje jednu lahvičku.
Sáček
Sáček z polyesteru/hliníku/polyethylenu (PET/alu/PE).
Jeden sáček obsahuje 1 tvrdou tobolku.
Balení obsahuje 5 nebo 20 tvrdých tobolek jednotlivě balených v sáčcích.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky by neměly být otevřeny. Pokud dojde k poškození tobolky, zabraňte kontaktu jejího práškového obsahu s kůží a sliznicemi. Pokud přijde Temozolomide Accord do styku s kůží nebo sliznicí, je třeba neprodleně a řádně ho smýt mýdlem a vodou.
Pacientům by mělo být doporučeno uchovávat tobolky mimo dohled a dosah dětí, nejlépe v uzamčené skříni.
Náhodné požití může být pro děti smrtelné.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
8. REGISTRAČNÍ ČÍSLO (A)
EU/1/10/615/021
EU/1/10/615/022
EU/1/10/615/035
EU/1/10/615/036
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:15. března 2010
Datum posledního prodloužení registrace: 12.Ledna 2015
10. DATUM REVIZE TEXTU DD.MM.RRRR
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu/
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Název a adresa výrobce odpovědného za propouštění šarží
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow,
Middlesex, HA1 4HF,
Velká Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Temozolomide Accord 5 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 5 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/001
EU/1/10/615/002
č.š.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 5 mg
Temozolomide Accord 20 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 20 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/005
EU/1/10/615/006
č.š.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 20 mg
Temozolomide Accord 100 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 100 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/009
EU/1/10/615/010
c.s.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 100 mg
Temozolomide Accord 140 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 140 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/013
EU/1/10/615/014
c.s.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 140 mg
Temozolomide Accord 180 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 180 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
c.s.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 180 mg
Temozolomide Accord 250 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 250 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/021
EU/1/10/615/022
c.s.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 250 mg
Temozolomide Accord 5 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 tvrdých tobolek 20 tvrdých tobolek
6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK LAHVIČKY
Temozolomide Accord 20 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 tvrdých tobolek 20 tvrdých tobolek
6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK LAHVIČKY
Temozolomide Accord 100 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 tvrdých tobolek 20 tvrdých tobolek
6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK LAHVIČKY
Temozolomide Accord 140 mg tvrdé tobolky T emozolomidum Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 tvrdých tobolek 20 tvrdých tobolek
6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK LAHVIČKY
Temozolomide Accord 180 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 tvrdých tobolek 20 tvrdých tobolek
6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK LAHVIČKY
Temozolomide Accord 250 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 tvrdých tobolek 20 tvrdých tobolek
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU SÁČEK
Temozolomide Accord 5 mg tvrdé tobolky temozolomidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tvrdá tobolka obsahuje temozolomidum 5 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu. Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
5 tvrdých tobolek 20 tvrdých tobolek
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
8. POUŽITELNOST
EXP:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH
PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/025
EU/1/10/615/026
č.š.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 5 mg
Jedna tvrdá tobolka obsahuje temozolomidum 20 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Před použitím si přečtěte příbalovou informaci.
Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road,
North Harrow, Middlesex, HA1 4HF, Velká Británie
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/10/615/027
EU/1/10/615/028
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Temozolomide 20 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU SÁČEK
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Jedna tvrdá tobolka obsahuje temozolomidum 100 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Před použitím si přečtěte příbalovou informaci. Perorální podání.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex, HA1 4HF, Velká Británie
EU/1/10/615/029
EU/1/10/615/030
č.š.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 100 mg

Temozolomide Accord 140 mg tvrdé tobolky
temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 140 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Před použitím si přečtěte příbalovou informaci.
Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF, Velká Británie
EU/1/10/615/031
EU/1/10/615/032
č.š.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 140 mg

Temozolomide Accord 180 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 180 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Před použitím si přečtěte příbalovou informaci. Perorální podání.
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
EU/1/10/615/033
EU/1/10/615/034
č.š.:
Výdej léčivého přípravku vázán na lékařský předpis.
Temozolomide 180 mg

Temozolomide Accord 250 mg tvrdé tobolky temozolomidum
Jedna tvrdá tobolka obsahuje temozolomidum 250 mg.
Obsahuje laktózu. Další informace viz příbalová informace.
5 tvrdých tobolek 20 tvrdých tobolek
Před použitím si přečtěte příbalovou informaci.
Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte přípravek mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Užití může být smrtelné.
Cytotoxické.
Tobolky neotvírejte, nedrťte je ani je nekousejte, polykejte je celé. Pokud je tobolka poškozená, zabraňte kontaktu s kůží, očima nebo nosem.
EXP:
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/10/615/035
EU/1/10/615/036
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Temozolomide 250 mg
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK SÁČKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Temozolomide Accord 5 mg tvrdé tobolky
temozolomidum
Perorální podání
3. POUŽITELNOST
EXP.:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 tvrdá tobolka 6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK SÁČKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Temozolomide Accord 20 mg tvrdé tobolky
temozolomidum
Perorální podání
EXP.:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 tvrdá tobolka 6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK SÁČKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Temozolomide Accord 100 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
EXP.:
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 tvrdá tobolka 6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK SÁČKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Temozolomide Accord 140 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
EXP.:
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 tvrdá tobolka 6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK SÁČKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Temozolomide Accord 180 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 tvrdá tobolka 6. JINÉ
ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK SÁČKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Temozolomide Accord 250 mg tvrdé tobolky
temozolomidum
Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP.:
Lot:
1 tvrdá tobolka 6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Temozolomide Accord 5 mg tvrdé tobolky Temozolomide Accord 20 mg tvrdé tobolky Temozolomide Accord 100 mg tvrdé tobolky Temozolomide Accord 140 mg tvrdé tobolky Temozolomide Accord 180 mg tvrdé tobolky Temozolomide Accord 250 mg tvrdé tobolky temozolomidum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků , sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je Temozolomide Accord a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Temozolomide Accord užívat
3. Jak se Temozolomide Accord užívá
4. Možné nežádoucí účinky
5. Jak Temozolomide Accord uchovávat
6. Obsah balení a další informace
1. Co je Temozolomide Accord a k čemu se používá
Temozolomide Accord je protinádorový lék.
Přípravek Temozolomide Accord tvrdé tobolky se používá k léčbě specifických forem nádorů mozku:
- u dospělých s nově diagnostikovaným specifickým nádorem mozku (multiformním glioblastomem). Temozolomid je prvně použit v kombinaci s radioterapií (souběžná fáze léčení) a potom samostatně (fáze monoterapie).
- u dětí ve věku 3 let a starších a u dospělých se specifickou formou nádoru mozku (např. multiformní glioblastom nebo anaplastický astrocytom), jestliže se tento nádor objeví znovu, nebo se po standardní léčbě znovu zhorší.
2. Čemu musíte věnovat pozornost, než začnete Temozolomide Accord užívat Neužívejte Temozolomide Accord
- jestliže jste alergický(á) na temozolomid nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
- jestliže jste prodělal(a) alergickou reakci na jiné protinádorové léčivo zvané dakarbazin. Příznaky alergické reakce zahrnují svědění, dušnost nebo sípání, otok obličeje, rtů, jazyka nebo hrdla.
- jestliže máte významně snížený počet určitých typů krevních buněk, např. počet bílých krvinek nebo krevních destiček. Tyto krevní buňky jsou důležité k potlačení infekce a k správnému srážení krve. Váš lékař bude před zahájením léčby kontrolovat Vaši krev, aby se ujistil, že máte dostatek těchto buněk.
Upozornění a opatření
Před použitím přípravku Temozolomide Accord se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou,
- jelikož máte být pečlivě sledován(a), zda se u Vás nevyvíjí závažná forma hrudní infekce (zápal plic vyvolaný Pneumocystis jirovecii - PCP). Jestliže jste nově diagnostikovaný(á) pacient(pacientka) (s multiformním glioblastomem), můžete temozolomid užívat po dobu 42 dnů v kombinaci s radioterapií. V tomto případě Vám lékař rovněž předepíše lék, který Vám pomůže předejít tomuto typu zápalu plic (PCP).
- pokud jste někdy měl(a) nebo možná nyní máte infekci způsobenou virem hepatitidy B. To proto, že přípravek temozolomide Accord by mohl způsobit, že se hepatitida B znovu aktivuje, což může být v některých případech smrtelné. Pacienti budou před začátkem léčby svým lékařem pečlivě zkontrolováni na příznaky této infekce.
- jestliže před zahájením léčby trpíte anémií, nízkým počtem krvinek (například bílých krvinek a krevních destiček), nebo máte problémy s krevní srážlivostí, nebo pokud se tyto poruchy objeví v průběhu léčby. Váš lékař možná bude muset dávky tohoto přípravku snížit, či jeho podávání přerušit, ukončit, nebo Vaši léčbu změnit. O tom, zda je nutné Vaši léčbu změnit, rozhodne lékař. V některých případech může být nutné podávání přípravku Temozolomide Accord zcela ukončit. V průběhu léčby budou prováděna pravidelná vyšetření Vaší krve, aby se sledoval Váš stav. Pokud se u Vás objeví horečka nebo příznaky infekce, okamžitě se poraďte se svým lékařem.
- jelikož existuje malé riziko jiných změn krevních buněk, včetně leukémie.
- Pokud pociťujete nevolnost, nebo zvracíte, což jsou velmi časté nežádoucí účinky temozolomidu (viz bod 4). Pokud zvracíte pravidelně před nebo během léčby, poraďte se se svým lékařem o možnosti užívat léky, které pomáhají zvracení předcházet nebo jej mírnit, a poraďte se, kdy máte nejlépe temozolomid užívat, dokud se zvracení neupraví. Pokud zvracíte po užití dávky, neberte další dávku ve stejný den.
- Pokud se u Vás vyskytne horečka nebo příznaky infekce, okamžitě kontaktujte svého lékaře.
- Pokud je Vám více než 70 let. Starší pacienti jsou náchylnější k infekcím, zvýšené tvorbě modřin nebo krvácení.
- Pokud máte potíže s ledvinami nebo játry, neboť Vaše dávka bude možná muset být upravena.
Děti a dospívající
Nepodávejte tento přípravek dětem do 3 let, jelikož nebyl u této skupiny hodnocen.
O pacientech ve věku 3 let a starších, kteří užívali Temozolomide Accord, jsou k dispozici omezené údaje.
Další léčivé přípravky a Temozolomide Accord
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Těhotenství, kojení a plodnost
Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Přípravkem Temozolomide Accord nesmíte být během těhotenství léčena, pokud to přímo nedoporučí Váš lékař.
Pacienti i pacientky musí žívat účinnou antikoncepci dokud užívají Temozolomide Accord (viz také „Mužská plodnost“).
Během léčby přípravkem Temozolomide Accord nesmíte kojit.
Mužská plodnost
Temozolomide Accord může způsobit trvalou neplodnost. Mužští pacienti mají používat účinnou antikoncepci a nepočít dítě po dobu až 6 měsíců od ukončení léčby. Doporučuje se jim, aby se před léčbou informovali o možnosti konzervace spermatu.
Před užitím jakéhokoli přípravku se poraďte se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
V průběhu léčby temozolomidem se můžete cítit unavený(á) či ospalý(á). V takovém případě neřiďte dopravní prostředek ani neobsluhujte žádné nástroje nebo stroje nebo jízdní kolo, dokud nezjistíte, jak na Vás tento přípravek působí (viz bod 4).
Temozolomide Accord obsahuje laktózu
Tobolka obsahuje laktózu (druh cukru). Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete tento léčivý přípravek užívat.
3. Jak se Temozolomide Accord užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Temozolomid může předepsat pouze odborník na léčbu nádorů mozku.
Dávkování a délka léčby
Správnou dávku temozolomidu určí Váš lékař na základě Vaší tělesné výšky a hmotnosti, a v závislosti na tom, zda Vám již v minulosti byla podávána chemoterapie. V některých případech můžete dostat další léky k užívání před a/nebo po užití temozolomidu, které zabraňují nebo potlačují zvracení.
Užívejte svou předepsanou dávku Temozolomidu Accord jednou denně. Přípravek užívejte nalačno; například minimálně jednu hodinu před plánovanou snídaní. Polykejte tobolky celé a zapíjejte je sklenicí vody. Tobolky neotvírejte, nedrťte ani nekousejte.
Pokud je tobolka poškozená, zabraňte kontaktu práškového obsahu s pokožkou, očima nebo nosem. Dbejte na to, abyste prášek nevdechl(a). Pokud se Vám omylem nějaký dostane do očí nebo nosu, omyjte zasaženou oblast vodou.
Pokud užíváte Temozolomide Accord v kombinaci s radioterapií (nově diagnostikovaní pacienti):
V průběhu léčby radioterapií začne Váš lékař léčbu temozolomidem dávkou 75 mg/m2 a přesná dávka, kterou budete užívat, bude záviset na Vaší tělesné hmotnosti a výšce. Tuto dávku budete užívat denně po dobu 42 dnů (maximálně 49 dnů) v kombinaci s radioterapií. V závislosti na Vašem krevním obraze a na tom, jak temozolomid snášíte, může být dávka pozdržena (podána později), nebo léčba ukončena.
Jakmile je radioterapie ukončena, přerušíte léčbu na 4 týdny, aby Váš organismus dostal možnost rekonvalescence.
Poté Vám bude přípravek podáván v léčebných cyklech, kterých může být maximálně 6. Každý cyklus trvá 28 dnů. V těchto cyklech budete užívat tobolky temozolomidu v dávce 150 mg/m2 jedenkrát denně po dobu prvních 5 dnů („dávkovací dny“) každého cyklu, poté dalších 23 dnů nebudete temozolomid užívat, to je dohromady 28 dnů léčebného cyklu.
Po 28. dni začne další cyklus, během kterého budete opět užívat tento přípravek jedenkrát denně po dobu 5 dnů s následujícími 23 dny bez temozolomidu. Dávka se může upravit, její podání oddálit nebo přerušit v závislosti na Vašem krevním obraze a na tom, jak temozolomid v průběhu každého léčebného cyklu snášíte.
Pokud užíváte přípravek Temozolomide Accord tobolky samotně (bez radioterapie):
Léčebný cyklus Temozolomidu Accord zahrnuje 28 dní. Budete užívat tobolky jednou denně po dobu prvních 5 dnů („dávkovací dny“) každého cyklu, poté dalších 23 dnů nebudete temozolomid užívat, to je dohromady 28 dnů léčebného cyklu.
Po 28. dni začne nový léčebný cyklus, během kterého budete opět užívat tento přípravek jednou denně po dobu 5 dní a následných 23 dní nebudete tento přípravek užívat. Před každým novým léčebným cyklem bude vyšetřen Váš krevní obraz a na základě výsledku tohoto vyšetření Vám může být dávka temozolomidu upravena.
Pokud jste zatím nebyl(a) léčen(a) chemoterapií, začnete se svou první dávkou temozolomidu 200 mg/m2 jednou denně po dobu prvních 5 dnů („dávkovací dny“) každého cyklu, poté dalších 23 dnů nebudete temozolomid užívat. Pokud jste již byl(a) léčen(a) chemoterapií, začnete se svou první dávkou temozolomidu 150 mg/m2 jednou denně po dobu prvních 5 dnů („dávkovací dny“) každého cyklu, poté dalších 23 dnů nebudete temozolomid užívat.
Podle výsledků Vašich krevních testů Vám Váš lékař může dávku pro další léčebný cyklus upravit. Pokaždé, když začínáte nový léčebný cyklus, ujistěte se, že přesně rozumíte, kolik tobolek každé síly potřebujete každý den užít, a kolik dní budete tuto dávku užívat.
Všichni pacienti
Tobolky temozolomidu se dodávají v různých silách (což je uvedeno na vnějším obalu v mg). Každá síla má různou barvu vrchní části tobolky. V závislosti na dávce temozolomidu, kterou Vám Váš lékař předepíše, budete možná muset užívat několik různých tobolek každý den během léčebného cyklu.
- Ujistěte se, že přesně rozumíte, kolik tobolek potřebujete užít od každé síly. Požádejte svého lékaře nebo lékárníka, aby Vám napsal, kolik tobolek které síly (včetně barvy) potřebujete každý dávkovací den užít.
- Ujistěte se, že přesně víte, které dny máte dávky užívat (tj. které dny jsou „dávkovací“).
- Ujistěte se, že před začátkem každého nového léčebného cyklu jste si s lékařem zkontroloval(a), jakou dávku máte užívat. Někdy se dávka nebo druhy tobolek a jejich počet, které budete muset užívat, může od minulého cyklu lišit.
- Pokud už máte přípravek doma a nevíte, nebo si nejste jistý(á), jak dávky užívat, poraďte se před začátkem nového léčebného cyklu se svým lékařem. Chyby v užívání přípravku mohou působit závažné zdravotní následky.
Jestliže jste užil(a) více přípravku Temozolomide Accord, než jste měl(a)
Pokud náhodně užijete více tobolek, než jste měl(a), okamžitě kontaktujte svého lékaře, lékárníka nebo zdravotní sestru.
Jestliže jste zapomněl(a) užít Temozolomide Accord
Užijte zapomenutou dávku co nejdříve tentýž den. Pokud jste zmeškal(a) celý den, poraďte se se svým lékařem. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku, pokud Vám to lékař neurčí.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pacienti léčení temozolomidem v kombinaci s radioterapií mohou mít jiné nežádoucí účinky než pacienti užívající temozolomid samostatně.
Neprodleně kontaktujte svého lékaře, jestliže se u Vás objeví následující:
- závažná alergická reakce (vyrážka, která může být svědivá, sípaní nebo jiné dýchací potíže)
- nekontrolovatelné krvácení
- nekontrolovatelné záchvaty
- horečka, silná, neustupující bolest hlavy.
Léčba temozolomidem může způsobit snížení počtu některých typů krvinek. To může vést ke vzniku podlitin nebo ke krvácení, anémii (nedostatek červených krvinek), horečce a/nebo snížené odolnosti vůči infekcím. Toto snížení počtu krvinek je obvykle krátkodobé, ale v některých případech může být dlouhotrvající a může vést k velmi závažné formě anémie (aplastická anémie). Váš lékař zajistí pravidelné vyšetřování Vaší krve, aby se zjistily jakékoli změny, a rozhodne o tom, zda je nutná specifická léčba. V některých případech může být nutné snížit dávky temozolomidu nebo ukončit jeho podávání.
Pokud jste nově diagnostikovaný(á) pacient (pacientka) užívající Temozolomide Accord k léčbě specifického nádoru mozku (multiformního glioblastomu) v kombinované léčbě s radioterapií a později užíváte temozolomid samostatně, mohou se u Vás objevit následující nežádoucí účinky. Může být nutný lékařský zásah.
Velmi časté nežádoucí účinky (mohou postihnout více než 1 z 10 osob):
• bolest hlavy
• zácpa
• nevolnost a/nebo zvracení
• vyrážka
• vypadávání vlasů
• ztráta chuti k jídlu
• únava
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob):
• abnormální výsledky jaterních testů
• změna počtu krvinek
• křeče, změna bdělosti, ospalost, porucha rovnováhy, závratě, zmatenost, zapomnětlivost, porucha koncentrace, brnění, pocit mravenčení, potíže s mluvením nebo porozuměním jazyku, třes, cévní mozková příhoda
• abnormální nebo rozostřené vidění, dvojité vidění
• ztráta sluchu, zvonění v uších
• krácení dechu, kašel
• boláky nebo vředy v ústech, průjem, bolest břicha, pálení žáhy, potíže s polykáním, sucho v ústech
• časté močení, potíže s udržením moče nebo únik moči
• podráždění nebo červenání kůže, suchá kůže, svědění
• svalová slabost, bolest kloubů, bolest svalů
• zvýšení cukru v krvi, ztráta tělesné hmotnosti
• infekce, zánět ran, bolest v krku, plísňová infekce v ústech, opary
• krvácení, zadržování tekutiny, otoky končetin, srážení krve
• alergické reakce, horečka, poškození ozářením, otok obličeje, bolest, změny chutě
• úzkost, deprese, změny nálad, neschopnost usnout nebo spát
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob):
• zvýšení jaterních enzymů (Váš lékař to bude kontrolovat)
• bušení srdce (abnormální srdeční rytmus)
• příznaky podobné chřipce, červené skvrny pod kůží
• dlouhotrvající nebo opakované křeče, třes nebo škubavé pohyby, částečné ochrnutí, potíže s koordinací a rovnováhou, potíže s polykáním, poruchy s vnímáním dotyku
• částečná ztráta zraku, suché nebo červené oči
• zánět středního ucha, bolest ucha nebo nepříjemné pocity při hlasitých zvucích, bolest uší, hluchota, točení hlavy,
• zánět plic, zánět vedlejších nosních dutin, zánět průdušek, ucpaný nos, nachlazení nebo chřipka
• pocit plnosti žaludku/nadýmání, potíže s ovládáním vyprazdňování střev, hemeroidy
• bolestivé močení
• olupování kůže, zvýšená citlivost kůže na sluneční světlo, změna barvy kůže, zvýšené pocení
• poškození svalů, bolest zad
• nízká hladina draslíku v krvi, zvýšení tělesné hmotnosti
• pásový opar, příznaky podobné chřipce
• krvácení do mozku, vysoký krevní tlak, srážení krve v plicích, otoky
• slabost, otok tváře, třesavka, změny vnímání chuti, zubní potíže
• impotence, vaginální krvácení, vynechání menstruace nebo silné menstruační krvácení, bolest prsů
• změny nálad, deprese, halucinace nebo ztráta paměti
• změny barvy j azyka
• změna čichového smyslu
• žízeň
Následující nežádoucí účinky se mohou objevit, pokud užíváte temozolomid samostatně (pacienti léčení pro nádor mozku, který se objevil znovu nebo se rozšířil).
Velmi časté (mohou postihnout více než 1 z 10 osob):
Abnormální krevní hodnoty, bolest hlavy, nevolnost, zvracení, zácpa, ztráta chuti, únava.
Časté (mohou postihnout až 1 z 10 osob):
Spavost, závratě, brnění, průjem, bolest břicha, potíže se zažíváním, vyrážka, svědění, ztráta vlasů, snížení tělesné hmotnosti, horečka, slabost, třesavka, celkový pocit nemoci, bolest, změna chuti, dušnost.
Méně časté (mohou postihnout až 1 ze 100 osob):
Změny v krevním obrazu.
Vzácné (mohou postihnout až 1 z 1 000 osob):
Kašel. Infekce včetně zápalu plic.
Velmi vzácné (mohou postihnout až 1 ze 10 000 osob):
Červenání kůže, svědivá vyrážka se žlutými nebo bílými pupínky, jejichž okolí je zánětlivě červené, vyrážka, alergické reakce.
Jiné nežádoucí účinky:
Byly zaznamenány případy jaterních nežádoucích účinků zahrnující zvýšené hladiny jaterních enzymů, zvýšenou hladinu bilirubinu nebo problémy s odtokem žluče (cholestáza) a zánětu jater a poškození jater, včetně smrtelného selhání jater.
Velmi vzácně se objevily při léčbě temozolomidem plicní nežádoucí účinky. Pacienti (pacientky) obvykle trpěli(y) dušností a kašlem. Pokud si všimnete některých z těchto příznaků, řekněte to svému lékaři.
Ve velmi vzácných případech byla pozorována závažná vyrážka s otokem kůže, včetně dlaní a chodidel, nebo bolestivé zarudnutí kůže a/nebo puchýřky na těle nebo v ústech. Jestliže se tyto příznaky vyskytnou, oznamte to neprodleně svému lékaři.
Velmi vzácně existuje u pacientů (pacientek) užívajících temozolomid a jemu podobná léčiva malé riziko vzniku druhotných nádorů, včetně leukémie.
Méně často byly hlášeny nové nebo reaktivované (opakující se) infekce způsobené cytomegaloviry a reaktivované infekce způsobené virem heapatitidy B.
Méně často byly hlášeny případy diabetes insipidus. Příznaky diabetes insipidus zahrnují nadměrné močení a pocit žízně.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného vDodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Temozolomide Accord uchovávat
Uchovávejte mimo dohled a dosah dětí, nejlépe v uzamčené skříni. Náhodné požití může být pro děti smrtelné.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Lahvička
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původní lahvičce.
Uchovávejte v dobře uzavřené lahvičce, aby byl přípravek chráněn před vlhkostí.
Sáček
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Pokud zjistíte změny ve vzhledu tobolek, oznamte to lékárníkovi.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co Temozolomide Accord obsahuje
- Léčivou látkou je temozolomidum.
Temozolomide Accord 5 mg tvrdé tobolky: Jedna tobolka obsahuje temozolomidum 5 mg. Temozolomide Accord 20 mg tvrdé tobolky: Jedna tobolka obsahuje temozolomidum 20 mg. Temozolomide Accord 100 mg tvrdé tobolky: Jedna tobolka obsahuje temozolomidum 100 mg. Temozolomide Accord 140 mg tvrdé tobolky: Jedna tobolka obsahuje temozolomidum 140 mg. Temozolomide Accord 180 mg tvrdé tobolky: Jedna tobolka obsahuje temozolomidum 180 mg. Temozolomide Accord 250 mg tvrdé tobolky: Jedna tobolka obsahuje temozolomidum 250 mg.
- Dalšími složkami jsou:
Obsah tobolky:
laktosa, koloidní bezvodý oxid křemičitý, sodná sůl karboxymethylškrobu typu A, kyselina vinná, kyselina stearová.
Obal tobolky:
Temozolomide Accord 5 mg tvrdé tobolky: želatina, oxid titaničitý (E171), žlutý oxid železitý (E172), indigokarmín (E132), čištěná voda.
Temozolomide Accord 20 mg tvrdé tobolky: želatina, oxid titaničitý (E171), žlutý oxid železitý (E172), čištěná voda.
Temozolomide Accord 100 mg tvrdé tobolky : želatina, oxid titaničitý (E171), červený oxid železitý (E172), čištěná voda.
Temozolomide Accord 140 mg tvrdé tobolky : želatina, oxid titaničitý (E171), indigokarmín (E132), čištěná voda.
Temozolomide Accord 180 mg tvrdé tobolky : želatina, oxid titaničitý (E171), žlutý oxid železitý (E172), červený oxid železitý (E172), čištěná voda.
Temozolomide Accord 250 mg tvrdé tobolky : želatina, oxid titaničitý (E171), čištěná voda. inkoustový potisk:
šelak, propylenglykol,černý oxid železitý (E172) a hydroxid draselný.
Jak Temozolomide Accord vypadá a co obsahuje toto balení
Temozolomide Accord 5 mg tvrdé tobolky mají bílé tělo, zelené víčko, na víčku je vytištěno 'TMZ' a na těle tobolky '5' černým inkoustem.
Temozolomide Accord 20 mg tvrdé tobolky mají bílé tělo, žluté víčko, na víčku je vytištěno 'TMZ' a na těle tobolky '20' černým inkoustem.
Temozolomide Accord 100 mg tvrdé tobolky mají bílé tělo, růžové víčko, na víčku je vytištěno 'TMZ' a na těle tobolky '100' černým inkoustem.
Temozolomide Accord 140 mg tvrdé tobolky mají bílé tělo, modré víčko, na víčku je vytištěno 'TMZ' a na těle tobolky ' 140' černým inkoustem.
Temozolomide Accord 180 mg tvrdé tobolky mají bílé tělo, kaštanové víčko, na víčku je vytištěno 'TMZ' a na těle tobolky '180' černým inkoustem.
Temozolomide Accord 250 mg tvrdé tobolky mají bílé tělo, bílé víčko, na víčku je vytištěno 'TMZ' a na těle tobolky '250' černým inkoustem.
Tvrdé tobolky jsou dodávány v lahvičkách ze skla hnědé barvy, obsahujících 5 nebo 20 tobolek.
Jedna krabička obsahuje 1 lahvičku.
Tvrdé tobolky jsou dodávány v sáčku obsahujícím 1 tobolku.
Jedna krabička obsahuje 5 nebo 20 sáčků.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce:
Accord Healthcare Limited Sage House, 319 Pinner Road, North Harrow,
Middlesex,
HA1 4HF,
Velká Británie
Tato příbalová informace byla naposledy revidována: MM/RRRR
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
148
DATUM REVIZE TEXTU
DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:15. března 2010
Datum posledního prodloužení registrace: 12. ledna 2015
DATUM REVIZE TEXTU DD.MM.RRRR
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu/
DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. března 2010
Datum posledního prodloužení registrace: 12. ledna 2015
DATUM REVIZE TEXTU DD.MM.RRRR
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu/