Synflorix
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Synflorix injekční suspenze v předplněné injekční stříkačce Synflorix injekční suspenze
Synflorix injekční suspenze ve vícedávkovém balení Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 dávka (0,5 ml) obsahuje:
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
Pneumococcale
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
polysaccharidum
serotypus 11,2 serotypus 41,2 serotypus 51,2 serotypus 6B1,2 serotypus 7F1,2 serotypus 9V1,2 serotypus 141,2 serotypus 18C1,3 serotypus 19F1,4 serotypus 23F1,2
1 mikrogram 3 mikrogramy 1 mikrogram 1 mikrogram 1 mikrogram 1 mikrogram 1 mikrogram 3 mikrogramy 3 mikrogramy 1 mikrogram
1 adsorbováno na fosforečnan hlinitý 0,5 miligramů Al3+
2 konjugovaná na protein D (odvozený z kmenů netypovatelného Haemophilus influenzae) jako
9-16 mikrogramů 5-10 mikrogramů 3-6 mikrogramů
proteinový nosič
3 konjugovaná na tetanický toxoid jako proteinový nosič
4 konjugovaná na difterický toxoid jako proteinový nosič
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze (injekce). Vakcína je zakalená bílá suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Aktivní imunizace proti invazivním onemocněním, pneumonii a akutní otitis media způsobeným Streptococcuspneumoniae u kojenců a dětí ve věku od 6 týdnů až do 5 let. Informace o ochraně proti specifickým pneumokokovým sérotypům viz bod 4.4 a bod 5.1.
Použití vakcíny Synflorix musí vycházet z oficiálních doporučení, která zohledňují dopad na pneumokoková onemocnění u různých věkových skupin, stejně jako variabilitu epidemiologie v různých zeměpisných oblastech.
4.2 Dávkování a způsob podání
Dávkování
Očkovací schéma vakcíny Synflorix musí být v souladu s oficiálními doporučeními.
Kojenci od 6 týdnů do 6 měsíců věku
Základní očkování třemi dávkami
Doporučené očkovací schéma k zajištění optimální ochrany tvoří čtyři dávky, každá po 0,5 ml. Základní očkovací schéma u kojenců spočívá v podání tří dávek, s první dávkou podanou obvykle ve věku 2 měsíců a s intervalem nejméně 1 měsíc mezi jednotlivými dávkami. První dávka může být podána již ve věku šesti týdnů. Posilovací (čtvrtou) dávku se doporučuje podat nejméně 6 měsíců po podání poslední dávky základního očkování. Upřednostňuje se podání mezi 12. až 15. měsícem věku dítěte (viz body 4.4 a 5.1).
Základní očkování dvěma dávkami
Alternativně, je-li vakcína Synflorix podávaná jako část rutinního očkovacího kalendáře, může být podána ve schématu tvořeném třemi dávkami, každá po 0,5 ml. První dávka může být podána od věku 2 měsíců, druhá dávka o 2 měsíce později. Posilovací (třetí) dávku se doporučuje podat s odstupem alespoň 6 měsíců od poslední dávky základního očkování (viz bod 5.1).
Předčasně narozené děti (narozené mezi 27. - 36. týdnem těhotenství)
U nedonošených dětí narozených alespoň ve 27. týdnu těhotenství tvoří doporučené očkovací schéma čtyři dávky, každá po 0,5 ml. Základní očkovací schéma u kojenců tvoří tři dávky, kde první dávka je podána ve věku 2 měsíců a další, dávky v odstupu vždy alespoň 1 měsíce. Posilovací (čtvrtá) dávka se doporučuje podat s odstupem alespoň 6 měsíců od poslední dávky základního očkování (viz body 4.4 a 5.1).
Neočkovaní starší kojenci a děti ve věku > 7 měsíců
- kojenci ve věku 7 - 11 měsíců: očkovací schéma spočívá v podání dvou základních 0,5ml dávek s intervalem nejméně 1 měsíc mezi dávkami. Posilovací (třetí) dávku se doporučuje podat
v druhém roce života s intervalem nejméně 2 měsíce po poslední základní dávce.
- děti ve věku 12 měsíců - 5 let: očkovací schéma spočívá v podání dvou 0,5ml dávek s intervalem nejméně 2 měsíce mezi dávkami.
Doporučuje se, aby jedinci, kterým je podána první dávka přípravku Synflorix, dokončili celé očkovací schéma přípravkem Synflorix.
Pediatrická populace
Bezpečnost a účinnost vakcíny Synflorix u dětí starších 5 let nebyly stanoveny.
Způsob podání
Vakcína se má podávat formou intramuskulární injekce. Přednostním místem podání je anterolaterální část stehna u kojenců, nebo deltový sval horní části paže u malých dětí.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na kterýkoli proteinový nosič tohoto přípravku.
Podobně jako u jiných vakcín i aplikace vakcíny Synflorix musí být odložena u osob trpících závažným akutním horečnatým onemocněním. Přítomnost mírné infekce, jako je nachlazení, by ale neměla být příčinou oddálení očkování.
4.4 Zvláštní upozornění a opatření pro použití
Stejně jako u všech vakcín podávaných injekčně musí být i po aplikaci této vakcíny pro případ vzácně se vyskytující anafylaktické reakce okamžitě k dispozici odpovídající lékařská péče a dohled.
Možné riziko apnoe a nutnost monitorování dýchání po dobu 48 - 72 hodin by se měly zvážit při podávání základního očkovacího schématu těžce nedonošeným dětem (narozené ve < 28. týdnu těhotenství) a to zvláště těm, které mají v předchozí anamnéze respirační nezralost. Protože prospěch očkování je u této skupiny dětí vysoký, neměla by se vakcinace odmítat ani oddalovat.
Synflorix nesmí být v žádném případě aplikován intravaskulárně nebo intradermálně. Údaje
0 subkutánním podání vakcíny Synflorix nejsou k dispozici.
U dětí od 2 let věku se může objevit v průběhu očkování, nebo i před ním, synkopa (mdloba) jako psychogenní reakce na injekční stříkačku s jehlou. Je důležité předem zajistit takové podmínky, aby při eventuální mdlobě nemohlo dojít k úrazu.
Stejně jako jiné vakcíny aplikované intramuskulárně, musí být i Synflorix podáván opatrně osobám s trombocytopenií nebo s jakoukoli poruchou koagulace, protože po intramuskulárním podání může u těchto osob dojít ke krvácení.
Je třeba se též řídit oficiálními doporučeními k očkování proti difterii, tetanu a Haemophilus influenzae typu b.
Ochrana proti pneumokokovým sérotypům, které nej sou ve vakcíně obsaženy, kromě zkříženě reaktivního sérotypu 19A (viz bod 5.1), nebo proti netypovatelnému Haemophilus influenzae nebyla dostatečně prokázána. Synflorix neposkytuje ochranu proti jiným mikroorganismům.
Stejně jako jiné vakcíny, Synflorix nemusí chránit všechny očkované jedince proti invazivnímu pneumokokovému onemocnění, pneumonii nebo otitis media způsobeným sérotypy obsaženými v této vakcíně a zkříženě reaktivním sérotypem 19A. Navíc se předpokládá, že celková ochrana proti otitis media a pneumonii by mohla být omezena a podstatně nižší než ochrana proti invazivnímu onemocnění způsobenému sérotypy této vakcíny a zkříženě reaktivním sérotypem 19A tím, že mezi původce těchto onemocnění patří kromě sérotypů Streptococcus pneumoniae obsažených ve vakcíně
1 mnohé další mikroorganismy (viz bod 5.1).
V klinických studiích vyvolával Synflorix imunitní odpověď na všech deset sérotypů obsažených v této vakcíně, ale velikost odpovědí se mezi jednotlivými sérotypy lišila. Funkční imunitní odpověď na sérotyp 1 a 5 byla nižší než odpověď na všechny další sérotypy vakcíny. Není známo, zda má tato nižší funkční imunitní odpověď na sérotypy 1 a 5 za následek nižší ochranný účinek proti invazivnímu onemocnění, pneumonii nebo otitis media způsobeným těmito sérotypy (viz bod 5.1).
Synflorix je určen pro děti od 6 týdnů do 5 let věku. Děti by měly dostat vakcínu Synflorix podle očkovacího schématu odpovídajícího věku dítěte v době zahájení očkování (viz bod 4.2). Data o bezpečnosti a imunogenitě nejsou u dětí nad 5 let věku zatím k dispozici.
U dětí s nedostatečnou imunitní odpovědí, ať už díky imunosupresivní terapii, genetické poruše, infekci HIV nebo z jiných příčin, může být protilátková odpověď na očkování snížená.
Údaje o bezpečnosti a imunogenitě u dětí, u nichž je zvýšené riziko pneumokokových infekcí (např. se srpkovitou anemií, vrozenou a získanou poruchou funkce sleziny, infekcí HIV, maligním onemocněním, nefrotickým syndromem), nejsou zatím pro Synflorix k dispozici. Očkování vysoce rizikových skupin by mělo být zváženo na základě individuálního přístupu (viz bod 4.2).
Dětem mladším 2 let má být podána vakcína Synflorix v očkovacím schématu odpovídajícím jejich věku (viz bod 4.2). Použití pneumokokové konjugované vakcíny nenahrazuje podání 23valentní pneumokokové polysacharidové vakcíny imunokompromitovaným dětem > 2 let nebo dětem > 2 let s nemocemi (jako jsou srpkovitá anémie, asplenie, infekce HIV, chronické onemocnění), které je řadí do skupiny s vyšším rizikem výskytu invazivního onemocnění způsobeného Streptococcus pneumoniae. Kdykoliv je to doporučeno, mají být děti v rizikové skupině ve věku > 24 měsíců a již očkované vakcínou Synflorix očkovány 23valentní pneumokokovou polysacharidovou vakcínou.
Interval mezi podáním pneumokokové konjugované vakcíny (Synflorix) a 23valentní pneumokokové polysacharidové vakcíny by měl být nejméně 8 týdnů. Nejsou dostupné žádné údaje o tom, zda může mít podání pneumokokové polysacharidové vakcíny dětem očkovaným v základním schématu vakcínou Synflorix za následek sníženou odpověď na další dávky pneumokokové polysacharidové vakcíny nebo pneumokokové konjugované vakcíny.
Profylaktické podání antipyretik před aplikací nebo bezprostředně po aplikaci vakcíny může snížit incidenci a intenzitu horečnatých reakcí po očkování. Klinická data získaná s paracetamolem a ibuprofenem nasvědčují tomu, že by profylaktické použití paracetamolu mohlo snižovat četnost horečky, zatímco profylaktické použití ibuprofenu prokázalo omezený vliv na snížení četnosti horečky. Klinická data naznačují, že paracetamol může snížit imunitní odpověď na Synflorix. Nicméně, klinický význam tohoto pozorování není znám.
Profylaktické podání antipyretik se doporučuje:
- U všech dětí, kterým je Synflorix podán současně s vakcínami s celobuněčnou pertusovou složkou vzhledem k vyšší frekvenci febrilních křečí (viz bod 4.8).
- U dětí s křečemi nebo s anamnézou febrilních křečí.
Antipyretická léčba by měla být zahájena v souladu s místními terapeutickými doporučeními.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Použití s dalšími vakcínami
Synflorix může být podán současně s některou z následujících monovalentních nebo kombinovaných vakcín [včetně DTPa-HBV-IPV/Hib a DTPw-HBV/Hib]: vakcínou proti difterii-tetanu-pertusi s acelulární pertusovou složkou (DTPa), vakcínou proti hepatitidě B (HBV), inaktivovanou vakcínou proti dětské obrně (IPV), vakcínou proti Haemophilus influenzae typu b (Hib), vakcínou proti difterii-tetanu-pertusi s celobuněčnou pertusovou složkou (DTPw), vakcínou proti spalničkám-příušnicím-zarděnkám (MMR), vakcínou proti planým neštovicím (V), konjugovanou vakcínou proti meningokokům séroskupiny C (CRM197 a TT konjugáty), konjugovanou vakcínou proti meningokokům séroskupin A, C, W-135 a Y (TT konjugát), perorální vakcínou proti dětské obrně (OPV) a perorální vakcínou proti rotavirům.
Injekce jednotlivých vakcín musí být aplikovány do různých míst.
Klinické studie prokázaly, že imunitní odpovědi a bezpečnostní profily těchto současně podávaných vakcín zůstaly nezměněny, s výjimkou odpovědi na inaktivovaný poliovirus typu 2, u kterého byly ve studiích pozorovány nekonzistentní výsledky (séroprotekce v rozmezí 78 % až 100 %). Navíc pokud v průběhu druhého roku života u dětí se základním očkováním třemi dávkami vakcíny Synflorix byla současně podána konjugovaná vakcína proti meningokokům séroskupin A, C, W-135 a Y (TT konjugát) s posilovací dávkou vakcíny Synflorix, pak byly pozorovány u jednoho pneumokokového sérotypu (18 C) nízké geometrické průměry hodnot koncentrace protilátek (GMC) a geometrické průměry titrů funkčních protilátek (OPA GMT). Toto souběžné podávání nemělo žádný dopad u dalších devíti pneumokokových sérotypů. Byla pozorována zvýšená protilátková odpověď na Hib-TT konjugát, difterický a tetanický toxoid. Klinický význam těchto pozorování není znám.
Použití se systémově podávanými imunosupresivními léčivými přípravky
Podobně jako u jiných vakcín lze očekávat, že u pacientů podstupujících imunosupresivní terapii nemusí být po očkování dosaženo odpovídající imunitní odpovědi.
Použití s profylaktickým podáním antipyretik
Viz bod 4.4.
4.6 Fertilita, těhotenství a kojení
Synflorix není určen k očkování dospělých. Údaje o jeho použití u lidí během těhotenství a laktace, ani odpovídající údaje z reprodukčních studií prováděných na zvířatech nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky Souhrnný bezpečnostní profil
Posouzení bezpečnosti vakcíny Synflorix bylo založeno na klinických studiích, kdy 22 429 zdravým dětem a 137 nedonošeným dětem bylo aplikováno v rámci základního očkování 63 905 dávek vakcíny Synflorix. V druhém roce života bylo posilovací dávkou vakcíny Synflorix očkováno 19 466 dětí a 116 nedonošených dětí.
Bezpečnost byla rovněž posouzena u 435 dříve neočkovaných dětí ve věku od 2 do 5 let, z nichž 285 jedinců obdrželo 2 dávky vakcíny Synflorix.
Ve všech studiích byl Synflorix podáván současně s doporučenými dětskými vakcínami.
Nejčastější nežádoucí účinky pozorované u kojenců po základním očkování byly: zarudnutí v místě vpichu injekce a podrážděnost, které se vyskytly u přibližně 41 %, respektive u 55 % všech podaných dávek. Po podání posilovací dávky byly nejčastějšími nežádoucími účinky bolest v místě vpichu injekce a podrážděnost, které se vyskytly v přibližně 51 %, respektive v 53 %. Většina těchto reakcí netrvala dlouho a byla mírného až středního stupně.
Po dalších dávkách základního očkovacího schématu nebylo pozorováno zvýšení incidence ani zvýšení závažnosti nežádoucích účinků.
Místní reaktogenita základního očkovacího schématu byla stejná u kojenců ve věku < 12 měsíců a u dětí ve věku > 12 měsíců s výjimkou bolesti v místě podání injekce, kde se výskyt zvýšil se zvyšujícím se věkem: bolest byla hlášena u více než 39 % kojenců ve věku < 12 měsíců a u více než 58 % dětí ve věku > 12 měsíců.
Po podání posilovací dávky dětem > 12 měsíců je pravděpodobnější výskyt reakcí v místě podání injekce ve srovnání s mírou reakce pozorovanou u kojenců v průběhu základního očkování vakcínou Synflorix.
Po podání záchytné (catch-up) dávky dětem ve věku 12 až 23 měsíců byl častěji hlášen výskyt kopřivky (méně časté) ve srovnání s výskytem pozorovaným u kojenců v průběhu základního a posilovacího očkování.
Reaktogenita byla vyšší u dětí, kterým byla současně podána vakcína s celobuněčnou pertusovou složkou. V klinické studii děti obdržely buď vakcínu Synflorix (N = 603) nebo 7valentní vakcínu Prevenar (N = 203) současně s DTPw vakcínou. Po podání základního očkování byla hlášena horečka > 38 °C a > 39 °C u 86,1 % a 14,7 % dětí, které obdržely Synflorix, a u 82,9 % a 11,6 % u dětí očkovaných 7valentní vakcínou Prevenar.
Ve srovnávacích klinických studiích byla incidence místních a celkových nežádoucích účinků hlášených do čtyř dnů po každé podané dávce ve stejném rozmezí jako po očkování 7valentní vakcínou Prevenar.
Seznam nežádoucích účinků v tabulce
Nežádoucí účinky (pro všechny věkové skupiny) považované přinejmenším za možná související s očkováním jsou utříděny podle četnosti.
(> 1/10)
Četnost nežádoucích účinků je definována následujícím způsobem:
Velmi časté: Časté:
Méně časté: Vzácné:
Velmi vzácné:
(> 1/100 až < 1/10)
(> 1/1 000 až < 1/100)
(> 1/10 000 až < 1/1 000) (< 1/10 000)
|
Třídy orgánových systémů |
Četnost výskytu |
Nežádoucí účinky |
|
Klinické studie | ||
|
Poruchy imunitního systému |
vzácné |
Alergické reakce (jako jsou alergická dermatitida, atopická dermatitida, ekzém) |
|
velmi vzácné |
Angioedém | |
|
Poruchy metabolismu a výživy |
velmi časté |
Ztráta chuti k jídlu |
|
Psychiatrické poruchy |
velmi časté | |
|
méně časté |
Neobvyklý pláč | |
|
Poruchy nervového systému |
velmi časté |
Ospalost |
|
vzácné |
Křeče (včetně febrilních) | |
|
Cévní poruchy |
velmi vzácné |
Kawasakiho nemoc |
|
Respirační, hrudní a mediastinální poruchy |
méně časté |
Apnoe u těžce nedonošených dětí (narozených ve < 28. týdnu těhotenství) (viz bod 4.4) |
|
Gastrointestinální poruchy |
méně časté | |
|
Poruchy kůže a podkožní tkáně |
méně časté | |
|
vzácné |
Kopřivka | |
|
Celkové poruchy a reakce v místě aplikace |
velmi časté |
Bolest, zarudnutí, otok v místě vpichu, horečka > 38 °C rektálně (věk < 2 roky) |
|
časté |
Reakce v místě podání injekce jako indurace v místě vpichu, horečka > 39 °C rektálně (věk < 2 roky) | |
|
méně časté |
Reakce v místě podání injekce jako hematom, krvácení a postižení uzlin | |
|
Nežádoucí reakce dodatečně hlášené po podání posilovači dávky základního očkování a/nebo přídatného očkování: | ||
|
Poruchy nervového systému |
méně časté |
Bolest hlavy (věk od 2 do 5 let) |
|
Gastrointestinální poruchy |
méně časté |
Nauzea (věk od 2 do 5 let) |
|
Celkové poruchy a reakce v místě aplikace |
časté |
Horečka > 38 °C rektálně (věk od 2 do 5 let) |
|
méně časté |
Reakce v místě podání injekce jako svědění, horečka > 40 °C rektálně (věk < 2 roky), horečka > 39 °C rektálně (věk od 2 do 5 let), difuzní otok končetiny v místě podání injekce, někdy zahrnující přiléhající kloub | |
|
Postmarketingové sledování | ||
|
Poruchy imunitního systému |
velmi vzácné |
Anafylaxe |
|
Poruchy nervového systému |
vzácné |
Hypotonicko-hyporesponzivní epizoda |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyl hlášen žádný případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny proti pneumokokům, ATC kód: J07AL52
1. Epidemiologická data
10 pneumokokových sérotypů obsažených v této vakcíně představuje hlavní sérotypy původce onemocnění a pokrývá tak přibližně 56 % až 90 % invazivních pneumokokových onemocnění (IPD) u dětí < 5 let věku v Evropě. Sérotypy 1, 5 a 7F v této věkové skupině způsobují 3,3 % až 24,1 % IPD v závislosti na lokalitě a sledovaném časovém období.
Pneumonie různé etiologie jsou celosvětově hlavní příčinou dětské morbidity a mortality.
V prospektivních studiích bylo odhadováno, že Streptococcus pneumoniae byl odpovědný za 30 -50 % bakteriálních pneumonií.
Akutní otitis media (AOM) je běžné dětské onemocnění různé etiologie. Bakterie mohou způsobit 60 - 70 % klinických případů AOM. Streptococcus pneumoniae a netypovatelný Haemophilus influenzae (NTHi) jsou nejčastějšími původci bakteriální AOM na celém světě.
2. Účinnost v klinických studiích
V rozsáhlé, dvojitě zaslepené, cluster-randomizované, kontrolované, klinické studii fáze III/IV provedené ve Finsku (FinlP) byly děti randomizovány do 4 skupin podle dvou očkovacích schémat kojenců [dvoudávkové (ve věku 3, 5 měsíců) nebo třídávkové (ve věku 3, 4, 5 měsíců) základní očkovací schéma následované posilující dávkou ve věku 11 měsíců], které obdržely buď Synflorix (2/3 klastrů), nebo vakcíny proti hepatitidě jako kontrolní (1/3 klastrů). V záchytné (catch-up) kohortě děti ve věku mezi 7 - 11 měsíci v době první dávky vakcíny obdržely vakcínu Synflorix nebo vakcínu proti hepatitidě B jako kontrolní podle 2dávkového základního očkovacího schématu následovaného posilovací dávkou a děti ve věku mezi 12 - 18 měsíci v době první dávky vakcíny obdržely 2 dávky buď vakcíny Synflorix, nebo vakcínu proti hepatitidě A jako kontrolní. U invazivních onemocnění a pneumonií diagnostikovaných v nemocničním prostředí byla průměrná doba sledování od první vakcinace 24 až 28 měsíců. Ve vnořené studii byli kojenci sledováni až přibližně do věku 21 měsíců, kdy byl zhodnocen vliv vakcíny Synflorix na nasofaryngeální nosičství a AOM diagnostikované lékařem a hlášené rodiči.
V rozsáhlé, randomizované, dvojitě zaslepené klinické studii fáze III (Clinical Otitis Media and Pneumonia Study - COMPAS) provedené v Argentině, Panamě a Kolumbii, zdraví kojenci ve věku 6 až 16 týdnů obdrželi buď vakcínu Synflorix, nebo vakcínu proti hepatitidě B jako kontrolní ve 2, 4 a 6 měsících věku následovanou buď vakcínou Synflorix, nebo vakcínou proti hepatitidě A jako kontrolní ve věku 15 až 18 měsíců.
2.1 Invazivní pneumokokové onemocnění (zahrnující sepsi, bakteriémii, meningitidu a pneumonii s bakteriémií)
Účinnost vakcíny (VE) byla demonstrována v prevenci mikrobiologicky prokázaného IPD způsobeného pneumokokovými sérotypy obsaženými ve vakcíně po podání vakcíny Synflorix kojencům ve schématu 2+1, nebo 3+1 v klinické studii FinIP a ve schématu 3+1 v klinické studii COMPAS (viz tabulka 1).
Tabulka 1: Počet případů IPD způsobených vakcinačními sérotypy a účinnost vakcíny (FinIP) a (COMPAS) u kojenců mladších 7 měsíců při vstupu do studie, kterým byla podána alespoň jedna dávka vakcíny (celková kohorta očkovaných kojenců)__
|
Typ IPD |
FinIP |
COMPAS | ||||||
|
Počet případů IPD |
VE (95% CI) |
Počet případů IPD |
VE (95% CI) | |||||
|
Synflorix 3+1 schéma |
Synflorix 2+1 schéma |
Kontrolní(2) |
3+1 schéma |
2+1 schéma |
Synflorix 3+1 schéma |
Kontrolní |
3+1 schéma | |
|
N 10 273 |
N 10 054 |
N 10 200 |
N 11 798 |
N 11 799 | ||||
|
Vakcinační sérotyp IPD(1) |
0 |
1 |
12 |
100 %(3) (82,8; 100) |
91,8 %(4) (58,3; 99,6) |
0 |
18 |
100 %(5) (77,3; 100) |
|
Sérotyp 6B IPD |
0 |
0 |
5 |
100 % (54,9; 100) |
100 % (54,5; 100) |
0 |
2 |
- |
|
Sérotyp 14 IPD |
0 |
0 |
4 |
100 % (39,6; 100) |
100 % (43,3; 100) |
0 |
9 |
100 % (49,5; 100) |
IPD invazivní pneumokokové onemocnění VE účinnost vakcíny (FinIP) a (COMPAS)
N počet jedinců ve skupině
CI interval spolehlivosti
(1) Ve FinIP kromě sérotypů 6B a 14, kultivačně prokázaná IPD způsobená pneumokokovými sérotypy obsaženými ve vakcíně zahrnovala 7F (1 případ ve skupině Synflorix 2+1), 18C, 19F a 23F (vždy 1 případ v kontrolních skupinách). Ve studii COMPAS byly vedle sérotypů 6B
a 14 detekovány sérotypy 5 (2 případy), 18C (4 případy) a 23F (1 případ).
(2) spojené dvě kontrolní skupiny kojenců
(3) p-hodnota < 0,0001
(4) p-hodnota = 0,0009
(5) VE v ATP kohortě byla 100% (95% CI: 74,3 - 100; 0 proti 16 případům)
Ve FinIP celkově pozorovaná účinnost vakcíny proti mikrobiologicky prokázanému IPD byla 100 % (95% CI: 85,6 - 100; 0 proti 14 případům) ve 3+1 schématu, 85,8 % (95% CI: 49,1 - 97,8; 2 proti 14 případům) ve schématu 2+1 a 93,0 % (95% CI: 74,9 - 98,9; 2 proti 14 případům) bez ohledu na základní očkovací schéma. V COMPAS byla celkově pozorovaná účinnost proti mikrobiologicky prokázanému IPD 66,7 % (95% CI: 21,8 - 85,9; 7 proti 21 případům).
Účinnost po záchytné (catch-up) imunizaci
Mezi 15 447 dětmi v kohortách se záchytným (catch-up) očkováním nebyly ve skupinách očkovaných vakcínou Synflorix žádné kultivačně prokázané případy IPD, zatímco bylo pozorováno 5 případů IPD způsobených vakcinačními sérotypy v kontrolních skupinách (sérotypy 4, 6B, 7F, 14 a 19F).
2.2 Pneumonie
Účinnost proti pneumonii byla zhodnocena ve studii COMPAS. Průměrná délka sledování od 2 týdnů po třetí dávce v ATP kohortě byla 23 měsíců (rozsah od 0 do 34 měsíců) v „interim“ analýze (IA) a 30 měsíců (rozsah od 0 do 44 měsíců) v závěrečné analýze. Na konci IA nebo v závěrečné analýze sledovacího období v ATP kohortě byl průměrný věk 29 měsíců (rozsah od 4 do 41 měsíců)
a 36 měsíců (rozsah od 4 do 50 měsíců). Podíl jednotlivců, kteří obdrželi posilovači dávku v ATP kohortě, byl 92,3 % v obou analýzách.
Účinnost vakcíny Synflorix proti prvním epizodám pravděpodobně bakteriální pneumonie získané v komunitě (CAP) vyskytující se od 2 týdnů po podání třetí dávky byla demonstrována v ATP kohortě (P hodnota < 0,002) v „interim“ analýze („event-driven“; primární cíl studie).
Pravděpodobně bakteriální CAP (B-CAP) je definována jako rentgenologicky potvrzený případ CAP s buď alveolární konsolidací/pleurálním výpotkem na rentgenovém snímku hrudníku, nebo s nealveolárními infiltráty, ale s C reaktivním proteinem (CRP) > 40 mg/l.
Účinnost vakcíny proti B-CAP pozorovaná v „interim“ analýze je uvedena níže (tabulka 2).
Tabulka 2: Počty a procenta jedinců s prvními epizodami B-CAP vyskytujícími se od 2 týdnů po podání třetí dávky vakcíny Synflorix nebo kontrolní vakcíny a účinnost vakcíny (ATP kohorta)
|
Synflorix N = 10 295 |
Kontrolní vakcína N = 10 201 |
Účinnost vakcíny | ||
|
N |
% (n/N) |
n |
% (n/N) | |
|
240 |
2,3 % |
304 |
3,0 % |
22,0 % (95% CI: 7,7; 34,2) |
N počet j edinců ve skupině
n/% počet/procento jedinců hlášených ve skupině s první epizodou B-CAP kdykoliv od 2 týdnů po
podání třetí dávky CI interval spolehlivosti
V „interim“ analýze (ATP kohorta) byla účinnost vakcíny proti prvním epizodám CAP s alveolární konsolidací nebo pleurálním výpotkem (C-CAP, WHO definice) 25,7 % (95% CI: 8,4; 39,6) a 6,7 % (95% CI: 0,7; 12,3) proti prvním epizodám klinicky suspektních CAP odeslaných k rentgenovému vyšetření.
V závěrečné analýze studie (ATP kohorta) byla účinnost vakcíny (první epizody) proti B-CAP 18,2 % (95% CI: 4,1; 30,3), proti C-CAP 22,4 % (95% CI: 5,7; 36,1) a 7,3 % (95% CI: 1,6; 12,6) proti klinicky suspektním CAP odeslaným k rentgenovému vyšetření. Účinnost pro vakcinační sérotypy byla 100 % (95 % CI: 41,9; 100) proti bakteriemické pneumokokové pneumonii nebo empyému. Ochrana proti B-CAP před posilovací dávkou a v době nebo po posilovací dávce byla 13,6 % (95% CI: -11,3; 33,0) a 21,7 % (95% CI: 3,4; 36,5). Pro C-CAP to bylo 15,1 % (95% CI: -15,5; 37,6)
a 26,3 % (95% CI: 4,4; 43,2).
U dětí < 36 měsíců věku byla redukce B-CAP a C-CAP největší (účinnost vakcíny 20,6 % [(95% CI: 6,5; 32,6) a 24,2 % (95% CI: 7,4; 38,0)]. Účinnost vakcíny u dětí > 36 měsíců naznačuje odeznívající ochranu. Přetrvávající ochrana proti B-CAP a C-CAP ve věku nad 36 měsíců není v současné době prokázána.
Výsledky studie COMPAS, která byla provedena v Latinské Americe, by měla být hodnocena s opatrností vzhledem k možným rozdílům v epidemiologii pneumonie v rozdílných zeměpisných lokalitách.
Ve studii FinlP byla účinnost vakcíny při snižování případů pneumonie diagnostikované v nemocničním prostředí (identifikované na základě MKN 10 kódů pro pneumonii) ve schématu 3+1 u kojenců 26,7 % (95% CI: 4,9; 43,5) a ve schématu 2+1 u kojenců 29,3 % (95% CI: 7,5; 46,3). Pro záchytné (catch-up) očkování byla účinnost vakcíny u kohorty 7 - 11 měsíců 33,2 % (95% CI: 3,0; 53,4) a u kohorty 12 - 18 měsíců 22,4 % (95% CI: -8,7; 44,8).
2.3 Akutní otitis media (AOM)
Dvě studie zkoumající účinnost, COMPAS a POET (Pneumococcal Otitis Media Efficacy Trial) byly provedeny s konjugovanými pneumokokovými vakcínami obsahujícími protein D: Synflorix a zkoumaná 11valentní konjugovaná vakcína (která navíc obsahovala sérotyp 3).
Ve studii COMPAS bylo 7 214 jedinců [Total Vaccinated cohort (TVC)] zahrnuto do analýzy účinnosti AOM, kde 5 989 jedinců bylo v kohortě ATP (viz tabulka 3).
Tabulka 3: Účinnost vakcíny proti AOM(1) ve studii COMPAS
|
Druh nebo příčina AOM |
Účinnost vakcíny (95% CI) |
|
atp(2) | |
|
Klinická AOM |
16,1 % (-1,1; 30,4)(3) |
|
Jakékoliv pneumokokové sérotypy |
56,1 % (13,4; 77,8) |
|
10 pneumokokových sérotypů obsažených ve |
67,1 % |
|
vakcíně |
(17,0; 86,9) |
|
Netypovatelný Haemophilus influenzae |
15,0 %(4) |
|
(NTHi) |
(-83,8; 60,7) |
CI interval spolehlivosti;
(1) první epizoda;
(2) období sledování s maximem 40 měsíců od 2 týdnů po třetí základní dávce;
(3) předem definovaná kriteria bez statistické významnosti (jednostranné p = 0,032). Avšak v TVC kohortě byla účinnost vakcíny proti první klinické epizodě AOM 19 % (95% CI: 4,4; 31,4).
(4) bez statistické významnosti.
V další velké randomizované dvojitě zaslepené studii (POET) provedené v České republice a na Slovensku byla 4 907 kojencům (ATP kohorta) v očkovacím schématu 3, 4, 5 a 12 - 15 měsíců podávána 11valentní kandidátní vakcína (11Pn-PD), která obsahovala 10 sérotypů obsažených ve vakcíně Synflorix (a navíc obsahující sérotyp 3, u něhož nebyla účinnost prokázána) nebo kontrolní vakcína (vakcína proti hepatitidě A).
Účinnost 11Pn-PD vakcíny proti výskytu první epizody AOM vyvolané sérotypem obsaženým ve vakcíně byla 52,6 % (95% CI: 35,0; 65,5). Sérotypově specifická účinnost proti první epizodě AOM byla prokázána pro sérotyp 6B (86,5 %, 95% CI: 54,9; 96,0), 14 (94,8 %, 95% CI: 61,0; 99,3), 19F (43,3 %, 95% CI: 6,3; 65,4) a 23F (70,8 %, 95% CI: 20,8; 89,2). Pro další sérotypy vakcíny byl počet případů AOM tak nízký, že nebylo možné učinit závěry týkající se účinnosti. Účinnost vakcíny proti jakékoli epizodě AOM způsobené jakýmkoli sérotypem pneumokoku byla 51,5 % (95% CI: 36,8; 62,9). Účinnost vakcíny proti první epizodě NTHi AoM byla 31,1 % (95% CI: -3,7; 54,2; nevýznamná). Účinnost proti jakékoliv epizodě NTHi AOM byla 35,3 % (95% CI: 1,8; 57,4). Odhadovaná účinnost vakcíny proti jakékoli klinické epizodě otitis media bez ohledu na etiologii byla
33,6 % (95% CI: 20,8; 44,3).
Na základě imunologických překlenovacích studií funkčních odpovědí (OPA) mezi vakcínou Synflorix a 11valentní kandidátní vakcínou použitou ve studii POET se předpokládá, že Synflorix poskytne obdobnou protektivní účinnost proti pneumokokovým AOM.
Nebylo pozorováno žádné zvýšení výskytu AOM způsobené jinými bakteriálními patogeny nebo sérotypy mimo vakcínu/sérotypy nesouvisejícími s vakcínou ani ve studii COMPAS (na základě hlášení několika případů), ani ve studii POET.
Účinnost proti AOM diagnostikované lékařem a hlášené rodiči byla zkoumána ve vnořené studii v rámci FinIP studie. Účinnost vakcíny byla pro schéma 3+1 6,1 % (95% CI: -2,7; 14,1) a pro schéma 2+1 7,4 % (95% CI: -2,8; 16,6) pro takto definovanou AOM v kohortě očkovaných kojenců.
2.4 Vliv na nasofaryngeální nosičství (NPC)
Účinek vakcíny Synflorix na nasofaryngeální nosičství byl studován ve 2 dvojitě zaslepených randomizovaných studiích užívajících inaktivní kontroly: ve vnořené studii FinIP provedené ve Finsku (5 023 jedinců) a ve studii COMPAS (1 700 jedinců).
Jak ve studii COMPAS, tak ve vnořené finské studii, Synflorix snížil nosičství vakcinálních typů se zřetelným zvýšením nevakcinačních sérotypů (mimo souvisejících s vakcínou) pozorovaným po posilovači dávce. Výsledky nebyly statisticky významné napříč všemi analýzami ve studii COMPAS. Avšak celkově byl zaznamenán trend snížení celkového pneumokokového nosičství.
V obou studiích byly významně sníženy jednotlivé sérotypy 6B a 19F. Ve vnořené finské studii bylo rovněž pozorováno významné snížení jednotlivých sérotypů 14, 23F a u 3dávkového základního schématu pro zkříženě reaktivní sérotyp 19A.
3. Účinnost v post-marketingovém sledování
V Brazílii, byla vakcína Synflorix zavedena do národního očkovacího programu (NIP) za použití očkovacího schématu 3 + 1 u kojenců (2, 4, 6 měsíců a přeočkování ve věku 12 měsíců) se záchytnou (catch-up) kampaní u dětí do 2 let. Na základě téměř 3 roky trvajícího sledování po zavedení vakcíny Synflorix strukturálně vyvážená studie případů a kontrol zaznamenala výrazný pokles kultivačně nebo PCR potvrzených IPD způsobených jakýmkoliv vakcinačním sérotypem a IPD způsobených jednotlivými sérotypy 6B, 14 a 19A.
Tabulka 4: Souhrn účinnosti vakcíny Synflorix na IPD v Brazílii
|
Typy IPD(1) |
Adjustovaná účinnost(2) % (95% CI) |
|
IPD způsobené jakýmkoliv vakcinačním sérotypem(3) |
83,8 % (65,9; 92,3) |
|
- Invazivní pneumonie nebo bakteriémie |
81,3 % (46,9; 93,4) |
|
- Meningitida |
87,7 % (61,4; 96,1) |
|
IPD způsobené jednotlivými sérotypy(4) | |
|
- 6B |
82,8 % (23,8; 96,1) |
|
- 14 |
87,7 % (60,8; 96,1) |
|
- 19A |
82,2 % (10,7; 96,4) |
(1) Kultivačně nebo PCR potvrzená IPD.
(2) Adjustovaná účinnost představuje procento snížení IPD ve skupině očkované vakcínou Synflorix ve srovnání s neočkovanou skupinou, při kontrole zavádějících faktorů.
(3) K analýze přispěly kultivačně nebo PCR potvrzené případy způsobené sérotypy 4, 6B, 7F, 9V, 14, 18C, 19F a 23F.
(4) Jednotlivé sérotypy, pro něž bylo dosaženo statistické významnosti při analýze účinnosti kontrolující zavádějící faktory (bez korekce na mnohonásobné srovnání).
Ve Finsku byla vakcína Synflorix zavedena do NIP v očkovacím schématu 2 + 1 u kojenců (3,
5 měsíců a přeočkování ve věku 12 měsíců) bez záchytné (catch-up) kampaně. Srovnání před a po NIP naznačuje významné snížení výskytu kultivačně potvrzených IPD, IPD způsobených vakcinačním sérotypem a IPD způsobených sérotypem 19A.
Tabulka 5: Incidence IPD a odpovídající míra snížení incidence IPD ve Finsku
|
IPD |
Incidence na 100 000 osoboroků |
Relativní snížení incidence(1) % (95% CI) | |
|
Před NIP |
Po NIP | ||
|
Jakékoliv potvrzené kultivačně |
62,9 |
12,9 |
80 % (72; 85) |
|
Jakýkoliv vakcinační sérotyp(2) |
49,1 |
4,2 |
92 % (86; 95) |
|
Sérotyp 19A |
5,5 |
2,1 |
62 % (20; 85) |
(1) Relativní snížení incidence ukazuje, o kolik byla incidence IPD snížena v kohortě dětí < 5 let očkovaných vakcínou Synflorix (sledované po dobu 3 let po zavedení do NIP) proti věkem a sezónou
párovaným neočkovaným historickým kohortám (každá sledována po dobu 3 let před zavedením vakcíny Synflorix do NIP).
(2) K analýze přispěly kultivačně potvrzené případy způsobené sérotypy 1, 4, 6B, 7F, 9V, 14, 18C, 19Fa23F.
V kanadském Quebeku byl Synflorix zaveden do imunizačního programu kojenců (2 základní dávky kojencům mladším 6 měsíců a posilující dávka ve 12 měsících) po 4,5letém užívání 7valentní vakcíny Prevenar. Na základě 1,5letého sledování po zavedení vakcíny Synflorix s více než 90% pokrytím věkové skupiny způsobilé k očkování byl pozorován pokles incidence IPD způsobených vakcinačními sérotypy (převážně díky změnám v onemocnění způsobeném sérotypem 7F) bez průvodního zvýšení incidence IPD způsobených nevakcinačními sérotypy. Souhrnně byla incidence IPD 35/100 000 osoboroků v kohortách vystavených očkování vakcínou Synflorix a 64/100 000 osoboroků
v kohortách vystavených očkování 7valentní vakcínou Prevenar, což představuje statisticky signifikantní rozdíl (p = 0,03). Z observačních studií tohoto typu není možné odvodit žádnou přímou souvislost mezi příčinou a následkem.
4. Data týkající se imunogenity
4.1 Imunologická non-inferiorita proti 7valentní vakcíně Prevenar
Podle doporučení WHO bylo hodnocení potenciální účinnosti proti IPD před registrací založeno na srovnání imunitních odpovědí na sedm sérotypů společných pro Synflorix a jinou pneumokokovou konjugovanou vakcínu s již prokázanou protektivní účinností (např. 7valentní Prevenar). Také byla měřena imunitní odpověď na další tři sérotypy obsažené ve vakcíně Synflorix.
V přímé (head-to-head) srovnávací studii se 7valentní vakcínou Prevenar byla pomocí metody ELISA prokázána non-inferiorita imunitní odpovědi na Synflorix pro všechny sérotypy (horní limit 96,5% intervalu spolehlivosti (CI) u rozdílu mezi skupinami > 10 %), vyjma 6B a 23F (tabulka 6). Pro sérotypy 6B a 23F dosáhlo prahové hladiny protilátek (tj. 0,20 pg/ml) jeden měsíc po třetí dávce vakcíny Synflorix 65,9 %, respektive 81,4 % kojenců očkovaných ve 2., 3. a 4. měsíci oproti 79,0 %, respektive 94,1 % po třech dávkách 7valentní vakcíny Prevenar. Klinický význam těchto rozdílů je nejasný, jelikož bylo pozorováno, že ve dvojitě zaslepené, cluster-randomizované studii byla vakcína Synflorix účinná proti IPD způsobenému sérotypem 6B (viz tabulka 1).
Procento očkovaných, kteří dosáhli prahových hladin protilátek pro další tři sérotypy obsažené ve vakcíně Synflorix (1,5 a 7F) bylo 97,3 %, respektive 99,0 % a 99,5 % a bylo srovnatelné s odpovědí u 7valentní vakcíny Prevenar na všech 7 sérotypů obsažených v obou vakcínách (95,8 %).
Tabulka 6: Srovnávací analýza mezi 7valentní vakcínou Prevenar a vakcínou Synflorix ocentu jedinců s koncentrací protilátek > 0,20 ug/ml j
|
Protilátky |
Synflorix |
7valentní vakcína Prevenar |
Rozdíl v %> 0,20 pg/ml (7valentní vakcína Prevenar mínus Synflorix) | ||||
|
N |
% |
N |
% |
% |
96,5% CI | ||
|
Anti-4 |
1 106 |
97,1 |
373 |
100 |
2,89 |
1,71 |
4,16 |
|
Anti-6B |
1 100 |
65,9 |
372 |
79,0 |
13,12 |
7,53 |
18,28 |
|
Anti-9V |
1 103 |
98,1 |
374 |
99,5 |
1,37 |
-0,28 |
2,56 |
|
Anti-14 |
1 100 |
99,5 |
374 |
99,5 |
-0,08 |
-1,66 |
0,71 |
|
Anti-18C |
1 102 |
96,0 |
374 |
98,9 |
2,92 |
0,88 |
4,57 |
|
Anti-19F |
1 104 |
95,4 |
375 |
99,2 |
3,83 |
1,87 |
5,50 |
|
Anti-23F |
1 102 |
81,4 |
374 |
94,1 |
12,72 |
8,89 |
16,13 |
Geometrické průměry koncentrací protilátek (GMCs) proti sedmi společným sérotypům vyvolaných po základním očkování vakcínou Synflorix byly nižší než po očkování 7valentní vakcínou Prevenar. GMCs před posilovací dávkou (8 až 12 měsíců po poslední dávce základního očkování) byly obecně pro obě vakcíny podobné. Po posilovací dávce byly GMCs vyvolané vakcínou Synflorix nižší pro většinu sérotypů společných se 7valentní vakcínou Prevenar.
Ve stejné studii bylo prokázáno, že Synflorix indukuje tvorbu funkčních protilátek proti všem sedmi sérotypům vakcíny. Titru OPA > 8 pro každý ze sérotypů společných pro obě vakcíny dosáhlo jeden měsíc po podání třetí dávky 87,7 % až 100 % jedinců očkovaných vakcínou Synflorix a 92,1 % až 100 % očkovaných vakcínou Prevenar. Rozdíl mezi oběma vakcínami v procentu jedinců s titry OPA > 8 byl < 5 % pro všechny společné sérotypy, včetně 6B a 23F. OPA geometrické průměry titrů protilátek (GMTs) po základním očkování a po posilovací dávce vyvolaných vakcínou Synflorix byly pro sedm společných sérotypů nižší než u 7valentní vakcíny Prevenar, s výjimkou sérotypu 19F.
Procento očkovaných vakcínou Synflorix, kteří dosáhli titr OPA > 8 pro sérotypy 1, 5 a 7F, bylo
65.7 %, 90,9 % a 99,6 % po základním očkování a 91,0 %, 96,3 % a 100 % po posilovací dávce. Odpověď OPA pro sérotypy 1 a 5 byla svou velikostí nižší než velikost odpovědi na ostatní sérotypy. Význam těchto nálezů vzhledem k protektivní účinnosti není znám. Odpověď na sérotyp 7F byla ve stejném rozmezí jako odpověď na sedm sérotypů společných pro obě vakcíny.
Rovněž bylo prokázáno, že Synflorix indukuje imunitní odpověď na zkříženě reaktivní sérotyp 19A.
48.8 % (95% CI: 42,9; 54,7) očkovaných dosáhlo titr OPA > 8 jeden měsíc po podání posilovací dávky.
Podání čtvrté (posilovací) dávky ve druhém roce života indukovalo anamnestickou protilátkovou odpověď měřenou metodou ELISA a OPA pro vakcinační sérotypya zkříženě reaktivní sérotyp 19A. Toto potvrzuje indukci imunitní paměti po třech dávkách základního očkování.
4.2 Další data týkající se imunogenity
Kojenci ve věku od 6 týdnů do 6 měsíců Třídávkové základní očkovací schéma
V celkem osmi studiích prováděných v různých zemích Evropy, v Chile a na Filipínách byla hodnocena imunogenita vakcíny Synflorix po třídávkovém základním očkování (N = 3 089) podle různých očkovacích schémat (6-10-14 týdnů, 2-3-4, 3-4-5 nebo 2-4-6 měsíců věku). Čtvrtá (posilovací) dávka byla podána v šesti klinických studiích 1 976 jedincům. Obecně vzato byly odpovědi na různá schémata očkování hodnoceny jako srovnatelné, i když o něco vyšší imunitní odpovědi byly pozorovány u schématu 2-4-6 měsíců.
Dvoudávkové základní očkovací schéma
Imunogenita vakcíny Synflorix po dvoudávkovém nebo třídávkovém základním očkovacím schématu byla u dětí mladších 6 měsíců hodnocena v klinické studii.
I když nebyl významný rozdíl mezi oběma skupinami v procentech jedinců s hladinou protilátek > 0,20 pg/ml (ELISA), procento jedinců pro sérotypy 6B a 23F bylo nižší, než pro jiné vakcinační sérotypy (viz tabulka 7 a tabulka 8). U jedinců očkovaných dvoudávkovým základním schématem procento jedinců dosahující titrů OPA > 8 bylo nižší ve srovnání s jedinci očkovanými třídávkovým základním schématem u sérotypů 6B, 18C a 23F (74,4 %; 82,8 %; 86,3 % pro dvoudávkové schéma a 88,9 %; 96,2 %; 97,7 % pro třídávkové schéma). Celkově bylo přetrvávání imunitní odpovědi až do podání posilovací dávky v 11 měsících věku nižší u skupiny jedinců očkovaných dvoudávkovým základním schématem. U obou schémat očkování byla pozorována odpověď na posilovací dávku svědčící o imunologickém primingu pro každý vakcinační sérotyp (tabulka 7 a tabulka 8). Po posilovací dávce bylo pozorováno nižší procento jedinců s titry OPA > 8 pro dvoudávkové schéma u sérotypů 5 (87,2 % versus 97,5 % pro třídávkové schéma) a 6B (81,1 % versus 90,3 %), všechny ostatní odpovědi byly srovnatelné.
Tabulka 7: Procento jedinců očkovaných dvoudávkovým základním schématem s hladinou protilátek > 0,20 pg/ml jeden měsíc po základním očkování a jeden měsíc po posilovací dávce
Protilátky
> 0,2 pg/ml (ELISA)
|
Po základní dávce |
Po |
posilovací dávce | ||||
|
% |
95% CI |
% |
95% CI | |||
|
Anti-1 |
97,4 |
93,4 |
99,3 |
99,4 |
96,5 |
100 |
|
Anti-4 |
98,0 |
94,4 |
99,6 |
100 |
97,6 |
100 |
|
Anti-5 |
96,1 |
91,6 |
98,5 |
100 |
97,6 |
100 |
|
Anti-6B |
55,7 |
47,3 |
63,8 |
88,5 |
82,4 |
93,0 |
|
Anti-7F |
96,7 |
92,5 |
98,9 |
100 |
97,7 |
100 |
|
Anti-9V |
93,4 |
88,2 |
96,8 |
99,4 |
96,5 |
100 |
|
Anti-14 |
96,1 |
91,6 |
98,5 |
99,4 |
96,5 |
100 |
|
Anti-18C |
96,1 |
91,6 |
98,5 |
100 |
97,7 |
100 |
|
Anti-19F |
92,8 |
87,4 |
96,3 |
96,2 |
91,8 |
98,6 |
|
Anti-23F |
69,3 |
61,3 |
76,5 |
96,1 |
91,7 |
98,6 |
Tabulka 8: Procento jedinců očkovaných třídávkovým základním schématem s hladinou protilátek > 0,20 pg/ml jeden měsíc po základním očkování a jeden měsíc po posilovači dávce
|
Protilátky |
> 0,2 pg/ml (ELISA) | |||||
|
Po základní dávce |
Po |
posilovací dávce | ||||
|
% |
95% CI |
% |
95% CI | |||
|
Anti-1 |
98,7 |
95,3 |
99,8 |
100 |
97,5 |
100 |
|
Anti-4 |
99,3 |
96,4 |
100 |
100 |
97,5 |
100 |
|
Anti-5 |
100 |
97,6 |
100 |
100 |
97,5 |
100 |
|
Anti-6B |
63,1 |
54,8 |
70,8 |
96,6 |
92,2 |
98,9 |
|
Anti-7F |
99,3 |
96,4 |
100 |
100 |
97,5 |
100 |
|
Anti-9V |
99,3 |
96,4 |
100 |
100 |
97,5 |
100 |
|
Anti-14 |
100 |
97,6 |
100 |
98,6 |
95,2 |
99,8 |
|
Anti-18C |
99,3 |
96,4 |
100 |
99,3 |
96,3 |
100 |
|
Anti-19F |
96,1 |
91,6 |
98,5 |
98,0 |
94,2 |
99,6 |
|
Anti-23F |
77,6 |
70,2 |
84,0 |
95,9 |
91,3 |
98,5 |
Pro zkříženě reaktivní sérotyp 19A byly pozorovány podobné ELISA GMCs protilátek po základním očkování a po přeočkování 2dávkovým očkovacím schématem [0,14 pg/ml (95% CI: 0,12; 0,17) a 0,73 pg/ml (95% CI: 0,58; 0,92)] a pro 3dávkové schéma [0,19 pg/ml (95% CI: 0,16; 0,24) a 0,87 pg/ml (95% CI: 0,69; 1,11)]. Procento jedinců s titry OPA > 8 a GMTs pozorovaných po základním očkování a po posilovači dávce bylo nižší u 2dávkového schématu, než u schématu s 3. dávkou. U obou schémat byla pozorována odpověď na posilovací dávku svědčící o imunologickém primingu.
Klinické důsledky nižší imunitní odpovědi po základním očkování a posilovací dávce pozorované u dvoudávkového základního očkovacího schématu nejsou známé.
Imunitní paměť
V následné studii hodnotící dvoudávkové a třídávkové základní očkovací schéma bylo demonstrováno přetrvávání protilátek ve 36 - 46 měsících věku, přičemž alespoň 83,7 % očkovaných jedinců, kteří obdrželi dvoudávkové základní očkování následované posilovací dávkou, zůstalo séropozitivních pro vakcinační sérotypy a pro zkříženě reaktivní sérotyp 19A. U jedinců, kteří obdrželi třídávkové základní schéma následované posilovací dávkou zůstalo alespoň 96,5 % jedinců séropozitivních pro vakcinační sérotypy a 86,4 % pro zkříženě reaktivní sérotyp 19A. Po samostatné dávce vakcíny Synflorix podané v průběhu 4. roku života, jako provokační dávce, se zvýšil násobek ELISA GMCs protilátek a OPA GMTs před očkováním a po očkování podobně u jedinců s dvoudávkovým základním schématem jako u jedinců s třídávkovým základním schématem. Tyto výsledky ukazují na imunologickou paměť u jedinců se základním očkováním u všech vakcinačních sérotypů a zkříženě reaktivního sérotypu 19A.
Neočkovaní kojenci a děti ve věku > 7 měsíců
Imunitní odpovědi vyvolané vakcínou Synflorix u dříve neočkovaných starších kojenců a dětí byly hodnoceny ve třech klinických studiích.
První klinická studie hodnotila imunitní odpovědi na vakcinační sérotypy a zkříženě reaktivní sérotyp 19A u dětí ve věku 7 - 11 měsíců, 12 - 23 měsíců a 2 až 5 let:
• Děti ve věku 7 - 11 měsíců byly očkovány 2 dávkami základního schématu s následnou posilovací dávkou ve druhém roce života. Imunitní odpověď po posilovací dávce byla v této věkové skupině obecně shodná s imunitní odpovědí pozorovanou po posilovací dávce
u kojenců očkovaných 3 dávkami základního očkování do 6. měsíce věku.
• U dětí ve věku 12 - 23 měsíců byly imunitní odpovědi vyvolané očkováním dvěma dávkami srovnatelné s odpověďmi vyvolanými očkováním třemi dávkami u kojenců mladších
6 měsíců s výjimkou vakcinačních sérotypů 18C a 19F stejně jako sérotypu 19A, pro které byly odpovědi u dětí ve věku 12 - 23 měsíců vyšší.
• U dětí ve věku od 2 do 5 let, které obdržely 1 dávku, byly ELISA GMCs podobné
u 6 vakcinačních sérotypů stejně jako u sérotypu 19A než ty, kterých bylo dosaženo po třídávkovém očkovacím schématu u kojenců mladších 6 měsíců, zatímco byly nižší po 4 vakcinačních sérotypech (sérotypy 1, 5, 14 a 23F). OPA GMTs byly podobné nebo vyšší po jedné dávce než po třídávkovém očkovacím schématu u kojenců mladších 6 měsíců s výjimkou sérotypu 5.
Ve druhé klinické studii jedna dávka podaná čtyři měsíce po dvou záchytných (catch-up) dávkách dětem ve věku 12 - 20 měsíců vyvolala zřetelné zvýšení ELISA GMCs a OPA GMTs (při srovnání odpovědi před a po poslední dávce), což ukazuje, že dvě catch-up dávky obstarají odpovídající priming.
Třetí klinická studie ukázala, že podání dvou dávek v odstupu dvou měsíců se zahájením očkování ve věku 36 - 46 měsíců vedlo k vyšším koncentracím protilátek ELISA GMCs a OPA GMTs, než jaké byly pozorovány jeden měsíc po 3. dávce základního očkovacího schématu pro každý vakcinační sérotyp a pro zkříženě reaktivní sérotyp 19A.
Poměr jedinců s koncentrací protilátek ELISA > 0,2 pg/ml nebo s titrem OPA > 8 pro každý vakcinační sérotyp byl srovnatelný nebo vyšší v catch-up skupině než u kojenců očkovaných třemi dávkami základního očkovacího schématu.
Po očkování základním schématem následovaným posilovací dávkou u kojenců nebo po očkování dvoudávkovým základním schématem u batolat nebylo vyšetřováno dlouhodobé přetrvávání protilátek.
V klinické studii bylo prokázáno, že Synflorix může být bezpečně podán ve druhém roce života jako posilovací dávka dětem očkovaným třemi dávkami základního očkování 7valentní vakcínou Prevenar. Tato studie ukázala, že imunitní odpověď na 7 sérotypů obsažených v obou vakcínách byla po posilovací dávce srovnatelná s odpovědí vyvolanou po posilovací dávce 7valentní vakcínou Prevenar. Nicméně děti, které byly v základním schématu očkovány 7valentní vakcínou Prevenar, nebyly v základním schématu očkovány proti dalším sérotypům obsaženým ve vakcíně Synflorix (1, 5 a 7F). Proto u dětí této věkové skupiny očkovaných jednou dávku vakcíny Synflorix nelze předvídat úroveň a délku trvání ochrany proti invazivním pneumokokovým onemocněním a otitis media způsobeným těmito třemi sérotypy.
4.3 Údaje týkající se imunogenity u předčasně narozených (nedonošených) dětí
Imunogenita vakcíny Synflorix u velmi nedonošených dětí (27. - 30. týden gestace) (N = 42), nedonošených dětí (31. - 36. týden gestace) (N = 82) a plně donošených dětí (> 36. týden gestace)
(N = 132) byla hodnocena po třídávkovém základním očkovacím schématu ve věku 2, 4, 6 měsíců. Imunogenita po čtvrté dávce (posilovací dávce) ve věku 15 až 18 měsíců byla hodnocena u 44 velmi nedonošených dětí, 69 nedonošených dětí a 127 plně donošených dětí.
Jeden měsíc po základním očkování (tj. po třetí dávce) alespoň 92,7 % jedinců dosáhlo koncentrace protilátek ELISA > 0,2 pg/ml, a alespoň 81,7 % dosáhlo titrů OPA > 8 pro každý vakcinační sérotyp, s výjimkou sérotypu 1 (alespoň 58,8 % s titrem OPA > 8). Podobné GMCs a OPA GMTs protilátek byly pozorovány u všech dětí s výjimkou snížených GMCs protilátek u sérotypů 4, 5, 9V a u zkříženě reaktivního sérotypu 19A u velmi nedonošených dětí a u sérotypu 9V u nedonošených dětí a snížených GMTs protilátek OPA u sérotypu 5 u velmi nedonošených dětí. Klinická významnost těchto rozdílů není známa.
Jeden měsíc po posilovací dávce se zvýšily hladiny ELISA GMCs a OPA GMTs protilátek u každého vakcinačního sérotypu a u zkříženě reaktivního sérotypu 19A, toto svědčí pro imunologickou paměť. Byly pozorovány podobné GMCs a OPA GMTs protilátek u všech dětí s výjimkou nižšího OPA GMTs u sérotypu 5 u velmi nedonošených dětí. Celkově, u každého vakcinačního sérotypu alespoň 97,6 % jedinců dosáhlo koncentrace protilátek ELISA > 0,2 pg/ml a alespoň 91,9 % dosáhlo titrů OPA > 8.
Evropská agentura pro léčivé přípravky pozdržela závazek podání výsledků studií s vakcínou Synflorix u jednoho nebo více podsouborů pediatrické populace u onemocnění vyvolaných Streptococcus pneumoniae a u akutního zánětu středního ucha vyvolaného Haemophilus influenzae (viz bod 4.2 informace pro použití u dětí).
5.2 Farmakokinetické vlastnosti
Hodnocení farmakokinetických vlastností není u vakcín dostupné.
5.3 Předklinické údaje vztahující se k bezpečnosti
Konvenční farmakologické studie bezpečnosti a toxicity po jednorázovém a opakovaném podávání provedené s llvalentní vakcínou odpovídající svým složením vakcíně Synflorix neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný Voda na injekci
Adsorbent viz bod 2.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
4 roky
Vícedávkové balení
Po prvním otevření vícedávkového balení je třeba vakcínu aplikovat ihned. Pokud není vakcína aplikována ihned, musí být uchovávána v chladničce (2 °C - 8 °C). Pokud není během 6 hodin vakcína aplikována, musí být znehodnocena.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Vícedávkové balení
Podmínky uchovávání tohoto léčivého přípravku po jeho prvním otevření jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení Předplněná injekční stříkačka
0,5 ml suspenze v předplněné injekční stříkačce (sklo typu I) s pístovou zátkou (butylpryž) s jehlami nebo bez jehel. Balení obsahuje 1, 10 nebo 50 předplněných injekčních stříkaček.
Injekční lahvička
0,5 ml suspenze v injekční lahvičce (sklo typu I) s pístovou zátkou (butylpryž). Balení obsahuje 1,
10 nebo 100 injekčních lahviček.
Vícedávkové balení
1 ml suspenze v injekční lahvičce (sklo typu I) s pístovou zátkou (butylpryž) pro 2 dávky. Balení obsahuje 100 injekčních lahviček.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Předplněná injekční stříkačka
Při uchovávání lze v předplněné injekční stříkačce pozorovat jemný bílý sediment a čirý bezbarvý supernatant; není to však známkou znehodnocení vakcíny.
Před aplikací musí být obsah předplněné injekční stříkačky před protřepáním a po protřepání vizuálně zkontrolován na přítomnost cizorodých částic a/nebo na změnu vzhledu. Jestliže svým vzhledem nevyhovuje, je třeba vakcínu vyřadit.
Vakcínu je třeba aplikovat po dosažení pokojové teploty.
Obsah předplněné injekční stříkačky musí být před aplikací dobře protřepán.
Pokyny k podávání vakcíny

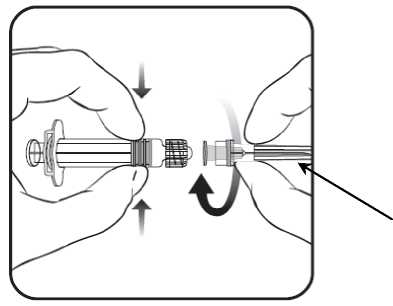
1. V jedné ruce držte tělo stříkačky (aniž byste ji drželi za píst) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
Píst stříkačky
Tělo stříkačky
Kryt
stříkačky
Kryt jehly
2. Jehlu ke stříkačce připevníte tak,
že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne.
3. Pak odstraňte ochranný kryt j ehly, což může jít někdy poněkud ztuha.
Injekční lahvička
Při uchovávání lze v injekční lahvičce pozorovat jemný bílý sediment a čirý bezbarvý supernatant; není to však známkou znehodnocení vakcíny.
Před aplikací musí být obsah injekční lahvičky před protřepáním a po protřepání vizuálně zkontrolován na přítomnost cizorodých částic a/nebo na změnu vzhledu. Jestliže svým vzhledem nevyhovuje, je třeba vakcínu vyřadit.
Vakcínu je třeba aplikovat po dosažení pokojové teploty.
Obsah injekční lahvičky musí být před aplikací dobře protřepán.
Vícedávkové balení
Při uchovávání lze v injekční lahvičce pozorovat jemný bílý sediment a čirý bezbarvý supernatant; není to však známkou znehodnocení vakcíny.
Před aplikací musí být obsah injekční lahvičky před protřepáním a po protřepání vizuálně zkontrolován na přítomnost cizorodých částic a/nebo na změnu vzhledu. Jestliže svým vzhledem nevyhovuje, je třeba vakcínu vyřadit.
Vakcínu je třeba aplikovat po dosažení pokojové teploty.
Obsah lahvičky musí být před aplikací dobře protřepán.
Při použití vícedávkové injekční lahvičky musí být k odebrání každé 0,5ml dávky použita sterilní jehla a injekční stříkačka. Je třeba zamezit kontaminaci obsahu lahvičky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de llnstitut 89
B-1330 Rixensart Belgie
8. REGISTRAČNÍ ČÍSLO(A)
Předplněná injekční stříkačka
EU/1/09/508/001
EU/1/09/508/002
EU/1/09/508/003
EU/1/09/508/004
EU/1/09/508/005
EU/1/09/508/010
Injekční lahvička EU/1/09/508/006 EU/1/09/508/007 EU/1/09/508/008
Vícedávkové balení EU/1/09/508/009
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. března 2009
Datum posledního prodloužení registrace: 21. února 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Názvy a adresy výrobců biologické léčivé látky
GlaxoSmithKline Biologicals S.A.
Pare de la Noire Epine Rue Fleming 20 B-1300 Wavre Belgie
GlaxoSmithKline Biologicals S.A.
Rue de l’Institut 89 BE-1330 Rixensart Belgie
GlaxoSmithKine Biologicals Kft.
Homoki Nagy István utca 1.
2100 Godollo Maďarsko
GlaxoSmithKline Biologicals 10, Tuas South Avenue 8 Singapore 637421 Singapore
Název a adresa výrobce odpovědného za propouštění šarží
GlaxoSmithKline Biologicals S.A.
Rue de l’Institut 89 BE-1330 Rixensart Belgie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
PAPÍROVÁ KRABIČKA S PŘEDPLNĚNOU INJEKČNÍ STŘÍKAČKOU S NEBO BEZ JEHLY, VE VELIKOSTI BALENÍ PO 1, 10, 50
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka (0,5 ml) obsahuje 1 mikrogram polysacharidu sérotypů 1, 5, 6B, 7F, 9V, 14 a 23F, a 3 mikrogramy sérotypů 4, 18C a 19F.
3. SEZNAM POMOCNÝCH LÁTEK
Chlorid sodný Voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční suspenze v předplněné injekční stříkačce
1 předplněná injekční stříkačka 1 dávka (0,5 ml)
10 předplněných injekčních stříkaček 10x 1 dávka (0,5 ml)
1 předplněná injekční stříkačka + 1 jehla 1 dávka (0,5 ml)
10 předplněných injekčních stříkaček + 10 jehel 10x 1 dávka (0,5 ml)
1 předplněná injekční stříkačka + 2 jehly 1 dávka (0,5 ml)
50 předplněných injekčních stříkaček 50x 1 dávka (0,5 ml)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Vakcínu je třeba aplikovat po dosažení pokojové teploty. Před použitím dobře protřepat.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/508/001 - 1 předplněná injekční stříkačka bez jehly EU/1/09/508/002 - 10 předplněných injekčních stříkaček bez jehly EU/1/09/508/003 - 1 předplněná injekční stříkačka s 1 jehlou EU/1/09/508/004 - 10 předplněných injekčních stříkaček s 10 jehlami EU/1/09/508/005 - 1 předplněná injekční stříkačka s 2 jehlami EU/1/09/508/010 - 50 předplněných injekčních stříkaček bez jehly
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Synflorix injekční suspenze v předplněné injekční stříkačce i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (0,5 ml)
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
INJEKČNÍ LAHVIČKA , VE VELIKOSTI BALENÍ PO 1, 10 NEBO 100
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Synflorix injekční suspenze
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka (0,5 ml) obsahuje 1 mikrogram polysacharidu
sérotypů 1, 5, 6B, 7F, 9V, 14 a 23F, a 3 mikrogramy sérotypů 4, 18C a 19F.
3. SEZNAM POMOCNÝCH LÁTEK
Chlorid sodný Voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční suspenze
1 injekční lahvička 1 dávka (0,5 ml)
10 injekčních lahviček 10x 1 dávka (0,5 ml)
100 injekčních lahviček 100x 1 dávka (0,5 ml)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Vakcínu je třeba aplikovat po dosažení pokojové teploty. Před použitím dobře protřepat.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/508/006 - 1 injekční lahvička EU/1/09/508/007 - 10 injekčních lahviček EU/1/09/508/008 - 100 injekčních lahviček
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Synflorix injekční suspenze i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (0,5 ml)
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
VÍCEDÁVKOVÁ INJEKČNÍ LAHVIČKA (2 DÁVKY), VE VELIKOSTI BALENÍ PO 100
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Synflorix injekční suspenze ve vícedávkovém balení Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka (0,5 ml) obsahuje 1 mikrogram polysacharidu
sérotypů 1, 5, 6B, 7F, 9V, 14 a 23F, a 3 mikrogramy sérotypů 4, 18C a 19F.
3. SEZNAM POMOCNÝCH LÁTEK
Chlorid sodný voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční suspenze ve vícedávkovém balení
100 VÍCEDÁVKOVÝCH injekčních lahviček (2 dávky v 1 injekční lahvičce; 1 dávka = 0,5 ml)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Vakcínu je třeba aplikovat po dosažení pokojové teploty. Před použitím dobře protřepat.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Po prvním otevření musí být vakcína během 6 hodin aplikována.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/508/009
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Synflorix injekce i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2 dávky (1 dávka = 0,5 ml)
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Synflorix injekční suspenze v předplněné injekční stříkačce
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno touto vakcínou, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tato vakcína byla předepsána výhradně Vašemu dítěti. Nedávejte ji žádné další osobě.
• Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je vakcína Synflorix a k čemu se používá
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Synflorix
3. Jak se vakcína Synflorix podává
4. Možné nežádoucí účinky
5. Jak vakcínu Synflorix uchovávat
6. Obsah balení a další informace
1. Co je vakcína Synflorix a k čemu se používá
Vakcína Synflorix je pneumokoková konjugovaná vakcína. Tuto vakcínu bude lékař nebo zdravotní sestra aplikovat Vašemu dítěti formou injekce.
Vakcína Synflorix pomáhá ochránit Vaše dítě, které je ve věku od 6 týdnů až do 5 let, před:
bakterií zvanou Streptococcus pneumoniae. Tato bakterie může způsobit těžká onemocnění včetně zánětu mozkových blan, sepse a bakteriémie (infekce krevního řečiště), stejně jako zánět středního ucha nebo zápal plic.
Jak Synflorix účinkuje
Vakcína Synflorix vyvolá v těle tvorbu protilátek. Protilátky jsou součástí imunitního systému, který ochrání Vaše dítě před těmito nemocemi.
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Synflorix Nepodávejte vakcínu Synflorix:
• Pokud Vaše dítě mělo dříve jakoukoli alergickou reakci (je přecitlivělé) na léčivou látku nebo na jakoukoli další pomocnou látku této vakcíny (které jsou vyjmenovány v bodě 6).
Příznaky alergické reakce mohou být svědivá kožní vyrážka, dušnost a otok obličeje nebo jazyka.
• Pokud má Vaše dítě závažné infekční onemocnění s horečkou (vyšší než 38 °C). V tom případě je třeba očkování odložit do doby, kdy se Vaše dítě bude cítit lépe. Mírná infekce, jako je například nachlazení, by neměla být překážkou očkování. Nicméně, nejdříve se poraďte se svým lékařem.
Pokud se Vašeho dítěte výše uvedené týká, nesmí být vakcína Synflorix podána. Pokud si nejste jist(a), poraďte se před očkováním Vašeho dítěte vakcínou Synflorix se svým lékařem nebo lékárníkem.
Upozornění a opatření:
Poraďte se se svým lékařem nebo lékárníkem, pokud:
• má Vaše dítě problémy se srážením krve nebo se mu snadno tvoří krevní podlitiny.
U dětí od 2 let věku při každém injekčním podávání léčiva nebo i před ním může dojít k mdlobám, proto informujte lékaře nebo zdravotní sestru, pokud Vaše dítě již někdy při injekci omdlelo.
Podobně jako jiné vakcíny, nemusí vakcína Synflorix plně ochránit všechny očkované jedince.
Vakcína Synflorix chrání pouze před infekcí vyvolanou bakteriemi, proti kterým byla vakcína vyvinuta.
U dětí s oslabeným imunitním systémem (například s HIV infekcí nebo s imunosupresivní léčbou) nemusí být dosaženo plného účinku vakcíny Synflorix.
Pokud si nejste jist(a), poraďte se před očkováním se svým lékařem nebo lékárníkem.
Další léčivé přípravky a Synflorix
Informujte svého lékaře nebo lékárníka o všech lécích, které Vaše dítě užívá nebo v nedávné době užívalo, nebo mohlo užívat a to i o lécích, které dostalo bez lékařského předpisu nebo o tom, jestli v nedávné době dostalo jakoukoli jinou vakcínu. Vakcína Synflorix nemusí být plně účinná, pokud Vaše dítě užívá léky, které mají vliv na zvládnutí infekce imunitním systémem.
Vakcína Synflorix může být podána současně s jinými dětskými vakcínami, jako například s vakcínou proti záškrtu, tetanu, černému (dávivému) kašli, Haemophilus influenzae typu b, dětské obrně (perorální nebo inaktivovaná vakcína), hepatitidě B, spalničkám, příušnicím a zarděnkám, planým neštovicím, s perorální vakcínou proti rotaviru stejně jako s konjugovanou vakcínou proti meningokokům séroskupiny C a séroskupin A, C, W-135, Y. Jednotlivé injekce jednotlivých vakcín musí být aplikovány do různých míst.
Váš lékař Vás může požádat, abyste svému dítěti před očkováním nebo ihned po očkování vakcínou Synflorix podal(a) léčivý přípravek snižující horečku (jako je paracetamol). To může pomoci zmírnit některé nežádoucí účinky (horečnaté reakce) vakcíny Synflorix. Nicméně, pokud Vaše dítě obdrží paracetamol před očkováním nebo ihned po očkování vakcínou Synflorix, získané hladiny protilátek mohou být mírně sníženy. Není známo, zda má snížení hladin protilátek dopad na ochranu proti pneumokokovým onemocněním.
Synflorix obsahuje sodík
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na dávku, to znamená, že je v podstatě „sodíku prostý“.
3. Jak se vakcína Synflorix podává Způsob podání
Vakcína Synflorix se aplikuje do svalu formou injekce. Obvykle se aplikuje do stehna nebo horní části paže.
Dávkování
Vaše dítě (ve věku od 6 týdnů do 6 měsíců) bude očkováno ve čtyřdávkovém očkovacím schématu na základě oficiálních doporučení nebo může Váš lékař použít i alternativní schéma. Je důležité poslouchat rady Vašeho lékaře nebo zdravotní sestry, aby Vaše dítě dokončilo celé očkovací schéma.
• Mezi jednotlivými dávkami musí být rozmezí alespoň jednoho měsíce s výjimkou poslední injekce, která bude podána alespoň 6 měsíců po třetí dávce.
• První dávka může být podána po dovršení 6 týdnů věku.
• Váš lékař Vás bude informovat, kdy je třeba se dostavit k aplikaci další dávky.
Předčasně narozené děti (narozené po 27. týdnu a dříve než ve 37. týdnu těhotenství)
Vašemu dítěti (ve věku od 2 měsíců do 6 měsíců) budou podány 3 dávky formou injekce, mezi každou dávkou bude časový odstup alespoň jednoho měsíce. Vaše dítě obdrží posilovací dávku v odstupu alespoň šesti měsíců po poslední injekci.
Kojencům ve věku od 7 do 11 měsíců budou podány 2 dávky, přičemž druhá dávka bude podána nejdříve za jeden měsíc po podání první dávky. Třetí dávka bude podána během druhého roku života, a to nejdříve za 2 měsíce od podání předchozí dávky.
Malým dětem ve věku od 12 měsíců do 5 let budou podány 2 dávky. Druhá dávka bude podána nejdříve za 2 měsíce od podání první dávky.
Jestliže jste se zapomněl(a) dostavit k aplikaci dávky
Pokud Vaše dítě vynechá aplikaci dávky, je třeba domluvit další návštěvu. Proto se poraďte s lékařem o dalším postupu, jak Vaše dítě ochránit.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. U tohoto přípravku se mohou vyskytnout následující nežádoucí účinky:
Velmi časté (mohou se objevit u více než 1 z 10 dávek vakcíny)
• bolest, zarudnutí nebo otok v místě vpichu vakcíny
• horečka 38 °C a vyšší;
• ospalost;
• podrážděnost;
• ztráta chuti k jídlu.
Časté (mohou se objevit až u 1 z 10 dávek vakcíny)
• zatvrdnutí v místě vpichu vakcíny.
Méně časté (mohou se objevit až u 1 ze 100 dávek vakcíny)
• svědění, podlitina, krvácení nebo malý otok v místě vpichu vakcíny;
• pocit na zvracení, průjem nebo nevolnost (zvracení);
• neobvyklý pláč;
• přechodná zástava dýchání (apnoe), pokud se dítě narodilo nedonošené (před nebo ve 28. týdnu těhotenství);
• bolest hlavy;
• kožní vyrážka;
• difusní otok končetiny, do které byla podána injekce, někdy zasahující přiléhající kloub;
• kopřivka.
Vzácné (mohou se objevit až u 1 z 1 000 dávek vakcíny)
• křeče bez teploty nebo křeče z horečky;
• alergické reakce jako kožní alergie;
• kolaps (náhlý nástup svalové ochablosti), období bezvědomí nebo ztráty kontaktu s okolím a bledost nebo namodralé zbarvení kůže.
Velmi vzácné (mohou se objevit až u 1 z 10 000 dávek vakcíny)
• závažné alergické reakce, které se mohou projevit:
- vystupující a svědivou vyrážkou (kopřivka);
- otokem, někdy tváře nebo úst (angioedém), vedoucím k obtížnému dýchání;
- kolapsem.
Tyto reakce se obvykle vyskytnou před opuštěním ordinace lékaře. Nicméně, pokud se u Vašeho dítěte vyskytnou některé z těchto příznaků, ihned kontaktujte lékaře.
• Kawasakiho nemoc (hlavními příznaky onemocnění jsou například: horečka, kožní vyrážka, zduření lymfatických uzlin, zánět a zarudnutí sliznic dutiny ústní a krku).
Posilovací dávka vakcíny Synflorix může zvýšit riziko nežádoucích účinků.
U dětí ve věku > 12 měsíců se riziko bolesti v místě podání injekce může zvýšit se zvyšujícím se věkem.
U těžce nedonošených dětí (narozených před nebo ve 28. týdnu těhotenství) se mohou 2. až 3. den po očkování objevit pauzy mezi jednotlivými dechy, které jsou delší než normálně.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak vakcínu Synflorix uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C).
• Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
• Chraňte před mrazem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
|
6. Obsah balení a další informace | |
|
Co vakcína Synflorix obsahuje | |
|
• Léčivými látkami jsou: | |
|
1 dávka (0,5 ml) obsahuje: | |
|
Pneumococcale polysaccharidum serotypus 11,2 |
1 mikrogram |
|
Pneumococcale polysaccharidum serotypus 41,2 |
3 mikrogramy |
|
Pneumococcale polysaccharidum serotypus 51,2 |
1 mikrogram |
|
Pneumococcale polysaccharidum serotypus 6B1,2 |
1 mikrogram |
|
Pneumococcale polysaccharidum serotypus 7F1,2 |
1 mikrogram |
|
Pneumococcale polysaccharidum serotypus 9V1,2 |
1 mikrogram |
|
Pneumococcale polysaccharidum serotypus 141,2 |
1 mikrogram |
|
Pneumococcale polysaccharidum serotypus 18C1,3 |
3 mikrogramy |
Pneumococcale polysaccharidum serotypus 19F1,4 Pneumococcale polysaccharidum serotypus 23F1,2
3 mikrogramy 1 mikrogram
1 adsorbováno na fosforečnan hlinitý
2 konjugovaná na protein D (získaný z kmenů netypovatelného Haemophilus influenzae) jako proteinový nosič
3 konjugovaná na tetanický toxoid jako proteinový nosič
4 konjugovaná na difterický toxoid jako proteinový nosič
0,5 miligramů Al3+ 9-16 mikrogramů
5-10 mikrogramů 3-6 mikrogramů
• Pomocnými látkami jsou: chlorid sodný a voda na injekci.
Jak vakcína Synflorix vypadá a co obsahuje toto balení
• Injekční suspenze v předplněné injekční stříkačce.
• V akcína Synflorix j e zakalená bílá suspenze.
• Vakcína Synflorix je dostupná v předplněných injekčních stříkačkách s jehlami nebo bez jehel v baleních po 1, 10 nebo 50 předplněných injekčních stříkačkách.
• Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
GlaxoSmithKline Biologicals s.a.
Rue de lInstitut 89 B-1330 Rixensart Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Etarapnu
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
Nederland
GlaxoSmithKline BV Tel: + 31 (0)30 69 38 100 nlinfo@gsk.com
Norge
GlaxoSmithKline AS
Eesti
GlaxoSmithKline Eesti OU
|
Tel: +372 667 6900 estonia@gsk.com |
Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
EXlába GlaxoSmithKline A.E.B.E TpA,: + 30 210 68 82 100 |
Osterreich GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com |
|
Espaňa GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Polska GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com |
Portugal GlaxoSmithKline - Produtos Farmaceuticos, Lda. Tel: + 351 21 412 95 00 |
|
Hrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999 |
Románia GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208 |
|
Ireland GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kúnpoq GlaxoSmithKline (Cyprus) Ltd TpA,: + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: +44 (0)800 221 441 customercontactuk@gsk.com |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
Následující informace je určena pouze pro zdravotnické pracovníky:
Při uchovávání lze v předplněné injekční stříkačce pozorovat jemný bílý sediment a čirý bezbarvý supematant; není to však známkou znehodnocení vakcíny.
Před aplikací musí být obsah předplněné injekční stříkačky před protřepáním a po protřepání vizuálně zkontrolován na přítomnost cizorodých částic a/nebo na změnu vzhledu. Jestliže svým vzhledem nevyhovuje, je třeba vakcínu vyřadit.
Vakcínu je třeba aplikovat po dosažení pokojové teploty.
Obsah předplněné injekční stříkačky musí být před aplikací dobře protřepán.
Vakcína je určena pouze k intramuskulárnímu podání. Vakcína nesmí být aplikována do žíly.
Je-li vakcína Synflorix podávána současně s dalšími vakcínami, je vhodné aplikovat jednotlivé vakcíny do různých míst.
Vakcína Synflorix nesmí být smísena s dalšími vakcínami.
Pokyny k podávání vakcíny předplněnou injekční stříkačkou
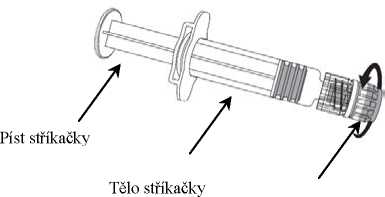
Kryt
stříkačky
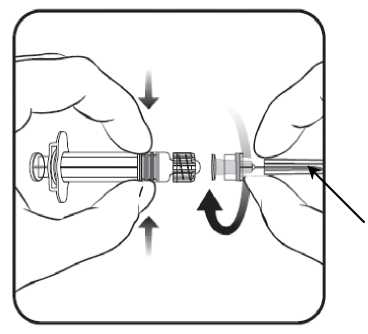
Krytjehly
1. V jedné ruce držte tělo stříkačky (aniž byste ji drželi za píst) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
2. Jehlu ke stříkačce připevníte tak, že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne.
3. Pak odstraňte ochranný kryt j ehly, což může jít někdy poněkud ztuha.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Příbalová informace: informace pro uživatele Synflorix injekční suspenze
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno touto vakcínou, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tato vakcína byla předepsána výhradně Vašemu dítěti. Nedávejte ji žádné další osobě.
• Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je vakcína Synflorix a k čemu se používá
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Synflorix
3. Jak se vakcína Synflorix podává
4. Možné nežádoucí účinky
5. Jak vakcínu Synflorix uchovávat
6. Obsah balení a další informace
1. Co je vakcína Synflorix a k čemu se používá
Vakcína Synflorix je pneumokoková konjugovaná vakcína. Tuto vakcínu bude lékař nebo zdravotní sestra aplikovat Vašemu dítěti formou injekce.
Vakcína Synflorix pomáhá ochránit Vaše dítě, které je ve věku od 6 týdnů až do 5 let, před:
bakterií zvanou Streptococcus pneumoniae. Tato bakterie může způsobit těžká onemocnění včetně zánětu mozkových blan, sepse a bakteriémie (infekce krevního řečiště), stejně jako zánět středního ucha nebo zápal plic.
Jak Synflorix účinkuje
Vakcína Synflorix vyvolá v těle tvorbu protilátek. Protilátky jsou součástí imunitního systému, který ochrání Vaše dítě před těmito nemocemi.
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Synflorix Nepodávejte vakcínu Synflorix:
• Pokud Vaše dítě mělo dříve jakoukoli alergickou reakci (je přecitlivělé) na léčivou látku nebo na jakoukoli další pomocnou látku této vakcíny (které jsou vyjmenovány v bodě 6).
Příznaky alergické reakce mohou být svědivá kožní vyrážka, dušnost a otok obličeje nebo jazyka.
• Pokud má Vaše dítě závažné infekční onemocnění s horečkou (vyšší než 38 °C). V tom případě je třeba očkování odložit do doby, kdy se Vaše dítě bude cítit lépe. Mírná infekce, jako je například nachlazení, by neměla být překážkou očkování. Nicméně, nejdříve se poraďte se svým lékařem.
Pokud se Vašeho dítěte výše uvedené týká, nesmí být vakcína Synflorix podána. Pokud si nejste jist(a), poraďte se před očkováním Vašeho dítěte vakcínou Synflorix se svým lékařem nebo lékárníkem.
Upozornění a opatření:
Poraďte se se svým lékařem nebo lékárníkem, pokud:
• má Vaše dítě problémy se srážením krve nebo se mu snadno tvoří krevní podlitiny.
U dětí od 2 let věku při každém injekčním podávání léčiva nebo i před ním může dojít k mdlobám, proto informujte lékaře nebo zdravotní sestru, pokud Vaše dítě již někdy při injekci omdlelo.
Podobně jako jiné vakcíny, nemusí vakcína Synflorix plně ochránit všechny očkované jedince.
Vakcína Synflorix chrání pouze před infekcí vyvolanou bakteriemi, proti kterým byla vakcína vyvinuta.
U dětí s oslabeným imunitním systémem (například s HIV infekcí nebo s imunosupresivní léčbou) nemusí být dosaženo plného účinku vakcíny Synflorix.
Pokud si nejste jist(a), poraďte se před očkováním se svým lékařem nebo lékárníkem.
Další léčivé přípravky a Synflorix
Informujte svého lékaře nebo lékárníka o všech lécích, které Vaše dítě užívá nebo v nedávné době užívalo, nebo mohlo užívat a to i o lécích, které dostalo bez lékařského předpisu nebo o tom, jestli v nedávné době dostalo jakoukoli jinou vakcínu. Vakcína Synflorix nemusí být plně účinná, pokud Vaše dítě užívá léky, které mají vliv na zvládnutí infekce imunitním systémem.
Vakcína Synflorix může být podána současně s jinými dětskými vakcínami, jako například s vakcínou proti záškrtu, tetanu, černému (dávivému) kašli, Haemophilus influenzae typu b, dětské obrně (perorální nebo inaktivovaná vakcína), hepatitidě B, spalničkám, příušnicím a zarděnkám, planým neštovicím, s perorální vakcínou proti rotaviru stejně jako s konjugovanou vakcínou proti meningokokům séroskupiny C a séroskupin A, C, W-135, Y. Jednotlivé injekce jednotlivých vakcín musí být aplikovány do různých míst.
Váš lékař Vás může požádat, abyste svému dítěti před očkováním nebo ihned po očkování vakcínou Synflorix podal(a) léčivý přípravek snižující horečku (jako je paracetamol). To může pomoci zmírnit některé nežádoucí účinky (horečnaté reakce) vakcíny Synflorix. Nicméně, pokud Vaše dítě obdrží paracetamol před očkováním nebo ihned po očkování vakcínou Synflorix, získané hladiny protilátek mohou být mírně sníženy. Není známo, zda má snížení hladin protilátek dopad na ochranu proti pneumokokovým onemocněním.
Synflorix obsahuje sodík
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na dávku, to znamená, že je v podstatě „sodíku prostý“.
3. Jak se vakcína Synflorix podává Způsob podání
Vakcína Synflorix se aplikuje do svalu formou injekce. Obvykle se aplikuje do stehna nebo horní části paže.
Dávkování
Vaše dítě (ve věku od 6 týdnů do 6 měsíců) bude očkováno ve čtyřdávkovém očkovacím schématu na základě oficiálních doporučení nebo může Váš lékař použít i alternativní schéma. Je důležité poslouchat rady Vašeho lékaře nebo zdravotní sestry, aby Vaše dítě dokončilo celé očkovací schéma.
• Mezi jednotlivými dávkami musí být rozmezí alespoň jednoho měsíce s výjimkou poslední injekce, která bude podána alespoň 6 měsíců po třetí dávce.
• První dávka může být podána po dovršení 6 týdnů věku.
• Váš lékař Vás bude informovat, kdy je třeba se dostavit k aplikaci další dávky.
Předčasně narozené děti (narozené po 27. týdnu a dříve než ve 37. týdnu těhotenství)
Vašemu dítěti (ve věku od 2 měsíců do 6 měsíců) budou podány 3 dávky formou injekce, mezi každou dávkou bude časový odstup alespoň jednoho měsíce. Vaše dítě obdrží posilovací dávku v odstupu alespoň šesti měsíců po poslední injekci.
Kojencům ve věku od 7 do 11 měsíců budou podány 2 dávky, přičemž druhá dávka bude podána nejdříve za jeden měsíc po podání první dávky. Třetí dávka bude podána během druhého roku života, a to nejdříve za 2 měsíce od podání předchozí dávky.
Malým dětem ve věku od 12 měsíců do 5 let budou podány 2 dávky. Druhá dávka bude podána nejdříve za 2 měsíce od podání první dávky.
Jestliže jste se zapomněl(a) dostavit k aplikaci dávky
Pokud Vaše dítě vynechá aplikaci dávky, je třeba domluvit další návštěvu. Proto se poraďte s lékařem o dalším postupu, jak Vaše dítě ochránit.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. U tohoto přípravku se mohou vyskytnout následující nežádoucí účinky:
Velmi časté (mohou se objevit u více než 1 z 10 dávek vakcíny)
• bolest, zarudnutí nebo otok v místě vpichu vakcíny;
• horečka 38 °C a vyšší;
• ospalost;
• podrážděnost;
• ztráta chuti k jídlu.
Časté (mohou se objevit až u 1 z 10 dávek vakcíny)
• zatvrdnutí v místě vpichu vakcíny.
Méně časté (mohou se objevit až u 1 ze 100 dávek vakcíny):
• svědění, podlitina, krvácení nebo malý otok v místě vpichu vakcíny;
• pocit na zvracení, průjem nebo nevolnost (zvracení);
• neobvyklý pláč;
• přechodná zástava dýchání (apnoe), pokud se dítě narodilo nedonošené (před nebo ve 28. týdnu těhotenství);
• bolest hlavy;
• kožní vyrážka;
• difusní otok končetiny, do které byla podána injekce, někdy zasahující přiléhající kloub;
• kopřivka.
Vzácné (mohou se objevit až u 1 z 1 000 dávek vakcíny)
• křeče bez teploty nebo křeče z horečky;
• alergické reakce jako kožní alergie;
• kolaps (náhlý nástup svalové ochablosti), období bezvědomí nebo ztráty kontaktu s okolím a bledost nebo namodralé zbarvení kůže.
Velmi vzácné (mohou se objevit až u 1 z 10 000 dávek vakcíny)
• závažné alergické reakce, které se mohou projevit:
- vystupující a svědivou vyrážkou (kopřivka);
- otokem, někdy tváře nebo úst (angioedém), vedoucím k obtížnému dýchání;
- kolapsem.
Tyto reakce se obvykle vyskytnou před opuštěním ordinace lékaře. Nicméně, pokud se u Vašeho dítěte vyskytnou některé z těchto příznaků, ihned kontaktujte lékaře.
• Kawasakiho nemoc (hlavními příznaky onemocnění jsou například: horečka, kožní vyrážka, zduření lymfatických uzlin, zánět a zarudnutí sliznic dutiny ústní a krku).
Posilovací dávka vakcíny Synflorix může zvýšit riziko nežádoucích účinků.
U dětí ve věku > 12 měsíců se riziko bolesti v místě podání injekce může zvýšit se zvyšujícím se věkem.
U těžce nedonošených dětí (narozených před nebo ve 28. týdnu těhotenství) se mohou 2. až 3. den po očkování objevit pauzy mezi jednotlivými dechy, které jsou delší než normálně.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak vakcínu Synflorix uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C).
• Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
• Chraňte před mrazem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co vakcína Synflorix obsahuje
• Léčivými látkami jsou:
1 dávka (0,5 ml) obsahuje: Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum
serotypus 11,2 serotypus 41,2 serotypus 51,2 serotypus 6B1,2 serotypus 7F1,2
1 mikrogram 3 mikrogramy 1 mikrogram 1 mikrogram 1 mikrogram
Pneumococcale polysaccharidum serotypus 9V1,2 Pneumococcale polysaccharidum serotypus 141,2 Pneumococcale polysaccharidum serotypus 18C1,3 Pneumococcale polysaccharidum serotypus 19F1,4 Pneumococcale polysaccharidum serotypus 23F1,2
1 mikrogram 1 mikrogram 3 mikrogramy 3 mikrogramy 1 mikrogram
0,5 miligramů Al3+ 9-16 mikrogramů
5-10 mikrogramů 3-6 mikrogramů
1 adsorbováno na fosforečnan hlinitý
2 konjugovaná na protein D (získaný z kmenů netypovatelného Haemophilus influenzae) jako proteinový nosič
3 konjugovaná na tetanický toxoid jako proteinový nosič
4 konjugovaná na difterický toxoid jako proteinový nosič
• Pomocnými látkami j sou: chlorid sodný a voda na injekci Jak vakcína Synflorix vypadá a co obsahuje toto balení
• Injekční suspenze.
• Vakcína Synflorix je zakalená bílá suspenze.
• Vakcína Synflorix je dostupná v injekčních lahvičkách v baleních po 1, 10 nebo 100 injekčních lahvičkách.
• Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
GlaxoSmithKline Biologicals s.a.
Rue de lInstitut 89 B-1330 Rixensart Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Etarapnu
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com Luxembourg/Luxemburg GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
Nederland
GlaxoSmithKline BV Tel: + 31 (0)30 69 38 100 nlinfo@gsk.com
|
Eesti GlaxoSmithKline Eesti OU Tel: +372 667 6900 estonia@gsk.com |
Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
EXlába GlaxoSmithKline A.E.B.E T@: + 30 210 68 82 100 |
Osterreich GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com |
|
Espaňa GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Polska GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com |
Portugal GlaxoSmithKline - Produtos Farmaceuticos, Lda. Tel: + 351 21 412 95 00 |
|
Hrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999 |
Románia GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208 |
|
Ireland GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kónpoq GlaxoSmithKline (Cyprus) Ltd T@: + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: +44 (0)800 221 441 customercontactuk@gsk.com |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
Následující informace je určena pouze pro zdravotnické pracovníky:
Při uchovávání lze v injekční lahvičce pozorovat jemný bílý sediment a čirý bezbarvý supernatant; není to však známkou znehodnocení vakcíny.
Před aplikací musí být obsah injekční lahvičky před protřepáním a po protřepání vizuálně zkontrolován na přítomnost cizorodých částic a/nebo na změnu vzhledu. Jestliže svým vzhledem nevyhovuje, je třeba vakcínu vyřadit.
Vakcínu je třeba aplikovat po dosažení pokojové teploty.
Obsah injekční lahvičky musí být před aplikací dobře protřepán.
Vakcína je určena pouze k intramuskulárnímu podání. Vakcína nesmí být aplikována do žíly.
Je-li vakcína Synflorix podávána současně s dalšími vakcínami, je vhodné aplikovat jednotlivé vakcíny do různých míst.
Vakcína Synflorix nesmí být smísena s dalšími vakcínami. Po natažení dávky vakcíny do stříkačky musí být jehla, která byla k natažení použita, nahrazena jehlou vhodnou k intramuskulární injekci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Příbalová informace: informace pro uživatele
Synflorix injekční suspenze ve vícedávkovém balení
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno touto vakcínou, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tato vakcína byla předepsána výhradně Vašemu dítěti. Nedávejte ji žádné další osobě.
• Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je vakcína Synflorix a k čemu se používá
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Synflorix
3. Jak se vakcína Synflorix podává
4. Možné nežádoucí účinky
5. Jak vakcínu Synflorix uchovávat
6. Obsah balení a další informace
1. Co je vakcína Synflorix a k čemu se používá
Vakcína Synflorix je pneumokoková konjugovaná vakcína. Tuto vakcínu bude lékař nebo zdravotní sestra aplikovat Vašemu dítěti formou injekce.
Vakcína Synflorix pomáhá ochránit Vaše dítě, které je ve věku od 6 týdnů až do 5 let, před:
bakterií, zvanou Streptococcus pneumoniae. Tato bakterie může způsobit těžká onemocnění včetně zánětu mozkových blan, sepse a bakteriémie (infekce krevního řečiště), stejně jako zánět středního ucha nebo zápal plic.
Jak Synflorix účinkuje
Vakcína Synflorix vyvolá v těle tvorbu protilátek. Protilátky jsou součástí imunitního systému, který ochrání Vaše dítě před těmito nemocemi.
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Synflorix Nepodávejte vakcínu Synflorix:
• Pokud Vaše dítě mělo dříve jakoukoli alergickou reakci (je přecitlivělé) na léčivou látku nebo na jakoukoli další pomocnou látku této vakcíny (které jsou vyjmenovány v bodě 6).
Příznaky alergické reakce mohou být svědivá kožní vyrážka, dušnost a otok obličeje nebo jazyka.
• Pokud má Vaše dítě závažné infekční onemocnění s horečkou (vyšší než 38 °C). V tom případě je třeba očkování odložit do doby, kdy se Vaše dítě bude cítit lépe. Mírná infekce, jako je například nachlazení, by neměla být překážkou očkování. Nicméně, nejdříve se poraďte se svým lékařem.
Pokud se Vašeho dítěte výše uvedené týká, nesmí být vakcína Synflorix podána. Pokud si nejste jist(a), poraďte se před očkováním Vašeho dítěte vakcínou Synflorix se svým lékařem nebo lékárníkem.
Upozornění a opatření:
Poraďte se se svým lékařem nebo lékárníkem, pokud:
• má Vaše dítě problémy se srážením krve nebo se mu snadno tvoří krevní podlitiny.
U dětí od 2 let věku při každém injekčním podávání léčiva nebo i před ním může dojít k mdlobám, proto informujte lékaře nebo zdravotní sestru, pokud Vaše dítě již někdy při injekci omdlelo.
Podobně jako jiné vakcíny, nemusí vakcína Synflorix plně ochránit všechny očkované jedince.
Vakcína Synflorix chrání pouze před infekcí vyvolanou bakteriemi, proti kterým byla vakcína vyvinuta.
U dětí s oslabeným imunitním systémem (například s HIV infekcí nebo s imunosupresivní léčbou) nemusí být dosaženo plného účinku vakcíny Synflorix.
Pokud si nejste jist(a), poraďte se před očkováním se svým lékařem nebo lékárníkem.
Další léčivé přípravky a Synflorix
Informujte svého lékaře nebo lékárníka o všech lécích, které Vaše dítě užívá nebo v nedávné době užívalo, nebo mohlo užívat a to i o lécích, které dostalo bez lékařského předpisu nebo o tom, jestli v nedávné době dostalo jakoukoli jinou vakcínu. Vakcína Synflorix nemusí být plně účinná, pokud Vaše dítě užívá léky, které mají vliv na zvládnutí infekce imunitním systémem.
Vakcína Synflorix může být podána současně s jinými dětskými vakcínami, jako například s vakcínou proti záškrtu, tetanu, černému (dávivému) kašli, Haemophilus influenzae typu b, dětské obrně (perorální nebo inaktivovaná vakcína), hepatitidě B, spalničkám, příušnicím a zarděnkám, planým neštovicím, s perorální vakcínou proti rotaviru stejně jako s konjugovanou vakcínou proti meningokokům séroskupiny C a séroskupin A, C, W-135, Y. Jednotlivé injekce jednotlivých vakcín musí být aplikovány do různých míst.
Váš lékař Vás může požádat, abyste svému dítěti před očkováním nebo ihned po očkování vakcínou Synflorix podal(a) léčivý přípravek snižující horečku (jako je paracetamol). To může pomoci zmírnit některé nežádoucí účinky (horečnaté reakce) vakcíny Synflorix. Nicméně, pokud Vaše dítě obdrží paracetamol před očkováním nebo ihned po očkování vakcínou Synflorix, získané hladiny protilátek mohou být mírně sníženy. Není známo, zda má snížení hladin protilátek dopad na ochranu proti pneumokokovým onemocněním.
Synflorix obsahuje sodík
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na dávku, to znamená, že je v podstatě „sodíku prostý“.
3. Jak se vakcína Synflorix podává Způsob podání
Vakcína Synflorix se aplikuje do svalu formou injekce. Obvykle se aplikuje do stehna nebo horní části paže.
Dávkování
Vaše dítě (ve věku od 6 týdnů do 6 měsíců) bude očkováno ve čtyřdávkovém očkovacím schématu na základě oficiálních doporučení nebo může Váš lékař použít i alternativní schéma. Je důležité poslouchat rady Vašeho lékaře nebo zdravotní sestry, aby Vaše dítě dokončilo celé očkovací schéma.
• Mezi jednotlivými dávkami musí být rozmezí alespoň jednoho měsíce s výjimkou poslední injekce, která bude podána alespoň 6 měsíců po třetí dávce.
• První dávka může být podána po dovršení 6 týdnů věku.
• Váš lékař Vás bude informovat, kdy je třeba se dostavit k aplikaci další dávky.
Předčasně narozené děti (narozené po 27. týdnu a dříve než ve 37. týdnu těhotenství)
Vašemu dítěti (ve věku od 2 měsíců do 6 měsíců) budou podány 3 dávky formou injekce, mezi každou dávkou bude časový odstup alespoň jednoho měsíce. Vaše dítě obdrží posilovací dávku v odstupu alespoň šesti měsíců po poslední injekci.
Kojencům ve věku od 7 do 11 měsíců budou podány 2 dávky, přičemž druhá dávka bude podána nejdříve za jeden měsíc po podání první dávky. Třetí dávka bude podána během druhého roku života, a to nejdříve za 2 měsíce od podání předchozí dávky.
Malým dětem ve věku od 12 měsíců do 5 let budou podány 2 dávky. Druhá dávka bude podána nejdříve za 2 měsíce od podání první dávky.
Jestliže jste se zapomněl(a) dostavit k aplikaci dávky
Pokud Vaše dítě vynechá aplikaci dávky, je třeba domluvit další návštěvu. Proto se poraďte s lékařem o dalším postupu, jak Vaše dítě ochránit.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. U tohoto přípravku se mohou vyskytnout následující nežádoucí účinky:
Velmi časté (mohou se objevit u více než 1 z 10 dávek vakcíny)
• bolest, zarudnutí nebo otok v místě vpichu vakcíny;
• horečka 38 °C a vyšší;
• ospalost;
• podrážděnost;
• ztráta chuti k jídlu.
Časté (mohou se objevit až u 1 z 10 dávek vakcíny)
• zatvrdnutí v místě vpichu vakcíny.
Méně časté (mohou se objevit až 1x ze 100 dávek vakcíny)
• svědění, podlitina, krvácení nebo malý otok v místě vpichu vakcíny;
• pocit na zvracení, průjem nebo nevolnost (zvracení);
• neobvyklý pláč;
• přechodná zástava dýchání (apnoe), pokud se dítě narodilo nedonošené (před nebo ve 28. týdnu těhotenství);
• bolest hlavy;
• kožní vyrážka;
• difusní otok končetiny, do které byla podána injekce, někdy zasahující přiléhající kloub;
• kopřivka.
Vzácné (mohou se objevit až u 1 z 1 000 dávek vakcíny)
• křeče bez teploty nebo křeče z horečky;
• alergické reakce jako kožní alergie;
• kolaps (náhlý nástup svalové ochablosti), období bezvědomí nebo ztráty kontaktu s okolím a bledost nebo namodralé zbarvení kůže.
Velmi vzácné (mohou se objevit až u 1 z 10 000 dávek vakcíny)
• závažné alergické reakce, které se mohou projevit:
- vystupující a svědivou vyrážkou (kopřivka);
- otokem, někdy tváře nebo úst (angioedém), vedoucím k obtížnému dýchání;
- kolapsem.
Tyto reakce se obvykle vyskytnou před opuštěním ordinace lékaře. Nicméně, pokud se u Vašeho dítěte vyskytnou některé z těchto příznaků, ihned kontaktujte lékaře.
• Kawasakiho nemoc (hlavními příznaky onemocnění jsou například: horečka, kožní vyrážka, zduření lymfatických uzlin, zánět a zarudnutí sliznic dutiny ústní a krku).
Posilovací dávka vakcíny Synflorix může zvýšit riziko nežádoucích účinků.
U dětí ve věku > 12 měsíců se riziko bolesti v místě podání injekce může zvýšit se zvyšujícím se věkem.
U těžce nedonošených dětí (narozených před nebo ve 28. týdnu těhotenství) se mohou 2. až 3. den po očkování objevit pauzy mezi jednotlivými dechy, které jsou delší než normálně.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak vakcínu Synflorix uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C).
• Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
• Chraňte před mrazem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co vakcína Synflorix obsahuje
• Léčivými látkami jsou:
1 dávka (0,5 ml) obsahuje: Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum Pneumococcale polysaccharidum
serotypus 11,2 serotypus 41,2 serotypus 51,2 serotypus 6B1,2 serotypus 7F1,2 serotypus 9V1,2
1 mikrogram 3 mikrogramy 1 mikrogram 1 mikrogram 1 mikrogram 1 mikrogram
Pneumococcale polysaccharidum serotypus 141,2 Pneumococcale polysaccharidum serotypus 18C1,3 Pneumococcale polysaccharidum serotypus 19F1,4 Pneumococcale polysaccharidum serotypus 23F1,2
1 mikrogram 3 mikrogramy 3 mikrogramy 1 mikrogram
1 adsorbováno na fosforečnan hlinitý
2 konjugovaná na protein D (získaný z kmenů netypovatelného Haemophilus influenzae) jako proteinový nosič
3 konjugovaná na tetanický toxoid jako proteinový nosič
4 konjugovaná na difterický toxoid jako proteinový nosič
0,5 miligramů Al3+ 9-16 mikrogramů
5-10 mikrogramů 3-6 mikrogramů
• Pomocnými látkami jsou: chlorid sodný a voda na injekci Jak vakcína Synflorix vypadá a co obsahuje toto balení
• Injekční suspenze ve vícedávkovém balení.
• V akcína Synflorix j e zakalená bílá suspenze.
• Vakcína Synflorix je dostupná v injekčních lahvičkách se dvěma dávkami v balení se 100 injekčními lahvičkami.
Držitel rozhodnutí o registraci a výrobce
GlaxoSmithKline Biologicals s.a.
Rue de lInstitut 89 B-1330 Rixensart Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Etarapnu
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com Luxembourg/Luxemburg GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
Nederland
GlaxoSmithKline BV Tel: + 31 (0)30 69 38 100 nlinfo@gsk.com
Norge
GlaxoSmithKline AS
Eesti
GlaxoSmithKline Eesti OU
|
Tel: +372 667 6900 estonia@gsk.com |
Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
EXlába GlaxoSmithKline A.E.B.E TpA.: + 30 210 68 82 100 |
Osterreich GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com |
|
Espaňa GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Polska GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com Hrvatska GlaxoSmithKline d.o.o. Tel.: + 385 (0)1 6051999 |
Portugal GlaxoSmithKline - Produtos Farmaceuticos, Lda. Tel: + 351 21 412 95 00 Románia GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208 |
|
Ireland GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s.r.o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kónpoq GlaxoSmithKline (Cyprus) Ltd TpA.: + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: +44 (0)800 221 441 customercontactuk@gsk.com |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
Následující informace je určena pouze pro zdravotnické pracovníky:
Při uchovávání lze v injekční lahvičce pozorovat jemný bílý sediment a čirý bezbarvý supernatant; není to však známkou znehodnocení vakcíny.
Před aplikací musí být obsah injekční lahvičky před protřepáním a po protřepání vizuálně zkontrolován na přítomnost cizorodých částic a/ nebo na změnu vzhledu. Jestliže svým vzhledem nevyhovuje, je třeba vakcínu vyřadit.
Vakcínu je třeba aplikovat po dosažení pokojové teploty.
Obsah injekční lahvičky musí být před aplikací dobře protřepán. Po prvním otevření vícedávkové injekční lahvičky je třeba vakcínu aplikovat ihned. Pokud není vakcína aplikována ihned, musí být uchovávána v chladničce (2 °C - 8 °C). Pokud není během 6 hodin vakcína aplikována, musí být zlikvidována.
Při použití vícedávkové injekční lahvičky musí být k odebrání každé dávky (0,5 ml) použita sterilní jehla a injekční stříkačka. Je třeba zamezit kontaminaci obsahu lahvičky
Vakcína je určena pouze k intramuskulárnímu podání. Vakcína nesmí být aplikována do žíly.
Je-li vakcína Synflorix podávána současně s dalšími vakcínami, je vhodné aplikovat jednotlivé vakcíny do různých míst.
Vakcína Synflorix nesmí být smísena s dalšími vakcínami. Po natažení dávky vakcíny do stříkačky musí být jehla, která byla k natažení použita, nahrazena jehlou vhodnou k intramuskulární injekci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
57