Sutent 12,5 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
SUTENT 12,5 mg tvrdé tobolky SUTENT 25 mg tvrdé tobolky SUTENT 37,5 mg tvrdé tobolky SUTENT 50 mg tvrdé tobolky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
12.5 mg tvrdé tobolky
Jedna tobolka obsahuje sunitinibi malas odpovídající 12,5 mg sunitinibum. 25 mg tvrdé tobolky
Jedna tobolka obsahuje sunitinibi malas odpovídající 25 mg sunitinibum.
37.5 mg tvrdé tobolky
Jedna tobolka obsahuje sunitinibi malas odpovídající 37,5 mg sunitinibum. 50 mg tvrdé tobolky
Jedna tobolka obsahuje sunitinibi malas odpovídající 50 mg sunitinibum. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
SUTENT 12,5 mg tvrdé tobolky
Oranžové želatinové tobolky s označením „STN 12,5 mg“ s oranžovým víčkem s bílým potiskem „Pfizer“, obsahující žluté až oranžové granule.
SUTENT 25 mg tvrdé tobolky
Oranžové želatinové tobolky s označením „STN 25 mg“ s karamelovým víčkem s bílým potiskem „Pfizer“, obsahující žluté až oranžové granule.
SUTENT 37,5 mg tvrdé tobolky
Žluté želatinové tobolky s označením „STN 37,5 mg“ s žlutým víčkem s černým potiskem „Pfizer“, obsahující žluté až oranžové granule.
SUTENT 50 mg tvrdé tobolky
Karamelové želatinové tobolky s označením „STN 50 mg“ s karamelovým víčkem s bílým potiskem „Pfizer“, obsahující žluté až oranžové granule.
KLINICKÉ ÚDAJE
4.
4.1 Terapeutické indikace
Gastrointestinalní stromální tumor (GIST)
SUTENT je u dospělých pacientů indikován k léčbě neresekovatelného a/nebo metastatického maligního gastrointestinálního stromálního tumoru (gastrointestinal stromal tumor = GIST) po selhání léčby imatinibem v důsledku rezistence nebo intolerance.
Metastatický adenokarcinom ledviny (MRCC)
SUTENT je u dospělých pacientů indikován pro léčbu pokročilého a/nebo metastatického renálního karcinomu (MRCC).
Pankreatické neuroendokrinní tumory (pNET)
SUTENT je u dospělých pacientů indikován k léčbě neresekovatelných nebo metastatických dobře diferencovaných pankreatických neuroendokrinních nádorů (pNET) s progresí onemocnění. Zkušenosti s užitím přípravku SUTENT jako léčiva první linie jsou limitované (viz bod 5.1).
4.2 Dávkování a způsob podání
Léčba sunitinibem by měla být zahájena lékařem se zkušenostmi s podáváním protinádorových léčivých přípravků.
Dávkování
Doporučená dávka přípravku SUTENT pro léčbu GIST a MRCC je 50 mg jednou denně perorálně po dobu 4 po sobě následujících týdnů, dále následuje 2-týdenní pauza (režim 4/2), která zakončuje celý 6-týdenní cyklus.
Doporučená dávka přípravku SUTENT pro léčbu pNET je 37,5 mg jednou denně perorálně bez naplánovaného přerušení užívání.
Úprava dávky
Bezpečnost a snášenlivost
Na základě individuální bezpečnosti a snášenlivosti se mohou při léčbě GIST a MRCC provádět úpravy dávky v přírůstcích po 12,5 mg. Denní dávka by neměla překročit 75 mg ani by neměla klesnout pod 25 mg.
Na základě individuální bezpečnosti a snášenlivosti se mohou při léčbě pNET provádět úpravy dávky v přírůstcích po 12,5 mg. Maximální denní dávka podávaná v klinické studii III. fáze zaměřené na pNET byla 50 mg.
Na základě individuální bezpečnosti a snášenlivosti může být nezbytné přerušení dávkování přípravku SUTENT.
CYP3A4 inhibitory/induktory
Je třeba se vyhnout současnému podání se silnými CYP3A4 induktory jako je rifampicin (viz body 4.4 a 4.5). Pokud to není možné, může být nutné zvyšovat dávku sunitinibu o přírůstky 12,5 mg (až na
87,5 mg na den při léčbě GIST a MRCC nebo 62,5 mg na den při léčbě pNET). Tolerabilita musí být pečlivě sledována.
Je třeba se vyhnout současnému podání se silnými CYP3A4 inhibitory, jako je ketokonazol (viz body 4.4 a 4.5). Pokud to není možné, může být nutné snížit dávku sunitinibu na denní minimum 37,5 mg při léčbě GIST a MRCC nebo na denní minimum 25 mg při léčbě pNET. Tolerabilita musí být pečlivě sledována.
Měl by se zvážit výběr alternativní současné medikace s žádným nebo minimálním potenciálem k indukci nebo inhibici CYP3A4.
Zvláštní populace
Pediatrická populace
Bezpečnost a účinnost sunitinibu u osob mladších než 18 let nebyla stanovena.
V současnosti dostupné omezené údaje jsou uvedeny v bodě 4.8, 5.1 a 5.2, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Starší pacienti (> 65 let)
Přibližně jedna třetina pacientů účastnících se klinických studií se sunitinibem byla ve věku 65 let nebo starších. Mezi mladšími a staršími pacienty nebyly pozorovány významné rozdíly v bezpečnosti nebo účinnosti.
Jaterní poškození
Úprava počáteční dávky se nedoporučuje, pokud je sunitinib podáván pacientům s mírnou nebo středně závažnou poruchou jaterní funkce (stupeň A a B dle Childa-Pugha). U pacientů se závažnou poruchou jaterní funkce stupně C dle Childa-Pugha nebyly studie se sunitinibem prováděny, a proto jeho podání pacientům se závažným jaterním poškozením nelze doporučit (viz bod 5.2).
Renální poškození
Pokud je sunitinib podáván pacientům s poruchou funkce ledvin (mírnou až závažnou) nebo pacientům na hemodialýze s poruchou ledvin v konečném stádiu (end-stage renal disease (ESRD) není úprava počáteční dávky nutná. Následná úprava dávky se musí zakládat na individuální bezpečnosti a snášenlivosti (viz bod 5.2).
Způsob podání
SUTENT se podává perorálně, může, ale nemusí být užíván s jídlem.
Pokud pacient zapomene lék užít, neměl by užít dávku dodatečně. Měl by užít doporučenou dávku následující den tak, jak by ji užil za normálních okolností.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Současnému podávání se silnými CYP3A4 induktory je třeba se vyhnout, protože to může vést ke snížení koncentrace sunitinibu v plazmě (viz body 4.2 a 4.5).
Současnému podávání se silnými CYP3A4 inhibitory je třeba se vyhnout, protože to může vést ke zvýšení koncentrace sunitinibu v plazmě (viz body 4.2 a 4.5).
Poruchy kůže a tkáně
Změna barvy kůže, asi v důsledku barvy (žluté) léčivé látky, je velmi častým nežádoucím účinkem, který se vyskytuje přibližně u 30 % pacientů. Pacienti by měli být upozorněni na to, že v průběhu léčby sunitinibem může dojít také k depigmentaci kůže nebo vlasů. Další možné dermatologické účinky mohou zahrnovat suchou pokožku, ztluštění nebo popraskání kůže, puchýř nebo příležitostnou vyrážku na dlaních a chodidlech.
Výše uvedené reakce nebyly kumulativní, byly typicky reverzibilní a obecně nevedly k přerušení léčby.
Byly hlášeny případy pyoderma gangrenosum, obecně reverzibilní po přerušení podávání přípravku. Byly hlášeny závažné kožní reakce včetně případů erythema multiforme (EM) a případů připomínajících Stevens-Johnsonův syndrom (SJS) a toxickou epidermální nekrolýzu (TEN), z nichž byly některé smrtelné. Objeví-li se známky a příznaky SJS, TEN, nebo EM (např. progresivní kožní vyrážka často doprovázená puchýři nebo slizničními lézemi), má být léčba sunitinibem přerušena. Je-li diagnóza SJS nebo TEN potvrzena, léčba nesmí být znovu zahájena. V některých případech podezření na EM pacienti po vymizení kožních reakcí tolerovali znovuzahájení léčby sunitinibem v nízkých dávkách; někteří z těchto pacientů dostávali rovněž souběžnou léčbu kortikoidy nebo antihistaminiky.
Krvácení a krvácení do tumoru
Případy krvácení, některé s fatálním průběhem, hlášené během poregistračního sledování zahrnovaly gastrointestinální, dýchací a močový trakt a mozkové krvácení.
Ve III. fázi studie GIST se objevily případy krvácení u 18% pacientů užívajících sunitinib v porovnání se 17% pacientů užívajících placebo. U nepředléčených pacientů s MRCC užívajících sunitinib mělo příhodu krvácení 39 % pacientů ve srovnání s 11 % pacientů užívajících interferon-a. Případy krvácení 3. nebo vyššího stupně se vyskytly u sedmnácti (4,5 %) pacientů užívajících sunitinib v porovnání s 5 (1,7 %) pacienty užívajícími IFN-a. Z pacientů užívajících sunitinib u na cytokiny-refrakterního MRCC se krvácení vyskytlo u 26 %. Případy krvácení, vyjma epistaxe, se vyskytovaly u 21,7 % pacientů užívajících sunitinib v klinické studii III. fáze zaměřené na pNET ve srovnání se 9,85 % pacientů užívajících placebo. Obvyklé zhodnocení takovéto příhody by mělo zahrnovat úplný krevní obraz a fyzikální vyšetření.
Epistaxe byla nejčastějším nežádoucím případem krvácení, byla hlášena přibližně u poloviny pacientů se solidními tumory, kteří prodělali příhodu krvácení. Některé z těchto případů epistaxe byly závažné, ale velmi vzácně fatální.
Byly hlášeny případy krvácení do tumoru, někdy dávané do souvislosti s nekrózou tumoru. Některé z těchto případů krvácení měly fatální průběh.
V klinických hodnoceních se objevilo krvácení do tumoru přibližně u 2 % pacientů s GIST. Tyto příhody se mohou objevit náhle a v případě plicních tumorů se mohou projevit jako závažná a život ohrožující hemoptýza nebo plicní krvácení. Případy plicního krvácení, někdy s fatálním průběhem byly pozorovány v klinických studiích a byly hlášeny i během poregistračního sledování u pacientů léčených sunitinibem v indikaci MRCC, GIST a karcinom plic. SUTENT není schválen pro podání pacientům s karcinomem plic.
U pacientů užívajících současně antikoagulancia (např. warfarin, acenokumarol) by se měl pravidelně sledovat celkový krevní obraz (krevní destičky), koagulační faktory (PT/INR) a tělesný stav.
Gastrointestinální poruchy
Průjem, nausea/zvracení, bolest břicha, dyspepsie a stomatitida/bolest v ústech byly nejčastěji zaznamenané gastrointestinální příhody, hlášeny byly rovněž případy esofagitidy (viz bod 4.8).
Podpůrná péče gastrointestinálních nežádoucích účinků vyžadujících léčbu může zahrnovat podávání léčivých přípravků s antiemetickými a antidiarrhoickými vlastnostmi nebo antacid.
Závažné, někdy fatální gastrointestinální komplikace, včetně gastrointestinální perforace, se objevily u pacientů s intraabdominálními malignitami, kteří byli léčeni sunitinibem. Fatální gastrointestinální krvácení se objevilo u 0,98 % pacientů užívajících placebo ve studii III. fáze s pacienty s GIST.
Hypertenze
Hypertenze byla velmi častým nežádoucím účinkem hlášeným v klinických studiích. Dávkování sunitinibu bylo sníženo nebo jeho podání přechodně přerušeno přibližně u 2,7 % těchto pacientů s hypertenzí. U žádného z pacientů nebyla léčba sunitinibem trvale ukončena. Závažná hypertenze (> 200 mmHg systolického nebo 110 mmHg diastolického tlaku) se objevila u 4,7% pacientů se solidními tumory. U nepředléčených pacientů s MRCC užívajících sunitinib byla hypertenze hlášena přibližně u 33,9 % pacientů ve srovnání s 3,6 % pacientů užívajících interferon-a. U nepředléčených pacientů se závažná hypertenze objevila u 12 % pacientů užívajících sunitinib a u < 1 % pacientů užívajících IFN-a. V klinické studii III. fáze zaměřené na pNET byla hypertenze zaznamenána u 26,5 % pacientů užívajících sunitinib ve srovnání se 4,9 % pacientů užívajících placebo. Závažná hypertenze se vyskytovala u 10 % pacientů s pNET užívajících sunitinib a 3 % pacientů s pNET užívajících placebo. U pacientů by měl být prováděn screening hypertenze a v případě potřeby léčba hypertenze. Dočasné přerušení léčby je doporučeno u pacientů se závažnou hypertenzí, která není ovlivnitelná farmakologicky. V léčbě je možné pokračovat, jakmile je hypertenze patřičně zvládnuta.
Hematologické poruchy
Poklesy celkového počtu neutrofilů 3. a 4. stupně závažnosti byly hlášeny u 10 %, resp. u 1,7 % pacientů v klinické studii III. fáze zaměřené na GIST, u 16 % resp. 1,6 % pacientů v klinické studii III. fáze zaměřené na metastazující renální karcinom a u 13 % resp. 2,4 % pacientů v klinické studii III. fáze u pNET. Poklesy počtu destiček 3. a 4. stupně závažnosti byly hlášeny u 3,7 %, resp. u 0,4 % pacientů v klinické studii III. fáze zaměřené na GIST, u 8,2 % resp. 1,1 % pacientů v klinické studii III. fáze zaměřené na MRCC a u 3,7 % resp. 1,2 % pacientů v klinické studii III. fáze zaměřené na pNET. Výše uvedené případy nebyly kumulativní, byly typicky reverzibilní a obecně nevedly k přerušení léčby. Žádná z těchto příhod v rámci klinických studií III. fáze nebyla fatální, nicméně v rámci poregistrační praxe byly vzácně hlášeny hematologické příhody s fatálním průběhem, ke kterým patřila hemoragie spojená s trombocytopenií a infekcemi v důsledku neutropenie.
Bylo pozorováno, že anemie se může objevit časně i pozdě během léčby sunitinibem, hlášeny byly případy 3. a 4. stupně.
U pacientů užívajících sunitinib by se mělo provádět vyšetření úplného krevního obrazu na začátku každého léčebného cyklu.
Srdeční poruchy
Případy kardiovaskulárních příhod, zahrnující srdeční selhání, kardiomyopatii a ischemii myokardu a infarkt myokardu, některé s fatálním průběhem, byly hlášeny u pacientů léčených sunitinibem. Tato data naznačují, že sunitinib zvyšuje riziko kardiomyopatie. Pro sunitinibem indukovanou kardiomyopatii nebyly u léčených pacientů zjištěny žádné další specifické rizikové faktory kromě účinku specifického pro léčivo. U pacientů, kteří jsou vystaveni riziku těchto příhod, nebo je mají v anamnéze, používejte sunitinib s opatrností.
V klinických hodnoceních byly zaznamenány případy snížení ejekční frakce levé komory (left ventricular ejection fraction LVEF) o > 20 % a pod dolní hranici normálních hodnot přibližně u 2 % pacientů, u kterých byl GIST léčen sunitinibem, u 4 % pacientů, u nichž byl na cytokiny refraktemí MRCC léčen přípravkem SUTENT, a u 2 % pacientů užívajících placebo ve studii zamcrenc na ^jIST. Tyto poklesy LVEF se ukázaly jako neprogresivní a často se při pokračující léčbě zlepšily. Ve studii nepředléčeného MRCC mělo 27 % pacientů užívajících sunitinib a 15 % pacientů užívajících interferon-a hodnotu LVEF pod dolní hranicí normálních hodnot. U dvou pacientů (<1%), kteří užívali sunitinib, byla stanovena diagnóza městnavého srdečního selhání (CHF).
‘Srdeční selhání’, ‘městnavé srdeční selhání’ nebo ‘selhání levé komory’ byly hlášeny u 1,2 % pacientů s GIST léčených sunitinibem a u 1 % pacientů užívajících placebo. V pivotní studii III. fáze u GIST (n = 312) se objevily s léčbou související fatální srdeční příhody u 1 % pacientů v každém rameni studie (tj. ramena se sunitinibem a s placebem). Ve studii II. fáze s pacienty s na cytokiny-refrakterním MRCC se u 0,9 % pacientů vyskytl s léčbou související fatální infarkt myokardu a ve studii III. fáze u nepředléčených pacientů s MRCC se vyskytly fatální srdeční příhody u 0,6 % pacientů v rameni s IFN-a a u 0 pacientů v rameni se sunitinibem. V klinické studii III. fáze zaměřené na pNET se u jednoho (1 %) pacienta užívajícího sunitinib objevilo s léčbou spojené fatální srdeční selhání. Vztah, je-li nějaký, mezi inhibicí receptoru tyrozinkinázy (receptor tyrosine kinase - RTK) a srdeční funkcí zůstává nejasný.
Pacienti, kteří během 12 měsíců předtím, než začali užívat sunitinib, prodělali takové příhody, jako jsou infarkt myokardu (včetně závažné/nestabilní anginy pectoris), bypass koronární nebo periferní arterie, symptomatické městnavé srdeční selhání (CHF), cerebrovaskulární příhodu nebo přechodnou ischemickou ataku nebo plicní embolii byly z klinických studií přípravku SUTENT vyřazeni. Není známo, zda u pacientů s těmito doprovodnými stavy je riziko rozvoje dysfunkce levé komory spojené s léčbou zvýšeno.
Pečlivé sledování klinických známek a příznaků městnavého srdečního selhání (CHF) je nutné provádět zejména u pacientů s kardiálními rizikovými faktory a/nebo s onemocněním koronárních arterií v anamnéze.
Lékařům se doporučuje zvážit toto riziko proti očekávanému přínosu léčby. U těchto pacientů by měly být pečlivě monitorovány klinické známky a příznaky městnavého srdečního selhání (CHF) během užívání sunitinibu. U pacientů užívajících sunitinib je třeba také zvážit výchozí hodnoty a pravidelné vyhodnocování LVEF. U pacientů bez kardiálních rizikových faktorů je třeba zvážit vyhodnocení výchozích hodnot ejekční frakce.
Při klinickém projevu městnavého srdečního selhání (CHF) se doporučuje přerušit léčbu přípravkem SUTENT. Podávání přípravku SUTENT by mělo být přerušeno a/nebo jeho dávka snížena u pacientů bez klinicky prokázaného městnavého srdečního selhání, ale s ejekční frakcí <50 % a >20 % výchozích hodnot.
Prodloužení QT intervalu
Údaje z preklinických (in vitro a in vivo) studií, při dávkách vyšších než jsou dávky doporučené u lidí, indikovaly, že sunitinib má schopnost potlačovat repolarizační proces srdečního akčního potenciálu (např. prodloužení QT intervalu).
Prodloužení QTc intervalu nad 500 ms bylo zaznamenáno u 0,5 % a změny od výchozí hodnoty o více než 60 ms se objevily u 1,1 % ze 450 pacientů se solidním tumorem; oba tyto parametry jsou považovány jako potenciálně významné změny. Při přibližně dvojnásobných terapeutických koncentracích se u sunitinibu prokázalo prodloužení QTcF intervalu (Frederica’s Correction).
Prodloužení QTc intervalu bylo zkoumáno ve studii u 24 pacientů, ve věku 20 - 87 let, s pokročilými malignitami. Výsledky této studie ukazují, že sunitinib má vliv na QTc (což je definováno jako střední změna adjustovaná na placebo větší než 10 ms s horní hranicí vyšší než 15 ms při 90% intervalu spolehlivosti) při terapeutické koncentraci (Den 3) při použití vstupní korekční metody v průběhu dne, a při vyšší než terapeutické koncentraci (Den 9) za použití obou vstupních korekčních metod. U žádného pacienta nebyla hodnota QTc >500 ms. Ačkoliv byl účinek na QTcF v Den 3 pozorován 24 hodin po dávce (tj. při terapeutické plazmatické koncentraci očekávané po doporučené zahajovací dávce 50 mg) za použití vstupní korekční metody v průběhu dne, klinický význam tohoto nálezu není jasný.
Při použití rozsáhlých sériových hodnocení EKG nálezů v daných časech odpovídajících buď terapeutickým, nebo vyšším než terapeutickým expozicím, u žádného z pacientů u hodnotitelné nebo ITT (intent-to-treat) populace nebylo pozorováno prodloužení QTc, které by bylo považované za „závažné“ (tj. rovnající se nebo větší než stupeň 3 podle CTCAE verze 3.0).
Při terapeutických plazmatických koncentracích byla maximální QTcF (Frederica’s correction) průměrná změna od výchozí hodnoty 9,6 ms (90% CI 15,1ms). Při přibližně dvojnásobných terapeutických koncentracích byla maximální QTcF změna od výchozí hodnoty 15,4 ms (90% CI:
22,4 ms). Moxifloxacin (400 mg) použitý jako pozitivní kontrola vykázal maximální průměrnou změnu QTcF od výchozí hodnoty 5,6 ms. U žádného subjektu nedošlo k prodloužení QTc intervalu většímu než 2. stupně (CTCAE verze 3.0).
Prodloužení QT intervalu může vést ke zvýšenému riziku ventrikulární/komorové arytmie včetně Torsade de pointes. Torsade de pointes byly pozorovány u <0.1% pacientů užívajících sunitinib.
Pacientům s prodloužením QT intervalu v anamnéze, pacientům užívajícím antiarytmika nebo léčivé přípravky, které mohou prodloužit QT interval nebo pacientům se závažnou preexistující srdeční chorobou, bradykardií nebo poruchou iontové rovnováhy by měl být sunitinib podáván s opatrností. Současné podávání sunitinibu se silnými CYP3A4 inhibitory je třeba omezit z důvodů možného zvýšení koncentrace sunitinibu v plazmě (viz body 4.2 a 4.5).
Žilní tromboembolické příhody
S léčbou související žilní tromboembolické příhody byly hlášeny u přibližně 1 % pacientů se solidními nádory, kteří užívali sunitinib v klinických studiích, včetně GIST a MRCC.
Ve III. fázi studie GIST prodělalo žilní tromboembolickou příhodu sedm pacientů (3%) užívajících SUTENT a žádný z pacientů užívajících placebo; hluboké žilní trombózy byly u pěti pacientů ze sedmi 3. stupně a u dvou pacientů byly 1. nebo 2. stupně. Čtyři z těchto sedmi pacientů s GIST přerušilo léčbu po prvním zpozorování HŽT.
Žilní tromboembolické příhody byly hlášeny u třinácti (3 %) pacientů užívajících sunitinib ve studii III. fáze s nepředléčeným MRCC a u čtyř pacientů (2%) ve dvou studiích s na cytokiny refrakterním MRCC. Devět z těchto pacientů mělo plicní embolie, jeden 2. stupně a osm 4. stupně, a osm z těchto pacientů mělo HŽT, jeden 1. stupně, dva2. stupně, čtyři pacienti 3. stupně a jeden 4. stupně. U jednoho pacienta s plicní embolií ve studii s na cytokiny refrakterním MRCC došlo k přerušení léčby.
U šesti (2%) pacientů s nepředléčeným MRCC užívajících interferon-a v první linii léčby MRCC se objevila žilní tromboembolická příhoda, jeden pacient (<1%) prodělal HŽT 3. stupně a pět pacientů (1%) mělo plicní embolie, všichni 4. stupně.
Žilní tromboembolické příhody byly hlášeny u 1 (1,2 %) subjektu v rameni se sunitinibem a 5 (6,1 %) subjektů v rameni s placebem v klinické studii III. fáze zaměřené na pNET. Dva z těchto subjektů užívajících placebo měly HŽT, jeden 2. stupně a jeden 3. stupně.
V registračních studiích GIST, MRCC a pNET nebyly zaznamenány žádné příhody s fatálním průběhem. Případy s fatálním průběhem byly pozorovány v rámci poregistračního sledování (viz respirační příhody a bod 4.8).
Arteriální tromboembolické příhody
U pacientů léčených sunitinibem byly hlášeny případy arteriálních tromboembolických příhod (ATE), někdy s fatálním průběhem. K nejčastějším příhodám patřily mozkové mrtvice, tranzientní ischemická ataka a cerebrální infarkt. K rizikovým faktorům souvisejícím s ATE se kromě základního maligního onemocnění a věku > 65 let řadila hypertenze, diabetes mellitus a předchozí tromboembolická nemoc.
Trombotická mikroangiopatie (TMA)
TMA, včetně trombotické trombocytopenické purpury (TTP) a hemolyticko-uremického syndromu (HUS), někdy vedoucí k renálnímu selhání nebo k fatálnímu průběhu, byla hlášena v klinických studiích i po uvedení přípravku na trh během léčby sunitinibem v monoterapii a v kombinaci s bevacizumabem. O diagnóze TMA je třeba uvažovat při výskytu hemolytické anemie, trombocytopenie, únavy, nepravidelně se objevujících neurologických příznaků, renálního poškození a horečky.
U pacientů, u nichž se rozvine TMA, by se měla léčba sunitinibem přerušit a je nutná okamžitá léčba. Po přerušení léčby byl pozorován ústup účinků TMA (viz bod 4.8).
Respirační příhody
Pacienti, u kterých se vyskytla plicní embolie během předcházejících 12 měsíců, byli ze studií s přípravkem SUTENT vyřazeni.
U pacientů, kteří užívali přípravek SUTENT v registračních studiích III. fáze, byly respirační příhody (tj. dyspnoe, pleurální efuze, plicní embolie nebo plicní edém) hlášeny přibližně u 17,8 % pacientů s GIST, přibližně u 26,7 % pacientů s MRCC a u 12 % pacientů s pNET.
Přibližně 22,2 % pacientů se solidními nádory, včetně GIST a MRCC, kteří užívali přípravek SUTENT v klinických studiích prodělalo plicní příhodu.
Případy plicní embolie byly pozorovány u přibližně 3,1 % pacientů s GIST a u přibližně 1,2 % pacientů s MRCC, kteří užívali přípravek SUTENT ve studiích III. fáze (viz bod 4.4 - Žilní tromboembolické příhody). Nebyly pozorovány žádné případy plicní embolie u pacientů s pNET užívajících sunitinib ve studiích III. fáze. Vzácné případy s fatálním průběhem byly pozorovány během poregistračního sledování (viz bod 4.8).
Dysfunkce štítné žlázy
Je doporučeno provést základní laboratorní měření funkce štítné žlázy u všech pacientů. Pacienti s preexistující hypotyreózou nebo hypertyreózou by měli být náležitě léčeni ještě před zahájením léčby sunitinibem. Během léčby sunitinibem by mělo být prováděno rutinní monitorování funkce štítné žlázy každé 3 měsíce. Navíc by známky a příznaky dysfunkce štítné žlázy měly být pečlivě sledovány během léčby u všech pacientů a u pacientů, u kterých se rozvinuly známky a/nebo příznaky naznačující dysfunkci štítné žlázy by mělo být prováděno laboratorní vyšetření funkce štítné žlázy, jak je klinicky indikováno. Pacienti, u kterých se vyvinula dysfunkce štítné žlázy, by měli být náležitě léčeni.
Bylo pozorováno, že hypotyreóza se může objevit časně i pozdně během léčby sunitinibem.
Hypotyreóza byla hlášena jako nežádoucí reakce u 7 pacientů (4 %) užívajících SUTENT během dvou studií s na cytokiny refrakterním MRCC, u 61 pacientů (16%) užívajících SUTENT a u tří pacientů (<1%) užívajících interferon-a ve studii s nepředléčeným MRCC.
Navíc bylo hlášeno zvýšení hladiny TSH u 4 pacientů (2 %) s na cytokiny refrakterním MRCC. Celkově 7 % pacientů s MRCC mělo buď klinické, nebo laboratorní známky léčbu vyžadující hypotyreózy. Získaná hypotyreóza byla pozorována u 6,2 % pacientů s GIST užívajících SUTENT v porovnání s 1 % užívajícím placebo. V klinické studii III. fáze zaměřené na pNET byla hlášena hypotyreóza u 6 pacientů (7,2 %) užívajících sunitinib a jednoho pacienta (1,2 %) užívajícího placebo.
Ve dvou studiích byla prospektivně sledována funkce štítné žlázy u pacientů s maligním nádorovým onemocněním prsu; přípravek SUTENT není schválen pro léčbu maligních nádorových onemocnění prsu. V jedné studii byla hlášena hypotyreóza u 15 (13,6 %) sledovaných osob léčených sunitinibem a u 3 (2,9 %) sledovaných osob se standardní léčbou. Zvýšený TSH v krvi byl hlášen u 1 (0,9 %) sledované osoby léčené sunitinibem a nebyl hlášen u žádné sledované osoby se standardní léčbou. Hypertyreóza nebyla hlášena u žádné sledované osoby léčené sunitinibem a byla hlášena u 1 (1,0 %) sledované osoby se standardní léčbou. V druhé studii byla hlášena hypotyreóza celkem u 31 (13 %) sledovaných osob léčených sunitinibem a u 2 (0,8 %) sledovaných osob léčených kapecitabinem. Zvýšený TSH v krvi byl hlášen u 12 (5,0 %) sledovaných osob léčených sunitinibem a nebyl hlášen u žádné sledované osoby léčené kapecitabinem. Hypertyreóza byla hlášena u 4 (1,7 %) sledovaných osob léčených sunitinibem a nebyla hlášena u žádné sledované osoby léčené kapecitabinem. Snížený TSH v krvi byl hlášen u 3 (1,3 %) sledovaných osob léčených sunitinibem a nebyl hlášen u žádné sledované osoby léčené kapecitabinem. Zvýšený T4 byl hlášen u 2 (0,8 %) sledovaných osob léčených sunitinibem a u 1 (0,4 %) sledované osoby léčené kapecitabinem. Zvýšený T3 byl hlášen u 1 (0,8 %) sledované osoby léčené sunitinibem a nebyl hlášen u žádné sledované osoby léčené kapecitabinem. Všechny hlášené účinky na štítnou žlázu byly stupně 1-2.
V klinických studiích a během poregistračního sledování byly méně často hlášeny případy hypertyreózy někdy následované hypotyreózou a případy zánětu štítné žlázy.
Pankreatitida
Zvýšení lipázy a amylázy v séru byla pozorována u pacientů s různými solidními nádory, kteří užívali sunitinib. Zvýšení lipázy byla přechodná a obecně nebyla doprovázena známkami a příznaky pankreatitidy u pacientů s různými solidními tumory.
Pankreatitida byla u pacientů s GIST nebo MRCC užívajících SUTENT pozorována méně často (<1%).
Byly hlášeny závažné případy pankreatitidy, některé s fatálním průběhem.
Pokud jsou přítomny příznaky pankreatitidy nebo jaterního selhání, pacient musí užívání sunitinibu přerušit a musí jim být poskytnuta náležitá podpůrná léčba.
Nebyl hlášen žádný případ pankreatitidy související s léčbou v klinické studii III. fáze zaměřené na pNET.
Hepatotoxicita
U pacientů léčených sunitinibem byla pozorována hepatotoxicita. Případy jaterního selhání, někdy s fatálními následky, byly pozorovány u < 1% pacientů se solidními tumory léčených sunitinibem. Je nutné sledovat jaterní funkční testy (alanin-aminotransferázu [ALT], aspartát-aminotransferázu [AST], hladiny bilirubinu) před zahájením léčby, během každého léčebného cyklu, a pokud je klinicky indikováno.
Poruchy jater a žlučových cest
Léčba sunitinibem může být spojena s cholecystitidou včetně akalkulózní cholecystitidy a emfysematózní cholecystitidy. V klinických registračních studiích byla incidence cholecystitidy 0,5 %. Byly hlášeny případy cholecystitidy po uvedení přípravku na trh.
Renální funkce
Byly hlášeny případy poruchy renálních funkcí, renálního selhání a/nebo akutního renálního selhání, v některých případech s fatálními následky.
Rizikové faktory spojené s poruchou renálních funkcí/renálního selhání u pacientů užívajících sunitinib zahrnovaly kromě základního onemocnění renální karcinomu, vyšší věk, diabetes mellitus, výchozí renální poškození, srdeční selhání, hypertenzi, sepsi, dehydrataci/hypovolemii a rabdomyolýzu.
Bezpečnost pokračující léčby přípravkem SUTENT u pacientů se středně závažnou až závažnou proteinurií nebyla systematicky hodnocena.
Byly hlášeny případy proteinurie a vzácné případy nefrotického syndromu. Před zahájením léčby by měl být proveden rozbor moči a u pacientů by mělo být sledováno, zda nedochází k rozvoji nebo zhoršení proteinurie. Podávání přípravku SUTENT je nutné vysadit u pacientů s nefrotickým syndromem.
Píštěl
Pokud se objeví tvorba píštěle, léčba sunitinibem musí být přerušena. O pokračujícím podávání sunitinibu pacientům s píštělí jsou dostupné omezené údaje.
Porucha hojení
Byly hlášeny případy poruchy hojení během léčby sunitinibem.
Žádné formální klinické studie účinku sunitinibu na hojení ran nebyly provedeny. Doporučuje se přechodné přerušení léčby sunitinibem z preventivních důvodů u pacientů podstupujících větší chirurgické zákroky. Klinické zkušenosti ohledně načasování opětovného zahájení léčby po rozsáhlé chirurgické intervenci jsou omezené. Proto rozhodnutí znovu zahájit léčbu sunitinibem následně po rozsáhlé chirurgické intervenci by se mělo zakládat na klinickém zhodnocení rekonvalescence/zotavení z chirurgického zákroku.
Osteonekróza čelisti (ONJ)
U pacientů léčených přípravkem SUTENT byly hlášeny případy ONJ. Většina případů se objevila u pacientů dostávajících před nebo současně s léčbou intravenózně bisfosfonáty, u kterých bylo riziko ONJ identifikováno. Je proto třeba velké opatrnosti, pokud jsou přípravek SUTENT a intravenózní bisfosfonáty užívány současně nebo následně.
Jako rizikový faktor jsou rovněž identifikovány invazivní dentální procedury. Před zahájením léčby přípravkem SUTENT je nutné zvážit stomatologickou kontrolu a příslušné preventivní stomatologické ošetření. U pacientů, kteří užívali nebo užívají intravenózní bisfosfonáty, se doporučuje invazivní dentální proceduře vyhnout, pokud je to možné (viz bod 4.8).
Hypersenzitivita/angioedém
Pokud se v důsledku hypersenzitivity objeví angioedém, léčba sunitinibem musí být přerušena a musí být poskytnuta standardní lékařská péče.
Poruchy nervového systému
Změny chuti
Dysgeusie byla hlášena přibližně u 28 % pacientů užívajících přípravek SUTENT v klinických hodnoceních.
V klinických studiích s přípravkem SUTENT a během poregistračního sledování byly pozorovány záchvaty u pacientů s radiologicky potvrzenými mozkovými metastázami i bez nich. Navíc bylo hlášeno několik případů (< 1 %), některé fatální, pacientů se záchvaty a radiologickým potvrzením reverzibilního syndromu okcipitální leukoencefalopatie (reversible posterior leukoencephalopathy syndrome RPLS). Pacienti se záchvaty a příznaky konzistentními s RPLS, jako je hypertenze, bolest hlavy, snížená bdělost, změněné mentální funkce a ztráta vidění, včetně kortikální slepoty, musí být léčeni pod lékařským vedením a léčba má zahrnovat i kontrolu hypertenze. Doporučuje se přechodně vysadit SUTENT, po vyřešení může být léčba znovu zahájena podle uvážení ošetřujícího lékaře.
Syndrom lýzy tumoru
Případy syndromu lýzy tumoru, někdy fatální, u pacientů léčených sunitinibem byly vzácně pozorovány v klinických studiích a byly hlášeny i v poregistračním sledování. Mezi rizikové faktory syndromu lýzy tumoru patří vysoká zátěž způsobená tumorem, chronická renální insuficience, oligurie, dehydratace, hypotenze a acidická moč. Pacienti by měli být pečlivě sledováni a léčeni podle klinické indikace a měla by se zvážit profylaktická hydratace.
Infekce
Byly hlášeny závažné infekce s nebo bez neutropenie, včetně některých s fatálním průběhem.Infekce pozorované nejčastěji při léčbě sunitinibem jsou infekce typicky viděné u pacientů s karcinomem např. infekce a sepse respiračního, močového traktu a kožní infekce a sepse.
Byly hlášeny vzácné případy nekrotizující fasciitidy, včetně postižení perinea, někdy fatální. U pacientů, u nichž se rozvine nekrotizující fasciitida, by se měla léčba sunitinibem přerušit a ihned by se měla zahájit vhodná léčba.
Hypoglykemie
Během léčby sunitinibem byl hlášen pokles hladiny glukózy v krvi, v některých případech klinicky symptomatický a vyžadující hospitalizaci z důvodu ztráty vědomí. V případě výskytu symptomatické hypoglykemie by mělo být podávání sunitinibu dočasně přerušeno. Hladinu glukózy v krvi je třeba u pacientů s diabetem pravidelně kontrolovat, aby bylo možno stanovit, zda je dávkování antidiabetika třeba upravit, a minimalizovat tak riziko hypoglykemie.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí byly provedeny pouze u dospělých.
Léčivé přípravky, které mohou zvýšit plazmatickou koncentraci sunitinibu
Současné podání jednorázové dávky sunitinibu se silným CYP3A4 inhibitorem ketokonazolem způsobilo u zdravých dobrovolníků zvýšení hodnot Cmax a AUC0-a, komplexu (sunitinib + primární metabolit) o 49 %, respektive o 51%.
Současné podávání sunitinibu se silnými inhibitory CYP3A4 (např. ritonavir, itrakonazol, erytromycin, klarithromycin, grapefruitová šťáva) může zvýšit koncentraci látky sunitinib.
Kombinaci s inhibitory CYP3A4 je třeba se vyhnout nebo by se měl zvážit výběr alternativní současné medikace s žádným nebo minimálním potenciálem k inhibici CYP3A4.
Pokud to není možné, může být nutné snížit dávku přípravku SUTENT na denní minimum 37,5 mg pro GIST a MRCC nebo denní minimum 25 mg pro pNET. Tolerabilita musí být pečlivě sledována (viz bod 4.2).
Léčivé přípravky, které mohou snížit plazmatickou koncentraci sunitinibu
Současné podání jednorázové dávky sunitinibu s CYP3A4 induktorem rifampicinem způsobilo u zdravých dobrovolníků snížení hodnot Cmax a AUC0-<X) komplexu (sunitinib + primární metabolit) o 23 %, respektive o 46 %.
Současné podávání sunitinibu se silnými induktory CYP3A4 (např. dexametazon, fenytoin, karbamazepin, rifampicin, fenobarbital nebo rostlinnými přípravky, které obsahují třezalku tečkovanou /Hypericum perforatum) může snížit koncentraci sunitinibu. Je třeba se kombinaci s induktory CYP3A4 vyhnout nebo by se měl zvážit výběr alternativní současné medikace s žádným nebo minimálním potenciálem k indukci CYP3A4. Pokud to není možné, může být nutné zvýšit dávku přípravku SUTENT o přírůstky 12,5 mg (až na 87,5 mg na den pro GIST a MRCC nebo na 62,5 mg na den pro pNET). Tolerabilita musí být pečlivě sledována (viz bod 4.2).
4.6 Fertilita, těhotenství a kojení
U těhotných žen nebyly provedeny žádné studie se sunitinibem. Studie na zvířatech prokázaly reprodukční toxicitu včetně fetálních malformací (viz bod 5.3). Přípravek SUTENT lze v těhotenství nebo u všech žen, které nepoužívají dostatečně účinnou antikoncepci, použít pouze tehdy, když potenciální přínos léčby převáží potenciální riziko pro plod. Pokud pacientka užívá přípravek v průběhu těhotenství nebo v průběhu léčby otěhotní, měla by být upozorněna na potenciální riziko pro plod.
Ženy v plodném věku by měly být upozorněny, aby se v průběhu léčby sunitinibem vyvarovaly otěhotnění a užívaly proto účinnou antikoncepci.
Kojení
Sunitinib a/nebo jeho metabolity jsou vylučovány do mateřského mléka potkanů. Není známo, zda se sunitinib nebo jeho primární aktivní metabolit vylučují do lidského mateřského mléka. Protože léčivé látky jsou často do mateřského mléka vylučovány a z důvodu potenciálních závažných nežádoucích účinků u kojených dětí, neměly by ženy v průběhu užívání přípravku SUTENT kojit.
Fertilita
Z neklinických nálezů vyplývá, že mužská i ženská fertilita může být postižena léčbou sunitinibem (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Pacienti by měli být upozorněni, že během léčby sunitinibem se u nich mohou vyskytnout závratě.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejzávažnějšími nežádoucími účinky souvisejícími se sunitinibem, některé fatální, jsou renální selhání, srdeční selhání, plicní embolie, perforace střev a krvácení (např. krvácení do dýchacího traktu, gastrointestinální krvácení, krvácení do tumoru, močového traktu a mozku). K nejčastějším nežádoucím účinkům všech stupňů závažnosti (které prodělali pacienti s RCC, GIST a pNET v registračních studiích) patří snížení chuti k jídlu, poruchy chuti, hypertenze, únava, gastrointestinální poruchy (tj. průjem, nausea, stomatitida, dyspepsie a zvracení) změna barvy kůže a syndrom palmo-plantární erytrodysestézie. Tyto symptomy mohou zmizet v průběhu léčby. Hypothyreóza se může
rozvinout během léčby. Hematologické poruchy (např. neutropenie, trombocytopenie, a anemie) jsou mezi nejčastějšími nežádoucími účinky léku.
Jiné fatální účinky, než které jsou uvedeny v bodě 4.4 výše nebo v bodě 4.8 dále a které byly považovány za eventuálně související se sunitinibem, zahrnovaly multisystémové orgánové selhání, diseminovanou intravaskulární koagulaci, peritoneální krvácení, adrenální insuficienci, pneumotorax, šok a náhlé úmrtí.
Seznam nežádoucích účinků v tabulce
Nežádoucí účinky, které byly hlášeny u pacientů s GIST, MRCC a pNET do databáze souhrnných údajů ze studií s 7115 pacienty , jsou uvedeny níže podle orgánových systémů, četnosti a stupně závažnosti (NCI-CTCAE). Nežádoucí účinky identifikované v klinických studiích po uvedení na trh jsou rovněž zahrnuty. V každé skupině četnosti jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Četnosti jsou definovány jako velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000) není známo (z dostupných údajů nelze určit).
Tabulka 1 - Nežádoucí účinky hlášené v klinických studiích
|
Třída orgánového systému |
Velmi časté >1/10 |
Časté >1/100 až <1/10 |
Méně časté >1/1 000 až <1/100 |
Vzácné >1/10 000 až <1/1 000 |
|
Infekce a infestace |
Virové infekce3 Respirační infekceb* Absces1^* Mykotické infekced Infekce močových cest Kožní infekcee Sepse£* |
Nekrotizující fasciitida* Bakteriální infekceg | ||
|
Poruchy krve a lymfatického systému |
Neutropenie Trombocytopenie Anemie Leukopenie |
Lymfopenie |
Pancytopenie |
Trombotická mikroangiopatieh* |
|
Poruchy imunitního systému |
Hypersenzitivita |
Angioedém | ||
|
Endokrinní poruchy |
Hypotyreóza |
Hypertyreóza |
Zánět štítné žlázy | |
|
Poruchy metabolismu a výživy |
Snížená chuť k jídlu |
Dehydratace Hypoglykemie |
Syndrom lýzy tumoru* | |
|
Psychiatrické poruchy |
Insomnie | |||
|
Poruchy nervového systému |
Závrať Bolest hlavy Poruchy chutiJ |
Periferní neuropatie Parestézie Hypestézie Hyperestézie |
Krvácení do mozku Cévní mozková příhoda Tranzitorní ischemická ataka |
Syndrom posteriorní reverzibilní encefalopatie |
|
Poruchy oka |
Periorbitální otok Otok očních víček Zvýšené slzení |
|
Třída orgánového systému |
Velmi časté >1/10 |
Časté >1/100 až <1/10 |
Méně časté >1/1 000 až <1/100 |
Vzácné >1/10 000 až <1/1 000 |
|
Srdeční poruchy |
Ischemie myokarduk* Snížení ejekční frakce’ |
Městnavé srdeční selhání Infarkt myokardum’ Srdeční selhání Kardiomyopatie Perikardiální efúze Prodloužený interval QT na elektrokardiogram u |
Selhání levé komory Torsade de pointes | |
|
Cévní poruchy |
Hypertenze |
Hluboká žilní trombóza Návaly horka Zarudnutí |
Nádorové krvácení | |
|
Respirační, hrudní a mediastinální poruchy |
Epistaxe |
Plicní embolie Pleurální efuze Hemoptýza Námahová dušnost Orofaryngeální bolestn Překrvení nosní sliznice Sucho v nose |
Krvácení do plic* Respirační selhání* | |
|
Gastrointestin ální poruchy |
Stomatitida0 Abdominální bolestp Zácpa |
Gastroezofageální reflux Dysfagie Krvácení do trávicího traktu Ezofagitida Břišní distenze Břišní diskomfort Rektální krvácení Krvácení dásní Vředy v ústech Proktalgie Cheilitida Hemoroidy Glosodynie Bolest úst Sucho v ústech Flatulence Nepříjemný pocit v ústech Říhání |
Gastrointestinální perforaceq’ Pankreatida Anální píštěl | |
|
Poruchy jater a žlučových cest |
Jaterní selhání* Cholecystitidar’ Abnormální funkce jater |
Hepatitida |
|
Třída orgánového systému |
Velmi časté >1/10 |
Časté >1/100 až <1/10 |
Méně časté >1/1 000 až <1/100 |
Vzácné >1/10 000 až <1/1 000 |
|
Poruchy kůže a podkožní tkáně |
Kožní diskoloraces Syndrom palmoplantární erytrodysestézie Změny barvy vlasů Suchá pokožka |
Odlupování kůže Kožní reakceu Ekzém Puchýře Erytém Alopecie Akné Pruritus Hyperpigmentace kůže Kožní léze Hyperkeratóza Dermatitida Poruchy nehtův |
Erythema multiforme Stevens-Johnsonův syndrom Pyoderma gangrenosum Toxická epidermální nekrolýza | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolest v končetinách Artralgie |
Muskuloskeletální bolest Svalové spasmy Myalgie Svalová slabost |
Osteonekróza čelisti Píštěl* |
Rabdomyolýza* Myopatie |
|
Poruchy ledvin a močových cest |
Renální selhání Akutní renální selhání Chromaturie Proteinurie |
Krvácení do močového traktu |
Nefrotický syndrom | |
|
Celkové poruchy a reakce v místě aplikace |
Zánět sliznice Únavaw Otokx Horečka |
Bolest na hrudi Bolest Onemocnění podobné chřipce |
Porucha hojení | |
|
Vyšetření |
Pokles tělesné hmotnosti Pokles počtu leukocytů Zvýšení lipázy Pokles počtu trombocytů Pokles hemoglobinu Zvýšená amylázay Zvýšená aspartátaminotransferáz a Zvýšená alaninaminotransferáza Zvýšený kreatinin v krvi Zvýšený krevní tlak Zvýšená kyselina močová v krvi |
Zvýšená kreatinfosfokináza v krvi Zvýšení tyreostimulačního hormonu (TSH) |
Následující pojmy kombinují: a Nazofaryngitidu a herpes úst
b Bronchitidu, infekci dolních cest dýchacích, pneumonii a infekci dýchacích cest c Absces, absces končetiny, anální absces, gingivální absces, jaterní absces, absces pankreatu, perineální absces, perirektální absces, absces konečníku, subkutánní absces a zubní absces d Ezofageální kandidózu a orální kandidózu
e Celulitidu a kožní infekci
f Sepsi a septický šok
g Abdominální absces, abdominální sepsi, divertikulitidu a osteomyelitidu
Trombotická mikroangiopatie, trombotická trombocytopenická purpura, hemolyticko-uremický syndrom
h
i
J
k
l
m
n
o
P
q
r
s
t
u
v
w
x
y
*
Sníženou chuť k jídlu a anorexii Dysgeuzii, ageuzii a poruchy chuti
Akutní koronární syndrom, anginu pectoris, nestabilní anginu pectoris, okluzi koronární arterie, ischemii myokardu Sníženou/abnormální ejekční frakci
Akutní infarkt myokardu, infarkt myokardu, němý infarkt myokardu Orofaryngeální a faryngolaryngeální bolest Stomatitidu a aftózní stomatitidu
Bolest břicha, bolest dolní poloviny břicha a bolest horní poloviny břicha
Gastrointestinální perforaci a intestinální perforaci
Cholecystitidu a akalkulózní cholecystitidu
Zežloutnutí kůže, změnu barvy kůže a poruchu pigmentace
Psoriatiformní dermatitidu, exfoliativní vyrážku, vyrážku, erytematózní vyrážku, folikulární vyrážku, generalizovanou vyrážku, makulózní vyrážku, makulopapulózní vyrážku a svědící vyrážku
Kožní reakci a kožní poruchu Poruchu nehtů a diskoloraci nehtu Únava a astenie
Otok obličeje, otok a periferní otok.
Amyláza a zvýšená amyláza Včetně fatálních příhod
Popis vybraných nežádoucích reakcí
Infekce a infestace: Byly hlášeny případy závažných infekcí (s neutropenií nebo bez ní) včetně případů končících smrtí. Byly hlášeny případy nekrotizující fasciitis, včetně perinea, někdy s fatálním průběhem (viz rovněž bod 4.4).
Poruchy krve a lymfatického systému: Byly hlášeny případy trombotické mikroangiopatie, v některých případech s fatálními následky (viz rovněž bod 4.4).
Poruchy imunitního systému: Byly hlášeny hypersenzitivní reakce, včetně angioedému.
Poruchy nervového systému: Bylo hlášeno několik případů pacientů se záchvaty a radiologickým potvrzením reverzibilního syndromu okcipatální leukoencefalopatie (RPLS). Některé případy měly fatální průběh (viz rovněž bod 4.4).
Poruchy metabolismu a výživy: U pacientů s pNET byla hlášena zvýšená míra výskytu případů hypoglykemie v porovnání s pacienty s MRCC a GIST. Nicméně většina těchto nežádoucích účinků pozorovaných v klinických studiích nebyla posuzována jako související se studijní léčbou.
Poruchy jater a žlučových cest: Byla hlášena jaterní dysfunkce, ta může zahrnovat abnormální jaterní funkční testy, hepatitidu nebo jaterní selhání.
Poruchy kůže a podkožní tkáně: Byly hlášeny případy pyoderma gangrenosum, zpravidla reverzibilní po přerušení léčby (viz také bod 4.4).
Poruchy svalové a kosterní soustavy a pojivové tkáně: Byly hlášeny případy myopatie a/nebo rabdomyolýzy, některé s akutním renálním selháním. Pacienti se známkami nebo příznaky svalové toxicity by měli být léčeni podle standardů lékařské praxe.
Byly hlášeny případy vzniku píštěle, někdy spojené s nekrózou a regresí tumoru, u některých případů byl hlášen fatální průběh.
Byly hlášeny případy osteonekrózy čelisti (ONJ) u pacientů léčených přípravkem SUTENT, většina z nich se objevila u pacientů, u kterých bylo identifikováno riziko ONJ, zejména expozice intravenózním bisfosfonátům a/nebo dentální choroba vyžadující invazivní dentální zákrok v anamnéze (viz rovněž bod 4.4).
Pediatrická populace
Byla provedena studie perorálně podávaného sunitinibu I. fáze s eskalací dávky u 35 pediatrických a mladých dospělých pacientů (věk 2-21 let) s refrakterními solidními tumory, kdy většina z nich měla mozkový tumor jako primární diagnózu. U všech účastníků studie se projevily nežádoucí účinky léku a u pacientů s předchozí expozicí účinkům antracyklinů nebo ozařování srdce byly tyto účinky závažné (stupeň toxicity >3) a zahrnovaly i srdeční toxicitu. Riziko srdečních nežádoucích účinků léku se jeví vyšší u pediatrických pacientů s předchozí expozicí účinkům srdečního ozařování a antracyklinu v porovnání s pacienty, u nichž k předchozí expozici nedošlo. Pro tuto populaci pacientů nebyla určena žádná maximální tolerovaná dávka sunitinibu vzhledem k toxicitám limitujícím dávku (viz bod 5.1). U pediatrických pacientů bez předchozí expozice antracyklinům nebo srdečnímu ozařování byly nejčastějšími nežádoucími účinky gastrointestinální toxicita, neutropenie, únava a zvýšená hodnota ALT.
Na základě populační analýzy farmakokinetiky (PK) a farmakokinetiky a farmakodynamiky (PK/PD) se předpovídá, že sunitinib v dávkách 25 mg/m2/den v režimu 4/2 u pediatrických pacientů (věk 6-11 a 12-17 let) s GIST poskytne srovnatelné expozice léku v plazmě a následně i profily bezpečnosti a účinnosti s expozicemi u dospělých pacientů s GIST léčených 50 mg/m2/den v režimu 4/2.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Specifické antidotum při předávkování sunitinibem neexistuje a léčba by měla spočívat v obecných podpůrných opatřeních. Eliminace nevstřebané léčivé látky, je-li indikována, můžeme docílit zvracením nebo výplachem žaludku. Byly hlášeny případy předávkování, některé byly spojeny s nežádoucími účinky odpovídajícími bezpečnostnímu profilu sunitinibu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antineoplastika, inhibitor protein-tyrosinkináz, ATC kód: L01XE04 Mechanismus účinku
Sunitinib-malát působí jako inhibitor mnoha receptorových tyrosinkináz, které se podílejí na růstu tumoru, patologické angiogenezi a metastatické progresi karcinomu. Sunitinib byl identifikován jako inhibitor receptorů pro růstový faktor z destiček (PDGFRa a PDGFRP), receptorů pro vaskulární endoteliální růstový faktor (VEGFR1, VEGFR2 a VEGFR3), receptoru faktoru kmenových buněk (KIT), Fms-podobné tyrosinkinázy 3 (Fms-like tyrosine kinase-3 = FLT3), receptoru kolonie stimulujícího faktoru (CSF-1R) a receptoru pro neurotrofický faktor odvozený od gliálních buněk (glial cell-line derived neurotrophic factor receptor = RET). Primární metabolit vykazoval v biochemických a buněčných analýzách podobnou účinnost jako sunitinib.
Klinická účinnost a bezpečnost
Klinická bezpečnost a účinnost přípravku SUTENT byla zkoumána v léčbě pacientů s maligním gastrointestinálním stromálním tumorem (GIST), kteří byli rezistentní k imatinibu (tj. byla u nich zaznamenána progrese choroby v průběhu nebo následně po léčbě imatinibem) nebo imatinib netolerovali (tj. byla u nich zaznamenána významná toxicita v průběhu léčby látkou imatinib, která znemožnila další léčbu), v léčbě pacientů s metastatickým adenokarcinomem ledviny (MRCC) a v léčbě pacientů s neresekovatelným pNET.
Účinnost přípravku je založena na době do progrese tumoru (time to tumor progression = TTP) a zvýšení přežití u GIST, na přežití bez známek progrese (PFS - progression free survival) a na míře objektivní odpovědi (ORR - Objective Response Rates) u nepředléčeného a/nebo na cytokiny refrakterního MRCC, a na přežití bez známek progrese u pNET.
Gastrointestinální stromální tumory (GIST)
Počáteční, otevřená fáze dávku zvyšující studie byla provedena u pacientů s GIST poté, co selhala léčba imatinibem v důsledku resistence nebo intolerance (medián maximální denní dávky 800 mg). Devadesát sedm pacientů bylo zařazeno v různých dávkách a režimech; 55 pacientů dostávalo 50 mg v doporučeném léčebném režimu 4 týdny s léčbou /2 týdny bez léčby („režim 4/2“).
V této studii byl medián času do progrese (TTP) 34,0 týdnů (95% CI = 22,0 - 46,0 týdnů).
Fáze III randomizované, dvojitě zaslepené, placebem kontrolované studie sunitinibu byla provedena u pacientů s GIST , kteří netolerovali imatinib nebo u nich byla zaznamenána progrese choroby v průběhu nebo následně po léčbě látkou imatinib (medián maximální denní dávky 800 mg). V této studii bylo randomizováno 312 pacientů (2:1) buď na léčbu 50 mg sunitinibu, nebo placebem perorálně jednou denně v režimu 4/2 až do progrese choroby nebo odstoupení ze studie z jiného důvodu (207 pacientů užívalo sunitinib a 105 pacientů užívalo placebo). Primární hodnocenou proměnnou účinnosti této studie byl čas do progrese tumoru (time to tumor progression = TTP) definovaný jako čas od randomizace do první zaznamenané objektivní progrese nádoru.
V době předem specifikované průběžné analýzy byl medián TTP u sunitinibu 28,9 týdnů (95% CI = 21,3 - 34,1 týdnů) jako výsledek hodnocení zkoušejícími a 27,3 týdnů (95% CI = 16,0 - 32,1 týdnů) jako výsledek hodnocení nezávislými posuzovateli, což bylo statisticky významně déle než hodnota TTP, která byly zaznamenána při užívání placeba, a to 5,1 týdnů (95% CI = 4,4-10,1 týdnů) jako výsledek hodnocení zkoušejícími a 6,4 týdnů (95% CI = 4,4 - 10,0 týdnů) jako výsledek hodnocení nezávislými posuzovateli. Rozdíl v celkovém přežití byl statisticky příznivější pro pacienty užívající sunitinib [poměr rizika: 0,491 (95% interval spolehlivosti: 0,290 - 0,831)], riziko úmrtí bylo ve skupině placeba dvakrát vyšší než ve skupině léčené sunitinibem.
Následně po průběžné analýze účinnosti a bezpečnosti byla studie na doporučení nezávislé komise DSMB (Data Safety Monitoring Board) odslepena a pacientům ve skupině s placebem byla následně nabídnuta odslepená léčba sunitinibem.
Sunitinib užívalo celkem 255 pacientů v odslepené fázi léčby, včetně 99 pacientů, kteří původně dostávali placebo.
Analýza primárních a sekundárních hodnocených proměnných v odslepené fázi studie opětovně potvrdila výsledky získané v době průběžné analýzy, tak jak ukazuje níže uvedená tabulka:
Tabulka 2 - Souhrn hodnocených veličin (ITT populace)
Dvojitě zaslepená léčba a
|
Medián (95% CI) |
Poměr rizika |
Placebová | |||
|
cross-over | |||||
|
skupina | |||||
|
Hodnocená veličina |
SUTENT |
Placebo |
(95% CI) |
p |
Léčbab |
|
Primární: | |||||
|
TTP (týdny) Průběžná |
27,3 (16,0 až |
6,4 (4,4 až 10,0) |
0,329 (0,233 až |
<0,001 | |
|
Závěrečná |
32,1) 26,6 (16,0 až |
6,4 (4,4 až 10,0 ) |
0,466) 0,339 (0,244 až |
<0,001 |
10,4 (4,3 až |
|
32,1) |
0,472) |
22,0) | |||
|
Sekundární | |||||
|
PFS (týdny)c Průběžná |
24,1 (11,1 až |
6,0 (4,4 až 9,9) |
0,333 (0,238 až |
<0,001 | |
|
Závěrečná |
28,3) 22,9 (10,9 až |
6,0 (4,4 až 9,7) |
0,467) 0,347 (0,253 až |
<0,001 | |
|
ORR (%)d |
28,0) |
0,475) | |||
|
Průběžná |
6,8 (3,7 až 11,1) |
0 (-) |
NA |
0,006 |
- |
|
Závěrečná |
6,6 (3,8 až 10,5) |
0 (-) |
NA |
0,004 |
10,1 (5,0 až |
|
OS (týdny)e Průběžná |
0,491 (0,290 až |
0,007 |
17,8) | ||
|
Závěrečná |
72,7 (61,3 až |
64,9 (45,7 až |
0,831) 0,876 (0,679 až |
0,306 | |
|
83,0) |
96,0) |
1,129) | |||
a Výsledky dvojitě zaslepené léčby na ITT populaci (intent-to-treat population, populace léčená dle původního léčebného záměru) s užitím centrálního radiologického vyhodnocení, jak požadováno
b Výsledky účinnosti na 99 pacientech, kteří přešli po odslepení z léčebné větve s placebem na léčbu přípravkem SUTENT. Vstupní hodnocení bylo opětovně provedeno v době cross-overu zkoušejícím.
c Průběžné číselné hodnoty PFS byly aktualizovány na základě přepočtu původních dat
d Výsledky míry objektivní odpovědi (ORR) jsou stanoveny jako procento pacientů, u nichž byla
potvrzena odpověď s 95% intervalem spolehlivosti. e Medián nebyl doposud dosažen, protože zatím nebyla získána všechna data.
Medián celkového přežití (OS, overall survival) u ITT populace byl 72,7 týdnů ve skupině léčené sunitinibem a 64,9 týdnů ve skupině s placebem (HR 0.876, 95% CI: 0,679 - 1,129, p = 0,306).
V rámci této analýzy byli do skupiny s placebem zahrnuti i pacienti randomizovaní původně do této skupiny, kteří následně obdrželi odslepenou léčbu sunitinibem.
Nepředléčený metastatický renální karcinom (MRCC)
Fáze III randomizované, multicentrické, mezinárodní studie hodnotící účinnost a bezpečnost sunitinibu v porovnání s interferonem-a byla provedena u pacientů s nepředléčeným MRCC. Bylo randomizováno 750 pacientů do léčebných ramen v poměru 1:1; byli léčeni buď sunitinibem v opakovaných 6-týdenních cyklech, sestávajících z perorálního podávání 50 mg denně po dobu 4 týdnů, po kterých následuje 2-týdenní pauza (režim 4/2) nebo interferon-a podávaný subkutánní injekcí v dávce 3 miliony jednotek (million units - MU) první týden, 6 MU druhý týden a 9 MU třetí týden a dále 3krát týdně v po sobě nenásledujících dnech.
Medián délky trvání léčby byl 11,1 měsíců (rozmezí: 0,4 - 46,1) u léčby sunitinibem a 4,1 měsíců (rozmezí: 0,1 - 45,6) u léčby interferonem- a. Závažné nežádoucí účinky spojené s léčbou (TRSAEs)
byly hlášeny u 23,7 % pacientů, kteří dostávali sunitinib, a u 6,9 % pacientů, kteří dostávali interferon-a. Z důvodu nežádoucích účinků byla léčba ukončena ve 20 % u sunitinibu a 23 % u interferonu-a. K přerušení léčby došlo u 202 pacientů (54 %) užívajících sunitinib a u 141 pacientů (39 %) užívajících interferon-a. Ke snížení dávky došlo u 194 pacientů (52 %) užívajících sunitinib a u 98 pacientů (27 %) užívajících interferon-a. Pacienti byli léčeni až do progrese onemocnění nebo vyřazení ze studie. Primární hodnocenou proměnnou účinnosti bylo přežití bez známek progrese (PFS - progression free survival). Plánovaná průběžná analýza ukázala statisticky signifikantní převahu sunitinibu oproti interferonu-a, v této studii byl medián PFS pro skupinu léčenou sunitinibem 47,3 týdnů v porovnání s 22,0 týdny pro skupinu léčenou interferonem -a; poměr rizika byl 0,415 (95% interval spolehlivosti: 0,320 - 0,539, p-hodnota <0,001). Ostatní cíle zahrnovaly míru objektivní odpovědi na léčbu (ORR, objective response rate), celkové přežití (OS, overall survival) a bezpečnost. Základní radiologické hodnocení bylo ukončeno po dosažení primárního hodnoceného cíle. V závěrečné analýze byla míra objektivní odpovědi na léčbu jako výsledek hodnocení zkoušejícími v rameni se sunitinibem 46 % (95% CI: 41 - 51) a v rameni s interferonem-a 12,0 % (95% CI: 9 - 16), (p<0,001).
Léčba sunitinibem byla spojena s delším přežitím v porovnání s interferonem-a. Medián celkového přežití (OS) byl 114,6 týdnů v rameni se sunitinibem (95% CI: 100,1 - 142,9 týdnů) a 94,9 týdnů v rameni s interferonem-a (95% CI: 77,7 - 117,0 týdnů) s poměrem rizika 0,821 (95% CI: 0,673 -1,001; p = 0,0510 podle nestratifikovaného log-rank testu).
Celková doba přežití bez progrese (overall PFS) a celkové přežití (OS), pozorované u ITT populace, která byla vyšetřena základním radiologickým laboratorním hodnocením, jsou shrnuty níže v tabulce:
Tabulka 3 - Souhrn cílů účinnosti (ITT populace)
|
Přehled doby přežití bez progrese (PFS) |
Sunitinib (n = 375) |
IFN-a (n = 375) |
|
Subjekt hodnocení, u kterého nenastala progrese |
161 (42,9) |
176 (46,9) |
|
nebo nezemřel [n (%)] | ||
|
Subjekt hodnocení, u kterého byla pozorována |
214 (57,1) |
199 (53,1) |
|
progrese nebo zemřel [n (%)] | ||
|
Přežití bez progrese (PFS, týdny) | ||
|
Kvartil (95% CI) | ||
|
25% |
22,7 (18,0 až 34,0) |
10,0 (7,3 až 10,3) |
|
50% |
48,3 (46,4 až 58,3) |
22,1 (17,1 až 24,0) |
|
75% |
84,3 (72,9 až 95,1) |
58,1 (45,6 až 82,1) |
|
Nestratifikovaná analýza | ||
|
Poměr rizika (sunitinib vs IFN-a) |
0,5268 | |
|
95% CI pro poměr rizika |
(0,4316 až 0,6430) | |
|
p-hodnotaa |
<0,0001 | |
|
a z dvoustranného log-rank testu | ||
|
Přehled celkového přežití (OS) |
Sunitinib |
IFN-a |
|
(n = 375) |
(n = 375) | |
|
U subjektu hodnocení není známo, zda zemřel |
185 (49,3) |
175 (46,7) |
|
[n (%)] | ||
|
Sledovaný subjekt hodnocení zemřel [n (%)] |
190 (50,7) |
200 (53,3) |
|
Celkové přežití (OS, týdny) | ||
|
Kvartil (95% CI) | ||
|
25% |
56,6 (48,7 až 68,4) |
41,7 (32,6 až 51,6) |
|
50% |
114,6 (100,1 až 142,9) |
94,9 (77,7 až 117,0) |
|
75% |
NA (NA až NA) |
NA (NA až NA) |
|
Nestratifikovaná analýza | ||
|
Poměr rizika (sunitinib vs IFN-a) |
0,8209 | |
|
95% CI pro poměr rizika |
(0,6730 až 1,0013) | |
|
p-hodnotaa |
0,0510 | |
a z dvoustranného log-rank testu NA: není k dispozici (nedosaženo)
Na cytokiny refrakterní metastatický adenokarcinom ledviny (MRCC)
Fáze II studie přípravku SUTENT byla provedena u pacientů, kteří byli refrakterní k předchozí cytokinové léčbě interleukinem-2 nebo interferonem-a. Šedesát tři pacientů užívalo zahajovací dávku 50 mg přípravku SUTENT perorálně jednou denně po dobu 4 po sobě jdoucích týdnů, následovaných 2 týdny bez léčby tak, aby byl zachován úplný 6-týdenní cyklus (režim 4/2). Primární hodnocenou proměnnou účinnosti byla míra objektivní odpovědi (Objective Response Rates = ORR) vycházející z kritérií hodnocení odpovědi u solidních tumorů (Response Evaluation Criteria in Solid Tumor = RECIST).
V této studii byla míra objektivní odpovědi 36,5% (95% interval spolehlivosti: 24,7 - 49,6) a medián času do progrese (TTP) 37,7 týdnů (95% interval spolehlivosti: 24,0 - 46,4).
Potvrzující, otevřená, jednoramenná, multicentrická studie hodnotící účinnost a bezpečnost přípravku SUTENT byla provedena u pacientů s MRCC, kteří byli refrakterní k předchozí cytokinové terapii.
Sto šest pacientů užívalo minimálně jednu 50 mg dávku přípravku SUTENT v režimu 4/2.
Primární hodnocenou proměnnou účinnosti této studie byla míra objektivní odpovědi (ORR). Sekundární hodnocené proměnné zahrnovaly TTP, trvání odpovědi (duration of response = DR) a celkové přežití (overall survival = OS).
V této studii byla míra objektivní odpovědi 35,8 % (95% interval spolehlivosti: 26,8 - 47,5). Medián DR a OS nebyl zatím dosažen.
Pankreatické neuroendokrinní tumory (pNET)
Podpůrné nezaslepené multicentrické klinické hodnocení fáze 2 stanovilo účinnost a bezpečnost podávání sunitinibu 50 mg denně (v monoterapii) podle plánu 4/2 (4 týdny léčby, 2 týdny přestávky v léčbě) u pacientů s neresekovatelnými pNET. U kohorty 66 pacientů, kteří měli tumor z ostrůvkových buněk pankreatu, byla odpověď na léčbu 17% (primární cíl).
Hlavní multicentrické, mezinárodní, randomizované, dvojitě zaslepené, placebem kontrolované klinické hodnocení fáze 3 podání sunitinibu (v monoterapii) bylo provedeno u pacientů s neresekovatelnými pNET.
Pacienti museli mít zdokumentovanou progresi onemocnění podle RECIST kritérií během předcházejících 12 měsíců. Pacienti byli dále randomizováni (1:1) a užívali buď sunitinib v dávce 37,5mg jednou denně bez plánované přestávky v terapii (n = 86), nebo placebo (n = 85).
Primárním cílem bylo porovnat délku přežití bez progrese onemocnění (progression-free survival-PFS) u pacientů, kteří užívali sunitinib, oproti pacientům, kteří užívali placebo. Dalším cílem bylo porovnat celkové přežití (overall survival-OS), odpověď na léčbu (objective response rate-ORR), hodnocení léčby pacientem (patient-reported outcome-PRO) a bezpečnost užívání daného přípravku.
Demografické údaje mezi skupinou užívající sunitinib a skupinou užívající placebo byly srovnatelné. Navíc 49 % pacientů, kteří užívali sunitinib, mělo endokrinně nefunkční tumor, oproti 52 % pacientů, kteří užívali placebo. 92 % pacientů z obou skupin mělo jaterní metastázy.
Použití analog somatostatinu bylo v tomto klinickém hodnocení povoleno.
Celkově 66 % pacientů, kteří užívali sunitinib, podstoupilo dříve systémovou léčbu, ve srovnání se 72 % pacientů, kteří užívali placebo. Navíc 24 % pacientů, kteří užívali sunitinib, podstoupilo léčbu analogy somatostatinu ve srovnání s 22 % pacientů, kteří užívali placebo.
Bylo pozorováno klinicky signifikantní zlepšení PFS dle hodnocení zkoušejících při užívání sunitinibu ve srovnání s placebem. Medián PFS byl 11,4 měsíců ve skupině, která užívala sunitinib, ve srovnání s 5,5 měsíci ve skupině, která užívala placebo [hazard ratio (poměr rizika pro definovanou kohortu k průměrnému riziku populace): 0,418 (95% CI: 0,263, 0,662) p = 0,0001)]; podobné výsledky progrese onemocnění byly pozorovány, když hodnocení léčebné odpovědi bylo založeno na aplikaci RECIST kritérií na hodnocení velikosti tumoru zkoušejícími - viz tabulka 4. Míra rizika (Hazard Ratio) favorizující použití sunitinibu byla pozorována u všech podskupin podle hodnocených základních charakteristik včetně počtu předchozích systémových terapií. Celkově 29 pacientů v rameni sunitinib a 24 v rameni s placebem nepodstoupilo dříve žádnou systémovou léčbu; mezi těmito pacienty byla míra rizika (hazard ratio) pro PFS 0,365 (95% CI: 0,156, 0,857), p = 0,0156. Podobně u 57 pacientů v rameni se sunitinibem (28 pacientů s jednou předcházející systémovou léčbou a 29 pacientů se dvěma nebo více předchozími systémovými léčbami) a 61 pacientů v rameni s placebem (25 pacientů s jednou předcházející systémovou léčbou a 36 pacientů se dvěma nebo více předchozími systémovými léčbami), bylo hazard ratio pro PFS 0,456 (95% CI: 0,264, 0,787), p = 0,0036.
Analýza senzitivity pro PFS byla vedena tam, kde byla progrese založena na hodnocení velikosti nádoru investigátory a kde všechny subjekty cenzorované z jiných důvodů než ukončení studie byly léčeny jako případy s PFS. Tato analýza poskytla konzervativní odhad/hodnocení léčebného účinku sunitinibu a podpořila primární analýzu, demonstrující míru rizika (hazard ratio) 0,507 (95% CI:
0,350, 0,733), p = 0,000193. Pivotní studie u pankreatických NET byla ukončena předčasně na doporučení nezávislé komise DMC (Drug Monitoring Committee) a primární cíl byl založen na hodnocení investigátorů, obojí mohlo ovlivnit odhadovaný léčebný efekt.
V zájmu vyřazení bias v hodnocení PFS zkoušejícími byla provedena zaslepená nezávislá centrální revize CT scanů, která podpořila hodnocení zkoušejících, jak ukazuje tabulka 4.
Tabulka 4 - Účinnost u pNET - výsledky studie fáze 3
|
Parametr účinnosti |
SUTENT (n = 86) |
Placebo (n = 85) |
Míra rizika (95% CI) |
P-hodnota |
|
Přežití bez známek progrese (PFS) podle hodnocení investigátorů [medián, měsíce (95% CI)] |
11,4 (7,4, 19,8) |
5,5 (3,6, 7,4) |
0,418 (0,263, 0,662) |
0,0001a |
|
Přežití bez známek progrese (PFS) [medián, měsíce (95% CI)] podle hodnocení založeném na aplikaci RECIST kritérií na hodnocení velikosti tumoru investigátory |
12,6 (7,4, 16,9) |
5,4 (3,5, 6,0) |
0,401 (0,252, 0,640) |
0,000066a |
|
Přežití bez známek progrese (PFS) [medián, měsíce (95% CI)] podle zaslepené nezávislé centrální revize hodnocení tumoru |
12,6 (11,1, 20,6) |
5,8 (3,8, 7,2) |
0,315 (0,181, 0,546) |
0,000015a |
|
Celkové přežití [5leté sledování] [medián, měsíce (95% CI)] |
38,6 (25,6, 56,4) |
29,1 (16,4, 36,8) |
0,730 (0,504, 1,057) |
0,0940a |
|
Míra objektivní odpovědi [%, (95% CI)] |
9,3 (3,2, 15,4) |
0 |
NA |
0,0066b |
CI=interval spolehlivosti, HR=poměr rizika, NA=není k dispozici a dvoustranný nestratifikovaný log-rank test
b Fisher’s Exact test
Obrázek 1 - PFS analýza ve studii fáze 3 u pNET - Kaplan-Meier analýza
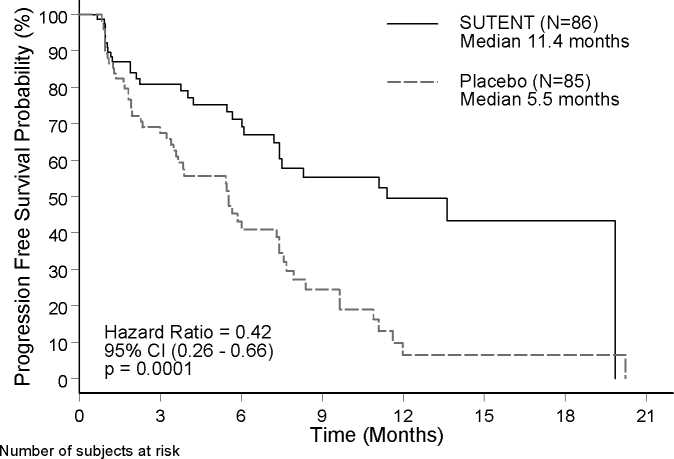
SUTENT 86 52 34 20 15 4 2
Placebo 85 42 20 9 2 2 2
osa x = Čas (Měsíce); osa y = Pravděpodobnost přežití bez známek progrese (%); -Sutent (N=86)
Medián 11,4 měsíců
------Placebo (N=85) Medián 5,5 měsíců; Poměr rizika = 0,42 95% CI (0,26 - 0,66) p = 0,0001
Počet subjektů s rizikem
Data pro celkové přežití v době ukončení studie [20,6 měsíců (95% interval spolehlivosti 20,6,medián nedosažen) pro rameno se sunitinibem oproti NR (nedosaženo) v ramenu s placebem (95% interval spolehlivosti 15,5, medián nedosažen) poměr rizika: 0,409 (95% interval spolehlivosti: 0,187, 0,894), p = 0,0204] nebyla konečná. V rameni sunitinibu bylo hlášeno 9 úmrtí, v rameni placeba 21 úmrtí.
Při progresi onemocnění byli pacienti odslepeni a pacientům ve skupině s placebem byla nabídnuta léčba sunitinibem v rozšířené open-label studii. V důsledku předčasného ukončení studie byla všem zbývajícím pacientům nabídnuta léčba sunitinibem v této rozšířené open -label studii. Celkově 59 z 85 (69,4 %) pacientů z ramene s placebem přešlo do open-label studie se sunitinibem, která byla určená pro pacienty po progresi onemocnění nebo pro pacienty, kteří po odslepení na konci studie, byli v rameni s placebem. Data celkového přežití pozorovaná po 5letém sledování v této rozšířené open-label studii ukázala poměr rizika 0,730 (95% interval spolehlivosti 0,504, 1,057).
Výsledky z European Organization for Research and Treatment of Cancer Quality of Life Questionnaire (EORTC QLQ-C30) ukázaly, že celková se zdravím související kvalita života a pět oblastí činností (fyzická, funkční, kognitivní, emocionální a společenská) byly u pacientů léčených sunitinibem zachována ve srovnání s placebem s limitovaným výskytem nežádoucích účinků.
Pediatrická populace
Zkušenosti s používáním sunitinibu u pediatrických pacientů jsou omezené (viz bod 4.2 Pediatrická populace).
Byla provedena studie perorálně podávaného sunitinibu I. fáze s eskalací dávky u pediatrických a mladých dospělých pacientů (věk 2-21 let) s refrakterními solidními tumory, kdy většina z nich měla při zařazení mozkový tumor jako primární diagnózu. V první části studie byla pozorována dávku limitující kardiotioxicita, a proto byla studie pozměněna, aby vyloučila pacienty s předchozí expozicí potenciálně kardiotoxickým terapiím (včetně antracyklinů) nebo ozařování srdce. V druhé části studie zahrnující pacienty s předchozí protinádorovou léčbou, ale bez rizikových faktorů pro srdeční toxicitu byl sunitinib všeobecně dobře snášen a klinicky zvladatelný při dávce 15 mg/m2/den v režimu 4/2. Žádný ze subjektů hodnocení nedosáhl úplné odpovědi nebo částečné odpovědi. Stabilní onemocnění bylo pozorováno u 6 pacientů (17 %). Jeden pacient s GIST byl zařazen s úrovní dávky 15 mg/m2, aniž by se prokázal jakýkoliv přínos. Pozorované nežádoucí účinky léku byly celkově podobné účinkům pozorovaným u dospělých (viz bod 4.8).
Populační analýza PK a PK/PD byla provedena v daném rozsahu s cílem extrapolovat cílové parametry PK a klíčové parametry bezpečnosti a účinnosti sunitinibu na pediatrické pacienty s GIST (věková skupina 6-17 let). Tato analýza byla založena na údajích shromážděných od dospělých s GIST nebo solidními tumory a od pediatrických pacientů se solidními tumory. Na základě modelačních analýz se neprokázalo, že mladší věk a menší velikost těla negativně ovlivňují odpověď na expozici léku v plazmě z hlediska bezpečnosti a účinnosti. Neukázalo se, že poměr přínosů a rizika sunitinibu je negativně ovlivněn mladším věkem nebo menší velikostí těla, ale je hlavně určován expozicí léku v plazmě.
Na základě výsledků simulace klinického hodnocení PK, bezpečnosti a účinnosti se předpovídá, že výchozí dávka přibližně 25 mg/m2/den v režimu 4/2 u pediatrických pacientů s GIST (věk 6-11 a 1217 let) zajistí srovnatelné expozice léku v plazmě a následně bezpečnost a účinnosti jako expozice u dospělých pacientů s GIST léčených 50 mg/den v režimu 4/2.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem SUTENT u jedné nebo více podskupin pediatrické populace s gastrointestinálním stromálním tumorem (GIST), (viz bod 4.2 Pediatrická populace).
Evropská léková agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem SUTENT u všech podskupin pediatrické populace pro léčbu karcinomu ledviny a ledvinné pánvičky (s výjimkou nefroblastomu, nefroblastomatózy, sarkomu z jasných buněk, mezoblastického nádoru ledvin, renálního medulárního karcinomu a rabdomyosarkomu ledviny), (informace o použití u dětí viz bod 4.2).
Evropská léková agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem SUTENT u všech skupin pediatrické populace pro léčbu gastrických a pankreatických NET (s výjimkou neuroblastomu, neuroganglioblastomu, feochromocytomu), (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika látky sunitinib byla hodnocena u 135 zdravých dobrovolníků a u 266 pacientů se solidními tumory. Farmakokinetické parametry byly během testování podobné jak u zdravých dobrovolníků, tak u populace pacientů se všemi solidními tumory.
V dávkovacím rozmezí 25 až 100 mg rostly proporcionálně s dávkou jak plocha pod křivkou vývoje plazmatické koncentrace v čase (AUC), tak maximální koncentrace Cmax. Při opakovaném denním podávání se sunitinib akumuluje 3- až 4-krát a jeho primární aktivní metabolit 7- až 10-krát. Koncentrace sunitinibu v rovnovážném stavu a koncetrace jeho primárního aktivního metabolitu jsou dosaženy v průběhu 10-14 dní. 14. den je kombinovaná plazmatická koncentrace sunitinibu a jeho aktivního metabolitu 62,9 - 101 ng/ml, což je cílová koncentrace predikovaná z preklinických dat, která inhibuje fosforylační receptor in vitro a následně působí zastavení růstu nádoru či jeho redukci in vivo. Primární aktivní metabolit se podílí z 23-37% na celkové expozici. Během testování režimů opakovaných denních podávání či opakovaných dávkovacích cyklů nebyly pozorovány žádné signifikantní změny ve farmakokinetice sunitinibu či jeho primárního aktivního metabolitu.
Absorpce
Po perorálním podání sunitinibu jsou maximální koncentrace (Cmax) pozorovány obecně mezi 6 - 12 hodinami (Tmax) po podání.
Jídlo nemá žádný vliv na biologickou dostupnost sunitinibu.
Distribuce
Během studií in vitro vazba látky sunitinib a jeho primárního aktivního metabolitu na lidské plazmatické proteiny byla v in vitro vzorcích 95%, resp. 90% bez zjevné závislosti na koncentraci. Distribuční prostor sunitinibu (Vd) byl velký - 2230 l, což ukazuje na distribuci do tkání.
Metabolické interakce
In vitro počítané hodnoty Ki pro všechny zkoušené isoformy cytochromuCYP (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 a CYP4A9/11) prokázaly, že sunitinib a jeho primární aktivní metabolit pravděpodobně neindukují klinicky významnou měrou metabolismus jiných aktivních látek, které mohou být metabolizovány těmito enzymy.
Biotransformace
Sunitinib je primárně metabolizován izoformou cytochromu P450, CYP3A4, který vytváří jeho primární aktivní metabolit desethyl-sunitinib, který je dále metabolizován stejným izoenzymem.
Současnému podání sunitinibu se silnými CYP3A4 induktory či inhibitory by se mělo vyvarovat, neboť plazmatické hladiny sunitinibu mohou být alterovány (viz body 4.4 a 4.5).
Eliminace
Exkrece je primárně stolicí (61 %) s renální eliminací nezměněné aktivní látky a metabolitů představující 16 % podané dávky. V metabolickém profilu představoval sunitinib a jeho primární aktivní metabolit 91,5 %, 86,4 % a 73,8 % radioaktivity v plazmě, moči a ve stolici.
Nevýznamné metabolity byly identifikovány v moči a stolici, ale obecně nebyly nalezeny v plazmě. Celková perorální clearance (CL/F) byla 34-62 l/hod.
Po perorálním podání zdravým dobrovolníkům byl eliminační poločas sunitinibu a jeho primární aktivního desethyl-metabolitu přibližně 40 - 60 hodin a 80 - 110 hodin.
Zvláštní populace
Jaterní poškození: Sunitinib a jeho primární metabolit jsou metabolizovány převážně v játrech. Systémové expozice jednorázové dávky sunitinibu byly u pacientů s mírnou nebo středně závažnou poruchou jaterní funkce (stupeň A a B dle Childa-Pugha) v porovnání s pacienty s normální funkcí jater podobné. U pacientů se závažnou poruchou jaterní funkce stupně C dle Childa-Pugha nebyly studie s přípravkem SUTENT prováděny.
Ze studií s pacienty s karcinomem byli vyloučeni pacienti s ALT nebo AST >2,5 x ULN (horní hranice normálních hodnot), nebo > 5,0 x ULN v rámci jaterních metastáz.
Renální poškození: Analýza farmakokinetiky v populaci prokázala, že clearance sunitinibu (CL/F) nebyla ovlivněna clearancí kreatininu v hodnoceném rozmezí (42 - 347 ml/min).
Systémové expozice po jednotlivé dávce sunitinibu byly u subjektů se závažným renálním poškozením (CLcr < 30 ml/min) v porovnání se subjekty s normální funkcí ledvin (CLcr > 80 ml/min) podobné. Ačkoliv sunitinib a jeho primární metabolit nebyly u subjektů s ESRD hemodialýzou eliminovány, celkové systémové expozice byly ve srovnání se subjekty s normální funkcí ledvin nižší o 47 % u sunitinibu a o 31 % u jeho primárního metabolitu.
Tělesná hmotnost, stav výkonnosti: Farmakokinetické analýzy populací na základě demografických dat ukazují, že není nutná úprava počáteční dávky dle tělesné hmotnosti či statutu výkonnosti dle Eastern Cooperative Oncology Group (ECOG).
Pohlaví: Dostupná data ukazují, že ženy mohou mít asi o 30% nižší clearance sunitinibu (CL/F) než muži. Tento rozdíl však nutně nevyžaduje úpravy počátečních dávek.
Pediatrická populace: Zkušenosti s použitím sunitinibu u pediatrických pacientů jsou omezené (viz bod 4.2 Pediatrická populace). Byly dokončeny populační PK analýzy databáze souhrnných údajů od dospělých pacientů s GIST a solidními tumory a pediatrických pacientů se solidními tumory. Byly provedeny postupné modelační analýzy kovariát s cílem vyhodnotit vliv věku a velikosti těla (celková tělesná hmotnost nebo celková plocha těla) a rovněž dalších kovariát na důležité PK parametry sunitinibu a jeho aktivního metabolitu. Kromě testovaných kovariát týkajících se věku a velikosti těla byl významnou kovariátou pro clearance sunitinibu věk (čím mladší věk pediatrického pacienta, tím nižší clearance). Podobně byla významnou kovariátou pro clearance aktivního metabolitu i plocha tělesného povrchu (čím nižší plocha povrchu těla, tím nižší clearance). Na základě konečných výsledků simulace modelového klinického hodnocení PK, když se vezmou v úvahu všechny vlivy kovariát, byla vyslovena předpověď, že dávka sunitinibu 25 mg/m2/den v režimu 4/2 u pediatrických pacientů (věk 6-11 a 12-17 let) s GIST dosáhne srovnatelných expozic léku v plazmě jako expozice u dospělých pacientů s GIST léčených dávkou 50 mg/den v režimu 4/2.
5.3 Předklinické údaje vztahující se k bezpečnosti
Ve studiích toxicity s opakovanou dávkou prováděných u opic a potkanů trvajících až 9 měsíců byly primárně zjištěnými cílovými orgány nežádoucího působení gastrointestinální trakt (zvracení a průjem u opic), nadledvinky (kortikální kongesce a/nebo krvácení u potkanů a opic, s nekrózou následovanou fibrózou u potkanů), hemolymfopoetický systém (hypocelularita kostní dřeně, a lymfoidní deplece thymu, sleziny a lymfatických uzlin), exokrinní pankreas (degranulace acinárních buněk s ojedinělou nekrózou buněk), slinné žlázy (acinární hypertrofie), kosti/klouby (ztluštění epifyzárních štěrbin), děloha (atrofie) a ovária (snížený folikulární vývoj). Všechny nálezy se vyskytly po klinicky významné plazmatické expozici sunitinibu. Navíc účinky pozorované v jiných studiích zahrnovaly prodloužení QTc intervalu, snížení LVEF a testikulární tubulární atrofii, nárůst mezangiálních buněk v ledvinách, krvácení v gastrointestinálním traktu a ústní sliznici, hypertrofii buněk adenohypofýzy. Změny na děloze (atrofie endometria) a na epifyzárních štěrbinách (ztluštění metafýzy nebo dysplazie chrupavky) jsou považovány za související s farmakologickým účinkem sunitinibu. Většina těchto nálezů byla reverzibilní po 2 až 6 týdnech bez léčby.
Genotoxicita
Genotoxický potenciál sunitinibu byl hodnocen in vitro a in vivo. Při použití metabolické aktivace jater potkanů nebyl sunitinib mutagenní u bakterií. Sunitinib nevyvolal in vitro strukturální chromozomální aberace v lidských lymfocytech z periferní krve. Polyploidie (numerické chromozomální aberace) byla pozorována in vitro v lidských lymfocytech z periferní krve jak za přítomnosti, tak při absenci metabolické aktivace. Sunitinib nebyl klastogenní pro kostní dřeň potkanů in vivo. Účinek hlavního aktivního metabolitu na genetickou toxicitu nebyl hodnocen.
Kancerogenita
V jednoměsíční studii pro stanovení rozmezí perorální dávky (0, 10, 25, 75, nebo 200 mg/kg/den) za použití žaludeční sondy s kontinuálním denním dávkováním u rasH2 transgenních myší byly při nejvyšších testovaných dávkách (200 mg/kg/den) pozorovány karcinom a hyperplázie Brunnerových žláz duodena.
Byla prováděna 6-měsíční studie kancerogenity za použití žaludeční sondy s kontinuálním denním dávkováním (0, 8, 25, 75 [sníženo na 50] mg/kg/den) u rasH2 transgenních myší. Byly pozorovány gastroduodenální karcinomy, zvýšený výskyt hemangiosarkomů, a/nebo hyperplázie sliznice žaludku při dávkách > 25 mg/kg/den podávaných po dobu 1 nebo 6 měsíců (> 7,3 x AUC pacientů s doporučenou denní dávkou - RDD).
V 2-leté studii kancerogenity na potkanech (0, 0,33, 1, nebo 3 mg/kg/den) vedlo podání sunitinibu v 28-denních cyklech následované 7-denní pauzou bez dávky ke zvýšení výskytu feochromocytomů a hyperplázie dřeně nadledvin u samců potkanů dostávajících 3 mg/kg/den po dobu >1 roku (> 7,3 krát AUC pacientů s doporučenou denní dávkou - RDD). Karcinom Brunnerových žláz duodena se objevil při dávce > 1 mg/kg/den u samic a při dávce 3 mg/kg/den u samců. Hyperplázie sliznice žaludku byla patrná při dávce 3 mg/kg/den u samců respektive se objevila při > 0,9, 7,8 a 7,8 násobku AUC pacientů s doporučenou denní dávkou - RDD. Význam neoplastických zjištění pozorovaných u rasH2 transgenních myší a ve studiích kancerogenity u potkanů při léčbě sunitinibem je nejasný.
Reprodukční a vývojové toxicity.
U samců nebo samic potkanů nebyly ve studiích reprodukční toxicity zaznamenány žádné nežádoucí účinky na fertilitu. Nicméně ve studiích toxicity s opakovanými dávkami prováděnými na potkanech a opicích byly pozorovány při klinicky významné systémové expozici účinky na fertilitu samic v podobě atrézie folikulů, degenerace žlutého tělíska, změn endometria v děloze a snížené hmotnosti dělohy a ovarií. Byl pozorován účinek na fertilitu samců potkanů v podobě tubulární atrofie ve varlatech, redukce spermií v nadvarlatech a koloidní deplece v prostatě a semenných váčcích při 25násobku systémové expozice u člověka.
Embryo-fetální mortalita u potkanů se projevovala signifikantním snížením počtu živých plodů, zvýšeným počtem resorpcí, zvýšenou postimplantační ztrátou a celkovou ztrátou vrhu u 8 z 28 březích samic při 5,5násobku systémové expozice u člověka. U králíků se jednalo o snížení hmotnosti gravidní dělohy a snížení počtu živých plodů způsobené zvýšeným počtem resorpcí, zvýšenou postimplantační ztrátu a celkovou ztrátu vrhů u 4 ze 6 březích samic při 3násobku systémové expozice u člověka.
Léčba potkanů sunitinibem během organogeneze vedla k ovlivnění vývoje při > 5 mg/kg/den, což se projevilo zvýšeným výskytem kosterních malformací plodu, převážně charakterizovaných jako opožděná osifikace hrudních/lumbálních obratlů; tyto účinky se vyskytly při 5,5násobku systémové expozice u člověka. U králíků se ovlivnění vývoje projevilo zvýšenou incidencí rozštěpu rtu při plazmatické expozici přibližně srovnatelné s klinickou a rozštěpu rtu a rozštěpu patra při 2,7násobku systémové expozice u člověka.
Sunitinib (0,3, 1,0, 3,0 mg/kg/den) byl hodnocen ve studii pre-a postnatálního rozvoje u březích samic potkanů. Při dávce > 1 mg/kg/den došlo ke snížení tělesné hmotnosti samic během gestace a laktace, nicméně až do dávky 3 mg/kg/den (očekávaná expozice > 2,3 x AUC pacientů s doporučenou denní dávkou - RDD) nebyla pozorována žádná mateřská reprodukční toxicita. Snížené tělesné hmotnosti u potomků byly pozorovány během období před a po odstavení při dávce 3 mg/kg/den. Žádný rozvoj toxicity nebyl pozorován při dávce 1 mg/kg/den (přibližná expozice > 0,9 x AUC pacientů s doporučenou denní dávkou).
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
12,5 mg tvrdé tobolky
Obsah tobolky
Mannitol (E421)
Sodná sůl kroskarmelózy Povidon (K-25)
Magnesium-stearát Obal tobolky Želatina
Oxid titaničitý (E171) Červený oxid železitý (E 172)
Tiskařské barvivo
Šelak
Propylenglykol Hydroxid sodný Povidon
Oxid titaničitý (E171)
25 mg tvrdé tobolky Obsah tobolky
Mannitol (E 421)
Sodná sůl kroskarmelózy Povidon (K-25) Magnesium stearát
Oranžový obal tobolky
Želatina
Červený oxid železitý (E 172) Oxid titaničitý (E 171)
Karamelový obal tobolky
Želatina
Oxid titaničitý (E 171)
Žlutý oxid železitý (E 172) Červený oxid železitý (E 172) Černý oxid železitý (E 172)
Tiskařské barvivo
Šelak
Propylenglykol Hydroxid sodný Povidon
Oxid titaničitý (E 171)
37,5 mg tvrdé tobolky
Obsah tobolky
Mannitol (E 421)
Sodná sůl kroskarmelózy Povidon (K-25) Magnesium stearát
Obal tobolky
Želatina
Oxid titaničitý (E 171) Žlutý oxid železitý (E 172)
Tiskařské barvivo
Šelak
Propylenglykol Hydroxid draselný Černý oxid železitý (E 172)
50 mg tvrdé tobolky
Obsah tobolky
Mannitol (E 421)
Sodná sůl kroskarmelózy Povidon (K-25) Magnesium stearát
Obal tobolky
Želatina
Oxid titaničitý (E 171)
Žlutý oxid železitý (E 172)
Červený oxid železitý (E 172)
Černý oxid železitý (E 172)
Tiskařské barvivo
Šelak
Propylenglykol Hydroxid sodný Povidon
Oxid titaničitý (E 171)
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
HDPE (high-density polyethylene) lahvičky s polypropylenovým uzávěrem, obsahují 30 tvrdých tobolek.
Poly(chlorotrifluoroethylen)/PVC perforovaný jednodávkový blistr s hliníkovou fólií potažený zatavenou lakovou vrstvou, obsahující 28 x 1 tvrdých tobolek.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer Ltd Ramsgate Road Sandwich, Kent CT13 9NJ Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
SUTENT 12,5 mg tvrdé tobolky
EU/1/06/347/001
EU/1/06/347/004
SUTENT 25 mg tvrdé tobolky
EU/1/06/347/002
EU/1/06/347/005
SUTENT 37,5 mg tvrdé tobolky
EU/1/06/347/007
EU/1/06/347/008
SUTENT 50 mg tvrdé tobolky
EU/1/06/347/003
EU/1/06/347/006
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19. července 2006
Datum posledního prodloužení registrace: 9. ledna 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Pfizer Italia S.r.L.
Via del Commercio Zona Industriale IT-63100 Marino del Tronto (Ascoli Piceno)
Itálie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2. registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 12,5 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Jedna tobolka obsahuje sunitinib-malát, odpovídající 12,5 mg sunitinibum
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
30 tvrdých tobolek
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Perorální podání
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ_
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/001 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 12,5 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Sutent 12,5 mg tvrdé tobolky
Sunitinibum
Perorální podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
30 tobolek
6 JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 25 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Jedna tobolka obsahuje sunitinib-malát, odpovídající 25 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
30 tvrdých tobolek
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Perorální podání
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ_
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/002 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 25 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Sutent 25 mg tvrdé tobolky
Sunitinibum
Perorální podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
30 tobolek
6 JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 37,5 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Jedna tobolka obsahuje sunitinib-malát, odpovídající 37,5 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
30 tvrdých tobolek
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Perorální podání
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ_
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/007 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 37,5 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Sutent 37,5 mg tvrdé tobolky
Sunitinibum
Perorální podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
30 tobolek
6 JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 50 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Jedna tobolka obsahuje sunitinib-malát, odpovídající 50 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
30 tvrdých tobolek
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Perorální podání
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ_
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/347/003
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 50 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Sutent 50 mg tvrdé tobolky
Sunitinibum
Perorální podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
30 tobolek
6 JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 12,5 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje sunitinib-malát, odpovídající 12,5 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
28 x 1 tvrdá tobolka
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/004 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 12,5 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 12,5 mg tvrdé tobolky Sunitinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.:
5. JINÉ
PO
ÚT
ST
ČT
PÁ
SO
NE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 25 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje sunitinib-malát, odpovídající 25 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
28 x 1 tvrdá tobolka
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/005 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 25 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 25 mg tvrdé tobolky Sunitinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.
5. JINÉ
PO
ÚT
ST
ČT
PÁ
SO
NE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 37,5 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje sunitinib-malát, odpovídající 37,5 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
28 x 1 tvrdá tobolka
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/008 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 37.5 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 37,5 mg tvrdé tobolky Sunitinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.:
5. JINÉ
PO
ÚT
ST
ČT
PÁ
SO
NE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 50 mg tvrdé tobolky Sunitinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje sunitinib-malát, odpovídající 50 mg sunitinibu
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
28 x 1 tvrdá tobolka
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/06/347/006 13 ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Sutent 50 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Sutent 50 mg tvrdé tobolky Sunitinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.
5. JINÉ
PO
ÚT
ST
ČT
PÁ
SO
NE
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
SUTENT 12,5 mg tvrdé tobolky SUTENT 37,5 mg tvrdé tobolky SUTENT 25 mg tvrdé tobolky SUTENT 50 mg tvrdé tobolky
Sunitinib
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Sutent a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Sutent užívat
3. Jak se přípravek Sutent užívá
4. Možné nežádoucí účinky
5. Jak přípravek Sutent uchovávat
6. Obsah balení a další informace
1. Co je přípravek Sutent a k čemu se používá
Sutent obsahuje léčivou látku sunitinib, což je inhibitor protein-tyrosinkináz. Je určený k léčbě nádorového onemocnění. Omezuje aktivitu zvláštní skupiny bílkovin, o nichž je známo, že se podílejí na růstu a šíření nádorových buněk.
Sutent Vám může předepsat pouze lékař, který má zkušenosti s podáváním protinádorových léčivých přípravků.
Sutent se používá k léčbě dospělých pacientů s následujícími typy nádoru:
- Gastrointestinální stromální tumor (GIST), typ nádoru žaludku a střev po selhání léčby imatinibem (jiný lék k léčbě nádorů) nebo pokud nemůžete imatinib užívat.
- Metastatický renální karcinom ledviny (MRCC), typ nádoru ledvin, který se šíří do ostatních částí těla.
- Pankreatické neuroendokrinní nádory (pNET) (nádory z hormon produkujících buněk slinivky břišní), který se zvětšil nebo nemůže být odstraněn chirurgicky.
Pokud budete mít jakékoli otázky týkající se mechanismu účinku přípravku Sutent a toho, proč Vám byl předepsán, zeptejte se svého lékaře.
Neužívejte přípravek Sutent:
- jestliže jste alergický(á) na sunitinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku Sutent se poraďte se svým lékařem:
- Jestliže máte vysoký krevní tlak. Sutent může zvýšit krevní tlak. Váš lékař může během léčby přípravkem Sutent kontrolovat Váš krevní tlak a bude-li třeba, můžete dostat léky ke snížení krevního tlaku.
- Jestliže máte nebo jste měl(a) poruchy krve, problémy s krvácením nebo tvorbou podlitin.
Léčba přípravkem Sutent může vést ke zvýšenému riziku krvácení nebo ke změnám počtu některých krevních buněk, a tak způsobit anemii nebo ovlivnit srážlivost krve. Pokud užíváte warfarin nebo acenokumarol, léky na ředění krve pro předcházení srážení krve, může to představovat zvýšené riziko krvácení. Informujte svého lékaře o jakémkoliv krvácení, které jste měl(a) během léčby přípravkem Sutent.
- Jestliže máte problémy se srdcem. Sutent může způsobit problémy se srdcem. Sdělte svému lékaři, jestliže se cítíte velmi unaven(a), máte zkrácený dech nebo Vám otékají nohy a kotníky.
- Jestliže máte abnormální změny srdečního rytmu. Sutent může způsobit abnormality Vašeho srdečního rytmu. K hodnocení těchto problémů si Váš lékař opatří v průběhu léčby přípravkem Sutent srdeční záznamy EKG. Sdělte svému lékaři, jestliže během užívání přípravku Sutent pociťujete závratě, mdloby nebo nadměrné bušení srdce.
- Jestliže jste měl(a) v nedávné době problém se srážlivostí krve v žilách a/nebo arteriích (typ krevních cév), včetně mrtvice, srdečního infarktu, embolie nebo trombózy. Informujte okamžitě svého lékaře, pokud máte během léčby přípravkem Sutent příznaky, jako jsou bolest na hrudi nebo tlak, bolest v rukou, zádech, krku nebo čelisti, zkrácení dechu, sníženou citlivost nebo slabost na jedné straně těla, obtíže s mluvením, bolest hlavy nebo závrať.
- Jestliže máte nebo jste měl(a) poškození nejmenších krevních cév nazývané trombotická mikroangiopatie (TMA). Sdělte svému lékaři, jestliže u Vás dojde k rozvoji horečky, únavy, vyčerpanosti, tvorbě podlitin, krvácení, otokům, zmatenosti, ztrátě zraku a záchvatům.
- Jestliže máte problémy se štítnou žlázou. Sutent může způsobit problémy se štítnou žlázou. Sdělte svému lékaři, pokud během užívání přípravku Sutent pozorujete, že se snadno unavíte, vnímáte chlad více než ostatní lidé nebo máte hlubší hlas. Před zahájením léčby přípravkem Sutent a pravidelně během léčby by Vám měla být provedena kontrola funkce štítné žlázy. Pokud Vaše štítná žláza neprodukuje dostatečné množství tyroidního hormonu, můžete být léčen(a) náhradním tyroidním hormonem.
- Jestliže máte nebo jste měl(a) onemocnění slinivky břišní nebo žlučníku. Sdělte svému lékaři, pokud se u Vás rozvinou jakékoliv z následujících známek nebo příznaků: bolest v oblasti žaludku (horní oblast břicha), pocit na zvracení, zvracení a horečka. Tyto stavy mohou být způsobeny zánětem slinivky břišní nebo žlučníku.
- Jestliže máte nebo jste měl(a) problémy s játry. Sdělte svému lékaři, pokud se u Vás během léčby přípravkem Sutent rozvinou některé z následujících známek a příznaků jaterních problémů: svědění, žluté zbarvení očí nebo kůže, tmavá moč a bolestivost nebo nepříjemný pocit v pravé horní oblasti břicha. Váš lékař by Vám měl provést krevní testy kvůli kontrole funkce jater před zahájením a v průběhu léčby přípravkem Sutent a pokud je klinicky indikováno.
- Jestliže máte nebo jste měl(a) problémy s ledvinami. Váš lékař bude sledovat funkci Vašich ledvin.
- Jestliže podstupujete nebo jste nedávno podstoupil(a) chirurgický zákrok. Sutent může mít vliv na hojení. Před operací se obvykle přípravek Sutent přestává užívat. Váš lékař rozhodne, kdy začnete přípravek Sutent užívat znovu.
- Předtím, než zahájíte léčbu přípravkem Sutent, Vám může být doporučena zubní prohlídka.
- sdělte svému lékaři okamžitě, pokud máte nebo jste měl(a) bolest v ústní dutině, bolest zubů a/nebo čelisti, otok nebo otlaky v ústech, sníženou citlivost nebo pocit tíhy v čelisti, ztrátu zubu.
- pokud potřebujete podstoupit invazivní zubní léčbu nebo zubní chirurgický zákrok, sdělte svému zubnímu lékaři, že jste léčen(a) přípravkem Sutent, zejména pokud ještě užíváte nebo jste užíval(a) bisfosfonáty podávané nitrožilně. Bisfosfonáty jsou léky užívané k prevenci kostních komplikací, které mohou být podávány z jiných lékařských důvodů.
- Jestliže máte nebo jste měl(a) poruchy kůže a podkožní tkáně. Během období, kdy užíváte přípravek, se může objevit "pyoderma gangrenosum" (bolestivé hnisavé vřídky na kůži) nebo „nekrotizující fasciitida“ (rychle se šířící infekce kůže/měkké tkáně, která může být život ohrožující). Tento nežádoucí účinek obvykle vymizí po ukončení užívání přípravku. Při užívání sunitinibu byly hlášeny závažné kožní vyrážky (Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, erythema multiforme), které se zpočátku projevují jako červené tečky nebo kruhovité skvrny často s puchýřem uprostřed. Vyrážka se může rozvinout do rozšíření puchýřů nebo olupování kůže a může být život ohrožující. Jestliže u Vás dojde k rozvoji vyrážky nebo uvedených kožních příznaků, okamžitě vyhledejte lékařskou pomoc.
- Jestliže máte nebo jste měl(a) záchvaty. Upozorněte svého lékaře co nejdříve, pokud máte vysoký krevní tlak, bolest hlavy, ztrátu vidění.
- Jestliže máte cukrovku. Hladinu cukru v krvi je třeba u pacientů s cukrovkou pravidelně kontrolovat, aby bylo možno stanovit, zda je dávkování antidiabetika třeba upravit,
a minimalizovat tak riziko hypoglykemie.
Děti a dospívající
Sutent není doporučen u osob mladších 18 let.
Další léčivé přípravky a přípravek Sutent
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době
užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Některé léky mohou ovlivňovat koncentrace přípravku Sutent ve Vašem organismu. Měl(a) byste
informovat svého lékaře, jestliže užíváte léky, které obsahují následující léčivé látky:
- ketokonazol, itrakonazol - používané k léčbě plísňových infekcí
- erythromycin, klarithromycin, rifampicin - užívané k léčbě infekcí
- ritonavir - užívaný k léčbě HIV
- dexamethazon - kortikosteroid užívaný pro různé stavy
- fenytoin, karbamazepin, fenobarbital - užívané k léčbě epilepsie a jiných neurologických stavů
- rostlinné přípravky obsahující třezalku tečkovanou (Hypericum perforatum) - užívané k léčbě depresí a úzkosti
Během užívání přípravku Sutent byste se měl(a) vyhnout pití grapefruitové šťávy.
Těhotenství a kojení
Informujte svého lékaře, pokud jste těhotná nebo se domníváte, že můžete být těhotná.
Přípravek Sutent by neměl být během těhotenství podáván, pokud to není nezbytně nutné. Váš lékař Vám vysvětlí možná rizika související s užíváním přípravku Sutent během těhotenství.
Ženy, které mohou otěhotnět, musí během léčby přípravkem Sutent užívat spolehlivou metodu antikoncepce.
Informujte svého lékaře, pokud kojíte. Během léčby přípravkem Sutent nekojte.
Řízení dopravních prostředků a obsluha strojů
Pokud se u Vás objeví závratě nebo pokud se budete cítit nezvykle unavený(á), věnujte zvláštní pozornost při řízení vozidel a obsluze strojů.
3. Jak se přípravek Sutent užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Váš lékař Vám předepíše dávku, která je pro Vás nejvhodnější v závislosti na typu nádoru, který je léčen. Při léčbě GIST nebo MRCC je obvyklá dávka 50 mg denně po dobu 28 dnů (4 týdny) s následným přerušením léčby na dobu 14 dnů (2 týdnů bez léku), což představuje 6týdenní léčebné cykly. Při léčbě pNET je obvyklá dávka 37,5 mg jednou denně bez přerušení léčby.
Váš lékař stanoví, jakou jednotlivou dávku léčiva budete potřebovat, a zda a kdy bude třeba ukončit léčbu přípravkem Sutent.
Přípravek Sutent může být užíván s jídlem nebo bez jídla.
Jestliže jste užil(a) více přípravku Sutent, než jste měl(a)
Pokud náhodně užijete příliš mnoho tobolek, informujte o tom ihned svého lékaře. Budete možná vyžadovat lékařskou péči.
Jestliže jste zapomněl(a) užít přípravek Sutent
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Je nutné okamžitě informovat svého lékaře, pokud proděláte kterýkoliv z následujících závažných nežádoucích účinků (viz rovněž Čemu musíte věnovat pozornost, než začnete přípravek Sutent užívat):
Problémy se srdcem. Sdělte svému lékaři, jestliže se cítíte velmi unaven(a), máte zkrácený dech nebo Vám otékají nohy a kotníky. Mohlo by se jednat o příznaky srdečních problémů, včetně srdečního selhání a poškození srdečního svalu (kardiomyopatie).
Plicní nebo dýchací obtíže. Sdělte svému lékaři, jestliže se u Vás rozvine kašel, bolest na hrudi, náhlý nástup dechové nedostatečnosti nebo vykašlávání krve. Mohlo by se jednat o příznaky takzvané plicní embolie, ke které dochází, když se do plic dostane krevní sraženina.
Onemocnění ledvin. Sdělte svému lékaři, pokud došlo ke změně frekvence nebo k nedostatečnému močení, což může být známkou selhání ledvin.
Krvácení. Okamžitě sdělte svému lékaři, pokud se u Vás během léčby přípravkem Sutent objeví kterýkoliv z následujících příznaků nebo vážné potíže s krvácením: bolest, oteklý žaludek (břicho), zvracení s příměsí krve, černá mazlavá stolice, krev v moči, bolest hlavy nebo změny Vašich mentálních funkcí, vykašlávání krve nebo krvavých hlenů z plic nebo dýchacích cest.
Destrukce (rozpad) nádorů vedoucí k proděravění střev. Sdělte svému lékaři, pokud se u Vás objeví silné bolesti břicha, horečka, pocit na zvracení, zvracení, krev ve stolici nebo změny stavu střev.
Další nežádoucí účinky přípravku Sutent mohou zahrnovat:
Velmi časté nežádoucí účinky (postihují více než 1 z 10 pacientů)
- Snížení počtu krevních destiček, červených krvinek a/nebo neutrofilů (typ bílých krvinek).
- Dušnost.
- Vysoký krevní tlak.
- Mimořádná únava, ztráta síly.
- Otok způsobený tekutinou pod kůží a kolem očí, hluboký alergický výsev.
- Bolest/podráždění v dutině ústní, vředy či zánět či suchost úst, poruchy chuti, žaludeční nevolnost, pocit na zvracení, zvracení, průjem, zácpa, bolesti/otékání břicha, ztráta/snížení chuti k jídlu.
- Snížená činnost štítné žlázy (hypotyreóza).
- Závrať.
- Bolest hlavy.
- Krvácení z nosu.
- Bolest zad, bolest kloubů.
- Bolest paží a nohou.
- Zežloutnutí kůže/změna zbarvení kůže, zvýšená pigmentace kůže, změna barvy vlasů, vyrážka na dlaních a chodidlech, vyrážka, suchá pokožka.
- Kašel.
- Horečka.
- Obtíže s usínáním.
Časté nežádoucí účinky (postihují 1 až 10 ze 100 pacientů)
- Krevní sraženiny v cévách.
- Nedostatečné krevní zásobení srdečního svalu v důsledku ucpání nebo zúžení věnčitých tepen.
- Bolest na hrudi.
- Snížené množství krve přečerpané srdcem.
- Zadržování tekutin včetně v oblasti plic.
- Infekce.
- Snížená hladina cukru v krvi. Pokud se u Vás vyskytnou jakékoliv známky a příznaky snížené hladiny cukru v krvi: Informujte svého lékaře co nejdříve, jakmile se u Vás objeví únava, bušení srdce, pocení, hlad a ztráta vědomí.
- Úbytek bílkovin v moči někdy vedoucí až k otokům.
- Příznaky podobné chřipce.
- Abnormální krevní testy včetně enzymů slinivky břišní a jatemích enzymů.
- Vysoká hladina kyseliny močové v krvi.
- Hemoroidy, bolest konečníku, krvácení z dásní, potíže při polykání nebo neschopnost polykat.
- Bolestivé nebo pálivé pocity na jazyku, zánět výstelky trávicího traktu, zvýšená plynatost v žaludku nebo střevech.
- Váhový úbytek.
- Muskuloskeletální bolest (bolest svalů a kostí), ochablost svalů, svalová únava, bolest svalů, svalové stahy.
- Suchost vnose, ucpaný nos.
- Zvýšená tvorba slz.
- Abnormální citlivost kůže, suchá kůže, svědění, tvorba kožních šupin a zánět kůže, puchýře, akné, změna barvy nehtů, vypadávání vlasů.
- Neobvyklé pocity v končetinách.
- Abnormální snížení/zvýšení citlivosti, zejména na dotyk.
- Pálení žáhy.
- Dehydratace.
- Návaly horka.
- Neobvyklé zbarvení moče.
- Deprese.
- Třesavka.
Méně časté nežádoucí účinky (postihují 1 až 10 z 1 000 pacientů)
- Život ohrožující infekce měkkých tkání, včetně oblasti v okolí konečníku a genitálu. Okamžitě informujte lékaře, pokud se objeví příznaky infekce v okolí poranění na kůži, včetně horečky, bolesti, zarudnutí, otoku nebo výtoku hnisu nebo krve.
- Mozková příhoda.
- Srdeční záchvat (infarkt) způsobený přerušením nebo snížením krevního zásobení srdce.
- Změny v elektrické aktivitě srdce či poruchy srdečního rytmu.
- Tekutina okolo srdce (perikardiální výpotek).
- Jaterní selhání.
- Bolest žaludku (břicha) způsobená zánětem slinivky břišní.
- Rozpad tkáně nádoru vedoucí k proděravění střeva (perforace).
- Zánět (otok a zarudnutí) žlučníku se žlučovými kameny nebo bez nich.
- Abnormální spojení jedné tělní dutiny s jinou tělní dutinou či s povrchem kůže (tvorba píštělí).
- Bolest v ústní dutině, bolest zubů a/nebo čelisti, otok nebo vředy v ústech, snížená citlivost nebo pocit tíhy v čelisti, ztráta zubu. Mohly by to být známky a příznaky poškození čelistní kosti (osteonekróza). Sdělte svému lékaři a zubnímu lékaři ihned, pokud jste něco z toho zaznamenal(a).
- Nadměrná tvorba hormonů štítné žlázy, které zvyšují množství energie, jež organismus vydává v klidovém stavu.
- Problémy s hojením po chirurgickém zákroku.
- Zvýšená hladina enzymu ze svalů (kreatinfosfokinázy).
- Nepřiměřená a nadměrná reakce na alergeny.
Vzácné nežádoucí účinky (postihují 1 až 10 z 10 000 pacientů)
- Závažné reakce na kůži nebo sliznicích (Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, erythema multiforme).
- Syndrom lýzy tumoru sestává z řady metabolických komplikací, které se mohou objevit během léčby nádoru. Tyto komplikace jsou způsobeny rozpadem umírajících buněk nádoru a mohou se projevit následujícími příznaky: pocit na zvracení, dušnost, nepravidelný srdeční tep, křeče ve svalech, záchvaty, kalná moč a únava spojená s abnormálními výsledky laboratorních testů (vysoké hladiny draslíku, kyseliny močové a fosforu a nízké hladiny vápníku v krvi), které mohou vést ke změnám funkce ledvin a akutnímu selhání ledvin.
- Abnormální rozpad svalové tkáně vedoucí k postižení funkce ledvin (rabdomyolýza).
- Abnormální změny na mozku, které mohou způsobovat určitou skupinu příznaků, včetně bolesti hlavy, zmatenosti, záchvatů a ztráty zraku (reverzibilní syndrom okcipitální leukoencefalopatie).
- Bolestivé vřídky na kůži (pyoderma gangrenosum).
- Zánět jater (hepatitida).
- Zánět štítné žlázy.
- Poškození nejmenších krevních cév nazývané trombotická mikroangiopatie (TMA).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Sutent uchovávat
- Uchovávejte tento přípravek mimo dohled a dosah dětí.
- Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a na štítku za „Použitelné do:“ nebo „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
- Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
- Nepoužívejte tento přípravek, pokud si všimnete, že obal je poškozený nebo vykazuje známky porušení.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Sutent obsahuje SUTENT 12,5 mg tvrdé tobolky
Léčivou látkou je sunitinibum. Jedna tobolka obsahuje sunitinibi malas odpovídající sunitinibum 12,5 mg.
Dalšími složkami jsou:
- Obsah tobolky: mannitol (E421), sodná sůl kroskarmelózy, povidon (K-25) a magnesium-stearát.
- Obal tobolky: želatina, červený oxid železitý (E172) a oxid titaničitý (E171).
- Potisk: obsahuje šelak, propylenglykol, hydroxid sodný, povidon a oxid titaničitý (E171).
SUTENT 25 mg tvrdé tobolky
Léčivou látkou je sunitinibum. Jedna tobolka obsahuje sunitinibi malas odpovídající sunitinibum 25 mg.
Dalšími složkami jsou:
- Obsah tobolky: mannitol, sodná sůl kroskarmelózy, povidon (K-25) a magnesium-stearát.
- Obal tobolky: želatina, oxid titaničitý (E171), žlutý oxid železitý (E172), červený oxid železitý (E172), černý oxid železitý (E172).
- Potisk: šelak, propylenglykol, hydroxid sodný, povidon a oxid titaničitý (E171).
SUTENT 37,5 mg tvrdé tobolky
Léčivou látkou je sunitinibum. Jedna tobolka obsahuje sunitinibi malas odpovídající sunitinibum 37,5 mg.
Dalšími složkami jsou:
- Obsah tobolky: mannitol, sodná sůl kroskarmelózy, povidon (K-25) a magnesium-stearát.
- Obal tobolky: želatina, oxid titaničitý (E171), žlutý oxid železitý (E172).
- Potisk: šelak, propylenglykol, hydroxid draselný, černý oxid železitý (E172).
SUTENT 50 mg tvrdé tobolky
Léčivou látkou je sunitinibum. Jedna tobolka obsahuje sunitinibi malas odpovídající sunitinibum 50 mg.
Dalšími složkami jsou:
- Obsah tobolky: mannitol, sodná sůl kroskarmelózy, povidon (K-25) a magnesium-stearát.
- Obal tobolky: želatina, oxid titaničitý (E171), žlutý oxid železitý (E172), červený oxid železitý (E172) a černý oxid železitý (E172).
- Potisk: šelak, propylenglykol, hydroxid sodný, povidon a oxid titaničitý (E171).
Jak přípravek Sutent vypadá a co obsahuje toto balení
Přípravek Sutent 12,5 mg je dodáván jako tvrdé želatinové tobolky s oranžovým víčkem a oranžovým tělem s bílým potiskem “Pfizer” na víčku a “STN 12,5 mg” na těle tobolky, obsahuje žlutý až oranžový granulát.
Přípravek Sutent 25 mg je dodáván jako tvrdé želatinové tobolky s karamelovým víčkem a oranžovým tělem s bílým potiskem “Pfizer” na víčku a “STN 25 mg” na těle tobolky, obsahuje žlutý až oranžový granulát.
Přípravek Sutent 37,5 mg je dodáván jako tvrdé želatinové tobolky se žlutým víčkem a žlutým tělem s černým potiskem “Pfizer” na víčku a “STN 37,5 mg” na těle tobolky, obsahuje žlutý až oranžový granulát.
Přípravek Sutent 50 mg je dodáván jako tvrdé želatinové tobolky s karamelovým víčkem a karamelovým tělem s bílým potiskem “Pfizer” na víčku a “STN 50 mg” na těle tobolky, obsahuje žlutý až oranžový granulát.
Je dostupný v plastových lahvičkách obsahujících 30 tobolek a v perforovaných jednodávkových blistrech obsahujících 28 x 1 tobolku.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Pfizer Limited Ramsgate Road Sandwich, Kent CT13 9NJ Velká Británie
Výrobce
Pfizer Italia S.r.L.
Via del Commercio - Zona Industriale 63100 Marino del Tronto (Ascoli Piceno)
Itálie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgique / Belgie /Belgien Pfizer S.A. / N.V. Tél/Tel: +32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. + 370 52 51 4000 |
|
Btarapna n$aň3ep HroKceMÓypr CAPH, KnoH Etnrapna Ten.: +359 2 970 4333 |
Luxembourg/Luxemburg Pfizer S.A. Tél/Tel: +32 (0)2 554 62 11 |
|
Česká republika Pfizer PFE, spol. s r.o. Tel.: +420 283 004 111 |
Magyarország Pfizer Kft. Tel.: +36-1-488-37-00 |
|
Danmark Pfizer ApS Tlf: +45 44 20 11 00 |
Malta V.J. Salomone Pharma Ltd. Tel. +356 21220174 |
|
Deutschland Pfizer Pharma GmbH Tel: +49 (0)30 550055 51000 |
Nederland Pfizer BV Tel: +31 (0)10 406 43 01 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel.: +372 666 7500 |
Norge Pfizer Norge AS Tlf: +47 67 52 61 00 |
|
EXXáSa Pfizer EA,Mg A.E. T^: +30 210 6785 800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
Espaňa Pfizer, S.L. Tél: +34 91 490 99 00 |
Polska Pfizer Polska Sp.z.o.o Tel.:+48 22 335 61 00 |
|
France Pfizer Tél: +33 (0)1 58 07 34 40 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Románia Pfizer Romania S.R.L. Tel: +40 (0) 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel.: + 386 (0)1 52 11 400 |
Ísland
Icepharma hf.
Sími: +354 540 8000
Italia
Pfizer S.r.l.
Tel: +39 06 33 18 21
Kúrcpog
Pfizer EALág A.E.(Cyprus Branch) T^.:+ 357 22 817690
Latvija
Pfizer Luxembourg SARL filiale Latvija Tel.: + 371 670 35 775
Slovenská republika
Pfizer Luxembourg SARL, organizačná zložka Tel.:+ 421 2 3355 5500
Suomi/Finland
Pfizer Oy
Puh./Tel: +358 (0)9 43 00 40 Sverige
Pfizer Innovations AB Tel: +46 (0)8 550 520 00
United Kingdom
Pfizer Limited,
Tel: +44 (0) 1304 616161
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
70