Sonovue
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
SonoVue, 8 mikrolitrů/ml, prášek a rozpouštědlo pro injekční disperzi
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden mililitr obsahuje sulfuris hexafluoridum 8 mikrolitrů v mikrobublinách .
Po rekonstituci dle pokynů obsahuje 1 ml výsledné disperze 8 mikrolitrů fluoridu sírového v mikrobublinách, což odpovídá koncentraci 45 mikrolitrů/g.
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční disperzi
SonoVue je souprava, která obsahuje 1 injekční lahvičku obsahující 25 mg lyofilizovaného prášku 1 předplněnou injekční stříkačku obsahující 5 ml chloridu sodného 1 přenosový systém typu Mini-Spike
Informace o vzhledu rekonstituovaného roztoku jsou uvedeny v bodě 6.6.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Tento léčivý přípravek je určen pouze k diagnostickým účelům.
SonoVue je určen k použití při ultrazvukovém zobrazování ke zvýšení echogenity krve, vedoucí ke zlepšení koeficientu signál - šum.
SonoVue se má použít pouze u pacientů, u nichž by vyšetření bez zvýšení kontrastu bylo neprůkazné. Echokardiografie
SonoVue je transpulmonární echokardiografická konstrastní látka k použití u pacientů s podezřením nebo s prokázaným kardiovaskulárním onemocněním k zvýraznění srdečních dutin a ke zvýraznění hranice endokardu levé komory.
Doppler makrovaskulatury
SonoVue zvyšuje přesnost při detekci nebo vyloučení abnormalit mozkových tepen a extrakraniálního průběhu karotidy nebo periferních tepen tak, že zlepšuje koeficient signál-šum Dopplerovského vyšetření.
SonoVue zvyšuje kvalitu znázornění průtoku krve při Dopplerovském vyšetření a délku klinicky užitečného zvýšení signálu při vyšetření portální žíly.
Doppler mikrovaskulatury
SonoVue zlepšuje zobrazení cévního systému jaterních a prsních lézí během Dopplerovské sonografie, což vede k přesnější charakterizaci lézí.
Tento přípravek má být podáván pouze lékaři se zkušeností v diagnostickém ultrazvukovém zobrazování.
Dávkování
Doporučené dávky SonoVue:
B-režim zobrazení srdečních dutin, v klidu nebo při zátěži: 2 ml.
Dopplerovské vyšetření cév: 2,4 ml.
Během jednoho vyšetření může být podána i druhá injekce doporučené dávky, pokud to lékař považuje za nezbytné.
Starší pacienti
Doporučené dávky platí také pro starší pacienty.
Pediatričtí pacienti
Bezpečnost a efektivnost SonoVue u pacientů mladších 18 let nebyla dosud prokázána a tento přípravek se u těchto pacientů nemá používat.
Způsob podání
Mikrobublinová disperze se před použitím připraví vstříknutím 5 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%) skrze zátku k obsahu injekční lahvičky. Injekční lahvička se pak prudce po několik sekund protřepává, až je lyofilizát zcela rozpuštěn. Požadovaný objem disperze může být nabrán do injekční stříkačky kdykoli do šesti hodin po rekonstituci. Těsně před nabráním do injekční stříkačky se má injekční lahvička protřepat, aby došlo k resuspendaci mikrobublin. SonoVue se má podávat okamžitě po nabrání do injekční stříkačky vstříknutím do periferní žíly. Každá injekce má být následována výplachem 5 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%).
Návod k přípravě tohoto léčivého přípravku před podáním viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
SonoVue je kontraindikován u pacientů se známou existencí pravo-levých zkratů, s těžkou plicní hypertenzí (plicní arteriální tlak> 90 mmHg), nekontrolovanou systémovou hypertenzí a u pacientů se syndromem dechové tísně dospělých.
SonoVue nesmí být používán v kombinaci s dobutaminem u pacientů s nestabilním stavem kardiovaskulárního systému, kde je dobutamin kontraindikován.
4.4 Zvláštní upozornění a opatření pro použití
EKG se má monitorovat podle klinické indikace u vysoce rizikových pacientů.
Je třeba zdůraznit, že zátěžová echokardiografie, která může imitovat ischemickou příhodu, může potenciálně zvýšit riziko užití SonoVue. Proto, má-li být SonoVue užit ve spojitosti se zátěžovou echokardiografií, pacient musí být ve stabilním stavu, ověřeném chyběním bolesti na hrudi nebo změnami EKG nálezu během dvou předešlých dnů.
Kromě toho se má během kontrastní SonoVue echokardiografie s farmakologickou zátěží (např. s dobutaminem) monitorovat EKG a krevní tlak.
Zvláštní opatrnost je nutná při zvažování podání SonoVue pacientům s nedávným akutním koronárním syndromem nebo klinicky nestabilní ischemickou chorobou srdeční včetně vyvíjejícího se nebo probíhajícího infarktu myokardu, typickou klidovou anginou pectoris během posledních 7 dnů, významným zhoršením kardiálních symptomů během posledních 7 dnů, nedávným zákrokem na koronárních tepnách, nebo jinými faktory naznačujícími klinickou nestabilitu (např. nedávné zhoršení EKG nálezu, laboratorní nebo klinické nálezy), akutním srdečním selháním, stupněm III/IV srdečního selhání nebo s těžkými arytmiemi, protože alergie a/nebo vazodilatační reakce u těchto pacientů mohou vést k život ohrožujícím stavům. SonoVue smí být podáván u těchto pacientů pouze po pečlivém zvážení rizika / prospěchu a během podání a po podání musí být provedeno pečlivé monitorování vitálních funkcí.
Musí být dostupné vybavení neodkladné péče a personál vyškolený pro jeho použití.
V případě anafylaktické reakce, mohou beta blokátory (včetně očních kapek) zhoršit reakci. Pacienti nemusí reagovat na obvyklé dávky adrenalinu, používané k léčbě alergické reakce.
Opatrnost se doporučuje, je-li SonoVue podáván pacientům s klinicky významným plicním onemocněním, včetně těžké chronické obstrukční plicní nemoci.
Doporučuje se, aby pacient byl během podání SonoVue a následně nejméně 30 minut pod bedlivým dohledem zdravotnického personálu.
Počet pacientů s následujícími potížemi, kteří byli vystaveni působení SonoVue v klinických studiích, je omezený, a proto se doporučuje opatrnost, pokud je tento přípravek podáván pacientům s: akutní endokarditidou, protetickými chlopněmi, akutním systémovým zánětem a/nebo sepsí, stavy zvýšené srážlivosti a/nebo nedávnou tromboembolií a ledvinovým nebo jaterním onemocněním v konečném stadiu.
SonoVue není vhodný k použití u pacientů s umělou plicní ventilací a pacientů s nestabilními neurologickými poruchami.
Ve studiích na zvířatech byly odhaleny biologické nežádoucí účinky podání echo-kontrastních látek interakcí s ultrazvukovým vlněním (jako poškození endoteliálních buněk a praskliny kapilár). Přestože tyto nežádoucí biologické účinky nebyly hlášeny u lidí, doporučuje se použití nízkého mechanického indexu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakcí
Žádné interakční studie nebyly provedeny. V klinických studiích u pacientů, jimž byly podávány různé kategorie nejběžnějších dlouhodobě užívaných léků, nebyly nalezeny žádné jasné spojitosti s ohledem na výskyt nežádoucích účinků.
4.6 Těhotenství a kojení
Klinická data na potvrzených těhotenstvích nejsou k dispozici. Studie na zvířatech nenaznačují žádné škodlivé účinky s ohledem na těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj (viz bod 5.3 Předklinické údaje vztahující se k bezpečnosti).
Z preventivních důvodů je vhodné vyhnout se používání SonoVue během těhotenství.
Kojení
Není známo, zda je fluorid sírový vylučován do lidského mléka. Avšak kvůli jeho rychlému vylučování z těla ve vydechovaném vzduchu se předpokládá, že kojení může být obnoveno 2-3 hodiny po podání SonoVue.
4.7 Účinky na schopnost řídit a obsluhovat stroje
SonoVue nemá žádný nebo má jen nepatrný vliv na schopnost řídit nebo ovládat stroje.
4.8 Nežádoucí účinky
Bezpečnost SonoVue byla hodnocena u 4653 dospělých pacientů v 58 klinických studiích.
Nežádoucí účinky jsou klasifikovány podle třídy orgánových systémů a četnosti za použití následujícího pravidla: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000), není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů |
Nežádoucí účinek | ||
|
Frekvence | |||
|
Méně časté (> 1/1000 až < 1/100) |
Vzácné (> 1/10000 až < 1/1000) |
Není známo (z dostupných údajů nelze určit) | |
|
Poruchy imunitního systému |
Hypersenzitivita* | ||
|
Psychiatrické poruchy | |||
|
Poruchy nervového systému |
Bolest hlavy, parestezie, závrať, dysgeusie |
Bolest hlavy způsobená sinusitidou |
Vazovagální reakce |
|
Poruchy oka |
Rozmazané vidění | ||
|
Cévní poruchy |
Zčervenání | ||
|
Srdeční poruchy |
Infarkt myokardu ** Ischemie myokardu ** | ||
|
Respirační, hrudní a mediastinální poruchy |
Faryngitida | ||
|
Gastrointestinální poruchy |
Nauzea Bolesti břicha | ||
|
Poruchy kůže a podkožní tkáně | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolesti zad | ||
|
Celkové poruchy a reakce v místě aplikace |
Tíže na hrudi, reakce v místě vpichu injekce, pocit horka |
Bolest na hrudi, bolest, únava | |
|
Vyšetření |
Vzestup glukózy v krvi | ||
* Případy hypersenzitivity mohou zahrnovat: kožní erytém, bradykardii, hypotenzi, dušnost, ztrátu vědomí, srdeční/kardio-respirační zástavu, anafylaktická reakce, anafylaktoidní reakce nebo anafylaktický šok.
** V některých případech hypersenzitivity u pacientů trpících onemocněním věnčitých tepen byla též zaznamenána ischemie a/nebo infarkt myokardu.
Ve velmi vzácných případech byly hlášeny smrtelné následky v časové souvislosti s podáním SonoVue. Všichni tito pacienti byli vysoce rizikoví kvůli závažným srdečním komplikacím, což mohlo vést k smrtelným následkům.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Vzhledem k tomu, že dosud neexistují případy předávkování, objektivní ani subjektivní příznaky předávkování nejsou identifikovány. Dávky až do 56 ml SonoVue byly podávány zdravým dobrovolníkům v klinické studii 1. fáze, aniž byly hlášeny vážné nežádoucí účinky. Pacient se má v případě předávkování sledovat a symptomaticky léčit.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Kontrastní látky pro vyšetření ultrazvukem ATC kód: V08DA.
Přídavek 0,9% injekčního roztoku chloridu sodného k lyofilizovanému prášku následovaný prudkým protřepáváním má za následek tvorbu mikrobublin fluoridu sírového. Mikrobubliny mají průměr přibližně 2,5 ^m, přičemž 90% má průměr menší než 6 ^m a 99% má průměr menší než 11 ^m. Jeden mililitr SonoVue obsahuje 8 ^l mikrobublin. Styčná plocha mezi bublinkou fluoridu sírového a vodným médiem funguje jako reflektor ultrazvukových paprsků, což zlepšuje echogenitu krve a zvyšuje kontrast mezi krví a okolní tkání.
Intenzita odraženého signálu závisí na koncentraci mikrobublin a frekvenci ultrazvukového paprsku. V navržených klinických dávkách SonoVue způsobil význačné zvýšení intenzity signálu na déle než 2 minuty pro B-režim zobrazování v echokardiografii a na 3 až 8 minut pro Dopplerovské zobrazení makrovaskulatury a mikrovaskulatury.
Fluorid sírový je inertní, neškodný plyn, těžko rozpustný ve vodných roztocích. V literatuře existují studie o použití tohoto plynu při studiu respirační fyziologie a pro pneumatickou retinopexii.
5.2 Farmakokinetické vlastnosti
Celkové množství fluoridu sírového podaného v klinické dávce je extrémně nízké (mikrobubliny v 2 ml dávce obsahují 16 ^l plynu). Fluorid sírový se rozpouští v krvi a je následně vydechován.
Po jednotlivé nitrožilní injekci 0,03 nebo 0,3 ml SonoVue/kg (přibližně 1 a 10 ti násobek maximální klinické dávky) lidským dobrovolníkům byl fluorid sírový rychle eliminován. Průměrný terminální poločas byl 12 minut (rozsah 2 až 33 minut). Více než 80% podaného fluoridu sírového bylo prokázáno ve vydechovaném vzduchu během 2 minut po injekci a téměř 100% po 15 minutách.
U pacientů s difuzní intersticiální plicní fibrózou bylo prokázáno ve vydechovaném vzduchu průměrně 100% fluoridu sírového a terminální poločas byl podobný poločasu změřenému u zdravých dobrovolníků.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinická data z běžných studií bezpečnostní farmakologie, genotoxicity a reprodukční toxicity neodhalují žádné zvláštní riziko pro lidské jedince. Cékální léze, které byly pozorovány v některých studiích s opakovanými dávkami u krys, ale ne u opic, nejsou relevantní pro lidské jedince za normálních podmínek podávání.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Makrogol 4000
Distearoylfosfatidylcholin
Sodná sůl dipalmitoylfosfatidylglycerolu
Kyselina palmitová
Rozpouštědlo
Injekční roztok chloridu sodného 9 mg/ml (0,9%).
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky.
Chemická a fyzikální stabilita po rekonstituci byla prokázána na dobu 6 hodin. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání přípravku před použitím jsou v odpovědnosti uživatele.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Podmínky uchovávání po rekonstituci léčivého přípravku viz bod 6.3.
6.5 Druh obalu a velikost balení
Balení 02 (s odděleným MiniSpike přenosovým systémem):
25 mg suchého, lyofilizovaného prášku v atmosféře fluoridu sírového v bezbarvé injekční lahvičce ze skla typu I, s elastomerovým uzávěrem.
Oddělený přenosový systém.
Předplněná injekční stříkačka ze skla typu I obsahující 5 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%).
6.6 Zvláštní opatření pro likvidaci přípravku
Před použitím přípravek zkontrolujte a ujistěte se, že obal a uzávěr nejsou poškozeny.
SonoVue musí být před použitím připraven vstříknutím 5 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%) skrz zátku k obsahu injekční lahvičky. Injekční lahvička se pak prudce protřepává po dobu 20 sekund. Poté může být žádaný objem disperze nabrán do injekční stříkačky podle použitého systému následovně:
Balení 02 (s odděleným MiniSpike přenosovým systémem)
vl.0-08/2000 ©BRG 2000
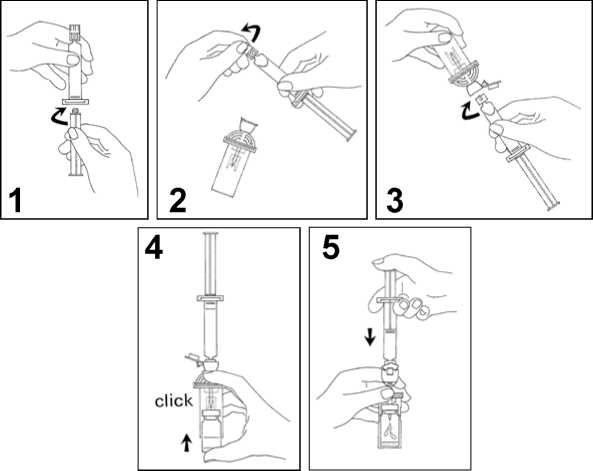
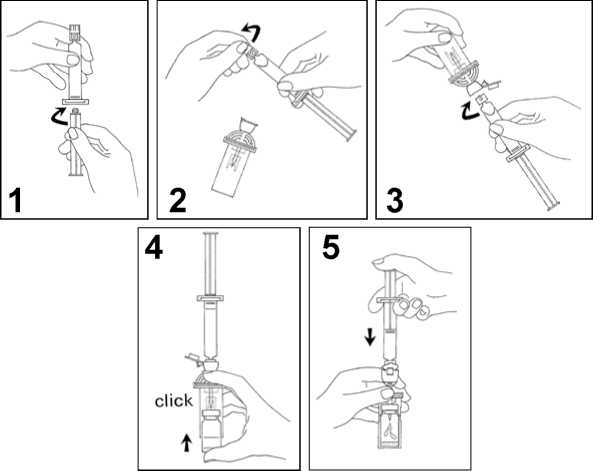
1. Připojte táhlo pístu na injekční stříkačku našroubováním ve směru hodinových ručiček.
2. Otevřete blistr MiniSpike přenosového systému a odstraňte víčko injekční stříkačky.
3. Otevřete kryt přenosového systému a připojte injekční stříkačku na přenosový systém našroubováním ve směru hodinových ručiček.
4. Odstraňte ochranný disk z injekční lahvičky. Vsuňte injekční lahvičku lehce do průhledné objímky přenosového systému a silným zatlačením zabezpečte injekční lahvičku na místě.
5. Vyprázdněte obsah injekční stříkačky do injekční lahvičky stlačením táhla pístu.
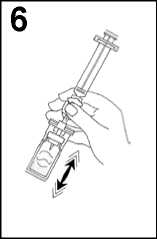
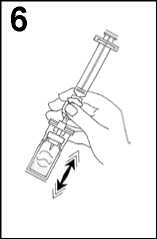
6. Prudce protřepávejte po 20 sekund, aby byl veškerý obsah injekční lahvičky promíchán a vytvořila se mléčná homogenní tekutina).
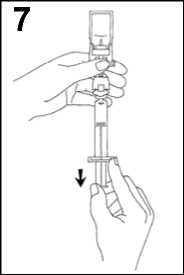
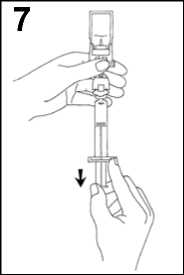
7. Převraťte systém a opatrně naberte SonoVue do injekční stříkačky.
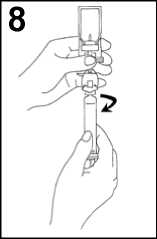
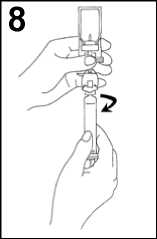
8. Odšroubujte injekční stříkačku od přenosového systému.
Nepoužívejte, pokud je získaná tekutina čirá a / nebo jsou v suspenzi vidět pevné částice lyofilizátu.
SonoVue se má podat okamžitě injekcí do periferní žíly.
Pokud SonoVue není použit okamžitě po rekonstituci, má se mikrobublinová disperze před nabráním do injekční stříkačky znovu protřepat. Chemická a fyzikální stabilita mikrobublinové disperze byla prokázána na dobu 6 hodin.
Injekční lahvička je určena pouze pro jedno vyšetření. Všechen nepoužitý léčivý přípravek nebo odpad musí být zlikvidovány v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bracco International B.V. Strawinskylaan 3051 NL - 1077 ZX Amsterdam Nizozemsko
8. REGISTRAČNÍ ČÍSLO
EU/1/01/177/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
26. března 2001/ 24. dubna 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ
LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Bracco Imaging S.p.A
Via Ribes 5, Biondustry Park
Colleretto Giacosa - 10010 (TO)
Itálie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2)
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Vnější obal, balení 02
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
SonoVue, sulfuris hexafluoridum 8 mikrolitrů/ml Prášek a rozpouštědlo pro injekční disperzi
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden mililitr obsahuje sulfuris hexafluoridum 8 mikrolitrů v mikrobublinách
3. SEZNAM POMOCNÝCH LÁTEK
Makrogol 4000, distearoylfosfatidylcholin, sodná sůl dipalmitoylfosfatidylglycerolu, kyselina palmitová
Rozpouštědlo: injekční roztok chloridu sodného 9 mg/ml (0,9%).
4. LÉKOVÁ FORMA A OBSAH BALENÍ
1 injekční lahvička obsahující 25 mg lyofilizovaného prášku k rozpuštění v 5 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%).
1 předplněná injekční stříkačka obsahující injekční roztok chloridu sodného 9 mg/ml (0,9%)
1 Mini-Spike Plus 6/8 (CE 0123) přenosový systém
1 ml rozpuštěné disperze obsahuje 8 mikrolitrů mikrobublin fluoridu sírového.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Intravenózní podání.
Před použitím si pečlivě přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Pouze k jednorázovému použití, všechen nespotřebovaný přípravek zlikvidujte
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bracco International B.V., Strawinskylaan 3051,
NL - 1077 ZX Amsterdam, Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/01/177/002
13. ČÍSLO ŠARŽE
c.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej lécivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
SonoVue 8 mikrolitrů/ml Prášek a rozpouštědlo pro injekční disperzi
2. ZPŮSOB PODÁNÍ
Intravenózní podání.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
25 mg lyofilizovaného prášku má být před podáním rekonstituováno v 5 ml injekčního roztoku chloridu sodného
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Injekční roztok chloridu sodného 9 mg/ml Pro použití se SonoVue
2. ZPŮSOB PODÁNÍ
Intravenózní podání
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace - informace pro pacienta
SonoVue, 8 mikrolitrů/ml, Prášek a rozpouštědlo pro injekční disperzi
sulfuris hexafluoridum
Přečtěte si pozorně celou příbalovou informaci dříve, než vám bude tento přípravek podán, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li případně další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán Vám, a proto jej nedávejte žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny
_v této příbalové informaci. Viz bod 4._
Co naleznete v této příbalové informaci
1. Co je SonoVue a k čemu se používá
2. Čemu musíte věnovat pozornost, než vám bude podán SonoVue
3. Jak se SonoVue podává
4. Možné nežádoucí účinky
5. Jak přípravek SonoVue uchovávat
6. Obsah balení a další informace
1. Co je SonoVue a k čemu se používá
SonoVue je kontrastní látka pouze pro diagnostické účely.
SonoVue je ultrazvuková kontrastní látka, která obsahuje drobné bublinky naplněné plynem označovaným jako fluorid sírový.
SonoVue je kontrastní látka, která pomáhá zajistit čistší ultrazvukový obraz vašeho srdce nebo vašich krevních cév anebo tkání jater a prsou.
2. Čemu musíte věnovat pozornost, než vám bude podán SonoVue
Přípravek SonoVue Vám nebude podán:
- jestliže j ste alergický(á) na fluorid sírový nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
- jestliže vám bylo řečeno, že máte pravo-levý srdeční zkrat
- jestliže máte závažnou plicní hypertenzi (tlak v plicní tepně > 90 mmHg)
- jestliže máte neléčený vysoký krevní tlak
- jestliže máte syndrom dechové tísně dospělých (závažný zdravotní stav charakteristický rozšířeným zánětem v plicích)
- jestliže vám bylo řečeno, abyste neužíval(a) přípravek společně s dobutaminem (lék, který stimuluje srdce) vzhledem k vašemu závažnému onemocnění srdce.
Upozornění a opatření
Informujte prosím svého lékaře, jestliže jste v posledních 2 dnech:
- měl(a) časté a/nebo opakované anginózní bolesti nebo bolesti na hrudi, zvláště pak, jestliže jste v minulosti trpěl(a) onemocněním srdce,
- měl(a) nedávné elektrokardiografické změny.
Před tím, než vám bude podán SonoVue, se poraďte se svým lékařem:
- jestliže jste měl(a) nedávno infarkt myokardu nebo jste podstoupil(a) operaci na věnčitých tepnách,
- jestliže trpíte anginou pectoris nebo bolestmi na hrudi nebo závažným onemocněním srdce,
- jestliže trpíte závažnými poruchami srdečního rytmu,
- jestliže se Vám nedávno zhoršilo srdeční onemocnění,
- jestliže máte akutní zánětlivé onemocnění obalu srdce (endokarditida),
- jestliže máte umělé srdeční chlopně,
- jestliže máte akutní celkový zánět nebo infekci,
- jestliže máte problém se srážením krve,
- jestliže máte závažné onemocnění ledvin nebo jater,
- jestliže máte neurologické onemocnění, které je nestabilní,
- jestliže máte závažné onemocnění plic anebo pokud potřebujete mechanickou podporu při dýchání.
Bude Vám monitorována aktivita vašeho srdce, váš krevní tlak a rytmus tak, že vám bude SonoVue podán spolu s lékem, cvičením nebo prostředkem, které stimulují srdce pro vizualizaci vašeho srdce při zátěži.
Děti a dospívající
SonoVue se nemá podávat pacientů mladším 18 let věku, protože nebyl u těchto skupin hodnocen. Další léčivé přípravky a SonoVue
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Zejména prosím informujte svého lékaře, pokud užíváte beta-blokátory (léky k léčbě onemocnění srdce a vysokého krevního tlaku nebo zeleného zákalu ve formě očních kapek).
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než vám bude tento přípravek podáván.
Není známo, zda SonoVue přechází do lidského mateřského mléka. Po ultrazvukovém vyšetření však nesmíte kojit po dobu dvou až tří hodin.
Řízení dopravních prostředků a obsluha strojů
SonoVue neovlivňuje schopnost řídit a používat stroje.
3. Jak se SonoVue podává
SonoVue vám podá lékař nebo zdravotnický pracovník, který má zkušenost s tímto typem vyšetření. Provede výpočet správné dávky pro Vás v závislosti na tom, která část těla je vyšetřována. Doporučená dávka je 2 nebo 2,4 ml na jednoho pacienta. Tato dávka může být dle potřeby opakována až do 4,8 ml.
Budete důkladně sledováni zdravotnickým pracovníkem po dobu alespoň 30 minut po injekci SonoVue.
Jestliže vám bylo podáno více SonoVue, než mělo
Předávkování je nepravděpodobné, protože SonoVue podává lékař. V případě předávkování provede lékař odpovídající opatření.
Možné nežádoucí účinky
4.
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Většina nežádoucích účinků u SonoVue je vzácných a obvykle nejsou závažné. Nicméně někteří pacienti mohou zaznamenat závažné nežádoucí účinky, které mohou vyžadovat léčbu.
Informujte ihned Vašeho lékaře, jestliže zaznamenáte některý z následujících nežádoucích účinků -můžete potřebovat neodkladnou léčbu:
- Příznaky vážné alergické reakce jako jsou otok obličeje, rtů, úst nebo hrdla, které mohou ztížit polykání nebo dýchání; kožní vyrážku; kopřivku; otok rukou, nohou nebo kotníků.
Při použití SonoVue byly hlášeny následující nežádoucí účinky:
Méně časté nežádoucí účinky (mohou postihnout až 1 osobu ze 100):
- Bolest hlavy
- Snížená citlivost
- Závrať
- Nezvyklá chuť v ústech
- Zarudnutí
- Bolesti na hrudi
- Podráždění v krku
- Pocit na zvracení (nauzea)
- Bolest břicha
- Svědění; kožní vyrážka
- Bolest zad
- Pocit horka
- Lokální reakce v místě vpichu injekce jako: bolest nebo neobvyklé pocity v místě vpichu injekce
- Zvýšení hladiny cukru v krvi
Vzácné (mohou postihnout až 1 osobu z 1000):
- Nespavost
- Bolest nebo tlak na čele, tvářích, nosu a mezi ušima
- Rozmazané vidění
- Snížení krevního tlaku
- Celková bolest
- Bolest na hrudi
- Únava
- Závažné a méně závažné alergické reakce (včetně zarudnutí kůže, snížení tepové frekvence, poklesu krevního tlaku, dušnosti, ztráty vědomí, srdeční/kardio-respirační zástavy nebo závažnější reakce s dechovými potížemi a závratí)
Není známo (frekvenci nelze z dostupných údajů určit):
- Mdloba
- U pacientů s onemocněním srdečních krevních cév byly v některých případech alergických reakcí hlášeny případy nedostatečného zásobení srdce kyslíkem a srdeční zástava.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek SonoVue uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na obalu. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Disperze SonoVue se má podat během 6 hodin po přípravě.
6. Obsah balení a další informace Co SonoVue obsahuje
- Léčivou látkou je sulfuris hexafluoridum ve formě mikrobublin.
- Pomocnými látkami jsou: makrogol 4000, distearoylfosfatidylcholin, sodná sůl dipalmitoylfosfatidylglycerolu, kyselina palmitová.
Skleněná injekční stříkačka obsahuje injekční roztok chloridu sodného 9 mg/ml (0,9%).
Jak přípravek SonoVue vypadá a co obsahuje toto balení
SonoVue je sada, která sestává ze skleněné injekční lahvičky obsahující bílý prášek, skleněné injekční stříkačky obsahující rozpouštědlo a přenosového systému.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Bracco International B.V.
Strawinskylaan 3051 NL-1077 ZX Amsterdam Nizozemsko
Výrobce:
Bracco Imaging S.p.A
Via Ribes 5, Biondustry Park
Colleretto Giacosa - 10010 (TO)
Itálie
Datum poslední revize textu Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
Následující informace jsou určené pouze pro profesionální zdravotnické pracovníky
Pokud se SonoVue nepoužívá těsně po rekonstituci, je třeba disperzi znovu před odběrem do stříkačky protřepat.
Přípravek j e určen pouze pro j edno vyšetření. Jakákoliv nepoužitá tekutina, která zůstává na konci
vyšetření, se musí vyhodit.
Pokyny pro rekonstituci:
Balení 02 (s odděleným MiniSpike přenosovým systémem CE0123)
„ Obrázky 1 až 8“
v1.0-08/2000 ©BRG 2000
1. Napojte táhlo pístu na injekční stříkačku našroubováním ve směru hodinových ručiček.
2. Otevřete blistr MiniSpike přenosového systému a odstraňte víčko injekční stříkačky.
3. Otevřete kryt přenosového systému a připojte injekční stříkačku na přenosový systém našroubováním ve směru hodinových ručiček.
4. Odstraňte ochranný disk z injekční lahvičky. Vsuňte injekční lahvičku lehce do průhledné objímky přenosového systému a silným zatlačením zabezpečte injekční lahvičku na místě.
5. Vyprázdněte obsah injekční stříkačky do injekční lahvičky stlačením táhla pístu.
6. Prudce protřepávejte po 20 sekund, aby byl veškerý obsah injekční lahvičky promíchán a vytvořila se mléčná homogenní tekutina.
7. Převraťte systém a opatrně naberte SonoVue do injekční stříkačky.
8. Odšroubujte injekční stříkačku od přenosového systému.
Po rekonstituci je SonoVue homogenní bílá mléčná disperze.
Nepoužívejte, pokud je získaná tekutina čirá a / nebo jsou v suspenzi vidět pevné částice
lyofilizátu.
Disperzi SonoVue je třeba podat během šesti hodin od její přípravy.
23