Somatuline Autogel 120 Mg
sp.zn. sukls110147/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC)
1. NÁZEV PŘÍPRAVKU
SOMATULINE AUTOGEL 60 mg, injekční roztok v předplněné stříkačce SOMATULINE AUTOGEL 90 mg, injekční roztok v předplněné stříkačce SOMATULINE AUTOGEL 120 mg, injekční roztok v předplněné stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna předplněná stříkačka obsahuje lanreotidum 60 mg, 90 mg, 120 mg (jako lanreotidi acetas).
Jedna předplněná stříkačka obsahuje supemasycený roztok lanreotid-acetátu, odpovídající 0,246 mg baze lanreotidu/mg roztoku, který zajišťuje podání dávky 60 mg, 90 mg nebo 120 mg lanreotidu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok v předplněné stříkačce.
Bílý až světle žlutý polotuhý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
SOMATULINE AUTOGEL je indikován:
• k dlouhodobé léčbě pacientů s akromegalií, kde cirkulující hladiny GH (růstového hormonu) a/nebo IGF-1 (inzulínu podobného růstového faktoru-1) zůstávají abnormální po chirurgické léčbě a/nebo radioterapii, nebo pro pacienty pro které není chirurgická léčba a/nebo radioterapie možností volby. Cílem léčby u akromegalie je snížit, nebo je-li to možné, normalizovat hodnoty GH a IGF-1.
• k úlevě od příznaků spojených s akromegalií.
• k léčbě gastroenteropankreatických neuroendokrinních nádorů (GEP-NETs) stupně 1 a podskupiny stupně 2 (index Ki67 až do 10%) středního střeva, pankreatu nebo s neznámou lokalizací, u kterých byl vyloučen původ v zadním střevě, u dospělých pacientů s inoperabilním lokálně pokročilým nebo metastatickým onemocněním (viz bod 5.1).
• k léčbě symptomů spojených s neuroendokrinními tumory.
4.2 Dávkování a způsob podání
Dávkování
Akromegalie a úleva od příznaků spojených s akromegalií Doporučená zahajovací dávka je 60 až 120 mg podaných každých 28 dní.
Je-li například dosud pacient léčen přípravkem SOMATULINE P.R. 30 mg v dávkování 1 injekce každých 14 dní, má být počáteční dávka přípravku SOMATULINE AUTOGEL 60 mg každých 28 dní. Je-li pacientovi podáván SOMATULINE P.R. 30 mg každých 10 dní, počáteční dávka SOMATULINE AUTOGEL má být 90 mg každých 28 dní.
Poté má být dávka individualizována podle odpovědi pacienta (hodnoceno jako snížení symptomů a/nebo snížení hodnot GH/IGF-1).
Není-li dosaženo požadované odpovědi, dávka může být zvýšena.
Je-li dosaženo kompletní kontroly nemoci (hodnota GH je pod 1 ng/ml, normalizace IGF1 a/nebo vymizení příznaků), dávka může být snížena.
Pacienti dobře kompenzovaní analogem somatostatinu mohou být léčení přípravkem SOMATULINE AUTOGEL 120 mg každých 42-56 dní.
Dlouhodobé monitorování příznaků, hodnot GH a IGF-1 se má provádět podle klinické potřeby.
Léčba gastroenteropankreatických neuroendokrinních nádorů stupně 1 a podskupiny stupně 2 (index Ki67 až do 10%) středního střeva, pankreatu nebo s neznámou lokalizací, u kterých byl vyloučen původ v zadním střevě, u dospělých pacientů s inoperabilním lokálně pokročilým nebo metastatickým onemocněním
Doporučená dávka je jedna injekce přípravku Somatuline Autogel 120 mg podaná každých 28 dní. Léčba přípravkem Somatuline Autogel má pokračovat tak dlouho, jak je potřeba pro kontrolu tumoru.
Léčba symptomů spojených s neuroendokrinními tumory Doporučená počáteční dávka je 60 až 120 mg podaných každých 28 dní.
Dávka má být přizpůsobena podle stupně dosažené symptomatické úlevy.
Pacienti dobře kompenzovaní analogem somatostatinu mohou být léčení přípravkem SOMATULINE AUTOGEL 120 mg každých 42-56 dní.
Porucha funkce jater a/nebo ledvin:
U pacientů se sníženou funkcí ledvin nebo jater není nutná žádná úprava dávky díky širokému terapeutickému oknu lanreotidu (viz bod 5.2)
Starší pacienti:
U starších pacientů není nutná žádná úprava dávky díky širokému terapeutickému oknu lanreotidu (viz bod 5.2)
Pediatrická populace:
SOMATULINE AUTOGEL není doporučen k použití u dětí a adolescentů pro nedostatek údajů o bezpečnosti a účinnosti.
Způsob podání
SOMATULINE AUTOGEL má být podán hlubokou subkutánní injekcí do horního zevního kvadrantu hýždě zdravotnickým profesionálem.
U pacientů léčených pro akromegalii nebo symptomy související s neuroendokrinními tumory, kteří dostávají stabilní dávku přípravku SOMATULINE AUTOGEL, může být po odpovídajícím zaškolení přípravek podán buď pacientem, nebo poučenou osobou. V případě, že si pacient aplikuje injekci sám, má být injekce podána do horní zevní části stehna.
O podání pacientem nebo poučenou osobou rozhoduje zdravotnický profesionál.
Bez ohledu na místo injekce nemá být kůže zřasena a jehla má být vpravena rychle celou svou délkou kolmo ke kůži.
Místo injekce se má střídat mezi pravou a levou stranou.
4.3 Kontraindikace
Hypersenzitivita na somatostatin nebo příbuzné peptidy nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Lanreotid může snižovat motilitu žlučníku a vést ke vzniku žlučových kamenů. Proto by měli být pacienti pravidelně sledováni.
Farmakologické studie u zvířat a u lidí ukazují, že lanreotid, stejně jako somatostatin a jeho analoga, snižuje sekreci inzulínu a glukagonu. Z tohoto důvodu se může u pacientů, léčených lanreotidem objevit hypoglykémie nebo hyperglykémie. Je třeba kontrolovat hladinu glukózy v krvi při zahájení léčby lanreotidem nebo při změně dávky a jakoukoli antidiabetickou léčbu je třeba podle toho přizpůsobit.
Během léčby lanreotidem bylo u akromegalických pacientů pozorováno mírné snížení funkcí štítné žlázy, ačkoliv klinický hypotyreoidismus je vzácný. Vyšetření thyreoidních funkcí by mělo být provedeno tam, kde je to klinicky indikováno.
U pacientů bez základních kardiálních problémů může vést lanreotid ke snížení pulsové frekvence, aniž by tato nutně dosáhla hranice bradykardie. U pacientů trpících na srdeční poruchy před léčbou lanreotidem se může objevit sinusová bradykardie. Pozornosti je třeba pokud se zahajuje léčba lanreotidem u pacientů s bradykardií (viz oddíl 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Farmakologické gastrointestinální účinky lanreotidu mohou vést ke snížení střevní absorpce současně podaných léků včetně cyklosporinu.
Průvodní podání cyklosporinu s lanreotidem může snížit relativní biodostupnost cyklosporinu, což může vyžadovat úpravu dávky cyklosporinu k udržení terapeutických hladin.
Interakce s léky s vysokou vazbou na plasmu jsou nepravděpodobné vzhledem k mírné vazbě lanreotidu na sérové proteiny.
Limitovaná publikovaná data naznačují, že průvodní podání somatostatinových analog a bromokriptinu může zvýšit dostupnost bromokriptinu.
Průvodní podání bradykardizujících léků (např. betablokátorů) může mít aditivní účinek na mírné snížení srdeční frekvence spojené s lanreotidem. Může být nutné upravit dávku takových průvodních léků.
Limitovaná dostupná publikovaná data naznačují, že somatostatinová analoga mohou snížit metabolickou clearance látek metabolizovaných enzymy cytochromu P450, což může být v důsledku suprese růstového hormonu. Jelikož není možné vyloučit tento účinek lanreotidu, jiné léky metabolizované především CYP3A4 a mající nízký terapeutický index (např. quinidin, terfenadin) by proto měly být použity s opatrností.
4.6 Fertilita, těhotenství a kojení
Studie na zvířatech neprokázaly teratogenní účinky související s lanreotidem během organogeneze. Údaje z limitovaného počtu těhotných žen, kterým byl podáván lanreotid, nenaznačují žádné nežádoucí účinky lanreotidu na těhotenství nebo na zdraví fetu/novorozence. Doposud nejsou k dispozici žádné jiné relevantní epidemiologické údaje.
Jelikož studie na zvířatech nej sou vždy prediktivní na odpověď člověka, lanreotid by měl být podán u těhotné ženy jen, je-li to jasně potřebné.
Kojení
Není známo, zda se léčivá látka vylučuje do mateřského mléka.
Jelikož se mnoho léčivých látek vylučuje do mateřského mléka, je třeba pozornosti, pokud je lanreotid podáván během laktace.
Fertilita
Snížená fertilita byla pozorována u samic potkanů v důsledku inhibice sekrece GH dávkami přesahujícími terapeutické dávky dosahované u člověka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Somatuline Autogel má mírný nebo středně závažný vliv na schopnost řídit a obsluhovat stroje. Nebyly provedeny žádné studie sledující vliv na schopnost řídit nebo obsluhovat stroje. Nicméně při použítí Somatuline Autogel byla hlášena závrať (viz bod 4.8), jestliže se toto u pacienta projeví, nesmí řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky hlášené pacienty s akromegalií a GEP-NETs léčenými lanreotidem v klinických studiích jsou vyjmenovány pod odpovídajícím orgánovým systémem podle následující klasifikace: velmi časté (> 1/10), časté (> 1/100 až 1/10), méně časté (> 1/1000 až 1/100).
4/11
Nejčastěji očekávané nežádoucí účinky po léčbě lanreotidem jsou gastrointestinální poruchy (nejčastěji hlášené jsou průjem a bolest břicha, obvykle mírné až průměrné a přechodné), cholelitiáza (často asymptomatická) a reakce v místě injekce (bolest, uzlíky a zatvrdnutí).
Profil nežádoucích účinků je pro všechny indikace podobný.
|
Třídy orgánových systémů |
Velmi časté (>1/10) |
Časté (>1/100 až <1/10) |
Méně časté (>1/1,000 až <1/100) |
Postmarketingové bezpečnostní zkušenosti (frekvence není známo) |
|
Poruchy metabolismu a výživy |
Hypoglykemie, Snížená chuť k jídlu**, hyperglykemie, diabetes mellitus | |||
|
Psychiatrické poruchy |
Nespavost* | |||
|
Poruchy nervového systému |
Závrať, bolest hlavy, letargie** | |||
|
Srdeční poruchy |
Sinusová bradykardie* | |||
|
Cévní poruchy |
Návaly horka* | |||
|
Gastrointestinální poruchy |
Průjem, řídká stolice, bolest břicha. |
zácpa, flatulence, břišní distenze, abdominální diskomfort, steatorea |
Odbarvená stolice |
Pankreatitida |
|
Poruchy jater a žlučových cest |
Cholelitiáza |
Dilatace žlučových cest* | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Muskuloskeletální bolest**, Myalgie* | |||
|
Poruchy kůže a podkožní tkáně |
Alopecie, Hypotrichóza* | |||
|
Celkové poruchy a reakce v místě aplikace |
Astenie, reakce v místě injekce (bolest, rezistence, indurace, uzlíky, svědění) | |||
|
Vyšetření |
zvýšené ALT,* abnormální AST*, abnormální ALT*, zvýšený bilirubin v krvi*, zvýšení glukózy v krvi*, zvýšený glykosylovaný hemoglobin*, pokles tělesné |
zvýšení AST*, zvýšení alkalické fosfatázy v krvi*, abnormální bilirubin v krvi*, snížení natria v krvi* |
|
hmotnosti*, pokles pankreatických enzymů** | ||||
|
Poruchy imunitního systému |
Alergické reakce (včetně angioedému, anfylaxe, hypersenzitivity) |
* založeno na studiích provedených u pacientů s akromegalií ** založeno na studiích provedených u pacientů s GEP-NETs
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10 webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Při předávkování jsou indikována symptomatická opatření.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: hypotalamické hormony. ATC kód: H01CB03
Lanreotid je oktapeptidový analog přirozeného somatostatinu. Stejně jako somatostatin je lanreotid inhibitor různých endokrinních, neuroendokrinních, exokrinních a parakrinních funkcí. Lanreotid vykazuje vysokou vazebnou afinitu k lidským receptorům pro somatostatin (SSTR) 2 a 5, a redukovanou afinitu k lidským SSTR 1, 3 a 4. Účinek na lidský SSTR 2 a 5 je hlavním mechanismem účinku zodpovědného za snížení GH. Lanreotid je aktivnější než přirozený somatostatin a prokazuje delší trvání účinku.
Lanreotid, stejně jako somatostatin, vykazuje všeobecný exokrinní antisekretorický účinek. Snižuje bazální sekreci motilinu, žaludečního inhibičního peptidu a pankreatického polypeptidu, ale nemá signifikantní účinek na sekretin nalačno nebo na sekreci gastrinu. Dále snižuje hladiny plasmatického chromograninu A a močové 5-HIAA (kyselina 5-hydroxyindoloctová) u pacientů s GEP-NETs a zvýšenými hladinami těchto tumorových markerů.
Lanreotid zjevně snižuje jídlem indukované zvýšení průtoku v arteria mesenterica superior a ve vena portae. Lanreotid signifikantně snižuje prostaglandinem E1 stimulovanou jejunální sekreci vody, sodíku, draslíku a chloridu. Lanreotid snižuje hladinu prolaktinu u dlouhodobě léčených pacientů s akromegalií.
V otevřené studii byl Somatuline Autogel 120 mg podáván každých 28 dní po dobu 48 týdnů 90-ti dosud neléčeným akromegalickým pacientům s diagnostikovaným hypofyzárním makroadenomem. Pacienti, u kterých se v průběhu trvání studie očekávala potřeba operace hypofýzy nebo radioterapie, byli vyloučeni.
Zatímco počet pacientů, kteří dosáhli požadovaných hodnot, nedosáhl statistické významnosti, u 56/89 pacientů (63% - 95% CI:52% - 73%) bylo v týdnu 48 pozorováno klinicky významné zmenšení objemu tumoru o > 20%. Zmenšení o méně než 20% bylo získáno u 24/89 pacientů (27%) a zvětšení
6/11
objemu tumoru bylo pozorováno u 9/89 pacientů (10%). V týdnu 48 bylo průměrné procentuální zmenšení objemu tumoru 26,8 %.Při počátečním vyšetření byly hladiny růstového hormonu < 2,5 jag/l u 13 (14,4%) pacientů a hladiny IGF-1 byly v normálním rozsahu u 1 (1,1%) pacienta.
V týdnu 48 byly hladiny růstového hormonu pod 2,5 pg/l u 77,8% pacientů a hladiny IGF-1 byly normalizovány u 50 %. Normalizované hladiny IGF-1 se současnou hladinou růstového hormonu pod 2,5 pg/l byly pozorovány u 43,5 % pacientů.
Většina pacientů hlásila zřetelnou úlevu od symptomů akromegalie jako je bolest hlavy (38,7%), únava (56,5%), nadměrné pocení (66,1%), artralgie (59,7%) a otoky měkkých tkání (66,1%). Snížení objemu tumoru stejně jako hladin růstového hormonu a IGF-1 bylo pozorováno od 12. až do 48. týdne. Ze studie byli vyloučeni pacienti, u kterých se v průběhu trvání studie očekávala potřeba operace hypofýzy nebo radioterapie.
Randomizovaná, dvojitě zaslepená, multicentrická, placebem kontrolovaná studie fáze III s fixní dobou trvání 96 týdnů s přípravkem Somatuline Autogel byla provedena u pacientů s gastroenteropankreatickými neuroendokrinními tumory za účelem hodnocení antiproliferativního účinku lanreotidu.
Pacienti byli randomizováni v poměru 1:1 tak, že dostávali buď Somatuline Autogel 120 mg každých 28 dní (n=101) nebo placebo (n=103). Randomizace byla rozvrstvena dle předchozí terapie při vstupu a přítomnosti/absenci progrese na počátku podle hodnocení RECIST 1.0 (Response Evaluation Criteria in Solid Tumors) během 3 až 6 měsíců screeningové fáze.
Pacienti měli metastatické a/nebo lokálně pokročilé inoperabilní onemocnění s histologicky potvrzeným dobře nebo středně dobře diferencovaným tumorem primárně lokalizovaným v pankreatu (44,6% pacientů), středním střevě (35,8%), zadním střevě (6,9%) nebo jiné/neznámé primární lokalizace (12,7%).
69% pacientů s GEP-NETs mělo tumor stupně 1 (G1), definovaný buď indexem proliferace Ki67<
2% (50,5% z celkové populace pacientů) nebo mitotický index < 2 mitózy/10 HPF (18,5% z celkové populace pacientů) a 30% pacientů s GEP-NETs mělo tumor v nižším rozsahu stupně 2 (G2) (definováno indexem Ki67> 2% - < 10%). Stupeň nebyl k dispozici u 1% pacientů. Ze studie byli vyloučeni pacienti s G2 GEP-NETs s vyšším buněčným indexem proliferace (Ki 67 >10% - < 20%) a G3 GEP neuroendokrinním karcinomem (Ki 67 index > 20%).
Celkově mělo 52,5% pacientů nálož tumoru v játrech <10%, 14,5% mělo nálož tumoru v játrech > 10 a <25% a 33% mělo nálož tumoru v játrech >25%.
Primárním cílem bylo přežití bez progrese (PFS) měřeno buď jako doba do progrese dle RECIST 1.0 nebo doba do úmrtí během 96 týdnů od prvního podání léčby. Analýza PFS využila nezávislého centrálně hodnoceného radiologického hodnocení progrese.
Tabulka 1: Výsledky ^ účinnosti studie fáze III
|
Medián přežití bez progrese (týdny) |
Poměr rizika (95% CI) |
Snížení rizika progrese nebo úmrtí |
p-value | |
|
Somatuline Autogel (n=101) |
Placebo (n=103) | |||
|
> 96 týdnů |
72.00 týdnů (95% CI : 48.57, 96.00) |
0.470 (0.304, 0.729) |
53% |
0.0002 |
Graf 1- Kaplan-Meierovy křivky přežití bez progrese
Soraarcdr* Aiicos* i -i = 'Cl;
- IWbil*
Placní n= 103
- T2 í>tfnu
ID
PGíTiůr VEtia = 0.47
96% a IO M -0.731
0 JZC2
Čas (týdny \
Poíeí subteKM stáae v ohroženi Ěornaiyíme: AgEogel 1 Dl 94
Piacetw 103 1Q1 fl?
Příznivý účinek lanreotidu na snížení rizika progrese nebo úmrtí byl konzistentní bez ohledu na lokalizaci primárního nádoru, nálož tumoru v játrech, předchozí chemoterapii, počátečním Ki67, stupni tumoru nebo dalších předem specifikovaných vlastnostech jak ukazuje Tabulka 2.
Klinicky relevantní přínos léčby s přípravkem Somatuline Autogel byl pozorován u pacientů s tumory pankreatu, středního střeva a jiného/neznámého původu, jak bylo v celkové populaci studie. Omezený počet pacientů s tumory zadního střeva (14/204) přispěl k obtížnosti interpretace výsledků v této podskupině. Dostupná data naznačovala nulový přínos lanreotidu u těchto pacientů.
Graf 2 - Výsledky Coxovy analýzy proporcionálních rizik proměnných PFS
|
w | |
|
Véh |
204 |
|
PoCaleíni chrgmojjraniP A |
199 |
|
Počáteční KÍ7 |
204 |
|
3tdy rtlífiS indfr.» JBMI) |
1W |
|
SlupaA nJSoru |
202 |
|
Nalož ■nádoru |a1roeh |
204 |
|
UmlSiénj primárního nacfcru |
204 |
|
Ptedehoaf ťiswBaémpla |
204 |
|
rTfldchoř- oparan* primárního napaiu |
204 |
|
Rasa |
204 |
|
Pohlaví |
204 |
|
Doba od alanovanl diagnózy |
204 |
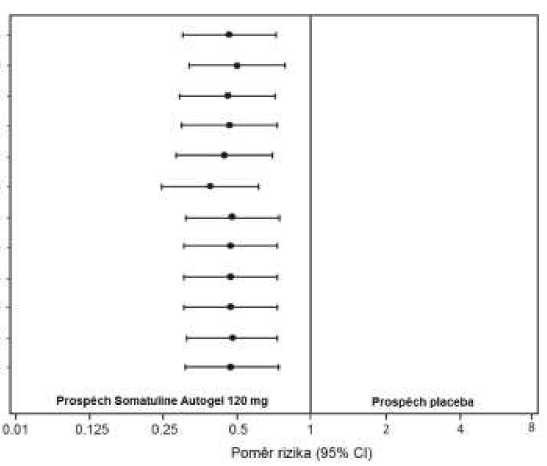
Poznámka Vfl«hny parníky rte® jsoíí pamiry tem pro Stima/Siřin* AwogeJ placabo Výslechy prorp^v.yr.h i&ou «T»«k«jí « &arro5iab»ých Co* fir*«tehj s podmínka-tti pra progresi pfi poůůLeínlnt yyJel/er ptedtíiazi léí&u pn vsLupv a aMminkam uvídenyra* ra vtrlfcáftii oae
K přechodu z placeba do otevřené studie se Somatuline Autogelem během prodloužení studie došlo u 45,6% (47/103) pacientů.
Pediatrická populace
Evropská léková agentura rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Somatuline Autogel u všech podskupin pediatrické populace u akromegalie a hypofyzárního gigantismu (pro informace o použití u pediatrické populace viz bod 4.2 ). Evropská agentura pro léčivé přípravky uvedla gastroenteropankreatické tumory (s výjimkou neuroblastomu, neuroganglioblastomu, fechromocytomu) na seznam třídy výjimek.
5.2 Farmakokinetické vlastnosti
Vlastní farmakokinetické parametry lanreotidu po intravenózním podání u zdravých dobrovolníků ukázaly limitovanou extravaskulární distribuci, s ustáleným stavem distribuce 16,1 l. Celková clearance byla 23,7 l/h, terminální poločas byl 1,14 hod. a střední pobytový čas byl 0.68 hod.
Ve studiích hodnotících exkreci bylo méně než 5 % lanreotidu vyloučeno do moči a méně než 0,5 % se objevilo nezměněno ve stolici, což naznačuje určitou biliární exkreci.
Po hlubokém subkutánním podání SOMATULINE AUTOGEL 60, 90 a 120 mg zdravým dobrovolníkům koncentrace lanreotiodu stoupá, až dosáhne průměrnou maximální sérovou koncentraci 4,25,8,39 a 6,79 ng/ml. Tyto hodnoty Cmax jsou dosaženy během prvního dne 8, 12 a 7 hodin po podání (střední hodnota). Od vrcholu sérová hladina koncentrace lanreotidu pomalu klesá podle kinetiky prvního řádu s terminálním eliminačním poločasem 23,3,27,4 a 30,1 dne a 4 týdny po podání byly průměrné sérové hladiny lanreotidu 0,9 , 1,11 a 1,69 ng/ml. Absolutní bioavailability byla 73,4,69,0 a 78,4 %.
Po hlubokém subkutánním podání SOMATULINE AUTOGEL 60, 90 a 120 mg akromegalickým pacientům koncentrace lanreotidu stoupá, až dosáhne průměrnou maximální sérovou koncentraci 1,6 , 3,5 a 3,1 ng/ml. Tyto hodnoty Cmax jsou dosaženy během prvního dne 6, 6 a 24 hodin po podání. Od vrcholu sérová hladina koncentrace lanreotidu pomalu klesá podle kinetiky prvního řádu a 4 týdny po podání byly průměrné sérové hladiny lanreotidu 0,7 , 1,0 a 1,4 ng/ml.
Ustáleného stavu sérových hladin lanreotidu bylo dosaženo v průměru po 4 injekcích každé 4 týdny. Po opakovaném podání dávky každé 4 týdny byly průměrné hodnoty Cmax v ustáleném stavu 3,8 , 5,7 a 7,7 ng/ml pro 60, 90 a 120 mg. Průměrné obdržené hodnoty Cmin byly 1,8 , 2,5 a 3,8 ng/ml. Fluktuační index vrcholového koryta byl mírný a pohyboval se od 81 do 108 %.
Po hlubokém subkutánním podání SOMATULINE AUTOGEL 60, 90 a 120 mg akromegalickým pacientům byl pozorován lineární farmakologický profil uvolňování.
Koryto sérových hladin lanreotidu získaných po třech hlubokých subkutánních injekcích přípravků SOMATULINE AUTOGEL 60, 90 nebo 120 mg podaných každých 28 dní jsou podobné ustálenému stavu sérových hladin lanreotidu získaných u akromegalických pacientů předtím léčených intramuskulárním podáním lanreotidu 30 mg - formy s prodlouženým uvolňováním (Somatuline P.R.) každých 14, 10 nebo 7 dní.
V populační farmakokinetické analýze provedené u 290 pacientů s GEP-NET léčených přípravkem Somatuline Autogel 120 mg, byl pozorován rychlý počáteční nástup s průměrnými hodnotami Cmax 7,49 ± 7,58 ng/mL, kterých bylo dosaženo během prvního dne po podání jediné injekce. Koncentrace rovnovážného stavu byly dosaženy po 5 injekcích přípravku Somatuline Autogel 120 mg podaných každých 28 dní a udržely se až do posledního hodnocení (až 96 týdnů po první injekci). Při rovnovážném stavu byly průměrné hodnoty Cmax 13.9 ± 7.44 ng/mL a průměrné minimální sérové hladiny byly 6.56 ± 1.99 ng/ml. Průměrný zjevný terminální poločas byl 49.8 ± 28.0 dní.
Porucha funkce ledvin/jater
Subjekty s těžkou poruchou funkce ledvin vykazují zhruba dvojnásobný pokles celkové sérové clearance lanreotidu s následným zvýšením poločasu a AUC. U subjektů se středně těžkou a těžkou poruchou funkce jater bylo pozorováno snížení clearance (30 %). Distribuční objem a střední pobytový čas se zvýšil u subjektů se všemi stupni hepatální insuficience.
Nebyl pozorován žádný účinek na clearance lanreotidu v rámci populační farmakokinetické analýzy pacientů s GEP-NETs zahrnující 165 pacientů s lehkou až středně těžkou poruchou funkce ledvin (106 a 59 v tomto pořadí) léčených přípravkem Somatuline Autogel. Pacienti s GEP-NET s těžkou poruchou funkce ledvin nebyli studováni.
Pacienti s GEP-NET s hepatálním poškozením (dle Child-Pugh skóre) nebyli studováni.
Není nutné měnit počáteční dávku u pacientů s renálním nebo hepatálním poškozením, jelikož očekávaná sérová koncentrace lanreotidu u těchto populací je v rozmezí sérových koncentrací bezpečně tolerovaných u zdravých subjektů.
Starší pacienti
Starší subjekty vykazují zvýšení poločasu a střední doby rezidence v porovnání s mladými zdravými subjekty. Není nutné měnit počáteční dávku u starších pacientů, jelikož očekávaná sérová koncentrace lanreotidu u této populace je v rozmezí sérových koncentrací bezpečně tolerovaných u zdravých subjektů.
V populační farmakokinetické analýze pacientů s GEP-NETs zahrnující 122 pacientů ve věku od 65 do 85 let nebyl pozorován žádný účinek na clearance a distribuční objem lanreotidu.
5.3 Předklinické údaje vztahující se k bezpečnosti přípravku
Ve studiích karcinogenicity (bioassay) prováděných na potkanech a myších nebyly pozorovány žádné systémové neoplastické změny v dávkách přesahujících terapeutické dávky dosahované u lidí. Zvýšená incidence podkožních nádorů byla pozorována v místě injekce pravděpodobně v důsledku zvýšené frekvence dávky u zvířat (denně) v porovnání s měsíčním dávkováním u lidí, a proto nemusí být klinicky relevantní.
Ve standardních řadových in vitro a in vivo testech nevykazoval lanreotid žádný genotoxický potenciál.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Voda na injekci, kyselina octová 99% (pro úpravu pH).
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
Po otevření ochranného laminátového sáčku by měl být přípravek bezprostředně podán.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 oC - 8 oC) v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
SOMATULINE AUTOGEL je dodáván v čiré polypropylenové předplněné stříkačce vybavené automatickým bezpečnostním systémem, jehlou z nerezavějící oceli, plastikovým krytem jehly (LDPE) a zátkou z bromobutylové pryže. Každá předplněná stříkačka je balena v laminátovém sáčku (nylonový / polyethylenový / aluminiový laminát) a krabičce.
Obsah balení
Krabička s jednou 0,5 ml stříkačkou s automatickým bezpečnostním systémem a jednou jehlou (1,2 mm x 20 mm).
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Injekční roztok v předplněné stříkačce je připraven k použití.
K bezprostřednímu jednorázovému použití po otevření.
Je důležité, aby injekce přípravku byla provedena přesně podle návodu uvedeného v příbalové informaci.
Nepoužívejte, jestliže laminátový sáček je poškozený nebo otevřený.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Ipsen Pharma, Boulogne Billancourt, Francie
8. REGISTRAČNÍ ČÍSLA
SOMATULINE AUTOGEL 60 mg: 56/002/03-C SOMATULINE AUTOGEL 90 mg: 56/003/03-C SOMATULINE AUTOGEL 120 mg: 56/004/03-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 8.1.2003
Datum posledního prodloužení registrace: 7.5.2014
10. DATUM REVIZE TEXTU
27.2.2015
11/11