Serevent Diskus
sp.zn. sukls167838/2011 a sukls163572/2013
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Serevent Diskus Dávkovaný prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Salmeteroli xinafoas, 72,5 mikrogramů, což odpovídá Salmeterolum 50 mikrogramů, v jedné dávce.
Pomocná látka se známým účinkem: monohydrát laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Dávkovaný prášek k inhalaci. Bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Salmeterol je agonista beta2-adrenoreceptorů s dlouhodobým účinkem, který se užívá pouze k doplnění kortikosteroidní léčby astma bronchiale. K dosažení optimální léčby kortikosteroidy poskytuje salmeterol dodatečnou symptomatickou léčbu (viz bod 4.4). Pacienty je nutné varovat, aby bez doporučení lékaře nepřerušovali ani neomezovali kortikosteroidní terapii, a to ani tehdy, cítí-li se lépe (viz bod 4.4).
• Dospělí
Při reverzibilní obstrukci dýchacích cest způsobené astmatem, chronickou obstrukční plicní nemocí (CHOPN) nebo chronickou bronchitidou poskytuje salmeterol dlouhotrvající (12 hodin) bronchodilataci. Dlouhodobá pravidelná léčba tímto přípravkem při dávkování dvakrát denně je vhodná k udržení příznaků pod kontrolou; s ohledem na jeho pomalejší nástup účinku (10 až 20 minut) však nemá být používán k úlevě od akutních příznaků astmatu - k té se má použít inhalační bronchodilatans s rychleji (do 5 minut) nastupujícím účinkem (např. salbutamol).
Salmeterol je indikován u pacientů, kteří potřebují pravidelnou bronchodilatační farmakoterapii, k prevenci nočních příznaků a/nebo k prevenci denních výkyvů příznaků způsobených reverzibilní obstrukční nemocí dýchacích cest (např. před tělesnou námahou nebo nevyhnutelnou expozicí alergenu).
Pravidelná léčba reverzibilní obstrukce dýchacích cest při astmatu, včetně dlouhotrvající prevence bronchospasmu vyvolávaného tělesnou námahou.
4.2 Dávkování a způsob podání
K dosažení plného terapeutického přínosu se doporučuje, aby při terapii reverzibilní obstrukce dýchacích cest způsobené astmatem, CHOPN a chronickou bronchitidou byl salmeterol užíván pravidelně. U pacientů s astmatem dochází k nástupu účinné bronchodilatace (více než 15 % zlepšení FEVj) během 10 až 20 minut. Plný účinek se projeví po prvních několika dávkách léčiva. Bronchodilatační účinky salmeterolu obvykle trvají 12 hodin. To je obzvlášť výhodné v léčbě nočních příznaků astmatu, CHOPN a chronické bronchitidy a v léčbě astmatu vyvolávaného tělesnou námahou.
Pacienty je nutné poučit, aby ke zvládnutí příznaků neinhalovali dodatečné dávky salmeterolu, nýbrž aby použili krátkodobě působícího inhalačního beta2-agonistu.
Vzhledem k tomu, že při užívání vysokých dávek se mohou u přípravků této skupiny vyskytnout nežádoucí účinky, dávkování nebo frekvence dávkování má být zvýšená pouze na doporučení lékaře.
Serevent Diskus se užívá výhradně inhalačně.
• Dospělí
Léčba astmatu, CHOPN a chronické bronchitidy.
Dospělí obvykle inhalují obsah jednoho blistru (1 x 50 mikrogramů salmeterolu) dvakrát denně.
U pacientů s těžší formou obstrukce dýchacích cest a s přetrvávajícími symptomy lze dávku zvýšit a inhalovat obsah dvou blistrů (2 x 50 mikrogramů salmeterolu) dvakrát denně.
• Děti starší než 4 roky
Děti od 4 let obvykle inhalují obsah jednoho blistru (1 x 50 mikrogramů salmeterolu) dvakrát denně.
• Děti mladší než 4 roky
Dosud není k dispozici dostatek klinických údajů, aby bylo možné doporučit používání salmeterolu u dětí do 4 let.
• Zvláštní skupiny pacientů
U starších pacientů nebo u osob s poruchou funkce ledvin není třeba dávkování upravovat.
4.3 Kontraindikace
Hypersensitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Léčba astmatu by měla probíhat podle stupňového programu. Serevent Diskus by neměl být používán (a není vhodný) jako počáteční léčba astmatu.
Terapie salmeterolem se nemá zahajovat u pacientů s významně nebo akutně se zhoršujícím astmatem.
Při bronchiálním astmatu salmeterol nenahrazuje perorální nebo inhalační kortikosteroidy. Používá se k jejich doplnění. Pacienti s bronchiálním astmatem musí být upozorněni, že sami nemohou ukončit léčbu kortikosteroidy anebo ji samovolně snížit, aniž by se poradili s lékařem, i když se při užívání salmeterolu cítí lépe.
Salmeterol není určen k léčbě akutních astmatických symptomů, k níž je nutné použít krátkodobě působícího inhalační bronchodilatancia (např. salbutamolu). Pacientům je třeba doporučit, aby k úlevě od akutních astmatických příznaků tyto přípravky měli stále při sobě.
Rostoucí potřeba podávání krátkodobě působících bronchodilatačních léčiv nutných k úlevě od vzniklých příznaků svědčí o zhoršení kontroly onemocnění. Pacient by měl být obeznámen s tím, že pokud úleva po krátkodobě působícím bronchodilatačním léčivu se stává málo účinnou, nebo potřebuje více inhalací než obvykle, je zapotřebí aplikovat záchrannou léčbu. Z tohoto důvodu by stav pacienta měl být pravidelně kontrolován lékařem a zvážena potřeba podání zvýšené protizánětlivé léčby (např. vyšších dávek inhalačních kortikosteroidů, nebo léčba perorálními kortikosteroidy). Těžká exacerbace astmatu musí být léčena obvyklým způsobem.
Ačkoliv Serevent může být použit jako přídatná léčba, pokud inhalační kortikosteroidy nevedou k odpovídající kontrole astmatických příznaků, pacienti by neměli zahájit léčbu přípravkem Serevent v průběhu závažné akutní exacerbace, nebo pokud mají výrazně zhoršující se, nebo akutně zhoršující se astma.
V průběhu léčby přípravkem Serevent může dojít k výskytu závažných nežádoucích příhod nebo exacerbací souvisejících s astmatem. Pacienti by měli být požádáni, aby pokračovali v léčbě a současně vyhledali pomoc lékaře, pokud příznaky astmatu nejsou pod kontrolou nebo se zhorší po zahájení léčby přípravkem Serevent.
Náhlé a progresivní zhoršení kontroly astmatu může ohrožovat život, a pacient má proto neodkladně absolvovat lékařské vyšetření. Je třeba zvážit zintenzivnění léčby kortikosteroidy. U rizikových pacientů lze zahájit každodenní monitorování maximální výdechové rychlosti (PEF). K udržovací léčbě astmatu by měl být salmeterol podán v kombinaci s inhalačními nebo perorálními kortikosteroidy. Dlouhodobě působící bronchodilatancia by neměla být podána samostatně nebo jako hlavní léčba používaná k pravidelné léčbě astma bronchiale (viz bod 4.1).
Postupné snižování dávky přípravku Serevent může být zváženo, jakmile jsou astmatické příznaky pod kontrolou. Je důležité, aby tito pacienti byli pravidelně sledováni po dobu snižování léčby. Měla by být použita nejnižší účinná dávka přípravku Serevent.
Pacienti by měli být obeznámeni s tím, že i když se po užívání salmeterolu cítí lépe, bez porady s lékařem nesmí ukončit léčbu kortikosteroidy ani snižovat jejich dávky.
Salmeterol má být podáván zvlášť opatrně pacientům s tyreotoxikózou.
Velmi vzácně bylo pozorováno zvýšení krevní hladiny glukosy (viz bod 4.8). Toto je třeba mít na zřeteli při předepisování přípravku pacientům s anamnézou diabetes mellitus.
Kardiovaskulární účinky, jako zvýšení systolického krevního tlaku a srdeční frekvence mohou být příležitostně pozorovány při užívání sympatomimetik, zvláště při podávání vyšších než terapeutických dávek. Pacientům s anamnézou kardiovaskulárního onemocnění by proto měl být salmeterol podáván obezřetně.
Důsledkem terapie beta2-agonistickým léčivem může být potenciálně závažná hypokalémie. Zvláštní opatrnost se doporučuje u akutního těžkého astmatu, protože tento účinek může být zesílen souběžnou terapií xantinovými deriváty, kortikosteroidy, diuretiky a hypoxií. V těchto situacích se doporučuje, aby byly monitorovány hladiny draslíku v krevním séru.
Údaje z velké klinické studie (the Salmeterol Multi-Centre Astma Research Trial, SMART) naznačily, že afro-američtí pacienti měli zvýšené riziko výskytu závažných respiračních nežádoucích příhod nebo úmrtí během užívání salmeterolu ve srovnání s placebem (viz bod 5.1). Není známo, zda k tomu došlo na základě farmakogenetiky, nebo jiných faktorů. (viz body 4.1 a 5.1). Beta2-agonisté s dlouhodobým účinkem, jako je salmeterol, mají být předepisováni s kortikosteroidy.
Současné užití systémově podávaného ketokonazolu významně zvyšuje systémovou expozici salmeterolu. To může vést ke zvýšení incidence systémových účinků (např. prodloužení QTc intervalu a palpitací). Pokud prospěch z léčby salmeterolem nepřeváží možné zvýšení rizika jeho systémových nežádoucích účinků, je třeba se společné léčbě s ketokonazolem nebo s dalšími silnými inhibitory CYP3A4 vyvarovat (viz bod 4.5).
Těžké astma vyžaduje pravidelné lékařské hodnocení, včetně funkčních vyšetření plic, protože pacienti jsou ohroženi těžkými záchvaty až úmrtím.
Aby se zajistila optimální dodávka léčiva do plic, je třeba přezkoušet, jak pacient ovládá techniku inhalace, a ujistit se, že je schopen synchronizovat nádech se spuštěním dávkovače.
Stejně jako při podávání jiných inhalačních přípravků může po inhalaci tohoto přípravku dojít k paradoxnímu bronchospasmu s bezprostředním zhoršením pískotů (hvízdavého dýchání). V takovém případě je nutné okamžitě zahájit léčbu s rychle a krátkodobě působícími inhalačními bronchodilatátory. Podávání salmeterolu se musí okamžitě ukončit, znovu zhodnotit stav pacienta, a podle potřeby má být zahájena alternativní terapie (viz bod 4.8).
V důsledku léčby beta2-agonisty byly pozorovány farmakologické nežádoucí účinky, jako jsou třes, subjektivní pocit palpitací a bolesti hlavy, avšak s tendencí k odeznívání a slábnutí při pravidelné terapii (viz bod 4.8).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
U pacientů s reverzibilní obstrukcí dýchacích cest je třeba se vyvarovat podávání neselektivních i selektivních beta-blokátorů, pokud neexistují závažné důvody pro jejich použití.
Důsledkem terapie beta2-agonistickým léčivem může být potenciálně závažná hypokalémie. Zvláštní opatrnost se doporučuje u akutního těžkého astmatu, protože tento účinek může být zesílen souběžnou terapií xantinovými deriváty, kortikosteroidy nebo diuretiky.
Silné inhibitory CYP3A4
Současné podávání ketokonazolu (400 mg perorálně lx denně) a salmeterolu (50 pg inhalačně 2x denně) 15 zdravým subjektům po dobu 7 dnů vedlo k významnému zvýšení plasmatické expozice salmeterolu (1,4-násobku Cmax a 15-násobku AUC). To může vést ke zvýšení incidence dalších systémových účinků léčby salmeterolem (např. prodloužení QTc intervalu a palpitacím) v porovnání s léčbou salmeterolem nebo ketokonazolem samotným (viz bod 4.4).
Nebyly pozorovány žádné klinicky významné účinky na krevní tlak, srdeční frekvenci, hladinu krevní glukózy a draslíku v krvi. Současné podávání s ketokonazolem nevedlo ke zvýšení eliminačního poločasu salmeterolu ani zvýšení kumulace salmeterolu při opakovaném dávkování.
Pokud prospěch z léčby salmeterolem nepřeváží možné zvýšení rizika jeho systémových nežádoucích účinků, je třeba se současnému podávání s ketokonazolem vyvarovat. Je pravděpodobné, že riziko interakcí s dalšími silnými inhibitory CYP3A4 (např. intrakonazolem, telithromycinem, ritonavirem) bude podobné.
Středně silné inhibitory CYP3A4
Současné podávání erythromycinu (500 mg perorálně 3x denně) a salmeterolu (50 pg inhalačně dvakrát denně) 15 zdravým subjektům po dobu 6 dnů vedlo k malému, statisticky nevýznamnému zvýšení expozice salmeterolu (1,4-násobku Cmax a 1,2-násobku AUC). Současné podávání s erythromycinem nebylo spojeno se žádnými závažnými nežádoucími účinky.
4.6 Fertilita, těhotenství a kojení
Fertilita
Nejsou dostupná data.
Ve studiích na zvířatech se některé účinky na plod typické pro beta2-agonisty vyskytly při expozici značně vyšších dávek než ty, které se vyskytují při terapeutickém užití. Rozsáhlé zkušenosti s jinými beta2-agonisty neprokázaly, že by tento účinek byl relevantní u žen užívajících klinické dávky.
Nejsou odpovídající a dobře kontrolované studie se salmeterolem u těhotných žen. Účinek salmeterolu u těhotných žen není znám.
Stejně jako u jiných léčiv, podávání tohoto přípravku v období těhotenství se doporučuje pouze v případě, kdy očekávaný přínos pro matku je větší než možné riziko pro plod.
Kojení
Po inhalační terapeutické dávce jsou plazmatické hladiny salmeterolu zanedbatelné, a proto hladiny v mateřském mléce jsou podle toho nízké. Nicméně, jelikož jsou omezené údaje o použití salmeterolu kojícími matkami, jeho podání by se mělo za těchto podmínek zvážit, zda očekávaný přínos pro matku je větší než možné riziko pro kojence.
Studie u kojících samiček podporují názor, že salmeterol se pravděpodobně vylučuje do mateřského mléka pouze ve velmi malém množství.
Studie prokázaly, že HFA-134a nemá vliv ani na reprodukci, ani na laktaci dospělých nebo dvou následujících generací potkanů, nebo na vývoj plodů potkanů nebo králíků.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Při užívání tohoto přípravku se neprojevil negativní vliv na činnost vyžadující zvýšenou pozornost, schopnost soustředění a koordinaci pohybů.
4.8 Nežádoucí účinky
V následujícím textu jsou nežádoucí účinky uvedené podle orgánových tříd a frekvence výskytu. Četnost nežádoucích účinků je definována jako velmi časté (>1/10), časté (>1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000) a velmi vzácné (< 1/10 000) včetně jednotlivých hlášených případů. Časté a méně časté byly odvozené z klinických dat. Incidence u placeba nebyla vzata v úvahu. Velmi vzácné nežádoucí účinky byly odvozeny z dat získaných při postmarketingovém sledování.
Následující četnost výskytu je odhadována od standardní dávky 50 mikrogramů dvakrát denně. Četnost u vyšší dávky 100 mikrogramů dvakrát denně byla rovněž vzata v úvahu, jestliže to bylo vhodné.
|
Třídy orgánových systémů |
Nežádoucí účinky |
Četnost |
|
Poruchy imunitního systému |
reakce přecitlivělostí s následujícími projevy: | |
|
kopřivka (svědění a zarudnutí) |
méně časté | |
|
anafylaktická reakce včetně edému a angioedému, bronchospasmu a anafylaktického šoku. |
velmi vzácné | |
|
Poruchy metabolismu a výživy |
hypokalémie |
vzácné |
|
hyperglykémie |
velmi vzácné | |
|
Psychiatrické poruchy |
méně časté | |
|
vzácné | ||
|
Poruchy nervového systému |
časté | |
|
časté | ||
|
závratě |
vzácné | |
|
Srdeční poruchy |
palpitace |
časté |
|
méně časté | ||
|
srdeční arytmie (včetně fibrilace síní, supraventrikulární tachykardie a extrasystol) |
velmi vzácné |
|
Respirační, hrudní a mediastinální poruchy |
podráždění hrdla |
velmi vzácné |
|
paradoxní bronchospasmus |
velmi vzácné | |
|
Gastrointestinální poruchy |
nausea |
velmi vzácné |
|
Poruchy pohybového systému a pojivové tkáně |
svalové křeče |
časté |
|
bolesti kloubů |
velmi vzácné | |
|
Celkové poruchy a reakce v místě aplikace |
nespecifická bolest na hrudi |
velmi vzácné |
Byly hlášeny farmakologické nežádoucí účinky beta2-agonistů, j ako j sou třes, bolest hlavy a palpitace, avšak s tendencí k odeznívání a slábnutí při pravidelné terapii. Třes a tachykardie byly pozorovány mnohem častěji při podávání dávek vyšších než 50 mikrogramů dvakrát denně.
Stejně jako při užívání jiných inhalačních přípravků se může vyskytnout paradoxní bronchospasmus se zhoršením hvízdavého dýchání (pískotů) bezprostředně po inhalaci.
V takovém případě je třeba ihned vdechnout rychle a krátkodobě působící bronchodilatační léčivo. Je nutné okamžitě ukončit užívání salmeterolu, pacient má být vyšetřen a podle potřeby má být zahájena alternativní terapie (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky a symptomy
Objektivními a subjektivními příznaky předávkování salmeterolu mají typické známky beta2-adrenergní stimulace, včetně třesu, bolesti hlavy tachykardie, zvýšení systolického krevního tlaku a hypokalémie.
Terapie
Dojde-li k předávkování, pacient má dostávat podpůrnou léčbu s nezbytným monitorováním. Další postup by měl vycházet z klinického průběhu nebo podle doporučení národního toxikologického centra.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina - Antiastmatikum. Selektivní agonisté beta2 adrenergních receptorů, ATC kód: R03AC12.
Mechanismus účinku
Salmeterol je selektivní dlouhodobě (12 hodin) působící agonista beta2-adrenoreceptorů, s dlouhým postranním řetězcem, který se váže na zevní místo receptoru.
Farmakodynamické vlastnosti
Díky těmto farmakologickým vlastnostem salmeterol nabízí účinněj ší ochranu proti bronchokonstrikci vyvolávané histaminem a navozuje dlouhodobější bronchodilataci (trvající nejméně 12 hodin) než doporučené dávky konvenčních krátkodobě působících beta2-agonistů. Studie in vitro prokázaly, že salmeterol je silně a dlouhodobě působící inhibitor uvolňování (z lidských plic) mediátorů žírných buněk, např. histaminu, leukotrienů a prostaglandinu D2.
U člověka salmeterol inhibuje časnou i pozdní fázi odezvy na inhalovaný alergen; inhibice pozdní fáze přetrvává po jednotlivé dávce po dobu delší než 30 hodin, když už bronchodilatační účinek není patrný. Jednorázová dávka salmeterolu utlumí bronchiální hyperreaktivitu. Tyto vlastnosti naznačují, že salmeterol má ještě další, jinou než bronchodilatační, účinnost - její plný klinický význam však dosud není jasný. Tento mechanismus je odlišný od protizánětlivého účinku kortikosteroidů, jejichž podávání by po předepsání přípravku Serevent Diskus nemělo být zastaveno ani omezeno.
Při studiu použití salmeterolu v léčbě stavů provázejících CHOPN bylo prokázáno, že zlepšuje příznaky a plicní funkci a kvalitu života. Salmeterol působí jako beta2-agonista na reverzibilní složky onemocnění. In vitro bylo rovněž prokázáno, že salmeterol zvyšuje frekvenci míhání řasinek lidských bronchiálních epiteliálních buněk, a že u pacientů s cystickou fibrózou omezuje acidotoxický efekt pseudomonádového toxinu na bronchiální epitel.
5.2 Farmakokinetické vlastnosti
Salmeterol působí místně v plicích, a proto jeho léčebné účinky nelze posuzovat podle plazmatických hladin. O farmakokinetice salmeterolu jsou k dispozici j en omezené údaje, a to pro technickou obtížnost stanovení léčiva v plazmě, neboť plazmatické koncentrace dosahované po inhalačním podání terapeutických dávek jsou velmi nízké (přibližně 200 pg/ml nebo méně).
V placebem kontrolovaných, zkřížených studiích lékové interakce u 15 zdravých jedinců, vedlo souběžné podávání salmeterolu (inhalovaného v dávce 50 mikrogramů dvakrát denně) a CYP3A4 inhibitoru ketokonazolu (v dávce 400 mg jednou denně perorálně) po dobu 7 dnů k významnému zvýšení plazmatické expozice salmeterolu (1,4-násobné zvýšení Cmax a 15-násobné zvýšení AUC). U opakovaných dávek nedošlo ke zvýšení kumulace salmeterolu. Při současném užívání salmeterolu a ketokonazolu byli tři jedinci vyřazení pro prodloužení QTc intervalu, nebo pro výskyt palpitací se sinusovou tachykardií. U zbývajících 12 jedinců
souběžné podávání salmeterolu a ketokonazolu nevedlo ke klinicky signifikantnímu účinku na srdeční frekvenci, hladinu draslíku v krvi, nebo délku QTc (viz bod 4.4).
Absorpce
Po pravidelném podávání salmeterol-xinafoátu byla v systémové cirkulaci prokázána kyselina hydroxynaftoová, dosahující koncentrací v ustáleném stavu přibližně 100 ng/ml.
Tyto koncentrace jsou až tisíckrát menší než hladiny v ustáleném stavu pozorované v toxikologických studiích a bylo prokázáno, že u pacientů s obstrukcí dýchacích cest ani po dlouhodobém (delším než 12 měsíců) pravidelném podávání nevyvolávají škodlivé účinky.
Distribuce
Nejsou data.
Metabolismus
Studie in vitro ukázaly, že salmeterol je rozsáhle metabolizován na alfa-hydroxysalmeterol (alifatická oxidace) cytochromem P450 3A4 (CYP3A4). Opakované studie dávkování se salmeterolem a erytromycinem u zdravých dobrovolníků neprokázaly klinicky signifikantní změny farmakodynamiky u dávky 500 mg erytromycinu třikrát denně. Avšak výsledek studie interakce salmeterolu s ketokonazolem prokázal významné zvýšení plazmatické expozice salmeterolu (viz body 4.4 a 4.5).
Eliminace
Nejsou data.
Klinické studie Astma bronchiale
SMART byla velkou klinickou studií probíhající v USA, která srovnávala bezpečnost salmeterolu, nebo placeba přidaných k obvyklé léčbě. Nebyly pozorovány významné rozdíly v primárním cíli kombinovaného počtu úmrtí spojených s poruchou respiračního systému a život ohrožujících stavů spojených s poruchou respiračního systému. Studie prokázala výrazné zvýšení úmrtí spojených s astmatem u pacientů užívajících salmeterol (13 úmrtí ze 13 176 pacientů léčených 28 týdnů salmeterolem, proti 3 úmrtím ze 13 179 pacientů s placebem). Studie nebyla zaměřena na to, aby posoudila vliv souběžného užití inhalačních kortikosteroidů. Post-hoc analýzy však ukázaly, že nebyly žádné významné rozdíly v úmrtích spojených s astmatem mezi léčenými skupinami pacientů užívajících inhalační kortikosteroidy na počátku studie (4/6 127 salmeterol, proti 3/6 138 s placebem). Počty úmrtí spojených s astmatem ve skupinách neužívajících inhalační kortikosteroidy byly 9/7 049 u salmeterolu, proti 0/7 041 u placeba.
Klíčové výsledky ze studie SMART: primární ukazatel
|
Skupina pacientů |
Počet příhod primárního cíle/počet pacientů |
Relativní riziko (CI95%) | |
|
salmeterol |
placebo | ||
|
Všichni pacienti |
50/13 176 |
36/13 179 |
1,40 (0,91; 2,14) |
|
Pacienti užívající inhalační kortikosteroidy |
23/6 127 |
19/6 138 |
1,21 (0,66; 2,23) |
|
Pacienti neužívající inhalační kortikosteroidy |
27/7 049 |
17/7 041 |
1,60 (0,87; 2,93) |
|
Afro-američtí pacienti |
20/2 366 |
5/2 319 |
4,10 (1,54; 10,90) |
|
(Riziko vyznačené tučně je statisticky významné na 95% hladině). | |||
Klíčové výsledky ze studie SMART podle užití inhalačních kortikosteroidů na počátku: sekundární cíle
|
Počet příhod sekundárních cílů/počet pacientů |
Relativní riziko (CI95 %) | ||
|
salmeterol |
placebo | ||
|
Úmrtí související s respiračním systémem | |||
|
Pacienti užívající inhalační kortikosteroidy |
10/6 127 |
5/6 138 |
2,01 (0,69; 5,86) |
|
Pacienti neužívající inhalační kortikosteroidy |
14/7 049 |
6/7 041 |
2,28 (0,88; 5,94) |
|
Úmrtí související s astmatem nebo život ohrožujícími stavy | |||
|
Pacienti užívající inhalační kortikosteroidy |
16/6 127 |
13/6 138 |
1,24 (0,60; 2,58) |
|
Pacienti neužívající inhalační kortikosteroidy |
21/7 049 |
9/7 041 |
2,39 (1,10; 5,22) |
|
Úmrtí související s astmatem | |||
|
Pacienti užívající inhalační kortikosteroidy |
4/6 127 |
3/6 138 |
1,35 (0,30; 6,04) |
|
Pacienti neužívající inhalační kortikosteroidy |
9/7 049 |
0/7 041 |
* |
|
(*= nebylo možné spočítat, jelikož v placebové skupině nedošlo k vývoji žádných nežádoucích příhod. Zvýrazněné hodnoty jsou statisticky významné na 95% hladině. V tabulce výše uvedené sekundární cíle dosahovaly statistické významnosti v celé populaci). Sekundární cíle z jakékoliv příčiny všech kombinovaných příčin úmrtí nebo život ohrožujících stavů, všech příčin úmrtí nebo všech příčin hospitalizací nedosáhly statistické významnosti v celé populaci. | |||
Klinické studie u pacientů s CHOPN
TORCH (Towards a Revolution in COPD Health) byla 3 roky probíhající klinickou studií hodnotící účinek léčby salmeterolu/flutikason-propionátu 50/500 mikrogramů podávaného dvakrát denně, 50 mikrogramů salmeterolu dvakrát denně, 500 mikrogramů flutikason-
propionátu v diskusu dvakrát denně nebo placeba na úmrtnost z jakékoliv příčiny u pacientů s CHOPN. Pacienti se středně závažnou až závažnou formou CHOPN s úvodní (prebronchodilatační) FEVj < 60 % náležité hodnoty byli randomizováni k dvojitě zaslepené medikaci. V průběhu studie byla pacientům povolena obvyklá léčba CHOPN s výjimkou jiných inhalačních kortikosteroidů, bronchodilatancií s dlouhodobým účinkem a dlouhodobé podávání systémových kortikosteroidů. Přežití bylo určeno po 3 letech u všech pacientů bez ohledu na ukončení léčby zahrnuté do studie. Primárním výsledkem byla redukce úmrtnosti z jakékoliv příčiny po 3 letech u salmeterolu/flutikason-propionátu proti placebu.
|
Placebo N = 1 524 |
Salmeterol 50 N = 1 521 |
Flutikason-propionát (FP) 500 N = 1 534 |
Salmeterol/FP 50/500 N = 1 533 | |
|
Úmrtnost z jakékoliv příčiny po 3 letech | ||||
|
Počet úmrtí (%) |
231 (15,2 %) |
205 (13,5 %) |
246 (16,0 %) |
193 (12,6 %) |
|
Poměrné riziko proti placebu (interval spolehlivosti) p hodnota |
Neuplatňuje se |
0,879 (0,73; 1,06) 0,180 |
1,060 (0,89; 1,27) 0,525 |
0,825 (0,68; 1,00) 0,052' |
|
Poměrné riziko Salmeterol/FP 50/500 proti složkám (interval spolehlivosti) p hodnota |
Neuplatňuje se |
0,932 (0,77; 1,13) 0,481 |
0,774 (0,64; 0,93) 0,007 |
Neuplatňuje se |
|
1. Nesignifikantní hodnota P-value primární účinnosti z long-rank analý |
byla přizpůsobená pro dvě průběžné analýzy srovnání /zy stratifikované podle kuřáctví. | |||
Salmeterol s flutikason-propionátem snížil riziko úmrtí kdykoliv v průběhu 3 let o 17,5 % ve srovnání s placebem (poměr rizika 0,825 (95% Cl: 0,68; 1,00, p = 0,052); všechny upravené pro analýzy v mezidobí). Došlo ke 12% snížení rizika úmrtí z jakékoliv příčiny kdykoliv během 3 let u salmeterolu ve srovnání s placebem (p = 0,180) a 6% zvýšení u flutikason-propionátu ve srovnání s placebem (p = 0,525).
Podpůrná analýza užívající model Coxova proporcionálního rizika poskytla poměr rizika 0,811 (95 % Cl: 0,670, 0,982, p = 0,031) pro salmeterol-FP proti placebu, což představuje 19% snížení rizika úmrtí kdykoliv během 3 let. Model přizpůsobený pro důležité faktory (kouření, věk, pohlaví, oblast, základní hodnota FEV1 a body mass index) neprokázal, že se léčebný přínos měnil podle těchto faktorů.
Procento pacientů, kteří zemřeli během 3 let z důvodů vztahujících se k CHOPN bylo 6 % u placeba, 6,1 % u salmeterolu, 6,9 % u FP a 4,7 % u salmeterol-FP.
Salmeterol-FP snížil výskyt středních až těžkých forem exacerbací o 25 % (95%Cl: 19 % až 31 %; p < 0,001) ve srovnání s placebem. Salmeterol-FP snížil výskyt exacerbací o 12 % ve srovnání se salmeterolem (95%Cl: 5 % až 19 %, p = 0,002) a o 9 % ve srovnání s FP (95% Cl: 1 % až 16 %, p = 0,024). Salmeterol významně snížil výskyt exacerbací ve srovnání s placebem o 15 % (95% Cl: 7 % až 22 %; p < 0,001) a flutikason-propionát o 18 % (95% Cl: 11 % až 24 %; p < 0,001).
Kvalita života vztahující se k zdravotnímu stavu měřená podle standardizovaného specifického dotazníku SGRQ se zlepšila u všech aktivních léčebných postupů ve srovnání s placebem. Průměrné zlepšení za 3 roky bylo pro salmeterol-FP srovnávaného s placebem -
3,1 jednotek (95% Cl: -4,1 až -2 ,1; p < 0,001), ve srovnání se salmeterolem -2,2 jednotek (p < 0,001) a ve srovnání s flutikason-propionátem bylo -1,2 jednotek (p = 0,017).
Po dobu 3letého období léčby byly hodnoty FEVj vyšší u jedinců léčených salmeterol-FP, než u pacientů léčených placebem (průměrný rozdíl po dobu 3 let 92 ml, 95% CI: 75 až 108 ml; p < 0,001). Salmeterol-FP byl rovněž více účinným než salmeterol, nebo FP pro zlepšení FEVi (průměrný rozdíl 50 ml, p < 0,001 u salmeterolu a 44 ml, p < 0,001 u FP).
Odhadovaná tříletá pravděpodobnost výskytu pneumonie hlášená jako nežádoucí příhoda byla 12,3 % u placeba, 13,3 % u salmeterolu, 18,3 % u flutikason-propionátu a 19,6 % u salmeterolu-FP (poměrné riziko pro salmeterol-FP proti placebu: 1,64; 95% CI: 1,33 až 2,01, p < 0,001). Nedošlo ke zvýšení úmrtí v souvislosti s pneumonií. Úmrtí během léčby, která byla posuzována jako primární zapříčiněná pneumonií, byla v 7 případech u placeba, 9 u salmeterolu, 13 u flutikason-propionátu a 8 u salmeterolu-FP. Nebyl významný rozdíl v pravděpodobnosti výskytu kostních zlomenin (5,1 % u placeba, 5,1 % u salmeterolu, 5,4 % u flutikason-propionátu a 6,3 % u salmeterolu-FP; poměrné riziko pro salmeterol-FP versus placebo: 1,22; 95% Cl: 0,87 až 1,72, p = 0,248). Výskyt nežádoucích účinků jako onemocnění očí, kostní onemocnění a poruchy osy hypotalamus-hypofýza-nadledviny byly nízké a nebyly pozorovány rozdíly mezi léčbami. Neprokázalo se zvýšení kardiologických nežádoucích účinků ve skupinách léčených salmeterolem.
5.3 Předklinické údaje vztahující se k bezpečnosti
V reprodukčních studiích na zvířatech byly při velmi vysokých dávkách pozorovány určité účinky na plod, typické pro beta2-agonistu.
V řadě studií používajících jak prokaryontní, tak eukaryontní buněčné systémy in vitro a in vivo u potkanů neměl salmeterol-xinafoát genotoxické účinky.
Salmeterol-xinafoát vyvolal v dlouhodobých studiích benigní tumory hladké svaloviny mesovaria u potkanů a uteru u myší, což je nález charakteristický pro tuto skupinu léčiv. Odborná literatura i naše vlastní farmakologické studie spolehlivě dokládají, že tyto účinky jsou druhově specifické a nemají význam pro klinické použití.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát laktosy
6.2 Inkompatibility
Neuplatňuje se.
24 měsíců.
6.4 Zvláštní opatření pro uchovávání
Přípravek uchovávejte při teplotě do 30 °C. Uchovávejte v původním vnitřním obalu, aby byl přípravek chráněn před světlem.
Nenechávejte přípravek na vlhkém místě, jako je koupelna.
Nepoužívejte po uplynutí doby použitelnosti uvedené na obalu.
6.5 Druh obalu a obsah balení
Prášek obsahující směs salmeterol-xinafoátu a monohydrátu laktosy je uzavřený ve stripovém blistru, který se skládá ze základní fólie s odstranitelnou fólií na víčku.
Zelený diskovitý plastikový inhaler s počítadlem dávek, obsahující stočený fóliový strip s 60 dávkami, krabička.
Velikost balení: 60 dávek po 50 mikrogramech léčivé látky.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Jak používat přípravek Serevent Diskus:
Inhalační pomůcka, zabalená v ochranné fólii, se vyjme z krabičky.
Vybalí se z ochranné fólie. Je v poloze ZAVŘENO.

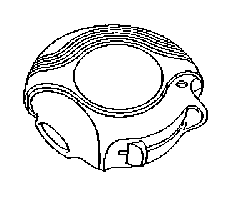
1. základní část
2. posuvná část
3. počítač dávek
4. jezdec
5. posuvná páčka
6. náustek
Diskus obsahuje 60 dávek léčivé látky ve formě prášku.
Každá dávka je přesně odměřená a je hygienicky chráněna. Inhalační pomůcka tedy nevyžaduje žádnou údržbu ani opětovné plnění.
Počítač dávek, který je uložen na horní straně, ukazuje, kolik dávek ještě zbývá. Číslice 5 až 0 jsou ČERVENÉ, aby byl pacient upozorněn, že zbývá už jen několik dávek.
Používání tohoto přípravku je snadné, jestliže se dodržují dále uvedené pokyny:
1. Otevírání inhalační pomůcky
2. Nastavení inhalační pomůcky
3. Inhalování
4. Ukončení inhalace
Posunutím páčky na inhalační pomůcce se otevře malý otvor v náustku, a tak se uvolní dávka, která je pak připravena k vdechnutí. Po zavření inhalační pomůcky se páčka automaticky vrátí do své původní polohy a je připravena na další dávku (až bude potřeba). Vnější kryt chrání inhalační pomůcku, pokud se právě nepoužívá.
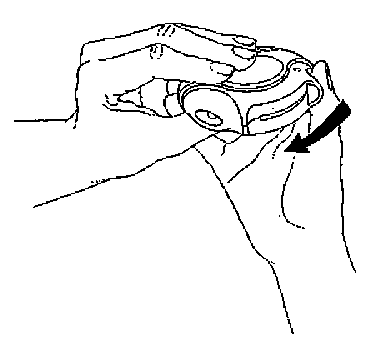
1. Otevírání inhalační pomůcky
Inhalační pomůcka se otevře tak, že se vnější kryt celého zařízení drží v jedné ruce a palec druhé ruky se vloží do jezdce. Palcem se jezdec zatlačí co nejvíce dozadu.
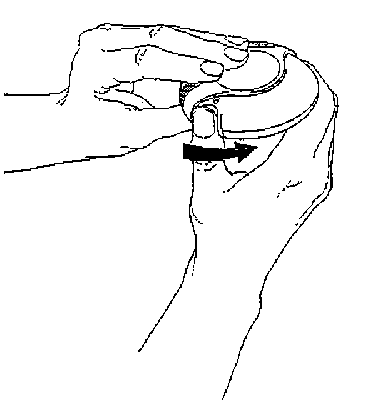
2. Nastavení inhalační pomůcky
Inhalační pomůcka se nastaví tak, aby byl náustek otočen směrem k pacientovi. Páčka se zatlačí co nejdále směrem od sebe, dokud necvakne. Pak je přípravek Serevent Diskus připraven k použití. Po každém zatlačení na páčku je připravena další dávka k vdechnutí. (Je to vidět na počítači dávek.) S páčkou se nesmí zbytečně manipulovat, protože se tím uvolní dávka, která se vyplýtvá bez užitku.
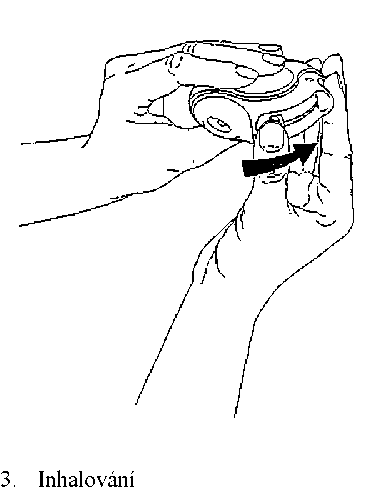
Před začátkem vdechování dávky je nutné si pozorně přečíst tuto část textu.
Před vložením inhalační pomůcky do úst se musí vydechnout, jak nejvíce to je bez námahy možné. Nikdy se nesmí vydechovat do inhalační pomůcky.
Náustek se přiloží ke rtům. Vdechuje se zvolna a hluboko přes inhalační pomůcku, ne nosem. Inhalační pomůcka se odloží.
Zadrží se dech asi na 10 sekund nebo na tak dlouho, jak je to bez námahy možné.
Pomalu se vydechne.
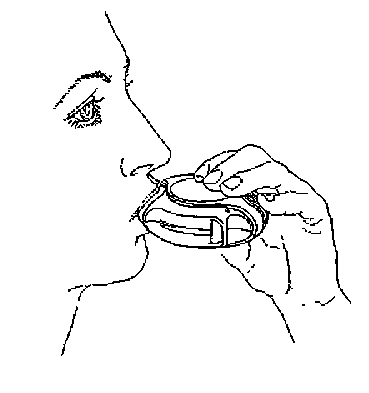
4. Ukončení inhalace
Inhalační pomůcka se zavře tak, že palec se vloží do jezdce a posune se jím co nejvíce směrem k sobě. Při zavření disku je slyšet zaklapnutí. Páčka se automaticky vrátí do původní polohy a je znovu připravena k aplikaci další dávky.
Pokud se užívají dvě dávky, musí se inhalační pomůcka zavřít a opakovat kroky 1 až 4. Upozornění
Přípravek Serevent Diskus se musí uchovávat v suchu.
Pokud se přípravek Serevent Diskus nepoužívá, nechává se inhalační pomůcka zavřená. Nikdy se do inhalační pomůcky nesmí vydechovat.
Dávka se uvolní pouhým posunutím páčky.
Dávka přípravku Serevent Diskus podávaná pomocí inhalační pomůcky se smí inhalovat pouze ústy.
Děti mohou užívat přípravek Serevent Diskus pouze pod dohledem dospělé osoby.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Glaxo Group Ltd., 980 Great West Road, Brentford, Middlesex, TW8 9GS, Velká Británie.
8. REGISTRAČNÍ ČÍSLO
14/029/02-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 6.2.2002
Datum posledního prodloužení registrace: 19.2.2014
10. DATUM REVIZE TEXTU
19.2.2014
16