Sancuso 3,1 Mg/24 Hodin
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
SANCUSO 3,1 mg/24 hodin transdermální náplast
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna transdermální náplast o velikosti 52 cm2 obsahuje 34,3 mg granisetronum, z čehož se uvolňuje
3,1 mg granisetronum za 24 hodin.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Transdermální náplast.
Tenká, průsvitná, matricová transdermální náplast obdélníkového tvaru s oblými rohy.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Transdermální náplast SANCUSO je indikována k prevenci nauzey a zvracení spojeného se středně nebo vysoce emetogenní chemoterapií u dospělých pacientů s plánovanou dobou trvání 3 až 5 po sobě jdoucích dní, v případech, kdy je perorální podání antiemetik komplikované z důvodu potíží s polykáním (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Dospělí
Aplikujte jednu transdermální náplast 24 až 48 hodin před chemoterapií podle potřeby.
Kvůli postupnému zvyšování plazmatických hladin granisetronu po aplikaci transdermální náplasti je možné na začátku chemoterapie pozorovat pomalejší nástup účinku v porovnání s perorálním podáním 2 mg granisetronu. Náplast je třeba aplikovat 24-48 hodin před chemoterapií.
Transdermální náplast by měla být odstraněna minimálně 24 hodin po dokončení chemoterapie. Transdermální náplast lze nosit až 7 dní v závislosti na době trvání chemoterapeutického režimu.
Po rutinním hematologickém vyšetření by z důvodu snížení možnosti nadbytečné expozice granisetronu měla být transdermální náplast aplikována pouze u pacientů, u nichž je oddálení chemoterapeutické léčby nepravděpodobné.
Souběžné _podávání kortikosteroidů
Pokyny Mezinárodní asociace podpůrné péče v onkologii (Multinational Association of Supportíve Care in Cancer, MASCC) doporučují před chemoterapií podávat dexamethason s antagonistou 5-HT3.V pivotní studii přípravku SANCUSO bylo souběžné podávání kortikosteroidů, např. dexamethasonu, povoleno za podmínky, že byl součástí chemoterapeutického režimu. Jakékoli navýšení podávání kortikosteroidů během studie bylo hlášeno jako záchranná léčba.
Starší pacienti
Dávkování jako u dospělých pacientů (viz body 4.4 a 5.2).
Porucha renální nebo jaterní funkce
Není nutná žádná úprava dávkování. Dávkování jako u dospělých pacientů (viz body 4.4 a 5.2). Ačkoli nebyl zjištěn žádný průkaz zvýšeného výskytu nežádoucích reakcí u pacientů s poruchou renální nebo jaterní funkce, kterým byl perorálně a intravenózně podáván granisetron, musí se vzhledem k farmakokinetice granisetronu u této populace postupovat se zvýšenou opatrností.
Pediatrická populace
Bezpečnost a účinnost přípravku SANCUSO u dětí ve věku od 0 do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Transdermální náplast je třeba aplikovat na čistou, suchou a intaktní zdravou kůži na vnější straně paže. Pokud není možné transdermální náplast aplikovat na paži, je možné ji nalepit na břicho. Transdermální náplast by se neměla umísťovat na zarudlou, podrážděnou nebo poškozenou kůži.
Každá transdermální náplast je balena v sáčku a měla by být použita hned po jeho otevření.
Snímatelnou fólii je třeba odstranit před použitím náplasti.
Transdermální náplast se nesmí stříhat.
V případě částečného nebo úplného odlepení transdermální náplasti je třeba původní transdermální náplast znovu přilepit na stejné místo pomocí lékařské lepící pásky (pokud je to nutné). Pokud transdermální náplast nelze znovu přilepit nebo je náplast poškozená, je třeba aplikovat novou transdermální náplast na stejné místo jako původní transdermální náplast. Pokud to není možné, je třeba novou transdermální náplast aplikovat na druhou paži. Nově aplikovaná transdermální náplast by měla být odstraněna podle časového schématu doporučeného výše.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku, na jiné antagonisty receptoru 5-HT3 nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Reakce v místě aplikace
V klinických hodnoceních s přípravkem SANCUSO byly hlášeny reakce v místě aplikace, které byly obecně mírné co do intenzity a nevedly k ukončení používání přípravku. V případě výskytu závažných reakcí nebo generalizované kožní reakce (např. alergické vyrážky, včetně erytematózní, makulární
a papulární vyrážky nebo pruritu) je nutné transdermální náplast odstranit.
Gastrointestinální poruchy
Jelikož granisetron může snižovat mobilitu tlustého střeva, po jeho podání je třeba sledovat pacienty se známkami subakutní obstrukce střeva.
Srdeční poruchy
Antagonisté receptoru 5-HT3, jako je granisetron, mohou souviset s arytmiemi nebo abnormálními nálezy na EKG. To může být potenciálně klinicky významné u pacientů s preexistující arytmií nebo převodními poruchami nebo u pacientů léčených antiarytmiky nebo betablokátory. V klinických studiích s přípravkem SANCUSO nebyly pozorovány žádné klinicky relevantní účinky.
Expozice slunečnímu světlu
Působení granisetronu může být ovlivněno přímým slunečním zářením nebo umělým slunečním světlem. Pacienti musí být poučeni, aby zakrývali místo aplikace transdermální náplasti, např. oblečením, pokud existuje riziko expozice slunečnímu záření kdykoli během nošení náplasti a po dobu 10 dní po jejím odstranění.
Sprchování nebo umývání
Sprchování nebo umývání lze provádět normálně i během používání náplastí SANCUSO. Činnostem, jako je plavání, intenzivní cvičení nebo návštěva sauny, je třeba se vyvarovat.
Vnější teplo
V oblasti aplikace transdermální náplasti je třeba se vyvarovat vnějšího tepla (například lahví s horkou vodou nebo ohřívacích polštářků).
Zvláštní populace
Není nutná úprava dávkování u starších pacientů nebo pacientů s poruchou renální nebo jaterní funkce. Ačkoli nebyl zjištěn žádný průkaz zvýšeného výskytu nežádoucích účinků u pacientů s poruchou renální nebo jaterní funkce, kterým byl perorálně a intravenózně podáván granisetron, musí se vzhledem k farmakokinetice granisetronu u této populace postupovat se zvýšenou opatrností.
Serotoninový syndrom
Byly hlášeny případy serotoninového syndromu během užívání antagonistů 5-HT3 buď samostatně, ale většinou v kombinaci s jinými serotoninergními léčivými přípravky (zahrnujícími selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory vychytávání serotoninu a noradrenalinu (SNRI). Doporučuje se odpovídající sledování pacientů pro příznaky podobné serotoninovému syndromu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie in vitro využívající lidské mikrozomy indikují, že granisetron nestimuluje ani neinhibuje enzymový systém cytochromu P450.
Vhledem k tomu, že granisetron je metabolizován enzymy jaterního cytochromu P450 metabolizujícími léky (CYP1A1 a CYP3A4), mohou induktory a inhibitory těchto enzymů měnit hodnotu clearance a následně poločas granisetronu.
U lidí vedla indukce jaterních enzymů fenobarbitalem ke zvýšení celkové plazmatické clearance (přibližně 25 %) po intravenózním podání granisetronu.
Při souběžném intravenózním podání antagonistů receptoru 5-HT3 a perorálním podání paracetamolu u lidí bylo hlášeno zablokování analgetického účinku v důsledku farmakodynamického mechanismu. Studie in vitro prokázaly, že ketokonazol může inhibovat metabolismus granisetronu prostřednictvím izoenzymu z rodiny 3A cytochromu P450. Klinický význam této skutečnosti není znám.
Ve studiích se zdravými subjekty nebyly prokázány žádné interakce mezi granisetronem a benzodiazepiny (lorazepamem), neuroleptiky (haloperidolem) nebo protivředovými léčivými přípravky (cimetidinem).
Nebyly pozorovány žádné klinicky významné lékové interakce mezi přípravkem SANCUSO a emetogenní nádorovou chemoterapií. Rovněž nebyly pozorovány žádné interakce mezi granisetronem a emetogenní nádorovou terapií. Ve shodě s těmito údaji nebyly v klinických studiích s přípravkem SANCUSO hlášeny žádné klinicky významné lékové interakce. Ve studiích klinických interakcí neměl aprepitant klinicky významné účinky na farmakokinetiku granisetronu.
Serotoninergní léčivé přípravkyky (např. SSRI a SNRI): byly hlášeny případy serotoninového syndromu po souběžném použití antagonistů 5-HT3 a jiných serotoninergních léků (zahrnujících SSRI a SNRI).
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání granisetronu těhotným ženám nejsou k dispozici. Studie se zvířaty neprokázaly přímé nebo nepřímé škodlivé účinky pokud jde o reprodukční toxicitu (viz bod 5.3). Podávání přípravku SANCUSO v těhotenství se z preventivních důvodů nedoporučuje.
Kojení
Není známo, zda se granisetron nebo jeho metabolity vylučují do lidského mateřského mléka. Kojení má být během léčby přípravkem SANCUSO přerušeno.
Fertilita
Údaje o vlivu granisetronu na lidskou fertilitu nejsou k dispozici. U potkanů neměla léčba granisetronem na fertilitu žádný vliv.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek SANCUSO nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Bezpečnostní profil přípravku SANCUSO vychází z kontrolovaných klinických hodnocení a ze zkušeností po uvedení přípravku na trh. Nejčastěji hlášeným nežádoucím účinkem v klinických studiích byla konstipace, která se vykytovala přibližně u 8,7 % pacientů. Většina nežádoucích účinků byla mírně nebo středně závažná.
Přehled nežádoucích účinků v tabulce
Nežádoucí účinky zjištěné z klinických studií a spontánních hlášení týkajících se přípravku SANCUSO jsou uvedeny v následující tabulce:
V rámci každé třídy orgánových systémů jsou nežádoucí účinky řazeny do následujících skupin dle četnosti: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10 000 až < 1/1000); velmi vzácné (< 1/10 000) a není známo (z dostupných údajů nelze určit).
Nežádoucí účinky jsou v každé skupině četností uvedeny podle klesající závažnosti.
Tabulka č. 1: Nežádoucí účinky hlášené pro přípravek SANCUSO
|
Třída orgánových systémů |
Nežádoucí účinek |
Četnost |
|
Poruchy metabolismu a výživy |
Menší chuť k jídlu |
Méně časté |
|
Poruchy nervového systému |
Méně časté | |
|
Dystonie |
Vzácné | |
|
Dyskineze |
Vzácné | |
|
Poruchy ucha a labyrintu |
Méně časté | |
|
Cévní poruchy |
Méně časté | |
|
Gastrointestinální poruchy |
Konstipace |
Časté |
|
Sucho v ústech, nauzea, dávení |
Méně časté | |
|
Poruchy jater a žlučových cest |
Zvýšená hladina alaninaminotransferázy, zvýšená hladina aspartátaminotransferázy, zvýšená hladina gama-glutamyltransferázy |
Méně časté |
|
Poruchy kůže a podkožní tkáně |
Podráždění v místě aplikace |
Méně časté |
|
Reakce v místě aplikace (bolest, pruritus, erytém, vyrážka nebo podráždění v místě aplikace)* |
Není známo | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Artralgie |
Méně časté |
|
Celkové poruchy a reakce v místě aplikace |
Generalizovaný edém |
Méně časté |
|
Poruchy imunitního systému |
Reakce z přecitlivělosti |
Není známo |
* Spontánní hlášení
Popis vybraných nežádoucích účinků
U pacientů, kteří jsou léčeni středně nebo vysoce emetogenní chemoterapií, se může vyskytovat zvracení i přesto, že dostávají antiemetickou léčbu, včetně přípravku SANCUSO.
Skupinové nežádoucí účinky (class-efects)
Nežádoucí účinky skupiny léků, do níž spadá granisetron, pozorované u jiných preparátů (perorálních a intravenózních) zahrnují následující:
- hypersenzitivní reakce, např. anafylaxe, kopřivka,
- insomnie,
- bolest hlavy,
- extrapyramidové reakce,
- somnolence,
- závratě,
- prodloužení intervalu QT,
- konstipace,
- průjem,
- zvýšená hladina j aterních transamináz,
- vyrážka,
- astenie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Pro granisetron neexistuje žádné specifické antidotum. V případě předávkování je nutné transdermální náplast odstranit. Je třeba poskytnout symptomatickou léčbu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiemetika, antagonisté serotoninových 5-HT3 receptorů ATC kód: A04AA02
Granisetron je účinné antiemetikum a vysoce selektivní antagonista 5-hydroxytryptaminu (receptorů 5-HT3). Farmakologické studie prokázaly, že granisetron je účinný proti nauzee a zvracení v důsledku cytostatické léčby. Studie vazby radioligandů prokázaly, že granisetron má zanedbatelnou afinitu k jiným typům receptorů včetně 5-HT1, 5-HT2, 5-HT4 a dopaminových D2 vazebných míst.
Pivotní, randomizovaná, dvojitě zaslepená, dvojitě maskovaná, mezinárodní studie fáze III porovnávala účinnost, snášenlivost a bezpečnost přípravku SANCUSO s perorálním podáváním 2 mg granisetronu jednou denně v prevenci nauzey a zvracení u celkového počtu 641 pacientů léčených vícedenní chemoterapií. Studie byla navržena tak, aby prokázala non-inferioritu přípravku SANCUSO vůči perorálně podávanému granisetronu.
Populace randomizovaná v rámci hodnocení zahrnovala 48 % mužů a 52 % žen ve věku od 16 do 86 let léčených středně emetogenní (SE) nebo vysoce emetogenní (VE) vícedenní chemoterapií. 78 % pacientů bylo bílé pleti, 12 % pacientů bylo asijského původu a 10 % hispánského/latinskoamerického původu.
Transdermální náplast s granisetronem byla aplikována 24 až 48 hodin před první dávkou chemoterapie a byla ponechána na těle po dobu 7 dní. Perorální granisetron byl podáván denně po dobu trvání chemoterapeutického režimu, vždy jednu hodinu před každou dávkou chemoterapie. Antiemetická aktivita byla hodnocena od prvního podání až do 24 hodin po zahájení podávání poslední dávky SE nebo VE chemoterapeutického režimu.
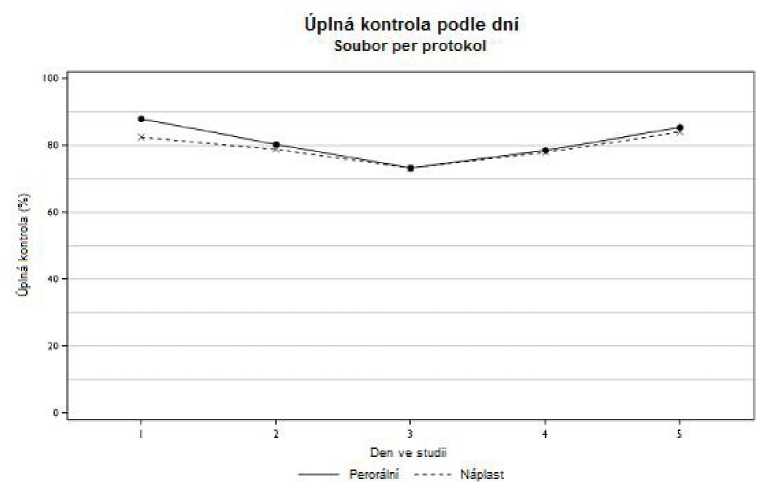
V souboru per protokol byla potvrzena non-inferiorita přípravku SANCUSO versus perorální granisetron a úplné kontroly bylo dosaženo u 60,2 % pacientů ve skupině léčené přípravkem SANCUSO a u 64,8 % pacientů léčených perorálním granisetronem (rozdíl -4,89 %; 95% interval spolehlivosti -12,91 % až +3,13 %; n = 284 transdermální náplast, n = 298 perorální podání). Úplná kontrola byla definována jako žádné zvracení a/nebo dávení, nanejvýš mírná nauzea a žádná záchranná léčba od prvního podání až do 24 hodin po zahájení podávání poslední dávky vícedenní chemoterapie.
Kvůli postupnému zvyšování plazmatických hladin granisetronu po aplikaci transdermální náplasti mohou být počáteční plazmatické hladiny na začátku chemoterapie nižší než při podání 2 mg perorálního granisetronu a může být pozorován pomalejší nástup účinku. Přípravek SANCUSO je tedy indikován k použití u pacientů, kdy je perorální podání antiemetik komplikované z důvodu potíží s polykáním.
Úplná kontrola podle dní je znázorněna níže.
V klinických hodnoceních s přípravkem SANCUSO nebyly v souvislosti s léčbou pozorovány žádné účinky na srdeční frekvenci nebo krevní tlak. Hodnocení série vyšetření EKG u pacientů neprokázalo žádné prodloužení intervalu QT a žádné morfologické změny v EKG. Účinek přípravku SANCUSO na interval QTc byl specificky hodnocen v zaslepeném, randomizovaném, paralelním, placebema pozitivně (moxifloxacinem) kontrolovaném podrobném hodnocení intervalu QTc s přípravkem SANCUSO provedeném u 240 dospělých subjektů mužského a ženského pohlaví. U přípravku SANCUSO nebyl pozorován žádný významný účinek na prodloužení intervalu QTc.
Hodnocení adheze transdermální náplasti u 621 pacientů, kteří byli léčeni transdermálními náplastmi buď s léčivou látkou, nebo s placebem, ukázalo, že během 7 denní aplikace transdermální náplasti se odlepilo méně než 1 % transdermálních náplastí.
Nejsou žádné zkušenosti získané z klinických hodnocení s používáním přípravku SANCUSO u pacientů, kteří dostávají chemoterapii po dobu kratší než 3 po sobě jdoucí dny nebo chemoterapii o více cyklech nebo chemoterapii s vysokými dávkami před transplantací kmenových buněk.
5.2 Farmakokinetické vlastnosti
Absorpce
Granisetron prochází intaktní kůží do systémového oběhu pasivní difuzí.
Po aplikaci přípravku SANCUSO se granisetron vstřebává pomalu a maximálních koncentrací se dosahuje po 24 až 48 hodinách.
Měřením zbytkového obsahu v transdermální náplasti po jejím sejmutí bylo zjištěno, že je distribuováno přibližně 65 % granisetronu, z čehož vyplývá průměrná denní dávka 3,1 mg denně.
U zdravých subjektů bylo hodnoceno současné podání jediné intravenózní bolusové dávky 0,01 mg/kg (maximálně 1 mg) granisetronu ve stejnou dobu, kdy byla aplikována transdermální náplast SANCUSO. Počátečního vrcholu plazmatických koncentrací granisetronu, který lze přisuzovat intravenózní dávce, bylo dosaženo do 10 minut po podání. Známý farmakokinetický profil transdermální náplasti po dobu používání (7 dní) nebyl dotčen.
Po aplikaci dvou transdermálních náplastí SANCUSO po sobě u zdravých subjektů, každá náplast po dobu sedmi dní, byly hladiny granisetronu po dobu studie zachovány s průkazem minimální akumulace.
Ve studii určené k vyhodnocení účinku tepla na transdermální cestu podání granisetronu z přípravku SANCUSO u zdravých subjektů byl použit ohřívací polštářek, který na transdermální náplasti vytvářel průměrnou teplotu 42 °C, a to 4 hodiny denně po dobu 5 dní používání náplasti. Zatímco použití ohřívacích polštářků bylo spojeno s nevýznamným a přechodným zvýšením průchodu granisetronu z transdermální náplasti během používání ohřívacího polštářku, při porovnání s kontrolní skupinou nebylo zjištěno žádné celkové zvýšení expozice granisetronu.
Ve farmakokinetické studii na zdravých dobrovolnících, kde byl přípravek SANCUSO aplikován po dobu 7 dní, byla střední celková expozice (AUC0 - nekonečno) 416 ng^h/ml (rozsah 55-1192 ng^h/ml s 89% interindividuální variabilitou. Střední hodnota Cmax byla 3,9 ng/ml (rozsah 0,7-9,5 ng/ml) se 77% interindividuální variabilitou. Tato variabilita je obdobná jako známá vysoká variabilita u farmakokinetiky granisetronu po perorálním nebo intravenózním podání.
Distribuce
Granisetron je distribuován se středním distribučním objemem přibližně 3 l/kg. Vazba na plazmatické proteiny je přibližně 65 %. Granisetron je distribuován volně do plazmy a erytrocytů.
Biotransformace
Nebyly zjištěny žádné rozdíly v metabolickém profilu granisetronu mezi perorálním a transdermálním podáním.
Granisetron je metabolizován zejména na 7-hydroxygranisetron a N9'-demethyl granisetron. Studie in vitro využívající lidské jaterní mikrozomy poukazují, že CYP1A1 je hlavním enzymem zodpovědným za 7-hydroxylaci granisetronu, zatímco CYP3A4 přispívá k 9’demethylaci.
Eliminace
Granisetron je metabolizován převážně v játrech. Po intravenózním podání dávky se střední plazmatická clearance pohybuje v rozsahu od 33,4 do 75,7 l/h u zdravých subjektů a od 14,7 do 33,6 l/h u pacientů s velkou interindividuální variabilitou. Střední plazmatický poločas je 4-6 hodin u zdravých subjektů a 9-12 hodin u pacientů. Po aplikaci transdermální náplasti byl zjevný plazmatický poločas granisetronu u zdravých subjektů prodloužený přibližně na 36 hodin v důsledku pomalé absorpce granisetronu přes kůži.
V klinických studiích provedených s přípravkem SANCUSO byla clearance u pacientů s nádorovým onemocněním přibližně poloviční oproti zdravým subjektům.
Po intravenózní injekci se přibližně 12 % dávky vylučuje v nezměněné formě močí, u zdravých subjektů do 48 hodin. Zbytek dávky se vylučuje ve formě metabolitů, 49 % v moči a 34 % ve stolici.
Farmakokinetika u zvláštních skupin populace
Vlivy pohlaví na farmakokinetiku přípravku SANCUSO nebyly konkrétně hodnoceny. V klinických studiích s přípravkem SANCUSO nebyly pozorovány žádné konzistentní vlivy pohlaví na jeho farmakokinetiku a byla hlášena vysoká interindividuální variabilita u obou pohlaví. Populační farmakokinetický model potvrdil, že pohlaví nemá vliv na farmakokinetiku přípravku SANCUSO.
Starší pacienti
V klinické studii nebyly pozorovány žádné rozdíly v plazmatické farmakokinetice přípravku SANCUSO u starších subjektů mužského a ženského pohlaví (> 65 let) v porovnání s mladšími subjekty (ve věku 18-45 let včetně).
Porucha renální nebo jaterní funkce
Nebyly provedeny žádné klinické studie specificky za účelem hodnocení farmakokinetiky přípravku SANCUSO u pacientů s poruchou renální a jaterní funkce. Na populačním farmakokinetickém modelu nebyl nalezen žádný jednoznačný vztah mezi renální funkcí (měřenou jako clearance kreatininu) a clearancí granisetronu. U pacientů s poruchou renální nebo jaterní funkce byla farmakokinetika granisetronu stanovena po intravenózním podání 40 ^g/kg granisetron-hydrochloridu v jedné dávce.
Porucha jaterní funkce
U pacientů s poruchou funkce jater v důsledku zasažení jater nádorem byla celková plazmatická clearance přibližně poloviční v porovnání s pacienty bez jaterní insuficience. Vzhledem k velké variabilitě farmakokinetických parametrů granisetronu a dobré toleranci i výrazně nad doporučenou dávkou není úprava dávky u pacientů s poruchou funkce jater nutná.
Porucha renální funkce
Nebyla pozorována žádná korelace mezi clearancí kreatininu a celkovou clearancí u pacientů s nádorovým onemocněním, což ukazuje, že porucha renální funkce nemá žádný vliv na farmakokinetiku granisetronu.
Index tělesné hmotnosti (BMI)
V klinické studii určené k hodnocení expozice granisetronu z přípravku SANCUSO u subjektů s odlišnými hladinami tělesného tuku, kde byl index BMI použit jako zástupný ukazatel tělesného tuku, nebyly pozorovány žádné rozdíly v plazmatické farmakokinetice přípravku SANCUSO u subjektů mužského a ženského pohlaví s nízkým indexem BMI [< 19,5 kg/m2 (muži), < 18,5 kg/m2 (ženy)] a vysokým indexem BMI (30,0 až 39,9 kg/m2 včetně) v porovnání s kontrolní skupinou (index BMI 20,0 až 24,9 kg/m2 včetně).
Pediatrická populace
Nebyly provedeny žádné studie hodnotící farmakokinetiku přípravku SANCUSO u pediatrické populace.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, reprodukční toxicity a genotoxicity neodhalily žádné zvláštní riziko pro člověka. Studie karcinogenity neprokázaly žádné zvláštní riziko pro člověka, pokud bylo použito doporučené dávkování. Při podávání vyšších dávek a podávání po delší dobu však riziko karcinogenity nelze vyloučit. Při krátké době podávání doporučené pro transdermální distribuční systém se karcinogenní riziko pro člověka nepředpokládá.
Při testování in vivo na morčatech neprokázaly transdermální náplasti SANCUSO žádný potenciál k fotoiritaci nebo fotosenzitivitě. Při testování in vitro na myší buněčné linii fibroblastů nebyl granisetron fototoxický. Při testování fotogenotoxického potenciálu in vitro na buněčné linii ovariálních buněk čínského křečka (CHO) granisetron zvyšoval procentní podíl buněk s chromozomálním poškozením po fotoiradiaci. Ačkoli klinická relevance tohoto nálezu není zcela jasná, pacienti by měli být poučeni, aby zakryli místo aplikace transdermální náplasti, pokud existuje riziko expozice slunečnímu záření kdykoli během používání náplasti a po dobu 10 dní po jejím odstranění (viz bod 4.4).
Při testování potenciálu kožní senzitivity na morčatech vykázal přípravek SANCUSO nízký iritační potenciál.
Studie prováděná na klonovaných iontových kanálech lidského srdce prokázala, že granisetron má potenciál ovlivnit repolarizaci myokardu prostřednictvím blokády draslíkových kanálů hERG.
Granisetron blokoval jak sodíkové, tak i draslíkové kanály, což mohlo ovlivnit depolarizaci a repolarizaci myokardu a tedy i intervaly PR, QRS a QT.
Tyto údaje pomáhají objasnit mechanismus, kterým dochází k některým změnám v EKG (především prodloužení intervalu QT a QRS) spojených s touto třídou látky. V klinických studiích s přípravkem SANCUSO, včetně podrobné studie intervalu QT na 240 zdravých subjektech, však nebyly zjištěny žádné klinicky relevantní vlivy na EKG (viz bod 5.1).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Krycí fólie Polyester
Adhezivní vrstva (matrix)
Kopolymer akrylátu s vinylacetátem
Ochranná snímatelná fólie Silikonizovaná pegoterátová fólie
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Každá transdermální náplast je zabalena v zataveném sáčku, který se skládá z papíru/hliníku/LLDPE potaženého polyesterem..
Krabička obsahuje 1 transdermální náplast.
6.6 Zvláštní opatření pro likvidaci přípravku
Transdermální náplast bude i po použití obsahovat léčivou látku. Po sejmutí je nutné transdermální náplast přeložit napůl, lepicí stranou dovnitř, a poté ji zlikvidovat mimo dosah dětí.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Kyowa Kirin Limited
Galabank Business Park
Galashiels
TD11QH
Velká Británie
Tel: +44 (0)1896 664000
Fax: +44 (0)1896 664001
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/766/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. dubna 2012.
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
PHARBIL Waltrop GmbH
Im Wirrigen 25
45731 Waltrop
Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky..
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
SANCUSO 3,1 mg/24 hodin transdermální náplast Granisetronum
Jedna transdermální náplast o velikosti 52 cm2 obsahuje 34,3 mg granisetronum, z čehož se uvolňuje 3,1 mg granisetronum za 24 hodin.
Pomocné látky: kopolymer akrylátu s vinylacetátem, polyester, silikonizovaná pegoterátová fólie.
1 transdermální náplast
Před použitím si přečtěte příbalovou informaci. Transdermální podání.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Kyowa Kirin Ltd, Galabank Business Park, Galashiels, TD1 1QH, Velká Británie.
12. REGISTRAČNÍ ČÍSLO/ČÍSLa
EU/1/12/766/001
13. ČÍSLO ŠARŽE
Č.š.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Sancuso
SANCUSO 3,1 mg/24 hodin transdermální náplast
Granisetronum
Transdermální podání
Před použitím si přečtěte příbalovou informaci.
EXP
Č.š.
1 transdermální náplast
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Uchovávejte mimo dohled a dosah dětí.
Kyowa Kirin Ltd
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienty
SANCUSO 3,1 mg/24 hodin transdermální náplast
Granisetronum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek SANCUSO a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek SANCUSO používat
3. Jak se přípravek SANCUSO používá
4. Možné nežádoucí účinky
5. Jak přípravek SANCUSO uchovávat
6. Obsah balení a další informace
1. Co je přípravek SANCUSO a k čemu se používá
Léčivou látkou přípravku SANCUSO je granisetron. Přípravek SANCUSO patří do skupiny léků zvaných antiemetika.
Přípravek SANCUSO je transdermální (kožní) náplast, která se používá k prevenci nauzey (pocitu nevolnosti) a zvracení u dospělých osob, které podstupují chemoterapeutickou léčbu (léky k léčbě nádorů) trvající 3 až 5 dní a mají problémy s polykáním tablet (například z důvodu bolesti, sucha nebo zánětu v ústech či krku).
Pokud se do prvního dne po chemoterapii nebudete cítit lépe nebo pokud se Vám přitíží, musíte se poradit s lékařem.
2. Čemu musíte věnovat pozornost, než začnete přípravek SANCUSO používat Nepoužívejte přípravek SANCUSO:
- jestliže j ste alergický(á) na granisetron nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6),
- jestliže jste alergický(á) na kterýkoli jiný lék proti nevolnosti, jehož název končí na „setron“, např. ondansetron.
Upozornění a opatření
Před použitím přípravku SANCUSO se poraďte se svým lékařem nebo zdravotní sestrou, jestliže pro Vás platí kterýkoli z následujících bodů:
- víte, že trpíte srdeční poruchou nebo onemocněním,
- trpíte bolestmi břicha nebo máte břicho oteklé,
- máte potíže s játry.
Lék obsažený v přípravku SANCUSO (granisetron) nemusí fungovat zcela správně a/nebo může vyvolat změny na kůži, je-li vystaven přímému slunečnímu záření nebo světlu z horského slunce nebo solárního lehátka. Je důležité postupovat následovně:
- když na sobě máte transdermální náplast, zakrývejte ji oblečením, pokud se budete pohybovat na slunci nebo v blízkosti horského slunce, včetně solárních lehátek;
- kůži, kde jste měl(a) nalepenou náplast SANCUSO, zakrývejte po dobu dalších 10 dní po sejmutí transdermální náplasti, aby Vaše kůže nebyla vystavena přímému slunečnímu záření.
Není známo, jak mohou činnosti, jako je plavání, intenzivní cvičení nebo návštěva sauny či vířivá koupel, ovlivnit přípravek SANCUSO. Během nošení přípravku SANCUSO se těchto aktivit vyvarujte. Během nošení transdermální náplasti SANCUSO se můžete nadále sprchovat a umývat jako obvykle.
V okolí transdermální náplasti je třeba se vyvarovat vnějšího tepla, například z lahví s horkou vodou nebo ohřívacích polštářků.
Děti a dospívající
Tento přípravek se nesmí používat u dětí nebo dospívajících do 18 let.
Další léčivé přípravky a přípravek SANCUSO
Informujte svého lékaře nebo zdravotní sestru o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Přípravek SANCUSO může ovlivnit způsob, jakým některé léky působí. Také některé jiné léky mohou ovlivnit způsob, jakým působí přípravek SANCUSO. Zejména informujte svého lékaře nebo zdravotní sestru, pokud užíváte tyto léky:
- paracetamol, používá se k léčbě bolesti;
- fenobarbital, používá se k léčbě epilepsie;
- ketokonazol, používá se k léčbě plísňových infekcí;
- SSRI (selektivní inhibitory zpětného vychytávání serotoninu) používané k léčbě deprese a/nebo úzkosti zahrnují fluoxetin, paroxetin, sertralin, fluvoxamin, citalopram, escitalopram;
- SNRI (inhibitory vychytávání serotoninu a noradernalinu) používané k léčbě deprese a/nebo úzkosti zahrnují venlafaxin, duloxetin.
Těhotenství a kojení
Jestliže jste těhotná, tento přípravek nepoužívejte, pokud Vám jej Váš lékař přímo nedoporučil.
V průběhu nošení náplasti přerušte kojení.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat.
Řízení dopravních prostředků a obsluha strojů
Přípravek SANCUSO nemá žádný nebo má zanedbatelný vliv na Vaši schopnost řídit nebo obsluhovat stroje.
3. Jak se přípravek SANCUSO používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo zdravotní sestrou.
Doporučená dávka přípravku je jedna transdermální náplast. Lék obsažený v přípravku SANCUSO postupně prostupuje kůží do Vašeho těla, a proto se náplast aplikuje 1 až 2 dny (24 až 48 hodin) před zahájením chemoterapeutické léčby.
Přípravek SANCUSO je určen k transdermálnímu podání. Tento přípravek uvolňuje léčivou látku pomalu a plynule skrz Vaši kůži do krevního oběhu po dobu, kdy nosíte transdermální náplast.
Na co pamatovat při používání transdermální náplasti
• Neuchovávejte či neskladujte transdermální náplast mimo zatavený sáček.
• Transdermální náplast nestříhejte na menší části.
• Používejte vždy jen j ednu transdermální náplast.
• Po sejmutí transdermální náplasti zkontrolujte stav své kůže a informujte svého lékaře, pokud si všimnete závažné kožní reakce (pokud bude Vaše kůže příliš zarudlá, bude svědit nebo se na ní objeví puchýřky).
• Transdermální náplast může ovlivnit přímé sluneční záření nebo světlo z horského slunce. Během nošení transdermální náplasti ji musíte nechávat zakrytou, například oděvem, pokud existuje riziko, že bude vystavena slunečnímu záření nebo světlu z horského slunce. Místo aplikace zakrývejte po dobu dalších 10 dní po sejmutí transdermální náplasti.
• Kontakt s vodou během koupání nebo sprchování nemá vliv na způsob, jakým přípravek SANCUSO působí. Transdermální náplast se však může částečně odlepit. Snažte se nezůstávat s transdermální náplastí ve vodě dlouhou dobu.
• Neexistují žádné informace o vlivu na transdermální náplast u činností, jako je intenzivní cvičení nebo návštěvy sauny či vířivé koupele. Měl(a) byste se proto během nošení náplasti SANCUSO těchto aktivit vyvarovat.
• V oblasti aplikace transdermální náplasti byste se měl(a) vyvarovat vnějšího tepla (například lahve s horkou vodou nebo ohřívacích polštářků).
Kdy aplikovat a odstranit transdermální náplast
Nevytahujte transdermální náplast ze sáčku, dokud nebudete připraven(a) ji použít. Transdermální náplast aplikujte alespoň 1 den (24 hodin) před plánovanou chemoterapií. Transdermální náplast lze aplikovat maximálně až 2 dny (48 hodin) před chemoterapií. Transdermální náplast noste po celou dobu chemoterapie. Transdermální náplast lze nosit až 7 dní v závislosti na době trvání chemoterapeutické léčby. Odstraňte ji nejméně 1 den (24 hodin) po dokončení chemoterapie.
Kam aplikovat transdermální náplast
Transdermální náplast umístěte na čisté, suché a zdravé místo na kůži na vnější straně paže. Jestliže umístění transdermální náplasti na paži u Vás není vhodné, může Vám lékař doporučit aplikaci v oblasti břicha. Oblast, kterou si zvolíte, nesmí být mastná a nedávno oholená a musí být bez kožních problémů, jako je poranění (pořezání nebo poškrábání) nebo podráždění (zarudnutí nebo vyrážka). Náplast SANCUSO neumísťujte na oblasti ošetřené krémy, oleji, pleťovými mléky, pudry nebo jinými kožními přípravky, které by mohly bránit dobré fixaci transdermální náplasti na kůži.
Jak aplikovat transdermální náplast
1. Vyjměte sáček z krabičky a v místě naříznutí jej otevřete. Každý sáček obsahuje jednu transdermální náplast SANCUSO nalepenou na.fólii z tuhého plastu.
2. Vyjměte transdermální náplast ze sáčku .
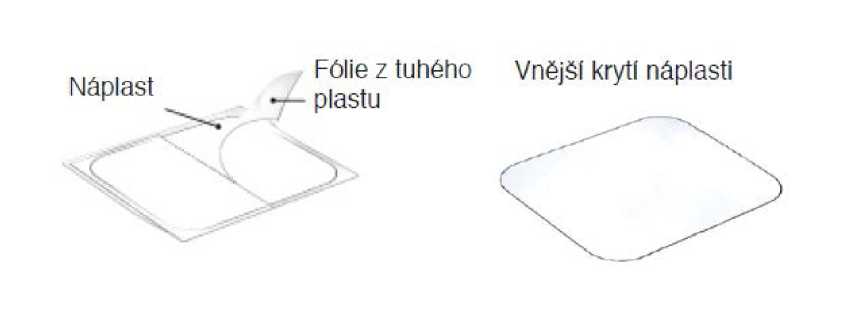
3. Lepicí strana transdermální náplasti je krytá dvoudílnou fólií z tuhého plastu. Transdermální náplast uprostřed přehněte a odstraňte polovinu fólie z tuhého plastu. Postupujte opatrně, aby se transdermální náplast neslepila k sobě. Nedotýkejte se lepicí strany transdermální náplasti.
4. Držte druhou polovinu fólie z tuhého plastu a přiložte transdermální náplast na kůži na vnější straně paže.
5. Sejměte druhou polovinu fólie z tuhého plastu a prsty pevně přitiskněte celou transdermální náplast na paži a uhlaďte ji. Náplast přitiskněte pevně, zvláště kolem jejích okrajů, aby dobře držela na kůži.
6. Po aplikaci transdermální náplasti si umyjte ruce.
7. Ponechte transdermální náplast na místě po celou dobu trvání Vaší chemoterapie.
8. Po odstranění transdermální náplasti ji znovu nepoužívejte, viz níže uvedené pokyny k odstranění a likvidaci transdermální náplasti (viz bod 5).
Po odstranění transdermální náplasti
1. Použitá transdermální náplast bude stále obsahovat nějaký granisetron a musí být okamžitě zlikvidována podle pokynů popsaných v bodě 5.
2. Po odstranění transdermální náplasti může na Vaší kůži zůstat trochu lepidla. Pro odstranění lepidla jemně omyjte místo aplikace mýdlem a vodou. Alkoholová nebo jiná rozpouštědla,
například odlakovač, mohou přivodit podráždění kůže a neměla by se proto používat.
3. Umyjte si ruce.
4. Po odstranění transdermální náplasti můžete na kůži v místě aplikace zaznamenat mírné zarudnutí. Toto zarudnutí by mělo časem vymizet. V opačném případě informujte svého lékaře.
Jestliže se transdermální náplast odlepí
Jestliže se transdermální náplast začne odlepovat, je možné takovou transdermální náplast připevnit na stejné místo na kůži. V případě potřeby použijte k připevnění transdermální náplasti chirurgický obvaz nebo lékařskou lepicí pásku. Jestliže transdermální náplast ztratíte nebo se náplast poškodí, znovu navštivte svého lékaře.
Jestliže jste použil(a) více přípravku SANCUSO, než jste měl(a)
Jestliže jste použil(a) více přípravku SANCUSO, než jste měl(a), jednoduše odstraňte nadbytečnou náplast (náplasti) a obraťte se na svého lékaře.
Jestliže jste zapomněl(a) použít přípravek SANCUSO
Je důležité, abyste přípravek SANCUSO používal(a) podle pokynů svého lékaře, aby nedošlo k nevolnosti nebo zvracení po absolvování chemoterapie. Jestliže jste zapomněl(a) aplikovat transdermální náplast ve správnou dobu, aplikujte ji hned, jak si vzpomenete, a co nejdříve před chemoterapií informujte svého lékaře.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
U pacientů léčených chemoterapií, která je středně nebo vysoce schopná vyvolávat nevolnost a zvracení, se může zvracení vyskytovat i přesto, že dostávají vhodnou léčbu, včetně přípravku SANCUSO.
Ihned informujte svého lékaře, jestliže se u Vás vyskytne zácpa nebo bolest či otok v oblasti břicha. Zácpa je častým nežádoucím účinkem a může postihovat až 1 pacienta z 10.
Odstraňte transdermální náplast a informujte svého lékaře, pokud si všimnete závažné kožní reakce (pokud bude Vaše kůže příliš zarudlá, bude svědit nebo se na ní objeví puchýřky). Kožní reakce v místě aplikace, jako je podráždění, svědění nebo zarudnutí, jsou méně časté a mohou postihovat až 1 pacienta ze 100.
Další možné nežádoucí účinky:
Méně časté nežádoucí účinky (mohou postihovat až 1 pacienta ze 100) jsou:
• bolest hlavy, pocit, že se Vám točí hlava, i když stojíte v klidu (závrať)
• menší chuť k j ídlu, pokles tělesné hmotnosti
• návaly horka (nebo zrudnutí)
• nevolnost (nauzea), dávení, sucho v ústech
• bolestivé klouby
• otok v důsledku zadržování vody (edém)
• změny v jaterních testech (pokud Vám budou provádět vyšetření krve, informujte lékaře nebo zdravotní sestru, že používáte přípravek SANCUSO).
Vzácné nežádoucí účinky (mohou postihovat až 1 pacienta z 1000) jsou:
• abnormální svalové pohyby (jako je třes, svalová ztuhlost a svalové křeče).
Nežádoucí účinky s neznámou frekvencí (z dostupných údajů nelze určit) jsou:
• alergické kožní reakce. Příznaky zahrnují červené vyvýšené a svědivé hrbolky.
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášenínežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek SANCUSO uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a sáčku za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Použité transdermální náplasti stále obsahují léčivé látky, které mohou být pro ostatní lidi škodlivé. Použitou transdermální náplast přeložte na polovinu lepicí stranou k sobě a bezpečně ji zlikvidujte, mimo dosah dětí. Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek SANCUSO obsahuje
- Léčivou látkou je granisetronum. Jedna transdermální náplast o velikosti 52 cm2 obsahuje 34,3 mg granisetronum, z čehož se uvolňuje 3,1 mg granisetronum za 24 hodin.
- Dalšími složkami jsou:
- AdheZivní vrstva: kopolymer akrylátu s vinylacetátem
- Krycí fólie: polyester
- Ochranná snímatelná fólie: silikonizovaná pegoterátová fólie
Jak přípravek SANCUSO vypadá a co obsahuje toto balení
Přípravek SANCUSO je tenká, průsvitná transdermální náplast obdélníkového tvaru s oblými rohy, přilepená na fólii z tuhého plastu. Transdermální náplast je zabalena v sáčku. Každá krabička obsahuje jeden sáček.
Držitel rozhodnutí o registraci
Kyowa Kirin Ltd
Galabank Business Park
Galashiels
TD11QH
Velká Británie
Tel: +44 (0)1896 664000
Fax: +44 (0)1896 664001
Výrobce
Pharbil Waltrop GmbH (dceřiná společnost společnosti NextPharma Im Wirrigen 25 Waltrop 45731 Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
Kyowa Kirin Ltd Tel: +44 (0)1896 66400
Belgie/Belgique/Belgien
Kyowa Kirin Ltd Tél/Tel: +44 (0)1896 664000
Bt^rapnn
Kyowa Kirin Ltd Ten.: + 44 (0)1896 664000
Česká republika
Kyowa Kirin Ltd Tel: +44 (0)1896 664000
Luxembourg/Luxemburg
Kyowa Kirin Ltd Tél/Tel: +44 (0)1896 664000
Magyarország
Kyowa Kirin Ltd Tel.: +44 (0)1896 664000
Danmark Malta
Kyowa Kirin Danmark filial af Kyowa Kirin AB Kyowa Kirin Ltd Tlf: + 800 15142627 Tel: +44 (0)1896 664000
Deutschland
Kyowa Kirin GmbH
Nederland
Kyowa Kirin Pharma BV
Tel: + 800 15142627
Tel: +31 (0)900 1231236
|
Eesti Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
Norge Kyowa Kirin Norge filial av Prostrakan AB Tlf: + 800 15142627 |
|
EkXába ANABIQIE IKE + 2102711020 |
Osterreich Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
|
Espaňa Kyowa Kirin Farmacéutica, S.L.U. Tel: +34 91 534 37 10 |
Polska Molteni Farmaceutici Polska Sp. z o.o. Tel.: + 48 (012) 653 15 71 |
|
France Kyowa Kirin Pharma Tél: +33 (0)1 55 39 14 30 |
Portugal Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
|
Hrvatska Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
Románia Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
|
Ireland Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
Slovenija Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
|
Ísland Kyowa Kirin Ltd Sími: +44 (0)1896 664000 |
Slovenská republika Kyowa Kirin Ltd Tel: +44 (0)1896 664000 |
|
Italia Kyowa Kirin s.r.l., Tel: +39 02 92169424 |
Suomi/Finland Kyowa Kirin AB filial i Finland Puh/Tel: + 800 15142627 |
|
Kónpoq CENTROM PHARMA LIMITED TqT: +357 22 692094 |
Sverige Kyowa Kirin AB Tel: + 800 15142627 |
|
Latvija Kyowa Kirin Ltd Tel: + 44 (0)1896 664000 |
United Kingdom Kyowa Kirin Ltd Tel: + 800 15142627 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
26