Rotateq
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
RotaTeq, perorální roztok Očkovací látka proti rotavirům, živá
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna dávka (2 ml) obsahuje:
|
Rotavirus typus* G1 |
ne |
|
Rotavirus typus* G2 |
ne |
|
Rotavirus typus* G3 |
ne |
|
Rotavirus typus* G4 |
ne |
|
Rotavirus typus* P1A[8] |
ne |
* humánní-bovinní rotavirové reasortanty (živé), vyrobené ve
méně než 2,2 x 106 IU1, 2 méně než 2,8 x 106 IU1’ 2 méně než 2,2 x 106 IU1, 2 méně než 2,0 x 106 IU1, 2 méně než 2,3 x 106 IU1, 2
Vero buňkách
1 infekční jednotky
2 jako spodní mez spolehlivosti (p = 0,95)
Pomocné látky se známým účinkem:
Tato očkovací látka obsahuje 1 080 mg sacharózy (viz bod 4.4). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Perorální roztok
Světle žlutá čirá tekutina, která může být až narůžovělá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
RotaTeq je indikován k aktivní imunizaci kojenců ve věku od 6 do 32 týdnů za účelem prevence gastroenteritidy způsobené rotavirovou infekcí (viz body 4.2, 4.4 a 5.1).
Přípravek RotaTeq je nutno používat na základě oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Od narození do 6 týdnů
Přípravek RotaTeq není u této podskupiny pediatrické populace indikován.
Bezpečnost a účinnost přípravku RotaTeq u jedinců od narození do 6 týdnů věku nebyla stanovena.
Od 6 týdnů do 32 týdnů
Očkovací schéma sestává ze tří dávek.
První dávku lze podat od věku 6 týdnů a ne později než ve věku 12 týdnů.
RotaTeq může být podáván předčasně narozeným dětem, jejichž gestační věk byl nejméně 25 týdnů. První dávka přípravku RotaTeq může být těmto dětem podána ve věku nejméně 6 týdnů (viz body 4.4.a 5.1).
Mezi dávkami musí být intervaly nejméně 4 týdny.
Doporučuje se třídávkové očkovací schéma dokončit do věku 20 až 22 týdnů. V případě potřeby lze třetí (poslední) dávku podat do věku 32 týdnů (viz bod 5.1).
Protože nejsou k dispozici údaje o zaměnitelnosti přípravku RotaTeq s jinými očkovacími látkami proti rotaviru, doporučuje se, aby kojenci, jimž se jako první podá k imunizaci proti rotaviru přípravek RotaTeq, dostali další dávky téže očkovací látky.
Pokud je zřejmé nebo silně podezřelé, že nebyla polknuta úplná dávka (např. kojenec očkovací látku vyplivl nebo vyzvrátil), lze podat jednu náhradní dávku na stejné očkovací návštěvě, nicméně v klinických studiích nebyla tato možnost hodnocena. Pokud problém přetrvává, další náhradní dávky nesmí být podány.
Po dokončení třídávkového očkovacího schématu se nedoporučuje podávat žádné další dávky (viz body 4.4 a 5.1 ohledně dostupných informací o přetrvávání ochrany).
Od 33 týdnů do 18 let
Přípravek RotaTeq není u této podskupiny pediatrické populace indikována.
Způsob podání
Přípravek RotaTeq je určena pouze k perorálnímu podání.
RotaTeq SE NESMÍ ZA ŽÁDNÝCH OKOLNOSTÍ APLIKOVAT INJEKČNĚ.
RotaTeq lze podávat bez ohledu na konzumaci jídla, tekutin nebo mateřského mléka.
Pokyny pro podání viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita po předchozím podání očkovací látky proti rotaviru.
Předchozí anamnéza intususcepce.
Jedinci s vrozenými malformacemi gastrointestinálního traktu, které by mohly predisponovat k intususcepci.
Kojenci se známým imonudeficitem nebo s podezřením na něj (viz body 4.4 a 4.8).
U kojenců s akutním závažným febrilním onemocněním je třeba podání přípravku RotaTeq odložit. Přítomnost lehké infekce není kontraindikací pro imunizaci.
U kojenců s akutním průjmem nebo zvracením je třeba podání přípravku RotaTeq odložit.
4.4 Zvláštní upozornění a opatření pro použití
Jako je tomu u všech očkovacích látek, vždy musí být snadno k dispozici vhodné lékařské ošetření pro případ anafylaktické příhody po podání očkovací látky (viz bod 4.8).
K dispozici nejsou žádné údaje z klinických studií ohledně bezpečnosti ani účinnosti podávání přípravku RotaTeq imunokompromitovaným kojencům, kojencům infikovaným virem HIV nebo kojencům, u nichž byla v období 42 dnů před podáním přípravku RotaTeq provedena krevní transfuze nebo jim byly podány imunoglobuliny. Neočekává se, že by asymptomatická infekce HIV ovlivnila bezpečnost nebo účinnost přípravku RotaTeq. Protože však neexistují dostatečné údaje, nedoporučuje se podávat přípravek RotaTeq kojencům s asymptomatickou infekcí HIV.
Případy gastroenteritidy v souvislosti s virem očkovací látky byly hlášeny po uvedení přípravku na trh u kojenců s těžkým kombinovaným imunodeficitem (severe combined immunodeficiency, SCID, viz bod 4.3).
Ve studiích se přípravek RotaTeq vylučovala stolicí u 8,9 % příjemců očkovací látky téměř výhradně v týdnu po dávce 1 a pouze u jednoho příjemce očkovací látky (0,3 %) po dávce 3. Vrchol exkrece nastal během 7 dní po dávce. Po uvedení přípravku na trh byl pozorován přenos kmenů virů očkovací látky na neočkované kontakty. RotaTeq musí být podáván s opatrností jedincům, kteří jsou v úzkém kontaktu s osobami s imunodeficitem (např. jedinci s malignitami nebo s jinak sníženou imunitou nebo jedinci dostávající imunosupresivní léčbu). Také osoby pečující o nedávno očkované by měly dodržovat přísnou hygienu zejména při manipulaci s exkrety.
V klinických studiích byl přípravek Rotateq podávána přibližně 1 000 dětem, které se narodily od 25. týdne do 36. týdne těhotenství. První očkovací dávka byla podána od 6. týdne po narození. Bezpečnost a účinnost přípravku Rotateq byla srovnatelná mezi touto podskupinou dětí a dětmi narozenými v termínu. Nicméně 19 z přibližně 1 000 dětí se narodilo v 25. až 28. týdnu těhotenství, 55 se narodilo v 29. až 31. týdnu a zbytek se narodil ve 32. až 36. týdnu těhotenství. Viz body 4.2. a 5.1.
Intususcepce
Jako opatření předběžné opatrnosti musí zdravotníci sledovat jakékoli příznaky poukazující na intususcepci (těžké bolesti břicha, úporné zvracení, krev ve stolici, nadýmání a/nebo vysoká horečka), protože údaje z observačních studií poukazují na zvýšené riziko intususcepce, zejména v průběhu 7 dní po očkování proti rotavirům (viz bod 4.8). Rodiče/doprovod dětí je nutno poučit, aby takové příznaky okamžitě hlásili svému poskytovateli zdravotní péče.
Pro pacienty s predispozicí k intususcepci viz bod 4.3.
Údaje o bezpečnosti a účinnosti u kojenců s aktivním onemocněním trávicího ústrojí (včetně chronického průjmu) nebo růstovou retardací nejsou k dispozici. Podávání přípravku RotaTeq je možné s opatrností zvážit u kojenců, u nichž by podle názoru lékaře mohlo nepodání očkovací látky znamenat větší riziko.
Úroveň ochrany poskytované přípravkem RotaTeq je založena na podání všech 3 dávek. Podobně jako u jiných očkovacích látek nemusí vakcinace očkovací látkou RotaTeq zajistit úplnou ochranu všem příjemcům. Přípravek RotaTeq nechrání proti gastroenteritidám způsobeným jinými patogeny než rotaviry.
Klinické studie účinnosti proti rotavirové gastroenteritidě byly provedeny v Evropě, USA, Latinské Americe a v Asii. V průběhu těchto studií byl nejčastějším genotypem rotaviru v krevním oběhu G1P[8]; zatímco rotaviry genotypů G2P[4], G3P[8], G4P[8] a G9P[8] byly zjišťovány méně často. Rozsah ochrany, který by mohl RotaTeq zajistit vůči jiným typům rotavirů a v jiných populacích, není znám.
K dispozici nejsou žádné klinické údaje ohledně použití přípravku RotaTeq k profylaxi po expozici infekci.
Přípravek RotaTeq obsahuje sacharózu. Pacientům se vzácnými dědičnými problémy, jakými jsou intolerance fruktózy, malabsorpce glukózy-galaktózy nebo nedostatek cukrázy-izomaltázy, se nesmí tato očkovací látka podat. Viz bod 2.
Možné riziko apnoe a nutnost monitorování dýchání po dobu 48-72 hodin je třeba zvážit, když se podávají dávky primární imunizace velmi předčasně narozeným dětem (narozeným v < 28. týdnu těhotenství) a zvláště těm, v jejichž předchozí anamnéze byla respirační nezralost. Protože přínos očkování je u této skupiny dětí vysoký, neměla by se vakcinace odmítat ani oddalovat.
RotaTeq SE NESMÍ ZA ŽÁDNÝCH OKOLNOSTÍ APLIKOVAT INJEKČNĚ.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné podávání přípravku RotaTeq s očkovacími látkami obsahujícími jeden nebo více následujících antigenů ve věku přibližně 2, 4 a 6 měsíců prokázalo, že nedošlo k ovlivnění imunitních odpovědí a bezpečnostních profilů podávaných očkovacích látek:
- očkovací látka proti difterii-tetanu-acelulární pertusi (DTaP)
- očkovací látka proti Haemophilus influenzae typu b (Hib)
- inaktivovaná očkovací látka proti poliomyelitidě (IPV)
- očkovací látka proti hepatitidě B (HBV)
- konjugovaná pneumokoková očkovací látka (PCV)
Současné podávání přípravku RotaTeq s očkovací látkou proti DTaP-IPV-HBV-Hib (Infanrix hexa) ve věku přibližně 2, 3 a 4 měsíce prokázalo, že v porovnání se samostatnými podáními nedošlo k ovlivnění imunitních odpovědí a bezpečnostních profilů současně podávaných očkovacích látek.
Současné podávání přípravku RotaTeq s konjugovanou očkovací látkou proti meningokoku skupiny C (MenCC, hodnocenou očkovací látkou byl konjugovaný tetanový toxoid) ve věku 3 a 5 měsíců (a většinou ve stejnou dobu jako očkovací látka proti DTaP-IPV-Hib), následované třetí dávkou přípravku RotaTeq ve věku přibližně 6 měsíců, prokázalo, že imunitní odpovědi na očkovací látky RotaTeq a MenCC nebyly ovlivněny. Současné podání vedlo k přijatelnému bezpečnostnímu profilu.
Současné podávání přípravku RotaTeq a perorální očkovací látky proti poliomyelitidě (OPV) neovlivnilo imunitní odpověď na antigeny polioviru. I když současné podávání OPV mírně snižovalo imunitní odpověď na očkovací látku proti rotaviru, současně není prokázáno, že může být ovlivněna klinická ochrana proti těžké rotavirové gastroenteritidě. Imunitní odpověď na přípravek RotaTeq nebyla ovlivněna, pokud byla OPV podána dva týdny po podání přípravku RotaTeq.
Proto lze přípravek RotaTeq podávat současně s monovalentními nebo kombinovanými dětskými očkovacími látkami obsahujícími jeden nebo více z následujících antigenů: DTaP, Hib, IPV nebo OPV, HBV, PCV a MenCC.
4.6 Fertilita, těhotenství a kojení
RotaTeq je určen pouze pro použití u dětí. Údaje o použití v těhotenství nebo při kojení nejsou tudíž dostupné a studie fertility nebo reprodukční studie na zvířatech nebyly provedeny.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
a. Souhrn bezpečnostního profilu
V podskupině kojenců ze 3 placebem kontrolovaných klinických studií (n = 6 130 příjemců přípravku RotaTeq a 5 560 příjemců placeba) byl RotaTeq hodnocen z hlediska všech nežádoucích účinků v době 42 dnů od vakcinace bez současného podání jiných pediatrických očkovacích látek nebo s nimi. Nežádoucí účinky se vyskytly celkem u 47,0 % kojenců dostávajících RotaTeq ve srovnání s 45,8 % kojenců dostávajících placebo. Nejčastěji uváděné nežádoucí účinky, které se vyskytly častěji při podávání očkovací látky než při podávání placeba, byly pyrexie (20,9 %), průjem (17,6 %) a zvracení (10,1 %).
U všech účastníků (36 150 příjemců přípravku RotaTeq a 35 536 příjemců placeba) 3 klinických hodnocení byly po dobu až 42 dní po každé dávce hodnoceny závažné nežádoucí účinky. Celková četnost těchto závažných nežádoucích účinků byla 0,1 % u příjemců přípravku RotaTeq a 0,2 % u příjemců placeba.
b. Tabulkový souhrn nežádoucích účinků
Dále jsou uvedeny nežádoucí účinky, které byly v klinických hodnoceních častější v očkované skupině, a to dle třídy orgánových systémů a četnosti. Na základě souhrnných údajů ze 3 klinických hodnocení, kde byla 6 130 dětem podán přípravek RotaTeq a 5 560 bylo podáno placebo, se uvedené nežádoucí účinky u osob, kterým byl podán přípravek RotaTeq, objevily s incidencí o 0,2 až 2,5 % vyšší než u příjemců placeba.
Četnosti jsou hlášeny jako:
velmi časté (> 1/10); časté (> 1/100, < 1/10); méně časté (> 1/1 000, < 1/100); vzácné (> 1/10 000,
< 1/1 000), velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit)
Nežádoucí účinky po podání přípravku RotaTeq v klinických hodnoceních a nežádoucí účinky hlášené
po uvedení na trh (kurzívou)
I J I
|
Třída orgánových systémů |
Četnost |
Nežádoucí účinek/příhoda |
|
Infekce a infestace |
Časté |
Infekce horních cest dýchacích |
|
Méně časté |
Nasofaryngitida, otitis media | |
|
Poruchy imunitního systému |
Není známo |
Anafylaktická reakce* |
|
Respirační, hrudní a mediastinální poruchy |
Vzácné |
Bronchospasmus |
|
Gastrointestinální poruchy |
Velmi časté | |
|
Méně časté |
Hematochezie'T, bolest horní poloviny břicha | |
|
Velmi vzácné |
Intususcepce a * | |
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Vzácné |
KopřivkaT | |
|
Není známo |
Angioedém1* | |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Pyrexie |
|
Není známo |
T Tento nežádoucí účinek byl zjištěn v poregistračním sledování. Kategorie četnosti byla
odhadnuta na základě relevantních klinických hodnocení. a Kategorie četnosti byly odhadnuty na základě údajů z observačních studií.
* Viz. bod 4.4.
* Poregistrační nežádoucí příhody (četnost nelze z dostupných údajů určit).
c. Popis vybraných nežádoucích účinků
Kawasakiho nemoc byla hlášena u 5 z 36 150 příjemců očkovací látky (< 0,1 %) a u 1 z 35 536 příjemců placeba (< 0,1 %) s relativním rizikem (RR) 4,9 [95% interval spolehlivosti (CI); 0,6-239,1] (není statisticky významné). U dětí, kterým byla podávána přípravek RotaTeq ve velké observační poregistrační studii bezpečnosti, žádné zvýšení rizika Kawasakiho nemoci nebylo pozorováno (viz bod 5.1).
Intususcepce
Údaje z observačních bezpečnostních studií provedených v několika zemích naznačují, že očkovací látky proti rotavirům přináší zvýšené riziko intususcepce, s výskytem až 6 dalších případů na 100 000 dětí v průběhu 7 dní po očkování. Existují omezené důkazy o mírném zvýšení rizika po druhé dávce. Původní výskyt intususcepce u dětí ve věku méně než 1 rok se v těchto zemích pohyboval od 33 do 101 na 100 000 dětí ročně. Zůstává nejasné, jestli rotavirové očkovací látky ovlivňují celkový výskyt intususcepce na základě delšího období sledování (viz bod 4.4).
d. Další zvláštní populace
Apnoe u velmi předčasně narozených dětí (< 28. týden těhotenství) (viz bod 4.4).
Po uvedení přípravku na trh byla u dětí s těžkým kombinovaným imunodeficitem (Severe Combined Immunodeficiency Disease - SCID) hlášena gastroenteritida s uvolňováním viru očkovací látky.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Existují hlášení o podání vyšších dávek přípravku RotaTeq, než doporučených.
Obecně byl profil nežádoucích účinků hlášených u předávkování srovnatelný s profilem pozorovaným u doporučených dávek přípravku RotaTeq.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny, virové vakcíny, ATC kód: J07BH02.
Účinnost
V klinických hodnoceních byla účinnost prokázána proti gastroenteritidě způsobené rotavirem
genotypů G1P[8], G2P[4], G3P[8], G4P[8] a G9P[8].
Účinnost ochrany přípravkem RotaTeq byla hodnocena dvěma způsoby v placebem kontrolované
studii REST (Rotavirus Efficacy and Safety Trial).
1. U 5 673 očkovaných kojenců (2 834 ve skupině s očkovací látkou) se hodnotila účinnost ochrany jako snížení incidence rotavirové (RV) gastroenteritidy vyvolané genotypy G proti nimž je očkovací látka zaměřena (G1-G4), která se vyskytla minimálně 14 dní po třetí dávce očkovací látky během celé první rotavirové sezóny po vakcinaci.
2. U 68 038 očkovaných kojenců (34 035 ve skupině s očkovací látkou) se hodnotila účinnost ochrany jako pokles četnosti hospitalizace a návštěv pohotovosti v důsledku RV gastroenteritidy v době od 14 dnů po třetí dávce.
Výsledky těchto analýz jsou uvedeny v následující tabulce.
|
Snížení incidence RV gastroenteritidy po celou sezónu po vakcinaci (RotaTeq n = 2 834) (% [95% interval spolehlivosti]) | ||||||
|
Účinnost proti jakékoli závažnosti c |
le genotypu rotaviru | |||||
|
Závažné onemocnění* (G1-G4) |
Stupeň závažnosti (G1-G4) |
G1 |
G2 |
G3 |
G4 |
G9 |
|
98,0 % [88,3; 100,0]T |
74,0 % [66,8; 79,9f |
74,9 % [67,3; 80,9]r |
63,4 % [2,6; 88,2]r |
82,7 % [< 0; 99,6] |
48,1 % [< 0; 91,6] |
65,4 % [< 0; 99,3] |
* Termín “závažný“ je definován jako skóre > 16/24 při použití validovaného klinického skórovacího systému založeného na intenzitě a trvání symptomů (horečka, zvracení, průjem a změny chování)
^ Statisticky významné
|
Snížení četnosti hospitalizace/návštěv pohotovosti v důsledku RV gastroenteritidy po dobu až 2 roky po očkování | |||||
|
(RotaTeq n = 34 035 |
) (% [95% interval spolehlivosti]) | ||||
|
G1-G4 |
G1 |
G2 |
G3 |
G4 |
G9 |
|
94,5 % |
95,1 % |
87,6 % |
93,4 % |
89,1 % |
100 % |
|
[91,2; 96,6]r |
[91,6; 97,1]Ť |
[< 0; 98,5] |
[49,4; 99,1]Ť |
[52,0; 97,5]r |
[69,6; 100]T |
T Statisticky významné
Snížení incidence RV gastroenteritidy vyvolané genotypy G1-G4 v druhé rotavirové sezóně po vakcinaci dosáhlo 88,0 % [95% interval spolehlivosti: 49,4; 98,7] u závažného onemocnění a 62,6 % [95% interval spolehlivosti: 44,3; 75,4] u onemocnění bez ohledu najeho závažnost.
Účinnost proti rotavirům genotypů G2P[4], G3P[8], G4P[8] a G9P[8] byla založena na menším počtu případů než účinnost proti sérotypům G1. Účinnost pozorovaná proti genotypu G2P[4] byla s největší pravděpodobností odvozena ze složky G2 očkovací látky.
V kombinované post-hoc analýze studie REST a další studie fáze III u dětí, které byly při podání
3. dávky ve věku >26 až < 32 týdnů, byla účinnost očkovací látky proti případům rotavirové gastroenteritidy vyvolaným sérotypy G1, G2, G3 a G4 (jakékoli závažnosti) 61,5 % [95% interval spolehlivosti: 14,2; 84,2].
Pouze ve Finsku byla provedena prodloužená část studie REST. Tato Finnish Extension Study (FES) zahrnovala podsoubor 20 736 subjektů hodnocení, které byly předtím zařazeny do studie REST. Děti do jednoho roku věku byly ve studii FES sledovány po dobu až 3 let po vakcinaci.
Ve studii REST bylo zdravotníky u populace hodnocené podle protokolu zaznamenáno 403 případů (20 ve vakcinované skupině a 383 v placebové skupině) souvisejících s rotavirovou gastroenteritidou G1-G4 a G9. Dodatečné údaje ze studie FES zvýšily počet o 136 zaznamenaných případů celkem, včetně 9 ve vakcinované skupině a 127 v placebové skupině. Celkem se během studie FES v příslušných skupinách vyskytlo 31%, respektive 25 % případů.
Na základě kombinovaných údajů ze studií REST a FES bylo za dobu až 3 let po vakcinaci snížení počtu hospitalizací a návštěv pohotovosti kvůli rotavirové gastroenteritidě 94,4 % (95% CI: 91,696,2) pro genotypy G1-G4, 95,5 % (95% CI: 92,8-97,2) pro genotyp G1, 81,9 % (95% CI: 16,1-98,0) pro genotyp G2, 89,0 % (95% CI: 53,3-98,7) pro genotyp G3, 83,4 % (95% CI: 51,2-95,8) pro genotyp G4 a 94,2 % (95% CI: 62,2-99,9) pro genotyp G9. V průběhu 3. roku nebyl ve vakcinované skupině (n = 3 112) žádný kontakt se zdravotní péčí kvůli rotavirové gastroenteritidě a v placebové skupině (n = 3 126) byl kontakt jeden (nebylo možno určit typ).
K dosažení úrovně a trvání ochrany proti rotavirové gastroenteritidě pozorované v klinických hodnoceních je potřeba podat úplnou sérii 3 vakcinačních dávek přípravku RotaTeq (viz bod 4.2).
Post hoc analýzy však ukázaly, že s pomocí přípravku RotaTeq bylo před podáním všech 3 dávek (tj. v době přibližně 14 dní po podání první dávky dál) dosaženo jistého snížení počtu případů rotavirové gastroenteritidy se závažností vyžadující hospitalizaci nebo návštěvu pohotovosti.
Účinnost u nedonošených dětí
Ve studii REST byl podán RotaTeq přibližně 1 000 dětem narozeným v 25. až 36. týdnu těhotenství. Účinnost přípravku RotaTeq byla srovnávána mezi touto podskupinou dětí a dětmi narozenými v termínu.
Poregistrační observační studie bezpečnosti
Ve velké, prospektivní, observační poregistrační studii ve Spojených Státech Amerických byla na 85 150 dětech, kterým byla podána jedna nebo více dávek přípravku RotaTeq (17 433 osobo-roků období sledování) analyzováno riziko Kawasakiho nemoci.
Během období sledování 0. až 30. den po očkování nebyl ve výskytu Kawasakiho nemoci zjištěn žádný statisticky významný rozdíl v porovnání s očekávaným dosavadním výskytem. Dále pak během období sledování 0. až 30. den nedošlo k žádnému statisticky významnému zvýšení rizika tohoto nežádoucího účinku v porovnání se souběžnou kontrolní skupinou kojenců, kterým byla podána očkovací látka DTaP, nikoli však přípravek RotaTeq (n = 62 617, 12 339 osobo-roků období sledování).
Byl zaznamenán 1 případ potvrzený ve zdravotní dokumentaci u kojenců očkovaných přípravkem RotaTeq v porovnání s 1 potvrzeným případem ve zdravotní dokumentaci pacienta v souběžné kontrolní skupině očkované očkovací látkou DTaP (relativní riziko = 0,7, 95% interval spolehlivosti (CI): 0,01-55,56). Celkové analýzy bezpečnosti neprokázaly žádná specifická bezpečnostní rizika.
Údaje ze studie účinnosti
Poregistrační studie prokazující účinnost v prevenci rotavirové gastroenteritidy (RVGE)
|
Design studie |
Zařazená populace |
Konečné ukazatele |
Účinnost |
Rotavirová |
|
(region) |
% [95% CI] |
sezóna | ||
|
Analýza databáze |
33 140 očkovaných |
Hospitalizace a návštěvy |
100 % [87; 100] |
2007 - 2008 |
|
údajů |
26 167 neočkovaných |
pohotovosti kvůli RVGE | ||
|
(USA) |
Věk > 7 měsíců | |||
|
Podány 3 dávky |
Onemocnění RVGE (bez hospitalizace) |
96 % [76; 100] | ||
|
Hospitalizace a návštěvy pohotovosti kvůli jakékoli gastroenteritidě |
59 % [47; 68] | |||
|
Kohortová studie |
1 895 očkovaných |
Hospitalizace kvůli RVGE |
98 % [83; 100] |
2007 - 2008 |
|
(Francie) |
3 dávkami 2 102 neočkovaných Věk < 2 roky |
2008 - 2009 | ||
|
Případová |
402 případů |
Hospitalizace a návštěvy |
80 % [74; 84] |
2011-2012 |
|
kontrolní studie |
2 559 kontrol* |
pohotovosti kvůli RVGE |
2012-2013 | |
|
(USA) |
Věk < 8 let |
Podle kmene | ||
|
Podány 3 dávky |
- G1P[8] |
89 % [55; 97] | ||
|
- G2P[4] |
87 % [65; 95] | |||
|
- G3P[8] |
80 % [64; 89] | |||
|
- G12P[8] Podle věku |
78% [71; 84] | |||
|
-1. rok života |
91 % [78; 96] | |||
|
- 2. rok života |
82 % [69; 89] | |||
|
- 3. rok života |
88 % [78; 93] | |||
|
- 4. rok života |
76% [51; 88] | |||
|
- 5. rok života |
60% [16; 81] | |||
|
-6.-7. rok života |
69 % [43; 84] |
* Kontrola akutní gastroenteritidy negativní na rotaviry
Imunogenita
Imunologický mechanismus, kterým RotaTeq chrání před rotavirovou gastroenteritidou, zatím není přesně znám. Imunologický korelát ochrany u očkovacích látek proti rotaviru zatím nebyl zjištěn. Ve studiích fáze III bylo po aplikaci tří dávek dosaženo u 92,5 % až 100 % jedinců očkovaných přípravkem RotaTeq statisticky významného zvýšení protilátek IgA proti rotaviru v séru. Očkovací látka indukuje imunitní odpověď (tzn. výskyt neutralizující protilátky v séru) vůči pěti proteinům lidského rotaviru exprimovaným na reasortantu (G1, G2, G3, G4 a P[8]).
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie perorální toxicity po jednorázovém a opakovaném podávání dávky myším neukazuje žádné zvláštní riziko pro člověka. Dávka podávaná myším byla přibližně 2,79 x 108 infekčních jednotek na kg (přibližně 14násobek předpokládané dávky pro kojence).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Sacharóza Citronan sodný
Monohydrát dihydrogenfosforečnanu sodného Hydroxid sodný Polysorbát 80
Živné půdy (s obsahem anorganických solí, aminokyselin a vitaminů)
Čištěná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
RotaTeq se musí podat ihned po vyjmutí z chladničky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C až 8 °C).
Uchovávejte dávkovací tubu v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
2 ml roztoku v předplněné stlačitelné tubě (LDPE) s twist-off víčkem (HDPE) v ochranném sáčku, velikost balení po 1 nebo 10 předplněných stlačitelných tubách.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Očkovací látku je třeba podávat perorálně bez mísení s jinými očkovacími látkami nebo roztoky. Neředit.
Podávání očkovací látky:

Roztržením otevřete ochranný sáček a vyjměte dávkovací tubu.
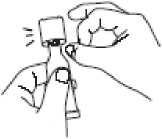
Podržte dávkovací tubu ve svislé poloze a poklepejte na twist-off víčko, aby se aplikátor vyprázdnil.
r
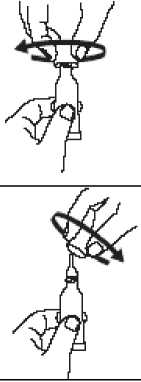
Otevřete dávkovací tubu 2 jednoduchými pohyby:
1. Aplikátor propíchněte otáčením víčka ve směru hodinových ručiček až na doraz.
2. Víčko sejměte otáčením proti směru hodinových ručiček.
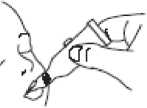
Dávku očkovací látky aplikujte jemným vymačkáváním tekutiny do úst kojence na vnitřní stranu tváře, dokud se dávkovací tuba nevyprázdní. (Ve špičce aplikátoru tuby může zůstat zbytková kapka.)
Prázdnou tubu a víčko vyhoďte do předepsaných nádob na biologický odpad podle místních předpisů.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Sanofi Pasteur MSD SNC 162 avenue Jean Jaures 69007 Lyon Francie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/06/348/001
EU/1/06/348/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 27. června 2006 Datum prodloužení registrace: 27. června 2011
10. DATUM REVIZE TEXTU:
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Název společnosti: Merck Sharp & Dohme Corp.
Adresa: Sumneytown Pike - PO Box 4 - West Point - Pensylvánie 19486
Stát: USA
Telefon: +1 215 652 5603
Název a adresa výrobce odpovědného za propouštění šarží
Název společnosti: Merck Sharp and Dohme B.V.
Adresa: Waarderweg 39, 2031 BN Haarlem, P.O. Box 581, 2003 PC Haarlem
Stát: Nizozemsko
Telefon: +31 23 5153153
Telefax: +31 23 5148000
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
RotaTeq - velikost balení po 1 ks jednodávkové (2ml) tuby RotaTeq - velikost balení po 10 ks jednodávkové (2ml) tuby
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
RotaTeq, perorální roztok Očkovací látka proti rotavirům, živá
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka (2 ml) obsahuje rotavirus typus*:
|
G1 |
> 2,2 x 106 IU1 |
|
G2 |
> 2,8 x 106 IU1 |
|
G3 |
> 2,2 x 106 IU1 |
|
G4 |
> 2,0 x 106 IU1 |
|
P1A[8] |
> 2,3 x 106 IU1 |
* humánní-bovinní rotavirové reasortanty (živé), vyrobené ve Vero buňkách. 1 infekční jednotky
3. SEZNAM POMOCNÝCH LÁTEK
Sacharosa
4. LÉKOVÁ FORMA A OBSAH BALENÍ
2 ml perorálního roztoku v tubě velikost balení po 1 tubě velikost balení po 10 tubách
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
POUZE K PERORÁLNÍMU PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Uchovávejte dávkovači tubu v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Prosím, přečtěte si v příbalové informaci, jak likvidovat léčiva, která již nepotřebujete.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Sanofi Pasteur MSD SNC 162 avenue Jean Jaures 69007 Lyon Francie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/348/001 balení po 1 tubě EU/1/06/348/002 balení po 10 tubách
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
RotaTeq, perorální roztok Očkovací látka proti rotavirům, živá
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Sanofi Pasteur MSD, SNC
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1 dávka
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
RotaTeq
Perorální roztok Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (2 ml)
6. JINÉ
SANOFI PASTEUR MSD, SNC
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
RotaTeq, perorální roztok
Očkovací látka proti rotavirům, živá
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno, protože obsahuje pro Vás důležité informace.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je RotaTeq a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vaše dítě dostane RotaTeq
3. Jak se RotaTeq používá
4. Možné nežádoucí účinky
5. Jak RotaTeq uchovávat
6. Obsah balení a další informace
1. Co je RotaTeq a k čemu se používá
RotaTeq je očkovací látka k perorálnímu podání, která pomáhá chránit kojence a malé děti před gastroenteritidou (průjem a zvracení) vyvolanou rotavirovou infekcí, přičemž se může podávat dětem od 6 do 32 týdnů věku (viz bod 3). Očkovací látka obsahuje pět typů živých rotavirových kmenů. Když kojenec dostane očkovací látku, imunitní systém (přirozená obranyschopnost organismu) začne tvořit protilátky proti nejčastěji se vyskytujícím typům rotavirů. Tyto protilátky pomáhají chránit před gastroenteritidou vyvolanou danými typy rotavirů.
2. Čemu musíte věnovat pozornost, než Vaše dítě dostane RotaTeq
Nepoužívejte RotaTeq:
- jestliže je Vaše dítě alergické na kteroukoli složku této očkovací látky (viz bod 6 Obsah balení a další informace);
- jestliže u Vašeho dítěte došlo po podání dávky přípravku RotaTeq nebo jiné očkovací látky proti rotavirům k rozvoji alergické reakce;
- jestliže Vaše dítě mělo dříve vchlípení střev (neprůchodnost střev, kdy jedna část střeva je vsunuta do jiné části střeva);
- jestliže se Vaše dítě narodilo s malformací gastrointestinálního (zažívacího) systému, který může být náchylný ke vchlípení střev;
- jestliže má Vaše dítě jakékoli onemocnění, které oslabuje jeho odolnost proti infekci.
- jestliže má Vaše dítě závažnou infekci s vysokou teplotou. Může být nutné očkování odložit, dokud se dítě neuzdraví. Lehká infekce, jako je nachlazení, nemusí být problém, ale nejprve sdělte tuto skutečnost lékaři;
- jestliže má Vaše dítě průjem nebo zvrací. Může být nutné očkování odložit, dokud se dítě neuzdraví.
Upozornění a opatření
Před použitím přípravku Rotateq se poraďte se svým lékařem nebo lékárníkem, jestliže Vaše dítě:
- dostalo krevní transfuzi nebo imunoglobuliny v průběhu posledních 6 týdnů.
- má blízký kontakt s osobou, jako je člen domácnosti, s oslabeným imunitním systémem, např. s osobou s rakovinou nebo s osobou užívající léky, které mohou oslabit imunitní systém.
- má jakoukoli poruchu zažívacího systému.
- nepřibývá na hmotnosti a neroste podle očekávání.
Vždy prosím dbejte na to, abyste si po výměně špinavých plen důkladně umyli ruce.
Podobně jako ostatní očkovací látky nemusí přípravek RotaTeq zajistit úplnou ochranu všem očkovaným dětem, i když dostaly všechny tři dávky.
Jestliže Vaše dítě již bylo nakaženo rotavirem, ale ještě není nemocné v době očkování, nemusí přípravek RotaTeq zajistit ochranu před onemocněním.
Přípravek RotaTeq nechrání před průjmem a zvracením z jiných příčin, než z těch vyvolaných rotavirem.
Další léčivé přípravky a přípravek RotaTeq
RotaTeq lze podat ve stejné době, kdy Vaše dítě dostává jiná běžně doporučená očkování, jako jsou očkovací látky proti difterii (záškrtu), tetanu, pertusi (černému kašli), Haemophilu influenzae typu b, inaktivovaná nebo perorální očkovací látka proti poliomyelitidě, očkovací látka proti hepatitidě B, konjugovaná pneumokoková očkovací látka a konjugovaná očkovací látka proti meningokoku skupiny C.
Informujte svého lékaře nebo lékárníka o všech lécích (nebo očkovacích látkách), které Vaše dítě užívá, které v nedávné době užívalo nebokteré možná bude užívat.
Přípravek RotaTeq s jídlem a pitím
Před očkováním ani po očkování přípravkem RotaTeq neexistují žádná omezení z hlediska konzumace jídla nebo tekutin, včetně mateřského mléka.
Přípravek RotaTeq obsahuje sacharózu.
Jestliže Vám bylo sděleno, že Vaše dítě trpí nesnášenlivostí naěkterých cukrů, informujte o tom ještě před podáním očkovací látky svého lékaře/zdravotnického pracovníka.
3. Jak se RotaTeq používá
RotaTeq JE URČEN POUZE K PERORÁLNÍMU PODÁNÍ.
Doporučené dávky přípravku RotaTeq podá Vašemu dítěti lékař nebo zdravotní sestra. Očkovací látka se podá mírným stisknutím tuby a vtlačením očkovací látky do úst dítěte. Očkovací látku lze podávat bez ohledu na konzumaci jídla, tekutin nebo mateřského mléka. V případě, že Vaše dítě většinu dávky očkovací látky vyplivne nebo vyzvrátí, lze podat jednu náhradní dávku na stejné očkovací návštěvě.
Očkovací látka se nesmí za žádných okolností aplikovat injekčně.
První dávku (2 ml) přípravku RotaTeq lze podat ve věku od 6. týdnů a musí být podána ve věku do 12 .týdnů (asi 3 měsíce). RotaTeq může být podáván předčasně narozeným dětem, jejichž gestační věk byl nejméně 25 týdnů. První dávka má být podaná těmto dětem mezi 6. až 12. týdnem života.
Vaše dítě dostane 3 dávky přípravku RotaTeq s odstupem nejméně 4 týdny. K zajištění ochrany před rotavirem je důležité, aby Vaše dítě dostalo všechny 3 dávky očkovací látky. Dává se přednost podání všech tří dávek ve věku do 20-22 týdnů a všechny tři dávky musí být podány nejpozději ve věku do 32 týdnů.
Pokud byla Vašemu dítěti podána první dávka přípravku RotaTeq, doporučuje se, aby Vaše dítě dostalo pro dokončení očkovacího schématu také RotaTeq (a nikoli jinou očkovací látku proti rotavirům).
Jestliže jste se zapomněl(a) dostavit pro dávku přípravku RotaTeq
Je třeba dbát pokynů lékaře/zdravotnického pracovníka ohledně dalších návštěv dítěte pro následné dávky očkovací látky. Jestliže zapomenete nebo se nemůžete k lékaři/zdravotnickému pracovníkovi v dobu určenou pro očkování dostavit, požádejte jej o radu.
4. Možné nežádoucí účinky
Podobně jako všechny očkovací látky, může mít i tato očkovací látka nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Následující nežádoucí účinky byly hlášeny v klinických studiích nebo po uvedení na trh v souvislosti s použitím přípravku RotaTeq:
|
Velmi časté (může se vyskytnout u více než 1 z 10 kojenců) | |
|
Časté (může se vyskytnout až u 1 ze 10 kojenců) |
infekce horních cest dýchacích |
|
Méně časté (může se vyskytnout až u 1 ze 100 kojenců) |
bolest žaludku, rýma a bolest v krku, ušní infekce, vyrážka, krev ve stolici* |
|
Vzácné (může se vyskytnout až u 1 z 1 000 kojenců) |
bronchospasmus (sípání nebo kašel), kopřivka* |
|
Velmi vzácné (může se vyskytnout až u 1 z 10 000 kojenců) |
vchlípení střev (obstrukce střeva, kdy jedna část střeva je vsunuta do jiné části střeva)*^ |
|
Není známo (četnost z dostupných údajů nelze určit) |
alergické reakce, které mohou být závažné (anafylaxe)*, alergický otok, který se může vyskytnout na obličeji, rtech, jazyku nebo hrdle*, podrážděnost* |
* Tento nežádoucí účinek byl hlášen po uvedení přípravku na trh.
^ Příznaky vchlípení střev mohou zahrnovat silné bolesti břicha, úporné zvracení, krev ve stolici, otok břicha a/nebo vysokou horečku.
U velmi předčasně narozených dětí (28. týden těhotenství nebo dříve) se 2 až 3 dny po vakcinaci mohou vyskytovat delší intervaly mezi nádechy, než je obvyklé.
Pokud byste chtěl(a) získat více informací o nežádoucích účincích přípravku RotaTeq, požádejte o ně svého lékaře/zdravotnického pracovníka.
Hlášení nežádoucích účinků
Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak RotaTeq uchovávat
Uchovávejte tuto očkovací látku mimo dohled a dosah dětí.
Nepoužívejte tuto očkovací látku po uplynutí doby použitelnosti uvedené na štítku za písmeny EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C až 8 °C). Uchovávejte dávkovací tubu v krabičce, aby byl přípravek chráněn před světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co RotaTeq obsahuje
Léčivými látkami přípravku RotaTeq je 5 humánních-bovinních reasortovaných kmenů rotaviru: G1 2,2 x 106 infekčních jednotek G2 2,8 x 106 infekčních jednotek G3 2,2 x 106 infekčních jednotek G4 2,0 x 106 infekčních jednotek P1A[8] 2,3 x 106 infekčních jednotek
Pomocnými látkami přípravku RotaTeq jsou: sacharóza, citronan sodný, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný, polysorbát 80, živné půdy (s obsahem anorganických solí, aminokyselin a vitaminů) a čištěná voda.
Jak RotaTeq vypadá a co obsahuje toto balení
Perorální roztok
Tato očkovací látka je obsažena v jednodávkových tubách a jedná se o světle žlutou čirou tekutinu, která může být až narůžovělá.
RotaTeq se dodává ve velikosti balení po 1 a 10 dávkovacích tubách. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci: Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francie
Výrobce odpovědný za propouštění šarží: Merck Sharp and Dohme, B.V., Waarderweg, 39, 2031 BN, Haarlem, Nizozemsko
Belgie/Belgique/Belgien
Sanofi Pasteur MSD, Tél/Tel: +32.2.726.95.84
EtnrapHH
MepK fflapn h floyM Etnrapnn EOOfl Ten.: + 359 2 819 3737 Česká republika
Merck Sharp & Dohme s.r.o., Tel.: +420 233 010 111
Lietuva
UAB Merck Sharp & Dohme, Tel.:
+370.5.2780.247
Luxembourg/Luxemburg
Sanofi Pasteur MSD, Tél: +32.2.726.95.84
Magyarország
MSD Pharma Hungary Kft., Tel.: + 36.1.888.5300
Danmark
Sanofi Pasteur MSD, Tlf: +45 23 32 69 29 Deutschland
Sanofi Pasteur MSD GmbH, Tel: +49 30 4991980
Eesti
Merck Sharp & Dohme OU, Tel: +372.6144 200 EXXáSa
BIANEH A.E., TpA,: +30.210.8009111 Espaňa
Sanofi Pasteur MSD S.A., Tel: +34.91.371.78.00 France
Sanofi Pasteur MSD SNC, Tél: +33.4.37.28.40.00 Hrvatska
Merck Sharp & Dohme d.o.o.
Tel: +385 1 6611 333 Ireland
Sanofi Pasteur MSD Ltd, Tel: +3531.468.5600 Ísland
Sanofi Pasteur MSD, Sími: +32.2.726.95.84 Italia
Sanofi Pasteur MSD Spa, Tel: +39.06.664.092.11 Kúrcpog
Merck Sharp & Dohme Cyprus Limited Tp^: 800 00 673 (+357 22866700)
Latvija
SIA Merck Sharp & Dohme Latvija Tel: +371.67364.224
Malta
Merck Sharp & Dohme Cyprus Limited., Tel: 8007 4433 (+356 99917558)
Nederland
Sanofi Pasteur MSD, Tel: +31.23.567.96.00 Norge
Sanofi Pasteur MSD, Tlf: +47.67.50.50.20 Osterreich
Sanofi Pasteur MSD GmbH, Tel:
+43 1 890 34 91 14 Polska
MSD Polska Sp. z o.o., Tel.: +48.22.549.51.00 Portugal
Sanofi Pasteur MSD, SA, Tel: +351.21.470.45.50 Románia
Merck Sharp & Dohme Romania S.R.L. Tel: +
4021 529 29 00
Slovenija
Merck Sharp & Dohme, inovativna zdravila d.o.o., Tel: +386.1.520.4201 Slovenská republika
Merck Sharp & Dohme, s. r. o., Tel: +421 2
58282010
Suomi/Finland
Sanofi Pasteur MSD, Puh/Tel: +358.9.565.88.30 Sverige
Sanofi Pasteur MSD, Tel: +46.8.564.888.60 United Kingdom
Sanofi Pasteur MSD Ltd, Tel: +44.1.628.785.291
Tato příbalová informace byla naposledy revidována:
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici nawebových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
Následující informace je určena pouze pro zdravotnické pracovníky:
Pokyny
Podávání očkovací látky:
|
if |
Roztržením otevřete ochranný sáček a vyjměte dávkovací tubu. |
|
Podržte dávkovací tubu ve svislé poloze a poklepejte na twist-off víčko, aby se aplikátor vyprázdnil. | |
|
Otevřete dávkovací tubu 2 jednoduchými pohyby: | |
|
1. Aplikátor propíchněte otáčením víčka ve směru hodinových ručiček až na doraz. | |
|
jř |
2. Víčko sejměte otáčením proti směru hodinových ručiček. |
|
ígfl / ^ O |
Dávku očkovací látky aplikujte jemným vymačkáváním tekutiny do úst kojence na vnitřní stranu tváře, dokud se dávkovací tuba nevyprázdní. (Ve špičce aplikátoru tuby může zůstat zbytková kapka.) |
|
Prázdnou tubu a víčko vyhoďte do předepsaných nádob na biologický odpad podle místních předpisů. |
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Viz také bod 3. Jak se RotaTeq používá.
27