Rotarix
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Rotarix, prášek pro perorální suspenzi s rozpouštědlem Živá rotavirová vakcína
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 dávka (1 ml) po rekonstituci obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum* ne méně než 106,0 CCID50
*Pomnožený na Vero buňkách
Pomocné látky se známým účinkem:
Tento léčivý přípravek obsahuje 9 mg sacharosy a 13,5 mg sorbitolu (viz bod 4.4).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro perorální suspenzi s rozpouštědlem.
Prášek je bílý.
Rozpouštědlo je zakalená tekutina s pomalu se usazujícím bílým sedimentem a bezbarvým supernatantem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Rotarix je určen k aktivní imunizaci dětí ve věku 6 až 24 týdnů za účelem prevence gastroenteritidy způsobené rotavirovou infekcí (viz body 4.2, 4.4 a 5.1).
Rotarix se má podávat podle oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Očkovací schéma se skládá ze dvou dávek. První dávka se může podávat od 6 týdnů věku. Interval mezi dávkami by měl být nejméně 4 týdny. Obě dávky očkování by se měly aplikovat pokud možno před dosažením věku 16 týdnů, ale očkovací schéma musí být dokončeno do 24. týdne věku.
Předčasně narozeným dětem, které se narodily alespoň po 27. týdnu gestačního věku, lze Rotarix podat ve stejném dávkování (viz body 4.8 a 5.1).
V klinických zkouškách bylo vzácně pozorováno vyplivnutí nebo regurgitace vakcíny a v takových případech nebyla podána náhradní dávka. Pokud ale dojde k málo pravděpodobnému jevu, že dítě vyplivne nebo vyzvrátí většinu podané dávky vakcíny, je možné podat při stejné návštěvě jednu náhradní dávku.
Doporučuje se, aby děti, které dostaly jako první dávku vakcíny Rotarix, dokončily 2-dávkové schéma vakcínou Rotarix. Nejsou k dispozici žádné údaje o bezpečnosti, imunogenicitě nebo účinnosti
očkování, pokud byl Rotarix podán jako první dávka a jako druhá dávka byla podána jiná rotavirová vakcína či naopak.
Pediatrická populace
Rotarix se nemá podávat dětem ve věku nad 24 týdnů.
Způsob podání
Rotarix je určen pouze k perorálnímu podání.
Rotarix se za žádných okolností nesmí podat injekčně.
Návod k přípravě nebo naředění léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersensitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersensitivita po předchozím podání rotavirových vakcín.
Intususcepce v anamnéze.
Osoby s nekorigovanou vrozenou malformací gastrointestinálního traktu, které by mohly být predisponovány ke vzniku intususcepce.
Subjekty s těžkou kombinovanou imunodeficiencí (SCID) (viz bod 4.8).
Aplikace vakcíny Rotarix musí být odložena u osob trpících akutním vážným horečnatým onemocněním. Přítomnost slabé infekce není kontraindikací imunizace.
Aplikace vakcíny Rotarix musí být odložena u osob trpících průjmem nebo zvracením.
4.4 Zvláštní upozornění a opatření pro použití
Podle správné klinické praxe by se před zahájením očkování měla sestavit anamnéza očkovaného zejména s ohledem na kontraindikace a klinické vyšetření.
Nejsou k dispozici údaje o bezpečnosti a účinnosti vakcíny Rotarix u dětí trpících gastrointestinálními nemocemi nebo poruchou růstu. U takových dětí se má podání vakcíny Rotarix s opatrností zvážit, zvláště pokud, podle názoru lékaře, nepodání vakcíny znamená vyšší riziko.
Jako preventivní opatření by měli zdravotničtí pracovníci sledovat jakékoliv příznaky svědčící pro intususcepci (závažné bolesti břicha, úporné zvracení, krvavé stolice, nadmutí břicha a/nebo vysoká horečka), protože údaje z pozorovacích bezpečnostních studií ukazují zvýšení rizika výskytu intususcepce většinou během 7 dní po očkování rotaviry (viz bod 4.8). Při výskytu těchto příznaků by rodiče/opatrovníci měli být požádáni o okamžité hlášení takových příznaků zdravotnickým pracovníkům.
Pokyny pro jedince s predispozicí vzniku intususcepce jsou v bodě 4.3.
Nepředpokládá se, že by asymptomatické HIV infekce nebo HIV infekce s mírnými příznaky ovlivňovaly bezpečnost a účinnost vakcíny Rotarix. V klinické studii s omezeným počtem kojenců s asymptomatickou HIV infekcí nebo HIV infekcí s mírnými příznaky nebyly žádné zjevné problémy s bezpečností prokázány (viz bod 4.8).
Aplikace vakcíny Rotarix dětem se známým nebo suspektním deficitem imunity musí být založena na pečlivém zvážení potenciálních přínosů a rizik.
Je známo, že po vakcinaci dochází k vylučování viru z vakcíny stolicí, s maximem exkrece okolo 7. dne. Částice virového antigenu detekované testem ELISA byly nalezeny v 50 % stolic odebraných po první dávce a ve 4 % stolic odebraných po druhé dávce. Když byly tyto stolice testovány na přítomnost živého kmene vakcíny, bylo jich pozitivních jen 17 %.
Byly pozorovány případy přenosu takto vyloučeného viru z vakcíny na séronegativní osoby, které byly v kontaktu s očkovanými jedinci, aniž by to vyvolalo nějaké klinické symptomy.
Rotarix by se měl podávat s opatrností u jedinců, kteří přicházejí do úzkého kontaktu s imunodeficitními osobami, jako jsou například osoby s nádorovým onemocněním nebo jinak imunokomprimované osoby nebo jedinci, kteří dostávají imunosupresivní terapii.
Osoby, které jsou v kontaktu s čerstvě očkovanými jedinci, by měly dodržovat osobní hygienu (např. mytí rukou po výměně dětských plen).
Možné riziko apnoe a nutnost monitorování dýchání po dobu 48 - 72 hodin by se měly zvážit, když se podávají dávky základního očkování velmi předčasně narozeným dětem (narozené ve < 28. týdnu těhotenství) a zvláště těm, v jejichž předchozí anamnéze byla respirační nezralost.
Protože prospěch očkování je u této skupiny dětí vysoký, neměla by se vakcinace odmítat ani oddalovat.
Protektivní imunitní odpovědi nemusí být dosaženo u všech očkovaných (viz bod 5.1).
Rozsah ochrany, kterou by Rotarix mohl poskytnout vůči ostatním rotavirovým kmenům, které necirkulovaly v klinických studiích, není v současnosti znám. Klinické studie, z nichž byly získány údaje o účinnosti, byly prováděny v Evropě, ve Střední a v Jižní Americe, Africe a Asii (viz bod 5.1).
Rotarix nechrání proti gastroenteritidě způsobené jinými patogeny, než jsou rotaviry.
Data o použití vakcíny Rotarix k post-expoziční profylaxi nejsou k dispozici.
Rotarix se za žádných okolností nesmí podat injekčně.
Vakcína obsahuje pomocné látky sacharosu a sorbitol. Pacienti, kteří mají vzácné dědičné problémy s fruktózovou intolerancí, s glukózo-galaktózovou malabsorpcí nebo se sacharázo-isomaltázovou insuficiencí by neměli tuto vakcínu dostávat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Rotarix lze podat současně s kteroukoliv z následujících monovalentních nebo kombinovaných vakcín [včetně hexavalentních vakcín (DTPa-HBV-IPV/Hib)]: vakcína proti difterii, tetanu, pertusi (celobuněčná) (DTPw), vakcína proti difterii, tetanu, pertusi (acelulární) (DTPa), vakcína proti Haemophilus influenzae typu b (Hib), inaktivovaná vakcína proti poliomyelitidě (IPV), vakcína proti hepatitidě B (HBV), konjugovaná pneumokoková vakcína a konjugovaná meningokoková vakcína séroskupiny C. Klinické studie prokázaly, že imunitní odpovědi a bezpečnostní profily podaných vakcín nebyly ovlivněny.
Současné podání vakcíny Rotarix a perorální vakcíny proti poliomyelitidě (OPV) neovlivňuje imunitní odpověď na polio antigeny. I když současné podání OPV může lehce snížit imunitní odpověď na rotavirovou vakcínu, v klinické studii zahrnující více než 4 200 osob, kterým byl podán Rotarix současně s OPV vakcínou se ukázalo, že klinická protekce proti vážné rotavirové gastroenteritidě zůstává zachována.
Nejsou žádná omezení týkající se konzumace potravy nebo tekutin, a to před ani po očkování dítěte.
Rotarix není určen k očkování dospělých. Nejsou dostupné údaje o použití vakcíny Rotarix během těhotenství a kojení.
Na základě údajů získaných v klinických studiích nesnižuje kojení ochranu proti rotavirové gastroenteritidě vyvolané vakcínou Rotarix. V době očkování je tedy možné pokračovat v kojení.
4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní.
4.8 Nežádoucí účinky Přehled bezpečnostního profilu
Níže prezentovaný bezpečnostní profil je založen na údajích z klinických studií vedených buď s lyofilizovanou nebo tekutou formou vakcíny Rotarix.
Celkově bylo ve čtyřech klinických studiích podáno přibližně 3 800 dávek vakcíny Rotarix v tekuté formě přibližně 1 900 kojencům. Tyto studie ukázaly, že bezpečnostní profil této tekuté formy je srovnatelný s lyofilizovanou formou.
Celkem bylo ve dvaceti třech klinických studiích podáno přibližně 51 000 kojencům zhruba 106 000 dávek vakcíny Rotarix (lyofilizované nebo tekuté formy).
Ve třech placebem kontrolovaných klinických studiích (Finsko, Indie a Bangladéš), ve kterých byl Rotarix podáván samotný (podání běžných dětských vakcín bylo časově upraveno), nebyl výskyt a závažnost předem určených nežádoucích účinků (údaje získány 8 dní po očkování), průjmu, zvracení, ztráty chuti k jídlu, horečky, podrážděnosti a kašle/výtoku z nosu při srovnání skupiny dostávající Rotarix a skupiny dostávající placebo významně odlišný. Po podání druhé dávky nebylo pozorováno zvýšení výskytu nebo závažnosti těchto nežádoucích účinků.
Ve shromážděných analýzách ze sedmnácti placebem kontrolovaných klinických studií (Evropa, Severní Amerika, Latinská Amerika, Asie, Afrika) včetně klinických studií s vakcínou Rotarix, která byla podávána současně s běžnými dětskými vakcínami (viz bod 4.5) byly následující nežádoucí účinky (údaje získány 31 dní po očkování) zvažovány jako možné v návaznosti na očkování.
Tabulkový výčet nežádoucích účinků
Hlášené nežádoucí účinky jsou uvedeny podle následující četnosti výskytu:
Frekvence jsou definovány jako:
Velmi časté (> 1/10)
Časté (> 1/100, < 1/10)
Méně časté (> 1/1 000, < 1/100)
Vzácné (> 1/10 000, < 1/1 000)
Velmi vzácné (< 1/10 000)
|
Třídy orgánových systémů |
Četnost výskytu |
Nežádoucí účinky |
|
Gastrointestinální poruchy |
časté | |
|
méně časté |
bolest břicha, nadýmání | |
|
velmi vzácné |
intususcepce (viz bod 4.4) | |
|
není známo* |
hematochezie |
|
není známo* |
gastroenteritis s vylučováním viru vakcíny u dětí s těžkým kombinovaným imunodeficitem (SCID) | |
|
Poruchy kůže a podkožní tkáně |
méně časté | |
|
Celkové poruchy a reakce v místě aplikace |
časté | |
|
Respirační, hrudní a mediastinální poruchy |
není známo* |
apnoe u velmi předčasně narozených dětí (narozených ve < 28. týdnu těhotenství) (viz bod 4.4). |
* Jelikož byly tyto nežádoucí účinky hlášeny spontánně, není možné spolehlivě odhadovat jejich četnost.
Popis některých nežádoucích účinků
Intususcepce
Data získaná z pozorovacích bezpečnostních studií provedených v několika zemích naznačují, že rotavirové vakcíny nesou zvýšené riziko vzniku intususcepce většinou během 7 dní po očkování.
V USA a Austrálii bylo pozorováno až 6 dalších případů ze 100 000 kojenců při běžném výskytu
33 až 101 na 100 000 kojenců (mladších než jeden rok věku) za rok. Existují omezené údaje o menším zvýšení rizika po druhé dávce. Zůstává nejasné, zda rotavirové vakcíny ovlivňují celkový výskyt intususcepce na základě delších období sledování (viz bod 4.4).
Další zvláštní skupiny populace
Bezpečnost u předčasně narozených dětí
V klinické studii byl 670 předčasně narozeným dětem v gestačním věku od 27 do 36 týdnů podán Rotarix a 339 bylo podáno placebo. První dávka jim byla podána od šesti týdnů po narození. Závažné nežádoucí účinky byly pozorovány u 5,1 % dětí, které obdržely Rotarix, ve srovnání s 6,8 % dětí, které obdržely placebo. Srovnatelný poměr ostatních nežádoucích účinků byl pozorován u dětí, které obdržely Rotarix a u dětí, které obdržely placebo. Nebyly hlášeny žádné případy intususcepce.
Bezpečnost u dětí s infekcí virem lidské imunodeficience (HIV)
V klinické studii byl 100 dětem s HIV infekcí podán Rotarix nebo placebo. Bezpečnostní profil byl mezi dětmi, které obdržely Rotarix, a dětmi, které obdržely placebo, srovnatelný.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Bylo hlášeno několik případů předávkování. Obecně,v těchto případech profil hlášených nežádoucích účinků byl podobný tomu, který se vyskytoval po podání doporučené dávky vakcíny Rotarix.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: vakcíny proti rotavirovým průjmovým infekcím,
ATC kód: J07BH01
Protektivní účinnost
V klinických zkouškách byla prokázána účinnost proti gastroenteritidě způsobené nejběžnějšími rotavirovými genotypy G1P[8], G2P[4], G3P[8], G4P[8] a G9P[8]. Navíc byla prokázána účinnost proti vzácným rotavirovým genotypům G8P[4] (závažná gastroenteritida) a G12P[6] (jakákoliv gastroenteridita). Tyto kmeny cirkulují po celém světě.
V Evropě, Latinské Americe, Africe a Asii byly provedeny klinické studie, v nichž se hodnotila protektivní účinnost vakcíny Rotarix proti jakékoli a proti závažné rotavirové gastroenteritidě.
Závažnost gastroenteritidy byla definována podle dvou rozdílných kriterií:
- Vesikariho 20 bodové škály, v níž se při hodnocení plného klinického obrazu rotavirové
gastroenteritidy bere v úvahu závažnost a trvání průjmu a zvracení, závažnost horečky a dehydratace stejně jako nutnost léčby nebo
- klinicky definované příznaky vytvořené podle kriterií Světové zdravotnické organizace (WHO).
Klinická protekce (ochrana) byla hodnocena ve skupině subjektů (ATP kohorta pro zjištění účinnosti), která zahrnovala všechny subjekty z ATP kohorty pro zjištění bezpečnosti, kteří byli ochotni zúčastnit se sledování účinnosti po stanovenou dobu.
Protektivní účinnost v Evropě
V klinické studii provedené v Evropě byl hodnocen Rotarix podávaný podle různých evropských schémat (2, 3 měsíce; 2, 4 měsíce; 3, 4 měsíce; 3, 5 měsíců) na 4 000 subjektech.
Protektivní účinnost pozorovaná po dvou dávkách vakcíny Rotarix během prvního a druhého roku života je uvedena v následující tabulce:
|
1. rok života Rotarix N = 2 572 Placebo N = 1 302 |
2. rok života Rotarix N = 2 554 Placebo N = 1 294 | ||||
|
Účinnost vakcíny (%) proti jakékoliv a záva f95% Cl |
žné rotavirové gastroenteritidě 1_ | ||||
|
Genotyp |
Jakákoliv závažnost |
Závažná1 |
Jakákoliv závažnost |
Závažná1' | |
|
G1P[8] |
95,6 [87,9; 98,8] |
96,4 [85,7; 99,6] |
82,7 [67,8; 91,3] |
96,5 [86,2; 99,6] | |
|
G2P[4] |
62,0* [< 0,0; 94,4] |
74,7* [< 0,0; 99,6] |
57,1 [< 0,0; 82,6] |
89,9 [9,4; 99,8] | |
|
G3P[8] |
89,9 [9,5; 99,8] |
100 [44,8; 100] |
79,7 [< 0,0; 98,1] |
83,1* [< 0,0; 99,7] | |
|
G4P[8] |
88,3 [57,5; 97,9] |
100 [64,9; 100] |
69,6* [< 0,0; 95,3] |
87,3 [< 0,0; 99,7] | |
|
G9P[8] |
75,6 [51,1; 88,5] |
94,7 [77,9; 99,4] |
70,5 [50,7; 82,8] |
76,8 [50,8; 89,7] | |
|
Kmeny s genotypem P[8] |
88,2 [80,8; 93,0] |
96,5 [90,6; 99,1] |
75,7 [65,0; 83,4] |
87,5 [77,8; 93,4] | |
|
Cirkulující rotavirové |
87,1 [79,6; 92,1] |
95,8 [89,6; 98,7] |
71,9 [61,2; 79,8] |
85,6 [75,8; 91,9] | |
|
kmeny | | ||
|
Účinnost vakcíny (%) proti rotavirové gastroenteritidě vyžadující lékařskou péči [95% CI1 | ||
|
Cirkulující |
91,8 |
76,2 |
|
rotavirové kmeny |
[84; 96,3] |
[63,0; 85,0] |
|
Účinnost vakcíny (%) proti rotavirové gastroenteritidě vyžadující hospitalizaci [95% CI1 | ||
|
Cirkulující |
100 |
92,2 |
|
rotavirové kmeny |
[81,8; 100] |
[65,6; 99,1] |
f Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
Účinnost vakcíny se během prvního roku života progresivně zvyšovala se zvyšující se závažností onemocnění až dosáhla 100 % (95% CI: 84,7; 100) při Vesikariho skóre > 17.
Protektivní účinnost v Latinské Americe
Klinická studie provedená v Latinské Americe hodnotila Rotarix na více než 20 000 subjektech. Závažnost gastroenteritidy (GE) byla definována podle kritérií WHO. Protektivní účinnost vakcíny proti závažné rotavirové (RV) gastroenteritidě vyžadující hospitalizaci a/nebo rehydratační terapii v lékařském zařízení a genotypově specifická účinnost vakcíny po dvou dávkách vakcíny Rotarix jsou uvedeny v následující tabulce:
|
Genotyp |
Závažná rotavirová gastroenteritidaf (první rok života) Rotarix N = 9 009 Placebo N = 8 858 |
Závažná rotavirová gastroenteritidaf (druhý rok života) Rotarix N = 7 175 Placebo N = 7 062 |
|
Účinnost (%) |
Účinnost (%) | |
|
[95% CH |
[95% CH | |
|
Všechny RVGE |
84,7 |
79,0 |
|
[71,7; 92,4] |
[66,4; 87,4] | |
|
G1P[8] |
91,8 |
72,4 |
|
[74,1; 98,4] |
[34,5; 89,9] | |
|
G3P[8] |
87,7 |
71,9* |
|
[8,3; 99,7] |
[< 0,0; 97,1] | |
|
G4P[8] |
50,8#* |
63,1 |
|
[< 0,0; 99,2] |
[0,7; 88,2] | |
|
G9P[8] |
90,6 |
87,7 |
|
[61,7; 98,9] |
[72,9; 95,3] | |
|
Kmeny |
90,9 |
79,5 |
|
s genotypem P[8] |
[79,2; 96,8] |
[67,0; 87,9] |
f Závažná rotavirová gastroenteritida byla definována jako epizoda průjmu s nebo bez zvracení, které vyžadovaly hospitalizaci a/nebo rehydratační léčbu v léčebném zařízení (kriterium WHO).
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
# Počty případů, na kterých byly založeny odhady účinnosti proti G4P[8], byly velmi malé (1 případ ve skupině vakcíny Rotarix a 2 případy ve skupině placeba).
Společná analýza výsledků z pěti studií účinnosti* ukázala 71,4 % (95% CI: 20,1; 91,1) účinnost proti závažné rotavirové gastroenteritidě (Vesikariho skóre > 11) způsobené rotavirem genotypu G2P[4] během prvního roku života.
* V těchto studiích byly body odhadu a intervaly spolehlivosti následující: 100 % (95% CI: -1 858,0; 100), 100 % (95% CI: 21,1; 100) a 45,4 % (95% CI: -81,5; 86,6), 74,7 % (95% CI: -386,2; 99,6). Pro zbývající studii nebyl dostupný žádný bod odhadu.
Protektivní účinnost v Africe
Klinická studie provedená v Africe (Rotarix: N = 2 974; placebo: N = 1 443) hodnotila Rotarix, který byl podán dětem přibližně ve věku 10 a 14 týdnů (2 dávky), nebo ve věku 6, 10 a 14 týdnů (3 dávky). Účinnost vakcíny byla proti závažné rotavirové gastroenteritidě v průběhu prvního roku života 61,2 % (95% CI: 44,0; 73,2). Protektivní účinek vakcíny (souhrné dávky) pozorovaný proti jakýmkoliv a závažným rotavirovým gastroenteritidám je uveden v následující tabulce:
|
Genotyp |
Jakákoliv rotavirová |
Závažná rotavirová |
|
gastroenteritida |
gastroenteritida^ | |
|
Rotarix N = 2 974 |
Rotarix N = 2 974 | |
|
placebo N = 1 443 |
placebo N = 1 443 | |
|
Účinnost (%) |
Účinnost (%) | |
|
[95% CI] |
[95% CH | |
|
G1P[8] |
68,3 |
56,6 |
|
[53,6; 78,51 |
[11,8; 78,81 | |
|
G2P[4] |
49,3 |
83,8 |
|
[4,6; 73,01 |
[9,6; 98,41 | |
|
G3P[8] |
43,4* |
51,5* |
|
[< 0; 83,71 |
[< 0; 96,51 | |
|
G8P[4] |
38,7* |
63,6 |
|
[< 0; 67,81 |
[5,9; 86,51 | |
|
G9P[8] |
41,8* |
56,9* |
|
[< 0; 72,31 |
[< 0; 85,51 | |
|
G12P[6] |
48,0 |
55,5* |
|
[9,7; 70,01 |
[< 0; 82,21 | |
|
Kmeny |
39,3 |
70,9 |
|
s genotypem P[4] |
[7,7; 59,91 |
[37,5; 87,01 |
|
Kmeny |
46,6 |
55,2* |
|
s genotypem P[6] |
[9,4; 68,41 |
[< 0; 81,31 |
|
Kmeny |
61,0 |
59,1 |
|
s genotypem P[8] |
[47,3; 71,21 |
[32,8; 75,31 |
! Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice * Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
Trvalá účinnost až do 3 let věku v Asii
Klinická studie provedená v Asii (Hongkong, Singapur a Thajsko) (Celková skupina očkovaných: Rotarix: N = 5 359; placebo: N = 5 349) hodnotila Rotarix, který byl podán odlišnými schématy (ve věku 2, 4 měsíce; ve věku 3, 4 měsíce).
V průběhu prvního roku bylo v období od 2 týdnů po druhé dávce až do věku jednoho roku ve skupině očkované vakcínou Rotarix významně méně subjektů s hlášenou závažnou rotavirovou gastroenteritidou způsobenou cirkulujícím divokým kmenem RV ve srovnání se skupinou očkovanou placebem (0,0 % proti 0,3 %) se 100,0 % (95% Cl: 72,2; 100) účinností vakcíny.
Protektivní účinnost po dvou dávkách vakcíny Rotarix proti závažné rotavirové gastroenteritidě sledované až do dvou let věku je uvedena v následující tabulce:

Účinnost vakcíny (%) proti závažným rotavirovým gastroenteritidám (95% CI)
|
Genotyp |
Závažnostf |
|
G1P[8] |
100,0 (80,8; 100,0) |
|
G2P[4] |
100,0* (< 0; 100,0) |
|
G3P[8] |
94,5 (64,9; 99,9) |
|
G9P[8] |
91,7 (43,8; 99,8) |
|
Kmeny s genotypem P[8] |
95,8 (83,8; 99,5) |
|
Cirkulující rotavirové kmeny |
96,1 (85,1; 99,5) |
|
Účinnost vakcíny (%) proti rotavirovým gastroenteritidám vyžadujícím hospitalizaci a/nebo rehydratační léčbu ve zdravotnickém zařízení [95% CI] | |
|
Cirkulující rotavirové kmeny |
94,2 (82,2; 98,8) |
f Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice * Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
V průběhu třetího roku života nebyly ve skupině léčené vakcínou Rotarix (N = 4 222) případy závažné RV gastroenteritidy proti 13 (0,3 %) ve skupině s placebem (N = 4 185). Účinnost vakcíny byla 100,0% (95% CI: 67,5; 100,0). Případy těžké RV gastroenteritidy byly způsobeny RV kmeny G1P [8], G2P [4], G3P [8] a G9P [8]. Výskyt závažných RV gastroenteritid spojených s jednotlivými genotypy byl příliš malý pro výpočet samotné účinnosti. Účinnost vakcíny proti závažným RV gastroenteritidám vyžadujícím hospitalizaci byla 100 % [95% CI: 72,4; 100,0].
Imunitní odpověď
Imunologický mechanismus, kterým Rotarix chrání proti rotavirové gastroenteritidě není zcela znám. Závislost mezi protilátkovou odpovědí na očkování proti rotaviru a ochranou proti rotavirové gastroenteritidě nebyla stanovena.
V následující tabulce je ukázáno množství subjektů původně séronegativních na rotaviry (titry IgA protilátky < 20 U/ml) (podle ELISA) v procentech s titry sérových anti-rotavirových IgA protilátek > 20 U/ml pozorovanými v různých studiích jeden až dva měsíce po druhé dávce vakcíny nebo placeba.
|
Očkovací schéma |
Země studie |
Vakcína |
Placebo | ||
|
N |
% > 20U/ml [95% CI1 |
N |
% > 20U/ml [95% CI1 | ||
|
2, 3 měsíce |
Francie, Německo |
239 |
82,8 [77,5; 87,41 |
127 |
8,7 [4,4; 15,01 |
|
2, 4 měsíce |
Španělsko |
186 |
85,5 [79,6; 90,21 |
89 |
12,4 [6,3; 21,01 |
|
3, 5 měsíce |
Finsko, Itálie |
180 |
94,4 [90,0; 97,31 |
114 |
3,5 [1,0; 8,71 |
|
3, 4 měsíce |
Česká republika |
182 |
84,6 [78,5; 89,51 |
90 |
2,2 [0,3; 7,81 |
|
2, 3 až 4 měsíce |
Latinská Amerika; 11 zemí |
393 |
77,9 % [73,8; 81,61 |
341 |
15,1 % [11,7; 19,01 |
|
10, 14 týdnů a 6, 10, 14 týdnů (souhrnně) |
Severní Afrika, Malawi |
221 |
58,4 [51,6; 64,91 |
111 |
22,5 [15,1; 31,41 |
Imunitní odpověď u předčasně narozených dětí
Imunogenicita vakcíny Rotarix byla v klinické studii s předčasně narozenými dětmi, které se narodily alespoň po 27. týdnu gestačního věku, stanovena u podskupiny 147 subjektů a bylo prokázáno, že Rotarix je v této populaci imunogenní: 1 měsíc po podání druhé dávky vakcíny dosáhlo titrů sérových anti-rotavirových IgA protilátek > 20 U/ml (podle ELISA) 85,7 % subjektů (95% CI:79,0; 90,9).
Účinnost po 2 dávkách v prevenci RVGE vedoucí k hospitalizaci
|
Země období (věk) |
Kmeny věkové rozpětí |
N $ (případy/kontroly) |
Účinnost % [95% CI] |
Délka sledování |
|
studie sponzorované společností GSK | ||||
|
Belgie 2008 - 2010 < 4 roky |
všechny 3 - 11 m > 12 m |
160/198 |
90 [81; 95] 91 [75; 97] 90 [76; 96) |
2,4 let |
|
G1P[8] |
41/53 |
95 [78; 99] | ||
|
G2P[4] 3 - 11 m > 12m |
80/103 |
85 [64; 94] 83 [11; 96] J 86 [58; 95] J | ||
|
Brazílie (Belém) 2008 - 2009 < 3 roky |
všechny 3 - 11 m > 12 m |
249/249 £ |
76 [58; 86] 96 [68; 99] 65 [37; 81) |
1 rok |
|
G2P[4] 3 - 11 m > 12 m |
222/222 £ |
75 [57; 86] 95 [66; 99] J 64 [34; 81] J | ||
|
Brazílie (Recife) 2006 - 2008 < 5 let |
všechny 6 - 11 m > 12 m |
NA § |
NA 81 [47; 93] 5 [< 0; 69] * |
2,5 let |
|
G2P[4] 6 - 11 m > 12 m |
61/424 § |
NA 85 [54; 95] 5 [< 0; 69]* | ||
|
všechny 6 - 11 m > 12 m |
NA f |
NA 80 [48; 92] 41 [< 0; 81] * | ||
|
G2P[4] 6 - 11 m > 12 m |
61/371 f |
NA 83 [51; 94] 41 [< 0; 81] * | ||
|
Singapur 2008 - 2010 < 5 let |
všechny |
136/272 |
84 [32; 96] |
2 roky |
|
G1P[8] |
89/89 |
91 [30; 99] | ||
|
Ostatní studie | ||||
|
Salvádor 2007 - 2009 < 2 roky |
všechny 6 - 11 m > 12 m |
251/770 £ |
76 [64; 84] ** 83 [68; 91] 59 [27; 77] |
2,5 let |
m: měsíce
NA: není k dispozici
$ Počet plně očkovaných (2 dávky) a neočkovaných případů a kontrol.
£ Účinnost vakcíny byla vypočtena využitím sousedů jako kontrol.
§ Účinnost vakcíny byla vypočtena využitím hospitalizovaných rotavirus- negativních kontrol. f Účinnost vakcíny byla vypočtena využitím hospitalizovaných kontrol s akutní infekcí respiračního traktu.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
**U jedinců, kteří neobdrželi celé očkovací schéma, byla účinnost po jedné dávce 51 % (95% CI:
26 ;67).
J Data z post-hoc analýz.
Dopad na úmrtnost'''
Dopadové studie (Impact studies) s vakcínou Rotarix provedené v Panamě, Brazílii a Mexiku ukázaly, že v průběhu 2 až 3 let po zahájení očkování poklesla úmrtnost na průjem z jakékoli příčiny u dětí mladších 5 let věku v rozsahu od 22 % do 56 %.
Dopad na hospitalizaci
V retrospektivní studii databáze v Belgii provedené u dětí ve věku 5 let a mladších byl dva roky po zahájení očkování přímý i nepřímý dopad očkování vakcínou Rotarix na hospitalizaci spojenou s rotavirem v rozsahu od 64 % (95% CI: 49; 76) do 80 % (95% CI: 77; 83). Podobné studie ukázaly snížení o 59 % v Brazílii, o 75 % v Austrálii a o 81 % v Salvádoru. Navíc tři dopadové studie provedené v Latinské Americe ukázaly, že dva roky po zahájení očkování se snížil výskyt případů průjmů z jakékoliv příčiny spojených s hospitalizací o 29 % až 37 %.
§POZNÁMKA: dopadové studie mají zjistit časovou souvislost, ale ne příčinnou souvislost mezi onemocněním a očkováním. Přirozená fluktuace výskytu onemocnění může rovněž ovlivnit pozorovaný časový efekt.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek
Sacharosa
Dextran
Sorbitol
Aminokyseliny
Živná půda (DMEM)
Rozpouštědlo Uhličitan vápenatý Xanthanová klovatina Sterilisovaná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Po rekonstituci:
Po rekonstituci se vakcína musí okamžitě aplikovat. Pokud není vakcína použita okamžitě, neměla by být připravená vakcína uchovávána při teplotě 2 - 25 °C po dobu delší než 24 hodin.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny viz bod 6.3.
6.5 Druh obalu a obsah balení
1 dávka prášku ve skleněném obalu (sklo typu I) se zátkou (butylpryž).
1 ml rozpouštědla v perorálním aplikátoru (sklo typu I) s pístovou zátkou a ochranným uzávěrem (butylpryž).
Převodní adaptér na rekonstituci (1 na dávku) v následujících velikostech balení:
• balení obsahující 1 skleněný obal s práškem a 1 perorální aplikátor s rozpouštědlem;
• balení obsahující 5 skleněných obalů s práškem a 5 perorálních aplikátorů s rozpouštědlem;
• balení obsahující 10 skleněných obalů s práškem a 10 perorálních aplikátorů s rozpouštědlem;
• balení obsahující 25 skleněných obalů s práškem a 25 perorálních aplikátorů s rozpouštědlem.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Před rekonstituci:
V perorálním aplikátoru obsahujícím rozpouštědlo lze při uchovávání pozorovat bílý sediment a čirý supernatant.
Před rekonstitucí by mělo být rozpouštědlo vizuálně zkontrolováno, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled.
Po rekonstituci:
Rekonstituovaná vakcína je trochu více zakalená než rozpouštědlo a má mléčně bílý vzhled.
Také rekonstituovaná vakcína by měla být před aplikací vizuálně zkontrolována, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled. Pokud jsou pozorovány cizorodé částice nebo změna vzhledu, je třeba vakcínu vyřadit.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod na rekonstituci a aplikaci vakcíny:
8. Natáhněte veškerou směs zpět do perorálního aplikátoru.
9. Odstraňte perorální aplikátor od převodního adaptéru.
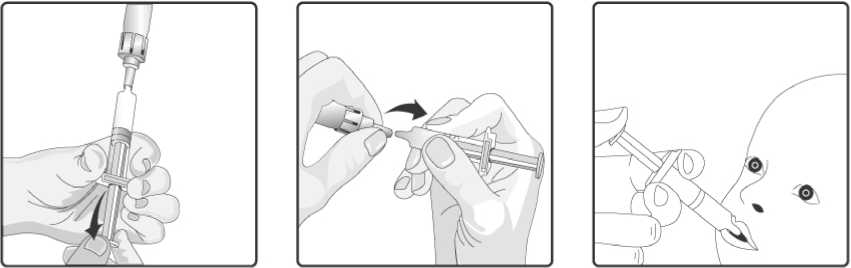
4. Odstraňte ochranný uzávěr z perorálního aplikátoru.
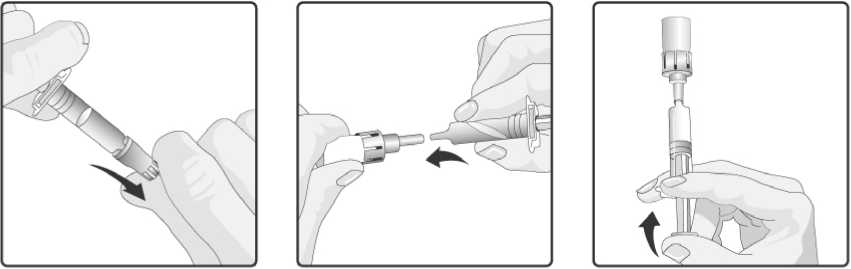
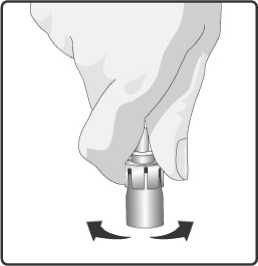
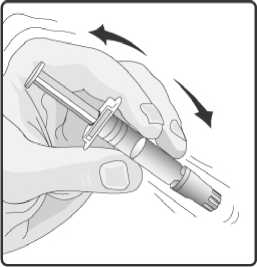
7. Skleněný obal se stále připojeným perorálním aplikátorem protřepejte a kontrolujte, zda se prášek úplně rozpustil. Rekonstituovaná vakcína bude vypadat o trochu více zakalená než samotné rozpouštědlo. Tento vzhled je normální.
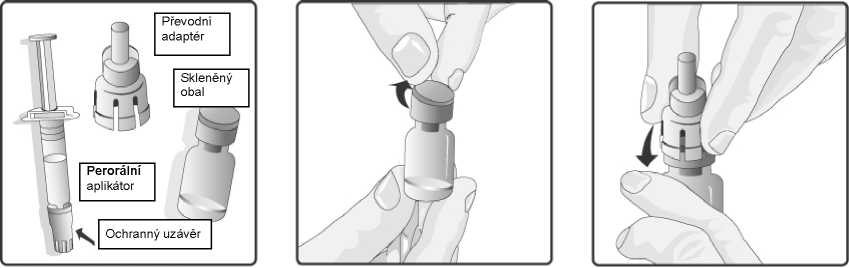
1. Odstraňte plastový kryt ze skleněného obalu obsahujícího prášek.
2. Nasaďte převodní adaptér na skleněný obal a tlačte ho směrem dolů, dokud není převodní adaptér správně a bezpečně připojen.
3. Perorální aplikátor obsahující rozpouštědlo řádně protřepejte. Protřepaná suspenze se bude jevit jako zakalená tekutina s pomalu se oddělujícím bílým sedimentem.
5. Nasaďte perorální aplikátor na převodní adaptér a silně jej do něho zatlačte.
6. Přeneste plný obsah perorálního
aplikátoru do skleněného kontejneru obsahujícího prášek.
10. Tato vakcína je určena pouze k perorálnímu podání. Dítě by se mělo usadit do zakloněné polohy. Aplikujte plný obsah perorálního aplikátoru perorálně (podáním plného obsahu perorálního aplikátoru na vnitřní stranu tváře).
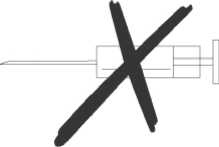
11. Nepodávejte injekčně.
Pokud se má rekonstituovaná vakcína před podáním dočasně uchovávat, nasaďte znovu na perorální aplikátor ochranný uzávěr. Perorální aplikátor obsahující rekonstituovanou vakcínu se má před perorálním podáním znovu lehce protřepat. Nepodávejte injekčně.
7. DRŽITEL ROZHODNUTI O REGISTRACI
GlaxoSmithKline Biologicals s.a.
Rue de l'Institut 89 B-1330 Rixensart, Belgie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/330/001
EU/1/05/330/002
EU/1/05/330/003
EU/1/05/330/004
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. února 2006
Datum posledního prodloužení registrace: 24. leden 2011
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
Rotarix perorální suspenze v předplněném perorálním aplikátoru Živá rotavirová vakcína
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 dávka (1,5 ml) obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum* ne méně než 106,0 CCID50
*Pomnožený na Vero buňkách Pomocná látka se známým účinkem:
Tento léčivý přípravek obsahuje 1 073 mg sacharózy (viz bod 4.4).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Perorální suspenze v předplněném perorálním aplikátoru. Rotarix je čirá bezbarvá tekutina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Rotarix je určen k aktivní imunizaci dětí ve věku 6 až 24 týdnů za účelem prevence gastroenteritidy způsobené rotavirovou infekcí (viz body 4.2, 4.4 a 5.1).
Rotarix se má podávat podle oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Očkovací schéma se skládá ze dvou dávek. První dávka se může podávat od 6 týdnů věku. Interval mezi dávkami by měl být nejméně 4 týdny. Obě dávky očkování by se měly aplikovat pokud možno před dosažením věku 16 týdnů, ale očkovací schéma musí být dokončeno do 24. týdne věku.
Předčasně narozeným dětem, které se narodily alespoň po 27. týdnu gestačního věku, lze Rotarix podat ve stejném dávkování (viz body 4.8 a 5.1).
V klinických zkouškách bylo vzácně pozorováno vyplivnutí nebo regurgitace vakcíny a v takových případech nebyla podána náhradní dávka. Pokud ale dojde k málo pravděpodobnému jevu, že dítě vyplivne nebo vyzvrátí většinu podané dávky vakcíny, je možné podat při stejné návštěvě jednu náhradní dávku.
Doporučuje se, aby děti, které dostaly jako první dávku vakcíny Rotarix, dokončily 2-dávkové schéma vakcínou Rotarix. Nejsou k dispozici žádné údaje o bezpečnosti, imunogenicitě nebo účinnosti očkování, pokud byl Rotarix podán jako první dávka a jako druhá dávka byla podána jiná rotavirová vakcína či naopak.
Pediatrická populace
Rotarix se nemá podávat dětem ve věku nad 24 týdnů.
Způsob podání
Rotarix je určen pouze k perorálnímu podání.
Rotarix se za žádných okolností nesmí podat injekčně.
Návod k přípravě nebo naředění léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersensitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersensitivita po předchozím podání rotavirových vakcín.
Intususcepce v anamnéze.
Osoby s nekorigovanou vrozenou malformací gastrointestinálního traktu, které by mohly být predisponovány ke vzniku intususcepce.
Subjekty s těžkou kombinovanou imunodeficiencí (SCID) (viz bod 4.8).
Aplikace vakcíny Rotarix musí být odložena u osob trpících akutním vážným horečnatým onemocněním. Přítomnost slabé infekce není kontraindikací imunizace.
Aplikace vakcíny Rotarix musí být odložena u osob trpících průjmem nebo zvracením.
4.4 Zvláštní upozornění a opatření pro použití
Podle správné klinické praxe by se před zahájením očkování měla sestavit anamnéza očkovaného zejména s ohledem na kontraindikace a klinické vyšetření.
Nejsou k dispozici údaje o bezpečnosti a účinnosti vakcíny Rotarix u dětí trpících gastrointestinálními nemocemi nebo poruchou růstu. U takových dětí se má podání vakcíny Rotarix s opatrností zvážit zvláště pokud, podle názoru lékaře, nepodání vakcíny znamená vyšší riziko.
Jako preventivní opatření by měli zdravotničtí pracovníci sledovat jakékoliv příznaky svědčící pro intususcepci (závažné bolesti břicha, úporné zvracení, krvavé stolice, nadmutí břicha a/nebo vysoká horečka), protože údaje z pozorovacích bezpečnostních studií ukazují zvýšení rizika výskytu intususcepce většinou během 7 dní po očkování rotaviry (viz bod 4.8). Při výskytu těchto příznaků by rodiče/opatrovníci měli být požádáni o okamžité hlášení takových příznaků zdravotnickým pracovníkům.
Pokyny pro jedince s predispozicí vzniku intususcepce jsou v bodě 4.3.
Nepředpokládá se, že by asymptomatické HIV infekce nebo HIV infekce s mírnými příznaky ovlivňovaly bezpečnost a účinnost vakcíny Rotarix. V klinické studii s omezeným počtem kojenců s asymptomatickou HIV infekcí nebo HIV infekcí s mírnými příznaky nebyly žádné zjevné problémy s bezpečností prokázány (viz bod 4.8).
Aplikace vakcíny Rotarix dětem se známým nebo suspektním deficitem imunity musí být založena na pečlivém zvážení potenciálních přínosů a rizik.
Je známo, že po vakcinaci dochází k vylučování viru z vakcíny stolicí, s maximem exkrece okolo 7. dne. Částice virového antigenu detekované testem ELISA byly nalezeny v 50 % stolic odebraných po první dávce lyofilizované formy vakcíny Rotarix a ve 4 % stolic odebraných po druhé dávce. Když byly tyto stolice testovány na přítomnost živého kmene vakcíny, bylo jich pozitivních jen 17 %. Ve dvou kontrolovaných komparativních studiích bylo po očkování tekutou formou vakcíny Rotarix vylučování viru vakcíny srovnatelné s vylučováním pozorovaným po očkování lyofilizovanou formou vakcíny Rotarix.
Byly pozorovány případy přenosu takto vyloučeného viru z vakcíny na séronegativní osoby, které byly v kontaktu s očkovanými jedinci, aniž by to vyvolalo nějaké klinické symptomy.
Rotarix by se měl podávat s opatrností u jedinců, kteří přicházejí do úzkého kontaktu s imunodeficitními osobami, jako jsou například osoby s nádorovým onemocněním nebo jinak imunokomprimované osoby nebo jedinci, kteří dostávají imunosupresivní terapii.
Osoby, které jsou v kontaktu s čerstvě očkovanými jedinci, by měly dodržovat osobní hygienu (např. mytí rukou po výměně dětských plen).
Možné riziko apnoe a nutnost monitorování dýchání po dobu 48 - 72 hodin by se měly zvážit, když se podávají dávky základního očkování velmi předčasně narozeným dětem (narozené ve < 28. týdnu těhotenství) a zvláště těm, v jejichž předchozí anamnéze byla respirační nezralost.
Protože prospěch očkování je u této skupiny dětí vysoký, neměla by se vakcinace odmítat ani oddalovat.
Protektivní imunitní odpovědi nemusí být dosaženo u všech očkovaných (viz bod 5.1).
Rozsah ochrany, kterou by Rotarix mohl poskytnout vůči ostatním rotavirovým kmenům, které necirkulovaly v klinických studiích, není v současnosti znám. Klinické studie, z nichž byly získány údaje o účinnosti, byly prováděny v Evropě, ve Střední a v Jižní Americe, Africe a Asii (viz bod 5.1).
Rotarix nechrání proti gastroenteritidě způsobené jinými patogeny než jsou rotaviry.
Data o použití vakcíny Rotarix k post-expoziční profylaxi nejsou k dispozici.
Rotarix se za žádných okolností nesmí podat injekčně.
Vakcína obsahuje jako pomocnou látku sacharózu. Pacienti, kteří mají vzácné dědičné problémy s fruktózovou intolerancí, s glukózo-galaktózovou malabsorpcí nebo se sacharázo-isomaltázovou insuficiencí by neměli tuto vakcínu dostávat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Rotarix lze podat současně s kteroukoliv z následujících monovalentních nebo kombinovaných vakcín [včetně hexavalentních vakcín (DTPa-HBV-IPV/Hib)]: vakcína proti difterii, tetanu, pertusi (celobuněčná) (DTPw), vakcína proti difterii, tetanu, pertusi (acelulární) (DTPa), vakcína proti Haemophilus influenzae typu b (Hib), inaktivovaná vakcína proti poliomyelitidě (IPV), vakcína proti hepatitidě B (HBV), konjugovaná pneumokoková vakcína a konjugovaná meningokoková vakcína séroskupiny C. Klinické studie prokázaly, že imunitní odpovědi a bezpečnostní profily podaných vakcín nebyly ovlivněny.
Současné podání vakcíny Rotarix a perorální vakcíny proti poliomyelitidě (OPV) neovlivňuje imunitní odpověď na polio antigeny. I když současné podání OPV může lehce snížit imunitní odpověď na rotavirovou vakcínu, v klinické studii zahrnující více než 4 200 osob, kterým byl podán Rotarix současně s OPV vakcínou se ukázalo, že klinická protekce proti vážné rotavirové gastroenteritidě zůstává zachována.
Nejsou žádná omezení týkající se konzumace potravy nebo tekutin, a to před ani po očkování dítěte.
4.6 Fertilita, těhotenství a kojení
Rotarix není určen k očkování dospělých. Nejsou dostupné údaje o použití vakcíny Rotarix během těhotenství a kojení.
Na základě údajů získaných v klinických studiích nesnižuje kojení ochranu proti rotavirové gastroenteritidě vyvolané vakcínou Rotarix. V době očkování je tedy možné pokračovat v kojení.
4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní.
4.8 Nežádoucí účinky Přehled bezpečnostního profilu
Níže prezentovaný bezpečnostní profil je založen na údajích z klinických studií vedených buď s lyofilizovanou nebo tekutou formou vakcíny Rotarix.
Celkově bylo ve čtyřech klinických studiích podáno přibližně 3 800 dávek vakcíny Rotarix v tekuté formě přibližně 1 900 kojencům. Tyto studie ukázaly, že bezpečnostní profil této tekuté formy je srovnatelný s lyofilizovanou formou.
Celkem bylo ve dvaceti třech klinických studiích podáno přibližně 51 000 kojencům zhruba 106 000 dávek vakcíny Rotarix (lyofilizované nebo tekuté formy).
Ve třech placebem kontrolovaných klinických studiích (Finsko, Indie a Bangladéš), ve kterých byl Rotarix podáván samotný (podání běžných dětských vakcín bylo časově upraveno) nebyl výskyt a závažnost předem určených nežádoucích účinků (údaje získany 8 dní po očkování), průjmu, zvracení, ztráty chuti k jídlu, horečky, podrážděnosti a kašle/výtoku z nosu při srovnání skupiny dostávající Rotarix a skupiny dostávající placebo významně odlišný. Po podání druhé dávky nebylo pozorováno zvýšení výskytu nebo závažnosti těchto nežádoucích účinků.
Ve shromážděných analýzách ze sedmnácti placebem kontrolovaných klinických studií (Evropa, Severní Amerika, Latinská Amerika, Asie, Afrika) včetně klinických studií s vakcínou Rotarix, která byla podávána současně s běžnými dětskými vakcínami (viz bod 4.5) byly následující nežádoucí účinky (údaje získány 31 dní po očkování) zvažovány jako možné v návaznosti na očkování.
Tabulkový výčet nežádoucích účinků
Hlášené nežádoucí účinky jsou uvedeny podle následující četnosti výskytu:
Frekvence jsou definovány jako:
Velmi časté (> 1/10)
Časté (> 1/100, < 1/10)
Méně časté (> 1/1 000, < 1/100)
Vzácné (> 1/10 000, < 1/1 000)
Velmi vzácné (< 1/10 000)
|
Třídy orgánových systémů |
Četnost výskytu |
Nežádoucí účinky |
|
Gastrointestinální poruchy |
časté | |
|
méně časté |
bolest břicha, nadýmání | |
|
velmi vzácné |
intususcepce (viz bod 4.4) | |
|
není známo* |
hematochezie | |
|
není známo* |
gastroenteritis s vylučováním viru vakcíny u dětí s těžkým kombinovaným imunodeficitem(SCID) | |
|
Poruchy kůže a podkožní tkáně |
méně časté | |
|
Celkové poruchy a reakce v místě aplikace |
časté | |
|
Respirační, hrudní a mediastinální poruchy |
není známo* |
apnoe u velmi předčasně narozených dětí (narozených ve < 28. týdnu těhotenství) (viz bod 4.4). |
* Jelikož byly tyto nežádoucí účinky hlášeny spontánně, není možné spolehlivě odhadovat jejich četnost.
Popis některých nežádoucích účinků
Intususcepce
Data získaná z pozorovacích bezpečnostních studií provedených v několika zemích naznačují, že rotavirové vakcíny nesou zvýšené riziko vzniku intususcepce většinou během 7 dní po očkování.
V USA a Austrálii bylo pozorováno až 6 dalších případů ze 100 000 kojenců při běžném výskytu
33 až 101 na 100 000 kojenců (mladších než jeden rok věku) za rok. Existují omezené údaje o menším zvýšení rizika po druhé dávce. Zůstává nejasné, zda rotavirové vakcíny ovlivňují celkový výskyt intususcepce na základě delších období sledování (viz bod 4.4).
Další zvláštní skupiny populace
Bezpečnost u předčasně narozených dětí
V klinické studii byl 670 předčasně narozeným dětem v gestačním věku od 27 do 36 týdnů podán Rotarix a 339 bylo podáno placebo. První dávka jim byla podána od šesti týdnů po narození. Závažné nežádoucí účinky byly pozorovány u 5,1 % dětí, které obdržely Rotarix, ve srovnání s 6,8 % dětí, které obdržely placebo. Srovnatelný poměr ostatních nežádoucích účinků byl pozorován u dětí, které obdržely Rotarix a u dětí, které obdržely placebo. Nebyly hlášeny žádné případy intususcepce.
Bezpečnost u dětí s infekcí virem lidské imunodeficience (HIV)
V klinické studii byl 100 dětem s HIV infekcí podán Rotarix nebo placebo. Bezpečnostní profil byl mezi dětmi, které obdržely Rotarix, a dětmi, které obdržely placebo, srovnatelný.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích
4.9 Předávkování
Bylo hlášeno několik případů předávkování. Obecně,v těchto případech profil hlášených nežádoucích účinků byl podobný tomu, který se vyskytoval po podání doporučené dávky vakcíny Rotarix.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny proti rotavirovým průjmovým infekcím, ATC kód: J07BH01
Protektivní účinnost lyofilizované formy vakcíny Rotarix
V klinických zkouškách byla prokázána účinnost proti gastroenteritidě způsobené nejběžnějšími rotavirovými genotypy G1P[8], G2P[4], G3P[8], G4P[8] a G9P[8]. Navíc byla prokázána účinnost proti vzácným rotavirovým genotypům G8P[4] (závažná gastroenteritida) a G12P[6] (jakákoliv gastroenteridita). Tyto kmeny cirkulují po celém světě.
V Evropě, Latinské Americe, Africe a Asii byly provedeny klinické studie, v nichž se hodnotila protektivní účinnost vakcíny Rotarix proti jakékoli a proti závažné rotavirové gastroenteritidě.
Závažnost gastroenteritidy byla definována podle dvou rozdílných kriterií:
- Vesikariho 20 bodové škály, v níž se při hodnocení plného klinického obrazu rotavirové
gastroenteritidy bere v úvahu závažnost a trvání průjmu a zvracení, závažnost horečky a dehydratace stejně jako nutnost léčby nebo
- klinicky definované příznaky vytvořené podle kriterií Světové zdravotnické organizace (WHO).
Klinická protekce (ochrana) byla hodnocena ve skupině subjektů (ATP kohorta pro zjištění účinnosti), která zahrnovala všechny subjekty z ATP kohorty pro zjištění bezpečnosti, kteří byli ochotni zúčastnit se sledování účinnosti po stanovenou dobu.
Protektivní účinnost v Evropě
V klinické studii provedené v Evropě byl hodnocen Rotarix podávaný podle různých evropských schémat (2, 3 měsíce; 2, 4 měsíce; 3, 4 měsíce; 3, 5 měsíců) na 4 000 subjektech.
Protektivní účinnost pozorovaná po dvou dávkách vakcíny Rotarix během prvního a druhého roku života a během obou let dohromady je uvedena v následující tabulce:
|
1. rok života Rotarix N = 2 572 Placebo N = 1 302 |
2. rok života Rotarix N = 2 554 Placebo N = 1 294 | |||
|
Účinnost va |
ccíny (%) proti jakékoliv a závažné rotavirové gastroenteritidě f95% Cil | |||
|
Genotyp |
Jakákoliv závažnost |
Závažná^ |
Jakákoliv závažnost |
Závažná^ |
|
G1P[8] |
95,6 [87,9; 98,8] |
96,4 [85,7; 99,6] |
82,7 [67,8; 91,3] |
96,5 [86,2; 99,6] |
|
G2P[4] |
62,0* [< 0,0; 94,4] |
74,7* [< 0,0; 99,6] |
57,1 [< 0,0; 82,6] |
89,9 [9,4; 99,8] |
|
G3P[8] |
89,9 [9,5; 99,8] |
100 [44,8; 100] |
79,7 [< 0,0; 98,1] |
83,1* [< 0,0; 99,7] |
|
G4P[8] |
88,3 [57,5; 97,9] |
100 [64,9; 100] |
69,6* [< 0,0; 95,3] |
87,3 [< 0,0; 99,7] |
|
G9P[8] |
75,6 [51,1; 88,5] |
94,7 [77,9; 99,4] |
70,5 [50,7; 82,8] |
76,8 [50,8; 89,7] |
|
Kmeny s genotypem P[8] |
88,2 [80,8; 93,0] |
96,5 [90,6; 99,1] |
75,7 [65,0; 83,4] |
87,5 [77,8; 93,4] |
|
Cirkulující rotavirové kmeny |
87,1 [79,6; 92,1] |
95,8 [89,6; 98,7] |
71,9 [61,2; 79,8] |
85,6 [75,8; 91,9] |
|
Účinnost vakcíny (%) proti rotavirové gastroer f95% CI |
iteritidě vyžadující lékařskou péči ] | |||
|
Cirkulující rotavirové kmeny |
91,8 [84; 96,3] |
76,2 [63,0; 85,0] | ||
|
Účinnost vakcíny (%) proti rotavirové gastroe T95% Cl |
nteritidě vyžadující hospitalizaci ] | |||
|
Cirkulující rotavirové kmeny |
100 [81,8; 100] |
92,2 [65,6; 99,1] | ||
^ Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
Účinnost vakcíny se během prvního roku života progresivně zvyšovala se zvyšující se závažností onemocnění až dosáhla 100 % (95% CI: 84,7; 100) při Vesikariho skóre > 17.
Protektivní účinnost v Latinské Americe
Klinická studie provedená v Latinské Americe hodnotila Rotarix na více než 20 000 subjektech. Závažnost gastroenteritidy byla definována podle kritérií WHO. Protektivní účinnost vakcíny proti závažné rotavirové gastroenteritidě vyžadující hospitalizaci a/nebo rehydratační terapii v lékařském zařízení a genotypově specifická účinnost vakcíny po dvou dávkách vakcíny Rotarix jsou uvedeny v následující tabulce:
|
Genotyp |
Závažná rotavirová gastroenteritidaf (první rok života) Rotarix N = 9 009 Placebo N = 8 858 |
Závažná rotavirová gastroenteritidaf (druhý rok života) Rotarix N = 7 175 Placebo N = 7 062 |
|
Účinnost (%) |
Účinnost (%) | |
|
T95% CI1 |
T95% CH | |
|
Všechny RVGE |
84,7 |
79,0 |
|
[71,7; 92,4] |
[66,4; 87,4] | |
|
G1P[8] |
91,8 |
72,4 |
|
[74,1; 98,4] |
[34,5; 89,9] | |
|
G3P[8] |
87,7 |
71,9* |
|
[8,3; 99,7] |
[< 0,0; 97,1] | |
|
G4P[8] |
50,8#* |
63,1 |
|
[< 0,0; 99,2] |
[0,7; 88,2] | |
|
G9P[8] |
90,6 |
87,7 |
|
[61,7; 98,9] |
[72,9; 95,3] | |
|
Kmeny |
90,9 |
79,5 |
|
s genotypem P[8] |
[79,2; 96,8] |
[67,0; 87,9] |
f Závažná rotavirová gastroenteritida byla definována jako epizoda průjmu s nebo bez zvracení, které vyžadovaly hospitalizaci a/nebo rehydratační léčbu v léčebném zařízení (kriterium WHO).
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
* Počty případů, na kterých byly založeny odhady účinnosti proti G4P[8], byly velmi malé (1 případ ve skupině vakcíny Rotarix a 2 případy ve skupině placeba).
Společná analýza výsledků z pěti studií účinnosti* ukázala 71,4 % (95% CI: 20,1; 91,1) účinnost proti závažné rotavirové gastroenteritidě (Vesikariho skóre > 11) způsobené rotavirem genotypu G2P[4] během prvního roku života.
* V těchto studiích byly body odhadu a intervaly spolehlivosti následující:
100 % (95% CI: -1 858,0; 100), 100 % (95% CI: 21,1; 100) a 45,4 % (95% CI: -81,5; 86,6), 74,7 % (95% CI:-386,2; 99,6). Pro zbývající studii nebyl dostupný žádný bod odhadu.
Protektivní účinnost v Africe
Klinická studie provedená v Africe (Rotarix: N = 2 974; placebo: N = 1 443) hodnotila Rotarix, který byl podán dětem přibližně ve věku 10 a 14 týdnů (2 dávky), nebo ve věku 6, 10 a 14 týdnů (3 dávky). Účinnost vakcíny byla proti závažné rotavirové gastroenteritidě v průběhu prvního roku života 61,2 % (95 % CI: 44,0; 73,2). Protektivní účinek vakcíny (souhrné dávky) pozorovaný proti jakýmkoliv a závažným rotavirovým gastroenteritidám je uveden v následující tabulce:
|
Genotyp |
Jakákoliv rotavirová |
Závažná rotavirová |
|
gastroenteritida |
gastroenteritida^ | |
|
Rotarix N = 2 974 |
Rotarix N = 2 974 | |
|
placebo N = 1 443 |
placebo N = 1 443 | |
|
Účinnost (%) |
Účinnost (%) | |
|
T95% CI1 |
T95% CI1 | |
|
G1P[8] |
68,3 |
56,6 |
|
[53,6; 78,51 |
[11,8; 78,81 | |
|
G2P[4] |
49,3 |
83,8 |
|
[4,6; 73,01 |
[9,6; 98,41 | |
|
G3P[8] |
43,4* |
51,5* |
|
[< 0; 83,71 |
[< 0; 96,51 | |
|
G8P[4] |
38,7* |
63,6 |
|
[< 0; 67,81 |
[5,9; 86,51 | |
|
G9P[8] |
41,8* |
56,9* |
|
[< 0; 72,31 |
[< 0; 85,51 | |
|
G12P[6] |
48,0 |
55,5* |
|
[9,7; 70,01 |
[< 0; 82,21 | |
|
Kmeny |
39,3 |
70,9 |
|
s genotypem P[4] |
[7,7; 59,91 |
[37,5; 87,01 |
|
Kmeny |
46,6 |
55,2* |
|
s genotypem P[6] |
[9,4; 68,41 |
[< 0; 81,31 |
|
Kmeny |
61,0 |
59,1 |
|
s genotypem P[8] |
[47,3; 71,21 |
[32,8; 75,31 |
f Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
Trvalá účinnost až do 3 let věku v Asii
Klinická studie provedená v Asii (Hongkong, Singapur a Thajsko) (Celková skupina očkovaných: Rotarix: N = 5 359; placebo: N = 5 349) hodnotila Rotarix, který byl podán odlišnými schématy (ve věku 2, 4 měsíce; ve věku 3, 4 měsíce).
V průběhu prvního roku bylo, v období od 2 týdnů po druhé dávce až do věku jednoho roku, ve skupině očkované vakcínou Rotarix významně méně subjektů s hlášenou závažnou rotavirovou gastroenteritidou způsobenou cirkulujícím divokým kmenem RV ve srovnání se skupinou očkovanou placebem (0,0 % proti 0,3 %) se 100 % (95% Cl: 72,2; 100) účinností vakcíny.
Protektivní účinnost po dvou dávkách vakcíny Rotarix proti závažné rotavirové gastroenteritidě sledované až do dvou let věku je uvedena v následující tabulce:
|
Účinnost až do 2 let věku Rotarix N = 5 263 Placebo N = 5 256 | |
|
Účinnost vakcíny (%) proti závažným rotavirovým gastroenteritidám (95% CI) | |
|
Genotyp |
Závažnostf |
|
G1P[8] |
100,0 (80,8; 100,0) |
|
G2P[4] |
100,0* (< 0; 100,0) |
|
G3P[8] |
94,5 (64,9; 99,9) |
|
G9P[8] |
91,7 (43,8; 99,8) |
|
Kmeny s genotypem P[8] |
95,8 (83,8; 99,5) |
|
Cirkulující rotavirové kmeny |
96,1 (85,1; 99,5) |
|
Účinnost vakcíny (%) proti rotavirovým gastroenteritidám vyžadujícím hospitalizaci a/nebo rehydratační léčbu ve zdravotnickém zařízení [95% CI] | |
| Cirkulující rotavirové kmeny |_94,2 (82,2; 98,8)_|
T Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
V průběhu třetího roku života nebyly ve skupině léčené vakcínou Rotarix (N = 4 222) případy závažné RV gastroenteritidy proti 13 (0,3 %) ve skupině s placebem (N = 4 185). Účinnost vakcíny byla 100,0% (95% CI: 67,5; 100,0). Případy těžké RV gastroenteritidy byly způsobeny RV kmeny G1P [8], G2P [4], G3P [8] a G9P [8] . Výskyt závažných RV gastroenteritid spojených s jednotlivými genotypy byl příliš malý pro výpočet samotné účinnosti. Účinnost vakcíny proti závažným RV gastroenteritidám vyžadujícím hospitalizaci byla 100 % [95% CI: 72,4; 100,0].
Protektivní účinnost tekuté formy
Vzhledem k tomu, že imunitní odpověď pozorovaná po podání 2 dávek tekuté formy vakcíny Rotarix byla srovnatelná s imunitní odpovědí pozorovanou po podání 2 dávek lyofilizované formy vakcíny Rotarix, může být úroveň účinnosti zaznamenaná po podání lyofilizované formy extrapolována na tekutou formu.
Imunitní odpověď
Imunologický mechanismus, kterým Rotarix chrání proti rotavirové gastroenteritidě není zcela znám. Závislost mezi protilátkovou odpovědí na očkování proti rotaviru a ochranou proti rotavirové gastroenteritidě nebyla stanovena.
V následující tabulce je ukázáno množství subjektů původně séronegativních na rotaviry (titry IgA protilátky < 20 U/ml) (podle ELISA) v procentech s titry sérových anti-rotavirových IgA protilátek > 20 U/ml pozorovanými v různých studiích jeden až dva měsíce po druhé dávce vakcíny nebo placeba.
|
Očkovací schéma |
Země studie |
Vakcína |
Placebo | ||
|
N |
% > 20 U/ml [95% CIl |
N |
% > 20 U/ml [95% CIl | ||
|
2, 3 měsíce |
Francie, Německo |
239 |
82,8 [77,5; 87,4l |
127 |
8,7 [4,4; 15,0l |
|
2, 4 měsíce |
Španělsko |
186 |
85,5 [79,6; 90,2l |
89 |
12,4 [6,3; 21,0l |
|
3, 5 měsíce |
Finsko, Itálie |
180 |
94,4 [90,0; 97,3l |
114 |
3,5 [1,0; 8,7l |
|
3, 4 měsíce |
Česká republika |
182 |
84,6 [78,5; 89,5l |
90 |
2,2 [0,3; 7,8l |
|
2, 3 až 4 měsíce |
Latinská Amerika; 11 zemí |
393 |
77,9 % [73,8; 81,6] |
341 |
15,1 % [11,7; 19,0l |
|
10, 14 týdnů a 6, 10, 14 týdnů (souhrnně) |
Severní Afrika, Malawi |
221 |
58,4 [51,6; 64,9] |
111 |
22,5 [15,1; 31,4l |
Ve třech srovnávacích kontrolovaných studiích byla imunitní odpověď vyvolaná tekutou formou vakcíny Rotarix srovnatelná s imunitní odpovědí vyvolanou lyofilizovanou formou vakcíny Rotarix.
Imunitní odpověď u předčasně narozených dětí
Imunogenicita vakcíny Rotarix byla v klinické studii s předčasně narozenými dětmi, které se narodily po alespoň 27. týdnu gestačního věku, stanovena u podskupiny 147 subjektů a bylo prokázáno, že
Rotarix je v této populaci imunogenní: 1 měsíc po podání druhé dávky vakcíny dosáhlo titrů sérových anti-rotavirových IgA protilátek > 20 U/ml (podle ELISA) 85,7 % subjektů (95% CI:79,0; 90,9).
Účinnost po 2 dávkách v prevenci RVGE vedoucí k hospitalizaci
|
Země období (věk) |
Kmeny věkové rozpětí |
N $ (případy/kontroly) |
Účinnost % [95% CI] |
Délka sledování |
|
studie sponzorované společností GSK | ||||
|
Belgie 2008 - 2010 < 4 roky |
všechny 3 - 11 m > 12 m |
160/198 |
90 [81; 95] 91 [75; 7] 90 [76; 96) |
2,4 let |
|
G1P[8] |
41/53 |
95 [78; 99] | ||
|
G2P[4] 3 - 11 m > 12 m |
80/103 |
85 [64; 94] 83 [11; 96] J 86 [58; 95] J | ||
|
Brazílie (Belém) 2008 - 2009 < 3 roky |
všechny 3 - 11 m > 12 m |
249/249 £ |
76 [58; 86] 96 [68; 99] 65 [37; 81) |
1 rok |
|
G2P[4] 3 - 11 m > 12 m |
222/222 £ |
75 [57; 86] 95 [66; 99] J 64 [34; 81] J | ||
|
Brazílie (Recife) 2006 - 2008 < 5 let |
všechny 6 - 11 m > 12 m |
NA § |
NA 81 [47; 93] 5 [< 0; 69] * |
2,5 let |
|
G2P[4] 6 - 11 m > 12 m |
61/424 § |
NA 85 [54; 95] 5 [< 0; 69]* | ||
|
všechny 6 - 11 m > 12 m |
NA f |
NA 80 [48; 92] 41 [< 0; 81] * | ||
|
G2P[4] 6 - 11 m > 12 m |
61/371 f |
NA 83 [51; 94] 41 [< 0; 81] * | ||
|
Singapur 2008 - 2010 < 5 let |
všechny |
136/272 |
84 [32; 96] |
2 roky |
|
G1P[8] |
89/89 |
91 [30; 99] | ||
|
Ostatní studie | ||||
|
Salvádor 2007 - 2009 < 2 roky |
všechny 6 - 11 m > 12 m |
251/770 £ |
76 [64; 84] ** 83 [68; 91] 59 [27; 77] |
2,5 let |
m: měsíce
NA: není k dispozici.
$ Počet plně očkovaných (2 dávky) a neočkovaných případů a kontrol.
£ Účinnost vakcíny byla vypočtena využitím sousedů jako kontrol.
§ Účinnost vakcíny byla vypočtena využitím hospitalizovaných rotavirus- negativních kontrol. f Účinnost vakcíny byla vypočtena využitím hospitalizovaných kontrol s akutní infekcí respiračního traktu.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
**U jedinců, kteří neobdrželi celé očkovací schéma, byla účinnost po jedné dávce 51 % (95% CI: 26; 67).
J Data z post-hoc analýz.
Dopad na úmrtnost'''
Dopadové studie (Impact studies) s vakcínou Rotarix provedené v Panamě, Brazílii a Mexiku ukázaly, že v průběhu 2 až 3 let po zahájení očkování poklesla úmrtnost na průjem z jakékoli příčiny u dětí mladších 5 let věku v rozsahu od 22 % do 56 %.
Dopad na hospitalizaci§
V retrospektivní studii databáze v Belgii provedené u dětí ve věku 5 let a mladších byl dva roky po zahájení očkování přímý i nepřímý dopad očkování vakcínou Rotarix na hospitalizaci spojenou s rotavirem v rozsahu od 64 % (95% CI: 49; 76) do 80 % (95% CI: 77; 83). Podobné studie ukázaly snížení o 59 % v Brazílii, o 75 % v Austrálii a o 81 % v Salvádoru. Navíc tři dopadové studie provedené v Latinské Americe ukázaly, že dva roky po zahájení očkování se snížil výskyt případů průjmů z jakékoliv příčiny spojených s hospitalizací o 29 % až 37 %.
§POZNÁMKA: dopadové studie mají zjistit časovou souvislost, ale ne příčinnou souvislost mezi onemocněním a očkováním. Přirozená fluktuace výskytu onemocnění může rovněž ovlivnit pozorovaný časový efekt.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Sacharosa Dinatrium-adipát Živná půda (DMEM)
Sterilisovaná čištěná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Vakcína se má použít ihned po otevření.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
1.5 ml perorální suspenze v předplněném perorálním aplikátoru (sklo typu I) s pístovou zátkou (butylpryž) a ochranným uzávěrem (butylpryž) v baleních o velikosti 1, 5, 10 nebo 25.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Vakcína je čirá bezbarvá tekutina bez viditelných částic, určená k perorálnímu podání.
Vakcína je připravena k použití (není nutné ji rekonstituovat ani ředit).
Vakcína se podává perorálně bez mísení s žádnými jinými vakcínami nebo roztoky.
Vakcína by měla být před aplikací vizuálně zkontrolována, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled. Pokud jsou pozorovány cizorodé částice nebo změna vzhledu, je třeba vakcínu vyřadit.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod na aplikaci vakcíny:
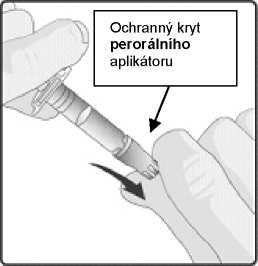
1. Odstraňte ochranný kryt z perorálního aplikátoru.
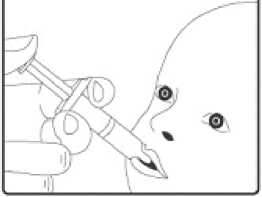
2. Tato vakcína je určena pouze k perorálnímu podání. Dítě by se mělo usadit do zakloněné polohy. Aplikujte plný obsah perorálního aplikátoru perorálně (t.j. do úst dítěte na vnitřní stranu tváře).
Prázdný perorální aplikátor a ochranný kryt vyhoďte, v souladu s místními požadavky, do kontejneru určeného pro biologické odpady.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a.
Rue de l'Institut 89 B-1330 Rixensart, Belgie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/330/005
EU/1/05/330/006
EU/1/05/330/007
EU/1/05/330/008
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. února 2006
Datum posledního prodloužení registrace: 24. leden 2011
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
Rotarix perorální suspenze Živá rotavirová vakcína
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 dávka (1,5 ml) obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum* ne méně než 106,0 CCID50
*Pomnožený na Vero buňkách Pomocná látka se známým účinkem:
Tento léčivý přípravek obsahuje 1 073 mg sacharózy (viz bod 4.4).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Perorální suspenze.
Rotarix je čirá bezbarvá tekutina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Rotarix je určen k aktivní imunizaci dětí ve věku 6 až 24 týdnů za účelem prevence gastroenteritidy způsobené rotavirovou infekcí (viz body 4.2, 4.4 a 5.1).
Rotarix se má podávat podle oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Očkovací schéma se skládá ze dvou dávek. První dávka se může podávat od 6 týdnů věku. Interval mezi dávkami by měl být nejméně 4 týdny. Obě dávky očkování by se měly aplikovat pokud možno před dosažením věku 16 týdnů, ale očkovací schéma musí být dokončeno do 24. týdne věku.
Předčasně narozeným dětem, které se narodily alespoň po 27. týdnu gestačního věku, lze Rotarix podat ve stejném dávkování (viz body 4.8 a 5.1).
V klinických zkouškách bylo vzácně pozorováno vyplivnutí nebo regurgitace vakcíny a v takových případech nebyla podána náhradní dávka. Pokud ale dojde k málo pravděpodobnému jevu, že dítě vyplivne nebo vyzvrátí většinu podané dávky vakcíny, je možné podat při stejné návštěvě jednu náhradní dávku.
Doporučuje se, aby děti, které dostaly jako první dávku vakcíny Rotarix, dokončily 2-dávkové schéma vakcínou Rotarix. Nejsou k dispozici žádné údaje o bezpečnosti, imunogenicitě nebo účinnosti očkování, pokud byl Rotarix podán jako první dávka a jako druhá dávka byla podána jiná rotavirová vakcína či naopak.
Pediatrická populace
Rotarix se nemá podávat dětem ve věku nad 24 týdnů.
Způsob podání
Rotarix je určen pouze k perorálnímu podání.
Rotarix se za žádných okolností nesmí podat injekčně.
Návod k přípravě nebo naředění léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersensitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersensitivita po předchozím podání rotavirových vakcín.
Intususcepce v anamnéze.
Osoby s nekorigovanou vrozenou malformací gastrointestinálního traktu, které by mohly být predisponovány ke vzniku intususcepce.
Subjekty s těžkou kombinovanou imunodeficiencí (SCID) (viz bod 4.8).
Aplikace vakcíny Rotarix musí být odložena u osob trpících akutním vážným horečnatým onemocněním. Přítomnost slabé infekce není kontraindikací imunizace.
Aplikace vakcíny Rotarix musí být odložena u osob trpících průjmem nebo zvracením.
4.4 Zvláštní upozornění a opatření pro použití
Podle správné klinické praxe by se před zahájením očkování měla sestavit anamnéza očkovaného zejména s ohledem na kontraindikace a klinické vyšetření.
Nejsou k dispozici údaje o bezpečnosti a účinnosti vakcíny Rotarix u dětí trpících gastrointestinálními nemocemi nebo poruchou růstu. U takových dětí se má podání vakcíny Rotarix s opatrností zvážit, zvláště pokud, podle názoru lékaře, nepodání vakcíny znamená vyšší riziko.
Jako preventivní opatření by měli zdravotničtí pracovníci sledovat jakékoliv příznaky svědčící pro intususcepci (závažné bolesti břicha, úporné zvracení, krvavé stolice, nadmutí břicha a/nebo vysoká horečka), protože údaje z pozorovacích bezpečnostních studií ukazují zvýšení rizika výskytu intususcepce většinou během 7 dní po očkování rotaviry (viz bod 4.8). Při výskytu těchto příznaků by rodiče/opatrovníci měli být požádáni o okamžité hlášení takových příznaků zdravotnickým pracovníkům.
Pokyny pro jedince s predispozicí vzniku intususcepce jsou v bodě 4.3.
Nepředpokládá se, že by asymptomatické HIV infekce nebo HIV infekce s mírnými příznaky ovlivňovaly bezpečnost a účinnost vakcíny Rotarix. V klinické studii s omezeným počtem kojenců s asymptomatickou HIV infekcí nebo HIV infekcí s mírnými příznaky nebyly žádné zjevné problémy s bezpečností prokázány (viz bod 4.8).
Aplikace vakcíny Rotarix dětem se známým nebo suspektním deficitem imunity musí být založena na pečlivém zvážení potenciálních přínosů a rizik.
Je známo, že po vakcinaci dochází k vylučování viru z vakcíny stolicí, s maximem exkrece okolo 7. dne. Částice virového antigenu detekované testem ELISA byly nalezeny v 50 % stolic odebraných po první dávce lyofilizované formy vakcíny Rotarix a ve 4 % stolic odebraných po druhé dávce. Když byly tyto stolice testovány na přítomnost živého kmene vakcíny, bylo jich pozitivních jen 17 %. Ve dvou kontrolovaných komparativních studiích bylo po očkování tekutou formou vakcíny Rotarix vylučování viru vakcíny srovnatelné s vylučováním pozorovaným po očkování lyofilizovanou formou vakcíny Rotarix.
Byly pozorovány případy přenosu takto vyloučeného viru z vakcíny na séronegativní osoby, které byly v kontaktu s očkovanými jedinci, aniž by to vyvolalo nějaké klinické symptomy.
Rotarix by se měl podávat s opatrností u jedinců, kteří přicházejí do úzkého kontaktu s imunodeficitními osobami, jako jsou například osoby s nádorovým onemocněním nebo jinak imunokomprimované osoby nebo jedinci, kteří dostávají imunosupresivní terapií.
Osoby, které jsou v kontaktu s čerstvě očkovanými jedinci, by měly dodržovat osobní hygienu (např. mytí rukou po výměně dětských plen).
Možné riziko apnoe a nutnost monitorování dýchání po dobu 48 - 72 hodin by se měly zvážit když se podávají dávky základního očkování velmi předčasně narozeným dětem (narozené ve < 28. týdnu těhotenství) a zvláště těm, v jejichž předchozí anamnéze byla respirační nezralost.
Protože prospěch očkování je u této skupiny dětí vysoký, neměla by se vakcinace odmítat ani oddalovat.
Protektivní imunitní odpovědi nemusí být dosaženo u všech očkovaných (viz bod 5.1).
Rozsah ochrany, kterou by Rotarix mohl poskytnout vůči ostatním rotavirovým kmenům, které necirkulovaly v klinických studiích, není v současnosti znám. Klinické studie, z nichž byly získány údaje o účinnosti, byly prováděny v Evropě, ve Střední a v Jižní Americe, Africe a Asii (viz bod 5.1).
Rotarix nechrání proti gastroenteritidě způsobené jinými patogeny než jsou rotaviry.
Data o použití vakcíny Rotarix k post-expoziční profylaxi nejsou k dispozici.
Rotarix se za žádných okolností nesmí podat injekčně.
Vakcína obsahuje jako pomocnou látku sacharózu. Pacienti, kteří mají vzácné dědičné problémy s fruktózovou intolerancí, s glukózo-galaktózovou malabsorpcí nebo se sacharázo-isomaltázovou insuficiencí by neměli tuto vakcínu dostávat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Rotarix lze podat současně s kteroukoliv z následujících monovalentních nebo kombinovaných vakcín [včetně hexavalentních vakcín (DTPa-HBV-IPV/Hib)]: vakcína proti difterii, tetanu, pertusi (celobuněčná) (DTPw), vakcína proti difterii, tetanu, pertusi (acelulární) (DTPa), vakcína proti Haemophilus influenzae typu b (Hib), inaktivovaná vakcína proti poliomyelitidě (IPV), vakcína proti hepatitidě B (HBV), konjugovaná pneumokoková vakcína a konjugovaná meningokoková vakcína séroskupiny C. Klinické studie prokázaly, že imunitní odpovědi a bezpečnostní profily podaných vakcín nebyly ovlivněny.
Současné podání vakcíny Rotarix a perorální vakcíny proti poliomyelitidě (OPV) neovlivňuje imunitní odpověď na polio antigeny. I když současné podání OPV může lehce snížit imunitní odpověď na rotavirovou vakcínu, v klinické studii zahrnující více než 4 200 osob, kterým byl podán Rotarix současně s OPV vakcínou se ukázalo, že klinická protekce proti vážné rotavirové gastroenteritidě zůstává zachována.
Nejsou žádná omezení týkající se konzumace potravy nebo tekutin, a to před ani po očkování dítěte.
4.6 Fertilita, těhotenství a kojení
Rotarix není určen k očkování dospělých. Nejsou dostupné údaje o použití vakcíny Rotarix během těhotenství a kojení.
Na základě údajů získaných v klinických studiích nesnižuje kojení ochranu proti rotavirové gastroenteritidě vyvolané vakcínou Rotarix. V době očkování je tedy možné pokračovat v kojení.
4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní.
4.8 Nežádoucí účinky Přehled bezpečnostního profilu
Níže prezentovaný bezpečnostní profil je založen na údajích z klinických studií vedených buď s lyofilizovanou nebo tekutou formou vakcíny Rotarix.
Celkově bylo ve čtyřech klinických studiích podáno přibližně 3 800 dávek vakcíny Rotarix v tekuté formě přibližně 1 900 kojencům. Tyto studie ukázaly, že bezpečnostní profil této tekuté formy je srovnatelný s lyofilizovanou formou.
Celkem bylo ve dvaceti třech klinických studiích podáno přibližně 51 000 kojencům zhruba 106 000 dávek vakcíny Rotarix (lyofilizované nebo tekuté formy).
Ve třech placebem kontrolovaných klinických studiích (Finsko, Indie a Bangladéš), ve kterých byl Rotarix podáván samotný (podání běžných dětských vakcín bylo časově upraveno) nebyl výskyt a závažnost předem určených nežádoucích účinků (údaje získány 8 dní po očkování), průjmu, zvracení, ztráty chuti k jídlu, horečky, podrážděnosti a kašle/výtoku z nosu při srovnání skupiny dostávající Rotarix a skupiny dostávající placebo významně odlišný. Po podání druhé dávky nebylo pozorováno zvýšení výskytu nebo závažnosti těchto nežádoucích účinků.
Ve shromážděných analýzách ze sedmnácti placebem kontrolovaných klinických studií (Evropa, Severní Amerika, Latinská Amerika, Asie, Afrika) včetně klinických studií s vakcínou Rotarix, která byla podávána současně s běžnými dětskými vakcínami (viz bod 4.5) byly následující nežádoucí účinky (údaje získány 31 dní po očkování) zvažovány jako možné v návaznosti na očkování.
Tabulkový výčet nežádoucích účinků
Hlášené nežádoucí účinky jsou uvedeny podle následující četnosti výskytu:
Frekvence jsou definovány jako:
Velmi časté (> 1/10)
Časté (> 1/100, < 1/10)
Méně časté (> 1/1 000, < 1/100)
Vzácné (> 1/10 000, < 1/1 000)
Velmi vzácné (< 1/10 000)
|
Třídy orgánových systémů |
Četnost výskytu |
Nežádoucí účinky |
|
Gastrointestinální poruchy |
časté | |
|
méně časté |
bolest břicha, nadýmání | |
|
velmi vzácné |
intususcepce (viz bod 4.4) | |
|
není známo* |
hematochezie | |
|
není známo* |
gastroenteritis s vylučováním viru vakcíny u dětí s těžkým kombinovaným imunodeficitem(SCID) | |
|
Poruchy kůže a podkožní tkáně |
méně časté | |
|
Celkové poruchy a reakce v místě aplikace |
časté | |
|
Respirační, hrudní a mediastinální poruchy |
není známo* |
apnoe u velmi předčasně narozených dětí (narozených ve < 28. týdnu těhotenství) (viz bod 4.4). |
* Jelikož byly tyto nežádoucí účinky hlášeny spontánně, není možné spolehlivě odhadovat jejich četnost.
Popis některých nežádoucích účinků
Intususcepce
Data získaná z pozorovacích bezpečnostních studií provedených v několika zemích naznačují, že rotavirové vakcíny nesou zvýšené riziko vzniku intususcepce většinou během 7 dní po očkování.
V USA a Austrálii bylo pozorováno až 6 dalších případů ze 100 000 kojenců při běžném výskytu
33 až 101 na 100 000 kojenců (mladších než jeden rok věku) za rok. Existují omezené údaje o menším zvýšení rizika po druhé dávce. Zůstává nejasné, zda rotavirové vakcíny ovlivňují celkový výskyt intususcepce na základě delších období sledování (viz bod 4.4).
Další zvláštní skupiny populace
Bezpečnost u předčasně narozených dětí
V klinické studii byl 670 předčasně narozeným dětem v gestačním věku od 27 do 36 týdnů podán Rotarix a 339 bylo podáno placebo. První dávka jim byla podána od šesti týdnů po narození. Závažné nežádoucí účinky byly pozorovány u 5,1 % dětí, které obdržely Rotarix, ve srovnání s 6,8 % dětí, které obdržely placebo. Srovnatelný poměr ostatních nežádoucích účinků byl pozorován u dětí, které obdržely Rotarix a u dětí, které obdržely placebo. Nebyly hlášeny žádné případy intususcepce.
Bezpečnost u dětí s infekcí virem lidské imunodeficience (HIV)
V klinické studii byl 100 dětem s HIV infekcí podán Rotarix nebo placebo. Bezpečnostní profil byl mezi dětmi, které obdržely Rotarix, a dětmi, které obdržely placebo, srovnatelný.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Bylo hlášeno několik případů předávkování. Obecně,v těchto případech profil hlášených nežádoucích účinků byl podobný tomu, který se vyskytoval po podání doporučené dávky vakcíny Rotarix.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny proti rotavirovým průjmovým infekcím, ATC kód: J07BH01
Protektivní účinnost lyofilizované formy vakcíny Rotarix
V klinických zkouškách byla prokázána účinnost proti gastroenteritidě způsobené nejběžnějšími rotavirovými genotypy G1P[8], G2P[4], G3P[8], G4P[8] a G9P[8]. Navíc byla prokázána účinnost proti vzácným rotavirovým genotypům G8P[4] (závažná gastroenteritida) a G12P[6] (jakákoliv gastroenteridita). Tyto kmeny cirkulují po celém světě.
V Evropě, Latinské Americe, Africe a Asii byly provedeny klinické studie, v nichž se hodnotila protektivní účinnost vakcíny Rotarix proti jakékoli a proti závažné rotavirové gastroenteritidě.
Závažnost gastroenteritidy byla definována podle dvou rozdílných kriterií:
- Vesikariho 20 bodové škály, v níž se při hodnocení plného klinického obrazu rotavirové
gastroenteritidy bere v úvahu závažnost a trvání průjmu a zvracení, závažnost horečky a dehydratace stejně jako nutnost léčby nebo
- klinicky definované příznaky vytvořené podle kriterií Světové zdravotnické organizace (WHO).
Klinická protekce (ochrana) byla hodnocena ve skupině subjektů (ATP kohorta pro zjištění účinnosti), která zahrnovala všechny subjekty z ATP kohorty pro zjištění bezpečnosti, kteří byli ochotni zúčastnit se sledování účinnosti po stanovenou dobu.
Protektivní účinnost v Evropě
V klinické studii provedené v Evropě byl hodnocen Rotarix podávaný podle různých evropských schémat (2, 3 měsíce; 2, 4 měsíce; 3, 4 měsíce; 3, 5 měsíců) na 4 000 subjektech.
Protektivní účinnost pozorovaná po dvou dávkách vakcíny Rotarix během prvního a druhého roku života a během obou let dohromady je uvedena v následující tabulce:
|
1. rok života Rotarix N = 2 572 Placebo N = 1 302 |
2. rok života Rotarix N = 2 554 Placebo N = 1 294 | |||
|
Účinnost va |
kcíny (%) proti jakékoliv a závažné rotavirové gastroenteritidě T95% CI1 | |||
|
Genotyp |
Jakákoliv závažnost |
Závažná1' |
Jakákoliv závažnost |
Závažná1 |
|
G1P[8] |
95,6 [87,9; 98,8] |
96,4 [85,7; 99,6] |
82,7 [67,8; 91,3] |
96,5 [86,2; 99,6] |
|
G2P[4] |
62,0* [< 0,0; 94,4] |
74,7* [< 0,0; 99,6] |
57,1 [< 0,0; 82,6] |
89,9 [9,4; 99,8] |
|
G3P[8] |
89,9 [9,5; 99,8] |
100 [44,8; 100] |
79,7 [< 0,0; 98,1] |
83,1* [< 0,0; 99,7] |
|
G4P[8] |
88,3 [57,5; 97,91 |
100 [64,9; 1001 |
69,6* [< 0,0; 95,31 |
87,3 [< 0,0; 99,71 |
|
G9P[8] |
75,6 [51,1; 88,51 |
94,7 [77,9; 99,41 |
70,5 [50,7; 82,81 |
76,8 [50,8; 89,71 |
|
Kmeny s genotypem P[8] |
88,2 [80,8; 93,01 |
96,5 [90,6; 99,11 |
75,7 [65,0; 83,41 |
87,5 [77,8; 93,41 |
|
Cirkulující rotavirové kmeny |
87,1 [79,6; 92,11 |
95,8 [89,6; 98,71 |
71,9 [61,2; 79,81 |
85,6 [75,8; 91,91 |
|
Účinnost vakcíny (%) proti rotavirové gastroenteritidě vyžadující lékařskou péči f95% CI1 | ||||
|
Cirkulující rotavirové kmeny |
91,8 [84; 96,31 |
76,2 [63,0; 85,01 | ||
|
Účinnost vakcíny (%) proti rotavirové gastroenteritidě vyžadující hospitalizaci T95% CI1 | ||||
|
Cirkulující rotavirové kmeny |
100 [81,8; 1001 |
92,2 [65,6; 99,11 | ||
f Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0.05). Tato data mají být interpretována s opatrností.
Účinnost vakcíny se během prvního roku života progresivně zvyšovala se zvyšující se závažností onemocnění až dosáhla 100 % (95% CI: 84,7; 100) při Vesikariho skóre > 17.
Protektivní účinnost v Latinské Americe
Klinická studie provedená v Latinské Americe hodnotila Rotarix na více než 20 000 subjektech. Závažnost gastroenteritidy byla definována podle kritérií WHO. Protektivní účinnost vakcíny proti závažné rotavirové gastroenteritidě vyžadující hospitalizaci a/nebo rehydratační terapii v lékařském zařízení a genotypově specifická účinnost vakcíny po dvou dávkách vakcíny Rotarix jsou uvedeny v následující tabulce:
|
Genotyp |
Závažná rotavirová gastroenteritidaf (první rok života) Rotarix N = 9 009 Placebo N = 8 858 |
Závažná rotavirová gastroenteritidaf (druhý rok života) Rotarix N = 7 175 Placebo N = 7 062 |
|
Účinnost (%) |
Účinnost (%) | |
|
T95% CI1 |
T95% CI1 | |
|
Všechny RVGE |
84,7 |
79,0 |
|
[71,7; 92,41 |
[66,4; 87,41 | |
|
G1P[8] |
91,8 |
72,4 |
|
[74,1; 98,41 |
[34,5; 89,91 | |
|
G3P[8] |
87,7 |
71,9* |
|
[8,3; 99,71 |
[< 0,0; 97,11 | |
|
G4P[8] |
50,8#* |
63,1 |
|
[< 0,0; 99,21 |
[0,7; 88,21 | |
|
G9P[8] |
90,6 |
87,7 |
|
[61,7; 98,91 |
[72,9; 95,31 | |
|
Kmeny |
90,9 |
79,5 |
|
s genotypem P[8] |
[79,2; 96,81 |
[67,0; 87,91 |
f Závažná rotavirová gastroenteritida byla definována jako epizoda průjmu s nebo bez zvracení, které vyžadovaly hospitalizaci a/nebo rehydratační léčbu v léčebném zařízení (kriterium WHO).
* Statisticky nevýznamné (p > 0.05). Tato data mají být interpretována s opatrností.
# Počty případů, na kterých byly založeny odhady účinnosti proti G4P[8], byly velmi malé (1 případ ve skupině vakcíny Rotarix a 2 případy ve skupině placeba).
Společná analýza výsledků z pěti studií účinnosti* ukázala 71,4 % (95% CI: 20,1; 91,1) účinnost proti závažné rotavirové gastroenteritidě (Vesikariho skóre > 11) způsobené rotavirem genotypu G2P[4] během prvního roku života.
* V těchto studiích byly body odhadu a intervaly spolehlivosti následující:
100 % (95% CI: -1 858,0; 100), 100 % (95% CI: 21,1; 100) a 45,4 % (95% CI: -81,5; 86,6), 74,7 % (95% CI :-386,2; 99,6). Pro zbývající studii nebyl dostupný žádný bod odhadu.
Protektivní účinnost v Africe
Klinická studie provedená v Africe (Rotarix: N = 2 974; placebo: N = 1 443) hodnotila Rotarix, který byl podán dětem přibližně ve věku 10 a 14 týdnů (2 dávky), nebo ve věku 6, 10 a 14 týdnů (3 dávky). Účinnost vakcíny byla proti závažné rotavirové gastroenteritidě v průběhu prvního roku života 61,2 % (95% CI: 44,0; 73,2). Protektivní účinek vakcíny (souhrné dávky) pozorovaný proti jakýmkoliv a závažným rotavirovým gastroenteritidám je uveden v následující tabulce:
|
Genotyp |
Jakákoliv rotavirová gastroenteritida Rotarix N = 2 974 placebo N = 1 443 |
Závažná rotavirová gastroenteritida^ Rotarix N = 2 974 placebo N = 1 443 |
|
Účinnost (%) |
Účinnost (%) | |
|
T95% CI1 |
T95% CH | |
|
G1P[8] |
68,3 |
56,6 |
|
[53,6; 78,5] |
[11,8; 78,8] | |
|
G2P[4] |
49,3 |
83,8 |
|
[4,6; 73,0] |
[9,6; 98,4] | |
|
G3P[8] |
43,4* |
51,5* |
|
[< 0; 83,7] |
[< 0; 96,5] | |
|
G8P[4] |
38,7* |
63,6 |
|
[< 0; 67,8] |
[5,9; 86,5] | |
|
G9P[8] |
41,8* |
56,9* |
|
[< 0; 72,3] |
[< 0; 85,5] | |
|
G12P[6] |
48,0 |
55,5* |
|
[9,7; 70,0] |
[< 0; 82,2] | |
|
Kmeny |
39,3 |
70,9 |
|
s genotypem P[4] |
[7,7; 59,9] |
[37,5; 87,0] |
|
Kmeny |
46,6 |
55,2* |
|
s genotypem P[6] |
[9,4; 68,4] |
[< 0; 81,3] |
|
Kmeny |
61,0 |
59,1 |
|
s genotypem P[8] |
[47,3; 71,2] |
[32,8; 75,3] |
! Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
Trvalá účinnost až do 3 let věku v Asii
Klinická studie provedená v Asii (Hongkong, Singapur a Thajsko) (Celková skupina očkovaných: Rotarix: N = 5 359; placebo: N = 5 349) hodnotila Rotarix, který byl podán odlišnými schématy (ve věku 2, 4 měsíce; ve věku 3, 4 měsíce).
V průběhu prvního roku bylo, v období od 2 týdnů po druhé dávce až do věku jednoho roku, ve skupině očkované vakcínou Rotarix významně méně subjektů s hlášenou závažnou rotavirovou gastroenteritidou způsobenou cirkulujícím divokým kmenem RV ve srovnání se skupinou očkovanou placebem (0,0 % proti 0,3 %) se 100 % (95% CI: 72,2; 100) účinností vakcíny.
Protektivní účinnost po dvou dávkách vakcíny Rotarix proti závažné rotavirové gastroenteritidě sledované až do dvou let věku je uvedena v následující tabulce:
|
Účinnost až do 2 let věku Rotarix N = 5 263 Placebo N = 5 256 | |
|
Účinnost vakcíny (%) proti závažným rotavirovým gastroenteritidám (95% CI) | |
|
Genotyp |
Závažnostf |
|
G1P[8] |
100,0 (80,8; 100,0) |
|
G2P[4] |
100,0* (< 0; 100,0) |
|
G3P[8] |
94,5 (64,9; 99,9) |
|
G9P[8] |
91,7 (43,8; 99,8) |
|
Kmeny s genotypem P[8] |
95,8 (83,8; 99,5) |
|
Cirkulující rotavirové kmeny |
96,1 (85,1; 99,5) |
|
Účinnost vakcíny (%) proti rotavirovým gastroenteritidám vyžadujícím hospitalizaci a/nebo rehydratační léčbu ve zdravotnickém zařízení [95% CI] | |
|
Cirkulující rotavirové kmeny |
94,2 (82,2; 98,8) |
f Závažná gastroenteritida byla definována se skóre > 11 Vesikariho stupnice.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
V průběhu třetího roku života nebyly ve skupině léčené vakcínou Rotarix (N = 4 222) případy závažné RV gastroenteritidy proti 13 (0,3 %) ve skupině s placebem (N = 4 185). Účinnost vakcíny byla 100,0 % (95% CI: 67,5; 100,0). Případy těžké RV gastroenteritidy byly způsobeny RV kmeny G1P [8], G2P [4], G3P [8] a G9P [8]. Výskyt závažných RV gastroenteritid spojených s jednotlivými genotypy byl příliš malý pro výpočet samotné účinnosti. Účinnost vakcíny proti závažným RV gastroenteritidám vyžadujícím hospitalizaci byla 100 % [95% CI: 72,4; 100,0].
Protektivní účinnost tekuté formy
Vzhledem k tomu, že imunitní odpověď pozorovaná po podání 2 dávek tekuté formy vakcíny Rotarix byla srovnatelná s imunitní odpovědí pozorovanou po podání 2 dávek lyofilizované formy vakcíny Rotarix, může být úroveň účinnosti zaznamenaná po podání lyofilizované formy extrapolována na tekutou formu.
Imunitní odpověď
Imunologický mechanismus, kterým Rotarix chrání proti rotavirové gastroenteritidě není zcela znám. Závislost mezi protilátkovou odpovědí na očkování proti rotaviru a ochranou proti rotavirové gastroenteritidě nebyla stanovena.
V následující tabulce je ukázáno množství subjektů původně séronegativních na rotaviry (titry IgA protilátky < 20 U/ml) (podle ELISA) v procentech s titry sérových anti-rotavirových IgA protilátek > 20 U/ml pozorovanými v různých studiích jeden až dva měsíce po druhé dávce vakcíny nebo placeba.
|
Očkovací schéma |
Země studie |
Vakcína |
Placebo | ||
|
N |
% > 20 U/ml [95% CI] |
N |
% > 20 U/ml [95% CI] | ||
|
2, 3 měsíce |
Francie, Německo |
239 |
82,8 [77,5; 87,41 |
127 |
8,7 [4,4; 15,01 |
|
2, 4 měsíce |
Španělsko |
186 |
85,5 [79,6; 90,21 |
89 |
12,4 [6,3; 21,01 |
|
3, 5 měsíce |
Finsko, Itálie |
180 |
94,4 [90,0; 97,31 |
114 |
3,5 [1,0; 8,71 |
|
3, 4 měsíce |
Česká republika |
182 |
84,6 [78,5; 89,51 |
90 |
2,2 [0,3; 7,81 |
|
2, 3 až 4 měsíce |
Latinská Amerika; 11 zemí |
393 |
77,9 % [73,8; 81,6] |
341 |
15,1 % [11,7; 19,01 |
|
10, 14 týdnů a 6, 10, 14 týdnů (souhrnně) |
Severní Afrika, Malawi |
221 |
58,4 [51,6; 64,9] |
111 |
22,5 [15,1; 31,41 |
Ve třech srovnávacích kontrolovaných studiích byla imunitní odpověď vyvolaná tekutou formou vakcíny Rotarix srovnatelná s imunitní odpovědí vyvolanou lyofilizovanou formou vakcíny Rotarix.
Imunitní odpověď u předčasně narozených dětí
Imunogenicita vakcíny Rotarix byla v klinické studii s předčasně narozenými dětmi, které se narodily po alespoň 27. týdnu gestačního věku, stanovena u podskupiny 147 subjektů a bylo prokázáno, že Rotarix je v této populaci imunogenní: 1 měsíc po podání druhé dávky vakcíny dosáhlo titrů sérových anti-rotavirových IgA protilátek > 20 U/ml (podle ELISA) 85,7 % subjektů (95% CI:79,0; 90,9).
|
Země období (věk) |
Kmeny věkové rozpětí |
N $ (případy/kontroly) |
Účinnost % [95% CI] |
Délka sledování |
|
studie sponzorované společností GSK | ||||
|
Belgie 2008 - 2010 < 4 roky |
všechny 3 - 11 m > 12 m |
160/198 |
90 [81; 95] 91 [75; 97] 90 [76; 96) |
2,4 let |
|
G1P[8] |
41/53 |
95 [78; 99] | ||
|
G2P[4] 3 - 11 m > 12 m |
80/103 |
85 [64; 94] 83 [11; 96] J 86 [58; 95] J | ||
|
Brazílie (Belém) 2008 - 2009 < 3 roky |
všechny 3 - 11 m > 12 m |
249/249 £ |
76 [58; 86] 96 [68; 99] 65 [37; 81) |
1 rok |
|
G2P[4] 3 - 11 m > 12 m |
222/222 £ |
75 [57; 86] 95 [66; 99] J 64 [34; 81] J | ||
|
Brazílie (Recife) 2006 - 2008 < 5 let |
všechny 6 - 11 m > 12 m |
NA § |
NA 81 [47; 93] 5 [< 0; 69] * |
2,5 let |
|
G2P[4] 6 - 11 m > 12 m |
61/424 § |
NA 85 [54; 95] 5 [< 0; 69] * | ||
|
všechny 6 - 11 m > 12 m |
NA f |
NA 80 [48; 92] 41 [< 0; 81] * | ||
|
G2P[4] 6 - 11 m > 12 m |
61/371 f |
NA 83 [51; 94] 41 [< 0; 81] * | ||
|
Singapur 2008 - 2010 < 5 let |
Všechny |
136/272 |
84 [32; 96] |
2 roky |
|
G1P[8] |
89/89 |
91 [30; 99] | ||
|
Ostatní studie | ||||
|
Salvádor 2007 - 2009 < 2 roky |
všechny 6 - 11 m > 12 m |
251/770 £ |
76 [64; 84] ** 83 [68; 91] 59 [27; 77] |
2,5 let |
m: měsíce
NA: není k dispozici
$ Počet plně očkovaných (2 dávky) a neočkovaných případů a kontrol.
£ Účinnost vakcíny byla vypočtena využitím sousedů jako kontrol.
§ Účinnost vakcíny byla vypočtena využitím hospitalizovaných rotavirus- negativních kontrol. f Účinnost vakcíny byla vypočtena využitím hospitalizovaných kontrol s akutní infekcí respiračního traktu.
* Statisticky nevýznamné (p > 0,05). Tato data mají být interpretována s opatrností.
**U jedinců, kteří neobdrželi celé očkovací schéma, byla účinnost po jedné dávce 51 % (95% CI: 26; 67).
J Data z post-hoc analýz.
Dopad na úmrtnost'''
Dopadové studie (Impact studies) s vakcínou Rotarix provedené v Panamě, Brazílii a Mexiku ukázaly, že v průběhu 2 až 3 let po zahájení očkování poklesla úmrtnost na průjem z jakékoli příčiny u dětí mladších 5 let věku v rozsahu od 22 % do 56 %.
V retrospektivní studii databáze v Belgii provedené u dětí ve věku 5 let a mladších byl dva roky po zahájení očkování přímý i nepřímý dopad očkování vakcínou Rotarix na hospitalizaci spojenou s rotavirem v rozsahu od 64 % (95% CI: 49; 76) do 80 % (95% CI: 77; 83). Podobné studie ukázaly snížení o 59 % v Brazílii, o 75 % v Austrálii a o 81 % v Salvádoru. Navíc tři dopadové studie provedené v Latinské Americe ukázaly, že dva roky po zahájení očkování se snížil výskyt případů průjmů z jakékoliv příčiny spojených s hospitalizací o 29 % až 37 %.
§POZNÁMKA: dopadové studie mají zjistit časovou souvislost, ale ne příčinnou souvislost mezi onemocněním a očkováním. Přirozená fluktuace výskytu onemocnění může rovněž ovlivnit pozorovaný časový efekt.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Sacharosa Dinatrium-adipát Živná půda (DMEM)
Sterilisovaná čištěná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Vakcína se má použít ihned po otevření.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
1.5 ml perorální suspenze ve stlačitelné tubě (polyethylen) opatřené membránou a ochranným krytem (polypropylen) v baleních o velikosti 1, 10 nebo 50.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Vakcína je čirá bezbarvá tekutina bez viditelných částic, určená k perorálnímu podání.
Vakcína je připravena k použití (není nutné ji rekonstituovat ani ředit).
Vakcína se podává perorálně bez mísení s žádnými jinými vakcínami nebo roztoky.
Vakcína by měla být před aplikací vizuálně zkontrolována, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled. Pokud jsou pozorovány cizorodé částice nebo změna vzhledu, je třeba vakcínu vyřadit.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod na aplikaci vakcíny:
Před podáním této vakcíny si prosím pečlivě přečtěte všechny níže uvedené pokyny.

A Co musíte udělat dříve než použijete vakcínu Rotarix
• Zkontrolujte dobu použitelnosti.
• Zkontrolujte, zda tuba nebyla poškozena, ani nebyla již otevřena.
• Zkontrolujte, zda suspenze je čirá a bezbarvá, bez cizích částic.
Pokud zjistíte nějakou odchylku, vakcínu neužívejte.
• Vakcína se podává perorálně - přímo z tuby.
• Je připravená k podání - s ničím ji nemusíte mísit.


B Příprava tuby
1. Sejměte kryt
• Ponechte si kryt - musíte jím propíchnout membránu.
• Držte tubu ve svislé poloze.
2. Opakovaně cvrnkněte prstem do horní části tuby, dokud nebude odstraněna veškerá suspenze
• Odstraňte suspenzi z nejužší části tuby cvrnkáním právě pod membranou.
3. Umístění krytu při otevření tuby
• Držte tubu ve svislé poloze.
• Držte tubu po stranách.
• Uvnitř horní části krytu je malý hrot - ve středu.
• Otočte kryt obráceně (180°).
4. Otevření tuby



• Nemusíte tubou točit. Zasunutím krytu dolů propíchněte membránu.
• Pak zvedněte kryt.
C Zkontrolujte, že tuba byla otevřena správně
1. Zkontrolujte, že membrána byla propíchnuta
• Na vrcholu tuby má být otvor.
2. Co máte dělat, pokud membrána nebyla propíchnuta
• Pokud membrána nebyla propíchnuta, vraťte se k bodu B a opakujte kroky 2, 3 a 4.
D Podání vakcíny
• Jakmile je tuba otevřena, zkontrolujte, zda suspenze je čirá bez cizích částic. Pokud zjistíte nějakou odchylku, vakcínu neužívejte.
• Vakcínu ihned podejte.
1. Poloha dítěte při podání vakcíny
• Posaďte dítě lehce zakloněné dozadu.
2. Aplikace vakcíny
• Jemně vymačkejte suspenzi do úst dítěte - na vnitřní stranu tváře.
• Při podání celé dávky vakcíny budete muset tubu stlačovat opakovaně - je v pořádku, že Vám trošku zůstane v hrotu tuby.
Prázdnou tubu a ochranný kryt vyhoďte do kontejneru určeného pro biologické odpady v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a.
Rue de l'Institut 89 B-1330 Rixensart, Belgie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/330/009
EU/1/05/330/010
EU/1/05/330/011
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. února 2006
Datum posledního prodloužení registrace: 24. leden 2011
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY/LÁTEK A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY/LÁTEK A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa vvrobce/vvrobců biologické léčivé látky/biologických léčivých látek
GlaxoSmithKline Biologicals s.a.
Pare de la Noire Epine Rue Fleming, 20 1300 Wavre Belgie
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89,
1330 Rixensart Belgie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl.
107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace, a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
• Povinnost uskutečnit poregistrační opatření
Za účelem určení přítomnosti prasečího circoviru typu I (PCV-1) ve vakcíně Rotarix se držiteli rozhodnutí o registraci ukládá:
• Vývoj vakcín neobsahujících PCV dle realizačního plánu, který je dohodnut s CHMP. Tento plán má být předložen nejpozději do 30. června 2016.
• Poskytovat aktuální informace o postupu výroby v 6měsíčních periodách.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
SKLENĚNÝ KONTEJNER S PERORÁLNÍM APLIKÁTOREM A ADAPTÉREM, VELIKOST BALENÍ 1, 5, 10 NEBO 25
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Rotarix prášek pro perorální suspenzi s rozpouštědlem Živá rotavirová vakcína
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 dávka (1 ml) po rekonstituci obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum* ne méně než 106,0 CCID50
*Pomnožený na Vero buňkách
3. SEZNAM POMOCNÝCH LÁTEK
Prášek: sacharosa. sorbitol
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek pro přípravu perorální suspenze s rozpouštědlem
1 skleněný obal: prášek 1 perorální aplikátor: rozpouštědlo 1 převodní adaptér 1 dávka (1 ml)
5 skleněných obalů: prášek 5 perorálních aplikátorů: rozpouštědlo 5 převodních adaptérů 5x 1 dávka (1 ml)
10 skleněných obalů: prášek 10 perorálních aplikátorů: rozpouštědlo 10 převodních adaptérů 10x 1 dávka (1 ml)
25 skleněných obalů: prášek 25 perorálních aplikátorů: rozpouštědlo 25 převodních adaptérů 25x 1 dávka (1 ml)
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Perorální podání
Nepodávejte injekčně!
Před použitím protřepat.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Doba použitelnosti po rekonstituci vakcíny je uvedena v příbalové informaci. EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Likvidujte v souladu s místními předpisy.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/05/330/001 - velikost balení 1 (skleněný obal + perorální aplikátor + převodní adaptér) EU/1/05/330/002 - velikost balení 5 (skleněný obal + perorální aplikátor + převodní adaptér) EU/1/05/330/003 - velikost balení 10 (skleněný obal + perorální aplikátor + převodní adaptér) EU/1/05/330/004 - velikost balení 25 (skleněný obal + perorální aplikátor + převodní adaptér)
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH
PERORÁLNÍ APLIKÁTOR S ROZPOUŠTĚDLEM URČENÝM K REKONSTITUCI PRÁŠKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
3. POUŽITELNOST
4. ČÍSLO ŠARŽE
5. JINÉ

MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU SKLENĚNÝ KONTEJNER S PRÁŠKEM URČENÝM K REKONSTITUCI ROZPOUŠTĚDLEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rotarix
Prášek properorální suspenzi Živá rotavirová vakcína Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka
6. JINÉ
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU
PERORÁLNÍ APLIKÁTOR S ROZPOUŠTĚDLEM URČENÝM K REKONSTITUCI
PRÁŠKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro Rotarix Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (1 ml)
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Rotarix perorální suspenze v předplněném perorálním aplikátoru Živá rotavirová vakcína
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 dávka (1,5 ml) obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum ne méně než 106,0 CCID50
3. SEZNAM POMOCNÝCH LÁTEK
Sacharosa
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Perorální suspenze v předplněném perorálním aplikátoru 1 předplněný perorální aplikátor 1 dávka (1,5 ml)
5 předplněných perorálních aplikátorů 5x 1 dávka (1,5 ml)
10 předplněných perorálních aplikátorů 10x 1 dávka (1,5 ml)
25 předplněných perorálních aplikátorů 25x 1 dávka (1,5 ml)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání Nepodávejte injekčně!
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Připraveno k použití.
Není nutné rekonstituovat.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Likvidujte v souladu s místními předpisy.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/05/330/005 - balení s 1 předplněným perorálním aplikátorem EU/1/05/330/006 - balení s 5 předplněnými perorálními aplikátory EU/1/05/330/007 - balení s 10 předplněnými perorálními aplikátory EU/1/05/330/008 - balení s 25 předplněnými perorálními aplikátory
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Rotarix perorální suspenze Živá rotavirová vakcína
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 dávka (1,5 ml) obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum ne méně než 106,0 CCID50
3. SEZNAM POMOCNÝCH LÁTEK
Sacharosa
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Perorální suspenze 1 tuba
1 dávka (1,5 ml)
10 tub
10x 1 dávka (1,5 ml)
50 tub
50x 1 dávka (1,5 ml)
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Perorální podání Nepodávejte injekčně!
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ

Před podáním vakcíny si přečtěte tyto pokyny.

Tato vakcína je určena pouze k perorálnímu podání.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Likvidujte v souladu s místními předpisy.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/05/330/009 - balení s 1 tubou EU/1/05/330/010 - balení s 10 tubami EU/1/05/330/011 - balení s 50 tubami
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
3. POUŽITELNOST
4. ČÍSLO ŠARŽE
5. JINÉ

1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rotarix
Perorální suspenze Živá rotavirová vakcína Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (1,5 ml)
6. JINÉ
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU TUBA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rotarix
Perorální suspenze Živá rotavirová vakcína Perorální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (1,5 ml)
6. JINÉ
Rotarix prášek pro perorální suspenzi s rozpouštědlem
Živá rotavirová vakcína
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno, protože obsahuje pro Vás důležité údaje.
- Ponechte si tuto příbalovou informaci. Je možné, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tato vakcína byla předepsána pouze Vašemu dítěti. Nedávejte ji žádné další osobě.
- Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Rotarix a k čemu se používá
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Rotarix
3. Jak se Rotarix podává
4. Možné nežádoucí účinky
5. Jak Rotarix uchovávat
6. Obsah balení a další informace
1. Co je Rotarix a k čemu se používá
Rotarix je virová vakcína obsahující živé, oslabené lidské rotaviry, která pomáhá chránit Vaše dítě od 6 týdnů věku před gastroenteritidou (průjem a zvracení) způsobenou rotavirovou infekcí.
Jak Rotarix působí:
Rotavirová infekce je nejčastější příčinou vážného průjmu u kojenců a malých dětí. Rotavirus se snadno přenáší z ruky do úst při kontaktu se stolicí infikované osoby. Většina dětí s rotavirovým průjmem se uzdraví sama. Ale některé děti velmi onemocní a nemoc je doprovázena vážným zvracením, průj mem a život ohrožující ztrátou tekutin vyžadující hospitalizaci.
Když j e jedinci podána vakcína, imunitní systém (přirozená obrana těla) si vytvoří protilátky proti nejčastěji se vyskytujícím typům rotavirů. Tyto protilátky chrání proti nemoci způsobené těmito typy rotaviru.
Tak, jak je tomu u všech vakcín, ani Rotarix nemusí úplně chránit všechny očkované osoby před rotavirovými infekcemi, kterým má zabránit.
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Rotarix
Nepoužívejte Rotarix:
• jestliže Vaše dítě mělo v minulosti jakoukoli alergickou reakci na rotavirové vakcíny nebo na kteroukoli složku této vakcíny (uvedenou v bodě 6). Projevy alergické reakce mohou zahrnovat svědivé kožní vyrážky, dýchací potíže a otok tváře nebo jazyka.
• jestliže Vaše dítě mělo v minulosti intususcepci (neprůchodnost střev, při níž se jedna část střeva vsune do sousední části).
• jestliže se Vaše dítě narodilo s vrozenou vadou střeva, která by ho činila náchylným k intususcepci.
• jestliže má Vaše dítě vzácné dědičné onemocnění, které ovliňuje imunitní systém, nazývané těžký kombinovaný imunodeficit (SCID).
• jestliže Vaše dítě má závažnou infekci s vysokou horečkou. Je možné, že bude nutné odložit očkování, dokud se neuzdraví. Slabá infekce jako například rýma, by neměla představovat problém, ale řekněte o tom nejdřív Vašemu lékaři.
• jestliže Vaše dítě má průjem nebo zvrací. Je možné, že bude nutné odložit očkování, dokud se neuzdraví.
Upozornění a opatření
Než Vaše dítě obdrží vakcínu Rotarix poraďte se se svým lékařem/poskytovatelem zdravotní péče, pokud dítě:
• je v blízkém kontaktu s osobou, například s členem domácnosti, která má oslabený imunitní systém, to je například osoba trpící rakovinou nebo osoba užívající léky, které mohou oslabovat imunitní systém.
• má jakoukoli poruchu gastrointestinálního systému.
• nepřibírá na hmotnosti a neroste tak, jak se očekává.
• trpí jakýmkoli onemocněním nebo užívá jakékoli léky, které snižují jeho odolnost vůči infekci.
Pokud po podání vakcíny Rotarix pozorujete u Vašeho dítěte závažnou bolest žaludku, úporné zvracení, krev ve stolici, otok břicha a/nebo vysokou horečku, ihned kontaktujte svého lékaře/poskytovatele zdravotní péče (viz rovněž bod 4 „Možné nežádoucí účinky“).
Tak jako vždy, dbejte prosím na to, abyste si po výměně zašpiněných dětských plen důkladně myli ruce.
Další léčivé přípravky a vakcína Rotarix
Informujte svého lékaře o všech lécích, které Vaše dítě užívá, které v nedávné době užívalo, nebo které možná bude užívat, nebo jestli v poslední době dostalo nějakou jinou vakcínu.
Rotarix může být Vašemu dítěti podán současně s dalšími běžně doporučovanými vakcínami, jako jsou vakcíny proti záškrtu, tetanu, pertusi (dávivému kašli), vakcína proti Haemophilus influenzae typu b, perorální nebo inaktivovaná vakcína proti dětské obrně, vakcína proti hepatitidě B stejně jako konjugovaná pneumokoková a meningokoková vakcína séroskupiny C.
Rotarix s jídlem a pitím
Před ani po očkování nejsou žádná omezení týkající se konzumace jídla nebo tekutin.
Kojení
Na základě údajů získaných v klinických studiích nesnižuje kojení ochranu proti rotavirové gastroenteritidě vyvolanou vakcínou Rotarix. V době očkování je tedy možné pokračovat v kojení.
Rotarix obsahuje sacharosu a sorbitol
Pokud Vám lékař sdělil, že očkované dítě nesnáší některé cukry, obraťte se před podáním této vakcíny na svého lékaře.
3. Jak se Rotarix podává
Doporučenou dávku vakcíny Rotarix podá Vašemu dítěti lékař nebo zdravotní sestra. Vakcína (1 ml tekutiny) bude podána perorálně. Tato vakcína nesmí být za žádných okolností podána injekčně.
Vaše dítě dostane dvě dávky vakcíny. Každá dávka bude podána samostatně ve vhodné době s časovým odstupem nejméně 4 týdnů mezi oběma dávkami. První dávka se může podávat od 6 týdnů věku. Obě dávky vakcíny se musí podat do 24. týdne věku, měly by se však podat pokud možno před dosažením věku 16 týdnů.
Podle stejného očkovacího schématu lze Rotarix podat předčasně narozeným dětem, pod podmínkou, že těhotenství trvalo alespoň 27 týdnů.
V případě, že Vaše dítě vyplivne nebo vyzvrátí většinu podané dávky vakcíny, je možné podat při stejné návštěvě jednu náhradní dávku.
Pokud je Vašemu dítěti jako první dávka podán Rotarix, doporučuje se, aby Vaše dítě jako druhou dávku dostalo také Rotarix a ne jinou rotavirovou vakcínu.
Je důležité, abyste se ve věci následných návštěv řídili pokyny Vašeho lékaře nebo zdravotní sestry. Pokud zapomenete přijít k lékaři v naplánované době, požádejte lékaře o radu.
4. Možné nežádoucí účinky
Podobně jako všechny léky může i tato vakcína způsobit nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Následující nežádoucí účinky se mohou vyskytnout s touto vakcínou:
♦ Časté (mohou se vyskytnout až u 1 na 10 dávek vakcíny):
• Průjem;
• Podrážděnost.
♦ Méně časté (mohou se vyskytnout až u 1 na 100 dávek vakcíny):
• Nadýmání, bolest břicha;
• Zánět kůže.
Nežádoucí účinky, které byly hlášeny v průběhu podávání vakcíny Rotarix:
• Velmi vzácné: intususcepce (část střeva je neprůchozí nebo vchlípená). Příznaky se mohou projevovat jako závažná bolest žaludku, přetrvávající zvracení, příměs krve ve stolici, otok břicha a/nebo vysoká teplota.
• Krev ve stolici.
• U velmi předčasně narozených dětí (narozených v nebo před 28. týdnem těhotenství) se mohou 2. až 3. den po očkování objevit pauzy mezi jednotlivými dechy, které jsou delší než normálně.
• Děti se vzácným dědičným onemocněním nazývaným těžký kombinovaný imunodeficit (SCID) mohou trpět zánětem žaludku nebo střev (gastroenteritis) a vylučovat virus stolicí. Příznaky gastroenteritidy mohou zahrnovat pocity nevolnosti, nevolnost, žaludeční křeče nebo průjem.
Hlášení nežádoucích účinků
Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Rotarix uchovávat
Uchovávejte mimo dohled a dosah dětí.
Nepoužívejte tuto vakcínu po uplynutí doby použitelnosti, uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu aby byl přípravek chráněn před světlem.
Po rekonstituci by se vakcína obsažená v perorálním aplikátoru měla okamžitě aplikovat. Pokud rekonstituovaná vakcína není použita během 24 hodin, měla by být znehodnocena.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Rotarix obsahuje
Léčivými látkami jsou:
Rotavirus RIX4414 humanum vivum attenuatum*
ne méně než 106,0 CCID:
'50
*Pomnožený na Vero buňkách
- Dalšími pomocnými látkami vakcíny Rotarix jsou:
Prášek: dextran, sacharosa, sorbitol (viz rovněž bod 2, Rotarix obsahuje sacharosu a sorbitol), aminokyseliny, živná půda (DMEM).
Rozpouštědlo: uhličitan vápenatý, xanthanová klovatina, sterilisovaná čištěná voda.
Jak vakcína Rotarix vypadá a co obsahuje toto balení
Prášek pro perorální suspenzi s rozpouštědlem.
Rotarix je dodáván ve formě bělavého prášku ve skleněném obalu obsahujícím jednu dávku a se samostatným perorálním aplikátorem s rozpouštědlem, který obsahuje pomalu se usazující bílý sediment a bezbarvý supernatant. Dodává se s převodním adaptérem, který umožňuje snadné přenesení rozpouštědla do skleněného obalu s práškem a smísení různých součástí vakcíny.
Před podáním vakcíny Vašemu dítěti musí být obě součásti smíseny dohromady. Smísená vakcína bude vypadat o něco zakalenější než samotné rozpouštědlo.
Rotarix je dostupný v baleních po 1, 5, 10 a 25 dávkách.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien Lietuva
GlaxoSmithKline Pharmaceuticals s.a./n.v. GlaxoSmithKline Lietuva UAB
Tél/Tel: + 32 10 85 52 00
Tel: +370 5 264 90 00
Eunrapnu
rnaKcoCMHTKaaňH EOOfl
Ten. + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Eesti
GlaxoSmithKline Eesti OU Tel: +372 667 6900 estonia@gsk.com
EXlába
GlaxoSmithKline A.E.B.E Tr(k: + 30 210 68 82 100
Espaňa
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700 es-ci@gsk.com
France
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com
Hrvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
Ireland
GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000
Ísland Vistor hf
Sími: +354 535 7000
Italia
GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11
Kúnpoq
Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
Malta
GlaxoSmithKline (Malta) Ltd Tel: + 356 21 238131
Nederland
KG GlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100 nlinfo@gsk.com
Norge
GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Portugal
Smith Kline & French Portuguesa, Produtos Farmaceuticos, Lda.
Tel: + 351 21 412 95 00 FI.PT@gsk.com
Románia
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Slovenija
GlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com
Slovenská republika
GlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com
Suomi/Finland
GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com
Sverige
GlaxoSmithKline (Cyprus) Ltd Tpk: + 357 22 39 70 00 gskcyprus@gsk.com
Latvija
GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com
GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com
United Kingdom
GlaxoSmithKline UK Tel: + 44 (0) 800 221 441 customercontactuk@gsk.com
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o léčivém tomto přípravku jsou k dispozici na webových stránkách Evropské agentury pro lékové přípravky: http://www.ema.europa.eu.
Následující informace je určena pouze pro zdravotnické pracovníky:
Před rekonstitucí
V perorálním aplikátoru obsahujícím rozpouštědlo lze při uchovávání pozorovat bílý sediment a čirý supernatant.
Před rekonstitucí by rozpouštědlo mělo být vizuálně zkontrolováno, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled.
Po rekonstituci
Rekonstituovaná vakcína je trochu více zakalená než rozpouštědlo a má mléčně bílý vzhled.
Také rekonstituovaná vakcína by měla být před aplikací vizuálně zkontrolována, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled. Pokud jsou pozorovány cizorodé částice nebo změna vzhledu, je třeba vakcínu vyřadit.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod na rekonstituci a aplikaci vakcíny:
8. Natáhněte veškerou směs zpět do perorálního aplikátoru.
9. Odstraňte perorální aplikátor od převodního adaptéru.



|
4. Odstraňte ochranný uzávěr z perorálního aplikátoru. |
5. Nasaďte perorální aplikátor na převodní adaptér a silně jej do něho zatlačte. |
6. Přeneste plný obsah perorálního aplikátoru do skleněného kontejneru obsahujícího prášek. | ||


7. Skleněný obal se stále připojeným perorálním aplikátorem protřepejte a zkontrolujte, zda se prášek úplně
rozpustil. Rekonstituovaná vakcína bude vypadat o trochu více zakalená než samotné rozpouštědlo. Tento vzhled je normální.





3. Perorální aplikátor obsahující rozpouštědlo řádně protřepejte. Protřepaná suspenze se bude jevit jako zakalená tekutina s pomalu se oddělujícím bílým sedimentem.
1. Odstraňte plastový kryt ze skleněného obalu obsahujícího prášek.
2. Nasaďte převodní adaptér na skleněný obal a tlačte ho směrem dolů, dokud není převodní adaptér správně a bezpečně připojen.
10. T ato vakcína je určena pouze k perorálnímu podání. Dítě by se mělo usadit do zakloněné polohy. Aplikujte plný obsah perorálního aplikátoru perorálně (podáním plného obsahu perorálního aplikátoru na vnitřní stranu tváře).
11. Nepodávejte injekčně.
Pokud se má rekonstituovaná vakcína před podáním dočasně uchovávat, nasaďte znovu na perorální aplikátor ochranný uzávěr. Perorální aplikátor obsahující rekonstituovanou vakcínu se má před perorálním podáním znovu lehce protřepat. Nepodávejte injekčně.
Rotarix perorální suspenze v předplněném perorálním aplikátoru
Živá rotavirová vakcína
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno, protože obsahuje pro Vás důležité údaje.
- Ponechte si tuto příbalovou informaci. Je možné, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tato vakcína byla předepsána pouze Vašemu dítěti. Nedávejte ji žádné další osobě.
- Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Rotarix a k čemu se používá
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Rotarix
3. Jak se Rotarix podává
4. Možné nežádoucí účinky
5. Jak Rotarix uchovávat
6. Obsah balení a další informace
1. Co je Rotarix a k čemu se používá
Rotarix je virová vakcína obsahující živé, oslabené lidské rotaviry, která pomáhá chránit Vaše dítě od 6 týdnů věku před gastroenteritidou (průjem a zvracení) způsobenou rotavirovou infekcí.
Jak Rotarix působí:
Rotavirová infekce je nejčastější příčinou vážného průjmu u kojenců a malých dětí. Rotavirus se snadno přenáší z ruky do úst při kontaktu se stolicí infikované osoby. Většina dětí s rotavirovým průjmem se uzdraví sama. Ale některé děti velmi onemocní a nemoc je doprovázena vážným zvracením, průjmem a život ohrožující ztrátou tekutin vyžadující hospitalizaci.
Když je jedinci podána vakcína, imunitní systém (přirozená obrana těla) si vytvoří protilátky proti nejčastěji se vyskytujícím typům rotavirů. Tyto protilátky chrání proti nemoci způsobené těmito typy rotavirů.
Tak, jak je tomu u všech vakcín, ani Rotarix nemusí úplně chránit všechny očkované osoby před rotavirovými infekcemi, kterým má zabránit.
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Rotarix
Nepoužívejte Rotarix:
• jestliže Vaše dítě mělo v minulosti jakoukoli alergickou reakci na rotavirové vakcíny nebo na kteroukoli složku této vakcíny (uvedenou v bodě 6). Projevy alergické reakce mohou zahrnovat svědivé kožní vyrážky, dýchací potíže a otok tváře nebo jazyka.
• jestliže Vaše dítě mělo v minulosti intususcepci (neprůchodnost střev, při níž se jedna část střeva vsune do sousední části).
• jestliže se Vaše dítě narodilo s vrozenou vadou střeva, jež by ho činila náchylným k intususcepci.
• jestliže má Vaše dítě vzácné dědičné onemocnění, které ovliňuje imunitní systém, nazývané těžký kombinovaný imunodeficit (SCID).
• jestliže Vaše dítě má závažnou infekci s vysokou horečkou. Je možné, že bude nutné odložit očkování, dokud se neuzdraví. Slabá infekce jako například rýma, by neměla představovat problém, ale řekněte o tom nejdřív Vašemu lékaři.
• jestliže Vaše dítě má průjem nebo zvrací. Je možné, že bude nutné odložit očkování, dokud se neuzdraví.
Upozornění a opatření
Než Vaše dítě obdrží vakcínu Rotarix poraďte se se svým lékařem/poskytovatelem zdravotní péče, pokud Vaše dítě:
• je v blízkém kontaktu s osobou, například s členem domácnosti, která má oslabený imunitní systém, to je například osoba trpící rakovinou nebo osoba užívající léky, které mohou oslabovat imunitní systém.
• má jakoukoli poruchu gastrointestinálního systému.
• nepřibírá na hmotnosti a neroste tak, jak se očekává.
• trpí jakýmkoli onemocněním nebo užívá jakékoli léky, které snižují jeho odolnost vůči infekci.
Pokud po podání vakcíny Rotarix pozorujete u Vašeho dítěte závažnou bolest žaludku, úporné zvracení, krev ve stolici, otok břicha a/nebo vysokou horečku, ihned kontaktujte svého lékaře/poskytovatele zdravotní péče (viz rovněž bod 4 „Možné nežádoucí účinky“).
Tak jako vždy, dbejte prosím na to, abyste si po výměně zašpiněných dětských plen důkladně myli ruce.
Další léčivé přípravky a vakcína Rotarix
Prosím, informujte svého lékaře o všech lécích, které Vaše dítě užívá, které v nedávné době užívalo, nebo které možná bude užívat, nebo jestli v poslední době dostalo nějakou jinou vakcínu.
Rotarix může být Vašemu dítěti podán současně s dalšími běžně doporučovanými vakcínami, jako jsou vakcíny proti záškrtu, tetanu, pertusi (dávivému kašli), vakcína proti Haemophilus influenzae typu b, perorální nebo inaktivovaná vakcína proti dětské obrně, vakcína proti hepatitidě B stejně jako konjugovaná pneumokoková a meningokoková vakcína séroskupiny C.
Rotarix s jídlem a pitím
Před ani po očkování nejsou žádná omezení týkající se konzumace jídla nebo tekutin.
Kojení
Na základě údajů získaných v klinických studiích nesnižuje kojení ochranu proti rotavirové gastroenteritidě vyvolanou vakcínou Rotarix. V době očkování je tedy možné pokračovat v kojení.
Rotarix obsahuje sacharosu a sorbitol
Pokud Vám lékař sdělil, že očkované dítě nesnáší některé cukry, obraťte se před podáním této vakcíny na svého lékaře.
3. Jak se Rotarix podává
Doporučenou dávku vakcíny Rotarix podá Vašemu dítěti lékař nebo zdravotní sestra. Vakcína (1,5 ml tekutiny) bude podána perorálně. Tato vakcína nesmí být za žádných okolností podána injekčně.
Vaše dítě dostane dvě dávky vakcíny. Každá dávka bude podána samostatně ve vhodné době s časovým odstupem nejméně 4 týdnů mezi oběma dávkami. První dávka se může podávat od 6 týdnů věku. Obě dávky vakcíny se musí podat do 24. týdne věku, měly by se však podat pokud možno před dosažením věku 16 týdnů.
Podle stejného očkovacího schématu lze Rotarix podat předčasně narozeným dětem, pod podmínkou, že těhotenství trvalo alespoň 27 týdnů.
V případě, že Vaše dítě vyplivne nebo vyzvrátí většinu podané dávky vakcíny, je možné podat při stejné návštěvě jednu náhradní dávku.
Pokud je Vašemu dítěti jako první dávka podán Rotarix, doporučuje se, aby Vaše dítě jako druhou dávku dostalo také Rotarix a ne jinou rotavirovou vakcínu.
Je důležité, abyste se ve věci následných návštěv řídili pokyny Vašeho lékaře nebo zdravotní sestry. Pokud zapomenete přijít k lékaři v naplánované době, požádejte lékaře o radu.
4. Možné nežádoucí účinky
Podobně jako všechny léky může i tato vakcína způsobit nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Následující nežádoucí účinky se mohou vyskytnout s vakcínou Rotarix:
♦ Časté (mohou se vyskytnout až u 1 na 10 dávek vakcíny):
• Průjem;
• Podrážděnost.
♦ Méně časté (mohou se vyskytnout až u 1 na 100 dávek vakcíny):
• Nadýmání; bolest břicha;
• Zánět kůže.
Nežádoucí účinky, které byly hlášeny v průběhu podávání vakcíny Rotarix:
• Velmi vzácné: intususcepce (část střeva je neprůchozí nebo vchlípená). Příznaky se mohou projevovat jako závažná bolest žaludku, přetrvávající zvracení, příměs krve ve stolici, otok břicha a/nebo vysoká teplota.
• Krev ve stolici.
• U velmi předčasně narozených dětí (narozených ve nebo před 28. týdnem těhotenství) se mohou 2. až 3. den po očkování objevit pauzy mezi jednotlivými dechy, které jsou delší než normálně.
• Děti se vzácným dědičným onemocněním nazývaným težký kombinovaný imunodeficit (SCID) mohou trpět zánětem žaludku nebo střev (gastroenteritis) a vylučovat virus stolicí. Příznaky gastroenteritidy mohou zahrnovat pocity nevolnosti, nevolnost, žaludeční křeče nebo průjem.
Hlášení nežádoucích účinků
Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, , sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Rotarix uchovávat
Uchovávejte mimo dohled a dosah dětí.
Nepoužívejte tuto vakcínu po uplynutí doby použitelnosti, uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu aby byl přípravek chráněn před světlem.
Vakcína se má použít ihned po otevření.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Rotarix obsahuje
Léčivými látkami jsou:
Rotavirus RIX4414 humanum vivum attenuatum*
ne méně než 106,0 CCID
'50
*Pomnožený na Vero buňkách
- Dalšími pomocnými látkami vakcíny Rotarix jsou: sacharosa (viz rovněž bod 2, Rotarix obsahuje sacharosu), dinatrium-adipát, živná půda (DMEM), sterilisovaná čištěná voda.
Jak přípravek Rotarix vypadá a co obsahuje toto balení
Perorální suspenze v předplněném perorálním aplikátoru.
Rotarix je dodáván ve formě čiré bezbarvé tekutiny v předplněném perorálním aplikátoru obsahujícím jednu dávku (1,5 ml).
Rotarix je dostupný v baleních po 1, 5, 10 a 25 dávkách.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien Lietuva
GlaxoSmithKline Pharmaceuticals s.a./n.v. GlaxoSmithKline Lietuva UAB
Tél/Tel: + 32 10 85 52 00
Tel: +370 5 264 90 00
Btarapnn
TaaKCoCMHTKaaHH EOOfl
Tea. + 359 2 953 10 34
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00
Malta
GlaxoSmithKline (Malta) Ltd Tel: + 356 21 238131
Deutschland
GlaxoSmithKline GmbH & Co. Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Eesti
GlaxoSmithKline Eesti OU Tel: +372 667 6900 estonia@gsk.com
EXlába
GlaxoSmithKline A.E.B.E T@: + 30 210 68 82 100
Espaňa
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700 es-ci@gsk.com
France
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com
Nederland
KG GlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100 nlinfo@gsk.com
Norge
GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Hrvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
Ireland
GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000
Ísland Vistor hf.
Sími: +354 535 7000
Kúnpoq
GlaxoSmithKline (Cyprus) Ltd T@: + 357 22 39 70 00 gskcyprus@gsk.com
Latvija
GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com
Portugal
Smith Kline & French Portuguesa, Produtos Farmaceuticos, Lda.
Tel: + 351 21 412 95 00 FI.PT@gsk.com
Románia
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Slovenija
GlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com
Slovenská republika
GlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com
Suomi/Finland
GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com
Sverige
GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com
United Kingdom
GlaxoSmithKline UK Tel: + 44 (0) 800 221 441 customercontactuk@gsk.com
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
Následující informace je určena pouze pro zdravotnické pracovníky:
Vakcína je čirá bezbarvá tekutina bez viditelných částic, určená k perorálnímu podání.
Vakcína je připravena k použití (není nutné ji rekonstituovat ani ředit).
Vakcína se podává perorálně bez mísení s žádnými jinými vakcínami nebo roztoky.
Vakcína by měla být před aplikací vizuálně zkontrolována, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled. Pokud jsou pozorovány cizorodé částice nebo změna vzhledu, je třeba vakcínu vyřadit.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod na aplikaci vakcíny:

1. Odstraňte ochranný kryt z perorálního aplikátoru.

2. Tato vakcína je určena pouze k perorálnímu podání. Dítě by se mělo usadit do zakloněné polohy. Aplikujte plný obsah perorálního aplikátoru perorálně (t.j. do úst dítěte na vnitřní stranu tváře).

3. Nepodávejte injekčně.
Prázdný perorální aplikátor a ochranný kryt vyhoďte, v souladu s místními požadavky, do kontejneru určeného pro biologické odpady.
Rotarix perorální suspenze
Živá rotavirová vakcína
Přečtěte si pozorně celou příbalovou informaci dříve, než bude Vaše dítě očkováno, protože obsahuje pro Vás důležité údaje.
- Ponechte si tuto příbalovou informaci. Je možné, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tato vakcína byla předepsána pouze Vašemu dítěti. Nedávejte ji žádné další osobě.
- Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Rotarix a k čemu se používá
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Rotarix
3. Jak se Rotarix podává
4. Možné nežádoucí účinky
5. Jak Rotarix uchovávat
6. Obsah balení a další informace
1. Co je Rotarix a k čemu se používá
Rotarix je virová vakcína obsahující živé, oslabené lidské rotaviry, která pomáhá chránit Vaše dítě před gastroenteritidou (průjem a zvracení) způsobenou rotavirovou infekcí.
Jak Rotarix působí:
Rotavirová infekce je nejčastější příčinou vážného průjmu u kojenců a malých dětí. Rotavirus se snadno přenáší z ruky do úst při kontaktu se stolicí infikované osoby. Většina dětí s rotavirovým průjmem se uzdraví sama. Ale některé děti velmi onemocní a nemoc je doprovázena vážným zvracením, průjmem a život ohrožující ztrátou tekutin vyžadující hospitalizaci.
Když je jedinci podána vakcína, imunitní systém (přirozená obrana těla) si vytvoří protilátky proti nejčastěji se vyskytujícím typům rotavirů. Tyto protilátky chrání proti nemoci způsobené těmito typy rotavirů.
Tak, jak je tomu u všech vakcín, ani Rotarix nemusí úplně chránit všechny očkované osoby před rotavirovými infekcemi, kterým má zabránit.
2. Čemu musíte věnovat pozornost, než bude Vaše dítě očkováno vakcínou Rotarix
Nepoužívejte Rotarix:
• jestliže Vaše dítě mělo v minulosti jakoukoli alergickou reakci na rotavirové vakcíny nebo na kteroukoli složku této vakcíny (uvedenou v bodě 6). Projevy alergické reakce mohou zahrnovat svědivé kožní vyrážky, dýchací potíže a otok tváře nebo jazyka.
• jestliže Vaše dítě mělo v minulosti intususcepci (neprůchodnost střev, při níž se jedna část střeva vsune do sousední části).
• jestliže se Vaše dítě narodilo s vrozenou vadou střeva, jež by ho činila náchylným k intususcepci.
• jestliže má Vaše dítě vzácné dědičné onemocnění, které ovliňuje imunitní systém, nazývané těžký kombinovaný imunodeficit (SCID).
• jestliže Vaše dítě má závažnou infekci s vysokou horečkou. Je možné, že bude nutné odložit očkování, dokud se neuzdraví. Slabá infekce jako například rýma, by neměla představovat problém, ale řekněte o tom nejdřív Vašemu lékaři.
• jestliže Vaše dítě má průjem nebo zvrací. Je možné, že bude nutné odložit očkování, dokud se neuzdraví.
Upozornění a opatření
Než Vaše dítě obdrží vakcínu Rotarix poraďte se se svým lékařem/poskytovatelem zdravotní péče, pokud Vaše dítě:
• je v blízkém kontaktu s osobou, například s členem domácnosti, která má oslabený imunitní systém, to je například osoba trpící rakovinou nebo osoba užívající léky, které mohou oslabovat imunitní systém.
• má jakoukoli poruchu gastrointestinálního systému.
• nepřibírá na hmotnosti a neroste tak, jak se očekává.
• trpí jakýmkoli onemocněním nebo užívá jakékoli léky, které snižují jeho odolnost vůči infekci.
Pokud po podání vakcíny Rotarix pozorujete u Vašeho dítěte závažnou bolest žaludku, úporné zvracení, krev ve stolici, otok břicha a/nebo vysokou horečku, ihned kontaktujte svého lékaře/poskytovatele zdravotní péče (viz rovněž bod 4 „Možné nežádoucí účinky“).
Tak jako vždy, dbejte prosím na to, abyste si po výměně zašpiněných dětských plen důkladně myli ruce.
Další léčivé přípravky a vakcína Rotarix
Informujte svého lékaře o všech lécích, které Vaše dítě užívá, které v nedávné době užívalo, nebo které možná bude užívat, nebo jestli v poslední době dostalo nějakou jinou vakcínu.
Rotarix může být Vašemu dítěti podán současně s dalšími běžně doporučovanými vakcínami, jako jsou vakcíny proti záškrtu, tetanu, pertusi (dávivému kašli), vakcína proti Haemophilus influenzae typu b, perorální nebo inaktivovaná vakcína proti dětské obrně, vakcína proti hepatitidě B, stejně jako konjugovaná pneumokoková a meningokoková vakcína séroskupiny C.
Rotarix s jídlem a pitím
Před ani po očkování nejsou žádná omezení týkající se konzumace jídla nebo tekutin.
Kojení
Na základě údajů získaných v klinických studiích nesnižuje kojení ochranu proti rotavirové gastroenteritidě vyvolanou vakcínou Rotarix. V době očkování je tedy možné pokračovat v kojení.
Rotarix obsahuje sacharosu
Pokud Vám lékař sdělil, že očkované dítě nesnáší některé cukry, obraťte se před podáním této vakcíny na svého lékaře.
3. Jak se Rotarix podává
Doporučenou dávku vakcíny Rotarix podá Vašemu dítěti lékař nebo zdravotní sestra. Vakcína (1,5 ml tekutiny) bude podána perorálně. Tato vakcína nesmí být za žádných okolností podána injekčně.
Vaše dítě dostane dvě dávky vakcíny. Každá dávka bude podána samostatně ve vhodné době s časovým odstupem nejméně 4 týdnů mezi oběma dávkami. První dávka se může podávat od 6 týdnů věku. Obě dávky vakcíny se musí podat do 24. týdne věku, měly by se však podat pokud možno před dosažením věku 16 týdnů.
Podle stejného očkovacího schématu lze Rotarix podat předčasně narozeným dětem, pod podmínkou, že těhotenství trvalo alespoň 27 týdnů.
V případě, že Vaše dítě vyplivne nebo vyzvrátí většinu podané dávky vakcíny, je možné podat při stejné návštěvě jednu náhradní dávku.
Pokud je Vašemu dítěti jako první dávka podán Rotarix, doporučuje se, aby Vaše dítě jako druhou dávku dostalo také Rotarix a ne jinou rotavirovou vakcínu.
Je důležité, abyste se ve věci následných návštěv řídili pokyny Vašeho lékaře nebo zdravotní sestry. Pokud zapomenete přijít k lékaři v naplánované době, požádejte lékaře o radu.
4. Možné nežádoucí účinky
Podobně jako všechny léky může i tato vakcína způsobit nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Následující nežádoucí účinky se mohou vyskytnout s touto vakcínou:
♦ Časté (Mohou se vyskytnout až u 1 na 10 dávek vakcíny):
• Průjem;
• Podrážděnost.
♦ Méně časté (Mohou se vyskytnout až u 1 na 100 dávek vakcíny):
• Nadýmání, bolest břicha;
• Zánět kůže.
Nežádoucí účinky, které byly hlášeny v průběhu podávání vakcíny Rotarix:
• Velmi vzácné: intususcepce (část střeva je neprůchozí nebo vchlípená). Příznaky se mohou projevovat jako závažná bolest žaludku, přetrvávající zvracení, příměs krve ve stolici, otok břicha a/nebo vysoká teplota.
• Krev ve stolici.
• U velmi předčasně narozených dětí (narozených ve nebo před 28. týdnem těhotenství) se mohou 2. až 3. den po očkování objevit pauzy mezi jednotlivými dechy, které jsou delší než normálně.
• Děti se vzácným dědičným onemocněním nazývaným težký kombinovaný imunodeficit (SCID) mohou trpět zánětem žaludku nebo střev (gastroenteritis) a vylučovat virus stolicí. Příznaky gastroenteritidy mohou zahrnovat pocity nevolnosti, nevolnost, žaludeční křeče nebo průjem.
Hlášení nežádoucích účinků
Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Rotarix uchovávat
Uchovávejte mimo dohled a dosah dětí.
Nepoužívejte tuto vakcínu po uplynutí doby použitelnosti, uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu aby byl přípravek chráněn před světlem.
Vakcína se má použít ihned po otevření.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Rotarix obsahuje
- Léčivými látkami jsou:
Rotavirus RIX4414 humanum vivum attenuatum* ne méně než 106,0 CCID50
*Pomnožený na Vero buňkách
- Dalšími pomocnými látkami vakcíny Rotarix jsou: sacharosa (viz rovněž bod 2, Rotarix obsahuje sacharosu), dinatrium-adipát, živná půda (DMEM), sterilisovaná čištěná voda.
Jak vakcína Rotarix vypadá a co obsahuje toto balení
Perorální suspenze.
Rotarix je dodáván ve formě čiré bezbarvé tekutiny v tubě obsahující jednu dávku (1,5 ml).
Rotarix je dostupný v baleních po 1, 10 a 50 dávkách.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Bt^rapnn
rnaKcoCMHTKaaňH EOOfl Ten. + 359 2 953 10 34
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
Malta
GlaxoSmithKline (Malta) Ltd Tel: + 356 21 238131
Deutschland
GlaxoSmithKline GmbH & Co. Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Eesti
GlaxoSmithKline Eesti OU Tel: +372 667 6900 estonia@gsk.com
EXlába
GlaxoSmithKline A.E.B.E Tpk: + 30 210 68 82 100
Espaňa
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700 es-ci@gsk.com
France
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com
Nederland
KG GlaxoSmithKline BV
Tel: + 31 (0)30 69 38 100 nlinfo@gsk.com
Norge
GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Ireland
GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000
Hrvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
Ísland Vistor hf.
Sími: +354 535 7000
Italia
GlaxoSmithKline S.p.A. Tel:+ 39 04 59 21 81 11
Kúnpoq
GlaxoSmithKline (Cyprus) Ltd T^k: + 357 22 39 70 00 gskcyprus@gsk.com
Latvija
GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com
Portugal
Smith Kline & French Portuguesa, Produtos Farmaceuticos, Lda.
Tel: + 351 21 412 95 00 FI.PT@gsk.com
Románia
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Slovenija
GlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com
Slovenská republika
GlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com
Suomi/Finland
GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com
Sverige
GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com
United Kingdom
GlaxoSmithKline UK Tel: + 44 (0) 800 221 441 customercontactuk@gsk.com
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
Následující informace je určena pouze pro zdravotnické pracovníky:
Vakcína je čirá bezbarvá tekutina bez viditelných částic, určená k perorálnímu podání.
Vakcína je připravena k použití (není nutné ji rekonstituovat ani ředit).
Vakcína se podává perorálně a nemísí se s žádnými jinými vakcínami nebo roztoky.
Vakcína by měla být před aplikací vizuálně zkontrolována, zda neobsahuje jakékoliv cizorodé částice a/nebo zda není změněn fyzikální vzhled. Pokud jsou pozorovány cizorodé částice nebo změna vzhledu, je třeba vakcínu vyřadit.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod na aplikaci vakcíny:
Před podáním této vakcíny si pečlivě přečtěte všechny níže uvedené pokyny.


A Co musíte udělat dříve než použijete vakcínu Rotarix
• Zkontrolujte dobu použitelnosti.
• Zkontrolujte, zda tuba nebyla poškozena, ani nebyla již otevřena.
• Zkontrolujte, zda suspenze je čirá a bezbarvá, bez cizích částic.
Pokud zjistíte nějakou odchylku, vakcínu neužívejte.
• Vakcína se podává perorálně - přímo z tuby.
• Je připravená k podání - s ničím ji nemusíte mísit.
B Příprava tuby
1. Sejměte kryt
• Ponechte si kryt - musíte jím propíchnout membránu.
• Držte tubu ve svislé poloze.
2. Opakovaně cvrnkněte prstem do horní části tuby, dokud nebude odstraněna veškerá suspenze
• Odstraňte suspenzi z nejužší části tuby cvrnkáním právě pod membranou.
3. Umístění krytu při otevření tuby




• Držte tubu ve svislé poloze.
• Držte tubu postraně.
• Uvnitř horní části krytu je malý hrot - ve středu.
• Otočte kryt obráceně - vzhůru nohama (o 180°).
4. Otevření tuby
• Nemusíte tubou točit. Zasunutím krytu dolů propíchněte membránu.
• Pak zvedněte kryt.
C Zkontrolujte, že tuba byla otevřena správně
1. Zkontrolujte, že membrána byla propíchnuta
• Na vrcholu tuby má být otvor.
2. Co máte dělat, pokud membrána nebyla propíchnuta
• Pokud membrána nebyla propíchnuta, vraťte se k bodu B a opakujte kroky 2, 3 a 4.
D Podání vakcíny
• Jakmile je tuba otevřena, zkontrolujte, zda suspenze je čirá bez cizích částic. Pokud zjistíte nějakou odchylku, vakcínu neužívejte.
• Vakcínu ihned podejte.
1. Poloha dítěte při podání vakcíny
• Posaďte dítě lehce zakloněné dozadu.
2. Aplikace vakcíny
• Jemně vymačkejte suspenzi do úst dítěte - na vnitřní stranu tváře.
• Při podání celé dávky vakcíny budete muset tubu stlačovat opakovaně - je v pořádku, že Vám trošku zůstane v hrotu tuby.
Prázdnou tubu a ochranný kryt vyhoďte do kontejneru určeného pro biologické odpady v souladu s místními požadavky.
84