Risperdal Consta 25 Mg
sp.zn. sukls63531/2015
r O V r
SOUHRN UDAJU O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
RISPERDAL CONSTA 25 mg, prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
RISPERDAL CONSTA 37,5 mg, prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
RISPERDAL CONSTA 50 mg, prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna lahvička obsahuje risperidonum 25 mg.
Jedna lahvička obsahuje risperidonum 37,5 mg.
Jedna lahvička obsahuje risperidonum 50 mg.
1 ml rekonstituované suspenze obsahuje risperidonum 12,5 mg.
1 ml rekonstituované suspenze obsahuje risperidonum 18,75 mg. 1 ml rekonstituované suspenze obsahuje risperidonum 25 mg.
Pomocné látky se známým účinkem 1 ml rekonstituované suspenze obsahuje 3 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním.
Injekční lahvička s práškem
Bílý až krémově bílý, volně rozptýlený prášek.
Předplněná injekční stříkačka s rozpouštědlem k rekonstituci Rozpouštědlo je čirý, bezbarvý roztok.
4. klinické Údaje
4.1 Terapeutické indikace
RISPERDAL CONSTA je indikován k udržovací léčbě schizofrenie u pacientů v současné době stabilizovaných na orálních antipsychoticích.
4.2 Dávkování a způsob podání
Dávkování
Dospělí Úvodní dávka:
Pro většinu pacientů se doporučuje dávka 25 mg 1x za dva týdny intramuskulámě. Pro pacienty na fixní dávce perorálního risperidonu po dva týdny nebo více je vhodné zvážit dále uvedené schéma přechodu. Pacientům léčeným dávkou perorálního risperidonu 4 mg nebo méně se podá 25 mg přípravku RISPERDAL CONSTA, zatímco pacientům léčeným vyššími perorálními dávkami se zváží podání dávky 37,5 mg přípravku RISPERDAL CONSTA.
Pokud pacienti neužívají v současnosti perorální risperidon, je nutno zvážit před výběrem i.m. úvodní dávky léčbu perorální. Doporučená úvodní dávka je 25 mg přípravku RISPERDAL CONSTA 1x za dva týdny. U pacientů na vyšších dávkách perorálních antipsychotik je nutno zvážit vyšší úvodní dávku přípravku RISPERDAL CONSTA, a to 37,5 mg.
Po první aplikaci přípravku RISPERDAL CONSTA je zapotřebí vzhledem ke třem týdnům latence nástupu účinku zajistit po tuto dobu dostatečnou antipsychotickou léčbu perorálním risperidonem nebo předchozím antipsychotikem (viz bod 5.2).
RISPERDAL CONSTA se nesmí používat u akutní exacerbace schizofrenie bez zajištění dostatečné antipsychotické léčby perorálním risperidonem nebo předchozím antipsychotikem vzhledem ke třem týdnům latence po první injekci přípravku RISPERDAL CONSTA.
Udržovací dávka:
Pro většinu pacientů se doporučuje dávka 25 mg 1x za dva týdny intramuskulámě. Pro některé pacienty může být vhodnější vyšší dávka 37,5 mg nebo 50 mg. Nedoporučuje se zvyšovat dávku častěji než jednou za 4 týdny. Výsledek tohoto zvýšení nelze očekávat dříve než za 3 týdny po první injekci vyšší dávky. V klinických studiích nebyl pozorován přínos dávky 75 mg. Vyšší dávky než 50 mg jednou za dva týdny se nedoporučují.
Starší pacienti
Úprava dávky není nutná. Doporučená dávka činí 25 mg 1x za dva týdny intramuskulámě. Pokud pacienti neužívají v současnosti perorální risperidon, je doporučená dávka 25 mg přípravku RISPERDAL CONSTA jednou za dva týdny. Pro pacienty na fixní dávce perorálního risperidonu po dva týdny nebo více je vhodné zvážit dále uvedené schéma přechodu. Pacientům léčeným dávkou perorálního risperidonu 4 mg nebo méně se podá 25 mg přípravku RISPERDAL CONSTA, zatímco pacientům léčeným vyššími perorálními dávkami se zváží podání dávky 37,5 mg přípravku RISPERDAL CONSTA.
Po první aplikaci přípravku RISPERDAL CONSTA je zapotřebí vzhledem ke třem týdnům latence nástupu účinku zajistit po tuto dobu dostatečnou antipsychotickou léčbu (viz bod 5.2). Klinické údaje u starší populace jsou omezené. U starších pacientů je nutno RISPERDAL CONSTA užívat s opatrností.
Porucha funkce jater a ledvin
Použití přípravku RISPERDAL CONSTA nebylo dosud sledováno u pacientů s poruchou funkce jater a ledvin.
V případě potřeby léčby pacientů s poruchou funkce jater nebo ledvin přípravkem RISPERDAL CONSTA se doporučuje zahájit léčbu dávkou 0,5 mg risperidonu 2x denně perorálně první týden. Druhý týden je možno užívat 1 mg risperidonu 2x denně nebo 2 mg 1x denně. Pokud je celková perorální denní dávka nejméně 2 mg dobře snášena, je možno aplikovat injekci přípravku RISPERDAL CONSTA 25 mg 1x za dva týdny.
Po první aplikaci přípravku RISPERDAL CONSTA je zapotřebí vzhledem ke třem týdnům latence nástupu účinku zajistit po tuto dobu dostatečnou antipsychotickou léčbu (viz bod 5.2).
Pediatrická populace
RISPERDAL CONSTA se nedoporučuje k používání u dětí do 18 let věku vzhledem k nedostatku údajů o bezpečnosti a účinnosti.
Způsob podání
RISPERDAL CONSTA se podává jednou za dva týdny hlubokou intramuskulární injekcí do deltového nebo hýžďového svalu za použití vhodné bezpečnostní jehly. Pro podání do deltového svalu se používá 1palcová jehla (25mm) a injekce se podává střídavě do obou paží. Pro podání do hýžďového svalu se používá 2palcová jehla (50mm) a injekce se podává střídavě do obou hýždí. Není určeno pro intravenózní podání (viz body 4.4 a 6.6).
Návod k přípravě a použití přípravku RISPERDAL CONSTA viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Před zahájením léčby přípravkem RISPERDAL CONSTA je zapotřebí u pacientů, kteří dosud nebyli léčeni risperidonem, zjistit snášenlivost perorálního risperidonu (viz bod 4.2).
Starší pacienti s demencí
RISPERDAL CONSTA nebyl studován u starších pacientů s demencí, proto není indikován k použití v této skupině pacientů. RISPERDAL CONSTA není schválen pro léčbu poruch chování spojených s demencí.
Zvýšení mortality u starších osob s demencí
V meta-analýze 17 kontrolovaných klinických studií atypických antipsychotik včetně přípravku RISPERDAL u starších pacientů s demencí léčených atypickými antipsychotiky byla ve srovnání s placebem zvýšena mortalita. V klinických studiích kontrolovaných placebem s perorálním přípravkem RISPERDAL byla v této populaci incidence mortality 4,0 % u pacientů léčených přípravkem RISPERDAL ve srovnání s 3,1 % u skupiny léčené placebem. Poměr odds ratio (95% interval spolehlivosti) byl 1,21 (0,7; 2,1). Průměrný věk (rozmezí) pacientů, kteří zemřeli, byl
86 let (rozmezí 67 - 100). Údaje ze dvou velkých observačních studií ukázaly, že u starších osob s demencí léčených klasickými antipsychotiky je nepatrně zvýšené riziko smrti ve srovnání s osobami, které léčeny nejsou. Neexistují dostatečné údaje, aby bylo možno přesně určit zvýšení tohoto rizika; příčina tohoto rizika není známa. Do jaké míry lze nálezy zvýšené úmrtnosti v observačních studiích spojit s antipsychotiky oproti některým charakteristikám pacientů není jasné.
Současné užívání s furosemidem
V placebem kontrolovaných klinických studiích s perorálně podávaným přípravkem RISPERDAL u starších pacientů s demencí byla kombinace furosemidu a risperidonu spojena
s vyšší incidencí mortality (7,3 %, průměrný věk 89 let, rozmezí 75 - 97) ve srovnání se skupinou léčenou samotným risperidonem (3,1 %, průměrný věk 84 let, rozmezí 70 - 96) nebo samotným furosemidem (4,1 %, průměrný věk 80 let, rozmezí 67 - 90). Zvýšení mortality u pacientů léčených furosemidem spolu s risperidonem bylo pozorováno ve dvou ze čtyř klinických studií. Současné užívání risperidonu s dalšími diuretiky (hlavně thiazidovými diuretiky užívanými v nízké dávce) nebylo s podobnými nálezy spojeno.
Patofyziologický mechanismus k vysvětlení tohoto jevu není znám a žádná konzistentní příčina úmrtí nebyla zjištěna. Přesto však je zapotřebí věnovat této kombinaci nebo současnému podávání dalších vysoce účinných diuretik zvýšenou pozornost a před zahájením léčby touto kombinací posoudit riziko a prospěch. U pacientů užívajících spolu s risperidonem jiná diuretika nedošlo ke zvýšení mortality. Nezávisle na léčbě byla obecným rizikovým faktorem mortality dehydratace, a proto je zapotřebí jí u starších pacientů s demencí zamezit.
Cerebrovaskulární nežádoucí příhody (CVAE)
V randomizovaných placebem kontrolovaných studiích u pacientů s demencí léčených některými atypickými antipsychotiky bylo pozorováno přibližně trojnásobně zvýšené riziko cerebrovaskulárních nežádoucích příhod. Sdružená data ze šesti placebem kontrolovaných klinických studií s přípravkem RISPERDAL u převážně starších pacientů (> 65 let věku)
s demencí ukázala, že CVAE (závažné a nezávažné, kombinované) se vyskytly u 3,3 %
(33/1 009) pacientů léčených risperidonem a u 1,2 % (8/712) pacientů, kterým bylo podáno placebo. Poměr odds ratio (95% interval spolehlivosti) byl 2,96 (1,34; 7,50). Mechanismus tohoto zvýšeného rizika není znám. Zvýšené riziko nelze vyloučit ani pro jiná antipsychotika nebo další populace pacientů. U pacientů s rizikovými faktory pro cerebrovaskulární příhodu je nutno RISPERDAL CONSTA používat s opatrností.
Ortostatická hypotenze
Vzhledem k blokádě alfa-aktivity způsobené risperidonem může docházet k (ortostatické) hypotenzi, zvláště na počátku léčby. V post-marketingu byla pozorována klinicky významná hypotenze při současné léčbě risperidonem a antihypertenzivy. Risperidon by měl být podáván s opatrností pacientům se známým kardiovaskulárním onemocněním (např. při srdečním selhání, infarktu myokardu, poruchách vodivosti, dehydrataci, hypovolemii nebo při cerebrovaskulárním onemocnění). V případě přetrvávající klinicky významné ortostatické hypotenze by mělo být zhodnoceno riziko a přínos další léčby přípravkem RISPERDAL CONSTA.
Leukopenie, neutropenie a agranulocytóza
U antipsychotik, včetně přípravku RISPERDAL CONSTA, byly hlášeny případy leukopenie, neutropenie a agranulocytózy. Agranulocytóza byla během postmarketingového sledování hlášena velmi vzácně (< 1/10 000 pacientů).
Pacienty s anamnézou klinicky významného nízkého počtu bílých krvinek nebo leukopenie/ neutropenie vyvolané léčivými přípravky je nutno během počátečních měsíců léčby monitorovat a zvážit ukončení léčby přípravkem RISPERDAL CONSTA při prvních známkách klinicky významného poklesu počtu bílých krvinek při nepřítomnosti jeho jiných možných příčin.
U pacientů s klinicky významnou neutropenií je nutno důkladně monitorovat horečku nebo jiné příznaky infekce, a pokud se takové příznaky objeví, okamžitě je léčit. U pacientů se závažnou neutropenií (absolutní počet neutrofilů < 1 x 109/l) je nutno léčbu přípravkem RISPERDAL CONSTA ukončit a sledovat počet bílých krvinek do návratu k normálu.
Tardivní dyskineze / extrapyramidové symptomy (TD/EPS)
Léčba přípravky s antagonistickým účinkem na dopaminové receptory je spojena s rizikem rozvoje tardivní dyskineze charakterizované rytmickými mimovolními pohyby, především svalů jazyka a/nebo obličeje. Nástup extrapyramidových příznaků je rizikovým faktorem pro tardivní dyskinezi. Pokud se objeví příznaky tardivní dyskineze, mělo by být posouzeno vysazení všech antipsychotik.
Neuroleptický maligní syndrom (NMS)
Při léčbě antipsychotiky byl rovněž popsán neuroleptický maligní syndrom projevující se hypertermií, svalovou rigiditou, vegetativní labilitou, poruchami vědomí a zvýšenými plazmatickými hladinami kreatinfosfokinázy. K dalším příznakům může patřit myoglobinurie (rhabdomyolýza) a akutní ledvinové selhání. Při výskytu uvedených příznaků je nutné vysadit všechna antipsychotika, včetně přípravku RISPERDAL CONSTA.
Parkinsonova choroba a demence s Lewyho tělísky
Při předepisování antipsychotik včetně přípravku RISPERDAL CONSTA pacientům trpícím Parkinsonovou chorobou nebo demencí s Lewyho tělísky (DLB) by měli lékaři posoudit poměr rizika a prospěchu. Parkinsonova choroba se s risperidonem může zhoršit. U obou skupin může být zvýšené riziko neuroleptického maligního syndromu a zvýšená citlivost k antipsychotikům; tito pacienti byli vyloučeni z klinických hodnocení. K projevům této zvýšené citlivosti může patřit zmatenost, otupělost, posturální nestabilita s častými pády doprovázející extrapyramidové příznaky.
Hypersenzitivní reakce
Ačkoli by před zahájením léčby přípravkem RISPERDAL CONSTA měla být stanovena snášenlivost perorálního risperidonu, byly u pacientů, kteří dříve tolerovali perorální risperidon, během postmarketingového sledování vzácně hlášeny anafylaktické reakce (viz body 4.2 a 4.8). Pokud dojde k hypersenzitivní reakci, přerušte užívání přípravku RISPERDAL CONSTA, zahajte obecná podpůrná opatření dle klinického stavu a monitorujte pacienta, dokud příznaky a symptomy neodezní (viz body 4.3 a 4.8).
Hyperglykemie a diabetes mellitus
V průběhu léčby přípravkem RISPERDAL CONSTA byly hlášeny hyperglykemie, diabetes mellitus a zhoršení již existujícího diabetu. V některých případech byl hlášen předchozí přírůstek tělesné hmotnosti, což mohlo být spouštěcím faktorem. Spojení s ketoacidózou bylo hlášeno velmi vzácně a spojení s diabetickým kómatem vzácně. Doporučuje se příslušné klinické monitorování v souladu s užívanými doporučeními pro antipsychotika. U pacientů léčených jakýmkoli atypickým antipsychotikem, včetně přípravku RISPERDAL CONSTA, je nutno monitorovat příznaky hyperglykemie (jako jsou polydipsie, polyurie, polyfagie a slabost) a pacienty s diabetem je nutno pravidelně monitorovat na zhoršení kontroly glukosy.
Při užívání přípravku RISPERDAL CONSTA byly hlášeny významné přírůstky tělesné hmotnosti. Tělesnou hmotnost je nutno pravidelně kontrolovat.
Hyperprolaktinemie
Hyperprolaktinemie je častý nežádoucí účinek během léčby přípravkem RISPERDAL CONSTA. Je doporučeno stanovit hladinu prolaktinu v plazmě u pacientů s prokázanými nežádoucími účinky spojených s prolaktinem (např. gynekomastie, menstruační poruchy, anovulace, poruchy fertility, snížení libida, poruchy erekce a galaktorea).
Studie na tkáňových kulturách ukazují, že buněčný růst v lidských nádorech prsu může být stimulován prolaktinem. Ačkoli dosud nebyla v klinických a epidemiologických studiích prokázána přímá souvislost s podáváním antipsychotik, u pacientů s příslušnou anamnézou je nutno postupovat opatrně. U pacientů s existující hyperprolaktinemií a u pacientů s dokumentovanými tumory závislými na prolaktinu je nutno RISPERDAL CONSTA používat s opatrností.
Prodloužení QT
Prodloužení QT intervalu bylo v post-marketingu hlášeno velmi vzácně. Jako u jiných antipsychotik je nutno při předepisování risperidonu postupovat opatrně u pacientů se známým kardiovaskulárním onemocněním, prodloužením QT intervalu v rodinné anamnéze, při bradykardii nebo poruchách elektrolytové rovnováhy (hypokalemie, hypomagnesemie), protože risperidon může zvýšit riziko arytmogenního účinku a při současném užívání s přípravky, které prodlužují QT interval.
Křeče
RISPERDAL CONSTA je nutno používat opatrně u pacientů s anamnézou křečí nebo jiných stavů, které potenciálně snižují křečový práh.
Priapismus
Během léčby přípravkem RISPERDAL CONSTA se může objevit priapismus vzhledem k blokádě alfa-adrenergního účinku risperidonem.
Regulace tělesné teploty
Antipsychotikům je přisuzována vlastnost rušit schopnost těla snižovat tělesnou teplotu. Pacientům, u kterých dojde k okolnostem přispívajícím ke zvýšení tělesné teploty, např. intenzivní cvičení, vystavení extrémním teplotám, současná léčba přípravky s anticholinergní aktivitou nebo dehydratace, je při předepisováni přípravku RISPERDAL CONSTA nutno věnovat příslušnou péči.
Žilní tromboembolismus
V souvislosti s užíváním antipsychotik se vyskytly případy žilního tromboembolismu (VTE). Vzhledem k tomu, že u pacientů léčených antipsychotiky jsou často přítomny získané rizikové faktory pro VTE, měly by být před i během léčby přípravkem RISPERDAL tyto rizikové faktory rozpoznány a následně by měla být uplatněna preventivní opatření.
U pacientů léčených přípravky s alfau-adrenergním antagonistickým účinkem, včetně přípravku RISPERDAL CONSTA (viz bod 4.8), byl během operací katarakty pozorován peroperační syndrom plovoucí duhovky (Intaroperative floppy iris syndrome = IFIS).
IFIS může zvýšit riziko očních komplikací v průběhu a po operaci. Před operací by měl být oční chirurg informován o užívání přípravků s alfau-adrenergním antagonistickým účinkem v současnosti anebo v minulosti. Potenciální přínos ukončení léčby alfar blokátorem před operací katarakty nebyl stanoven a musí být porovnán s rizikem ukončení léčby antipsychotiky.
Antiemetický účinek
V předklinických studiích s risperidonem byl pozorován antiemetický účinek. Pokud se tento účinek vyskytne u lidí, může maskovat příznaky a projevy předávkování některými léčivými přípravky nebo stavy, jako je střevní neprůchodnost, Reyův syndrom a mozkový nádor.
Porucha funkce jater nebo ledvin
Ačkoli použití perorálního risperidonu u pacientů s ledvinovou nebo jaterní nedostatečností bylo hodnoceno v klinických studiích, u přípravku RISPERDAL CONSTA tomu tak nebylo. U této skupiny pacientů musí být RISPERDAL CONSTA podáván se zvýšenou opatrností (viz bod 4.2).
Podání
Je nutno věnovat pozornost tomu, aby přípravek RISPERDAL CONSTA nebyl omylem aplikován do krevní cévy.
Pomocné látky
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Interakce přípravku RISPERDAL CONSTA při současném podávání s jinými přípravky nebyly systematicky hodnoceny. Údaje o interakcích uvedené v tomto bodě jsou založeny na hodnoceních s perorálním přípravkem RISPERDAL.
Interakce související s farmakodynamikou
Přípravky prodlužující QT interval
Stejně jako u jiných antipsychotik je nutná opatrnost při předepisování risperidonu spolu s léčivými přípravky, o kterých je známo, že prodlužují QT interval, jako jsou antiarytmika (např. chinidin, disopyramid, prokainamid, propafenon, amiodaron, sotalol), tricyklickými antidepresivy (např. amitriptylin), tetracyklickými antidepresivy (např. maprotilin), některými antihistaminiky, jinými antipsychotiky, některými antimalariky (např. chinin, meflochin) a přípravky způsobujícími poruchu elektrolytové rovnováhy (hypokalemie, hypomagnesemie), bradykardii nebo přípravky, které inhibují metabolismus risperidonu v játrech. Tento seznam je příkladný, nikoli úplný.
Centrálně účinkující přípravky a alkohol
Risperidon je nutno používat opatrně v kombinaci s dalšími centrálně účinkujícími léčivými přípravky včetně alkoholu, opiátů, antihistaminik a benzodiazepinů vzhledem ke zvýšenému riziku sedace.
Levodopa a agonisté histaminu
RISPERDAL CONSTA může zeslabit účinek levodopy a jiných agonistů dopaminu. Je-li tato kombinace nutná, zejména v konečném stadiu Parkinsonovy choroby, je nutno předepsat nejnižší účinnou dávku obou přípravků.
Antihypertenziva
V post-marketingovém období byla při současném užívání risperidonu a antihypertenziv pozorována klinicky významná hypotenze.
Interakce související s farmakokinetikou
Risperidon je metabolizován převážně prostřednictvím CYP2D6 a v menší míře prostřednictvím CYP3A4. Jak risperidon tak i jeho aktivní metabolit 9-hydroxyrisperidon jsou substráty P-glykoproteinu (P-gp). Látky, které ovlivňují aktivitu CYP2D6 nebo silné inhibitory nebo induktory aktivity CYP3A4 a/nebo P-gp mohou mít účinek na farmakokinetiku účinné antipsychotické frakce risperidonu.
Silné inhibitory CYP2D6
Současné podávání přípravku RISPERDAL CONSTA se silným inhibitorem CYP2D6 může zvýšit plazmatické koncentrace risperidonu, ale méně už koncentrace účinné antipsychotické frakce. Vyšší dávky silného inhibitoru CYP2D6 mohou zvýšit koncentraci účinné antipsychotické frakce risperidonu (např. paroxetin, viz níže). Předpokládá se, že jiné inhibitory CYP2D6, jako je chinidin mohou mít vliv na plazmatické koncentrace risperidonu podobným způsobem. Při zahájení či ukončení léčby a současném užívání paroxetinu, chinidinu nebo jiného silného inhibitoru CYP2D6, zvláště při vyšších dávkách, by měl lékař přehodnotit dávkování přípravku RISPERDAL CONSTA.
Inhibitory CYP3A4 a/nebo P-glykoproteinu
Současné užívání přípravku RISPERDAL CONSTA spolu se silnými inhibitory CYP3A4 a/nebo inhibitory P-gp může podstatně zvýšit plazmatické koncentrace účinné antipsychotické frakce risperidonu. Pokud je při zahájena nebo ukončena léčba současně užívaným itrakonazolem a/nebo jiným silným inhibitorem CYP3A4 a/nebo P-gp měl by lékař přehodnotit dávkování přípravku RISPERDAL CONSTA.
Induktory CYP3A4 a/nebo P-glykoproteinu
Současné užívání přípravku RISPERDAL CONSTA spolu se silnými induktory CYP3A4 a/nebo induktory P-gp může snížit plazmatické koncentrace účinné antipsychotické frakce risperidonu. Pokud je zahájena nebo ukončena léčba současně užívaným karbamazepinem a/nebo jiným silným induktorem CYP3A4 a/nebo P-gp měl by lékař přehodnotit dávkování přípravku RISPERDAL CONSTA. Účinky induktorů CYP3A4 se projevují v závislosti na čase a může trvat nejméně 2 týdny od zahájení léčby do dosažení maximálního účinku. Naopak při ukončení léčby může trvat nejméně 2 týdny, než indukce CYP3A4 poklesne.
Léky s vysokou vazbou na proteiny
Pokud je přípravek RISPERDAL CONSTA užíván spolu s přípravky s vysokou vazbou na proteiny, není klinicky relevantní vytlačení z vazby na plazmatické bílkoviny ani u jednoho z léků. Při současném podávání těchto přípravků je třeba nahlédnou do informací o přípravku pro informace o způsobu metabolismu a možné potřebě úpravy dávkování.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých. Relevance výsledků z těchto studií u pediatrické populace není známá.
Příklady
Příklady přípravků, které se mohou potenciálně ovlivňovat, nebo u kterých nebyly prokázány
interakce s risperidonem jsou uvedeny níže:
Vliv jiných léčivých přípravků na farmakokinetiku risperidonu:
Antibakteriální látky:
• Erythromycin, mírný inhibitor CYP3A4 a inhibitor P-gp nemění farmakokinetiku risperidonu a účinné antipsychotické frakce.
• Rifampicin, silný induktor CYP3A4 a induktor P-gp snižuje plazmatické koncentrace a účinné antipsychotické frakce.
Anticholinesterázy:
• Donepezil a galantamin, oba substráty CYP2D6 a CYP3A4, nevykazují klinicky významný účinek na farmakokinetiku risperidonu ani účinné antipsychotické frakce.
Antiepileptika:
• Karbamazepin, silný induktor CYP3A4 a induktor P-gp prokazatelně snižuje plazmatické koncentrace účinné antipsychotické frakce risperidonu. Podobné účinky mohou být pozorovány např. u fenytoinu a fenobarbitalu, které také indukují jaterní enzym CYP3A4, stejně jako P-glykoprotein.
• Topiramát mírně snižuje biologickou dostupnost risperidonu , nikoli však účinné antipsychotické frakce. Proto není pravděpodobné, že by tato interakce měla klinický význam.
Antimykotika:
• Itrakonazol, silný inhibitor CYP3A4 a inhibitor P-gp, v dávce 200 mg/den zvyšuje plazmatické koncentrace účinné psychotické frakce přibližně o 70 % při dávce risperidonu 2 až 8 mg/den.
• Ketokonazol, silný inhibitor CYP3A4 a inhibitor P-gp, v dávce 200 mg/den zvyšuje plazmatické koncentrace risperidonu a snižuje plazmatické koncentrace 9-hydroxyrisperidonu.
Antipsychotika:
• Fenothiaziny mohou zvyšovat plazmatické koncentrace risperidonu, nikoli však účinné antipsychotické frakce.
Antivirotika:
• Inhibitory proteázy: nejsou dostupné údaje z oficiálního hodnocení, nicméně vzhledem k tomu, že ritonavir je silným inhibitorem CYP3A4 a slabým inhibitorem CYP2D6, mohou ritoanvir a ritonavirem zesílené inhibitory proteázy zvýšit koncentrace účinné antipsychotické frakce risperidonu .
Betablokátory:
• Některé betablokátory mohou zvyšovat plazmatické koncentrace risperidonu, nikoli však účinné antipsychotické frakce.
Blokátory kalciových kanálů:
• Verapamil, mírný inhibitor CYP3A4 a inhibitor P-gp, zvyšuje plazmatické koncentrace risperidonu a účinné antipsychotické frakce.
Gastrointestinální přípravky:
• Antagonisté H2-receptorů: cimetidin a ranitidin, oba slabé inhibitory CYP2D6 a CYP3A4, zvyšují biologickou dostupnost risperidonu, pouze minimálně však zvyšují dostupnost účinné antipsychotické frakce.
SSRI a tricyklická antidepresiva:
• Fluoxetin, silný inhibitor CYP2D6, zvyšuje plazmatické koncentrace risperidonu, ale méně už účinné antipsychotické frakce.
• Paroxetin, silný inhibitor CYP2D6, zvyšuje plazmatické koncentrace risperidonu, ale
při dávce do 20 mg/den už méně koncentrace účinné antipsychotické frakce. Vyšší dávky paroxetinu však mohou zvýšit plazmatickou koncentraci i u účinné antipsychotické frakce.
• Tricyklická antidepresiva mohou zvyšovat plazmatické koncentrace risperidonu, ale nikoli účinné antipsychotické frakce. Amitriptylin neovlivňuje farmakokinetiku risperidonu ani účinné antipsychotické frakce.
• Sertralin, slabý inhibitor CYP2D6, a fluvoxamin, slabý inhibitor CYP3A4, v dávce až do 100 mg/den nejsou spojovány s klinicky významnými změnami v koncentracích účinné antipsychotické frakce risperidonu. Nicméně denní dávky sertralinu nebo fluvoxaminu vyšší než 100 mg mohou zvýšit koncentrace účinné antipsychotické frakce risperidonu.
Účinky risperidonu na farmakokinetiku ostatních přípravků
Antiepileptika:
• Risperidon neprokázal klinicky významný účinek na farmakokinetiku valproátu nebo topiramátu.
Antipsychotika:
• Aripiprazol, substrát CYP2D6 a CYP3A4: risperidon v tabletách nebo injekcích neovlivňuje farmakokinetiku aripiprazolu a jeho aktivního metabolitu dehydroaripiprazolu.
Digitalisové glykosidy:
• Risperidon neprokázal klinicky významný účinek na farmakokinetiku digoxinu.
Lithium:
• Risperidon neprokázal klinicky významný účinek na farmakokinetiku lithia.
Současné užívání risperidonu s furosemidem
• Viz informace v bodě 4.4 týkající se zvýšené úmrtnosti starších pacientů s demencí, užívajících současně furosemid.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o podávání risperidonu těhotným ženám nejsou k dispozici.
Risperidon nebyl ve studiích na zvířatech teratogenní, ale byly pozorovány jiné typy reprodukční toxicity (viz bod 5.3). Potenciální riziko pro člověka není známo.
U novorozenců, kteří byli během třetího trimestru těhotenství vystaveni vlivu antipsychotik (včetně přípravku RISPERDAL CONSTA), existuje riziko nežádoucích účinků včetně extrapyramidových příznaků a/nebo příznaků z vysazení. Tyto příznaky se mohou lišit v délce trvání i v závažnosti. Byly hlášeny případy agitovanosti, hypertonie, hypotonie, tremoru, somnolence, respirační tísně nebo poruch příjmu potravy. Proto by novorozenci měli být pečlivě monitorováni.
RISPERDAL CONSTA by neměl být během těhotenství podáván, pokud to není nezbytně nutné. Kojení
Ve studiích na zvířatech byl risperidon i 9-hydroxy-risperidon vylučován do mléka. Bylo prokázáno, že se risperidon a 9-hydroxy-risperidon vylučují v malém množství také do lidského mateřského mléka. O nežádoucích účincích na kojené děti nejsou dostupné údaje. Výhody kojení by proto měly být posouzeny oproti potenciálnímu riziku pro dítě.
Fertilita
Podobně jako další léčivé přípravky, které antagonizují dopaminové D2 receptory, zvyšuje RISPERDAL hladinu prolaktinu. Hyperprolaktinemie může potlačovat hypothalamický GnRH, což vede ke snížení sekrece gonadotropinu hypofýzou. To může dále inhibovat reprodukční funkce u ženských i mužských pacientů narušením gonadální steroidogeneze.
V předklinických studiích nebyly pozorovány relevantní účinky.
4.7 Účinky na schopnost řídit a obsluhovat stroje
RISPERDAL CONSTA má malý nebo mírný vliv na schopnost řídit nebo obsluhovat stroje vzhledem k jeho účinku na nervový systém a účinku na zrak (viz bod 4.8). Proto by pacienti měli být upozorněni, aby neřídili nebo neobsluhovali stroje, dokud nebude známa jejich individuální vnímavost.
4.8 Nežádoucí účinky
Nejčastěji hlášenými nežádoucími účinky (výskyt > 1/10) jsou: nespavost, úzkost, bolest hlavy, infekce horních cest dýchacích, parkinsonismus a deprese.
Nežádoucí účinky, jevící se jako závislé na dávce, zahrnují parkinsonismus a akatizii.
V post-marketingu byly hlášeny závažné reakce v místě injekce, včetně nekrózy v místě injekce, abscesu, celulitidy, vředu, hematomu, cysty a nodu. Četnost je klasifikována jako „není známo“ (z dostupných údajů nelze určit). Jednotlivé případy vyžadovaly chirurgický zákrok.
Dále jsou uvedeny nežádoucí účinky hlášené z klinických hodnocení a post-marketingové zkušenosti s risperidonem podle kategorie četností z klinických hodnocení s přípravkem RISPERDAL CONSTA. Používána je následující terminologie a frekvence: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000) a velmi vzácné (< 1/10 000).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů |
Nežádoucí účinky | ||||
|
Četnost | |||||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Velmi vzácné | |
|
Infekce a infestace |
infekce horních cest dýchacích |
pneumonie, bronchitida, sinusitida, infekce močových cest, chřipka |
infekce dýchacích cest, cystitida, infekce ucha, infekce oka, tonsilitida, onychomykóza, celulitida, infekce, lokalizovaná infekce, virová infekce, akarodermatitida, subkutánní absces | ||
|
Poruchy krve a lymfatického systému |
anemie |
snížení počtu bílých krvinek, trombocytopenie, snížení hematokritu |
agranulocytóza c, neutropenie, zvýšení počtu eozinofilů | ||
|
Poruchy imunitního systému |
hypersenzitivita |
anafylaktická reakce c | |||
|
Endokrinní poruchy |
hyperprolaktinemie a |
přítomnost glukosy v moči |
nepřiměřená sekrece antidiuretického hormonu | ||
|
Poruchy metabolismu a výživy |
hyperglykemie, zvýšení tělesné hmotnosti, zvýšení chuti k jídlu, snížení tělesné hmotnosti, snížení chuti k jídlu |
diabetes mellitus b, anorexie, zvýšení hladin triglyceridů v krvi, zvýšení hladiny cholesterolu v krvi |
otrava vodou c, hypoglykemie, hyperinsulinemie c, polydipsie |
diabetická ketoacidóza | |
|
Psychiatrické poruchy |
porucha spánku, agitovanost, snížení libida |
mánie, stav zmatenosti, anorgasmie, nervozita, noční můry |
otupělost | ||
|
Poruchy nervového systému |
parkinsonismusd, bolest hlavy |
útlum/ospalost, akatizie d, dystonie d, závrať, dyskineze d, tremor |
tardivní dyskineze, cerebrální ischemie, ztráta vědomí, konvulze d, synkopa, psychomotorická hyperaktivita, porucha rovnováhy, abnormální koordinace, posturální závrať, porucha pozornosti, dysartrie, dysgeuzie, hypestezie, parestezie |
neuroleptický maligní syndrom, cerebrovaskulární porucha, neodpovídání na podněty, snížená úroveň vědomí, diabetické kóma, titubace hlavy | |
|
Poruchy oka |
rozmazané vidění, |
zánět spojivek, suché oko, zvýšená tvorba slz, oční hyperemie |
okluze retinální arterie, glaukom, porucha hybnosti očí, protáčení očí, fotofobie, tvorba ospalků, syndrom plovoucí duhovky (peroperační)c | ||
|
Poruchy ucha a labyrintu |
vertigo, tinitus, bolest ucha | ||||
|
Srdeční poruchy |
fibrilace síní, atrioventrikulární blokáda, poruchy vedení vzruchu, prodloužení QT na EKG, bradykardie, abnormální EKG, palpitace |
sinusová arytmie | |||
|
Cévní poruchy |
hypertenze, hypotenze |
ortostatická hypotenze |
plicní embolie, žilní trombóza, návaly | ||
|
Respirační, hrudní a mediastinální poruchy |
dyspnoe, faryngolaryngeální bolest, kašel, kongesce nosní sliznice |
hyperventilace, kongesce sliznic dýchacích cest, sípání, epistaxe |
syndrom spánkové apnoe, aspirační pneumonie, plicní kongesce, šelest, dysfonie, respirační onemocnění | ||
|
Gastro- intestinální poruchy |
bolest břicha, břišní diskomfort, zvracení, nauzea, zácpa, gastroenteritida, průjem, dyspepsie, sucho v ústech, bolest zubů |
inkontinence stolice, dysfagie, flatulence |
pankreatitida, obstrukce střev, otok jazyka, fekalom, cheilitida |
ileus | |
|
Poruchy kůže a podkožní tkáně |
svědění, alopecie, ekzém, suchá kůže, erytém, změna zbarvení kůže, akné, seboroická dermatitida |
poléková vyrážka, kopřivka, hyperkeratóza, lupy, poruchy kůže, kožní léze |
angioedém | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
svalové spasmy, muskuloskeletální bolest, bolest zad, artralgie |
zvýšení hladiny kreatin-fosfokinázy v krvi, ztuhlost kloubů, otok kloubů, svalová slabost, bolest krční páteře |
rhabdomyolýza, abnormální držení těla | ||
|
Poruchy ledvin a močových cest |
inkontinence moči |
polakisurie, retence moči, dysurie | |||
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím |
syndrom z vysazení léku u novorozenců c |
|
Poruchy reprodukčního systému a prsu |
erektilní dysfunkce, amenorea, galaktorea |
porucha ejakulace, opoždění menstruace, porucha menstruace d, gynekomastie, sexuální dysfunkce, bolest prsů, nepříjemný pocit v prsou, vaginální výtok |
priapismus c, překrvení prsů, zvětšení prsů, sekrece z prsů | ||
|
Celkové poruchy a reakce v místě aplikace |
otok d, pyrexie, bolest na hrudi, astenie, únava, bolest, reakce v místě injekce |
otok obličeje, zimnice, zvýšení tělesné teploty, abnormální chůze, žízeň, nepříjemný pocit na hrudi, malátnost, abnormální pocit, induracec |
hypotermie, snížení tělesné teploty, chlad končetin, syndrom z vysazení léku, diskomfort | ||
|
Poruchy jater a žlučových cest |
zvýšení hladin jaterních transamináz, zvýšení hladiny gamaglutamyl-transferázy |
zvýšení hodnot jaterních enzymů | |||
|
Poranění, otravy a procedurální komplikace |
pád |
bolest spojená se zákrokem |
a Hyperprolaktinemie může v některých případech vést ke gynekomastii, menstruačním potížím, amenoree, anovulaci, galaktoree, poruše fertility, sníženému libidu, či erektilní dysfukci.
b V placebem kontrolovaných hodnoceních byl diabetes mellitus hlášen u 0,18 % risperidonem léčených pacientů ve srovnání s 0,11 % ve skupině s placebem. Celkový výskyt ze všech klinických hodnocení byl u pacientů léčených risperidonem 0,43 %. c Nebylo pozorováno v klinických hodnoceních s přípravkem RISPERDAL CONSTA ale při post-marketingovém používání risperidonu.
d Může se vyskytnout extrapyramidová porucha: Parkinsonismus (hypersekrece slin, muskuloskeletální ztuhlost, parkinsonismus, slinění, fenomén „ozubeného kola“, bradykineze, hypokineze, ztuhlost obličeje, svalové napětí, akineze, ztuhlost šíje, svalová ztuhlost, parkinsonská chůze a abnormální glabelární reflex, parkinsonský klidový třes), akatizie (akatizie, neklid, hyperkineze a syndrom neklidných nohou), třes, dyskineze (dyskineze, svalové záškuby, choreoatetóza, atetóza a myoklonus), dystonie. Dystonie zahrnuje dystonii, hypertonii, tortikolis, mimovolní svalové stahy, svalové stahy, blefarospasmus, okulogyraci, paralýzu jazyka, spasmus tváře, laryngospasmus, myotonii, opistotonus, orofaryngeální spasmus, pleurototonus, spasmus jazyka a trismus. Je nutno si uvědomit, že bylo zahrnuto širší spektrum příznaků, které nemusejí mít nutně extrapyramidový původ. Insomnie zahrnuje iniciální insomnii, střední insomnii; Konvulze zahrnují konvulze typu grand mal; Menstruační poruchy zahrnují nepravidelnou menstruaci, oligomenoreu; Otok zahrnuje celkový otok, periferní otok, důlkový edém.
Nežádoucí účinky pozorované u lékových forem obsahujících paliperidon Paliperidon je účinným metabolitem risperidonu, proto se profily nežádoucích účinků obou látek (včetně perorálních a injekčních lékových forem) prolínají. Navíc k výše uvedeným nežádoucím účinkům byly při užívání přípravků s paliperidonem pozorovány následující nežádoucí účinky, které lze očekávat také u přípravku RISPERDAL CONSTA.
Srdeční poruchy: Syndrom posturální ortostatické tachykardie
Anafylaktická reakce
V postmarketingovém sledování u pacientů, kteří dříve tolerovali perorální risperidon byly vzácně hlášeny případy anafylaktické reakce po injekci přípravku RISPERDAL CONSTA (viz bod 4.4).
Účinky třídy
Podobně jako u jiných antipsychotik byly po uvedení na trh hlášeny velmi vzácné případy prodloužení QT intervalu. Další účinky na srdce spojené s touto skupinou přípravků hlášené u antipsychotik, která prodlužují QT interval, zahrnují arytmii, ventrikulární fibrilaci, ventrikulární tachykardii, náhlé úmrtí, zástavu srdce a torsade de pointes.
Žilní tromboembolismus
V souvislosti s antipsychotiky byly hlášeny případy žilního tromboembolismu, včetně případů plicní embolie a hluboké žilní trombózy (frekvence není známa).
Přírůstek tělesné hmotnosti
Ve 12týdenní dvojitě slepé placebem kontrolované klinické studii došlo u 9 % pacientů léčených přípravkem RISPERDAL CONSTA k přírůstku tělesné hmotnosti > 7 % ve srovnání se 6 % pacientů, kterým bylo podáváno placebo. V jednoleté otevřené studii u přípravku RISPERDAL CONSTA byly změny tělesné hmotnosti obvykle ±7 % oproti výchozímu stavu; přírůstek tělesné hmotnosti > 7 % mělo 25 % pacientů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Vzhledem k tomu, že předávkování při parenterálním podání je oproti perorálnímu méně pravděpodobné, je prezentována informace pro perorální podání.
Příznaky
Všeobecně se jedná o příznaky vyplývající z vystupňování známých farmakologických účinků risperidonu. Patří k nim ospalost a sedace, tachykardie a hypotenze a extrapyramidové symptomy. Při předávkování byly hlášeny případy prodloužení QT intervalu a křečí. Torsade de pointes byly hlášeny v souvislosti s kombinovaným předávkováním perorálním přípravkem RISPERDAL a paroxetinem.
V případě akutního předávkování je zapotřebí zjistit, zda se nejedná o současné předávkování více přípravky.
Léčba
Je nutné udržovat průchodnost dýchacích cest a zajistit adekvátní okysličení a ventilaci. Okamžitě je nutno zahájit monitorování kardiovaskulárních funkcí a udržovat je kontinuálně s cílem detekce možných arytmií.
Specifické antidotum přípravku RISPERDAL není známo, proto je zapotřebí zahájit podpůrnou léčbu. Hypotenzi a cirkulační kolaps je nutno léčit adekvátním způsobem - intravenózním podáním tekutin a/nebo sympatomimetiky. Při závažných extrapyramidových příznacích by měla být podávána anticholinergika. Pacient by měl být podroben pečlivému lékařskému dohledu a monitorován až do normalizace stavu.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiná antipsychotika, ATC kód: N05AX08 Mechanismus účinku
Risperidon je selektivní monoaminergní antagonista s jedinečnými vlastnostmi. Vyznačuje se vysokou afinitou k serotoninergním 5-HT2 a dopaminergním D2 receptorům. Risperidon se rovněž váže na alfai-adrenergní receptory a s nižší afinitou na Hi-histaminové a alfa2-adrenergní receptory. Risperidon nemá afinitu k cholinergním receptorům. Ačkoliv je risperidon velmi silným D2 antagonistou, s čímž souvisí jeho terapeutický účinek na pozitivní příznaky schizofrenie, ve srovnání s klasickými antipsychotiky způsobuje nižší útlum psychomotorické aktivity a méně často navozuje katalepsii. Vyvážený centrální serotoninový a dopaminový antagonismus může snižovat pohotovost k nežádoucím extrapyramidovým účinkům a současně rozšiřovat terapeutickou účinnost na negativní a afektivní symptomy schizofrenie.
Klinická účinnost
Účinnost přípravku RISPERDAL CONSTA (25 mg a 50 mg) při léčbě projevů psychotických poruch (schizofrenie/schizoafektivních poruch) byla sledována v průběhu 12týdenní placebem kontrolované klinické studie u dospělých psychotických hospitalizovaných a ambulantních pacientů, kteří splňovali DSM-IV (Drug Safety Management) kritéria pro schizofrenii.
Ve 12týdenní srovnávací studii stabilizovaných pacientů se schizofrenií byl shledán RISPERDAL CONSTA stejně účinný jako perorální tabletové lékové formy. Byla rovněž sledována dlouhodobá (50 týdnů) bezpečnost a účinnost přípravku RISPERDAL CONSTA v otevřené studii u stabilizovaných psychotických hospitalizovaných a ambulantních pacientů, kteří splňovali DSM-IV kritéria pro schizofrenii nebo schizoafektivní poruchy. Prodloužený účinek u přípravku RISPERDAL CONSTA byl udržován na stejné výši (Obrázek 1).
Obrázek 1. Časový průběh průměrných hodnot celkového PANSS skóre (LOCF - Last observation carried forward) u pacientů se schizofrenií
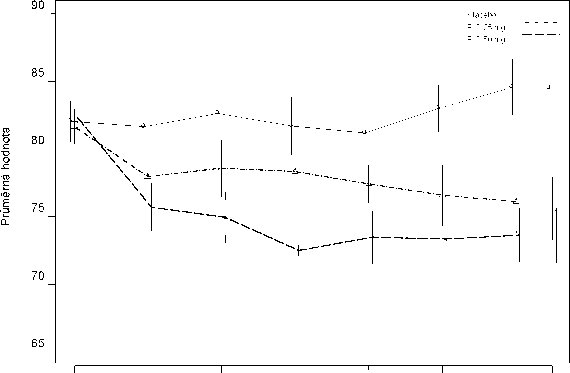
Zahájení 2 4 6 8 10 12 Ukončení
Týden
5.2 Farmakokinetické vlastnosti
Absorpce
Po aplikaci přípravku RISPERDAL CONSTA dochází k úplné absorpci risperidonu.
Po jednorázové intramuskulární injekci přípravku RISPERDAL CONSTA se léčivo uvolňuje v nízké úvodní dávce (< 1 % dávky) s následnou latencí tří týdnů. Hlavní uvolňování léčiva nastupuje od třetího týdne dále, udržuje se od 4. do 6. týdne a klesá v sedmém týdnu. Během prvních tří týdnů léčby přípravkem RISPERDAL CONSTA by proto měla být podávána perorální antipsychotická suplementace (viz bod 4.2).
Kombinací uvolňování léčiva a dávkovacího režimu (intramuskulární injekce každé dva týdny) je dosaženo stálých plazmatických koncentrací. Terapeutické plazmatické koncentrace přetrvávají do 4. až 6. týdne po poslední aplikaci přípravku RISPERdAl CONSTA.
Po opakované intramuskulární injekci 25 nebo 50 mg přípravku RISPERDAL CONSTA 1x za dva týdny se pohybují střední plazmatické koncentrace účinné antipsychotické frakce mezi 9,9 -
19,2 ng/ml a vrcholové plazmatické koncentrace mezi 17,9 - 45,5 ng/ml. U pacientů, kterým bylo aplikováno 25 - 50 mg 1x za dva týdny, nebyla během dlouhodobého podávání (12 měsíců) pozorována akumulace risperidonu.
Výše uvedené studie byly provedeny s podáním do hýžďového svalu. Intramuskulární injekce do deltového a hýžďového svalu jsou ve stejné dávce bioekvivalentní a tudíž zaměnitelné.
Distribuce
Risperidon je rychle distribuován. Distribuční objem činí 1 - 2 l/kg. V plazmě se risperidon váže na albumin a kyselý alfa1- glykoprotein. Podíl risperidonu vázaného na plazmatické proteiny představuje 90 %, u účinného metabolitu 9-hydroxy-risperidonu 77 %.
Risperidon je metabolizován cytochromem CYP2D6 na 9-hydroxy-risperidon, jehož farmakologický účinek je podobný risperidonu. Risperidon a 9-hydroxy-risperidon tvoří účinnou antipsychotickou frakci. CYP2D6 je předmětem genetického polymorfismu. Rychlí metabolizátoři CYP2D přeměňují risperidon na 9-hydroxy-risperidon rychle, zatímco pomalí metabolizátoři CYP2D jej přeměňují mnohem pomaleji. Ačkoli rychlí metabolizátoři mají nižší hladinu risperidonu a vyšší hladinu 9-hydroxy-risperidonu než pomalí metabolizátoři, farmakokinetika kombinace risperidonu a 9-hydroxy-risperidonu (tj. aktivní antipsychotické frakce) po jednorázovém a opakovaném podání je obdobná jak u rychlých tak i pomalých metabolizátorů CYP2D6.
Další cestou metabolizace risperidonu je N-dealkylace. In vitro studie na lidských jaterních mikrozomech ukázaly, že risperidon v klinicky významných koncentracích neinhibuje podstatně metabolismus látek metabolizovaných isoenzymy cytochromu P450 včetněCYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 a CYP3A5. Jeden týden po podání perorálního risperidonu je 70 % dávky vyloučeno močí a 14 % stolicí. V moči představují risperidon a 9-hydroxy-risperidon 35 - 45 % perorálně podané dávky. Zbývající podíl tvoří neaktivní metabolity. Eliminační fáze je úplně ukončena přibližně za 7 až 8 týdnů po poslední injekci přípravku RISPERDAL CONSTA.
Linearita
Farmakokinetika risperidonu je lineární také v rozmezí dávek 25 - 50 mg při podání injekce jednou za 2 týdny.
Starší pacienti, porucha funkce jater a ledvin
Studie farmakokinetiky s jednorázovým perorálním podáním perorálního risperidonu prokázala u starších pacientů v průměru o 43 % vyšší plazmatické koncentrace účinné antipsychotické frakce, o 38 % delší poločas a snížení clearance účinné antipsychotické frakce o 30 %.
U dospělých se středně závažnou poruchou funkce ledvin byla clearance aktivní složky ~48% hodnoty clearance u mladých zdravých dospělých (ve věku 25 - 35 let). U dospělých se závažnou poruchou funkce ledvin byla clearance aktivní složky ~31% hodnoty clearance u mladých zdravých dospělých. Poločas aktivní složky byl 16,7 hod. u zdravých mladých dospělých;
24,9 hod. u dospělých se středně závažnou poruchou funkce ledvin (nebo ~1,5krát delší než u mladých dospělých) a 28,8 hod. u pacientů se závažnou poruchou funkce ledvin (nebo ~1,7krát delší než u mladých dospělých).
U pacientů s jaterní insuficiencí byly plazmatické koncentrace risperidonu normální, ale průměrná volná plazmatická frakce risperidonu byla zvýšena přibližně o 37,1 %.
Clearance po perorálním podání a eliminační poločas risperidonu a jeho aktivní složky u dospělých se středně závažnou a závažnou poruchou funkce jater nebyly významně odlišné od těchto parametrů u mladých zdravých dospělých osob.
Vztah farmakokinetiky a farmakodynamiky
Vztah mezi plazmatickými koncentracemi účinné antipsychotické frakce a změnami v celkovém PANSS (Positive and Negative Syndrome Scale) a celkovém ESRS (Extrapyramidal Symptom Rating Scale) skóre nebyl nalezen v žádné klinické studii fáze III, kde byla sledována účinnost a bezpečnost.
Pohlaví, rasa a kouření
Analýza farmakokinetiky u populace neprokázala žádný významný vliv pohlaví, rasy nebo kouření na farmakokinetiku risperidonu nebo účinné antipsychotické frakce.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podobně jako u perorálního risperidonu byly ve studiích (sub)chronické toxicity u potkanů a psů s přípravkem RISPERDAL CONSTA (až do 12 měsíců intramuskulárního podání) největším účinkem prolaktinem způsobená stimulace prsní žlázy, změny genitálu u samců i samic a účinky na centrální nervový systém (CNS), které souvisely s farmakodynamickou aktivitou risperidonu. Ve studiích toxicity s perorálním risperidonem u mláďat potkanů byly pozorovány vyšší mortalita mláďat a zpožďování fyzického vývoje. Ve 40týdenní studii u štěňat s perorálním risperidonem bylo zpožděno pohlavní zrání. Růst dlouhých kostí nebyl dotčen u psů při 3,6násobku maximální humánní perorální expozice pro dospívající (1,5 mg/den) na základě posouzení AUC; účinek na dlouhé kosti a pohlavní zrání byly pozorovány při 15násobku maximální humánní perorální expozice pro dospívající.
Risperidon nebyl teratogenní u potkanů a králíků. V reprodukčních studiích s risperidonem u potkanů byly pozorovány nežádoucí účinky na páření a na porodní hmotnost a přežití mláďat.
U potkanů byla intrauterinní expozice risperidonu spojena s kognitivním deficitem v dospělosti. Další antagonisté dopaminu měli při podání březím zvířatům negativní vliv na učení a motorický vývoj mláďat.
Aplikace přípravku RISPERDAL CONSTA laboratorním samcům i samicím potkanů v dávce 40 mg/kg/2 týdny po 12 a 24 měsíců vyvolala osteodystrofii. Účinná dávka vyvolávající osteodystrofii u potkanů vztažena k mg/m2 byla osminásobkem doporučené dávky pro člověka a dle plazmatické koncentrace 2násobkem předpokládané plazmatické koncentrace u člověka po aplikaci nejvyšší doporučené dávky. Osteodystrofie nebyla pozorována u psů, kterým byl aplikován přípravek RISPERDAL CONSTA po 12 měsíců v dávce až do 20 mg/kg/2 týdny. Tato dávka představuje 14násobek plazmatických koncentrací po aplikaci nejvyšší doporučené dávky u člověka.
Neexistují důkazy genotoxického potenciálu.
Jak lze očekávat u silného dopaminového D2-antagonisty, ve studiích perorální karcinogenity risperidonu u potkanů a myší bylo pozorováno zvýšení výskytu adenomů hypofýzy (myši), endokrinních adenomů slinivky (potkani) a adenomů mléčné žlázy (oba druhy).
Ve studii karcinogenity s přípravkem RISPERDAL CONSTA podávaným intramuskulárně u laboratorních potkanů Wistar (Hannover) (v dávkách 5 a 40 mg/kg/2 týdny) byla pozorována zvýšená incidence tumorů endokrinního pankreatu, hypofýzy a adrenálních medulárních tumorů u dávky 40 mg/kg, zatímco tumory prsní žlázy byly pozorovány u dávek 5 a 40 mg/kg. Tyto tumory pozorované po perorálním a intramuskulárním podání lze spojit s prodlouženým antagonismem dopaminu D2 a hyperprolaktinemií. Studie na tkáňových kulturách dále naznačují, že by buněčný růst v lidských tumorech prsu mohl být stimulován prolaktinem. U obou skupin byla pozorována hyperkalcemie přispívající ke zvýšení incidence adrenálních medulárních tumorů u potkanů léčených přípravkem RISPERDAL CONSTA. Není důvod předpokládat, že hyperkalcemie může způsobit u člověka feochromocytom.
Ledvinové tubulámí adenomy se objevily u samců potkanů léčených přípravkem RISPERDAL CONSTA při dávkování 40 mg/kg/2 týdny. Ledvinové tumory se nevyskytovaly při nízkém dávkování, u 0,9% roztoku NaCl nebo v kontrolní skupině s vehikulem obsahujícím mikročástice. Mechanismus vzniku ledvinových tumorů u samců laboratorních potkanů Wistar (Hannover) není znám. Ke zvýšení incidence ledvinových tumorů nedošlo u studií karcinogenity při perorálním podání risperidonu u laboratorních potkanů Wistar (Wiga) nebo u „Swiss“ myší. Studie karcinogenity po perorálním podání vedené za účelem zjištění podkmenových rozdílů v profilu nádorů svědčí o podstatném rozdílu ve spontánních, na stáří závislých nenádorových ledvinových změnách, rozdílu ve zvýšení sérových hladin prolaktinu a ledvinových změnách mezi podkmenem Wistar (Hannover) a Wistar (Wiga). Nebyly zjištěny žádné údaje o ledvinových změnách u psů po dlouhodobé aplikaci přípravku RISPERDAL CONSTA.
Význam osteodystrofie, tumorů způsobených prolaktinem a předpokládaných ledvinových tumorů specifických pro podkmeny laboratorních potkanů ve smyslu rizika pro člověka není znám.
Po aplikaci vysokých dávek přípravku RISPERDAL CONSTA bylo u psů a potkanů pozorováno lokální podráždění v místě injekce. Ve 24měsíční studii intramuskulární karcinogenity u laboratorních potkanů nebyla zjištěna vyšší incidence lokálních tumorů ve skupině s vehikulem ani ve skupině s léčivou látkou.
In vitro a in vivo modely na zvířatech ukazují, že vysoké dávky risperidonu mohou způsobit prodloužení QT intervalu, což bylo spojováno s teoreticky zvýšeným rizikem torsade de pointes u pacientů.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek pro injekční suspenzi Polyglaktin
Rozpouštědlo Polysorbát 20 Sodná sůl karmelosy Hydrogenfosforečnan sodný Kyselina citronová Chlorid sodný Hydroxid sodný Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
3 roky při 2 - 8 °C
Po rekonstituci: Chemická a fyzikální stabilita je prokázána při teplotě 25 °C po dobu 24 hodin.
Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, jsou doba a podmínky uchovávání přípravku po otevření před použitím v odpovědnosti uživatele a normálně by doba neměla být delší než 6 hodin při 25 °C, pokud rekonstituce neproběhla za kontrolovaných a validovaných aseptických podmínek.
6.4 Zvláštní opatření pro uchovávání
Celé balení se uchovává v chladničce (2 - 8 °C).
Pokud není k dispozici chladnička, RISPERDAL CONSTA může být před aplikací uchováván při teplotě nepřesahující 25 °C maximálně 7 dní.
Uchovávejte v původním obalu.
Podmínky uchovávání rekonstituovaného přípravku viz bod 6.3.
6.5 Druh obalu a obsah balení
Aplikátor injekční lahvičky pro rekonstituci bez injekční jehly
- Jedna lahvička obsahující prášek pro injekční suspenzi s prodlouženým uvolňováním.
- Jeden aplikátor West-Medimop Vial Adaptér pro rekonstituci (dále jen adaptér).
- Jedna předplněná injekční stříkačka obsahující rozpouštědlo pro RISPERDAL CONSTA.
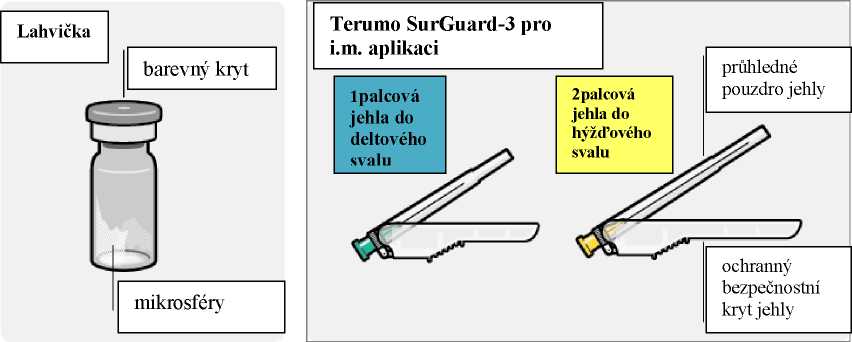
- Dvě jehly Terumo SurGuard 3 pro intramuskulární injekci [ 21G UTW 1palcová (0,8 mm x 25 mm) bezpečnostní jehla s bezpečnostním zařízením pro podání do deltového svalu a 20G TW 2palcová (0,9 mm x 51 mm) bezpečnostní jehla s bezpečnostním zařízením pro podání do hýžďového svalu].
Risperdal Consta je dostupný v baleních obsahujících 1 nebo 5 (svázaných) balení.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Důležité informace
K zajištění úspěšného podání přípravku RISPERDAL CONSTA je nutno věnovat důkladnou pozornost „Pokynům pro použití“ rozepsaným po jednotlivých krocích.
Použijte dodané komponenty
Složky (komponenty) v tomto balení j sou speciálně navrženy pro použití přípravku RISPERDAL COnStA. RISPERDAL CONSTA musí být rekonstituován pouze rozpouštědlem, které je součástí tohoto balení.
Nenahrazujte žádné komponenty tohoto balení.
Neuchovávejte suspenzi po rekonstituci
Aplikujte dávku co nejdříve po naředění, aby se zabránilo usazování.
Správné dávkování
Musí být podán celý obsah lahvičky, aby bylo zajištěno dosažení zamýšlené dávky přípravku RISPERDAL CONSTA.
JEDNORÁZOVÉ ZAŘÍZENÍ
Nepoužívejte opakovaně
Zdravotnické prostředky vyžadují specifické materiálové vlastnosti, aby mohly být použity, jak bylo zamýšleno. Tyto vlastnosti byly ověřeny pouze pro jednorázové použití. Jakýkoliv pokus o opakované použití aplikátoru může vést k narušení jeho celistvosti a zhoršení použití.
Obsah balení
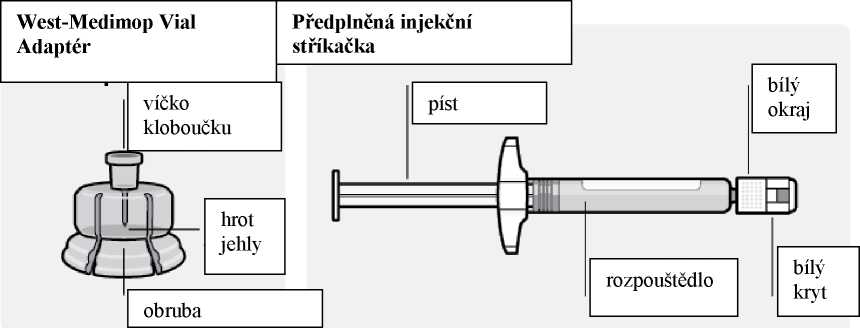
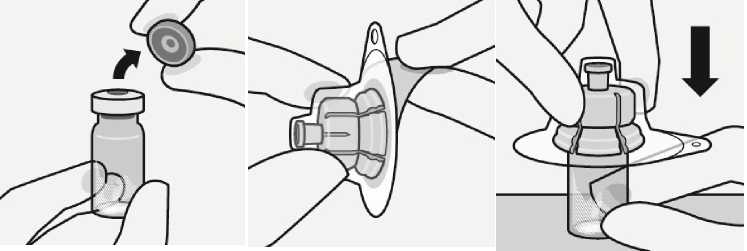
Krok 1
Sestavení jednotlivých částí
Otevření blistru Připojení lahvičky k adaptéru
Vyčkejte 30 minut
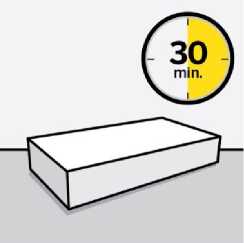
Vyjměte z chladničky balení přípravku a před rekonstitucí jej ponechte stát k docílení pokojové teploty přibližně 30 minut.
Neohřívejte přípravek žádným jiným způsobem.
Odstraňte kryt z lahvičky
Oddělte barevný kryt z injekční lahvičky.
Otřete vršek šedé zátky
desinfekčním
tampónem.
Nechte oschnout na vzduchu.
Neodstraňujte šedou gumovou zátku.
Připravte si adaptér
Uchopte sterilní blistr jak je znázorněno. Odlepte papírovou část blistru.
Nevyjímejte adaptér z blistru.
Nedotýkejte se špičky jehly. Mohlo by to způsobit kontaminaci.
Připojte adaptér k lahvičce
Umístěte lahvičku na tvrdý povrch a držte ji za její spodek. Umístěte adaptér na střed šedé gumové zátky. Tlačte adaptér směrem dolů na horní část lahvičky, dokud nebude bezpečně usazen na místě.
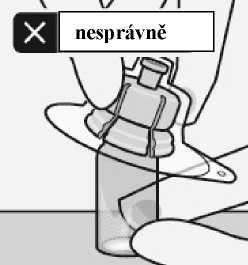
Nepokládejte adaptér na lahvičku šikmo. Rozpouštědlo by mohlo při přesunu do lahvičky prosáknout.
Připojení předplněné injekční stříkačky k adaptéru
Odstranění sterilního Správné uchopení Odstranění krytu Připojení stříkačky
blistru Uchopte stříkačku za Držte bílý okraj k adaptéru
bílý okraj na jejím stříkačky a oddělte Držte adaptér za
! Vyjměte adaptér ze sterilního blistru jen v případě, že jste připraveni oddělit bílý kryt z injekční stříkačky.
konci.
Během spojování nedržte stříkačku za skleněnou část.
D Držte lahvičku ve svislé poloze, aby tekutina nevytékala.
Držte lahvičku za její spodní část a sejměte z adaptéru sterilní blistr.
Neprotřepávejte.
Nedotýkejte se
odkrytého kloboučku adaptéru.
Může to způsobit kontaminaci.
bílý kryt.
Neotáčejte nebo neodřezávejte bílý kryt.
Nedotýkejte se
špičky stříkačky. Mohlo by to způsobit kontaminaci.
rA-
|
f\ | |
|
in> | |
|
[L_ | |
|
Takto vypadá stříkačka po odstranění bílého krytu. | |
Oddělený kryt můžete vyhodit.
jeho obrubu, aby se nehýbal. Držte stříkačku za bílý okraj a poté vsuňte její špičku do otvoru adaptéru.
Nedržte stříkačku za její skleněnou část. Může to způsobit, že se bílý kroužek uvolní nebo odpojí.
Připojte stříkačku k adaptéru pevným točivým pohybem ve směru hodinových ručiček, dokud pevně nepřiléhá. Nepřetáhněte. Přetažení může způsobit zlomení špičky stříkačky.
Krok 2
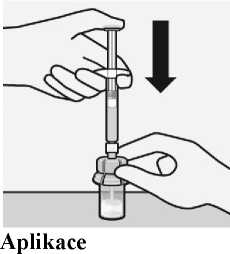
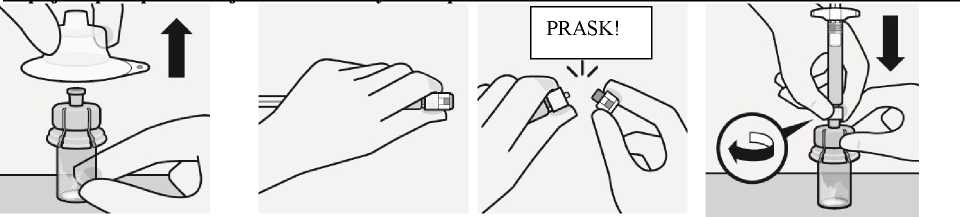
Rekonstituce mikrosfér
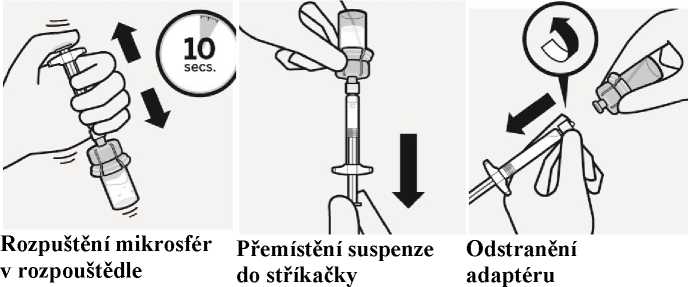
rozpouštědla
Vstříkněte obsah injekční stříkačky s rozpouštědlem do lahvičky.
A—-
Obsah lahvičky je nyní pod tlakem. Tlačte píst palcem směrem dolů.
Třepejte lahvičkou důkladně nejméně 10 sekund a píst při tom přidržujte směrem dolů, jak je znázorněno. Zkontrolujte suspenzi. Když je správně p romíchána, je stejnorodá, hustá a mléčně zbarvená. V tekutině jsou viditelné mikrosféry (částice). Ihned přistupte k
Obraťte lahvičku dnem vzhůru. Pomalu táhněte píst a nasávejte všechnu tekutinu z lahvičky do stříkačky.
Držte stříkačku za bílý okraj a odšroubujte stříkačku od adaptéru.
Oddělte
perforovanou část nálepky na lahvičce. Nalepte odtrženou část nálepky na stříkačku kvůli identifikaci.
Injekční lahvičku a
adaptér znehodnoťte
dalšímu kroku, aby nedošlo k usazení suspenze.
příslušným
způsobem.
Krok 3
Připojení jehly
|
-J1 |
li (i |
i T |
|
1palcová jehla |
2palcová jehla | |
|
do deltového svalu |
do hýžďového svalu | |
|
J | ||
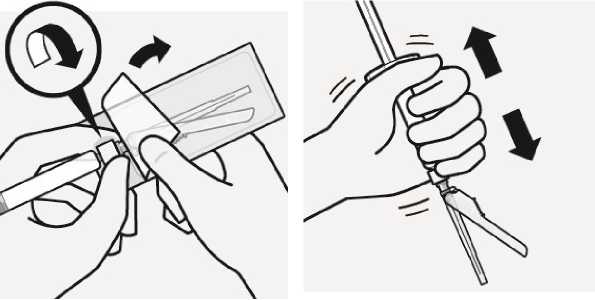
Výběr příslušné jehly
Vyberte jehlu dle místa podání (hýžďového nebo deltového).
Nasazení jehly
Otevřete sáček s jehlou a uchopte ji za její konec, jak je znázorněno.
Uchopte stříkačku za bílý okraj a nasaďte jehlu na klobouček pevným točivým pohybem ve směru hodinových ručiček až do konce.
Nedotýkejte se odkrytého kloboučku jehly. Může to způsobit kontaminaci.
Rozpuštění mikrosfér
Úplně odstraňte blistr. Těsně před injekcí protřepejte znovu důkladně obsah ve stříkačce, protože mohlo dojít k usazování suspenze.
Krok 4
Aplikace injekce
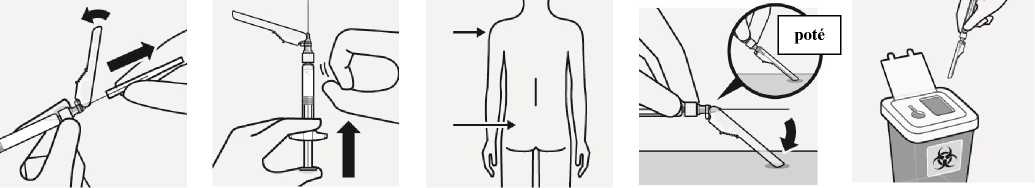
Odstranění průhledného krytu jehly
Odklopte bezpečnostní kryt jehly směrem ke stříkačce tak, jak je znázorněno. Poté uchopte injekční
Odstranění
vzduchových
bublin
Držte stříkačku jehlou vzhůru a jemně poklepejte stříkačku, aby se vzduchové bubliny dostaly do horní
Aplikace injekce
Okamžitě aplikujte celý obsah injekční stříkačky intramuskulárně (i.m.) do hýžďového nebo deltového svalu pacienta.
Pro podání do
Bezpečnostní kryt jehly
Jednou rukou zatlačte na bezpečnostní kryt jehly v úhlu 45 stupňů proti pevnému tvrdému povrchu. Stlačte
Správná likvidace jehel
Zkontrolujte, zda je jehla úplně zasunuta do bezpečnostního krytu. Vyhoďte všechny části do určené nádoby.
stříkačku za bílý okraj a opatrně sejměte průhledný kryt jehly. Neotáčejte průhledným krytem jehly, protože by mohlo dojít k uvolnění spojení v kloboučku.
části. Pomalým a opatrným posouváním pístu směrem nahoru vytlačte vzduch ze stříkačky.
hýžďového svalu zvolte vnější horní kvadrant hýžďové oblasti. Neaplikujte intravenózně.
kryt pevným a rychlým pohybem, dokud se jehla úplně nezasune do bezpečnostního krytu.
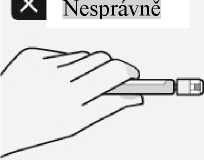
Zamezení poranění jehlou
Nepoužívejte obě
ruce.
Bezpečnostní kryt jehly záměrně neodpojujte a neporušujte pravidla bezpečné manipulace s ním. Nepokoušejte se narovnat jehlu nebo používat
bezpečnostní kryt, pokud je jehla ohnutá nebo poškozená.
Také vyhoďte další nepoužitou jehlu přiloženou v balení.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Janssen-Cilag s.r.o., Karla Engliše 3201/6, 150 00, Praha, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
RISPERDAL CONSTA 25 mg: 68/068/03-C
RISPERDAL CONSTA 37,5 mg: 68/069/03-C
RISPERDAL CONSTA 50 mg: 68/070/03-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19.2.2003
Datum posledního prodloužení registrace: 16.6.2014
10. DATUM REVIZE TEXTU
13.11.2015
27/27