Revatio 0,8 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Revatio 20 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje sildenafilum 20 mg (ve formě citrátu).
Pomocná látka se známým účinkem Jedna tableta obsahuje 0,7 mg laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Bílé kulaté bikonvexní potahované tablety, označené na jedné straně “PFIZER” a “RVT 20” na straně druhé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dospělí
Léčba dospělých pacientů trpících plicní arteriální hypertenzí třídy II a III podle klasifikace WHO, s cílem zlepšit fyzickou zdatnost. Byla prokázána účinnost v léčbě primární plicní hypertenze a plicní hypertenze při onemocnění pojivových tkání.
Pediatrická populace
Léčba pediatrických pacientů ve věku 1-17 let s plicní arteriální hypertenzí. Účinnost ve smyslu zlepšení fyzické zdatnosti nebo plicní hemodynamiky byla prokázána u primární plicní hypertenze a plicní hypertenze při vrozené srdeční vadě (viz bod 5.1).
4.2 Dávkování a způsob podání
Léčbu může zahájit a dále sledovat pouze lékař se zkušenostmi s léčbou plicní arteriální hypertenze.
V případě zhoršení klinických funkcí navzdory léčbě přípravkem Revatio je třeba zvážit jiné možnosti léčby.
Dávkování
Dospělí
Doporučená dávka je 20 mg 3x denně. Lékař musí poučit pacienta, který zapomene užít dávku přípravku Revatio, aby užil dávku co nejdříve a poté pokračoval v užívání jako obvykle. Pacient nesmí užít dvojitou dávku jako náhradu zapomenuté dávky.
Pediatrická populace (1 rok až 17 let)
U pediatrických pacientů ve věku 1-17 let je doporučená dávka při hmotnosti < 20 kg 10 mg 3x denně a při hmotnosti > 20 kg je 20 mg 3x denně. Vyšší než doporučené dávky se nesmí pediatrickým pacientům s PAH podávat (viz rovněž body 4.4 a 5.1). 20 mg tableta nesmí být podána v případech, kde je možné podání 10 mg 3x denně mladším pacientům. Jsou k dispozici jiné lékové pro podání pacientům s hmotností < 20 kg a jiným mladším pacientům, kteří nejsou schopni polykat tablety.
Použití u _pacientů užívajících další léčivé _přípravky
Jakékoli úpravě dávky musí předcházet pečlivé zhodnocení poměru přínosu a rizika. Úprava dávky směrem dolů na 20 mg 2x denně je vhodná při souběžném podání sildenafilu pacientům užívajícím inhibitory CYP3A4, jako je erythromycin nebo sachinavir. Snížení dávky na 20 mg 1x denně je doporučeno při souběžném podání se silnějšími inhibitory CYP3A4 jako je klarithromycin, telithromycin a nefazodon. Pro užití sildenafilu s nejsilnějšími induktory CYP3A4 viz bod 4.3. Při souběžném podání s induktory CYP3A4 může existovat potřeba úpravy dávky sildenafilu (viz bod
4.5) .
Zvláštní populace
Starší pacienti (> 65 let)
Úprava dávky není u starších pacientů potřeba. Klinická účinnost, měřená porovnáním vzdálenosti 6minutové chůze, může být u starších pacientů nižší.
Poškození ledvin
Úprava dávky při zahájení léčby není potřeba u pacientů s poškozením ledvin, včetně závažného poškození ledvin (clearance kreatininu < 30 ml/min). Pouze pokud není léčba dobře snášena, je třeba zvážit, po pečlivém vyhodnocení poměru přínosu a rizika, úpravu dávky směrem dolů na 20 mg 2x denně.
Poškození j jater
U pacientů s poškozením jater (Child-Pugh skóre A a B) není úprava dávky při zahájení léčby potřeba. Pouze pokud není léčba dobře snášena, je třeba zvážit po pečlivém vyhodnocení poměru přínosu a rizika úpravu dávky směrem dolů na 20 mg 2x denně.
Přípravek Revatio je kontraindikován u pacientů se závažným poškozením jater (Child-Pugh skóre C) (viz bod 4.3).
Pediatrická populace
Bezpečnost a účinnost přípravku Revatio u dětí mladších 1 roku nebyla zjišťována. Nejsou k dispozici žádné údaje.
Ukončení léčby
Dostupné údaje nenaznačují, že by přerušení léčby přípravkem Revatio bylo spojeno s rebound-efektem - zhoršením symptomů plicní arteriální hypertenze. Před ukončením léčby je ale vhodné zvážit postupné snižování dávky, aby se zabránilo případnému vzniku náhlého klinického zhoršení. Během období vysazování přípravku se doporučuje zvýšená pozornost.
Způsob podání
Přípravek Revatio je určen k perorálnímu podání. Tablety se užívají s odstupem přibližně 6 až 8 hodin, s jídlem nebo bez jídla.
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Současné užití s látkami schopnými uvolňovat oxid dusnatý (jako je amylnitrit) nebo nitráty v jakékoli formě vzhledem k hypotenzivnímu účinku nitrátů (viz bod 5.1).
Současné podávání PDE5 inhibitorů, včetně sildenafilu, se stimulátory guanylátcyklázy, jako je riocigvát, je kontraindikováno, protože může potenciálně vést k symptomatické hypotenzi (viz bod
4.5) .
Kombinace s nejsilnějšími inhibitory CYP3A4 (např. ketokonazol, itrakonazol, ritonavir) (viz bod
4.5) .
Pacienti, kteří v důsledku nearteritické přední ischemické neuropatie optického nervu (NAION) ztratili zrak u jednoho oka, bez ohledu na to, zda tato příhoda souvisela s předchozím užitím PDE5 inhibitoru či nikoli (viz bod 4.4).
Bezpečnost sildenafilu nebyla studována v následujících podskupinách pacientů a jeho užití je proto kontraindikováno:
Závažné poškození jater,
Nedávná anamnéza cévní mozkové příhody nebo infarktu myokardu,
Závažná hypotenze (krevní tlak < 90/50 mmHg) na počátku léčby.
4.4 Zvláštní upozornění a opatření pro použití
Účinnost přípravku Revatio nebyla zjišťována u pacientů se závažnou plicní arteriální hypertenzí (funkční třída IV). Dojde-li ke zhoršení klinických funkcí, je třeba zvážit možnost léčby doporučenou pro závažnou fázi onemocnění (např. epoprostenol) (viz bod 4.2). Poměr přínosu a rizika sildenafilu nebyl zjišťován u pacientů s plicní arteriální hypertenzí funkční třídy I dle WHO. Studie se sildenafilem byly prováděny u forem plicní arteriální hypertenze: primární (idiopatické), při onemocnění pojivové tkáně a PAH při vrozené srdeční vadě (viz bod 5.1). Užití sildenafilu u jiných forem PAH není doporučeno.
V dlouhodobé pediatrické rozšířené studii byl u pacientů, kteří užívali vyšší než doporučené dávky, pozorován zvýšený počet úmrtí. Proto se nesmí pediatrickým pacientům s PAH podávat vyšší než doporučené dávky (viz rovněž body 4.2 a 5.1).
Retinitis pigmentosa
Bezpečnost sildenafilu nebyla zjišťována u pacientů se známou dědičnou degenerativní poruchou retiny, jako je retinitis pigmentosa (menší část těchto pacientů má dědičné poruchy fosfodiesterázy retiny), a proto není jeho použití doporučeno.
Vazodilatační účinek
Při předepisování sildenafilu by měl lékař pečlivě zvážit, zda by pacient s některými onemocněními mohl být nepříznivě ovlivněn mírným až středně silným vazodilatačním účinkem sildenafilu, např. pacient s hypotenzí, dehydratací, se závažnou obstrukcí odtoku krve z levé komory nebo autonomní dysfunkcí (viz bod 4.4).
Kardiovaskulární rizikové faktory
Po uvedení sildenafilu na trh v indikaci léčby erektilní dysfunkce, byly hlášeny případy závažných kardiovaskulárních příhod včetně infarktu myokardu, nestabilní anginy pectoris, náhlé srdeční smrti, komorové arytmie, mozkového krvácení, tranzitorních ischemických atak, hypertenze a hypotenze. Tyto příhody se vyskytly v časové souvislosti s užitím sildenafilu. Většina z těchto pacientů, ale ne všichni, měla již dříve existující kardiovaskulární rizikové faktory. Rada hlášených příhod vznikla během nebo krátce po pohlavním styku a několik hlášených příhod vzniklo krátce po užití sildenafilu bez souvislosti se sexuální aktivitou. Není možné určit, zda tyto příhody souvisejí přímo s těmito nebo jinými faktory.
Priapismus
Sildenafil by měl být užíván s opatrností u pacientů s anatomickými deformacemi penisu (jako je angulace, kavernózní fibróza či Peyroneova choroba) či u pacientů, kteří mají onemocnění predisponující k priapismu (jako je srpkovitá anémie, mnohočetný myelom či leukémie).
Při použití sildenafilu po uvedení přípravku na trh byla hlášena protrahovaná erekce a priapismus.
V případě erekce, která přetrvává déle než 4 hodiny, má pacient vyhledat okamžitou lékařskou pomoc. Pokud není priapismus okamžitě léčen, mohl by vést k poškození tkáně penisu a trvalé ztrátě potence (viz bod 4.8).
Vazookluzivní krize u pacientů se srpkovitou anémií
Sildenafil nesmí být podáván pacientům s plicní hypertenzí sekundární k srpkovité anémii.
V klinických studiích byly u pacientů užívajících přípravek Revatio častěji hlášeny příhody vazookluzivní krize než u pacientů užívajících placebo, což mělo za následek předčasné ukončení studie.
Účinky na zrak
V souvislosti s užitím sildenafilu i jiných inhibitorů PDE5 byly spontánně hlášeny případy poruchy zraku. V souvislosti s užitím sildenafilu i jiných inhibitorů PDE5 byly spontánně a z observační studie hlášeny případy vzácného onemocnění nearteritické přední ischemické neuropatie optického nervu (NAION) (viz bod 4.8). V případě náhlé poruchy zraku je nutné ihned ukončit léčbu a zvážit další možnosti léčby (viz bod 4.3).
Alfa-blokátory
Současné podávání sildenafilu pacientům užívajícím alfa-blokátory může u některých vnímavých pacientů vést k symptomatické hypotenzi (viz bod 4.5). Aby se minimalizovala možnost vzniku posturální hypotenze, měli by pacienti, léčení alfa-blokátory, být před zahájením terapie sildenafilem hemodynamicky stabilní. Lékaři by měli pacienty poučit, jak se zachovat v případě, že se objeví příznaky hypotenze.
Krvácivé stavy
Studie provedené na lidských krevních destičkách naznačují, že sildenafil in vitro zesiluje antiagregační účinky nitroprusidu sodného. Informace o bezpečnosti podávání sildenafilu pacientům s krvácivými stavy či aktivním peptickým vředem nejsou k dispozici. Proto by těmto pacientům měl sildenafil být podáván pouze po pečlivém zvážení přínosu a rizika.
Antagonisté vitamínu K
U pacientů s plicní arteriální hypertenzí a zvláště u pacientů s plicní arteriální hypertenzí při onemocnění pojivové tkáně existuje možnost zvýšení rizika krvácení, je-li sildenafil podán pacientům již užívajícím antagonistu vitamínu K.
Venookluzivní choroba
O užití sildenafilu u pacientů s plicní arteriální hypertenzí spojenou s plicní venookluzivní chorobou nejsou k dispozici žádné údaje. Při užití vazodilatačních přípravků (hlavně prostacyklinu) byly však u těchto pacientů hlášeny případy život ohrožujícího plicního edému. Proto když se u pacientů s plicní arteriální hypertenzí po podání sildenafilu objeví příznaky plicního edému, je třeba vzít v úvahu přidruženou venookluzivní chorobu.
Nesnášenlivost galaktózy
Potah tablet obsahuje monohydrát laktózy. Pacienti se vzácnými dědičnými poruchami nesnášenlivosti galaktózy, vrozeným deficitem laktázy nebo poruchami vstřebávání glukózy-galaktózy by neměli tento léčivý přípravek užívat.
Užívání sildenafilu s bosentanem
Účinnost sildenafilu u pacientů již léčených bosentanem nebyla přesvědčivě prokázána (viz body 4.5 a 5.1).
Současné použití s jinými inhibitory PDE5
Bezpečnost a účinnost kombinace sildenafilu s jinými inhibitory PDE5, včetně přípravku Viagra, nebyla u pacientů s PAH hodnocena. Proto se případné použití těchto kombinací nedoporučuje (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinky ostatních přípravků na sildenafil In vitro studie
Metabolizmus sildenafilu je zprostředkován převážně cytochromem P450 (CYP), izoformou 3A4 (hlavní cesta) a 2C9 (vedlejší cesta). Proto inhibitory těchto izoenzymů mohou snížit clearance sildenafilu a induktory těchto enzymů mohou jeho clearance zvýšit. Pro doporučení dávek viz body 4.2 a 4.3.
In vivo studie
Bylo hodnoceno souběžné podání p.o. sildenafilu a i.v. epoprostenolu (viz bod 4.8 a 5.1).
Účinnost a bezpečnost sildenafilu souběžně podávaného s jinou léčbou plicní arteriální hypertenze (např. ambrisentan, iloprost) nebyla v kontrolovaných studiích zjišťována. Proto je v případě souběžné léčby nutná opatrnost.
Bezpečnost a účinnost sildenafilu při souběžném podání s jinými inhibitory PDE5 nebyla u pacientů s plicní arteriální hypertenzí zjišťována (viz bod 4.4).
Populační farmakokinetická analýza dat z klinických studií plicní arteriální hypertenze ukázala snížení clearance sildenafilu a/nebo zvýšení perorální biologické dostupnosti, pokud byl sildenafil podáván spolu se substráty CYP3A4 či s kombinací substrátů CYP3A4 a beta-blokátorů. Tyto faktory byly jediné, které statisticky významně ovlivňovaly farmakokinetiku sildenafilu u pacientů s plicní hypertenzí. Expozice sildenafilu u pacientů užívajících substráty CYP3A4 či substráty CYP3A4 s beta-blokátory byla o 43 % a o 66 % vyšší než u pacientů, kteří tuto skupinu léků neužívali.
Expozice sildenafilu byla 5x vyšší při dávce 80 mg 3x denně ve srovnání s expozicí při dávce 20 mg 3x denně. Toto rozmezí koncentrací pokrývá vzestup expozice sildenafilu pozorovaný ve specificky navržených studiích lékových interakcí s inhibitory CYP3A4 (kromě nejsilnějších inhibitorů CYP3A4, např. ketokonazol, itrakonazol, ritonavir).
Předpoklad, že induktory CYP3A4 mají značný vliv na farmakokinetiku sildenafilu u pacientů s plicní arteriální hypertenzí, byl potvrzen v interakční studii in vivo s induktorem CYP3A4 bosentanem.
Současné podávání bosentanu (středně silný induktor CYP3A4, CYP2C9 a možná i CYP2C19) v dávce 125 mg 2x denně se sildenafilem v dávce 80 mg 3x denně (při rovnovážném stavu) po dobu 6 dnů vedlo u zdravých dobrovolníků k 63 % snížení AUC sildenafilu. Populační farmakokinetická analýza údajů o sildenafilu získaných od dospělých pacientů s PAH v klinických hodnoceních zahrnujících 12týdenní studii k zhodnocení účinnosti a bezpečnosti perorálně podávaného sildenafilu v dávce 20 mg třikrát denně, přidaného ke stabilní dávce bosentanu (62,5 mg - 125 mg dvakrát denně), ukázala snížení expozice sildenafilu při souběžném podávání s bosentanem podobné tomu, které bylo pozorováno u zdravých dobrovolníků (viz body 4.4 a 5.1).
Účinnost sildenafilu je třeba více monitorovat u pacientů, kteří souběžně užívají silné induktory CYP3A4, jako je karbamazepin, fenytoin, fenobarbital, třezalka a rifampicin.
Současné podávání inhibitoru HIV proteázy ritonaviru, který je vysoce účinným inhibitorem P450, při rovnovážném stavu (500 mg 2x denně) a sildenafilu (100 mg, jedna dávka) vedlo k 300 % (čtyřnásobnému) vzestupu Cmax sildenafilu a 1000 % (jedenáctinásobnému) vzestupu plazmatické AUC sildenafilu. Po 24 hodinách byly plazmatické hladiny sildenafilu stále kolem 200 ng/ml, v porovnání s 5 ng/ml při podávání sildenafilu samotného. To je v souladu s výrazným účinkem ritonaviru na široké spektrum substrátů P450. Vzhledem k těmto výsledkům je současné podávání sildenafilu a ritonaviru pacientům s plicní arteriální hypertenzí kontraindikováno (viz bod 4.3).
Současné podávání inhibitoru HIV proteázy sachinaviru, inhibitoru CYP3A4, při rovnovážném stavu (1200 mg 3x denně) spolu se sildenafilem (100 mg, jedna dávka) vedlo ke 140 % vzestupu Cmax sildenafilu a 210 % vzestupu AUC sildenafilu. Sildenafil neměl žádný účinek na farmakokinetiku sachinaviru. Pro doporučení dávek viz bod 4.2.
Pokud byla jednotlivá dávka 100 mg sildenafilu podána s erythromycinem, středně silným inhibitorem CYP3A4, při rovnovážném stavu (500 mg 2x denně po dobu 5 dnů), došlo k 182 % vzestupu systémové expozice sildenafilu (AUC). Pro doporučení dávek viz bod 4.2. U zdravých mužských dobrovolníků nebyly pozorovány známky vlivu azithromycinu (500 mg denně po dobu 3 dnů) na AUC, Cmax, Tmax, eliminační konstantu nebo následný poločas sildenafilu nebo jeho hlavních cirkulujících metabolitů. Není potřeba úprava dávek. Cimetidin (800 mg), inhibitor cytochromu P450 a nespecifický inhibitor CYP3A4, způsoboval 56 % vzestup plazmatických koncentrací sildenafilu, pokud byl podáván zdravým dobrovolníkům současně se sildenafilem v dávce 50 mg. Není potřeba úprava dávek.
Nejsilnější inhibitory CYP3A4, jako je ketokonazol a itrakonazol mají zřejmě účinky podobné jako ritonavir (viz bod 4.3). Inhibitory CYP3A4 jako je klarithromycin, telithromycin a nefazodon mají zřejmě účinek mezi účinkem ritonaviru a inhibitory CYP3A4 jako je sachinavir nebo erythromycin, předpokládá se sedminásobný vzestup expozice. Proto jsou-li užívány inhibitory CYP3A4, je doporučena úprava dávkování, viz bod 4.2.
Populační farmakokinetická analýza u pacientů s plicní arteriální hypertenzí naznačuje, že souběžné podání beta-blokátorů v kombinaci se substráty CYP3A4 může vyústit v další vzestup expozice sildenafilu ve srovnání s podáním samotných substrátů CYP3A4.
Grapefruitová šťáva je slabým inhibitorem metabolizmu CYP3A4 ve střevní stěně a může vést k mírnému vzestupu plazmatických hladin sildenafilu. Není potřeba úprava dávek, nicméně se nedoporučuje souběžné podání sildenafilu a grapefruitové šťávy.
Jednotlivá dávka antacid (hydroxid hořečnatý/hydroxid hlinitý) neovlivnila biologickou dostupnost sildenafilu.
Současné podávání perorální antikoncepce (ethinylestradiol 30 ^g a levonorgestrel 150 ^g) nemělo na farmakokinetiku sildenafilu žádný vliv.
Nikorandil je hybridní aktivátor draslíkových kanálů a nitrát. Vzhledem k nitrátové složce má potenciál k závažným interakcím se sildenafilem (viz bod 4.3).
Účinky sildenafilu na jiné přípravky
In vitro studie
Sildenafil je slabý inhibitor cytochromu P450, izoforem 1A2, 2C9, 2C19, 2D6, 2E1 a 3A4 (IC50 > 150 |uM).
Neexistují data týkající se interakce sildenafilu a nespecifických inhibitorů fosfodiesterázy, jako je teofylin a dipyridamol.
In vivo studie
Při podání sildenafilu (50 mg) souběžně s tolbutamidem (250 mg) či warfarinem (40 mg), které jsou oba metabolizovány na CYP2C9, nebyly pozorovány žádné interakce.
Sildenafil neměl významný vliv na expozici atorvastatinu (AUC zvýšeno o 11 %), z čehož lze usuzovat, že sildenafil nemá klinicky významný účinek na CYP3A4.
Žádné interakce nebyly pozorovány ani mezi sildenafilem (100 mg, jedna dávka) a acenokumarolem.
Sildenafil (50 mg) nepotencoval prodloužení doby krvácení, způsobené kyselinou acetylsalicylovou (150 mg).
Sildenafil (50 mg) nepotencoval hypotenzivní účinek alkoholu u zdravých dobrovolníků s průměrnou maximální hladinou alkoholu v krvi 80 mg/dl.
Ve studii se zdravými dobrovolníky vedl sildenafil při rovnovážném stavu (80 mg 3x denně) k 50% vzestupu AUC bosentanu (125 mg 2x denně). Populační farmakokinetická analýza údajů ze studie u dospělých pacientů s PAH na základní léčbě bosentanem (62,5 mg - 125 mg 2x denně) ukázala při souběžném podávání sildenafilu v ustáleném stavu (20 mg 3x denně) vzestup AUC bosentanu v menším rozsahu (20% (95% CI: 9,8 - 30,8), než bylo pozorováno u zdravých dobrovolníků při souběžném podávání s 80 mg sildenafilu 3x denně (viz body 4.4 a 5.1).
Ve specifické studii interakcí, kde byl sildenafil (100 mg) podáván současně s amlodipinem u hypertenzních pacientů, došlo k přídatnému snížení systolického krevního tlaku vleže o 8 mmHg. Odpovídající přídatné snížení diastolického tlaku vleže bylo 7 mmHg. Tato přídatná snížení tlaku byla srovnatelná s podáním samotného sildenafilu zdravým dobrovolníkům.
Ve třech specifických studiích lékových interakcí byl pacientům s benigní hyperplázií prostaty (BPH) stabilizovaným na terapii doxazosinem podáván současně doxazosin (4 mg a 8 mg) a sildenafil (25 mg, 50 mg či 100 mg). V těchto studovaných populacích byl pozorován přídatný pokles systolického a diastolického krevního tlaku vleže průměrně o 7/7 mmHg, 9/5 mmHg a 8/4 mmHg v uvedeném pořadí a průměrný pokles krevního tlaku vestoje o 6/6 mmHg, 11/4 mmHg a 4/5 mmHg. Když byly sildenafil a doxazosin podávány současně pacientům stabilizovaným na léčbě doxazosinem, byly vzácně hlášeny případy pacientů, kteří měli epizody symptomatické posturální hypotenze. Tato hlášení zahrnovala závrať a točení hlavy, ale nikoliv synkopy. Současné podávání sildenafilu pacientům užívajícím alfa-blokátory může u některých vnímavých pacientů vést k symptomatické hypotenzi (viz bod 4.4).
Sildenafil (100 mg, jedna dávka) neovlivnil farmakokinetiku inhibitoru HIV proteázy sachinaviru, jenž je substrátem/inhibitorem CYP3A4, v rovnovážném stavu.
Ve shodě se známými účinky sildenafilu na metabolizmus oxidu dusnatého/cyklického guanosin monofosfátu (cGMP) (viz bod 5.1) je sildenafil schopen zesilovat hypotenzivní účinky nitrátů. Jeho současné užití s látkami schopnými uvolňovat oxid dusnatý nebo nitráty v jakékoli formě je proto kontraindikováno (viz bod 4.3).
Riocigvát: Předklinické studie ukázaly aditivní systémový účinek při snižování krevního tlaku, když byly inhibitory PDE5 kombinovány s riocigvátem. V klinických studiích bylo prokázáno, že riocigvát zesiluje hypotenzní účinek inhibitorů PDE5. U sledované populace nebyl prokázán příznivý klinický účinek kombinace. Současné užívání riocigvátu s PDE5 inhibitory, včetně sildenafilu, je kontraindikováno (viz bod 4.3).
Sildenafil nemá žádný klinicky významný dopad na plazmatické hladiny perorálních kontraceptiv (ethinylestradiol 30 ^.g a levonorgestrel 150 ^.g).
Pediatrická populace
Interakční studie byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku, a kontracepce u mužů i žen
Vzhledem k nedostatku údajů o účinku přípravku Revatio na těhotné ženy, není doporučeno jeho užití u žen ve fertilním věku, pokud neužívají vhodnou kontracepční metodu.
Nejsou k dispozici údaje týkající se použití sildenafilu u těhotných žen. Studie se zvířaty neukazují žádný přímý nebo nepřímý nežádoucí účinek na těhotenství a vývoj zárodku/plodu. Studie se zvířaty prokázaly toxicitu týkající se postnatálního vývoje (viz bod 5.3).
Vzhledem k nedostatku údajů by v případech, kdy to není nezbytné, neměl být přípravek Revatio podáván těhotným ženám.
Kojení
Není známo, zda sildenafil prochází do mateřského mléka. Přípravek Revatio by neměl být podáván kojícím matkám.
Fertilita
Neklinická data neprokázala na základě běžných studií fertility žádné riziko pro člověka (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Revatio má mírný vliv na schopnost řídit a obsluhovat stroje.
Vzhledem k tomu, že byly v klinických studiích sildenafilu popsány závratě a poruchy zraku, pacienti by předtím, než budou řídit či používat stroje, měli být poučeni o tom, jak mohou být přípravkem Revatio ovlivněni
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
V pivotní, placebem kontrolované studii léčby plicní arteriální hypertenze přípravkem Revatio, bylo randomizováno celkem 207 pacientů k léčbě přípravkem Revatio v dávkách 20 mg, 40 mg a 80 mg 3x denně a 70 pacientů k užívání placeba. Délka léčby byla 12 týdnů. Celková četnost přerušení léčby ve skupině léčené sildenafilem v dávkách 20 mg, 40 mg a 80 mg 3x denně byla 2,9%, 3% resp. 8,5%, ve srovnání s 2,9% ve skupině užívající placebo. Z 277 pacientů, kteří dokončili léčbu v pivotní studii, jich 259 vstoupilo do rozšířené dlouhodobé studie. Byly podávány dávky do 80 mg 3x denně (4násobně vyšší než doporučená dávka 20 mg 3x denně) a po 3 letech dostávalo dávku přípravku Revatio 80 mg 3x denně 87% ze 183 pacientů.
V placebem kontrolované studii s přípravkem Revatio, jako přídatné léčby k intravenózně podanému epoprostenolu v léčbě plicní arteriální hypertenze, bylo 134 pacientů léčeno přípravkem Revatio (ve fixní titraci začínající na 20 mg s přechodem na 40 mg a posléze na 80 mg, 3x denně, dle snášenlivosti) a epoprostenolem a 131 pacientů léčených placebem a epoprostenolem. Délka léčby byla 16 týdnů. Celková četnost přerušení léčby u pacientů léčených sildenafilem/epoprostenolem
z důvodu nežádoucích účinků byla 5,2 % v porovnání s 10,7 % u pacientů užívajících placebo/epoprostenol. Nově hlášené nežádoucí účinky, které se objevily častěji u skupiny užívající sildenafil/epoprostenol, byly oční hyperemie, rozmazané vidění, ucpaný nos, noční pocení, bolest zad a sucho v ústech. Známé nežádoucí účinky - bolest hlavy, návaly, bolest končetin a otok - byly zaznamenány s vyšší četností u pacientů léčených sildenafilem/ epoprostenolem ve srovnání s placebem/ epoprostenolem. Ze všech subjektů, které dokončily původní studii, jich 242 vstoupilo do rozšířené dlouhodobé studie. Byly podávány dávky do 80 mg 3x denně a po 3 letech dostávalo dávku přípravku Revatio 80 mg 3x denně 68% ze 133 pacientů.
Ve 2 placebem kontrolovaných studiích byly nežádoucí příhody všeobecně mírné až střední závažnosti. Nejčastějším nežádoucím účinkem při léčbě přípravkem Revatio (10 % nebo více) v porovnání s placebem byla bolest hlavy, návaly, dyspepsie, průjem a bolesti končetin.
Nežádoucí účinky uvedené v tabulce
V následující tabulce jsou shrnuty nežádoucí účinky, které se vyskytly u > 1 % pacientů léčených přípravkem Revatio a byly častější (rozdíl > 1 %) u přípravku Revatio v pilotní studii nebo v souboru kombinovaných dat získaných z placebem kontrolovaných studií léčby plicní arteriální hypertenze při dávkách 20, 40 a 80 mg 3x denně. Jsou seřazeny podle skupin a frekvence (velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100) a není známo (z dostupných dat není možné určit)). V každém určení frekvence jsou nežádoucí účinky seřazeny podle klesající závažnosti. Hlášení ze sledování po uvedení přípravku na trh jsou uvedena kurzívou.
|
MedDRA třídy orgánových systémů (v.14.0) Infekce a infestace |
Nežádoucí účinky |
|
Časté |
celulitida, chřipka, bronchitida, sinusitida, rinitida, gastroenteritida |
|
Poruchy krve a lymfatického systému Časté | |
|
Poruchy metabolizmu a výživy Časté |
retence tekutin |
|
Psychiatrické poruchy Časté |
insomnie, úzkost |
|
Poruchy nervového systému Velmi časté Časté |
migréna, třes, parestézie, pocity pálení, hypestezie |
|
Poruchy oka Časté Méně časté Není známo |
krvácení retiny, poškození zraku, rozmazané vidění, fotofobie, chromatopsie, cyanopsie, podráždění oka, oční hyperemie snížení ostrosti zraku, dvojité vidění, nepříjemný pocit v oku Nearteritická přední ischemická neuropatie optického nervu (NAION)*, retinální cévní okluze*, poruchy zorného pole* |
|
Poruchy ucha a labyrintu Časté Není známo |
náhlá ztráta sluchu |
|
Cévní poruchy Velmi časté Není známo |
flush |
|
Respirační, hrudní a mediastinální poruchy Časté |
Epistaxe, kašel, ucpaný nos |
|
Gastrointestinální poruchy Velmi časté Časté |
gastritida, refluxní choroba jícnu, hemoroidy, abdominální distenze, sucho v ústech |
|
Poruchy kůže a podkožní tkáně Časté Není známo |
alopecie, erytém, noční pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Velmi časté Časté |
bolest končetin myalgie, bolest zad |
|
Poruchy ledvin a močových cest Méně časté |
hematurie |
|
MedDRA třídy orgánových systémů (v.14.0) |
Nežádoucí účinky |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté |
penilní hemoragie, hematospermie, gynekomastie |
|
Není známo |
priapismus, zvýšená erekce |
|
Celkové poruchy a reakce v místě aplikace | |
|
Časté | |
*Tyto nežádoucí účinky byly hlášeny u pacientů užívajících sildenafil pro léčbu erektilní dysfunkce (MED).
Pediatrická _ populace
V placebem kontrolované studii přípravku Revatio u pacientů ve věku 1-17 let s plicní arteriální hypertenzí bylo léčeno celkem 174 pacientů 3x denně buď nízkou dávkou (10 mg u pacientů s hmotností > 20 kg; žádný pacient s hmotností < 20 kg neužíval nízkou dávku), střední dávkou (10 mg u pacientů s hmotností > 8-20 kg, 20 mg u pacientů s hmotností > 20-45 kg, 40 mg u pacientů s hmotností > 45 kg) nebo vysokou dávkou (20 mg u pacientů s hmotností > 8-20 kg, 40 mg u pacientů s hmotností > 20-45 kg, 80 mg u pacientů s hmotností > 45 kg) přípravku Revatio a 60 pacientů dostávalo placebo.
Profil nežádoucích účinků pozorovaný v této pediatrické studii byl obecně shodný s profilem pozorovaným u dospělých (viz tabulka výše). Nejčastějšími nežádoucími účinky, které byly pozorovány (s četností > 1 %) u pacientů léčených přípravkem Revatio (kombinované dávky) s četností > 1 % oproti pacientům, kterým bylo podáváno placebo, byly horečka (11,5 %), infekce horních cest dýchacích (11,5 %), zvracení (10,9 %), zvýšená erekce (včetně spontánní erekce penisu u mužských subjektů) (9,0 %), nauzea (4,6 %), bronchitida (4,6 %), faryngitida (4,0 %), rinorea (3,4 %), pneumonie (2,9 %) a rinitida (2,9 %).
Celkem 220 z 234 pediatrických subjektů léčených v krátkodobé placebem kontrolované studii vstoupilo do dlouhodobé pokračující studie. Subjekty léčené sildenafilem pokračovaly ve stejném léčebném režimu, zatímco subjekty ze skupiny užívající v krátkodobé studii placebo byly náhodně nově zařazeny do skupiny léčené sildenafilem.
Nejčastěji hlášené nežádoucí účinky v průběhu trvání krátkodobé a dlouhodobé studie byly v zásadě obdobné jako nežádoucí účinky pozorované v krátkodobé studii. Nežádoucími účinky, které byly hlášeny u > 10 % z 229 subjektů léčených sildenafilem (kombinovaná skupina dávek, včetně 9 pacientů, kteří nepokračovali do dlouhodobé studie), byly infekce horních cest dýchacích (31 %), bolest hlavy (26 %), zvracení (22 %), bronchitida (20 %), faryngitida (18 %), pyrexie (17 %), průjem (15 %), chřipka (12 %) a epistaxe (12 %). Většina těchto nežádoucích účinků byla považována za mírné a středně závažné.
Závažné nežádoucí účinky byly hlášeny u 94 (41 %) z 229 subjektů užívajících sildenafil. Z 94 subjektů nahlašujících závažné nežádoucí účinky jich 14/55 (25,5 %) bylo ve skupině užívající nízkou dávku, 35/74 (47,3 %) ve skupině užívající střední dávku a 45/100 (45 %) ve skupině užívající vysokou dávku. Nejčastějšími nežádoucími účinky, které byly hlášeny s frekvencí > 1 % u subjektů léčených sildenafilem (kombinovaná skupina dávek), byly pneumonie (7,4 %), srdeční selhání (5,2 %), plicní hypertenze (5,2 %), infekce horních cest dýchacích (3,1 %), pravostranné srdeční selhání (2,6 %), gastroenteritida (2,6 %), synkopa (2,2 %), bronchitida (2,2 %), bronchopneumonie (2,2 %), plicní arteriální hypertenze (2,2 %), bolest na hrudi (1,7 %), zubní kaz (1,7 %), kardiogenní šok (1,3 %), virová gastroenteritida (1,3 %), infekce močového ústrojí (1,3 %).
Následující závažné nežádoucí účinky byly považovány za související s léčbou: enterokolitida, křeče, hypersenzitivita, stridor, hypoxie, neurosenzorická hluchota a komorová arytmie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Ve studiích jednotlivých dávek až do 800 mg u zdravých dobrovolníků byly nežádoucí účinky podobné těm, které byly pozorované při nižších dávkách, ale jejich míra výskytu a závažnost stoupala. Při jednotlivé dávce 200 mg byla incidence nežádoucích reakcí vzrůstající (bolest hlavy, návaly, závratě, dyspepsie, otok nosní sliznice a porucha zraku).
V případě předávkování je vhodné zahájit podle potřeby standardní podpůrnou terapii. Renální dialýza nezrychluje clearance sildenafilu, protože je silně vázán na bílkoviny plazmy a není vylučován močí.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: urologika, léky užívané k léčbě erektilní dysfunkce, ATC kód:
G04BE03
Mechanizmus účinku.
Sildenafil je silný a selektivní inhibitor cGMP specifické fosfodiesterázy typu 5 (PDE5), enzymu zodpovědného za degradaci cGMP. Enzym PDE5 je kromě kavernózního tělíska v penisu přítomen i ve svalovině plicních cév. Sildenafil tedy v hladkých svalech plicních cév zvyšuje hladinu cGMP a vede tak k jejich relaxaci. U pacientů s plicní arteriální hypertenzí to vede k selektivní vazodilataci plicního řečiště a v menší míře i k systémové vazodilataci.
Farmakodynamický účinek
Studie in vitro ukázaly, že sildenafil je selektivní k PDE5. Jeho účinek je mohutnější na PDE5 než na ostatní známé fosfodiesterázy. Ve srovnání s PDE6, která je zapojena do fototransdukční kaskády v sítnici, je selektivita k PDE5 10násobná. Selektivita oproti PDE1 je 80násobná a oproti PDE 2, 3, 4, 7, 8, 9, 10 a 11 potom 700násobná. Sildenafil má především více jak 4000násobnou selektivitu k PDE5 než k PDE3, izoformě fosfodiesterázy specifické k cAMP, zapojené do kontroly srdeční kontraktility.
Sildenafil způsobuje mírný a přechodný pokles systémového krevního tlaku, který ve většině případů nemá klinické projevy. Po dlouhodobém podávání 80 mg 3x denně pacientům se systémovou hypertenzí došlo k poklesu v průměru o 9,4 mmHg a 9,1 mmHg, od výchozích hodnot systolického a diastolického krevního tlaku vleže. Po dlouhodobém podávání 80 mg 3x denně pacientům s plicní arteriální hypertenzí byly pozorovány menší účinky na krevní tlak (snížení systolického i diastolického tlaku o 2 mmHg). Při doporučené dávce 20 mg 3x denně nebylo pozorováno snížení systolického ani diastolického tlaku.
Jednotlivá perorální dávka sildenafilu do výše 100 mg neměla u zdravých dobrovolníků žádné klinicky významné účinky na EKG. Při chronickém dávkování 80 mg 3x denně pacientům s plicní arteriální hypertenzí nebyly hlášeny žádné významné změny na EKG.
Ve studii zkoumající hemodynamický účinek jednotlivé dávky 100 mg sildenafilu u 14 pacientů se závažným onemocněním koronárních tepen (> 70 % stenóza alespoň jedné koronární tepny) byl průměrný systolický a diastolický tlak v klidu snížen o 7 % a 6 % v porovnání s výchozí hodnotou. Průměrný plicní systolický tlak byl snížen o 9 %. Sildenafil nevykazoval žádný účinek na srdeční výdej a nezhoršoval průtok zúženými koronárními tepnami.
U některých testovaných subjektů byla jednu hodinu po užití dávky 100 mg pozorována za použití Farnsworth-Munsellova testu se 100 odstíny mírná a přechodná porucha rozlišování barev (modrá/zelená), dvě hodiny po dávce nebyl žádný efekt patrný. Předpokládaný mechanizmus této změny v rozlišení barev je spojen s inhibicí PDE6, která je zapojena do kaskády fototransdukce v retině. Sildenafil nemá vliv na zrakovou ostrost nebo vnímání kontrastu. V malé, placebem kontrolované studii pacientů s prokázanou makulární degenerací spojenou s raným věkem (n=9), nevykazoval sildenafil v jednotlivé dávce 100 mg významný vliv na provedené zrakové testy (zraková ostrost, Amslerova mřížka, rozlišení barev simulovaného semaforu, Humphreyho perimetr a fotostres).
Klinická účinnost a bezpečnost
Účinnost u dospělých _pacientů s plicní arteriální hypertenzí (PAH)
Randomizovaná dvojitě slepá studie kontrolovaná placebem byla provedena u 278 pacientů s primární PAH, sekundární PAH při onemocnění pojivové tkáně a PAH po chirurgické korekci vrozené srdeční vady. Pacienti byli randomizováni do jedné ze čtyř skupin: placebo, 20 mg sildenafilu, 40 mg sildenafilu a 80 mg sildenafilu, v dávce 3x denně. Z 278 randomizovaných pacientů 277 obdrželo alespoň jednu dávku studovaného léku. Studovaná populace se skládala z 68 (25 %) mužů a 209 (75 %) žen průměrného věku 49 let (rozmezí 18-81 let) s výchozí hodnotou 6minutového testu chůze v rozmezí 100 až 450 metrů včetně (průměr: 344 metrů). 175 pacientů (63 %) bylo diagnostikováno s primární plicní hypertenzí, 84 (30 %) bylo diagnostikováno s plicní arteriální hypertenzí při onemocnění pojivové tkáně a 18 (7 %) pacientů bylo diagnostikováno s plicní arteriální hypertenzí po chirurgické korekci vrozené srdeční vady. Studie se účastnilo nejvíce pacientů se třídou II dle WHO klasifikace (107/277, 39 %) nebo III (160/277, 58 %) s průměrnou výchozí vzdáleností 6minutové chůze 378 resp. 326 metrů; méně pacientů bylo se třídou I (1/2777, 0,4 %) nebo IV (9/277, 3 %). Pacienti s ejekční frakcí levé komory < 45 % nebo indexem komorového zkrácení < 0,2 nebyli studováni.
Sildenafil (nebo placebo) byl přidán k výchozí terapii, která mohla zahrnovat kombinaci antikoagulace, digoxinu, blokátoru kalciového kanálu, diuretika nebo kyslíku. Užití prostacyklinu, prostacyklinových analogů a antagonistů endotelinových receptorů jako přídatné terapie nebylo dovoleno, a stejně tak nebylo dovoleno doplňování argininu. Pacienti, kteří dříve selhali v terapii bosentanem byli ze studie vyloučeni.
Primárním sledovaným parametrem účinnosti byla změna vzdálenosti 6minutové chůze (6minute walk distance, 6MWD) od výchozích hodnot ve 12. týdnu. Statisticky významné prodloužení 6MWD bylo pozorováno u všech tří dávkovacích schémat sildenafilu v porovnání s placebem. Prodloužení 6MWD, korigované o placebo, bylo 45 m (p<0,0001), 46 m (p <0,0001) a 50 m (p<0,0001) pro sildenafil v dávce 20 mg, 40 mg a 80 mg 3x denně v tomto pořadí. Rozdíl mezi jednotlivými dávkami sildenafilu nebyl významný. U pacientů s výchozí hodnotou 6MWD < 325 metrů byla pozorována zlepšená účinnost při použití vyšších dávek (o placebo korigované zlepšení o 58 metrů u dávky 20 mg 3x denně, o 65 metrů u dávky 40 mg 3x denně a o 87 metrů u dávky 80 mg 3x denně).
Při analýze podle funkčních tříd WHO byl u skupiny užívající dávku 20 mg pozorován statisticky významný nárůst ve 6MWD. U třídy II a třídy III byly pozorovány nárůsty (korigované o placebo) o 49 metrů (p = 0,0007) resp. o 45 metrů (p = 0,0031)
Zlepšení 6MWD bylo zřetelné po 4 týdnech léčby a tento účinek přetrvával v 8. a 12. týdnu. Výsledky byly u podskupin všeobecně konzistentní, vzhledem k etiologii (primární PAH a PAH při onemocnění pojivové tkáně), funkční třídě dle WHO, pohlaví, rase, místu, průměrném plicním arteriálním tlaku (mPAP) a indexu plicní vaskulární rezistence (PVRI).
Pacienti užívající všechny dávky sildenafilu dosáhli ve srovnání s těmi, kteří užívali placebo, statisticky významného snížení středního plicního arteriálního tlaku (mPAP) a plicní vaskulární rezistence (PVR). Účinky léčby korigované o placebo u mPAP byly -2,7 mmHg (p=0,04) u sildenafilu 20 mg 3x denně, -3 mmHg (p=0,01) u sildenafilu 40 mg 3x denně a -5,1 mmHg (p=0,0001) u sildenafilu 80 mg 3x denně. Účinky léčby korigované o placebo u PVR byly -178 dyne.sec/cm5 (p=0,0051) u sildenafilu 20 mg 3x denně, -195 dyne.sec/cm5 (p=0,0017) u sildenafilu 40 mg 3x denně a -320 dyne.sec/cm5 (p<0,0001) u sildenafilu 80 mg 3x denně. Ve 12 týdnu bylo u sildenafilu 20 mg, 40 mg resp. 80 mg 3x denně procentní snížení PVR (11,2 %, 12,9 %, 23,3 %) proporčně větší než snížení systémové vaskulární rezistence (SVR) (7,2 %, 5,9 %, 14,4 %). Vliv sildenafilu na mortalitu není znám.
Vyšší podíl pacientů léčených jednotlivými dávkami sildenafilu (tj. 28 %, 36 % resp. 42 % subjektů užívajících sildenafil v dávce 20 mg, 40 mg resp. 80 mg 3x denně) vykazoval ve 12 týdnu zlepšení alespoň o jednu funkční třídu dle WHO v porovnání s placebem (7%). Poměr šancí (Odds ratio) byl 2,92 (p=0,0087), 4,32 (p=0,0004) a 5,75 (p<0,0001).
Dlouhodobá data o přežití u dosud neléčených pacientů
Pacienti zařazeni do pivotní studie měli možnost pokračovat v dlouhodobé rozšířené otevřené studii.
Po 3 letech dostávalo 87% pacientů dávku 80 mg 3x denně. V pivotní studii bylo přípravkem Revatio léčeno 207 pacientů a jejich dlouhodobý status přežití byl sledován po dobu nejméně 3 let. V této populaci byly odhady přežití dle Kaplan-Meierovy metody 96 % v prvním roce, 91 % v druhém roce a 82 % v třetím roce. Přežití u pacientů WHO funkční třídy II bylo při výchozích hodnotách 99 % v prvním roce, 91 % v druhém roce a 84 % v třetím roce a u pacientů WHO funkční třídy III bylo při výchozích hodnotách 94 % v prvním roce, 90 % v druhém roce a 81 % v třetím roce.
Účinnost u dospělých pacientů s PAH (v kombinaci s epoprostenolem)
Byla provedena randomizovaná, dvojitě slepá, placebem kontrolovaná studie s 276 pacienty s PAH, kteří byli stabilizováni na léčbě intravenózně podaným epoprostenolem. Mezi pacienty s PAH byli zařazeni pacienti s primární PAH (212/267, 79 %) a PAH při onemocnění pojivových tkání (55/267,
21 %). Většina pacientů patřila podle výchozích hodnot WHO klasifikace do funkční třídy II (68/267, 26 %) nebo III (175/267, 66 %); méně pacientů patřilo do funkční třídy I (3/267, 1 %) nebo IV (16/267, 6 %); u minima pacientů (5/267, 2 %) WHO funkční třída nebyla známa. Pacienti byli randomizováni do skupiny užívající placebo nebo sildenafil (ve fixní titraci začínající na 20 mg s přechodem na 40 mg a posléze na 80 mg, 3x denně, dle snášenlivosti) užívané v kombinaci s intravenózním epoprostenolem.
Primárním sledovaným parametrem účinnosti byla změna vzdálenosti 6minutové chůze od výchozích hodnot v 16 týdnu. V porovnání s placebem byl zaznamenán statisticky významný příznivější účinek sildenafilu na vzdálenost při 6minutové chůzi. Byl zaznamenán, o hodnoty placeba korigovaný, průměrný nárůst vzdálenosti chůze o 26 metrů ve prospěch sildenafilu (95% CI: 10,8; 41,2) (p=0,0009). U pacientů s výchozí hodnotou vzdálenosti chůze >325 metrů byl pozorován efekt léčby 38,4 metru ve prospěch sildenafilu; u pacientů s výchozí hodnotou vzdálenosti chůze <325 metrů byl pozorován léčebný efekt 2,3 metry ve prospěch placeba. U pacientů s primární PAH byl efekt léčby
31,1 metru v porovnání se 7,7 metru u pacientů s PAH při onemocnění pojivových tkání. Rozdíl ve výsledcích mezi randomizovanými podskupinami mohl být náhodný vzhledem k omezené velikosti skupin.
Pacienti léčeni sildenafilem dosáhli statisticky významného snížení středního tlaku v plicnici (mPAP = mean Pulmonary Arterial Pressure) ve srovnání s pacienty dostávajícími placebo. Byl zaznamenán, o hodnoty placeba korigovaný, průměrný efekt léčby -3,9 mmHg ve prospěch sildenafilu (95% CI: -5,7; -2,1) (p=0,00003). Doba do klinického zhoršení byla sekundárním cílovým ukazatelem, definovaným jako doba od randomizace do výskytu prvních příhod klinického zhoršení (úmrtí, transplantace plic, zahájení léčby bosentanem nebo klinické zhoršení vyžadující změnu léčby epoprostenolem). Léčba sildenafilem významně prodlužuje dobu do klinického zhoršení PAH v porovnání s placebem (p=0,0074). Příhody klinického zhoršení zaznamenalo 23 subjektů ve skupině užívající placebo (17,6 %) v porovnání s 8 subjekty ve skupině léčené sildenafilem (6,0 %).
Dlouhodobá data o _přežití ze studie s epoprostenolem
Pacienti zařazeni do studie s přídatnou léčbou epoprostenolem, měli možnost pokračovat v dlouhodobé rozšířené otevřené studii. Po 3 letech dostávalo 68% pacientů dávku 80 mg 3x denně. Celkem 134 pacientů bylo léčeno přípravkem Revatio v původní studii a jejich dlouhodobý status přežití byl hodnocen po nejméně 3 letech. V této populaci byly odhady přežití dle Kaplan/Meierovy metody po 1 roce 92%, po 2 letech 81% a po 3 letech 74%.
Účinnost a bezpečnost u dospělých _pacientů s PAH (při _použití v kombinaci s bosentanem)
Byla provedena randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie u 103 klinicky stabilních subjektů s PAH (funkční třída II a III dle WHO klasifikace), léčených bosentanem po dobu nejméně tří měsíců. Mezi pacienty s PAH byli zařazeni pacienti s primární PAH a PAH spojenou s onemocněním pojivové tkáně. Pacienti byli randomizováni do skupiny s placebem nebo sildenafilem (20 mg 3x denně) v kombinaci s bosentanem (62,5 - 125 mg 2x denně). Primárním cílovým parametrem účinnosti byla změna 6MWD ve 12. týdnu oproti výchozí hodnotě. Výsledky ukazují, že u 6MWD neexistuje žádný významný rozdíl v pozorované průměrné změně od výchozí hodnoty mezi sildenafilem 20 mg a placebem (13,62 metru (95% CI: -3,89 až 31,12) oproti 14,08 metru (95% CI: -1,78 až 29,95)).
Byly pozorovány rozdíly v 6MWD mezi pacienty s primární PAH a PAH spojenou s onemocněním pojivové tkáně. U subjektů s primární PAH (67 subjektů) činila průměrná změna od výchozí hodnoty 26,39 metru (95% CI: 10,70 až 42,08) ve skupině se sildenafilem a 11,84 metru (95% CI: -8,83 až 32,52) ve skupině s placebem. U subjektů s PAH spojenou s onemocněním pojivové tkáně (36 subjektů) však průměrná změna od výchozí hodnoty činila -18,32 metru (95% CI: -65,66 až 29,02) ve skupině se sildenafilem a 17,50 metru (95% CI: -9,41 až 44,41) ve skupině s placebem.
Celkově byly nežádoucí příhody obecně podobné u obou léčebných skupin (sildenafil plus bosentan oproti bosentanu samotnému) a ve shodě se známým profilem bezpečnosti sildenafilu při použití v monoterapii (viz body 4.4 a 4.5).
Pediatrická populace
V randomizované, dvojitě slepé, multicentrické, placebem kontrolované studii s paralelními skupinami s různými dávkami bylo léčeno 234 subjektů ve věku 1-17 let. Subjekty (38 % mužských a 62 % ženských subjektů) vážily > 8 kg a trpěly primární plicní hypertenzí (PPH) [33 %], nebo PAH sekundární k vrozené srdeční vadě [levo-pravý zkrat 37 %, chirurgicky řešeno 30 %]. V této studii bylo 63 z 234 (27 %) pacientů mladších 7 let (nízká dávka sildenafilu = 2; střední dávka = 17; vysoká dávka = 28; placebo = 16) a 171 z 234 (73 %) pacientů bylo ve věku 7 let a starších (nízká dávka sildenafilu = 40; střední dávka = 38; vysoká dávka = 49; placebo = 44). Nejvíce subjektů mělo na začátku léčby funkční třídu dle WHO I (75/234, 32 %) nebo II (120/234, 51 %), méně pacientů mělo třídu III (35/234, 15 %) nebo IV (1/234, 0,4 %); u malého počtu pacientů nebyla třída známa (3/234,
1,3 %). Pacienti dříve nebyli léčeni konkrétní léčbou PAH a ve studii nebylo povoleno užití prostacyklinu, analogů prostacyklinu a antagonistů endotelinového receptoru, ani náhrady argininu, nitrátů, alfa-blokátorů a silných inhibitorů CYP450 3A4.
Primárním cílovým parametrem účinnosti ve studii bylo vyhodnocení účinnosti 16týdenní chronické léčby perorálně podaným sildenafilem u pediatrických subjektů zlepšit fyzickou zdatnost, měřenou kardiopulmonálním zátěžovým testem (CPET) u subjektů, které byly vývojově schopné test podstoupit (n= 115). Sekundárním cílovým parametrem bylo hemodynamické sledování, vyhodnocení příznaků, měření funkční třídy dle WHO, změny doprovodné léčby a kvality života.
Subjekty byly alokovány do 1 ze 3 skupin léčených sildenafilem; nízké (10 mg), střední (10-40 mg) a vysoké (20-80 mg) dávky přípravku Revatio, podané 3x denně, nebo do skupiny užívající placebo. Konkrétní dávky podané v rámci skupiny byly závislé na tělesné hmotnosti (viz bod 4.8). Poměr subjektů užívajících podpůrnou léčbu před zahájením léčby (antikoagulancia, digoxin, blokátory kalciového kanálu, diuretika a/nebo kyslík) byl podobný v kombinované skupině léčené sildenafilem (47,7 %) a placebem (41,7 %).
Primárním cílovým parametrem účinnosti ve studii byla procentní změna vrcholového příjmu kyslíku (VO2 peak) korigovaná o placebo oproti výchozím hodnotám, měřená testem CPET ve skupinách užívajících kombinované dávky (Tabulka 2). Celkově bylo v testu CPET vyhodnoceno 106 z 234 subjektů (45 %), což zahrnovalo pacienty > 7 let a vývojově schopné test podstoupit. Děti mladší 7 let (kombinovaná dávka sildenafilu = 47, placebo = 16) byly hodnoceny pouze podle sekundárních cílových parametrů. Průměrné hodnoty výchozího vrcholového příjmu kyslíku (VO2) byly srovnatelné ve všech skupinách léčených sildenafilem (17,37 až 18,03 ml/kg/min), a mírně vyšší ve skupině užívající placebo (20,02 ml/kg/min.). Výsledky hlavní analýzy (kombinované skupiny vs. placebo) nebyly statisticky významné (p = 0,056) (viz Tabulka 2). Odhadovaný rozdíl mezi střední dávkou sildenafilu a placebem byl 11,33 % (95% CI: 1,72 to 20,94) (viz Tabulka 2).
Tabulka 2: % změna vrcholového VO2 oproti výchozím hodnotám korigovaná o placebo, podle aktivní léčebné skupiny
Léčebná skupina Nízká dávka (n=24)
Střední dávka (n=26)
Vysoká dávka (n=27)
Kombinace skupin (n
1,72, 20,94
-1,64, 17,60
-0,19, 15,60
n=29 ve skupině užívající placebo
Odhady podle ANCOVA s korekcí pro ostatní náhodné proměnné výchozího vrcholového VO2, etiologie a tělesné hmotnosti skupin.
Pomocí indexu plicní vaskulární rezistence (PVRI) a průměrného plicního arteriálním tlaku (mPAP) byla pozorována zlepšení závislá na velikosti podané dávky. Skupiny léčené střední a vysokou dávkou sildenafilu vykazovaly snížení PVRI oproti placebu, o 18 % (95% CI: 2 % až 32 %) resp. 27 % (95% CI: 14 % až 39 %), zatímco skupina léčená nízkou dávkou nevykazovala významný rozdíl oproti placebu (rozdíl byl 2 %). Skupiny léčené střední a vysokou dávkou sildenafilu vykazovaly změny mPAP oproti výchozím hodnotám v porovnání s placebem, o -3,5 mmHg (95% CI: -8,9, 1,9) resp. -
7,3 mmHg (95% CI: -12,4, -2,1), zatímco skupina léčená nízkou dávkou vykazovala pouze malý nebo žádný rozdíl (rozdíl o 1,6 mmHg). Bylo pozorováno zlepšení srdečního indexu u všech skupin léčených sildenafilem, oproti placebu: 10 % u nízké, 4 % u střední a 15 % u vysoké dávky.
Významná zlepšení funkční třídy byla prokázána pouze u subjektů léčených sildenafilem ve vysokých dávkách v porovnání s placebem. Poměr šancí (Odds ratio) u nízké, střední a vysoké dávky v porovnání s placebem byl 0,6 (95% CI: 0,18, 2,01), 2,25 (95% CI: 0,75, 6,69) resp. 4,52 (95% CI: 1,56, 13,10).
Údaje z dlouhodobého pokračování v léčbě
Celkem 220 z 234 pediatrických subjektů léčených v krátkodobé placebem kontrolované studii vstoupilo do dlouhodobé pokračující studie. Subjekty ze skupiny užívající v krátkodobé studii placebo byly náhodně nově zařazeny do skupiny léčené sildenafilem; subjekty s hmotností < 20 kg byly zařazeny do skupin užívajících střední nebo vysokou dávku (v poměru 1 : 1), zatímco subjekty s hmotností > 20 kg byly zařazeny do skupin užívajících nízkou, střední nebo vysokou dávku (v poměru 1:1:1). Z celkem 229 subjektů užívajících sildenafil, bylo do skupin užívajících nízkou, střední, resp. vysokou dávku zařazeno 55, 74, resp. 100 subjektů. V krátkodobé i dlouhodobé studii se celková doba léčby od dvojitého zaslepení u jednotlivých subjektů pohybovala od 3 do 3129 dní. Ve skupině léčené sildenafilem byla střední doba léčby sildenafilem 1696 dní (vyjma 5 subjektů, které po dvojitém zaslepení dostávaly placebo a nebyly léčeny v dlouhodobé pokračující studii).
Odhad přežití ve 3. roce dle Kaplan-Meierovy metody u pacientů s výchozí tělesnou hmotností > 20 kg byl 94 % ve skupině s nízkou dávkou, 93 % ve skupině se střední dávkou a 85 % ve skupině s vysokou dávkou; u pacientů s výchozí tělesnou hmotností < 20 kg byl 94 % ve skupině se střední dávkou a 93 % ve skupině s vysokou dávkou (viz body 4.4 a 4.8).
V průběhu provádění studie bylo hlášeno celkem 42 případů úmrtí, v průběhu studie, nebo i během následného sledování přežití. K 37 případům úmrtí došlo dříve, než bylo u subjektů rozhodnuto o snížení titrace na nižší dávkování na základě pozorované nerovnováhy v parametru mortality s rostoucími dávkami sildenafilu. Mezi těmito 37 případy úmrtí byly počty (%) případů úmrtí ve skupinách s nízkou, střední, resp. vysokou dávkou sildenafilu 5/55 (9,1 %), 10/74 (13,5 %), resp.
22/100 (22 %). Následně bylo hlášeno dalších 5 případů úmrtí (3 případy ve skupině se střední dávkou a 2 případy ve skupině s vysokou dávkou). Příčiny úmrtí byly typické pro pacienty s PAH. Vyšší než doporučené dávky se nesmí pediatrickým pacientům s PAH podávat (viz body 4.2 a 4.4).
žádné
roce
Po 1 roce od zahájení placebem kontrolované studie byl zjišťován vrcholový VO2. Ze subjektů léčených sildenafilem vývojově schopných podstoupit test CPET nevykázalo 59 ze 114 (52 %) zhoršení vrcholového VO2 od zahájení léčby sildenafilem. Podobně 191 z 229 subjektů (83 %) užívajících sildenafil buď udrželo, nebo zlepšilo svou funkční třídu dle WHO při hodnocení po léčby.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studie s přípravkem Revatio u novorozenců s PAH (viz bod 4.2 informace o použití u dětí).
5.2 Farmakokinetické vlastnosti
Absorpce
Sildenafil se rychle vstřebává. Maximálních pozorovaných plazmatických hladin se dosahuje během 30 až 120 minut (medián 60 minut) po perorálním podání nalačno. Průměrná absolutní perorální biologická dostupnost je 41% (rozmezí 25-63 %). Po perorálním podávání sildenafilu 3x denně stoupá AUC a Cmax v rozsahu dávek 20-40 mg úměrně dávce. Po perorální dávce 80 mg 3x denně byl pozorován o něco vyšší než proporční vzestup plazmatických hladin. U pacientů s plicní arteriální hypertenzí je perorální biologická dostupnost sildenafilu po podání dávky 80 mg 3x denně průměrně o 43 % vyšší (90% CI: 27-60 %) v porovnání s nižší dávkou.
Pokud je sildenafil užíván s jídlem, je míra absorpce snížena, s průměrným zpožděním Tmax o 60 minut a průměrným poklesem Cmax o 29 %, stupeň absorpce ale nebyl významně ovlivněn (AUC snížena o 11%).
Distribuce
Průměrný distribuční objem v rovnovážném stavu (Vss) je pro sildenafil 105 l, což svědčí pro distribuci do tkání. Po perorální dávce 20 mg 3x denně jsou průměrné maximální plazmatické hladiny sildenafilu v rovnovážném stavu přibližně 113 ng/ml. Sildenafil a jeho hlavní cirkulující N-demetylovaný metabolit se váží na plazmatické bílkoviny přibližně z 96 %. Vazba na bílkoviny plazmy není závislá na celkové koncentraci.
Biotransformace
Sildenafil je odbouráván především jaterními mikrozomálními izoenzymy CYP3A4 (hlavní cesta) a CYP2C9 (vedlejší cesta). Hlavní cirkulující metabolit vzniká N-demetylací sildenafilu. Tento metabolit má profil fosfodiesterázové aktivity podobný sildenafilu a in vitro účinek na PDE5 přibližně 50 % ve srovnání s mateřskou látkou. N-demetylovaný metabolit je dále metabolizován s terminálním poločasem přibližně 4 hodiny. U pacientů s plicní arteriální hypertenzí jsou plazmatické koncentrace u N-demetylovaného metabolitu přibližně 72 % koncentrace sildenafilu při dávkování 20 mg 3x denně (to představuje 36% podíl na farmakologických účincích sildenafilu). Následný vliv na účinnost není znám.
Eliminace
Celková tělesná clearance sildenafilu je 41 l/hod s výsledným koncovým poločasem 3-5 hodin. Po perorálním nebo intravenózním podání je sildenafil vylučován jako metabolity převážně ve stolici (přibližně 80 % podané perorální dávky) a v menší míře močí (přibližně 13 % podané perorální dávky).
Farmakokinetika u zvláštních skupin pacientů
Starší pacienti
Zdraví starší dobrovolníci (65 let a více) vykazovali sníženou clearance sildenafilu, což vedlo k vyšším plazmatickým hladinám sildenafilu přibližně o 90 % a jeho aktivního N-demetylovaného metabolitu, v porovnání s mladšími zdravými dobrovolníky (18-45 let). Vzhledem k věkovým rozdílům ve vazbě na plazmatické bílkoviny byl odpovídající vzestup volné plazmatické koncentrace sildenafilu přibližně 40 %.
Renální insuficience
U dobrovolníků s mírným až středním poškozením ledvin (clearance kreatininu = 30-80 ml/min) nebyla farmakokinetika sildenafilu po podání jednotlivé 50 mg dávky změněna. U dobrovolníků s těžkým stupněm poškození ledvin (clearance kreatininu < 30 ml/min) byla clearance sildenafilu snížena, což vedlo k průměrnému vzestupu AUC a Cmax o 100 % a 88 % ve srovnání s věkově odpovídajícími dobrovolníky bez renálního poškození. Navíc byly u pacientů s těžkým poškozením ledvin významně zvýšeny hodnoty AUC a Cmax pro N-demetylovaný metabolit o 200 % a 79 %, v porovnání se subjekty s normální renální funkcí.
Jaterní insuficience
U dobrovolníků s mírnou až střední jaterní cirhózou (Child-Pugh skóre A a B) byla clearance sildenafilu snížena, což vedlo k vzestupu AUC (85 %) a Cmax (47 %) ve srovnání s dobrovolníky odpovídajícího věku bez poškození jater. Navíc byly u subjektů s cirhózou hodnoty AUC a Cmax N-demetylovaného metabolitu výrazně zvýšené o 154 % a 87 %, v porovnání se subjekty s normální jaterní funkcí. Farmakokinetika sildenafilu u pacientů s těžkým poškozením jater nebyla studována.
Populační farmakokinetika
Průměrné koncentrace rovnovážného stavu byly u pacientů s plicní arteriální hypertenzí v rozsahu studovaných dávek 20-80 mg 3x denně o 20-50 % vyšší ve srovnání se zdravými dobrovolníky. Cmin byla ve srovnání se zdravými dobrovolníky dvojnásobná. Tyto závěry naznačují nižší clearance a/nebo vyšší perorální biologickou dostupnost sildenafilu u pacientů s plicní arteriální hypertenzí ve srovnání se zdravými dobrovolníky.
Pediatrická _ populace
Na základě analýzy farmakokinetického profilu sildenafilu u pacientů zahrnutých v pediatrických klinických studiích, se tělesná hmotnost ukázala být prediktorem expozice u dětí. Hodnoty poločasu plazmatické koncentrace sildenafilu jsou odhadovány na 4,2-4,4 hodiny u tělesné hmotnosti 10-70 kg a nevykazovaly žádný rozdíl, který by mohl být klinicky významný. Cmax po jednorázovém podání 20 mg sildenafilu p.o. byl odhadnut na 49 ng/ml u pacienta vážícího 70 kg, 104 ng/ml u pacienta vážícího 20 kg a 165 ng/ml u pacienta vážícího 10 kg. Cmax po jednorázovém podání 10 mg sildenafilu p.o. byla odhadnuta na 24 ng/ml u pacienta vážícího 70 kg, 53 ng/ml u pacienta vážícího 20 kg a 85 ng/ml u pacienta vážícího 10 kg. Tmax byl odhadnut na přibližně 1 hodinu a byl téměř nezávislý na tělesné hmotnosti.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje, získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, toxicity při reprodukci a vývoje, neodhalily žádné zvláštní riziko pro člověka.
U mláďat potkanů, která byla pre- a postnatálně léčena sildenafilem v dávce 60 mg/kg, byla při expozici přibližně 50x vyšší než je očekávaná expozice u člověka při dávce 20 mg 3x denně, pozorována snížená velikost vrhu, nižší hmotnost mláďat v den narození a snížené přežití po 4 dnech. Účinky v neklinických studiích byly pozorovány při expozicích dostatečně převyšujících maximální expozici u člověka, což svědčí o malém významu při klinickém použití.
U zvířat nebyly při klinicky relevantních expozicích pozorovány žádné nežádoucí účinky, potenciálně klinicky významné, které by rovněž nebyly pozorovány v klinických studiích.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Mikrokrystalická celulosa Hydrogenfosforečnan vápenatý Sodná sůl kroskarmelosy Magnesium-stearát
Potah
Hypromelosa Oxid titaničitý (E171)
Monohydrát laktosy Triacetin.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
5 let
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
PVC/Al blistry obsahující 90 tablet.
Velikost balení je 90 tablet v krabičce.
PVC/Al blistry obsahující 300 tablet.
Velikost balení je 300 tablet v krabičce.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a zacházení s ním
Žádné zvláštní požadavky pro likvidaci.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer Limited, Sandwich, Kent CT13 9NJ, Velká Británie
8. REGISTRAČNÍ ČÍSLO
EU/1/05/318/001
EU/1/05/318/004
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28.října 2005 Datum posledního prodloužení: 23.září 2010
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
1. NÁZEV PŘÍPRAVKU
Revatio 0,8 mg/ml injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden mililitr roztoku obsahuje sildenafilum 0,8 mg (ve formě citrátu). Jedna 20ml lahvička obsahuje 12,5 ml roztoku (10 mg sildenafilu ve formě citrátu).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok Čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Revatio injekční roztok je určen k léčbě dospělých pacientů (> 18 let) trpících plicní arteriální hypertenzí, kterým byl předepsán přípravek Revatio v perorální formě, ale dočasně nemohou perorální přípravek užívat, a jinak jsou klinicky i hemodynamicky stabilní.
Přípravek Revatio tablety je určen k léčbě dospělých pacientů trpících plicní arteriální hypertenzí třídy II a III podle klasifikace WHO, s cílem zlepšit fyzickou zdatnost. Byla prokázána účinnost v léčbě primární plicní hypertenze a plicní hypertenze při onemocnění pojivových tkání.
4.2 Dávkování a způsob podání
Léčbu může zahájit a dále sledovat pouze lékař se zkušenostmi s léčbou plicní arteriální hypertenze.
V případě zhoršení klinických funkcí navzdory léčbě přípravkem Revatio je třeba zvážit jiné možnosti léčby.
Přípravek Revatio injekční roztok je možné podat pouze pacientům, kterým byl předepsán přípravek Revatio tablety, jako náhrada perorálního podání v podmínkách, kdy dočasně nemohou perorální léčbu přípravkem Revatio užívat.
Bezpečnost a účinnost dávek vyšších než 12,5 ml (10 mg) 3x denně nebyla stanovena.
Dávkování
Dospělí
Doporučená dávka je 10 mg (odpovídající 12,5 ml) 3x denně podaná i.v. jako bolus (viz bod 6.6).
Dávka 10 mg přípravku Revatio injekční roztok je určena k zajištění expozice sildenafilu a jeho N-demetylovaného metabolitu a farmakologických účinků srovnatelných s dávkou 20 mg podanou p.o..
Použití u _pacientů užívajících další léčivé _přípravky
Jakékoli úpravě dávky musí předcházet pečlivé zhodnocení poměru přínosu a rizika. Úprava dávky směrem dolů na 20 mg 2x denně je vhodná při souběžném podání sildenafilu pacientům užívajícím inhibitory CYP3A4, jako je erythromycin nebo sachinavir. Snížení dávky na 20 mg 1x denně je doporučeno při souběžném podání se silnějšími inhibitory CYP3A4 jako je klarithromycin, telithromycin a nefazodon. Pro užití sildenafilu s nejsilnějšími induktory CYP3A4 viz bod 4.3. Při souběžném podání s induktory CYP3A4 může existovat potřeba úpravy dávky sildenafilu (viz bod
4.5) .
Zvláštní populace
Starší pacienti (> 65 let)
Úprava dávkování není u starších pacientů potřeba. Klinická účinnost, měřená porovnáním vzdálenosti 6minutové chůze, může být u starších pacientů nižší.
Poškození ledvin
Úprava dávky při zahájení léčby není potřeba u pacientů s poškozením ledvin, včetně závažného poškození ledvin (clearance kreatininu < 30 ml/min). Pouze pokud není léčba dobře snášena, je třeba zvážit, po pečlivém vyhodnocení poměru přínosu a rizika, úpravu dávky směrem dolů na 20 mg 2x denně.
Poškození jater
U pacientů s poškozením jater (Child-Pugh skóre A a B) není úprava dávky při zahájení léčby potřeba. Pouze pokud není léčba dobře snášena, je třeba zvážit po pečlivém vyhodnocení poměru přínosu a rizika úpravu dávky směrem dolů na 20 mg 2x denně.
Přípravek Revatio je kontraindikován u pacientů se závažným poškozením jater (Child-Pugh skóre C) (viz bod 4.3).
Pediatrická _ populace
Přípravek Revatio injekční roztok není doporučen k použití u dětí mladších 18 let vzhledem k nedostatečným údajům o bezpečnosti a účinnosti.
Ukončení léčby
Dostupné údaje nenaznačují, že by přerušení p.o. léčby přípravkem Revatio bylo spojeno s rebound-efektem - zhoršením symptomů plicní arteriální hypertenze. Před ukončením léčby je ale vhodné zvážit postupné snižování dávky, aby se zabránilo případnému vzniku náhlého klinického zhoršení. Během období vysazování přípravku se doporučuje zvýšená pozornost.
Způsob podání
Přípravek Revatio injekční roztok je určen k intravenóznímu podání jako bolus. Viz bod 6.6 pro instrukce k použití.
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Současné užití s látkami schopnými uvolňovat oxid dusnatý (jako je amylnitrit) nebo nitráty v jakékoli formě vzhledem k hypotenzivnímu účinku nitrátů (viz bod 5.1).
Současné podávání PDE5 inhibitorů, včetně sildenafilu, se stimulátory guanylátcyklázy, jako je riocigvát, je kontraindikováno, protože může potenciálně vést k symptomatické hypotenzi (viz bod
4.5) .
Kombinace s nejsilnějšími inhibitory CYP3A4 (např. ketokonazol, itrakonazol, ritonavir) (viz bod
4.5) .
Pacienti, kteří v důsledku nearteritické přední ischemické neuropatie optického nervu (NAION) ztratili zrak u jednoho oka, bez ohledu na to, zda tato příhoda souvisela s předchozím užitím PDE5 inhibitoru (viz bod 4.4) či nikoli.
Bezpečnost sildenafilu nebyla studována v následujících podskupinách pacientů a jeho užití je proto kontraindikováno:
Závažné poškození jater,
Nedávná anamnéza cévní mozkové příhody nebo infarktu myokardu,
Závažná hypotenze (krevní tlak < 90/50 mmHg) na počátku léčby.
4.4 Zvláštní upozornění a opatření pro použití
Nejsou k dispozici údaje o užití sildenafilu podávaného i.v. u pacientů klinicky nebo hemodynamicky nestabilních. Proto se jeho podávání těmto pacientům nedoporučuje.
Účinnost přípravku Revatio nebyla zjišťována u pacientů se závažnou plicní arteriální hypertenzí (funkční třída IV). Dojde-li ke zhoršení klinických funkcí, je třeba zvážit možnost léčby doporučenou pro závažnou fázi onemocnění (např. epoprostenol) (viz bod 4.2).
Poměr přínosu a rizika sildenafilu nebyl zjišťován u pacientů s plicní arteriální hypertenzí funkční třídy I dle WHO. Studie se sildenafilem byly prováděny u forem plicní arteriální hypertenze: primární (idiopatické), při onemocnění pojivové tkáně a PAH při vrozené srdeční vadě (viz bod 5.1). Užití sildenafilu u jiných forem PAH není doporučeno.
Retinitis pigmentosa
Bezpečnost sildenafilu nebyla zjišťována u pacientů se známou dědičnou degenerativní poruchou retiny, jako je Retinitis pigmentosa (menší část těchto pacientů má dědičné poruchy fosfodiesterázy retiny), a proto není jeho použití doporučeno.
Vazodilatační účinek
Při předepisování sildenafilu by měl lékař pečlivě zvážit, zda by pacient s některými onemocněními mohl být nepříznivě ovlivněn mírným až středně silným vazodilatačním účinkem sildenafilu, např. pacient s hypotenzí, dehydratací, se závažnou obstrukcí odtoku krve z levé komory nebo autonomní dysfunkcí (viz bod 4.4).
Kardiovaskulární rizikové faktory
Po uvedení sildenafilu na trh v indikaci léčby erektilní dysfunkce, byly hlášeny případy závažných kardiovaskulárních příhod včetně infarktu myokardu, nestabilní anginy pectoris, náhlé srdeční smrti, komorové arytmie, mozkového krvácení, tranzitorních ischemických atak, hypertenze a hypotenze. Tyto příhody se vyskytly v časové souvislosti s užitím sildenafilu. Většina z těchto pacientů, ale ne všichni, měla již dříve existující kardiovaskulární rizikové faktory. Rada hlášených příhod vznikla během nebo krátce po pohlavním styku a několik hlášených příhod vzniklo krátce po užití sildenafilu bez souvislosti se sexuální aktivitou. Není možné určit, zda tyto příhody souvisejí přímo s těmito nebo jinými faktory.
Priapismus
Sildenafil by měl být užíván s opatrností u pacientů s anatomickými deformacemi penisu (jako je angulace, kavernózní fibróza či Peyroneova choroba) či u pacientů, kteří mají onemocnění predisponující k priapismu (jako je srpkovitá anémie, mnohočetný myelom či leukémie).
Při použití sildenafilu po uvedení přípravku na trh byla hlášena protrahovaná erekce a priapismus.
V případě erekce, která přetrvává déle než 4 hodiny, má pacient vyhledat okamžitou lékařskou pomoc. Pokud není priapismus okamžitě léčen, mohl by vést k poškození tkáně penisu a trvalé ztrátě potence (viz bod 4.8).
Vazookluzivní krize u pacientů se srpkovitou anémií
Sildenafil nesmí být podáván pacientům s plicní hypertenzí sekundární k srpkovité anémii.
V klinických studiích byly u pacientů užívajících přípravek Revatio častěji hlášeny příhody vazookluzivní krize než u pacientů užívajících placebo, což mělo za následek předčasné ukončení studie.
Účinky na. zrak
V souvislosti s užitím sildenafilu i jiných inhibitorů PDE5 byly spontánně hlášeny případy poruchy zraku. V souvislosti s užitím sildenafilu i jiných inhibitorů PDE5 byly spontánně a z observační studie hlášeny případy vzácného onemocnění nearteritické přední ischemické neuropatie optického nervu (NAION) (viz bod 4.8). V případě náhlé poruchy zraku je nutné ihned ukončit léčbu a zvážit další možnosti léčby (viz bod 4.3).
Alfa-blokátorv
Současné podávání sildenafilu pacientům užívajícím alfa-blokátory může u některých vnímavých pacientů vést k symptomatické hypotenzi (viz bod 4.5). Aby se minimalizovala možnost vzniku posturální hypotenze, měli by pacienti, léčení alfa-blokátory, být před zahájením terapie sildenafilem hemodynamicky stabilní. Lékaři by měli pacienty poučit, jak se zachovat v případě, že se objeví příznaky hypotenze.
Krvácivé stavy
Studie provedené na lidských krevních destičkách naznačují, že sildenafil in vitro zesiluje antiagregační účinky nitroprusidu sodného. Informace o bezpečnosti podávání sildenafilu pacientům s krvácivými stavy či aktivním peptickým vředem nejsou k dispozici. Proto by těmto pacientům měl sildenafil být podáván pouze po pečlivém zvážení přínosu a rizika.
Antagonisté vitamínu K
U pacientů s plicní arteriální hypertenzí a zvláště u pacientů s plicní arteriální hypertenzí při onemocnění pojivové tkáně existuje možnost zvýšení rizika krvácení, je-li sildenafil podán pacientům již užívajícím antagonistu vitamínu K.
Venookluzivní choroba
O užití sildenafilu u pacientů s plicní arteriální hypertenzí spojenou s plicní venookluzivní chorobou nejsou k dispozici žádné údaje. Při užití vazodilatačních přípravků (hlavně prostacyklinu) byly však u těchto pacientů hlášeny případy život ohrožujícího plicního edému. Proto když se u pacientů s plicní arteriální hypertenzí po podání sildenafilu objeví příznaky plicního edému, je třeba vzít v úvahu přidruženou venookluzivní chorobu.
Užívání sildenafilu s bosentanem
Účinnost sildenafilu u pacientů již léčených bosentanem nebyla přesvědčivě prokázána (viz body 4.5 a 5.1).
Současné použití s jinými inhibitory PDE5
Bezpečnost a účinnost kombinace sildenafilu s jinými inhibitory PDE5, včetně přípravku Viagra, nebyla u pacientů s PAH hodnocena. Proto se případné použití těchto kombinací nedoporučuje (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Není-li uvedeno jinak, studie lékových interakcí byly provedeny se zdravými dobrovolníky - muži, užívajícími sildenafil p.o.. Tyto výsledky jsou relevantní i pro další populace a cesty podání.
Účinky ostatních přípravků na i.v. sildenafil
Odhady vycházející z farmakokinetických modelů naznačují, že lékových interakcí s inhibitory CYP3A4 bude méně než těch pozorovaných u p.o. sildenafilu. Závažnost těchto interakcí lze očekávat nižší pro i.v. sildenafil, protože interakce p.o. sildenafilu jsou alespoň z části ovlivněné first pass efektem metabolizmu.
Účinky ostatních přípravků na p.o. sildenafil In vitro studie
Metabolizmus sildenafilu je zprostředkován převážně cytochromem P450 (CYP), izoformou 3A4 (hlavní cesta) a 2C9 (vedlejší cesta). Proto inhibitory těchto izoenzymů mohou snížit clearance
sildenafilu a induktory těchto enzymů mohou jeho clearance zvýšit. Pro doporučení dávek viz body
4.2 a 4.3.
In vivo studie
Bylo hodnoceno souběžné podání p.o. sildenafilu a i.v. epoprostenolu (viz bod 4.8 a 5.1).
Účinnost a bezpečnost sildenafilu souběžně podávaného s jinou léčbou plicní arteriální hypertenze (např. ambrisentan, iloprost) nebyla v kontrolovaných studiích zjišťována. Proto je v případě souběžné léčby nutná opatrnost.
Bezpečnost a účinnost sildenafilu při souběžném podání s jinými inhibitory PDE5 nebyla u pacientů s plicní arteriální hypertenzí zjišťována (viz bod 4.4).
Populační farmakokinetická analýza dat z klinických studií plicní arteriální hypertenze ukázala snížení clearance sildenafilu a/nebo zvýšení perorální biologické dostupnosti, pokud byl sildenafil podáván spolu se substráty CYP3A4 či s kombinací substrátů CYP3A4 a beta-blokátorů. Tyto faktory byly jediné, které statisticky významně ovlivňovaly farmakokinetiku p.o. sildenafilu u pacientů s plicní hypertenzí. Expozice sildenafilu u pacientů užívajících substráty CYP3A4 či substráty CYP3A4 s beta-blokátory byla o 43 % a o 66 % vyšší než u pacientů, kteří tuto skupinu léků neužívali.
Expozice sildenafilu byla 5x vyšší při p.o. dávce 80 mg 3x denně ve srovnání s expozicí při p.o. dávce 20 mg 3x denně. Toto rozmezí koncentrací pokrývá vzestup expozice sildenafilu pozorovaný ve specificky navržených studiích lékových interakcí s inhibitory CYP3A4 (kromě nejsilnějších inhibitorů CYP3A4, např. ketokonazol, itrakonazol, ritonavir).
Předpoklad, že induktory CYP3A4 mají značný vliv na farmakokinetiku p.o. sildenafilu u pacientů s plicní arteriální hypertenzí, byl potvrzen v interakční studii in vivo s induktorem CYP3A4 bosentanem.
Současné podávání bosentanu (středně silný induktor CYP3A4, CYP2C9 a možná i CYP2C19) v dávce 125 mg 2x denně se sildenafilem v p.o. dávce 80 mg 3x denně (při rovnovážném stavu) po dobu 6 dnů vedlo u zdravých dobrovolníků k 63 % snížení AUC sildenafilu. Populační farmakokinetická analýza údajů o sildenafilu získaných od dospělých pacientů s PAH v klinických hodnoceních zahrnujících 12týdenní studii k zhodnocení účinnosti a bezpečnosti perorálně podávaného sildenafilu v dávce 20 mg třikrát denně, přidaného ke stabilní dávce bosentanu (62,5 mg - 125 mg dvakrát denně), ukázala snížení expozice sildenafilu při souběžném podávání s bosentanem podobné tomu, které bylo pozorováno u zdravých dobrovolníků (viz body 4.4 a 5.1).
Účinnost sildenafilu je třeba více monitorovat u pacientů, kteří souběžně užívají silné induktory CYP3A4, jako je karbamazepin, fenytoin, fenobarbital, třezalka a rifampicin.
Současné podávání inhibitoru HIV proteázy ritonaviru, který je vysoce účinným inhibitorem P450, při rovnovážném stavu (500 mg 2x denně) a p.o. sildenafilu (100 mg, jedna dávka) vedlo k 300 % (čtyřnásobnému) vzestupu Cmax sildenafilu a 1000 % (jedenáctinásobnému) vzestupu plazmatické AUC sildenafilu. Po 24 hodinách byly plazmatické hladiny sildenafilu stále kolem 200 ng/ml, v porovnání s 5 ng/ml při podávání sildenafilu samotného. To je v souladu s výrazným účinkem ritonaviru na široké spektrum substrátů P450. Vzhledem k těmto výsledkům je současné podávání sildenafilu a ritonaviru pacientům s plicní arteriální hypertenzí kontraindikováno (viz bod 4.3).
Současné podávání inhibitoru HIV proteázy sachinaviru, inhibitoru CYP3A4, při rovnovážném stavu (1200 mg 3x denně) spolu s p.o. sildenafilem (100 mg, jedna dávka) vedlo ke 140 % vzestupu Cmax sildenafilu a 210 % vzestupu AUC sildenafilu. Sildenafil neměl žádný účinek na farmakokinetiku sachinaviru. Pro doporučení dávek viz body 4.2 a 4.3.
Pokud byla jednotlivá dávka 100 mg p.o. sildenafilu podána s erythromycinem, středně silným inhibitorem CYP3A4, při rovnovážném stavu (500 mg 2x denně po dobu 5 dnů), došlo k 182 % vzestupu systémové expozice sildenafilu (AUC). Pro doporučení dávek viz body 4.2 a 4.3.
U zdravých mužských dobrovolníků nebyly pozorovány známky vlivu azithromycinu (500 mg denně
po dobu 3 dnů) na AUC, Cmax, Tmax, eliminační konstantu nebo následný poločas p.o. sildenafilu nebo jeho hlavních cirkulujících metabolitů. Není potřeba úprava dávek. Cimetidin (800 mg), inhibitor cytochromu P450 a nespecifický inhibitor CYP3A4, způsoboval 56 % vzestup plazmatických koncentrací sildenafilu, pokud byl podáván zdravým dobrovolníkům současně se sildenafilem v dávce 50 mg. Není potřeba úprava dávek.
Nejsilnější inhibitory CYP3A4, jako je ketokonazol a itrakonazol mají zřejmě účinky podobné jako ritonavir (viz bod 4.3). Inhibitory CYP3A4 jako je klarithromycin, telithromycin a nefazodon) mají zřejmě účinek mezi účinkem ritonaviru a inhibitory CYP3A4 jako je sachinavir nebo erythromycin, předpokládá se sedminásobný vzestup expozice. Proto jsou-li užívány inhibitory CYP3A4, je doporučena úprava dávkování viz bod 4.2.
Populační farmakokinetická analýza u pacientů s plicní arteriální hypertenzí užívajících p.o. sildenafil naznačuje, že souběžné podání beta-blokátorů v kombinaci se substráty CYP3A4 může vyústit v další vzestup expozice sildenafilu ve srovnání s podáním samotných substrátů CYP3A4.
Grapefruitová šťáva je slabým inhibitorem metabolizmu CYP3A4 ve střevní stěně a může vést k mírnému vzestupu plazmatických hladin p.o. sildenafilu. Není potřeba úprava dávek, nicméně se nedoporučuje souběžné podání sildenafilu a grapefruitové šťávy.
Jednotlivá dávka antacid (hydroxid hořečnatý/hydroxid hlinitý) neovlivnila biologickou dostupnost p.o. sildenafilu.
Současné podávání perorální antikoncepce (ethinylestradiol 30 ^g a levonorgestrel 150 ^g) nemělo na farmakokinetiku p.o. sildenafilu žádný vliv.
Nikorandil je hybridní aktivátor draslíkových kanálů a nitrát. Vzhledem k nitrátové složce má potenciál k závažným interakcím se sildenafilem (viz bod 4.3).
Účinky p.o. sildenafilu na jiné přípravky
In vitro studie
Sildenafil je slabý inhibitor cytochromu P450, izoforem 1A2, 2C9, 2C19, 2D6, 2E1 a 3A4 (IC50 > 150 |uM).
Neexistují data týkající se interakce sildenafilu a nespecifických inhibitorů fosfodiesterázy, jako je teofylin a dipyridamol.
In vivo studie
Při podání p.o. sildenafilu (50 mg) souběžně s tolbutamidem (250 mg) či warfarinem (40 mg), které jsou oba metabolizovány na CYP2C9, nebyly pozorovány žádné interakce.
Sildenafil p.o. neměl významný vliv na expozici atorvastatinu (AUC zvýšeno o 11 %), z čehož lze usuzovat, že sildenafil nemá klinicky významný účinek na CYP3A4.
Žádné interakce nebyly pozorovány ani mezi sildenafilem (100 mg, jedna p.o. dávka) a acenokumarolem.
Sildenafil p.o. (50 mg) nepotencoval prodloužení doby krvácení, způsobené kyselinou acetylsalicylovou (150 mg).
Sildenafil p.o. (50 mg) nepotencoval hypotenzivní účinek alkoholu u zdravých dobrovolníků s průměrnou maximální hladinou alkoholu v krvi 80 mg/dl.
Ve studii se zdravými dobrovolníky vedl p.o. sildenafil při rovnovážném stavu (80 mg 3x denně) k 50% vzestupu AUC bosentanu (125 mg 2x denně). Populační farmakokinetická analýza údajů ze studie u dospělých pacientů s PAH na základní léčbě bosentanem (62,5 mg - 125 mg 2x denně) ukázala při souběžném podávání sildenafilu v ustáleném stavu (20 mg 3x denně) vzestup AUC bosentanu v menším rozsahu (20% (95% CI: 9,8 - 30,8), než bylo pozorováno u zdravých dobrovolníků při souběžném podávání s 80 mg sildenafilu 3x denně (viz body 4.4 a 5.1).
Ve specifické studii interakcí, kde byl p.o. sildenafil (100 mg) podáván současně s amlodipinem u hypertenzivních pacientů, došlo k přídatnému snížení systolického krevního tlaku vleže o 8 mmHg. Odpovídající přídatné snížení diastolického tlaku vleže bylo 7 mmHg. Tato přídatná snížení tlaku byla srovnatelná s podáním samotného sildenafilu zdravým dobrovolníkům.
Ve třech specifických studiích lékových interakcí byl pacientům s benigní hyperplázií prostaty (BPH) stabilizovaným na terapii doxazosinem podáván současně doxazosin (4 mg a 8 mg) a p.o. sildenafil (25 mg, 50 mg či 100 mg). V těchto studovaných populacích byl pozorován přídatný pokles systolického a diastolického krevního tlaku vleže průměrně o 7/7 mmHg, 9/5 mmHg a 8/4 mmHg v uvedeném pořadí a průměrný pokles krevního tlaku vestoje o 6/6 mmHg, 11/4 mmHg a 4/5 mmHg. Když byly sildenafil a doxazosin podávány současně pacientům stabilizovaným na léčbě doxazosinem, byly vzácně hlášeny případy pacientů, kteří měli epizody symptomatické posturální hypotenze. Tato hlášení zahrnovala závrať a točení hlavy, ale nikoliv synkopy. Současné podávání sildenafilu pacientům užívajícím alfa-blokátory může u některých vnímavých pacientů vést k symptomatické hypotenzi (viz bod 4.4).
Sildenafil (100 mg, jedna p.o. dávka) neovlivnil farmakokinetiku inhibitoru HIV proteázy sachinaviru, jenž je substrátem/inhibitorem CYP3A4, v rovnovážném stavu.
Ve shodě se známými účinky sildenafilu na metabolizmus oxidu dusnatého/cyklického guanosin monofosfátu (cGMP) (viz bod 5.1) je sildenafil schopen zesilovat hypotenzivní účinky nitrátů. Jeho současné užití s látkami schopnými uvolňovat oxid dusnatý nebo nitráty v jakékoli formě je proto kontraindikováno (viz bod 4.3).
Riocigvát: Předklinické studie ukázaly aditivní systémový účinek při snižování krevního tlaku, když byly inhibitory PDE5 kombinovány s riocigvátem. V klinických studiích bylo prokázáno, že riocigvát zesiluje hypotenzní účinek inhibitorů PDE5. U sledované populace nebyl prokázán příznivý klinický účinek kombinace. Současné užívání riocigvátu s PDE5 inhibitory, včetně sildenafilu, je kontraindikováno (viz bod 4.3).
Sildenafil p.o. nemá žádný klinicky významný dopad na plazmatické hladiny perorálních kontraceptiv (ethinylestradiol 30 ^.g a levonorgestrel 150 ^.g).
Pediatrická populace
Interakční studie byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku a kontracepce u mužů i žen
Vzhledem k nedostatku údajů o účinku přípravku Revatio na těhotné ženy, není doporučeno jeho užití u žen ve fertilním věku, pokud neužívají vhodnou kontracepční metodu.
Nejsou k dispozici údaje týkající se použití sildenafilu u těhotných žen. Studie se zvířaty neukazují žádný přímý nebo nepřímý nežádoucí účinek na těhotenství a vývoj zárodku/plodu. Studie se zvířaty prokázaly toxicitu týkající se postnatálního vývoje (viz bod 5.3).
Vzhledem k nedostatku údajů by v případech, kdy to není nezbytné, neměl být přípravek Revatio podáván těhotným ženám.
Kojení
Není známo, zda sildenafil prochází do mateřského mléka. Přípravek Revatio by neměl být podáván kojícím matkám.
Fertilita
Neklinická data neprokázala na základě běžných studií fertility žádné riziko pro člověka (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Revatio má mírný vliv na schopnost řídit a obsluhovat stroje.
Vzhledem k tomu, že byly v klinických studiích sildenafilu popsány závratě a poruchy zraku, pacienti by předtím, než budou řídit či používat stroje, měli být poučeni o tom, jak mohou být přípravkem Revatio ovlivněni.
4.8 Nežádoucí účinky
Nežádoucí účinky vyplývající z léčby přípravkem Revatio podaným i.v. jsou podobné těm pozorovaným při léčbě přípravkem Revatio podaným p.o.. Vzhledem k tomu, že o použití přípravku Revatio podaného i.v. jsou pouze omezené údaje, a farmakokinetické modely naznačují, že při podání 20 mg p.o. a 10 mg i.v. se dosahuje podobných plazmatických expozic, jsou bezpečnostní informace pro přípravek Revatio podaný i.v. podpořené údaji o přípravku Revatio podaného p.o.
Intravenózní podání
10mg dávka přípravku Revatio injekční roztok předpovídá zajištění celkové expozice volného sildenafilu a jeho N-demetylovaného metabolitu a jejich kombinovaného farmakologického účinku srovnatelného s účinky 20mg dávky podané p.o.
Otevřená studie A1481262 v 1 centru, s jednou dávkou zjišťovala bezpečnost, tolerabilitu a farmakokinetiku jednorázové intravenózní dávky sildenafilu (10 mg) podanou jako bolus pacientům s PAH, kteří již užívali a byli stabilní na dávce přípravku Revatio 20 mg 3x denně podané p.o..
Celkově bylo zařazeno a dokončilo studii 10 pacientů s PAH. Střední změny v systolickém a diastolickém krevním tlaku měřeném ve stoje byly malé (< 10 mmHg) a vrátily se k původním hodnotám za 2 hodiny. S těmito změnami nebyly spojeny příznaky hypotenze. Střední změny srdečního tepu byly klinicky nevýznamné. 2 subjekty zaznamenaly celkem 3 nežádoucí účinky (zčervenání, flatulence a návaly horka). Ve studii byl zaznamenán 1 závažný nežádoucí účinek u subjektu se závažnou ischemickou kardiomyopatií, který prodělal komorovou fibrilaci a zemřel 6 dnů po podání poslední dávky studijní medikace; tento účinek byl vyhodnocen jako nesouvisející se studijní medikací.
Perorální podání
V pivotní, placebem kontrolované studii léčby plicní arteriální hypertenze přípravkem Revatio, bylo randomizováno celkem 207 pacientů k léčbě přípravkem Revatio podaným p.o. v dávkách 20 mg, 40 mg a 80 mg 3x denně a 70 pacientů k užívání placeba. Délka léčby byla 12 týdnů. Celková četnost přerušení léčby ve skupině léčené sildenafilem v dávkách 20 mg, 40 mg a 80 mg 3x denně byla 2,9%, 3% resp. 8,5%, ve srovnání s 2,9% ve skupině užívající placebo. Z 277 pacientů, kteří dokončili léčbu v pivotní studii, jich 259 vstoupilo do rozšířené dlouhodobé studie. Byly podávány dávky do 80 mg 3x denně (4násobně vyšší než doporučená dávka 20 mg 3x denně) a po 3 letech dostávalo dávku přípravku Revatio 80 mg 3x denně 87% ze 183 pacientů.
V placebem kontrolované studii s přípravkem Revatio, jako přídatné léčby k intravenózně podanému epoprostenolu v léčbě plicní arteriální hypertenze, bylo 134 pacientů léčeno přípravkem Revatio podaným p.o. (ve fixní titraci začínající na 20 mg s přechodem na 40 mg a posléze na 80 mg, 3x denně, dle snášenlivosti) a epoprostenolem a 131 pacientů léčených placebem a epoprostenolem.
Délka léčby byla 16 týdnů. Celková četnost přerušení léčby u pacientů léčených sildenafilem/epoprostenolem z důvodu nežádoucích účinků byla 5,2 % v porovnání s 10,7 % u pacientů užívajících placebo/epoprostenol. Nově hlášené nežádoucí účinky, které se objevily častěji u skupiny užívající sildenafil/epoprostenol, byly oční hyperemie, rozmazané vidění, ucpaný nos, noční pocení, bolest zad a sucho v ústech. Známé nežádoucí účinky - bolest hlavy, návaly, bolest končetin a otok - byly zaznamenány s vyšší četností u pacientů léčených sildenafilem/ epoprostenolem ve srovnání s placebem/ epoprostenolem. Ze všech subjektů, které dokončily původní studii, jich 242 vstoupilo do rozšířené dlouhodobé studie. Byly podávány dávky do 80 mg 3x denně a po 3 letech dostávalo dávku přípravku Revatio 80 mg 3x denně 68% ze 133 pacientů.
Ve 2 placebem kontrolovaných studiích s přípravkem Revatio podaným p.o. byly nežádoucí příhody všeobecně mírné až střední závažnosti. Nejčastějším nežádoucím účinkem při léčbě přípravkem Revatio (10 % nebo více) v porovnání s placebem byla bolest hlavy, návaly, dyspepsie, průjem a bolesti končetin.
Nežádoucí účinky uvedené v tabulce
V následující tabulce jsou shrnuty nežádoucí účinky, které se vyskytly u > 1 % pacientů léčených přípravkem Revatio a byly častější (rozdíl > 1 %) u přípravku Revatio v pilotní studii nebo v souboru kombinovaných dat získaných z placebem kontrolovaných studií léčby plicní arteriální hypertenze při p.o. dávkách 20, 40 a 80 mg 3x denně. Jsou seřazeny podle skupin a frekvence (velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100) a není známo (z dostupných dat není možné určit)). V každém určení frekvence jsou nežádoucí účinky seřazeny podle klesající závažnosti. Hlášení ze sledování po uvedení přípravku na trh jsou uvedena kurzívou.
|
MedDRA třídy orgánových systémů (v.14.0) |
Nežádoucí účinky |
|
Infekce a infestace | |
|
Časté Poruchy krve a lymfatického systému |
celulitida, chřipka, bronchitida, sinusitida, rinitida, gastroenteritida |
|
Časté | |
|
Poruchy metabolizmu a výživy | |
|
Časté |
retence tekutin |
|
Psychiatrické poruchy | |
|
Časté |
insomnie, úzkost |
|
Poruchy nervového systému | |
|
Velmi časté | |
|
Časté |
migréna, třes, parestézie, pocity pálení, hypestezie |
|
Poruchy oka | |
|
Časté |
krvácení retiny, poškození zraku, rozmazané vidění, fotofobie, chromatopsie, cyanopsie, podráždění oka, oční hyperemie |
|
Méně časté |
snížení ostrosti zraku, dvojité vidění, nepříjemný pocit v oku |
|
Není známo |
Nearteritická přední ischemická neuropatie optického nervu (NAION)*, retinální cévní okluze*, poruchy zorného pole* |
|
Poruchy ucha a labyrintu | |
|
Časté | |
|
Není známo |
náhlá ztráta sluchu |
|
Cévní poruchy | |
|
Velmi časté |
flush |
|
Není známo | |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté |
epistaxe, kašel, ucpaný nos |
|
MedDRA třídy orgánových systémů (v.14.0) |
Nežádoucí účinky |
|
Gastrointestinální poruchy | |
|
Velmi časté | |
|
Časté |
gastritida, refluxní choroba jícnu, hemoroidy, abdominální distenze, sucho v ústech |
|
Poruchy kůže a podkožní tkáně | |
|
Časté |
alopecie, erytém, noční pocení |
|
Není známo Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Velmi časté |
bolest končetin |
|
Časté |
myalgie, bolest zad |
|
Poruchy ledvin a močových cest | |
|
Méně časté |
hematurie |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté |
penilní hemoragie, hematospermie, gynekomastie |
|
Není známo |
priapismus, zvýšená erekce |
|
Celkové poruchy a reakce v místě aplikace | |
|
Časté | |
*Tyto nežádoucí účinky byly hlášeny u pacientů užívajících sildenafil pro léčbu erektilní dysfunkce (MED).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Ve studiích jednotlivých p.o. dávek až do 800 mg u zdravých dobrovolníků byly nežádoucí účinky podobné těm, které byly pozorované při nižších dávkách, ale jejich míra výskytu a závažnost stoupala. Při jednotlivé p.o. dávce 200 mg byla incidence nežádoucích reakcí vzrůstající (bolest hlavy, návaly, závratě, dyspepsie, otok nosní sliznice a porucha zraku).
V případě předávkování je vhodné zahájit dle potřeby standardní podpůrnou terapii. Renální dialýza nezrychluje clearance sildenafilu, protože je silně vázán na bílkoviny plazmy a není vylučován močí.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: urologika, léky užívané k léčbě erektilní dysfunkce, ATC kód: G04BE03
Mechanizmus účinku.
Sildenafil je silný a selektivní inhibitor cGMP specifické fosfodiesterázy typu 5 (PDE5), enzymu zodpovědného za degradaci cGMP. Enzym PDE5 je kromě kavernózního tělíska v penisu přítomen i ve svalovině plicních cév. Sildenafil tedy v hladkých svalech plicních cév zvyšuje hladinu cGMP a vede tak k jejich relaxaci. U pacientů s plicní arteriální hypertenzí to vede k selektivní vazodilataci plicního řečiště a v menší míře i k systémové vazodilataci.
Farmakodynamický účinek
Studie in vitro ukázaly, že sildenafil je selektivní k PDE5. Jeho účinek je mohutnější na PDE5 než na ostatní známé fosfodiesterázy. Ve srovnání s PDE6, která je zapojena do fototransdukční kaskády v sítnici, je selektivita k PDE5 10násobná. Selektivita oproti PDE1 je 80násobná a oproti PDE 2, 3, 4, 7, 8, 9, 10 a 11 potom 700násobná. Sildenafil má především více jak 4000násobnou selektivitu k PDE5 než k PDE3, izoformě fosfodiesterázy specifické k cAMP, zapojené do kontroly srdeční kontraktility.
Sildenafil způsobuje mírný a přechodný pokles systémového krevního tlaku, který ve většině případů nemá klinické projevy. Po dlouhodobém podávání 80 mg 3x denně p.o. pacientům se systémovou hypertenzí došlo k poklesu v průměru o 9,4 mmHg a 9,1 mmHg, od výchozích hodnot systolického a diastolického krevního tlaku vleže. Po dlouhodobém podávání 80 mg 3x denně p.o. pacientům s plicní arteriální hypertenzí byly pozorovány menší účinky na krevní tlak (snížení systolického i diastolického tlaku o 2 mmHg). Při doporučené dávce 20 mg 3x p.o. denně nebylo pozorováno snížení systolického ani diastolického tlaku.
Jednotlivá perorální dávka sildenafilu do výše 100 mg neměla u zdravých dobrovolníků žádné klinicky významné účinky na EKG. Při chronickém dávkování 80 mg 3x denně pacientům s plicní arteriální hypertenzí nebyly hlášeny žádné významné změny na EKG.
Ve studii zkoumající hemodynamický účinek jednotlivé dávky 100 mg sildenafilu u 14 pacientů se závažným onemocněním koronárních tepen (> 70 % stenóza alespoň jedné koronární tepny) byl průměrný systolický a diastolický tlak v klidu snížen o 7 % a 6 % v porovnání s výchozí hodnotou. Průměrný plicní systolický tlak byl snížen o 9 %. Sildenafil nevykazoval žádný účinek na srdeční výdej a nezhoršoval průtok zúženými koronárními tepnami.
U některých testovaných subjektů byla jednu hodinu po užití dávky 100 mg pozorována za použití Farnsworth-Munsellova testu se 100 odstíny mírná a přechodná porucha rozlišování barev (modrá/zelená), dvě hodiny po dávce nebyl žádný efekt patrný. Předpokládaný mechanizmus této změny v rozlišení barev je spojen s inhibicí PDE6, která je zapojena do kaskády fototransdukce v retině. Sildenafil nemá vliv na zrakovou ostrost nebo vnímání kontrastu. V malé, placebem kontrolované studii pacientů s prokázanou makulární degenerací spojenou s raným věkem (n=9), nevykazoval sildenafil v jednotlivé dávce 100 mg významný vliv na provedené zrakové testy (zraková ostrost, Amslerova mřížka, rozlišení barev simulovaného semaforu, Humphreyho perimetr a fotostres).
Klinická účinnost a bezpečnost
Účinnost sildenafilu podaného i.v. u dospělých pacientů s PAH
10mg dávka přípravku Revatio injekční roztok předpokládá zajištění celkové expozice volného sildenafilu a jeho N-demetylovaného metabolitu a jejich kombinovaného farmakologického účinku srovnatelného s účinky 20mg dávky podané p.o.. Tento odhad je založen pouze na farmakokinetických údajích (viz bod 5.2 Farmakokinetické vlastnosti). Důsledky následné nižší expozice aktivnímu N-demetylovanému metabolitu pozorované po opakovaném i.v. podání přípravku Revatio nebyly zjišťovány. Nebyly provedeny žádné studie pro potvrzení srovnatelné účinnosti obou lékových forem.
Otevřená studie A1481262 v 1 centru, s jednou dávkou zjišťovala bezpečnost, tolerabilitu a farmakokinetiku jednorázové intravenózní dávky sildenafilu (10 mg) podanou jako bolus pacientům s PAH, kteří již užívali a byli stabilní na dávce přípravku Revatio 20 mg 3x denně podané p.o..
Celkově bylo zařazeno a dokončilo studii 10 pacientů. 8 subjektů užívalo bosentan a 1 subjekt užíval treprostinil navíc k bosentanu a přípravku Revatio. Po podání dávky byl po 30, 60, 120, 180 a 360 minutách měřen krevní tlak v sedě a ve stoje a srdeční tep. Střední změny oproti původním hodnotám krevního tlaku vsedě byly nejvyšší po 1 hodině, -9,1 mmHg (SD ± 12,5) pro systolický a -3,0 mmHg (SD ± 4,9) pro diastolický krevní tlak. Střední změny v systolickém a diastolickém krevním tlaku měřeném ve stoje byly malé (< 10 mmHg) a vrátily se k původním hodnotám za 2 hodiny.
Účinnost sildenafilu podaného p.o. u dospělých pacientů s PAH
Randomizovaná dvojitě slepá studie kontrolovaná placebem byla provedena u 278 pacientů s primární PAH, sekundární PAH při onemocnění pojivové tkáně a PAH po chirurgické korekci vrozené srdeční vady. Pacienti byli randomizováni do jedné ze čtyř skupin: placebo, 20 mg sildenafilu, 40 mg sildenafilu a 80 mg sildenafilu, v dávce 3x denně. Z 278 randomizovaných pacientů 277 obdrželo alespoň jednu dávku studovaného léku. Studovaná populace se skládala z 68 (25 %) mužů a 209 (75 %) žen průměrného věku 49 let (rozmezí 18-81 let) s výchozí hodnotou 6minutového testu chůze v rozmezí 100 až 450 metrů včetně (průměr: 344 metrů). 175 pacientů (63 %) bylo diagnostikováno s primární plicní hypertenzí, 84 (30 %) bylo diagnostikováno s plicní arteriální hypertenzí při onemocnění pojivové tkáně a 18 (7 %) pacientů bylo diagnostikováno s plicní arteriální hypertenzí po chirurgické korekci vrozené srdeční vady. Studie se účastnilo nejvíce pacientů se třídou II dle WHO klasifikace (107/277, 39 %) nebo III (160/277, 58 %) s průměrnou výchozí vzdáleností 6minutové chůze 378 resp. 326 metrů; méně pacientů bylo se třídou I (1/2777, 0,4 %) nebo IV (9/277, 3 %). Pacienti s ejekční frakcí levé komory < 45 % nebo indexem komorového zkrácení < 0,2 nebyli studováni.
Sildenafil (nebo placebo) byl přidán k výchozí terapii, která mohla zahrnovat kombinaci antikoagulace, digoxinu, blokátoru kalciového kanálu, diuretika nebo kyslíku. Užití prostacyklinu, prostacyklinových analogů a antagonistů endotelinových receptorů jako přídatné terapie nebylo dovoleno, a stejně tak nebylo dovoleno doplňování argininu. Pacienti, kteří dříve selhali v terapii bosentanem byli ze studie vyloučeni.
Primárním sledovaným parametrem účinnosti byla změna vzdálenosti 6minutové chůze (6minute walk distance, 6MWD) od výchozích hodnot ve 12. týdnu. Statisticky významné prodloužení 6MWD bylo pozorováno u všech tří dávkovacích schémat sildenafilu v porovnání s placebem. Prodloužení 6MWD, korigované o placebo, bylo 45 m (p<0,0001), 46 m (p <0,0001) a 50 m (p<0,0001) pro sildenafil v dávce 20 mg, 40 mg a 80 mg 3x denně v tomto pořadí. Rozdíl mezi jednotlivými dávkami sildenafilu nebyl významný. U pacientů s výchozí hodnotou 6MWD < 325 metrů byla pozorována zlepšená účinnost při použití vyšších dávek (o placebo korigované zlepšení o 58 metrů u dávky 20 mg 3x denně, o 65 metrů u dávky 40 mg 3x denně a o 87 metrů u dávky 80 mg 3x denně).
Při analýze podle funkčních tříd WHO byl u skupiny užívající dávku 20 mg pozorován statisticky významný nárůst ve 6MWD. U třídy II a třídy III byly pozorovány nárůsty (korigované o placebo) o 49 metrů (p = 0,0007) resp. o 45 metrů (p = 0,0031)
Zlepšení 6MWD bylo zřetelné po 4 týdnech léčby a tento účinek přetrvával v 8. a 12. týdnu. Výsledky byly u podskupin všeobecně konzistentní, vzhledem k etiologii (primární PAH a PAH při onemocnění pojivové tkáně), funkční třídě dle WHO, pohlaví, rase, místu, průměrném plicním arteriálním tlaku (mPAP) a indexu plicní vaskulární rezistence (PVRI).
Pacienti užívající všechny dávky sildenafilu dosáhli ve srovnání s těmi, kteří užívali placebo, statisticky významného snížení středního plicního arteriálního tlaku (mPAP) a plicní vaskulární rezistence (PVR). Účinky léčby korigované o placebo u mPAP byly -2,7 mmHg (p=0,04) u sildenafilu 20 mg 3x denně, -3 mmHg (p=0,01) u sildenafilu 40 mg 3x denně a -5,1 mmHg (p=0,0001) u sildenafilu 80 mg 3x denně. Účinky léčby korigované o placebo u PVR byly -178 dyne.sec/cm5 (p=0,0051) u sildenafilu 20 mg 3x denně, -195 dyne.sec/cm5 (p=0,0017) u sildenafilu 40 mg 3x denně a -320 dyne.sec/cm5 (p<0,0001) u sildenafilu 80 mg 3x denně. Ve 12 týdnu bylo u sildenafilu 20 mg, 40 mg resp. 80 mg procentní snížení PVR (11,2%, 12,9 %, 23,3 %) proporčně větší než snížení systémové vaskulární rezistence (SVR) (7,2 %, 5,9 %, 14,4 %). Vliv sildenafilu na mortalitu není znám.
Vyšší podíl pacientů léčených jednotlivými dávkami sildenafilu (tj. 28 %, 36 % resp. 42 % subjektů užívajících sildenafil v dávce 20 mg, 40 mg resp. 80 mg 3x denně) vykazoval ve 12 týdnu zlepšení
alespoň o jednu funkční třídu dle WHO v porovnání s placebem (7%). Poměr šancí (Odds ratio) byl 2,92 (p=0,0087), 4,32 (p=0,0004) a 5,75 (p<0,0001).
Dlouhodobá data o přežití u dosud neléčených pacientů
Pacienti zařazeni do pivotní studie s perorálním podáním měli možnost pokračovat v dlouhodobé rozšířené otevřené studii. Po 3 letech dostávalo 87% pacientů dávku 80 mg 3x denně. V pivotní studii bylo přípravkem Revatio léčeno 207 pacientů a jejich dlouhodobý status přežití byl sledován po dobu nejméně 3 let. V této populaci byly odhady přežití dle Kaplan-Meierovy metody 96 % v prvním roce, 91 % v druhém roce a 82 % v třetím roce. Přežití u pacientů WHO funkční třídy II bylo při výchozích hodnotách 99 % v prvním roce, 91 % v druhém roce a 84 % v třetím roce a u pacientů WHO funkční třídy III bylo při výchozích hodnotách 94 % v prvním roce, 90 % v druhém roce a 81 % v třetím roce.
Účinnost sildenafilu podaného p.o. u dospělých pacientů s PAH (v kombinaci s epoprostenolem)
Byla provedena randomizovaná, dvojitě slepá, placebem kontrolovaná studie s 276 pacienty s PAH, kteří byli stabilizováni na léčbě intravenózně podaným epoprostenolem. Mezi pacienty s PAH byli zařazeni pacienti s primární PAH (212/267, 79 %) a PAH při onemocnění pojivových tkání (55/267,
21 %). Většina pacientů patřila podle výchozích hodnot WHO klasifikace do funkční třídy II (68/267, 26%) nebo III (175/267, 66 %); méně pacientů patřilo do funkční třídy I (3/267, 1 %) nebo IV (16/267, 6 %); u minima pacientů (5/267, 2 %) WHO funkční třída nebyla známa. Pacienti byli randomizováni do skupiny užívající placebo nebo sildenafil (ve fixní titraci začínající na 20 mg s přechodem na 40 mg a posléze na 80 mg, 3x denně, dle snášenlivosti) užívané v kombinaci s intravenózním epoprostenolem.
Primárním sledovaným parametrem účinnosti byla změna vzdálenosti 6minutové chůze od výchozích hodnot v 16 týdnu. V porovnání s placebem byl zaznamenán statisticky významný příznivější účinek sildenafilu na vzdálenost při 6minutové chůzi. Byl zaznamenán, o hodnoty placeba korigovaný, průměrný nárůst vzdálenosti chůze o 26 metrů ve prospěch sildenafilu (95% CI: 10,8; 41,2) (p=0,0009). U pacientů s výchozí hodnotou vzdálenosti chůze >325 metrů byl pozorován efekt léčby 38,4 metru ve prospěch sildenafilu; u pacientů s výchozí hodnotou vzdálenosti chůze <325 metrů byl pozorován léčebný efekt 2,3 metry ve prospěch placeba. U pacientů s primární PAH byl efekt léčby
31,1 metru v porovnání se 7,7 metru u pacientů s PAH při onemocnění pojivových tkání. Rozdíl ve výsledcích mezi randomizovanými podskupinami mohl být náhodný vzhledem k omezené velikosti skupin.
Pacienti léčeni sildenafilem dosáhli statisticky významného snížení středního tlaku v plicnici (mPAP) ve srovnání s pacienty dostávajícími placebo. Byl zaznamenán, o hodnoty placeba korigovaný, průměrný efekt léčby -3,9 mmHg ve prospěch sildenafilu (95% CI: -5,7; -2,1) (p=0,00003). Doba do klinického zhoršení byla sekundárním cílovým ukazatelem, definovaným jako doba od randomizace do zaznamenání prvních příznaků klinického zhoršení (úmrtí, transplantace plic, zahájení léčby bosentanem nebo klinické zhoršení vyžadující změnu léčby epoprostenolem). Léčba sildenafilem významně prodlužuje dobu do klinického zhoršení PAH v porovnání s placebem (p=0,0074). Příznaky klinického zhoršení zaznamenalo 23 subjektů ve skupině užívající placebo (17,6 %) v porovnání s 8 subjekty ve skupině léčené sildenafilem (6,0 %).
Dlouhodobá data o _přežití ze studie s epoprostenolem
Pacienti zařazeni do studie s přídatnou léčbou epoprostenolem, měli možnost pokračovat v dlouhodobé rozšířené otevřené studii. Po 3 letech dostávalo 68% pacientů dávku 80 mg 3x denně. Celkem 134 pacientů bylo léčeno přípravkem Revatio v původní studii a jejich dlouhodobý status přežití byl hodnocen po nejméně 3 letech. V této populaci byly odhady přežití dle Kaplan/Meierovy metody po 1 roce 92%, po 2 letech 81% a po 3 letech 74%.
Účinnost a bezpečnost u dospělých _pacientů s PAH (při _použití v kombinaci s bosentanem)
Byla provedena randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie u 103 klinicky stabilních subjektů s PAH (funkční třída II a III dle WHO klasifikace), léčených bosentanem po dobu nejméně tří měsíců. Mezi pacienty s PAH byli zařazeni pacienti s primární PAH a PAH spojenou s onemocněním pojivové tkáně. Pacienti byli randomizováni do skupiny s placebem nebo sildenafilem (20 mg 3x denně) v kombinaci s bosentanem (62,5 - 125 mg 2x denně). Primárním cílovým
parametrem účinnosti byla změna 6MWD ve 12. týdnu oproti výchozí hodnotě. Výsledky ukazují, že u 6MWD neexistuje žádný významný rozdíl v pozorované průměrné změně od výchozí hodnoty mezi sildenafilem 20 mg a placebem (13,62 metru (95% CI: -3,89 až 31,12) oproti 14,08 metru (95% CI: -1,78 až 29,95)).
Byly pozorovány rozdíly v 6MWD mezi pacienty s primární PAH a PAH spojenou s onemocněním pojivové tkáně. U subjektů s primární PAH (67 subjektů) činila průměrná změna od výchozí hodnoty 26,39 metru (95% CI: 10,70 až 42,08) ve skupině se sildenafilem a 11,84 metru (95% CI: -8,83 až 32,52) ve skupině s placebem. U subjektů s PAH spojenou s onemocněním pojivové tkáně (36 subjektů) však průměrná změna od výchozí hodnoty činila -18,32 metru (95% CI: -65,66 až 29,02) ve skupině se sildenafilem a 17,50 metru (95% CI: -9,41 až 44,41) ve skupině s placebem.
Celkově byly nežádoucí příhody obecně podobné u obou léčebných skupin (sildenafil plus bosentan oproti bosentanu samotnému) a ve shodě se známým profilem bezpečnosti sildenafilu při použití v monoterapii (viz body 4.4 a 4.5).
5.2 Farmakokinetické vlastnosti
Absorpce
Průměrná absolutní perorální biologická dostupnost je 41 % (rozmezí 25-63 %). Ve studii A1481262 byly pozorovány: Cmax 248 ng/ml, CL 30,3 l/hod a AUC (0.w) 330 ng h/ml. Cmax N-demetylovaného metabolitu byla 30,8 ng/ml a AUC (0.OT) 147 ng h/ml.
Distribuce
Průměrný distribuční objem v rovnovážném stavu (Vss) je pro sildenafil 105 l, což svědčí pro distribuci do tkání. Po perorální dávce 20 mg 3x denně jsou průměrné maximální plazmatické hladiny sildenafilu v rovnovážném stavu přibližně 113 ng/ml. Sildenafil a jeho hlavní cirkulující N-demetylovaný metabolit se váží na plazmatické bílkoviny přibližně z 96 %. Vazba na bílkoviny plazmy není závislá na celkové koncentraci.
Biotransformace
Sildenafil je odbouráván především jaterními mikrozomálními izoenzymy CYP3A4 (hlavní cesta) a CYP2C9 (vedlejší cesta). Hlavní cirkulující metabolit vzniká N-demetylací sildenafilu. Tento metabolit má profil fosfodiesterázové aktivity podobný sildenafilu a in vitro účinek na PDE5 přibližně 50 % ve srovnání s mateřskou látkou. N-demetylovaný metabolit je dále metabolizován s terminálním poločasem přibližně 4 hodiny. U pacientů s plicní arteriální hypertenzí jsou plazmatické koncentrace u N-demetylovaného metabolitu přibližně 72 % koncentrace sildenafilu při dávkování 20 mg 3x denně p.o. (to představuje 36 % podíl na farmakologických účincích sildenafilu). Následný vliv na účinnost není znám. U zdravých dobrovolníků jsou plazmatické hladiny N-demetylovaného metabolitu po i.v. podání výrazně nižší než ty pozorované po p.o. podání. Plazmatické koncentrace N-demetylovaného metabolitu v ustáleném stavu jsou přibližně 16 % hladin sildenafilu po i.v. podání a 61 % po p.o. podání.
Eliminace
Celková tělesná clearance sildenafilu je 41 l/hod s výsledným koncovým poločasem 3-5 hodin. Po perorálním nebo intravenózním podání je sildenafil vylučován jako metabolity převážně ve stolici (přibližně 80 % podané perorální dávky) a v menší míře močí (přibližně 13 % podané perorální dávky).
Farmakokinetika u zvláštních skupin pacientů
Starší _ pacienti
Zdraví starší dobrovolníci (65 let a více) vykazovali sníženou clearance sildenafilu, což vedlo k vyšším plazmatickým hladinám sildenafilu přibližně o 90 % a jeho aktivního N-4demetylovaného metabolitu, v porovnání s mladšími zdravými dobrovolníky (18-45 let). Vzhledem k věkovým rozdílům ve vazbě na plazmatické bílkoviny byl odpovídající vzestup volné plazmatické koncentrace sildenafilu přibližně 40 %.
Renální insuficience
U dobrovolníků s mírným až středním poškozením ledvin (clearance kreatininu = 30-80 ml/min) nebyla farmakokinetika sildenafilu po podání jednotlivé 50 mg dávky změněna. U dobrovolníků s těžkým stupněm poškození ledvin (clearance kreatininu < 30 ml/min) byla clearance sildenafilu snížena, což vedlo k průměrnému vzestupu AUC a Cmax o 100 % a 88 % ve srovnání s věkově odpovídajícími dobrovolníky bez renálního poškození. Navíc byly u pacientů s těžkým poškozením ledvin významně zvýšeny hodnoty AUC a Cmax pro N-demetylovaný metabolit o 200 % a 79 %, v porovnání se subjekty s normální renální funkcí.
Jaterní insuficience
U dobrovolníků s mírnou až střední jaterní cirhózou (Child-Pugh skóre A a B) byla clearance sildenafilu snížena, což vedlo k vzestupu AUC (85 %) a Cmax (47 %) ve srovnání s dobrovolníky odpovídajícího věku bez poškození jater. Navíc byly u subjektů s cirhózou hodnoty AUC a Cmax N-demetylovaného metabolitu výrazně zvýšené o 154 % a 87 %, v porovnání se subjekty s normální jaterní funkcí. Farmakokinetika sildenafilu u pacientů s těžkým poškozením jater nebyla studována.
Populační farmakokinetika
Průměrné koncentrace rovnovážného stavu byly u pacientů s plicní arteriální hypertenzí v rozsahu studovaných p.o. dávek 20-80 mg 3x denně o 20-50 % vyšší ve srovnání se zdravými dobrovolníky. Cmin byla ve srovnání se zdravými dobrovolníky dvojnásobná. Tyto závěry naznačují nižší clearance a/nebo vyšší perorální biologickou dostupnost sildenafilu u pacientů s plicní arteriální hypertenzí ve srovnání se zdravými dobrovolníky.
5.3 Předklinické údaje vztahující se k bezpečnosti přípravku
Neklinické údaje, získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, toxicity při reprodukci a vývoje, neodhalily žádné zvláštní riziko pro člověka.
U mláďat potkanů, která byla pre- a postnatálně léčena sildenafilem v dávce 60 mg/kg, byla při expozici přibližně 50x vyšší než je očekávaná i.v. expozice u člověka při dávce 10 mg 3x denně, pozorována snížená velikost vrhu, nižší hmotnost mláďat v den narození a snížené přežití po 4 dnech. Účinky v neklinických studiích byly pozorovány při expozicích dostatečně převyšujících maximální expozici u člověka, což svědčí o malém významu při klinickém použití.
U zvířat nebyly při klinicky relevantních expozicích pozorovány žádné nežádoucí účinky, potenciálně klinicky významné, které by rovněž nebyly pozorovány v klinických studiích.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Glukosa Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky nebo intravenózními rozpouštědly kromě těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a velikost balení
Jedno balení obsahuje jednu 20ml průhlednou lahvičku ze skla typu I, s chlorobutylovou pryžovou zátkou a hliníkovým krytem.
6.6 Zvláštní opatření pro likvidaci přípravku a zacházení s ním
Tento léčivý přípravek před použitím nevyžaduje rozpouštění ani ředění.
Jedna 20ml lahvička obsahuje 10 mg sildenafilu (ve formě citrátu). Doporučená dávka 10 mg je v objemu 12,5 ml a podává se intravenózně jako bolus.
Chemická a fyzikální stabilita byla prokázána s následujícími rozpouštědly
5% roztok glukózy
roztok chloridu sodného 9 mg/ml (0,9%)
Ringerův roztok s mléčnanem sodným
roztok 5% glukózy/0,45% chloridu sodného
roztok 5% glukózy/Ringerův roztok s mléčnanem sodným
roztok 5% glukózy/20 mEq chloridu draselného
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer Limited, Sandwich, Kent CT13 9NJ, Velká Británie
8. REGISTRAČNÍ ČÍSLO
EU/1/05/318/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28.října 2005 Datum posledního prodloužení: 23.září 2010
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
NÁZEV PŘÍPRAVKU
1.
Revatio 10 mg/ml prášek pro přípravu perorální suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Po rekonstituci obsahuje jeden mililitr perorální suspenze sildenafilum 10 mg (ve formě citrátu).
Jedna lahvička rekonstituované perorální suspenze (112 ml) obsahuje sildenafilum 1,12 g (ve formě citrátu).
Pomocná látka se známým účinkem
Jeden mililitr perorální suspenze obsahuje 250 mg sorbitolu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro přípravu perorální suspenze Bílý až téměř bílý prášek
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dospělí
Léčba dospělých pacientů trpících plicní arteriální hypertenzí třídy II a III podle klasifikace WHO, s cílem zlepšit fyzickou zdatnost. Byla prokázána účinnost v léčbě primární plicní hypertenze a plicní hypertenze při onemocnění pojivových tkání.
Pediatrická populace
Léčba pediatrických pacientů ve věku 1-17 let s plicní arteriální hypertenzí. Účinnost ve smyslu zlepšení fyzické zdatnosti nebo plicní hemodynamiky byla prokázána u primární plicní hypertenze a plicní hypertenze při vrozené srdeční vadě (viz bod 5.1).
4.2 Dávkování a způsob podání
Léčbu může zahájit a dále sledovat pouze lékař se zkušenostmi s léčbou plicní arteriální hypertenze. V případě zhoršení klinických funkcí navzdory léčbě přípravkem Revatio je třeba zvážit jiné možnosti léčby.
Dávkování
Dospělí
Doporučená dávka je 20 mg 3x denně. Lékař musí poučit pacienta, který zapomene užít dávku přípravku Revatio, aby užil dávku co nejdříve a poté pokračoval v užívání jako obvykle. Pacient nesmí užít dvojitou dávku jako náhradu zapomenuté dávky.
Pediatrická populace (1 rok až 17 let)
U pediatrických pacientů ve věku 1-17 let je doporučená dávka při hmotnosti <20 kg 10 mg (1 ml rekonstituované suspenze) 3x denně a při hmotnosti > 20 kg je 20 mg (2 ml rekonstituované suspenze) 3x denně. Vyšší než doporučené dávky se nesmí pediatrickým pacientům s PAH podávat (viz rovněž body 4.4 a 5.1).
Použití u _pacientů užívajících další léčivé _přípravky
Jakékoli úpravě dávky musí předcházet pečlivé zhodnocení poměru přínosu a rizika. Úprava dávky směrem dolů na 20 mg 2x denně je vhodná při souběžném podání sildenafilu pacientům užívajícím inhibitory CYP3A4, jako je erythromycin nebo sachinavir. Snížení dávky na 20 mg 1x denně je doporučeno při souběžném podání se silnějšími inhibitory CYP3A4 jako je klarithromycin, telithromycin a nefazodon. Pro užití sildenafilu s nejsilnějšími induktory CYP3A4 viz bod 4.3. Při souběžném podání s induktory CYP3A4 může existovat potřeba úpravy dávky sildenafilu (viz bod
4.5).
Zvláštní populace
Starší pacienti (> 65 let)
Úprava dávky není u starších pacientů potřeba. Klinická účinnost, měřená porovnáním vzdálenosti 6minutové chůze, může být u starších pacientů nižší.
Poškození ledvin
Úprava dávky při zahájení léčby není potřeba u pacientů s poškozením ledvin, včetně závažného poškození ledvin (clearance kreatininu < 30 ml/min). Pouze pokud není léčba dobře snášena, je třeba zvážit, po pečlivém vyhodnocení poměru přínosu a rizika, úpravu dávky směrem dolů na 20 mg 2x denně.
Poškození j jater
U pacientů s poškozením jater (Child-Pugh skóre A a B) není úprava dávky při zahájení léčby potřeba. Pouze pokud není léčba dobře snášena, je třeba zvážit po pečlivém vyhodnocení poměru přínosu a rizika úpravu dávky směrem dolů na 20 mg 2x denně.
Přípravek Revatio je kontraindikován u pacientů se závažným poškozením jater (Child-Pugh skóre C) (viz bod 4.3).
Pediatrická populace
Bezpečnost a účinnost přípravku Revatio u dětí mladších 1 roku nebyla zjišťována. Nejsou k dispozici žádné údaje.
Ukončení léčby
Dostupné údaje nenaznačují, že by přerušení léčby přípravkem Revatio bylo spojeno s rebound-efektem - zhoršením symptomů plicní arteriální hypertenze. Před ukončením léčby je ale vhodné zvážit postupné snižování dávky, aby se zabránilo případnému vzniku náhlého klinického zhoršení. Během období vysazování přípravku se doporučuje zvýšená pozornost.
Způsob podání
Přípravek Revatio prášek pro přípravu perorální suspenze je určen pouze k perorálnímu podání. Naředěná perorální suspenze (bílá perorální suspenze s příchutí hroznového vína) se užívá s odstupem přibližně 6 až 8 hodin, s jídlem nebo bez jídla.
Před odměřením požadované dávky protřepávejte řádně lahvičku po dobu alespoň 10 sekund.
Pro informace o přípravě léčivého přípravku před podáním viz bod 6.6.
4.3 Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Současné užití s látkami schopnými uvolňovat oxid dusnatý (jako je amylnitrit) nebo nitráty v jakékoli formě vzhledem k hypotenzivnímu účinku nitrátů (viz bod 5.1).
Současné podávání PDE5 inhibitorů, včetně sildenafilu, se stimulátory guanylátcyklázy, jako je riocigvát, je kontraindikováno, protože může potenciálně vést k symptomatické hypotenzi (viz bod
4.5) .
Kombinace s nejsilnějšími inhibitory CYP3A4 (např. ketokonazol, itrakonazol, ritonavir) (viz bod
4.5) .
Pacienti, kteří v důsledku nearteritické přední ischemické neuropatie optického nervu (NAION) ztratili zrak u jednoho oka, bez ohledu na to, zda tato příhoda souvisela s předchozím užitím PDE5 inhibitoru či nikoli (viz bod 4.4).
Bezpečnost sildenafilu nebyla studována v následujících podskupinách pacientů, a jeho užití je proto kontraindikováno:
Závažné poškození jater,
Nedávná anamnéza cévní mozkové příhody nebo infarktu myokardu,
Závažná hypotenze (krevní tlak < 90/50 mmHg) na počátku léčby.
4.4 Zvláštní upozornění a opatření pro použití
Účinnost přípravku Revatio nebyla zjišťována u pacientů se závažnou plicní arteriální hypertenzí (funkční třída IV). Dojde-li ke zhoršení klinických funkcí, je třeba zvážit možnost léčby doporučenou pro závažnou fázi onemocnění (např. epoprostenol) (viz bod 4.2). Poměr přínosu a rizika sildenafilu nebyl zjišťován u pacientů s plicní arteriální hypertenzí funkční třídy I dle WHO. Studie se sildenafilem byly prováděny u forem plicní arteriální hypertenze: primární (idiopatické), při onemocnění pojivové tkáně a PAH při vrozené srdeční vadě (viz bod 5.1). Užití sildenafilu u jiných forem PAH není doporučeno.
V dlouhodobé pediatrické rozšířené studii byl u pacientů, kteří užívali vyšší než doporučené dávky, pozorován zvýšený počet úmrtí. Proto se nesmí pediatrickým pacientům s PAH podávat vyšší než doporučené dávky (viz rovněž body 4.2 a 5.1).
Retinitis pigmentosa
Bezpečnost sildenafilu nebyla zjišťována u pacientů se známou dědičnou degenerativní poruchou retiny, jako je retinitis pigmentosa (menší část těchto pacientů má dědičné poruchy fosfodiesterázy retiny), a proto není jeho použití doporučeno.
Vazodilatační účinek
Při předepisování sildenafilu by měl lékař pečlivě zvážit, zda by pacient s některými onemocněními mohl být nepříznivě ovlivněn mírným až středně silným vazodilatačním účinkem sildenafilu, např. pacient s hypotenzí, dehydratací, se závažnou obstrukcí odtoku krve z levé komory nebo autonomní dysfunkcí (viz bod 4.4).
Kardiovaskulární rizikové faktory
Po uvedení sildenafilu na trh v indikaci léčby erektilní dysfunkce, byly hlášeny případy závažných kardiovaskulárních příhod včetně infarktu myokardu, nestabilní anginy pectoris, náhlé srdeční smrti, komorové arytmie, mozkového krvácení, tranzitorních ischemických atak, hypertenze a hypotenze. Tyto příhody se vyskytly v časové souvislosti s užitím sildenafilu. Většina z těchto pacientů, ale ne všichni, měla již dříve existující kardiovaskulární rizikové faktory. Rada hlášených příhod vznikla během nebo krátce po pohlavním styku a několik hlášených příhod vzniklo krátce po užití sildenafilu bez souvislosti se sexuální aktivitou. Není možné určit, zda tyto příhody souvisejí přímo s těmito nebo jinými faktory.
Priapismus
Sildenafil by měl být užíván s opatrností u pacientů s anatomickými deformacemi penisu (jako je angulace, kavernózní fibróza či Peyroneova choroba) či u pacientů, kteří mají onemocnění predisponující k priapismu (jako je srpkovitá anémie, mnohočetný myelom či leukémie).
Při použití sildenafilu po uvedení přípravku na trh byla hlášena protrahovaná erekce a priapismus.
V případě erekce, která přetrvává déle než 4 hodiny, má pacient vyhledat okamžitou lékařskou pomoc. Pokud není priapismus okamžitě léčen, mohl by vést k poškození tkáně penisu a trvalé ztrátě potence (viz bod 4.8).
Vazookluzivní krize u pacientů se srpkovitou anémií
Sildenafil nesmí být podáván pacientům s plicní hypertenzí sekundární k srpkovité anémii.
V klinických studiích byly u pacientů užívajících přípravek Revatio častěji hlášeny příhody vazookluzivní krize než u pacientů užívajících placebo, což mělo za následek předčasné ukončení studie.
Účinky na. zrak
V souvislosti s užitím sildenafilu i jiných inhibitorů PDE5 byly spontánně hlášeny případy poruchy zraku. V souvislosti s užitím sildenafilu i jiných inhibitorů PDE5 byly spontánně a z observační studie hlášeny případy vzácného onemocnění nearteritické přední ischemické neuropatie optického nervu (NAION) (viz bod 4.8). V případě náhlé poruchy zraku je nutné ihned ukončit léčbu a zvážit další možnosti léčby (viz bod 4.3).
Alfa-blokátory
Současné podávání sildenafilu pacientům užívajícím alfa-blokátory může u některých vnímavých pacientů vést k symptomatické hypotenzi (viz bod 4.5). Aby se minimalizovala možnost vzniku posturální hypotenze, měli by pacienti, léčení alfa-blokátory, být před zahájením terapie sildenafilem hemodynamicky stabilní. Lékaři by měli pacienty poučit, jak se zachovat v případě, že se objeví příznaky hypotenze.
Krvácivé stavy
Studie provedené na lidských krevních destičkách naznačují, že sildenafil in vitro zesiluje antiagregační účinky nitroprusidu sodného. Informace o bezpečnosti podávání sildenafilu pacientům s krvácivými stavy či aktivním peptickým vředem nejsou k dispozici. Proto by těmto pacientům měl sildenafil být podáván pouze po pečlivém zvážení přínosu a rizika.
Antagonisté vitamínu K
U pacientů s plicní arteriální hypertenzí a zvláště u pacientů s plicní arteriální hypertenzí při onemocnění pojivové tkáně existuje možnost zvýšení rizika krvácení, je-li sildenafil podán pacientům již užívajícím antagonistu vitamínu K.
Venookluzivní choroba
O užití sildenafilu u pacientů s plicní arteriální hypertenzí spojenou s plicní venookluzivní chorobou nejsou k dispozici žádné údaje. Při užití vazodilatačních přípravků (hlavně prostacyklinu) byly však u těchto pacientů hlášeny případy život ohrožujícího plicního edému. Proto když se u pacientů s plicní arteriální hypertenzí po podání sildenafilu objeví příznaky plicního edému, je třeba vzít v úvahu přidruženou venookluzivní chorobu.
Nesnášenlivost fruktózy
Prášek obsahuje sorbitol. Pacienti se vzácnými dědičnými poruchami nesnášenlivosti fruktózy by neměli tento léčivý přípravek užívat.
Užívání sildenafilu s bosentanem
Účinnost sildenafilu u pacientů již léčených bosentanem nebyla přesvědčivě prokázána (viz body 4.5 a 5.1).
Současné použití s jinými inhibitory PDE5
Bezpečnost a účinnost kombinace sildenafilu s jinými inhibitory PDE5, včetně přípravku Viagra, nebyla u pacientů s PAH hodnocena. Proto se případné použití těchto kombinací nedoporučuje (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinky ostatních přípravků na sildenafil In vitro studie
Metabolizmus sildenafilu je zprostředkován převážně cytochromem P450 (CYP), izoformou 3A4 (hlavní cesta) a 2C9 (vedlejší cesta). Proto inhibitory těchto izoenzymů mohou snížit clearance sildenafilu a induktory těchto enzymů mohou jeho clearance zvýšit. Pro doporučení dávek viz body
4.2 a 4.3.
In vivo studie
Bylo hodnoceno souběžné podání p.o. sildenafilu a i.v. epoprostenolu (viz bod 4.8 a 5.1).
Účinnost a bezpečnost sildenafilu souběžně podávaného s jinou léčbou plicní arteriální hypertenze (např. ambrisentan, iloprost) nebyla v kontrolovaných studiích zjišťována. Proto je v případě souběžné léčby nutná opatrnost. Existuje farmakokinetická interakce mezi sildenafilem a bosentanem (viz níže informace o interakcích s induktory cytochromu CYP3A4 a účinkem na sildenafil a ostatní léčivé přípravky).
Bezpečnost a účinnost sildenafilu při souběžném podání s jinými inhibitory PDE5 nebyla u pacientů s plicní arteriální hypertenzí zjišťována (viz bod 4.4).
Populační farmakokinetická analýza dat z klinických studií plicní arteriální hypertenze ukázala snížení clearance sildenafilu a/nebo zvýšení perorální biologické dostupnosti, pokud byl sildenafil podáván spolu se substráty CYP3A4 či s kombinací substrátů CYP3A4 a beta-blokátorů. Tyto faktory byly jediné, které statisticky významně ovlivňovaly farmakokinetiku sildenafilu u pacientů s plicní hypertenzí. Expozice sildenafilu u pacientů užívajících substráty CYP3A4 či substráty CYP3A4 s beta-blokátory byla o 43 % a o 66 % vyšší než u pacientů, kteří tuto skupinu léků neužívali.
Expozice sildenafilu byla 5x vyšší při dávce 80 mg 3x denně ve srovnání s expozicí při dávce 20 mg 3x denně. Toto rozmezí koncentrací pokrývá vzestup expozice sildenafilu pozorovaný ve specificky navržených studiích lékových interakcí s inhibitory CYP3A4 (kromě nejsilnějších inhibitorů CYP3A4, např. ketokonazol, itrakonazol, ritonavir).
Předpoklad, že induktory CYP3A4 mají značný vliv na farmakokinetiku sildenafilu u pacientů s plicní arteriální hypertenzí, byl potvrzen v interakční studii in vivo s induktorem CYP3A4 bosentanem.
Současné podávání bosentanu (středně silný induktor CYP3A4, CYP2C9 a možná i CYP2C19) v dávce 125 mg 2x denně se sildenafilem v dávce 80 mg 3x denně (při rovnovážném stavu) po dobu 6 dnů vedlo u zdravých dobrovolníků k 63 % snížení AUC sildenafilu. Populační farmakokinetická analýza údajů o sildenafilu získaných od dospělých pacientů s PAH v klinických hodnoceních zahrnujících 12týdenní studii k zhodnocení účinnosti a bezpečnosti perorálně podávaného sildenafilu v dávce 20 mg třikrát denně, přidaného ke stabilní dávce bosentanu (62,5 mg - 125 mg dvakrát denně), ukázala snížení expozice sildenafilu při souběžném podávání s bosentanem podobné tomu, které bylo pozorováno u zdravých dobrovolníků (viz body 4.4 a 5.1).
Účinnost sildenafilu je třeba více monitorovat u pacientů, kteří souběžně užívají silné induktory CYP3A4, jako je karbamazepin, fenytoin, fenobarbital, třezalka a rifampicin.
Současné podávání inhibitoru HIV proteázy ritonaviru, který je vysoce účinným inhibitorem P450, při rovnovážném stavu (500 mg 2x denně) a sildenafilu (100 mg, jedna dávka) vedlo k 300 % (čtyřnásobnému) vzestupu Cmax sildenafilu a 1000 % (jedenáctinásobnému) vzestupu plazmatické AUC sildenafilu. Po 24 hodinách byly plazmatické hladiny sildenafilu stále kolem 200 ng/ml, v porovnání s 5 ng/ml při podávání sildenafilu samotného. To je v souladu s výrazným účinkem ritonaviru na široké spektrum substrátů P450. Vzhledem k těmto výsledkům je současné podávání sildenafilu a ritonaviru pacientům s plicní arteriální hypertenzí kontraindikováno (viz bod 4.3).
Současné podávání inhibitoru HIV proteázy sachinaviru, inhibitoru CYP3A4, při rovnovážném stavu (1200 mg 3x denně) spolu se sildenafilem (100 mg, jedna dávka) vedlo ke 140 % vzestupu Cmax sildenafilu a 210 % vzestupu AUC sildenafilu. Sildenafil neměl žádný účinek na farmakokinetiku sachinaviru. Pro doporučení dávek viz bod 4.2.
Pokud byla jednotlivá dávka 100 mg sildenafilu podána s erythromycinem, středně silným inhibitorem CYP3A4, při rovnovážném stavu (500 mg 2x denně po dobu 5 dnů), došlo k 182 % vzestupu systémové expozice sildenafilu (AUC). Pro doporučení dávek viz bod 4.2. U zdravých mužských dobrovolníků nebyly pozorovány známky vlivu azithromycinu (500 mg denně po dobu 3 dnů) na AUC, Cmax, Tmax, eliminační konstantu nebo následný poločas sildenafilu nebo jeho hlavních cirkulujících metabolitů. Není potřeba úprava dávek. Cimetidin (800 mg), inhibitor cytochromu P450 a nespecifický inhibitor CYP3A4, způsoboval 56 % vzestup plazmatických koncentrací sildenafilu, pokud byl podáván zdravým dobrovolníkům současně se sildenafilem v dávce 50 mg. Není potřeba úprava dávek.
Nejsilnější inhibitory CYP3A4, jako je ketokonazol a itrakonazol mají zřejmě účinky podobné jako ritonavir (viz bod 4.3). Inhibitory CYP3A4 jako je klarithromycin, telithromycin a nefazodon mají zřejmě účinek mezi účinkem ritonaviru a inhibitory CYP3A4 jako je sachinavir nebo erythromycin, předpokládá se sedminásobný vzestup expozice. Proto jsou-li užívány inhibitory CYP3A4, je doporučena úprava dávkování (viz bod 4.2).
Populační farmakokinetická analýza u pacientů s plicní arteriální hypertenzí naznačuje, že souběžné podání beta-blokátorů v kombinaci se substráty CYP3A4 může vyústit v další vzestup expozice sildenafilu ve srovnání s podáním samotných substrátů CYP3A4.
Grapefruitová šťáva je slabým inhibitorem metabolizmu CYP3A4 ve střevní stěně a může vést k mírnému vzestupu plazmatických hladin sildenafilu. Není potřeba úprava dávek, nicméně se nedoporučuje souběžné podání sildenafilu a grapefruitové šťávy.
Jednotlivá dávka antacid (hydroxid hořečnatý/hydroxid hlinitý) neovlivnila biologickou dostupnost sildenafilu.
Současné podávání perorální antikoncepce (ethinylestradiol 30 ^g a levonorgestrel 150 ^.g) nemělo na farmakokinetiku sildenafilu žádný vliv.
Nikorandil je hybridní aktivátor draslíkových kanálů a nitrát. Vzhledem k nitrátové složce má potenciál k závažným interakcím se sildenafilem (viz bod 4.3).
Účinky sildenafilu na jiné přípravky
In vitro studie
Sildenafil je slabý inhibitor cytochromu P450, izoforem 1A2, 2C9, 2C19, 2D6, 2E1 a 3A4 (IC50 > 150 |uM).
Neexistují data týkající se interakce sildenafilu a nespecifických inhibitorů fosfodiesterázy, jako je teofylin a dipyridamol.
In vivo studie
Při podání sildenafilu (50 mg) souběžně s tolbutamidem (250 mg) či warfarinem (40 mg), které jsou oba metabolizovány na CYP2C9, nebyly pozorovány žádné interakce.
Sildenafil neměl významný vliv na expozici atorvastatinu (AUC zvýšeno o 11 %), z čehož lze usuzovat, že sildenafil nemá klinicky významný účinek na CYP3A4.
Žádné interakce nebyly pozorovány ani mezi sildenafilem (100 mg, jedna dávka) a acenokumarolem.
Sildenafil (50 mg) nepotencoval prodloužení doby krvácení, způsobené kyselinou acetylsalicylovou (150 mg).
Sildenafil (50 mg) nepotencoval hypotenzivní účinek alkoholu u zdravých dobrovolníků s průměrnou maximální hladinou alkoholu v krvi 80 mg/dl.
Ve studii se zdravými dobrovolníky vedl sildenafil při rovnovážném stavu (80 mg 3x denně) k 50 % vzestupu AUC bosentanu (125 mg 2x denně). Populační farmakokinetická analýza údajů ze studie u dospělých pacientů s PAH na základní léčbě bosentanem (62,5 mg - 125 mg 2x denně) ukázala při souběžném podávání sildenafilu v ustáleném stavu (20 mg 3x denně) vzestup AUC bosentanu v menším rozsahu (20% (95% CI: 9,8 - 30,8), než bylo pozorováno u zdravých dobrovolníků při souběžném podávání s 80 mg sildenafilu 3x denně (viz body 4.4 a 5.1).
Ve specifické studii interakcí, kde byl sildenafil (100 mg) podáván současně s amlodipinem u hypertenzních pacientů, došlo k přídatnému snížení systolického krevního tlaku vleže o 8 mmHg. Odpovídající přídatné snížení diastolického tlaku vleže bylo 7 mmHg. Tato přídatná snížení tlaku byla srovnatelná s podáním samotného sildenafilu zdravým dobrovolníkům.
Ve třech specifických studiích lékových interakcí byl pacientům s benigní hyperplázií prostaty (BPH) stabilizovaným na terapii doxazosinem podáván současně doxazosin (4 mg a 8 mg) a sildenafil (25 mg, 50 mg či 100 mg). V těchto studovaných populacích byl pozorován přídatný pokles systolického a diastolického krevního tlaku vleže průměrně o 7/7 mmHg, 9/5 mmHg a 8/4 mmHg v uvedeném pořadí a průměrný pokles krevního tlaku vestoje o 6/6 mmHg, 11/4 mmHg a 4/5 mmHg. Když byly sildenafil a doxazosin podávány současně pacientům stabilizovaným na léčbě doxazosinem, byly vzácně hlášeny případy pacientů, kteří měli epizody symptomatické posturální hypotenze. Tato hlášení zahrnovala závrať a točení hlavy, ale nikoliv synkopy. Současné podávání sildenafilu pacientům užívajícím alfa-blokátory může u některých vnímavých pacientů vést k symptomatické hypotenzi (viz bod 4.4).
Sildenafil (100 mg, jedna dávka) neovlivnil farmakokinetiku inhibitoru HIV proteázy sachinaviru, jenž je substrátem/inhibitorem CYP3A4, v rovnovážném stavu.
Ve shodě se známými účinky sildenafilu na metabolizmus oxidu dusnatého/cyklického guanosin monofosfátu (cGMP) (viz bod 5.1) je sildenafil schopen zesilovat hypotenzivní účinky nitrátů. Jeho současné užití s látkami schopnými uvolňovat oxid dusnatý nebo nitráty v jakékoli formě je proto kontraindikováno (viz bod 4.3).
Riocigvát: Předklinické studie ukázaly aditivní systémový účinek při snižování krevního tlaku, když byly inhibitory PDE5 kombinovány s riocigvátem. V klinických studiích bylo prokázáno, že riocigvát zesiluje hypotenzní účinek inhibitorů PDE5. U sledované populace nebyl prokázán příznivý klinický účinek kombinace. Současné užívání riocigvátu s PDE5 inhibitory, včetně sildenafilu, je kontraindikováno (viz bod 4.3).
Sildenafil nemá žádný klinicky významný dopad na plazmatické hladiny perorálních kontraceptiv (ethinylestradiol 30 ^.g a levonorgestrel 150 ^.g).
Pediatrická populace
Interakční studie byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku, a kontracepce u mužů i žen
Vzhledem k nedostatku údajů o účinku přípravku Revatio na těhotné ženy, není doporučeno jeho užití u žen ve fertilním věku, pokud neužívají vhodnou kontracepční metodu.
Nejsou k dispozici údaje týkající se použití sildenafilu u těhotných žen. Studie se zvířaty neukazují žádný přímý nebo nepřímý nežádoucí účinek na těhotenství a vývoj zárodku/plodu. Studie se zvířaty prokázaly toxicitu týkající se postnatálního vývoje (viz bod 5.3).
Vzhledem k nedostatku údajů by v případech, kdy to není nezbytné, neměl být přípravek Revatio podáván těhotným ženám.
Kojení
Není známo, zda sildenafil prochází do mateřského mléka. Přípravek Revatio by neměl být podáván kojícím matkám.
Fertilita
Neklinická data neprokázala na základě běžných studií fertility žádné riziko pro člověka (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Revatio má mírný vliv na schopnost řídit a obsluhovat stroje.
Vzhledem k tomu, že byly v klinických studiích sildenafilu popsány závratě a poruchy zraku, pacienti by předtím, než budou řídit či používat stroje, měli být poučeni o tom, jak mohou být přípravkem Revatio ovlivněni.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
V pivotní, placebem kontrolované studii léčby plicní arteriální hypertenze přípravkem Revatio, bylo randomizováno celkem 207 pacientů k léčbě přípravkem Revatio v dávkách 20 mg, 40 mg a 80 mg 3x denně a 70 pacientů k užívání placeba. Délka léčby byla 12 týdnů. Celková četnost přerušení léčby ve skupině léčené sildenafilem v dávkách 20 mg, 40 mg a 80 mg 3x denně byla 2,9%, 3% resp. 8,5%, ve srovnání s 2,9% ve skupině užívající placebo. Z 277 pacientů, kteří dokončili léčbu v pivotní studii, jich 259 vstoupilo do rozšířené dlouhodobé studie. Byly podávány dávky do 80 mg 3x denně (4násobně vyšší než doporučená dávka 20 mg 3x denně) a po 3 letech dostávalo dávku přípravku Revatio 80 mg 3x denně 87% ze 183 pacientů.
V placebem kontrolované studii s přípravkem Revatio, jako přídatné léčby k intravenózně podanému epoprostenolu v léčbě plicní arteriální hypertenze, bylo 134 pacientů léčeno přípravkem Revatio (ve fixní titraci začínající na 20 mg s přechodem na 40 mg a posléze na 80 mg, 3x denně, dle snášenlivosti) a epoprostenolem a 131 pacientů léčených placebem a epoprostenolem. Délka léčby byla 16 týdnů. Celková četnost přerušení léčby u pacientů léčených sildenafilem/epoprostenolem
z důvodu nežádoucích účinků byla 5,2 % v porovnání s 10,7 % u pacientů užívajících placebo/epoprostenol. Nově hlášené nežádoucí účinky, které se objevily častěji u skupiny užívající sildenafil/epoprostenol, byly oční hyperemie, rozmazané vidění, ucpaný nos, noční pocení, bolest zad a sucho v ústech. Známé nežádoucí účinky - bolest hlavy, návaly, bolest končetin a otok - byly zaznamenány s vyšší četností u pacientů léčených sildenafilem/ epoprostenolem ve srovnání s placebem/ epoprostenolem. Ze všech subjektů, které dokončily původní studii, jich 242 vstoupilo do rozšířené dlouhodobé studie. Byly podávány dávky do 80 mg 3x denně a po 3 letech dostávalo dávku přípravku Revatio 80 mg 3x denně 68% ze 133 pacientů.
Ve 2 placebem kontrolovaných studiích byly nežádoucí příhody všeobecně mírné až střední závažnosti. Nejčastějším nežádoucím účinkem při léčbě přípravkem Revatio (10 % nebo více) v porovnání s placebem byla bolest hlavy, návaly, dyspepsie, průjem a bolesti končetin.
Nežádoucí účinky uvedené v tabulce
V následující tabulce jsou shrnuty nežádoucí účinky, které se vyskytly u > 1 % pacientů léčených přípravkem Revatio a byly častější (rozdíl > 1 %) u přípravku Revatio v pilotní studii nebo v souboru kombinovaných dat získaných z placebem kontrolovaných studií léčby plicní arteriální hypertenze při dávkách 20, 40 a 80 mg 3x denně. Jsou seřazeny podle skupin a frekvence (velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100) a není známo (z dostupných dat není možné určit)). V každém určení frekvence jsou nežádoucí účinky seřazeny podle klesající závažnosti. Hlášení ze sledování po uvedení přípravku na trh jsou uvedena kurzívou.
|
MedDRA třídy orgánových systémů (v.14.0.) Infekce a infestace |
Nežádoucí účinky |
|
Časté |
celulitida, chřipka, bronchitida, sinusitida, rinitida, gastroenteritida |
|
Poruchy krve a lymfatického systému Časté | |
|
Poruchy metabolizmu a výživy Časté |
retence tekutin |
|
Psychiatrické poruchy Časté |
insomnie, úzkost |
|
Poruchy nervového systému Velmi časté Časté |
migréna, třes, parestézie, pocity pálení, hypestezie |
|
Poruchy oka Časté Méně časté Není známo |
krvácení retiny, poruchy zraku, rozmazané vidění, fotofobie, chromatopsie, cyanopsie, podráždění oka, oční hyperemie snížení ostrosti zraku, dvojité vidění, nepříjemný pocit v oku nearteritická přední ischemická neuropatie optického nervu (NAION)*, retinální cévní okluze* a poruchy zorného pole* |
|
Poruchy ucha a labyrintu Časté Není známo |
náhlá ztráta sluchu |
|
Cévní poruchy Velmi časté Není známo |
flush |
|
Respirační, hrudní a mediastinální poruchy Časté |
epistaxe, kašel, ucpaný nos |
|
Gastrointestinální poruchy Velmi časté Časté |
gastritida, refluxní choroba jícnu, hemoroidy, abdominální distenze, sucho v ústech |
|
Poruchy kůže a podkožní tkáně Časté Není známo |
alopecie, erytém, noční pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Velmi časté |
bolest končetin |
|
MedDRA třídy orgánových systémů (v.14.0.) |
Nežádoucí účinky |
|
Časté |
myalgie, bolest zad |
|
Poruchy ledvin a močových cest | |
|
Méně časté |
hematurie |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté |
penilní hemoragie, hematospermie, gynekomastie |
|
Není známo |
priapismus, zvýšená erekce |
|
Celkové poruchy a reakce v místě aplikace | |
|
Časté | |
*Tyto nežádoucí účinky byly hlášeny u pacientů užívajících sildenafil pro léčbu erektilní dysfunkce (MED)
Pediatrická populace
V placebem kontrolované studii přípravku Revatio u pacientů ve věku 1-17 let s plicní arteriální hypertenzí bylo léčeno celkem 174 pacientů 3x denně buď nízkou dávkou (10 mg u pacientů s hmotností > 20 kg; žádný pacient s hmotností < 20 kg neužíval nízkou dávku), střední dávkou (10 mg u pacientů s hmotností > 8-20 kg, 20 mg u pacientů s hmotností > 20-45 kg, 40 mg u pacientů s hmotností > 45 kg) nebo vysokou dávkou (20 mg u pacientů s hmotností > 8-20 kg, 40 mg u pacientů s hmotností > 20-45 kg, 80 mg u pacientů s hmotností > 45 kg) přípravku Revatio a 60 pacientů dostávalo placebo.
Profil nežádoucích účinků pozorovaný v této pediatrické studii byl obecně shodný s profilem pozorovaným u dospělých (viz tabulka výše). Nejčastějšími nežádoucími účinky, které byly pozorovány (s četností > 1 %) u pacientů léčených přípravkem Revatio (kombinované dávky) s četností > 1 % oproti pacientům, kterým bylo podáváno placebo, byly horečka (11,5 %), infekce horních cest dýchacích (11,5 %), zvracení (10,9 %), zvýšená erekce (včetně spontánní erekce penisu u mužských subjektů) (9,0 %), nauzea (4,6 %), bronchitida (4,6 %), faryngitida (4,0 %), rinorea (3,4 %), pneumonie (2,9 %) a rinitida (2,9 %).
Celkem 220 z 234 pediatrických subjektů léčených v krátkodobé placebem kontrolované studii vstoupilo do dlouhodobé pokračující studie. Subjekty léčené sildenafilem pokračovaly ve stejném léčebném režimu, zatímco subjekty ze skupiny užívající v krátkodobé studii placebo byly náhodně nově zařazeny do skupiny léčené sildenafilem.
Nejčastěji hlášené nežádoucí účinky v průběhu trvání krátkodobé a dlouhodobé studie byly v zásadě obdobné jako nežádoucí účinky pozorované v krátkodobé studii. Nežádoucími účinky, které byly hlášeny u > 10% z 229 subjektů léčených sildenafilem (kombinovaná skupina dávek, včetně 9 pacientů, kteří nepokračovali do dlouhodobé studie), byly infekce horních cest dýchacích (31 %), bolest hlavy (26%), zvracení (22 %), bronchitida (20%), faryngitida (18 %), pyrexie (17 %), průjem (15 %), chřipka (12 %) a epistaxe (12 %). Většina těchto nežádoucích účinků byla považována za mírné a středně závažné.
Závažné nežádoucí účinky byly hlášeny u 94 (41%) z 229 subjektů užívajících sildenafil. Z 94 subjektů nahlašujících závažné nežádoucí účinky jich 14/55 (25,5 %) bylo ve skupině užívající nízkou dávku, 35/74 (47,3 %) ve skupině užívající střední dávku a 45/100 (45 %) ve skupině užívající vysokou dávku. Nejčastějšími nežádoucími účinky, které byly hlášeny s frekvencí > 1% u subjektů léčených sildenafilem (kombinovaná skupina dávek), byly pneumonie (7,4 %), srdeční selhání (5,2 %), plicní hypertenze (5,2 %), infekce horních cest dýchacích (3,1 %), pravostranné srdeční selhání (2,6 %), gastroenteritida (2,6 %), synkopa (2,2 %), bronchitida (2,2 %), bronchopneumonie (2,2 %), plicní arteriální hypertenze (2,2 %), bolest na hrudi (1,7 %), zubní kaz (1,7 %), kardiogenní šok (1,3 %), virová gastroenteritida (1,3 %), infekce močového ústrojí (1,3 %).
Následující závažné nežádoucí účinky byly považovány za související s léčbou: enterokolitida, křeče, hypersenzitivita, stridor, hypoxie, neurosenzorická hluchota a komorová arytmie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Ve studiích jednotlivých dávek až do 800 mg u zdravých dobrovolníků byly nežádoucí účinky podobné těm, které byly pozorované při nižších dávkách, ale jejich míra výskytu a závažnost stoupala. Při jednotlivé dávce 200 mg byla incidence nežádoucích reakcí vzrůstající (bolest hlavy, návaly, závratě, dyspepsie, otok nosní sliznice a porucha zraku).
V případě předávkování je vhodné zahájit dle potřeby standardní podpůrnou terapii. Renální dialýza nezrychluje clearance sildenafilu, protože je silně vázán na bílkoviny plazmy a není vylučován močí.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: urologika, léky užívané k léčbě erektilní dysfunkce, ATC kód:
G04BE03
Mechanizmus účinku
Sildenafil je silný a selektivní inhibitor cGMP specifické fosfodiesterázy typu 5 (PDE5), enzymu zodpovědného za degradaci cGMP. Enzym PDE5 je kromě kavernózního tělíska v penisu přítomen i ve svalovině plicních cév. Sildenafil tedy v hladkých svalech plicních cév zvyšuje hladinu cGMP a vede tak k jejich relaxaci. U pacientů s plicní arteriální hypertenzí to vede k selektivní vazodilataci plicního řečiště a v menší míře i k systémové vazodilataci.
Farmakodynamický účinek
Studie in vitro ukázaly, že sildenafil je selektivní k PDE5. Jeho účinek je mohutnější na PDE5 než na ostatní známé fosfodiesterázy. Ve srovnání s PDE6, která je zapojena do fototransdukční kaskády v sítnici, je selektivita k PDE5 10násobná. Selektivita oproti PDE1 je 80násobná a oproti PDE 2, 3, 4, 7, 8, 9, 10 a 11 potom 700násobná. Sildenafil má především více jak 4000násobnou selektivitu k PDE5 než k PDE3, izoformě fosfodiesterázy specifické k cAMP, zapojené do kontroly srdeční kontraktility.
Sildenafil způsobuje mírný a přechodný pokles systémového krevního tlaku, který ve většině případů nemá klinické projevy. Po dlouhodobém podávání 80 mg 3x denně pacientům se systémovou hypertenzí došlo k poklesu v průměru o 9,4 mmHg a 9,1 mmHg, od výchozích hodnot systolického a diastolického krevního tlaku vleže. Po dlouhodobém podávání 80 mg 3x denně pacientům s plicní arteriální hypertenzí byly pozorovány menší účinky na krevní tlak (snížení systolického i diastolického tlaku o 2 mmHg). Při doporučené dávce 20 mg 3x denně nebylo pozorováno snížení systolického ani diastolického tlaku.
Jednotlivá perorální dávka sildenafilu do výše 100 mg neměla u zdravých dobrovolníků žádné klinicky významné účinky na EKG. Při chronickém dávkování 80 mg 3x denně pacientům s plicní arteriální hypertenzí nebyly hlášeny žádné významné změny na EKG.
Ve studii zkoumající hemodynamický účinek jednotlivé dávky 100 mg sildenafilu u 14 pacientů se závažným onemocněním koronárních tepen (> 70 % stenóza alespoň jedné koronární tepny) byl průměrný systolický a diastolický tlak v klidu snížen o 7 % a 6 % v porovnání s výchozí hodnotou.
Průměrný plicní systolický tlak byl snížen o 9 %. Sildenafil nevykazoval žádný účinek na srdeční výdej a nezhoršoval průtok zúženými koronárními tepnami.
U některých testovaných subjektů byla jednu hodinu po užití dávky 100 mg pozorována za použití Farnsworth-Munsellova testu se 100 odstíny mírná a přechodná porucha rozlišování barev (modrá/zelená), dvě hodiny po dávce nebyl žádný efekt patrný. Předpokládaný mechanizmus této změny v rozlišení barev je spojen s inhibicí PDE6, která je zapojena do kaskády fototransdukce v retině. Sildenafil nemá vliv na zrakovou ostrost nebo vnímání kontrastu. V malé, placebem kontrolované studii pacientů s prokázanou makulární degenerací spojenou s raným věkem (n=9), nevykazoval sildenafil v jednotlivé dávce 100 mg významný vliv na provedené zrakové testy (zraková ostrost, Amslerova mřížka, rozlišení barev simulovaného semaforu, Humphreyho perimetr a fotostres).
Klinická účinnost a bezpečnost
Účinnost u dospělých _pacientů s plicní arteriální hypertenzí (PAH)
Randomizovaná dvojitě slepá studie kontrolovaná placebem byla provedena u 278 pacientů s primární PAH, sekundární PAH při onemocnění pojivové tkáně a PAH po chirurgické korekci vrozené srdeční vady. Pacienti byli randomizováni do jedné ze čtyř skupin: placebo, 20 mg sildenafilu, 40 mg sildenafilu a 80 mg sildenafilu, v dávce 3x denně. Z 278 randomizovaných pacientů 277 obdrželo alespoň jednu dávku studovaného léku. Studovaná populace se skládala z 68 (25 %) mužů a 209 (75 %) žen průměrného věku 49 let (rozmezí 18-81 let) s výchozí hodnotou 6minutového testu chůze v rozmezí 100 až 450 metrů včetně (průměr: 344 metrů). 175 pacientů (63 %) bylo diagnostikováno s primární plicní hypertenzí, 84 (30 %) bylo diagnostikováno s plicní arteriální hypertenzí při onemocnění pojivové tkáně a 18 (7 %) pacientů bylo diagnostikováno s plicní arteriální hypertenzí po chirurgické korekci vrozené srdeční vady. Studie se účastnilo nejvíce pacientů se třídou II dle WHO klasifikace (107/277, 39 %) nebo III (160/277, 58 %) s průměrnou výchozí vzdáleností 6minutové chůze 378 resp. 326 metrů; méně pacientů bylo se třídou I (1/2777, 0,4 %) nebo IV (9/277, 3 %). Pacienti s ejekční frakcí levé komory < 45 % nebo indexem komorového zkrácení < 0,2 nebyli studováni.
Sildenafil (nebo placebo) byl přidán k výchozí terapii, která mohla zahrnovat kombinaci antikoagulace, digoxinu, blokátoru kalciového kanálu, diuretika nebo kyslíku. Užití prostacyklinu, prostacyklinových analogů a antagonistů endotelinových receptorů jako přídatné terapie nebylo dovoleno, a stejně tak nebylo dovoleno doplňování argininu. Pacienti, kteří dříve selhali v terapii bosentanem byli ze studie vyloučeni.
Primárním sledovaným parametrem účinnosti byla změna vzdálenosti 6minutové chůze (6minute walk distance, 6MWD) od výchozích hodnot ve 12. týdnu. Statisticky významné prodloužení 6MWD bylo pozorováno u všech tří dávkovacích schémat sildenafilu v porovnání s placebem. Prodloužení 6MWD, korigované o placebo, bylo 45 m (P<0,0001), 46 m (p <0,0001) a 50 m (p<0,0001) pro sildenafil v dávce 20 mg, 40 mg a 80 mg 3x denně v tomto pořadí. Rozdíl mezi jednotlivými dávkami sildenafilu nebyl významný. U pacientů s výchozí hodnotou 6MWD < 325 metrů byla pozorována zlepšená účinnost při použití vyšších dávek (o placebo korigované zlepšení o 58 metrů u dávky 20 mg 3x denně, o 65 metrů u dávky 40 mg 3x denně a o 87 metrů u dávky 80 mg 3x denně).
Při analýze podle funkčních tříd WHO byl u skupiny užívající dávku 20 mg pozorován statisticky významný nárůst ve 6MWD. U třídy II a třídy III byly pozorovány nárůsty (korigované o placebo) o 49 metrů (p = 0,0007) resp. o 45 metrů (p = 0,0031)
Zlepšení 6MWD bylo zřetelné po 4 týdnech léčby a tento účinek přetrvával v 8. a 12. týdnu. Výsledky byly u podskupin všeobecně konzistentní, vzhledem k výchozím vzdálenostem chůze, etiologii (primární PAH a PAH při onemocnění pojivové tkáně), funkční třídě dle WHO, pohlaví, rase, místu, průměrném plicním arteriálním tlaku (mPAP) a indexu plicní vaskulární rezistence (PVRI).
Pacienti užívající všechny dávky sildenafilu dosáhli ve srovnání s těmi, kteří užívali placebo, statisticky významného snížení středního plicního arteriálního tlaku (mPAP) a plicní vaskulární rezistence (PVR). Účinky léčby korigované o placebo u mPAP byly -2,7 mmHg (p=0,04) u sildenafilu
20 mg 3x denně, -3 mmHg (p=0,01) u sildenafilu 40 mg 3x denně a -5,1 mmHg (p=0,0001) u sildenafilu 80 mg 3x denně. Účinky léčby korigované o placebo u PVR byly -178 dyne.sec/cm5 (p=0,0051) u sildenafilu 20 mg 3x denně, -195 dyne.sec/cm5 (p=0,0017) u sildenafilu 40 mg 3x denně a -320 dyne.sec/cm5 (p<0,0001) u sildenafilu 80 mg 3x denně. Ve 12 týdnu bylo u sildenafilu 20 mg, 40 mg resp. 80 mg 3x denně procentní snížení PVR (11,2 %, 12,9 %, 23,3 %) proporčně větší než snížení systémové vaskulární rezistence (SVR) (7,2 %, 5,9 %, 14,4 %). Vliv sildenafilu na mortalitu není znám.
Vyšší podíl pacientů léčených jednotlivými dávkami sildenafilu (tj. 28 %, 36 % resp. 42 % subjektů užívajících sildenafil v dávce 20 mg, 40 mg resp. 80 mg 3x denně) vykazoval ve 12 týdnu zlepšení alespoň o jednu funkční třídu dle WHO v porovnání s placebem (7%). Poměr šancí (Odds ratio) byl 2,92 (p=0,0087), 4,32 (p=0,0004) a 5,75 (p<0,0001).
Dlouhodobá data o přežití u dosud neléčených pacientů
Pacienti zařazeni do pivotní studie měli možnost pokračovat v dlouhodobé rozšířené otevřené studii.
Po 3 letech dostávalo 87% pacientů dávku 80 mg 3x denně. V pivotní studii bylo přípravkem Revatio léčeno 207 pacientů a jejich dlouhodobý status přežití byl sledován po dobu nejméně 3 let. V této populaci byly odhady přežití dle Kaplan-Meierovy metody 96 % v prvním roce, 91 % v druhém roce a 82 % v třetím roce. Přežití u pacientů WHO funkční třídy II bylo při výchozích hodnotách 99 % v prvním roce, 91 % v druhém roce a 84 % v třetím roce a u pacientů WHO funkční třídy III bylo při výchozích hodnotách 94 % v prvním roce, 90 % v druhém roce a 81 % v třetím roce.
Účinnost u dospělých pacientů s PAH (v kombinaci s epoprostenolem)
Byla provedena randomizovaná, dvojitě slepá, placebem kontrolovaná studie s 276 pacienty s PAH, kteří byli stabilizováni na léčbě intravenózně podaným epoprostenolem. Mezi pacienty s PAH byli zařazeni pacienti s primární PAH (212/267, 79 %) a PAH při onemocnění pojivových tkání (55/267,
21 %). Většina pacientů patřila podle výchozích hodnot WHO klasifikace do funkční třídy II (68/267, 26 %) nebo III (175/267, 66 %); méně pacientů patřilo do funkční třídy I (3/267, 1 %) nebo IV (16/267, 6 %); u minima pacientů (5/267, 2 %) WHO funkční třída nebyla známa. Pacienti byli randomizováni do skupiny užívající placebo nebo sildenafil (ve fixní titraci začínající na 20 mg
s přechodem na 40 mg a posléze na 80 mg, 3x denně, dle snášenlivosti) užívané v kombinaci s intravenózním epoprostenolem.
Primárním sledovaným parametrem účinnosti byla změna vzdálenosti 6minutové chůze od výchozích hodnot v 16 týdnu. V porovnání s placebem byl zaznamenán statisticky významný příznivější účinek sildenafilu na vzdálenost při 6minutové chůzi. Byl zaznamenán, o hodnoty placeba korigovaný, průměrný nárůst vzdálenosti chůze o 26 metrů ve prospěch sildenafilu (95% CI: 10,8; 41,2) (p=0,0009). U pacientů s výchozí hodnotou vzdálenosti chůze >325 metrů byl pozorován efekt léčby 38,4 metru ve prospěch sildenafilu; u pacientů s výchozí hodnotou vzdálenosti chůze <325 metrů byl pozorován léčebný efekt 2,3 metry ve prospěch placeba. U pacientů s primární PAH byl efekt léčby
31,1 metru v porovnání se 7,7 metru u pacientů s PAH při onemocnění pojivových tkání. Rozdíl ve výsledcích mezi randomizovanými podskupinami mohl být náhodný vzhledem k omezené velikosti skupin.
Pacienti léčeni sildenafilem dosáhli statisticky významného snížení středního tlaku v plicnici (mPAP = mean Pulmonary Arterial Pressure) ve srovnání s pacienty dostávajícími placebo. Byl zaznamenán, o hodnoty placeba korigovaný, průměrný efekt léčby -3,9 mmHg ve prospěch sildenafilu (95% CI: -5,7; -2,1) (p=0,00003). Doba do klinického zhoršení byla sekundárním cílovým ukazatelem, definovaným jako doba od randomizace do výskytu prvních příhod klinického zhoršení (úmrtí, transplantace plic, zahájení léčby bosentanem nebo klinické zhoršení vyžadující změnu léčby epoprostenolem). Léčba sildenafilem významně prodlužuje dobu do klinického zhoršení PAH v porovnání s placebem (p=0,0074). Příhody klinického zhoršení zaznamenalo 23 subjektů ve skupině užívající placebo (17,6 %) v porovnání s 8 subjekty ve skupině léčené sildenafilem (6,0 %).
Dlouhodobá data o přežití ze studie s epoprostenolem
Pacienti zařazeni do studie s přídatnou léčbou epoprostenolem, měli možnost pokračovat v dlouhodobé rozšířené otevřené studii. Po 3 letech dostávalo 68% pacientů dávku 80 mg 3x denně.
Celkem 134 pacientů bylo léčeno přípravkem Revatio v původní studii a jejich dlouhodobý status přežití byl hodnocen po nejméně 3 letech. V této populaci byly odhady přežití dle Kaplan/Meierovy metody po 1 roce 92%, po 2 letech 81% a po 3 letech 74%.
Účinnost a bezpečnost u dospělých _pacientů s PAH (při _použití v kombinaci s bosentanem)
Byla provedena randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie u 103 klinicky stabilních subjektů s PAH (funkční třída II a III dle WHO klasifikace), léčených bosentanem po dobu nejméně tří měsíců. Mezi pacienty s PAH byli zařazeni pacienti s primární PAH a PAH spojenou s onemocněním pojivové tkáně. Pacienti byli randomizováni do skupiny s placebem nebo sildenafilem (20 mg 3x denně) v kombinaci s bosentanem (62,5 - 125 mg 2x denně). Primárním cílovým parametrem účinnosti byla změna 6MWD ve 12. týdnu oproti výchozí hodnotě. Výsledky ukazují, že u 6MWD neexistuje žádný významný rozdíl v pozorované průměrné změně od výchozí hodnoty mezi sildenafilem 20 mg a placebem (13,62 metru (95% CI: -3,89 až 31,12) oproti 14,08 metru (95% CI: -1,78 až 29,95)).
Byly pozorovány rozdíly v 6MWD mezi pacienty s primární PAH a PAH spojenou s onemocněním pojivové tkáně. U subjektů s primární PAH (67 subjektů) činila průměrná změna od výchozí hodnoty 26,39 metru (95% CI: 10,70 až 42,08) ve skupině se sildenafilem a 11,84 metru (95% CI: -8,83 až 32,52) ve skupině s placebem. U subjektů s PAH spojenou s onemocněním pojivové tkáně (36 subjektů) však průměrná změna od výchozí hodnoty činila -18,32 metru (95% CI: -65,66 až 29,02) ve skupině se sildenafilem a 17,50 metru (95% CI: -9,41 až 44,41) ve skupině s placebem.
Celkově byly nežádoucí příhody obecně podobné u obou léčebných skupin (sildenafil plus bosentan oproti bosentanu samotnému) a ve shodě se známým profilem bezpečnosti sildenafilu při použití v monoterapii (viz body 4.4 a 4.5).
Pediatrická populace
V randomizované, dvojitě slepé, multicentrické, placebem kontrolované studii s paralelními skupinami s různými dávkami bylo léčeno 234 subjektů ve věku 1-17 let. Subjekty (38 % mužských a 62 % ženských subjektů) vážily > 8 kg a trpěly primární plicní hypertenzí (PPH) [33 %], nebo PAH sekundární k vrozené srdeční vadě [levo-pravý zkrat 37 %, chirurgicky řešeno 30 %]. V této studii bylo 63 z 234 (27 %) pacientů mladších 7 let (nízká dávka sildenafilu = 2; střední dávka = 17; vysoká dávka = 28; placebo = 16) a 171 z 234 (73 %) pacientů bylo ve věku 7 let a starších (nízká dávka sildenafilu = 40; střední dávka = 38; vysoká dávka = 49; placebo = 44). Nejvíce subjektů mělo na začátku léčby funkční třídu dle WHO I (75/234, 32 %) nebo II (120/234, 51 %), méně pacientů mělo třídu III (35/234, 15 %) nebo IV (1/234, 0,4 %); u malého počtu pacientů nebyla třída známa (3/234,
1,3 %). Pacienti dříve nebyli léčeni konkrétní léčbou PAH a ve studii nebylo povoleno užití prostacyklinu, analogů prostacyklinu a antagonistů endotelinového receptoru, ani náhrady argininu, nitrátů, alfa-blokátorů a silných inhibitorů CYP450 3A4.
Primárním cílovým parametrem účinnosti ve studii bylo vyhodnocení účinnosti 16týdenní chronické léčby perorálně podaným sildenafilem u pediatrických subjektů zlepšit fyzickou zdatnost, měřenou kardiopulmonálním zátěžovým testem (CPET) u subjektů, které byly vývojově schopné test podstoupit (n= 115). Sekundárním cílovým parametrem bylo hemodynamické sledování, vyhodnocení příznaků, měření funkční třídy dle WHO, změny doprovodné léčby a kvality života.
Subjekty byly alokovány do 1 ze 3 skupin léčených sildenafilem; nízké (10 mg), střední (10-40 mg) a vysoké (20-80 mg) dávky přípravku Revatio, podané 3x denně, nebo do skupiny užívající placebo. Konkrétní dávky podané v rámci skupiny byly závislé na tělesné hmotnosti (viz bod 4.8). Poměr subjektů užívajících podpůrnou léčbu před zahájením léčby (antikoagulancia, digoxin, blokátory kalciového kanálu, diuretika a/nebo kyslík) byl podobný v kombinované skupině léčené sildenafilem (47,7 %) a placebem (41,7 %).
Primárním cílovým parametrem účinnosti ve studii byla procentní změna vrcholového příjmu kyslíku (VO2 peak) korigovaná o placebo oproti výchozím hodnotám, měřená testem CPET ve skupinách užívajících kombinované dávky (Tabulka 2). Celkově bylo v testu CPET vyhodnoceno 106 z 234 subjektů (45 %), což zahrnovalo pacienty > 7 let a vývojově schopné test podstoupit. Děti mladší 7 let (kombinovaná dávka sildenafilu = 47, placebo = 16) byly hodnoceny pouze podle sekundárních cílových parametrů. Průměrné hodnoty výchozího vrcholového příjmu kyslíku (VO2) byly srovnatelné ve všech skupinách léčených sildenafilem (17,37 až 18,03 ml/kg/min), a mírně vyšší ve skupině užívající placebo (20,02 ml/kg/min.). Výsledky hlavní analýzy (kombinované skupiny vs. placebo) nebyly statisticky významné (p = 0,056) (viz Tabulka 2). Odhadovaný rozdíl mezi střední dávkou sildenafilu a placebem byl 11,33 % (95% CI: 1,72 to 20,94) (viz Tabulka 2).
Tabulka 2: % změna vrcholového VO2 oproti výchozím hodnotám korigovaná o placebo, podle aktivní léčebné skupiny
Odhad rozdílu
3,81
95% interval spolehlivosti
-6,11, 13,73
Léčebná skupina Nízká dávka (n=24)
Střední dávka 11,33 1,72, 20,94
(n=26)
Vysoká dávka 7,98 -1,64, 17,60
(n=27)
Kombinace skupin (n=77) 7,71 -0,19, 15,60
(p = 0,056)
n=29 ve skupině užívající placebo
Odhady podle ANCOVA s korekcí pro ostatní náhodné proměnné výchozího vrcholového VO2, etiologie a tělesné hmotnosti skupin.
Pomocí indexu plicní vaskulární rezistence (PVRI) a průměrného plicního arteriálním tlaku (mPAP) byla pozorována zlepšení závislá na velikosti podané dávky. Skupiny léčené střední a vysokou dávkou sildenafilu vykazovaly snížení PVRI oproti placebu, o 18 % (95% CI: 2 % až 32 %) resp. 27 % (95% CI: 14 % až 39 %), zatímco skupina léčená nízkou dávkou nevykazovala významný rozdíl oproti placebu (rozdíl byl 2 %). Skupiny léčené střední a vysokou dávkou sildenafilu vykazovaly změny mPAP oproti výchozím hodnotám v porovnání s placebem, o -3,5 mmHg (95% CI: -8,9, 1,9) resp. -
7,3 mmHg (95% CI: -12,4, -2,1), zatímco skupina léčená nízkou dávkou vykazovala pouze malý nebo žádný rozdíl (rozdíl o 1,6 mmHg). Bylo pozorováno zlepšení srdečního indexu u všech skupin léčených sildenafilem, oproti placebu: 10 % u nízké, 4 % u střední a 15 % u vysoké dávky.
Významná zlepšení funkční třídy byla prokázána pouze u subjektů léčených sildenafilem ve vysokých dávkách v porovnání s placebem. Poměr šancí (Odds ratio) u nízké, střední a vysoké dávky v porovnání s placebem byl 0,6 (95% CI: 0,18, 2,01), 2,25 (95% CI: 0,75, 6,69) resp. 4,52 (95% CI: 1,56, 13,10).
Údaje z dlouhodobého pokračování v léčbě
Celkem 220 z 234 pediatrických subjektů léčených v krátkodobé placebem kontrolované studii vstoupilo do dlouhodobé pokračující studie. Subjekty ze skupiny užívající v krátkodobé studii placebo byly náhodně nově zařazeny do skupiny léčené sildenafilem; subjekty s hmotností < 20 kg byly zařazeny do skupin užívajících střední nebo vysokou dávku (v poměru 1 : 1), zatímco subjekty s hmotností > 20 kg byly zařazeny do skupin užívajících nízkou, střední nebo vysokou dávku (v poměru 1:1:1). Z celkem 229 subjektů užívajících sildenafil, bylo do skupin užívajících nízkou, střední, resp. vysokou dávku zařazeno 55, 74, resp. 100 subjektů. V krátkodobé i dlouhodobé studii se celková doba léčby od dvojitého zaslepení u jednotlivých subjektů pohybovala od 3 do 3129 dní. Ve skupině léčené sildenafilem byla střední doba léčby sildenafilem 1696 dní (vyjma 5 subjektů, které po dvojitém zaslepení dostávaly placebo a nebyly léčeny v dlouhodobé pokračující studii).
Odhad přežití ve 3. roce dle Kaplan-Meierovy metody u pacientů s výchozí tělesnou hmotností > 20 kg byl 94 % ve skupině s nízkou dávkou, 93 % ve skupině se střední dávkou a 85 % ve skupině s vysokou dávkou; u pacientů s výchozí tělesnou hmotností < 20 kg byl 94 % ve skupině se střední dávkou a 93 % ve skupině s vysokou dávkou (viz body 4.4 a 4.8).
V průběhu provádění studie bylo hlášeno celkem 42 případů úmrtí, v průběhu studie, nebo i během následného sledování přežití. K 37 případům úmrtí došlo dříve, než bylo u subjektů rozhodnuto o snížení titrace na nižší dávkování na základě pozorované nerovnováhy v parametru mortality s rostoucími dávkami sildenafilu. Mezi těmito 37 případy úmrtí byly počty (%) případů úmrtí ve skupinách s nízkou, střední, resp. vysokou dávkou sildenafilu 5/55 (9,1 %), 10/74 (13,5 %), resp. 22/100 (22 %). Následně bylo hlášeno dalších 5 případů úmrtí (3 případy ve skupině se střední dávkou a 2 případy ve skupině s vysokou dávkou). Příčiny úmrtí byly typické pro pacienty s PAH. Vyšší než doporučené dávky se nesmí pediatrickým pacientům s PAH podávat (viz body 4.2 a 4.4).
žádné
roce
Po 1 roce od zahájení placebem kontrolované studie byl zjišťován vrcholový VO2. Ze subjektů léčených sildenafilem vývojově schopných podstoupit test CPET nevykázalo 59 ze 114 (52 %) zhoršení vrcholového VO2 od zahájení léčby sildenafilem. Podobně 191 z 229 subjektů (83 %) užívajících sildenafil buď udrželo, nebo zlepšilo svou funkční třídu dle WHO při hodnocení po léčby.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studie s přípravkem Revatio u novorozenců s PAH (viz bod 4.2 informace o použití u dětí).
5.2 Farmakokinetické vlastnosti
Absorpce
Sildenafil se rychle vstřebává. Maximálních pozorovaných plazmatických hladin se dosahuje během 30 až 120 minut (medián 60 minut) po perorálním podání nalačno. Průměrná absolutní perorální biologická dostupnost je 41% (rozmezí 25-63 %). Po perorálním podávání sildenafilu 3x denně stoupá AUC a Cmax v rozsahu dávek 20-40 mg úměrně dávce. Po perorální dávce 80 mg 3x denně byl pozorován o něco vyšší než proporční vzestup plazmatických hladin. U pacientů s plicní arteriální hypertenzí je perorální biologická dostupnost sildenafilu po podání dávky 80 mg 3x denně průměrně o 43 % vyšší (90% CI: 27-60 %) v porovnání s nižší dávkou.
Pokud je sildenafil užíván s jídlem, je míra absorpce snížena, s průměrným zpožděním Tmax o 60 minut a průměrným poklesem Cmax o 29 %, stupeň absorpce ale nebyl významně ovlivněn (AUC snížena o 11%).
Distribuce
Průměrný distribuční objem v rovnovážném stavu (Vss) je pro sildenafil 105 l, což svědčí pro distribuci do tkání. Po perorální dávce 20 mg 3x denně jsou průměrné maximální plazmatické hladiny sildenafilu v rovnovážném stavu přibližně 113 ng/ml. Sildenafil a jeho hlavní cirkulující N-demetylovaný metabolit se váží na plazmatické bílkoviny přibližně z 96 %. Vazba na bílkoviny plazmy není závislá na celkové koncentraci.
Biotransformace
Sildenafil je odbouráván především jaterními mikrozomálními izoenzymy CYP3A4 (hlavní cesta) a CYP2C9 (vedlejší cesta). Hlavní cirkulující metabolit vzniká N-demetylací sildenafilu. Tento metabolit má profil fosfodiesterázové aktivity podobný sildenafilu a in vitro účinek na PDE5 přibližně 50 % ve srovnání s mateřskou látkou. N-demetylovaný metabolit je dále metabolizován s terminálním poločasem přibližně 4 hodiny. U pacientů s plicní arteriální hypertenzí jsou plazmatické koncentrace u N-demetylovaného metabolitu přibližně 72 % koncentrace sildenafilu při dávkování 20 mg 3x denně (to představuje 36% podíl na farmakologických účincích sildenafilu). Následný vliv na účinnost není znám.
Eliminace
Celková tělesná clearance sildenafilu je 41 l/hod s výsledným koncovým poločasem 3-5 hodin. Po perorálním nebo intravenózním podání je sildenafil vylučován jako metabolity převážně ve stolici (přibližně 80 % podané perorální dávky) a v menší míře močí (přibližně 13 % podané perorální dávky).
Starší pacienti
Zdraví starší dobrovolníci (65 let a více) vykazovali sníženou clearance sildenafilu, což vedlo k vyšším plazmatickým hladinám sildenafilu přibližně o 90 % a jeho aktivního N-demetylovaného metabolitu, v porovnání s mladšími zdravými dobrovolníky (18-45 let). Vzhledem k věkovým rozdílům ve vazbě na plazmatické bílkoviny byl odpovídající vzestup volné plazmatické koncentrace sildenafilu přibližně 40 %.
Renální insuficience
U dobrovolníků s mírným až středním poškozením ledvin (clearance kreatininu = 30-80 ml/min) nebyla farmakokinetika sildenafilu po podání jednotlivé 50 mg dávky změněna. U dobrovolníků s těžkým stupněm poškození ledvin (clearance kreatininu < 30 ml/min) byla clearance sildenafilu snížena, což vedlo k průměrnému vzestupu AUC a Cmax o 100 % a 88 % ve srovnání s věkově odpovídajícími dobrovolníky bez renálního poškození. Navíc byly u pacientů s těžkým poškozením ledvin významně zvýšeny hodnoty AUC a Cmax pro N-demetylovaný metabolit o 200 % a 79 %, v porovnání se subjekty s normální renální funkcí.
Jaterní insuficience
U dobrovolníků s mírnou až střední jaterní cirhózou (Child-Pugh skóre A a B) byla clearance sildenafilu snížena, což vedlo k vzestupu AUC (85 %) a Cmax (47 %) ve srovnání s dobrovolníky odpovídajícího věku bez poškození jater. Navíc byly u subjektů s cirhózou hodnoty AUC a Cmax N-demetylovaného metabolitu výrazně zvýšené o 154 % a 87 %, v porovnání se subjekty s normální jaterní funkcí. Farmakokinetika sildenafilu u pacientů s těžkým poškozením jater nebyla studována.
Populační _ farmakokinetika
Průměrné koncentrace rovnovážného stavu byly u pacientů s plicní arteriální hypertenzí v rozsahu studovaných dávek 20-80 mg 3x denně o 20-50 % vyšší ve srovnání se zdravými dobrovolníky. Cmin byla ve srovnání se zdravými dobrovolníky dvojnásobná. Tyto závěry naznačují nižší clearance a/nebo vyšší perorální biologickou dostupnost sildenafilu u pacientů s plicní arteriální hypertenzí ve srovnání se zdravými dobrovolníky.
Pediatrická _ populace
Na základě analýzy farmakokinetického profilu sildenafilu u pacientů zahrnutých v pediatrických klinických studiích, se tělesná hmotnost ukázala být prediktorem expozice u dětí. Hodnoty poločasu plazmatické koncentrace sildenafilu jsou odhadovány na 4,2-4,4 hodiny u tělesné hmotnosti 10-70 kg a nevykazovaly žádný rozdíl, který by mohl být klinicky významný. Cmax po jednorázovém podání 20 mg sildenafilu p.o. byl odhadnut na 49 ng/ml u pacienta vážícího 70 kg, 104 ng/ml u pacienta vážícího 20 kg a 165 ng/ml u pacienta vážícího 10 kg. Cmax po jednorázovém podání 10 mg sildenafilu p.o. byla odhadnuta na 24 ng/ml u pacienta vážícího 70 kg, 53 ng/ml u pacienta vážícího 20 kg a 85 ng/ml u pacienta vážícího 10 kg. Tmax byl odhadnut na přibližně 1 hodinu a byl téměř nezávislý na tělesné hmotnosti.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje, získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, toxicity při reprodukci a vývoje, neodhalily žádné zvláštní riziko pro člověka.
U mláďat potkanů, která byla pre- a postnatálně léčena sildenafilem v dávce 60 mg/kg, byla při expozici přibližně 50x vyšší než je očekávaná expozice u člověka při dávce 20 mg 3x denně, pozorována snížená velikost vrhu, nižší hmotnost mláďat v den narození a snížené přežití po 4 dnech. Účinky v neklinických studiích byly pozorovány při expozicích dostatečně převyšujících maximální expozici u člověka, což svědčí o malém významu při klinickém použití.
U zvířat nebyly při klinicky relevantních expozicích pozorovány žádné nežádoucí účinky, potenciálně klinicky významné, které by rovněž nebyly pozorovány v klinických studiích.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek pro přípravu perorální suspenze:
Sorbitol
Bezvodá kyselina citronová Sukralosa Natrium-citrát Xanthanová klovatina Oxid titaničitý (E171)
Natrium-benzoát (E211)
Koloidní bezvodý oxid křemičitý
Aroma hroznového vína:
Maltodextrin
Koncentrát šťávy z hroznového vína Arabská klovatina Koncentrát ananasové šťávy Bezvodá kyselina citronová Přírodní aroma
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
Po rekonstituci: perorální suspenze je stabilní po dobu 30 dnů
6.4 Zvláštní opatření pro uchovávání
Prášek
Uchovávejte při teplotě do 30 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Perorální suspenze
Uchovávejte při teplotě do 30 °C nebo v chladničce (2-8 °C).
Chraňte před mrazem.
Podmínky uchovávání po rekonstituci přípravku viz bod 6.3.
6.5 Druh obalu a obsah balení
125ml skleněná lahvička jantarové barvy (s PP šroubovacím uzávěrem) obsahuje 32,27 g prášku pro přípravu perorální suspenze.
Po naředění obsahuje lahvička 112 ml perorální suspenze, z čehož 90 ml je určeno k podání. Velikost balení: 1 lahvička
Balení rovněž obsahuje PP odměrku (se značkou 30 ml), PP perorální dávkovací stříkačku (3 ml) s HDPE pístem a LDPE adaptérem na lahvičku.
6.6 Zvláštní opatření pro likvidaci přípravku a zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Doporučuje se, aby lékárník suspenzi přípravku Revatio před vydáním pacientovi připravil.
Instrukce k rekonstituci
Poznámka: K rekonstituci obsahu lahvičky je nutné použít celý objem 90 ml (3x30 ml) bez ohledu na dávku, která má být podána.
1. Poklepejte na lahvičku, aby se prášek uvolnil.
2. Sejměte uzávěr.
3. Za použití přiložené odměrky a podle značky odměřte 30 ml vody a přelijte do lahvičky. Za použití přiložené odměrky odměřte dalších 30 ml vody a přilijte do lahvičky. (obrázek 1)
4. Vraťte uzávěr a lahvičku důkladně protřepávejte po dobu alespoň 30 sekund. (obrázek 2)
5. Sejměte uzávěr.
6. Za použití přiložené odměrky odměřte dalších 30 ml vody a přilijte do lahvičky. Vždy přidejte celý objem 90 ml (3x30 ml) vody bez ohledu na dávku, která má být podána. (obrázek 3)
7. Vraťte uzávěr a lahvičku důkladně protřepávejte po dobu alespoň 30 sekund. (obrázek 4)
obrázek 4
8. Sejměte uzávěr.
9. Do hrdla lahvičky nasaďte adaptér (viz obrázek 5 níže). Adaptér slouží ke snazšímu natažení dávky perorální dávkovací stříkačkou z lahvičky. Vraťte uzávěr.
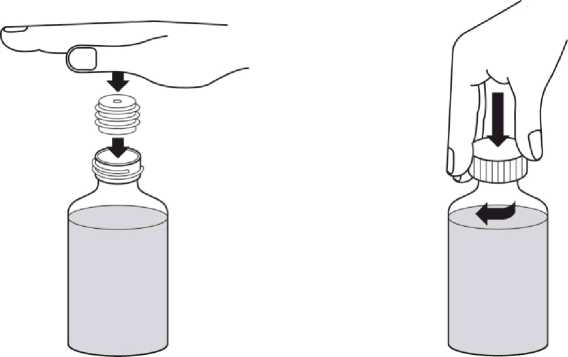
obrázek 5
10. Po naředění prášku vznikne bílá perorální suspenze s příchutí hroznového vína. Na štítek lahvičky napište datum použitelnosti naředěné perorální suspenze (datum použitelnosti rekonstituované perorální suspenze je 30 dnů od data naředění). Po tomto datu je nutné nevyužitý přípravek zlikvidovat, nebo vrátit do lékárny.
Instrukce pro použití
1. Před použitím uzavřenou lahvičku naředěné perorální suspenze důkladně protřepávejte po dobu alespoň 10 sekund. Sejměte uzávěr (obrázek 6).
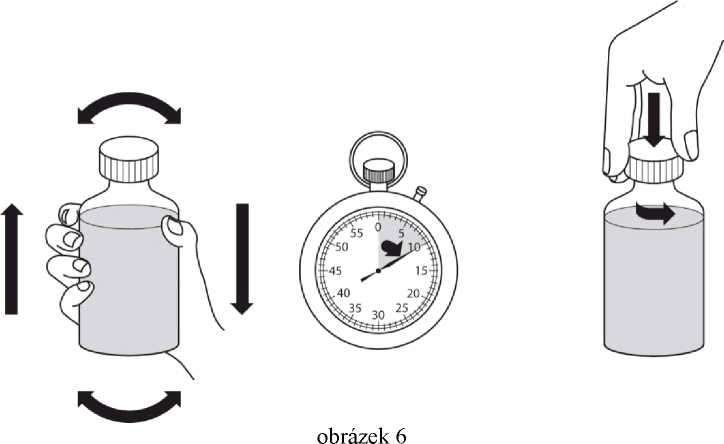
2. Postavte lahvičku na rovný povrch a vložte konec perorální dávkovací stříkačky do adaptéru
(obrázek 7).
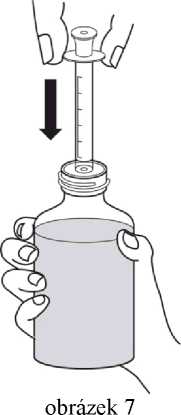
3. Otočte lahvičku dnem vzhůru, s perorální dávkovači stříkačkou stále nasazenou. Pomalu
vytáhněte píst perorální dávkovači stříkačky ke značce Vaší dávky (natažení 1 ml odpovídá dávce 10 mg, natažení 2 ml odpovídá dávce 20 mg). K přesnému odměření dávky je třeba, aby konec pístu byl zároveň s příslušnou značkou na perorální dávkovací stříkačce (obrázek 8).
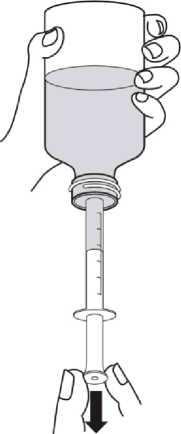
obrázek 8
4. Jsou-li ve stříkačce velké bubliny, zatlačte pomalu píst zpět do stříkačky. Tím dojde k vrácení léku zpět do lahvičky. Zopakujte krok 3.
5. Otočte lahvičku do původní polohy, s perorální dávkovací stříkačkou stále nasazenou. Vyjměte perorální dávkovací stříkačku z lahvičky.
6. Vložte konec perorální dávkovací stříkačky do úst. Směřujte konec perorální dávkovací stříkačky k jedné z tváří. POMALU stlačujte píst perorální dávkovací stříkačky. Nevytlačujte přípravek příliš rychle. Pokud je přípravek podáván dítěti, ujistěte se před podáním přípravku, že sedí, nebo je přidrženo ve zpřímené poloze (obrázek 9).
7. Na lahvičku vraťte uzávěr, adaptér nechte v lahvičce. Vypláchněte perorální dávkovací stříkačku podle doporučení uvedeného níže.
Čištění a skladování stříkačky:
1. Stříkačku je nutné propláchnout po každém použití. Vytáhněte ze stříkačky píst a obě části propláchněte ve vodě.
2. Obě části osušte. Nasaďte píst zpět do stříkačky. Uchovávejte ji na bezpečném čistém místě spolu s lékem.
Po naředění se doporučuje perorální suspenzi podávat pouze perorální dávkovací stříkačkou
přiloženou v balení. Pro podrobnější návod k použití viz příbalová informace.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer Limited, Sandwich, Kent CT13 9NJ, Velká Británie
8. REGISTRAČNÍ ČÍSLO
EU/1/05/318/003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28.října 2005 Datum posledního prodloužení: 23.září 2010
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Jméno a adresa výrobce odpovědného/ výrobců odpovědných za propouštění šarží
Fareva Amboise Zone Industrielle 29 Route des Industries 37530 Pocé-sur-Cisse Francie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej přípravku vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky.
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik
Držitel rozhodnutí o registraci se musí dohodnout na systému kontrolované distribuce 20ml injekční lahvičky přípravku Revatio 0,8 mg/ml injekční roztok s příslušnými národními regulačními agenturami a uvedený program musí být realizován na národní úrovni pro všechny zdravotnické pracovníky, kteří budou přípravek Revatio 0,8 mg/ml injekční roztok předepisovat a/nebo vydávat, a rovněž musí zajistit, že tito obdrží následující:
• Informace pro zdravotnické pracovníky
• Výtisk Souhrnu údajů o přípravku (SPC)
• Formulář DCF (Data Capture Form) vytvořený pro zjednodušení hlášení příhod hypotenze a souvisejících potíží
Informace pro zdravotnické pracovníky musí obsahovat následující klíčové prvky:
• Informace o farmakovigilančním programu sledování možných rizik klinicky významné hypotenze a souvisejících potíží, které se zaznamenávají do DCF.
Držitel rozhodnutí o registraci se musí dohodnout s autoritami příslušného členského státu na informaci pro zdravotnické pracovníky a zdravotnických pracovnících, kteří budou přípravek předepisovat, ještě před uvedením 20ml injekční lahvičky přípravku Revatio 0,8 mg/ml injekční roztok na trh.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Revatio 20 mg potahované tablety sildenafilum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jedna tableta obsahuje 20 mg sildenafilu (ve formě citrátu).
3. SEZNAM POMOCNÝCH LÁTEK
Přípravek obsahuje monohydrát laktózy.
Pro další informace si přečtěte Příbalovou informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
90 potahovaných tablet 300 potahovaných tablet
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Limited Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/318/001
EU/1/05/318/004
13. ČÍSLO ŠARŽE
Č.šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Revatio 20 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Revatio 0,8 mg/ml injekční roztok sildenafilum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK_
Jeden mililitr roztoku obsahuje 0,8 mg sildenafilu (ve formě citrátu).
Jedna 20ml injekční lahvička obsahuje 12,5 ml roztoku (10 mg sildenafilu ve formě citrátu).
3. SEZNAM POMOCNÝCH LÁTEK
Přípravek obsahuje glukózu a vodu na injekci.
4. LÉKOVÁ FORMA A VELIKOST BALENÍ
Injekční roztok
1 injekční lahvička 10 mg /12,5 ml
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intravenózní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Limited Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/318/002
13. ČÍSLO ŠARŽE
Č.šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Revatio 0,8 mg/ml
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH VNITŘNÍ OBAL/BLISTR_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ~
Revatio 20 mg tablety sildenafilum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
LOT
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Revatio 10 mg/ml prášek pro přípravu perorální suspenze sildenafilum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Po rekonstituci obsahuje jeden mililitr suspenze 10 mg sildenafilu (ve formě citrátu).
Jedna lahvička suspenze po rekonstituci (112 ml) obsahuje 1,12 gramu sildenafilu (ve formě citrátu).
3. SEZNAM POMOCNÝCH LÁTEK
Přípravek obsahuje sorbitol.
Pro další informace si přečtěte Příbalovou informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek pro přípravu perorální suspenze 1 lahvička
1 adaptér na lahvičku, 1 odměrka a 1 perorální dávkovací stříkačka
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím lahvičku důkladně protřepejte. Před použitím si přečtěte příbalovou informaci. Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Prášek: Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Po rekonstituci: Uchovávejte při teplotě do 30°C nebo v chladničce při teplotě 2-8 °C. Chraňte před mrazem. Po 30 dnech od rekonstituce nevyužitou suspenzi zlikvidujte.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Limited Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/318/003
13. ČÍSLO ŠARŽE
Č.šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
Revatio 10 mg/ml
ÚDAJE UVÁDĚNÉ NA VNITRNÍM OBALU LAHVIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Revatio 10 mg/ml prášek pro přípravu perorální suspenze sildenafilum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Po rekonstituci obsahuje jeden mililitr suspenze 10 mg sildenafilu (ve formě citrátu).
Jedna lahvička naředěné suspenze (112 ml) obsahuje 1,12 gramů sildenafilu (ve formě citrátu).
3. SEZNAM POMOCNÝCH LÁTEK
Přípravek obsahuje sorbitol.
Pro další informace si přečtěte Příbalovou informaci
4. LÉKOVÁ FORMA A VELIKOST BALENÍ
Prášek pro přípravu perorální suspenze
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím lahvičku důkladně protřepejte. Před použitím si přečtěte příbalovou informaci. Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Prášek: Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Po rekonstituci: Uchovávejte při teplotě do 30 °C nebo v chladničce při teplotě 2-8 °C. Chraňte před mrazem. Po 30 dnech od rekonstituce nevyužitou suspenzi zlikvidujte.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Limited Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/05/318/003
13. ČÍSLO ŠARŽE
Č.šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Revatio 20 mg potahované tablety
sildenafilum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
V příbalové informaci naleznete
1. Co je přípravek Revatio a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat
3. Jak se přípravek Revatio užívá
4. Možné nežádoucí účinky
5. Jak přípravek Revatio uchovávat
6. Obsah balení a další informace
1. Co je přípravek Revatio a k čemu se používá
Přípravek Revatio obsahuje léčivou látku, která patří do skupiny léků nazývaných inhibitory fosfodiesterázy 5 (PDE5).
Přípravek Revatio snižuje krevní tlak v plicích rozšířením plicních cév.
Přípravek Revatio se používá k léčbě dospělých a dětí a dospívajících ve věku 1-17 let s vysokým krevním tlakem v krevních cévách v plicích (plicní arteriální hypertenze).
2. Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat
Neužívejte přípravek Revatio
- jestliže jste alergický(á) na sildenafil nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže užíváte léky obsahující nitráty nebo látky uvolňující oxid dusnatý, jako je amylnitrit. Tyto léky se často užívají jako úleva od příznaků bolesti na hrudi (anginy pectoris). Přípravek Revatio může nebezpečně zvýšit účinek těchto léků. Informujte svého lékaře, pokud kterýkoliv z těchto léků užíváte. Pokud si nejste jistý(á), poraďte se svým lékařem nebo lékárníkem.
- jestliže užíváte riocigvát. Tento lék se používá k léčbě plicní arteriální hypertenze (tj. vysokého krevního tlaku v plicích) a chronické tromboembolické plicní hypertenze (tj. vysokého krevního tlaku v plicích sekundárních krevních sraženin). U PDE5 inhibitorů, jako je například Revatio, bylo prokázáno, že zvyšují hypotenzní účinek tohoto léku. Pokud užíváte riocigvát nebo si nejste jistý(á), informujte svého lékaře.
- jestliže jste nedávno měl(a) mozkovou mrtvici nebo infarkt, jestliže máte závažné onemocnění jater nebo velmi nízký tlak (<90/50 mmHg).
- jestliže užíváte přípravky k léčbě mykotických infekcí, obsahující ketokonazol nebo itrakonazol nebo léky obsahující ritonavir (léčba HIV).
- jestliže jste přišel(přišla) o zrak v důsledku poruchy cévního zásobení očního nervu, která se nazývá nearteritická přední ischemická neuropatie optického nervu (NAION).
Upozornění a opatření
Před užitím přípravku Revatio se poraďte se svým lékařem, pokud
- je Vaše choroba způsobena uzavřenou nebo zúženou žílou v plicích spíše než uzavřenou nebo zúženou tepnou.
- máte závažné srdeční potíže.
- trpíte poruchou funkce srdečních komor.
- máte vysoký krevní tlak v plicních cévách.
- máte nízký krevní tlak v klidu.
- jste ztratil(a) velké množství vody (dehydratace), např. při nadměrném pocení nebo nedostatečném příjmu tekutin. K tomu může dojít při horečce, zvracení nebo průjmu.
- trpíte vzácnou dědičnou poruchou oka (retinitis pigmentosa).
- trpíte poruchou červených krvinek (srpkovitou anémií), nádorovým onemocněním krvinek (leukémií), nádorovým onemocněním kostní dřeně (mnohočetným myelomem) nebo jakoukoliv chorobou či deformitou penisu.
- máte v současné době žaludeční vřed, krvácivou poruchu (jako je hemofilie) nebo problémy s krvácením z nosu.
- užíváte léčivé přípravky k léčbě erektilní dysfunkce.
Při léčbě mužské erektilní dysfunkce byly při užití PDE5 inhibitorů, včetně sildenafilu, hlášeny s neznámou četností následující nežádoucí účinky na zrak: částečné, náhlé, dočasné či trvalé zhoršení nebo ztráta zraku jednoho či obou očí. Zaznamenáte-li náhlé zhoršení či ztrátu zraku, přestaňte přípravek Revatio užívat a okamžitě vyhledejte svého lékaře (viz též bod 4).
Po užití sildenafilu byla u mužů hlášena prodloužená a někdy bolestivá erekce. Pokud máte erekci trvající déle než 4 hodiny, přestaňte přípravek Revatio užívat a okamžitě vyhledejte svého lékaře
(viz též bod 4).
Zvláštní opatření pro pacienty s poškozením ledvin či jater
Informujte svého lékaře, pokud máte onemocnění jater či ledvin, může Vám upravit dávkování.
Děti
Přípravek Revatio nesmí užívat děti mladší než 1 rok.
Další léčivé přípravky a přípravek Revatio
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době
užíval(a), nebo které možná budete užívat.
- Léky obsahující nitráty, nebo uvolňující oxid dusnatý, jako je amylnitrit („poppers“). Tyto léky jsou obvykle předepisovány k úlevě od příznaků anginy pectoris nebo bolesti na hrudi (viz bod 2 Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat).
- Informujte svého lékaře nebo lékárníka, pokud již užíváte riocigvát.
- Léky k léčbě plicní hypertenze (např. bosentan, iloprost).
- Přípravky obsahující třezalku tečkovanou (bylinný prostředek), rifampicin (používaný k léčbě bakteriální infekce), karbamazepin, fenytoin a fenobarbital (používané mj. v léčbě epilepsie).
- Léky, které zabraňují srážení krve (např. warfarin), přestože jejich současné užití nemělo za následek žádné nežádoucí účinky.
- Léky obsahující erythromycin, klarithromycin, telithromycin (antibiotika užívaná při léčbě určitých druhů bakteriálních infekcí), sachinavir (k léčbě HIV) nebo nefazodon (k léčbě mentální deprese), protože může být nutné upravit Vaši dávku.
- Alfa-blokátory (např. doxazosin) k léčbě vysokého krevního tlaku nebo potíží s prostatou, protože kombinace těchto 2 léčivých přípravků může způsobit příznaky snížení krevního tlaku (např. závrať, točení hlavy).
Přípravek Revatio s jídlem a pitím
Během léčby přípravkem Revatio nepijte grapefruitovou šťávu.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Není-li to nezbytné, nesmí se přípravek Revatio během těhotenství užívat.
Přípravek Revatio se nesmí podávat ženám, které mohou otěhotnět, pokud nepoužívají spolehlivou kontracepční metodu.
Ukončete kojení, když začnete užívat přípravek Revatio. Kojící ženy by neměly přípravek Revatio užívat, protože není známo, zda přípravek přechází do mateřského mléka.
Řízení dopravních prostředků a obsluha strojů
Přípravek Revatio může způsobit závratě a ovlivnit zrak. Měl(a) byste vědět, jak reagujete na tento přípravek dříve, než budete řídit či obsluhovat stroje.
Přípravek Revatio obsahuje laktosu
Sdělil-li Vám lékař někdy, že trpíte nesnášenlivostí některých cukrů, kontaktujte svého lékaře před užitím tohoto přípravku.
3. Jak se přípravek Revatio užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
U dospělých je doporučená dávka přípravku 20 mg 3x denně (v odstupu 6 až 8 hodin), užívá se s jídlem i bez jídla.
Užití u dětí a dospívajících
U dětí a dospívajících ve věku 1-17 let je doporučená dávka buď 10 mg 3x denně při hmotnosti dítěte nižší než 20 kg nebo 20 mg 3x denně při hmotnosti dítěte vyšší než 20 kg, užívá se s jídlem i bez jídla. Vyšší dávky se u dětí nesmí podávat. Tento přípravek má být použit pouze v případě podání 20 mg 3 x denně. Jsou k dispozici jiné lékové formy pro podání pacientům s hmotností < 20 kg a jiným mladším pacientům, kteří nejsou schopni polykat tablety.
Jestliže jste užil(a) více přípravku Revatio, než jste měl(a)
Neměl(a) byste užívat více přípravku, než vám lékař doporučil. Jestliže užijete více přípravku, než bylo doporučeno, kontaktujte ihned svého lékaře. Užívání vyšší dávky přípravku Revatio může zvýšit riziko nežádoucích účinků.
Jestliže jste zapomněl(a) užít přípravek Revatio
Jestliže si zapomenete vzít přípravek Revatio, užijte vynechanou dávku ihned, jak si vzpomenete, dále pokračujte v užívání přípravku v obvyklém čase. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) užívat přípravek Revatio
Náhlé ukončení léčby přípravkem Revatio může vést ke zhoršení příznaků Vaší nemoci. Nepřestávejte užívat přípravek Revatio, pokud Vám to nedoporučí Váš lékař. Než úplně přestanete přípravek užívat, Váš lékař Vám doporučí postupné snižování dávky po dobu několika dnů.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Zaznamenáte-li některý z následujících nežádoucích účinků, přestaňte přípravek Revatio užívat a ihned se obraťte na svého lékaře (viz rovněž bod 2):
- zaznamenáte-li náhlé zhoršení nebo ztrátu zraku (četnost není známa).
- máte-li erekci, trvající setrvale déle než 4 hodiny. Po užití sildenafilu byla u mužů hlášena prodloužená a někdy bolestivá erekce (četnost není známa).
Dospělí
Nežádoucí účinky hlášené velmi často (mohou postihnout více než 1 pacienta z 10): bolesti hlavy, návaly horka v obličeji, poruchy trávení, průjem a bolesti paží nebo nohou.
Nežádoucí účinky hlášené často (mohou postihnout až 1 z 10 pacientů) zahrnovaly: podkožní infekce, příznaky podobné chřipce, zánět dutin, snížený počet červených krvinek (chudokrevnost), zadržování tekutin, potíže se spánkem, úzkost, migrénu, třes, brnění (mravenčení), pocit pálení, sníženou citlivost, krvácení očního pozadí, ovlivnění zraku, rozmazané vidění a citlivost na světlo, účinek na barevné vidění, podráždění oka, překrvení očí/zarudnutí očí, závrať, zánět průdušek, krvácení z nosu, rýmu, kašel, ucpaný nos, zánět žaludku, zánět žaludeční sliznice a střev, pálení žáhy, hemoroidy, pocit roztažení břišní krajiny, sucho v ústech, vypadávání vlasů, zčervenání kůže, noční pocení, bolesti svalů, bolest zad a zvýšenou tělesnou teplotu.
Nežádoucí účinky hlášené méně často (mohou postihnout až 1 ze 100 pacientů) zahrnovaly: sníženou ostrost zraku, dvojité vidění, nepříjemné pocity v oku, krvácení z penisu, přítomnost krve ve spermatu a/nebo v moči a zvětšení prsů u mužů.
Byly též hlášeny kožní vyrážka, náhlé zhoršení nebo ztráta sluchu a pokles krevního tlaku, s neznámou četností (četnost nelze z dostupných údajů stanovit).
Děti a dospívající
Následující vážné nežádoucí účinky byly hlášeny často (mohou se vyskytnout až u 1 pacienta z 10): zápal plic, srdeční selhání, pravostranné srdeční selhání, srdeční šok, vysoký krevní tlak v plicích, bolest na hrudi, mdloby, infekce dýchacích cest, zánět průdušek, virová infekce žaludku a střev, infekce močového ústrojí a zubní kazy.
Následující vážné nežádoucí účinky související s léčbou byly hlášeny méně často (mohou se vyskytnout až u 1 pacienta ze 100): alergické reakce (jako je kožní vyrážka, otok obličeje, rtů a jazyka, sípot, potíže s dýcháním nebo polykáním), křeče, nepravidelný srdeční tep, porucha sluchu, zánět trávicího traktu a dýchavičnost.
Nežádoucí účinky hlášené velmi často (mohou se vyskytnout u více než 1 pacienta z 10) byly: bolest hlavy, zvracení, krční infekce, horečka, průjem, chřipka a krvácení z nosu.
Nežádoucí účinky hlášené často (mohou se vyskytnout až u 1 pacienta z 10) byly: nevolnost, zvýšená erekce, zápal plic a rýma.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Revatio uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Revatio obsahuje
- Léčivou látkou je sildenafilum. Jedna tableta obsahuje 20 mg sildenafilu (ve formě citrátu).
- Pomocnými látkami jsou:
Jádro tablety: mikrokrystalická celulosa, hydrogenfosforečnan vápenatý, sodná sůl kroskarmelosy, magnesium-stearát
Potah: hypromelosa, oxid titaničitý (E171), monohydrát laktosy, triacetin.
Jak přípravek Revatio vypadá a co obsahuje toto balení
Přípravek Revatio je ve formě bílých kulatých potahovaných tablet. Tablety jsou na jedné straně označeny “PFIZER” a na druhé “RVT 20”. Tablety se dodávají v balení obsahujícím 90 tablet a v balení obsahujícím 300 tablet. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Pfizer Limited, Sandwich, Kent CT13 9NJ, Velká Británie.
Výrobce:
Fareva Amboise, Zone Industrielle, 29 route des Industries, 37530 Pocé-sur-Cisse, Francie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgie /Belgique / Belgien Pfizer S.A./N.V. Tél/Tel: +32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000 |
|
BtnrapHH n^aň3ep HroKceMÓypr CAPH, KnoH Btnrapua Ten.: +359 2 970 4333 |
Luxembourg/Luxemburg Pfizer S.A. Tél/Tel: +32 (0)2 554 62 11 |
|
Česká republika Pfizer s r.o. Tel: +420-283-004-111 |
Magyarország Pfizer Kft. Tel.: +36 1 488 37 00 |
|
Danmark Pfizer ApS Tlf: +45 44 20 11 00 |
Malta V.J. Salomone Pharma Ltd. Tel: + 356 21 22 01 74 |
|
Deutschland Pfizer Pharma PFE GmbH Tel: +49 (0)800 8535555 |
Nederland Pfizer bv Tel: +31 (0)10 406 43 01 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Norge Pfizer AS Tlf: +47 67 52 61 00 |
|
EXXáSa Pfizer EALág A.E. TpL +30 210 678 5800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
Espaňa Pfizer GEP, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer PFE France Tél: +33 (0)1 58 07 34 40 |
Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 |
Románia Pfizer Románia S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel: + 386/1/52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizačná zložka Tel: +421-2-3355 5500 |
|
Italia Pfizer Italia S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
Kúrcpog Sverige
PFIZER EAAAI A.E. (CYPRUS BRANCH) Pfizer AB
T^: +357 22 817690 Tel: + 46 (0)8 550 520 00
Latvija United Kingdom
Pfizer Luxembourg SARL filiale Latvija Pfizer Limited
Tel: +371 6 70 35 775 Tel: +44 (0)1304 616161
Tato příbalová informace byla naposledy revidována:
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/. Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
Příbalová informace: informace pro uživatele
Revatio 0,8 mg/ml injekční roztok
sildenafilum
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude podán, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
V příbalové informaci naleznete
1. Co je přípravek Revatio a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vám přípravek Revatio bude podán
3. Jak se přípravek Revatio podává
4. Možné nežádoucí účinky
5. Jak přípravek Revatio uchovávat
6. Obsah balení a další informace
1. Co je přípravek Revatio a k čemu se používá
Přípravek Revatio obsahuje léčivou látku, která patří do skupiny léků nazývaných inhibitory fosfodiesterázy 5 (PDE5).
Přípravek Revatio snižuje krevní tlak v plicích rozšířením plicních cév.
Přípravek Revatio se používá k léčbě vysokého krevního tlaku v plicních cévách (plicní arteriální hypertenze) u dospělých.
Přípravek Revatio injekční roztok je další lékovou formou přípravku Revatio pro pacienty, kteří dočasně nemohou užívat tablety.
2. Čemu musíte věnovat pozornost, než Vám přípravek Revatio bude podán
Přípravek Revatio Vám nebude podán
- jestliže jste alergický(á) na sildenafil nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže užíváte léky obsahující nitráty nebo látky uvolňující oxid dusnatý, jako je amylnitrit. Tyto léky se často užívají jako úleva od příznaků bolesti na hrudi (anginy pectoris). Přípravek Revatio může nebezpečně zvýšit účinek těchto léků. Informujte svého lékaře, pokud kterýkoliv z těchto léků užíváte. Pokud si nejste jistý(á), poraďte se svým lékařem nebo lékárníkem.
- jestliže užíváte riocigvát. Tento lék se používá k léčbě plicní arteriální hypertenze (tj. vysokého krevního tlaku v plicích) a chronické tromboembolické plicní hypertenze (tj. vysokého krevního tlaku v plicích sekundárních krevních sraženin). U PDE5 inhibitorů, jako je například Revatio, bylo prokázáno, že zvyšují hypotenzní účinek tohoto léku. Pokud užíváte riocigvát nebo si nejste jistý(á), informujte svého lékaře.
- jestliže jste nedávno měl(a) mozkovou mrtvici nebo infarkt, jestliže máte závažné onemocnění jater nebo velmi nízký tlak (<90/50 mmHg).
jestliže užíváte přípravky k léčbě mykotických infekcí, obsahující ketokonazol nebo itrakonazol nebo léky obsahující ritonavir (léčba HIV).
jestliže jste přišel(přišla) o zrak v důsledku poruchy cévního zásobení očního nervu, která se nazývá nearteritická přední ischemická neuropatie optického nervu (NAION).
Upozornění a opatření
Před použitím přípravku Revatio se poraďte se svým lékařem, pokud:
- je Vaše choroba způsobena uzavřenou nebo zúženou žílou v plicích spíše než uzavřenou nebo zúženou tepnou.
- máte závažné srdeční potíže.
- trpíte poruchou funkce srdečních komor.
- máte vysoký krevní tlak v plicních cévách.
- máte nízký krevní tlak v klidu.
- jste ztratil(a) velké množství vody (dehydratace), např. při nadměrném pocení nebo nedostatečném příjmu tekutin. K tomu může dojít při horečce, zvracení nebo průjmu.
- trpíte vzácnou dědičnou poruchou oka (retinitis pigmentosa).
- trpíte poruchou červených krvinek (srpkovitou anémií), nádorovým onemocněním krvinek (leukémií), nádorovým onemocněním kostní dřeně (mnohočetným myelomem) nebo jakoukoliv chorobou či deformitou penisu.
- máte v současné době žaludeční vřed, krvácivou poruchu (jako je hemofilie) nebo problémy s krvácením z nosu.
- užíváte léčivé přípravky k léčbě erektilní dysfunkce.
Při léčbě mužské erektilní dysfunkce byly při užití PDE5 inhibitorů, včetně sildenafilu, hlášeny s neznámou četností následující nežádoucí účinky na zrak: částečné, náhlé, dočasné či trvalé zhoršení nebo ztráta zraku jednoho či obou očí. Zaznamenáte-li náhlé zhoršení či ztrátu zraku, přestaňte přípravek Revatio užívat a okamžitě vyhledejte svého lékaře (viz též bod 4).
Po užití sildenafilu byla u mužů hlášena prodloužená a někdy bolestivá erekce. Pokud máte erekci trvající déle než 4 hodiny, přestaňte přípravek Revatio užívat a okamžitě vyhledejte svého lékaře
(viz též bod 4).
Zvláštní opatření pro pacienty s poškozením ledvin či jater
Informujte svého lékaře, pokud máte onemocnění jater či ledvin, může Vám upravit dávkování.
Děti a dospívající
Přípravek Revatio nesmí užívat děti a dospívající mladší než 18 let.
Další léčivé přípravky a přípravek Revatio
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době
užíval(a), nebo které možná budete užívat.
- Léky obsahující nitráty, nebo uvolňující oxid dusnatý, jako je amylnitrit („poppers“). Tyto léky jsou obvykle předepisovány k úlevě od příznaků anginy pectoris nebo bolesti na hrudi (viz bod 2 Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat).
- Informujte svého lékaře nebo lékárníka, pokud již užíváte riocigvát.
- Léky k léčbě plicní hypertenze (např. bosentan, iloprost).
- Přípravky obsahující třezalku tečkovanou (bylinný prostředek), rifampicin (používaný k léčbě bakteriální infekce), karbamazepin, fenytoin a fenobarbital (používané mj. v léčbě epilepsie).
- Léky, které zabraňují srážení krve (např. warfarin), přestože jejich současné užití nemělo za následek žádné nežádoucí účinky.
- Léky obsahující erythromycin, klarithromycin, telithromycin (antibiotika užívaná při léčbě určitých druhů bakteriálních infekcí), sachinavir (k léčbě HIV) nebo nefazodon (k léčbě mentální deprese), protože může být nutné upravit Vaši dávku.
- Alfa-blokátory (např. doxazosin) k léčbě vysokého krevního tlaku nebo potíží s prostatou, protože kombinace těchto 2 léčivých přípravků může způsobit příznaky snížení krevního tlaku (např. závrať, točení hlavy).
Přípravek Revatio s jídlem a pitím
Během léčby přípravkem Revatio nepijte grapefruitovou šťávu.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než Vám bude tento přípravek podán. Není-li to nezbytné, nesmí se přípravek Revatio během těhotenství užívat.
Přípravek Revatio se nesmí podávat ženám, které mohou otěhotnět, pokud nepoužívají spolehlivou kontracepční metodu.
Ukončete kojení, když začnete užívat přípravek Revatio. Kojící ženy by neměly přípravek Revatio užívat, protože není známo, zda přípravek přechází do mateřského mléka.
Řízení dopravních prostředků a obsluha strojů
Přípravek Revatio může způsobit závratě a ovlivnit zrak. Měl(a) byste vědět, jak reagujete na tento přípravek dříve, než budete řídit či obsluhovat stroje.
3. Jak se přípravek Revatio podává
Přípravek Revatio se podává intravenózní injekcí a vždy Vám jej podá Váš lékař nebo sestra. Váš lékař určí délku léčby a množství přípravku Revatio injekční roztok, které budete každý den dostávat a bude sledovat Váš stav a Vaši odpověď na léčbu. Obvyklá dávka je 10 mg (odpovídá 12,5 ml) 3x denně.
Přípravek Revatio injekční roztok Vám bude podán místo přípravku Revatio tablety.
Jestliže Vám bylo podáno větší množství přípravku Revatio, než bylo stanoveno
Máte-li obavu, že Vám bylo podáno příliš mnoho přípravku Revatio, kontaktujte ihned svého lékaře nebo zdravotní sestru. Užívání vyšší dávky přípravku Revatio může zvýšit riziko nežádoucích účinků.
Jestliže byla vynechána dávka přípravku Revatio
Vzhledem k tomu, že tento přípravek dostáváte pod lékařským dohledem, není pravděpodobné, že by byla dávka vynechána. Informujte ale svého lékaře nebo lékárníka, máte-li dojem, že dávka byla vynechána. Nesmí být podána dvojnásobná dávka, aby byla nahrazena vynechaná dávka.
Jestliže přestanete dostávat přípravek Revatio
Náhlé ukončení léčby přípravkem Revatio může vést ke zhoršení příznaků Vaší nemoci. Než úplně přestanete přípravek dostávat, Váš lékař bude postupně snižovat dávky po dobu několika dnů.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
Možné nežádoucí účinky
4.
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Zaznamenáte-li některý z následujících nežádoucích účinků, přestaňte přípravek Revatio užívat a ihned se obraťte na svého lékaře (viz rovněž bod 2):
- zaznamenáte-li náhlé zhoršení nebo ztrátu zraku (četnost není známa).
- máte-li erekci, trvající setrvale déle než 4 hodiny. Po užití sildenafilu byla u mužů hlášena prodloužená a někdy bolestivá erekce (četnost není známa).
Dospělí
Nežádoucí účinky hlášené z klinické studie s přípravkem Revatio podávaným intravenózně byly podobné těm hlášeným v klinických studiích s přípravkem Revatio podávaným ve formě tablet.
V klinických studiích byly nežádoucí účinky hlášené často (mohou postihnout až 1 pacienta z 10): návaly horka v obličeji, bolest hlavy, nízký krevní tlak a nevolnost.
V klinických studiích byly nežádoucí účinky hlášené často (mohou postihnout až 1 pacienta z 10) u pacientů s plicní arteriální hypertenzí: návaly horka v obličeji a nevolnost.
V klinických studiích s přípravkem Revatio tablety byly nežádoucími účinky hlášenými velmi často (mohou postihnout více než 1 pacienta z 10): bolesti hlavy, návaly horka v obličeji, poruchy trávení, průjem a bolesti paží nebo nohou.
Nežádoucí účinky hlášené často (mohou postihnout až 1 z 10 pacientů) zahrnovaly: podkožní infekce, příznaky podobné chřipce, zánět dutin, snížený počet červených krvinek (chudokrevnost), zadržování tekutin, potíže se spánkem, úzkost, migrénu, třes, brnění (mravenčení), pocit pálení, sníženou citlivost, krvácení očního pozadí, ovlivnění zraku, rozmazané vidění a citlivost na světlo, účinek na barevné vidění, podráždění oka, překrvení očí/zarudnutí očí, závrať, zánět průdušek, krvácení z nosu, rýmu, kašel, ucpaný nos, zánět žaludku, zánět žaludeční sliznice a střev, pálení žáhy, hemoroidy, pocit roztažení břišní krajiny, sucho v ústech, vypadávání vlasů, zčervenání kůže, noční pocení, bolesti svalů, bolest zad a zvýšenou tělesnou teplotu.
Nežádoucí účinky hlášené méně často (mohou postihnout až 1 ze 100 pacientů) zahrnovaly: sníženou ostrost zraku, dvojité vidění, nepříjemné pocity v oku, krvácení z penisu, přítomnost krve ve spermatu a/nebo v moči a zvětšení prsů u mužů.
Byly též hlášeny kožní vyrážka, náhlé zhoršení nebo ztráta sluchu a pokles krevního tlaku, s neznámou četností (četnost nelze z dostupných údajů stanovit).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Revatio uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku lahvičky a na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Přípravek Revatio nevyžaduje žádné zvláštní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Revatio obsahuje
- Léčivou látkou je sildenafilum. Jeden mililitr obsahuje 0,8 mg sildenafilu (ve formě citrátu). Jedna 20ml lahvička obsahuje 10 mg sildenafilu (ve formě citrátu).
- Pomocnými látkami jsou glukosa a voda na injekci.
Jak přípravek Revatio vypadá a co obsahuje toto balení
Jedno balení přípravku Revatio injekční roztok obsahuje jednu 20ml průhlednou skleněnou lahvičku, uzavřenou chlorobutylovou pryžovou zátkou a hliníkovým krytem.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Pfizer Limited, Sandwich, Kent CT13 9NJ, Velká Británie.
Výrobce:
Fareva Amboise, Zone Industrielle, 29 route des Industries, 37530 Pocé-sur-Cisse, Francie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgie /Belgique / Belgien
Pfizer S.A./N.V.
Tél/Tel: +32 (0)2 554 62 11
Eunrapnu
n$aň3ep HroKceMÓypr CAPH, KnoH Etnrapnn Ten.: +359 2 970 4333
Česká republika
Pfizer s. r.o.
Tel: +420-283-004-111
Danmark
Pfizer ApS
Tlf: +45 44 20 11 00
Deutschland
Pfizer Pharma PFE GmbH Tel: +49 (0)800 8535555
Eesti
Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500
EkXúha
Pfizer Ekkág A.E.
Tpk: +30 210 678 5800
Latvija
Pfizer Luxembourg SARL filiale Latvija Tel: +371 670 35 775
Luxembourg/Luxemburg
Pfizer S.A.
Tél/Tel: +32 (0)2 554 62 11
Magyarország
Pfizer Kft.
Tel.: + 36 1 488 37 00 Malta
V.J. Salomone Pharma Ltd.
Tel: + 356 21 22 01 74
Nederland
Pfizer bv
Tel: +31 (0)10 406 43 01
Norge
Pfizer AS
Tlf: +47 67 52 61 00 Osterreich
Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0
|
Espaňa Pfizer GEP, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer PFE France Tél: +33 (0)1 58 07 34 40 |
Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 |
Románia Pfizer Románia S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel: + 386/1/52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizačná zložka Tel: +421-2-3355 5500 |
|
Italia Pfizer Italia S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
|
Kúnpoq PFIZER EAAAI A.E. (pobočka Kypr) T^: +357 22 817690 |
Sverige Pfizer AB Tel: + 46 (0)8 550 520 00 |
|
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 6 70 35 775 |
United Kingdom Pfizer Limited Tel: +44 (0)1304 616161 |
Tato příbalová informace byla naposledy revidována:
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/. Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
Příbalová informace: informace pro pacienta
Revatio 10 mg/ml prášek pro přípravu perorální suspenze
sildenafilum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
V příbalové informaci naleznete:
1. Co je přípravek Revatio a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat
3. Jak se přípravek Revatio užívá
4. Možné nežádoucí účinky
5. Jak přípravek Revatio uchovávat
6. Obsah balení a další informace
1. Co je přípravek Revatio a k čemu se používá
Přípravek Revatio obsahuje léčivou látku, která patří do skupiny léků nazývaných inhibitory fosfodiesterázy 5 (PDE5).
Přípravek Revatio snižuje krevní tlak v plicích rozšířením plicních cév.
Přípravek Revatio se používá k léčbě dospělých a dětí a dospívajících ve věku 1-17 let s vysokým krevním tlakem v krevních cévách v plicích (plicní arteriální hypertenze).
2. Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat
Neužívejte přípravek Revatio
- jestliže jste alergický(á) na sildenafil nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže užíváte léky obsahující nitráty nebo látky uvolňující oxid dusnatý, jako je amylnitrit. Tyto léky se často užívají jako úleva od příznaků bolesti na hrudi (anginy pectoris). Přípravek Revatio může nebezpečně zvýšit účinek těchto léků. Informujte svého lékaře, pokud kterýkoliv z těchto léků užíváte. Pokud si nejste jistý(á), poraďte se svým lékařem nebo lékárníkem.
- jestliže užíváte riocigvát. Tento lék se používá k léčbě plicní arteriální hypertenze (tj. vysokého krevního tlaku v plicích) a chronické tromboembolické plicní hypertenze (tj. vysokého krevního tlaku v plicích sekundárních krevních sraženin). U PDE5 inhibitorů, jako je například Revatio, bylo prokázáno, že zvyšují hypotenzní účinek tohoto léku. Pokud užíváte riocigvát nebo si nejste jistý(á), informujte svého lékaře.
- jestliže jste nedávno měl(a) mozkovou mrtvici nebo infarkt, jestliže máte závažné onemocnění jater nebo velmi nízký tlak (<90/50 mmHg).
- jestliže užíváte přípravky k léčbě mykotických infekcí, obsahující ketokonazol nebo itrakonazol nebo léky obsahující ritonavir (léčba HIV).
- jestliže jste přišel(přišla) o zrak v důsledku poruchy cévního zásobení očního nervu, která se nazývá nearteritická přední ischemická neuropatie optického nervu (NAION).
Upozornění a opatření
Před užitím přípravku Revatio se poraďte se svým lékařem, pokud
- je Vaše choroba způsobena uzavřenou nebo zúženou žílou v plicích spíše než uzavřenou nebo zúženou tepnou.
- máte závažné srdeční potíže.
- trpíte poruchou funkce srdečních komor.
- máte vysoký krevní tlak v plicních cévách.
- máte nízký krevní tlak v klidu.
- jste ztratil(a) velké množství vody (dehydratace), např. při nadměrném pocení nebo nedostatečném příjmu tekutin. K tomu může dojít při horečce, zvracení nebo průjmu.
- trpíte vzácnou dědičnou poruchou oka (retinitis pigmentosa).
- trpíte poruchou červených krvinek (srpkovitou anémií), nádorovým onemocněním krvinek (leukémií), nádorovým onemocněním kostní dřeně (mnohočetným myelomem) nebo jakoukoliv chorobou či deformitou penisu.
- máte v současné době žaludeční vřed, krvácivou poruchu (jako je hemofilie) nebo problémy s krvácením z nosu.
- užíváte léčivé přípravky k léčbě erektilní dysfunkce.
Při léčbě mužské erektilní dysfunkce byly při užití PDE5 inhibitorů, včetně sildenafilu, hlášeny s neznámou četností následující nežádoucí účinky na zrak: částečné, náhlé, dočasné či trvalé zhoršení nebo ztráta zraku jednoho či obou očí. Zaznamenáte-li náhlé zhoršení či ztrátu zraku, přestaňte přípravek Revatio užívat a okamžitě vyhledejte svého lékaře (viz též bod 4).
Po užití sildenafilu byla u mužů hlášena prodloužená a někdy bolestivá erekce. Pokud máte erekci trvající déle než 4 hodiny, přestaňte přípravek Revatio užívat a okamžitě vyhledejte svého lékaře
(viz též bod 4).
Zvláštní opatření pro pacienty s poškozením ledvin či jater
Informujte svého lékaře, pokud máte onemocnění jater či ledvin, může Vám upravit dávkování.
Děti
Přípravek Revatio nesmí užívat děti mladší než 1 rok.
Další léčivé přípravky a přípravek Revatio
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a), nebo které možná budete užívat.
- Léky obsahující nitráty, nebo uvolňující oxid dusnatý, jako je amylnitrit („poppers“). Tyto léky jsou obvykle předepisovány k úlevě od příznaků anginy pectoris nebo bolesti na hrudi (viz bod 2 Čemu musíte věnovat pozornost, než začnete přípravek Revatio užívat).
- Informujte svého lékaře nebo lékárníka, pokud již užíváte riocigvát.
- Léky k léčbě plicní hypertenze (např. bosentan, iloprost).
- Přípravky obsahující třezalku tečkovanou (bylinný prostředek), rifampicin (používaný k léčbě bakteriální infekce), karbamazepin, fenytoin a fenobarbital (používané mj. k léčbě epilepsie).
- Léky, které zabraňují srážení krve (např. warfarin), přestože jejich současné užití nemělo za následek žádné nežádoucí účinky.
- Léky obsahující erythromycin, klarithromycin, telithromycin (antibiotika užívaná při léčbě určitých druhů bakteriálních infekcí), sachinavir (k léčbě HIV) nebo nefazodon (k léčbě mentální deprese), protože může být nutné upravit Vaši dávku.
- Alfa-blokátory (např. doxazosin) k léčbě vysokého krevního tlaku nebo potíží s prostatou, protože kombinace těchto 2 léčivých přípravků může způsobit příznaky snížení krevního tlaku (např. závrať, točení hlavy).
Přípravek Revatio s jídlem a pitím
Během léčby přípravkem Revatio nepijte grapefruitovou šťávu.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Není-li to nezbytné, nesmí se přípravek Revatio během těhotenství užívat.
Přípravek Revatio se nesmí podávat ženám, které mohou otěhotnět, pokud nepoužívají spolehlivou kontracepční metodu.
Ukončete kojení, když začnete užívat přípravek Revatio. Kojící ženy by neměly přípravek Revatio užívat, protože není známo, zda přípravek přechází do mateřského mléka.
Řízení dopravních prostředků a obsluha strojů
Přípravek Revatio může způsobit závratě a ovlivnit zrak. Měl(a) byste vědět, jak reagujete na tento přípravek dříve, než budete řídit či obsluhovat stroje.
Přípravek Revatio obsahuje sorbitol
Sdělil-li Vám lékař někdy, že trpíte nesnášenlivostí některých cukrů, kontaktujte svého lékaře před užitím tohoto přípravku.
3. Jak se přípravek Revatio užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
U dospělých je doporučená dávka přípravku 20 mg 3x denně (v odstupu 6 až 8 hodin), užívá se s jídlem i bez jídla.
Užití u dětí a dospívajících
U dětí a dospívajících ve věku 1-17 let je doporučená dávka buď 10 mg (1 ml perorální suspenze) 3x denně při hmotnosti dítěte nižší než 20 kg nebo 20 mg (2 ml perorální suspenze) 3x denně při hmotnosti dítěte vyšší než 20 kg, užívá se s jídlem i bez jídla. Vyšší dávky se u dětí nesmí podávat.
Perorální suspenzi je nutné před použitím důkladně protřepávat po dobu alespoň 10 sekund.
Instrukce k naředění perorální suspenze
Doporučuje se, aby Vám ještě před vydáním lékárník suspenzi přípravku Revatio připravil.
Po naředění je perorální suspenze tekutá. Není-li prášek rozpuštěn, nařeďte perorální suspenzi podle níže uvedených doporučení.
Poznámka: K naředění obsahu lahvičky je nutné použít celý objem 90 ml (3x30 ml) bez ohledu na dávku, kterou máte užívat.
1. Poklepejte na lahvičku, aby se prášek uvolnil.
2. Sejměte uzávěr.
3. Za použití přiložené odměrky a podle značky odměřte 30 ml vody a přelijte do lahvičky. Za použití přiložené odměrky odměřte dalších 30 ml vody a přilijte do lahvičky (obrázek 1).

4. Vraťte uzávěr a lahvičku důkladně protřepávejte po dobu alespoň 30 sekund (obrázek 2).

obrázek 2
5. Sejměte uzávěr.
6. Za použití přiložené odměrky odměřte dalších 30 ml vody a přilijte do lahvičky. Vždy přidejte celý objem 90 ml (3x30 ml) vody bez ohledu na dávku, která má být podána (obrázek 3).

obrázek 3
7. Vraťte uzávěr a lahvičku důkladně protřepávejte po dobu alespoň 30 sekund (obrázek 4).

obrázek 4
8. Sejměte uzávěr.
9. Do hrdla lahvičky nasaďte adaptér (viz obrázek 5 níže). Adaptér slouží ke snazšímu natažení dávky perorální dávkovací stříkačkou z lahvičky. Vraťte uzávěr na lahvičku.

obrázek 5
10. Na štítek lahvičky napište datum použitelnosti naředěné perorální suspenze (datum použitelnosti naředěné perorální suspenze je 30 dnů od data naředění). Po tomto datu je nutné nevyužitou perorální suspenzi zlikvidovat, nebo vrátit do lékárny.
Instrukce pro použití
Váš lékárník Vám poradí, jak se za pomoci přiložené perorální dávkovací stříkačky naměří Vaše dávka. Po naředění lze perorální suspenzi podávat pouze přiloženou perorální dávkovací stříkačkou. Před užitím perorální suspenze si, prosím, přečtěte níže uvedené instrukce.
Před použitím uzavřenou lahvičku s naředěnou perorální suspenzí důkladně protřepávejte po dobu alespoň 10 sekund. Sejměte uzávěr (obrázek 6).

2. Postavte lahvičku na rovný povrch a vložte konec perorální dávkovací stříkačky do adaptéru
(obrázek 7).

3. Otočte lahvičku dnem vzhůru, s perorální dávkovači stříkačkou stále nasazenou. Pomalu
vytáhněte píst perorální dávkovači stříkačky ke značce Vaší dávky (natažení 1 ml odpovídá dávce 10 mg, natažení 2 ml odpovídá dávce 20 mg). K přesnému odměření dávky je třeba, aby konec pístu byl zároveň s příslušnou značkou na perorální dávkovací stříkačce (obrázek 8).

obrázek 8
4. Jsou-li ve stříkačce velké bubliny, zatlačte pomalu píst zpět do stříkačky. Tím dojde k vrácení léku zpět do lahvičky. Zopakujte krok 3.
5. Otočte lahvičku do původní polohy, s perorální dávkovací stříkačkou stále nasazenou. Vyjměte perorální dávkovací stříkačku z lahvičky.
6. Vložte konec perorální dávkovací stříkačky do úst. Směřujte konec perorální dávkovací stříkačky k jedné z tváří. POMALU stlačujte píst perorální dávkovací stříkačky. Nevytlačujte přípravek příliš rychle. Pokud je přípravek podáván dítěti, ujistěte se před podáním přípravku, že sedí, nebo je přidrženo ve zpřímené poloze (obrázek 9).

7. Na lahvičku vraťte uzávěr, adaptér nechte v lahvičce. Vypláchněte perorální dávkovací stříkačku podle doporučení uvedeného níže.
Čištění a skladování stříkačky:
1. Stříkačku je nutné propláchnout po každém použití. Vytáhněte ze stříkačky píst a obě části propláchněte ve vodě.
2. Obě části osušte. Nasaďte píst zpět do stříkačky. Uchovávejte ji na bezpečném čistém místě spolu s lékem.
Jestliže jste užil(a) více přípravku Revatio, než jste měl(a)
Neměl(a) byste užívat více přípravku, než Vám lékař doporučil. Jestliže užijete více přípravku, než bylo doporučeno, kontaktujte ihned svého lékaře. Užívání vyšší dávky přípravku Revatio může zvýšit riziko nežádoucích účinků.
Jestliže jste zapomněl(a) užít přípravek Revatio
Jestliže si zapomenete vzít přípravek Revatio, užijte vynechanou dávku ihned, jak si vzpomenete, dále pokračujte v užívání přípravku v obvyklém čase. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) užívat přípravek Revatio
Náhlé ukončení léčby přípravkem Revatio může vést ke zhoršení příznaků Vaší nemoci. Nepřestávejte užívat přípravek Revatio, pokud Vám to nedoporučí Váš lékař. Než úplně přestanete přípravek užívat, Váš lékař Vám doporučí postupné snižování dávky po dobu několika dnů.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Zaznamenáte-li některý z následujících nežádoucích účinků, přestaňte přípravek Revatio užívat a ihned se obraťte na svého lékaře (viz rovněž bod 2):
- zaznamenáte-li náhlé zhoršení nebo ztrátu zraku (četnost není známa).
- máte-li erekci, trvající setrvale déle než 4 hodiny. Po užití sildenafilu byla u mužů hlášena prodloužená a někdy bolestivá erekce (četnost není známa).
Dospělí
Nežádoucí účinky hlášené velmi často (mohou postihnout více než 1 pacienta z 10): bolesti hlavy, návaly horka v obličeji, poruchy trávení, průjem a bolesti paží nebo nohou.
Nežádoucí účinky hlášené často (mohou postihnout až 1 z10 pacientů) zahrnovaly: podkožní infekce, příznaky podobné chřipce, zánět dutin, snížený počet červených krvinek (chudokrevnost), zadržování tekutin, potíže se spánkem, úzkost, migrénu, třes, brnění (mravenčení), pocit pálení, sníženou citlivost, krvácení očního pozadí, ovlivnění zraku, rozmazané vidění a citlivost na světlo, účinek na barevné vidění, podráždění oka, překrvení očí/zarudnutí očí, závrať, zánět průdušek, krvácení z nosu, rýmu, kašel, ucpaný nos, zánět žaludku, zánět žaludeční sliznice a střev, pálení žáhy, hemoroidy, pocit roztažení břišní krajiny, sucho v ústech, vypadávání vlasů, zčervenání kůže, noční pocení, bolesti svalů, bolest zad a zvýšenou tělesnou teplotu.
Nežádoucí účinky hlášené méně často (mohou postihnout až 1 ze 100 pacientů) zahrnovaly: sníženou ostrost zraku, dvojité vidění, nepříjemné pocity v oku, krvácení z penisu, přítomnost krve ve spermatu a/nebo v moči a zvětšení prsů u mužů.
Byly též hlášeny kožní vyrážka, náhlé zhoršení nebo ztráta sluchu a pokles krevního tlaku, s neznámou četností (četnost nelze z dostupných údajů stanovit).
Děti a dospívající
Následující vážné nežádoucí účinky byly hlášeny často (mohou se vyskytnout až u 1 pacienta z 10): zápal plic, srdeční selhání, pravostranné srdeční selhání, srdeční šok, vysoký krevní tlak v plicích, bolest na hrudi, mdloby, infekce dýchacích cest, zánět průdušek, virová infekce žaludku a střev, infekce močového ústrojí a zubní kazy.
Následující vážné nežádoucí účinky související s léčbou byly hlášeny méně často (mohou se vyskytnout až u 1 pacienta ze 100): alergické reakce (jako je kožní vyrážka, otok obličeje, rtů a jazyka, sípot, potíže s dýcháním nebo polykáním), křeče, nepravidelný srdeční tep, porucha sluchu, zánět trávicího traktu a dýchavičnost.
Nežádoucí účinky hlášené velmi často (mohou se vyskytnout u více než 1 pacienta z 10) byly: bolest hlavy, zvracení, krční infekce, horečka, průjem, chřipka a krvácení z nosu.
Nežádoucí účinky hlášené často (mohou se vyskytnout až u 1 pacienta z 10) byly: nevolnost, zvýšená erekce, zápal plic a rýma.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Revatio uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce za „Použitelné do:“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Prášek
Uchovávejte při teplotě do 30 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Naředěná perorální suspenze
Uchovávejte při teplotě do 30 °C nebo v chladničce při teplotě 2-8 °C. Chraňte před mrazem. Po 30 dnech od naředění nevyužitou perorální suspenzi zlikvidujte.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Revatio obsahuje
- Léčivou látkou je sildenafilum (ve formě citrátu). Po naředění obsahuje jeden mililitr perorální suspenze 10 mg sildenafilu (ve formě citrátu). Jedna lahvička naředěné perorální suspenze (112 ml) obsahuje 1,12 gramu sildenafilu (ve formě citrátu).
- Pomocnými látkami jsou:
Prášek pro přípravu perorální suspenze: sorbitol, bezvodá kyselina citronová, sukralosa, natrium-citrát, xanthanová klovatina, oxid titaničitý (E171), natrium-benzoát (E211), koloidní bezvodý oxid křemičitý.
Aroma hroznového vína: maltodextrin, koncentrát šťávy z hroznového vína, arabská klovatina, koncentrát ananasové šťávy, bezvodá kyselina citronová, přírodní aroma.
Jak přípravek Revatio vypadá a co obsahuje toto balení
Přípravek Revatio je ve formě bílého až téměř bílého prášku pro přípravu perorální suspenze, ze kterého se po naředění vodou vytvoří bílá perorální suspenze s příchutí hroznového vína.
Jedna 125ml skleněná lahvička (s plastovým uzávěrem) obsahuje 32,27 gramu prášku pro přípravu perorální suspenze.
Po naředění obsahuje lahvička 112 ml perorální suspenze, z čehož je 90 ml určeno k podání.
Velikost balení: 1 lahvička
Jedno balení rovněž obsahuje plastovou odměrku (k odměření 30 ml), plastovou perorální dávkovací stříkačku (3 ml), píst a adaptér na lahvičku.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Pfizer Limited, Sandwich, Kent CT13 9NJ, Velká Británie.
Výrobce
Fareva Amboise, Zone Industrielle, 29 route des Industries, 37530 Pocé-sur-Cisse, Francie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgie /Belgique / Belgien
Pfizer S.A./N.V.
Tél/Tel: +32 (0)2 554 62 11
Bt^rapuu
n$aň3ep HroKceMÓypr CAPH, KnoH Etarapna Ten.: +359 2 970 4333
Česká republika
Pfizer s. r.o.
Tel: +420-283-004-111
Danmark
Pfizer ApS
Tlf: +45 44 20 11 00
Deutschland
Pfizer Pharma PFE GmbH Tel: +49 (0)800 8535555
Lietuva
Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000
Luxembourg/Luxemburg
Pfizer S.A.
Tél/Tel: +32 (0)2 554 62 11
Magyarország
Pfizer Kft.
Tel.: + 36 1 488 37 00 Malta
V.J. Salomone Pharma Ltd.
Tel: + 356 21 22 01 74
Nederland
Pfizer bv
Tel: +31 (0)10 406 43 01
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Norge Pfizer AS Tlf: +47 67 52 61 00 |
|
EXXáSa Pfizer EAAág A.E. Tn^: +30 210 678 5800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
Espaňa Pfizer GEP, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer PFE France Tél: +33 (0)1 58 07 34 40 |
Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 |
Románia Pfizer Románia S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel: + 386/1/52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizačná zložka Tel: +421-2-3355 5500 |
|
Italia Pfizer Italia S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
|
Kúnpoq PFIZER EAAAI A.E. (CYPRUS BRANCH) Tn^: +357 22 817690 |
Sverige Pfizer AB Tel: + 46 (0)8 550 520 00 |
|
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 6 70 35 775 |
United Kingdom Pfizer Limited Tel: +44 (0)1304 616161 |
Tato příbalová informace byla naposledy revidována:
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/. Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
98