Rapifen
sp.zn. sukls174131/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU RAPIFEN
0,5 mg/ml, injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Alfentanili hydrochloridum 0,544 mg v 1 ml, odpovídá alfentanilum 0,50 mg v 1 ml Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok
Popis přípravku: čirý bezbarvý roztok bez viditelných částic. Sterilní, izotonický vodný roztok bez konzervačních přísad, určený k intravenóznímu podání.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
RAPIFEN je u dospělých indikován:
• k úvodu do anestezie;
• jako opioidní analgetikum k celkové nebo regionální anestezii při krátkodobých (injekce bolusu) i dlouhodobých chirurgických výkonech (bolus následovaný opakovanými injekcemi nebo infuzí).
Vzhledem k rychlému a krátkodobému účinku je RAPIFEN vhodný zejména jako opioidní analgetikum pro krátkodobé výkony a ambulantní chirurgii. Je však vhodný rovněž jako analgetický doplněk pro středně dlouhé a dlouhotrvající výkony, neboť periody velmi bolestivých stimulů lze obvykle překonávat opakovanými nízkými dávkami přípravku RAPIFEN, případně přizpůsobením rychlosti infuze.
RAPIFEN je u novorozenců, kojenců a dětí a dospívajících indikován jako:
• opioidní analgetikum v kombinaci s hypnotikem k úvodu do anestezie;
• opioidní analgetikum k celkové anestezii, při krátkodobých i dlouhodobých chirurgických výkonech.
4.2 Dávkování a způsob podání
RAPIFEN se podává jako injekce bolusu (krátkodobé výkony) nebo jako bolus následovaný opakovanými injekcemi nebo infuzí (dlouhodobé bolestivé chirurgické výkony).
Dávkování přípravku RAPIFEN má být stanoveno individuálně s přihlédnutím k věku, tělesné hmotnosti, fyzické kondici, základnímu onemocnění, užívání dalších léčivých přípravků, druhu chirurgického výkonu a anestezie.
Bradykardii lze předejít intravenózní (i.v.) aplikací nízké dávky anticholinergika těsně před úvodem do anestezie.
Dospělí
1. Použití k úvodu do anestezie
1. v. bolus > 120 Mg/kg (17 ml/70 kg) přípravku RAPIFEN navozuje bezvědomí a analgetický účinek při zachování dobré kardiovaskulární stability u pacientů s adekvátní myorelaxací.
2. Krátkodobé výkony a použití u ambulantních pacientů
V nízkých dávkách je RAPIFEN vhodný pro malé krátkodobé chirurgické výkony a pro ambulantní pacienty za předpokladu dostupnosti kardiopulmonálního monitorovacího zařízení.
I.v. bolus 7 - 15 Mg/kg (1 - 2 ml/70 kg) je obvykle dostatečný pro výkony kratší než 10 minut. Jestliže trvá výkon déle než 10 minut, aplikuje se dále 7 - 15 Mg/kg (1 - 2 ml/70 kg) v intervalu každých 10 -15 minut nebo dle potřeby.
Ačkoli musí být k dispozici zařízení pro podporu ventilace, při pomalé aplikaci dávky 7 Mg/kg (1 ml/70 kg) nebo nižší je ve většině případů zachováno spontánní dýchání; při této technice lze opakovaně aplikovat 3,5 Mg/kg (0,5 ml/70 kg).
Případná pooperační nauzea je poměrně krátkodobá a obvykle korigovatelná konvenčními prostředky.
3. Středně dlouhé výkony
Počáteční dávka i.v. bolusu má být uzpůsobena předpokládané délce trvání chirurgického výkonu:
Tabulka 1: Dávkování u středně dlouhých výkonů
|
Trvání výkonu |
RAPIFEN dávka i.v. bolusu | |
|
(min) |
Mg^g |
ml/70 kg |
|
10 - 30 |
20 - 40 |
3 - 6 |
|
30 - 60 |
40 - 80 |
6 - 12 |
|
> 60 |
80 - 150 |
12 - 20 |
Trvá-li operace déle nebo je-li agresivnější, lze analgezii udržovat:
- buď další aplikací přípravku RAPIFEN v dávce 15 Mg/kg (2 ml/70 kg) podle potřeby, kromě posledních 10 minut výkonu, kdy nemá být RAPIFEN podáván vzhledem k možnosti pooperační respirační deprese;
- nebo infuzí přípravku RAPIFEN rychlostí 1 Mg/kg/min (0,14 ml/70 kg/min) ukončenou 5 - 10 minut před dokončením výkonu.
Periody bolestivých stimulů lze snadno zvládnout opakovanou aplikací nízkých dávek alfentanilu nebo přechodně zvýšenou rychlostí infuze.
Pokud je RAPIFEN použit bez směsi N2O/O2 nebo jiného inhalačního anestetika, musejí být udržovací dávky přípravku RAPIFEN vyšší.
4. Dlouhotrvající výkony
RAPIFEN může být používán jako analgetická komponenta u dlouhotrvajících chirurgických výkonů, zejména při indikaci rychlé extubace. Optimální analgezie a stabilního vegetativního stavu lze docílit individuálně přizpůsobenou úvodní dávkou a přizpůsobením rychlosti infuze závažnosti operačních stimulů a reakcím pacienta.
Pediatrická populace
Pro děti všech věkových kategorií, a to i pro krátkodobé výkony u spontánně dýchajících dětí, musí být k dispozici zařízení pro asistovanou ventilaci.
Data týkající se dětí, zejména ve věku od 1 měsíce do 1 roku, jsou omezená (viz bod 5.2).
Novorozenci (0 až 27 dní): Farmakokinetika je u novorozenců velmi variabilní, zejména u předčasně narozených. Clearance a vazba na bílkoviny jsou nižší a může být nutné snížit dávku alfentanilu. Novorozenci mají být pečlivě sledováni a dávka alfentanilu má být titrována podle odpovědi.
Kojenci a batolata (28 dní až 23 měsíců): U kojenců a batolat může být ve srovnání s dospělými vyšší clearance. Pro udržení analgezie může být třeba zvýšit rychlost infuze alfentanilu.
Děti (2 až 11 let): Clearance může být u dětí mírně vyšší a může být třeba zvýšit rychlost infuze.
Dospívající : Farmakokinetika alfentanilu u dospívajících je podobná farmakokinetice u dospělých, proto nejsou nutná žádná specifická doporučení ohledně dávkování.
Doporučené dávkování u pediatrických pacientů
Velká variabilita odpovědí na alfentanil ztěžuje doporučení pro dávkování u mladších dětí. U starších dětí je za odpovídající dávku k úvodu do anestezie (tj. jako doplněk propofolu nebo inhalační anestezie) nebo jako analgetikum považován bolus 10 až 20 pg/kg alfentanilu. Mohou být podány dodatečné bolusy 5 až 10 pg/kg alfentanilu v odpovídajících intervalech.
K udržení analgezie během chirurgického výkonu může být u dětí podán RAPIFEN infuzí o rychlosti 0,5 až 2 pg/kg/min. Dávka musí být titrována (snižována nebo zvyšována) podle individuálních potřeb pacienta. Při kombinaci s intravenózním anestetikem je doporučená dávka přibližně 1 pg/kg/min.
U novorozenců a velmi malých dětí může být po podání alfentanilu vyšší riziko respiračních komplikací a svalové rigidity. Nutná opatření jsou uvedena v bodě 4.4.
Starší a oslabení pacienti
Počáteční dávka má být snížena u starších (ve věku od 65 let) a oslabených pacientů. Účinek počáteční dávky je třeba vzít v úvahu při stanovení dodatečných dávek.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na jiné opioidy.
4.4 Zvláštní upozornění a opatření pro použití
Přípravek podléhá zákonu o návykových látkách. Na přípravek vzniká léková závislost.
Upozornění platná pro všechny silné opioidy:
Respirační deprese
Respirační deprese závisí na dávce a lze jí zamezit podáním specifického antagonisty opioidních receptorů. Vzhledem k tomu, že respirační deprese může přetrvávat déle než účinek antagonisty, může být nutné opakované podání antagonisty. Hluboká analgezie je doprovázena výraznou respirační depresí a ztrátou vědomí, která může přetrvávat nebo recidivovat v pooperačním období. Pacienti mají být proto pod náležitým dohledem. Musejí být k dispozici resuscitační zařízení a antagonisté opioidních receptorů. Hyperventilace v průběhu anestezie může narušit pacientovu odpověď na CO2 a ovlivnit pooperační respiraci.
Svalová ztuhlost
Může se vyskytnout svalová ztuhlost postihující i hrudní svalstvo; ztuhlosti však lze zabránit těmito opatřeními: pomalou i.v. injekcí (obvykle postačující při nízkém dávkování), premedikací benzodiazepiny a použitím myorelaxancií. Může docházet k neepileptickým (myo)klonickým záškubům.
Srdeční onemocnění
Jestliže nebyla pacientovi podána dostatečná dávka anticholinergik nebo při kombinaci přípravku RAPIFEN s nevagolytickými myorelaxancii, může se vyskytnout bradykardie, případně srdeční zástava. Bradykardii lze léčit atropinem.
Zvláštní podmínky dávkování
Stejně jako jiné opioidy, může i RAPIFEN navodit hypotenzi, zvláště u hypovolemických pacientů. Je zapotřebí zajistit příslušná opatření zaměřená na udržení stabilního arteriálního tlaku.
U pacientů s limitovanou intracerebrální compliance je nutné se vyvarovat podání rychlého bolusu opioidů; u těchto pacientů může být přechodný pokles středního arteriálního tlaku někdy provázen krátkodobým snížením mozkového perfuzního tlaku.
Léčba pacientů dlouhodobě léčených opioidy nebo pacientů s abúzem opioidů v anamnéze může vyžadovat zvýšení dávkování.
U starších a oslabených pacientů se doporučuje snížit dávkování. Stejně jako jiné opioidy, i RAPIFEN je zapotřebí titrovat opatrně u pacientů s nekorigovaným hypothyreoidismem, plicním onemocněním, se sníženou respirační rezervou, s alkoholismem, narušenými jaterními nebo ledvinovými funkcemi. Léčba těchto pacientů vyžaduje rovněž prodloužené pooperační monitorování.
Pediatrická populace
Při podání alfentanilu novorozencům nebo velmi malým dětem může, ve srovnání se staršími dětmi a dospělými, existovat vyšší riziko respiračních komplikací. Z tohoto důvodu je třeba malé děti monitorovat okamžitě po podání alfentanilu. Při použití u dětí všech věkových skupin, včetně krátkodobých zákroků u spontánně dýchajících dětí, musí být dostupné zařízení pro asistovanou ventilaci.
Pokud je alfentanil použit u novorozenců a malých kojenců, je vzhledem k riziku svalové rigidity nutno zvážit současné podání myorelaxancia. Všechny děti mají být po ukončení podávání alfentanilu dostatečně dlouhou dobu monitorovány, aby se zajistil návrat spontánního dýchání.
Vzhledem k variabilní farmakokinetice u novorozenců může být třeba nižší dávka alfentanilu. Novorozenci mají být pečlivě sledováni a dávka alfentanilu má být titrována podle odpovědi na dávku (viz bod 4.2).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Přípravky ovlivňující účinek alfentanilu
Barbituráty, benzodiazepiny, neuroleptika, halogenované plyny a další neselektivní depresory CNS (např. alkohol) mohou potencovat respirační depresi vyvolanou opioidy.
Pokud pacient užívá některé léky z uvedených skupin, postačuje nižší než obvyklá dávka přípravku RAPIFEN. Po předchozím podání přípravku RAPIFEN je zároveň v případě potřeby nutné snížit dávku přípravků s depresivním účinkem na CNS.
Alfentanil je metabolizován převážně enzymy lidského cytochromu P450 3A4. In vitro údaje naznačují, že účinné inhibitory cytochromu P450 3A4 (např. ketokonazol, itrakonazol, ritonavir) mohou inhibovat metabolismus alfentanilu. Výsledky farmakokinetických studií potvrzují, že metabolismus alfentanilu je inhibován flukonazolem, vorikonazolem, erythromycinem, diltiazemem a cimetidinem (známými inhibitory enzymů cytochromu P450 3A4). Tím by mohlo být zvýšeno riziko prodloužené nebo zpožděné respirační deprese. Současné podávání těchto léčiv vyžaduje zvláštní péči a sledování pacienta, zejména však může vyvolat nutnost snížení dávky přípravku RAPIFEN.
Pro inhibitory MAO obvykle platí doporučení ukončit aplikaci 2 týdny před plánovaným chirurgickým nebo jiným výkonem vyžadujícím podání anestetik.
Účinek alfentanilu na metabolismus jiných léčivých přípravků
Koncentrace propofolu podaného v kombinaci s přípravkem RAPIFEN jsou o 17 % vyšší než bez přítomnosti přípravku RAPIFEN. Současné podávání alfentanilu a propofolu může vyžadovat nižší dávku přípravku RAPIFEN.
4.6 Fertilita, těhotenství a kojení Těhotenství
Přestože předklinické zkoušení neprokázalo teratogenní nebo akutní embryotoxický účinek, pro vyhodnocení škodlivých účinků u člověka nejsou k dispozici postačující údaje (viz bod 5.3 Předklinické údaje vztahující se k bezpečnosti). Před podáním tohoto přípravku těhotným je proto nutné posoudit léčebný přínos oproti možnému riziku.
Intravenózní podání během porodu (včetně císařského řezu) se nedoporučuje, protože RAPIFEN prochází placentou a může potlačit spontánní dýchání v novorozeneckém období. Jestliže je v takovém případě RAPIFEN podán, musí být neprodleně k dispozici vybavení pro asistovanou ventilaci pro matku a kojence.
Pro dítě musí být vždy dostupný také antagonista opioidů. Poločas antagonisty opioidů může být kratší než poločas alfentanilu, proto může být nezbytné opakované podání antagonisty opioidů.
Kojení
RAPIFEN může přestupovat do mateřského mléka. Kojení nebo používání odstříkaného mateřského mléka proto nelze doporučit do 24 hodin po aplikaci přípravku RAPIFEN.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Řízení vozu a obsluha strojů se nedoporučuje minimálně 24 hodin po podání přípravku RAPIFEN.
4.8 Nežádoucí účinky
Údaje z klinických hodnocení
Bezpečnost přípravku RAPIFEN byla hodnocena u 1 157 pacientů, kteří se účastnili 18 klinických hodnocení. RAPIFEN byl podáván jako agens indukující anestezii nebo jako analgetická/anestetická podpora při místní nebo celkové anestezii u krátce, středně nebo dlouho trvajících chirurgických zákroků. Těmto subjektům byla podána nejméně jedna dávka přípravku RAPIFEN a byly u nich vyhodnoceny údaje o bezpečnosti. Nežádoucí účinky hlášené u > 1% pacientů, kteří se účastnili těchto hodnocení a byl jim podán RAPIFEN, j sou uvedeny v tabulce 2.
|
Třídy orgánových systémů Nežádoucí účinek |
RAPIFEN (n = 1 157) % |
|
Psychiatrické poruchy | |
|
Vzrušení |
1,8 |
|
Poruchy nervového systému | |
|
Porucha hybnosti |
7,9 |
|
Závrať |
2,4 |
|
Sedace |
1,5 |
|
Dyskineze |
1,4 |
|
Poruchy oka | |
|
Porucha vidění |
1,1 |
|
Srdeční poruchy | |
|
Bradykardie |
5,4 |
|
1,0 | |
|
Cévní poruchy | |
|
4,1 | |
|
Hypertenze |
2,2 |
|
Snížení tlaku krve |
1,3 |
|
Zvýšení tlaku krve |
1,0 |
|
Respirační, hrudní a mediastinální poruchy | |
|
Apnoe |
8,6 |
|
Gastrointestinální poruchy | |
|
17,0 | |
|
14,0 | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Svalová ztuhlost |
3,1 |
|
Celkové poruchy a reakce v místě aplikace | |
|
Únava |
2,0 |
|
1,8 | |
|
Bolest v místě injekce |
1,6 |
|
Poranění, otravy a procedurální komplikace | |
|
Procedurální bolest |
1.1 |
Další nežádoucí účinky, které se vyskytly u < 1 % pacientů léčených přípravkem RAPIFEN v těchto 18 klinických hodnoceních, j sou uvedeny v tabulce 3.
Třídy orgánových systémů
nežádoucí účinek_
Psychiatrické poruchy
Agitace
Pláč
Poruchy nervového systému
Bolest hlavy Somnolence Neragování na podněty Srdeční poruchy Arytmie
Snížení srdečního tepu Cévní poruchy Bolest žil
Respirační, hrudní a mediastinální poruchy
Bronchospasmus
Škytání
Hyperkapnie
Laryngospasmus
Epistaxe
Respirační deprese Poruchy kůže a podkožní tkáně
Alergická dermatitida
Hyperhidróza
Pruritus
Celkové poruchy a reakce v místě aplikace
Bolest
Poranění, otravy a procedurální komplikace
Pooperační zmatenost Pooperační agitace
Komplikace v dýchacích cestách při anestezii Neurologické anestetické komplikace Procedurální komplikace
Komplikace při endotracheální intubaci_
Postmarketingové sledování
Nežádoucí účinky identifikované během post-marketingového používání přípravku RAPIFEN jsou uvedeny v tabulce 4. Nežádoucí účinky jsou uvedeny podle četnosti na základě spontánních hlášení.
Frekvence četností jsou uvedeny podle následující konvence:
Velmi časté Časté
Méně časté Vzácné Velmi vzácné
> 1/10
> 1/100 až < 1/10
> 1/1 000 až < 1/100 >1 /10 000 až < 1/1 000
< 1/10 000, není známo (z dostupných údajů nelze určit)
Tabulka 4 Nežádoucí účinky zjištěné během podávání přípravku RAPIFEN
_v postmarketingu s frekvencemi získanými ze spontánních hlášení_
Poruchy imunitního systému
Velmi vzácné Hypersenzitivita (včetně anafylaktické reakce, anafylaktoidní reakce a kopřivky)
Psychiatrické poruchy
Velmi vzácné Dezorientace Poruchy nervového systému
Velmi vzácné Ztráta vědomía, konvulze, myoklonus
Poruchy oka
Velmi vzácné Mióza
Srdeční poruchy
Velmi vzácné Srdeční zástava
Respirační, hrudní a mediastinální poruchy
Velmi vzácné Zástava dechu, respirační depreseb, kašel
Poruchy kůže a podkožní tkáně
Velmi vzácné Erytém, vyrážka
Celkové poruchy a reakce v místě aplikace
Velmi vzácné Pyrexie
a Pooperační období.
b Včetně fatálních případů.
Pediatrická populace
Očekává se, že četnost, typ a závažnost nežádoucích účinků u dětí jsou stejné jako u dospělých, s následujícími výjimkami:
U novorozenců byla častěji pozorována mírná až středně těžká svalová rigidita, i když počet novorozenců v klinických studiích byl malý. Méně často se může objevit těžká svalová rigidita a záškuby a tyto mohou být doprovázené přechodným zhoršeným dýcháním, zejména při vysokých dávkách přípravku RAPIFEN nebo vysoké rychlosti intravenózní injekce.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky
Projevy předávkování přípravkem RAPIFEN jsou zvýrazněním jeho farmakologického účinku. Může nastat respirační deprese, s různým stupněm závažnosti od bradypnoe až k apnoe.
Léčba
Při hypoventilaci nebo apnoe je zapotřebí podávat kyslík a dle potřeby zavádět asistované nebo řízené dýchání. Ke zvládnutí respirační deprese by měl být podán specifický antagonista opioidních receptorů. To nevylučuje nutnost využití dalších okamžitých protiopatření. Respirační deprese může svým trváním přesahovat trvání účinku antagonisty, což může vést k potřebě jeho opakované aplikace.
Jestliže je respirační deprese provázena svalovou ztuhlostí, může být pro usnadnění asistovaného nebo řízeného dýchání zapotřebí podávat intravenózně neuromuskulární blokátory.
Pacienta je zapotřebí pečlivě sledovat, dbát na udržování tělesné teploty a zajistit odpovídající přísun tekutin. Při těžké nebo přetrvávající hypotenzi je potřebné počítat s možností hypovolemie a v případě potvrzené hypovolemie podat parenterálně vhodné roztoky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Anestetika celková, opioidní, alfentanil ATC kód: N01A H02
Alfentanil je silné rychle a krátkodobě působící opioidní analgetikum chemicky příbuzné fentanylu. Nástup účinku alfentanilu nastává po intravenózní aplikaci téměř okamžitě, představuje pouze čtvrtinu hodnoty oproti ekvianalgetické dávce fentanylu. Maximální analgetický a respiračně depresorický účinek se dostavuje během 1 - 2 minut (30 minut u morfinu).
Délka účinku alfentanilu představuje pouze třetinu hodnoty oproti ekvianalgetické dávce fentanylu a je prokazatelně závislá na dávce. Pro analgezii delší než 60 minut je vhodnější využít infuzi. Tlumivý účinek alfentanilu na dechovou frekvenci a alveolární ventilaci je rovněž kratší než u fentanylu, ve většině případů přetrvává analgezie déle než respirační deprese. Trvání a stupeň respirační deprese jsou závislé na dávce.
Při vysokých dávkách (> 120 ^.g/kg) navozuje alfentanil spánek a lze jej proto využít k úvodu do anestezie, spánek bývá plynulý bezbolestný, není provázen kardiovaskulární nebo hormonální stresovou odezvou na intubaci.
Podobně jako jiná opioidní analgetika může alfentanil v závislosti na dávce a rychlosti aplikace vyvolat svalovou ztuhlost, eufórii, miózu a bradykardii.
Při dávkách alfentanilu až do 200 ^g/kg nebyly zaznamenány zvýšené hladiny histaminu nebo klinické příznaky svědčící pro jeho vyplavení.
Zotavení po aplikaci alfentanilu je typicky rychlé a plynulé, s nízkým výskytem pooperační nauzey a zvracení.
Všechny účinky alfentanilu je možno antagonizovat specifickým antagonistou opioidních receptorů.
5.2 Farmakokinetické vlastnosti
Alfentanil je syntetický opioid s ^-agonistickým farmakologickým účinkem, který se používá pouze intravenózně.
Distribuce
Sekvenční distribuční poločasy alfentanilu jsou 0,4 - 2,2 minut a 8 - 32 minut. K rychlé, ale omezené tkáňové distribuci léčiva významně přispívá nízká úroveň ionizace (11 % při pH = 7,4). Distribuční objemy se pohybují v rozmezí 1,27 - 4,81 l (distribuční objem centrálního kompartmentu) a 12,1 - 98,2 l (distribuční objem v rovnovážném stavu). Vazba alfentanilu na plazmatické bílkoviny činí přibližně
92 %.
Biotransformace
Alfentanil je metabolizován převážně v játrech. Pouze 1 % nezměněného alfentanilu lze nalézt v moči. Metabolity nejsou farmakologicky účinné a v 70 - 80 % se vylučují močí.
Eliminace
Alfentanil se po intravenózní aplikaci rychle vylučuje. Udávají se výsledné eliminační poločasy 83 -223 minut. Plazmatická clearance představuje u osob ve věku mladších 40 let v průměru 356 ml/min a klesá přibližně o 8 % za deset let od 40 let věku. V moči bylo nalezeno pouze 1 % nezměněného alfentanilu. Jakmile již bylo infuzí dosaženo rovnovážného stavu, zůstává eliminační poločas nenarušen. Po ukončení aplikace se pacient rychle probouzí bez následných postopioidních účinků.
Zvláštní populace
Pediatrická populace
Údaje u dětí jsou omezené. Hodnoty farmakokinetických parametrů jsou uvedeny v následující tabulce.
|
Farmakokinetické parametry alfentanilu |
u pediatrických subjektů | ||
|
tl/2p |
CL |
Vdss | |
|
(hod) |
(ml/kg/min) |
(l/kg) | |
|
Předčasně narození novorozenci (0 - 27 dní) Gestační věk 25 - 40 týdnů; n = 68 |
0,7 - 8,8 |
0,9 - 8,4 |
0,3 - 1,2 |
|
Novorozenci narození v termínu (0 - 27 dní) Gestační věk 35 - 41 týdnů; n = 18 |
4,1 - 5,5 |
1,7 - 3,2 |
0,5 - 0,8 |
|
Kojenci a batolata 28 dní - 23 měsíců; n = 34 |
0,9 - 1,2 |
7,7 - 13,1 |
0,4 - 1,1 |
|
Děti 2 - 11 let; n = 32 |
0,7 - 1 3 |
4,7 - 10,2 |
0,2 - 1,0 |
|
Dospívající 12 - 14 let; n = 3 |
1,1 - 1,9 |
5,5 - 7,4 |
0,3 - 0,6 |
Poznámka: Údaje pro novorozence, kojence a batolata, a děti jsou uvedeny jako rozmezí průměrných hodnot.
CL = clearance, Vdss = distribuční objem v rovnovážném stavu, ti/2p = poločas v eliminační fázi.
Vazba na proteiny u novorozenců je 75 % a u dětí se zvyšuje na 85 %.
Farmakokinetické informace týkající se použití alfentanilu u dětí jsou omezené. Alfentanil je metabolizován CYP3A4. U novorozenců je aktivita CYP3A4 nízká, po narození se zvyšuje a v jednom měsíci dosahuje 30 až 40 % hodnot u dospělých. Aktivita CYPA4 se dále zvyšuje na 45 % v 6 měsících, na 80 % ve 12 měsících a hodnot u dospělých dosahuje ve věku 6 let.
Zhoršená funkce jater
Po jednorázové intravenózní dávce 50 pg/kg byl eliminační poločas u cirhotických pacientů významně delší než u kontrolní skupiny. Distribuční objem zůstal nezměněn. Volná frakce alfentanilu se u cirhotických pacientů zvyšuje na 18,5 % oproti 11,5 % u kontrolní skupiny. Zvýšení volné frakce spolu se snížením clearance z 3,06 ml/min/kg u kontrolní skupiny na 1,6 ml/min/kg u cirhotických pacientů vede k delšímu a výraznějšímu účinku (viz bod 4.4).
Zhoršená funkce ledvin
Distribuční objem a clearance volné frakce jsou u pacientů se zhoršenou funkcí ledvin a kontrolní skupiny obdobné. Volná frakce alfentanilu u pacientů se zhoršenou funkcí ledvin je zvýšena na 12,4 (19 %) ve srovnání s 10,3 (11 %) u kontrolní skupiny. To může vést ke zvýšení klinického účinku alfentanilu (viz bod 4.4).
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické účinky byly pozorovány pouze po expozicích dostatečně převyšujících maximální expozici u člověka, což svědčí pro malý význam při klinickém použití.
Alfentanil vykazuje velmi široké bezpečnostní rozpětí. Vyjádřeno u potkanů poměrem LD50/ED50 pro nejnižší hladinu analgezie činí hodnota alfentanilu 1080 ve srovnání s 4,6 u pethidinu, 69,5 u morfinu a 277 u fentanylu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný, voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
5 let
Z mikrobiologického hlediska, pokud způsob otevření/rekonstituce/ředění nevyloučí riziko mikrobiologické kontaminace, přípravek má být použit okamžitě. Pokud není použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání. Podmínky pro uchovávání naředěného přípravku viz bod 6.3.
6.5 Druh obalu a obsah balení
Ampulky z bezbarvého skla, vložka z umělé hmoty, krabička.
Velikost balení: 5x 2 ml
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Výdej přípravku je vázán na lékařský předpis a podléhá příslušným ustanovením zákona o návykových látkách. Omamná látka I.
V případě potřeby je možno RAPIFEN kombinovat s infuzními roztoky obsahujícími chlorid sodný nebo glukózu. Tyto roztoky jsou kompatibilní s plastovými infuzními soupravami a měly by být aplikovány okamžitě po naředění.
Při otevírání ampulky používejte ochranné rukavice.
Návod k otevření ampulky:
1. Podržte ampulku mezi palcem a ukazováčkem tak, aby zúžená část zůstala volná.
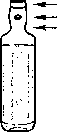
barevné proužky barevný bod místo Ulomení
2. Druhou rukou uchopte zúženou část ampulky tak, že opřete krček ampulky o ukazováček; palec přitiskněte na barevně označený bod souběžně
s barevnými proužky.
3. Přidržujte palec na označeném místě a ulomte zúženou část ampulky. Držte ampulku pevně v ruce.
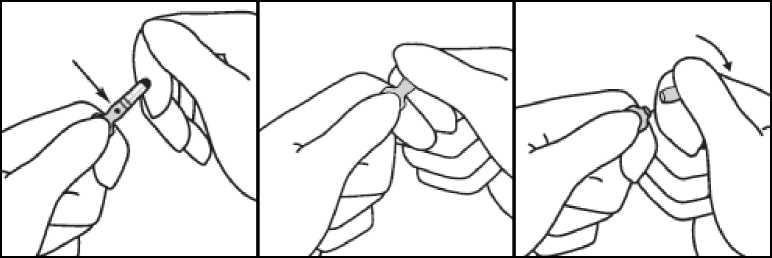
V případě náhodné dermální expozice opláchněte zasažené místo vodou. Vyhněte se použití mýdla, alkoholu a jiných čisticích látek, které mohou způsobit chemické nebo fyzické oděrky na kůži.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Janssen-Cilag s.r.o., Praha, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
05/156/87-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23. 6. 1987
Datum posledního prodloužení registrace: 9. 7. 2014
10. DATUM REVIZE TEXTU
17.8.2015
12/12