Quinsair 240 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
▼ Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Quinsair 240 mg roztok k rozprašování
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku k rozprašování obsahuje levofloxacinum hemidydricum ekvivalentní levofloxacinum 100 mg. Jedna ampulka obsahuje levofloxacinum 240 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztok k rozprašování.
Čirý, slabě žlutý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Quinsair je indikován k léčbě chronických plicních infekcí způsobených Pseudomonas aeruginosa u dospělých pacientů s cystickou fibrózou (CF, viz bod 5.1).
Je nutné přihlížet k oficiálním doporučením týkajícím se správného použití antibakteriálních látek.
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka je 240 mg (jedna ampulka) podávaných inhalací dvakrát denně (viz bod 5.2).
Přípravek Quinsair je používán ve střídajících se 28denních cyklech léčby následovaných 28 dny bez léčby. Cyklická terapie může pokračovat tak dlouho, jak to podle názoru lékaře bude klinicky prospěšné pro pacienta.
Dávky je zapotřebí inhalovat co nejpřesněji v intervalu 12 hodin.
Pokud dojde ke zmeškání dávky, je nutné ji použít co nejdříve, jakmile si pacient vzpomene s tím, že je před inhalací další dávky povolen interval nejméně 8 hodin. Pacienti nemají inhalovat obsah více než jedné ampulky, aby nahradili zmeškanou dávku.
Pokud se vyskytne akutní symptomatický bronchospasmus po používání přípravku Quinsair může být prospěšné použití krátkodobě působícího inhalačního bronchodilatancia nejméně 15 minut až 4 hodiny před následnými dávkami (viz body 4.4 a 4.8).
Starší pacienti (> 65 let)
Bezpečnost a účinnosti přípravku Quinsair u starších pacientů s CF nebyla stanovena.
Porucha funkce ledvin
Dávky se nemusí upravovat u pacientů s lehkou až středně těžkou poruchou funkce ledvin (odhadovaná clearance kreatininu > 20 ml/min pomocí Cockcroftova-Gaultova vzorce). Přípravek Quinsair se nedoporučuje k použití u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu < 20 ml/min).
Porucha funkce jater
Úprava dávkování se nevyžaduje (viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku Quinsair u dětí ve věku do 18 let nebyla dosud stanovena. V současnosti dostupné údaje jsou popsány v bodech 4.8, 5.1 , 5.2. a 5.3.; ohledně dávkování však nelze stanovit žádné doporučení.
Způsob podání
Inhalační podání.
Jakmile se ampulka otevře, obsah se musí použít neprodleně (viz bod 6.6).
U pacientů užívajících více inhalační ch terapií je doporučené pořadí podávání následující:
1. Bronchodilatancia
2. Dornáza alfa
3. Techniky čištění dýchacích cest
4. Přípravek Quinsair
5. Inhalované steroidy.
Přípravek Quinsair je zapotřebí používat s rozprašovací sadou Zirela (včetně aerosolové hlavice Zirela) dodávanou v balení s regulátorem eBase nebo rychlou řídicí jednotkou eFlow (viz bod 6.6). Návod k použití výrobce rozprašovací sady Zirela je zapotřebí prostudovat před prvním použitím přípravku Quinsair.
Studie in vitro používající rozprašovací systém Zirela s přípravkem Quinsair prokázaly následující charakteristiky podávání léčivého přípravku: hmotnostní střední aerodynamický průměr (distribuce velikosti kapek): 3,56 mikrometrů (geometrická směrodatná odchylka 1,51 ), rychlost podávání dávky: 24,86 mg/minuta (směrodatná odchylka, SD 4,05 ) a celkové množství podaného přípravku: 236,1 mg (7,1 SD). Rozprašovací systém Zirela byl používán k podávání přípravku Quinsair v klinických studiích popsaných v bodě 5.1.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku, jiné chinolony nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 tohoto přípravku.
• Onemocnění šlach související s podáváním fluorochinolonu v anamnéze.
• Epilepsie.
• Těhotenství.
• Kojící ženy.
4.4 Zvláštní upozornění a opatření pro použití
Hypersenzitivní reakce
Levofloxacin může způsobit potenciálně fatální hypersenzitivní reakce (např. angioedém a anafylaktický šok).
Závažné bulózní reakce
Při systémovém podávání levofloxacinu byly hlášeny závažné bulózní kožní účinky, například Stevens-Johnsonův syndrom nebo toxická epidermální nekrolýza (viz bod 4.8).
Poruchy funkce jater a žlučových cest
U levofloxacinu byly hlášeny případy nekrózy jater až fatální selhání jater, a to především u pacientů se závažnými základními chorobami, jako je sepse (viz bod 4.8). Pacienty je třeba upozornit, aby ukončili léčbu a kontaktovali svého lékaře, pokud zaznamenají známky a příznaky onemocnění jater, např. anorexii, žloutenku, tmavou moč, svědění nebo citlivost v oblasti břicha.
Prolongace QT intervalu
Při používání fluorochinolonů včetně levofloxacinu je zapotřebí postupovat opatrně u pacientů se známými rizikovými faktory pro prolongaci QT intervalu (viz body 4.5, 4.8 a 4.9), jako jsou například:
• Vrozený syndrom prodlouženého QT.
• Současné používání léčivých látek, o nichž je známo, že prodlužují interval QT (např. antiarytmika třídy IA a III, tricyklická antidepresiva, makrolidy, antipsychotika).
• Nekorigovaná nerovnováha elektrolytů (např. hypokalemie, hypomagnesemie).
• Srdeční onemocnění (např. srdeční selhání, infarkt myokardu, bradykardie).
Na působení léčivých přípravků prodlužujících QT interval mohou být citlivější starší pacienti a ženy. Proto je u těchto populací zapotřebí dbát zvýšené opatrnosti při podávání fluorochinolonů včetně levofloxacinu.
Pacienti s predispozicí k záchvatům
Chinolony mohou snižovat křečový práh a mohou spouštět záchvaty (viz bod 4.8). Levofloxacin je kontraindikován u pacientů s epilepsií v anamnéze (viz bod 4.3) a podobně jako jiné chinolony je třeba jej používat s mimořádnou opatrností u pacientů predisponovaných k záchvatům nebo se souběžnou léčbou léčivými látkami, které snižují cerebrální práh záchvatů, jako je například theofylin (viz bod 4.5).
Psychotické reakce
Psychotické reakce byly hlášeny u pacientů používajících chinolony včetně levofloxacinu. Ve velmi vzácných případech tyto reakce přecházely do sebevražedných myšlenek a sebepoškozujícího chování - někdy pouze po jediné dávce levofloxacinu (viz bod 4.8). Opatrnost se doporučuje, pokud se levofloxacin používá u psychotických pacientů nebo pacientů s psychiatrickým omezením v anamnéze.
Periferní neuropatie
U pacientů léčených fluorochinolony včetně levofloxacinu byly hlášeny periferní senzorická neuropatie a periferní senzomotorická neuropatie. Tyto neuropatie mohou mít náhlý nástup (viz bod 4.8). Pokud se u pacienta vyskytnou příznaky neuropatie, má být léčba levofloxacinem ukončena, aby se předešlo vzniku ireverzibilních změn.
Exacerbace myasthenia gravis
Fluorochinolony včetně levofloxacinu působí jako neuromuskulární blokátory a mohou exacerbovat svalovou slabost u pacientů s myasthenia gravis. Při použití fluorochinolonů u těchto pacientů byly po uvedení přípravku na trh zaznamenány závažné nežádoucí účinky zahrnující úmrtí a nutnost podpory dýchání. U pacientů se známou anamnézou myasthenia gravis se levofloxacin nedoporučuje.
Tendinitida
Tendinitida a ruptura šlachy, někdy bilaterální, se mohou objevit do 48 hodin od zahájení léčby
levofloxacinem a byly hlášeny až do několika měsíců po vysazení léčby. Riziko tendinitidy a ruptury šlachy se zvyšuje u pacientů ve věku nad 60 let, u pacientů používajících denní dávky 1000 mg a u pacientů užívajících kortikosteroidy.
Tendinitida byla během klinických hodnocení hlášena u pacientů s CF používajících přípravek Quinsair jako méně častý nežádoucí účinek (viz bod 4.8).
Bronchospasmus
Bronchospasmus je komplikací související s inhalačními terapiemi včetně přípravku Quinsair (viz bod 4.8). Pokud se vyskytne akutní symptomatický bronchospasmus po podávání léčby, může být prospěšné použití krátkodobě působícího inhalačního bronchodilatancia před následnými dávkami (viz body 4.2).
Hemoptýza
Použití inhalovaných léčivých přípravků může vyvolat kašlací reflex. Podávání přípravku Quinsair u pacientů s klinicky signifikantní hemoptýzou se má zahajovat pouze v případě, že výhody léčby převažují nad riziky vyvolání dalšího krvácení.
Pacienti s deficiencí glukózo-6-fosfát-dehvdrogenázv
Pacienti s latentními nebo aktuálními defekty aktivity glukózo-6-fosfát-dehydrogenázy mohou být při léčení chinolovými antibakteriálními přípravky náchylní k hemolytickým reakcím. Proto je zapotřebí sledovat potenciální výskyt hemolýzy, pokud se bude muset u těchto pacientů používat levofloxacin.
Pacienti léčení antagonisty vitamínu K
Kvůli možnému zvýšení hodnot koagulačních testů (PT/INR) a/nebo krvácení u pacientů léčených levofloxacinem v kombinaci s antagonistou vitamínu K (např. warfarinem) je nutné při současném podání těchto léčivých látek sledovat koagulační testy (viz bod 4.5).
Dysglykemie
Stejně jako u všech chinolonů byly hlášeny poruchy glykemie, včetně hypoglykemie i hyperglykemie, obvykle u diabetických pacientů dostávajících současně léčbu perorálním antidiabetikem (např. glibenklamidem) nebo inzulínem. U diabetických pacientů se doporučuje pečlivé sledování krevní glukózy (viz bod 4.8).
Onemocnění spojená s Clostridium difficile
Průjem, zvláště pokud je závažný, přetrvávající a/nebo krvavý během léčby levofloxacinem nebo po ní (včetně několika týdnů po léčbě), může být příznakem onemocnění souvisejícího s Clostridium difficile (CDAD). Závažnost CDAD se může pohybovat od mírné po život ohrožující, kdy nejzávažnější formu představuje pseudomembranózní kolitida.
Rezistence na levofloxacin, další antibakteriální přípravky a mikroorganismy vyžadující léčbu
Vývoj P. aeruginosa rezistentního vůči fluorochinolonu a superinfekce dalšími mikroorganismy nereagujícími na fluorochinolon představují potenciální rizika spojená s použitím přípravku Quinsair. Obj eví-li se v průběhu terapie superinfekce, je třeba zavést příslušná opatření.
Poruchy zraku
Pokud se objeví poruchy zraku nebo pacient zaznamená jakékoli účinky na zrak, je zapotřebí okamžitě konzultovat situaci se specializovaným očním lékařem (viz body 4.7 a 4.8).
Prevence fotosenzitizace
U levofloxacinu byla hlášena fotosenzitizace (viz bod 4.8). Doporučuje se, aby se pacienti sami zbytečně nevystavovali silnému slunečnímu záření nebo UV paprskům z umělých zdrojů (např. lampa horského sluníčka, solárium) během léčby a 48 hodin po ukončení léčby, aby nedošlo k fotosenzitizaci.
Interference s laboratorními testy
Při stanovení opiátů v moči se u pacientů léčených levofloxacinem mohou vyskytnout falešně pozitivní výsledky. Může být zapotřebí ověřit pozitivní screening na opiáty specifičtější metodou.
Protože levofloxacin může inhibovat růst Mycobacterium tuberculosis, mohou se při bakteriologické diagnostice tuberkulózy objevit falešně negativní výsledky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinky jiných léčivých přípravků na levofloxacin.
Levofloxacin se primárně vylučuje nezměněný v moči a metabolismus je minimální (viz bod 5.2). Interakce s inhibitory nebo induktory CYP se proto neočekávají.
Theofylin, fenbufen nebo podobná nesteroidní antiflogistika
V klinické studii nebyly nalezeny žádné farmakokinetické interakce levofloxacinu s theofylinem.
Může však dojít k výraznému snížení prahu mozkových záchvatů, jsou-li chinolony podávány současně s theofylinem, nesteroidními antiflogistiky nebo jinými přípravky, které práh záchvatů snižují. Koncentrace levofloxacinu byly asi o 13% vyšší v přítomnosti fenbufenu než při podávání levofloxacinu samotného.
Probenecid a cimetidin
Renální clearance levofloxacinu byla snížena cimetidinem (24%) a probenecidem (34%). To je způsobeno tím, že obě léčivé látky mají schopnost blokovat tubulární renální sekreci levofloxacinu.
Při dávkách zkoušených ve studiích však není pravděpodobné, že statisticky významné kinetické odchylky budou klinicky významné. Opatrnosti je třeba dbát při současném podávání levofloxacinu s látkami, které ovlivňují tubulární renální sekreci, např. probenecid a cimetidin, zejména u pacientů s poruchou funkce ledvin.
Další důležité informace
Klinické farmakologické studie ukázaly, že farmakokinetika levofloxacinu nebyla z pohledu klinického významu nikterak ovlivněna při současném podávání levofloxacinu s následujícími látkami: uhličitanem vápenatým, digoxinem, glibenklamidem, ranitidinem.
Účinky levofloxacinu na jiné léčivé přípravky
Substráty CYP1A2
Ve farmakokinetické interakční studii levofloxacin neovlivňoval farmakokinetiku theofylinu (který je substrátem CYP1A2), což ukazuje, že levofloxacin není inhibitorem CYP1A2.
Substráty CYP2C9
Studie in vitro naznačila nízký potenciál k interakci mezi levofloxacinem a substráty CYP2C9.
Interakce zprostředkované účinky na transportéry
Studie in vitro prokázaly, že inhibice klíčových transportérů spojených s lékovou dispozicí v ledvinách (organický polypeptid -1B1 transportující anionty (OATP1B1), OATP1B3, organický transportér-1 aniontů (OAT1), OAT3 a organický kationtový transportér-2 (OCT2)) při expozicích po inhalaci 240 mg levofloxacinu dvakrát denně je nízká.
Dále klinické údaje nenaznačují interakci se substráty P-glykoproteinu (P-gp), jako je například digoxin.
Cyklosporin
Biologický poločas cyklosporinu byl při současném podání s levofloxacinem zvýšen o 33%. Antagonisté vitaminu K
Zvýšení koagulačních testů (PT/INR) a/nebo krvácení, které může být závažné, byly hlášeny u pacientů léčených levofloxacinem v kombinaci s antagonisty vitaminu K (např. warfarin). U pacientů léčených antagonisty vitaminu K proto mají být sledovány koagulační testy (viz bod 4.4).
Léčivé přípravky, o kterých je známo, že prodlužují QT interval
Levofloxacin má být používán s opatrností u pacientů léčených přípravky, o kterých je známo, že prodlužují interval QT (například antiarytmika třídy IA a III, tricyklická antidepresiva, makrolidy, antipsychotika).
4.6 Fertilita, těhotenství a kojení
Jsou k dispozici pouze omezené údaje týkající se použití levofloxacinu u těhotných žen. Studie reprodukční toxicity s levofloxacinem na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3).
Nicméně z důvodu chybějících údajů u člověka a kvůli experimentálně zjištěnému riziku poškození zatížených chrupavek v rostoucím organismu v důsledku používání fluorochinolonů nesmí být levofloxacin podáván těhotným ženám (viz body 4.3 a 5.3).
Kojení
Informace o vylučování levofloxacinu do lidského mateřského mléka jsou nedostatečné; ostatní fluorochinolony se však do mléka vylučují.
Z důvodu chybějících údajů u člověka a kvůli experimentálně zjištěnému riziku poškození zatížených chrupavek v rostoucím organismu v důsledku užívání fluorochinolonů nesmí být Quinsair podáván těhotným ženám (viz body 4.3 a 5.3).
Fertilita
Levofloxacin nezpůsobuje poruchu fertility ani poruchu reprodukční výkonnosti u potkanů (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Některé z nežádoucích účinků přípravku (např. únava, astenie, poruchy zraku, závratě) mohou nepříznivě ovlivnit pacientovu pozornost a schopnost reagovat. Pacienti, kteří mají takovéto příznaky, nemají řídit motorová vozidla ani obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Bezpečnost doporučené dávky přípravku Quinsair byla hodnocena u 472 pacientů s CF ve dvou dvojitě zaslepených placebem kontrolovaných klinických hodnoceních s jedním cyklem a ve studii s aktivním komparátorem s volitelným nekontrolovaným prodloužením.
Nejčastěji hlášenými nežádoucími účinky byly kašel/produktivní kašel (54%), dysgeuzie (30%) a únava/astenie (25%).
Tabulka se seznamem nežádoucích účinků hlášených u přípravku Quinsair
Nežádoucí účinky, které vykazují přiměřenou pravděpodobnost kauzálního vztahu s přípravkem Quinsair, jsou uvedeny podle tříd orgánových systémů MedDRA. Nežádoucí účinky léčivého přípravku jsou seřazeny podle frekvence a účinky s nejvyšší frekvencí výskytu jsou uvedeny jako první. Používají se následující termíny a frekvence: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů |
Velmi časté (> 1/10) |
Časté (> 1/100 až < 1/10) |
Méně časté (> 1/1 000 až < 1/100) |
|
Infekce a infestace |
Vulvovaginální mykotická infekce |
Orální mykotická infekce | |
|
Poruchy krve a lymfatického systému |
Anémie*, Neutropenie** | ||
|
Poruchy imunitního systému |
Hypersenzitivita* | ||
|
Poruchy metabolismu a výživy |
Anorexie* | ||
|
Psychiatrické poruchy |
Insomnie* |
Anxieta*, Deprese* | |
|
Poruchy nervového systému |
Dysgeuzie |
Bolesti hlavy, Závratě* |
Hyposmie*, Somnolence* |
|
Poruchy oka |
Poruchy vidění* | ||
|
Poruchy ucha a labyrintu |
Tinitus* |
Ztráta sluchu* | |
|
Srdeční poruchy |
Tachykardie* | ||
|
Respirační, hrudní a mediastinální poruchy |
Kašel/produktivní Změny bronchiálního sekretu (objem a viskozita)*, Hemoptýza* |
Dysfonie |
Bronchospasmus**, Bronchiální hyperaktivita, Obstrukční porucha dýchacích cest |
|
Gastrointestinální poruchy |
Bolesti v břišní krajině*, Průjem*, Zácpa* |
Říhání, Dyspepsie*, Plynatost* | |
|
Poruchy jater a žlučových cest |
Hepatitida*, Hyperbilirubinemie* | ||
|
Poruchy kůže a podkožní tkáně |
Kopřivka*, Pruritus* | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Artralgie, Myalgie* |
Tendinitida, Kostochondritida, Ztuhlost kloubů |
|
Poruchy ledvin a močových cest |
Selhání ledvin* | ||
|
Celkové poruchy a reakce v místě aplikace |
Únava/ astenie, Snížená tolerance fyzické námahy |
Pyrexie | |
|
Vyšetření |
Snížená tělesná hmotnost**, Objem usilovného výdechu* |
Zvýšení alaninaminotransferázy, Zvýšení aspartátaminotransferázy, Zhoršení výsledků funkčních plicních testů * Zvýšení nebo snížení hladiny krevní glukózy*, Zvýšení kreatininu v krvi*, Abnormální dechové ozvy* |
Abnormální výsledky funkčních jaterních testů, Zvýšení alkalické fosfatázy v krvi*, Prodloužený interval QT na elektrokardiogramu*, Zvýšený počet eosinofilů*, Snížený počet trombocytů* |
|
* Nežádoucí příhody s nejistou souvislostí s přípravkem Quinsair, ale o nichž je známo, že jsou spojeny se systémovým podáváním levofloxacinu a/nebo jsou věrohodně spojovány s přípravkem Quinsair a byly v klinických studiích hlášeny častěji než u placeba. ** Další údaje naleznete v následujícím odstavci. | |||
Tabulka se seznamem dalších nežádoucích účinků hlášených po systémovém podávání levofloxacinu
Nežádoucí účinky, které vykazují alespoň přiměřenou pravděpodobnost kauzálního vtahu s levofloxacinem, jsou uvedeny podle tříd orgánových systémů MedDRA. Nežádoucí účinky léčivého přípravku jsou seřazeny podle frekvence a účinky s nejvyšší závažností jsou uvedeny jako první. Používají se následující termíny a frekvence: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů |
Méně časté (> 1/1 000 až < 1/100) |
Vzácné (> 1/10 000 až < 1/1 000) |
Není známo (Nelze odhadnout z dostupných údajů) |
|
Poruchy krve a lymfatického systému |
Pancytopenie*, Agranulocytóza*, Hemolytická anémie* | ||
|
Poruchy imunitního systému |
Angioedém |
Anafylaktický šok, Anafylaktoidní šok | |
|
Poruchy metabolismu a výživy |
Hypoglykemické kóma | ||
|
Psychiatrické poruchy |
Stav zmatenosti, Nervozita |
Psychotické reakce (např. halucinace, paranoia), Agitovanost, Abnormální sny, Noční můry |
Psychotické poruchy se sebepoškozujícím jednáním včetně suicidální myšlenky nebo pokusu o sebevraždu |
|
Poruchy nervového systému |
Konvulze, Parestézie |
Periferní senzorická neuropatie, Periferní senzomotorická neuropatie, Dyskineze, Extrapyramidální porucha, Synkopa, Benigní intrakraniální hypertenze | |
|
Poruchy oka |
Přechodná ztráta zraku | ||
|
Poruchy ucha a labyrintu | |||
|
Srdeční poruchy |
Palpitace |
Ventrikulární tachykardie Ventrikulární arytmie a torsade de pointes | |
|
Cévní poruchy | |||
|
Respirační, hrudní a mediastinální poruchy |
Alergická pneumonitida | ||
|
Poruchy jater a žlučových cest |
Žloutenka a závažná porucha funkce jater včetně případů s fatálním akutním selháním jater | ||
|
Poruchy kůže a podkožní tkáně |
Hyperhidróza |
Toxická epidermální nekrolýza, Stevensův- Johnsonův syndrom, Erythema multiforme, Fotosenzitivní reakce, Leukocytoklastická vaskulitida, Stomatitida | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Svalová slabost |
Rhabdomyolýza, Ruptura šlachy, Ruptura vazu, Ruptura svalu, Artritida | |
|
Celkové poruchy a reakce v místě aplikace |
Bolest (včetně bolesti zad, hrudníku a končetin) | ||
|
* Další údaje naleznete v následujícím odstavci. | |||
Popis vybraných nežádoucích účinků
Pokud se vyskytne symptomatická bronchokonstrikce po podávání přípravku Quinsair, může být prospěšné použití krátkodobě působícího inhalačního bronchodilatancia před následnými dávkami (viz
body 4.2.a 4.4).
Byl hlášen pokles tělesné hmotnosti jako nežádoucí příhoda během klinických studií, ale primárně se mělo za to, že jde spíše o onemocnění než účinek související s léčivým přípravkem.
Po systémovém podávání levofloxacinu byly hlášeny závažné hematologické nežádoucí účinky, jako jsou pancytopenie, agranulocytóza a hemolytická anémie. Jejich frekvence nelze z dostupných údajů odhadnout.
Pediatrická populace
V klinických hodnoceních dostávalo 51 dospívajících s CF (> 12 až < 18 let) přípravek Quinsair 240 mg dvakrát denně a 6 dospívajících s CF dostávalo přípravek Quinsair 120 mg (n = 3) nebo 240 mg (n = 3) jednou denně. Kromě toho 14 dětí s CF (> 6 až < 12 let věku) a 13 adolescentů s CF (> 12 až < 17 let věku) dostávalo přípravek Quinsair 180 mg nebo 240 mg jednou denně po dobu 14 dní. Na základě tohoto omezeného množství údajů se zdá, že v bezpečnostním profilu přípravku Quinsair není žádný klinicky významný rozdíl u těchto podskupin pediatrické populace v porovnání s profilem u dospělých. Byly však pozorovány dva případy artralgie u dětí v klinických hodnoceních s přípravkem Quinsair a chybí dlouhodobá bezpečnostní data zvláště s ohledem na účinek na chrupavku pozorovaný u zvířat (viz body 4.2 a 5.3).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměrů přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V případě předávkování je vhodné zahájit symptomatickou léčbu. Pacienta je zapotřebí sledovat a zajistit udržování odpovídající hydratace. Vzhledem k možnosti prodloužení intervalu QT máo být zajištěno monitorování EKG. Hemodialýza, včetně peritoneální a kontinuální ambulantní peritoneální dialýzy (CAPD), není k odstranění levofloxacinu z těla účinná. Neexistuje žádné specifické antidotum.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antibakteriální léčiva pro systémovou aplikaci, fluorochinolony ATC kód: J01MA12
Levofloxacin je syntetické antibakteriální agens ze třídy fluorochinolonů. Levofloxacin je S(-) enantiomer racemické léčivé látky ofloxacinu.
Mechanismus účinku
Jako fluorochinolonové antibakteriální agens působí levofloxacin na bakteriální DNA- gyrázu a na topoizomerázu IV.
Vztah PK/PD
Stupeň antibakteriální aktivity levofloxacinu závisí na podílu Cmax/MIC a AUC/MIC (Cmax = maximální koncentrace v místě infekce, AUC = plocha pod křivkou plazmatických hodnot a MIC = minimální inhibiční koncentrace).
Rezistence
Rezistence na levofloxacin se vyvíjí pomalu postupným procesem spojeným s mutací cílového místa v DNA gyráze a topoizomeráze IV. Snížená citlivost na levofloxacin může být rovněž výsledkem získání proteinů kódujících plasmidy, které chrání tyto cíle před inhibicí. Jiný mechanismus rezistence, jako je snížená propustnost bakteriálních bariér (známé u Pseudomonas aeruginosa) a efluxní mechanismy, může také ovlivnit rezistenci na levofloxacin.
Zkřížená rezistence je pozorována i mezi levofloxacinem a ostatními fluorochinolony.
Hraniční hodnoty
Zjištěné hraniční hodnoty citlivosti pro systémové (perorální nebo intravenózní podání) levofloxacinu neplatí pro inhalační podání.
Klinická účinnost.
Klinická účinnost byla prokázána ve dvou placebem kontrolovaných studiích a jedné studii s aktivním komparátorem u 448 pacientů randomizovaných k podávání přípravku Quinsair 240 mg dvakrát denně.
Byla provedena dvě randomizovaná dvojitě zaslepená placebem kontrolovaná klinická hodnocení s jediným cyklem (studie 204 a 207) u pacientů s CF chronicky infikovaných P. aeruginosa. Do studie byli zařazení dospělí a dospívající pacienti (> 12 až < 18 let a s tělesnou hmotností > 30 kg), kteří měli procentuální FEVi předpovídaný v rozmezí 25% až 85%. Před zařazením do studie všichni pacienti také absolvovali minimálně 3 cykly inhalační antipseudomonální antimikrobiální terapie trvající 12 měsíců (studie 204) nebo 18 měsíců (studie 207), ale žádnou léčbu během 28 dnů bezprostředně předcházejících zařazení do studie. Kromě studijního léčiva pacienti nadále používali standardní léčbu v rámci péče při chronické plicní infekci. Pro přípravek Quinsair 240 mg dvakrát denně po 28 dnů bylo celkem randomizováno 259 pacientů (> 18 let, n = 226; > 12 až < 18 let věku, n = 33) a 147 bylo randomizováno pro placebo (> 18 let, n = 127; > 12 až < 18 let věku, n = 20). Tyto dvě placebem kontrolované studie prokázaly, že 28 dnů léčby přípravkem Quinsair 240 mg dvakrát denně vedlo k významnému zlepšení relativní změny vůči výchozímu stavu u odhadovaného procentuálního podílu FEV1 v porovnání s placebem (viz tabulka 1).
Tabulka 1: Odhadovaná procentuální relativní změna FEV1 vůči výchozímu stavu do dne 28 v placebem kontrolovaných studiích účinnosti a bezpečnosti přípravku Quinsair u pacientů s
CF
|
Předpovídaný procentuální podíl FEV1 |
Podpůrné studie | |||
|
Studie 207 (ITT) |
Studie 204 (ITT) a | |||
|
Placebo |
Quinsair 240 mg dvakrát denně |
Placebo |
Quinsair 240 mg dvakrát denně | |
|
N = 110 |
N = 220 |
N = 37 |
N = 39 | |
|
> 12 až < 18 let, n (%) |
16 (14,5) |
30 (13,6) |
4 (10,8) |
3 (7,7) |
|
> 18 let, n (%) |
94 (85,5) |
190 (86,4) |
33 (89,2) |
36 (92,3) |
|
Výchozí průměr (SD) |
56,32 (15,906) |
56,53 (15,748) |
52,4 (13,42) |
48,8 (15,15) |
|
Relativní změna od výchozího stavu do dne 28 LS průměr (SE) |
1,24 (1,041) |
3,66 (0,866) |
-3,46 (2,828) |
6,11 (2,929) |
|
Rozdíl v léčbě v den 28 [95% CI] b |
2,42 [0,53, 4,31]; P = 0,012 c |
9,57 [3,39, 15,75]; P = 0,0026 c | ||
CI = interval spolehlivosti, FEV1 = usilovný expirační objem za 1 sekundu; ITT = úmysl léčit (všichni randomizovaní pacienti); P = hodnota p; SD = směrodatná odchylka; SE = standardní chyba; ANCOVA = analýza kovariance._
a ANCOVA s podmínkami pro léčbu, region, věk (16 až18 let, > 18 let), a výchozí odhadovaný procentuální podíl FEV1 jako kvartily. (Pozn.: Ve studii 204 bylo na Quinsair 120 mg jednou denně randomizováno dalších 38 pacientů (> 18 let, n = 35; > 16 až < 18 let věku, n = 3) a dalších 37 pacientů bylo randomizováno na Quinsair 240 mg jednou denně (> 18 let, n = 34; > 16 až < 18 let věku, n = 3).)b Průměrný rozdíl LS pro přípravek Quinsair minus placebo.
c Testováno při použití alfa 0,05._
Studie 209 (hlavní fáze) byla randomizovaná otevřená aktivně kontrolovaná studie noninferiority s paralelními skupinami porovnávající přípravek Quinsair s inhalačním roztokem tobramycinu (TIS) ve 3 léčebných cyklech. Každý léčebný cyklus zahrnoval 28 dnů léčby přípravkem Quinsair 240 mg dvakrát denně nebo TIS 300 mg dvakrát denně, po němž následovalo 28 dnů bez inhalovaných antibiotik. Do studie byli zařazení dospělí a adolescentní pacienti (> 12 až < 18 let a vážící > 30 kg), kteří měli odhadovaný procentuální FEV1 v rozmezí 25% až 85%. Všichni pacienti také absolvovali minimálně 3 cykly TIS ve 12 měsících před zařazením do studie, ale ne během 28 dnů bezprostředně předcházejících zařazení do studie. Kromě studijního léčiva pacienti nadále používali standardní léčbu v rámci péče při chronické plicní infekci. Celkem 189 pacientů bylo randomizováno na Quinsair 240 mg dvakrát denně (> 18 let, n = 170; > 12 až < 18 let věku, n = 19) a 93 bylo randomizováno na placebo (> 18 let, n = 84; > 12 až < 18 let věku, n = 9). Výsledky získané pro primární a klíčové sekundární cílové parametry jsou uvedeny v tabulce 2.
Tabulka 2: Výsledky pro primární a klíčové sekundární cílové parametry v aktivně kontrolované studii účinnosti a bezpečnosti přípravku Quinsair u pacientů s CF
|
Parametr |
Pivotní studie - studie 209 (hlavní fáze, ITT) | ||
|
TIS 300 mg dvakrát denně N = 93 |
Quinsair 240 mg dvakrát denně N = 189 |
Rozdíl v léčbě a | |
|
> 12 až < 18 let, n (%) |
9 (9,7) |
19 (10,1) * | |
|
> 18 let, n (%) |
84 (90,3) |
170 (89,9) | |
|
Odhadovaný procentuální podíl FEV1 Výchozí průměr (SD) |
53,20 (15,700) |
54,78 (17,022) | |
|
Primární cílový parametr: | |||
|
Relativní změna FEV1 od výchozího stavu do dne 28 cyklu 1 |
N = 93 0,38 (1,262) b |
N = 189 2,24 (1,019) b |
LS průměr [95% CI]: 1,86 [-0,66, 4,39] c |
|
Sekundární cílové parametry: | |||
|
Relativní změna FEV1 od výchozího stavu do dne 28 cyklu 2 |
N = 84 -0,62 (1,352) b |
N = 170 2,35 (1,025) b |
LS průměr [95% CI]: 2,96 [-0,03, 5,95] |
|
Relativní změna FEV1 od výchozího stavu do dne 28 cyklu 3 |
N = 83 -0,09 (1,385) b |
N = 166 1,98 (1,049) b |
LS průměr [95% CI]: 2,07 [-1,01, 5,15] |
|
Respirační doména dotazníku pro cystickou fibrózu - revidováno ( CFQ-R) Změna od výchozího stavu do dne 28 cyklu 1 |
N = 91 -1,31 (1,576) b |
N = 186 1,88 (1,278) b |
LS průměr [95% CI]: 3,19 [0,05, 6,32] P=0,046 e |
|
Střední doba do podání anti-pseudomonálních antimikrobiálních přípravků |
N = 93 110 dny |
N = 189 141 dny |
Poměr rizika [95% CI] d: 0,73 [0,53, 1,01] P = 0,040 e |
|
Střední doba do pulmonální exacerbace |
N = 93 90,5 dny |
N = 189 131 dny |
Poměr rizika [95% CI] d: 0,78 [0,57, 1,07] P = 0,154 e |
CI = interval spolehlivosti, FEVi = usilovný expirační objem za 1 sekundu; ITT = úmysl léčit (všichni randomizovaní pacienti); P = hodnota p; SD = směrodatná odchylka; SE = standardní chyba; TIS = inhalační roztok tobramycinu.
* Pozn: Jeden dospívající randomizovaný na Quinsair 240 mg dvakrát denně nedostal studijní terapii. a Rozdíl v léčbě pro přípravek Quinsair minus TIS, nebo poměr rizika pro Quinsair/TIS. b LS průměr (SE)
c Noninferiorita byla testována pomocí předem specifikovaného pevného rozpětí noninferiority 4% 28. den 1. cyklu.
d Odhady byly získány z Coxova modelu proporcionálních rizik.
e P hodnota stanovená pomocí log-rank testu._
Pacienti, kteří dokončili studii 209 (hlavní fáze) by mohli pokračovat ve volitelné rozšířené fázi pro 3 další cykly (tj. 28 dnů léčby přípravkem Quinsair 240 mg dvakrát denně následovaných 28 dny bez léčby). Celkem 88 pacientů obdrželo nejméně 1 dávku přípravku Quinsair ve studii 209 (rozšířená fáze), 32 z nich dostávalo TIS a 56 z nich dostávalo přípravek Quinsair v hlavní fázi). Během rozšířené fáze se změna průměru LS pro odhadovaný procentuální podíl FEV1 pohybovala v rozmezí od 4,83% do 1,46% v rámci 3 dodatečných léčebných cyklů. U podskupiny pacientů, kteří dostávali TIS během hlavní fáze a přešli na přípravek Quinsair v rozšířené fázi, bylo zlepšení odhadovaného procentuálního podílu FEV1 význačnější u přípravku Quinsair než u TIS (změna průměru LS v odhadovaném procentuálním podílu FEV1 u TIS se pohybovala v rozmezí od 0,97% do 3,60% v rámci cyklů 1 až 3 a v rozmezí 4,00% až 6,91% v rámci cyklů 4 až 6 u přípravku Quinsair). U dílčí skupiny pacientů, kteří dostávali přípravek Quinsair během hlavní a rozšířené fáze (tj. Cykly 1 až 6) se změna průměru LS u odhadovaného procentuálního podílu FEV1 pohybovala v rozpětí od 3,6% do 4,6% s výjimkou cyklu 6, kde se blížila výchozímu stavu (-0,15%). Podíl pacientů, kteří dostávali přípravek Quinsair v průběhu studie 209, hlavní a rozšířená fáze, s nejvyšší MIC levofloxacinu v izolátu P. aeruginosa překračující 1 pg/ml, byl podobný na konci léčby během cyklu 1 a 3 v hlavní fázi (76,6% až 83,3%) a na konci léčby během cyklu 4 až 6 v rozšířené fázi (77,8% až 87,5%).
Pediatrická populace
Ve studiích 204, 207 a 209 byla relativní změna odhadovaného procentuálního podílu FEV1 od výchozího stavu do konce léčby v cyklu 1 podobně velká u 51 dospívajících s CF (> 12 až < 18 let a tělesná hmotnost > 30 kg), kteří dostávali přípravek Quinsair 240 mg dvakrát denně, jako u dospělých. Účinnost nebyla hodnocena u 14 dětí s CF (> 6 až < 12 let věku) a u 13 dospívajících s CF (> 12 až < 17 let věku), kteří se zúčastnili studie 206.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Quinsair u jedné nebo více podskupin pediatrické populace pacientů s cystickou fibrózou s plicní infekcí/kolonizací P. aeruginosa (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Maximální koncentrace levofloxacinu v plazmě (Cmax) po inhalačním podání nastala přibližně za 0,5 -1 hodinu po dávce samotné.
Podání více dávek přípravku Quinsair 240 mg dvakrát denně inhalací vede k systémové expozici levofloxacinu přibližně o 50% nižší, než je pozorována po systémovém podání srovnatelných dávek (viz tabulka 3). Nicméně u systémových expozic byla pozorována variabilita, což znamená, že sérové hladiny levofloxacinu po inhalaci přípravku Quinsair mohou někdy poklesnout v rozsahu koncentrací pozorovaných po systémovém podání srovnatelných dávek.
Tabulka 3: Porovnání průměrných (SD) farmakokinetických parametrů vícenásobné dávky levofloxacinu po podání přípravku Quinsair inhalací pacientům s CF a po perorálním a
|
intravenózním podání |
evofloxacinu zdravým t |
ospělým dobrovolníkům. | |
|
F arm akokinetický |
Přípravek Quinsair |
Systémový levofloxacin | |
|
parametr |
240 mg inhalace BID |
500 mg perorálně QD QD* |
500 mg i.v. QD* |
|
Cmax (Pg/ml) |
2,4 (1,0) |
5,7 (1,4) |
6,4 (0,8) |
|
AUC(0-24) (pg^h/ml) |
20,9 (12,5) |
47,5 (6,7) |
54,6 (11,1) |
|
i.v. = intravenózní, QD = quaque die (jednou denně), BID = bis in die (dvakrát denně) * Odhadovaná hodnota pro farmakokinetickou analýzu populace u pacientů s CF ** Zdraví muži ve věku 18 až 53 let | |||
U pacientů s CF byly po podání přípravku Quinsair 240 mg dvakrát denně pozorovány vysoké koncentrace levofloxacinu ve sputu. Průměrné koncentrace ve sputu po dávce byly přibližně 500-1900 pg/ml a byly přibližně 400-1700 krát vyšší než koncentrace pozorované v séru.
Distribuce
Přibližně 30-40 % levofloxacinu se váže na bílkoviny v séru. Průměrný zjevný distribuční objem levofloxacinu je po inhalaci přípravku Quinsair 240 mg dvakrát denně přibližně 250 l.
Biotransformace
Levofloxacin je metabolizován ve velmi malé míře na desmethyl-levofloxacin a levofloxacin N-oxid. Tyto metabolity tvoří méně než 5% dávky a jsou vylučovány močí. Levofloxacin je stereochemicky stabilní a nepodléhá chirální inverzi.
Eliminace
Levofloxacin je systémově absorbován po inhalaci přípravku Quinsair a eliminován podobně jako levofloxacin po systémovém podání. Po perorálním a intravenózním podání je levofloxacin z plazmy vylučován relativně pomalu (t/ = 6 - 8 hod). Poločas levofloxacinu po inhalaci přípravku Quinsair je přibližně 5 až 7 hodin. Vylučování probíhá primárně renální cestou (> 85% dávky po perorálním nebo intravenózním podání). Průměrná zjevná celková clearance levofloxacinu po jednorázovém podání dávky 500 mg byla 175 +/- 29,2 ml/min. Zjevná clearance (CL/F) levofloxacinu po inhalaci přípravku Quinsair 240 mg dvakrát denně je 31,8 +/- 22,4 l/hodinu.
Linearita
Po systémovém podání levofloxacin udržuje lineární průběh farmakokinetiky v rozsahu 50 až 1000 mg.
Pacienti s poruchou funkce ledvin
Účinky poruchy funkce ledvin na farmakokinetiku levofloxacinu podávaného inhalací nebyly zkoumány. V klinických studiích s přípravkem Quinsair však nebyly použity úpravy dávky, což dovolovalo zahrnout pacienty s lehkou až středně těžkou poruchou funkce ledvin (odhadovaná clearance kreatininu > 20 ml/min pomocí Cockcroftova-Gaultova vzorce u dospělých pacientů > 20 ml/min/1,73 m2 pomocí Bedside Schwartzova vzorce u pacientů < 18 let). Studie používající systémové podání levofloxacinu ukazují, že farmakokinetika levofloxacinu je poruchou funkce ledvin ovlivněna; s klesající funkcí ledvin (odhadovaná clearance kreatininu 50 ml/min) klesá renální eliminace a clearance, zatímco se poločas eliminace zvětšuje.
Proto dávky přípravku Quinsair nemusí být u pacientů s lehkou až středně těžkou poruchou poruchou funkce ledvin upravovány. Přípravek Quinsair se přesto nedoporučuje k použití u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu <20 ml/min, viz bod 4.2).
Pacienti s poruchou funkce jater
Farmakokinetické studie s přípravkem Quinsair u pacientů s poruchou funkce jater nebyly prováděny. Kvůli omezenému rozsahu metabolismu levofloxacinu v játrech se neočekává, že bude farmakokinetika levofloxacinu ovlivněna poruchou funkce jater.
Pediatrická populace
Bezpečnost a účinnost přípravku Quinsair u dětí ve věku do < 18 let nebyla dosud stanovena (viz bod 4.2).
Farmakokinetika levofloxacinu po inhalaci přípravku Quinsair 240 mg dvakrát denně byla zkoumána u pediatrických pacientů s CF ve věku 12 let a starších a s tělesnou hmotností > 30 kg. Populační model farmakokinetiky založený na odběrech na farmakokinetiku prokázal, že sérové koncentrace levofloxacinu byly po 28 dnech léčby u pediatrických a dospělých pacientů srovnatelné. Ve studii 207 byly u dospělých pacientů v porovnání s pediatrickými pacienty pozorovány vyšší koncentrace ve sputu; podobné koncentrace ve sputu byly pozorovány u dospělých a pediatrických pacientů ve studii 209.
Ve studii 206 byla také hodnocena farmakokinetika dávek levofloxacinu stanovených podle tělesné hmotnosti a podávaných inhalačně jednou denně po dobu 14 dnů pediatrickým pacientům s CF (> 6 až < 12 let věku, n = 14 a > 12 až < 17 let věku, n = 13). Pacienti s tělesnou hmotností 22 až 30 kg dostávali 180 mg levofloxacinu denně. Dávkování podle tělesné hmotnosti vedlo ke konzistentní PK expozici v séru a sputu napříč věkovými skupinami (7 až 16 let věku) a váhovými kategoriemi (22 až 61 kg). Sérová PK expozice byla obdobná při porovnání u dětí na dávkách podle tělesné hmotnosti a u dospělých, kteří dostávali Quinsair 240 mg jednou denně. Expozice PK ve sputu u dětí ve věku 7 a 16 let byla přibližně jedna třetina expozice u dospělých.
Starší pacienti (> 65 let)
Farmakokinetika levofloxacinu podávaného inhalací nebyla u starších pacientů zkoumána. Po systémovém podání se neobjevují žádné významné rozdíly ve farmakokinetice u mladých a starších subjektů hodnocení s výjimkou těch, které souvisí s poklesy clearance kreatininu vyvolanými věkem.
Pohlaví
Výsledky analýzy farmakokinetiky populace po podání přípravku Quinsair neprokázaly rozdíly v systémové expozici levofloxacinu vzhledem k pohlaví.
Rasa
Vlivy rasy na farmakokinetiku levofloxacinu podávaného inhalací nebyly zkoumány. Po systémovém podání byl zkoumán vliv rasy na farmakokinetiku levofloxacinu pomocí analýzy kovariát prováděné na datech od 72 subjektů hodnocení: 48 bělochů a 24 nebělochů. Zjevná celková tělesná clearance a zjevný distribuční objem nebyly rasou subjektu hodnocení dotčeny.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií toxicity po jednorázovém podání, toxicity po opakovaném podávání, hodnocení kancerogenního potenciálu a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
Bylo demonstrováno, že fluorochinolony vyvolaly artropatii nosných kloubů u nezralých zvířat.
Stejně jako ostatní fluorochinolony má i levofloxacin účinek na chrupavky (tvorba dutin a puchýřků) u laboratorních potkanů a psů. Tyto nálezy byly více výrazné u mladých zvířat.
Levofloxacin nevyvolal žádné genové mutace bakteriálních buněk ani buněk savců. Způsobil však chromozomální aberace u plicních buněk čínských křečků in vitro. Tyto účinky lze považovat za následek inhibice topoizomerázy II. In vivo testy (mikronukleový test, výměna sesterských chromatid, neplánovaná syntéza DNA, dominantní letální testy) neprokázaly žádný genotoxický potenciál. Studie na myších prokázaly, že levofloxacin má fototoxický účinek pouze při velmi vysokých dávkách. V testu fotomutagenity levofloxacin neprokázal žádný genotoxický potenciál. V testu fotokarcinogenity redukoval nádorové bujení.
Levofloxacin nezpůsobil zhoršení fertility ani reprodukční výkonnost u potkanů a jeho jediným účinkem na plody byla zpožděná zralost v důsledku mateřské toxicity.
Neklinické studie prováděné s levofloxacinem s využitím inhalační cesty neodhalily, na základě konvenčních studií bezpečnostní farmakologie (respirační), toxicity po jediném podání a toxicity po vícenásobném podání, žádné zvláštní nebezpečí pro lidi.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Hexahydrát chloridu hořečnatého Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Ampulka
3 ml, ampulka z nízkohustotního polyethylenu.
Sáček
Laminátový sáček uzavřený ve fólii obsahující 4 ampulky.
Vnitřní obal
56 ampulek (14 sáčků po 4) .
Vnější obal
Přípravek Quinsair se dodává jako28denní balení. To zahrnuje vnitřní krabičku obsahující 56 ampulí a příbalovou informaci. Vnější krabička rovněž obsahuje jednu rozprašovací sadu Zirela zabalenou do vlastní krabičky s návodem k použití od výrobce.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Pouze pro jednorázové použití. Jakmile se ampulka otevře, obsah se musí neprodleně použít . Jakýkoliv nepoužitý přípravek se musí zlikvidovat.
Přípravek Quinsair se podává inhalací po dobu 5 minut pomocí rozprašovací sady Zirela specificky určené pro přípravek Quinsair a aerosolové hlavice Zirela připojené k regulátoru eBase nebo rychlé řídicí jednotce eFlow (viz bod 4.2). Přípravek Quinsair se nemá používat s žádným jiným typem nástavce nebo aerosolové hlavice.
Základní pokyny pro použití jsou uvedeny níže. Podrobnější pokyny jsou k dispozici v příbalové informaci a návodu k použití od výrobce.
Vyprázdněte veškerý obsah jedné ampulky do nádobky na přípravek rozprašovací sady Zirela. Uzavřete nádobku na léčivý přípravek vyrovnáním úchytů krytky přípravku a štěrbin na nádobce. Stlačte dolů a otočte krytkou ve směru hodinových ručiček tak daleko, jak to jen půjde. Posaďte pacienta, aby zaujal uvolněně svislou polohu. Držte násadec ve vodorovné poloze, stiskněte a přidržte tlačítko zapnuto/vypnuto na regulátoru po několik sekund. Regulátor jednou „pípne“ a rozsvítí se zelená světelná kontrolka. Po několika sekundách začne aerosolová mlha proudit do aerosolové komory rozprašovací sady Zirela. Držte nástavec ve vodorovné poloze, vložte náustek do úst pacienta, který jej musí pevně sevřít rty. Vyzvěte pacienta, aby vdechoval a vydechoval náustkem, dokud léčba neskončí. Jakmile léčba skončí, regulátor dvakrát „pípne“. Odpojte regulátor a rozeberte rozprašovací sadu Zirela kvůli čištění a dezinfekci.
Do rozprašovací sady Zirela nedávejte žádné jiné léčivé přípravky.
Všechen léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Raptor Pharmaceuticals Europe B.V.
Naritaweg 165 1043 BW Amsterdam Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/973/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 26/03/2015
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Adare Pharmaceuticals S.r.l.
Via Martin Luther King, 13 20060 Pessano con Bornago (MI)
Itálie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace. Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření:
|
Popis |
Termín splnění |
|
Provést neintervenční postautorizační bezpečnostní studii u subjektů v registru pacientů s CF k hodnocení dlouhodobého bezpečnostního profilu přípravku Quinsair v běžné praxi v Evropské unii. |
Kumulativní průběžné analýzy -ročně Závěrečná zpráva studie - do 2. čtvrtletí 2022 |
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
VNĚJŠÍ KRABIČKA OBSAHUJÍCÍ VNITŘNÍ KRABIČKU S 56 AMPULKAMI (14 SÁČKŮ
V r
PO 4 ) PLUS JEDNA ROZPRAŠOVACÍ SADA „ZIRELA“
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Quinsair 240 mg roztok k rozprašování Levofloxacinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku k rozprašování obsahuje levofloxacinum hemidydricum ekvivalentní levofloxacinum 100 mg. Jedna ampulka obsahuje levofloxacinum 240 mg .
3. SEZNAM POMOCNÝCH LÁTEK
Hexahydrát chloridu hořečnatého a voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ_
Roztok k rozprašování.
56 ampulek (14 sáčků po 4)
Toto balení rovněž obsahuje jednu rozprašovací sadu Zirela.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
Pouze pro jednorázové použití. Po otevření ihned použijte. Inhalační podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Raptor Pharmaceuticals Europe B.V. Naritaweg 165 1043 BW Amsterdam Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/973/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Quinsair
VNITŘNÍ KRABIČKA OBSAHUJÍCÍ 56 AMPULEK (14 SÁČKŮ PO 4)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Quinsair 240 mg roztok k rozprašování Levofloxacinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku k rozprašování obsahuje levofloxacinum hemihydricum ekvivalentní levofloxacinum 100 mg. Jedna ampulka obsahuje g levofloxacinum 240 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Hexahydrát chloridu hořečnatého a voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Roztok k rozprašování.
56 ampulek (14 sáčků po 4)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
Pouze pro jednorázové použití. Po otevření ihned použijte. Inhalační podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Raptor Pharmaceuticals Europe B.V. Naritaweg 165 1043 BW Amsterdam Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/973/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Quinsair
LAMINÁTOVÝ SÁČEK UZAVŘENÝ VE FÓLII, OBSAHUJÍCÍ 4 AMPULKY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Quinsair 240 mg roztok k rozprašování Levofloxacinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku k rozprašování obsahuje levofloxacinum hemihydricum ekvivalentní levofloxacinum 100 mg. Jedna ampulka obsahuje g levofloxacinum 240 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Hexahydrát chloridu hořečnatého a voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Roztok k rozprašování. 4 ampulky
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze pro jednorázové použití. Po otevření ihned použijte. Inhalační podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Raptor Pharmaceuticals Europe B.V. Naritaweg 165 1043 BW Amsterdam Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/973/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU LDPE AMPULKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Quinsair 240 mg roztok k rozprašování
Levofloxacinum
Inhalační podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
2,4 ml
6. JINÉ
Příbalová informace: Informace pro pacienta
Quinsair 240 mg roztok k rozprašování
Levofloxacinum
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoliv další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoliv nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Quinsair a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Quinsair používat
3. Jak se přípravek Quinsair používá
4. Možné nežádoucí účinky
5. Jak přípravek Quinsair uchovávat
6. Obsah balení a další informace
1. Co je přípravek Quinsair a k čemu se používá
Přípravek Quinsair obsahuje antibiotikum nazývané levofloxacin. Patří do skupiny antibiotik, které se nazývají fluorochinolony.
Přípravek Quinsair se používá k léčbě plicních infekcí způsobených bakterií Pseudomonas aeruginosa u dospělých s cystickou fibrózou. Pokud nebude infekce řádně léčena, bude nadále poškozovat plíce a způsobovat další dýchací obtíže.
2. Čemu musíte věnovat pozornost, než začnete přípravek Quinsair používat
Nepoužívejte přípravek Quinsair:
- jestliže jste alergický(á) na levofloxacin nebo na kterékoli chinolonové antibiotikum, jako jsou moxifloxacin, ciprofloxacin nebo ofloxacin, nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže jste někdy měl(a) problémy se šlachami (zánět šlachy nebo přetržená šlacha) během léčby jiným chinolonovým antibiotikem
- jestliže trpíte epilepsií
- jestliže j ste těhotná nebo kojíte
Upozornění a opatření
Předtím, než budete používat přípravek Quinsair, informujte svého lékaře, že máte nebo jste
měl(a) kterékoliv z následujících onemocnění:
- Ledvinové obtíže
- Závažná alergická reakce. Příznaky jsou uvedeny v bodě 4.
- Závažné kožní reakce
Pokud budete léčen(a) přípravkem Quinsair, možná budete trpět závažnou kožní reakcí jako například tvorbou puchýřů nebo lézemi (poškozením kůže). Pokud po používání přípravku Quinsair zaznamenáte jakékoliv kožní reakce, informujte svého lékaře.
Porucha funkce jater. Příznaky jsou uvedeny v bodě 4.
Abnormality srdečního rytmu
Přípravek Quinsair může způsobovat změny srdečního rytmu, zvláště pokud užíváte jakékoliv léky na srdeční obtíže nebo nízké hladiny draslíku či hořčíku v krvi. Ženy, které užívají tyto typy léků, mají mnohem vyšší pravděpodobnost výskytu těchto obtíží. Pokud se během používání přípravku Quinsair objeví bušení srdce nebo nepravidelný srdeční rytmus, oznamte to ihned svému lékaři.
Záchvaty a křeče
Chinolonová antibiotika včetně přípravku Quinsair mohou způsobovat záchvaty nebo křeče (záchvaty ). Pokud se tak stane, přestaňte přípravek Quinsair používat a neprodleně vyhledejte svého lékaře.
Deprese nebo problémy s duševním zdravím Poškození nervů
Přípravek Quinsair může způsobovat periferní neuropatii (poškození nervů). Pokud se Vám v končetinách objeví bolest, pálení, mravenčení, necitlivost nebo slabost, zastavte používání přípravku Quinsair a ihned to oznamte svému lékaři.
Onemocnění způsobující svalovou slabost nebo únavu nazývané myasthenia gravis Zánět šlachy způsobující bolest, ztuhlost a/nebo otok kloubů (tendinitida)
Dýchací obtíže, které mohou sahat od mírných až po závažné (bronchospasmus)
Vykašlávání krve nebo krví zbarveného hlenu z dýchacích cest Deficience glukózo-6-fosfát-dehvdrogenázv
Chinolonová antibiotika, například přípravek Quinsair, mohou u pacientů způsobovat deficienci glukózo-6-fosfát-dehydrogenázy (vzácné dědičné onemocnění), která způsobuje náchylnost ke krevním komplikacím způsobujícím náhlé zvýšení tělesné teploty, zežloutnutí kůže a sliznic, tmavé zbarvení moče, bledost, unavenost, těžké rychlé dýchání a slabý rychlý pulz. Jestliže budete mít jakékoliv dotazy ohledně tohoto onemocnění, pohovořte si o tom se svým lékařem.
Cukrovka
Chinolonová antibiotika včetně přípravku Quinsair mohou způsobit buď příliš vysoké, nebo příliš nízké hladiny glukózy v krvi. Pokud jste diabetik/čka, je nutné, abyste pečlivě sledovali hladiny krevní glukózy.
Během léčby přípravkem Quinsair nebo po ní se u vás může objevit průjem. Jestliže půjde o závažný nebo přetrvávající průjem nebo zjistíte, že máte ve stolici krev, přestaňte okamžitě přípravek Quinsair používat a oznamte to svému lékaři. Neužívejte žádné léky na léčbu průjmu bez toho, že se o tom nejprve poradíte se svým lékařem.
Rezistence na antibiotika
Bakterie se mohou po určité době stát rezistentní na léčbu antibiotikem. To znamená, že přípravek Quinsair se nemá používat jako prevence plicních infekcí. Je nutné jej používat pouze k léčbě plicních infekcí způsobených Pseudomonas aeruginosa. Jestliže budete mít jakékoliv obavy nebo dotazy ohledně rezistence, pohovořte si o tom se svým lékařem.
- Superinfekce
Dlouhodobá léčba antibiotiky může někdy znamenat, že dostanete jinou infekci způsobenou bakteriemi, které nejsou antibiotikem ovlivněny (superinfekce). Jestliže budete mít jakékoliv obavy nebo dotazy ohledně superinfekce, pohovořte si o tom se svým lékařem.
- Zrakové problémy
Pokud během používání přípravku Quinsair zaznamenáte jakékoliv změny vidění nebo jakékoliv jiné problémy zraku, ihned kontaktujte očního lékaře.
- Fotosenzitivita
Přípravek Quinsair může zvýšit citlivost kůže na sluneční záření. Vyhýbejte dlouhodobé expozici slunečnímu záření nebo silnému slunečnímu světlu a nepoužívejte solárium ani jakékoliv jiné UV lampy v době, kdy používáte přípravek Quinsair a 48 hodin od ukončení léčby.
- Falešné výsledky testů
V době, kdy jste léčen(a) přípravkem Quinsair mohou některé testy (např. potvrzení tuberkulózy nebo vyšetření kvůli silnějším lékům proti bolesti) dávat falešné výsledky.
Děti a dospívající
Přípravek Quinsair se nemá podávat dětem a dospívajícím mladším 18 let, protože o jeho použití v této věkové skupině není dostatek informací.
Další léčivé přípravky a přípravek Quinsair
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Účinky těchto léků se mohou navzájem ovlivňovat s účinky přípravku Quinsair.
Obraťte se na svého lékaře, pokud budete užívat jakékoliv z následujících léčiv:
- Antagonisté vitamínu K jako například warfarin (používaný k zabránění srážení krve). Užívání těchto léčiv s přípravkem Quinsair může vést ke zvýšené krvácivosti. Lékař Vám možná bude muset provádět pravidelné krevní testy, aby zkontroloval, jak dobře se Vám může krev srážet.
- Theofylin (používaný k léčbě dýchacích obtíží) nebo nesteroidní protizánětlivá léčiva (NSAID), jako jsou fenbufen, kyselina acetylsalicylová (látka přítomná v moha léčivech, používaná k úlevě od bolesti a snížení horečky, dále jako prevence srážení krve) nebo ibuprofen. Používání přípravku Quinsair současně s těmito léčivy by u Vás mohlo zvýšit riziko záchvatů (křečí).
- Léčiva jako jsou probenecid (používaný jako prevence dny) nebo cimetidin (používaný k léčbě žaludečních vředů). Používání přípravku Quinsair současně s těmito léčivy by mohlo ovlivnit způsob, jak ledviny léčivo vylučují, což je zvláště důležité, pokud trpíte ledvinovými obtížemi.
- Cyklosporin (používaný po transplantaci orgánů) nebo léčiva, která ovlivňují srdeční rytmus (například antiarytmika, tricyklická antidepresiva, makrolidová antibiotika nebo antipsychotika. Přípravek Quinsair může ovlivnit účinky těchto léků. Lékař Vám vysvětlí více.
Těhotenství a kojení
Přípravek Quinsair se nesmí používat během těhotenství nebo kojení. Pokud jste těhotná, kojíte, nebo se domníváte, že těhotná můžete být, či plánujete-li otěhotnění, poraďte se se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Přípravek Quinsair Vám může způsobit závratě, únavu, slabost nebo způsobit problémy s viděním. Pokud k tomu dojde, neřiďte a neobsluhujte žádné přístroje nebo stroje.
Jak se přípravek Quinsair používá
3.
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Kolik přípravku mám použít?
Inhalujte obsah jedné ampulky (240 mg) dvakrát denně pomocí rozprašovacího systému Zirela.
Inhalace léčiva pomocí rozprašovače trvá přibližně 5 minut.
Kdy jej mám použít?
Inhalace přípravku Quinsair každý den ve stejnou dobu Vám pomůže zapamatovat si, kdy si máte své léčivo vzít. Léčivo inhalujte následovně:
- 1 ampulka ráno za použití rozprašovače Zirela
- 1 ampulka večer za použití rozprašovače Zirela Nejlepší je udržovat mezi dávkami interval 12 hodin.
Jak dlouho budu přípravek Quinsair používat?
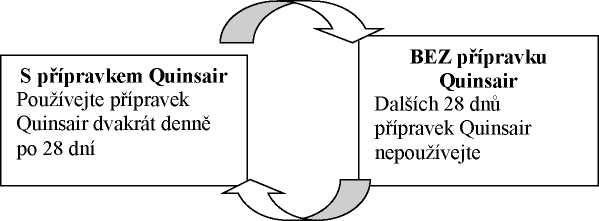
Používejte přípravek Quinsair každý den po dobu 28 dnů, pak si udělejte 28denní přestávku, během níž nebudete žádný přípravek Quinsair používat. Pak zahajte další léčebný cyklus.
Je důležité, abyste dodržoval(a) používání přípravku dvakrát denně během 28 dnů s léčbou a abyste dodržoval(a) cyklus 28 dnů léčby/28 dnů bez léčby tak dlouho, jak Vám lékař určí.
Opakujte
Jaké další léčivo Vám může lékař předepsat, pokud se objeví dýchací potíže při používání přípravku Quinsair?
Pokud budete trpět dýchacími obtížemi po používání přípravku Quinsair, lékař Vám může předepsat inhalátor obsahující bronchodilatační léčivo (přípravek rozšiřující průdušky, např. salbutamol). Inhalujte toto léčivo nejméně 15 minut nebo až 4 hodiny před další dávkou přípravku Quinsair.
Jak postupovat, pokud používám několik různých inhalátorů a jiné terapie cystické fibrózy?
Pokud používáte několik různých inhalačních léčebných postupů a jiné terapie cystické fibrózy, doporučuje se, abyste svá léčiva používali v následujícím pořadí:
1. bronchodilatancia
2. alfa dornáza
3. techniky zprůchodnění dýchacích cest
4. přípravek Quinsair
5. inhalační steroidy
Jak přípravek použít
Přípravek Quinsair je nutno používat inhalací pomocí rozprašovací sady Zirela (včetně aerosolové hlavice Zirela). Ten je zapotřebí připojit buď k regulátoru eBase, nebo rychlé řídicí jednotce eFlow.
Důležité informace, které potřebujete znát předtím, než začnete
- Každá ampulka je pouze pro jednorázové použití. Jakmile ampulku otevřete, obsah se musí neprodleně použít.
- Přípravek Quinsair nesmíte použít, pokud zjistíte, že sáček v uzavřené fólii nebo ampulky byly porušeny.
- Přípravek Quinsair nesmíte použít, pokud j e zakalený nebo j sou v roztoku částice.
- Nemíchejte přípravek Quinsair s žádnými jinými léčivy v rozprašovací sadě Zirela.
- Do rozprašovací sady Zirela nedávejte žádné jiné léčivé přípravky než přípravek Quinsair.
- Nepokoušejte se inhalovat přípravek Quinsair pomocí jakéhokoliv jiného typu rozprašovací sady.
- Před zahájením léčby zkontrolujte, zda rozprašovací systém Zirela funguje správně.
- Kapalinu v ampulce nepolykejte.
Pečlivě si přečtěte návod k použití od výrobce, který je dodáván s rozprašovací sadou Zirela.
Jak si připravím rozprašovací systém k inhalaci přípravku?
Uchovávejte návod k použití systému Zirela na bezpečném místě, protože uvádí veškeré podrobnosti o sestavení zařízení.
1) Dbejte na to, aby byla inhalační sada Zirela umístěna na plochém a stabilním povrchu.
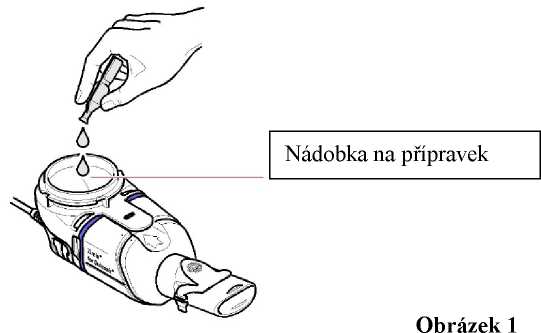
2) Vyprázdněte veškerý obsah jedné ampulky do nádobky na přípravek rozprašovací sady Zirela (obrázek 1). Ampulku musíte zcela vyprázdnit, jemně s ní poklepejte o boční stěnu nádobky, pokud to bude nutné.
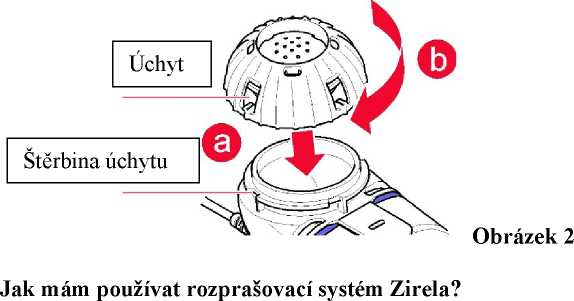
3) Uzavřete nádobku na léčivý přípravek vyrovnáním úchytů krytky přípravku a štěrbin na nádobce (a). Stlačte dolů a otočte krytkou ve směru hodinových ručiček tak daleko, jak to jen půjde (b, obrázek 2).
1) Při zahájení léčby seďte uvolněně a vzpřímeně.
2) Držte sadu ve vodorovné poloze, stiskněte a přidržte tlačítko zapnuto/vypnuto na regulátoru po několik sekund. Uslyšíte jedno „pípnutí“ a světelná kontrolka bude svítit zeleně.
3) Po několika sekundách začne aerosolová mlha proudit do aerosolové komory rozprašovací sady Zirela. Pokud mlha aerosolu proudit nezačne, pokyny naleznete v návodu k použití systému Zirela od výrobce.
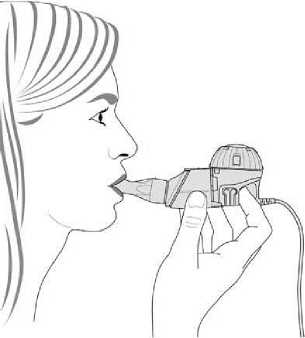
4) Udržujte sadu ve vodorovné poloze, vložte si náustek do úst a sevřete jej svými rty (obrázek 3).
Obrázek 3
5) Normálně dýchejte (vdechujte a vydechujte) přes náustek. Snažte se nedýchat nosem. Pokračujte v pohodlném nadechování a vydechování, dokud léčba neskončí. Inhalace přípravku pomocí rozprašovače trvá přibližně 5 minut.
6) Jakmile bude podán veškerý přípravek, uslyšíte dvě „pípnutí“, což znamená, že léčba byla dokončena.
7) Jakmile skončíte, otevřete krytku přípravku, abyste se přesvědčil(a), že byl spotřebován veškerý přípravek. Několik kapek přípravku může na konci léčby zůstat na dně nádobky. To je v pořádku. Pokud zde ale zůstane více než několik kapek, vraťte uzávěr přípravku zpět a znovu zahajte léčbu.
8) Jakmile bude léčba dokončena, odpojte regulátor a rozeberte rozprašovací sadu Zirela pro čištění a dezinfekci. Návod k použití výrobce poskytne všechny podrobnosti o čištění a dezinfekci.
Jak postupovat, pokud budu muset zastavit svoji léčbu před jejím dokončením??
Pokud budete muset z jakéhokoliv důvodu zastavit léčbu před jejím dokončením, stiskněte a přidržte na jednu sekundu tlačítko zapnuto/vypnuto na regulátoru. Po dokončení léčby se sám vypne a když budete připraveni znovu začít, stiskněte a přidržte opět na jednu sekundu tlačítko zapnout/vypnout. Léčba se zahájí znovu. Musíte vdechovat a vydechovat náustkem jako předtím.
Jak a kdy vyměním rozprašovací sadu Zirela?
Jedna rozprašovací sada se má použít pro jeden 28denní léčebný cyklus. Pokyny pro čištění a uchovávání zařízení naleznete v návodu k použití od výrobce.
Jestliže jste použil(a) více přípravku Quinsair, než jste měl(a)
Jestliže jste použil(a) více přípravku Quinsair, než jste měl(a), oznamte to co nejdříve svému lékaři. Pokud obsah ampulky spolknete, nemějte obavy, ale oznamte to co nejdříve svému lékaři.
Jestliže jste zapomněl(a) použít přípravek Quinsair
Jestliže jste na dávku zapomněl(a), použijte sadu co nejdříve, jak si vzpomenete, dokud zbývá 8hodinový interval před inhalací další dávky. Pokud však již bude téměř čas na Vaši další dávku, vynechanou dávku vynechejte.
Neinhalujte obsah více než jedné ampulky, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek Quinsair
Nepřestávejte používat přípravek Quinsair, aniž byste o tom nejprve hovořil(a) se svým lékařem, protože plicní infekce se může zhoršit.
Máte-li jakékoliv další otázky k používání tohoto léčivého přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Některé nežádoucí účinky mohou být závažné
Pokud si povšimnete závažné alergické reakce po inhalaci přípravku Quinsair, vyhledejte neprodleně neodkladnou lékařskou pomoc. Příznaky zahrnují:
- Celkové svědění a pocit tepla - zvláště postihující vlasovou část hlavy, ústa, hrdlo, dlaně nebo plosky chodidel
- Závažná sípání či hlučné nebo obtížné dýchání
- Závažná kopřivka/urtikárie
- Otok v oblasti rtů, obličeje, hrdla nebo jazyka
- Bledá nebo našedlá barva kůže
- Rychlý srdeční tep
- Mdloba nebo ztráta vědomí
Zastavte používání přípravku Quinsair a neprodleně oznamte svému lékaři:
- Jestliže zaznamenáte bolest, ztuhlost a/nebo otok kloubů
- Jestliže se objeví problémy s játry. Příznaky zahrnují:
- Ztrátu chuti k jídlu
- Zežloutnutí kůže a očí (žloutenka)
- Tmavou barvu moči
- Svědění
- Napětí (bolest) v oblasti žaludku (břicha)
Ostatní nežádoucí účinky mohou zahrnovat:
Velmi časté: mohou postihnout více než 1 pacienta z 10
- Kašel
- Abnormální vnímání chuti
- Unavenost, slabost a nižší tolerance vůči fyzické námaze
- Ztráta chuti k j ídlu a úbytek tělesné hmotnosti
- Dušnost
- Změny množství a hustoty hlenu
- Vykašlávání krve
- Snížené množství vzduchu, která lze vydechnout za jednu sekundu (snížení hodnoty testu FEVi)
Časté: mohou postihnout až 1 pacienta a z 10
- Kvasinková infekce v oblasti pochvy
- Nespavost nebo obtíže se spánkem
- Bolest hlavy
- Závratě
- Ušní šelest (tinnitus)
- Změna hlasu
- Pocit na zvracení a zvracení
- Bolesti v břišní krajině
- Průjem
- Zácpa
- Vyrážka
- Bolesti kloubů nebo svalů
- Horečka
- Abnormální výsledky vyšetření krve (zvýšené hladiny určitých jaterních enzymů nebo
bilirubinu v krvi a snížené výsledky testu funkce ledvin)
- Snížení hodnot výsledků testu funkce plic
- Zvýšené nebo snížené množství cukru (glukózy) v krvi
- Abnormální poslechové dechové fenomény
Méně časté: mohou postihnout až 1 pacientk zE 100
- Kvasinková infekce v ústech
- Nízký počet červených krvinek v krvi (anémie) nebo krevních destiček (které napomáhají srážení krve)
- Nízký nebo zvýšený počet bílých krvinek v krvi
- Pocit úzkosti, neklid či agitovanost a/nebo deprese
- Snížené čichové vnímání
- Pocit ospalosti
- Změny vidění
- Ztráta sluchu
- Zrychlený srdeční puls
- Dýchací obtíže
- Říhání
- Zažívací potíže
- Plynatost
- Kopřivka/urtikárie a svědění
- Bolest hrudní stěny
- Selhání ledvin
- Změny srdečního rytmu
Dále byly po užívání tablet nebo po podání intravenózní infuze levofloxacinu pozorovány následující nežádoucí účinky, které se tedy mohou objevit po použití přípravku Quinsair:
Méně časté: mohou se vyskytnout až u 1 pacienta ze 100
- Zmatenost nebo nervozita
- Třes
- Závratě nebo točení hlavy (vertigo)
- Nadměrné pocení
Vzácné: mohou se vyskytnout až u 1 pacientay z 1000
- Halucinace a/nebo patologická podezíravost
- Podrážděnost
- Nezvyklé sny nebo noční můry
- Křeče (záchvaty)
- Pocity píchání (jako špendlíky a jehlami) a/nebo necitlivost
- Bušení srdce
- Nízký krevní tlak
- Svalová slabost
Není známo: četnost nelze z dostupných údajů odhadnout
- Nízký počet všech typů krevních buněk v krvi
- Diabetické kóma
- Závažné psychické potíže (které mohou ve velmi vzácných případech vést k sebepoškození)
- Bolest, pálení, píchání, necitlivost a/nebo slabost v končetinách (neuropatie)
- Mimovolní svalové pohyby, záškuby nebo křeče
- Mdloby
- Silné pulzující bolesti hlavy se ztrátou zraku
- Dočasná ztráta zraku
- Zrychlený nebo abnormální srdeční tep
- Zánět plic
- Závažné kožní reakce jako jsou bolestivé puchýře nebo poškození v oblasti úst, nosu nebo pochvy
- Zvýšená citlivost kůže na sluneční nebo UV záření (solárium nebo UV lampy)
- Zánět krevních cév
- Zánět v oblasti úst nebo rtů
- Rychlý rozpad svalů
- Zánět šlach nebo přetržení šlach
- Bolesti v oblasti zad, hrudníku, horních a dolních končetin.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoliv nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Quinsair uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti vyznačené na ampulce, sáčku ve fólii a krabičkách za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Každá ampulka je pouze pro jednorázové použití. Jakmile se ampulka otevře, obsah se musí neprodleně použít. Jakýkoliv nepoužitý přípravek musí být zlikvidován. Vraťte jakékoliv nepoužité, neotevřené ampulky z pásku zpět do sáčku, aby byly chráněny před světlem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Tento přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Quinsair obsahuje
- Léčivou látkou je levofloxacinum. Jedna ampulka obsahuje levofloxacinum hemihydricum v množství odpovídajícím levofloxacinum 240 mg.
- Pomocným látkami jsou hexahydrát chloridu hořečnatého a voda na injekci.
Jak přípravek Quinsair vypadá a co obsahuje toto balení
Přípravek Quinsair je čirý, světležlutý roztok k rozprašování.
Přípravek je dodáván v malých 3ml plastových ampulkách. V sáčku ve fólii jsou uzavřeny čtyři ampulky a jedna krabička obsahuje 14 sáčků.
Jedno 28denní balení přípravku Quinsair obsahuje jednu krabičku s 56 ampulkami (14 sáčků po 4 ) a jednu krabičku obsahující rozprašovací sadu Zirela s návodem k použití od výrobce.
Ampulka je označena pouze v angličtině. Informace uvedené na ampulce jsou tyto:
Na přední straně krčku ampulky
Quinsair 240 mg Roztok k rozprašování.
Levofloxacin
Inhalační podání 2,4 ml
V oblasti „zvlnění“ na obou stranách krčku ampulky
LOT (č.š.:)
EXP (Použitelné do)
Držitel rozhodnutí o registraci
Raptor Pharmaceuticals Europe B.V.
Naritaweg 165
1043 BW Amsterdam
Nizozemsko
Výrobce
Adare Pharmaceuticals S.r.l.
Via Martin Luther King, 13 20060 Pessano con Bornago (MI)
Itálie
Další informace o tomto přípravku získáte u držitele rozhodnutí o registraci.
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu. Jsou zde rovněž odkazy na jiné webové stránky o vzácných onemocněních a léčbách.
40