Priorix Inj. Stříkačka
sp. zn. sukls167840/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Priorix inj. stříkačka - prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce Živá atenuovaná vakcína proti spalničkám, příušnicím a zarděnkám
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 dávka rekonstituované vakcíny (0,5 ml) obsahuje:
Morbillorum virus attenuatum1 (kmen Schwarz) ne méně než 1030 CCID503
Parotitidis virus attenuatum1 (kmen RIT 4385, odvozený od ne méně než 103,7 CCID503
kmene Jeryl Lynn)
Rubeolae virus attenuatum2 (kmen Wistar RA 27/3) ne méně než 1030 CCID503
1 pomnoženo na buňkách kuřecích embryí
2 pomnoženo na lidských diploidních buňkách (MRC-5)
3 50% infekční dávka tkáňové kultury
Vakcína obsahuje stopové množství neomycinu, viz bod 4.3.
Pomocné látky se známým účinkem:
Vakcína obsahuje 9 mg sorbitolu, viz bod 4.4.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce.
Lyofilizovaný komponent vakcíny proti spalničkám, příušnicím a zarděnkám je bělavý až světle růžový prášek. Rozpouštědlo je čirý a bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Priorix inj. stříkačka je určen k aktivní imunizaci dětí od věku 9 měsíců nebo starších, dospívajících a dospělých proti příušnicím, spalničkám a zarděnkám.
Pro očkování dětí ve věku mezi 9 a 12 měsíci, viz body 4.2, 4.4 a 5.1.
4.2 Dávkování a způsob podání
Dávkování
Očkování vakcínou Priorix inj. stříkačka se má provádět na základě oficiálních doporučení.
Děti od věku 12 měsíců nebo starší
Dávka je 0,5 ml. Druhá dávka se má podat podle oficiálního doporučení.
Priorix inj. stříkačka může být podán jedincům, kteří již dříve byli očkováni jinou monovalentní nebo kombinovanou vakcínou proti spalničkám, příušnicím a zarděnkám.
Kojenci ve věku mezi 9 a 12 měsíci
Odpověď kojenců očkovaných v prvním roce života nemusí být dostatečná na všechny složky vakcíny. V případě, že epidemiologická situace vyžaduje očkování kojenců v jejich prvním roce života (např. vypuknutí epidemie nebo cestování do endemických oblastí), doporučuje se podat druhou dávku vakcíny Priorix inj. stříkačka ve druhém roce života, přednostně během tří měsíců po první dávce. Za podmínek, že interval mezi oběma dávkami nebude kratší než čtyři týdny (viz body 4.4 a 5.1).
Kojenci ve věku méně než 9 měsíců věku
Bezpečnost a účinnost vakcíny Priorix inj. stříkačka u dětí mladších 9 měsíců nebyla stanovena. Způsob podání
Priorix inj. stříkačka se podává subkutánně, může se však podat též intramuskulárně (viz body 4.4 a 5.1).
Pacientům s trombocytopenií nebo s poruchami krevní srážlivosti je lépe vakcínu podat subkutánně (viz bod 4.4).
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na neomycin. Výskyt kontaktní dermatitidy po neomycinu v anamnéze však není kontraindikací. Hypersenzitivní reakce na vaječnou bílkovinu, viz bod 4.4.
Závažná humorální nebo buněčná (primární nebo získaná) imunodeficience, např. závažné kombinované imunodeficience, agamaglobulinemie a AIDS nebo symptomatická HIV infekce nebo věkově specifický procentuální podíl CD4+ T-lymfocytů u dětí mladších 12 měsíců: CD4+ < 25 %; u dětí mezi 12 - 35 měsíci: CD4+ < 20 %; u dětí mezi 36 - 59 měsíci: CD4+ < 15 % (viz bod 4.4).
Těhotenství. Ženám, které plánují těhotenství, by se mělo doporučit oddálení otěhotnění o 1 měsíc po očkování (viz bod 4.6).
Podobně jako u jiných vakcín musí být aplikace vakcíny Priorix inj. stříkačka odložena v případě závažného akutního horečnatého onemocnění. Přítomnost slabé infekce, jako nachlazení, však není důvodem k odložení očkování.
4.4 Zvláštní upozornění a opatření pro použití
Stejně jako u všech injekčních vakcín musí být i po aplikaci této vakcíny pro vzácný případ rozvoje anafylaktické reakce okamžitě k dispozici odpovídající lékařská péče a dohled.
Před aplikací vakcíny je nutné vyčkat, až se alkohol nebo jiná antiseptika použitá k dezinfekci místa vpichu odpaří z kůže, aby nedošlo k inaktivaci atenuovaných virů obsažených ve vakcíně.
U dětí očkovaných v prvním roce života nemusí dojít k odpovídající imunitní odpovědi vůči komponentám vakcíny, protože u nich přetrvávají mateřské protilátky (viz body 4.2 a 5.1).
Priorix inj. stříkačka se má podávat s opatrností osobám s onemocněním centrálního nervového systému (CNS), náchylným k febrilním křečím nebo osobám, u nichž jsou v rodinné anamnéze uvedeny křeče. Očkovaný jedinec s anamnézou febrilních křečí se musí pečlivě sledovat.
Viry spalniček a příušnic se získávají reprodukcí na kulturách buněk kuřecích embryí a mohou obsahovat stopy vaječných bílkovin. U jedinců, kteří mají v anamnéze výskyt anafylaktických, anafylaktoidních nebo jiných bezprostředních reakcí (například generalizovaný výskyt kopřivky, otok úst a krku, potíže s dýcháním, hypotenzi nebo šok) následujících po konzumaci vajíčka, může být po očkování zvýšené riziko výskytu bezprostředních reakcí z přecitlivělosti, i když k těmto typům reakcí dochází velmi vzácně. Jedinci, u nichž došlo po konzumaci vajíčka k anafylaktické reakci, musí být očkováni s výjimečnou opatrností a lékař musí mít k dispozici prostředky ke zvládnutí anafylaxe, pokud by k ní došlo.
Pacientům se vzácnou vrozenou fruktózovou intolerancí se Priorix inj. stříkačka nemá podávat, jelikož obsahuje sorbitol.
Při očkování do 72 hodin po expozici spalničkám byla pozorována limitovaná ochrana proti spalničkám.
Zvláště u dospívajících se může objevit v průběhu očkování, nebo i před ním synkopa (mdloba) jako psychogenní reakce na injekční stříkačku s jehlou. Synkopa může být během zotavování doprovázena různými neurologickými příznaky, jako jsou přechodné poruchy zraku, parestézie a tonicko-klonické křeče končetin. Je důležité předem zajistit, aby při eventuální mdlobě nemohlo dojít k úrazu.
Tak jako u každé jiné vakcíny, protektivní imunitní odpovědi nemusí být dosaženo u všech očkovaných.
PRIORIX NESMÍ BÝT V ŽÁDNÉM PŘÍPADĚ PODÁN INTRAVASKULÁRNĚ.
T rombocytopenie
Po očkování živými vakcínami proti příušnicím, spalničkám a zarděnkám byly hlášeny případy zhoršení trombocytopenie a případy rekurence trombocytopenie u osob, u kterých došlo k výskytu trombocytopenie po první dávce těchto vakcín. Vznik trombocytopenie v souvislosti s očkováním proti spalničkám, příušnicím a zarděnkám je vzácný a trombocytopenie obecně spontánně ustoupí.
U pacientů s trombocytopenií, nebo s trombocytopenií v anamnéze po očkování proti spalničkám, příušnicím a zarděnkám je třeba riziko a přínos očkování vakcínou Priorix inj. stříkačka velmi pečlivě posoudit. Tito pacienti by měli být očkováni s opatrností a přednostně subkutánní cestou.
Imunokompromitovaní pacienti
U pacientů s vybranými imunodeficiencemi je třeba očkování zvážit tak, aby přínos převážil nad rizikem (např. jedinci HIV asymptomatičtí, s deficitem podtřídy IgG, vrozenou neutropenií, chronickou granulomatozou a s onemocněním při nedostatku komplementu).
Imunokompromitovaní pacienti, u kterých není kontraindikace k podání této vakcíny (viz bod 4.3), nemusí na očkování odpovědět tak dobře, jako imunokompetentní pacienti. Proto někteří z těchto pacientů v případě kontaktu mohou onemocnět příušnicemi, spalničkami nebo zarděnkami, navzdory očkování. Tito pacienti musí být pečlivě sledováni na přítomnost příznaků příušnic, spalniček a zarděnek.
Přenos vakcinálních virů
Přenos infekce spalniček a příušnic z očkovaných jedinců na vnímavé osoby nebyl zaznamenán. Je známo, že mezi 7. až 28. dnem po očkování dochází k faryngeální exkreci viru zarděnek a viru spalniček s maximem okolo 11. dne. Dosud však nebyla zaznamenána nákaza zarděnkami a spalničkami, která by byla způsobená takto vylučovaným virem. Přenos viru zarděnek na kojence mateřským mlékem i transplacentární cestou byl zaznamenán, aniž by došlo ke klinickému onemocnění.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Vakcínu Priorix inj. stříkačka lze současně aplikovat (ale do různých míst) s jakoukoli z následujících monovalentních nebo kombinovaných vakcín [včetně hexavalentních vakcín (DTPa-HBV-IPV/Hib)]: vakcínou proti difterii, tetanu a pertusi (acelulární komponenta) (DTPa), vakcínou proti Haemophilus influenzae typu b (Hib), inaktivovanou vakcínou proti poliomyelitidě (IPV), vakcínou proti hepatitidě B (HBV), vakcínou proti hepatitidě A (HAV), konjugovanou vakcínou proti meningokokům skupiny C (MenC), vakcínou proti varicella zoster (VZV), perorální vakcínou proti poliomyelitidě (OPV) a konjugovanou 10valentní pneumokokovou vakcínou, v souladu s místním doporučením.
Pokud se nepodávají vakcíny současně, doporučuje se, aby rozmezí mezi podáním vakcíny Priorix inj. stříkačka a dalších živých atenuovaných vakcín bylo alespoň jeden měsíc.
Nejsou žádné údaje, které by podporovaly podávání vakcíny Priorix inj. stříkačka s jinými vakcínami.
V případě, že se očkovaný jedinec má podrobit tuberkulinovému testu, měl by se test provést před nebo současně s očkováním, protože živý virus spalniček, příušnic a zarděnek může způsobit dočasný pokles citlivosti kožního tuberkulinového testu. Dočasné snížení citlivosti trvá maximálně 6 týdnů, po tuto dobu se nemá tuberkulinový test provádět, protože by se mohly získat falešné negativní výsledky.
Očkování jedinců, kterým byla podána krevní transfúze nebo lidské gamaglobuliny, by se mělo odložit o 3 měsíce, nebo déle (až o 11 měsíců) v závislosti na dávce podaného lidského globulinu, protože příjmem protilátek proti příušnicím, spalničkám a zarděnkám se zvyšuje pravděpodobnost selhání očkování.
4.6 Fertilita, těhotenství a kojení
Fertilita
Vakcína Priorix inj. stříkačka nebyla zahrnuta do studií fertility. Těhotenství
Těhotné ženy nemají být očkovány vakcínou Priorix inj. stříkačka.
Avšak u žen, které byly očkovány v období těhotenství, kdy o něm nevěděly, po aplikaci vakcíny proti spalničkám, příušnicím nebo zarděnkám nebylo pozorováno poškození plodu.
I když teoreticky riziko není možné vyloučit, nejsou hlášeny případy vrozeného zarděnkového syndromu u více než 3 500 vnímavých žen, které byly neplánovaně očkovány vakcínami proti zarděnkám v raném stadiu těhotenství. Proto, neúmyslné očkování vakcínou proti spalničkám, příušnicím nebo zarděnkám žen, které o těhotenství ještě neví, by nemělo být důvodem k ukončení těhotenství.
Po dobu 1 měsíce po očkování je třeba se vyhnout otěhotnění. Ženám, které těhotenství plánují, by se mělo doporučit oddálení otěhotnění.
Kojení
Odpovídající data o použití vakcíny Priorix inj. stříkačka během kojení jsou omezené. Klinické studie ukázaly, že kojící ženy po porodu očkované živou atenuovanou vakcínou proti zarděnkám mohou vylučovat virus do mateřského mléka, který přechází na kojené dítě, aniž by došlo k zjevným příznakům onemocnění. Pouze v případě, že je u dítěte potvrzeno nebo je podezření, že došlo k poruše imunity, mělo by být riziko a přínos očkování matky vyhodnoceno (viz bod 4.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Priorix inj. stříkačka nemá žádný nebo jen zanedbatelný vliv na řízení motorových vozidel a obsluhu strojů.
4.8 Nežádoucí účinky Přehled bezpečnostního profilu
Bezpečnostní profil uváděný dále je podložen daty získanými v klinických studiích, v nichž bylo více než 12 000 jedinců očkováno vakcínou Priorix inj. stříkačka.
Nežádoucí účinky, které se mohou vyskytnout po podání kombinované vakcíny proti spalničkám, příušnicím a zarděnkám odpovídají nežádoucím účinkům, které byly pozorovány po podání monovalentních vakcín samotných nebo v kombinaci.
V kontrolovaných klinických studiích byly aktivně monitorovány příznaky a symptomy, které se vyskytly až do 42 dní po očkování. Očkovaní jedinci byli požádáni, aby během této doby hlásili jakoukoli klinickou příhodu.
Nejčastějšími nežádoucími účinky při očkování vakcínou Priorix inj. stříkačka byly zarudnutí v místě podání injekce a horečka > 38 °C (měřeno rektálně), nebo > 37,5 °C (měřeno axilárně/perorálně).
Výčet nežádoucích účinků
Hlášené nežádoucí účinky jsou seřazeny podle četnosti výskytu: Velmi časté (> 1/10)
Časté (> 1/100 až < 1/10)
Méně časté (> 1/1 000 až < 1/100)
Vzácné (>1/10 000 až < 1/1 000)
Klinické studie
Infekce a infestace:
Časté: infekce horních cest dýchacích; Méně časté: otitis media.
Poruchy krve a lymfatického systému: Méně časté: lymfadenopatie.
Poruchy imunitního systému:
Vzácné: alergické reakce.
Poruchy metabolismu a výživy:
Méně časté: anorexie.
Psychiatrické poruchy:
Méně časté: nervozita, abnormální pláč, nespavost.
Poruchy nervového systému:
Vzácné: febrilní křeče.
Poruchy oka:
Méně časté: konjunktivitida.
Respirační, hrudní a mediastinální poruchy:
Méně časté: bronchitida, kašel.
Gastrointestinální poruchy:
Méně časté: otok příušní žlázy, průjem, zvracení.
Poruchy kůže a podkožní tkáně:
Časté: vyrážka.
Celkové poruchy a reakce v místě aplikace:
Velmi časté: zarudnutí v místě vpichu injekce, horečka > 38 °C (měřeno rektálně) nebo > 37,5 °C (měřeno axilárně/perorálně).
Časté: bolest a otok v místě vpichu injekce, horečka > 39,5 °C (měřeno rektálně) nebo > 39 °C (měřeno axilárně/perorálně).
Obecně četnost výskytu nežádoucích účinků byla po podání první a druhé dávky vakcíny podobná. Výjimkou byla jen bolest v místě vpichu vakcíny, která se vyskytovala „Často“ po první dávce vakcíny, zatímco po druhé dávce se vyskytovala „Velmi často“
Postmarketingové sledování
V průběhu postmarketingového sledování byly ve vzácných případech identifikovány následující nežádoucí účinky. Vzhledem k tomu, že jsou údaje dobrovolně hlášeny populací neznámé velikosti, není možné poskytnout skutečný odhad četnosti výskytu nežádoucích účinků.
Infekce a infestace:
Meningitida, příznaky připomínající spalničky, příznaky připomínající příušnice (včetně orchitidy, epididymitidy a parotitidy).
Poruchy krve a lymfatického systému:
Trombocytopenie, trombocytopenická purpura.
Poruchy imunitního systému:
Anafylaktické reakce.
Poruchy nervového systému:
Encefalitida*, cerebelitida, příznaky podobné cerebelitidě (včetně přechodné poruchy chůze a přechodné ataxie), Guillain Barréův syndrom, transverzální myelitida, periferní neuritida.
Cévní poruchy Vaskulitidy.
Poruchy kůže a podkožní tkáně:
Erythema multiforme.
Poruchy svalové a kosterní soustavy a pojivové tkáně:
Artralgie, artritida.
* Výskyt encefalitidy byl hlášen s frekvencí menší než 1 na 10 milionů dávek vakcíny. Riziko vzniku encefalitidy po podání vakcíny je daleko nižší než riziko encefalitidy způsobené infekcí přírodními viry (viry spalniček: 1 na 1 000 až 2 000 případů; viry příušnic: 2 - 4 na 1 000 případů; viry zarděnek: přibližně 1 na 6 000 případů).
Náhodná intravaskulární aplikace může vést k velmi vážným reakcím či dokonce k šoku. Bezprostřední opatření záleží na vážnosti reakce (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Během postmarketingového sledování bezpečnosti vakcíny byly hlášeny případy předávkování (podání až dvojnásobné dávky). Po předávkování nebyly hlášeny žádné nežádoucí účinky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: virové vakcíny.
ATC kód: J07BD52.
Imunitní odpověď u dětí ve věku 12 měsíců a starších
V klinických studiích u dětí od 12 měsíců do 2 let věku bylo prokázáno, že vakcína Priorix inj. stříkačka je vysoce imunogenní.
Při očkování séronegativních jedinců byly při očkování jednou dávkou vakcíny Priorix inj. stříkačka protilátky proti spalničkám u 98,1 %, protilátky proti příušnicím u 94,4 % a protilátky proti zarděnkám u 100 % očkovaných.
Dva roky po základním očkování došlo k sérokonverzi proti spalničkám u 93,4 % očkovaných jedinců, proti příušnicím u 94,4 % očkovaných jedinců a u 100 % očkovaných jedinců proti zarděnkám.
Ačkoliv nejsou dostupná data týkající se protektivního účinku vakcíny Priorix inj. stříkačka, imunogenicita je přijímána jako projev protektivní účinnosti. Avšak některé studie ukazují, že účinnost proti příušnicím může být nižší, než byla pozorovaná sérokonverze u příušnic.
Imunitní odpověď u dětí ve věku od 9 do 10 měsíců
Klinická studie zahrnovala 300 zdravých kojenců ve věku od 9 do 10 měsíců v době první dávky vakcíny. Z toho 147 jedinců obdrželo současně vakcínu Priorix inj. stříkačka a Varilrix. Dosažená sérokonverze po očkování proti spalničkám byla 92,6%, po očkování proti příušnicím byla 91,5% a po očkování proti zarděnkám byla 100%. Sérokonverze hlášená po druhé dávce podané 3 měsíce po první dávce byla 100% po očkování proti spalničkám a 99,2% po očkování proti příušnicím. K dosažení optimální imunitní odpovědi by druhá dávka vakcíny Priorix inj. stříkačka měla být podána do 3 měsíců po první dávce.
Dospívající a dospělí
Bezpečnost a imunogenicita vakcíny Priorix inj. stříkačka u dospívajících a dospělých nebyly v klinických studiích sledovány.
Intramuskulámí podání
V klinických studiích omezený počet jedinců obdržel vakcínu Priorix inj. stříkačka intramuskulárně. Míry sérokonverze u třech složek vakcíny byly srovnatelné s těmi, které byly pozorovány po subkutánním podání.
5.2 Farmakokinetické vlastnosti
Vyhodnocení farmakokinetických vlastností vakcín se nevyžaduje.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě studií toxicity po opakovaném podávání na zvířatech neodhalily žádnou lokální nebo systémovou toxicitu vakcíny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek
aminokyseliny, laktosa (bezvodá), mannitol,, sorbitol.
Rozpouštědlo voda na injekci.
6.2 Inkompatibility
Vzhledem k tomu, že nejsou k dispozici studie zabývající se kompatibilitou, nesmí být tato vakcína míchána s jinými vakcínami v jedné injekční stříkačce.
6.3 Doba použitelnosti
2 roky.
Vakcína se má aplikovat ihned po rekonstituci. Pokud to není možné, musí se rekonstituovaná vakcína uchovávat při 2 °C - 8 °C a použít nejdéle do 8 hodin.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte a převážejte chlazené (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Lyofilizát je ve skleněné lahvičce (sklo typu I) opatřené pryžovou zátkou.
0,5 ml rozpouštědla v předplněné injekční stříkačce (sklo typu I) s pryžovým pístem v balení s nebo bez jehel v následujících velikostech balení:
- s 1 samostatnou jehlou: v balení po 20 nebo 40;
- se 2 samostatnými jehlami: v balení po 1, 10, 25 nebo 100;
- bez jehel: v balení po 1, 10, 20, 25, 40 nebo 100.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rozpouštědlo i rekonstituovaná vakcína musí být před použitím opticky zkontrolovány na přítomnost cizorodých částic a na změnu vzhledu. Jestliže vzhledem nevyhovují, je nutné rozpouštědlo nebo rekonstituovanou vakcínu vyřadit.
Vakcína musí být rekonstituována přidáním plného obsahu rozpouštědla z předplněné injekční stříkačky do lahvičky s práškem.
Připojení jehly k injekční stříkačce viz níže přiložený popis.
Injekční stříkačka dodávaná s vakcínou Priorix inj. stříkačka však může být lehce odlišná (bez šroubovacího závitu) od injekční stříkačky popsané na obrázku.
V tomto případě by měla být jehla připevněna bez šroubování.
Jehla
Krytjehly
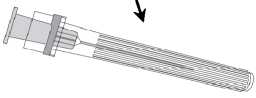
Stříkačka

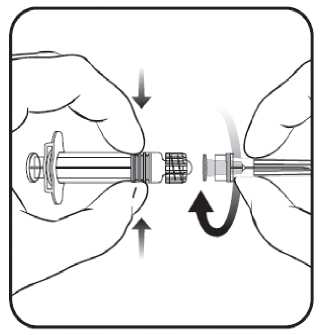
1. V jedné ruce držte tělo stříkačky (aniž byste ji drželi za píst) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
2. Jehlu ke stříkačce připevníte tak, že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne (viz obrázek).
3. Pak odstraňte ochranný kryt jehly, což může jít někdy poněkud ztuha.
Přidejte rozpouštědlo k prášku. Po přidání rozpouštědla k prášku směs protřepávejte, dokud se všechen prášek úplně nerozpustí v rozpouštědle.
Barva rozpuštěné vakcíny se pohybuje od jasně broskvové do fialově červené, závisí na možné variabilitě pH a nemá vliv na kvalitu vakcíny.
Celý obsah lahvičky se vyprázdní a aplikuje.
K podání vakcíny je nutné použít novou jehlu.
Je nutné se vyhnout kontaktu s dezinfekčním prostředkem (viz bod 4.4).
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals S.A., rue de l’Institut 89,
1330 Rixensart, Belgie.
8. REGISTRAČNÍ ČÍSLO(A)
59/739/99-A/C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 3.11.1999
Datum posledního prodloužení registrace: 25.5.2013
10. DATUM REVIZE TEXTU
15.6.2015
10