Pheburane 483 Mg/G
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
PHEBURANE 483 mg/g granule.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden gram granulí obsahuje natrii phenylbutyras 483 mg.
Pomocná látka/Pomocné látky se známým účinkem:
Jeden gram granulí natrium-fenylburytátu obsahuje 124 mg (5,4 mmol) sodíku a 768 mg sacharózy. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Granule.
Bílé až téměř bílé granule.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
PHEBURANE je indikován jako pomocná léčba v průběhu chronické terapie poruch metabolismu močoviny, zahrnujících deficit karbamoylfosfátsyntetázy, ornitin-karbamoyltransferázy nebo argininosukcinátsyntetázy.
Je indikován u všech pacientů s časnou/neonatální formou tohoto onemocnění (kompletním deficitem enzymu, objevujícím se v průběhu prvních 28 dnů života). Je také indikován u pacientů s pozdní formou tohoto onemocnění (částečným deficitem enzymu, který se objevuje po prvním měsíci života), kteří mají v anamnéze hyperamonemickou encefalopatii.
4.2 Dávkování a způsob podání
Léčba přípravkem PHEBURANE by měla být prováděna pod dohledem lékaře, který má zkušenosti s léčbou poruch metabolismu močoviny.
Dávkování
Denní dávka by měla být upravena podle individuálních potřeb na základě tolerance bílkovin a takového denního příjmu bílkovin v potravě, který je nutný pro podporu růstu a vývoje.
Obvyklá celková denní dávka natrium-fenylbutyrátu v klinické praxi je:
• 450 - 600 mg/kg/den u novorozenců, kojenců a dětí s tělesnou hmotností do 20 kg,
• 9,9 - 13,0 g/m2/den u dětí s tělesnou hmotností vyšší než 20 kg, dospívajících a dospělých.
Bezpečnost a účinnost dávek nad 20 g/den nebyla stanovena.
Monitorování léčby
Plazmatické hladiny amoniaku, argininu, esenciálních aminokyselin (zejména aminokyselin s rozvětveným řetězcem), karnitinu a sérových proteinů by měly být udržovány v normálním rozmezí. Hladina glutaminu v plazmě by měla být udržována na hladinách pod 1 000 pmol/l.
Péče o výživu
Přípravek PHEBURANE musí být užíván v kombinaci s omezením příjmu bílkovin ve stravě, a v některých případech i se suplementací esenciálních aminokyselin a kamitinu.
Suplementace citrulinem a argininem je nutná u pacientů s diagnózou neonatální formy deficitu karbamoylfosfátsyntetázy nebo omitin-karbamoyltransferázy v dávkách 0,17 g/kg/den nebo 3,8 g/m2/den.
Suplementace argininem je nutná u pacientů s diagnózou deficitu argininosukcinátsyntetázy v dávkách 0,4 - 0,7 g/kg/den nebo 8,8 - 15,4 g/m2/den.
Je-li indikována nízkokalorická suplementace, je doporučován produkt neobsahující bílkoviny.
Speciální populace
Insuficience ledvin a _jater
Vzhledem k tomu, že játra a ledviny se podílí na metabolismu a vylučování natrium-fenylbutyrátu, měli by pacienti se sníženou funkcí jater a ledvin užívat přípravek PHEBURANE s opatrností.
Způsob podání
Přípravek PHEBURANE se podává perorálně. Protože se přípravek PHEBURANE rozpouští pomalu, neměl by být podáván nazogastrickou sondou nebo gastrostomickou kanylou.
Celková denní dávka by měla být rozdělena na stejné dávky, které se podávají s každým jídlem nebo při každém krmení (např. u malých dětí 4-6krát za den). Granule se polykají přímo a zapíjejí se nápojem (vodou, ovocnými džusy, umělým mlékem pro kojence neobsahujícím proteiny) nebo mohou být nasypány na lžičku pevné stravy (šťouchaných brambor nebo jablečného pyré), v tom případě je důležité spolknout je okamžitě, aby se zachovalo zastření chuti.
Dodávána je kalibrovaná odměrná lžička se stupnicí po 250 mg, která umožňuje dávkování až do 3 g natrium-fenylbutyrátu.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1,
• těhotenství,
• kojení.
4.4 Zvláštní upozornění a opatření pro použití
Obsah klinicky významných elektrolytů
• Přípravek PHEBURANE obsahuje 124 mg (5,4 mmol) sodíku v jednom gramu natrium-fenylbutyrátu, což odpovídá maximální denní dávce 2,5 mg (108 mmol) sodíku na 20 g natrium-fenylbutyrátu. Přípravek PHEBURANE by měl být proto užíván s opatrností u pacientů s městnavým srdečním selháním nebo těžkou formou renální insuficience a u klinických stavů s retencí sodíku s otoky.
• Během léčby se mají monitorovat hladiny kalia v séru, protože vylučování fenylacetylglutaminu ledvinami může indukovat ztráty kalia močí.
Obecná rizika
• U řady pacientů se může objevit akutní hyperamonemická encefalopatie, i když jsou léčeni.
• Přípravek PHEBURANE se nedoporučuje k léčbě akutní hyperamonemie, která představuje naléhavý zdravotní stav.
Pomocné látky se známým účinkem
• Tento léčivý přípravek obsahuje sodík. To je nutné vzít v úvahu u pacientů na dietě s nízkým množstvím sodíku.
• Tento léčivý přípravek obsahuje sacharózu. Tuto skutečnost je nutné vzít v úvahu u pacientů s diabetem mellitus. Pacienti se vzácnými dědičnými poruchami typu intolerance fruktózy,
3
glukózové-galaktózové malabsorpce a nebo sacharózo-izomaltázové deficience by neměli tento léčivý přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné podávání probenecidu může ovlivnit vylučování konjugátu natrium-fenylbutyrátu ledvinami. Byly publikovány zprávy o hyperamonemii indukované haloperidolem a valproátem. Kortikosteroidy mohou vyvolat rozpad tělesných proteinů a zvýšení plazmatických hladin amoniaku. Je doporučováno častější monitorování plazmatických hladin amoniaku při užívání těchto léčivých přípravků.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku / Antikoncepce u mužů a žen U žen ve fertilním věku je nutné použít účinné antikoncepční prostředky.
Bezpečnost tohoto léčivého přípravku v průběhu těhotenství nebyla stanovena. Hodnocení experimentálních studií u zvířat prokázalo reprodukční toxicitu natrium-fenylbutyrátu, tj. účinky na vývoj embrya nebo plodu. Působení fenylacetátu (účinného metabolitu fenylbutyrátu) na mláďata krys v prenatální fázi vývoje mělo za následek léze kortikálních pyramidových buněk; dendritické výběžky byly delší a tenčí oproti normálu a vyskytovaly se v nižším počtu. Význam těchto údajů pro těhotné ženy není znám; užívání přípravku PHEBURANE je tedy v průběhu těhotenství kontraindikováno (viz bod 4.3). Ženy ve fertilním věku musí používat účinnou metodu antikoncepce.
Kojení
U mláďat potkanů, kterým byly podávány podkožně vysoké dávky fenylacetátu (190 - 474 mg/kg), byla pozorována snížená proliferace a zvýšený úbytek neuronů, a rovněž snížení myelinu v CNS. Dozrávání mozkových synapsí bylo zpomalené a byl snížen počet funkčních nervových zakončení v mozku, což mělo za následek poruchu růstu mozku. Jelikož nebylo stanoveno, zda je fenylacetát vylučován do mateřského mléka, je použití přípravku PHEBURANE kontraindikováno v průběhu kojení (viz bod 4.3).
Fertilita
Nejsou k dispozici žádné důkazy o účinku natrium-fenylbutyrátu na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek PHEBURANE má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
V klinických studiích s natrium-fenylbutyrátem mělo 56 % pacientů nejméně jednu nežádoucí příhodu a 78 % těchto nežádoucích příhod bylo považováno za nesouvisející s natrium-fenylbutyrátem.
Nežádoucí účinky postihovaly převážně reprodukční a gastrointestinální systém.
Tabulkový přehled nežádoucích účinků
Nežádoucí účinky jsou uvedeny v následující tabulce podle tělesných systémů a jejich výskytu.
Výskyt je definovaný jako: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů |
F rekvence |
Nežádoucí účinky |
|
Poruchy krve a lymfatického systému |
časté |
anémie, trombocytopenie, leukopenie, leukocytóza, trombocytóza |
|
méně časté |
aplastická anémie, ekchymóza | |
|
Poruchy metabolismu a výživy_ |
časté |
metabolická acidóza, alkalóza, snížení chuti k jídlu |
|
Psychiatrické poruchy |
časté | |
|
Poruchy nervového systému |
časté |
synkopa, bolest hlavy |
|
Srdeční poruchy |
časté |
otoky |
|
méně časté | ||
|
Gastrointestinální poruchy |
časté | |
|
méně časté |
pankreatitida, peptický vřed, krvácení z konečníku, gastritida | |
|
Poruchy kůže a podkožní tkáně |
časté |
vyrážka, nepříjemný tělesný zápach |
|
Poruchy ledvin a močových cest |
časté |
renální tubulární acidóza |
|
Poruchy reprodukčního systému a prsu |
velmi časté |
amenorea, nepravidelné menstruační krvácení |
|
Vyšetření |
časté |
snížení hladiny draslíku, albuminu, celkové bílkoviny a fosfátu, zvýšení alkalické fosfatázy v krvi, transamináz, bilirubinu, kyseliny močové, chloridů, fosfátu a sodíku, zvýšení tělesné hmotnosti |
Popis vybraných nežádoucích účinků
Byl popsán případ pravděpodobné toxické reakce na natrium-fenylbutyrát (450 mg/kg/den) u 18leté pacientky s anorexií, u které se vyvinula metabolická encefalopatie s laktátovou acidózou, těžkou hypokalemií, pancytopenií, periferní neuropatií a pankreatitidou. Po snížení dávky se pacientka uzdravila s výjimkou epizod recidivující pankreatitidy, která nakonec urychlila vysazení léčby.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Vyskytl se jeden případ předávkování u 5měsíčního dítěte jako náhodné požití dávky 10 g
(1 370 mg/kg). U pacienta se vyskytl průjem, podrážděnost a metabolická acidóza s hypokalemií. Tyto
příznaky u pacienta vymizely během 48 hodin po symptomatické terapii.
Tyto příznaky odpovídají akumulaci fenylacetátu, která se projevila jako neurotoxicita limitovaná dávkou při intravenózním podávání v dávkách do 400 mg/kg/den. Mezi projevy neurotoxicity patřily hlavně somnolence, únava a omámení. Méně častými projevy neurotoxicity byly zmatenost, bolesti hlavy, porucha chuti, snížení sluchu, dezorientace, porucha paměti a exacerbace přítomné neuropatie.
V případě předávkování je nutno přerušit léčbu a zahájit podpůrná opatření. Hemodialýza nebo peritoneální dialýza může být prospěšná.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiné přípravky pro léčbu různých poruch trávicího traktu a metabolismu, různé přípravky pro léčbu trávicího traktu a metabolismu, ATC kód: A16AX03.
Mechanismus účinku a farmakodynamické účinky
Natrium-fenylbutyrát je prekurzor a je rychle metabolizován na fenylacetát. Fenylacetát je metabolicky aktivní sloučenina, jež se acetylací konjuguje s glutaminem a tvoří fenylacetylglutamin, který je vylučován ledvinami. Molární množství fenylacetylglutaminu je srovnatelné s močovinou (každý obsahuje 2 mol dusíku), a poskytuje tedy alternativní prostředek pro vylučování odpadního dusíku.
Klinická účinnost a bezpečnost
Na základě studií sledujících vylučování fenylacetylglutaminu u pacientů s poruchami metabolismu močoviny je možno odhadnout, že na každý podaný gram natrium-fenylbutyrátu se vytvoří mezi 0,12 a 0,15 g fenylacetylglutaminu. Výsledkem toho je, že natrium-fenylbutyrát snižuje zvýšené plasmatické hladiny amoniaku a glutaminu u pacientů s poruchami metabolismu močoviny. Je důležité stanovit diagnózu v časné fázi a zahájit léčbu okamžitě, aby došlo ke zlepšení přežívání a klinického výsledku.
U pacientů s pozdní formou deficitu, včetně žen s heterozygotní formou deficitu ornitin-karbamoyltransferázy, kteří překonali hyperamonemickou encefalopatii a byli dlouhodobě léčeni omezením bílkovin ve stravě a natrium-fenylbutyrátem, byl výskyt přežívání 98 %. Většina pacientů měla výsledky IQ testů v průměru odpovídajícímu nízkému průměru/hraničnímu rozmezí mentální retardace. Výkonnost jejich rozpoznávacích funkcí zůstala relativně stabilní v průběhu užívání fenylbutyrátu. Exacerbace existujícího neurologického postižení není během léčby pravděpodobná a u některých pacientů může perzistovat neurologická porucha.
Přípravek PHEBURANE může být nutné užívat celoživotně, pokud není volbou ortotopická transplantace jater.
Pediatrická populace
Dříve měla neonatální forma poruchy metabolismu močoviny během prvního roku života téměř vždy fatální průběh, a to i v případě, že byla léčena peritoneální dialýzou a esenciálními aminokyselinami, nebo pomocí jejich analog neobsahujících dusík. Při hemodialýze došlo při použití alternativních metabolických cest vylučování odpadního dusíku (natrium-fenylbutyrátu, natrium-benzoátu a natrium-fenylacetátu), omezení bílkovin ve stravě a v některých případech suplementace esenciálními aminokyselinami ke zvýšení přežívání na téměř 80 % u novorozenců, u nichž byla diagnóza stanovena po porodu (ale v průběhu prvního měsíce života), a většina úmrtí se vyskytla v průběhu ataky akutní hyperamonemické encefalopatie. U pacientů s neonatální formou onemocnění byl zaznamenán vysoký výskyt mentální retardace.
U pacientů, u nichž byla stanovena diagnóza v průběhu těhotenství a kteří byli léčeni před výskytem ataky hyperamonemické encefalopatie, bylo přežívání 100%, ale i u těchto pacientů došlo k mnoha následným poruchám kognitivních funkcí a k dalším neurologickým výpadkům.
5.2 Farmakokinetické vlastnosti
Je známo, že fenylbutyrát je oxidován na fenylacetát, který pomocí enzymatické konjugace s glutaminem v játrech a ledvinách tvoří fenylacetylglutamin. Fenylacetát je také hydrolyzován pomocí esteráz v játrech a krvi.
Koncentrace fenylbutyrátu a jeho metabolitů v plazmě a moči byly získány u normálních dospělých jedinců nalačno, kteří dostávali natrium-fenylbutyrát v jednotlivých dávkách 5 g, a u pacientů s poruchou metabolismu močoviny, hemoglobinopatiemi a cirhózou, kteří dostávali natrium-fenylbutyrát v jednotlivých a opakovaných perorálních dávkách do 20 g/den (nekontrolované studie). Farmakokinetika fenylbutyrátu a jeho metabolitů byla také sledována u pacientů s nádorovým onemocněním po intravenózní aplikaci natrium-fenylbutyrátu (do 2 g/m2) nebo fenylacetátu v infuzi.
Absorpce
Fenylbutyrát se rychle vstřebává při podmínkách nalačno. Po jednorázové perorální dávce 5 g natrium-fenylbutyrátu v tabletách byly zaznamenány měřitelné plazmatické hladiny fenylbutyrátu 15 minut po podání dávky. Průměrná doba pro dosažení maximální koncentrace byla 1 hodina a průměrná maximální koncentrace 195 pg/ml. Eliminační poločas byl přibližně 0,8 hodiny.
Účinek potravy na absorpci není známý.
Distribuce v organismu
Distribuční objem fenylbutyrátu je 0,2 l/kg.
Biotransformace
Po jednotlivé dávce 5 g natrium-fenylbutyrátu ve formě granulí byly zaznamenány měřitelné plazmatické hladiny fenylacetátu 30 minut a fenylacetylglutaminu 60 minut po podání dávky. Průměrná doba pro dosažení maximální koncentrace byla 3,55 hodiny, respektive 3,23 hodiny, a průměrná maximální koncentrace byla 45,3 pg/ml, respektive 62,8 pg/ml. Eliminační poločas byl přibližně 1,3 hodiny, respektive 2,4 hodiny.
Studie u vysokých dávek fenylacetátu podaného intravenózně prokázaly nelineární farmakokinetiku charakterizovanou saturabilním metabolismem u fenylacetylglutaminu. Opakované dávkování fenylacetátu prokázalo indukci clearance.
U většiny pacientů s poruchou metabolismu močoviny nebo s hemoglobinopatiemi, kteří dostávali různé dávky fenylbutyrátu (300 - 650 mg/kg/den až do 20 g/den), nebyla zaznamenána žádná plasmatická hladina fenylacetátu ráno nalačno. U pacientů s poruchou funkce jater může být přeměna fenylacetátu na fenylacetylglutamin relativně pomalejší. Tři pacienti s cirhózou jater (z celkem 6 pacientů), kteří užívali opakované perorální dávky natrium-fenylbutyrátu (20 g/den ve třech dávkách), měli ustálené plazmatické hladiny fenylacetátu třetí den, které byly pětkrát vyšší než hladiny dosažené po první dávce.
U zdravých dobrovolníků byly nalezeny rozdíly u pohlaví ve farmakokinetických parametrech fenylbutyrátu a fenylacetátu (AUC a Cmax byly přibližně o 30-50 % vyšší u žen), ale tyto rozdíly se neobjevily u fenylacetylglutaminu. To může být způsobeno lipofilitou natrium-fenylbutyrátu a následnými rozdíly v distribučním objemu.
Vylučování
Přibližně 80-100 % léčivého přípravku je vyloučeno ledvinami v průběhu 24 hodin ve formě konjugátu - fenylacetylglutaminu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Natrium-fenylbutyrát byl negativní ve dvou testech na mutagenní vlastnosti, tj. Amesově testu a mikronukleárním testu. Výsledky naznačují, že natrium-fenylbutyrát nevyvolal žádné mutagenní účinky u Amesova testu s metabolickou aktivací nebo bez ní.
Výsledky mikronukleárního testu naznačují, že natrium-fenylbutyrát neměl žádné klastogenní účinky u potkanů, kteří dostávali toxické nebo netoxické dávky (24 a 48 hodin po jednorázovém podání dávek od 878 do 2 800 mg/kg).
Studie sledující kancerogenní vlastnosti a účinky na fertilitu nebyly u natrium-fenylbutyrátu provedeny.
6.1 Seznam pomocných látek
zrněný cukr (sacharóza a kukuřičný škrob),
hypromelosa,
ethylcelulosa N7,
makrogol 1500,
povidon K25.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky.
Po prvním otevření spotřebujte do 45 dní.
6.4 Zvláštní opatření pro uchovávání Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
HDPE lahvička s dětským bezpečnostním uzávěrem a vysoušedlem, obsahující 174 g granulí. Každá krabička obsahuje jednu lahvičku.
Dodávána je i kalibrovaná odměrná lžička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
V případě mísení granulí s pevnou stravou nebo tekutinami je důležité, aby byl přípravek spolknut okamžitě po smíchání
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Lucane Pharma 172 rue de Charonne 75011 Paříž Francie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/13/822/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 31.července 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropská agentury pro léčivé přípravky na adrese http://www.ema.europa.eu/.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ / VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
VÝROBCE ODPOVĚDNÝ / VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
A.
Název a adresa výrobce odpovědného za propouštění šarží
Lucane Pharma 172 rue de Charonne 75011 Paříž Francie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Neuplatňuje se.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
PHEBURANE 483 mg/g granule natrii phenylbutyras
1 gram granulí obsahuje natrii phenylbutyras 483 mg
Obsahuje sodík a sacharózu.
Další informace viz příbalová informace.
Granule.
Krabička: jedna lahvička se 174 g granulí. Lahvička: 174 g granulí.
Před použitím si přečtěte příbalovou informaci. Perorální podání.
Používejte pouze kalibrovanou odměrnou lžičku.
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
EXP:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Lucane Pharma 172 rue de Charonne 75011 Paříž - Francie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/822/001
13 ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
PHEBURANE 483 mg/g [pouze vnější obal]
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
PHEBURANE 483 mg/g granule
natrii phenylbutyras
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek PHEBURANE a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek PHEBURANE užívat
3. Jak se přípravek PHEBURANE užívá
4. Možné nežádoucí účinky
5. Jak přípravek PHEBURANE uchovávat
6. Obsah balení a další informace
1. Co je přípravek PHEBURANE a k čemu se používá
Přípravek PHEBURANE obsahuje léčivou látku natrium-fenylbutyrát, která se používá k léčbě pacientů všech věkových kategorií s poruchami metabolismu močoviny. Tyto vzácné poruchy vznikají z důvodu nedostatku určitých jaterních enzymů, které jsou nutné k odstranění odpadního dusíku ve formě amoniaku.
Dusík je stavebním prvkem proteinů, které jsou podstatnou součástí stravy, kterou jíme. Při odbourávání proteinů po jídle v těle vzniká odpadní dusík ve formě amoniaku, který se hromadí, protože tělo jej není schopné vyloučit. Zvýšená hladina amoniaku v krvi (amonemie) je zvláště toxická pro mozek a v závažných případech vede ke snížení hladiny vědomí a kómatu.
Přípravek PHEBURANE napomáhá tělu odstraňovat odpadní dusík, čímž snižuje množství amoniaku ve Vašem těle. Přípravek PHEBURANE se nicméně musí užívat spolu s dietou omezující proteiny, navrženou konkrétně pro Vás lékařem a dietologem. Tuto dietu musíte pečlivě dodržovat.
2. Čemu musíte věnovat pozornost, než začnete přípravek PHEBURANE užívat Neužívejte přípravek PHEBURANE:
• jestliže jste alergický(á) na natrium-fenylbutyrát nebo na kteroukoli další složku tohoto
přípravku (uvedenou v bodě 6),
• jestliže j ste těhotná,
• jestliže kojíte.
Upozornění a opatření
Před užitím přípravku PHEBURANE se poraďte se svým lékařem nebo lékárníkem:
• jestliže trpíte městnavým srdečním selháním (typem srdečního onemocnění, kdy srdce nemůže přečerpávat tělem dostatek krve) nebo sníženou funkcí ledvin,
• jestliže máte sníženou funkci ledvin nebo jater, protože přípravek PHEBURANE je z těla vylučován ledvinami a játry
Přípravek PHEBURANE nezabrání výskytu akutního nadbytku amoniaku v krvi. Pokud k tomu dojde, objeví se u Vás příznaky, jako je nevolnost (nauzea), zvracení, zmatenost a budete potřebovat okamžitou lékařskou pomoc.
Pokud jsou u Vás nutné laboratorní testy, je důležité upozornit Vašeho lékaře, že užíváte přípravek PHEBURANE, protože natrium-fenylbutyrát může ovlivňovat výsledky některých laboratorních testů (např. krevní elektrolyty nebo bílkovina nebo vyšetření jaterních funkcí).
V případě jakékoli pochybnosti se obraťte na svého lékaře nebo lékárníka.
Další léčivé přípravky a přípravek PHEBURANE
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Je zvláště důležité, abyste informovali svého lékaře, pokud užíváte léčivé přípravky obsahující:
• valproát (léčivý přípravek proti epilepsii),
• haloperidol (používaný k léčbě některých psychotických poruch),
• kortikosteroidy (léčivé přípravky, které se používají ke zmírnění bolesti v zanícených částech těla),
• probenecid (k léčbě hyperurikémie, vysoké hladiny kyseliny močové v krvi, která bývá přítomna u dny).
Tyto léčivé přípravky mohou ovlivnit účinek přípravku PHEBURANE a bude nutné provádět častější kontroly Vaší krve. Pokud si nejste jistý/á, zda Vaše léčivé přípravky obsahují tyto látky, měl(a) byste se poradit se svým lékařem nebo lékárníkem.
Těhotenství a kojení
Neužívejte přípravek PHEBURANE, pokud jste těhotná, protože tento přípravek může nepříznivě ovlivnit Vaše nenarozené dítě.
Pokud jste žena, která by mohla otěhotnět, musíte v průběhu léčby přípravkem PHEBURANE užívat spolehlivou antikoncepci. Zeptejte se svého lékaře na podrobnosti.
Neužívejte přípravek PHEBURANE, pokud kojíte, protože tento přípravek může přecházet do mateřského mléka a mohl by poškodit Vaše dítě.
Řízení dopravních prostředků a obsluha strojů
Není pravděpodobné, že by přípravek PHEBURANE ovlivnil Vaši schopnost řídit a obsluhovat stroje. Přípravek PHEBURANE obsahuje sodík a sacharózu
Tento léčivý přípravek obsahuje v jednom gramu natrium-fenylbutyrátu 124 mg (5,4 mmol) sodíku To je nutné vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
Tento léčivý přípravek obsahuje v jednom gramu natrium-fenylbutyrátu 768 g sacharózy. Tuto skutečnost je nutné vzít v úvahu, pokud trpíte diabetem (cukrovkou). Pokud Vás Váš lékař informoval, že trpíte nesnášenlivostí některých cukrů, poraďte se s ním dříve, než začnete tento přípravek užívat.
3. Jak se přípravek PHEBURANE užívá
Vždy užívejte přípravek PHEBURANE přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Denní dávka přípravku PHEBURANE se vypočítá na základě Vaší tolerance bílkovin, stravy a tělesné hmotnosti nebo tělesného povrchu. Bude tedy nutné provádět u Vás pravidelné kontroly krve pro stanovení správné denní dávky. Množství granulí, které máte užívat, Vám sdělí Váš lékař.
Způsob podání
Přípravek PHEBURANE se užívá ústy. Protože se rozpouští pomalu, neměl by být přípravek PHEBURANE podáván gastrostomií (kanylou, která prochází přes břicho do žaludku) nebo nazogastrickou sondou (kanylou, která prochází přes nos do žaludku).
Přípravek PHEBURANE se musí užívat se speciální dietou s nízkým obsahem bílkovin.
Přípravek PHEBURANE se užívá s každým jídlem nebo krmením. U malých dětí to může být 4 až 6 krát denně.
Spolu s tímto léčivým přípravkem je dodávána kalibrovaná odměrná lžička, která umožňuje dávkovat až 3 g natrium-fenylbutyrátu. Tuto odměrnou lžičku použijte pouze k odměření dávky.
Pro odměření dávky
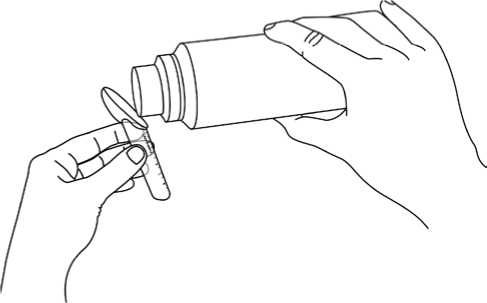
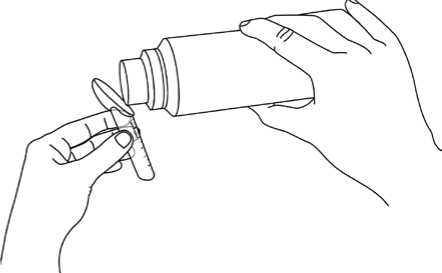
• rysky na lžičce ukazují množství (v gramech natrium-fenylbutyrátu). Užívejte přesné množství předepsané Vaším lékařem,
• nasypte granule přímo na lžičku, jak je znázorněno na obrázku (na vnějším obalu a na konci strany 2 této informace),
• poklepte lžičkou o stůl, aby se hladina granulí srovnala do vodorovné roviny a pokračujte v plnění dle potřeby.
Granule se polykají přímo a zapíjejí se nápojem (vodou, ovocnými džusy, umělým mlékem pro kojence neobsahujícím proteiny) nebo mohou být nasypány na lžičku pevné stravy (šťouchaných brambor nebo jablečného pyré). Pokud granule smícháte s jídlem, je důležité užít je okamžitě, což zabrání tomu, aby způsobily chuťové vjemy.
Bude nutné, abyste užíval(a) tento léčivý přípravek a celoživotně dodržoval(a) dietu.
Jestliže jste užil(a) více přípravku PHEBURANE, než jste měl(a)
U pacientů, kteří požili velmi vysoké dávky natrium-fenylbutyrátu, se vyskytly:
• ospalost, únava, závratě a méně často zmatenost,
• bolesti hlavy,
• změny chuti (poruchy chuti),
• pokles sluchu,
• dezorientace,
• zhoršení paměti,
• zhoršení stávajících neurologických onemocnění.
Pokud se u Vás vyskytnou některé výše uvedené příznaky, informujte okamžitě svého lékaře nebo kontaktuje nejbližší lékařskou pohotovost, kde bude zahájena podpůrná léčba.
Jestliže jste zapomněl(a) užít přípravek PHEBURANE
Měl(a) byste užít dávku co nejdříve s dalším jídlem.
Ujistěte se, že mezi dávkami je interval minimálně 3 hodiny.
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Jestliže se objeví přetrvávající zvracení, měl(a) byste kontaktovat okamžitě svého lékaře.
Velmi časté nežádoucí účinky (u více než 1 člověka z 10): nepravidelná menstruace a zástava menstruačního krvácení u žen v plodném věku. Jestliže jste sexuálně aktivní a úplně u Vás ustane menstruace, nepředpokládejte, že je to způsobeno přípravkem PHEBURANE. Jestliže dojde k této situaci, obraťte se na svého lékaře, protože nepřítomnost menstruace může být způsobena těhotenstvím (viz bod „Těhotenství a kojení“ výše) nebo menopauzou.
Časté nežádoucí účinky (mohou postihovat více než 1 člověka ze 100): změny počtu krevních buněk (červených krvinek, bílých krvinek a krevních destiček), změny množství bikarbonátu v krvi (změny rovnováhy kyselin a zásad), snížená chuť k jídlu, deprese, podrážděnost, bolest hlavy, omdlévání, zadržování tekutin (otok), změny chuti (poruchy vnímání chuti), bolest břicha, zvracení, nevolnost, zácpa, nepříjemný tělesný zápach, vyrážka, abnormální funkce ledvin, váhový přírůstek, změny hodnot laboratorních testů.
Méně časté nežádoucí účinky (mohou postihovat více než 1člověka z 1 000): nedostatek červených krvinek z důvodu útlumu kostní dřeně, tvorba podlitin, poruchy srdečního rytmu, krvácení z konečníku, podráždění žaludku, žaludeční vředy, zánět slinivky břišní.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek PHEBURANE uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Přípravek PHEBURANE nepoužívejte po uplynutí doby použitelnosti, uvedené na krabičce a na štítku lahvičky za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte při teplotě do 25 °C.
Po prvním otevření balení je nutné přípravek PHEBURANE spotřebovat do 45 dní.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo do domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek PHEBURANE obsahuje
Léčivou látkou je natrium-fenylbutyrát.
Jeden gram granulí obsahuje 483 mg natrium-fenylbutyrátu.
Dalšími složkami jsou: cukr (sacharóza a kukuřičný škrob, viz bod 2 „přípravek PHEBURANE obsahuje sacharózu“), hypromelosa, ethylcelulosa N7, makrogol 1500, povidon K25)
Jak přípravek PHEBURANE vypadá a co obsahuje toto balení
Granule přípravku PHEBURANE jsou bílé až téměř bílé.
Granule jsou baleny v plastových lahvičkách s dětským bezpečnostním a s vysoušedlem.
Jedna lahvička obsahuje 174 g granulí. Každá krabička obsahuje 1 lahvičku.
Dodávána je i kalibrovaná odměrná lžička.
Držitel rozhodnutí o registraci
Lucane Pharma 172 rue de Charonne 75011 Paříž - Francie
Výrobce
Lucane Pharma 172 rue de Charonne 75011 Paříž Francie
|
Další informace o tomto přípravku získáte |
u místního zástupce držitele rozhodnutí o registraci |
|
Belgie/Belgique/Belgien Lucane Pharma Tél/Tel: + 33 153 868 750 info@Jucanepharma.com |
Lietuva Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
BtnrapHH Lucane Pharma Ten.: + 33 153 868 750 info@Jucanepharma.com |
Luxembourg/Luxemburg Lucane Pharma Tél/Tel: + 33 153 868 750 |
|
Česká republika Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
Magyarország Medical Need Europe AB Tel.: + 46 8 533 39 500 info@medicalneed.com |
|
Danmark Medical Need Europe AB Tlf: + 46 8 533 39 500 info@medicalneed.com |
Malta Lucane Pharma Tel: + 33 153 868 750 |
|
Deutschland Lucane Pharma Tel: + 33 153 868 750 info@Jucanepharma.com |
Nederland Lucane Pharma Tel: + 33 153 868 750 info@Jucanepharma.com |
|
Eesti Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
Norge Medical Need Europe AB Tlf: + 46 8 533 39 500 info@medicalneed.com |
|
EXlába Lucane Pharma TqT.: + 33 153 868 750 |
Osterreich Lucane Pharma Tel: + 33 153 868 750 |
|
Espaňa Lucane Pharma Tel: + 33 153 868 750 |
Polska Medical Need Europe AB Tel.: + 46 8 533 39 500 info@medicalneed.com |
|
France Lucane Pharma Tél: + 33 153 868 750 |
Portugal Lucane Pharma Tel: + 33 153 868 750 |
|
Hrvatska Lucane Pharma Tel: + 33 153 868 750 |
Románia Lucane Pharma Tel: + 33 153 868 750 |
|
Ireland Lucane Pharma Tel: + 33 153 868 750 |
Slovenija Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Island Medical Need Europe AB Sími: + 46 8 533 39 500 info@medicalneed.com |
Slovenská republika Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Italia Lucane Pharma Tel: + 33 153 868 750 info@4ucanepharma.com |
Suomi/Finland Medical Need Europe AB Puh/Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Kónpoq Lucane Pharma Tp^: + 33 153 868 750 |
Sverige Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Latvija Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
United Kingdom Lucane Pharma Tel: + 33 153 868 750 info@4ucanepharma.com |
Tato příbalová informace byla naposledy revidována:
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
22