Ovitrelle 250 Mikrogramů/0,5 Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Ovitrelle 250 mikrogramů/0,5 ml, injekční roztok v předplněné injekční stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna předplněná injekční stříkačka obsahuje 250 mikrogramů choriogonadotropinum alfa1 (což odpovídá přibližně 6 500 IU) v0,5 ml roztoku.
*rekombinantní lidský chorionický gonadotropin, r-hCG produkovaný na buňkách ovarií křečíka čínského (Chinese hamster ovary, CHO) technologií rekombinantní DNA.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok v předplněné injekční stříkačce.
Čirý bezbarvý, až lehce nažloutlý roztok.
pH roztoku je 7,0 ± 0,3, osmolalita 250 - 400 mOsm/kg.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Ovitrelle je indikován k léčbě
• dospělých žen podstupujících superovulaci před technikou asistované reprodukce jako oplodnění in vitro (IVF): přípravek Ovitrelle se podává ke spuštění konečného zrání folikulu a luteinizace po stimulaci růstu folikulů.
• dospělých žen s anovulací nebo oligo-ovulací: přípravek Ovitrelle je podáván ke spuštění ovulace a luteinizace u žen s anovulací nebo oligo-ovulací po stimulaci růstu folikulů.
4.2 Dávkování a způsob podání
Léčba přípravkem Ovitrelle by měla být prováděna pod dohledem lékaře se zkušenostmi s léčbou poruch plodnosti.
Dávkování
Maximální dávka je 250 mikrogramů. Doporučuje se následující schéma dávek
• Ženy podstupující superovulaci před technikou asistované reprodukce jako oplodnění in vitro (IVF)
Podává se jedna předplněná injekční stříkačka přípravku Ovitrelle (250 mikrogramů) 24 až 48 hodin po posledním podání přípravku obsahujícího folikuly stimulující hormon (FSH) nebo lidského menopauzálního gonadotropinu (hMG), tj. když je dosaženo optimální stimulace růstu folikulů.
Zvláštní populace
Poruchy ledvin nebo jater
Bezpečnost, účinnost a farmakokinetika přípravku Ovitrelle u pacientů s poruchami ledvin nebo jater nebyla stanovena.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Ovitrelle u pediatrické populace.
Způsob podání
K subkutánnímu podání. Samostatnou aplikaci přípravku Ovitrelle by měli provádět pouze pacienti, kteří jsou dostatečně proškoleni a mají přístup k odborné pomoci.
Ovitrelle je pouze k jednorázovému použití.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Nádory hypotalamu nebo hypofýzy
• Zvětšení ovarií nebo cysta z jiného důvodu než polycystické onemocnění ovarií
• Gynekologické krvácení neznámé etiologie
• Karcinom ovarií, dělohy nebo prsu
• Mimoděložní těhotenství v předchozích 3 měsících
• Aktivní tromboembolické onemocnění
• Primární selhání ovarií
• Anomálie pohlavních orgánů neslučitelné s těhotenstvím
• Fibroidní nádory dělohy neslučitelné s těhotenstvím
• Ženy po menopauze
4.4 Zvláštní upozornění a opatření pro použití
Před zahájením léčby by měla být zhodnocena neplodnost páru jako vhodná k této léčbě a měly by být zhodnoceny možné kontraindikace otěhotnění. Dále by pacientky měly být vyšetřeny na hypotyreoidismus, nedostatečnost kůry nadledvin, hyperprolaktinémii a nádory hypofýzy či hypotalamu, a měla by být provedena jejich vhodná léčba.
Neexistují klinické zkušenosti s přípravkem Ovitrelle v léčbě jiných stavů (jako je insuficience žlutého tělíska nebo v léčbě u mužů), proto není přípravek Ovitrelle v těchto případech indikován.
Syndrom hyperstimulace ovarií (OHSS)
U pacientek podstupujících stimulaci růstu folikulů je zvýšené riziko rozvoje (OHSS) z důvodu tvorby vícečetných folikulů.
Syndrom hyperstimulace ovarií se může stát vážným zdravotním problémem charakteristickým velkými cystami na vaječnících s tendencí k prasknutí, zvyšováním tělesné hmotnosti, dyspnoe, oligurií nebo přítomností ascitu s klinickým obrazem oběhové dysfunkce. Závažný OHSS může být ve vzácných případech komplikován hemoperitoneem, akutní respirační tísní, torzí ovaria a tromboembolismem.
K minimalizaci rizika OHSS se musí provádět před zahájením léčby a dále v pravidelných intervalech během léčby ultrazvukové vyšetření růstu folikulů a/nebo stanovení hladin sérového estradiolu. U anovulace se riziko OHSS zvyšuje při sérové hladině estradiolu > 1 500 pg/ml (5 400 pmol/l) a při přítomnosti více než 3 folikulů o průměru 14 mm a více. Při technikách asistované reprodukce se riziko OHSS zvyšuje při sérovém estradiolu > 3 000 pg/ml (11 000 pmol/l) a 18 či více folikulech o průměru 11 mm a více.
OHSS na podkladě nadměrné ovariální odpovědi se lze vyhnout vynecháním podání hCG. Pokud se
tedy objeví příznaky ovariální hyperstimulace, jako je hladina estradiolu > 5 500 pg/ml
(20 000 pmol/l) a/nebo je přítomno celkem 30 a více folikulů, doporučuje se vynechat podání hCG.
Pacientce je třeba doporučit vynechání pohlavního styku nebo používání bariérových antikoncepčních metod po dobu minimálně 4 dnů.
Vícečetné těhotenství
U pacientek podstupujících indukci ovulace existuje zvýšená incidence vícečetného těhotenství a porodů (nejčastěji dvojčat) ve srovnání s přirozeným početím. Riziko vícečetného těhotenství při použití technik asistované reprodukce má vztah k počtu implantovaných embryí.
Dodržování doporučeného dávkování přípravku Ovitrelle a režimu podávání spolu s pečlivým sledováním léčby minimalizuje riziko OHSS a vícečetného těhotenství.
Potrat
Procento potratů u žen s anovulací i u žen podstupujících umělé oplodnění je vyšší než v normální populaci, ale je srovnatelné s procenty pozorovanými u žen s jinými poruchami plodnosti.
Ektopická gravidita
Jelikož neplodné ženy podstupující techniky ART, a zejména IVF, mají často tubální abnormality, může být výskyt ektopické gravidity zvýšený. Je důležité provést včas ultrazvukové vyšetření k potvrzení, že se jedná o nitroděložní těhotenství a vyloučení mimoděložního těhotenství.
Kongenitální malformace
Výskyt kongenitálních malformací po ART může být trochu vyšší než po spontánním oplodnění. Má se za to, že původcem toho jsou rozdíly v matečních charakteristikách (např. mateřské vajíčko, spermatické vlastnosti) a vyšší výskyt vícečetných těhotenství.
Tromboembolické příhody
U žen s nedávnou nebo probíhající tromboembolickou nemocí nebo u žen s obecně rozpoznanými rizikovými faktory pro tromboembolické příhody, jako je osobní nebo rodinná anamnéza, může léčba gonadotropiny dále zvýšit riziko výskytu nebo zhoršení průběhu těchto příhod. U těchto žen je nutné zvážit přínos podávání gonadotropinu oproti rizikům. Je třeba vzít v úvahu, že samotné těhotenství, stejně jako OHSS, také přináší zvýšené riziko tromboembolických příhod, jako je plicní embolie, ischemická příhoda nebo infarkt myokardu.
Interference se sérovými nebo močovými testy
V průběhu podávání může přípravek Ovitrelle do deseti dnů ovlivňovat imunologické stanovení sérového nebo močového hCG, což může vést k falešně pozitivnímu výsledku těhotenského testu. Pacientky by o této skutečnosti měly být informovány
Další informace
Během léčby přípravkem Ovitrelle je možná mírná stimulace štítné žlázy, jejíž klinický význam není znám.
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí s přípravkem Ovitrelle a jinými léčivými přípravky, nicméně během léčby hCG nebyly zaznamenány žádné klinicky významné lékové interakce.
4.6 Fertilita, těhotenství a kojení
Neexistuje žádná indikace k použití přípravku Ovitrelle během těhotenství. Nejsou k dispozici žádné klinické údaje týkající se expozice přípravku během těhotenství. Nebyly provedeny reprodukční studie s choriogonadotropinem alfa u zvířat (viz bod 5.3). Potenciální riziko u lidí není známo.
Kojení
Přípravek Ovitrelle není během kojení indikován. Neexistují údaje o vylučování choriogonadotropinu alfa do mléka.
Fertilita
Přípravek Ovitrelle je indikován k použití při poruchách plodnosti (viz bod 4.1).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Předpokládá se, že přípravek Ovitrelle nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Přehled bezpečnostního profilu
Ve srovnávacích studiích s různými dávkami přípravku Ovitrelle byla zjištěna dávkově závislá souvislost následujících nežádoucích účinků s přípravkem Ovitrelle: OHSS a zvracení a nevolnost. OHSS byl pozorován přibližně u 4 % pacientek léčených přípravkem Ovitrelle. Závažný OHSS byl zaznamenán u méně než 0,5 % pacientek (viz bod 4.4).
Seznam nežádoucích účinků
Následující definice se vztahují k četnosti výskytu používané dále: velmi časté (>1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000), velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
Poruchy imunitního systému
Velmi vzácné: mírná až závažná hypersenzitivní reakce, včetně anafylaktické reakce a šoku
Psychiatrické _ poruchy
Méně časté: deprese, podrážděnost, neklid
Poruchy nervového systému Časté: bolest hlavy
Cévní _ poruchy
Velmi vzácné: tromboembolismus, většinou asociovaný se závažným OHSS
Gastrointestinální poruchy
Časté: zvracení, nauzea, bolest břicha
Méně časté: průjem
Poruchy kůže a podkožní tkáně
Velmi vzácné: mírná reverzibilní kožní reakce, projevující se jako vyrážka
Poruchy reprodukčního systému a prsu Časté: mírný nebo střední OHSS
Méně časté: závažný OHSS, bolesti v prsu
Celkové _poruchy a reakce v místě aplikace
Časté: únava, reakce v místě podání injekce
Ektopická gravidita, torze ovaria a další komplikace byly popsány u pacientů po aplikaci hCG. Ty jsou považovány za průvodní jevy vztahující se k technice asistované reprodukce.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Účinky předávkování přípravkem Ovitrelle nejsou známy.
Nicméně existuje možnost, že by se po předávkování přípravkem Ovitrelle vyskytl syndrom OHSS (viz bod 4.4).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Pohlavní hormony a modulátory pohlavního systému, gonadotropiny, ATC kód: G03G A08
Mechanismus účinku
Ovitrelle je přípravek obsahující choriový gonadotropin vyráběný rekombinantní DNA technologií. Sekvenci aminokyselin má stejnou jako močový hCG. Choriový gonadotropin se váže na buňky folikulární théky a granulózní vrstvy na transmembránový receptor, který sdílí s luteinizačním hormonem, LH/CG receptor.
Farmakodynamické účinky
Hlavní farmakodynamickou aktivitou u žen je znovuzahájení meiózy ovocytů, prasknutí folikulu (ovulace), tvorby corpus luteum a tvorba progesteronu a estradiolu žlutým tělískem.
U žen působí choriový gonadotropin jako náhrada vlny luteinizačního hormonu, která spouští ovulaci.
Přípravek Ovitrelle se používá ke spuštění konečného zrání folikulu a rané luteinizaci po použití přípravku ke stimulaci růstu folikulů.
Klinická účinnost a bezpečnost
Ve srovnávacích klinických studiích bylo podání 250 mikrogramů přípravku Ovitrelle stejně účinné jako 5 000 IU a 10 000 IU močového hCG na vyvolání konečného zrání folikulu a rané luteinizace při technikách asistované reprodukce a stejně účinné jako 5 000 IU močového hCG na vyvolání ovulace.
Dosud neexistují známky tvorby protilátek na přípravek Ovitrelle u lidí. Opakované podávání přípravku Ovitrelle bylo testováno pouze na mužích. Klinické testování u žen v indikaci ART a anovulace bylo omezeno na jeden cyklus léčby.
5.2 Farmakokinetické vlastnosti
Po intravenózním podání je choriogonadotropin alfa distribuován do extracelulární tekutiny s distribučním poločasem asi 4,5 hodiny. Rovnovážný distribuční objem a celková clearance jsou 6 l a 0,2 l/hod. Nejsou důkazy, že by se choriogonadotropin alfa metabolizoval či byl vylučován jinak než endogenní hCG.
Po subkutánním podání je choriogonadotropin alfa eliminován z těla s poločasem asi 30 hodin a jeho absolutní biologická dostupnost je asi 40 %.
Srovnávací studie mezi v lyofylizovanou a tekutou formou přípravku ukázala jejich bioekvivalenci.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání a genotoxicity neodhalily žádné zvláštní riziko pro člověka. Studie kancerogenního potenciálu nebyly provedeny. To je odůvodněno bílkovinnou povahou léčivé látky a negativním výsledkem testů na genotoxicitu.
Reprodukční studie nebyly prováděny na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Mannitol Methionin Poloxamer 188
Kyselina fosforečná (pro nastavení pH)
Hydroxid sodný (pro nastavení pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Po otevření musí být léčivý přípravek okamžitě spotřebován. Stabilita při použití však byla prokázána na 24 hodin při teplotě + 2 až 8 °C.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C). Uchovávejte v původním obalu. Během doby použitelnosti může být přípravek uchováván při teplotě do 25 °C po dobu 30 dní bez opětovného zchlazení během tohoto období. Pokud přípravek nebyl během těchto 30 dní spotřebován, musí být zlikvidován.
6.5 Druh obalu a obsah balení
0,5 ml roztoku v předplněné injekční stříkačce (sklo typu I) s pístovou zátkou (halobutylová guma) a pístem (umělá hmota) a s injekční jehlou (nerez) - balení po 1 kuse.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Podán může být pouze čirý roztok bez jakýchkoli částic. Pouze k jednorázovému použití.
Samostatnou aplikaci přípravku Ovitrelle by měli provádět pouze pacienti, kteří jsou dostatečně proškoleni a mají přístup k odborné pomoci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/00/165/007
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 02/02/2001
Datum posledního prodloužení registrace: 02/02/2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
Ovitrelle 250 mikrogramů, injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedno předplněné pero obsahuje 250 mikrogramů choriogonadotropinum alfa2 (což odpovídá přibližně 6 500 IU)
*rekombinantní lidský chorionický gonadotropin, r-hCG, produkován na buňkách ovarií křečíka čínského (Chinese hamster ovary, CHO) technologií rekombinantní DNA.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok v předplněném peru.
Čirý bezbarvý, až lehce nažloutlý roztok.
pH roztoku je 7,0 ± 0,3, osmolalita 250 - 400 mOsm/kg.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Ovitrelle je indikován k léčbě
• dospělých žen podstupujících superovulaci před technikou asistované reprodukce jako oplodnění in vitro (IVF): Přípravek Ovitrelle se podává ke spuštění konečného zrání folikulu a luteinizace po stimulaci růstu folikulů.
• dospělých žen s anovulací nebo oligo-ovulací: přípravek Ovitrelle je podáván ke spuštění ovulace a luteinizace u žen s anovulací nebo oligo-ovulací po stimulaci růstu folikulů.
4.2 Dávkování a způsob podání
Léčba přípravkem Ovitrelle by měla být prováděna pod dohledem lékaře se zkušenostmi s léčbou poruch plodnosti.
Dávkování
Maximální dávka je 250 mikrogramů. Doporučuje se následující dávkovací schéma
• Ženy podstupující superovulaci před technikou asistované reprodukce jako oplodnění in vitro (IVF):
Podává se jedno předplněné pero přípravku Ovitrelle (250 mikrogramů) 24 až 48 hodin po posledním podání přípravku obsahujícího folikuly stimulující hormon (FSH) nebo lidského menopauzálního gonadotropinu (hMG), tj. když je dosaženo optimální stimulace růstu folikulů.
Zvláštní populace
Poruchy ledvin nebo jater
Bezpečnost, účinnost a farmakokinetika přípravku Ovitrelle u pacientů s poruchami ledvin nebo jater nebyla stanovena.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Ovitrelle u pediatrické populace.
Způsob podání
K subkutánnímu podání. Samostatnou aplikaci by měli provádět pouze pacienti, kteří jsou dostatečně proškoleni a mají přístup k odborné pomoci.
Ovitrelle je pouze k jednorázovému použití.
Pokyny k podání s předplněným perem naleznete v bodě 6.6 a „Návodu k použití“ na krabičce.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• Nádory hypotalamu a hypofýzy
• Zvětšení ovarií nebo cysta z jiného důvodu než polycystické onemocnění ovarií
• Gynekologické krvácení neznámé etiologie
• Karcinom ovaria, dělohy nebo prsu
• Mimoděložní těhotenství v předchozích 3 měsících
• Aktivní tromboembolické onemocnění
• Primární selhání ovarií
• Anomálie pohlavních orgánů neslučitelné s těhotenstvím
• Fibroidní nádory dělohy neslučitelné s těhotenstvím
• Ženy po menopauze
4.4 Zvláštní upozornění a opatření pro použití
Před zahájením léčby by měla být zhodnocena neplodnost páru jako vhodná k této léčbě a měly by být zhodnoceny možné kontraindikace otěhotnění. Dále by pacientky měly být vyšetřeny na hypotyreoidismus, nedostatečnost kůry nadledvin, hyperprolaktinémii a nádory hypofýzy či hypotalamu, a měla by být provedena jejich vhodná léčba.
Neexistují klinické zkušenosti s přípravkem Ovitrelle v léčbě jiných stavů (jako je insuficience žlutého tělíska nebo v léčbě u mužů), proto není přípravek Ovitrelle v těchto případech indikován.
Syndrom hyperstimulace ovarií (OHSS)
U pacientek podstupujících stimulaci růstu folikulů je zvýšené riziko rozvoje OHSS z důvodu tvorby vícečetných folikulů.
OHSS se může stát vážným zdravotním problémem charakteristickým velkými cystami na vaječnících s tendencí k prasknutí, zvyšováním tělesné hmotnosti, dyspnoe, oligurií, nebo přítomností ascitu s klinickým obrazem oběhové dysfunkce. Závažný OHSS může být ve vzácných případech komplikován hemoperitoneem, akutní respirační tísní, torzí ovária a tromboembolismem.
K minimalizaci rizika OHSS se musí provádět před zahájením léčby a dále v pravidelných intervalech během léčby ultrazvukové vyšetření růstu folikulů a/nebo stanovení hladin sérového estradiolu. U anovulace se riziko OHSS zvyšuje při sérové hladině estradiolu > 1 500 pg/ml (5 400 pmol/l) a při přítomnosti více než 3 folikulů o průměru 14 mm a více. Při technikách asistované reprodukce se riziko OHSS zvyšuje při sérovém estradiolu > 3 000 pg/ml (11 000 pmol/l) a 18 či více folikulech o průměru 11 mm a více.
OHSS na podkladě nadměrné ovariální odpovědi se lze vyhnout vynecháním podání hCG. Pokud se tedy objeví příznaky ovariální hyperstimulace, jako je hladina estradiolu > 5 500 pg/ml (20 000 pmol/l) a/nebo je přítomno celkem 30 a více folikulů, doporučuje se vynechat podání hCG. Pacientce je třeba doporučit vynechání pohlavního styku nebo používání bariérových antikoncepčních metod po dobu minimálně 4 dnů.
Vícečetné těhotenství
U pacientek podstupujících indukci ovulace existuje zvýšená incidence vícečetných těhotenství a porodů (nejčastěji dvojčat) ve srovnání s přirozeným početím. Riziko vícečetného těhotenství při použití technik asistované reprodukce má vztah k počtu implantovaných embryí.
Dodržování doporučeného dávkování přípravku Ovitrelle a režimu podávání spolu s pečlivým sledováním léčby minimalizuje riziko OHSS a vícečetného těhotenství.
Potrat
Procento potratů u žen s anovulací i u žen podstupujících umělé oplodnění je vyšší než v normální populaci, ale je srovnatelné s procenty pozorovanými u žen s jinými poruchami plodnosti.
Ektopická gravidita
Jelikož neplodné ženy podstupující techniky ART, a zejména IVF, mají často tubální abnormality, může být výskyt ektopické gravidity zvýšený. Je důležité provést včas ultrazvukové vyšetření k potvrzení, že se jedná o nitroděložní těhotenství a vyloučení mimoděložního těhotenství.
Kongenitální malformace
Výskyt kongenitálních malformací po ART může být trochu vyšší než po spontánním oplodnění. Má se za to, že původcem toho jsou rozdíly v matečních charakteristikách (např. mateřské vajíčko, spermatické vlastnosti) a vyšší výskyt vícečetných těhotenství.
Tromboembolické příhody
U žen s nedávnou nebo probíhající tromboembolickou nemocí nebo u žen s obecně rozpoznanými rizikovými faktory pro tromboembolické příhody, jako je osobní nebo rodinná anamnéza, může léčba gonadotropiny dále zvýšit riziko výskytu nebo zhoršení průběhu těchto příhod. U těchto žen je nutné zvážit přínos podávání gonadotropinu oproti rizikům. Je třeba vzít v úvahu, že samotné těhotenství, stejně jako OHSS, také přináší zvýšené riziko tromboembolických příhod, jako je plicní embolie, ischemická příhoda nebo infarkt myokardu.
Interference se sérovými nebo močovými testy
V průběhu podávání může přípravek Ovitrelle do deseti dnů ovlivňovat imunologické stanovení sérového nebo močového hCG, což může vést k falešně pozitivnímu výsledku těhotenského testu. Pacientky by o této skutečnosti měly být informovány
Další informace
Během léčby přípravkem Ovitrelle je možná mírná stimulace štítné žlázy, jejíž klinický význam není znám.
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí s přípravkem Ovitrelle a jinými léčivými přípravky, nicméně během léčby hCG nebyly zaznamenány žádné klinicky významné lékové interakce.
4.6 Fertilita, těhotenství a kojení
Neexistuje žádná indikace k použití přípravku Ovitrelle během těhotenství. Nejsou k dispozici žádné klinické údaje týkající se expozice přípravku během těhotenství. Nebyly provedeny reprodukční studie s choriogonadotropinem alfa u zvířat (viz bod 5.3). Potenciální riziko u lidí není známo.
Kojení
Přípravek Ovitrelle není během kojení indikován. Neexistují údaje o vylučování choriogonadotropinu alfa do mléka.
Fertilita
Přípravek Ovitrelle je indikován k použití při poruchách plodnosti (viz bod 4.1).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Předpokládá se, že přípravek Ovitrelle nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Přehled bezpečnostního profilu
Ve srovnávacích studiích s různými dávkami přípravku Ovitrelle byla zjištěna dávkově závislá souvislost následujících nežádoucích účinků s přípravkem Ovitrelle: OHSS a zvracení a nevolnost. OHSS byl pozorován přibližně u 4 % pacientek léčených přípravkem Ovitrelle. Závažný OHSS byl zaznamenán u méně než 0,5 % pacientek (viz bod 4.4).
Seznam nežádoucích účinků
Následující definice se vztahují k četnosti výskytu používané dále: velmi časté (>1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000), velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
Poruchy imunitního systému
Velmi vzácné: mírná až závažná hypersenzitivní reakce, včetně anafylaktické reakce a šoku
Psychiatrické poruchy
Méně časté: deprese, podrážděnost, neklid
Poruchy nervového systému Časté: bolest hlavy
Cévní poruchy
Velmi vzácné: tromboembolismus, většinou asociovaný se závažným OHSS
Gastrointestinální poruchy
Časté: zvracení, nauzea, bolest břicha
Méně časté: průjem
Poruchy kůže a _podkožní tkáně
Velmi vzácné: mírná reverzibilní kožní reakce, projevující se jako vyrážka
Poruchy reprodukčního systému a _prsu Časté: mírný nebo střední OHSS
Méně časté: závažný OHSS, bolesti v prsu
Celkové poruchy a reakce v místě aplikace
Časté: únava, reakce v místě podání injekce
Ektopická gravidita, torze ovaria a další komplikace byly popsány u pacientů po aplikaci hCG. Ty jsou považovány za průvodní jevy vztahující se k technice asistované reprodukce.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Účinky předávkování přípravkem Ovitrelle nejsou známy.
Nicméně existuje možnost, že by se po předávkování přípravkem Ovitrelle vyskytl syndrom OHSS (viz bod 4.4).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Pohlavní hormony a modulátory pohlavního systému, gonadotropiny, ATC kód: G03G A08
Mechanismus účinku
Přípravek Ovitrelle je přípravek obsahující choriový gonadotropin vyráběný rekombinantní DNA technologií. Sekvenci aminokyselin má stejnou jako močový hCG. Choriový gonadotropin se váže na buňky folikulární théky a granulózní vrstvy na transmembránový receptor, který sdílí s luteinizačním hormonem, LH/CG receptor.
Farmakodynamické účinky
Hlavní farmakodynamickou aktivitou u žen je znovuzahájení meiózy ovocytů, prasknutí folikulu (ovulace), tvorby corpus luteum a tvorba progesteronu a estradiolu žlutým tělískem.
U žen působí choriový gonadotropin jako náhrada -vlny luteinizačního hormonu, která spouští ovulaci.
Přípravek Ovitrelle se používá ke spuštění konečného zrání folikulu a rané luteinizaci po použití přípravku ke stimulaci růstu folikulů.
Klinická účinnost a bezpečnost
Ve srovnávacích klinických studiích bylo podání 250 mikrogramů přípravku Ovitrelle stejně účinné jako 5 000 IU a 10 000 IU močového hCG na vyvolání konečného zrání folikulu a rané luteinizace při technikách asistované reprodukce a stejně účinné jako 5 000 IU močového hCG na vyvolání ovulace.
Dosud neexistují známky tvorby protilátek na přípravek Ovitrelle u lidí. Opakované podávání přípravku Ovitrelle bylo testováno pouze na mužích. Klinické testování u žen v indikaci ART a anovulace bylo omezeno na jeden cyklus léčby.
5.2 Farmakokinetické vlastnosti
Po intravenózním podání je choriogonadotropin alfa distribuován do extracelulární tekutiny s distribučním poločasem asi 4,5 hodiny. Rovnovážný distribuční objem a celková clearance jsou 6 l a 0,2 l/hod. Nejsou důkazy, že by se choriogonadotropin alfa metabolizoval či byl vylučován jinak než endogenní hCG.
Po subkutánním podání je choriogonadotropin alfa eliminován z těla s poločasem asi 30 hodin a jeho absolutní biologická dostupnost je asi 40 %.
Srovnávací studie mezi v lyofylizovanou a tekutou formou přípravku ukázala jejich bioekvivalenci.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání a genotoxicity neodhalily žádné zvláštní riziko pro člověka. Studie kancerogenního potenciálu nebyly provedeny. To je odůvodněno bílkovinnou povahou léčivé látky a negativním výsledkem testů na genotoxicitu.
Reprodukční studie nebyly prováděny na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Mannitol
Methionin
Dihydrát hydrogenfosforečnanu sodného Monohydrát dihydrogenfosforečnanu sodného Poloxamer 188
Kyselina fosforečná (pro nastavení pH)
Hydroxid sodný (pro nastavení pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Po otevření musí být léčivý přípravek okamžitě spotřebován.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
6.5 Druh obalu a obsah balení
3 ml zásobní vložka (sklo typu I s pístovou zátkou z bromobutylové gumy a hliníkovým víčkem s bromobutylovou gumou) sestaveným do předplněného pera. Jedno předplněné pero obsahuje 0,5 ml injekčního roztoku.
V balení je 1 předplněné pero a 1 injekční jehla.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Viz „Návodu k použití“ na krabičce.
Pouze k jednorázovému použití. Každou jehlu a pero použijte pouze jednou.
Samostatnou aplikaci přípravku Ovitrelle by měli provádět pouze pacienti, kteří jsou dostatečně proškoleni a mají přístup k odborné pomoci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/00/165/008
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 02/02/2001
Datum posledního prodloužení registrace: 02/02/2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Merck Serono S.A.
Zone Industrielle de l’Ouriettaz
1170 Aubonne
Švýcarsko
Název a adresa výrobce odpovědného za propouštění šarží
Merck Serono S.p.A.
Via delle Magnolie 15 70026 Modugno (Bari)
Itálie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2)
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
KRABIČKA S 1 INJEKČNÍ PŘEDPLNĚNOU INJEKČNÍ STŘÍKAČKOU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
OVITRELLE 250 mikrogramů/0,5 ml, injekční roztok v předplněné injekční stříkačce. Choriogonadotropinum alfa.
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje: 250 mikrogramů (6 500 IU) choriogonadotropinum alfa
3. SEZNAM POMOCNÝCH LÁTEK
Mannitol, methionin, poloxamer 188, kyselina fosforečná (pro nastavení pH), hydroxid sodný (pro nastavení pH), voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
1 předplněná injekční stříkačka obsahující 0,5 ml injekčního roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce. Uchovávejte v původním obalu. Přípravek může být uchováván po dobu 30 dní při teplotě do + 25 °C bez opětovného zchlazení během tohoto období a pokud nebyl během těchto 30 dní spotřebován, musí být zlikvidován.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/00/165/007
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
ovitrelle 250/0,5 ml
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
OVITRELLE 250 mikrogramů, injekční roztok v předplněném peru Choriogonadotropinum alfa
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedno předplněné pero obsahuje: 250 mikrogramů (přibližně 6 500 IU) choriogonadotropinum alfa
3. SEZNAM POMOCNÝCH LÁTEK
Mannitol, methionin, dihydrát hydrogenfosforečnanu sodného, monohydrát dihydrogenfosforečnanu sodného, poloxamer 188, kyselina fosforečná (na úpravu pH), hydroxid sodný (na úpravu pH), voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
1 předplněné pero v 0,5 ml roztoku 1 injekční jehla
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze k jednorázovému použití
Před použitím si přečtěte příbalovou informaci.
Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce. Chraňte před mrazem.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/00/165/008
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
ovitrelle 250 pero
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Ovitrelle 250 mikrogramů/0,5 ml, injekční roztok v předplněné injekční stříkačce Choriogonadotropinum alfa Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
250 mikrogramů/0,5 ml
6. JINÉ
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITRNÍM OBALU OZNAČENÍ pReDPLNĚNÉHO PERA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Ovitrelle 250 mikrogramů, injekční roztok v předplněném peru Choriogonadotropinum alfa Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
250 mikrogramů/0,5 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Ovitrelle 250 mikrogramů/0,5 ml, injekční roztok v předplněné injekční stříkačce
Choriogonadotropin alfa
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Ovitrelle a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Ovitrelle používat
3. Jak se přípravek Ovitrelle používá
4. Možné nežádoucí účinky
5. Jak přípravek Ovitrelle uchovávat
6. Obsah balení a další informace
1. Co je přípravek Ovitrelle a k čemu se používá Co je přípravek Ovitrelle
Přípravek Ovitrelle obsahuje látku nazývanou choriogonadotropin alfa, připravenou v laboratoři speciální technikou rekombinantní DNA. Choriogonadotropin alfa je shodný s hormonem, který se přirozeně vyskytuje ve vašem těle a nazývá se „choriový gonadotropin“, který je zapojen do reprodukce a fertility.
K čemu se přípravek Ovitrelle používá
Přípravek Ovitrelle se používá spolu s ostatními léčivými přípravky:
• Pomáhá při vývoji a prasknutí některých folikulů (z nichž každé z nich obsahuje vajíčko) u žen podstupujících techniky asistované reprodukce (postupy, které vám mohou pomoci otěhotnět), jako „fertilizace in vitro“. Nejprve Vám budou podány jiné léčivé přípravky k povzbuzení růstu a vývoje několika folikulů
• Pomáhá při uvolnění vajíčka z vaječníku (indukce ovulace) u žen, které nejsou schopny produkovat vajíčka („anovulace“) nebo u žen, kterým se tvoří jen málo vajíček („oligo-ovulace“). Nejprve Vám budou podány jiné léčivé přípravky, které navodí růst a prasknutí folikulů.
2. Čemu musíte věnovat pozornost, než začnete přípravek Ovitrelle používat Neužívejte přípravek Ovitrelle
• jestliže jste alergická na choriogonadotropin alfa nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• jestliže máte nádor části mozku zvané „hypotalamus“ nebo „hypofýza“
• máte-li zvětšené vaječníky nebo váčky naplněné tekutinou ve vaječnících (ovariální cysty) neznámého původu.
• trpíte-li nevysvětlitelným krvácením z pochvy
• jestliže máte rakovinu vaječníku, dělohy či prsu
• jestliže u Vás proběhlo mimoděložní těhotenství v posledních třech měsících
• trpíte-li vážným zánětem žil nebo krevními sraženinami v žilách (aktivní tromboembolické onemocnění)
• trpíte-li stavem, který obvykle znemožňuje normální těhotenství, jako je menopauza nebo předčasná menopauza (selhání vaječníků), nebo vývojové vady pohlavních orgánů.
Nepoužívejte přípravek Ovitrelle, pokud se Vás týkají kterékoli z výše uvedených podmínek. Pokud si nejste jistá, konzultujte tuto situaci se svým lékařem před použitím tohoto léčivého přípravku.
Upozornění a opatření
Před zahájením musí být vyšetřena plodnost Vaše a Vašeho partnera lékařem, který má zkušenosti s léčbou poruch plodnosti.
Syndrom hyperstimulace ovarií (OHSS)
Tento lék může zvýšit riziko rozvoje syndromu hyperstimulace ovarií (OHSS). Dochází k němu, pokud se vytvoří příliš mnoho folikulů a stanou se z nich velké cysty.
Pokud máte bolesti v dolní části břicha, přibýváte rychle na váze, pociťujete nevolnost nebo zvracíte nebo máte potíže při dýchání, neaplikujte si injekci přípravku Ovitrelle a tuto situaci ihned oznamte svému lékaři (viz bod 4). Pokud se u Vás vyvíjí OHSS, bude Vám doporučeno nemít pohlavní styk nebo používat bariérové antikoncepční metody po dobu čtyř dní.
Riziko OHSS se snižuje při použití normální dávky přípravku Ovitrelle a pokud jste během léčby pečlivě sledována (např. krevní testy k určení hladiny estradiolu a ultrazvuk).
Vícečetná těhotenství a/nebo porodní komplikace
Při užívání přípravku Ovitrelle máte vyšší riziko otěhotnět současně více plody („vícečetné těhotenství“, obvykle dvojčata), než při přirozeném početí. Vícečetné těhotenství může vést ke zdravotním komplikacím pro Vás nebo Vaše děti. Pokud podstupujete techniky asistované reprodukce, riziko vzniku vícečetného těhotenství souvisí s počtem oplozených vajíček a počtu embryí vložených do vaší dělohy. Vícečetná těhotenství a specifické vlastnosti některých problémů souvisejících s plodností (např. věk) mohou rovněž souviset se zvýšenou pravděpodobností porodních komplikací.
Riziko vícečetného těhotenství se snižuje při použití normální dávku přípravku Ovitrelle a pokud jste během léčby pečlivě sledována (např. krevní testy k určení hladiny estradiolu a ultrazvuk).
Ektopické těhotenství
Těhotenství mimo dělohu (ektopické těhotenství) se může objevit u žen s poškozenými vejcovody (kanálky, které přenášejí vajíčka z vaječníků do dělohy). Lékař proto musí provést včasné ultrazvukové vyšetření, aby se vyloučila možnost mimoděložního těhotenství.
Potrat
Pokud podstupujete techniky asistované reprodukce nebo stimulaci vaječníků k tvorbě vajíček, jste více náchylná k výskytu potratu než průměrná žena.
Problémy s krevními sraženinami (tromboembolické příhody)
Pokud jste měla ve vzdálené nebo nedávné minulosti krevní sraženiny v dolních končetinách nebo v plicích, infarkt myokardu nebo mozkovou mrtvici, nebo pokud k tomu došlo ve Vaší rodině, existuje u Vás vyšší riziko výskytu těchto problémů nebo jejich zhoršení během léčby přípravkem Ovitrelle.
Těhotenské testy
Pokud si provádíte těhotenský test pomocí vyšetření séra nebo moči po použití přípravku Ovitrelle a do deseti dnů po aplikaci, můžete získat falešně pozitivní výsledek testu. Pokud si nejste jistá, konzultujte to se svým lékařem.
Děti a dospívající
Přípravek Ovitrelle není určen k použití u dětí a mladistvých.
Další léčivé přípravky a přípravek Ovitrelle
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užívala nebo které možná budete užívat.
Těhotenství a kojení
Nepoužívejte přípravek Ovitrelle, jestliže jste těhotná nebo kojíte.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete jakýkoli přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Neočekává se, že by přípravek Ovitrelle ovlivnil schopnost řídit vozidla a obsluhovat stroje. Důležité informace o některých složkách přípravku Ovitrelle
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Ovitrelle používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem nebo lékárníkem.
Kolik přípravku se používá
• Doporučená dávka přípravku je 1 předplněná injekční stříkačka (250 mikrogramů/0,5 ml) podávaná jako jednorázová injekce.
• Váš lékaře Vám přesně vysvětlí, kdy si injekci aplikovat.
Použití tohoto léku
• Přípravek Ovitrelle je určen k subkutánnímu podání, to znamená k injekčnímu podání pod kůži .
• Každá předplněná injekční stříkačka je určena k jednorázovému použití. Použít je možno pouze čirý roztok bez jakýchkoli částic.
• Váš lékař nebo zdravotní sestra Vám ukáže, jak přípravek Ovitrelle injekční stříkačka aplikovat.
• Přípravek Ovitrelle aplikujte tak, jak Vás učil lékař nebo zdravotní sestra.
• Po aplikaci injekce bezpečným způsobem odstraňte jehlu.
Pokud si sama podáváte přípravek Ovitrelle, pozorně si přečtěte následující pokyny:
1. Umyjte si ruce. Je důležité, aby Vaše ruce a všechny používané prostředky byly co nejčistší.
2. Připravte si vše, co budete potřebovat. Pamatujte, že tampóny napuštěné alkoholem nejsou součástí balení. Najděte si čistou plochu a na ni položte věci potřebné k aplikaci.
- 2 tampónky napuštěné alkoholem,
- 1 předplněnou injekční stříkačku s lékem,
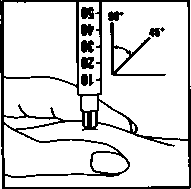
Roztok okamžitě aplikujte: Lékař nebo zdravotní sestra Vám již poradili, kam injekci podat (např. břicho, přední část stehna). Očistěte zvolené místo alkoholovým tampónem. Pevně stiskněte kůži k sobě a vpíchněte jehlu pod úhlem 45° až 90° pohybem jako při hodu šipky. Vstříkněte obsah stříkačky pod kůži, jak jste byla poučena. Nevpichujte přímo do žíly. Vstřikujte pomalu celý obsah roztoku. Poté jehlu ihned vyjměte a očistěte místo injekce alkoholovým tampónem krouživým pohybem.
3.
Injekce:
4. Vyhoďte všechny použité potřeby:
Po dokončení injekce ihned vyhoďte prázdnou stříkačku do pevné nádoby. Všechen nespotřebovaný roztok musí být vyhozen.
Jestliže jste použila více přípravku Ovitrelle, než jste měla
Při použití nadměrného množství přípravku Ovitrelle je možný výskyt syndromu hyperstimulace.Okamžitě vyhledejte lékaře, pokud by se u Vás vyskytly bolesti dolní části břicha, rychle jste přibrala na váze, pociťovala nevolnost nebo se vyskytlo zvracení nebo dechové obtíže.
Jestliže jste zapomněla použít přípravek Ovitrelle
Pokud zapomenete použít přípravek Ovitrelle, oznamte to prosím co nejdříve svému lékaři.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud zaznamenáte některý z následujících závažných nežádoucích účinků, přestaňte okamžitě používat přípravek Ovitrelle a ihned navštivte lékaře - mohla byste potřebovat urgentní lékařskou léčbu:
• Alergické reakce jako je rychlý nebo nepravidelný puls, zduření jazyka a hrdla, kýchání, sípání nebo vážné dechové obtíže jsou velmi vzácné (mohou se vyskytnout až u 1 z 10 000 osob).
• Bolest v dolní části břicha společně s nevolností nebo zvracením mohou být příznaky syndromu hyperstimulace ovarií (OHSS). To může znamenat, že vaječníky zvýšeně reagují na léčbu a dochází vývoji velkých vaječníkových cyst (viz také bod 2 „Syndrom hyperstimulace ovarií (OHSS)“). Tento nežádoucí účinek je častý (může se vyskytnout až u 1 z 10 osob).
• OHSS se může stát vážným s jasně zvětšenými vaječníky, sníženou tvorbou moči, přibýváním na váze, obtížemi oři dýchání a možnou akumulací tekutiny v žaludku nebo hrudníku. Tento nežádoucí účinek je méně častý (může se vyskytnout až u 1 ze 100 osob).
• Závažné komplikace týkající se srážení krve (tromboembolické příhody) nezávislé na OHSS se objevují velmi vzácně. To může způsobit bolesti na hrudi, zástavu dechu, mozkovou mrtvici nebo infarkt myokardu (viz také bod 2 pod názvem „Problémy s krevními sraženinami“).
Další nežádoucí účinky
Časté (mohou se vyskytnout až u 1 z 10 osob)
• Bolest hlavy, únava
• Lokální reakce v místě aplikace injekce, bolest, zarudnutí nebo otok.
Méně časté (mohou se vyskytnout až u 1 ze 100 osob)
• Průjem
• Deprese, podrážděnost nebo neklid
• Bolesti prsů
Velmi vzácné (mohou se vyskytnout až u 1 z 10 000 osob)
• Mírná kožní alergická reakce, například vyrážka.
Těhotenství mimo dělohu, torze vaječníku (stav postihující vaječníky) a další komplikace mohou vzniknout na základě technik asistované reprodukce aplikovaných Vaším lékařem.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Ovitrelle uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a na krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C). Uchovávejte v původním obalu. Injekční roztok Ovitrelle 250 mikrogramů může být uchováván při pokojové teplotě (do + 25 °C) po dobu 30 dní bez opětovného zchlazení během tohoto období a musí být zlikvidován, pokud není během těchto 30 dní spotřebován.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Ovitrelle obsahuje
• Léčivou látkou je choriogonadotropinum alfa, je vyráběn rekombinantní DNA technologií.
• Každá předplněná injekční stříkačka obsahuje 250 mikrogramů/0,5 ml (což odpovídá 6 500 IU).
• Dalšími složkami jsou mannitol, methionin, poloxamer 188, kyselina fosforečná, hydroxid sodný, voda na injekci.
Jak přípravek Ovitrelle vypadá a co obsahuje toto balení
Přípravek Ovitrelle se dodává jako injekční roztok. Je dostupný v předplněné injekční stříkačce (balení po 1 stříkačce).
Držitel rozhodnutí o registraci
Merck Serono Europe Limited, 56 Marsh Wall, London E14 9TP, Velká Británie.
Výrobce
Merck Serono S.p.A., Via delle Magnolie 15, 70026 Modugno (Bari), Itálie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien MERCK NV/SA Tél/Tel: +32-2-686 07 11 |
Lietuva Merck Serono UAB Tel: +370 37320603 |
|
BtnrapHH „MepK EtnrapHa“ EAfl Ten.: +359 24461 111 |
Luxembourg/Luxemburg MERCK NV/SA, Belgique/Belgien Tél/Tel: +32-2-686 07 11 |
|
Česká republika Merck spol.s.r.o Tel. +420 272084211 |
Magyarország Merck Kft. Tel: +36-1-463-8100 |
|
Danmark Merck A/S Tlf: +45 35253550 |
Malta Cherubino Ltd Tel: +356-21-343270/1/2/3/4 |
|
Deutschland Merck Serono GmbH Tel: +49-6151-6285-0 |
Nederland Merck BV Tel: +31-20-6582800 |
|
Eesti Merck Serono OU Tel: +372 682 5882 |
Norge Merck Serono Norge Tlf: +47 67 90 35 90 |
|
EAAáSa Merck A.E. T^A: +30-210-61 65 100 |
Osterreich Merck GesmbH. Tel: +43 1 57600-0 |
|
Espaňa Merck S.L. Línea de Información: 900 200 400 Tel: +34-91-745 44 00 |
Polska Merck Sp. z o.o. Tel.: +48 22 53 59 700 |
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Románia MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
Ovitrelle 250 mikrogramů, injekční roztok v předplněném peru
Choriogonadotropin alfa
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Ovitrelle a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Ovitrelle používat
3. Jak se přípravek Ovitrelle používá
4. Možné nežádoucí účinky
5. Jak přípravek Ovitrelle uchovávat
6. Obsah balení a další informace
1. Co je přípravek Ovitrelle a k čemu se používá Co je přípravek Ovitrelle
Přípravek Ovitrelle obsahuje látku nazývanou choriogonadotropin alfa, připravenou v laboratoři speciální technikou rekombinantní DNA. Choriogonadotropin alfa je shodný s hormonem, který se přirozeně vyskytuje ve vašem těle a nazývá se „choriový gonadotropin“, který je zapojen do reprodukce a fertility.
K čemu se přípravek Ovitrelle používá
Přípravek Ovitrelle se používá spolu s ostatními léčivými přípravky:
• Pomáhá při vývoji a prasknutí některých folikulů (z nichž každé z nich obsahuje vajíčko) u žen podstupujících techniky asistované reprodukce (postupy, které vám mohou pomoci otěhotnět), jako „fertilizace in vitro“. Nejprve Vám budou podány jiné léčivé přípravky k povzbuzení růstu a vývoje několika folikulů
• Pomáhá při uvolnění vajíčka z vaječníku (indukce ovulace) u žen, které nejsou schopny produkovat vajíčka („anovulace“) nebo u žen, kterým se tvoří jen málo vajíček („oligo-ovulace“). Nejprve Vám budou podány jiné léčivé přípravky, které navodí růst a prasknutí folikulů.
2. Čemu musíte věnovat pozornost, než začnete přípravek Ovitrelle používat Neužívejte přípravek Ovitrelle
• jestliže jste alergická na choriogonadotropin nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• jestliže máte nádor části mozku zvané „hypotalamus“ nebo „hypofýza“
• máte-li zvětšené vaječníky nebo váčky naplněné tekutinou ve vaječnících (ovariální cysty) neznámého původu.
• trpíte-li nevysvětlitelným krvácením z pochvy
• jestliže máte rakovinu vaječníku, dělohy či prsu
• jestliže u Vás proběhlo mimoděložní těhotenství v posledních třech měsících
• trpíte-li vážným zánětem žil nebo krevními sraženinami v žilách (aktivní tromboembolické onemocnění)
• trpíte-li stavem, který obvykle znemožňuje normální těhotenství, jako je menopauza nebo předčasná menopauza (selhání vaječníků), nebo vývojové vady pohlavních orgánů.
Nepoužívejte přípravek Ovitrelle, pokud se Vás týkají kterékoli z výše uvedených podmínek. Pokud si nejste jistá, konzultujte tuto situaci se svým lékařem před použitím tohoto léčivého přípravku.
Upozornění a opatření
Před zahájením musí být vyšetřena plodnost Vaše a Vašeho partnera lékařem, který má zkušenosti s léčbou poruch plodnosti.
Syndrom hyperstimulace ovarií (OHSS)
Tento lék může zvýšit riziko rozvoje syndromu hyperstimulace ovarií (OHSS). Dochází k němu, pokud se vytvoří příliš mnoho folikulů a stanou se z nich velké cysty.
Pokud máte bolesti v dolní části břicha, přibýváte rychle na váze, pociťujete nevolnost nebo zvracíte nebo máte potíže při dýchání, neaplikujte si injekci přípravku Ovitrelle a tuto situaci ihned oznamte svému lékaři (viz bod 4). Pokud se u Vás vyvíjí OHSS, bude Vám doporučeno nemít pohlavní styk nebo používat bariérové antikoncepční metody po dobu čtyř dní.
Riziko OHSS se snižuje při použití normální dávky přípravku Ovitrelle a pokud jste během léčby pečlivě sledována (např. krevní testy k určení hladiny estradiolu a ultrazvuk).
Vícečetná těhotenství a/nebo porodní komplikace
Při užívání přípravku Ovitrelle máte vyšší riziko otěhotnět současně více plody („vícečetné těhotenství“, obvykle dvojčata), než při přirozeném početí. Vícečetné těhotenství může vést ke zdravotním komplikacím pro Vás nebo Vaše děti. Pokud podstupujete techniky asistované reprodukce, riziko vzniku vícečetného těhotenství souvisí s počtem oplozených vajíček a počtu embryí vložených do vaší dělohy. Vícečetná těhotenství a specifické vlastnosti některých problémů souvisejících s plodností (např. věk) mohou rovněž souviset se zvýšenou pravděpodobností porodních komplikací.
Riziko vícečetného těhotenství se snižuje při použití normální dávky přípravku Ovitrelle a pokud jste během léčby pečlivě sledována (např. krevní testy k určení hladiny estradiolu a ultrazvuk).
Ektopické těhotenství
Těhotenství mimo dělohu (ektopické těhotenství) se může objevit u žen s poškozenými vejcovody (kanálky, které přenášejí vajíčka z vaječníků do dělohy). Lékař proto musí provést včasné ultrazvukové vyšetření, aby se vyloučila možnost mimoděložního těhotenství.
Potrat
Pokud podstupujete techniky asistované reprodukce nebo stimulaci vaječníků k tvorbě vajíček, jste více náchylná k výskytu potratu než průměrná žena.
Problémy s krevními sraženinami (tromboembolické příhody)
Pokud jste měla ve vzdálené nebo nedávné minulosti krevní sraženiny v dolních končetinách nebo v plicích, infarkt myokardu nebo mozkovou mrtvici, nebo pokud k tomu došlo ve Vaší rodině, existuje u Vás vyšší riziko výskytu těchto problémů nebo jejich zhoršení během léčby přípravkem Ovitrelle.
Těhotenské testy
Pokud si provádíte těhotenský test pomocí vyšetření séra nebo moči po použití přípravku Ovitrelle a do deseti dnů po aplikaci, můžete získat falešně pozitivní výsledek testu. Pokud si nejste jistá, konzultujte to se svým lékařem.
Děti a dospívající
Přípravek Ovitrelle není určen k použití u dětí a mladistvých.
Další léčivé přípravky a přípravek Ovitrelle
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užívala nebo které možná budete užívat.
Těhotenství a kojení
Nepoužívejte přípravek Ovitrelle, jestliže jste těhotná nebo kojíte.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete jakýkoli přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Neočekává se, že by přípravek Ovitrelle ovlivnil schopnost řídit vozidla a obsluhovat stroje. Důležité informace o některých složkách přípravku Ovitrelle
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Ovitrelle používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem nebo lékárníkem.
Kolik přípravku se používá
• Doporučená dávka přípravku je 1 předplněné pero (250 mikrogramů/0,5 ml) podávaná jako jednorázová injekce.
• Váš lékaře Vám přesně vysvětlí, kdy si injekci aplikovat.
Použití tohoto léku
• Přípravek Ovitrelle je určen k injekčnímu podání pod kůži (subkutánně).
• Každé předplněné pero je určeno k jednorázovému použití.
• Váš lékař nebo zdravotní sestra vám ukáže, jak předplněné pero Ovitrelle používat k injekčnímu podání léčivého přípravku.
• Pokud si sama aplikujete přípravek Ovitrelle, čtěte prosím pečlivě následující instrukce „Návodu k použití“ na krabičce.
• Přípravek Ovitrelle aplikujte tak, jak Vás učil lékař nebo zdravotní sestra.
• Po aplikaci injekce bezpečným způsobem odstraňte jehlu a pero zlikvidujte
Jestliže jste použila více přípravku Ovitrelle, než jste měla
Při použití nadměrného množství Ovitrelle je možný výskyt syndromu hyperstimulace. Okamžitě vyhledejte lékaře, pokud by se u Vás vyskytly bolesti dolní části břicha, rychle jste přibrala na váze, pociťovala nevolnost nebo se vyskytlo zvracení nebo dechové obtíže.
Jestliže jste zapomněla použít přípravek Ovitrelle
Pokud zapomenete použít přípravek Ovitrelle, oznamte to prosím co nejdříve svému lékaři.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud zaznamenáte některý z následujících závažných nežádoucích účinků, přestaňte okamžitě používat přípravek Ovitrelle a ihned navštivte lékaře - mohla byste potřebovat urgentní lékařskou léčbu:
• Alergické reakce jako je rychlý nebo nepravidelný puls, zduření jazyka a hrdla, kýchání, sípání nebo vážné dechové obtíže jsou velmi vzácné (mohou se vyskytnout až u 1 z 10 000 osob).
• Bolest v dolní části břicha společně s nevolností nebo zvracením mohou být příznaky syndromu hyperstimulace ovarií (OHSS). To může znamenat, že vaječníky zvýšeně reagují na léčbu a dochází vývoji velkých vaječníkových cyst (viz také bod 2 „Syndrom hyperstimulace ovarií (OHSS)“). Tento nežádoucí účinek je častý (může se vyskytnout až u 1 z 10 osob).
• OHSS se může stát vážným s jasně zvětšenými vaječníky, sníženou tvorbou moči, přibýváním na váze, obtížemi oři dýchání a možnou akumulací tekutiny v žaludku nebo hrudníku. Tento nežádoucí účinek je méně častý (může se vyskytnout až u 1 ze 100 osob).
• Závažné komplikace týkající se srážení krve (tromboembolické příhody) nezávislé na OHSS se objevují velmi vzácně. To může způsobit bolesti na hrudi, zástavu dechu, mozkovou mrtvici nebo infarkt myokardu (viz také bod 2 pod názvem „Problémy s krevními sraženinami“).
Další nežádoucí účinky
Časté (mohou se vyskytnout až u 1 z 10 osob)
• Bolest hlavy, únava
• Lokální reakce v místě aplikace injekce, bolest, zarudnutí nebo otok.
Méně časté (mohou se vyskytnout až u 1 ze 100 osob)
• Průjem
• Deprese, podrážděnost nebo neklid
• Bolesti prsů
Velmi vzácné (mohou se vyskytnout až u 1 z 10 000 osob)
• Mírná kožní alergická reakce, například vyrážka.
Těhotenství mimo dělohu, torze vaječníku (stav postihující vaječníky) a další komplikace mohou vzniknout na základě technik asistované reprodukce aplikovaných Vaším lékařem.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Ovitrelle uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a na krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Nepoužívejte přípravek Ovitrelle, pokud si všimnete viditelných známek poškození, roztok není čirý nebo obsahuje částice.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Ovitrelle obsahuje
• Léčivou látkou je choriogonadotropinum alfa, který byl vytvořen technologií rekombinantní DNA na buňkách ovarií křečíka čínského (CHO).
• Každé předplněné pero obsahuje 250 mikrogramů choriogonadotropinum alfa v 0,5 ml (což odpovídá přibližně 6 500 mezinárodních jednotek IU).
• Dalšími složkami jsou mannitol, methionin, dihydrát hydrogenfosforečnanu sodného, monohydrát dihydrogenfosforečnanu sodného, poloxamer 188, kyselina fosforečná (na úpravu pH), hydroxid sodný (na úpravu pH), voda na injekci.
Jak přípravek Ovitrelle vypadá a co obsahuje toto balení
• Ovitrelle se dodává jako čirý, bezbarvý až lehce nažloutlý injekční roztok v předplněném peru.
• Jedno předplněné pero obsahuje 0,5 ml injekčního roztoku.
• V balení se dodává 1 předplněné pero a 1 jehla na jedno použití pro injekce.
Držitel rozhodnutí o registraci
Merck Serono Europe Limited, 56 Marsh Wall, London E14 9TP, Velká Británie.
Výrobce
Merck Serono S.p.A., Via delle Magnolie 15, 70026 Modugno (Bari), Itálie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
MERCK NV/SA Tél/Tel: +32-2-686 07 11
Bt^rapuu
„MepK Btarapua“ EAfl Ten.: +359 24461 111
Česká republika
Merck spol.s.r.o Tel. +420 272084211
Danmark
Merck A/S Tlf: +45 35253550
Deutschland
Merck Serono GmbH Tel: +49-6151-6285-0
Eesti
Merck Serono OU Tel: +372 682 5882
EAAúha Merck A.E.
T^A: +30-210-61 65 100
Espaňa
Merck S.L.
Línea de Información: 900 200 400 Tel: +34-91-745 44 00
Lietuva
Merck Serono UAB Tel: +370 37320603
Luxembourg/Luxemburg
MERCK NV/SA, Belgique/Belgien Tél/Tel: +32-2-686 07 11
Magyarország
Merck Kft.
Tel: +36-1-463-8100
Malta
Cherubino Ltd
Tel: +356-21-343270/1/2/3/4
Nederland
Merck BV
Tel: +31-20-6582800 Norge
Merck Serono Norge Tlf: +47 67 90 35 90
Osterreich
Merck GesmbH.
Tel: +43 1 57600-0
Polska
Merck Sp. z o.o.
Tel.: +48 22 53 59 700
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Románia MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nana^or^ou AtS Tn^.: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Ovitrelle 250 mikrogramů injekční roztok v předplněném peru
Návod k použití
OBSAH
1. Jak používat předplněné pero Ovitrelle
2. Než začnete předplněné pero používat
3. Příprava předplněného pera pro injekci
4. Nastavení dávky - „Jak nastavit dávku na 250“
5. Aplikace dávky
6. Po injekci
1. Jak používat předplněné pero Ovitrelle
• Než začnete předplněné pero používat, přečtěte si nejprve všechny následující pokyny.
• Toto pero používejte pouze Vy, nepůjčujte ho nikomu dalšímu.
• Aplikujte injekci přípravku Ovitrelle podle instrukcí svého lékaře nebo zdravotní sestry.
• Toto pero je jen na jedno použití.
2. Než začnete předplněné pero používat
2.1. Umyjte si ruce
• Je důležité, aby Vaše ruce a všechny věci, které budete používat při přípravě pera, byly co možná nejčistší.
2.2. Najděte si nějaké čisté místo
• Vhodným místem je například čistý stůl nebo pracovní deska linky.
2.3. Připravte si všechny věci, které budete potřebovat, a rozložte si je na pracovní ploše:
• tamponky namočené v alkoholu
• předplněné pero
• jehlu.
Obrázek dole ukazuje, jak předplněné pero vypadá, zároveň s označením jednotlivých součástí:
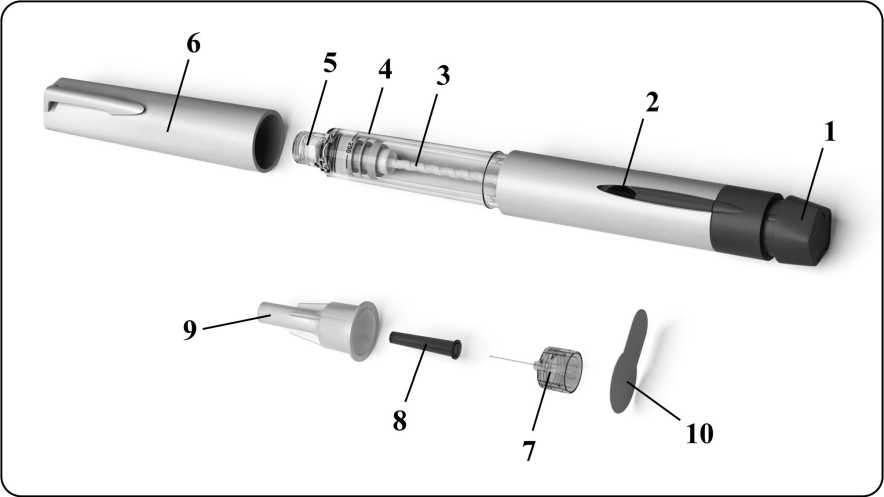
|
1. |
tlačítko pro nastavení dávky |
6. |
krytka pera |
|
2. |
displej dávky |
7. |
odstranitelná jehla |
|
3. |
plunžrový píst |
8. |
vnitřní ochrana jehly |
|
4. |
držák nádržky |
9. |
vnější kryt jehly |
|
5. |
konektor jehly se závitem |
10. |
snímací poutko |
|
3. |
Příprava předplněného pera pro injekci | ||
|
3.1. |
Sejměte víčko pera |
3.2. Nasaďte jehlu
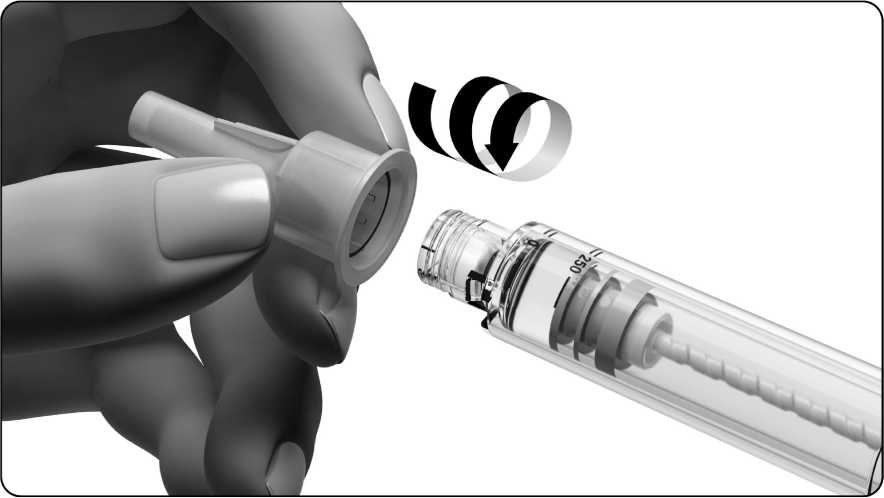
• Vezměte si jehlu. Použijte pouze jehlu na jedno použití dodávanou k předplněnému peru Ovitrelle
• Zkontrolujte, zda není snímací poutko na vnějším krytu jehly poškozené nebo uvolněné. UPOZORNĚNÍ:
Pokud je snímací poutko poškozené nebo uvolněné, jehlu nepoužívejte a vezměte si jinou. Nepoužitou jehlu s nasazeným vnějším víčkem vyhoďte. Zeptejte se svého lékárníka, jak likvidovat jehly, které již nepotřebujete.
• Odstraňte snímací poutko ke krytu jehly.
• Vnější kryt jehly pevně uchopte.
• Hrot pera se závitem zatlačte do vnějšího krytu jehly a šroubujte vnější kryt jehly, dokud nebude pevně dotažen.
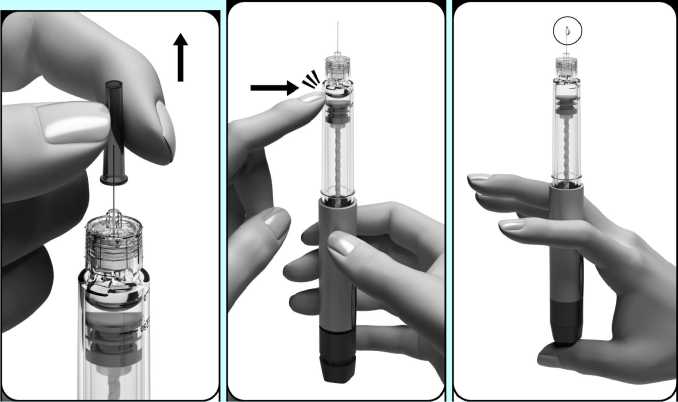
• Odstraňte vnější kryt jehly opatrným vytažením. Ponechejte vnitřní ochranu jehly na místě.
• Nezahazujte vnější kryt jehly; budete ho potřebovat při odstraňování jehly z předplněného pera.
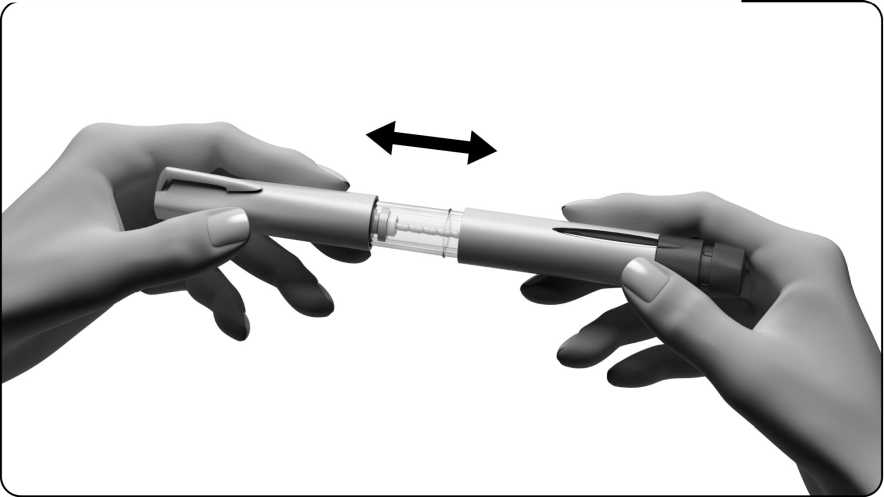
3.3. Nejprve odstraňte všechny velké vzduchové bubliny
• Pozorně sledujte držák nádržky.
• Jestliže nevidíte velké vzduchové bubliny, předplněné pero je připraveno k použití. Přejděte přímo ke kroku „4. Jak nastavit dávku na 250“.
Jako velkou vzduchovou bublinu označujeme bublinu, která vyplňuje hrot držáku nádržky, držíte-li předplněné pero tak, že jehla směřuje nahoru (viz obrázek). Jestliže uvnitř držáku nádržky vidíte velké vzduchové bubliny, musíte je odstranit. Mohou se zde nacházet malé bubliny, které ulpívají na vnitřní stěně držáku nádržky pera. Malých bublinek se nemusíte obávat, není třeba je odstraňovat.

Odstranění velké vzduchové bubliny:
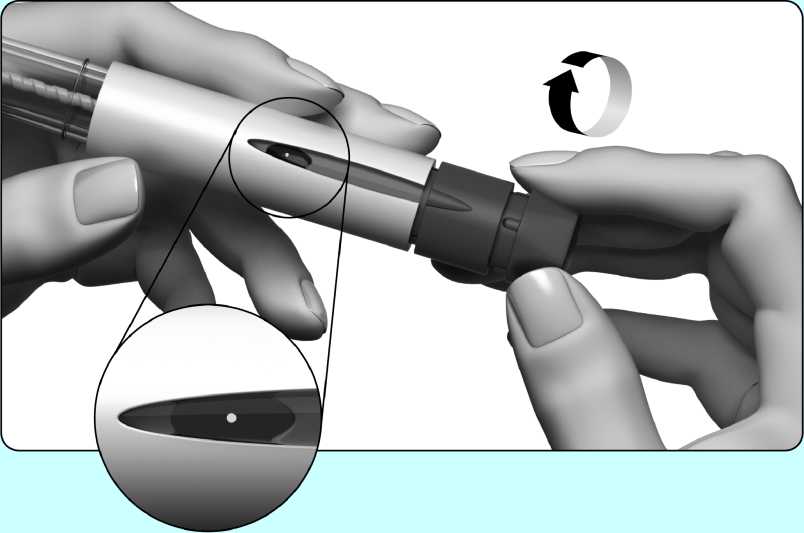
1. Opatrně otáčejte tlačítkem pro nastavení dávky ve směru hodinových ručiček, až se na displeji dávky objeví tečka (•). Jestliže tuto polohu přejdete, jednoduše otáčejte tlačítkem pro nastavení
dávky zpět až k tečce (•).
2. Odstraňte vnitřní ochranu jehly a držte pero s jehlou směřující nahoru.
3. Prstem jemně poklepejte na držák nádržky, aby vzduchové bubliny vystoupaly nahoru k jehle. S jehlou směřující stále nahoru stiskněte pomalu tlačítko pro nastavení dávky tak daleko, jak jen to je možné.
4. Na špičce jehly se musí objevit kapka tekutiny. To znamená, že je předplněné pero připraveno k použití.
5. Jestliže tekutinu nevidíte, můžete to zkusit podruhé (můžete to provést maximálně dvakrát) počínaje krokem 1 bodu „Odstranění velké vzduchové bubliny“ výše.
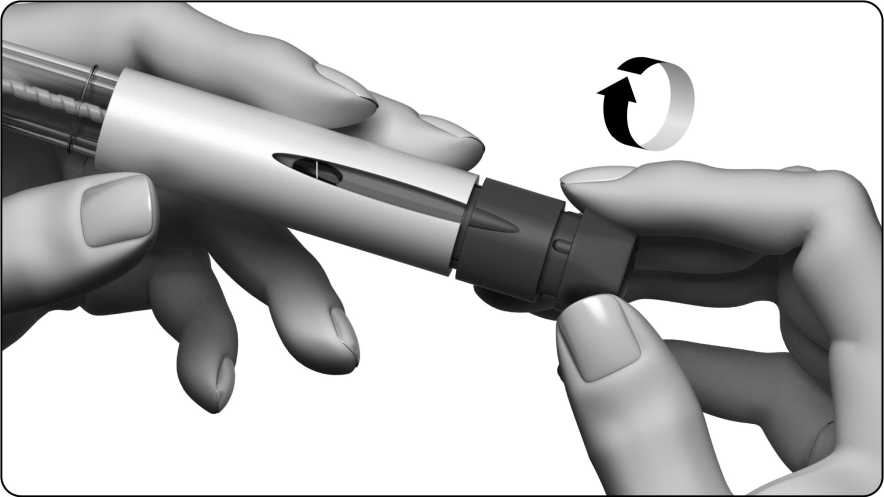
Opatrně otáčejte tlačítkem pro nastavení dávky ve směru hodinových ručiček. Displej dávky zobrazí rovnou čáru a Vy pokračujete v otáčení, až na displeji uvidíte číslo 250.
Během otáčení za tlačítko pro nastavení dávky netahejte ani jej nezatlačujte.
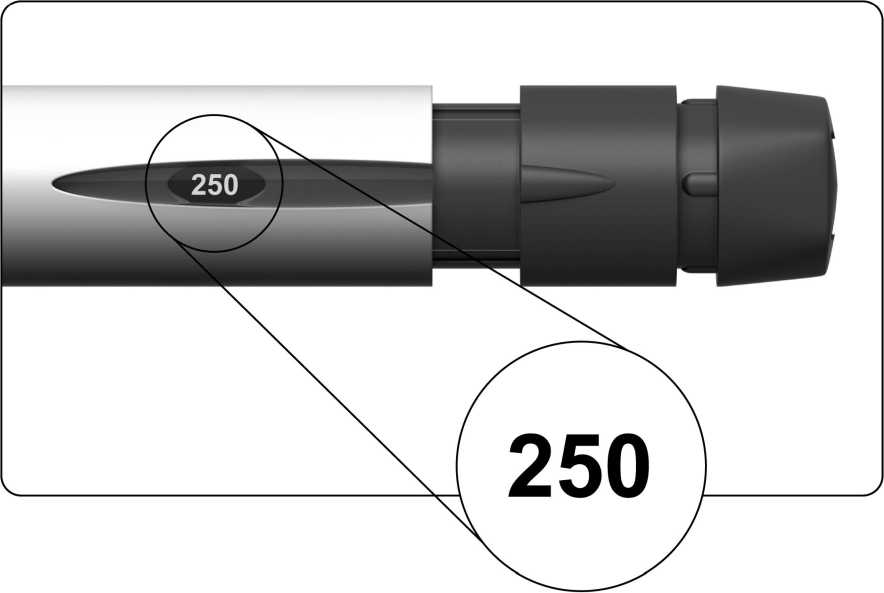
Displej dávky zobrazí "250", viz obrázek níže.
5. Aplikace dávky
5.1. Zvolte si místo pro aplikaci dávky - podle doporučení lékaře nebo zdravotní sestry.
5.2. Pokožku v místě aplikace injekce otřete tamponkem navlhčeným v alkoholu.
5.3. Znovu zkontrolujte, zda se na displeji dávky zobrazuje číslo 250. Jestliže se nezobrazuje, musíte hodnotu upravit (viz krok „4. Nastavení dávky na 250“).
5.4. Opatrně odstraňte vnitřní ochranu jehly a vyhoďte ji, pokud tak již nebylo učiněno v kroku „3.3 Nejprve odstraňte všechny velké vzduchové bubliny“ , když se odstraňoval vzduch.
5.5. Aplikujte si dávku podle pokynů lékaře nebo zdravotní sestry.
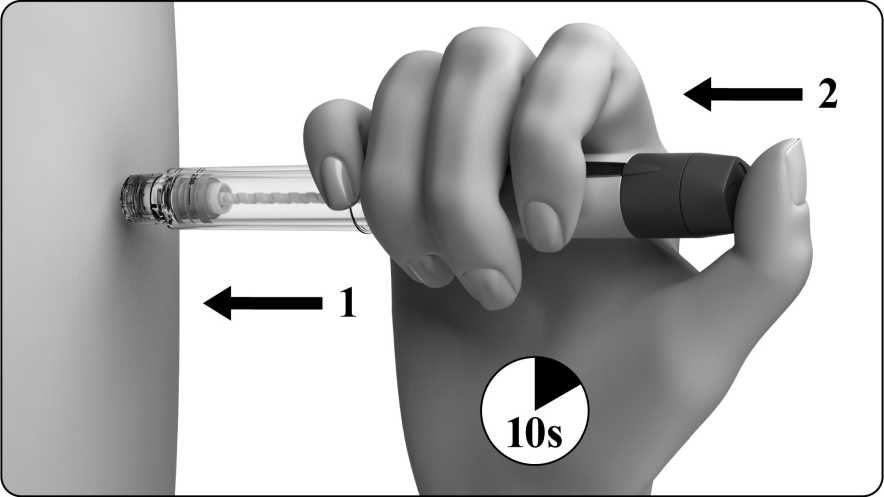
• Nejprve opatrně vložte jehlu na pokožku a potom stiskněte tlačítko pro nastavení dávky, jak nejvíc to půjde, jak je znázorněno na obrázku níže.
• Jehlu musíte ponechat zapíchnutou v pokožce alespoň 10 sekund. Tlačítko pro nastavení dávky musí zůstat po celou dobu stisknuté.
• Číslo dávky zobrazené na displeji dávky se vrátí na 0. To znamená, že byla aplikována celá dávka.
• Po 10 sekundách vytáhněte jehlu z pokožky. Tlačítko pro nastavení dávky přitom držte stále stisknuté.
6. Po injekci
6.1 Zkontrolujte, zda displej dávky zobrazuje 0.
• To potvrzuje, že dávka byla podána celá. Nepokoušejte se opakovat aplikaci dávky.
• V případě, že na displeji není zobrazena 0, kontaktujte svého lékaře nebo lékárníka.

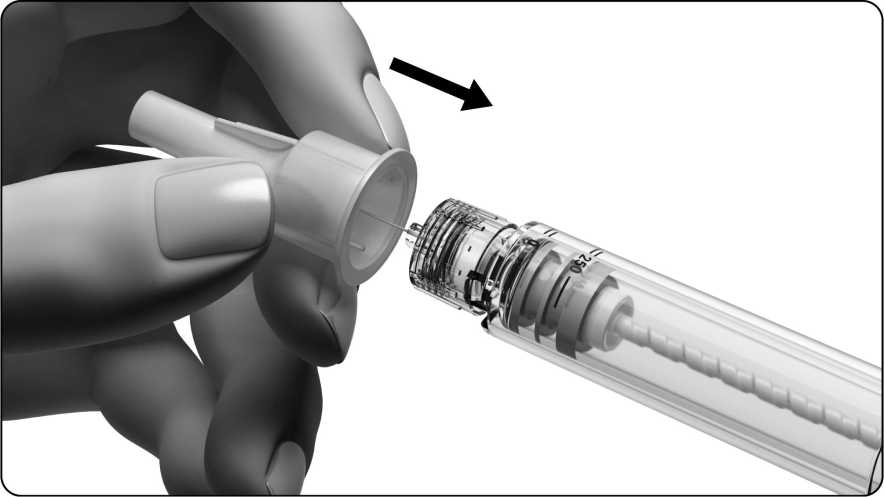
6.2 Sejmutí jehly
• Držte předplněné pero pevně za držák nádržky.
• Vnější kryt jehly opatrně nasaďte zpátky na jehlu.
Uchopte jehlu za vnější kryt a odšroubujte ji.
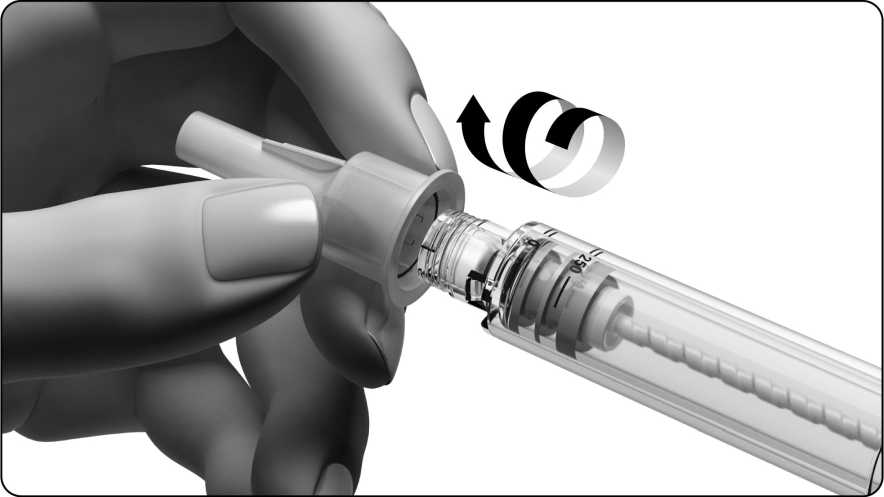
• Dávejte pozor, abyste se jehlou nepíchli.
• Nyní nasaďte krytku zpět na pero.
6.3 Likvidace
• Každou jehlu a každé pero použijte pouze jednou.
• Po dokončení injekce bezpečně odstraňte použitou jehlu a pero zlikvidujte.
• Doporučujeme vložit ho zpátky do původního obalu. Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Když je pero prázdné, zeptejte se svého lékárníka, jak ho máte zlikvidovat.
47
Ženy s anovulací nebo oligo-ovulací:
Podává se jedna předplněná injekční stříkačka přípravku Ovitrelle (250 mikrogramů) 24 až 48 hodin po dosažení optimální stimulace růstu folikulů. Pacientce se doporučuje mít pohlavní styk v ten samý den a den po injekci přípravku Ovitrelle.
Ženy s anovulací nebo oligo-ovulací
Podává se jedno předplněné pero přípravku Ovitrelle (250 mikrogramů) 24 až 48 hodin po dosažení optimální stimulace růstu folikulů. Pacientce se doporučuje mít pohlavní styk v ten samý den a den po injekci přípravku Ovitrelle.