Olanzapin Actavis 5 Mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
Krabička na jednodávkové blistry se slupovací folií
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Olanzapin Actavis 5 mg Tablety dispergovatelné v ústech Olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 5 mg.
Obsahuje aspartam (E951), který je zdrojem fenylalaninu. Může být škodlivý pro osoby s fenylketonurií.
7 tablet dispergovatelných v ústech 14 tablet dispergovatelných v ústech 28 tablet dispergovatelných v ústech 30 tablet dispergovatelných v ústech 35 tablet dispergovatelných v ústech 56 tablet dispergovatelných v ústech 70 tablet dispergovatelných v ústech 96 tablet dispergovatelných v ústech 100 tablet dispergovatelných v ústech
Perorální podání
Před použitím si přečtěte příbalovou informaci.
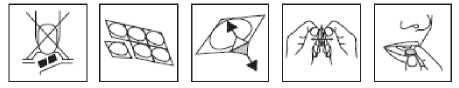
1. Mějte suché ruce. Nevytlačujte tabletu z blistru.
2. Oddělte jeden dílek blistru od stripu.
3. Opatrně sloupněte folii.
4. Vyjměte tabletu.
5. Vložte tabletu do úst.
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Nepoužitelné léčivo vraťte do lékárny.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Actavis Group PTC ehf Reykjavikurvegur 76-78 220 Hafnarfjordur Island
12 REGISTRAČNÍ ČÍSLO/ČÍSLA
Reg. č.: 68/400/08-C 13 ČÍSLO ŠARŽE
Č. šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
olanzapin actavis 5 mg
Olanzapin Actavis 5 mg Tablety dispergovatelné v ústech Olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 5 mg.
Obsahuje aspartam (E951), který je zdrojem fenylalaninu. Může být škodlivý pro osoby s fenylketonurií.
7 tablet dispergovatelných v ústech 14 tablet dispergovatelných v ústech 28 tablet dispergovatelných v ústech 30 tablet dispergovatelných v ústech 35 tablet dispergovatelných v ústech 56 tablet dispergovatelných v ústech 70 tablet dispergovatelných v ústech 100 tablet dispergovatelných v ústech
Perorální podání
Před použitím si přečtěte příbalovou informaci.
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Nepoužitelné léčivo vraťte do lékárny.
Tt název a adresa držitele rozhodnutí o registraci
Actavis Group PTC ehf Reykjavikurvegur 76-78 220 Hafnarfjordur Island
12. registrační císlo/císla
Reg. č.: 68/400/08-C
13. ČÍSLO ŠARŽE
Č. šarže:
14. klasifikace pro výdej
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ 16. informace v braillove písmu olanzapin actavis 5 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH Jednodávkové blistry se slupovací fólií a blistry s protrhávací folií_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Olanzapin Actavis 5 mg Tablety dispergovatelné v ústech Olanzapinum
2 NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Actavis Group PTC ehf
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
LOT
5. JINÉ
Olanzapin Actavis 5 mg Tablety dispergovatelné v ústech Olanzapinum
Jedna tableta dispergovatelná v ústech obsahuje olanzapinum 5 mg.
Obsahuje aspartam (E951), který je zdrojem fenylalaninu. Může být škodlivý pro osoby s fenylketonurií.
30 tablet dispergovatelných v ústech 100 tablet dispergovatelných v ústech
Perorální podání
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Upozornění! Lahvička obsahuje vysoušedlo, nepolykejte!
EXP
Uchovávejte v dobře uzavřeném původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Nepoužitelné léčivo vraťte do lékárny.
Actavis Group PTC ehf Reykjavikurvegur 76-78 220 Hafnarfjordur
Island 12. REGISTRAČNÍ CÍSLO/CÍSLA
Reg. č.: 68/400/08-C 13 ČÍSLO ŠARŽE
Č. šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis. 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
pouze na krabičce: olanzapin actavis 5 mg
7/7