Octanate 1 000 Iu/5 Ml
sp. zn. sukls3115/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Octanate 1000 IU/5 ml
prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička a obsahuje factor VIII coagulationis humanus 1000 IU. Po rozpuštění v 5 ml rozpouštědla přípravek obsahuje průměrně factor VIII coagulationis humanus 200 IU/ml.
Vyrobeno z plazmy lidských dárců.
Přípravek obsahuje průměrně < 120 IU von Willebrandova faktoru (VWF:Rco) na ml.
Pomocná látka se známým účinkem:
Sodík až 1,75 mmol (40 mg) na dávku Koncentrace sodíku po rekonstituci: 250-350 mmol/l
Úplný seznam pomocných látek viz bod 6.1.
* Síla (IU) je stanovena použitím chromogenního testu dle Evropského lékopisu. Střední specifická aktivita Octanate je > 100 IU/mg proteinu.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Prášek je bílý nebo světle žlutý, může vypadat také jako drobivá hmota.
Rozpouštědlo je čirá, bezbarvá tekutina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba a profylaxe krvácení u pacientů s hemofilií A (vrozený nedostatek faktoru VIII)
Přípravek neobsahuje von Willebrandův faktor ve farmakologicky účinném množství a proto není indikován pro léčbu von Willebrandovy choroby.
4.2 Dávkování a způsob podání
Léčba má být zahájena pod dozorem lékaře, který má zkušenosti s léčbou hemofilie.
Dávkování
Dávkování a délka substituční léčby závisí na závažnosti nedostatku faktoru VIII, místě a rozsahu krvácení a na klinickém stavu pacienta.
Počet jednotek podaného faktoru VIII je vyjádřen v Mezinárodních jednotkách (IU), které jsou vztaženy k současnému standardu WHO pro přípravky obsahující faktor VIII. Plazmatická aktivita faktoru VIII se vyjadřuje buď v procentech (vzhledem k normální lidské plazmě) nebo v mezinárodních jednotkách (vzhledem k mezinárodnímu standardu faktoru VIII v plazmě).
Jedna Mezinárodní jednotka (IU) aktivity faktoru VIII se rovná množství faktoru VIII v 1 ml normální lidské plazmy. Výpočet požadované dávky faktoru VIII je založen na empirickém zjištění, že 1 IU faktoru VIII na 1 kg tělesné hmotnosti zvyšuje aktivitu plazmatického faktoru VIII o 1,5 - 2 % normální aktivity. Potřebná dávka se určuje podle následujícího vzorce:
Potřebné jednotky = tělesná hmotnost (kg) x žádaný vzestup faktoru VIII (%) (IU/dl) x 0,5
Dávka a četnost podávání mají být vždy vztaženy ke klinické účinnosti v individuálním případě.
V případě následujících krvácivých příhod nemá v daném období poklesnout aktivita faktoru VIII pod danou hodnotu plazmatické aktivity (v % z normálu). Následující tabulka může sloužit jako vodítko pro stanovení dávkování při krvácivých příhodách nebo chirurgickém zákroku:
|
Stupeň krvácení / Typ chirurgického výkonu |
Požadovaná hodnota faktoru VIII (%) (IU/dl) |
Frekvence dávkování (hodiny) / Délka trvání léčby (dny) |
|
Krvácení | ||
|
Časná hemartróza, krvácení do svalů nebo ústní dutiny |
20-40 |
Opakujte infuze každých 12 až 24 hodin, nejméně jeden den, dokud se krvácení, které se vyznačuje bolestí, nezastaví nebo se nedosáhne vyléčení. |
|
Intenzivnější hemartróza, krvácení do svalů nebo hematom |
30-60 |
Opakujte infuze každých 12 až 24 hodin po 3-4 dny či více, dokud bolest a akutní postižení nepřejde. |
|
Život ohrožující krvácení |
60-100 |
Opakujte infuze každých 8 až 24, dokud nebezpečí nepomine. |
|
Operace | ||
|
Menší Včetně extrakce zubu |
30-60 |
Každých 24 hodin, nejméně 1 den, dokud se nedosáhne vyléčení. |
|
Větší |
80-100 (před operací a po operaci) |
Opakujte infuze každých 8 až 24 hodin až do adekvátního zahojení rány, pak pokračujte v terapii nejméně dalších 7 dní, abyste udrželi aktivitu faktoru VIII na 30 % až 60 % (IU/dl). |
V průběhu léčby se doporučuje stanovování hladin faktoru VIII jako vodítko pro dávkování a frekvenci podávání opakovaných infuzí. Zejména v případě větších chirurgických výkonů je nezbytné přesné sledování substituční terapie pomocí koagulačních vyšetření (aktivity plazmatického faktoru VIII). Odpovědi jednotlivých pacienti na podání faktoru VIII se mohou lišit dosahováním různých hodnot uzdravení (recovery in vivo) a vykazováním různého poločasu.
Pro dlouhodobou profylaxi krvácení u pacientů s těžkou hemofilií A jsou obvyklé dávky 20 až 40 IU faktoru VIII na kg tělesné hmotnosti v intervalu dvou až tří dnů.
Pediatrická populace
Klinická studie prováděná u 15 pacientů ve věku 6 let a mladších neukázala žádné specifické požadavky na dávkování u dětí.
Klinická data o použití Octanate u dříve neléčených pacientů (PUP) jsou omezená (viz část 4.8).
Pacienty je třeba sledovat vzhledem k rozvoji inhibitorů faktoru VIII. Jestliže není dosaženo předpokládané hladiny aktivity faktoru VIII nebo jestliže se krvácení nedostane pod kontrolu podáním vhodné dávky, má být provedeno vyšetření na přítomnost inhibitorů faktoru VIII. U pacientů s vysokou hladinou inhibitorů nemusí být terapie podáváním faktoru VIII efektivní, v takovém případě mají být zváženy jiné terapeutické možnosti. Léčba takovýchto pacientů má být řízena lékařem se zkušenostmi s péčí o pacienty s hemofilií. Viz také 4.4.
Způsob podání
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6. Přípravek má být podán intravenózně. Doporučuje se nepodávat více než 2-3 ml za minutu.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
- Stejně jako u jiných intravenózních přípravků obsahujících proteiny může dojít ke vzniku hypersenzitivní reakce. Přípravek obsahuje stopy jiných lidských proteinů než faktor VIII. Pacienti mají být informováni o časných projevech hypersenzitivní reakce, jako jsou např. vyrážka generalizovaná kopřivka, pocit tíhy na prsou, sípot, hypotenze a anafylaxe. Jestliže se tyto symptomy objeví, pacientům má být doporučeno ihned přerušit podávání přípravku a kontaktovat svého lékaře.
V případě šoku má být léčba vedena podle zásad běžných pro léčbu šoku.
- Tvorba neutralizujících protilátek (inhibitorů) proti faktoru VIII je známou komplikací léčby jedinců s hemofilií A. Tyto inhibitory jsou obvykle IgG imunoglobuliny namířené proti prokoagulační aktivitě faktoru VIII, které jsou kvantifikovány v Bethesda jednotkách (BU) na ml plazmy za použití modifikované zkoušky. Riziko vývinu inhibitorů koreluje s expozicí antihemofilického faktoru VIII, toto riziko je největší během prvních 20 expozičních dnů. Vzácně se mohou inhibitory vyvinout po prvních 100 expozičních dnech. Pacienti léčení lidským koagulačním faktorem VIII mají být pečlivě monitorováni na vývoj inhibujících protilátek příslušným klinickým vyšetřením a laboratorními testy. Viz také bod 4.8 Nežádoucí účinky.
- V literatuře jsou uváděny údaje poukazující na souvislost mezi výskytem inhibitoru faktoru VIII a alergickými reakcemi. U pacientů se zkušeností s alergickými reakcemi má být proto zjišťována přítomnost inhibitoru. U pacientů s inhibitory faktoru VIII je také vyšší riziko výskytu anafylaktické reakce při následné léčbě faktorem VIII. Z tohoto důvodu se má počáteční podání faktoru VIII dle posouzení ošetřujícím lékařem provádět pod dohledem lékaře a má se zajistit odpovídající lékařská péče pro zvládnutí alergických reakcí.
- Standardní opatření zabraňující infekcím způsobeným použitím přípravků vyrobených z lidské krve nebo plazmy zahrnují výběr dárců, vyšetření jednotlivých odběrů a plazmatických poolů na specifické infekční markery a zařazení účinných výrobných kroků pro inaktivaci nebo odstranění virů. Přes všechna tato opatření při podání léků vyráběných z lidské krve nebo plazmy nelze možnost přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné typy infekcí.
- Přijatá opatření jsou považována za účinná u tzv. obalených virů, například virů HIV, HBV a HCV, a u neobaleného viru HAV. Omezený účinek mají tato opatření u neobalených virů, jako je parvovirus B19. Infekce parvovirem B19 může být velmi závažná u těhotných žen (fetální infekce) a u jedinců s imunodeficiencí nebo jedinců se zvýšenou erytropoézou (například hemolytická anemie).
- U pacientů, kteří pravidelně/opakovaně dostávají přípravky s faktorem VIII vyrobeným z lidské plazmy, se má zvážit vhodné očkování (hepatitida A a B)
Při každé aplikaci přípravku Octanate pacientovi se důrazně doporučuje zaznamenat název a číslo šarže přípravku, aby bylo možné zpětně přiřadit k pacientovi číslo použité šarže.
Tento léčivý přípravek obsahuje až 1,75 mmol (40 mg) sodíku na dávku. To je třeba vzít v úvahu u pacientů na kontrolované sodíkové dietě.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly prováděny žádné studie ohledně interakce.
Nejsou známy žádné interakce lidského koagulačního faktoru VIII s jinými léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
Nejsou žádné nebo pouze omezané údaje o použití přípravku Octanate u těhotných žen. Reprodukční studie na zvířatech nebyly s faktorem VIII prováděny. Vzhledem ke vzácnému výskytu hemofilie A u žen není k dispozici zkušenost s použitím faktoru VIII během těhotenství a kojení. Proto se má přípravek během těhotenství nebo kojení používat pouze tehdy, je-li to nezbytně nutné.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Octanate nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
- Ve vzácných případech byla pozorována hypersenzitivita nebo alergická reakce (která může zahrnovat angioedém, pálení a bodání v místě infuze, zimnice, zarudnutí kůže, generalizovaná kopřivka, bolesti hlavy, vyrážka, hypotenze, apatie, nauzea, neklid, tachykardie, pocit tíhy na prsou, mravenčení, zvracení, sípot) a v některých případech se může vyvinout do závažné anafylaxie (včetně šoku).
- Ve vzácných případech se vyskytla horečka.
- U pacientů s hemofilií A se mohou vyvinout protilátky (inhibitory) proti faktoru VIII. Jestliže se tyto inhibitory objeví, projeví se tato skutečnost jako nedostatečná klinická odpověď organizmu. V takovém případě se doporučuje kontaktovat specializované hemofilické centrum.
V průběžné klinické studii s dříve neléčenými pacienty (PUP) se u 3 z 39 PUP (7,6 %) léčených přípravkem Octanate dle potřeby (on-demand treatment) vytvořily inhibitory s titrem přes 5 BU. U jednoho pacienta se vytvořily inhibitory s titrem pod 5 BU. Dva případy (5,1 %) byly klinicky závažné; u zbývajících dvou subjektů se objevily inhibitory, které spontáně zanikly bez změny dávkování přípravku Octanate . Ve všech případech se inhibitory vyvinuly při léčbě dle potřeby (on-demand treatment) a před uplynutím 50 expozičních dní. 35 PUP mělo základní hodnotu aktivity FVIII < 1 % a 4 PUP měly < 2 % FVIII:C V momentě prozatimní analýzy mělo 34 pacientů již 20 a více expozičních dní přípravku Octanate a 30 pacientů mělo 50 a více expozičních dní přípravku Octanate. Nebyly pozorovány žádné inhibitory u PUP dostávajících profylaxi přípravkem Octanate. Během studie podstoupilo 12 PUP celkem 14 chirurgických zákroků. Střední věk při prvním podání byl 7 měsíců (rozmezí 3 dny až 67 měsíců). Střední počet expozičních dnů v klinické studii byl 100 (rozmezí 1-553).
|
Třídy orgánových systémů |
Vzácné |
Velmi vzácné |
|
Poruchy imunitního systému |
Hypersenzitivmí reakce |
Anafylaktický šok |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Vyšetřní |
Protilátky proti faktoru VIII v krvi |
Vzácné (> 1/10 000 a < 1/1 000)
Velmi vzácné (< 1/10 000)
Informace o virové bezpečnosti viz bod 4.4.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Nebyly hlášeny žádné případy předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Koagulační faktory: krevní koagulační faktor VIII ATC kód: B02BD02
Komplex faktoru VIII/von Willebrandova faktoru se skládá ze dvou molekul (FVIII a vWF) s různými fyziologickými funkcemi. Po infuzi hemofilickému pacientovi se faktor VIII naváže na von Willebrandův faktor v krevním řečišti pacienta.
Aktivovaný faktor VIII působí jako kofaktor pro aktivovaný faktor IX tím, že akceleruje konverzi faktoru X na aktivovaný faktor X. Aktivovaný faktor X konvertuj e protrombin na trombin. Trombin potom konvertuje fibrinogen na fibrin a může se vytvořit sraženina.
Hemofilie A je pohlavně vázaná dědičná porucha koagulace krve způsobená sníženou hladinou faktoru VIII:C. způsobující krvácení do kloubů, do svalů nebo do vnitřních orgánů, a to spontánně nebo jako následek traumatu po nehodě nebo chirurgickém zákroku. Touto substituční terapií se plazmatická hladina faktoru VIII zvyšuje a umožní se dočasná korekce deficitu faktoru a korekce tendence ke krvácení.
Přípravek Octanate je hodnocen pro uvedení terapie imuno-toleranční indukce (ITI) u pokračující výzkumné klinické studie.
V prozatimní analýze 69 pacientů dosud léčených přípravkem Octanate pomocí ITI terapie dokončilo studii 49 pacientů. U pacientů s úspěšně eliminovanými inhibitory došlo k významné redukci počtu měsíčních krvácení.
5.2 Farmakokinetické vlastnosti
Lidský krevní koagulační faktor VIII (z prášku) je běžnou složkou lidské plazmy a působí jako endogenní faktor VIII. Po podání přípravku průměrně dvě třetiny až tři čtvrtiny faktoru VIII zůstávají v krevním řečišti. Hladina aktivita faktoru VIII v plazmě má dosáhnout 80-120 % předpokládané aktivity.
Aktivita plazmatického faktoru VIII se snižuje dvoufázovým exponenciálním rozpadem. V počáteční fázi distribuce mezi intravaskulárními prostory a ostatními částmi (tělní tekutiny) probíhá s poločasem rozpadu z plazmy od 3 do 6 hodin. V následující pomalejší fázi (která pravděpodobně reflektuje spotřebu faktoru VIII) se poločas pohybuje v rozmezí 8-20 hodin s průměrem 12 hodin. Toto odpovídá skutečnému biologickému poločasu.
U přípravku Octanate byly ve dvou farmakokinetických studiích s 10 resp. 14 hemofilickými pacienty dosaženy následující výsledky:
|
Uzdravení (% x IU-1 x kg) |
AUC* norm (% x h x IU-1 x kg) |
Poločas (h) |
MRT* (h) |
Clearance (ml x h-1 x kg) | |
|
Studie 1, n = 10 Střední hodnota ±SD* |
2,4 ± 0,36 |
45,5 ± 17,2 |
14,3 ± 4,01 |
19,6 ± 6,05 |
2,6 ± 1,21 |
|
Studie 2, n = 14 Střední hodnota ±SD* |
2,4 ± 0,25 |
33,4 ± 8,50 |
12,6 ± 3,03 |
16,6 ± 3,73 |
3,2 ± 0,88 |
AUC* = plocha pod křivkou MRT* = střední doba zdržení SD* = standardní odchylka
5.3 Předklinické údaje vztahující se k bezpečnosti
Omezené toxikologické údaje dostupné pro tributyl-fosfát (TNBP) a polysorbát 80 (tween 80) - činidla (rozpouštědla/detergenty) použitá při virové inaktivaci SD metodou během výroby přípravku Octanate - ukazují, že nežádoucí účinky vedoucí k předvídanému ohrožení člověka jsou nepravděpodobné.
Dokonce i dávky několikrát převyšující doporučené dávky na kg váhy u těchto reagencií neukazují žádný toxický vliv na laboratorní zvířata. Mutagenní potenciál nebyl zjištěn u žádné z těchto dvou látek.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
- dihydrát natrium-citrátu
- chlorid sodný
- chlorid vápenatý
- glycin
Rozpouštědlo: voda na injekci
6.2 Inkompatibility
Vzhledem k absenci inkompatibilitní studie nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
Má použita pouze přiložená injekční/infuzní souprava, protože v důsledku adsorpce koagulačního faktoru VIII na vnitřní povrchy některých injekčních/infuzních zařízení může dojít k selhání léčby.
6.3 Doba použitelnosti
2 roky
Rekonstituovaný roztok musí být spotřebován okamžitě a pouze během jednoho podání.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte lahvičku ve vnějším obalu, aby byl přípravek chráněn před světlem. Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3
6.5 Druh obalu a obsah balení
Jedno balení Octanate 1000 IU/5 ml obsahuje:
- prášek ve skleněné lahvičce (sklo třídy I) se zátkou (chlorobutylová nebo bromobutylová pryž) a odtrhovacím víčkem
- 5 ml rozpouštědla ve skleněné lahvičce (sklo třídy I) se zátkou (chlorobutylová nebo brombutylová pryž) a odtrhovacím víčkem
jedna jednorázová injekční stříkačka, 1 přepouštěcí set Mix2VialTM, jedna injekční souprava a dva desinfekční alkoholové tampony.
Jedna lahvička přípravku Octanate 1000 IU/5 ml obsahuje 1000 IU lidského koagulačního faktoru VIII.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
• Čtěte prosím pozorně všechny pokyny a postupujte pečlivě podle nich!
• Nepoužívejte přípravek Octanate po uplynutí exspirační doby vyznačené na obalu.
• Během níže uvedeného postupu musí být zachována sterilita!
• Před podáním rekonstituovaný lékařský výrobek vizuálně zkontrolujte, zda neobsahuje usazeniny, částečky cizího materiálu, zákal a zda nezměnil barvu. Roztok musí být čirý nebo mírně opalizující. Nepoužívejte zakalené roztoky nebo roztoky s usazeninami.
• Použijte připravený roztok okamžitě, aby se předešlo mikrobiální kontaminaci.
• Používejte pouze přiložený injekční set. Použití jiného injekčního/infuzního zařízení může způsobit dodatečné riziko a selhání léčby.
Návod na přípravu roztoku:
1. Nepoužívejte přípravek ihned po vyjmutí z chladničky. Nechejte rozpouštědlo i prášek v uzavřených lahvičkách dosáhnout pokojové teploty.
2. Odstraňte víčko z obou lahviček a očistěte pryžové zátky jedním z přiložených alkoholových tamponů.
3. Zařízení Mix2VialTM je popsáno na obr. 1. Položte lahvičku s rozpouštědlem na rovný povrch a pevně ji držte. Vezměte Mix2VialTM, otočte jej horní stranou dolů. Nasaďte Mix2VialTM jeho modrým koncem na horní část lahvičky s rozpouštědlem a silně jej zatlačte dolů, dokud lahvičku nepropíchnete (obr. 2 + 3).
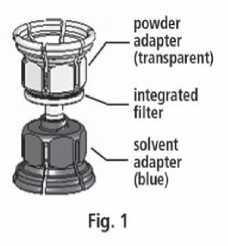


Fig. 3
4. Položte lahvičku s práškem na pevný povrch a pevně jí držte.

Vezměte lahvičku s rozpouštědlem s připojeným Mix2VialTM a otočte ji dnem vzhůru. Nasaďte ji průhledným koncem na horní část lahvičky s práškem a silně zatlačte dolů, dokud lahvičku nepropíchnete (obr. 4). Rozpouštědlo přeteče samo do lahvičky s práškem

Fig, 4

lueA|os
w

Fig. 5
5. Zlehka otáčejte se spojenými lahvičkami, dokud se přípravek nerozpustí. Rozpouštění je dokončeno při pokojové teplotě během méně než 10 minut. Během přípravy se může objevit jemné napěnění. Rozšroubujte Mix2Vial™ na dvě části (obr. 5). Napěnění zmizí.
Odstraňte prázdnou lahvičku od rozpouštědla spolu s modrou částí Mix2Vial™.
Návod na injekci:
Z důvodu opatrnosti by vám měl být měřen puls před a během injekce. Pokud se vyskytne výrazné zvýšení vašeho pulsu, zpomalte rychlost injekce nebo podávání na krátký čas přerušte.
1. Nasaďte injekční stříkačku na průhlednou část Mix2Vial™. Otočte lahvičku dnem vzhůru a nasajte roztok do stříkačky (obr. 6).
Roztok ve stříkačce má být čirý nebo slabě perlově lesklý.
Jakmile je roztok převeden do stříkačky, pevně stříkačku uchopte a oddělte ji od Mix2Vial™ (obr. 7). Odstraňte Mix2Vial™ spolu s prázdnou lahvičkou.



Fíg. 7
2. Vydesinfikujte zamýšlené místo aplikace injekce přiloženým alkoholovým tamponem.
3. Nasaďte přiloženou injekční soupravu na stříkačku.
4. Zaveďte injekční jehlu do zvolené žíly. Pokud používáte turniket pro snadnější viditelnost žíly, tento turniket by měl být odstraněn před zahájením injekce přípravku Octanate. Do stříkačky se nesmí dostat žádná krev, aby nedošlo k riziku tvorby fibrinových sraženin.
5. Vstřikujte roztok pomalu do žíly, rychlost nemá být větší než 2-3 ml za minutu.
Pokud užíváte více než jednu lahvičku přípravku Octanate pro jednu léčbu, můžete použít znovu stejnou injekční soupravu a stříkačku. Mix2Vial™, je však vždy pouze pro jednou použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Octapharma (IP) Limited The Zenith Building 26 Spring Gardens Manchester M2 1AB Velká Británie
8. REGISTRAČNÍ CÍSLO(A)
75/140/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
4.3.2015
10. DATUM REVIZE TEXTU:
4.3.2015
11/11