Obizur 500 U
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
OBIZUR 500 U prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička s práškem obsahuje nominálně 500 jednotek antihemofilního faktoru VIII (rekombinantního) bez domény B, prasečí sekvence, susoctocogum alfa.
Po rekonstituci obsahuje přípravek OBIZUR přibližně susoctocogum alfa 500 U/ml.
Síla (U) je stanovena pomocí vyšetření koagulace jednofázovou metodou (one-stage coagulation assay, OSCA). Specifická aktivita přípravku OBIZUR je přibližně 10 000 U/mg proteinu.
OBIZUR (antihemofilní faktor VIII (rekombinantní), prasečí sekvence) je purifikovaný protein, který má 1448 aminokyselin a přibližnou molekulovou hmotnost 175 kDa.
Je vyráběn technologií rekombinantní DNA (rDNA) v ledvinových buňkách mláďat křečka (baby hamster kidney, BHK). BHK buňky se kultivují v médiu, které obsahuje fetální bovinní sérum. Výrobní postup nepoužívá lidské sérum ani produkty z lidských proteinů a neobsahuje žádné další materiály zvířecího původu.
Pomocná látka/Pomocné látky se známým účinkem
Jedna injekční lahvička obsahuje 4,4 mg (198 mmol) sodíku na každý ml rekonstituovaného roztoku. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok. Prášek je bílý.
Rozpouštědlo je čiré a bezbarvé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba krvácivých epizod u pacientů se získanou hemofilií způsobenou protilátkami proti faktoru VIII. Přípravek OBIZUR je indikován k léčbě dospělých.
4.2 Dávkování a způsob podání
Léčba přípravkem OBIZUR má probíhat pod dohledem lékaře se zkušenostmi s léčbou hemofilie.
Přípravek je určen pouze k podání v nemocnici. Vyžaduje klinický dohled nad stavem krvácení pacienta.
Dávkování
Dávka, frekvence a délka terapie přípravkem OBIZUR závisejí na místě, rozsahu a závažnosti krvácivé epizody, cílové aktivitě faktoru VIII a na klinickém stavu pacienta.
Počet podávaných jednotek faktoru VIII se vyjadřuje v jednotkách (U), které jsou odvozeny z interní normy a byly kalibrovány podle stávající normy WHO pro přípravky s faktorem VIII.
Jedna jednotka (U) aktivity faktoru VIII odpovídá množství faktoru VIII v jednom ml normální lidské plazmy.
Doporučená počáteční dávka je 200 U na kilogram tělesné hmotnosti podávaná intravenózní injekcí (viz bod 6.6).
Požadovaná počáteční dávka přípravku OBIZUR pro pacienta se vypočítá pomocí tohoto vzorce:
Počáteční dávka (U/kg) ť Síla přípravku (U/injekční lahvička) x Tělesná hmotnost (kg) = Počet
injekčních lahviček
např. pro 70 kg vážícího pacienta se počet injekčních lahviček pro počáteční dávku vypočítá takto:
200 U/kg ť 500 U/injekční lahvička x 70 kg = 28 injekčních lahviček
Monitorujte aktivitu faktoru VIII a klinický stav 30 minut po první injekci a 3 hodiny po podání přípravku OBIZUR.
Monitorujte aktivitu faktoru VIII těsně před následujícími dávkami a 30 minut po nich. V tabulce níže naleznete doporučené cílové údolní hladiny faktoru VIII.
Doporučuje se jednofázový test srážlivosti faktoru VIII, protože byl použit při stanovení síly přípravku OBIZUR a průměrné míry „recovery“ (viz bod 4.4 a 5.2).
Dávka a frekvence podání má vycházet z výsledků aktivity faktoru VIII (aby se udržela v doporučených mezích) a na dosažené klinické odpovědi.
Údaje o účinnosti a bezpečnosti u pacientů se získanou hemofilií jsou omezené (viz bod 5.1). Počáteční fáze
|
Typ krvácení |
Cílová údolní aktivita |
Počáteční |
Následující |
Frekvence a |
|
faktoru VIII (jednotky |
dávka |
dávka |
délka trvání | |
|
na dl nebo % normální |
(jednotek |
následného | ||
|
hodnoty) |
na kg) |
dávkování | ||
|
Mírné až středně silné povrchový sval / bez neurovaskulárního postižení a krvácení do kloubu |
> 50 % |
Titrujte následující dávky na základě klinické odpovědi a k udržení cílové údolní aktivity faktoru VIII |
Dávka každé 4 hodiny až 12 hodin, frekvenci lze upravit podle klinické odpovědi a naměřené aktivity faktoru VIII | |
|
Větší středně silné až silné intramuskulární, retroperitoneální, gastrointestinální, intrakraniální krvácení |
> 80 % |
200 | ||
Jakmile krvácení zareaguje, obvykle během prvních 24 hodin, pokračujte v podávání přípravku OBIZUR v dávce, která udržuje údolní aktivitu FVIII na 30-40 %, dokud nebude krvácení pod kontrolou. Maximální aktivita FVIII v krvi nesmí přesáhnout 200 %.
Délka léčby závisí na klinickém úsudku.
Pediatrická populace
Použití u dětí a dospívajících ve věku do 18 let s vrozenou hemofilií nebo ve vzácných případech získané hemofilie není v současnosti schváleno.
Způsob podání
Intravenózní podání.
Celkový objem rekonstituovaného přípravku OBIZUR se má podávat rychlostí 1 až 2 ml za minutu. Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Známé anafylaktické reakce na léčivou látku, křeččí protein nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Hypersenzitivita
Při léčbě přípravkem OBIZUR může dojít k hypersenzitivním alergickým reakcím. Přípravek obsahuje stopová množství křeččích proteinů.
Objeví-li se příznaky hypersenzitivity, pacientům by se mělo doporučit, aby ihned přerušili používání tohoto léčivého přípravku a obrátili se na svého lékaře. Pacienti by měli být informováni o časných známkách reakcí přecitlivělosti, včetně kopřivky, generalizované kopřivky, tísně na hrudi, sípotu, hypotenze a anafylaxe.
V případě šoku by se mělo provést standardní lékařské ošetření šoku.
Tvorba, inhibičních protilátek
Před expozicí a po expozici přípravku OBIZUR byly detekovány inhibiční protilátky proti prasečímu faktoru VIII (měřeno pomocí modifikace Nijmegen metody stanovení Bethesda). Při výchozím stavu (před léčbou) byly zaznamenány titry inhibitorů až do výše 29 jednotek Bethesda, a přesto pacienti reagovali na přípravek OBIZUR příznivě. Doporučuje se, aby byla léčba založena na klinickém úsudku a nikoli na detekci inhibičních protilátek stanovením Bethesda.
Klinické informace o tvorbě inhibičních protilátek vůči přípravku OBIZUR po opakovaném podání jsou nedostatečné. Proto se přípravek OBIZUR smí podávat, pouze pokud se to považuje za klinicky nezbytné. Rozsáhlá kožní purpura nevyžaduje nezbytně léčbu.
Přípravek OBIZUR je vyráběn technologií rekombinantní DNA v ledvinových buňkách mláďat křečka. Protilátky proti proteinu ledvinových buněk mláďat křečka nebyly u pacientů detekovány po expozici přípravku OBIZUR.
Vysoká a udržovaná aktivita faktoru VIII v krvi může pacienta predisponovat k tromboembolickým příhodám. Zvláštnímu riziku jsou vystaveni zejména jedinci s preexistujícím kardiovaskulárním onemocněním a starší osoby.
Je-li nutná venózní katetrizace, je třeba vzít v úvahu riziko komplikací spojených s katetrem, jako je trombóza v místě katetru.
Aktivita faktoru VIII určená pomocí chromogenního stanovení je obecně nižší než aktivita faktoru VIII určená pomocí jednofázového testu srážlivosti. Měření aktivity faktoru VIII se musí vždy provádět s použitím stejné metodiky stanovení u všech pacientů. Jednofázový test se doporučuje proto, že byl použit při stanovení síly a průměrné míry „recovery“ přípravku OBIZUR (viz body 4.2 a 5.2).
Název a číslo šarže
Důrazně se doporučuje zaznamenat název a číslo šarže přípravku při každém podání přípravku OBIZUR pacientovi, aby se zachovala informace propojující pacienta a šarži léčivého přípravku.
Obsah sodíku
Jedna injekční lahvička obsahuje 4,4 mg (198 mmol) sodíku na každý ml rekonstituovaného roztoku. Tuto skutečnost by měli vzít v úvahu pacienti na dietě s omezeným příjmem sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly hlášeny žádné interakce přípravku OBIZUR s jinými léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
Nebyly provedeny studie reprodukce na zvířatech s přípravkem OBIZUR. Zkušenosti s podáváním přípravku OBIZUR během těhotenství a kojení nejsou k dispozici. Proto se má přípravek OBIZUR používat během těhotenství a kojení pouze, pokud je to jasně indikováno.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek OBIZUR nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu:
Jsou možné reakce přecitlivělosti nebo alergické reakce (které mohou zahrnovat angioedém, pálení a bodání v místě injekce, zimnici, zrudnutí, generalizovanou kopřivku, bolest hlavy, kopřivku, hypotenzi, letargii, nevolnost, neklid, tachykardii, tíseň na hrudi, brnění, zvracení, sípot) a mohou se rozvinout do závažné anafylaxe (včetně šoku) (viz bod 4.4).
Pacienti se získanou hemofilií mohou vytvářet inhibiční protilátky proti prasečímu faktoru VIII. Tabulkový seznam nežádoucích účinků:
Níže uvedená tabulka byla sestavena podle klasifikace orgánových systémů MedDRA (třída orgánového systému a preferovaný termín). V klinickém hodnocení podávání přípravku OBIZUR při získané hemofilii byla u 29 dospělých subjektů hodnocena bezpečnost.
Četnosti byly vyhodnoceny podle následujícího pravidla: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10000 až <1/1000), velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit)._ _
|
Třída orgánového systému |
Preferovaný termín MedDRA |
Četnost |
|
Vyšetření |
Pozitivní test na inhibiční protilátky proti prasečímu faktoru VIII (viz bod 4.4) |
Časté |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Účinky dávek vyšších, než jsou doporučené dávky přípravku OBIZUR, nebyly charakterizovány.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: hemostatika, krevní koagulační faktor VIII, prasečí sekvence. ATC kód: B02BD14
Mechanismus účinku
Přípravek OBIZUR je rekombinantní faktor VIII bez domény B, prasečí sekvence (susoktogog alfa). Jedná se o glykoprotein.
Ihned po uvolnění do oběhu pacienta se faktor VIII váže na von Willebrandův faktor (vWF). Komplex faktor VIII / von Willebrandův faktor se skládá ze dvou molekul (faktor VIII a von Willebrandův faktor) s rozdílnými fyziologickými funkcemi. Aktivovaný faktor VIII působí jako kofaktor pro aktivovaný faktor IX, a urychluje tak přeměnu faktoru X na aktivovaný faktor X, který nakonec přeměňuje protrombin na trombin. Trombin následně mění fibrinogen na fibrin a může dojít ke vzniku sraženiny.
Získaná hemofilie je vzácná porucha krvácení, při níž pacienti s normálními geny pro faktor VIII vytvářejí inhibiční protilátky namířené proti faktoru VIII. Tyto protilátky neutralizují cirkulující lidský faktor VIII a vedou tak ke vzniku nedostatku dostupného faktoru VIII. Cirkulující protilátky (inhibitory) zaměřené proti lidskému faktoru VIII mají minimální nebo žádnou zkříženou reaktivitu vůči přípravku OBIZUR.
Přípravek OBIZUR dočasně nahrazuje inhibovaný endogenní faktor VIII, který je nutný k účinné hemostáze.
Klinická účinnost a bezpečnost
Bezpečnost a účinnost přípravku OBIZUR při léčbě závažných krvácivých epizod u subjektů se získanou hemofilií s autoimunitními inhibičními protilátkami vůči lidskému faktoru VIII byla zkoumána v prospektivním, nerandomizovaném, otevřeném klinickém hodnocení 28 subjektů (18 bělochů, 6 černochů a 4 Asijci). Do tohoto hodnocení byly zahrnuty subjekty se život a/nebo končetinu ohrožujícím krvácením vyžadujícím hospitalizaci.
Všechny počáteční krvácivé epizody vykazovaly pozitivní odpověď na léčbu 24 hodin po podání počátečních dávek dle posouzení hlavního zkoušejícího. Za pozitivní odpověď se považovala situace, kdy krvácení ustalo nebo se zmírnilo se současným klinickým zlepšením nebo s aktivitou faktoru VIII přesahující předem danou cílovou hodnotu.
Pozitivní odpověď byla pozorována u 95 % (19/20) subjektů hodnocených po 8 hodinách a 100 % (18/18) po 16 hodinách. Kromě odpovědi na léčbu byla celková úspěšnost léčby stanovena zkoušejícím na základě jeho/její schopnosti ukončit podávání nebo snížit dávku a/nebo četnost dávkování přípravku OBIZUR. Celkem 24/28 (86 %) subjektů dosáhlo úspěšné kontroly (odeznění) krvácivé epizody. U subjektů léčených přípravkem OBIZUR jako terapie první linie, definovaná jako žádné nedávné předchozí použití antihemoragických přípravků před první léčbou přípravkem OBIZUR, bylo u 16/17 (94 %) hlášen konečný úspěch léčby. U jedenácti subjektů bylo hlášeno, že jim byly před první léčbou přípravkem OBIZUR podány antihemoragické přípravky (např. rFVIIa, koncentrát aktivovaného protrombinového komplexu, kyselina tranexamová). Z těchto 11 subjektů byla léčba nakonec úspěšná u osmi (73 %).
Medián dávky na jednu injekci nutné k úspěšné léčbě primárního krvácení byl 133 U/kg a medián celkové dávky činil 1523 U/kg za medián doby 6 dní. Medián počtu infuzí za den na jeden subjekt činil 1,76 (rozmezí: 0,2 až 5,6). Během období prvních 24 hodin činil medián celkové dávky použité v klinické studii 493 U/kg a medián počtu infuzí 3. Pokud byla po 24 hodinách nutná další léčba, činil medián celkové použité dávky ke zvládnutí krvácivé epizody 1050 U/kg a medián počtu infuzí 10,5 (medián dávky 100 U/kg).
Další informace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem OBIZUR u všech podskupin pediatrické populace při léčbě získané hemofilie (informace o použití u dětí viz bod 4.2).
Tento léčivý přípravek byl registrován za „výjimečných okolností“. Znamená to, že vzhledem ke vzácné povaze onemocnění, pro které je indikován, nebylo možné získat úplné informace o přínosech a rizicích tohoto léčivého přípravku.
Evropská agentura pro léčivé přípravky každoročně vyhodnotí jakékoli nově dostupné informace a tento souhrn údajů o přípravku bude podle potřeby aktualizován.
5.2 Farmakokinetické vlastnosti
Farmakokinetické údaje naměřené u 5 subjektů se získanou hemofilií během stavu bez krvácení jsou uvedeny v tabulce 1.
|
Tabulka 1: Individuální farmakokinetické údaje o aktivitě faktoru VIII po podání poslední dávky přípravku OBIZUR 5 subjektům se získanou hemofilií. Subjekty se nacházely ve stavu bez krvácení. Aktivita faktoru VIII byla měřena jednofázovým testem srážlivosti. | ||||||||
|
Subjekt |
Dávka (U) |
Dávka (U/kg) |
Výchozí aktivita hFVIII (%) |
ť/2 (h) |
Tmax (h) |
Amax (%) |
AUC0-t (%-t) |
AUC0-<x> (%-t) |
|
1 |
5000 |
76,7 |
89 |
17 |
0,42 |
213 |
3124 |
4988 |
|
2 |
2934 |
30,0 |
18 |
4,6 |
0,42 |
100 |
694 |
712 |
|
3 |
7540 |
144,2 |
3 |
5,3 |
0,45 |
74 |
473 |
492 |
|
4 |
9720 |
206,8 |
0 |
1,8 |
0,50 |
53 |
122 |
135 |
|
5 |
10000 |
133,3 |
N/A |
4,2 |
0,75 |
178 |
1583 |
1686 |
Amax = maximální pozorovaná % aktivita; AUC0-t = plocha pod křivkou koncentrace vs. čas od doby 0 do poslední měřitelné koncentrace; AUC0-<X) = plocha pod křivkou koncentrace vs. čas od doby 0 extrapolovaná do nekonečna; t/2 =terminální poločas; Tmax = doba maximální pozorované % aktivity, N/A = není k dispozici.
Průměrná míra „recovery“ po počáteční dávce 200 U/kg činila 1,06 ± 0,75 U/ml na U/kg (rozmezí 0,10-2,61), měřeno pomocí vyšetření koagulace jednofázovou metodou.
Přestože je aktivita faktoru VIII určená pomocí chromogenního stanovení obecně nižší než aktivita faktoru VIII určená pomocí jednofázového testu srážlivosti, měly aktivity faktoru VIII po infuzi u pacientů se získanou hemofilií v klinické studii OBI-1-301 tendenci být vyšší, pokud se stanovovaly
pomocí chromogenního stanovení, než když byly stanoveny jednofázovým testem srážlivosti (viz bod 4.4).
Inhibiční protilátky proti přípravku OBIZUR se měřily pomocí modifikace Nijmegen metody stanovení Bethesda. U tří subjektů zařazených do farmakokinetické analýzy byl ve výchozím stavu detekovatelný titr inhibitorů proti prasečímu faktoru VIII (> 0,6 jednotek Bethesda (BU)/ml). U tří z pěti subjektů nebyl po léčbě detekovatelný titr inhibitorů proti prasečímu faktoru VIII (< 0,6 BU/ml na základě posledního hlášeného výsledku), u dvou subjektů byl detekovatelný titr inhibitorů proti prasečímu faktoru VIII (> 0,6 BU/ml).
Průměrný poločas přípravku OBIZUR u devíti vyhodnotitelných subjektů ve stavu s krvácením činil (přibližně) 10 hodin (rozmezí 2,6 až 28,6 hodin).
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti nebo toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka. Ve studiích toxicity po opakovaném podávání však měla incidence a závažnost glomerulopatie pozorované u opic, kterým byl intravenózně podán přípravek OBIZUR v dávkách 75, 225 a 750 U/kg/den, tendenci v průběhu času vzrůstat.
Studie reprodukce na zvířatech nebyly s přípravkem OBIZUR provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek
Polysorbát 80 Chlorid sodný
Dihydrát chloridu vápenatého
Sacharóza
Trometamol
Trometamol-hydrochlorid Dihydrát natrium-citrátu
Rozpouštědlo Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Rekonstituovaný roztok má být použit ihned, avšak ne déle než 3 hodiny po rekonstituci.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
Jedno balení přípravku OBIZUR obsahuje 1, 5 nebo 10 kusů každé následujících položek
• injekční lahvičky (sklo typu I) se zátkou (butylová pryž) a odnímatelným uzávěrem,
• předplněné (sklo typu I) injekční stříkačky se zátkou (butylová pryž) a pryžovým uzávěrem hrotu a adaptérem Luer Lock,
• zařízení pro přenos kapaliny se zabudovaným plastovým hrotem.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Po rekonstituci je roztok čirý, bezbarvý, bez částic a má pH 6,8 až 7,2. Osmolalita pufru přípravku se pohybuje v rozmezí od 59 do 65 10% mOsm/kg H2O.
Před podáním je třeba rekonstituovaný léčivý přípravek zkontrolovat zrakem, zda neobsahuje částice nebo není zabarven. Roztoky s částicemi nebo zabarvením se nesmí podávat.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Příprava
Před zahájením rekonstituce budete potřebovat následující pomůcky:
• vypočítaný počet injekčních lahviček s práškem,
• stejný počet 1ml injekčních stříkaček s rozpouštědlem a sterilních adaptérů injekční lahvičky,
• tampóny napuštěné alkoholem,
• velkou sterilní injekční stříkačku na konečný objem rekonstituovaného přípravku.
Níže uvedené postupy slouží jako obecné pokyny pro přípravu a rekonstituci přípravku OBIZUR, Následujícími pokyny pro rekonstituci se řiďte u každé injekční lahvičky s práškem určené k rekonstituci.
Rekonstituce
Během postupu rekonstituce používejte aseptickou techniku.
1. Vytemperujte injekční lahvičku s práškem přípravku OBIZUR a předplněnou injekční stříkačku s rozpouštědlem na pokojovou teplotu.
2. Sejměte plastový uzávěr z injekční lahvičky s práškem přípravku OBIZUR (Obrázek A).
3. Otřete pryžovou zátku tampónem napuštěným alkoholem (není součástí balení přípravku) a nechte před použitím oschnout.
4. Odtrhněte kryt balení adaptéru injekční lahvičky (Obrázek B). Nedotýkejte se hrotu luer lock ve středu adaptéru injekční lahvičky. Nevyndávejte adaptér injekční lahvičky z balení.
5. Umístěte balení s adaptérem injekční lahvičky na čistý povrch tak, aby hrot luer lock mířil vzhůru.
6. Sejměte bezpečnostní uzávěr z předplněné injekční stříkačky s rozpouštědlem (Obrázek C).
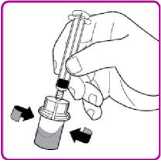
7. Pevně držte balení s adaptérem injekční lahvičky a připojte předplněnou injekční stříkačku s rozpouštědlem k adaptéru zatlačením hrotu injekční stříkačky směrem dolů na luer lock ve středu adaptéru, a poté stříkačkou otáčejte ve směru hodinových ručiček, dokud se nezajistí. Neutahujte příliš (Obrázek D).
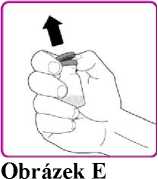
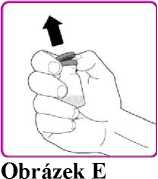
8. Sundejte plastový obal (Obrázek E).
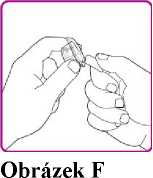
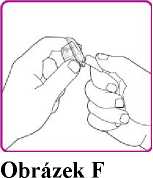
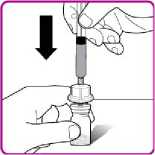
9. Umístěte injekční lahvičku s práškem přípravku OBIZUR na čistý, rovný, tvrdý povrch. Umístěte adaptér injekční lahvičky nad injekční lahvičku s práškem přípravku OBIZUR a silně protlačte filtrovací hrot adaptéru skrz střed pryžového kroužku injekční lahvičky s práškem přípravku OBIZUR, až průhledný plastový uzávěr dosedne na injekční lahvičku (Obrázek F).
10. Stlačte píst dolů, abyste injikovali veškeré rozpouštědlo ze stříkačky do injekční lahvičky s práškem přípravku OBIZUR.
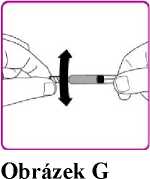
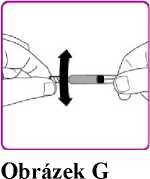
11. Opatrně kružte injekční lahvičkou s práškem přípravku OBIZUR, aniž byste sundávali injekční stříkačku, dokud se všechen prášek zcela nerozpustí/nerekonstituuje (Obrázek G). Rekonstituovaný roztok se má před podáním zkontrolovat zrakem, zda neobsahuje částice. Nepoužívejte, pokud pozorujete částice nebo zabarvení.
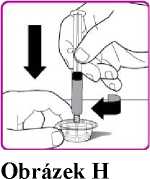
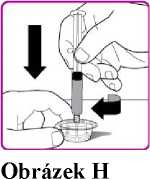
12. Jednou rukou držte injekční lahvičku a adaptér injekční lahvičky a druhou rukou pevně uchopte tělo předplněné injekční stříkačky s rozpouštědlem a pohybem proti směru hodinových ručiček odšroubujte stříkačku z adaptéru injekční lahvičky (Obrázek H).
13. Pokud se přípravek OBIZUR uchovává při pokojové teplotě, použijte ho ihned a do tří hodin od rekonstituce.
Obrázek A
Obrázek B
Obrázek C
Obrázek D
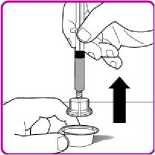
Podání
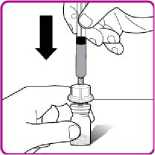
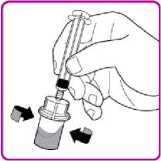
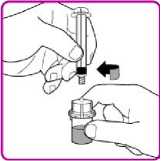
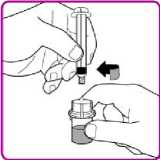
Pouze k intravenózní injekci!
• Před podáním zkontrolujte rekonstituovaný roztok přípravku OBIZUR, zda neobsahuje částice nebo není zabarven. Roztok má být čirý a bezbarvý. Nepodávejte, pokud pozorujete částice nebo zabarvení.
• Nepodávejte přípravek OBIZUR stejným aplikačním setem nebo ze stejné nádoby spolu s jinými injekčními léčivými přípravky.
Za použití aseptické techniky podejte přípravek následovně:
1. Po rekonstituci všech injekčních lahviček připojte velkou injekční stříkačku k adaptéru injekční lahvičky lehkým zatlačením hrotu stříkačky dolů na luer lock ve středu adaptéru, a poté stříkačkou otáčejte ve směru hodinových ručiček, dokud se nezajistí.
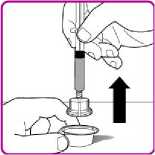
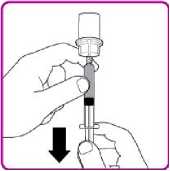
2. Obraťte injekční lahvičku dnem vzhůru, vtlačte vzduch z injekční stříkačky do lahvičky a natáhněte rekonstituovaný přípravek OBIZUR do stříkačky (Obrázek I).
Obrázek I
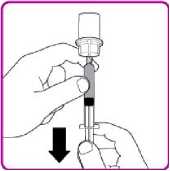
3. Odšroubujte velkou stříkačku proti směru hodinových ručiček od adaptéru injekční lahvičky a zopakujte tento postup se všemi injekčními lahvičkami rekonstituovaného přípravku OBIZUR, dokud nezískáte celkový objem určený k podání.
4. Podejte celkový objem rekonstituovaného přípravku OBIZUR intravenózně rychlostí 1 až 2 ml za minutu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Baxalta Innovations GmbH Industriestrasse 67 A-1221 Vídeň Rakousko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/15/1035/001
EU/1/15/1035/002
EU/1/15/1035/003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ používání LÉČIVÉHO PŘÍPRAVKU
E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA
PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Baxalta US, Inc 27 Maple Street Milford MA 01757
SPOJENÉ STÁTY AMERICKÉ
Název a adresa výrobce odpovědného za propouštění šarží
Baxter AG Industriestrasse 67 A-1221 Vídeň RAKOUSKO
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik.
• Další opatření k minimalizaci rizik
Před uvedením přípravku OBIZUR na trh v každém členském státě se musí držitel rozhodnutí o registraci dohodnout s příslušným vnitrostátním orgánem na obsahu a formátu edukačního programu, včetně komunikačních médií, způsobů distribuce a jakýchkoli dalších aspektů programu.
Edukační program má za cíl minimalizovat chyby při dávkování.
Držitel rozhodnutí o registraci zajistí, aby v každém členském státě, kde se přípravek OBIZUR uvádí na trh, měli všichni zdravotničtí pracovníci, u nichž se očekává, že budou předepisovat a vydávat přípravek OBIZUR, přístup k následujícímu edukačnímu balíčku nebo aby jim byl tento balíček poskytnut:
• Edukační materiál pro lékaře
Edukační materiál pro lékaře má obsahovat:
• Souhrn údajů o přípravku
• Školicí materiál pro zdravotnické pracovníky
Školicí materiál pro zdravotnické pracovníky mají obsahovat tyto klíčové položky:
• Brožuru pro zdravotnické pracovníky obsahující podrobný výpočet počtu injekčních lahviček pro pacienta vážícího například 70 kg.
• On-line video pro další rozvedení požadovaného výpočtu a podání léku.
E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO
REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ
Tato registrace byla schválena za „výjimečných okolností“, a proto podle článku 14(8) nařízení (ES) č. 726/2004 držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření:
|
Popis |
Termín splnění |
|
Za účelem shromáždění a analýzy okamžitých a dlouhodobých údajů o klinické účinnosti a bezpečnosti u všech pacientů se získanou hemofilií léčených přípravkem OBIZUR musí držitel rozhodnutí o registraci provést program dohledu / zřídit registr dle schváleného protokolu a po neomezenou dobu. |
Každoročně při výročním přehodnocení |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA
1. NÁZEV PŘÍPRAVKU
OBIZUR 500 U prášek a rozpouštědlo pro injekční roztok susoctocogum alfa
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje po rekonstituci přibližně 500 U antihemofilního faktoru VIII (rekombinantního), prasečí sekvence, susoctocogum alfa.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky:
Polysorbát 80 Chlorid sodný
Dihydrát chloridu vápenatého
Sacharóza
Trometamol
Trometamol-hydrochlorid
Dihydrát natrium-citrátu
Před použitím si přečtěte příbalovou informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Jedna, pět, deset injekčních lahviček
Jedna, pět, deset předplněných injekčních stříkaček s rozpouštědlem Jeden, pět, deset adaptérů injekční lahvičky
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
K intravenóznímu podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Použijte ihned nebo během 3 hodin po rekonstituci.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Baxalta Innovations GmbH A-1221 Vídeň Rakousko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/15/1035/001
EU/1/15/1035/002
EU/1/15/1035/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
S jedinečným vnitrostátním kódem
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
OBIZUR 500 U prášek pro injekční roztok
Susoctocogum alfa
i.v.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Jednorázová injekce.
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
500 U
6. JINÉ
Logo Baxalta
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro přípravek OBIZUR Voda na injekci.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
OBIZUR 500 U prášek a rozpouštědlo pro injekční roztok
Susoctocogum alfa
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek OBIZUR a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek OBIZUR používat
3. Jak se přípravek OBIZUR používá
4. Možné nežádoucí účinky
5. Jak přípravek OBIZUR uchovávat
6. Obsah balení a další informace
1. Co je přípravek OBIZUR a k čemu se používá
Přípravek OBIZUR obsahuje léčivou látku susoktokog alfa, antihemofilní faktor VIII, prasečí sekvence. Faktor VIII je nezbytný pro srážení krve a zástavu krvácení.
U pacientů se získanou hemofilií nefunguje faktor VIII správně, protože si pacient vytvořil protilátky proti svému vlastnímu faktoru VIII, které neutralizují tento faktor srážení krve.
Přípravek OBIZUR se používá k léčbě krvácivých epizod u dospělých se získanou hemofilií (porucha krvácení způsobená nedostatečnou aktivitou faktoru VIII v důsledku vzniku protilátek). Tyto protilátky mají na přípravek OBIZUR méně neutralizační účinek než na lidský faktor VIII.
Přípravek OBIZUR obnovuje tuto chybějící aktivitu faktoru VIII a pomáhá krvi se srážet v místě krvácení.
2. Čemu musíte věnovat pozornost, než začnete přípravek OBIZUR používat
Přípravek je určen pouze k podání v nemocnici. Vyžaduje klinický dohled nad stavem krvácení pacienta.
Nepoužívejte přípravek OBIZUR:
- jestliže jste alergický(á) na susoktokog alfa nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6),
- jestliže jste alergický(á) na křeččí proteiny (v přípravku OBIZUR mohou být přítomná stopová množství pocházející z výrobního procesu).
Pokud si nejste jistý(á), poraďte se se svým lékařem před použitím tohoto přípravku.
Upozornění a opatření
Před použitím přípravku OBIZUR se poraďte se svým lékařem.
Existuje velmi malá šance, že se u Vás může objevit alergická reakce na přípravek OBIZUR. Měl(a) byste si dát pozor na časné známky alergické reakce (známky a příznaky viz bod 4). Pokud se objeví kterýkoli z těchto příznaků, má se podávání injekce ukončit. Závažné příznaky, včetně ztíženého dýchání a (téměř) mdlob, vyžadují akutní ošetření.
Pacienti vytvářející inhibiční protilátky proti přípravku OBIZUR
Váš lékař může kontrolovat, zda nemáte inhibiční protilátky proti prasečímu faktoru VIII.
Váš lékař Vám bude kontrolovat hladinu faktoru VIII v krvi, aby ověřil, zda dostáváte dostatečné množství faktoru VIII. Váš lékař bude rovněž kontrolovat, zda je krvácení dostatečně pod kontrolou.
Sdělte svému lékaři, pokud jste v minulosti trpěl(a) srdečně cévním onemocněním nebo pokud u Vás existuje známé riziko trombózy (onemocnění v důsledku krevních sraženin v normálním cévním řečišti), protože při vysoké a udržované hladině faktoru VIII v krvi nelze vyloučit možnost rozvoje tromboembolických onemocnění.
Název a číslo šarže
Důrazně se doporučuje, aby při každém použití přípravku OBIZUR zaznamenal zdravotnický pracovník název a číslo šarže léčivého přípravku za účelem uchování informace propojující Vaši léčbu s šarží přípravku.
Použití u dětí a dospívajících
Přípravek OBIZUR není v současné době schválenk léčbě pacientů ve věku do 18 let, u nichž je vrozená hemofilie vzácná.
Další léčivé přípravky a přípravek OBIZUR
Informujte svého lékaře o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat. Nejsou známy žádné interakce přípravku OBIZUR s jinými léčivými přípravky.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat.
Řízení dopravních prostředků a obsluha strojů
Přípravek OBIZUR nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
Přípravek OBIZUR obsahuje sodík
Tento léčivý přípravek obsahuje po připravení 4,4 mg sodíku na mililitr.
Poraďte se se svým lékařem, pokud jste na dietě s omezeným příjmem sodíku.
3. Jak se přípravek OBIZUR používá
Léčbu přípravkem OBIZUR bude provádět lékař, který má zkušenosti s péčí o pacienty s hemofilií (krvácivé poruchy).
Váš lékař Vám vypočítá dávku přípravku OBIZUR (v jednotkách neboli U) podle Vašeho stavu a tělesné hmotnosti. Četnost a délka podávání bude záviset na tom, jak dobře u Vás bude přípravek OBIZUR fungovat. Substituční léčba přípravkem OBIZUR je obvykle dočasná, dokud krvácení neodezní nebo nejsou zničeny protilátky proti Vašemu vlastnímu faktoru VIII.
Doporučená první dávka je 200 U na kilogram tělesné hmotnosti podávaná nitrožilní injekcí.
Váš lékař Vám bude pravidelně měřit aktivitu faktoru VIII, aby se rozhodl ohledně následující dávky a četnosti podávání přípravku OBIZUR.
Krvácení obvykle na léčbu zareaguje během prvních 24 hodin. Váš lékař Vám bude upravovat dávku a trvání léčby přípravkem OBIZUR, dokud se krvácení nezastaví.
Celkový objem rekonstituovaného přípravku OBIZUR se má podávat rychlostí 1 až 2 ml za minutu.
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Jestliže jste použil(a) více přípravku OBIZUR, než jste měl(a)
Vždy používejte přípravek OBIZUR přesně podle pokynů svého lékaře. Jestliže jste použil(a) více přípravku OBIZUR, než se doporučuje, sdělte to co možná nejdříve svému lékaři.
Jestliže jste zapomněl(a) použít přípravek OBIZUR
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku. Pokud jste vynechal(a) dávku a nevíte, jak ji nahradit, obraťte se na svého lékaře.
Jestliže jste přestal(a) používat přípravek OBIZUR
Nepřestávejte používat přípravek OBIZUR bez porady se svým lékařem.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Objeví-li se závažné a náhlé alergické reakce, musí se injekce ihned ukončit. Musíte okamžitě kontaktovat svého lékaře, pokud máte kterýkoli z těchto časných příznaků:
- otok rtů a jazyka,
- pálení a bodání v místě injekce,
- zimnice, zrudnutí,
- kopřivka, svědění kůže celého těla,
- bolest hlavy, nízký krevní tlak,
- letargie, nevolnost, neklid,
- rychlý srdeční tep, tíseň na hrudi,
- brnění, zvracení,
- sípot.
Časté nežádoucí účinky (mohou postihnout až 1 osobu z 10)
- Vznik protilátek proti tomuto léčivému přípravku
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek OBIZUR uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce, injekční lahvičce a předplněné injekční stříkačce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Použijte rekonstituovaný roztok ihned, avšak ne později než 3 hodiny po úplném rozpuštění prášku.
Po rekonstituci má být roztok čirý a bezbarvý.
Nepodávejte, pokud pozorujete částice nebo zabarvení.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek OBIZUR obsahuje
- Léčivou látkou je susoctocogum alfa (antihemofilní faktor VIII, prasečí sekvence, vyráběný technologií rekombinantní DNA). Jedna injekční lahvička s práškem obsahuje susoctocogum alfa 500 U.
- Dalšími složkami prášku jsou polysorbát 80, chlorid sodný (viz také bod 2), dihydrát chloridu vápenatého, sacharóza, trometamol, trometamol-hydrochlorid, dihydrát natrium-citrátu.
- Rozpouštědlem je 1 ml vody na injekci.
Jak přípravek OBIZUR vypadá a co obsahuje toto balení
Jedno balení obsahuje 1, 5 nebo 10 následujících položek:
- skleněná injekční lahvička přípravku OBIZUR 500 U, bílý, drolivý prášek, s pryžovou zátkou a odnímatelným uzávěrem,
- předplněná skleněná injekční stříkačka s 1 ml vody na injekci s pryžovým uzávěrem hrotu a adaptérem Luer Lock,
- zařízení pro přenos kapaliny se zabudovaným plastovým hrotem.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Baxalta Innovations GmbH Industriestrasse 67 A-1221 Vídeň Rakousko
Výrobce Baxter AG Industriestrasse 67 A-1221 Vídeň Rakousko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Baxalta Belgium SPRL Tél./Tel.: +32 2 892 62 00 |
Lietuva UAB Baxter Lithuania Tel: +370 5 269 16 90 / +370 5 252 71 00 |
|
BtarapHH EaKCTep Etarapna EOOfl Tea.: + 359 2 9808482 |
Luxembourg/Luxemburg Baxalta Belgium SPRL Tél/Tel: +32 2 892 62 00 |
|
Česká republika Baxter Czech spol.s r.o. Tel.: +420 225774111 |
Magyarország Baxter Hungary Kft Tel.: +36 1 202 1980 |
|
Danmark Baxalta Denmark A/S Tlf.: +45 32 70 12 00 |
Malta Baxalta UK Limited Tel.: +44 1 635 798 777 |
|
Deutschland Baxalta Deutschland GmbH Tel.: +49 89 262077-011 |
Nederland Baxalta Netherlands B.V. Tel.: +31 30 799 27 77 |
|
Eesti OU Baxter Estonia Tel.: +372 6 515 120 |
Norge Baxalta Norway AS Tlf.: +47 22 585 000 |
|
EXlába Baxter Hellas EnE TqT,: +30 210 28 80 000 |
Osterreich Baxalta Osterreich GmbH Tel.: +43 1 20100-0 |
|
Espaňa Baxalta Spain S.L. Tel.: +34 91 790 42 22 |
Polska Baxter Polska Sp. z.o.o. Tel.: +48 22 4883 777 |
|
France Baxalta France SAS Tél.: +33 1 70 96 06 00 |
Portugal Baxalta Portugal, Unipessoal, Lda. Tel.: +351 21 122 03 00 |
|
Hrvatska Baxter d.o.o. Tel.: +386 1 420 16 80 |
Románia FARMACEUTICA REMEDIA SA Tel.: + 40 21 321 16 40 |
|
Ireland Baxalta UK Limited Tel.: +44 1 635 798 777 |
Slovenija Baxter d.o.o. Tel.: +386 1 420 16 80 |
|
Island Lyfjaver ehf. Sími: +354 533 6100 |
Slovenská republika Baxter Slovakia, s.r.o. Tel: +421 2 3210 1150 |
|
Italia Baxalta Italy S.r.l. Tel.: +39 06 45224 600 |
Suomi/Finland Baxalta Finland Oy Puh/Tel.: +358 201 478 200 |
|
Kúnpoq Baxter Hellas EnE TnT.: +30 210 28 80 000 |
Sverige Baxalta Sweden AB Tel.: +46 8 50 53 26 00 |
Tato příbalová informace byla naposledy revidována MM.RRRR.
Tento léčivý přípravek byl registrován za „výjimečných okolností“. Znamená to, že vzhledem ke vzácné povaze tohoto onemocnění nebylo možné získat o tomto léčivém přípravku úplné informace. Evropská agentura pro léčivé přípravky každoročně vyhodnotí jakékoli nové informace týkající se tohoto léčivého přípravku a tato příbalová informace bude podle potřeby aktualizována.
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu <a na webových stránkách {název národní agentury, příslušná webová adresa}>. <Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
<Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.>
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
POKYNY PRO PŘÍPRAVU A PODÁNÍ
Příprava
Před zahájením rekonstituce budete potřebovat následující pomůcky:
• vypočítaný počet injekčních lahviček s práškem,
• stejný počet 1ml injekčních stříkaček s rozpouštědlem a sterilních adaptérů injekční lahvičky,
• tampón napuštěný alkoholem,
• velkou sterilní injekční stříkačku na konečný objem rekonstituovaného přípravku.
Níže uvedené postupy slouží jako obecné pokyny pro přípravu a rekonstituci přípravku OBIZUR,
Následujícími pokyny pro rekonstituci se řiďte u každé injekční lahvičky s práškem určené k podání.
Rekonstituce
Během postupu rekonstituce používejte aseptickou techniku.
1. Vytemperujte injekční lahvičku s práškem přípravku OBIZUR a předplněnou injekční stříkačku s rozpouštědlem na pokojovou teplotu.
2. Sejměte plastový uzávěr z injekční lahvičky s práškem přípravku OBIZUR (Obrázek A).
3. Otřete pryžovou zátku tampónem napuštěným alkholem (není součástí balení přípravku) a nechte před použitím oschnout.
4. Odtrhněte kryt balení adaptéru injekční lahvičky (Obrázek B). Nedotýkejte se hrotu luer lock ve středu adaptéru injekční lahvičky. Nevyndávejte adaptér injekční lahvičky z balení.
5. Umístěte balení s adaptérem injekční lahvičky na čistý povrch tak, aby hrot luer lock mířil vzhůru.
6. Sejměte bezpečnostní uzávěr z předplněné injekční stříkačky s rozpouštědlem (Obrázek C).
7. Pevně držte balení s adaptérem injekční lahvičky a připojte předplněnou injekční stříkačku s rozpouštědlem k adaptéru zatlačením hrotu injekční stříkačky směrem dolů na luer lock ve středu adaptéru, a poté stříkačkou otáčejte ve směru hodinových ručiček, dokud se nezajistí. Neutahujte příliš (Obrázek D).
8. Sundejte plastový obal (Obrázek E).
9. Umístěte injekční lahvičku s práškem přípravku OBIZUR na čistý, rovný, tvrdý povrch. Umístěte adaptér injekční lahvičky nad injekční lahvičku s práškem přípravku OBIZUR a silně protlačte filtrovací hrot adaptéru skrz střed pryžového kroužku injekční lahvičky s práškem přípravku OBIZUR, až průhledný plastový uzávěr dosedne na injekční lahvičku (Obrázek F).
10. Stlačte píst dolů, abyste injikovali veškeré rozpouštědlo ze stříkačky do injekční lahvičky s práškem přípravku OBIZUR.
11. Opatrně kružte injekční lahvičkou s práškem přípravku OBIZUR, aniž byste sundávali injekční stříkačku, dokud se všechen prášek zcela nerozpustí/nerekonstituuje (Obrázek G). Rekonstituovaný roztok se má před podáním zkontrolovat zrakem, zda neobsahuje částice. Nepoužívejte, pokud pozorujete částice nebo zabarvení.
12. Jednou rukou držte injekční lahvičku s práškem a adaptér injekční lahvičky a druhou rukou pevně uchopte tělo předplněné injekční stříkačky s rozpouštědlem a pohybem proti směru hodinových ručiček odšroubujte stříkačku z adaptéru injekční lahvičky (Obrázek H).
13. Pokud se přípravek OBIZUR uchovává při pokojové teplotě, použijte ho ihned a do tří hodin od rekonstituce.
Obrázek A
Obrázek B
Obrázek C
Obrázek D
Podání
Pouze k intravenózní injekci!
• Před podáním zkontrolujte rekonstituovaný roztok přípravku OBIZUR, zda neobsahuje částice nebo není zabarven. Roztok má být čirý a bezbarvý. Nepodávejte, pokud pozorujete částice nebo zabarvení.
• Nepodávejte přípravek OBIZUR stejným aplikačním setem nebo ze stejné nádoby spolu s jinými injekčními léčivými přípravky.
Za použití aseptické techniky podejte přípravek následovně:
1. Po rekonstituci všech injekčních lahviček připojte velkou injekční stříkačku k adaptéru injekční lahvičky lehkým zatlačením hrotu stříkačky dolů na luer lock ve středu adaptéru, a poté stříkačkou otáčejte ve směru hodinových ručiček, dokud se nezajistí.
2. Obraťte injekční lahvičku dnem vzhůru, vtlačte vzduch z injekční stříkačky do lahvičky a natáhněte rekonstituovaný přípravek OBIZUR do stříkačky (Obrázek I).
Obrázek I
3. Odšroubujte velkou stříkačku proti směru hodinových ručiček od adaptéru injekční lahvičky a zopakujte tento postup se všemi injekčními lahvičkami rekonstituovaného přípravku OBIZUR, dokud nezískáte celkový objem určený k podání.
4. Podejte celkový objem rekonstituovaného přípravku OBIZUR intravenózně rychlostí 1 až 2 ml za minutu.
Požadovaná počáteční dávka přípravku OBIZUR pro pacienta se vypočítá pomocí tohoto vzorce: Počáteční dávka (U/kg) ť Síla přípravku (U/injekční lahvička) x Tělesná hmotnost (kg) = Počet
injekčních lahviček
např. pro 70 kg vážícího pacienta se počet injekčních lahviček pro počáteční dávku vypočítá takto: 200 U/kg ť 500 U/injekční lahvička x 70 kg = 28 injekčních lahviček
Dávkování
Doporučená počáteční dávka je 200 U na kilogram tělesné hmotnosti podávaná nitrožilní injekcí.
|
Typ krvácení |
Cílová údolní aktivita faktoru VIII (jednotky na dl nebo % normální hodnoty) |
Počáteční dávka (jednotek na kg) |
Následující dávka |
Frekvence a délka trvání následného dávkování |
|
mírné a středně silné, povrchový sval / bez neurovaskulárního postižení a krvácení do kloubu |
> 50 % |
200 |
Titrujte následující dávky na základě klinické odpovědi a k udržení cílové údolní aktivity faktoru VIII |
Dávka každé 4 hodiny až 12 hodin, frekvenci lze upravit podle klinické odpovědi a naměřené aktivity faktoru VIII |
|
Větší středně silné až silné intramuskulární, retroperitoneální, gastrointestinální, intrakraniální krvácení |
> 80 % |
PŘÍLOHA IV
ZÁVĚRY O UDĚLENÍ ROZHODNUTÍ O REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ PŘEDLOŽENÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY
Závěry předložené Evropskou agenturou pro léčivé přípravky:
• Registrace přípravku za výjimečných okolností
Výbor CHMP posoudil žádost a je toho názoru, že poměr přínosů a rizik je příznivý, a proto doporučuje, aby přípravku byla udělena registrace za výjimečných okolností, jak je podrobněji popsáno v Evropské veřejné zprávě o hodnocení.
31