Nuvaring 0,120 Mg/0,015 Mg Za 24 Hodin, Vaginální Inzert
Sp.zn.sukls223706/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
NuvaRing 0,120 mg/0,015 mg za 24 hodin, vaginální inzert
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
NuvaRing obsahuje etonogestrelum 11,7 mg a ethinylestradiolum 2,7 mg.
Kroužek uvolňuje za 24 hod průměrně 0,120 mg etonogestrelu a 0,015 mg ethinylestradiolu po dobu 3 týdnů.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Vaginální inzert.
NuvaRing je ohebný, průhledný, bezbarvý až téměř bezbarvý kroužek, který má zevní průměr 54 mm a průměr průřezu 4 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Kontraceptivum.
NuvaRing je určen pro ženy ve fertilním věku. Bezpečnost a účinnost byly prokázány u žen ve věku od 18 do 40 let.
Rozhodnutí předepsat přípravek NuvaRing by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku NuvaRing v porovnání s dalšími přípravky CHC (viz body 4.3 a 4.4).
4.2 Dávkování a způsob podání
Dávkování
Aby bylo dosaženo kontracepční účinnosti, NuvaRing musí být používán podle pokynů (viz „Jak používat přípravek NuvaRing“ a „Jak zahájit používání přípravku NuvaRing“).
Pediatrická populace
Bezpečnost a účinnost přípravku NuvaRing u dospívajících ve věku do 18 let nebyla studována.
Způsob podání
JAK POUŽÍVAT PŘÍPRAVEK NUVARING
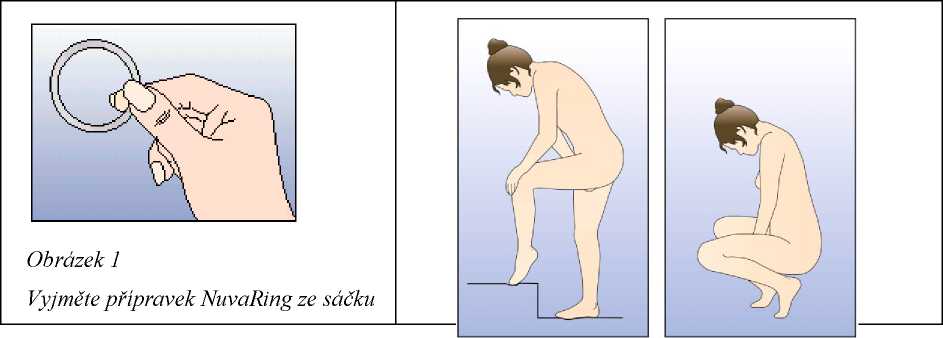
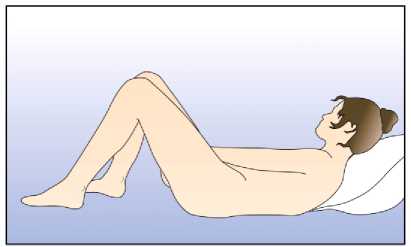
Žena si může zavádět do pochvy přípravek NuvaRing sama. Lékař by jí měl poradit, jak jej zavádět a jak jej odstraňovat. K zavádění by si žena měla vybrat polohu, která je pro ni nejpohodlnější, např. ve stoje s jednou nohou zvednutou, v dřepu nebo vleže. Přípravek NuvaRing by se měl stlačit a zavést do pochvy tak, aby žena měla po zavedení dobrý pocit. Možnou alternativou je zavést kroužek pomocí NuvaRing aplikátoru, který je distribuován samostatně. NuvaRing aplikátor nemusí být dostupný ve všech zemích. Přesná poloha přípravku NuvaRing v pochvě není rozhodující pro antikoncepční účinek kroužku (viz obrázky 1-4).
Jakmile byl přípravek NuvaRing zaveden (viz „Jak zahájit používání přípravku NuvaRing“), je ponechán v pochvě trvale po 3 týdny. Žena by si měla zvyknout ověřovat si pravidelně přítomnost přípravku NuvaRing v pochvě. Jestliže je přípravek NuvaRing náhodně vypuzen, měla by žena následovat instrukce v bodě 4.2 „Co dělat, když byl kroužek po nějakou dobu mimo pochvu” (pro více informací viz také bod 4.4 „Vypuzení”).
Po 3 týdnech používání musí být přípravek NuvaRing odstraněn ve stejný den v týdnu, kdy byl zaveden. Po jednotýdenní přestávce bez kroužku se zavádí nový kroužek (např. jestliže je přípravek NuvaRing zaveden ve středu asi ve 22 hodin, pak by měl být odstraněn opět ve středu o 3 týdny později, také asi ve 22 hodin. Následující středu by pak měl být zaveden nový kroužek).
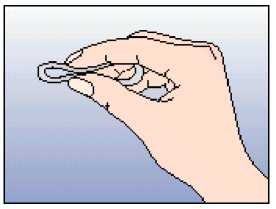
Přípravek NuvaRing může být vytažen zaháknutím ukazováčku za kroužek nebo uchopením kroužku ukazováčkem a prostředníkem a vytažením (Obrázek 5). Použitý kroužek by se měl vložit do sáčku (uchovávejte mimo dosah dětí a domácích zvířat) a být zlikvidován tak, jak je to popsáno v bodě 6.6. Za 2-3 dny po odstranění přípravku NuvaRing dojde obvykle ke krvácení z vysazení, které nemusí úplně skončit do doby, kdy je třeba zavést nový kroužek.
Obrázek 2 Kroužek stlačte
Obrázek 3
Pro zavedení kroužku si zvolte pohodlnou polohu
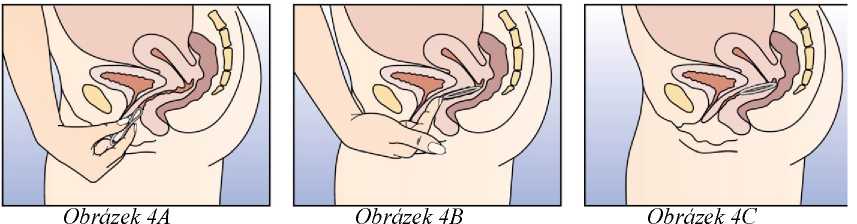
Zaveďte kroužek do pochvy jednou rukou (Obrázek 4A), v případě potřeby roztáhněte stydké pysky druhou rukou. Zasuňte kroužek do pochvy tak, abyste se po jeho zavedení cítila dobře (Obrázek 4B). Ponechte kroužek v pochvě po 3 týdny (Obrázek 4C).
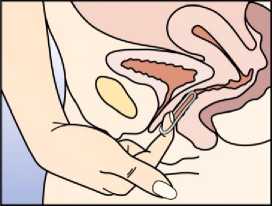
Obrázek 5:
NuvaRing může být vytažen zaháknutím ukazováčku za kroužek nebo uchopením kroužku ukazováčkem a prostředníkem a vytažením.
JAK ZAHÁJIT POUŽÍVÁNÍ PŘÍPRAVKU NUVARING
Žádná hormonální antikoncepce v předchozím cyklu
NuvaRing by měl být zaveden první den přirozeného cyklu (tj. první den menstruačního krvácení). Zavedení 2. až 5. den je možné, ale během prvního cyklu je po dobu prvních 7 dnů doporučeno navíc používání bariérové metody antikoncepce.
Přechod z kombinované hormonální antikoncepce
Žena by si měla zavést přípravek NuvaRing nejpozději v den, který následuje po období bez tablet, náplasti nebo den po poslední placebové tabletě své předchozí kombinované hormonální antikoncepce.
Pokud žena (po)užívala svou předcházející metodu důsledně a správně, a jestliže je tedy jisté, že není těhotná, může také přejít ze své předchozí kombinované hormonální antikoncepce kterýkoli den cyklu.
Interval bez hormonů předchozí antikoncepce by neměl být nikdy delší, než je jeho doporučené trvání.
Přechod z čistě gestagenní metody (minipilulka, implantát nebo injekce) nebo z nitroděložního systému uvolňujícího gestagen (IUD).
U minipilulky může žena přejít na používání kroužku kdykoliv (u implantátu nebo IUD to lze učinit v den jejich odstranění a u injekcí tehdy, když by měla následovat další injekce), ale ve všech těchto případech by měla žena v prvních 7 dnech navíc používat bariérovou metodu antikoncepce.
Po potratu v prvním trimestru
Žena může začít okamžitě. V tom případě nemusí používat žádná další antikoncepční opatření. Pokud je okamžité zahájení antikoncepce pokládáno za nežádoucí, měla by se žena řídit pokyny uvedenými v odstavci „Žádná hormonální antikoncepce v předchozím cyklu“. Až do zavedení kroužku by pak měla používat jinou antikoncepční metodu.
Po porodu nebo potratu ve druhém trimestru Kojící ženy viz bod 4.6.
Ženě by mělo být doporučeno, aby si zavedla kroužek čtvrtý týden po porodu nebo po potratu ve druhém trimestru. Pokud začne později, pak by v prvních 7 dnech po zavedení přípravku NuvaRing měla používat navíc bariérovou metodu antikoncepce. Jestliže však již došlo k pohlavnímu styku, musí být vyloučeno těhotenství nebo je třeba před zavedením kroužku vyčkat do první menstruace.
ODCHYLKY OD DOPORUČENÉHO REŽIMU
Antikoncepční účinnost a kontrola cyklu může být ohrožena, jestliže se žena odchýlí od doporučeného režimu. Aby se v případě takové odchylky vyhnula ztrátě antikoncepční účinnosti, je vhodné jí dát následující radu:
• Co dělat, když je období bez zavedeného kroužku delší
V tom případě by si žena měla zavést kroužek ihned, jak si na to vzpomene. V následujících 7 dnech by měla navíc používat bariérovou metodu, jako např. kondom. Pokud došlo v období, kdy neměla zavedený kroužek, k pohlavnímu styku, je třeba uvážit možnost otěhotnění. Čím delší je období bez kroužku, tím vyšší je riziko otěhotnění.
• Co dělat, když byl kroužek po nějakou dobu mimo pochvu
Přípravek NuvaRing by měl být ponechán v pochvě po celé období 3 týdnů. Jestliže je kroužek náhodně vypuzen, může být opláchnut studenou nebo vlažnou vodou (ne horkou) a okamžitě opět zaveden.
Jestliže byl přípravek NuvaRing mimo pochvu méně než 3 hodiny, pak není antikoncepční účinnost snížena. Žena by si měla znovu kroužek zavést, hned jak je to možné, ale nejpozději do 3 hodin.
Jestliže přípravek NuvaRing byl, nebo se domníváte, že by mohl být, mimo pochvu déle než 3 hodiny během 1. nebo 2. týdne používání, pak jeho antikoncepční účinek může být snížen. Žena by si měla kroužek znovu zavést ihned, jak si to uvědomí. Po dobu prvních 7 dnů nepřetržitého používání přípravku NuvaRing by pak měla používat bariérovou metodu např. kondom. Čím déle je přípravek NuvaRing mimo pochvu a čím blíže je to k běžnému období bez kroužku, tím vyšší je riziko otěhotnění.
Jestliže přípravek NuvaRing byl, nebo se domníváte, že mohl být, mimo pochvu déle než 3 hodiny během 3. týdne, z celkového třítýdenního období, pak jeho antikoncepční účinek může být snížen. Žena by měla kroužek znehodnotit a použít jednu z těchto 2 možností:
1. Okamžitě si zavést nový kroužek
Poznámka: Zavedením nového kroužku začíná nové třítýdenní období. Žena nemusí mít krvácení z vysazení v období svého cyklu. Nicméně špinění nebo krvácení z průniku se mohou objevit.
2. Ponechá pauzu na krvácení z vysazení a zavede nový kroužek, avšak ne později než za 7 dní (7 x 24 hodin) od odstranění nebo vypuzení minulého kroužku.
Poznámka: Tato možnost se může použít pouze tehdy, jestliže kroužek byl používán soustavně v předešlých 7 dnech.
• Co dělat v případě prodlouženého používání kroužku
Ačkoliv toto není doporučený režim, tak jestliže byl přípravek NuvaRing používán maximálně po 4 týdny, je jeho antikoncepční působení ještě dostačující. Žena může dodržet týdenní interval bez kroužku, a pak si zavést nový kroužek. Pokud ale měla kroužek zavedený déle než 4 týdny, může být jeho antikoncepční účinnost snížena a před zavedením dalšího přípravku NuvaRing je třeba vyloučit těhotenství.
Jestliže se žena neřídila doporučeným režimem, a poté u ní nedošlo k následnému krvácení z vysazení v období bez zavedeného kroužku, je rovněž třeba před zavedením dalšího kroužku vyloučit těhotenství.
JAK ODDÁLIT NEBO POSUNOUT MENSTRUACI
Ve výjimečných případech, kdy je potřeba oddálit menstruaci, si může žena zavést nový kroužek ihned po odstranění starého, aniž by dodržela týdenní interval bez kroužku. Nový kroužek může být opět používán až po dobu 3 týdnů. V té době může dojít ke krvácení nebo špinění. Pravidelné používání přípravku NuvaRing je pak zahájeno po obvyklé týdenní přestávce bez kroužku.
Aby mohla posunout menstruaci na jiný den týdne, než ve kterém ji dostává v současnosti, je možné ženě poradit, aby zkrátila následující období bez kroužku o požadovaný počet dní. Čím kratší je interval bez zavedeného kroužku, tím větší je pravděpodobnost, že u ní nedojde ke krvácení z vysazení a že se naopak objeví krvácení z průniku nebo špinění při použití dalšího kroužku.
4.3 Kontraindikace
Kombinovaná hormonální antikoncepce (CHC) by se neměla používat u následujících stavů. Pokud by se některý z těchto stavů objevil poprvé v průběhu používání přípravku NuvaRing, je třeba kroužek ihned odstranit.
• Přítomnost nebo riziko žilního tromboembolismu (VTE)
o Žilní tromboembolismus - současný žilní tromboembolismus (léčený pomocí antikoagulancií) nebo anamnéza VTE (např. hluboká žilní trombóza [DVT] nebo plicní embolie [PE]).
o Známá dědičná nebo získaná predispozice pro žilní tromboembolismus, jako je rezistence na APC (včetně faktoru V Leiden), deficit antitrombinu III, deficit proteinu C, deficit proteinu S.
o Velký chirurgický zákrok s déletrvající imobilizací (viz bod 4.4).
o Vysoké riziko žilního tromboembolismu v důsledku přítomnosti více rizikových faktorů (viz bod 4.4).
• Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
o Arteriální tromboembolismus - současný arteriální tromboembolismus, anamnéza arteriálního tromboembolismu (např. infarkt myokardu) nebo prodromální stav (např. angina pectoris);
o Cerebrovaskulární onemocnění - současná cévní mozková příhoda, anamnéza cévní mozkové příhody nebo prodromálního stavu (např. tranzitorní ischemická ataka, TIA);
o Známá hereditární nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinemie a antifosfolipidové protilátky (antikardiolipinové protilátky, lupus antikoagulans);
o Anamnéza migrény s fokálními neurologickými příznaky;
o Vysoké riziko arteriálního tromboembolismu v důsledku vícečetných rizikových faktorů (viz bod 4.4) nebo přítomnosti jednoho závažného rizikového faktoru, jako je:
• diabetes mellitus s cévními příznaky;
• závažná hypertenze;
• závažná dyslipoproteinemie.
• Pankreatitida současná nebo v anamnéze, pokud byla spojena s těžkou hypertriglyceridemií.
• Závažné onemocnění jater současné nebo v anamnéze, pokud se hodnoty jaterních funkcí nevrátily k normálu.
• Nádory jater (benigní nebo maligní) současné nebo v anamnéze.
• Známé malignity pohlavních orgánů nebo prsů či podezření na ně, pokud jsou ovlivněny pohlavními steroidy.
• Vaginální krvácení neznámého původu.
• Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku přípravku NuvaRing uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
UPOZORNĚNÍ
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, měla by být vhodnost
přípravku NuvaRing s ženou prodiskutována.
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů by mělo
být ženě doporučeno, aby kontaktovala svého lékaře, který stanoví, zda by měla používání přípravku
NuvaRing ukončit.
1. Oběhové poruchy
Riziko žilního tromboembolismu (VTE)
• Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE) ve srovnání s jejím neužíváním. Přípravky, které obsahují levonorgestrel, norgestimát nebo norethisteron jsou spojovány s nejnižším rizikem VTE. Další přípravky, jako je přípravek NuvaRing, mohou mít až dvakrát vyšší úroveň rizika. Rozhodnutí používat jakýkoli přípravek jiný než ten, který má nejnižší riziko VTE, by mělo být učiněno pouze po diskusi se ženou, aby se zajistilo, že rozumí riziku VTE u přípravku NuvaRing, rozumí, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je nejvyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko je zvýšené, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
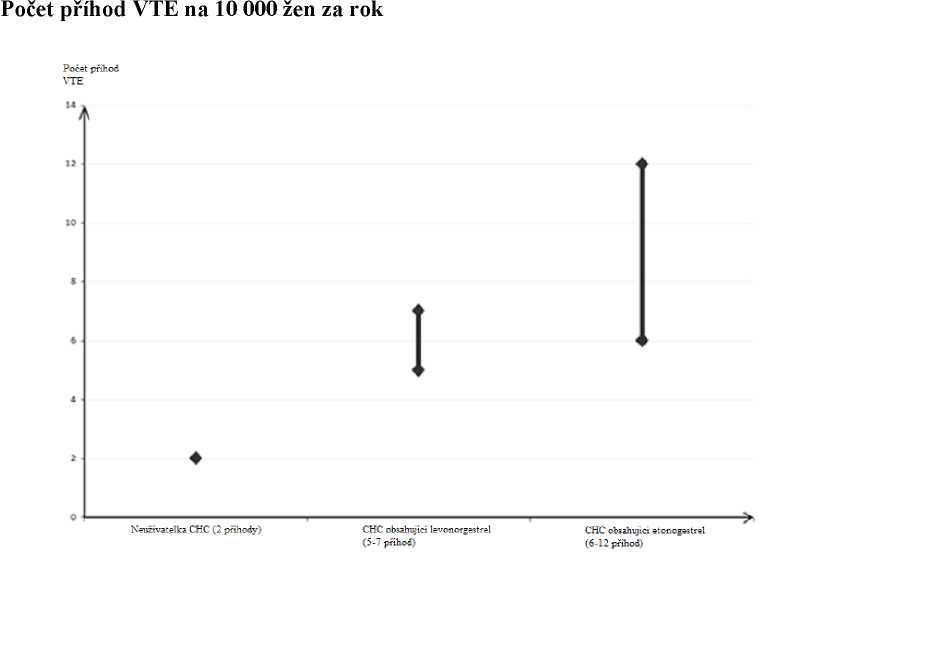
• U žen, které neužívají CHC a nejsou těhotné, se asi u 2 z 10 000 vyvine VTE v průběhu jednoho roku. U každé jednotlivé ženy však může být riziko daleko vyšší v závislosti na jejích základních rizikových faktorech (viz níže).
• Odhaduje se, že z 10 000 žen, které používají nízkodávkovou CHC obsahující levonorgestrel se asi u 61 vyvine VTE během jednoho roku. Byly zjištěny nekonzistentní výsledky týkající se rizika VTE u přípravku NuvaRing ve srovnání s CHC obsahující levonorgestrel (s odhady relativního rizika pohybujícími se od žádného zvýšení, RR = 0,96 do téměř dvojnásobného zvýšení RR = 1,90). To odpovídá přibližně 6 až 12 VTE za rok na 10 000 žen, které používají přípravek NuvaRing. V obou případech je tento počet VTE za rok menší než počet očekávaný u žen během těhotenství nebo v období po porodu.
• VTE může být fatální v 1-2 % případů.
1 Střední bod rozmezí 5-7 na 10 000 WY (žen-roků) na základě relativního rizika pro CHC obsahující levonorgestrel oproti jejímu nepoužívání přibližně 2,3 až 3,6
7
• Extrémně vzácně byla hlášena trombóza u uživatelek CHC v dalších cévách, např. jatemích, mezenterických, renálních nebo retinálních žilách a tepnách.
Rizikové faktory VTE
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka).
Přípravek NuvaRing je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů - v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory VTE
|
Rizikový faktor |
Poznámka |
|
Obezita (index tělesné hmotnosti nad 30 kg/m2) |
Při zvýšení BMI se značně zvyšuje riziko. Zvláště důležité je zvážit, zda jsou také přítomny další rizikové faktory. |
|
Prodloužená imobilizace, velký chirurgický zákrok, jakýkoli chirurgický zákrok na nohách a pánvi, neurochirurgický zákrok nebo větší trauma. Poznámka: dočasná imobilizace, |
V těchto situacích je doporučeno ukončit používání/užívání náplasti/pilulky/kroužku (v případě plánovaného chirurgického výkonu minimálně 4 týdny předem) a nezahajovat užívání/používání do dvou týdnů po kompletní remobilizaci. Měla by se použít další antikoncepční metoda pro zabránění nechtěnému těhotenství. |
|
včetně cestování letadlem > 4 hodiny může být také rizikovým faktorem VTE, zvláště u žen s dalšími rizikovými faktory |
Antitrombotická léčba by měla být zvážena, pokud přípravek NuvaRing nebyl předem vysazen. |
|
Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). |
Pokud je suspektní hereditární predispozice, měla by být žena před rozhodnutím o používání jakékoli CHC odeslána k odborníkovi na konzultaci. |
|
Další onemocnění související s VTE |
Zhoubné onemocnění, systémový lupus erythematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anemie |
|
Vyšší věk |
Zvláště nad 35 let |
• Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
• Zvýšené riziko tromboembolismu v těhotenství a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6).
Příznaky VTE (hluboká žilní trombóza a plicní embolie)
V případě příznaků by mělo být ženě doporučeno, aby vyhledala okamžitou lékařskou pomoc a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
Příznaky plicní embolie (PE) mohou zahrnovat:
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin. Pokud nastane okluze v oku, mohou se příznaky pohybovat od nebolestivého rozmazaného vidění, které může přejít do ztráty zraku. Někdy může nastat ztráta zraku téměř okamžitě.
Riziko arteriálního tromboembolismu (ATE)
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Rizikové faktory ATE
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulámí příhody u uživatelek CHC se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek NuvaRing je kontraindikován, pokud má žena jeden závažný rizikový faktor nebo více rizikových faktorů ATE, které pro ni představují riziko arteriální trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů - v tomto případě by mělo být zváženo její celkové riziko. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory ATE
|
Rizikový faktor |
Poznámka |
|
Vyšší věk |
Zvláště nad 35 let |
|
Kouření |
Ženě by mělo být doporučeno, aby nekouřila, pokud chce používat CHC. Ženám ve věku nad 35 let, které dále kouří, by mělo být důrazně doporučeno, aby používaly jinou metodu antikoncepce. |
|
Hypertenze | |
|
Obezita (index tělesné hmotnosti nad 30 kg/m2) |
Při zvýšení BMI se značně zvyšuje riziko. Zvláště důležité u žen s dalšími rizikovými faktory |
|
Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). |
Pokud je suspektní hereditární predispozice, měla by být žena odeslána k odborníkovi na konzultaci před rozhodnutím o používání jakékoli CHC. |
|
Migréna |
Zvýšení frekvence nebo závažnosti migrény během používání CHC (což může být prodromální známka cévní mozkové příhody) může být důvodem okamžitého ukončení léčby. |
|
Další onemocnění související s nežádoucími cévními příhodami |
Diabetes mellitus, hyperhomocysteinemie, chlopenní srdeční vada a fibrilace síní, dyslipoproteinemie a systémový lupus erythematodes. |
Příznaky ATE
V případě příznaků by mělo být ženě doporučeno, aby vyhledala okamžitou lékařskou pomoc a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
Dočasné příznaky naznačují, že se jedná o tranzitorní ischemickou ataku (TIA).
Příznaky infarktu myokardu (IM) mohou zahrnovat:
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
• V případě suspektní nebo potvrzené VTE nebo ATE se CHC nemá dále používat. Měla by být používána adekvátní antikoncepční metoda z důvodu teratogenity antikoagulační léčby (kumariny).
2. Nádory
• Epidemiologické studie ukazují na zvýšené riziko vzniku rakoviny děložního hrdla u žen dlouhodobě užívajících COC a infikovaných lidským papilomavirem (HPV). Stále však není jisté, do jaké míry je toto zjištění zkresleno dalšími vlivy (např. rozdíl v počtu sexuálních partnerů nebo v používání bariérových kontraceptiv). Nejsou dostupné žádné epidemiologické údaje o riziku vzniku rakoviny děložního čípku u uživatelek přípravku NuvaRing (viz „lékařské vyšetření/konzultace“).
• V metaanalýze 54 epidemiolologických studií bylo uvedeno, že relativní riziko vzniku rakoviny prsu je u žen, které momentálně užívají COC, lehce zvýšeno (RR=1,24). Toto zvýšené riziko v průběhu 10 let po skončení užívání COC postupně vymizí. Protože rakovina prsu je vzácná u žen mladších než 40 let, je zvýšený počet diagnóz rakoviny prsu u žen v současnosti a nově užívajících COC malý, v poměru k celkovému riziku jejího vzniku. Rakovina prsu diagnostikovaná u dlouhodobých uživatelek COC j e často méně pokročilá než ta, která byla diagnostikována u žen nikdy neužívajících COC. Toto zvýšené riziko může být způsobeno časnější diagnózou rakoviny u žen užívajících COC, biologickým působením COC nebo kombinací obou možností.
• U uživatelek COC byly ve vzácných případech popsány benigní nádory jater a zcela výjimečně i maligní jaterní nádory. V ojedinělých případech vedly tyto nádory k život ohrožujícímu nitrobřišnímu krvácení. Proto, pokud dojde u žen používajících NuvaRing k silné epigastrické bolesti, ke zvětšení jater nebo ke známkám intraabdominálního krvácení, je třeba při diferenciální diagnóze myslet na nádor jater.
3. Jiné stavy
• Pokud má žena hypertriglyceridemii nebo pokud se toto onemocnění vyskytlo v její rodině, pak je u ní zvýšené riziko vzniku pankreatitidy, jestliže užívá hormonální antikoncepci.
• I když byl malý vzestup krevního tlaku pozorován u mnoha žen užívajících hormonální antikoncepci, klinicky významný vzestup tlaku je vzácný. Jasný vztah mezi užíváním hormonální antikoncepce a klinickou hypertenzí nebyl stanoven. Nicméně pokud by se vyvinula v průběhu používání přípravku NuvaRing dlouhodobá, klinicky závažná hypertenze, pak je rozumné, aby lékař přerušil aplikaci kroužku a léčil hypertenzi. Jestliže to pak uzná za vhodné, může znovu zavést přípravek NuvaRing, jakmile bylo antihypertenzní léčbou dosaženo normální hodnoty krevního tlaku.
• Bylo hlášeno, že následující stavy mohou vzniknout nebo se zhoršit jak v průběhu těhotenství, tak při užívání hormonální antikoncepce, i když jejich vzájemný vztah není průkazný: žloutenka a/nebo pruritus související s cholestázou; tvorba žlučových kamenů; porfyrie; systémový lupus erythematodes; hemolyticko-uremický syndrom; Sydenhamova chorea; herpes gestationis; ztráta sluchu způsobená otosklerózou, (dědičný) angioedém.
• Akutní nebo chronické poruchy jaterní funkce mohou vyžadovat přestávku v používání přípravku NuvaRing do té doby, než se ukazatelé jaterních funkcí vrátí k normálu. Recidiva cholestatické žloutenky a/nebo svědění souvisejícího s cholestázou, které poprvé vznikly v průběhu těhotenství nebo předchozího užívání pohlavních steroidů, j sou důvodem k ukončení aplikace kroužku.
• Ačkoliv estrogeny a gestageny mohou mít vliv na periferní inzulinovou rezistenci a glukózovou toleranci, nic nenasvědčuje tomu, že by u diabetiček užívajících hormonální kontraceptiva bylo třeba změnit léčebný režim. Diabetičky by nicméně měly být v průběhu používání přípravku NuvaRing pečlivě sledovány, zvláště v prvních měsících používání.
• V souvislosti s užíváním hormonálních kontraceptiv bylo hlášeno zhoršení Crohnovy choroby a ulcerózní kolitidy.
• Příležitostně se může objevit chloasma, zvláště u těch žen, které chloasma měly v těhotenství. Ženy s takovouto anamnézou by se neměly v období používání přípravku NuvaRing vystavovat slunci nebo ultrafialovému záření.
• Pokud má žena některou z následujících potíží, pak se jí možná nepodaří zavést NuvaRing správně nebo jí kroužek může vypadnout: prolaps děložního čípku, cystokéla a/nebo rektokéla, těžká nebo chronická zácpa.
Velmi vzácně bylo hlášeno u přípravku NuvaRing neúmyslné zavedení do močové trubice s možností skončení v močovém měchýři. Proto by nesprávné umístění mělo být zváženo při diferenciální diagnostice v případě příznaků cystitidy.
• V průběhu používání přípravku NuvaRing může občas dojít k zánětu pochvy. Nic nesvědčí tomu, že by byla účinnost přípravku NuvaRing ovlivněna léčbou kolpitidy, ani že by jeho používání ovlivnilo její léčbu (viz bod 4.5).
• Velmi vzácně bylo hlášeno přilnutí kroužku k vaginální sliznici, které vyžadovalo jeho vyjmutí zdravotnickým pracovníkem.
LÉKAŘSKÉ VYŠETŘENÍ/KONZULTACE
Před zahájením nebo opětovným zahájením používání přípravku NuvaRing by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření při zvážení kontraindikací (viz bod 4.3) a upozornění (viz bod 4.4). Je důležité, aby byla žena upozorněna na informace o žilní a arteriální trombóze, včetně rizika přípravku NuvaRing v porovnání s dalšími typy CHC, na příznaky VTE a ATE, známé rizikové faktory a co by měla dělat v případě suspektní trombózy.
Žena by také měla být informována, aby si pečlivě přečetla příbalovou informaci pro uživatele a aby dodržovala uvedené instrukce. Frekvence a povaha vyšetření by měly být založeny na stanovených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být informovány, že hormonální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími sexuálně přenosnými chorobami.
SNÍŽENÁ ÚČINNOST
Účinnost přípravku NuvaRing může být snížena v případě nevhodného používání (bod 4.2) nebo současně probíhající léčby (bod 4.5).
SNÍŽENÁ KONTROLA CYKLU
V průběhu používání přípravku NuvaRing může dojít k nepravidelnému krvácení (špinění nebo krvácení z průniku). Jestliže se nepravidelné krvácení objeví po pravidelných cyklech a při používání přípravku NuvaRing v souladu s doporučeným režimem, pak je třeba uvážit možné nehormonální příčiny a provést adekvátní diagnostická vyšetření, která jsou indikována k vyloučení malignity nebo těhotenství. Mezi ně může patřit i kyretáž.
U některých žen nemusí dojít v období bez kroužku ke krvácení z vysazení. Jestliže byl přípravek NuvaRing používán podle instrukcí popsaných v bodě 4.2, je nepravděpodobné, že by žena byla těhotná. Nicméně pokud by před prvním vynechaným krvácením z vysazení byl používán nesprávně, nebo jestliže nedošlo ke krvácení z vysazení dvakrát po sobě, pak je třeba vyloučit těhotenství dříve, než bude přípravek NuvaRing opět zaveden.
VYSTAVENÍ MUŽE VLIVU ETHINYLESTRADIOLU A ETONOGESTRELU
Rozsah a možné farmakologické důsledky vystavení mužského sexuálního partnera působení ethinylestradiolu a etonogestrelu přes penis nebyly sledovány.
ZLOMENÝ KROUŽEK
Velmi zřídka bylo hlášeno, že byl přípravek NuvaRing zlomen během použití (viz bod 4.5). Žena odstraní zlomený kroužek, a co nejdříve zavede nový kroužek a používá bariérovou antikoncepci jako např. kondom po dobu 7 dní. Je třeba zvážit možnost těhotenství a žena by se měla poradit se svým lékařem.
VYPUZENÍ
Bylo hlášeno vypuzení přípravku NuvaRing, např. pokud kroužek nebyl pečlivě zaveden, byl odstraněn s tamponem, během pohlavního styku nebo při závažné nebo chronické zácpě. Dlouhotrvající vypuzení může vést ke snížení antikoncepčního účinku a/nebo ke krvácení z průniku. Proto k zajištění účinnosti by žena měla přítomnost přípravku NuvaRing pravidelně kontrolovat.
Je-li přípravek náhodně vypuzen a je mimo pochvu méně než 3 hodiny, antikoncepční účinek není snížen. Žena by měla vypuzený kroužek opláchnout studenou nebo vlažnou vodou (ne horkou) a zavést si ho znovu co nejrychleji, ale nejpozději do 3 hodin.
Pokud přípravek NuvaRing byl, nebo se domníváte, že mohl být, mimo pochvu déle než 3 hodiny, antikoncepční účinek může být snížen. V tomto případě je nutné postupovat, jak je uvedeno v bodě 4.2 „Co dělat, když byl kroužek po nějakou dobu mimo pochvu“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
INTERAKCE S JINÝMI LÉČIVÝMI PŘÍPRAVKY
Interakce mezi hormonálními antikoncepčními přípravky a jinými léčivými přípravky může vést ke krvácení z průniku a/nebo k selhání antikoncepčního účinku. Následující interakce jsou popsány v literatuře.
Jatemí metabolismus: může dojít k interakci s léčivými přípravky, které indukují mikrosomální enzymy, což může mít za důsledek zvýšenou clearance pohlavních hormonů (např. fenytoin, fenobarbital, primidon, karbamazepin, rifampicin, patrně také oxkarbazepin, topiramát, felbamát, ritonavir, griseofulvin a přípravky obsahující třezalku).
Ženy léčené těmito přípravky by měly kromě přípravku NuvaRing dočasně používat navíc i bariérovou metodu nebo zvolit jinou metodu antikoncepce. U přípravků indukujících mikrosomální enzymy by měla bariérová metoda být používána v průběhu současného podávání obou přípravků a ještě 28 dnů po jejich vysazení.
Jestliže současné podávání jiných přípravků pokračuje i po ukončení třítýdenního cyklu přípravku NuvaRing, pak by měl být další kroužek zaveden okamžitě, bez obvyklého týdne bez kroužku.
Bylo hlášeno snížení antikoncepčního účinku při léčbě antibiotiky, jako je penicilin a tetracyklin. Mechanismus účinku nebyl vysvětlen. Ve farmakokinetických interakčních studiích, při perorálním podání amoxicilinu (875 mg dvakrát denně) nebo doxycyklinu (200 mg první den, další dny 100 mg denně) po dobu 10 dní během používání přípravku NuvaRing, nebyla významně ovlivněna farmakokinetika etonogestrelu a EE. Ženy, které jsou léčeny antibiotiky (s výjimkou amoxicilinu a doxycyklinu) by měly používat bariérovou metodu antikoncepce ještě 7 dní po ukončení léčby. Jestliže současné podávání dalších léčivých přípravků pokračuje i po ukončení třítýdenního cyklu přípravku NuvaRing, pak by měl být další kroužek zaveden okamžitě, bez obvyklého týdne bez kroužku.
Na základě farmakokinetických údajů lze říci, že není pravděpodobné, že by vaginálně podaná antimykotika a spermicidní přípravky ovlivnily antikoncepční účinnost a bezpečnost přípravku NuvaRing. Během současného podávání antimykotických globulí je možnost porušení kroužku zvýšena (viz bod 4.4 „Zlomený kroužek“).
Hormonální kontraceptiva mohou zasahovat do metabolismu jiných přípravků. Proto mohou být jejich plazmatické a tkáňové koncentrace zvýšeny (např. cyklosporin) nebo sníženy (např. lamotrigin).
Pacientka by měla lékaři oznámit, které léky současně dostává, aby byly identifikovány potenciální interakce.
LABORATORNÍ TESTY
Užívání antikoncepčních steroidů může ovlivnit výsledky některých laboratorních testů, včetně biochemických parametrů funkcí jater, štítné žlázy, nadledvin a ledvin, plazmatických hladin bílkovinných přenašečů (např. globulinu vázajícího kortikosteroidy a globulinu vázajícího pohlavní hormony), frakcí lipidů/lipoproteinů, parametrů metabolismu sacharidů a parametrů koagulace a fibrinolýzy. Změny zpravidla zůstávají v normálním laboratorním rozmezí.
INTERAKCE S TAMPONY
Farmakokinetické údaje ukazují, že tampony nemají vliv na účinek systémové absorpce hormonů uvolňovaných z přípravku NuvaRing. Vzácně může být přípravek NuvaRing vypuzen při odstraňování tamponu (viz „Co dělat, když byl kroužek po nějakou dobu mimo pochvu“).
4.6 Fertilita, těhotenství a kojení
Fertilita
NuvaRing je indikován k prevenci před otěhotněním. Pokud chce žena přestat používat přípravek NuvaRing, protože chce otěhotnět, je doporučeno, aby počkala, až bude mít své pravidelné menstruační krvácení před pokusem o otěhotnění. To jí pomůže stanovit datum porodu.
V průběhu těhotenství není přípravek NuvaRing indikován. Pokud dojde k těhotenství s přípravkem NuvaRing in situ, pak je třeba kroužek odstranit. Rozsáhlé epidemiologické studie neprokázaly ani zvýšené riziko vzniku vrozených vad u dětí, které se narodily ženám užívajícím před těhotenstvím COC, ani teratogenní vliv, když byly COC neúmyslně používány v časném těhotenství.
Klinická studie u malého počtu žen ukázala, že navzdory intravaginálnímu podání jsou nitroděložní koncentrace kontracepčních steroidů u žen s přípravkem NuvaRing podobné koncentracím u žen užívajících COC (viz bod 5.2). Klinická zkušenost týkající se výsledků těhotenství u žen vystavených vlivu přípravku NuvaRing nebyla zatím hlášena.
Zvýšené riziko VTE během poporodního období je třeba brát v úvahu při znovuzahájení používání přípravku NuvaRing (viz bod 4.2 a 4.4).
Kojení
Kojení může být estrogeny ovlivněno, poněvadž mohou snížit množství a změnit složení mateřského mléka. Proto se obecně nedoporučuje zavést přípravek NuvaRing dříve, než kojící matka úplně odstaví své dítě. Malá množství antikoncepčních steroidů a/nebo jejich metabolitů mohou být vylučována do mateřského mléka, neexistuje však žádný důkaz, že by nepříznivě ovlivnily zdraví dítěte.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vzhledem k jeho farmakodynamickému profilu nemá přípravek NuvaRing žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Nej častějšími nežádoucími účinky uváděnými v klinických studiích s přípravkem NuvaRing byly bolesti hlavy, vaginální infekce a vaginální výtok, které byly hlášeny u 5-6 % žen.
Popis vybraných nežádoucích účinků
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, cévní mozkové příhody, tranzitorních ischemických atak, žilní trombózy a plicní embolie a je podrobněji popsáno v bodě 4.4.
Také další nežádoucí účinky byly hlášeny u uživatelek CHC a jsou podrobněji popsány v bodě 4.4.
Nežádoucí účinky, které byly hlášeny v klinických studiích, observačních studiích nebo po uvedení přípravku NuvaRing na trh, jsou v níže uvedené tabulce. Jsou zde uvedeny nejčastěji uváděné MedDRA termíny popisující závažné nežádoucí účinky.
Všechny nežádoucí účinky jsou uvedeny podle třídy orgánového systému a četnosti; časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000) a není známo (z dostupných údajů nelze určit).
|
Třídy orgánových systémů |
Časté |
Méně časté |
Vzácné |
Není známo1 |
|
Infekce a infestace |
Vaginální infekce |
Cervicitida, cystitida, infekce močového ústrojí | ||
|
Poruchy imunitního systému |
Hypersenzitivita | |||
|
Poruchy metabolismu a výživy |
Zvýšená chuť k jídlu | |||
|
Psychiatrické poruchy |
Deprese, snížení libida |
Afektivní labilita, změny nálad, střídání nálad | ||
|
Poruchy nervového systému |
Bolest hlavy, migréna |
Závratě, hypestezie | ||
|
Poruchy oka |
Porucha vidění | |||
|
Cévní poruchy |
Žilní tromboembolismus Arteriální tromboembolismus | |||
|
Gastrointestinální poruchy |
Bolesti břicha, nauzea | |||
|
Poruchy kůže a podkožní tkáně |
Akné |
Chloasma Kopřivka | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolest zad, svalové spasmy, bolest končetin | |||
|
Poruchy ledvin a močových cest |
Dysurie, nutkavé močení, polakisurie | |||
|
Poruchy reprodukčního systému a prsu |
Napětí prsů, svědění ženských genitálií, dysmenorea, bolest v pánvi, vaginální výtok |
Amenorea, prsní diskomfort, zvětšení prsů, zbytnění prsní žlázy, cervikální polyp, krvácení při pohlavním styku, bolest při pohlavním styku, cervikální ektropium, fibrózně-cystická mastopatie, menoragie, metroragie, pánevní diskomfort, premenstruační syndrom, děložní stah, pocit pálení pochvy, vaginální pach, vaginální bolest, vulvovaginální diskomfort, vulvovaginální suchost |
Galaktorea |
Poruchy penisu |
|
Celkové poruchy a reakce v místě aplikace |
Únava, podrážděnost, malátnost, edém, pocit z cizího tělesa | |||
|
Vyšetření |
Zvýšení tělesné hmotnosti |
Zvýšení krevního tlaku | ||
|
Poranění, otravy a procedurální komplikace |
Nepříjemný pocit ze zavedeného kroužku, vypuzení vaginální kontracepce |
Komplikace kontracepce, zlomení kroužku |
1 Seznam nežádoucích účinků na základě spontánního hlášení.
V souvislosti s užíváním CHC byly hlášeny hormon dependentní nádory (např. nádory jater, rakovina prsu). Pro další informace viz bod 4.4.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: http: //www .sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Nebyl zjištěn žádný závažný škodlivý vliv v případě předávkování hormonálními kontraceptivy. Symptomy, ke kterým může v tomto případě dojít, zahrnují nauzeu, zvracení, a u mladých dívek lehké vaginální krvácení. Neexistují žádná antidota a léčba by měla být symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiná gynekologika, kontraceptiva intravaginální, vaginální kroužek s gestagenem a estrogenem, ATC kód: G02BB01
Mechanismus účinku
NuvaRing obsahuje etonogestrel a ethinylestradiol. Etonogestrel je gestagen odvozený od 19-nortestosteronu, který se váže vysokou afinitou na receptory progesteronu v cílových orgánech. Ethinylestradiol je estrogen hojně používaný v antikoncepčních přípravcích. Antikoncepční působení přípravku NuvaRing je založeno na různých mechanismech, z nichž nejdůležitější je zábrana ovulace.
Klinická účinnost a bezpečnost
Klinické studie byly prováděny po celém světě (USA, EU a Brazílie) u žen ve věku mezi 18 a 40 roky. Kontracepční účinnost se jeví přinejmenším srovnatelná se známou účinností kombinovaných perorálních kontraceptiv. Následující tabulky ukazují Pearl index (počet těhotenství na 100 žen během jednoho roku užívání) plynoucí z klinických studií s přípravkem NuvaRing.
|
Analytické metody |
Pearl index |
95 % Cl |
Počet cyklů |
|
ITT (chyba uživatelky + chyba metody) |
0,96 |
0,64-1,39 |
37,977 |
|
PP (chyba metody) |
0,64 |
0,35-1,07 |
28,723 |
V případě používání vysokodávkových COC (0,05 mg ethinylestradiolu) je sníženo riziko karcinomu vaječníku a karcinomu endometria. Není zatím zcela jasné, zda se tato skutečnost vztahuje i na nízkodávková kontraceptiva, jako je NuvaRing.
KRVÁCENÍ
Velká srovnávací studie s perorální antikoncepcí 150/30 pg levonorgestrel/ethinylestradiol (n=512 vs. n=518) hodnotící charakter vaginálního krvácení během 13 cyklů vykazuje nízký výskyt špinění nebo krvácení z průniku u přípravku NuvaRing (2,0-6,4 %). Mimo to bylo vaginální krvácení u většiny osob omezeno výhradně na interval bez kroužku (58,8 - 72,8 %).
ÚČINEK NA KOSTNÍ MINERÁLNÍ DENZITU
Účinek přípravku NuvaRing (n=76) na kostní minerální denzitu (BMD) byl studován ve srovnání s nehormonálním intrauterinním tělískem (IUD) u žen (n=31) po dobu 2 let. Nebyly pozorovány žádné nežádoucí účinky na kostní minerální denzitu.
Pediatrická populace
Bezpečnost a účinnost přípravku NuvaRing u dospívajících ve věku do 18 let nebyla studována.
5.2 Farmakokinetické vlastnosti Etonogestrel
Absorpce
Etonogestrel uvolněný z přípravku NuvaRing je rychle vstřebáván poševní sliznicí. Maximální koncentrace etonogestrelu v séru, která je přibližně 1 700 pg/ml, je dosažena asi za týden po zavedení kroužku. Sérové koncentrace vykazují malé výkyvy a pozvolna klesají, až dosahují přibližně hodnoty 1 600 pg/ml po 1 týdnu užívání, hodnoty 1 500 pg/ml po 2 týdnech a hodnoty 1 400 pg/ml po 3 týdnech používání. Absolutní biologická dostupnost je přibližně 100 %, což je více, než při perorálním podání. Cervikální a intrauterinní hladina etonogestrelu byla měřena pouze u mála žen, které používaly přípravek NuvaRing nebo perorální antikoncepci obsahující 0,150 mg desogestrelu a 0,020 mg ethinylestradiolu. Zjištěné hladiny byly porovnatelné.
Distribuce
Etonogestrel je vázán na sérový albumin a na globulin vázající pohlavní hormony (SHBG). Zdánlivý objem distribuce etonogestrelu je 2,3 l/kg.
Biotransformace
Etonogestrel je metabolizován obvyklými cestami metabolismu steroidů. Zdánlivá clearance séra je asi 3,5 l/h. Nebyla zjištěna žádná interakce se současně podávaným ethinylestradiolem.
Eliminace
Hladiny etonogestrelu v séru se snižují ve dvou fázích. Terminální vylučovací fáze je charakterizována poločasem odpovídajícím přibližně 29 hodinám. Etonogestrel a jeho metabolity jsou vylučovány močí a žlučí v poměru asi 1,7:1. Poločas vylučování metabolitů je asi 6 dnů.
Ethinylestradiol
Absorpce
Ethinylestradiol uvolňovaný z přípravku NuvaRing je rychle vstřebáván poševní sliznicí. Maximální sérové koncentrace asi 35 pg/ml je dosahováno za 3 dny po zavedení a dochází k poklesu na hodnotu 19 pg/ml po 1 týdnu, na hodnotu 18 pg/ml po 2 týdnech a na hodnotu 18 pg/ml po 3 týdnech používání. Měsíční systémová expozice ethinylestradiolu (AUC0-m) činí u přípravku NuvaRing
10,9 ng.h/ml. Absolutní biologická dostupnost je asi 56 %, což je srovnatelné s perorálním podáním ethinylestradiolu. Cervikální a intrauterinní hladiny ethinylestradiolu byly měřeny pouze u malého počtu žen, které používaly přípravek NuvaRing nebo perorální antikoncepci obsahující 0,150 mg desogestrelu a 0,020 mg ethinylestradiolu. Zjištěné hladiny byly srovnatelné.
Distribuce
Ethinylestradiol je vysoce, avšak nespecificky, vázán na sérový albumin. Zdánlivý objem distribuce byl stanoven na asi 15 l/kg.
Biotransformace
Ethinylestradiol je primárně metabolizován aromatickou hydroxylací, ale vytváří se mnoho druhů hydroxylovaných a methylovaných metabolitů. Ty jsou přítomny jako volné metabolity a jako konjugáty sulfátu a glukuronidů. Zdánlivá clearance je asi 35 l/h.
Eliminace
Sérové hladiny ethinylestradiolu klesají ve dvou fázích. Terminální fáze eliminace je charakterizována velkými individuálními variacemi poločasu, které mají za následek medián poločasu asi 34 hodin. Nezměněný ethinylestradiol není vylučován; metabolity ethinylestradiolu jsou vylučovány močí a žlučí v poměru 1,3:1. Poločas vylučování metabolitu je asi 1,5 dne.
Zvláštní populace
Pediatrická populace
Farmakokinetika přípravku NuvaRing u zdravých dospívajících žen ve věku do 18 let, které menstruují (postmenarche), nebyla studována.
Porucha funkce ledvin
Nebyly provedeny žádné studie, které by hodnotily účinek poruchy funkce ledvin na farmakokinetiku přípravku NuvaRing.
Porucha funkce jater
Nebyly provedeny žádné studie, které by hodnotily účinek poruchy funkce jater na farmakokinetiku přípravku NuvaRing. Nicméně steroidní hormony mohou být špatně metabolizovány u žen s poruchou funkce jater.
Etnické skupiny
Nebyly provedeny žádné formální studie, které by hodnotily farmakokinetiku u etnických skupin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení karcinogenního potenciálu a reprodukční toxicity ethinylestradiolu a etonogestrelu neodhalily žádná zvláštní rizika pro člověka než ta, která jsou již známa.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
kopolymer ethylenu s vinyl-acetátem, 28 % vinyl-acetátu kopolymer ethylenu s vinyl-acetátem, 9 % vinyl-acetátu magnesium-stearát
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
40 měsíců
6.4 Zvláštní opatření pro uchovávání
Před výdejem:
3 roky, uchovávejte v chladničce při teplotě 2 °C - 8 °C.
V době výdeje:
Vydávající napíše na krabičku datum jejího výdeje. Kroužek by měl být zaveden ne později než čtyři měsíce po datu výdeje a vždy před datem expirace. Vždy je nutné řídit se dřívějším datem.
Po výdeji:
4 měsíce, uchovávejte při teplotě do 30°C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
6.5 Druh obalu a obsah balení
Sáček obsahující jeden NuvaRing. Sáček je vyrobený z aluminiové fólie s vnitřní vrstvou nízkomolekulárního polyethylenu a zevní vrstvou polyethylenetereftalátu (PET). Je vodotěsný a lze jej opakovaně uzavřít. Sáček je zabalen v potištěné papírové krabičce spolu s příbalovou informací v českém jazyce. Každé balení obsahuje 1 nebo 3 kroužky.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Viz bod 4.2. Vydávající má na krabičce označit datum výdeje a datum, před kterým je třeba přípravek NuvaRing použít. U balení se 3 kroužky se doporučuje vyznačit datum jak na krabičku, tak také na sáčky. Přípravek NuvaRing by měl být zaveden ne později než čtyři měsíce po datu výdeje a vždy před datem expirace. Vždy je nutné řídit se dřívějším datem. Po vyjmutí z pochvy by měl být přípravek NuvaRing uložen do sáčku, který lze znovu uzavřít a měl by být zlikvidován spolu s normálním domácím odpadem tak, aby nedošlo k náhodnému kontaktu s jinými osobami. Přípravek NuvaRing by neměl být spláchnut do toalety. Jakýkoliv nepoužitý (proexpirovaný) kroužek musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
N.V. Organon Kloosterstraat 6 5349 AB Oss Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
17/408/07-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
4.7.2007 / 4.4.2012
10. DATUM REVIZE TEXTU 26.2.2016
21