Numient 195 Mg/48,75 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Numient 95 mg/23,75 mg tvrdé tobolky s řízeným uvolňováním Numient 145 mg/36,25 mg tvrdé tobolky s řízeným uvolňováním Numient 195 mg/48,75 mg tvrdé tobolky s řízeným uvolňováním Numient 245 mg/61,25 mg tvrdé tobolky s řízeným uvolňováním
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
95 mg/23,75 mg, tvrdé tobolky s řízeným uvolňováním
Jedna tobolka obsahuje levodopum 95 mg a carbidopum 23,75 mg (jako carbidopum monohydricum) 145 mg/36,25 mg, tvrdé tobolky s řízeným uvolňováním
Jedna tobolka obsahuje levodopum 145 mg a carbidopum 36,25 mg (jako carbidopum monohydricum) 195 mg/48,75 mg, tvrdé tobolky s řízeným uvolňováním
Jedna tobolka obsahuje levodopum 195 mg a carbidopum 48,75 mg (jako carbidopum monohydricum) 245 mg/61,25 mg, tvrdé tobolky s řízeným uvolňováním
Jedna tobolka obsahuje levodopum 245 mg a carbidopum 61,25 mg (jako carbidopum monohydricum) Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka s řízeným uvolňováním
95 mg/23,75 mg, tvrdá tobolka s řízeným uvolňováním
Bílé tělo a modré víčko o velikosti 18 x 6 mm s potiskem modrým inkoustem „IPX066“ a „95“
145 mg/36,25 mg, tvrdá tobolka s řízeným uvolňováním
Světle modré tělo a modré víčko o velikosti 19 x 7 mm s potiskem modrým inkoustem „IPX066“ a „145“.
195 mg/48,75 mg, tvrdá tobolka s řízeným uvolňováním
Žluté tělo a modré víčko o velikosti 24 x 8 mm s potiskem modrým inkoustem „IPX066“ a „195“. 245 mg/61,25 mg, tvrdá tobolka s řízeným uvolňováním
Modré tělo a modré víčko o velikosti 23 x 9 mm s potiskem modrým inkoustem „IPX066“ a „245“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba dospělých pacientů s Parkinsonovou nemocí.
4.2 Dávkování a způsob podání
Dávkování
Numient se doporučuje podávat perorálně, přibližně každých 6 hodin. Podávání tohoto léčivého přípravku více než 5krát za den se nedoporučuje.
Každá síla tobolky může být použita samostatně nebo dle potřeby v kombinaci s tobolkami jiné síly. Použití tohoto léčivého přípravku s jinými léčivými přípravky obsahujícími levodopu doposud nebylo hodnoceno.
Doporučené dávkování má být dodrženo na počátku léčby a upraveno podle klinické odpovědi.
Počáteční dávka a titrace u pacientů, kteří doposud nebyli léčeni levodopou
Počáteční dávka je jedna tobolka obsahující 95 mg levodopy a 23,75 mg karbidopy třikrát denně (3xd) po dobu prvních tří dnů; tuto dávku lze zvýšit na jednu tvrdou tobolku s řízeným uvolňováním obsahující 145 mg levodopy a 36,25 mg karbidopy třikrát denně od 4. dne léčby.
Další zvyšování má být řešeno individuálně podle klinické odpovědi. Denní dávka přípravku musí být stanovena pečlivou titrací. Pacienti mají být udržováni na co nejnižší dávce potřebné k dosažení kontroly příznaků, aby se minimalizovaly nežádoucí účinky jako dyskineze a nauzea.
S podáváním celkové denní dávky vyšší než 1 170 mg levodopy u pacientů, kteří doposud nebyli levodopou léčeni, existují jen omezené zkušenosti.
Převedení pacientů z jiných léčivých přípravků obsahujících levodopu/inhibitor dopa-dekarboxylázy (DDC) (karbidopa nebo benserazid) s okamžitým uvolňováním na přípravek Numient
Vzhledem k farmakokinetickým vlastnostem přípravku Numient nejsou dávky a četnost dávkování přípravku Numient vzájemně zaměnitelné s dávkami a četností dávkování jiných léčivých přípravků obsahujících levodopu/inhibitor DDC s okamžitým uvolňováním (viz bod 5.2).
Při počátečním převedení pacientů z léčivého přípravku s okamžitým uvolňováním levodopy/inhibitoru DDC na přípravek Numient se doporučuje použít pro počáteční dávkování pokyny pro převod dávek uvedené v tabulce 1.
Tabulka 1: Pokyny pro počáteční převod z léčivých přípravků s okamžitým uvolňováním (IR) levodopy/inhibitoru DDC na přípravek Numient u pacientů s Parkinsonovou nemocí.
|
Celková denní dávka levodopy v přípravcích s okamžitým uvolňováním levodopy/inhibitoru DDC (mg) |
Počáteční celková denní dávka přípravku Numient (levodopa v mg) |
Navrhovaná počáteční dávka přípravku Numient |
|
400 až 549 |
855 |
3 tvrdé tobolky 95 mg/23,75 mg 3xd |
|
550 až 749 |
1 140 |
4 tvrdé tobolky 95 mg/23,75 mg 3xd |
|
750 až 949 |
1 305 |
3 tvrdé tobolky 145 mg/36,25 mg 3xd |
|
950 až 1 249 |
1 755 |
3 tvrdé tobolky 195 mg/48,75 mg 3xd |
|
> 1 250 |
2 340 |
4 tvrdé tobolky 195 mg/48,75 mg 3xd nebo |
|
2 205 |
3 tvrdé tobolky 245 mg/61,25 mg 3xd |
Při počátečním převedení pacientů z kombinace levodopy/inhibitoru DDC s okamžitým uvolňováním plus inhibitoru katechol-o-metyltransferázy (COMT) (např. entakaponu) na přípravek Numient se doporučuje použít pro počáteční dávkování pokynů pro převod dávek uvedený v tabulce 2.
Tabulka 2: Pokyny pro počáteční převedení pacientů z kombinace levodopy/inhibitoru DDC s okamžitým uvolňováním plus inhibitoru katechol-o-metyltransferázy (COMT) (např. entakaponu) na přípravek Numient u pacientů s Parkinsonovou nemocí
|
Celková denní dávka levodopy (mg) v přípravcích obsahujících kombinaci levodopy/inhibitoru DDC/entakaponu |
Počáteční celková denní dávka přípravku Numient (levodopa v mg) |
Navrhovaná počáteční dávka přípravku Numient |
|
400 až 549 |
1 140 |
4 tvrdé tobolky 95 mg/23,75 mg 3xd |
|
550 až 749 |
1 470 |
2 tvrdé tobolk 245 mg/61,25 mg 3xd |
|
750 až 949 |
1 755 |
3 tvrdé tobolky 195 mg/48,75 mg 3xd |
|
950 až 1 249 |
2 205 |
3 tvrdé tobolky 245 mg/61,25 mg 3xd |
|
> 1 250 |
2 940 |
4 tvrdé tobolky 245 mg/61,25 mg 3xd |
Při převádění pacientů z léčivých přípravků s levodopou/inhibitorem DDC na přípravek Numient má být dávka upravena k udržení dostatečné kontroly příznaků. Četnost dávkování je možné změnit ze tří dávek za den na maximálně pětkrát za den, pokud není pozorována dostatečná kontrola příznaků. Ze studií u pacientů s pokročilou Parkinsonovou nemocí existují omezené údaje o používání dávek překračujících 2 450 mg levodopy a 612,5 mg karbidopy podávaných ve formě přípravku Numient.
Konečná celková denní dávka levodopy z přípravku Numient se rovná asi dvojnásobku konečné celkové denní dávky levodopy z tablet s okamžitým uvolňováním, zatímco konečná celková denní dávka levodopy z přípravku Numient je asi trojnásobek konečné celkové dávky levodopy z kombinovaných přípravků levodopy/inhibitoru DDC/entakaponu.
Převedení pacientů specificky z jiných léčivých přípravků s řízeným uvolňováním levodopy /inhibitoru DDC na přípravek Numient
Pro pacienty v současnosti léčené léčivými přípravky s řízeným uvolňováním levodopy/inhibitoru DDC existují omezené informace týkající se přechodu na přípravek Numient. Počáteční celkovou denní dávku přípravku Numient uvedenou v tabulce 1 výše možná bude potřeba snížit přibližně o 30 % pro pacienty přecházející specificky z léčivých přípravků s řízeným uvolňováním levodopy/inhibitoru DDC na přípravek Numient.
Udržovací léčba
Jelikož je Parkinsonova nemoc progresivním onemocněním, doporučuje se provádět periodická klinická vyhodnocení. Léčba má být individuálně upravena pro každého pacienta podle požadované léčebné odpovědi.
Přidání dalších léčivých přípravků k léčbě Parkinsonovy nemoci
Levodopu/karbidopu s řízeným uvolňováním lze používat dohromady s dalšími léčivými přípravky k léčbě Parkinsonovy nemoci. Může však být potřebné upravit dávky (viz bod 4.5).
Přerušení léčby
Sporadické případy komplexu příznaků připomínajícího neuroleptický maligní syndrom (NMS) byly spojovány se snížením dávky a vysazením léčivých přípravků obsahujících levodopu/karbidopu. Pacienti mají být pečlivě sledováni, pokud se vyžaduje náhlé snížení nebo přerušení užívání tobolek léčivého přípravku s řízeným uvolňováním levodopy/karbidopy, zejména pokud pacient užívá antipsychotika (viz bod 4.4).
Pokud je nutná celková anestezie, tobolky léčivého přípravku s řízeným uvolňováním levodopy/karbidopy mohou být užívány, dokud je pacientovi povoleno užívat perorální léčivé přípravky. Pokud je léčba dočasně přerušena, obvyklá dávka má být podána, jakmile je pacient schopen užít perorální léčivé přípravky.
Starší pacienti
U starších pacientů se nevyžaduje žádná úprava dávky léčivého přípravku s řízeným uvolňováním levodopy/karbidopy.
Porucha funkce ledvin
Vliv funkce ledvin na clearance levodopy/karbidopy je omezený (viz bod 5.2). Přípravek Numient nebyl hodnocen u pacientů s poruchou funkce ledvin. Doporučuje se podávat tento léčivý přípravek s opatrností u pacientů s těžkou poruchou funkce ledvin (viz bod 4.4).
Porucha funkce jater
Přípravek Numient nebyl hodnocen u pacientů s poruchou funkce jater. Doporučuje se podávat tento léčivý přípravek s opatrností u pacientů s těžkou poruchou funkce jater (viz bod 4.4).
Pediatrická populace
Bezpečnost a účinnost přípravku Numient u dětí ve věku do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Přípravek Numient se má zapít sklenicí vody a může se užívat s jídlem nebo bez jídla. Velmi kalorická jídla s vysokým obsahem tuku zpožďují vstřebávání levodopy o dvě hodiny. Navíc jídla s vysokým obsahem bílkovin mohou zhoršit klinickou odpověď snížením vstřebávání levodopy (viz bod 4.5). Přípravek Numient se proto nemá užívat ve stejnou dobu s jídly s vysokým obsahem bílkovin. Tvrdá tobolka s řízeným uvolňováním se má polykat vcelku a nesmí se žvýkat ani drtit, aby byl zachován účinek řízeného uvolňování levodopy/karbidopy. Alternativně u pacientů, kteří mají potíže s polykáním tobolky, lze tento léčivý přípravek podat opatrným otevřením tobolky a vysypáním celého obsahu na malé množství (např. 2 polévkové lžíce) měkké potravy, například jablečného pyré, jogurtu nebo pudinku. Směs léčivého přípravku/potraviny má být zcela a ihned spolknuta bez žvýkání a nesmí se uchovávat pro další použití. Nelze vyloučit, že ohříváním může dojít ke změně vlastností léčivého přípravku. Léčivý přípravek nesmí být ohříván ani přidáván do horkých potravin.
Přípravky obsahující síran železnatý mají být podávány odděleně od levodopy/karbidopy s co nejdelší časovou prodlevou mezi podáním (viz bod 4.5).
4.3 Kontraindikace
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
- Glaukom s uzavřeným úhlem.
- Feochromocytom.
- Souběžné podávání neselektivních inhibitorů monoaminooxidázy (MAO). Tyto inhibitory musí být vysazeny nejméně dva týdny před zahájením léčby (viz bod 4.5).
- Neuroleptický maligní syndrom (NMS) a/nebo netraumatická rhabdomyolýza v anamnéze.
4.4 Zvláštní upozornění a opatření pro použití
Účinky na CNS a duševní poruchy
Somnolence a případy náhlého usnutí
Levodopa je spojována se somnolencí a případy náhlého usnutí (viz bod 4.7). Velmi vzácně bylo hlášeno náhlé usnutí během denních činností, v některých případech bez uvědomění si tohoto stavu nebo bez varovných signálů. Pacienti musí o této skutečnosti být informováni a musí jim být doporučena opatrnost v případě řízení nebo obsluhy strojů během léčby (viz bod 4.7). Pacienti, u nichž docházelo k somnolenci a/nebo případům náhlého usnutí, nesmí řídit nebo obsluhovat stroje. Dále je možné zvážit snížení dávky nebo ukončení léčby.
Neuroleptický maligní syndrom (NMS)
Sporadické případy komplexu příznaků připomínajícího NMS byly hlášeny v souvislosti se snížením dávky a vysazením léčivých přípravků obsahujících levodopu/karbidopu. NMS je život ohrožující syndrom charakterizovaný horečkou nebo hypertermií a může být spojován s rhabdomyolýzou. Byly hlášeny neurologické nálezy, včetně svalové rigidity, mimovolních pohybů, změněného vědomí, změn duševního stavu; jiné poruchy, například autonomní dysfunkce, tachykardie, tachypnoe, pocení, hyper-nebo hypotenze; laboratorní nálezy, například zvýšená hladina kreatinfosfokinázy, leukocytóza, myoglobinurie a zvýšená hladina sérového myoglobinu. Pacienti proto musí být pečlivě sledováni, pokud dojde k náhlému omezení nebo přerušení dávek levodopy/karbidopy, zejména pokud pacient dostává antipsychotika (viz bod 4.2).
Duševní poruchy
Pacienti mohou zaznamenat nový nebo zhoršený duševní stav a změny chování, které mohou být závažné, včetně psychotického a sebevražedného chování během léčby levodopou nebo po zahájení či zvýšení dávek levodopy. Takové abnormální způsoby myšlení a chování mohou zahrnovat jeden nebo několik z řady projevů, včetně úzkosti, deprese, paranoidních představ, iluzí, halucinací, zmatenosti, psychotického chování, dezorientace, agresivního chování, agitovanosti a deliria.
Pacienti, kteří mají těžkou psychotickou poruchu nebo psychotickou poruchou v anamnéze, musí být levodopou/karbidopou léčeni s opatrností, protože je zde riziko zhoršení psychózy. Navíc některé léčivé přípravky používané k léčbě psychózy mohou zhoršit příznaky Parkinsonovy nemoci a mohou snížit účinnost levodopy/karbidopy. Souběžné užívání antipsychotik má být pečlivě sledováno, zda nedošlo ke zhoršení motorických příznaků Parkinsonovy nemoci, zejména pokud se používají antagonisté D2 receptorů (viz bod 4.5).
Impulzivní poruchy (Impulse control disorder, ICD)
Pacienti by měli být pravidelně monitorováni z důvodu možnosti rozvoje impulzivních poruch.
Pacienti a jejich ošetřovatelé by měli být upozorněni, že u pacientů léčených agonisty dopaminu a/nebo jinými dopaminergními přípravky obsahujícími levodopu se mohou rozvinout symptomy impulzivních poruch včetně patologického hráčství, zvýšeného libida, hypersexuality, nutkavého
utrácení nebo nakupování, záchvatovitého a nutkavého přejídání a dopaminového dysregulačního syndromu. Pokud se tyto příznaky objeví, doporučuje se léčbu přehodnotit.
Dyskineze
Léčivé přípravky obsahující levodopu způsobují dyskineze, které mohou vyžadovat úpravu léčby. Karbidopa umožňuje, aby se do mozku dostalo více levodopy a tvořilo se více dopaminu, což zvyšuje riziko některých nežádoucích účinků postihujících CNS včetně dyskineze. Doporučuje se sledovat pacienty, zda u nich nedošlo k nástupu nebo vývoji dyskineze, a případně odpovídajícím způsobem upravit dávky levodopy/karbidopy.
Ortostatická hypotenze
Levodopa/karbidopa může způsobit ortostatickou hypotenzi. Kombinace Levodopy/karbidopy se má používat s opatrností v případě souběžného užívání léčivých přípravků, které mohou způsobit ortostatickou hypotenzi, např. antihypertenziva.
Glaukom
Pacienti s chronickým glaukomem s otevřeným úhlem mohou být při zachování opatrnosti léčeni levodopou/karbidopou, pokud je nitrooční tlak dobře kontrolován a je pečlivě sledováno, zda u pacienta nedochází ke změnám nitroočního tlaku během léčby.
Melanom
Epidemiologické studie ukázaly, že u pacientů s Parkinsonovou nemocí je vyšší riziko (2- až přibližně 6krát vyšší) výskytu melanomu než u běžné populace. Není zřejmé, zda pozorované zvýšené riziko bylo způsobeno Parkinsonovou nemocí nebo jinými faktory, například léčivými přípravky použitými k léčbě Parkinsonovy nemoci.
Z výše uvedených důvodů se doporučuje pacientům a předepisujícím lékařům, aby často a pravidelně kontrolovali výskyt melanomu při používání levodopy/karbidopy, zejména u pacientů s podezřelými, nediagnostikovanými kožními lézemi nebo výskytem melanomu v anamnéze. Doporučuje se provádět periodické vyšetření kůže řádně kvalifikovanými osobami (např. dermatology).
Laboratorní vyšetření
Při dlouhodbé léčbě levodopou/karbidopou byly pozorovány snížené hladiny hemoglobinu a hematokritu. Periodické hodnocení jaterních, hematopoetických, kardiovaskulárních a renálních funkcí se doporučuje v průběhu dlouhodobější léčby.
Přípravky s obsahem levodopy/karbidopy mohou způsobit falešně pozitivní výsledky vyšetření na přítomnost ketolátek, pokud se použije testovací proužek pro zjištění ketonurie. Tato reakce se nezmění při zahřátí vzorku moči. Falešně negativní výsledky mohou být získány po použití metody s glukózoxidázou pro glykosurii.
Zvláštní populace
Levodopa/karbidopa se má podávat s opatrností u pacientů s ischemickou chorobou srdeční, závažným kardiovaskulárním nebo plicním onemocněním, astma bronchiale, poruchou renálních, jaterních nebo endokrinních funkcí, nebo žaludečními vředy v anamnéze (kvůli možnosti krvácení do horního gastrointestinálního traktu) a konvulzemi v anamnéze.
Při podávání levodopy/karbidopy pacientům s infarktem myokardu v anamnéze s reziduální atriální, nodální nebo ventrikulární arytmií je nutná opatrnost. U takových pacientů mají být sledovány srdeční funkce zejména pečlivě během období počátečních úprav dávek.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Inhibitory monoaminooxidázy
Neselektivní inhibitory monoaminooxidázy musí být vysazeny nejméně 2 týdny před zahájením léčby tobolkami léčivého přípravku s řízeným uvolňováním levodopy/karbidopy (viz bod 4.3).
Přípravek Numient může být užíván souběžně s doporučenou dávkou inhibitoru MAO, který je selektivní pro inhibitor MAO typ B jako selegilin a rasagilin. Existuje známá léková interakce levodopy s inhibitory MAO typ B, která zesiluje účinky levodopy. Tato kombinace může být spojována se závažnou ortostatickou hypotenzí.
Při přidání inhibitoru MAO, který je selektivní pro typ B, bude možná nutné dávku levodopy snížit. Pacienti mají být udržováni na co nejnižší dávce potřebné k dosažení kontroly příznaků, aby se minimalizovaly nežádoucí účinky.
Antagonisté dopaminových D2 receptorů, benzodiazepiny a isoniazid
Antagonisté dopaminových D2 receptorů (např. fenothiaziny, butyrofenony, risperidon), benzodiazepiny a isoniazid mohou snížit léčebné účinky levodopy. Pacienti užívající tyto léčivé přípravky společně s levodopou/karbidopou mají být pečlivě sledováni s ohledem na ztrátu léčebné odpovědi.
Tricyklická antidepresiva
Vzácně byly hlášeny nežádoucí účinky, včetně hypertenze a dyskineze, plynoucí ze souběžného užívání tricyklických antidepresiv a levodopy/karbidopy.
Antihypertenziva
Symptomatická posturální hypotenze se objevovala, když byla přidána kombinace levodopy a inhibitoru dekarboxylázy k léčbě pacientů, kteří již užívali určitá antihypertenziva. Úprava dávek antihypertenziv může být potřebná během titrační fáze léčby tímto léčivým přípravkem s řízeným uvolňováním levodopy/karbidopy.
Anticholinergika
Anticholinergika mohou účinkovat synergicky s levodopou ke zlepšení třesu. Souběžné užívání však může způsobit zhoršení poruchy s mimovolními pohyby. Anticholinergika mohou zhoršit účinek levodopy kvůli opožděné absorpci. Může být potřeba upravit dávkování levodopy.
Fenytoin a papaverin
Vzácně bylo hlášeno, že prospěšné účinky levodopy u Parkinsonovy nemoci byly zvráceny fenytoinem a papaverinem. Pacienti užívající tyto léčivé přípravky s levodopou/karbidopou mají být pečlivě sledováni s ohledem na ztrátu léčebné odpovědi.
Inhibitory COMT
Účinek společného podávání těchto tobolek s řízeným uvolňováním levodopy/karbidopy a inhibitorů COMT jako entakapon doposud nebyl studován. Bylo prokázáno, že přidání entakaponu k levodopě/karbidopě zvýšilo biologickou dostupnost levodopy o 30 %. Může být potřeba snížit dávku tobolek léčivého přípravku s řízeným uvolňováním levodopy/karbidopy při souběžném užívání inhibitorů COMT.
Soli železa
Levodopa/karbidopa a soli železa nebo multivitaminy obsahující soli železa mají být společně podávány s opatrností. Soli železa mohou s levodopou a karbidopou tvořit cheláty. Přípravky obsahující síran železnatý a levodopu/karbidopu mají být podávány odděleně, s co nejdelší časovou prodlevou mezi jejich podáním (viz bod 4.2).
Interakce s alkoholem
Společné podání přípravku Numient in vivo s až 40% alkoholem (v/v) nevedlo k okamžitému uvolnění dávky (tzv. „dose-dumping“) levodopy nebo karbidopy.
Interakce s jídlem:
U zdravých dospělých osob po perorálním podání přípravku Numient po tučném, velmi kalorickém jídle došlo ke snížení Cmax levodopy o 21 %, zatímco celkový rozsah absorpce levodopy (AUCinf) byl podobný (13% zvýšení), jaký byl pozorován u stavu nalačno (viz bod 5.2). Podání s velmi tučným a velmi kalorickým jídlem zpožďuje absorpci levodopy až o 2 hodiny (viz bod 4.2).
Po podání obsahu tablety s řízeným uvolňováním vysypaného na malé množství (např. 2 polévkové lžíce) měkké potravy, jako je jablečné pyré, jogurt nebo pudink, byly rychlost a rozsah absorpce levodopy podobné hodnotám, jaké byly pozorovány u stavu nalačno.
Levodopa si v transportu konkuruje s určitými aminokyselinami, proto jídla s vysokým obsahem proteinů mohou zhoršit absorpci levodopy.
Účinek levodopy a karbidopy na metabolismus jiných léčivých přípravků Inhibiční nebo indukční účinky levodopy a karbidopy doposud nebyly zkoumat.
4.6 Fertilita, těhotenství a kojení Těhotenství
Z použití levodopy/karbidopy u těhotných žen neexistuje žádné nebo jen omezené množství údajů. Studie na zvířatech prokázaly reprodukční toxicitu. (viz bod 5.3). Přípravek Numient se nedoporučuje během těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci, pokud přínosy pro matku nepřevyšují případná rizika pro plod.
Kojení
Karbidopa se u potkanů vylučuje do mateřského mléka, ale není známo, zda se karbidopa nebo její metabolity vylučují do lidského mateřského mléka. Ve studii u jedné kojící matky s Parkinsonovou nemocí bylo hlášeno vylučování levodopy do lidského mateřského mléka. Neexistují dostatečné informace o účincích levodopy/karbidopy nebo jejich metabolitů u novorozenců/kojenců. Kojení by má být během léčby přípravkem Numient přerušeno.
Fertilita
Nejsou dostupné žádné údaje o účincích levodopy nebo karbidopy na lidskou fertilitu. Účinky levodopy na fertilitu byly hodnoceny ve studiích u myší (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Levodopa může mít výrazný vliv na schopnost řídit nebo obsluhovat stroje. Určité nežádoucí účinky, jako je ospalost a závratě, které byly hlášeny s těmito tobolkami léčivého přípravku s řízeným uvolňováním levodopy/karbidopy, mohou ovlivnit schopnost pacientů řídit nebo obsluhovat stroje.
Pacienti léčení těmito tobolkami léčivého přípravku s řízeným uvolňováním levodopy/karbidopy, u nichž se projevuje somnolence a/nebo případy náhlého usnutí, musí být informováni, aby se vyhýbali řízení nebo činnostem, které by je nebo ostatní mohly vystavit riziku závažného zranění nebo úmrtí (např. obsluhování strojů), dokud takové opakující se epizody a somnolence nevymizí (viz také bod 4.4).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Mezi nejčastějšími hlášenými nežádoucími účinky přípravku Numient byla nauzea, která se vyskytla přibližně u 12 % všech pacientů, závrať, bolest hlavy a dyskineze, které se vyskytly přibližně u 8 % všech pacientů, a insomnie, která se vyskytla přibližně u 6 % všech pacientů. Závažné případy gastrointestinálního krvácení (méně časté) a alergického edému (méně časté) byly hlášeny v klinických studiích s přípravkem Numient. Komplex příznaků připomínající neuroleptický maligní syndrom a rhabdomyolýzu se může objevit u léčivých přípravků obsahujících levodopu/karbidopu, ačkoliv v klinických studiích s přípravkem Numient nebyly žádné takové případy zjištěny.
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky jsou uvedeny níže podle tříd orgánových systémů (SOC) a frekvence (tabulka 3). Frekvence jsou definované jako: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1 000), velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Nežádoucí účinky pozorované při klinickém vývoji přípravku Numient | ||||
|
Třída orgánových systému |
Velmi časté |
Časté |
Méně časté |
Není známoa) |
|
Novotvary benigní, maligní a blíže neurčené (zahrnující cysty a polypy) |
Melanom (viz bod 4.4) | |||
|
Poruchy krve a lymfatického systému |
Agranulocytóza, trombocytopenie, leukopenie | |||
|
Poruchy metabolismu a výživy |
Úbytek tělesné hmotnosti |
Snížená chuť k jídlu, zvýšení tělesné hmotnosti | ||
|
Psychiatrické poruchy |
Kognitivní porucha, stav zmatenosti, halucinace, deprese (viz bod 4.5), úzkost, abnormální sny, insomnie |
Psychotické epizody, impulzivní porucha (viz bod 4.4), agitovanost |
Sebevražedné pokusy (viz bod 4.4), dezorientace, dopaminergní dysregulační syndrom, euforie, zvýšené libido | |
|
Poruchy nervového systému |
Dystonie, fenomén „on-off", dyskineze, somnolence, poruchy chůze, závratě, zhoršení Parkinsonovy nemoci, parestézie, bolest hlavy, tremor |
Epileptické křeče, náhlé usnutí (viz bod 4.4), trismus, syndrom neklidných nohou |
Neuroleptický maligní syndrom (viz body 4.3 a 4.4), ataxie | |
|
Poruchy oka |
Rozmazané vidění, diplopie, mydriáza |
Okulogyrické krize, aktivace latentního Hornerova syndromu, blefarospasmus | ||
|
Srdeční poruchy |
Poruchy srdečního rytmub) (viz bod 4.4) |
Palpitace | ||
|
Cévní poruchy |
Ortostatická hypotenze (viz bod 4.4 a 4.9), hypertenze (viz bod 4.5) |
Synkopa, tromboflebitida | ||
|
Respirační, hrudní a mediastinální poruchy |
Abnormální vzorce dýchání, chrapot | |||
|
Gastrointestinální |
Bolest břicha, zácpa, průjem, sucho |
Gastrointe stinální krvácení, peptický |
Tmavé sliny, bruxismus, | |
|
Nežádoucí účinky pozorované při klinickém vývoji přípravku Numient | ||||
|
Třída orgánových systému |
Velmi časté |
Časté |
Méně časté |
Není známoa) |
|
poruchy |
v ústech, zvracení |
vřed (viz bod 4.4), dysfagie, dysgeuzie, glosodynie, flatulence |
škytavka, nadměrné slinění | |
|
Poruchy kůže a podkožní tkáně |
Návaly horka, nadměrné pocení, vyrážka (viz bod 4.3) |
Alergický edém, pruritus (viz bod 4.3) |
Henochova-Schonleinova purpura, kopřivka (viz bod 4.3), vypadávání vlasů, exantém, tmavý pot | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Svalové spasmy | |||
|
Poruchy ledvin a močových cest |
Retence moči |
Tmavá moč, močová inkontinence | ||
|
Poruchy reprodukčního systému a prsu |
Priapismus | |||
|
Celkové poruchy a reakce v místě aplikace |
Pády, periferní edém, nekardiální bolest na hrudi, astenie, únava | |||
|
Vyšetření |
Zvýšená hladina AST, ALT, LDH, bilirubinu, krevního cukru, kreatininu, kyseliny močové, snížené hodnoty hemoglobinu a hematokritu; krev v moči |
Zvýšená hladina močovinového dusíku, alkalické fosfatázy, pozitivní Coombsův test, přítomnost leukocytů a bakterií v moči | ||
a) Nežádoucí účinky, které nebyly pozorovány v klinickém vývoji přípravku Numient, ale byly hlášeny u jiných léčivých přípravků s levodopou/karbidopou.
b) Kombinovaný termín, který zahrnuje fibrilace síní, flutter síní, atrioventrikulámí blok, raménkovou blokádu, sick sinus syndrom, bradykardii a tachykardii.
Popis vybraných nežádoucích účinků
Náhlé usnutí
Přípravek Numient je spojován se somnolencí a velmi vzácně byl spojován s nadměrnou somnolencí během dne a případy náhlého usnutí.
Impulzivní poruchy
U pacientů léčených agonisty dopaminu a/nebo dopaminergními přípravky obsahujícími levodopu se mohou rozvinout symptomy jako patologické hráčství, zvýšené libido, hypersexualita, nutkavé utrácení nebo nakupování a záchvatovité a nutkavé přejídání (viz bod 4.4).
Laboratorní hodnoty
Velmi vzácně byly hlášeny případy falešně diagnostikovaného feochromocytomu u pacientů léčených levodopou/karbidopou. Opatrnosti je třeba při interpretaci katecholaminů a jejich metabolitů v plazmě a moči u pacientů léčených levodopou nebo levodopou/karbidopou.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky a známky
Akutní příznaky předávkování levodopou/inhibitorem DDC lze očekávat u dopaminergní hyperstimulace. Dávky několika gramů mohou vést k poruchám CNS, při vyšších dávkách roste pravděpodobnost výskytu kardiovaskulární poruchy (např. hypotenze, sinusová tachykardie) a mnohem závažnějších psychiatrických problémů. Předávkování levodopou může vést k systémovým komplikacím, způsobeným dopaminergní hyperstimulací.
Léčba
Léčba akutního předávkování přípravky s levodopou/inhibitorem DDC je stejná jako léčba akutního předávkování levodopou. Pyridoxin není účinný ke zvrácení účinku tohoto kombinovaného léčivého přípravku. Elektrokardiografické monitorování má být zavedeno a pacient má být pečlivě sledován, zda se u něho neobjeví arytmie; v případě potřeby zahajte vhodnou antiarytmickou léčbu. Další léčba má probíhat dle klinické indikace nebo dle doporučení národního toxikologického centra, jsou-li k dispozici.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiparkinsonika, dopaminergní léčiva, ATC kód: N04BA02 Mechanismus účinku
Levodopa je prekurzor dopaminu a podává se jako léčebná náhrada dopaminu u Parkinsonovy nemoci.
Karbidopa je inhibitor periferní dekarboxylázy aromatických aminokyselin. Brání metabolické přeměně levodopy na dopamin v periferním oběhu, a zajišťuje tak, že se větší část dávky dostane do mozku, kde dopamin projeví své terapeutické účinky. Je možné použít nižší dávku levodopy, když je podávána společně s karbidopou, čímž se omezuje výskyt a závažnost periferních nežádoucích účinků.
Farmakodynamické účinky
Když je levodopa podávána perorálně, proběhne rychle dekarboxylace na dopamin v extracerebrálních tkáních, takže pouze malá část podané dávky je transportována v nezměněném stavu do centrálního
nervového systému. Z tohoto důvodu se vyžadují velké dávky levodopy pro adekvátní léčebný účinek a ty mohou být často doprovázeny nauzeou a dalšími nežádoucími účinky, přičemž některé z nich lze připisovat dopaminu tvořenému v extracerebrálních tkáních.
Karbidopa inhibuje dekarboxylaci periferní levodopy. Nepřechází hemato-encefalickou bariéru a neovlivňuje metabolismus levodopy v centrálním nervovém systému. Jelikož její inhibice dekarboxylázy je omezena na extracerebrální tkáně, díky podávání karbidopy s levodopou se do mozku dostane více levodopy. Přidáním karbidopy k levodopě se snižují periferní účinky (nauzea, zvracení) způsobené dekarboxylací levodopy; karbidopa však nesnižuje nežádoucí účinky způsobené centrálním účinkem levodopy.
Klinická účinnost a bezpečnost
Pacienti s Parkinsonovou nemocí doposud neléčení levodopou APEX-PD
Účinnost přípravku Numient u pacientů s časnou fází Parkinsonovy nemoci byla stanovena v randomizovaném, dvojitě zaslepeném, placebem kontrolovaném, 30týdenním klinickém hodnocení s pevnou dávkou a paralelními skupinami u 381 pacientů, kteří měli medián doby trvání onemocnění 1 rok a omezenou nebo žádnou předchozí expozici levodopě a agonistům dopaminu. Pacienti pokračovali ve stabilní souběžné léčbě antiparkinsoniky. Vhodní pacienti byli randomizováni (1:1:1:1) k užívání placeba nebo jedné ze tří pevných dávek levodopy/karbidopy, tj. 145 mg/36,25 mg,
245 mg/61,25 mg nebo 390 mg/97,5 mg třikrát denně. Pacientům nebylo povoleno užívat doplňkově levodopu nebo inhibitory katechol-o-metyltransferázy (COMT). Pacienti dostávající léčivý přípravek s řízeným uvolňováním levodopy/karbidopy zahájili léčbu dávkou 95 mg levodopy/23,75 mg karbidopy třikrát denně (3xd). Dávka byla zvýšena od 4. dne a nejvyšší cílové dávky (390 mg levodopy/97,5 mg karbidopy 3xd) bylo dosaženo do 22. dne.
Primárním cílovým parametrem účinnosti byla průměrná změna skóre podle Unifikované škály pro hodnocení Parkinsonovy choroby (Unified Parkinson’s Disease Rating Scale, UPDRS) část II (aktivity každodenního života) plus část III k motorickému skóre v 30. týdnu nebo při předčasném ukončení oproti výchozímu stavu. Každá z těchto tří léčeb s řízeným uvolňováním levodopy/karbidopy byla statisticky výrazně superiorní vůči placebu podle primárního měřítka (tabulka 4).
Tabulka 4: Průměrná změna skóre UPDRS část IIplus část III ve 30. týdnu (nebo při předčasném ukončení) oproti výchozímu stavu u pacientů s Parkinsonovou nemocí doposud neléčených levodopou (APEX-PD)
|
Průměrné skóre UPDRS (část II a část III) a) | |||
|
Léčba |
Výchozí stavb) |
30. týden (nebo při předčasném ukončení) |
Změna oproti výchozímu stavu v 30. týdnu (nebo při předčasném ukončení)c) |
|
Placebo |
36,5 |
35,9 |
-0,6 |
|
Numient 145 mgd) |
36,1 |
24,4 |
-11,7 e) |
|
Numient 245 mgd) |
38,2 |
25,3 |
-12,9 e) |
|
Numient 390 mgd) |
36,3 |
21,4 |
-14,9 e) |
a) U UPDRS vyšší skóre označuje závažnější poruchu
b) Všechny hodnoty založené na 361 pacientech z populace podle původního léčebného záměru („intent-to-treat“), kteří měli platné hodnoty
z konce studie
c) Negativní čísla označují zlepšení v porovnání s výchozí hodnotou
d) Třikrát denně
e) P-hodnota je nižší než 0,05 oproti placebu
Pacienti s pokročilou Parkinsonovou nemocí
Účinnost a bezpečnost přípravku Numient u pacientů s pokročilým stupněm Parkinsonovy nemoci byly zkoumány ve 2 dvojitě zaslepených, aktivně kontrolovaných studiích: paralelní studie ADVANCE-PD (studie IPX066-B09-02; 22 týdnů) a studie ASCEND-PD se zkříženým uspořádáním (studie IPX066-B-09-06, část 1; 11 týdnů).
Primárním cílovým parametrem v obou studiích bylo procento období „off" během doby v bdělém stavu. Hlavní sekundární cílové parametry zahrnovaly období „off‘, období „on" bez nepříjemné dyskineze a skóre UPDRS pro část II + III. Ve studii ADVANCE-PD byl posuzován také celkový klinický dojem změny (Clinical Global Impression of Change, CGI-C) hodnocený lékařem.
ADVANCE-PD
Studie ADVANCE-PD byla 22týdení studie zahrnující 3týdenní úpravu dávky předstudijní léčby levodopou/karbidopou s okamžitým uvolňováním před 6týdením přechodem na přípravek Numient. Poté byli pacienti randomizováni do dvojitě zaslepeného 13týdenního období hodnocené léčby buď levodopou/karbidopou s optimalizovaným okamžitým uvolňováním, nebo přípravkem Numient. Celkem 471 pacientů bylo udržováno ve stabilním režimu alespoň 400 mg levodopy za den před vstoupením do klinického hodnocení. Dávkování souběžných antiparkinsonik bylo udržováno stabilní. Pacientům nebylo povoleno užívat doplňkově levodopu/karbidopu nebo inhibitory katechol-o-metyltransferázy (COMT) během klinického hodnocení. Celkem bylo randomizováno 393 pacientů (průměrný věk 63,2 let; 65 % mužů).
ASCEND-PD
Studie ASCEND-PD proběhla jako randomizovaná, dvojitě zaslepená studie se 2 léčbami, 2 obdobími a zkříženým uspořádáním, do které bylo zařazeno 110 pacientů na stabilním režimu levodopy/karbidopy/entakaponu (LCE) obsahujícím nejméně 400 mg levodopy denně. Minimální četnost dávek byla čtyřikrát za den po dobu nejméně 4 týdnů při vstupu do klinického hodnocení. Dávky souběžných antiparkinsonik byly během studie udržovány stabilní. Během 6týdenního období došlo k převedení léčby LCE na přípravek Numient. Po této konverzi dávky bylo 91 pacientů zapojených do studie (průměrný věk: 64,1 let; 75 % mužů) randomizováno a léčeno přípravkem Numient, po kterém následovala předstudijní léčba LCE, nebo naopak. Všechny údaje týkající se účinnosti vycházejí z údajů od 84 pacientů, kteří dokončili studii, s výjimkou údajů z deníků pacienta, které byly získány od 83 pacientů. Obě období dvojitě zaslepené hodnocené léčby trvala 2 týdny. Mezi těmito obdobími podstoupili všichni pacienti nezaslepenou léčbu přípravkem Numient po dobu 1 týdne.
Nejčastěji hlášenými souběžnými léčivými přípravky k léčbě Parkinsonovy nemoci u randomizovaných pacientů byly agonisté dopaminu (64 %) a inhibitory MAO (37 %).
Výsledky
Hlavní výsledky studií jsou shrnuty v tabulce 5.
|
Studie |
ADVANCE-PD |
ASCEND-PD (se zkříženým uspořádáním) | ||
|
Počet pacientů | ||||
|
Počet zařazených |
471 |
110 | ||
|
Počet v konverzi |
450 |
110 | ||
|
Počet randomizovaných |
393 |
91 | ||
|
Počet s dokončenou léčbou |
368 |
84 | ||
|
Charakteristiky randomizovaných pacientů | ||||
|
Věk [let (SD)] |
63,2 (9,4) |
64,1 (9,3) | ||
|
Délka trvání PD [let (SD)] |
7,4 (4,5) |
10,0 (5,3) | ||
|
Výsledky | ||||
|
Léčebná ramena |
Numient |
IR L-dopaf |
Numient |
LCE |
|
n = 201 |
n = 192 |
n = 84 | ||
|
Dávka (mg), medián (rozmezí) |
1 330 (570; 5 390) |
800 (400; 2 000) |
1 495 (735;4 900) |
600 (400; 1 600) |
|
Procento období „off“* | ||||
|
Výchozí stav, průměrná hodnota |
36,9 % |
36,0 % |
36,1 % | |
|
Cílový parametr, průměrná hodnota |
23,8 % |
29,8 % |
24,0 % |
32,5 % |
|
Rozdíl (95% IS) |
-5,8 % (-8,8; -2,7) |
-8,6 % (-12,4; -4,7) | ||
|
p-hodnota |
< 0,0001 |
< 0,0001 | ||
|
Období „off" (hodin)* | ||||
|
Výchozí stav, průměrná hodnota |
6,1 |
5,9 |
5.9 | |
|
Změna při cílovém parametru |
-2,2 |
-1,0 |
-2.1 |
-0.7 |
|
Rozdíl (95% IS) |
-1,0 (- |
1,5; -0,5) |
-1,4 (-2,1; -0,8) | |
|
p-hodnota |
< 0,0001 |
< 0,0001 | ||
|
Období „on" bez dyskineze nebo bez obtížné dyskineze (hodin) | ||||
|
Výchozí stav, průměrná hodnota |
10,0 |
10,1 |
9,8 | |
|
Změna při cílovém parametru |
+1,9 |
+0,8 |
+1,5 |
+0,1 |
|
Rozdíl (95% IS) |
1.0 (0,5; 1,5) |
1,4 (0,7; 2,0) | ||
|
p-hodnota |
0,0002 |
< 0,0001 | ||
|
Skoré UPDRSn-m | ||||
|
Výchozí stav, průměrná hodnota |
32,3 |
32,4 |
32,0 | |
|
Změna při cílovém parametru |
-5,7 |
-2,1 |
-2,7 |
-0,3 |
|
Rozdíl (95% IS) |
-4,0 (-5,9; -2,0) |
-2,6 (-4,8; -0,4) | ||
|
p-hodnota |
< 0,0001 |
0,0233 | ||
|
Analýza respondérů | ||||
|
zlepšení období „off" > 1 hodina (95% IS) |
63,2 % (56,5; 69,9) |
45,3 % (38,3; 52,4) |
64,0 % (54,1; 74,0) |
50,0 % (39,6; 60,5) |
|
p-hodnota |
< 0,0001 |
0,0094 | ||
|
Mnohem větší zlepšení CGI-C (95% IS) |
40,0 % (33,2; 46,8) |
13,7 % (8,8; 18,6) |
není k dispozici |
není k dispozici |
|
p-hodnota |
< 0,0001 |
není k c |
ispozici | |
Zkratky: CGI-C: celkový klinický dojem změny hodnocený lékařem oproti výchozímu stavu; IS: interval spolehlivosti; IR: okamžité uvolňování; LCE: levodopa/karbidopa/entakapon; L-dopa?: levodopa/karbidopa; LS: nejmenší čtverce; PD: Parkinsonova nemoc; SD: standardní odchylka.
*Ve studii ADVANCE-PD byl pro konec studie použit model analýzy kovariance (ANCOVA) s léčbou a centry jako hlavními faktory a interakcí z hlediska léčby podle centra a výchozího stavu jako kovariátou.
Údaje ve studii ASCEND-PD byly analyzovány za použití standardní analýzy rozptylu se smíšeným modelem. Léčba, posloupnost a období byly zahrnuty jako fixní faktory, faktory variability u jednoho pacienta a mezi pacienty byly zahrnuty jako proměnné. Vlivy období, posloupnosti/převedení (p-hodnoty u všech > 0,10) nebyly ve studii ASCEND-PD prokázány.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Numient u všech podskupin pediatrické populace v léčbě idiopatické Parkinsonovy nemoci (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Levodopa
Farmakokinetika přípravku Numient byla hodnocena po jedné dávce u zdravých dobrovolníků a po jedné dávce a několika dávkách u pacientů s Parkinsonovou nemocí. Farmakokinetika jedné dávky u zdravých dobrovolníků po perorálním podání 2 tobolek přípravku Numient 195 mg levodopy/48,75 mg karbidopy je uvedena na obrázku 1.
Obrázek 1: Profily průměrné koncentrace-času plazmatických koncentrací levodopy u 22 dospělých osob po podání jedné perorální dávky 2 tobolek přípravku Numient 195 mg levodopy/48,75 mg karbidopy
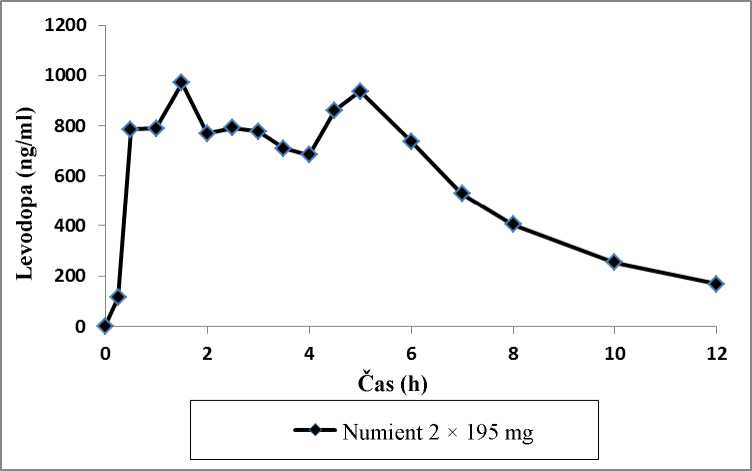
Biologická dostupnost levodopy z přípravku Numient u pacientů byla přibližně 70 % ve vztahu k přípravku s okamžitým uvolňováním levodopy/karbidopy. U srovnatelných dávek vede přípravek Numient k maximální koncentraci levodopy (Cmax), která se rovná 30 % koncentrace přípravku s okamžitým uvolňováním levodopy/karbidopy. Po počátečním maximu asi za jednu hodinu jsou plazmatické koncentrace udržovány po dobu asi 4 až 5 hodin, než začnou klesat. Maximální plazmatické koncentrace se dosáhne za dobu asi 4,5 hodiny. U pacientů s Parkinsonovou nemocí byla farmakokinetika několika dávek srovnatelná s farmakokinetikou jedné dávky, tj. došlo k minimální akumulaci levodopy z léčivého přípravku s řízeným uvolňováním levodopy/karbidopy.
Po několika dávkách u pacientů měla levodopa/karbidopa s řízeným uvolňováním omezené výkyvy koncentrace levodopy v plazmě s indexem kolísání z maximální do minimální hodnoty 1,5, s minimální akumulací levodopy.
Karbidopa
Po perorálním podání dávky léčivého přípravku s řízeným uvolňováním levodopy/karbidopy došlo k maximální koncentraci přibližně za 3,5 hodiny. Biologická dostupnost karbidopy z tohoto léčivého přípravku byla přibližně 50 % ve vztahu k tabletám s okamžitým uvolňováním levodopy a karbidopy.
Vliv jídla
U zdravých dospělých osob se po perorálním podání léčivého přípravku s řízeným uvolňováním levodopy/karbidopy po tučném, velmi kalorickém jídle snížila hodnota Cmax levodopy o 21 %.
Celkový rozsah absorpce levodopy (AUCinf) byl podobný (13% zvýšení), jaký byl pozorován u stavu nalačno. Podání s velmi tučným a velmi kalorickým jídlem zpožďuje absorpci levodopy až o 2 hodiny.
Po podání obsahu tablety s řízeným uvolňováním vysypaného na malé množství měkké potravy, jako je jablečné pyré, byly rychlost a rozsah absorpce levodopy podobné hodnotám, jaké byly pozorovány u stavu nalačno.
Levodopa si v transportu konkuruje s určitými aminokyselinami, proto jídla s vysokým obsahem proteinů mohou zhoršit absorpci levodopy.
Distribuce
Levodopa
Levodopa je vázána na plazmatické proteiny jen v malé míře (10-30 %). Levodopa přechází hemato-encefalickou bariéru pomocí aktivních transportérů pro velké neutrální aminokyseliny.
Karbidopa
Karbidopa je přibližně z 36 % vázaná na plazmatické proteiny. Karbidopa nepřechází hemato-encefalickou bariéru v klinicky relevantních dávkách.
Biotransformace
Levodopa
U levodopy dochází k rozsáhlému rozkladu na různé metabolity. Dvě hlavní metabolické cesty jsou dekarboxylace pomocí dopadekarboxylázy (DDC) a o-metylace pomocí katechol-o-metyltransferázy (COMT). Nezměněná levodopa představuje méně než 10 % celkového množství vyloučeného močí. Terminální fáze eliminačního poločasu levodopy, aktivní zbytek s antiparkinsonickým účinkem, je přibližně 2 hodiny za přítomnosti karbidopy.
Karbidopa
Karbidopa se rozpadá na dva hlavní metabolity: a-methyl-3-methoxy-4-hydroxyfenylpropionovou kyselinu a a-methyl-3, 4-dihydroxy-fenylpropionovou kyselinu. Tyto dva metabolity se primárně vylučují močí v nezměněném stavu nebo jako glukuronidy. Nezměněná karbidopa představuje 30 % celkového množství vyloučeného močí. Terminální fáze eliminačního poločasu karbidopy je přibližně 2 hodiny.
Linearita dávky
Přípravek Numient vykazuje farmakokinetiku úměrnou dávce jak pro karbidopu, tak pro levodopu v rozmezí síly dávek levodopy od 95 mg do 245 mg.
Porucha funkce ledvin
Ledvinami vyloučená levodopa v nezměněném stavu představuje pouze asi 10 % clearance. Proto porucha funkce ledvin může mít potenciálně malý účinek na expozici levodopy. Levodopa/karbidopa s řízeným uvolňováním má být pacientům s těžkou poruchou funkce ledvin podávána s opatrností (viz bod 4.2).
Porucha funkce jater
Neproběhly žádné studie farmakokinetiky levodopy a karbidopy u pacientů s poruchou funkce jater (viz bod 4.2). Levodopa/karbidopa s řízeným uvolňováním má být pacientům s těžkou poruchou funkce jater podávána s opatrností.
Pediatrická populace
Neproběhly žádné studie farmakokinetiky levodopy a karbidopy při podávání přípravku Numient dětem.
Starší osoby
Ve farmakokinetických studiích prováděných u pacientů po podání jedné dávky přípravku Numient se systémová expozice levodopě obecně zvyšovala se zvyšujícím se věkem, kde hodnoty AUC byly v průměru přibližně o 15 % vyšší u starších osob (> 65 let) než u mladších pacientů (< 65 let).
Pohlaví
Levodopa
Po jedné dávce přípravku Numient u pacientů s Parkinsonovou nemocí byla plazmatická AUC a Cmax levodopy vyšší u žen než u mužů (v průměru 37 % pro AUC a 35 % pro Cmax). Tyto rozdíly se primárně vysvětlují nižší tělesnou hmotností žen.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka.
Reprodukční toxikologie
Jak levodopa, tak kombinace karbidopy a levodopy způsobovaly viscerální a skeletální malformace u králíků.
Nebyly pozorovány žádné účinky na samčí či samičí reprodukční orgány u toxikologických studií s opakovanými dávkami u myší, potkanů nebo opic se samostatnou levodopou nebo v kombinaci s karbidopou. Levodopa však mírně ovlivňovala chování potkaních samců při páření.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Obsah tobolky mikrokrystalická celulosaa
mannitol
kyselina vinná
ethylcelulosa
hypromelosa
sodná sůl karboxymethylškrobu
natrium-lauryl-sulfát
povidon
mastek
kopolymer MA/MMA 1:1
kopolymer MA/MMA 1:2
triethyl-citrát
sodná sůl kroskarmelosy
magnesium-stearát
Obal tobolky
hlinitý lak indigokarmínu (E132) žlutý oxid železitý (E172) oxid titaničitý (E171) želatina
Inkoust
modrý inkoust šelak (E904) propylenglykol
hlinitý lak indigokarmínu (E132)
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
18 měsíců
60 dní po prvním otevření.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
Podmínky uchovávání tohoto léčivého přípravku po jeho prvním otevření jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Neprůhledná bílá lahvička z polyetylenu o vysoké hustotě (HDPE) s polypropylenovým šroubovacím uzávěrem. Do lahve je vloženo vysoušedlo.
Jedna lahvička obsahuje 25, 100 nebo 240 tvrdých tobolek s řízeným uvolňováním.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Impax Laboratories (Netherlands) B.V.
Schiphol Boulevard 231 1118 BH Schiphol Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
Numient 95 mg/23,75 mg, tvrdé tobolky s řízeným uvolňováním
EU/1/15/1044/001 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/002 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/003 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 145 mg/36,25 mg, tvrdé tobolky s řízeným uvolňováním
EU/1/15/1044/004 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/005 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/006 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 195 mg/48,75 mg, tvrdé tobolky s řízeným uvolňováním
EU/1/15/1044/007 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/008 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/009 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 245 mg/61,25 mg, tvrdé tobolky s řízeným uvolňováním
EU/1/15/1044/010 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/011 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/012 (240 tvrdých tobolek s řízeným uvolňováním)
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: DD. měsíc RRRR
10. DATUM REVIZE TEXTU MM.RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Central Pharma Contract Packing Limited Caxton Road, Bedford, Bedfordshire MK41 0XZ Velká Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Numient 95 mg/23,75 mg tvrdé tobolky s řízeným uvolňováním Numient 145 mg/36,25 mg tvrdé tobolky s řízeným uvolňováním Numient 195 mg/48,75 mg tvrdé tobolky s řízeným uvolňováním Numient 245 mg/61,25 mg tvrdé tobolky s řízeným uvolňováním levodopum/carbidopum
Jedna tobolka obsahuje levodopum 95 mg a carbidopum 23,75 mg (jako carbidopum monohydricum) Jedna tobolka obsahuje levodopum 145 mg a carbidopum 36,25 mg (jako carbidopum monohydricum) Jedna tobolka obsahuje levodopum 195 mg a carbidopum 48,75 mg (jako carbidopum monohydricum) Jedna tobolka obsahuje levodopum 245 mg a carbidopum 61,25 mg (jako carbidopum monohydricum)
25 tvrdých tobolek s řízeným uvolňováním 100 tvrdých tobolek s řízeným uvolňováním 240 tvrdých tobolek s řízeným uvolňováním
Před použitím si přečtěte příbalovou informaci. Perorální podání.
Polykejte celé, nežvýkejte.
Uchovávejte mimo dohled a dosah dětí.
Po otevření lahvičky spotřebujte během 60 dní. Otevřeno:
Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Impax Laboratories (Netherlands) B.V. Schiphol Boulevard 231 1118 BH Schiphol Nizozemsko
Numient 95 mg/23,75 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/001 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/002 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/003 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 145 mg/36,25 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/004 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/005 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/006 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 195 mg/48,75 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/007 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/008 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/009 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 245 mg/61,25 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/010 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/011 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/012 (240 tvrdých tobolek s řízeným uvolňováním)
Lot
Numient 95/23,75 mg Numient 145/36,25 mg Numient 195/48,75 mg Numient 245/61,25 mg
Numient 95 mg/23,75 mg tvrdé tobolky s řízeným uvolňováním Numient 145 mg/36,25 mg tvrdé tobolky s řízeným uvolňováním Numient 195 mg/48,75 mg tvrdé tobolky s řízeným uvolňováním Numient 245 mg/61,25 mg tvrdé tobolky s řízeným uvolňováním levodopum/carbidopum
Jedna tobolka obsahuje levodopum 95 mg a carbidopum 23,75 mg (jako carbidopum monohydricum) Jedna tobolka obsahuje levodopum 145 mg a carbidopum 36,25 mg (jako carbidopum monohydricum) Jedna tobolka obsahuje levodopum 195 mg a carbidopum 48,75 mg (jako carbidopum monohydricum) Jedna tobolka obsahuje levodopum 245 mg a carbidopum 61,25 mg (jako carbidopum monohydricum)
25 tvrdých tobolek s řízeným uvolňováním 100 tvrdých tobolek s řízeným uvolňováním 240 tvrdých tobolek s řízeným uvolňováním
Před použitím si přečtěte příbalovou informaci. Perorální podání.
Polykejte celé, nežvýkejte.
Uchovávejte mimo dohled a dosah dětí.
EXP
Po otevření lahvičky spotřebujte během 60 dní.
Otevřeno:
Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Logo Impax
Numient 95 mg/23,75 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/001 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/002 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/003 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 145 mg/36,25 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/004 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/005 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/006 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 195 mg/48,75 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/007 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/008 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/009 (240 tvrdých tobolek s řízeným uvolňováním)
Numient 245 mg/61,25 mg tvrdé tobolky s řízeným uvolňováním EU/1/15/1044/010 (25 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/011 (100 tvrdých tobolek s řízeným uvolňováním) EU/1/15/1044/012 (240 tvrdých tobolek s řízeným uvolňováním)
Lot
Příbalová informace: informace pro pacienta Numient 95 mg/23,75 mg tvrdé tobolky s řízeným uvolňováním Numient 145 mg/36,25 mg tvrdé tobolky s řízeným uvolňováním
Numient 195 mg/48,75 mg tvrdé tobolky s řízeným uvolňováním
Numient 245 mg/61,25 mg tvrdé tobolky s řízeným uvolňováním
levodopum/carbidopum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Numient a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Numient užívat
3. Jak se přípravek Numient užívá
4. Možné nežádoucí účinky
5. Jak přípravek Numient uchovávat
6. Obsah balení a další informace
1. Co je přípravek Numient a k čemu se používá
Přípravek Numient obsahuje dva různé léky označované jako levodopa a karbidopa v jedné tvrdé tobolce.
- levodopa se v mozku mění na látku zvanou „dopamin“. Dopamin pomáhá zlepšit příznaky Parkinsonovy nemoci.
- karbidopa patří do skupiny léků označovaných jako „inhibitory dekarboxylázy aromatických aminokyselin“. Napomáhá tomu, aby levodopa účinkovala lépe, protože zpomaluje rychlost, jakou se levodopa v těle rozkládá.
Numient se používá ke zlepšení příznaků Parkinsonovy nemoci u dospělých.
2. Čemu musíte věnovat pozornost, než začnete přípravek Numient užívat
Neužívejte přípravek Numient:
- jestliže j ste alergický(á) na levodopu nebo karbidopu nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6),
- jestliže máte glaukom (zelený zákal) s uzavřeným úhlem (oční onemocnění),
- jestliže máte feochromocytom (vzácný nádor nadledvin),
- jestliže užíváte určité léky k léčbě deprese [neselektivní inhibitory monoaminooxidázy (MAO)], musíte tyto léky přestat užívat alespoň dva týdny před tím, než zahájíte užívání přípravku Numient (viz také „Další léčivé přípravky a přípravek Numient“),
- jestliže j ste někdy měl(a) neuroleptický maligní syndrom (NMS - vzácná závažná reakce na léky užívané k léčbě těžkých duševních poruch),
- jestliže jste někdy měl(a) netraumatickou rhabdomyolýzou (vzácné svalové onemocnění). Upozornění a opatření
Před užitím přípravku Numient se poraďte se svým lékařem nebo lékárníkem, pokud máte, někdy jste měl(a), nebo se u Vás objeví následující problémy:
- případy náhlého usnutí nebo se někdy cítíte velmi ospalý(á),
- jakákoliv forma těžké duševní poruchy, jako psychóza,
- pocity deprese, sebevražedné myšlenky, nebo pokud si všimnete neobvyklých změn chování
- třes, podráždění, zmatenost, horečka, rychlý puls nebo velké výkyvy krevního tlaku, nebo pokud zaznamenáte, že máte velmi tuhé svaly nebo dochází k jejich prudkému škubání. Pokud se u Vás vyskytne kterýkoli z těchto problémů, obraťte se ihned na svého lékaře.
- oční onemocnění nazývané chronický glaukom (zelený zákal) s otevřeným úhlem, jelikož může být potřeba upravit Vaši dávku a sledovat tlak v očích,
- melanom nebo podezřelé kožní léze,
- srdeční příhoda (srdeční infarkt), problémy se srdečním tepem, oběhem nebo dýcháním,
- problémy s ledvinami nebo játry,
- vřed ve střevě (nazývaný „duodenální“ nebo „peptický vřed“),
- endokrinní (hormonální) onemocnění,
- průduškové astma,
- obsesivní (nutkavé) chování,
- křeče,
- nízký krevní tlak nebo pocit na omdlení při vstávání
- nově zjištěný nebo zvýšený výskyt abnormálních pohybů těla (dyskineze).
Pokud si nejste jistý(á), zda se Vás některý z výše uvedených bodů týká, promluvte si o tom se svým lékařem nebo lékárníkem, než začnete přípravek Numient užívat.
Pokud musíte podstoupit chirurgický zákrok, informujte svého lékaře, že užíváte přípravek Numient. Impulzivní poruchy
Informujte svého lékaře, pokud Vy nebo Vaši rodinní příslušníci, či ošetřovatelé zaznamenáte, že se u Vás objevuje nutkání nebo touha chovat se neobvyklým způsobem, či nemůžete odolat nutkání, popudu či pokušení provádět některé činnosti, kterými byste mohl(a) poškodit sebe či své okolí. Tyto projevy jsou nazývány impulzivními poruchami a může mezi ně patřit návykové hráčství, nadměrná konzumace jídla nebo nadměrné utrácení, abnormálně vysoký zájem o sex nebo nárůst sexuálních myšlenek a pocitů. Váš lékař možná bude muset přehodnotit Vaši léčbu.
Vyšetření
Možná budete během dlouhodobé léčby léčivými přípravky obsahujícími levodopu/karbidopu potřebovat vyšetření funkce srdce, jater, ledvin a krevních buněk. Pokud budete muset podstoupit vyšetření krve nebo moči, řekněte lékaři nebo zdravotní sestře, že užíváte přípravek Numient. Důvodem je, že tento lék může ovlivnit některá vyšetření.
Děti a dospívající
Použití přípravku Numient se nedoporučuje u pacientů mladších 18 let. Bezpečnost a účinnost přípravku Numient u pacientů ve věku do 18 let nebyla dosud hodnocena.
Další léčivé přípravky a přípravek Numient
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Důvodem je, že některé léky mohou ovlivnit účinky přípravku Numient.
Neužívejte přípravek Numient, pokud jste užil(a) léčivý přípravek nazývaný „neselektivní inhibitor monoaminooxidázy (MAO)“ k léčbu deprese během posledních 14 dní. Tyto léčivé přípravky zahrnují isokarboxazid a fenelzin. Pokud se Vás to týká, neužívejte přípravek Numient a poraďte se s lékařem nebo lékárníkem.
Zejména řekněte svému lékaři nebo lékárníkovi, pokud užíváte následující léky:
- jiné léky k léčbě Parkinsonovy nemoci, například „anticholinergika“ (např. orfenadrin a trihexyfenidyl), „selektivní inhibitory MAO-B“ (např. selegilin a rasagilin) a „inhibitor COMT“ (např. entakapon),
- síran železnatý (používaný k léčbě anémie způsobené nízkou hladinou železa v krvi). Kvůli levodopě/karbidopě může tělo obtížněji vstřebávat železo. Proto neužívejte přípravek Numient a doplňky obsahující železo nebo multivitaminové doplňky obsahující železo současně. Po užití jednoho z přípravků počkejte nejméně 2 až 3 hodiny, než užijete druhý,
- fenothiaziny - například chlorpromazin, promazin a prochloroperazin (používané k léčbě duševních chorob),
- benzodiazepiny jako alprazolam, diazepam a lorazepam používané k léčbě úzkosti,
- tricyklická antidepresiva (TCA; používaná k léčbě deprese),
- papaverin (používaný ke zlepšení prokrvení po celém těle),
- léky k léčbě vysokého krevního tlaku (hypertenze),
- fenytoin, který se používá k léčbě epileptických záchvatů (křečí),
- isoniazid, který se používá k léčbě tuberkulózy,
- antagonisté dopaminu, kteří se používají k léčbě duševních poruch, pocitu na zvracení a zvracení
Přípravek Numient s jídlem a pitím
Velmi kalorická jídla s vysokým obsahem tuku zpožďují vstřebávání levodopy o dvě hodiny. Pokud Vaše strava obsahuje příliš mnoho bílkovin (maso, vejce, mléko, sýr), přípravek Numient nemusí účinkovat tak dobře, jak by měl. Neužívejte tobolky současně s jídlem s vysokým obsahem tuku nebo vysokým obsahem bílkovin.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete přípravek Numient užívat.
Přípravek Numient se nedoporučuje během těhotenství a u žen v plodném věku, které nepoužívají antikoncepci. Váš lékař však může rozhodnout o podání přípravku Numient, pokud očekávané přínosy léčby převažují nad možnými riziky pro nenarozené dítě.
Ženy během léčby přípravkem Numient nesmí kojit.
Řízení dopravních prostředků a obsluha strojů
Přípravek Numient může způsobit somnolenci (nadměrnou ospalost) a epizody náhlého usnutí. Proto se musíte vyhýbat řízení nebo činnostem, kterými byste mohl(a) sebe nebo ostatní vystavit riziku závažného zranění nebo úmrtí (např. obsluhování strojů), dokud takové opakující se epizody a somnolence nevymizí.
3. Jak se přípravek Numient užívá
- Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
- Váš lékař Vám řekne, kolik přesně tobolek přípravku Numient máte každý den užívat.
- Pokud jste nikdy dříve neužíval(a) levodopu, obvyklá počáteční dávka přípravku Numient je jedna 95mg tobolka třikrát denně po dobu tří dnů. V závislosti na tom, jak odpovídáte na léčbu, Váš lékař pak může dávku čtvrtý den zvýšit.
- Pokud jste již užíval(a) levodopu, lékař určí vhodný počáteční režim dávkování podle Vaší současné dávky levodopy.
- Přípravek Numient se má užívat přibližně každých šest hodin a ne více než 5krát za den.
- Tento lék užívejte ústy a zapijte sklenicí vody. Tobolky musíte polykat celé. Tobolky nelamte, nedrťte ani nežvýkejte.
- Pokud máte potíže s polykáním tobolky, může být tento lék podán opatrným otevřením tobolky a vysypáním celého obsahu na malé množství (např. 2 polévkové lžíce) měkké potravy, například jablečného pyré, jogurtu nebo pudinku. Směs léčivého přípravku/potraviny neohřívejte a obsah tobolky nesypte na horké potraviny. Spolkněte směs léčivého přípravku/potravy kompletně a ihned bez žvýkání a neuchovávejte ji pro budoucí použití.
- Užívejte tobolky v pravidelných intervalech podle pokynů lékaře.
- Neměňte časy, kdy užíváte tobolky nebo jiné léky k léčbě Parkinsonovy nemoci, bez předchozí konzultace se svým lékařem. Tobolky přípravku Numient byste neměl(a) užívat v kratších intervalech než po 4 hodinách.
- Přípravek Numient lze užívat s jídlem i bez jídla. Neužívejte tobolky s jídlem s vysokým obsahem tuku nebo bílkovin, protože se tím zpozdí působení léku.
- Promluvte si se svým lékařem nebo lékárníkem, pokud se domníváte, že je účinek přípravku Numient příliš silný nebo příliš slabý, nebo pokud se u Vás objeví případné nežádoucí účinky.
- V závislosti na tom, jak odpovídáte na léčbu, Váš lékař pak může dávku zvýšit nebo snížit a upravit četnost dávkování.
Jestliže jste užil(a) více přípravku Numient, než jste měl(a)
Jestliže jste užil(a) více přípravku Numient, než jste měl(a) (nebo pokud někdo jiný náhodně požije přípravek Numient), ihned kontaktujte svého lékaře nebo lékárníka. V případě předávkování se můžete cítit zmateně nebo podrážděně a Váš srdeční tep může být pomalejší nebo rychlejší než normálně.
Jestliže jste zapomněl(a) užít přípravek Numient
Užijte jej, jakmile si vzpomenete, pokud již téměř nenadešel čas Vaší další dávky. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku. Užijte zbývající dávky ve správném čase.
Jestliže jste přestal(a) užívat přípravek Numient
Nepřestávejte užívat přípravek Numient ani neměňte jeho dávkování, aniž byste se nejdřív poradil(a) se svým lékařem, a to ani když se cítíte lépe.
Nepřestávejte užívat přípravek Numient náhle
Může to způsobit svalové potíže, horečku a duševní změny.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u Vás vyskytne kterýkoli z následujících příznaků, ihned kontaktujte svého lékaře:
- krvácení do žaludku nebo střev, což se může projevit jako krev ve stolici nebo tmavá stolice,
- alergická reakce, jejíž příznaky mohou zahrnovat kopřivku, svědění, vyrážku, otok obličeje, rtů, jazyka nebo hrdla. To může způsobit obtíže s dýcháním a polykáním.
- Vaše svaly jsou velmi tuhé nebo dochází k jejich prudkým záškubům, objevuje se třes, podráždění, zmatenost, horečka, rychlý puls nebo velké výkyvy krevního tlaku. Může se jednat o příznaky neuroleptického maligního syndromu (NMS, vzácné závažné reakce na léky užívané v léčbě poruch centrálního nervového systému) nebo rhabdomyolýzy (vzácné závažné svalové poruchy).
Další možné nežádoucí účinky:
Velmi časté (mohou postihovat více než 1 z 10 osob)
- Nevolnost (pocit na zvracení)
Časté (mohou postihovat 1 z 10 osob)
- Úbytek tělesné hmotnosti
- Zrakové nebo zvukové vjemy věcí, které nejsou skutečné, deprese, úzkost, somnolence (nadměrná ospalost), problémy s usínáním a/nebo udržením spánku, abnormální sny, zmatenost, porucha paměti a myšlení
- Kroucení a opakované pohyby nebo abnormální pozice způsobené mimovolními svalovými stahy (dystonie), abnormální mimovolní pohyby (dyskineze), fenomén „on-off" (doba, kdy léčivý přípravek účinkuje, a pak přestane účinkovat na Vaše příznaky), zhoršení Parkinsonovy nemoci, abnormální chůze, závrať, nadměrná ospalost, pocit píchání a mravenčení v horních a/nebo dolních končetinách, třes, bolest hlavy
- Nepravidelný srdeční rytmus
- Vysoký krevní tlak, abnormálně nízký krevní tlak při vstávání
- Dušnost
- Bolest břicha, zácpa, průjem, sucho v ústech, zvracení
- Návaly horka, nadměrné pocení, vyrážka
- Svalové křeče
- Pády
- Otoky horních a/nebo dolních končetin
- Bolest na hrudi nezpůsobená srdeční chorobou
- Úbytek síly, únava
Méně časté (mohou postihovat 1 ze 100 osob)
- Melanom (typ nádorového onemocnění kůže)
- Anémie (malý počet červených krvinek)
- Menší chuť k jídlu, zvýšení tělesné hmotnosti
- Psychotická epizoda, podráždění
- Impulzivní poruchy (viz níže)
- Případy náhlého usnutí, syndrom neklidných nohou (nepříjemný pocit v nohou s nutkáním hýbat jimi), obtíže s otevřením úst, křeče
- Dvojité vidění, rozšířené zorničky, rozmazané vidění
- Bušení srdce
- Mdloby, krevní sraženina nebo zánět v cévě
- Krvácení do žaludku nebo střev, peptický vřed, potíže s polykáním, zažívací potíže, neobvyklá chuť v ústech, pocit pálení na jazyku, nadměrná plynatost (nadýmání)
- Alergická reakce, která může zahrnovat kopřivku, svědění, vyrážku, otok obličeje, rtů, jazyka nebo hrdla, potíže s dýcháním nebo polykáním, svědění
- Neschopnost vymočit se
- Celkový pocit nemoci (malátnost)
- Zvýšená hladina cukru, kyseliny močové a/nebo jaterních enzymů v krvi
- Abnormální výsledky vyšetření funkce ledvin a/nebo krev v moči
Můžete rovněž zaznamenat následující nežádoucí účinky:
- Neschopnost odolat nutkání provádět činnost, která by Vás mohla poškodit, mezi tyto činnosti mohou patřit:
- Silné nutkání k nadměrnému hazardu i přes riziko vážných rodinných nebo osobních následků
- Změněný nebo zvýšený zájem o sex a chování, které ve Vás nebo ve Vašem okolí budí zvýšené obavy, např. zvýšený sexuální apetit
- Nekontrolovatelné nadměrné nakupování nebo utrácení
- Záchvatovité přejídání (příjem velkého množství potravy za krátkou dobu) nebo nutkavé přejídání (příjem většího množství jídla, než je obvyklé a než je nutné pro zahnání hladu)
Informujte svého lékaře, pokud zaznamenáte některý z těchto nežádoucích účinků. Váš lékař s Vámi probere možnosti, jak tyto nežádoucí účinky zvládat či je omezit.
Byly také hlášeny následující nežádoucí účinky, ale pravděpodobnost jejich výskytu není známa:
- Nízký počet krvinek (bílých krvinek, krevních destiček)
- Nadužívání některých léků používaných k léčbě Parkinsonovy nemoci
- Pokus o sebevraždu, pocit dezorientace, zvýšené sexuální touhy
- Závažné dlouhotrvající abnormální pohyby oka, Hornerův syndrom (pokles očního víčka, malá zornice a snížené pocení na jedné straně obličeje), záškuby očního víčka
- Abnormální vzorce dýchání
- Nadměrné nebo tmavě zbarvené sliny, skřípání zuby, škytavka
- Ztráta vlasů, vyrážka (včetně závažné vyrážky nazývané Henoch-Schonleinova purpura), tmavě zbarvený pot
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Numient uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Uchovávejte při teplotě do 30 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a na lahvičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Po otevření lahvičky spotřebujte během 60 dní.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Numient obsahuje
- Léčivými látkami přípravku Numient jsou levodopum a carbidopum
- Jedna 95 mg/23,75 mg tvrdá tobolka s řízeným uvolňováním obsahuje levodopum 95 mg a carbidopum 23,75 mg (jako carbidopum monohydricummonohydrát)
- Jedna 145 mg/36,25 mg tvrdá tobolka s řízeným uvolňováním obsahuje levodopum 145 mg a carbidopum 36,25 mg (jako carbidopum monohydricummonohydrát)
- Jedna 195 mg/48,75 mg tvrdá tobolka s řízeným uvolňováním obsahuje levodopum 195 mg a carbidopum 48,75 mg (jako carbidopum monohydricummonohydrát)
- Jedna 245 mg/61,25 mg tvrdá tobolka s řízeným uvolňováním obsahuje levodopum 245 mg a carbidopum 61,25 mg (jako carbidopum monohydricummonohydrát)
- Dalšími složkami jsou mikrokrystalická celulosa, mannitol, kyselina vinná, ethylcelulosa, hypromelosa, sodná sůl karboxymethylškrobu, natrium-lauryl-sulfát, povidon, mastek, kopolymer MA/MMA 1:1, kopolymer MA/MMA 1:2, triethyl-citrát, sodná sůl kroskarmelosy a magnesium-stearát.
- Složkami obalu tvrdé tobolky j sou hlinitý lak indigokarmínu (E132), žlutý oxid železitý (E172), oxid titaničitý (E171) a želatina.
- Složkami inkoustu jsou modrý inkoust, šelak (E904), propylenglykol a hlinitý lak indigokarmínu (E132).
Jak přípravek Numient vypadá a co obsahuje toto balení
Přípravek Numient je tvrdá tobolka s řízeným uvolňováním.
95 mg/23,75 mg, tvrdá tobolka s řízeným uvolňováním
Bílé tělo a modré víčko o velikosti 18 x 6 mm s potiskem modrým inkoustem „IPX066“ a „95“
145 mg/36,25 mg, tvrdá tobolka s řízeným uvolňováním
Světle modré tělo a modré víčko o velikosti 19 x 7 mm s potiskem modrým inkoustem „IPX066“ a „145“.
195 mg/48,75 mg, tvrdá tobolka s řízeným uvolňováním
Žluté tělo a modré víčko o velikosti 24 x 8 mm s potiskem modrým inkoustem „IPX066“ a „195“.
245 mg/61,25 mg, tvrdá tobolka s řízeným uvolňováním
Modré tělo a modré víčko o velikosti 23 x 9 mm s potiskem modrým inkoustem „IPX066“ a „245“.
Tobolky Numient se dodávají v plastových lahvičkách s vysoušedlem a plastovým uzávěrem, k dispozici jsou lahvičky obsahující 25, 100 nebo 240 tvrdých tobolek. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Impax Laboratories (Netherlands) B.V.
Schiphol Boulevard 231 1118 BH Schiphol Nizozemsko
Výrobce:
Central Pharma Contract Packing Limited Caxton Road, Bedford, Bedfordshire MK41 0XZ Velká Británie 44(0) 1234 227816
Tato příbalová informace byla naposledy revidována MM.RRRR.
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
39