Novothirteen 2 500 Iu
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje catridecacogum* (rekombinantní koagulační faktor XIII) (rDNA): 2 500 IU ve 3 ml. Po rekonstituci odpovídá koncentraci 833 IU/ml. Specifická aktivita přípravku NovoThirteen je přibližně 165 IU/mg proteinu.
* Vyrobená rekombinantní DNA technologií v kvasinkách (Saccharomyces cerevisiae).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok Bílý prášek a čiré a bezbarvé rozpouštědlo.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dlouhodobá profylaktická léčba krvácení u dospělých a pediatrických pacientů s vrozeným nedostatkem podjednotky A faktoru XIII.
4.2 Dávkování a způsob podání
Léčba by měla být zahájena pod dohledem lékaře se zkušenostmi s léčbou vzácných krvácivých poruch. Vrozený nedostatek podjednotky A faktoru XIII by měl být potvrzen příslušnými diagnostickými postupy zahrnujícími stanovení aktivity faktoru XIII a imunologický test, a pokud je to vhodné, genotypizaci.
Dávkování
Účinnost tohoto léčivého přípravku je vyjádřena v mezinárodních jednotkách (IU).
Ačkoliv je dávkování vyjádřeno ve stejných jednotkách (IU), liší se dávkování přípravku NovoThirteen od dávkovacího schématu ostatních přípravků obsahujících FXIII (viz bod 4.4.).
Doporučená dávka je 35 IU/kg tělesné hmotnosti (TH) jednou měsíčně (každých 28 dnů +/- 2 dny), podaná intravenózní bolusovou injekcí.
Na základě aktuální koncentrace přípravku NovoThirteen lze objem dávky (v mililitrech) určený pro podání pacientům s tělesnou hmotností alespoň 24 kg vypočítat z následujícího vzorce:
Objem dávky v ml = 0,042 x TH pacienta (kg)
Lékař může zvažovat nutnou úpravu dávky v určitých situacích, kdy doporučená dávka 35 IU/kg/měsíc není dostatečná k prevenci krvácení. Tato úprava dávky by měla být založena na hladinách aktivity FXIII.
Doporučuje se sledovat hladiny aktivity přípravku NovoThirteen pomocí standardního testování aktivity FXIII.
Pediatrická populace
Při podávání přípravku NovoThirteen pediatrickým pacientům není nutná úprava dávky. Platí, že má být použita dávka 35 IU/kg tělesné hmotnosti (viz bod 5.2 „Pediatrická populace“).
Pokud však je pacientova tělesná hmotnost nižší než 24 kg, má být při stanovení dávky malým dětem rekonstituovaný přípravek NovoThirteen naředěn 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 % (viz bod 6.6 „Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním -použití u pediatrické populace“).
Objem dávky rekonstituovaného přípravku NovoThirteen, naředěného 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %, lze vypočítat podle následujícího vzorce:
Objem dávky v ml = 0,117* x tělesná hmotnost v kilogramech.
*Výpočet korekčního faktoru 0,117 je vztažen na přesné množství přípravku, nikoliv na jeho deklarované množství.
Současně dostupné údaje jsou uvedeny v bodech 4.8, 5.1 a 5.2.
Způsob podání
Po rekonstituci je třeba přípravek podávat samostatně a nikoliv smísený s infuzními roztoky či v infuzi.
Přípravek by měl být podáván v pomalé bolusové intravenózní injekci rychlostí nepřekračující 2 ml/minutu.
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
U pacientů s nedostatkem FXIII není přípravek NovoThirteen účinný při použití k měsíční profylaktické léčbě krvácení u pacientů s vrozeným nedostatkem podjednotky B FXIII. Nedostatek podjednotky B FXIII je spojený s mnohem kratším poločasem podávané farmakologicky aktivní podjednotky A. Nedostatek podjednotky by měl být u pacientů stanoven ještě před léčbou příslušnými diagnostickými postupy zahrnujícími stanovení aktivity faktoru XIII a imunologický test a, pokud je to vhodné, genotypizaci.
Symptomatická (on demand) léčba akutního krvácení nebo krvácení mezi jednotlivými infuzemi přípravku NovoThirteen nebyla v klinických studiích zkoumána. V takových situacích je nutno zvažovat alternativní léčbu.
Vzhledem k tomu, že se dávkování a koncentrace FXIII v přípravku NovoThirteen liší od dávkování a koncentrace jiných přípravků obsahujících FXIII, je nutno při výpočtu vhodné dávky u jednotlivých pacientů dbát opatrnosti (viz vzorec pro výpočet dávky v bodě 4.2.).
Protože přípravek NovoThirteen obsahuje rekombinantní protein, může způsobovat alergické reakce včetně anafylaktických reakcí. Pacienti musí být informováni o časných příznacích reakcí přecitlivělosti (zahrnujících kopřivku, generalizovanou kopřivku, tlak na prsou, sípot, hypotenzi) a anafylaxe. V případě alergické nebo anafylaktické reakce je třeba podávání přípravku okamžitě přerušit a v další léčbě přípravkem NovoThirteen nepokračovat.
Vznik inhibitorů
V klinických studiích nebyla zjištěna tvorba inhibitorů na léčbu přípravkem NovoThirteen. Přítomnost inhibitorů lze očekávat v případě nedostatečné terapeutické odpovědi, která se projevuje jako krvácení, nebo po získání laboratorních nálezů zahrnujících aktivitu FXIII, která nedosahuje očekávaných úrovní. V případě podezření na inhibitory je potřeba provést testy na protilátky.
Pacienti s potvrzenými neutralizujícími protilátkami proti FXIII nesmí být léčeni přípravkem NovoThirteen bez přísného sledování.
Riziko trombózy:
S rekonstituovaným přípravkem je třeba zacházet v souladu s informacemi uvedenými v bodě 6.3. Je třeba zabránit nesprávnému uchovávání přípravku po rekonstituci, jelikož by mohlo dojít ke ztrátě sterility a zvýšení hladin aktivovaného přípravku NovoThirteen. Zvýšené hladiny aktivovaného přípravku NovoThirteen mohou zvýšit riziko trombózy.
V případě predispozice k onemocnění trombózou je třeba dbát opatrnosti kvůli stabilizujícímu účinku přípravku NovoThirteen na fibrin. Může dojít ke stabilizaci trombu, což zvyšuje riziko okluze cév.
Pacienti s poškozením jater nebyli sledováni. Přípravek NovoThirteen nemusí být účinný u pacientů s poškozením jater, pokud je toto poškození dostatečně závažné, aby vedlo ke snížení hladin podjednotek B FXIII. U pacientů se závažným poškozením jater je potřeba sledovat úrovně aktivity FXIII.
Existuje omezená klinická zkušenost s podáváním přípravku NovoThirteen starším pacientům s vrozeným nedostatkem FXIII.
Pacienti s renální insuficiencí vyžadující dialýzu nebyli v klinických studiích sledováni.
Léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekční lahvičku. To znamená, že je v podstatě sodíku prostý.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nejsou k dispozici žádné klinické údaje o interakci mezi přípravkem NovoThirteen a jinými léčivými přípravky.
Na základě neklinické studie (viz bod 5.3) se nedoporučuje kombinovat přípravek NovoThirteen a rFVIIa.
4.6 Fertilita, těhotenství a kojení
Klinické údaje o podávání přípravku NovoThirteen těhotným ženám nejsou k dispozici. Studie reprodukční toxicity na zvířatech jsou nedostatečné (viz bod 5.3), jelikož přípravek NovoThirteen nebyl testován na březích zvířatech. Riziko pro člověka není známo. S ohledem na terapeutickou potřebu lze však použití přípravku NovoThirteen jako substituční terapie během těhotenství zvážit.
Kojení
Není známo, zda se rFXIII vylučuje do lidského mateřského mléka. Vylučování léčivé látky rFXIII do mléka nebylo studováno na zvířatech. Při rozhodování zda pokračovat/přerušit kojení či zda pokračovat/přerušit léčbu přípravkem NovoThirteen by měl být vzat v úvahu přínos kojení pro dítě a přínos léčby přípravkem NovoThirteen pro matku.
Fertilita
V neklinických studiích nebyl pozorován účinek na reprodukční orgány. Nejsou známy žádné údaje o možném účinku na fertilitu u člověka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek NovoThirteen nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
V klinických studiích byl přípravek NovoThirteen podáván 56 pacientům s vrozeným nedostatkem podjednotky A faktoru XIII (1 043 podání přípravku NovoThirteen). 15 pacientů bylo ve věku od 6 let do méně než 18 let a 6 pacientů bylo mladších 6 let (celkem byl přípravek NovoThirteen u pediatrických pacientů (do 18 let) použit k 393 podáním).
Jako nejčastější nežádoucí účinek je uváděna bolest hlavy, která byla hlášena u 34 % pacientů.
Souhrn nežádoucích účinků v tabulce
Frekvence výskytu všech nežádoucích účinků zjištěných u 51 pacientů s vrozeným nedostatkem FXIII exponovaných v klinických studiích jsou uvedeny v následující tabulce podle tříd orgánových systémů.
Frekvence výskytu jsou definovány podle následující konvence: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit). V rámci každé skupiny frekvence výskytu jsou nežádoucí účinky uvedeny v pořadí klesající závažnosti.
|
Poruchy krve a lymfatického systému Časté (>1/100 až <1/10) |
Leukopenie a zhoršená neutropenie |
|
Poruchy nervového systému Časté (>1/100 až <1/10) | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Časté (>1/100 až <1/10) |
Bolesti končetin |
|
Celkové poruchy a reakce v místě aplikace Časté (>1/100 až <1/10) |
Bolest v místě vpichu |
|
Vyšetření Časté (>1/100 až <1/10) |
Neneutralizující protilátky |
Časté (>1/100 až <1/10)
Fibrinové D-dimery zvýšeny
Popis vybraných nežádoucích účinků
U jednoho pacienta s dříve známou neutropenií došlo během léčby přípravkem NovoThirteen k mírnému zhoršení neutropenie a leukopenie. Následné přerušení podávání přípravku NovoThirteen navrátilo množství neutrofilů u tohoto pacienta na podobnou úroveň jako před léčbou tímto přípravkem.
Neneutralizující protilátky byly pozorovány u 4 z 56 exponovaných pacientů s vrozeným nedostatkem FXIII. Čtyři nežádoucí účinky spojené s neneutralizujícími protilátkami se projevily u pacientů do 18 let (věk 8 let, 8 let, 14 let a 16 let). Tyto protilátky byly pozorovány na začátku léčby přípravkem NovoThirteen. Všichni 4 pacienti dostali alespoň 2 dávky přípravku NovoThirteen. 3 z těchto pacientů byli ze studie vyřazeni a pokračovali ve své původní léčbě. Jeden pacient pokračoval v léčbě rFXIII a hladina protilátek u něj poklesla pod detekční limit. Protilátky neměly žádný inhibiční účinek a u pacientů nedošlo v souvislosti s těmito protilátkami k žádným nežádoucím účinkům či krvácení. Výskyt těchto protilátek byl u všech pacientů přechodný.
U jednoho zdravého subjektu došlo po podání první dávky přípravku NovoThirteen k vytvoření nízkého titru přechodných neneutralizujících protilátek. Protilátky neměly žádnou inhibiční aktivitu a u subjektu nedošlo v souvislosti s těmito protilátkami k žádným nežádoucím účinkům ani ke krvácení. Protilátky během 6měsíčního sledování zmizely.
V poregistrační studii bezpečnosti byl u dětí s dědičným nedostatkem faktoru XIII po několika letech léčby přípravkem NovoThirteen pozorován přechodný výskyt non-neutralizujících protilátek. S těmito protilátkami nebyly spojeny žádné klinické nálezy.
Pediatrická populace
V klinických studiích byly nežádoucí účinky častěji hlášeny u pacientů od 6 let avšak mladších 18 let než u dospělých. 4 pacienti (25 %) ve věku mezi 6 až 18 roky měli závažné nežádoucí účinky oproti 3 pacientům (8,5 %) nad 18 let, kteří byli postiženi závažnými nežádoucími účinky. Ve čtyřech případech byly na počátku léčby hlášeny non-neutralizující protilátky u pacientů ve věku od 6 do
18 let. 3 z těchto pacientů byli ze studie vyřazeni z důvodů nežádoucích účinků.
U pacientů ve věku do 6 let nebyly hlášeny ani protilátky proti rFXIII, ani tromboembolické nežádoucí příhody či další problémy s bezpečností.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V hlášených případech předávkování přípravkem NovoThirteen (až 2,3násobek dávky) nebyly pozorovány žádné klinické příznaky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antikoagulancia, koagulační faktor XIII, ATC kód: B02BD11. Mechanismus účinku
V plazmě cirkuluje FXIII jako heterotetramer [A2B2] složený ze 2 podjednotek A FXIII a 2 podjednotek B FXIII vázaných mezi sebou silnými nekovalentními vazbami. Podjednotka B FXIII působí v oběhu jako nosičová molekula podjednotky A FXIII a je přítomná v plazmě v nadbytku. Když se podjednotka A FXIII naváže na podjednotku B FXIII [A2B2], poločas podjednotky A FXIII [A2] se prodlouží. FXIII je proenzym (protransglutamináza), který je aktivovaný trombinem za přítomnosti iontů Ca2+. Enzymatickou aktivitu nese podjednotka A FXIII. Po aktivaci se podjednotka A FXIII oddělí od podjednotky B FXIII, a tím se odkryje aktivní místo podjednotky A FXIII. Aktivní transglutamináza příčně naváže fibrin a další proteiny, což vede ke zvýšení mechanické pevnosti a odolnosti vůči fibrinolýze fibrinové sraženiny a přispívá ke zlepšení adheze destiček a sraženiny k poškozené tkáni.
Přípravek NovoThirteen je podjednotka A rekombinantního koagulačního faktoru XIII, která je vyrobená rekombinantní DNA technologií v kvasinkách (Saccharomyces cerevisiae). Je strukturálně shodná s lidskou podjednotkou A FXIII [A2]. Přípravek NovoThirteen (podjednotka A) se váže na volnou lidskou podjednotku B FXIII, čímž vznikne heterotetramer [rA2B2] s podobným poločasem, jaký má endogenní [A2B2].
Farmakodynamické účinky
V současnosti neexistují metody, které by mohly posloužit ke kvantitativnímu zhodnocení farmakodynamiky FXIII in vivo. Výsledky běžných koagulačních testů jsou normální, jelikož je ovlivněna kvalita sraženiny. Testování rozpustnosti sraženiny má široké použití jako indikátor nedostatku FXIII; toto testování je však kvalitativní, a pokud je provedeno správně, je test pozitivní pouze tehdy, je-li aktivita FXIII ve vzorku blízká nule.
Přípravek NovoThirteen vykazuje stejné farmakodynamické vlastnosti v plazmě jako endogenní FXIII.
Klinická účinnost a bezpečnost
Byla provedena pilotní prospektivní, otevřená, jednoramenná studie fáze 3 (F13CD-1725) zahrnující 41 pacientů s nedostatkem podjednotky A FXIII, mající za úkol zjistit hemostatickou účinnost rFXIII u pacientů s vrozeným nedostatkem FXIII, tak jak ji odráží frekvence krvácivých příhod vyžadujících léčbu přípravkem obsahujícím FXIII. Použité dávkovací schéma bylo 35 IU/kg/měsíc (každých 28 dnů+/-2 dny). Ve studii bylo u čtyř pacientů během léčby pomocí rFXIII pozorováno pět krvácivých příhod vyžadujících léčbu přípravkem obsahujícím FXIII.
Průměrný počet krvácení vyžadujících léčbu byl stanoven na 0,151 na pacienta/rok. V analýze primárních cílových parametrů, zahrnující zkoumané období, byla frekvence výskytu u 41 pacientů upravená podle věku (počet na pacienta/rok) pro krvácení vyžadující léčbu během léčby rFXIII 0,053/rok (95% CI: 0,010 - 0,272; stanoveno na základě modelu odpovídajícího průměrnému věku testované populace 26,4 let).
Pediatrická populace
Analýzy dat pediatrických pacientů zahrnutých do klinických studií neprokázaly rozdíly v odezvě na léčbu související s věkem.
Patnáct dětí ve věku od 6 let do méně než 18 let a šest dětí mladších 6 let bylo léčeno přípravkem NovoThirteen při celkem 393 podáních.
Děti ve věku nad 6 let byly sledovány v pivotní klinické studii fáze 3 (F13CD-1725) a v dále probíhající rozšířené studii (F13CD-3720), jež hodnotila bezpečnost substituční léčby přípravkem NovoThirteen podávaným jednou měsíčně.
Šest pacientů mladších 6 let bylo sledováno ve farmakokinetické studii fáze 3b (F13CD-3760) s podáním jednorázové dávky. Poté byli zahrnuti do dále probíhající dlouhodobé follow-up studie (F13CD-3835) hodnotící bezpečnost a účinnost substituční léčby přípravkem NovoThirteen podávaným jednou měsíčně. Během 8,7 let kumulativního dalšího sledování nebyly u pacientů mladších 6 let (při celkovém počtu dávek 116) zaznamenány žádné krvácivé příhody vyžadující léčbu. Navrhovaná dávka 35 IU/kg se ukázala jako vhodná k poskytnutí hemostatického pokrytí u této mladé populace.
5.2 Farmakokinetické vlastnosti
Na základě aktivity FXIII změřené Berichromovým testem pro 471 měsíčních dávek rFXIII byl u pacientů s vrozeným nedostatkem FXIII odhadovaný poločas rFXIII 11,8 dne. To je v souladu s eliminační farmakokinetikou odhadovanou z klinické farmakologické studie u zdravých subjektů, která stanovila poločas na 11,8 dne. V této studii byl průměrný distribuční objem v ustáleném stavu 47 ml/kg, průměrná doba výskytu 15,5 dne a průměrná clearance 0,13 ml/kg.
Pediatrická populace
Ve farmakokinetické studii u 6 dětí (ve věku od 1 roku do méně než 6 let) s vrozeným nedostatkem podjednotky A faktoru XIII byla intravenózně podána jednorázová dávka 35 IU/kg přípravku NovoThirteen. Průměrný ti/2 faktoru XIII byl přibližně 15 dní (rozmezí 10 až 25 dní). Průměrná clearance u dětí v této studii byla 0,15 ml/h/kg.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě farmakologických studií bezpečnosti a toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka. Všechna zjištění v programu neklinické bezpečnosti se vztahovala k očekávané nadměrně zvýšené farmakologii (povšechná trombóza, ischemická nekróza a konečná úmrtnost) rFXIII a neproteolyticky aktivovaného rekombinantního FXIII při hladinách dávek přesahujících (>48krát) maximální doporučenou klinickou dávku 35 IU/kg.
Možný synergický účinek kombinované léčby rFXIII a rFVIIa na pokročilém kardiovaskulárním modelu u opice makaka jávského vedl k neadekvátně silné farmakologické reakci (trombóze a úmrtí) při nižší dávce než při podávání samostatných složek.
Nebyly provedeny studie reprodukční ani vývojové toxicity u zvířat. U studií toxicity po opakovaném podávání nebyly zaznamenány žádné účinky na reprodukční orgány.
Genotoxický potenciál ani karcinogenita nebyly studovány, jelikož rFXIII je endogenní protein.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Chlorid sodný Sacharóza Polysorbát 20 L-histidin
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
Rozpouštědlo:
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Přípravek musí být použit okamžitě po rekonstituci z důvodu rizika mikrobiologické kontaminace.
6.4 Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2°C - 8°C).
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Chraňte před mrazem.
Podmínky uchovávání rekonstituovaného léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Prášek (2 500 IU) v injekční lahvičce (sklo typu 1) s pryžovou zátkou (chlorobutyl) a 3,2 ml rozpouštědla v injekční lahvičce (sklo typu 1) s pryžovou zátkou (bromobutyl) a adaptér na injekční lahvičku pro rekonstituci.
Velikost balení: po jedné injekční lahvičce s práškem, jedné injekční lahvičce s rozpouštědlem a jednom adaptéru.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Instrukce pro použití přípravku NovoThirteen
K rekonstituci a podání tohoto přípravku je zapotřebí následující vybavení: 10ml injekční stříkačka nebo injekční stříkačka vhodné velikosti odpovídající injekčnímu objemu, alkoholové tampony, přibalený adaptér na injekční lahvičku a infuzní souprava (hadička, motýlková jehla).
Příprava roztoku
Vždy používejte aseptickou techniku. Než začnete, umyjte si ruce. Zahřejte injekční lahvičky s práškem a rozpouštědlem na teplotu nepřevyšující 25°C držením lahviček v ruce. Očistěte pryžové zátky na injekčních lahvičkách alkoholovými tampony a nechejte je před použitím oschnout.
Přípravek se rekonstituuje pomocí přibaleného adaptéru na injekční lahvičku.
Připojte adaptér injekční lahvičky k lahvičce s rozpouštědlem (voda na injekci). Dávejte pozor, abyste se nedotkl(a) hrotu na adaptéru injekční lahvičky.
Natáhněte vzduch do stříkačky vytažením pístu v množství, které odpovídá celkovému množství rozpouštědla v injekční lahvičce s rozpouštědlem.
Našroubujte pevně injekční stříkačku na adaptér na injekční lahvičce s rozpouštědlem. Stlačením pístu vytlačte vzduch do injekční lahvičky, dokud nepocítíte zřetelný odpor.
Držte stříkačku s injekční lahvičkou s rozpouštědlem dnem vzhůru. Vytažením pístu natáhněte rozpouštědlo do injekční stříkačky.
Nakloněním injekční stříkačky s adaptérem odstraňte prázdnou injekční lahvičku.
Nasaďte adaptér, který je stále připojen k injekční stříkačce, na injekční lahvičku s práškem. Pomalým stisknutím pístu vstříkněte rozpouštědlo do injekční lahvičky s práškem. Ujistěte se, že proud rozpouštědla nesměřuje přímo na prášek. Mohlo by to způsobit napěnění.
Jemným kroužením injekční lahvičkou rozpusťte všechen prášek. Injekční lahvičkou netřepejte, mohlo by to způsobit napěnění. NovoThirteen musí být před aplikací vizuálně zkontrolován, zda neobsahuje jakékoliv cizorodé částečky hmoty nebo zda není zabarven.
Pokud toto zaznamenáte, roztok nepoužívejte.
Rekonstituovaný přípravek NovoThirteen je čirý bezbarvý roztok.
Pokud je zapotřebí větší dávky, opakujte postup v samostatné injekční stříkačce, dokud nebude k dispozici požadovaná dávka.
Pokud je pacientova tělesná hmotnost nižší než 24 kg, má být rekonstituovaný přípravek NovoThirteen naředěn 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 % (další instrukce k naředění viz bod Použití u pediatrické populace).
Důležité upozornění
Jakmile je přípravek NovoThirteen připraven k injekci, musí být okamžitě použit.
Aplikace roztoku
Před otočením stříkačky dnem vzhůru se ujistěte, že je píst zcela zatlačený dovnitř (píst může být tlakem v injekční lahvičce vytlačen ven). Držte stříkačku s injekční lahvičkou dnem vzhůru a vytažením pístu natáhněte množství vypočítané pro injekci.
Odšroubujte adaptér s injekční lahvičkou.
Přípravek je nyní připraven k injekci.
Injekční stříkačku, adaptér na injekční lahvičku, infuzní soupravu a injekční lahvičky bezpečně zlikvidujte. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Použití u pediatrické populace
Naředění rekonstituovaného přípravku injekčním roztokem chloridu sodného o koncentraci 0,9 %
Pokud je pacientova tělesná hmotnost nižší než 24 kg, musí být rekonstituovaný přípravek NovoThirteen naředěn 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %. To umožní podání dávky malým dětem (viz bod 4.2 „Dávkování a způsob podání - Pediatrická populace“).
K naředění rekonstituovaného přípravku NovoThirteen je zapotřebí následující vybavení: injekční lahvička obsahující injekční roztok chloridu sodného o koncentraci 0,9 %, 10ml injekční stříkačka a alkoholové tampony.
Návod k naředění
Při naředění je třeba dodržovat aseptické postupy.
Do 10ml injekční stříkačky opatrně natáhněte přesně 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %.
Do injekční lahvičky s rekonstituovaným přípravkem NovoThirteen pomalu vstříkněte 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %.
Jemným kroužením injekční lahvičkou roztok promíchejte.
Naředěný roztok je čirý a bezbarvý. Roztok zkontrolujte, zda neobsahuje pevné částice či zda není zabarvený. Pokud ano, zlikvidujte jej.
Po naředění přejděte ke kroku „Aplikace roztoku“.
Všechen zbylý naředěný přípravek musí být okamžitě zlikvidován.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
8. REGISTRAČNÍ ČÍSLO
EU/1/12/775/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 3. září 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu/.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
Novo Nordisk A/S Hagedornsvej 1 DK-2820 Gentofte Dánsko
Název a adresa výrobce odpovědného za propouštění šarží
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ TOHOTO LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo během 60 dní z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
• Další opatření k minimalizaci rizik
Držitel rozhodnutí o registraci musí zajistit, aby všichni lékaři, u nichž se předpokládá, že přípravek NovoThirteen budou předepisovat či předepisují, obdrželi při uvádění přípravku na trh informativní dopis spolu s edukačním balíčkem, který bude obsahovat:
1. Brožurku pro lékaře
2. Brožurku pro pacienta
Oba dokumenty jsou určeny k použití jako součást edukačního plánu, který má minimalizovat riziko chyb v medikaci, riziko tromboembolických příhod v důsledku zvýšených hladin neproteolyticky aktivovaného rFXIII v souvislosti s nesprávným uchováváním a riziko léčby mimořádného krvácení mimo schválené indikace. Držitel rozhodnutí o registraci musí zajistit harmonizaci terminologie používané v brožurkách a v informacích o přípravku.
Brožurka pro lékaře musí obsahovat následující klíčové údaje a body:
• indikaci přípravku
• riziko použití mimo schválené indikace v rámci vrozeného nedostatku FXIII
• příslušné diagnostické postupy pro potvrzení nedostatku podjednotky A FXIII
• upozornění na rozdíl v dávkování a koncentraci mezi přípravkem NovoThirteen a ostatními přípravky obsahujícími FXIII (Doporučená dávka přípravku NovoThirteen je 35 IU/kg tělesné hmotnosti (TH) jednou měsíčně, podávaná jako intravenózní bolusová injekce. Objem dávky v mililitrech má být vypočítán na základě tělesné hmotnosti každého pacienta za použití následujícího vzorce: objem dávky v ml = 0,042 x TH pacienta (kg), pokud je tělesná hmotnost >24 kg nebo objem dávky v ml = 0,117 x TH pacienta (kg), pokud je tělesná hmotnost
<24 kg)).
• informaci o správném zacházení a rizicích spojených se zacházením nesprávným
• embolické a tromboembolické příhody včetně zvýšeného rizika okluze cév u pacientů s rizikem trombózy
• co dělat v případě nesprávného uchovávání, trombózy nebo embolie
• kontraindikace v případě přecitlivělosti
• varování a opatření v případě anafylaxe
• důležitost shromažďovaní dat o bezpečnosti a způsob, jak zaznamenávat pacienty v PASS a dalších registrech
• distribuci a používání brožurek pro pacienty a nutnost zajistit, aby pacient brožurku pročetl a porozuměl jí
• Souhrn údajů o přípravku.
Brožurka pro pacienty by měla být pacientům distribuována předepisujícími lékaři a musí obsahovat následující klíčové údaje a body:
• indikaci přípravku
• riziko použití mimo schválené indikace v rámci vrozeného nedostatku FXIII
• jak přípravek bezpečně uchovávat, jak s ním zacházet a jak ho rekonstituovat a podávat
• rizika spojená s nesprávným uchováváním a zacházením
• jak rozpoznat potenciální nežádoucí účinky (trombóza a embolie)
• co dělat v případě nesprávného uchovávání, trombózy nebo embolie
• Příbalovou informaci.
Držitel rozhodnutí o registraci musí tento edukační plán zavést na národní úrovni, před uvedením přípravku na trh. Konečný obsah, formát a způsob distribuce obou dokumentů musí být odsouhlaseny příslušnou národní agenturou členského státu.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rDNA faktor XIII)
2. OBSAH LÉČIVÉ LÁTKY
Jedna injekční lahvička obsahuje catridecacogum (rekombinantní koagulační faktor XIII) (rDNA) 2 500 IU ve 3 ml, po naředění odpovídá koncentraci 833 IU/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Prášek: chlorid sodný, sacharóza, polysorbát 20, L-histidin, kyselina chlorovodíková (k úpravě pH), hydroxid sodný (k úpravě pH)
Rozpouštědlo: voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok Prášek v injekční lahvičce 2 500 IU,
3,2 ml rozpouštědla v injekční lahvičce,
1 adaptér na injekční lahvičku
5. ZPŮSOB A CESTA PODÁNÍ
Intravenózní podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do
Přípravek musí být použit okamžitě po rekonstituci z důvodu rizika mikrobiologické kontaminace.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce (2°C-8°C).
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
12. REGISTRAČNÍ ČÍSLO
EU/1/12/775/001
13. ČÍSLO ŠARŽE
č.š.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
NovoThirteen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
NovoThirteen 2 500 IU prášek na injekci catridecacogum
Intravenózní podání po rekonstituci
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Použitelné do
4. ČÍSLO ŠARŽE
C.š.
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2 500IU
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Rozpouštědlo pro NovoThirteen
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Použitelné do
4. ČÍSLO ŠARŽE
C.š.
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
3,2 ml vody na injekci
6. JINÉ
Pro rekonstituci
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem
catridecacogum (rekombinantní koagulační faktor XIII)
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek NovoThirteen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek NovoThirteen používat
3. Jak se přípravek NovoThirteen používá
4. Možné nežádoucí účinky
5. Jak přípravek NovoThirteen uchovávat
6. Obsah balení a další informace
1. Co je přípravek NovoThirteen a k čemu se používá Co je přípravek NovoThirteen
Přípravek NovoThirteen obsahuje léčivou látku katridekakog, který je identický s lidským koagulačním faktorem XIII, enzymem nezbytným pro tvorbu krevních sraženin.
K čemu se přípravek NovoThirteen používá
Přípravek NovoThirteen se používá v prevenci krvácení u pacientů, kteří nemají dostatek faktoru XIII. Přípravek NovoThirteen nahrazuje chybějící faktor XIII a vytváří kolem počáteční krevní sraženiny síť, čímž ji pomáhá stabilizovat.
2. Čemu musíte věnovat pozornost, než začnete přípravek NovoThirteen používat Nepoužívejte přípravek NovoThirteen
• jestliže jste alergický(á) na katridekakog nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud si nejste jistý(á), před použitím tohoto přípravku se zeptejte svého lékaře.
Upozornění a opatření
Před použitím přípravku NovoThirteen se poraďte se svým lékařem:
• pokud u vás existuje nebo někdy existovalo vyšší riziko tvorby krevních sraženin (trombózy), jelikož přípravek NovoThirteen může zvyšovat závažnost již existující krevní sraženiny.
• pokud trpíte nebo jste někdy trpěl(a) poškozením jater.
Okamžitě se obraťte na svého lékaře:
• pokud se u vás během léčby přípravkem NovoThirteen projeví krvácení spontánní a/nebo vyžadující léčbu. V tomto případě vám lékař předepíše k léčbě krvácení alternativní lék.
• pokud se u vás projeví alergická reakce na rekombinantní krevní koagulační faktor XIII. Příznaky mohou zahrnovat: kopřivku, svědění, otoky, dýchací potíže, nízký krevní tlak (bledá, chladná pokožka, rychlý srdeční tep), závratě a pocení.
Další léčivé přípravky a přípravek NovoThirteen
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Nedoporučuje se užívat přípravek NovoThirteen společně s rekombinantním koagulačním faktorem VIIa (další faktor srážení krve).
Těhotenství a kojení
Během těhotenství a kojení může být užívání přípravku NovoThirteen nezbytné.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat.
NovoThirteen obsahuje sodík.
Léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekční lahvičku. To znamená, že je v podstatě sodíku prostý.
3. Jak se přípravek NovoThirteen používá
Léčba by měla být zahájena pod dohledem lékaře se zkušenostmi s léčbou vzácných krvácivých poruch.
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Přípravek NovoThirteen se podává jako injekce do žíly. Velikost dávky závisí na vaší tělesné hmotnosti. Obvyklá dávka je 35 IU na každý kilogram tělesné hmotnosti. Injekce se aplikují jednou měsíčně (každých 28 dnů +/- 2 dny).
Na základě koncentrace roztoku přípravku NovoThirteen lze objem dávky určený pro podání (v mililitrech) vypočítat z následujícího vzorce:
Objem dávky v ml = 0,042 x vaše tělesná hmotnost v kg.
Měl(a) byste užívat pouze předepsanou dávku, kterou vypočetl váš lékař pomocí tohoto vzorce, přičemž je nutno vzít v úvahu, že obvyklá dávka a koncentrace přípravku NovoThirteen se liší od dávkování a koncentrace jiných přípravků obsahujících FXIII.
Lékař může dávku upravit, pokud to považuje za nutné.
Použití u malých dětí
Naředění rekonstituovaného přípravku 6 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %
Pokud je přípravek NovoThirteen podáván dítěti, jehož tělesná hmotnost je nižší než 24 kg, musí být rekonstituovaný přípravek NovoThirteen naředěn 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %. To umožní podání dávky malým dětem (více informací viz „Instrukce pro použití přípravku NovoThirteen - Naředění rekonstituovaného přípravku injekčním roztokem chloridu sodného o koncentraci 0,9 %“).
Objem dávky rekonstituovaného přípravku NovoThirteen naředěného 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 % lze vypočítat podle následujícího vzorce:
Objem dávky v ml = 0,117* x tělesná hmotnost v kilogramech.
*Výpočet faktoru 0,117 je vztažen na přesné množství přípravku, nikoliv na jeho deklarované množství.
Rekonstituovaný NovoThirteen musí být podáván rychlostí nepřevyšující 2 ml/minutu.
Více informací, jak připravit injekci, najdete v části ‘Instrukce pro použití přípravku NovoThirteen’. Použití u dětí a dospívajících
U dětí a dospívajících může být NovoThirteen používán stejně jako u dospělých.
Jestliže jste použil(a) více přípravku NovoThirteen, než jste měl(a)
Existují omezené informace o předávkování přípravkem NovoThirteen. Žádný z hlášených případů nevykazoval známky onemocnění. Pokud jste si aplikoval(a) více přípravku NovoThirteen než jste měl(a), obraťte se na svého lékaře.
Jestliže jste zapomněl(a) použít přípravek NovoThirteen
Jestliže jste na injekci přípravku NovoThirteen zapomněl(a), sdělte to svému lékaři. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek NovoThirteen
Pokud přestanete přípravek NovoThirteen užívat, nejste chráněn(a) vůči krvácení. Nepřestávejte používat přípravek NovoThirteen, aniž byste se poradil(a) se svým lékařem. Váš lékař vám vysvětlí, co by se mohlo stát, přestanete-li s léčbou, a probere s vámi další možnosti.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Nežádoucí účinky zahrnují:
Časté:
Postihují až 1 pacienta z 10
• Bolest hlavy (nejčastější nežádoucí účinek)
• Bolest v místě aplikace injekce
• Bolest dolních končetin a paží
• Zvýšené množství malých proteinových fragmentů vzniklých rozrušením krevních sraženin
• Pokles počtu některých typů bílých krvinek. To znamená, že vaše tělo může být náchylnější k infekcím.
• Vznik neneutralizujících protilátek faktoru XIII, jež nemají žádný vliv na účinek léčivé látky. Nežádoucí účinky u dětí
Nežádoucí účinky pozorované u dětí jsou stejné jako nežádoucí účinky pozorované rovněž u dospělých, avšak mohou být u dětí častější než u dospělých.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a vnějším obalu za ‘Použitelné do ’. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněný před světlem.
Jakmile je přípravek NovoThirteen připraven k injekci, musí být okamžitě použit.
Roztok je čirý a bezbarvý. Nepoužívejte tento přípravek, pokud obsahuje částice nebo je po rekonstituci zabarvený.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek NovoThirteen obsahuje
• Léčivou látkou je catridecacogum - katridekakog* (rekombinantní koagulační faktor XIII):
2500 IU/3 ml. Po rekonstituci odpovídá koncentraci 833 IU/ml.
• Dalšími složkami v prášku jsou chlorid sodný, sacharóza, polysorbát 20, L-histidin, kyselina chlorovodíková (k úpravě pH), hydroxid sodný (k úpravě pH). Rozpouštědlo je voda na injekci.
• vyrobený rekombinantní DNA technologií v kvasinkách (Saccharomyces cerevisiae).
Jak přípravek NovoThirteen vypadá a co obsahuje toto balení
NovoThirteen je dodáván jako prášek pro přípravu injekčního roztoku s rozpouštědlem (2 500 IU prášku v injekční lahvičce a 3,2 ml rozpouštědla v injekční lahvičce, s adaptérem na injekční lahvičku).
Velikost balení je po jedné injekční lahvičce s práškem, 1 injekční lahvičce s rozpouštědlem a 1 adaptéru na injekční lahvičku.
Bílý prášek a čiré a bezbarvé rozpouštědlo.
Držitel rozhodnutí o registraci a výrobce
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese: http://www.ema.europa.eu
K rekonstituci a podání tohoto přípravku je zapotřebí následující vybavení: 10ml injekční stříkačka nebo injekční stříkačka vhodné velikosti odpovídající injekčnímu objemu, alkoholové tampony, přibalený adaptér na injekční lahvičku a infuzní souprava (hadička, motýlková jehla).
Injekční lahvička
Injekční lahvička
s rozpouštědlem
s praskem
Plastové vičko (bílé)
Plastové vičko (oranžové)
Pryžová
zátka
Adapter na injekční
lahvičku
Ochranné
Ochranný papír
Pryžová zátka
Tm
Hrot
Příprava roztoku
Vždy používejte aseptickou techniku. Než začnete, umyjte si ruce. Zahřejte injekční lahvičky s práškem a rozpouštědlem na teplotu nepřevyšující 25°C držením lahvičky v ruce tak dlouho, dokud nebude mít stejnou teplotu jako ruka. Sejměte plastová víčka z obou injekčních lahviček. Pokud jsou víčka uvolněná nebo chybí, injekční lahvičky nepoužívejte. Očistěte pryžové zátky na injekčních lahvičkách alkoholovými tampony a nechejte je před použitím oschnout.
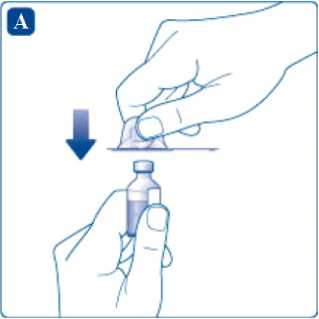
Přípravek se rekonstituuje pomocí přibaleného adaptéru na injekční lahvičku.
Sundejte z adaptéru na injekční lahvičku ochranný papír, avšak adaptér ponechte v obalu (ochranném víčku). Připojte adaptér injekční lahvičky k lahvičce s rozpouštědlem (voda na injekci). Dávejte pozor, abyste se nedotkl(a) hrotu na adaptéru na injekční lahvičku.
Jakmile jej připojíte, odstraňte z adaptéru injekční lahvičky ochranné víčko.
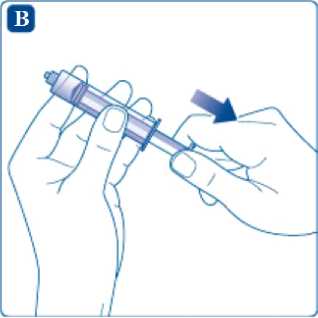
Natáhněte vzduch do stříkačky vytažením pístu, a to v takovém množství, které odpovídá celkovému množství rozpouštědla v injekční lahvičce s rozpouštědlem.
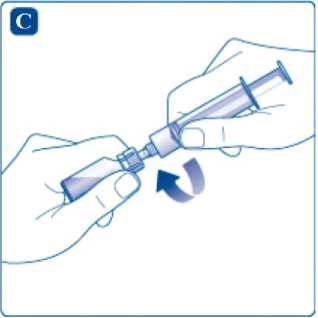
Našroubujte pevně injekční stříkačku na adaptér na injekční lahvičce s rozpouštědlem. Stlačením pístu vytlačte vzduch do injekční lahvičky, dokud nepocítíte zřetelný odpor.
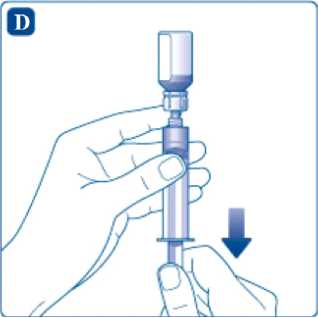
Držte stříkačku s injekční lahvičkou s rozpouštědlem dnem vzhůru. Vytažením pístu natáhněte rozpouštědlo do injekční stříkačky.
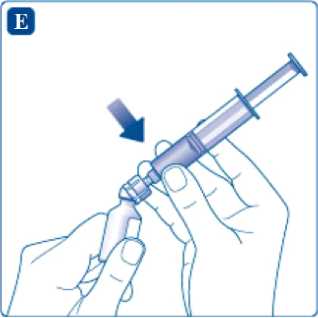
Nakloněním injekční stříkačky s adaptérem odstraňte prázdnou injekční lahvičku.
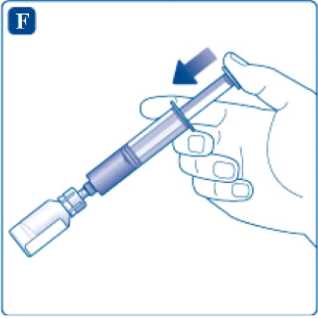
Nasaďte adaptér, který je stále připojen k injekční stříkačce, na injekční lahvičku s práškem. Držte injekční stříkačku lehce nakloněnou s injekční lahvičkou směřující dolů. Pomalým stisknutím pístu vstříkněte rozpouštědlo do injekční lahvičky s práškem. Ujistěte se, že proud rozpouštědla nesměřuje přímo na prášek. Mohlo by to způsobit napěnění.
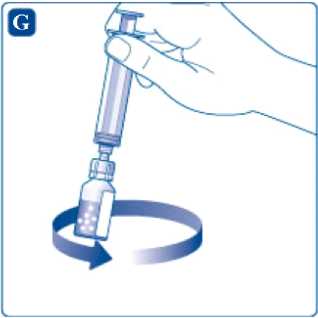
Jemným kroužením injekční lahvičkou rozpusťte všechen prášek. Injekční lahvičkou netřepejte, mohlo by to způsobit napěnění.
NovoThirteen musí být před aplikací vizuálně zkontrolován, zda neobsahuje jakékoliv cizorodé částečky hmoty nebo zda není zabarven. Pokud ano, nepoužívejte ho.
Rekonstituovaný NovoThirteen je čirý bezbarvý roztok.
Pokud je zapotřebí větší dávky, opakujte postup v samostatné injekční stříkačce, dokud nebude k dispozici požadovaná dávka.
Důležité upozornění
Jakmile je přípravek NovoThirteen připraven k injekci, musí být okamžitě použit.
V případě, že je zapotřebí naředit rekonstituovaný přípravek NovoThirteen, postupujte podle návodu v bodě „Naředění rekonstituovaného přípravku injekčním roztokem chloridu sodného o koncentraci
0,9 %“
Aplikace roztoku
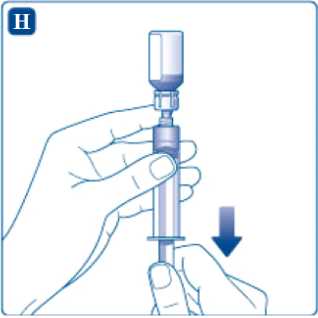
Před otočením stříkačky dnem vzhůru se ujistěte, že je píst zcela zatlačený dovnitř (píst může být tlakem v injekční lahvičce vytlačen ven). Držte stříkačku s injekční lahvičkou dnem vzhůru a vytažením pístu natáhněte množství vypočítané pro injekci.
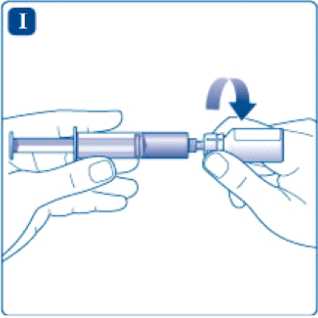
Odšroubujte adaptér s prázdnou injekční lahvičkou.
Přípravek je nyní připraven k injekci do žíly. Dodržujte postup aplikace injekce doporučený vaším lékařem.
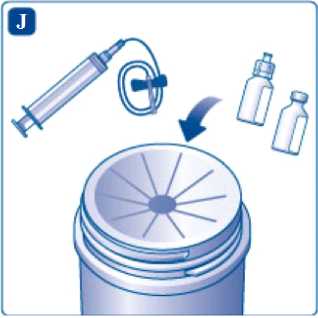
Injekční stříkačku, adaptér na injekční lahvičku, infuzní soupravu a injekční lahvičky bezpečně zlikvidujte. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Naředění rekonstituovaného přípravku injekčním roztokem chloridu sodného o koncentraci 0,9 %
Pokud je nutno naředit rekonstituovaný přípravek NovoThirteen proto, aby mohl být podán dětem, jejichž tělesná hmotnost je nižší než 24 kg, musí být rekonstituovaný přípravek NovoThirteen naředěn 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 % (viz bod 3 „Jak se přípravek NovoThirteen používá - Použití u malých dětí“).
Návod k naředění rekonstituovaného přípravku NovoThirteen
K naředění rekonstituovaného přípravku NovoThirteen je zapotřebí následující vybavení: injekční lahvička obsahující injekční roztok chloridu sodného koncentraci 0,9 %, 10ml injekční stříkačka a alkoholové tampony.
Návod k naředění
Naředění je třeba provádět za dodržení aseptických postupů.
Do 10ml injekční stříkačky opatrně natáhněte přesně 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %.
Do injekční lahvičky s rekonstituovaným přípravkem NovoThirteen pomalu vstříkněte 6,0 ml injekčního roztoku chloridu sodného o koncentraci 0,9 %.
Jemným kroužením injekční lahvičkou roztok promíchejte.
Naředěný roztok je čirý a bezbarvý. Roztok zkontrolujte, zda neobsahuje pevné částice či zda není zabarvený. Pokud ano, zlikvidujte jej.
Po naředění přejděte ke kroku „Aplikace roztoku“.
Všechen zbylý naředěný přípravek musí být okamžitě zlikvidován.
V případě jakýchkoliv otázek požádejte o radu lékaře či zdravotní sestru.
30