Nocdurna 50 Mikrogramů Perorální Lyofilizát
Sp.zn.sukls59607/2015, sukls59609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Nocduma 25 mikrogramů perorální lyofilizát Nocduma 50 mikrogramů perorální lyofilizát
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden perorální lyofilizát obsahuje desmopressini acetas odpovídající desmopressinum 25 nebo 50 mikrogramů.
Úplný seznam pomocných látek viz 6.1.
3. LÉKOVÁ FORMA
Perorální lyofilizát.
Nocdurna 25 mikrogramů:
Bílý, kulatý perorální lyofilizát o průměru přibližně 12 mm, označený na jedné straně 25. Nocdurna 50 mikrogramů:
Bílý, kulatý perorální lyofilizát o průměru přibližně 12 mm, označený na jedné straně 50.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Nocdurna je indikován pro symptomatickou léčbu nykturie v důsledku idiopatické noční polyurie dospělých (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
• Ženy: 25 mikrogramů denně, jednu hodinu před večerním ulehnutím, užívá se sublinguálně bez vody.
• Muži: 50 mikrogramů denně, jednu hodinu před večerním ulehnutím, užívá se sublinguálně bez vody.
Nedoporučuje se zvýšení dávky tohoto přípravku u pacientů > 65 let.
Pokud je v případě nedostatečné léčebné odpovědi na přípravek Nocdurna uvažováno o vyšších dávkách desmopresinu pro pacienty mladší 65 let, měl by být použit jiný přípravek obsahující perorální lyofilizát desmopresinu (viz body 4.4, 4.8 a 5.1)
V případě známek retence vody a/nebo hyponatrémie (bolesti hlavy, nausea/zvracení, přírůstek tělesné hmotnosti, v závažných případech také křeče) je třeba přerušit a přehodnotit léčbu. Při opětném podávání léku je nutné důsledně dodržet restrikci příjmu tekutin a monitorovat sérové koncentrace sodíku (viz bod 4.4).
Přípravek Nocduma by měl být vysazen, pokud dojde k poklesu sérové koncentrace sodíku pod dolní mez normy (tj. 135 mmol/l)
Zvláštní skupiny pacientů
Starší pacienti (65 let a starší)
U starších pacientů užívajících desmopresin je riziko vzniku hyponatrémie vyšší, tito pacienti současně mají často snížené renální funkce. U této věkové skupiny je proto nutná léčba s opatrností, neměly by být podávány denní dávky vyšší než 25 mikrogramů u žen a 50 mikrogramů u mužů a rovněž je třeba, aby natrémei před zahájením léčby byla v normálních mezích, dále je třeba ji zkontrolovat v prvním týdnu terapie (4-8 dnů po zahájení) a opět po 1 měsíci. Přípravek Nocdurna má být vysazen, pokud koncentrace sodíku v séru klesne pod dolní mez normy (viz bod 4.4). Pokračování v terapii musí být pečlivě zváženo u starších pacientů, u nichž se během prvních tří měsíců léčení neprojeví léčebný přínos.
Poškození ledvin
Přípravek Nocdurna je kontraindikován u pacientů se středně těžkou a těžkou renální insuficiencí (viz bod 4.3).
Poškození jater
U pacientů s poškozením jater není nutné provádět úpravy dávky (viz bod 5.2).
Pediatrická populace
V pediatrické populaci není žádné relevantní použití přípravku Nocdurna v indikaci symptomatické léčby nykturie v důsledku idiopatické noční polyurie.
Způsob podání
Přípravek Nocdurna se vloží pod jazyk, kde se rozpustí bez nutnosti pít vodu.
Příjem potravy může snížit intenzitu a trvání antidiuretického účinku při nízkých dávkách desmopresinu (viz bod 5.2)
4.3 Kontraindikace
• Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• Habituální nebo psychogenní polydipsie (vedoucí k tvorbě moče přesahující 40 ml/kg/24 hodin)
• Známá nebo suspektní kardiální insuficience nebo jiné onemocnění spojené s retencí tekutin, kde je nutné užívání diuretik, včetně pozitivní anamnézy těchto onemocnění
• Středně těžká až těžká renální insuficience (clearance kreatininu pod 50 ml/min)
• Známá anamnéza hyponatrémie
• Syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH)
4.4 Zvláštní upozornění a opatření pro použití
Pacienti, zejména starší, by měli před zahájením léčení přípravkem Nocdurna podstoupit klinické vyšetření lékařem, protože noční polyurie může být příznakem kardiovaskulárního nebo jiného onemocnění spojeného s retencí tekutin. Pokud je jakékoli podezření na takové současně přítomné onemocnění, není léčba desmopresinem doporučena (viz také bod 4.3).
Příjem tekutin musí být v době od 1 hodiny před až do 8 hodin po podání omezen na minimum. Léčba bez současného snížení příjmu tekutin může vést k prolongované retenci tekutin a/nebo hyponatrémii s doprovodnými varovnými známkami a příznaky nebo i bez nich (bolest hlavy, nausea/zvracení, přírůstek tělesné hmotnosti a v závažných případech křeče).
Starší pacienti s koncentrací sodíku v dolním rozmezí normálních hodnot mohou mít zvýšené riziko hyponatrémie. U pacientů ve věku 65 let a starších by měla být monitorována sérová koncentrace sodíku před zahájením léčby, v prvním týdnu užívání (4-8 dnů) a poté znovu jeden měsíc po zahájení terapie (viz bod 4.2).
Při dávkování 50 mikrogramů denně mohou mít ženy ve srovnání s muži zvýšené riziko hyponatrémie (viz bod 5.1). Je proto důležité, aby bylo dodrženo doporučené dávkování podle pohlaví.
Přípravek Nocdurna má být vysazen, pokud koncentrace sodíku v séru klesne pod dolní mez normy.
Desmopresin má být podáván s opatrností u pacientů s onemocněními, při nichž dochází k poruchám rovnováhy tekutin a/nebo elektrolytů.
Léčba desmopresinem by měla být přerušena a přehodnocena v průběhu akutního interkurentního onemocnění, které se vyznačuje poruchou rovnováhy tekutin a/nebo elektrolytů (například systémová infekce, horečka nebo gastroenteritis).
Je nutno dodržovat bezpečnostní preventivní opatření k zabránění vzniku hyponatrémie, zejména věnovat zvláštní pozornost omezení příjmu tekutin a zajistit častější monitorování hladiny natrémie v případě současného užívání léků, které mohou indukovat SIADH, např. tricyklická antidepresiva, selektivní inhibitory zpětného vychytávání serotoninu, chlorpromazin, diuretika a karbamazepin, a některá antidiabetika ze skupiny derivátů sulfnonylurey, zejména chlorpropamid, a v případě současné terapie nesteroidními protizánětlivými léky (NSAID).
Zvláštní opatrnosti je třeba u pacientů užívajících thiazidová nebo kličková diuretika v indikaci terapie hypertenze či jiných onemocnění, která nejsou spojena s přetížením tekutinami. Monitorování hladiny sodíku je u těchto pacientů nutné. Před zahájením léčby je třeba zvážit případy těžké dysfunkce močového měchýře a poruchy vyprazdňování močového měchýře způsobené obstrukcí.
Zvláštní opatrnost je nutná při cystické fibróze, ischemické chorobě srdeční, hypertenzi, chronickém onemocnění ledvin a preeklampsii.
Pokud nedojde po zahájení léčby desmopresinem ke snížení noční produkce moči, je třeba zvážit diagnózu nefrogenního diabetu insipidu.
Zvláštní opatrnosti je třeba u pacientů užívajících lithium, protože při podávání desmopresinu k terapii nykturie může dojít k zamaskování vzniku časného stadia nefrogenního diabetu insipidu indukovaného lithiem. Desmopresin se nedoporučuje podávat u pacientů, u nichž je podezření na přítomnost lithiem indukovaného nefrogenního diabetu insipidu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Farmakodynamické interakce
Látky, o nichž je známo, že indukují SIADH, mohou zvýšit riziko retence vody/hyponatrémie (např. tricyklická antidepresiva, selektivní inhibitory zpětného vychytávání serotoninu, chlorpromazin, diuretika a karbamazepin, a také některá antidiabetika ze skupiny derivátů sulfnonylurey, zejména chlorpropamid). (viz bod 4.4).
NSAID a oxytocin mohou zesílit antidiuretický účinek desmopresinu a mohou vést k retenci vody/hyponatrémii (viz bod 4.4).
Lithium může snížit antidiuretický účinek.
Farmakokinetické interakce
Současné léčení loperamidem může vést k trojnásobnému zvýšení plasmatických koncentrací desmopresinu po perorálním podání, což může vést ke zvýšení rizika retence vody/vzniku hyponatrémie. I když nebyl proveden formální výzkum, mohou mít stejný účinek léky zpomalující střevní transport.
Standardizované jídlo obsahující 27 % tuků vedlo k významnému zpomalení vstřebávání tablet desmopresinu (rychlosti a množství). Nebyl pozorován žádný významný účinek na farmakodynamiku (tvorba moče nebo osmolalita).
Příjem potravy může snížit intenzitu a trvání antidiuretického účinku při užívání nízkých perorálních dávek tablet desmopresinu.
4.6 Fertilita, těhotenství a kojení
Při podávání těhotným ženám je třeba postupovat s opatrností.
Výsledky získané u omezeného počtu (n = 53) exponovaných těhotenství u žen s diabetes insipidus a také výsledky získané u omezeného počtu exponovaných těhotenství u žen s krvácivými komplikacemi (n=216) nesvědčí pro nežádoucí účinky desmopresinu na těhotenství nebo na zdraví plodu/novorozeného dítěte. V současné době nejsou dostupné žádné jiné relevantní epidemiologické údaje. Studie na zvířatech nesvědčí pro žádný přímý nebo nepřímý škodlivý účinek ve vztahu k těhotenství, vývoji embrya/plodu, porodu nebo poporodnímu vývoji.
Reprodukční studie u zvířat nezjistily žádné klinicky relevantní účinky na rodiče nebo potomky. Analýzy in vitro provedené v modelu humánního zárodečného listu ukázaly, že nedochází k transplancentálnímu přenosu desmopresinu při jeho podání v terapeutických koncentracích odpovídajících doporučené dávce.
Kojení
Výsledky chemických analýz mateřského mléka kojících matek léčených vysokými dávkami desmopresin-acetátu (300 mikrogramů intranazálně) ukazují, že množství desmopresinu, která mohou být přenesena na dítě, jsou podstatně nižší než množství potřebná k ovlivnění diurézy. Není proto nutné ukončit kojení.
Fertilita
Studie desmopresinu u zvířat nezjistily žádné poškození fertility u samců a samic potkanů.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Nocdurna nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Shrnutí profilu bezpečnosti
Podle frekvence výskytu nežádoucích lékových reakcí popsaných v klinických studiích s přípravkem Nocduma v indikaci nykturie u mužů (50 mikrogramů; N=222) a žen (25 mikrogramů; N=219) byly nejčastěji hlášeny sucho v ústech (13 %), bolest hlavy (3 %), hyponatrémie (3 %) a závratě (2 %).
Popis vybraných nežádoucích reakcí:
Nejzávažnější nežádoucí účinky léčby desmopresinem je hyponatrémie, která je spojena s bolestí hlavy, nauseou, zvracením, sníženou koncentrací sodíku v séru, přírůstkem tělesné hmotnosti, ,malátností, bolestmi břicha, svalovými křečemi, závratěmi, zmateností, poruchami vědomí a v závažných případech křečemi a kómatem. Hyponatrémie je důsledkem antidiuretického působení, vzniká zvýšeným zpětným vstřebáváním vody v renálních tubulech a osmotickým naředěním krevní plasmy. Ve studiích léčby nykturie u dospělých byla většina případů hyponatrémie zaznamenána v prvních dnech podávání desmopresinu nebo v souvislosti se zvýšením dávky. Zvláštní pozornost je třeba věnovat preventivním opatřením popsaným v bodu 4.4.
Ženy mají vyšší riziko hyponatrémie, což může být důsledkem zvýšené vnímavosti renálních tubulů vůči vazopresinu a jeho analogům ve srovnání s muži. Toto riziko je minimalizováno doporučením nižší dávky u žen. Riziko hyponatrémie u pacientů starších než 65 let dále snižuje doporučení monitorovat natrémii v této věkové skupině (viz body 4.2 a 4.4).
Tabulka uvádějící seznam nežádoucích reakcí
Níže uvedená tabulka ukazuje hlášené frekvence výskytu nežádoucích účinků. Uvedené frekvence jsou definovány následovně: velmi časté (>1/10), časté (>1/100 až <1/10) a méně časté (>1/1,000 až <1/100).
Tabulka 1: Frekvence hlášených nežádoucích účinků (studie fáze III a postmarketingová sdělení)
|
Vyjadřování frekvence podle MedDRA |
Velmi časté (> 1/10) |
Časté (> 1/100 až < 1/10) |
Málo časté (> 1/1 000 až < 1/100) |
|
Poruchy metabolismu a výživy |
Hyponatrémie | ||
|
Poruchy nervového systému |
Bolesti hlavy Závratě | ||
|
Gastrointestinální poruchy |
Sucho v ústech* |
Nausea |
Zácpa Abdominální dyskomfort |
|
Celkové poruchy a reakce v místě aplikace |
Únava Periferní otoky |
*Je třeba uvést, že v některých klinických studiích byly subjekty specificky dotazovány na sucho ústech.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky:
Předávkování přípravku Nocdurna vede k déletrvajícímu účinku se zvýšeným rizikem retence vody a vzniku hyponatrémie.
Léčba:
Léčba hyponatrémie je vždy vedena individuálně. Je nutné přerušit podávání desmopresinu, omezit příjem tekutin a v případě potřeby zahájit symptomatickou terapii.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Vasopresin a analoga.
ATC kód: H01B A02
Mechanismus účinku
Přípravek Nocdurna obsahuje desmopresin, syntetický derivát přirozeně se vyskytujícího antidiuretického hormonu arginin- vasopresinu (AVP). Desmopresin napodobuje antidiuretický účinek vasopresinu vazbou na V2 receptory v renálních sběrných tubulech ledvin, kde vede k zpětnému vstřebávání vody do těla. Toto zpětné vstřebávání se projeví snížením tvorby moče v průběhu noci. Vzhledem k navrženým nízkým dávkám specifickým podle pohlaví (25 mikrogramů pro ženy a 50 mikrogramů pro muže) a omezené době trvání účinku přípravku Nocdurna se antidiuretická aktivita omezuje na období nočního spánku.
Farmakodynamické účinky
V studii CS29 byla korigovaná dávka přípravku Nocdurna v závislosti na tělesné hmotnosti, která indukovala 50 % maximálně dosažitelného účinku léku na objem noční moče, významně odlišná pro ženy a muže. Aby bylo dosaženo identického dynamického účinku, byl odhad hodnoty expozice pro muže byl 2,7 krát (95% CI: 1,3-8,1) vyšší než pro ženy, což odpovídá vyšší vnímavosti žen vůči desmopresinu. Rozvoj hyponatrémie je závislý na dávce. Ženy mají vyšší riziko vzniku hyponatrémie než muži. Incidence hyponatrémie se zvyšuje s věkem (viz body 4.2 and 4.4).
Klinická účinnost
Účinnost přípravku Nocdurna byla prokázána ve dvou randomizovaných, dvojitě slepých, placebem kontrolovaných studiích u 268 žen (studie CS40, desmopresin Melt 25 mikrogramů versus placebo) a u 395 mužů (studie CS41, desmopresin Melt 50 mikrogramů a 75 mikrogramů versus placebo) s nykturií definovanou jako >2 nykturie za noc a polyurie u 90 % žen a 87 % mužů.
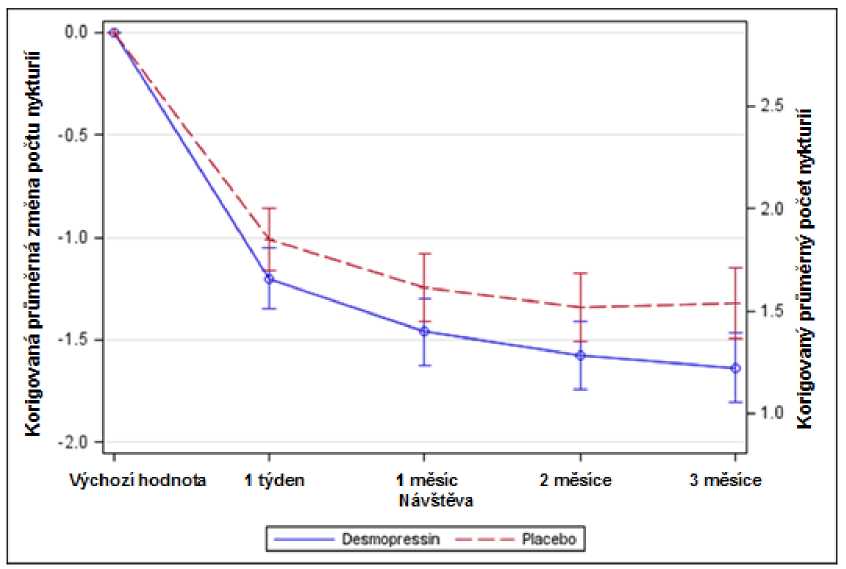
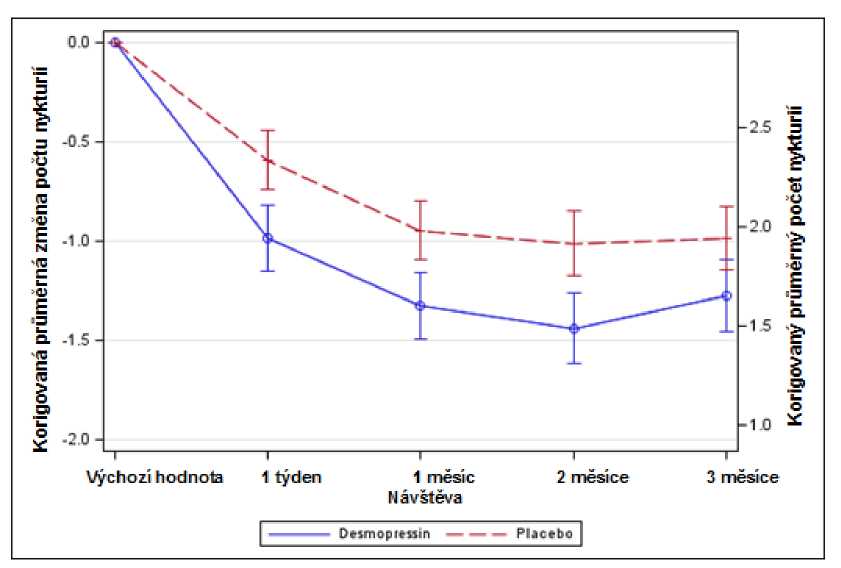
Obě studie dosáhly obou tzv. koprimárních výsledných ukazatelů se statisticky významnými rozdíly ve prospěch desmopresinu Melt v průběhu 3měsíčního období. Bylo pozorováno statisticky významné snížení korigovaného průměrného počtu nočních močení oproti vstupním hodnotám při léčbě desmopresinem Melt 25 mikrogramů (-1,46) ve srovnání s placebem (-1,24) v studii žen (p=0,028) (obr. 1) a při terapii desmopresinem Melt 50 mikrogramů (-1,25) proti placebu (-0,88) ve studii mužů (p=0,0003) (obr. 2). Poměr subjektů s >33% poklesem průměrného počtu nočních močení (terapeutická odpověď) byl významně vyšší- téměř dvojnásobný. Poměr šancí (odds ratio) pro >33% snížení při desmopresinu Melt 25 mikrogramů ve srovnání s placebem byl 1,85 (p=0,006) v studii u žen a poměr šancí pro >33% snížení při desmopresinu Melt 50 mikrogramů ve srovnání s placebem byl 1,98 (p=0,0009) v studii u mužů.
Z hlediska sekundárních ukazatelů bylo po 3 měsících terapie pozorováno prodloužení doby prvního nerušeného spánku (doby do prvního nočního močení po usnutí) o 49 minut ve studii u žen a o 39 minut ve studii u mužů. Bylo pozorováno statisticky významné zlepšení kvality života pro desmopresin Melt 25 mikrogramů (celkové skóre N-QoL 27,24) oproti placebu (21,90) (p=0,0226) u žen, a zlepšení pro desmopresin Melt 50 mikrogramů (celkové skóre N-QoL 18,37) proti placebu (13,88) (p=0,0385) u mužů. V obou studiích bylo zjištěno silné spojení (p<0,0001) mezi léčebnou odpovědí (snížení počtu nočních močení a prodloužení doby prvního nerušeného spánku) a zlepšením kvality života pacientů.
Obrázek 1. Koprimární výsledné ukazatele: Nykturie během 3měsíční terapie- korigovaná průměrná změna oproti výchozím hodnotám (Zeny, CS40 Analýza celého souboru)
Obrázek 2. Koprimární výsledné ukazatele: Nykturie během 3měsíční terapie- korigovaná průměrná změna oproti výchozím hodnotám - (Muži, CS41 Analýza celého souboru)
Ve dvojitě slepé randomizované klinické studii byla hodnocena účinnost a bezpečnost kombinované terapie desmopresinem Melt a tolterodinem v tobolkách s prodlouženým uvolňováním v léčbě hyperaktivního močového měchýře s nykturií u žen po dobu 3 měsíců. Byla sledována expozice čtyřiceti devíti subjektů kombinaci přípravku Nocdurna (desmopresin Melt) 25 mikrogramů a tolterodinu 4 miligramy. V této studii nebyly pozorovány žádné vážné nežádoucí účinky (SAE) a profily bezpečnosti kombinované terapie byly podobné bezpečnostnímu profilu přípravku Nocdurna 25 mikrogramů. Účinnost ve smyslu snížení průměrného počtu nykturií oproti výchozím hodnotám v průběhu 3měsíční léčby byla numericky vyšší ve skupině kombinované terapie oproti monoterapii tolterodinem ( -0,34 nykturií) v analýze celého souboru, přičemž v analýze souboru podle protokolu bylo dosaženo hladiny statistické významnosti (p=0,049)- snížení o 0,41 nykturií při kombinační terapii.
Rozdíly mezi pohlavími v klinické bezpečnosti a. účinnosti
Klinická studie [FE992026 CS029] analyzovala odpověď na dávku přípravku Nocdurna u žen a mužů pro dávky od 10 do 100 mikrogramů: U žen nebylo dosaženo žádného navýšení farmakodynamického účinku nad dávkou 25 mikrogramů, což ukazuje, že plató odpovědí bylo u žen dosaženo při 25 mikrogramech. U mužů bylo zjištěno větší snížení objemu moče při 50 mikrogramech, ale při 100 mikrogramech již nebylo podstatně vyšší. Zvýšení dávky na 50 mikrogramů u žen nevedlo k navýšení účinnosti, ale bylo ve věkové skupině nad 50 let spojeno s 5násobným zvýšením rizika hyponatrémie ve srovnání s muži (p = 0.015).
5.2 Farmakokinetické vlastnosti
Absorpce
Celková průměrná absolutní biologická dostupnost desmopresinu podávaného sublinguálně v dřívějších studiích stanovení dávky při 200, 400 a 800 mikrogramů je 0,25%, při 95% intervalu spolehlivosti 0,21 - 0,31 %. Desmopresin vykazuje střední až vysokou variabilitu v biologické dostupnosti, jak u jednoho a téhož subjektu tak mezi subjekty. U desmopresinu byla pozorována dávková linearita, co se týče AUC a Cmax v rozpětí 60 až 240 mikrogramů. Nebyla však hodnocena biologická dostupnost dávek pod 60 mikrogramů.
Distribuce
Distribuci desmopresinu popisuje nejlépe model rozdělení do dvou kompartmentů s distribučním objemem v průběhu fáze eliminace 0,3-0,5 l/kg.
Biotransformace
Metabolismus desmopresinu in vivo nebyl zkoumán. Studie metabolismu v humánních jaterních mikrozomech in vitro nezjistily žádný významný jaterní metabolismus pomocí systému cytochromu P450. Je tedy nepravděpodobné, že metabolismus v humánních játrech in vivo bude probíhat cestou systému cytochromu P450. Vliv desmopresinu na FK jiných léků je pravděpodobně minimální, v důsledku chybění inhibice systému metabolismu cestou cytochromu P450.
Eliminace
Celková clearance desmopresinu byla vypočtena na 7,6 l/hod. Terminální poločas desmopresinu se odhaduje na 2,8 hodin. U zdravých subjektů byla frakce vyloučené nezměněné látky 52 % (44 % -60 %).
Linearita/nelinearita
Žádné známky nesvědčí pro nelinearitu v kterémkoli z farmakokinetických parametrů desmopresinu. Charakteristiky specifických skupin pacientů
Poškození ledvin:
V závislosti na stupni poškození ledvin dochází k zvyšování AUC a poločasu podle stupně závažnosti poškození ledvin. Desmopresin je kontraindikován u pacientů se středně těžkým až těžkým poškozením ledvin (clearance kreatininu nižší než 50 ml/min).
Tabulka 2: Farmakokinetické parametry pro různé stupně renální insuficience. Údaje z CS001.
|
Clearance kreatininu |
Renální funkce |
AUC (Hod*pg/ml) |
T/ (hodiny) | |
|
Zdravé subjekty |
> 80 ml/min |
Normální |
186 |
2,8 |
|
Mírná |
50-80 ml/min |
Mírně snížené |
281 |
4,0 |
|
Středně těžká |
30-49 ml/min |
Středně závažně snížené |
453 |
6,7 |
|
Těžká |
5-29 ml/min |
Závažně snížené |
682 |
8,7 |
Poškození jater:
V této populaci pacientů nebyly provedeny žádné studie.
Není pravděpodobné, že dojde k interakci desmopresinu s léky ovlivňujícími jaterní metabolismus, protože ve studiích in vitro s použitím humánních mikrozomů bylo prokázáno, že desmopresin není významně metabolizován játry.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinická data získaná ze studií farmakokinetiky, toxicity opakovaných dávek, genotoxicity a toxicity neprokázala žádná specifická rizika s ohledem na lidskou reprodukci.
Studie kancerogenity nebyly s desmopresinem provedeny, protože je velmi podobný přirozeně se vyskytujícímu peptidovému hormonu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Želatina
Mannitol (E 421)
Bezvodá kyselina citrónová
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
4 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
Uchovávejte v původním balení, aby byl přípravek chráněn před vlhkostí a světlem.
Použijte tabletu bezprostředně po otevření jednotlivého blistru.
6.5 Druh obalu a velikost balení
Perforované jednodávkové blistry balené v krabičce.
Spodní folie blistru je z vícevrstevného materiálu PVC/OPA/Al/OPA/PVC, krycí folie blistru je z vícevrstevného tepelně zataveného materiálu lak /Al/PET/ papír.
Velikost balení:
10x1, 30x1, 90x1 nebo 100x1 perorální lyophilizát
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
FERRING Pharmaceuticals CZ s.r.o.
K Rybníku 475
252 42 Jesenice u Prahy
Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
Nocdurna 25 mikrogramů perorální lyofilizát: 56/272/16-C Nocdurna 50 mikrogramů perorální lyofilizát: 56/273/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15.6.2016
10. DATUM REVIZE TEXTU 15.6.2016
11