Nimenrix
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Nimenrix prášek pro injekční roztok a rozpouštědlo v předplněné injekční stříkačce Konjugovaná vakcína proti meningokokům skupin A, C, W-135 a Y
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Po rekonstituci 1 dávka (0,5 ml) obsahuje:
5 mikrogramů 5 mikrogramů 5 mikrogramů 5 mikrogramů
44 mikrogramů
Neisseria meningitidis A polysacharidum1 Neisseria meningitidis C polysacharidum1 Neisseria meningitidis W-135 polysacharidum1 Neisseria meningitidis Y polysacharidum1
1konjugováno na proteinový nosič tetanický toxoid
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok a rozpouštědlo Prášek je bílý.
Rozpouštědlo je čiré, bezbarvé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Nimenrix je indikován k aktivní imunizaci osob od 12 měsíců věku a starších proti invazivnímu meningokokovému onemocnění způsobenému Neisseria meningitidis skupiny A, C, W-135 a Y.
4.2 Dávkování a způsob podání
Dávkování
Nimenrix se má podávat v souladu s dostupnými oficiálními doporučeními.
K imunizaci se používá jedna dávka 0,5 ml rekonstituované vakcíny.
Nimenrix lze podat jako přeočkování jedincům, kteří dříve dostali základní očkování vakcínou Nimenrix nebo jinými konjugovanými či polysacharidovými meningokokovými vakcínami (viz body 4.4 a 5.1).
U určitých osob lze zvážit druhou dávku vakcíny Nimenrix (viz bod 4.4).
Bezpečnost a účinnost vakcíny Nimenrix u dětí mladších 12 měsíců nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Imunizace se provádí pouze intramuskulámí injekcí, nejlépe do deltového svalu.
U dětí ve věku 12 až 23 měsíců lze vakcínu rovněž aplikovat do anterolaterální strany stehna (viz body 4.4 a 4.5).
Instrukce týkající se rekonstituce léčivého přípravku před podáním viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Nimenrix se nesmí za žádných okolností podávat intravaskulárně, intradermálně ani subkutánně.
Podle zásad správné klinické praxe předchází očkování zhodnocení anamnézy (zejména s ohledem na předchozí očkování a možný výskyt nežádoucích účinků) a klinické vyšetření.
Pro případ vzácné anafylaktické reakce po podání vakcíny musí být vždy k dispozici příslušná lékařská péče a dohled.
Interkurentní onemocnění
Očkování vakcínou Nimenrix je třeba odložit u osob trpících závažným akutním horečnatým onemocněním. Lehká infekce, jako je např. nachlazení, by neměla být důvodem k odložení očkování.
Synkopa
Během jakéhokoliv očkování, nebo dokonce před ním, může dojít zejména u dospívajících v důsledku psychogenní reakce na injekční jehlu k synkopě (mdlobě). Tato reakce může být doprovázena závažnými neurologickými příznaky, jako je přechodná porucha zraku, parestezie a tonicko-klonické záškuby končetin během zotavení. Je důležité přijmout příslušná opatření, aby při mdlobách nedošlo k poranění.
Trombocytopenie a poruchy krevní srážlivosti
Nimenrix je třeba podávat s opatrností osobám s trombocytopenií nebo s jakoukoli poruchou krevní srážlivosti, protože po intramuskulámí aplikaci může dojít u těchto osob ke krvácení.
Imunodeficience
Lze očekávat, že u pacientů léčených imunosupresivy nebo u pacientů s imunodeficiencí nemusí dojít k vyvolání odpovídající imunitní odpovědi.
Bezpečnost a imunogenicita nebyla hodnocena u pacientů se zvýšenou citlivostí k meningokokové infekci způsobené určitými onemocněními, jako jsou deficience terminálního komplementu a anatomická nebo funkční asplenie. U těchto osob nemusí dojít k vyvolání odpovídající imunitní odpovědi.
Ochrana proti meningokokovému onemocnění
Nimenrix poskytuje ochranu pouze proti Neisseria meningitidis skupiny A, C, W-135 a Y. Tato vakcína nechrání proti žádným jiným skupinám Neisseria meningitidis.
K vyvolání protektivní imunitní odpovědi nemusí dojít u všech očkovaných osob.
Vliv předchozího očkovánípolysacharidovou meningokokovou vakcínou Osoby dříve očkované polysacharidovou meningokokovou vakcínou a poté s odstupem 30 až 42 měsíců vakcínou Nimenrix měly nižší geometrický průměr titrů protilátek (GTM - geometric means titres) měřených pomocí analýzy baktericidních protilátek v séru za použití králičího komplementu (rSBA) ve srovnání s osobami, které nebyly očkovány žádnou meningokokovou vakcínou během předchozích 10 let (viz bod 5.1). Klinický význam těchto pozorování není známý.
Vliv přítomnosti protilátek proti tetanickému toxoidu před očkováním
Bezpečnost a imunogenicita vakcíny Nimenrix byla hodnocena při následném nebo společném podání spolu s vakcínou DTaP-HBV-IPV/Hib v druhém roce života. Podání vakcíny Nimenrix jeden měsíc po vakcíně DTaP-HBV-IPV/Hib vedlo k nižším rSBA GMT proti MenA, MenC a MenW-135 v porovnání se souběžným podáním (viz bod 4.5). Klinický význam těchto pozorování není známý.
Imunitní odpovědi u batolat ve věku 12-14 měsíců
Za jeden měsíc po podání dávky měla batolata ve věku 12-14 měsíců podobné protilátkové odpovědi rSBA na skupiny A, C, W-135 a Y po jedné dávce vakcíny Nimenrix i po dvou dávkách vakcíny Nimenrix podaných s odstupem dvou měsíců.
Jedna dávka byla spojena s nižšími titry sérových baktericidních protilátek proti skupinám W-135 a Y v analýze za použití lidského komplementu (hSBA) v porovnání se dvěma dávkami podanými s odstupem dvou měsíců. Po jedné nebo dvou dávkách byly pozorovány podobné odpovědi na skupiny A a C (viz bod 5.1). Klinický význam těchto zjištění není znám. Pokud se u batolete očekává vyšší riziko invazivního meningokokového onemocnění kvůli expozici skupinám W-135 a Y, lze zvážit podání druhé dávky v intervalu 2 měsíců. Ohledně poklesu protilátek proti MenA nebo MenC po první dávce vakcíny Nimenrix u dětí ve věku 12-23 měsíců si přečtěte informace o perzistenci titrů sérových baktericidních protilátek.
Perzistence titrů sérových baktericidních protilátek
Po podání vakcíny Nimenrix nastává pokles titrů sérových baktericidních protilátek proti MenA, když byl při analýze použitý lidský komplement (hSBA) (viz bod 5.1). Klinický význam poklesu titrů protilátek hSBA-MenA není znám. Pokud se však u určitého pacienta očekává vyšší riziko expozice MenA a pokud mu byla podána dávka vakcíny Nimenrix před více než rokem, lze zvážit podání posilovací dávky.
Pokles titrů protilátek byl v čase pozorován u skupin A, C,W-135 a Y. Klinický význam poklesu titrů protilátek není znám. Posilovací dávka může být zvážena u očkovaných jedinců v batolecím věku, kteří jsou vystaveni vysokému riziku expozice meningokokovým onemocněním způsobeným skupinami A, C,W-135 nebo Y (viz bod 5.1).
Vliv vakcíny Nimenrix na koncentraci protilátek proti tetanu
Ačkoli po očkování vakcínou Nimenrix bylo pozorováno zvýšení koncentrace protilátek proti tetanickému toxoidu (TT), přípravek Nimenrix nenahrazuje očkování proti tetanu.
Podávání vakcíny Nimenrix společně s vakcínou obsahující TT, nebo jeden měsíc před jejím podáním během druhého roku života nemělo vliv na odpověď na TT ani významně neovlivnilo bezpečnost. Pro osoby starší než 2 roky nejsou k dispozici žádné údaje.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nimenrix lze podávat společně s jakoukoli z následujících očkovacích látek: vakcíny proti hepatitidě A (HAV) a hepatitidě B (HIV), vakcína proti spalničkám, příušnicím a zarděnkám (MMR), vakcína proti spalničkám, příušnicím, zarděnkám a planým neštovicím (MMRV), desetivalentní pneumokoková konjugovaná vakcína nebo neadjuvovaná vakcína proti sezónní chřipce.
Nimenrix lze rovněž podávat společně s kombinovanými vakcínami proti záškrtu, tetanu a černému kašli (acelulární pertuse) během druhého roku života, včetně kombinace vakcín DTaP s vakcínou proti hepatitidě B, dětské obrně (inaktivovaná vakcína) nebo Haemophilus influenzae typu b, jako je vakcína DTaP-HBV-IPV/Hib.
Kdykoli je to možné, mají se vakcína Nimenrix a vakcína obsahující TT, jako je např. vakcína DTaP-HBV-IPV/Hib, podávat společně, nebo je třeba přípravek Nimenrix podat alespoň jeden měsíc před podáním vakcíny obsahující TT. Následné podání vakcíny Nimenrix jeden měsíc po vakcíně DTaP-HBV-IPV/Hib vedlo k nižším GMT u protilátek proti skupinám A, C,W-135 a Y. Klinický význam těchto pozorování není znám, protože nejméně 99,4 % subjektů (N = 178) mělo rSBA titry >8 v každé skupině (A, C, W-135, Y) (viz bod 4.4).
Jeden měsíc po společném podání s desetivalentní pneumokokovou konjugovanou vakcínou byly pozorovány nižší GMC a OPA (opsonophagocyt assay) GMT protilátek u jednoho pneumokokového sérotypu (sérotypu 18C konjugovaného na transportní protein pro tetanický toxoid). Klinický významn tohoto pozorování není znám. Nebyl pozorován žádný vliv společného podávání na dalších devět pneumokokových sérotypů.
Pokud se vakcína Nimenrix podává spolu s jinou injekční vakcínu, je třeba vakcíny aplikovat do různých míst.
U pacientů léčených imunosupresivy lze očekávat, že nemusí dojít k vyvolání dostatečné imunitní odpovědi.
4.6 Fertilita, těhotenství a kojení
K dispozici jsou pouze omezené zkušenosti týkající se použití vakcíny Nimenrix u těhotných žen.
Studie se zvířaty nenaznačují přímé ani nepřímé škodlivé účinky s ohledem na těhotenství, embryo/fetální vývoj, porod ani postnatální vývoj (viz bod 5.3).
Nimenrix by se měl v těhotenství použít pouze, pokud je to nezbytně nutné a pokud možné výhody převáží možná rizika pro plod.
Kojení
Není známo, zda se Nimenrix vylučuje do mateřského mléka.
Nimenrix by se měl při kojení použít pouze pokud možné výhody převáží možná rizika.
Fertilita
Studie se zvířaty nenaznačují na přímé ani nepřímé škodlivé účinky s ohledem na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie hodnotící vliv vakcíny Nimenrix na schopnost řídit a obsluhovat stroje. Některé nežádoucí účinky uvedené v bodě 4.8 „Nežádoucí účinky“ však mohou ovlivnit schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Bezpečnostní profil uvedený níže je založený na souhrnné analýze 9 621 subjektů, které byly v rámci klinických studií očkovány jednou dávkou vakcíny Nimenrix. Tato souhrnná analýza zahrnuje údaje od 3 079 batolat (12 měsíců až 23 měsíců), 909 dětí mezi 2 a 5 lety, 990 dětí mezi 6 a 10 lety,
2 317 dospívajících (11 až 17 let) a 2 326 dospělých (18 až 55 let).
Ve všech věkových skupinách byly nejčastěji hlášenými lokálními nežádoucími účinky po očkování bolest (24,1 % až 41,3 %), zarudnutí (15,5 % až 35,6 %) a otok (11,3 % až 19,9 %).
Ve věkových skupinách 12 - 23 měsíců a 2 - 5 let byly nejčastěji hlášené celkové nežádoucí účinky po očkování podrážděnost (44,0 % a 9,2 %), spavost (34,1 % a 10,8 %), ztráta chuti k jídlu (26,6 % a 8,2 %) a horečka (17,1 % a 8,1 %).
Ve věkové skupině 12-14 měsíců, která dostala 2 dávky vakcíny Nimenrix podané s odstupem 2 měsíců, byla první a druhá dávka spojena s podobnou lokální a systémovou reakcí.
Ve věkových skupinách 6-10, 11 - 17 a > 18 let byly nejčastěji hlášené celkové nežádoucí účinky po očkování bolest hlavy (15,7 %, 22,0 % a 21,5 %), únava (15,6 %, 21,9 % a 20,7 %), gastrointestinální příznaky (9,3 %, 9,4 % a 8,3 %) a horečka (8,0 %, 5,3 % a 4,9 %).
Profil lokálních a celkových nežádoucích účinků při přeočkování vakcínou Nimenrix po základním očkování vakcínou Nimenrix nebo jinými konjugovanými či polysacharidovými meningokokovými vakcínami byl podobný profilu lokálních a celkových nežádoucích účinků pozorovanému po základním očkování vakcínou Nimenrix s výjimkou gastrointestinálních příznaků (zahrnujících průjem, zvracení a nevolnost), které byly velmi časté.
V samostatné studii byla podána jedna dávka vakcíny Nimenrix 274 subjektům ve věku 56 let a starším. Všechny nežádoucí účinky hlášené v této studii byly již pozorovány u mladších věkových skupin.
Souhrn nežádoucích účinků v tabulce
Nežádoucí účinky jsou zaznamenány podle následujících kategorií četností:
Velmi časté: Časté:
Méně časté: Vzácné:
Velmi vzácné:
(> 1/10)
(> 1/100 až < 1/10)
(> 1/1 000 až < 1/100)
(> 1/10 000 až < 1/1 000) (< 1/10 000)
|
Třída orgánových systémů |
Četnost |
Nežádoucí účinky |
|
Klinické studie | ||
|
Poruchy metabolismu a výživy |
Velmi časté |
Ztráta chuti k jídlu |
|
Psychiatrické poruchy |
Velmi časté | |
|
Méně časté |
Nespavost, pláč | |
|
Poruchy nervového systému |
Velmi časté |
Spavost, bolest hlavy |
|
Méně časté |
Hypestezie, závrať | |
|
Gastrointestinální poruchy |
Časté |
Gastrointestinální příznaky (včetně průjmu, |
|
zvracení a nauzey) | ||
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Myalgie, bolest končetin |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Horečka, otok, bolest a zarudnutí v místě vpichu injekce, únava |
|
Časté |
Hematom v místě vpichu injekce | |
|
Méně časté |
Malátnost, reakce v místě vpichu injekce (včetně indurace, svědění, zteplání a necitlivosti) | |
|
Postmarketingové sledování | ||
|
Celkové poruchy a reakce v místě aplikace |
Vzácné |
Rozsáhlý otok končetiny v místě vpichu injekce, často spojen se zarudnutím, někdy postihující přilehlý kloub nebo otok celé končetiny |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyl hlášen žádný případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny, meningokokové vakcíny, ATC kód: J07AH08 Mechanismus účinku
Antikapsulární meningokokové protilátky chrání před meningokokovým onemocněním prostřednictvím komplementem zprostředkované baktericidní aktivity. Nimenrix indukuje tvorbu baktericidních protilátek proti kapsulárním polysacharidům skupiny A, C, W-135 a Y, hodnocenou pomocí analýzy za použití králičího (rSBA) nebo lidského komplementu (hSBA).
Farmakodynamické účinky
Imunogenicita
Imunogenicita jedné dávky vakcíny Nimenrix byla hodnocena u více než 8 000 subjektů ve věku > 12 měsíců.
Účinnost vakcíny byla odvozena od průkazu imunologické non-inferiority (založené převážně na srovnávacích poměrech s titry rSBA, které jsou alespoň 8) vůči registrovaným meningokokovým vakcínám. Imunogenicita byla měřena za použití rSBA nebo hSBA, které jsou biologickými markery protektivní účinnosti proti meningokokům skupin A, C, W-135 a Y.
Perzistence imunitní odpovědi
Perzistence imunitní odpovědi vyvolané podáním vakcíny Nimenrix byla hodnocena až 60 měsíců po očkování u subjektů ve věku 12 měsíců až 55 let.
Protilátky vyvolané podáním přípravku Nimenrix byly podobné nebo vyšší než protilátky vyvolané registrovanými meningokokovými vakcínami (tj. vakcínou MenC-CRM u subjektů ve věku 12 - 23 let a vakcínou ACWY-PS u subjetků ve věku starších 2 let).
Odpověď na přeočkování
V klinických hodnoceních bylo hodnoceno použití vakcíny Nimenrix jako přeočkování po základním očkování přípravkem Nimenrix nebo jinými meningokokovými vakcínami (kvadrivalentní konjugovanou meningokokovou vakcínou A, C, W a Y-DT nebo monovalentními konjugovanými vakcínami skupiny C).
Batolata
Imunogenicita u batolat ve věku 12-23 měsíců
V klinických studiích MenACWY-TT-039 a MenACWY-TT-040 jedna dávka vakcíny Nimenrix vyvolávala odpovědi rBSA proti všem čtyřem meningokokovým skupinám, přičemž odpověď proti skupině C byla srovnatelná s odpovědí vyvolanou registrovanou vakcínou MenC-CRM, pokud jde o % subjektů s titry rSBA > 8 (tabulka 1).
Tabulka 1: Baktericidní protilátková odpověď (rSBA*) u batolat ve věku 12 - 23 měsíců
|
Skupina |
Odpověď na |
Studie MenACWY-TT-039(1) |
Studie MenACWY-TT-040(2) | ||||
|
N |
>8 (95% CI) |
GMT (95% CI) |
N |
>8 (95% CI) |
GMT (95% CI) | ||
|
A |
Nimenrix |
354 |
99,7 % (98,4; 100) |
2 205 (2 008; 2 422) |
183 |
98,4 % (95,3; 99,7) |
3 170 (2 577;3899) |
|
C |
Nimenrix |
354 |
99,7 % (98,4; 100) |
478 (437; 522) |
183 |
97,3 % (93,7; 99,1) |
829 (672; 1 021) |
|
vakcína MenC-CRM |
121 |
97,5 % (92,9; 99,5) |
212 (170; 265) |
114 |
98,2 % (93,8; 99,8) |
691 (521; 918) | |
|
W-135 |
Nimenrix |
354 |
100 % (99,0; 100) |
2 682 (2 453; 2 932) |
186 |
98,4 % (95,4; 99,7) |
4 022 (3 269; 4 949) |
|
Y |
Nimenrix |
354 |
100 % (99,0; 100) |
2 729 (2 473; 3 013) |
185 |
97,3 % (93,8; 99,1) |
3 168 (2 522; 3 979) |
Analýza imunogenicity byla provedena v ATP kohortác
h pro hodnocení imunogenicity.
(1) krevní vzorky byly odebrány 42 až 56 dnů po vakcinaci
(2) krevní vzorky byly odebrány 30 až 42 dnů po vakcinaci * testováno v GSK laboratořích.
Ve studii MenACWY-TT-039 byla jako sekundární cílový parametr hodnocena baktericidní aktivita v séru rovněž s použitím lidského séra jako zdroje komplementu (hSBA) (tabulka 2).
Tabulka 2: Baktericidní protilátková odpověď (hSBA*) u batolat ve věku 12 - 23 měsíců
|
Skupina |
Odpověď na |
N |
Studie MenACWY-TT-039(1) * | |
|
>8 (95% CI) |
GMT (95% CI) | |||
|
A |
Nimenrix |
338 |
77,2 % (72,4; 81,6) |
19,0 (16,4; 22,1) |
|
C |
Nimenrix |
341 |
98,5 % (96,6; 99,5) |
196 (175; 219) |
|
vakcína MenC-CRM |
116 |
81,9% (73,7; 88,4) |
40,3 (29,5; 55,1) | |
|
W-135 |
Nimenrix |
336 |
87,5 % (83,5; 90,8) |
48,9 (41,2; 58,0) |
|
Y |
Nimenrix |
329 |
79,3 % (74,5; 83,6) |
30,9 (25,8; 37,1) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. (1) krevní vzorky byly odebrány 42 až 56 dnů po vakcinaci * testováno v GSK laboratořích.
Ve studii Men ACWY-TT-104 byla hodnocena imunitní odpověď po jedné nebo dvou dávkách vakcíny Nimenrix, podaných s odstupem 2 měsíců, jeden měsíc po poslední vakcinaci. Vakcína Nimenrix vyvolávala baktericidní odpovědi proti všem čtyřem skupinám, které byly podobné, pokud jde o % subjektů s titrem rSBA >8 a GMT po jedné nebo dvou dávkách (tabulka 3).
Tabulka 3: Baktericidní protilátková odpověď (rSBA*) u batolat ve věku 12 - 14 měsíců
|
Skupina |
Odpověď na |
Načasování |
Studie MenACWY-TT-104(1) | ||
|
N |
>8 (95%CI) |
GMT (95% CI) | |||
|
A |
Nimenrix 1 dávka |
Po dávce 1 |
181 |
97,8 % (94,4, 99,4) |
1 445,4 (1 126,1, 1 855,2) |
|
Nimenrix 2 dávky |
Po dávce 1 |
158 |
96,8 % (92,8, 99,0) |
1 275,2 (970,5, 1 675,4) | |
|
Po dávce 2 |
150 |
98,0 % (94,3, 99,6) |
1 176,3 (921,8, 1 501) | ||
|
C |
Nimenrix 1 dávka |
Po dávce 1 |
180 |
95,0 % (90,7, 97,7) |
454,4 (347,7, 593,8) |
|
Nimenrix 2 dávky |
Po dávce 1 |
157 |
95,5 % (91,0, 98,2) |
369,3 (280,9, 485,5) | |
|
Po dávce 2 |
150 |
98,7 % (95,3, 99,8) |
639,1 (521,8, 782,9) | ||
|
W-135 |
Nimenrix 1 dávka |
Po dávce 1 |
181 |
95,0 % (90,8, 97,7) |
2 136,1 (1 614,9, 2 825,5) |
|
Nimenrix 2 dávky |
Po dávce 1 |
158 |
94,9 % (90,3, 97,8) |
2 030,1 (1 510,7, 2 728,2) | |
|
Po dávce 2 |
150 |
100 % (97,6, 100) |
3 533 (2 914,5, 4 282,7) | ||
|
Y |
Nimenrix 1 dávka |
Po dávce 1 |
181 |
92,8 % (88,0, 96,1) |
955.8 (709,1, 1 288,3) |
|
Nimenrix 2 dávky |
Po dávce 1 |
157 |
93,6 % (88,6, 96,9) |
933,3 (692,3, 1 258,3) | |
|
Po dávce 2 |
150 |
99,3 % (96,3, 100) |
1 133,6 (944,5, 1 360,5) | ||
Analýza imunogenicity byla provedena v ATP
kohortě pro hodnocení imunogenicity.
(1) krevní vzorky byly odebrány 21 až 48 dnů po vakcinaci * testováno v laboratořích Public Health England.
Ve studii Men ACWY-TT-104 byla jako sekundární cílový parametr hodnocena baktericidní aktivita v séru rovněž s použitím hSBA. Vakcína Nimenrix vyvolávala baktericidní odpověď proti skupinám W-135 a Y, která byla vyšší, pokud jde o % subjektů s titrem hSBA >8 při podání dvou dávek v porovnání s jednou dávkou. Podobné odpovědi, pokud jde o % subjektů s titrem hSBA > 8, byly pozorovány u skupin A a C (tabulka 4).
|
Tabulka 4: Baktericidní protilát |
íová odpověď hSBA* u batolat ve věku 12 - 14 měsíců | ||||
|
Skupina |
Odpověď na |
Načasování |
Studie MenACWY-TT-104(1) | ||
|
N |
>8 (95%CI) |
GMT (95% CI) | |||
|
A |
Nimenrix 1 dávka |
Po dávce 1 |
75 |
96,0 % (88,8, 99,2) |
119,3 (88,0, 161,7) |
|
Nimenrix 2 dávky |
Po dávce 1 |
66 |
97,0 % (89,5, 99,6) |
132,9 (98,1, 180,1) | |
|
Po dávce 2 |
66 |
97,0 % (89,5, 99,6) |
170,5 (126,2, 230,2) | ||
|
C |
Nimenrix 1 dávka |
Po dávce 1 |
79 |
98,7 % (93,1, 100) |
151,2 (104,7, 218,3) |
|
Nimenrix 2 dávky |
Po dávce 1 |
70 |
95,7 % (88,0, 99,1) |
161 (110, 236) | |
|
Po dávce 2 |
69 |
100 % (94,8, 100) |
1 753,3 (1 277,7, 2 404,2) | ||
|
W-135 |
Nimenrix 1 dávka |
Po dávce 1 |
72 |
62,5 % (50,3, 73,6) |
27,5 (16,1, 46,8) |
|
Nimenrix 2 dávky |
Po dávce 1 |
61 |
68,9 % (55,7, 80,1) |
26,2 (16,0, 43,0) | |
|
Po dávce 2 |
70 |
97,1 % (90,1, 99,7) |
756,8 (550,1, 1 041,3) | ||
|
Y |
Nimenrix 1 dávka |
Po dávce 1 |
71 |
67,6 % (55,5, 78,20) |
41,2 (23,7, 71,5) |
|
Nimenrix 2 dávky |
Po dávce 1 |
56 |
64,3 % (50,4, 76,6) |
31,9 (17,6, 57,9) | |
|
Po dávce 2 |
64 |
95,3 % (86,9, 99,0) |
513,0 (339,4, 775,4) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. (1) krevní vzorky byly odebrány 21 až 48 dnů po vakcinaci * testováno v GSK laboratořích.
Perzistence imunitní odpovědi u batolat ve věku 12-23 měsíců
U dětí primárně očkovaných v batolecím věku byla perzistence imunitní odpovědi hodnocena pomocí rSBA a hSBA ve studiích MenACWY-TT-048 a MenACWY TT-032 až 4 roky po primárním očkování ve studii MenACWY-TT 039 (tabulka 5) a až 5 let po primárním očkování ve studii MenACWY-TT-027 (tabulka 6).
Tabulka 5: Údaje týkající se čtyřleté perzistence u batolat ve věku 12 - 23 měsíců při očkování _(studie MenACWY-TT-048)_
|
Skupina |
Odpověď na |
Časový bod (rok) |
rSBA* |
hSBA** | ||||
|
N |
>8 (95% CI) |
GMT (95% CI) |
N |
>8 (95%CI) |
GMT (95%CI) | |||
|
A*** |
Nimenrix |
3 |
2 |
59,9 % (53,7; 65,9) |
19,3 (15,7; 23,6) |
251 |
35,9 % (29,9; 42,1) |
5,8 (4,8; 7,0) |
|
4 |
2 |
74,1 % (67,9; 79,7) |
107 (77,6; 148) |
198 |
28,8 % (22,6; 35,6) |
4,9 (4,0; 6,0) | ||
|
C |
Nimenrix |
3 |
2 |
35,9 % (30,1; 42,0) |
9,8 (8,1; 11,7) |
253 |
78,3 % (72,7; 83,2) |
37,8 (29,4; 48,6) |
|
4 |
2 |
40,4 % (34,0; 47,2) |
12,3 (9,8; 15,3) |
209 |
73,2 % (66,7; 79,1) |
32,0 (23,8; 43,0) | ||
|
Vakcína MenC- CRM |
3 |
4 |
13,0 % (4,9; 26,3) |
5,7 (4,2; 7,7) |
31 |
41,9 % (24,5; 60,9) |
6,2 (3,7; 10,3) | |
|
4 |
4 |
35,6 % (21,9; 51,2) |
13,5 (7,4; 24,5) |
32 |
46,9 % (29,1; 65,3) |
11,3 (4,9; 25,6) | ||
|
W-135 |
Nimenrix |
3 |
2 |
49,8 % (43,6; 56,0) |
24,9 (19,2; 32,4) |
254 |
82,3 % (77,0; 86,8) |
52,0 (41,4; 65,2) |
|
4 |
2 |
49,3 % (42,6; 56,1) |
30,5 (22,4; 41,5) |
165 |
80,6 % (73,7; 86,3) |
47,1 (35,7; 62,2) | ||
|
Y |
Nimenrix |
3 |
2 |
53,8 % (47,6; 60,0) |
22,3 (17,6; 28,4) |
250 |
72,0 % (66,0; 77,5) |
33,2 (25,9; 42,5) |
|
4 |
2 |
58,2 % (51,5; 64,7) |
36,2 (27,1; 48,4) |
130 |
65,4 % (56,5; 73,5) |
29,8 (20,2; 44,1) | ||
|
Analýza imunogenicity |
byla proved |
ena v ATP kohortě pro hodnocení perzistence adaptované pro | ||||||
každý časový bod.
*rSBA testování provedeno v Public Health England (PHE) laboratořích ve Velké Británii. ** Testováno v GSK laboratořích.
***Podobně jako nárůst GMTs v rSBA MenA byl pozorován nárůst geometrických průměrů koncentrací IgG MenA mezi rokem 3 a rokem 4.
Tabulka 6: Údaje týkající se pětileté perzistence u batolat ve věku 12 - 23 měsíců v době
očkování (studie MenACWY-TT-032)
- v |-
|
Skupina |
Odpověď na |
Časový bod (rok) |
rSBA* |
hSBA1 | ||||
|
N |
>8 (95% CI) |
GMT (95% CI) |
N |
>8 (95% CI) |
GMT (95% CI) | |||
|
A |
Nimenrix |
4 |
45 |
64,4 % (48,8; 78,1) |
35,1 (19,4; 63,4) |
44 |
52,3 % (36,7; 67,5) |
8,8 (5,4; 14,2) |
|
5 |
49 |
73,5 % (58,9; 85,1) |
37,4 (22,1; 63,2) |
45 |
35,6 % (21,9: 51,2) |
5,2 (3,4; 7,8) | ||
|
C |
Nimenrix |
4 |
45 |
97,8 % (88,2; 99,9) |
110 (62.7; 192) |
45 |
97,8 % (88,2; 99,9) |
370 (214; 640) |
|
5 |
49 |
77,6 % (63,4; 88,2) |
48,9 (28,5; 84,0) |
48 |
91,7% (80,0; 97,7) |
216 (124; 379) | ||
|
Vakcína MenC- CRM |
4 |
10 |
80,0 % (44,4; 97,5) |
137 (22,6; 832) |
10 |
70,0 % (34,8; 93,3) |
91,9 (9,8; 859) | |
|
5 |
11 |
63,6 % (30,8; 89,1) |
26,5 (6,5; 107) |
11 |
90,9 % (58,7; 99,8) |
109 (21,2; 557) | ||
|
W-135 |
Nimenrix |
4 |
45 |
60,0 % (44,3; 74,3) |
50,8 (24,0; 108) |
45 |
84,4 % (70,5; 93,5) |
76,9 (44,0; 134) |
|
5 |
49 |
34,7 % (21,7; 49,6) |
18,2 (9,3; 35,3) |
46 |
82,6 % (68,6; 92,2) |
59,7 (35,1; 101) | ||
|
Y |
Nimenrix |
4 |
45 |
62,2 % (46,5; 76,2) |
44,9 (22,6; 89,3) |
41 |
87,8 % (73,8; 95,9) |
74,6 (44,5; 125) |
|
5 |
49 |
42,9 % (28,8; 57,8) |
20,6 (10,9; 39,2) |
45 |
80,0 % (65,4; 90,4) |
70,6 (38,7; 129) | ||
Perzistence imunogenicity byla analyzována použitím roku 5 ATP kohorty. Selekční bias hlavně kvůli přeočkování subjektů s MenC rSBA titry <8 a jejich vyloučení z následného časového bodu (následných časových bodů) může vést k nadhodnocení titrů.
*rSBA testování provedeno v PHE laboratořích ve Velké Británii.
Ve studii MenACWY-TT-014 bylo hodnoceno vyvolání imunitní paměti jeden měsíc po podání pětiny dávky vakcíny ACWY-PS (10 ^g každého polysacharidu) dětem ve třetím roce života, které byly primárně očkované ve studii MenACWY-TT-013 vakcínou Nimenrix nebo registrovanou vakcínou MenC-CRM ve věku 12 až 14 měsíců.
Jeden měsíc po podání provokační (challenge) dávky byly GMT vyvolané u subjektů primárně očkovaných vakcínou Nimenrix zvýšeny 6,5 až 8násobně u skupin A, C, W-135 a Y a ukazovaly, že Nimenrix indukuje imunitní paměť vůči skupinám A, W-135 a Y. Post-challenge GMT rSBA-MenC byly podobné v obou studijních skupinách, což ukazuje, že Nimenrix indukuje obdobnou imunitní paměť vůči skupině C jako registrovaná vakcína MenC-CRM (tabulka 7).
Tabulka 7: Imunitní odpověď (rSBA*) 1 měsíc po provokačním (challenge) očkování u subjektů
primárně očkovaných vakcínou Nimenrix nebo vakcínou MenC-CRM ve věku 12 až 14 měsíců
|
Skupina |
Odpověď na |
Pre-challenge |
Post-challenge | ||
|
N |
GMT (95% CI) |
N |
GMT (95% CI) | ||
|
A |
Nimenrix |
32 |
544 (325;911) |
25 |
3 322 (2 294; 4 810) |
|
C |
Nimenrix |
31 |
174 (105; 289) |
32 |
5 966 (4128; 8621) |
|
vakcína MenC-CRM |
28 |
34,4 (15,8; 75,3) |
30 |
5 265 (3 437; 8 065) | |
|
W-135 |
Nimenrix |
32 |
644 (394; 1 052) |
32 |
1 1058 (8 587; 14 240) |
|
Y |
Nimenrix |
32 |
440 (274; 706) |
32 |
5 737 (4 216; 7 806) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. * Testováno v GSK laboratořích.
Děti
Imunogenicita u dětí ve věku 2- 10 let
Ve dvou srovnávacích studiích prováděných u subjektů ve věku 2 - 10 let dostala jedna skupina subjektů jednu dávku vakcíny Nimenrix a druhá skupina jako srovnávací přípravek jednu dávku buď registrovanou vakcínu MenC-CRM (studie MenACWY-TT-081) nebo registrované polysacharidové vakcíny proti meningokokům skupin A, C, W-135, Y (ACWY-PS) společnosti GlaxoSmithKline Biologicals (studie MenACWY-TT-038).
Ve studii MenACWY-TT-038 bylo prokázáno, že Nimenrix je non-inferiorní k registrované vakcíně ACWY-PS, pokud jde o odpověď na vakcínu u všech čtyř skupin (A, C, W-135 a Y) (viz tabulka 8).
Odpověď na vakcínu byla definována jako poměr subjektů s:
• rSBA titry > 32 u původně séronegativních subjektů (tj. rSBA titr před vakcinací < 8)
• alespoň 4násobné zvýšení rSBA titrů u původně séropozitivních subjektů z hodnot před očkováním na hodnoty po očkování (tj. rSBA titr před vakcinací > 8)
Ve studii MenACWY-TT-081 bylo prokázáno, že vakcína Nimenrix byla non-inferiorní kjiné registrované vakcíně MenC-CRM, pokud jde o odpověď na vakcínu ve skupině MenC [94,8 %
(95% CI: 91,4; 97,1) resp. 95,7 % (95% CI: 89,2; 98,8)]; GMT byly nižší ve skupině s vakcínou Nimenrix [2 795 (95% CI: 2 393; 3 263)] ve srovnání s vakcínou MenC-CRM [5 292 (95% CI: 3 815; 7 340)].
PS u dětí ve věku 2-10 let 1 měsíc po očkování (studie MenACWY-TT-038)
|
Skupin a |
Nimenrix |
vakcína ACWY-PS | ||||
|
N |
VR (95% CI) |
GMT (95% CI) |
N |
VR (95% CI) |
GMT (95% CI) | |
|
A |
594 |
89,1 % (86,3; 91,5) |
6 343 (5 998; 6 708) |
192 |
64,6 % (57,4; 71,3) |
2 283 (2 023; 2 577) |
|
C |
691 |
96,1 % (94,4; 97,4) |
4 813 (4 342; 5 335) |
234 |
89,7 % (85,1; 93,3) |
1 317 (1 043; 1 663) |
|
W-135 |
691 |
97,4 % (95,9; 98,4) |
11 543 (10 873; 12 255) |
236 |
82,6 % (77,2; 87,2) |
2 158 (1 815; 2 565) |
|
Y |
723 |
92,7 % (90,5; 94,5) |
10 825 (10 233; 11 452) |
240 |
68,8 % (62,5; 74,6) |
2 613 (2 237; 3 052) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. VR: odpověď na vakcínu (vaccine response)
* testováno v GSK laboratořích.
Perzistence imunitní odpovědi u dětí ve věku 2- 10 let
Ve studii MenACWY-TT-088 byla perzistence imunitní odpovědi hodnocena pomocí rSBA a hSBA až do 44 měsíců po očkování u dětí ve věku 2 - 10 let primárně očkovaných ve studii MenACWY-TT-081 (tabulka 9).
Tabulka 9: Údaje týkající se 44 měsíční persistence u dětí ve věku 2-10 let při očkování
|
Skupina |
Odpověď na |
Časový bod (měsíce) |
rSBA* |
hSBA** | ||||
|
N |
>8 (95%CI) |
GMT (95%CI) |
N |
>8 (95%CI) |
GMT (95%CI) | |||
|
A |
Nimenrix |
32 |
193 |
86,5 % (80,9; 91,0) |
196 (144; 267) |
90 |
25,6 % (16,9; 35,8) |
4,6 (3,3; 6,3) |
|
44 |
189 |
85,7 % (79,9; 90,4) |
307 (224; 423) |
89 |
25,8 % (17,1; 36,2) |
4,8 (3,4; 6,7) | ||
|
C |
Nimenrix |
32 |
192 |
64,6 % (57,4; 71,3) |
34,8 (26,0; 46,4) |
90 |
95,6 % (89,0; 98,8) |
75,9 (53,4; 108) |
|
44 |
189 |
37,0 % (30,1; 44,3) |
14,5 (10,9; 19,2) |
82 |
76,8 % (66,2; 85,4) |
36,4 (23,1; 57,2) | ||
|
Vakcína MenC- CRM |
32 |
69 |
76,8 % (65,1; 86,1) |
86,5 (47,3; 158) |
33 |
90,9 % (75,7; 98,1) |
82,2 (34,6; 196) | |
|
44 |
66 |
45,5 % (33,1; 58,2) |
31,0 (16,6; 58,0) |
31 |
64,5 % (45,4; 80,8) |
38,8 (13,3; 113) | ||
|
W-135 |
Nimenrix |
32 |
193 |
77,2 % (70,6; 82,9) |
214 (149; 307) |
86 |
84,9 % (75,5; 91,7) |
69,9 (48,2; 101) |
|
44 |
189 |
68,3 % (61,1; 74,8) |
103 (72,5; 148) |
87 |
80,5 % (70,6; 88,2) |
64,3 (42,7; 96,8) | ||
|
Y |
Nimenrix |
32 |
193 |
81,3 % (75,1; 86,6) |
227 (165; 314) |
91 |
81,3 % (71,8; 88,7) |
79,2 (52,5; 119) |
|
44 |
189 |
62,4 % (55,1; 69,4) |
78,9 (54,6; 114) |
76 |
82,9 % (72,5; 90,6) |
127 (78,0; 206) | ||
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptované pro každý časový bod.
*rSBA testování provedeno v PHE laboratořích ve Velké Británii.
** Testováno v GSK laboratořích.
Perzistence imunitní odpovědi u dětí ve věku 6- 10 let
Ve studii MenACWY-TT-028 byla perzistence imunitní odpovědi hodnocena pomocí hSBA jeden rok po očkování u dětí ve věku 6 - 10 let primárně očkovaných ve studii MenACWY-TT-027 (tabulka 10) (viz bod 4.4).
Tabulka 10: Údaje 1 měsíc po očkování a perzistence (hSBA*) 1 rok po očkování u dětí ve věku
6-10 let
|
Skupina |
Odpověď na |
1 měsíc po očkování |
Perzistence 1 rok |
po očkování | |||
|
N |
> 8 (95%CI) |
GMT (95%CI) |
N |
> 8 (95%CI) |
GMT (95%CI) | ||
|
A |
Nimenrix |
105 |
80,0 % (71,1; 87,2) |
53,4 (37,3; 76,2) |
104 |
16,3 % (9,8; 24,9) |
3,5 (2,7; 4,4) |
|
ACWY-PS |
35 |
25,7 % (12,5; 43,3) |
4,1 (2,6; 6,5) |
35 |
5,7 % (0,7; 19,2) |
2,5 (1,9; 3,3) | |
|
C |
Nimenrix |
101 |
89,1 % (81,3; 94,4) |
156 (99,3; 244) |
105 |
95,2 % (89,2; 98,4) |
129 (95,4; 176) |
|
ACWY-PS |
38 |
39,5 % (24,0; 56,6) |
13,1 (5,4; 32,0) |
31 |
32,3 % (16,7; 51,4) |
7,7 (3,5; 17,3) | |
|
W-135 |
Nimenrix |
103 |
95,1 % (89,0; 98,4) |
133 (99,9; 178) |
103 |
100 % (96,5; 100) |
257 (218;302) |
|
ACWY-PS |
35 |
34,3 % (19,1; 52,2) |
5,8 (3,3; 9,9) |
31 |
12,9 % (3,6; 29,8) |
3,4 (2,0; 5,8) | |
|
Y |
Nimenrix |
89 |
83,1 % (73,7; 90,2) |
95,1 (62,4; 145) |
106 |
99,1 % (94,9; 100) |
265 (213;330) |
|
ACWY-PS |
32 |
43,8 % (26,4; 62,3) |
12,5 (5,6; 27,7) |
36 |
33,3 % (18,6; 51,0) |
9,3 (4,3; 19,9) | |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence. * Testováno v GSK laboratořích.
Dospívající a dospělí
Imunogenicita u dospívajících ve věku 11 - 17 let a dospělých ve věku > 18 let Ve dvou klinických studiích prováděných u dospívajících ve věku 11 - 17 let (studie MenACWY-TT-036) a u dospělých ve věku 18-55 let (studie study MenACWY-TT-035) byla podávána buď jedna dávka vakcíny Nimenrix nebo jedna dávka vakcíny ACWY-PS.
U dospívajících i dospělých bylo prokázáno, že Nimenrix je imunologicky non-inferiorní k vakcíně ACWY-PS, pokud jde o odpověď na vakcínu, jak je definována výše (tabulka 11). Odpověď na všechny čtyři meningokokové skupiny navozená vakcínou Nimenrix byla buď podobná, nebo vyšší, než odpověď vyvolaná vakcínou ACWY-PS.
Tabulka 11: Baktericidní protilátková odpověď (rSBA*) na vakcínu Nimenrix a vakcínu
ACWY-PS u dospívajících ve věku 11 - 17 let a dospělých ve věku > 18 let 1 měsíc po očkování__
|
Studie (Věkové rozmezí) |
Skupin a |
Nimenrix |
vakcína ACWY-PS | ||||
|
N |
VR (95% CI) |
GMT (95% CI) |
N |
VR (95% CI) |
GMT (95% CI) | ||
|
Studie MenACWY -TT-036 (11-17 let) |
A |
553 |
85,4 % (82,1; 88,2) |
5 928 (5 557; 6 324) |
191 |
77,5 % (70,9; 83,2) |
2 947 (2 612; 3 326) |
|
C |
642 |
97,4 % (95,8; 98,5) |
13 110 (11 939;14 395) |
211 |
96,7 % (93,3; 98,7) |
8 222 (6 807; 9 930) | |
|
W-135 |
639 |
96,4 % (94,6; 97,7) |
8 247 (7 639; 8 903) |
216 |
87,5 % (82,3; 91,6) |
2 633 (2 299; 3 014) | |
|
Y |
657 |
93,8 % (91,6; 95,5) |
14 086 (13 168; 15 069) |
219 |
78,5 % (72,5; 83,8) |
5 066 (4 463; 5 751) | |
|
Studie |
A |
743 |
80,1 % |
3625 |
252 |
69,8 % |
2127 |
|
MenACWY -TT-035 (18-55 let) |
(77,0; 82,9) |
(3372; 3897) |
(63,8; 75,4) |
(1909;2370) | |||
|
C |
849 |
91,5 % (89,4; 93,3) |
8866 (8011; 9812) |
288 |
92,0 % (88,3; 94,9) |
7371 (6297;8628) | |
|
W-135 |
860 |
90,2 % (88,1; 92,1) |
5136 (4699;5614) |
283 |
85,5 % (80,9; 89,4) |
2461 (2081; 2911) | |
|
Y |
862 |
87,0 % (84,6; 89,2) |
7711 (7100; 8374) |
288 |
78,8 % (73,6; 83,4) |
4314 (3782; 4921) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. VR: odpověď na vakcínu * testováno v GSK laboratořích.
V samostatné studii (MenACWY-TT-085) byla podána jedna dávka vakcíny Nimenrix 194 libanonským dospělým ve věku 56 let a starším (včetně 133 ve věku 56 - 65 let a 61 ve věku
> 65 let). Procento subjektů s rSBA titry (měřeno v GSK laboratořích) > 128 bylo před očkováním v rozsahu od 45 % (MenC) do 62 % (MenY). Celkově bylo jeden měsíc po očkování % subjektů očkovaných s rSBA titry > 128 v rozsahu od 93 % (MenC) do 97 % (MenY). V podskupině ve věku
> 65 let bylo % očkovaných subjektů s rSBA titry > 128 jeden měsíc po očkování v rozsahu od 90 % (MenA) do 97 % (MenY).
Perzistence imunitní odpovědi u dospívajících ve věku 11 - 17 let
Ve studii MenACWY-TT-043 byla perzistence imunitní odpovědi hodnocena 5 let po očkování u dospívajících primárně očkovaných ve studii MenACWY-TT-036 (tabulka 12). Primární výsledky této studie viz tabulka 11.
Tabulka 12: Údaje týkající se pětileté perzistence (rSBA*) u dospívajících ve věku 11 - 17 let při vakcinaci
|
Skupi na |
Časový bod (roky) |
Nimenrix |
Vakcína ACWY-PS | ||||
|
N |
>8 (95%CI) |
GMT (95%CI) |
N |
>8 (95%CI) |
GMT (95%CI) | ||
|
A |
3 |
449 |
92,9 % (90,1; 95,1) |
448 (381; 527) |
150 |
82,7 % (75,6; 88,4) |
206 (147; 288) |
|
5 |
236 |
97,5 % (94,5; 99,1) |
644 (531; 781) |
86 |
93,0 % (85,4; 97,4) |
296 (202; 433) | |
|
C |
3 |
449 |
91,1 % (88,1; 93,6) |
371 (309; 446) |
150 |
86,0 % (79,4; 91,1) |
390 (262; 580) |
|
5 |
236 |
88,6 % (83,8; 92,3) |
249 (194; 318) |
85 |
87,1 % (78,0; 93,4) |
366 (224; 599) | |
|
W-135 |
3 |
449 |
82,0 % (78,1; 85,4) |
338 (268; 426) |
150 |
30,0 % (22,8; 38,0) |
16,0 (10,9; 23,6) |
|
5 |
236 |
86,0 % (80,9; 90,2) |
437 (324; 588) |
86 |
34,9 % (24,9; 45,9) |
19,7 (11,8; 32,9) | |
|
Y |
3 |
449 |
93,1 % (90,3; 95,3) |
740 (620; 884) |
150 |
58,0 % (49,7; 66,0) |
69,6 (44,6; 109) |
|
5 |
236 |
96,6 % (93,4; 98,5) |
1000 (824; 1214) |
86 |
66,3 % (55,3; 76,1) |
125 (71,2; 219) | |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptovaná pro každý časový bod.
* rSBA testování provedeno v PHE laboratořích ve Velké Británii.
Perzistence imunitní odpovědi u dospívajících a dospělých ve věku 11-25 let Ve studii MenACWY-TT-059 byla perzistence imunitní odpovědi hodnocena pomocí hSBA 1 rok a 5 let po očkování u dospívajících a dospělých ve věku 11-25 let primárně očkovaných ve studii MenACWY-TT-052 (tabulka 13) (viz bod 4.4).
Tabulka 13: Údaje 1 měsíc po očkování a perzistence (hSBA*) 5 let po očkování u dospívajících a dospělých ve věku 11-25 let____
|
Skupina |
Odpověď na |
Časový bod |
N |
> 8 (95%CI) |
GMT (95%CI) |
|
A |
Nimenrix |
měsíc 1 |
356 |
82,0 % (77,6; 85,9) |
58,7 (48,6; 70,9) |
|
rok 1 |
350 |
29,1 % (24,4; 34,2) |
5,4 (4,5; 6,4) | ||
|
rok 5 |
141 |
48,9 % (40,4; 57,5) |
8,9 (6,8; 11,8) | ||
|
C |
Nimenrix |
měsíc 1 |
359 |
96,1 % (93,5; 97,9) |
532 (424; 668) |
|
rok 1 |
336 |
94,9 % (92,0; 97,0) |
172 (142;207) | ||
|
rok 5 |
140 |
92,9 % (87,3; 96,5) |
94,6 (65,9; 136) | ||
|
W-135 |
Nimenrix |
měsíc 1 |
334 |
91,0% (87,4; 93,9) |
117 (96,8; 141) |
|
rok 1 |
327 |
98,5 % (96,5; 99,5) |
197 (173;225) | ||
|
rok 5 |
138 |
87,0% (80,2; 92,1) |
103 (76,3; 140) | ||
|
Y |
Nimenrix |
měsíc 1 |
364 |
95,1 % (92,3; 97,0) |
246 (208; 291) |
|
rok 1 |
356 |
97,8 % (95,6; 99,0) |
272 (237; 311) | ||
|
rok 5 |
142 |
94,4 % (89,2; 97,5) |
225 (174;290) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptované pro každý časový bod.
* Testováno v GSK laboratořích.
Odpověď na posilovači dávku u subjektů dříve očkovaných konjugovanou meningokokovou vakcínou proti Neisseria meningitidis
Posilovací očkování vakcínou Nimenrix po základním očkování u kojenců, dětí, dospívajících a dospělých: U subjektů očkovaných vakcínou Nimenrix ve věku 1 rok a starších a přeočkovaných vakcínou Nimenrix za 4 nebo 5 let později více než 99,0 % všech subjektů dosáhlo po přeočkování titrů SBA > 1:8 u všech analýz (studie MenACWY-TT-062, 048, 059, 088). Jeden měsíc po posilovací dávce byly vyvolané hodnoty GMT významně vyšší než hodnoty ve skupině kontrol k léčbě naivních odpovídajícího věku, což naznačuje, že vakcína Nimenrix vyvolává imunitní paměť na skupiny A, C, W-135 aY.
Odpověď pozorovaná po podání posilovací dávky u skupiny C byla u vakcíny Nimenrix podobná jako odpověď pozorovaná u subjektů očkovaných a přeočkovaných monovalentní konjugovanou vakcínou MenC-CRM. Jeden rok po podání posilovací dávky vakcíny Nimenrix přetrvávaly titry SBA > 1:8 nejméně u 95,5 % subjektů (studie MenACWY-TT-048, věk 12 až 23 měsíců při základním očkování).
Pokud byla vakcína Nimenrix použita jako posilovací dávka po základním očkování konjugovanou vakcínou MenACWY-DT nebo monovalentní konjugovanou vakcínou skupiny C (studie MenACWY-TT-059, věk 10 až 25 let při základním očkování, a studie MenACWY-TT-088, věk 2 až 10 let při primárním očkování), titry se u všech skupin zvýšily 48 - 340krát a 100 % subjektů dosáhlo titrů SBA > 1:8.
Odpověď na posilovací dávku u subjektů dříve očkovaných polysacharidovou vakcínou proti Neisseria meningitidis
Ve studii MenACWY-TT-021 prováděné u subjektů ve věku 4,5 - 34 let byla imunogenicita vakcíny Nimenrix podávané mezi 30. a 42. měsícem po očkování vakcínou ACWY-PS porovnávána s imunogenicitou vakcíny Nimenrix podané subjektům odpovídajícího věku, které nebyly v předchozích 10 letech očkovány žádnou meningokokovou vakcínou. Imunitní odpověď (rSBA titr >8) byla pozorována ve všech skupinách (A, C, W-135, Y) u všech subjektů bez ohledu na anamnézu očkování proti meningokokům. GMT rSBA byly významně nižší u subjektů, které dostaly jednu dávku vakcíny ACWY-PS 30 -42 měsíců před podáním vakcíny Nimenrix (tabulka 14) (viz bod 4.4).
podle jejich anamnézy očkování proti meningokokům
|
Skupin a |
Subjekty očkované před 30 až 42 měsíci vakcínou ACWY-PS |
Subjekty, které nedostaly v posledních 10 letech žádnou meningokokovou vakcínu | ||||
|
N |
>8 (95%CI) |
GMT (95%CI) |
N |
>8 (95%CI) |
GMT (95%CI) | |
|
A |
146 |
100 % (97,5; 100) |
6 869 (6 045; 7 805) |
69 |
100 % (94,8; 100) |
13 015 (10 722; 15 798) |
|
C |
169 |
100 % (97,8; 100) |
1 946 (1 583; 2 391) |
75 |
100 % (95,2; 100) |
5 495 (4 266; 7 076) |
|
W-135 |
169 |
100 % (97,8; 100) |
4 636 (3 942; 5 451) |
75 |
100 % (95,2; 100) |
9 078 (7 088;11 627) |
|
Y |
169 |
100 % (97,8; 100) |
7 800 (6 683; 9 104) |
75 |
100 % (95,2; 100) |
13 895 (11 186; 17 261) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity.
* Testováno v GSK laboratořích.
Evropská agentura pro léčivé přípravky nevyžaduje splnění povinnosti předložit výsledky studií s vakcínou Nimenrix u jedné nebo více podskupin pediatrické populace v indikaci prevence meningokokového onemocnění způsobeného Neisseria meningitidis skupiny A, C, W-135 a Y (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Není aplikovatelné.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií lokální snášenlivosti, akutní toxicity, toxicity po opakovaném podávání, reprodukční a vývojové toxicity a fertility neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Sacharosa
Trometamol
Rozpouštědlo:
Chlorid sodný Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky
Po rekonstituci:
Po rekonstituci musí být vakcína použita bezodkladně. Ačkoliv prodleva se nedoporučuje, stabilita byla nicméně po rekonstituci prokázána po dobu 8 hodin při teplotě 30 °C. Pokud vakcína není použita v průběhu 8 hodin, nesmí se již podávat.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Prášek v injekční lahvičce (sklo typu I) se zátkou (butylová pryž) a rozpouštědlo v předplněné injekční stříkačce se zátkou (butylová pryž).
Velikost balení 1 a 10, s jehlami nebo bez jehel.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Návod pro rekonstituci vakcíny přiloženým rozpouštědlem v předplněné injekční stříkačce
Nimenrix musí být rekonstituován přidáním celého obsahu rozpouštědla z předplněné injekční stríkačky do injekční lahvičky obsahující prášek.
Připojení jehly k injekční stříkačce viz obrázek níže. Injekční stříkačka dodávaná s vakcínou Nimenrix však může být lehce odlišná (bez šroubovacího závitu) od injekční stříkačky popsané na obrázku.
V tomto případě připojte jehlu bez šroubování.
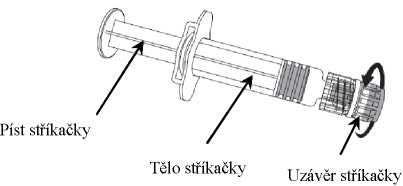
1. Držte tělo stříkačky jednou rukou (nedržte stříkačku za píst), odšroubujte uzávěr stříkačky otáčením proti směru hodinových ručiček.
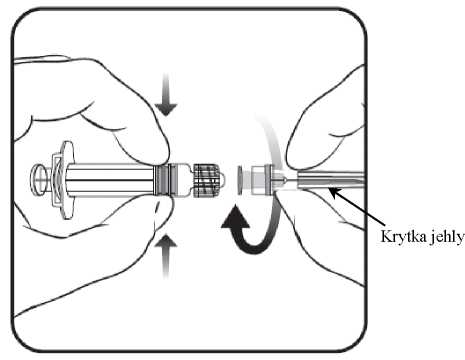
2. Abyste připojil(a) jehlu ke stříkačce, našroubuje jehlu na stříkačku
ve směru hodinových ručiček dokud neucítíte, že je pevně připojena (viz obrázek).
3. Odstraňte krytku jehly, což může jít někdy trochu obtížně.
4. Přidejte rozpouštědlo k prášku. Po přidání rozpouštědla k prášku směs protřepávejte, dokud se všechen prášek úplně nerozpustí v rozpouštědle.
Rekonstituovaná vakcína je čirý bezbarvý roztok.
Rekonstituovanou vakcínu je třeba před podáním zkontrolovat pohledem, zda neobsahuje cizí částice a/nebo odchylky od fyzikálního vzhledu. V případě zaznamenání jakýchkoli změn vakcínu znehodnoťte.
Po rekonstituci je nutné vakcínu bezodkladně použít.
K podání vakcíny je nutné použít novou jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpadní materiál musí být znehodnocen v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/767/001
EU/1/12/767/002
EU/1/12/767/003
EU/1/12/767/004
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. dubna 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Nimenrix prášek pro injekční roztok a rozpouštědlo v ampulce Konjugovaná vakcína proti meningokokům skupin A, C, W-135 a Y
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Neisseria meningitidis group A polysacharidum1 Neisseria meningitidis group C polysacharidum1 Neisseria meningitidis group W-135 polysacharidum1 Neisseria meningitidis group Y polysacharidum1
1konjugováno na proteinový nosič tetanický toxoid
5 mikrogramů 5 mikrogramů 5 mikrogramů 5 mikrogramů
44 mikrogramů
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok a rozpouštědlo Prášek je bílý.
Rozpouštědlo je čiré, bezbarvé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Nimenrix je indikován k aktivní imunizaci osob od 12 měsíců věku a starších proti invazivnímu meningokokovému onemocnění způsobenému Neisseria meningitidis skupiny A, C, W-135 a Y.
4.2 Dávkování a způsob podání
Dávkování
Nimenrix se má podávat v souladu s dostupnými oficiálními doporučeními.
K imunizaci se používá jedna dávka 0,5 ml rekonstituované vakcíny.
Nimenrix lze podat jako přeočkování jedincům, kteří dříve dostali základní očkování vakcínou Nimenrix nebo jinými konjugovanými či polysacharidovými meningokokovými vakcínami (viz body 4.4 a 5.1).
U určitých osob lze zvážit druhou dávku vakcíny Nimenrix (viz bod 4.4).
Bezpečnost a účinnost vakcíny Nimenrix u dětí mladších 12 měsíců nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Imunizace se provádí pouze intramuskulámí injekcí, nejlépe do deltového svalu.
U dětí ve věku 12 až 23 měsíců lze vakcínu rovněž aplikovat do anterolaterální strany stehna (viz body 4.4 a 4.5).
Instrukce týkající se rekonstituce léčivého přípravku před podáním viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Nimenrix se nesmí za žádných okolností podávat intravaskulárně, intradermálně ani subkutánně.
Podle zásad správné klinické praxe předchází očkování zhodnocení anamnézy (zejména s ohledem na předchozí očkování a možný výskyt nežádoucích účinků) a klinické vyšetření.
Pro případ vzácné anafylaktické reakce po podání vakcíny musí být vždy k dispozici příslušná lékařská péče a dohled.
Interkurentní onemocnění
Očkování vakcínou Nimenrix je třeba odložit u osob trpících závažným akutním horečnatým onemocněním. Lehká infekce, jako je např. nachlazení, by neměla být důvodem k odložení očkování.
Synkopa
Během jakéhokoliv očkování, nebo dokonce před ním, může dojít zejména u dospívajících v důsledku psychogenní reakce na injekční jehlu k synkopě (mdlobě). Tato reakce může být doprovázena závažnými neurologickými příznaky, jako je přechodná porucha zraku, parestezie a tonicko-klonické záškuby končetin během zotavení. Je důležité přijmout příslušná opatření, aby při mdlobách nedošlo k poranění.
Trombocytopenie a poruchy krevní srážlivosti
Nimenrix je třeba podávat s opatrností osobám s trombocytopenií nebo s jakoukoli poruchou krevní srážlivosti, protože po intramuskulámí aplikaci může dojít u těchto osob ke krvácení.
Imunodeficience
Lze očekávat, že u pacientů léčených imunosupresivy nebo u pacientů s imunodeficiencí nemusí dojít k vyvolání odpovídající imunitní odpovědi.
Bezpečnost a imunogenicita nebyla hodnocena u pacientů se zvýšenou citlivostí k meningokokové infekci způsobené určitými onemocněními, jako jsou deficience terminálního komplementu a anatomická nebo funkční asplenie. U těchto osob nemusí dojít k vyvolání odpovídající imunitní odpovědi.
Ochrana proti meningokokovému onemocnění
Nimenrix poskytuje ochranu pouze proti Neisseria meningitidis skupiny A, C, W-135 a Y. Tato vakcína nechrání proti žádným jiným skupinám Neisseria meningitidis.
K vyvolání protektivní imunitní odpovědi nemusí dojít u všech očkovaných osob.
Vliv předchozího očkovánípolysacharidovou meningokokovou vakcínou Osoby dříve očkované polysacharidovou meningokokovou vakcínou a poté s odstupem 30 až 42 měsíců vakcínou Nimenrix měly nižší geometrický průměr titrů protilátek (GTM - geometric means titres) měřených pomocí analýzy baktericidních protilátek v séru za použití králičího komplementu (rSBA) ve srovnání s osobami, které nebyly očkovány žádnou meningokokovou vakcínou během předchozích 10 let (viz bod 5.1). Klinický význam těchto pozorování není známý.
Vliv přítomnosti protilátek proti tetanickému toxoidu před očkováním
Bezpečnost a imunogenicita vakcíny Nimenrix byla hodnocena při následném nebo společném podání spolu s vakcínou DTaP-HBV-IPV/Hib v druhém roce života. Podání vakcíny Nimenrix jeden měsíc po vakcíně DTaP-HBV-IPV/Hib vedlo k nižším rSBA GMT proti MenA, MenC a MenW-135 v porovnání se souběžným podáním (viz bod 4.5). Klinický význam těchto pozorování není známý.
Imunitní odpovědi u batolat ve věku 12-14 měsíců
Za jeden měsíc po podání dávky měla batolata ve věku 12-14 měsíců podobné protilátkové odpovědi rSBA na skupiny A, C, W-135 a Y po jedné dávce vakcíny Nimenrix i po dvou dávkách vakcíny Nimenrix podaných s odstupem dvou měsíců.
Jedna dávka byla spojena s nižšími titry sérových baktericidních protilátek proti skupinám W-135 a Y v analýze za použití lidského komplementu (hSBA) v porovnání se dvěma dávkami podanými s odstupem dvou měsíců. Po jedné nebo dvou dávkách byly pozorovány podobné odpovědi na skupiny A a C (viz bod 5.1). Klinický význam těchto zjištění není znám. Pokud e u batolete očekává vyšší riziko invazivního meningokokového onemocnění kvůli expozici skupinám W-135 a Y, lze zvážit podání druhé dávky v intervalu 2 měsíců. Ohledně poklesu protilátek proti MenA nebo MenC po první dávce vakcíny Nimenrix u dětí ve věku 12-23 měsíců si přečtěte informace o perzistenci titrů sérových baktericidních protilátek.
Perzistence titrů sérových baktericidních protilátek
Po podání vakcíny Nimenrix nastává pokles titrů sérových baktericidních protilátek proti MenA, když byl při analýze použitý lidský komplement (hSBA) (viz bod 5.1). Klinický význam poklesu titrů protilátek hSBA-MenA není znám. Pokud se však u určitého pacienta očekává vyšší riziko expozice MenA a pokud mu byla podána dávka vakcíny Nimenrix před více než rokem, lze zvážit podání posilovací dávky.
Pokles titrů protilátek byl v čase pozorován u skupin A, C,W-135 a Y. Klinický význam poklesu titrů protilátek není znám. Posilovací dávka může být zvážena u očkovaných jedinců v batolecím věku, kteří jsou vystaveni vysokému riziku expozice meningokokovým onemocněním způsobeným skupinami A, C,W-135 nebo Y (viz bod 5.1).
Vliv vakcíny Nimenrix na koncentraci protilátek proti tetanu
Ačkoli po očkování vakcínou Nimenrix bylo pozorováno zvýšení koncentrace protilátek proti tetanickému toxoidu (TT), přípravek Nimenrix nenahrazuje očkování proti tetanu.
Podávání vakcíny Nimenrix společně s vakcínou obsahující TT, nebo jeden měsíc před jejím podáním během druhého roku života nemělo vliv na odpověď na TT ani významně neovlivnilo bezpečnost. Pro osoby starší než 2 roky nejsou k dispozici žádné údaje.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nimenrix lze podávat společně s jakoukoli z následujících očkovacích látek: vakcíny proti hepatitidě A (HAV) a hepatitidě B (HIV), vakcína proti spalničkám, příušnicím a zarděnkám (MMR), vakcína proti spalničkám, příušnicím, zarděnkám a planým neštovicím (MMRV), desetivalentní pneumokoková konjugovaná vakcína nebo neadjuvovaná vakcína proti sezónní chřipce.
Nimenrix lze rovněž podávat společně s kombinovanými vakcínami proti záškrtu, tetanu a černému kašli (acelulární pertuse) během druhého roku života, včetně kombinace vakcín DTaP s vakcínou proti hepatitidě B, dětské obrně (inaktivovaná vakcína) nebo Haemophilus influenzae typu b, jako je vakcína DTaP-HBV-IPV/Hib.
Kdykoli je to možné, mají se vakcíny Nimenrix a vakcína obsahující TT, jako je např. vakcína DTaP-HBV-IPV/Hib, podávat společně, nebo je třeba přípravek Nimenrix podat alespoň jeden měsíc před podáním vakcíny obsahující TT. Následné podání vakcíny Nimenrix jeden měsíc po vakcíně DTaP-HBV-IPV/Hib vedlo k nižším GMT u protilátek proti skupinám A, C, W-135, Y. Klinický význam těchto pozorování není znám, protože nejméně 99,4 % subjektů (N = 178) mělo rSBA titry >8 v každé skupině (A, C, W-135, Y) (viz bod 4.4).
Jeden měsíc po společném podání s desetivalentní pneumokokovou konjugovanou vakcínou byly pozorovány nižší GMC a OPA (opsonophagocyt assay) GMT protilátek u jednoho pneumokokového sérotypu (sérotypu 18C konjugovaného na transportní protein pro tetanický toxoid). Klinický významn tohoto pozorování není znám. Nebyl pozorován žádný vliv společného podávání na dalších devět pneumokokových sérotypů.
Pokud se vakcína Nimenrix podává spolu s jinou injekční vakcínu, je třeba vakcíny aplikovat do různých míst.
U pacientů léčených imunosupresivy lze očekávat, že nemusí dojít k vyvolání dostatečné imunitní odpovědi.
4.6 Fertilita, těhotenství a kojení
K dispozici jsou pouze omezené zkušenosti týkající se použití vakcíny Nimenrix u těhotných žen.
Studie se zvířaty nenaznačují přímé ani nepřímé škodlivé účinky s ohledem na těhotenství, embryo/fetální vývoj, porod ani postnatální vývoj (viz bod 5.3).
Nimenrix by se měl v těhotenství použít pouze, pokud je to nezbytně nutné a pokud možné výhody převáží možná rizika pro plod.
Kojení
Není známo, zda se Nimenrix vylučuje do mateřského mléka.
Nimenrix by se měl při kojení použít pouze pokud možné výhody převáží možná rizika.
Fertilita
Studie se zvířaty nenaznačují na přímé ani nepřímé škodlivé účinky s ohledem na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie hodnotící vliv vakcíny Nimenrix na schopnost řídit a obsluhovat stroje. Některé nežádoucí účinky uvedené v bodě 4.8 „Nežádoucí účinky“ však mohou ovlivnit schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Bezpečnostní profil uvedený níže je založený na souhrnné analýze 9 621 subjektů, které byly v rámci klinických studií očkovány jednou dávkou vakcíny Nimenrix. Tato souhrnná analýza zahrnuje údaje od 3 079 batolat (12 měsíců až 23 měsíců), 909 dětí mezi 2 a 5 lety, 990 dětí mezi 6 a 10 lety,
2 317 dospívajících (11 až 17 let) a 2 326 dospělých (18 až 55 let).
Ve všech věkových skupinách byly nejčastěji hlášenými lokálními nežádoucími účinky po očkování bolest (24,1 % až 41,3 %), zarudnutí (15,5 % až 35,6 %) a otok (11,3 % až 19,9 %).
Ve věkových skupinách 12 - 23 měsíců a 2 - 5 let byly nejčastěji hlášené celkové nežádoucí účinky po očkování podrážděnost (44,0 % a 9,2 %), spavost (34,1 % a 10,8 %), ztráta chuti k jídlu (26,6 % a 8,2 %) a horečka (17,1 % a 8,1 %).
Ve věkové skupině 12-14 měsíců, která dostala 2 dávky vakcíny Nimenrix podané s odstupem 2 měsíců, byla první a druhá dávka spojena s podobnou lokální a systémovou reakcí.
Ve věkových skupinách 6-10, 11-17 a > 18 let byly nejčastěji hlášené celkové nežádoucí účinky po očkování bolest hlavy (15,7 %, 22,0 % a 21,5 %), únava (15,6 %, 21,9 % a 20,7 %), gastrointestinální příznaky (9,3 %, 9,4 % a 8,3 %) a horečka (8,0 %, 5,3 % a 4,9 %).
Profil lokálních a celkových nežádoucích účinků při přeočkování vakcínou Nimenrix po základním očkování vakcínou Nimenrix nebo jinými konjugovanými či polysacharidovými meningokokovými vakcínami byl podobný profilu lokálních a celkových nežádoucích účinků pozorovanému po základním očkování vakcínou Nimenrix s výjimkou gastrointestinálních příznaků (zahrnujících průjem, zvracení a nevolnost), které byly velmi časté.
V samostatné studii byla podána jedna dávka vakcíny Nimenrix 274 subjektům ve věku 56 let a starším. Všechny nežádoucí účinky hlášené v této studii byly již pozorovány u mladších věkových skupin.
Souhrn nežádoucích účinků v tabulce
Nežádoucí účinky jsou zaznamenány podle následujících kategorií četností:
Velmi časté: Časté:
Méně časté: Vzácné:
Velmi vzácné:
(> 1/10)
(> 1/100 až < 1/10)
(> 1/1 000 až < 1/100)
(> 1/10 000 až < 1/1 000) (< 1/10 000)
|
Třída orgánových systémů |
Četnost |
Nežádoucí účinky |
|
Klinické studie | ||
|
Poruchy metabolismu a výživy |
Velmi časté |
Ztráta chuti k jídlu |
|
Psychiatrické poruchy |
Velmi časté | |
|
Méně časté |
Nespavost, pláč | |
|
Poruchy nervového systému |
Velmi časté |
Spavost, bolest hlavy |
|
Méně časté |
Hypestezie, závrať | |
|
Gastrointestinální poruchy |
Časté |
Gastrointestinální příznaky (včetně průjmu, |
|
zvracení a nauzey) | ||
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Myalgie, bolest končetin |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Horečka, otok, bolest a zarudnutí v místě vpichu injekce, únava |
|
Časté |
Hematom v místě vpichu injekce | |
|
Méně časté |
Malátnost, reakce v místě vpichu injekce (včetně indurace, svědění, zteplání a necitlivosti) | |
|
Postmarketingové sledování | ||
|
Celkové poruchy a reakce v místě aplikace |
Vzácné |
Rozsáhlý otok končetiny v místě vpichu injekce, často spojen se zarudnutím, někdy postihující přilehlý kloub nebo otok celé končetiny |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyl hlášen žádný případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny, meningokokové vakcíny, ATC kód: J07AH08 Mechanismus účinku
Antikapsulární meningokokové protilátky chrání před meningokokovým onemocněním prostřednictvím komplementem zprostředkované baktericidní aktivity. Nimenrix indukuje tvorbu baktericidních protilátek proti kapsulárním polysacharidům skupiny A, C, W-135 a Y, hodnocenou pomocí analýzy za použití králičího (rSBA) nebo lidského komplementu (hSBA).
Farmakodynamické účinky
Imunogenicita
Imunogenicita jedné dávky vakcíny Nimenrix byla hodnocena u více než 8 000 subjektů ve věku > 12 měsíců.
Účinnost vakcíny byla odvozena od průkazu imunologické non-inferiority (založené převážně na srovnávacích poměrech s titry rSBA, které jsou alespoň 8) vůči registrovaným meningokokovým vakcínám. Imunogenicita byla měřena za použití rSBA nebo hSBA, které jsou biologickými markery protektivní účinnosti proti meningokokům skupin A, C, W-135 a Y.
Perzistence imunitní odpovědi
Perzistence imunitní odpovědi vyvolané podáním vakcíny Nimenrix byla hodnocena až 60 měsíců po očkování u subjektů ve věku 12 měsíců až 55 let.
Protilátky vyvolané podáním přípravku Nimenrix byly podobné nebo vyšší než protilátky vyvolané registrovanými meningokokovými vakcínami (tj. vakcínou MenC-CRM u subjektů ve věku 12 - 23 let a vakcínou ACWY-PS u subjetků ve věku starších 2 let).
Odpověď na přeočkování
V klinických hodnoceních bylo hodnoceno použití vakcíny Nimenrix jako přeočkování po základním očkování přípravkem Nimenrix nebo jinými meningokokovými vakcínami (kvadrivalentní konjugovanou meningokokovou vakcínou A, C, W a Y-DT nebo monovalentními konjugovanými vakcínami skupiny C).
Batolata
Imunogenicita u batolat ve věku 12-23 měsíců
V klinických studiích MenACWY-TT-039 a MenACWY-TT-040 jedna dávka vakcíny Nimenrix vyvolávala odpovědi rSBA proti všem čtyřem meningokokovým skupinám, přičemž odpověď proti skupině C byla srovnatelná s odpovědí vyvolanou registrovanou vakcínou MenC-CRM, pokud jde o % subjektů s titry rSBA > 8 (tabulka 1).
Tabulka 1: Baktericidní protilátková odpověď (rSBA*) u batolat ve věku 12 - 23 měsíců
|
Skupina |
Odpověď na |
Studie MenACWY-TT-039(1) |
Studie MenACWY-TT-040(2) | ||||
|
N |
>8 (95% CI) |
GMT (95% CI) |
N |
>8 (95% CI) |
GMT (95% CI) | ||
|
A |
Nimenrix |
354 |
99,7 % (98,4; 100) |
2 205 (2 008;2 422) |
183 |
98,4 % (95,3;99,7) |
3 170 (2 577; 3 899) |
|
C |
Nimenrix |
354 |
99,7 % (98,4; 100) |
478 (437; 522) |
183 |
97,3 % (93,7; 99,1) |
829 (672; 1 021) |
|
vakcína MenC-CRM |
121 |
97,5 % (92,9; 99,5) |
212 (170; 265) |
114 |
98,2 % (93,8; 99,8) |
691 (521; 918) | |
|
W-135 |
Nimenrix |
354 |
100 % (99,0; 100) |
2 682 (2 453; 2 932) |
186 |
98,4 % (95,4; 99,7) |
4 022 (3 269; 4 949) |
|
Y |
Nimenrix |
354 |
100 % (99,0; 100) |
2 729 (2 473; 3 013) |
185 |
97,3 % (93,8; 99,1) |
3 168 (2 522; 3 979) |
Analýza imunogenicity byla provedena v ATP kohortách pro hodnocení imunogenicity.
(1) krevní vzorky byly odebrány 42 až 56 dnů po vakcinaci
(2) krevní vzorky byly odebrány 30 až 42 dnů po vakcinaci * testováno v GSK laboratořích.
Ve studii MenACWY-TT-039 byla jako sekundární cílový parametr hodnocena baktericidní aktivita v séru rovněž s použitím lidského séra jako zdroje komplementu (hSBA) (tabulka 2).
Tabulka 2: Baktericidní protilátková odpověď (hSBA*) u batolat ve věku 12 -23 měsíců
|
Skupina |
Odpověď na |
N |
Studie MenACWY-TT-039(1) * | |
|
>8 (95% CI) |
GMT (95% CI) | |||
|
A |
Nimenrix |
338 |
77,2 % (72,4; 81,6) |
19,0 (16,4; 22,1) |
|
C |
Nimenrix |
341 |
98,5 % (96,6; 99,5) |
196 (175; 219) |
|
vakcína MenC-CRM |
116 |
81,9% (73,7; 88,4) |
40,3 (29,5; 55,1) | |
|
W-135 |
Nimenrix |
336 |
87,5 % (83,5; 90,8) |
48,9 (41,2; 58,0) |
|
Y |
Nimenrix |
329 |
79,3 % (74,5; 83,6) |
30,9 (25,8; 37,1) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. (1) krevní vzorky byly odebrány 42 až 56 dnů po vakcinaci * testováno v GSK laboratořích.
Ve studii Men ACWY-TT-104 byla hodnocena imunitní odpověď po jedné nebo dvou dávkách vakcíny Nimenrix, podaných s odstupem 2 měsíců, jeden měsíc po poslední vakcinaci. Vakcína Nimenrix vyvolávala baktericidní odpovědi proti všem čtyřem skupinám, které byly podobné, pokud jde o % subjektů s titrem rSBA >8 a GMT po jedné nebo dvou dávkách (tabulka 3).
Tabulka 3: Baktericidní protilátková odpověď (rSBA*) u batolat ve věku 12 - 14 měsíců
|
Skupina |
Odpověď na |
Načasování |
Studie MenACWY-TT-104 (1) | ||
|
N |
>8 (95%CI) |
GMT (95% CI) | |||
|
A |
Nimenrix 1 dávka |
Po dávce 1 |
181 |
97,8 % (94,4, 99,4) |
1 445,4 (1 126,1, 1 855,2) |
|
Nimenrix 2 dávky |
Po dávce 1 |
158 |
96,8 % (92,8, 99,0) |
1 275,2 (970,5, 1 675,4) | |
|
Po dávce 2 |
150 |
98,0 % (94,3, 99,6) |
1 176,3 (921,8, 1 501) | ||
|
C |
Nimenrix 1 dávka |
Po dávce 1 |
180 |
95,0 % (90,7, 97,7) |
454,4 (347,7, 593,8) |
|
Nimenrix 2 dávky |
Po dávce 1 |
157 |
95,5 % (91,0, 98,2) |
369,3 (280,9, 485,5) | |
|
Po dávce 2 |
150 |
98,7 % (95,3, 99,8) |
639,1 (521,8, 782,9) | ||
|
W-135 |
Nimenrix 1 dávka |
Po dávce 1 |
181 |
95,0 % (90,8, 97,7) |
2 136,1 (1 614,9, 2 825,5) |
|
Nimenrix 2 dávky |
Po dávce 1 |
158 |
94,9 % (90,3, 97,8) |
2 030,1 (1 510,7, 2 728,2) | |
|
Po dávce 2 |
150 |
100 % (97,6, 100) |
3 533 (2 914,5, 4 282,7) | ||
|
Y |
Nimenrix 1 dávka |
Po dávce 1 |
181 |
92,8 % (88,0, 96,1) |
955.8 (709,1, 1 288,3) |
|
Nimenrix 2 dávky |
Po dávce 1 |
157 |
93,6 % (88,6, 96,9) |
933,3 (692,3, 1 258,3) | |
|
Po dávce 2 |
150 |
99,3 % (96,3, 100) |
1 133,6 (944,5, 1 360,5) | ||
Analýza imunogenicity byla provedena v ATP
kohortě pro hodnocení imunogenicity.
(1) krevní vzorky byly odebrány 21 až 48 dnů po vakcinaci * testováno v laboratořích Public Health England.
Ve studii Men ACWY-TT-104 byla jako sekundární cílový parametr hodnocena baktericidní aktivita v séru rovněž s použitím hSBA. Vakcína Nimenrix vyvolávala baktericidní odpověď proti skupinám W-135 a Y, která byla vyšší, pokud jde o % subjektů s titrem hSBA >8 při podání dvou dávek v porovnání s jedinou dávkou. Podobné odpovědi, pokud jde o % subjektů s titrem hSBA > 8, byly pozorovány u skupin A a C (tabulka 4).
Tabulka 4: Baktericidní protilátková odpověď hSBA* u batolat ve věku 12 - 14 měsíců
|
Skupina |
Odpověď na |
Načasování |
Studie MenACWY-TT-104(1) | ||
|
N |
>8 (95%CI) |
GMT (95% CI) | |||
|
A |
Nimenrix 1 dávka |
Po dávce 1 |
75 |
96,0 % (88,8, 99,2) |
119,3 (88,0, 161,7) |
|
Nimenrix 2 dávky |
Po dávce 1 |
66 |
97,0 % (89,5, 99,6) |
132,9 (98,1, 180,1) | |
|
Po dávce 2 |
66 |
97,0 % (89,5, 99,6) |
170,5 (126,2, 230,2) | ||
|
C |
Nimenrix 1 dávka |
Po dávce 1 |
79 |
98,7 % (93,1, 100) |
151,2 (104,7, 218,3) |
|
Nimenrix 2 dávky |
Po dávce 1 |
70 |
95,7 % (88,0, 99,1) |
161 (110, 236) | |
|
Po dávce 2 |
69 |
100 % (94,8, 100) |
1 753,3 (1 277,7, 2 404,2) | ||
|
W-135 |
Nimenrix 1 dávka |
Po dávce 1 |
72 |
62,5 % (50,3, 73,6) |
27,5 (16,1, 46,8) |
|
Nimenrix 2 dávky |
Po dávce 1 |
61 |
68,9 % (55,7, 80,1) |
26,2 (16,0, 43,0) | |
|
Po dávce 2 |
70 |
97,1 % (90,1, 99,7) |
756,8 (550,1, 1 041,3) | ||
|
Y |
Nimenrix 1 dávka |
Po dávce 1 |
71 |
67,6 % (55,5, 78,20 |
41,2 (23,7, 71,5) |
|
Nimenrix 2 dávky |
Po dávce 1 |
56 |
64,3 % (50,4, 76,6) |
31,9 (17,6, 57,9) | |
|
Po dávce 2 |
64 |
95,3 % (86,9, 99,0) |
513,0 (339,4, 775,4) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. (1) krevní vzorky byly odebrány 21 až 48 dnů po vakcinaci * testováno v GSK laboratořích.
Perzistence imunitní odpovědi u batolat ve věku 12-23 měsíců
U dětí primárně očkovaných v batolecím věku byla perzistence imunitní odpovědi hodnocena pomocí rSBA a hSBA ve studiích MenACWY-TT-048 a MenACWY TT-032 až 4 roky po primárním očkování ve studii MenACWY-TT-039 (tabulka 5) a až 5 let po primárním očkování ve studii MenACWY-TT-027 (tabulka 6).
Tabulka 5: Údaje týkající se čtyřleté perzistence u batolat ve věku 12 - 23 měsíců při očkování
|
Skupin a |
Odpověď na |
Časový bod (rok) |
rSBA* |
hSBA** | ||||
|
N |
>8 (95% CI) |
GMT (95% CI) |
N |
>8 (95%CI) |
GMT (95%CI) | |||
|
A*** |
Nimenrix |
3 |
262 |
59,9 % (53,7; 65,9) |
19,3 (15,7; 23,6) |
251 |
35,9 % (29,9; 42,1) |
5,8 (4,8; 7,0) |
|
4 |
224 |
74,1 % (67,9; 79,7) |
107 (77,6; 148) |
198 |
28,8 % (22,6; 35,6) |
4,9 (4,0; 6,0) | ||
|
C |
Nimenrix |
3 |
262 |
35,9 % (30,1; 42,0) |
9,8 (8,1; 11,7) |
253 |
78,3 % (72,7; 83,2) |
37,8 (29,4; 48,6) |
|
4 |
225 |
40,4 % (34,0; 47,2) |
12,3 (9,8; 15,3) |
209 |
73,2 % (66,7; 79,1) |
32,0 (23,8; 43,0) | ||
|
Vakcína MenC- CRM |
3 |
46 |
13,0 % (4,9; 26,3) |
5,7 (4,2; 7,7) |
31 |
41,9 % (24,5; 60,9) |
6,2 (3,7; 10,3) | |
|
4 |
45 |
35,6 % (21,9; 51,2) |
13,5 (7,4; 24,5) |
32 |
46,9 % (29,1; 65,3) |
11,3 (4,9; 25,6) | ||
|
W-135 |
Nimenrix |
3 |
261 |
49,8 % (43,6; 56,0) |
24,9 (19,2; 32,4) |
254 |
82,3 % (77,0; 86,8) |
52,0 (41,4; 65,2) |
|
4 |
225 |
49,3 % (42,6; 56,1) |
30,5 (22,4; 41,5) |
165 |
80,6 % (73,7; 86,3) |
47,1 (35,7; 62,2) | ||
|
Y |
Nimenrix |
3 |
262 |
53,8 % (47,6; 60,0) |
22,3 (17,6; 28,4) |
250 |
72,0 % (66,0; 77,5) |
33,2 (25,9; 42,5) |
|
4 |
225 |
58,2 % |
36,2 |
130 |
65,4 % |
29,8 | ||
|
(51,5; 64,7) |
(27,1; 48,4) |
(56,5; 73,5) |
(20,2; 44,1) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptované pro každý časový bod.
*rSBA testování provedeno v Public Health England (PHE) laboratořích ve Velké Británii.
** Testováno v GSK laboratořích.
***Podobně jako nárůst GMTs v rSBA MenA byl pozorován nárůst geometrických průměrů koncentrací IgG MenA mezi rokem 3 a rokem 4.
Tabulka 6: Údaje týkající se pětileté perzistence u batolat ve věku 12 - 23 měsíců v době
očkování (studie MenACWY-TT-032) -1—5-1-
|
Skupina |
Odpověď na |
Časový bod (rok) |
rSBA* |
hSBA** | ||||
|
N |
>8 (95% CI) |
GMT (95% CI) |
N |
>8 (95% CI) |
GMT (95% CI) | |||
|
A |
Nimenrix |
4 |
45 |
64,4 % (48,8; 78,1) |
35,1 (19,4; 63,4) |
44 |
52,3 % (36,7; 67,5) |
8,8 (5,4; 14,2) |
|
5 |
49 |
73,5 % (58,9; 85,1) |
37,4 (22,1; 63,2) |
45 |
35,6 % (21,9: 51,2) |
5,2 (3,4; 7,8) | ||
|
C |
Nimenrix |
4 |
45 |
97,8 % (88,2; 99,9) |
110 (62.7; 192) |
45 |
97,8 % (88,2; 99,9) |
370 (214; 640) |
|
5 |
49 |
77,6 % (63,4; 88,2) |
48,9 (28,5; 84,0) |
48 |
91,7 % (80,0; 97,7) |
216 (124; 379) | ||
|
Vakcína MenC- CRM |
4 |
10 |
80,0 % (44,4; 97,5) |
137 (22,6; 832) |
10 |
70,0 % (34,8; 93,3) |
91,9 (9,8; 859) | |
|
5 |
11 |
63,6 % (30,8; 89,1) |
26,5 (6,5; 107) |
11 |
90,9 % (58,7; 99,8) |
109 (21,2; 557) | ||
|
W-135 |
Nimenrix |
4 |
45 |
60,0 % (44,3; 74,3) |
50,8 (24,0; 108) |
45 |
84,4 % (70,5; 93,5) |
76,9 (44,0; 134) |
|
5 |
49 |
34,7 % (21,7; 49,6) |
18,2 (9,3; 35,3) |
46 |
82,6 % (68,6; 92,2) |
59,7 (35,1; 101) | ||
|
Y |
Nimenrix |
4 |
45 |
62,2 % (46,5; 76,2) |
44,9 (22,6; 89,3) |
41 |
87,8 % (73,8; 95,9) |
74,6 (44,5; 125) |
|
5 |
49 |
42,9 % (28,8; 57,8) |
20,6 (10,9; 39,2) |
45 |
80,0 % (65,4; 90,4) |
70,6 (38,7; 129) | ||
Perzistence imunogenicity byla analyzována použitím roku 5 ATP kohorty. Selekční bias hlavně kvůli přeočkování subjektů s MenC rSBA titry <8 a jejich vyloučení z následného časového bodu (následných časových bodů) může vést k nadhodnocení titrů.
*rSBA testování provedeno v PHE laboratořích ve Velké Británii.
** Testováno v GSK laboratořích.
Imunitní paměť
Ve studii MenACWY-TT-014 bylo hodnoceno vyvolání imunitní paměti jeden měsíc po podání pětiny dávky vakcíny ACWY-PS (10 ^g každého polysacharidu) dětem ve třetím roce života, které byly primárně očkované ve studii MenACWY-TT-013 vakcínou Nimenrix nebo registrovanou vakcínou MenC-CRM ve věku 12 až 14 měsíců.
Jeden měsíc po podání provokační (challenge) dávky byly GMT vyvolané u subjektů primárně očkovaných vakcínou Nimenrix zvýšeny 6,5 až 8násobně u skupin A, C, W-135 a Y a ukazovaly, že Nimenrix indukuje imunitní paměť vůči skupinám A, W-135 a Y. Post-challenge GMT rSBA-MenC byly podobné v obou studijních skupinách, což ukazuje, že Nimenrix indukuje obdobnou imunitní paměť vůči skupině C jako registrovaná vakcína MenC-CRM (tabulka 7).
primárně očkovaných vakcínou Nimenrix nebo vakcínou MenC-CRM ve věku 12 až 14 měsíců
|
Skupina |
Odpověď na |
Pre-challenge |
Post-challenge | ||
|
N |
GMT (95% CI) |
N |
GMT (95% CI) | ||
|
A |
Nimenrix |
32 |
544 (325;911) |
25 |
3 322 (2 294; 4 810) |
|
C |
Nimenrix |
31 |
174 (105; 289) |
32 |
5 966 (4 128; 8 621) |
|
vakcína MenC-CRM |
28 |
34,4 (15,8; 75,3) |
30 |
5 265 (3 437; 8 065) | |
|
W-135 |
Nimenrix |
32 |
644 (394; 1 052) |
32 |
11 058 (8 587; 14 240) |
|
Y |
Nimenrix |
32 |
440 (274; 706) |
32 |
5 737 (4 216; 7 806) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. *Testováno v GSK laboratořích.
Děti
Imunogenicita u dětí ve věku 2- 10 let
Ve dvou srovnávacích studiích prováděných u subjektů ve věku 2 - 10 let dostala jedna skupina subjektů jednu dávku vakcíny Nimenrix a druhá skupina jako srovnávací přípravek jednu dávku buď registrovanou vakcínu MenC-CRM (studie MenACWY-TT-081) nebo registrované polysacharidové vakcíny proti meningokokům skupin A, C, W-135, Y (ACWY-PS) společnosti GlaxoSmithKline Biologicals (studie MenACWY-TT-038).
Ve studii MenACWY-TT-038 bylo prokázáno, že Nimenrix je non-inferiorní k registrované vakcíně ACWY-PC, pokud jde o odpověď na vakcínu u všech čtyř skupin (A, C, W-135 a Y) (viz tabulka 8).
Odpověď na vakcínu byla definována jako poměr subjektů s:
• rSBA titry > 32 u původně séronegativních subjektů (tj. rSBA titr před vakcinací < 8)
• alespoň 4násobné zvýšení rSBA titrů u původně séropozitivních subjektů z hodnot před očkováním hodnoty po očkování (tj. rSBA titr před vakcinací > 8)
Ve studii MenACWY-TT-081 bylo prokázáno, že vakcína Nimenrix byla non-inferiorní kjiné registrované vakcíně MenC-CRM , pokud jde o odpověď na vakcínu ve skupině MenC [94,8 % (95% CI: 91,4; 97,1) resp. 95,7 % (95% CI: 89,2; 98,8)]; GMT byly nižší ve skupině s vakcínou Nimenrix [2 795 (95% CI: 2 393; 3 263)] ve srovnání s vakcínou MenC-CRM [5 292 (95% CI: 3 815; 7 340)].
Tabulka 8: Baktericidní protilátková odpověď (rSBA*) na vakcínu Nimenrix a vakcínu ACWY-
PC u dětí ve věku 2-10 let 1 měsíc po očkování (studie MenACWY-TT-038)
|
Skupin a |
Nimenrix |
vakcína ACWY-PC | ||||
|
N |
VR (95% CI) |
GMT (95% CI) |
N |
VR (95% CI) |
GMT (95% CI) | |
|
A |
594 |
89,1 % (86,3; 91,5) |
6 343 (5 998; 6 708) |
192 |
64,6 % (57,4; 71,3) |
2 283 (2 023; 2 577) |
|
C |
691 |
96,1 % (94,4; 97,4) |
4 813 (4 342; 5 335) |
234 |
89,7 % (85,1; 93,3) |
1 317 (1 043; 1 663) |
|
W-135 |
691 |
97,4 % (95,9; 98,4) |
11 543 (10 873; 12 255) |
236 |
82,6 % (77,2; 87,2) |
2 158 (1 815; 2 565) |
|
Y |
723 |
92,7 % (90,5; 94,5) |
10 825 (10 233; 11 452) |
240 |
68,8 % (62,5; 74,6) |
2 613 (2 237; 3 052) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. VR: odpověď na vakcínu (vaccine response)
* testováno v GSK laboratořích.
Perzistence imunitní odpovědi u dětí ve věku 2- 10 let
Ve studii MenACWY-TT-088 byla perzistence imunitní odpovědi hodnocena pomocí rSBA a hSBA až do 44 měsíců po očkování u dětí ve věku 2 - 10 let primárně očkovaných ve studii MenACWY-TT-081 (tabulka 9).
Tabulka 9: Údaje týkající se 44 měsíční perzistence u dětí ve věku 2-10 let při očkování
|
Skupina |
Odpověď na |
Časový bod (měsíce) |
rSBA* |
hSBA** | ||||
|
N |
>8 (95%CI) |
GMT (95%CI) |
N |
>8 (95%CI) |
GMT (95%CI) | |||
|
A |
Nimenrix |
32 |
193 |
86,5 % (80,9; 91,0) |
196 (144; 267) |
90 |
25,6 % (16,9; 35,8) |
4,6 (3,3; 6,3) |
|
44 |
189 |
85,7 % (79,9; 90,4) |
307 (224; 423) |
89 |
25,8 % (17,1; 36,2) |
4,8 (3,4; 6,7) | ||
|
C |
Nimenrix |
32 |
192 |
64,6 % (57,4; 71,3) |
34,8 (26,0; 46,4) |
90 |
95,6 % (89,0; 98,8) |
75,9 (53,4; 108) |
|
44 |
189 |
37,0 % (30,1; 44,3) |
14,5 (10,9; 19,2) |
82 |
76,8 % (66,2; 85,4) |
36,4 (23,1; 57,2) | ||
|
Vakcína MenC- CRM |
32 |
69 |
76,8 % (65,1; 86,1) |
86,5 (47,3; 158) |
33 |
90,9 % (75,7; 98,1) |
82,2 (34,6; 196) | |
|
44 |
66 |
45,5 % (33,1; 58,2) |
31,0 (16,6; 58,0) |
31 |
64,5 % (45,4; 80,8) |
38,8 (13,3; 113) | ||
|
W-135 |
Nimenrix |
32 |
193 |
77,2 % (70,6; 82,9) |
214 (149; 307) |
86 |
84,9 % (75,5; 91,7) |
69,9 (48,2; 101) |
|
44 |
189 |
68,3 % (61,1; 74,8) |
103 (72,5; 148) |
87 |
80,5 % (70,6; 88,2) |
64,3 (42,7; 96,8) | ||
|
Y |
Nimenrix |
32 |
193 |
81,3 % (75,1; 86,6) |
227 (165; 314) |
91 |
81,3 % (71,8; 88,7) |
79,2 (52,5; 119) |
|
44 |
189 |
62,4 % (55,1; 69,4) |
78,9 (54,6; 114) |
76 |
82,9 % (72,5; 90,6) |
127 (78,0; 206) | ||
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptované pro každý časový bod.
*rSBA testování provedeno v PHE laboratořích ve Velké Británii.
** Testováno v GSK laboratořích.
Perzistence imunitní odpovědi u dětí ve věku 6- 10 let
Ve studii MenACWY-TT-028 byla perzistence imunitní odpovědi hodnocena pomocí hSBA jeden rok po očkování u dětí ve věku 6 - 10 let primárně očkovaných ve studii MenACWY-TT-027 (tabulka 10) (viz bod 4.4).
6-10 let
|
Skupina |
Odpověď na |
1 měsíc po očkování |
Perzistence 1 rok |
po očkování | |||
|
N |
> 8 (95% CI) |
GMT (95% CI) |
N |
> 8 (95% CI) |
GMT (95% CI) | ||
|
A |
Nimenrix |
105 |
80,0 % (71,1; 87,2) |
53,4 (37,3; 76,2) |
104 |
16,3 % (9,8; 24,9) |
3,5 (2,7; 4,4) |
|
ACWY-PS |
35 |
25,7 % (12,5; 43,3) |
4,1 (2,6; 6,5) |
35 |
5,7 % (0,7; 19,2) |
2,5 (1,9; 3,3) | |
|
C |
Nimenrix |
101 |
89,1 % (81,3; 94,4) |
156 (99,3; 244) |
105 |
95,2 % (89,2; 98,4) |
129 (95,4; 176) |
|
ACWY-PS |
38 |
39,5 % (24,0; 56,6) |
13,1 (5,4; 32,0) |
31 |
32,3 % (16,7; 51,4) |
7,7 (3,5; 17,3) | |
|
W-135 |
Nimenrix |
103 |
95,1 % (89,0; 98,4) |
133 (99,9; 178) |
103 |
100 % (96,5; 100) |
257 (218; 302) |
|
ACWY-PS |
35 |
34,3 % (19,1; 52,2) |
5,8 (3,3; 9,9) |
31 |
12,9 % (3,6; 29,8) |
3,4 (2,0; 5,8) | |
|
Y |
Nimenrix |
89 |
83,1 % (73,7; 90,2) |
95,1 (62,4; 145) |
106 |
99,1 % (94,9; 100) |
265 (213; 330) |
|
ACWY-PS |
32 |
43,8 % (26,4; 62,3) |
12,5 (5,6; 27,7) |
36 |
33,3 % (18,6; 51,0) |
9,3 (4,3; 19,9) | |
Analýza imunogenicity
byla provedena v ATP kohortě pro hodnocení perzistence.
* Testováno v GSK laboratořích.
Dospívající a dospělí
Imunogenicita u dospívajících ve věku 11 - 17 let a dospělých ve věku > 18 let Ve dvou klinických studiích prováděných u dospívajících ve věku 11 - 17 let (studie MenACWY-TT-036) a u dospělých ve věku 18-55 let (studie study MenACWY-TT-035) byla podávána buď jedna dávka vakcíny Nimenrix nebo jedna dávka vakcíny ACWY-PS.
U dospívajících i dospělých bylo prokázáno, že Nimenrix je imunologicky non-inferiorní k vakcíně ACWY-PS, pokud jde o odpověď na vakcínu, jak je definována výše (tabulka 11). Odpověď na všechny čtyři meningokokové skupiny navozená vakcínou Nimenrix byla buď podobná, nebo vyšší, než odpověď vyvolaná vakcínou ACWY-PS.
Tabulka 11: Baktericidní protilátková odpověď (rSBA*) na vakcínu Nimenrix a vakcínu
ACWY-PS u dospívajících ve věku 11 - 17 let a dospělých ve věku > 18 let 1 měsíc po očkování__
|
Studie (Věkové rozmezí) |
Skupin a |
Nimenrix |
vakcína ACWY-PS | ||||
|
N |
VR (95% CI) |
GMT (95% CI) |
N |
VR (95% CI) |
GMT (95% CI) | ||
|
Studie MenACWY -TT-036 (11-17 let) |
A |
553 |
85,4 % (82,1; 88,2) |
5 928 (5 557; 6 324) |
191 |
77,5 % (70,9; 83,2) |
2 947 (2 612; 3 326) |
|
C |
642 |
97,4 % (95,8; 98,5) |
13 110 (11 939; 14 395) |
211 |
96,7 % (93,3; 98,7) |
8 222 (6 807; 9 930) | |
|
W-135 |
639 |
96,4 % (94,6; 97,7) |
8 247 (7 639; 8 903) |
216 |
87,5 % (82,3; 91,6) |
2 633 (2 299; 3 014) | |
|
Y |
657 |
93,8 % (91,6; 95,5) |
14 086 (13 168; 15 069) |
219 |
78,5 % (72,5; 83,8) |
5 066 (4 463; 5 751) | |
|
Studie MenACWY -TT-035 (18-55 let) |
A |
743 |
80,1 % (77,0; 82,9) |
3 625 (3 372; 3 897) |
252 |
69,8 % (63,8; 75,4) |
2 127 (1 909; 2 370) |
|
C |
849 |
91,5 % (89,4; 93,3) |
8 866 (8 011; 9 812) |
288 |
92,0 % (88,3; 94,9) |
7 371 (6 297; 8 628) | |
|
W-135 |
860 |
90,2 % |
5 136 |
283 |
85,5 % |
2 461 | |
|
(88,1; 92,1) |
(4 699; 5 614) |
(80,9; 89,4) |
(2 081; 2 911) | ||||
|
Y |
862 |
87,0 % (84,6; 89,2) |
7 711 (7 100; 8 374) |
288 |
78,8 % (73,6; 83,4) |
4 314 (3 782; 4 921) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity. VR: odpověď na vakcínu * testováno v GSK laboratořích.
V samostatné studii (MenACWY-TT-085) byla podána jedna dávka vakcíny Nimenrix
194 libanonským dospělým ve věku 56 let a starším (včetně 133 ve věku 56 - 65 let a 61 ve věku
> 65 let). Procento subjektů s rSBA titry (měřeno v GSK laboratořích) > 128 bylo před očkováním v rozsahu od 45 % (MenC) do 62 % (MenY). Celkově bylo jeden měsíc po očkování % subjektů očkovaných s rSBA titry > 128 v rozsahu od 93 % (MenC) do 97 % (MenY). V podskupině ve věku
> 65 let bylo % očkovaných subjektů s rSBA titry > 128 jeden měsíc po očkování v rozsahu od 90 % (MenA) do 97 % (MenY).
Perzistence imunitní odpovědi u dospívajících ve věku 11 - 17 let
Ve studii MenACWY-TT-043 byla perzistence imunitní odpovědi hodnocena 5 let po očkování u dospívajících primárně očkovaných ve studii MenACWY-TT-036 (tabulka 12). Primární výsledky této studie viz tabulka 11.
Tabulka 12: Údaje týkající se pětileté perzistence (rSBA*) u dospívajících ve věku 11 - 17 let při vakcinaci
|
Skupi na |
Časový bod (roky) |
Nimenrix |
Vakcína ACWY-PS | ||||
|
N |
>8 (95%CI) |
GMT (95%CI) |
N |
>8 (95%CI) |
GMT (95%CI) | ||
|
A |
3 |
449 |
92,9 % (90,1; 95,1) |
448 (381; 527) |
150 |
82,7 % (75,6; 88,4) |
206 (147; 288) |
|
5 |
236 |
97,5 % (94,5; 99,1) |
644 (531; 781) |
86 |
93,0 % (85,4; 97,4) |
296 (202; 433) | |
|
C |
3 |
449 |
91,1 % (88,1; 93,6) |
371 (309; 446) |
150 |
86,0 % (79,4; 91,1) |
390 (262; 580) |
|
5 |
236 |
88,6 % (83,8; 92,3) |
249 (194; 318) |
85 |
87,1 % (78,0; 93,4) |
366 (224; 599) | |
|
W-135 |
3 |
449 |
82,0 % (78,1; 85,4) |
338 (268; 426) |
150 |
30,0 % (22,8; 38,0) |
16,0 (10,9; 23,6) |
|
5 |
236 |
86,0 % (80,9; 90,2) |
437 (324; 588) |
86 |
34,9 % (24,9; 45,9) |
19,7 (11,8; 32,9) | |
|
Y |
3 |
449 |
93,1 % (90,3; 95,3) |
740 (620; 884) |
150 |
58,0 % (49,7; 66,0) |
69,6 (44,6; 109) |
|
5 |
236 |
96,6 % (93,4; 98,5) |
1000 (824;1214) |
86 |
66,3 % (55,3; 76,1) |
125 (71,2; 219) | |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptovaná pro každý časový bod.
* rSBA testování provedeno v PHE laboratořích ve Velké Británii.
Perzistence imunitní odpovědi u dospívajících a dospělých ve věku 11-25 let Ve studii MenACWY-TT-059 byla perzistence imunitní odpovědi hodnocena pomocí hSBA 1 rok a 5 let po očkování u dospívajících a dospělých ve věku 11-25 let primárně očkovaných ve studii MenACWY-TT-052 (tabulka 13) (viz bod 4.4).
Tabulka 13: Údaje 1 měsíc po očkování a perzistence (hSBA*) 5 let po očkování u dospívajících a dospělých ve věku 11-25 let____
|
Skupina |
Odpověď na |
Časový bod |
N |
> 8 (95%CI) |
GMT (95%CI) |
|
A |
Nimenrix |
měsíc 1 |
356 |
82,0 % (77,6; 85,9) |
58,7 (48,6; 70,9) |
|
rok 1 |
350 |
29,1 % (24,4; 34,2) |
5,4 (4,5; 6,4) | ||
|
rok 5 |
141 |
48,9 % (40,4; 57,5) |
8,9 (6,8; 11,8) | ||
|
C |
Nimenrix |
měsíc 1 |
359 |
96,1 % (93,5; 97,9) |
532 (424; 668) |
|
rok 1 |
336 |
94,9 % (92,0; 97,0) |
172 (142;207) | ||
|
rok 5 |
140 |
92,9 % (87,3; 96,5) |
94,6 (65,9; 136) | ||
|
W-135 |
Nimenrix |
měsíc 1 |
334 |
91,0% (87,4; 93,9) |
117 (96,8; 141) |
|
rok 1 |
327 |
98,5 % (96,5; 99,5) |
197 (173;225) | ||
|
rok 5 |
138 |
87,0% (80,2; 92,1) |
103 (76,3; 140) | ||
|
Y |
Nimenrix |
měsíc 1 |
364 |
95,1 % (92,3; 97,0) |
246 (208; 291) |
|
rok 1 |
356 |
97,8 % (95,6; 99,0) |
272 (237; 311) | ||
|
rok 5 |
142 |
94,4 % (89,2; 97,5) |
225 (174;290) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení perzistence adaptované pro každý časový bod.
* Testováno v GSK laboratořích.
Odpověď na posilovači dávku u subjektů dříve očkovaných konjugovanou meningokokovou vakcínou proti Neisseria meningitidis
Posilovací očkování vakcínou Nimenrix po základním očkování u kojenců, dětí, dospívajících a dospělých: U subjektů očkovaných vakcínou Nimenrix ve věku 1 rok a starších a přeočkovaných vakcínou Nimenrix za 4 nebo 5 let později více než 99,0 % všech subjektů dosáhlo po přeočkování titrů SBA > 1:8 u všech analýz (studie MenACWY-TT-062, 048, 059, 088). Jeden měsíc po posilovací dávce byly vyvolané hodnoty GMT významně vyšší než hodnoty ve skupině kontrol k léčbě naivních odpovídajícího věku, což naznačuje, že vakcína Nimenrix vyvolává imunitní paměť na skupiny A, C, W-135 aY.
Odpověď pozorovaná po podání posilovací dávky u skupiny C byla u vakcíny Nimenrix podobná jako odpověď pozorovaná u subjektů očkovaných a přeočkovaných monovalentní konjugovanou vakcínou MenC-CRM. Jeden rok po podání posilovací dávky vakcíny Nimenrix přetrvávaly titry SBA > 1:8 nejméně u 95,5 % subjektů (studie MenACWY-TT-048, věk 12 až 23 měsíců při základním očkování).
Pokud byla vakcína Nimenrix použita jako posilovací dávka po základním očkování konjugovanou vakcínou MenACWY-DT nebo monovalentní konjugovanou vakcínou skupiny C (studie MenACWY-TT-059, věk 10 až 25 let při základním očkování, a studie MenACWY-TT-088, věk 2 až 10 let při primárním očkování), titry se u všech skupin zvýšily 48 - 340krát a 100 % subjektů dosáhlo titrů SBA > 1:8.
Odpověď na posilovací dávku u subjektů dříve očkovaných polysacharidovou vakcínou proti Neisseria meningitidis
Ve studii MenACWY-TT-021 prováděné u subjektů ve věku 4,5 - 34 let byla imunogenicita vakcíny Nimenrix podávané mezi 30. a 42. měsícem po očkování vakcínou ACWY-PS porovnávána s imunogenicitou vakcíny Nimenrix podané subjektům odpovídajícího věku, které nebyly v předchozích 10 letech očkovány žádnou meningokokovou vakcínou. Imunitní odpověď (rSBA titr >8) byla pozorována ve všech skupinách (A, C, W-135, Y) u všech subjektů bez ohledu na anamnézu očkování proti meningokokům. GMT rSBA byly významně nižší u subjektů, které dostaly jednu dávku vakcíny ACWY-PS 30 - 42 měsíců před podáním vakcíny Nimenrix (tabulka 14) (viz bod 4.4).
podle jejich anamnézy očkování proti meningokokům
|
Skupin a |
Subjekty očkované před 30 až 42 měsíci vakcínou ACWY-PS |
Subjekty, které nedostaly v posledních 10 letech žádnou meningokokovou vakcínu | ||||
|
N |
>8 (95%CI) |
GMT (95%CI) |
N |
>8 (95%CI) |
GMT (95%CI) | |
|
A |
146 |
100 % (97,5; 100) |
6 869 (6 045; 7 805) |
69 |
100 % (94,8; 100) |
13 015 (10 722; 15 798) |
|
C |
169 |
100 % (97,8; 100) |
1 946 (1 583; 2 391) |
75 |
100 % (95,2; 100) |
5 495 (4 266; 7 076) |
|
W-135 |
169 |
100 % (97,8; 100) |
4 636 (3 942; 5 451) |
75 |
100 % (95,2; 100) |
9 078 (7 088;11 627) |
|
Y |
169 |
100 % (97,8; 100) |
7 800 (6 683; 9 104) |
75 |
100 % (95,2; 100) |
13 895 (11 186; 17 261) |
Analýza imunogenicity byla provedena v ATP kohortě pro hodnocení imunogenicity.
* Testováno v GSK laboratořích.
Evropská agentura pro léčivé přípravky nevyžaduje splnění povinnosti předložit výsledky studií s vakcínou Nimenrix u jedné nebo více podskupin pediatrické populace v indikaci prevence meningokokového onemocnění způsobeného Neisseria meningitidis skupiny A, C, W-135 a Y (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií lokální snášenlivosti, akutní toxicity, toxicity po opakovaném podávání, reprodukční a vývojové toxicity a fertility neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Sacharosa
Trometamol
Rozpouštědlo:
Chlorid sodný Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky
Po rekonstituci:
Po rekonstituci musí být vakcína použita bezodkladně. Ačkoliv prodleva se nedoporučuje, stabilita byla nicméně po rekonstituci prokázána po dobu 8 hodin při teplotě 30 °C. Pokud vakcína není použita v průběhu 8 hodin, nesmí se již podávat.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Prášek v injekční lahvičce (sklo typu I) se zátkou (butylová pryž) a rozpouštědlo v ampulce (sklo typu I).
Velikost balení 1, 10 a 100.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Návod pro rekonstituci vakcíny rozpouštědlem v ampulce
Nimenrix musí být rekonstituován přidáním celého obsahu rozpouštědla z ampulky do injekční lahvičky obsahující prášek.
1. Odlomte vrchní část ampulky, nasajte rozpouštědlo injekční stříkačkou a přidejte rozpouštědlo k prášku.
2. Směs je třeba dobře protřepat, dokud se prášek úplně nerozpustí v rozpouštědle. Rekonstituovaná vakcína je čirý bezbarvý roztok.
Rekonstituovanou vakcínu je třeba zkontrolovat pohledem, zda neobsahuje cizí částice a/nebo odchylky od fyzikálního vzhledu před podáním. V případě pozorování jakýchkoli změn vakcínu znehodnoťte. Po rekonstituci je nutné vakcínu bezodkladně použít. K podání vakcíny je nutné použít novou jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpadní materiál musí být znehodnocen v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/767/005
EU/1/12/767/006
EU/1/12/767/007
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. dubna 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky GlaxoSmithKline Biologicals S.A.
89, rue de l'Institut B-1330 Rixensart Belgie
GlaxoSmithKine Biologicals Kft.
Homoki Nagy István utca 1.
2100 Godollo Maďarsko
GlaxoSmithKline Biologicals S.A.
Parc de la Noire Epine 20, rue Fleming B-1300 Wavre Belgie
Název a adresa výrobce odpovědného za propouštění šarží
Pfizer Manufacturing Belgium N.V.
Rijksweg 12 B-2870 Puurs Belgie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
TTV 1 ř V, V f V V r
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst.
7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
D.
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření:
|
Popis |
Termín plnění |
|
Studie hodnotící okamžité a dlouhodobé titry protilátek vyvolané po očkování jednou nebo dvěma dávkami vakcíny Nimenrix podanými dětem ve věku 12 -23 měsíců. Údaje o bezpečnosti a perzistenci protilátek až do doby 5 let a údaje o souběžném podávání přípravku MenACWY-TT s přípravkem Prevenar 13 budou poskytnuty v následných zprávách ze studie za 1, 3 a 5 let po očkování. |
1 rok CSR Q1 2017 3 roky CSR Q1 2019 5 let CSRQ1 2021 |
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
1 INJEKČNÍ LAHVIČKA A 1 PŘEDPLNĚNÁ INJEKČNÍ STŘÍKAČKA BEZ JEHLY 1 INJEKČNÍ LAHVIČKA A 1 PŘEDPLNĚNÁ INJEKČNÍ STŘÍKAČKA SE 2 JEHLAMI 10 INJEKČNÍCH LAHVIČEK A 10 PŘEDPLNĚNÝCH INJEKČNÍCH STŘÍKAČEK BEZ JEHLY
10 INJEKČNÍCH LAHVIČEK A 10 PŘEDPLNĚNÝCH INJEKČNÍCH STŘÍKAČEK S 20 JEHLAMI
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Nimenrix prášek pro injekční roztok a rozpouštědlo v předplněné injekční stříkačce Konjugovaná vakcína proti meningokokům skupin A, C, W-135 a Y
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Po rekonstituci 1 dávka (0,5 ml) obsahuje 5 mikrogramů Neisseria meningitidis A, C, W-135 aY polysacharidum.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: Sacharosa Trometamol Chlorid sodný Voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
prášek pro injekční roztok a rozpouštědlo v předplněné injekční stříkačce
1 injekční lahvička: prášek 1 předplněná injekční stříkačka: rozpouštědlo 1 dávka (0,5 ml)
10 injekčních lahviček: prášek
10 předplněných injekčních stříkaček: rozpouštědlo
10x 1 dávka (0,5 ml)
1 injekční lahvička: prášek
1 předplněná injekční stříkačka: rozpouštědlo
2 jehly
1 dávka (0,5 ml)
10 injekčních lahviček: prášek
10 předplněných injekčních stříkaček: rozpouštědlo
20 jehel
10x 1 dávka (0,5 ml)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulámí podání.
Před použitím důkladně protřepejte.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Použijte bezodkladně po rekonstituci.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Zlikvidujte v souladu s místními předpisy.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/767/001 - balení po 1, bez jehly EU/1/12/767/002 - balení po 10, bez jehly EU/1/12/767/003 - balení po 1, se 2 jehlami EU/1/12/767/004 - balení po 10, s 20 jehlami
13. ČÍSLO ŠARŽE
Lot
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
1 INJEKČNÍ LAHVIČKA A 1 AMPULKA 10 INJEKČNÍCH LAHVIČEK A 10 AMPULEK 100 INJEKČNÍCH LAHVIČEK A 100 AMPULEK
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Nimenrix prášek pro injekční roztok a rozpouštědlo v ampulce Konjugovaná vakcína proti meningokokům skupin A, C, W-135 a Y
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Po rekonstituci 1 dávka (0,5 ml) obsahuje 5 mikrogramů Neisseria meningitidis A, C, W-135 aY polysacharidum.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: Sacharosa Trometamol Chlorid sodný Voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
prášek pro injekční roztok a rozpouštědlo v ampulce
1 injekční lahvička: prášek 1 ampulka: rozpouštědlo 1 dávka (0,5 ml)
10 injekčních lahviček: prášek 10 ampulek: rozpouštědlo 10x 1 dávka (0,5 ml)
100 injekčních lahviček: prášek 100 ampulek: rozpouštědlo 100x 1 dávka (0,5 ml)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intramuskulární podání.
Před použitím důkladně protřepejte.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Použijte bezodkladně po rekonstituci.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Zlikvidujte v souladu s místními předpisy.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/767/005 - balení po 1 EU/1/12/767/006 - balení po 10 EU/1/12/767/007 - balení po 100
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro Nimenrix i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (0,5 ml)
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro Nimenrix i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (0,5 ml)
6. JINÉ
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU INJEKČNÍ LAHVIČKA S MEN ACWY KONJUGÁTEM V PRÁŠKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Prášek pro Nimenrix MenACWY konjugát i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Nimenrix prášek pro injekční roztok a rozpouštědlo v předplněné injekční stříkačce
Konjugovaná vakcína proti meningokokům skupin A, C, W-135 a Y
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tato vakcína podána, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tato vakcína byla předepsána Vám nebo Vašemu dítěti. Nedávejte ji žádné další osobě.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Tato příbalová informace byla napsána, jako kdyby jí četla osoba, které bude vakcína podána. Vzhledem k tomu, že vakcínu lze podávat dospělým i dětem, můžete číst tyto informace také před očkováním Vašeho dítěte místo něj.
Co naleznete v této příbalové informaci
1. Co je Nimenrix a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vám bude Nimenrix podán
3. Jak se Nimenrix podává
4. Možné nežádoucí účinky
5. Jak Nimenrix uchovávat
6. Obsah balení a další informace
1. Co je Nimenrix a k čemu se používá Co je Nimenrix a k čemu se používá
Nimenrix je vakcína (očkovací látka), která pomáhá chránit před infekcí způsobenou bakteriemi nazývanými „Neisseria meningitidis“ typů A, C, W-135 a Y.
Bakterie „Neisseria meningitidis“ typů A, C, W-135 a Y mohou způsobit závažná onemocnění, jako jsou:
• meningitida (zánět mozkových blan) - infekce tkáně, která obklopuje mozek a míchu
• septikémie (otrava krve) - infekce krve
Tyto infekce se snadno přenášejí z jedné osoby na druhou a mohou vést k úmrtí, pokud nejsou léčeny. Nimenrix lze podat dospělým, dospívajícím i dětem starším než 12 měsíců.
Jak Nimenrix účinkuje
Nimenrix pomáhá tělu tvořit jeho vlastní ochranu proti těmto bakteriím (protilátky). Tyto protilátky pak pomáhají chránit před onemocněním.
Nimenrix chrání pouze proti infekcím vyvolaným bakteriemi „Neisseria meningitidis“ typů A, C, W-135 aY.
2. Čemu musíte věnovat pozornost, než Vám bude Nimenrix podán Nimenrix Vám nesmí být podán, pokud:
• jste alergický(á) na léčivé látky nebo na kteroukoli další složku této očkovací látky (uvedenou v bodě 6).
Známky alergické reakce mohou zahrnovat svědivou kožní vyrážku, dušnost, otok obličeje a jazyka. Pokud zaznamenáte jakýkoli z těchto příznaků, okamžitě vyhledejte svého lékaře.
Pokud si nejste jistý(á), poraďte se se svým lékařem nebo zdravotní sestrou dříve, než Vám bude vakcína Nimenrix podána.
Upozornění a opatření:
Poraďte se se svým lékařem nebo zdravotní sestrou dříve, než Vám bude podána tato vakcína, jestliže:
• máte infekci doprovázenou horečkou (více než 38 °C). Pokud se Vás toto týká, očkování Vám nebude podáno, dokud se nebudete cítit lépe. Méně závažné infekce, jako např. nachlazení, by neměly být u tohoto očkování problém. Poraďte se však přesto nejprve se svým lékařem nebo zdravotní sestrou.
• pokud máte problémy s krvácivostí nebo pokud se Vám snadno tvoří modřiny.
Pokud se Vás cokoli z výše zmíněného týká (nebo pokud si nejste jistý/á), poraďte se se svým lékařem nebo zdravotní sestrou dříve, než Vám bude vakcína Nimenrix podána.
Nimenrix nemusí plně chránit všechny očkované osoby. Pokud máte slabý imunitní systém (např. z důvodu infekce virem HIV nebo pokud užíváte léky, které ovlivňují ímunitní systém), je možné, že nebudete mít z očkování vakcínou Nimenrix plný prospěch.
Během podání jakékoli injekce nebo dokonce před jejím podáním může u některých osob (převážně u dospívajících) dojít k mdlobám. Proto sdělte lékaři nebo zdravotní sestře, pokud jste již někdy při předchozí injekci omdlel(a).
Další léčivé přípravky a Nimenrix
Prosím, informujte svého lékaře nebo zdravotní sestru o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Nimenrix nemusí účinkovat správně, pokud užíváte léky, které ovlivňují imunitní systém.
Nimenrix lze podávat ve stejnou dobu, jako jiné vakcíny, např. vakcíny proti hepatitidě A a hepatitidě B, vakcínu proti spalničkám, příušnicím a zarděnkám, vakcínu proti spalničkám, příušnicím, zarděnkám a planým neštovicím, desetivalentní konjugovanou pneumokokovou vakcínu nebo neadjuvovanou vakcínu proti sezónní chřipce.
V druhém roce života lze vakcínu Nimenrix rovněž podávat ve stejnou dobu, jako kombinované vakcíny proti záškrtu, tetanu a černému kašli (acelulární pertuse), včetně kombinovaných vakcín proti záškrtu, tetanu a černému kašli s vakcínou proti hepatitidě B, dětské obrně (inaktivovaná vakcína) nebo Heamophilus influenzae typu b, jako je vakcína DTaP-HBV-IPV/Hib.
Kdykoli je to možné, podává se vakcína Nimenrix a vakcína obsahující tetanus, jako např. vakcína DTaP-BV-IVP/Hib ve stejnou dobu, nebo se vakcína Nimenrix podává alespoň jeden měsíc před podáním vakcíny obsahující tetanus.
Pro každou vakcínu se použije jiné místo vpichu.
Těhotenství a kojení
Pokud jste těhotná, myslíte si, že můžete být těhotná, těhotenství plánujete nebo kojíte, musíte to sdělit svému lékaři dříve, než Vám bude vakcína Nimenrix podána.
Řízení dopravních prostředků a obsluha strojů
Není pravděpodobné, že by vakcína Nimenrix ovlivnila schopnost řídit nebo obsluhovat stroje. Pokud se však necítíte dobře, neřiďte ani neobsluhujte stroje.
Jak se Nimenrix podává
3.
Jak se vakcína podává
Nimenrix Vám podá lékař nebo zdravotní sestra.
• Podává se do svalu.
• Obvykle se u dětí, dospívajících a dospělých podává do horní části paže, nebo u dětí ve věku 12 až 23 měsíců do stehna.
Kolik přípravku se podává
Doporučená dávka je jedna injekce (0,5 ml) vakcíny Nimenrix.
Prosím, sdělte svému lékaři, pokud jste již byl(a) dříve očkován(a) jinou meningokokovou vakcínou, než vakcínou Nimenrix.
Lékař Vám sdělí, zda a kdy bude nutné podat další injekci vakcíny Nimenrix, především pokud jste Vy nebo Vaše dítě:
• dostali svou první dávku ve věku 12-23 měsíců a mohli byste být ohroženi infekcí způsobenou
Neisseria meningitidis typu A, C, W-135 aY;
• byli v době prvního očkování ve věku 2 let nebo starší a mohli byste být ohroženi infekcí
Neisseria meningitidis typu A.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i vakcína Nimenrix nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Velmi časté (mohou se objevit u více než 1 z 10 dávek vakcíny):
• horečka;
• unavenost (únava);
• bolest hlavy;
• pocit ospalosti;
• ztráta chuti k jídlu;
• pocit podrážděnosti;
• otok, bolest a zarudnutí v místě vpichu injekce.
Časté (mohou se objevit u maximálně 1 z 10 dávek vakcíny):
• modřina (hematom) v místě vpichu injekce;
• žaludeční a trávící problémy, jako např. průjem, zvracení a nevolnost.
Méně časté (mohou se objevit u maximálně 1 ze 100 dávek vakcíny):
• vyrážka;
• pláč;
• svědění;
• pocit závrati;
• bolest svalů;
• bolest rukou nebo nohou;
• celkový pocit nevůle;
• obtíže se spaním;
• snížení citlivosti, zejména na kůži;
• reakce v místě vpichu injekce, jako např. svědění, pocit horka nebo necitlivosti nebo tvrdé bulky.
Vzácné (mohou se objevit u méně než 1 z 1 000 dávek vakcíny):
• otok a zarudnutí v místě vpichu injekce, která mohou postihnout rozsáhlou část končetiny, do které byla očkovací látka podána.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Nimenrix uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C).
• Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
• Chraňte před mrazem.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Nimenrix obsahuje
• Léčivými látkami jsou:
- po rekonstituci 1 dávka (0,5 ml) obsahuje:
5 mikrogramů 5 mikrogramů 5 mikrogramů 5 mikrogramů 44 mikrogramů
Neisseria meningitidis A polysacharidum1 Neisseria meningitidis C polysacharidum1 Neisseria meningitidis W-135 polysacharidum1 Neisseria meningitidis Y polysacharidum1 1konjugováno na bílkovinný nosič tetanický toxoid
• Dalšími složkami jsou:
- v prášku: sacharosa a trometamol
- v rozpouštědle: chlorid sodný a voda na injekci
Jak Nimenrix vypadá a co obsahuje toto balení
Nimenrix je prášek pro injekční roztok a rozpouštědlo Nimenrix je dodáván jako bílý prášek v jednodávkové skleněné injekční lahvičce a čiré bezbarvé rozpouštědlo v předplněné injekční stříkačce.
Prášek a rozpouštědlo je nutné před použitím smíchat. Smíchaná vakcína bude čirá, bezbarvá tekutina. Nimenrix je dostupný v balení po 1 nebo 10, s jehlami nebo bez jehel.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
Výrobce odpovědný za propouštění šarží: Pfizer Manufacturing Belgium N.V. Rijksweg 12 B-2870 Puurs Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Pfizer S.A./N.V. Tél/Tel: +32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. + 370 52 51 4000 |
|
Btarapna n$aň3ep HroKceMÓypr CAPH, Khoh EbnrapHH Ten: +359 2 970 4333 |
Magyarország Pfizer Kft. Tel: +36 1 488 3700 |
|
Česká republika Pfizer PFE, spol. s r.o. Tel: +420 283 004 111 |
Malta Vivian Corporation Ltd. Tel: + 35621 344610 |
|
Danmark Pfizer ApS Tlf: +45 44 201 100 |
Nederland Pfizer BV Tel: +31 (0)10 406 43 01 |
|
Deutschland Pfizer Pharma GmbH Tel: +49 (0)30 550055-51000 |
Norge Pfizer Norge AS Tlf: +47 67 52 61 00 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
ELXáSa Pfizer EAAág A.E. TpL: +30 210 6785 800 |
Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
|
Espaňa Pfizer, S.L. Télf:+34914909900 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 55 00 |
|
France Pfizer Tél +33 1 58 07 34 40 |
Románia Pfizer Romania S.R.L Tel: +40 (0) 21 207 28 00 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel.: + 386 (0) 1 52 11 400 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenská republika Pfizer Luxembourg SARL, organizačná zložka Tel: + 421 2 3355 5500 |
|
Ísland Icepharma hf. Simi: + 354 540 8000 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Kúrcpog
Pfizer EAAAE A.E. (Cyprus Branch) Tnk: +357 22 817690
Latvija
Pfizer Luxembourg SARL filiale Latvija Tel.: + 371 670 35 775
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europea.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Tato vakcína je pouze k intramuskulárnímu podání. Nepodávejte jí intravaskulárně, intradermálně ani subkutánně.
Pokud se Nimenrix podává společně s dalšími vakcínami, je třeba je aplikovat do různých injekčních míst. Nimenrix se nesmí míchat s dalšími vakcínami.
Návod pro rekonstituci vakcíny přiloženým rozpouštědlem v předplněné injekční stříkačce
Nimenrix musí být rekonstituovám přidáním celého obsahu rozpouštědla z předplněné injekční stríkačky do injekční lahvičky obsahující prášek.
Připojení jehly k injekční stříkačce viz obrázek. Injekční stříkačka dodávaná s vakcínou Nimenrix však může být lehce odlišná (bez šroubovacího závitu) od injekční stříkačky popsané na obrázku. V tomto případě připojte jehlu bez šroubování.
1. Držte tělo stříkačky jednou rukou (nedržte stříkačku za píst), odšroubujte uzávěr stříkačky otáčením proti směru hodinových ručiček.
2. Abyste připojil(a) jehlu ke stříkačce, našroubuje jehlu na stříkačku ve směru hodinových ručiček dokud neucítíte, že je pevně připojena (viz obrázek).
3. Odstraňte krytku jehly, což může jít někdy trochu obtížně.
United Kingdom
Pfizer Limited
Tel: +44 (0) 1304 616161

Tělo stříkačky Uzávěr stříkačky
Píst stříkačky

4. Přidejte rozpouštědlo k prášku. Po přidání rozpouštědla k prášku směs protřepávejte, dokud se všechen prášek úplně nerozpustí v rozpouštědle.
Rekonstituovaná vakcína je čirý bezbarvý roztok.
Rekonstituovanou vakcínu je třeba před podáním zkontrolovat pohledem, zda neobsahuje cizí částice a/nebo odchylky od fyzikálního vzhledu. V případě zaznamenání jakýchkoli změn vakcínu znehodnoťte. Po rekonstituci je nutné vakcínu bezodkladně použít. K podání vakcíny je nutné použít novou jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpadní materiál musí být znehodnocen v souladu s místními požadavky.
Příbalová informace: informace pro uživatele
Nimenrix prášek pro injekční roztok a rozpouštědlo v ampulce
Konjugovaná vakcína proti meningokokům skupin A, C, W-135 aY
'VTento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tato vakcína podána, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tato vakcína byla předepsána Vám nebo Vašemu dítěti. Nedávejte ji žádné další osobě.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Tato příbalová informace byla napsána, jako kdyby jí četla osoba, které bude vakcína podána. Vzhledem k tomu, že vakcínu lze podávat dospělým i dětem, můžete číst tyto informace také před očkováním Vašeho dítěte místo něj.
Co naleznete v této příbalové informaci
1. Co je Nimenrix a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vám bude Nimenrix podán
3. Jak se Nimenrix podává
4. Možné nežádoucí účinky
5. Jak Nimenrix uchovávat
6. Obsah balení a další informace
1. Co je Nimenrix a k čemu se používá Co je Nimenrix a k čemu se používá
Nimenrix je vakcína (očkovací látka), která pomáhá chránit před infekcí způsobenou bakteriemi nazývanými „Neisseria meningitidis“ typů A, C, W-135 a Y.
Bakterie „Neisseria meningitidis“ typů A, C, W-135 a Y mohou způsobit závažná onemocnění, jako jsou:
• meningitida (zánět mozkových blan) - infekce tkáně, která obklopuje mozek a míchu
• septikémie (otrava krve) - infekce krve
Tyto infekce se snadno přenášejí z jedné osoby na druhou a mohou vést k úmrtí, pokud nejsou léčeny.
Nimenrix lze podat dospělým, dospívajícím i dětem starším než 12 měsíců.
Jak Nimenrix účinkuje
Nimenrix pomáhá tělu tvořit jeho vlastní ochranu proti těmto bakteriím (protilátky). Tyto protilátky pak pomáhají chránit před onemocněním.
Nimenrix chrání pouze proti infekcím vyvolaným bakteriemi „Neisseria meningitidis“ typů A, C, W-135 aY.
2. Čemu musíte věnovat pozornost, než Vám bude Nimenrix podán Nimenrix Vám nesmí být podán, pokud:
• jste alergický(á) na léčivé látky nebo na kteroukoli další složku této očkovací látky (uvedenou v bodě 6).
Známky alergické reakce mohou zahrnovat svědivou kožní vyrážku, dušnost, otok obličeje a jazyka. Pokud zaznamenáte jakýkoli z těchto příznaků, okamžitě vyhledejte svého lékaře.
Pokud si nejste jistý(á), poraďte se se svým lékařem nebo zdravotní sestrou dříve, než Vám bude vakcína Nimenrix podána.
Upozornění a opatření:
Poraďte se se svým lékařem nebo zdravotní sestrou dříve, než Vám bude podána tato vakcína, jestliže:
• máte infekci doprovázenou horečkou (více než 38 °C). Pokud se Vás toto týká, očkování Vám nebude podáno, dokud se nebudete cítit lépe. Méně závažné infekce, jako např. nachlazení, by neměly být u tohoto očkování problém. Poraďte se však přesto nejprve se svým lékařem nebo zdravotní sestrou.
• pokud máte problémy s krvácivostí nebo pokud se Vám snadno tvoří modřiny.
Pokud se Vás cokoli z výše zmíněného týká (nebo pokud si nejste jistý/á), poraďte se se svým lékařem nebo zdravotní sestrou dříve, než Vám bude vakcína Nimenrix podána.
Nimenrix nemusí plně chránit všechny očkované osoby. Pokud máte slabý imunitní systém (např. z důvodu infekce virem HIV nebo pokud užíváte léky, které ovlivňují ímunitní systém), je možné, že nebudete mít z očkování vakcínou Nimenrix plný prospěch.
Během podání jakékoli injekce nebo dokonce před jejím podáním může u některých osob (převážně u dospívajících) dojít k mdlobám. Proto sdělte lékaři nebo zdravotní sestře, pokud jste již někdy při předchozí injekci omdlel(a).
Další léčivé přípravky a Nimenrix
Prosím, informujte svého lékaře nebo zdravotní sestru o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Nimenrix nemusí účinkovat správně, pokud užíváte léky, které ovlivňují imunitní systém.
Nimenrix lze podávat ve stejnou dobu, jako jiné vakcíny, např. vakcíny proti hepatitidě A a hepatitidě B, vakcínu proti spalničkám, příušnicím a zarděnkám, vakcínu proti spalničkám, příušnicím, zarděnkám a planým neštovicím, desetivalentní konjugovanou pneumokokovou vakcínu nebo neadjuvovanou vakcínu proti sezónní chřipce.
V druhém roce života lze vakcínu Nimenrix rovněž podávat ve stejnou dobu, jako kombinované vakcíny proti záškrtu, tetanu a černému kašli (acelulární pertuse), včetně kombinovaných vakcín proti záškrtu, tetanu a černému kašli s vakcínou proti hepatitidě B, dětské obrně (inaktivovaná vakcína) nebo Heamophilus influenzae typu b, jako je vakcína DTaP-HBV-IPV/Hib.
Kdykoli je to možné, podává se vakcína Nimenrix a vakcína obsahující tetanus, jako např. vakcína DTaP-BV-IVP/Hib ve stejnou dobu, nebo se vakcína Nimenrix podává alespoň jeden měsíc před podáním vakcíny obsahující tetanus.
Pro každou vakcínu se použije jiné místo vpichu.
Těhotenství a kojení
Pokud jste těhotná, myslíte si, že můžete být těhotná, těhotenství plánujete nebo kojíte, musíte to sdělit svému lékaři dříve, než Vám bude vakcína Nimenrix podána.
Řízení dopravních prostředků a obsluha strojů
Není pravděpodobné, že by vakcína Nimenrix ovlivnila schopnost řídit nebo obsluhovat stroje. Pokud se však necítíte dobře, neřiďte ani neobsluhujte stroje.
Jak se Nimenrix podává
3.
Jak se vakcína podává
Nimenrix Vám podá lékař nebo zdravotní sestra.
• Podává se do svalu.
• Obvykle se u dětí, dospívajících a dospělých podává do horní části paže, nebo u dětí ve věku 12 až 23 měsíců do stehna.
Kolik přípravku se podává
Doporučená dávka je jedna injekce (0,5 ml) vakcíny Nimenrix.
Prosím, sdělte svému lékaři, pokud jste již byl(a) dříve očkován(a) jinou meningokokovou vakcínou, než vakcínou Nimenrix.
Lékař Vám sdělí, zda a kdy bude nutné podat další injekci vakcíny Nimenrix, především pokud jste Vy nebo Vaše dítě:
• dostali svou první dávku ve věku 12-23 měsíců a mohli byste být ohroženi infekcí způsobenou
Neisseria meningitidis typu A, C, W-135 a Y;
• byli v době prvního očkování ve věku 2 let nebo starší a mohli byste být ohroženi infekcí
Neisseria meningitidis typu A.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i vakcína Nimenrix nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Velmi časté (mohou se objevit u více než 1 z 10 dávek vakcíny):
• horečka;
• unavenost (únava);
• bolest hlavy;
• pocit ospalosti;
• ztráta chuti k jídlu;
• pocit podrážděnosti;
• otok, bolest a zarudnutí v místě vpichu injekce.
Časté (mohou se objevit u maximálně 1 z 10 dávek vakcíny):
• modřina (hematom) v místě vpichu injekce;
• žaludeční a trávící problémy, jako např. průjem, zvracení a nevolnost.
Méně časté (mohou se objevit u maximálně 1 ze 100 dávek vakcíny):
• vyrážka;
• pláč;
• svědění;
• pocit závrati;
• bolest svalů;
• bolest rukou nebo nohou;
• celkový pocit nevůle;
• obtíže se spaním;
• snížení citlivosti, zejména na kůži;
• reakce v místě vpichu injekce, jako např. svědění, pocit horka nebo necitlivosti nebo tvrdé bulky.
Vzácné (mohou se objevit u méně než 1 z 1 000 dávek vakcíny):
• otok a zarudnutí v místě vpichu injekce, která mohou postihnout rozsáhlou část končetiny, do které byla očkovací látka podána.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Nimenrix uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C).
• Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
• Chraňte před mrazem.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Nimenrix obsahuje
• Léčivými látkami jsou:
- po rekonstituci 1 dávka (0,5 ml) obsahuje: Neisseria meningitidis A polysacharidum1 Neisseria meningitidis C polysacharidum1 Neisseria meningitidis W-135 polysacharidum1 Neisseria meningitidis Y polysacharidum1 1konjugováno na bílkovinný nosič tetanický toxoid
5 mikrogramů 5 mikrogramů 5 mikrogramů 5 mikrogramů 44 mikrogramů
• Dalšími složkami jsou:
- v prášku: sacharosa a trometamol
- v rozpouštědle: chlorid sodný a voda na injekci
Jak Nimenrix vypadá a co obsahuje toto balení
Nimenrix je prášek pro injekční roztok a rozpouštědlo.
Nimenrix je dodáván jako bílý prášek v jednodávkové skleněné injekční lahvičce a čiré bezbarvé rozpouštědlo v ampulce.
Prášek a rozpouštědlo je nutné před použitím smíchat. Smíchaná vakcína bude čirá, bezbarvá tekutina. Nimenrix je dostupný v balení po 1, 10 nebo 100.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Velká Británie
Výrobce odpovědný za propouštění šarží: Pfizer Manufacturing Belgium N.V. Rijksweg 12 B-2870 Puurs Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Pfizer S.A./N.V. Tél/Tel: +32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. + 370 52 51 4000 |
|
Btarapna n$aň3ep HroKceMÓypr CAPH, Khoh EbnrapHH Ten: +359 2 970 4333 |
Magyarország Pfizer Kft. Tel: +36 1 488 3700 |
|
Česká republika Pfizer PFE, spol. s r.o. Tel: +420 283 004 111 |
Malta Vivian Corporation Ltd. Tel: + 35621 344610 |
|
Danmark Pfizer ApS Tlf: +45 44 201 100 |
Nederland Pfizer BV Tel: +31 (0)10 406 43 01 |
|
Deutschland Pfizer Pharma GmbH Tel: +49 (0)30 550055-51000 |
Norge Pfizer Norge AS Tlf: +47 67 52 61 00 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
ELXáSa Pfizer EAAág A.E. TpL: +30 210 6785 800 |
Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
|
Espaňa Pfizer, S.L. Télf:+34914909900 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
|
France Pfizer Tél +33 1 58 07 34 40 |
Románia Pfizer Romania S.R.L Tel: +40 (0) 21 207 28 00 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s področja farmacevtske dejavnosti, Ljubljana Tel.: + 386 (0) 1 52 11 400 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenská republika Pfizer Luxembourg SARL, organizačná zložka Tel: + 421 2 3355 5500 |
|
Ísland Icepharma hf. Simi: + 354 540 8000 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
United Kingdom
Pfizer Limited
Tel: +44 (0) 1304 616161
Kúrcpog
Pfizer EAAAE A.E. (Cyprus Branch) Tnk: +357 22 817690
Latvija
Pfizer Luxembourg SARL filiale Latvija Tel.: + 371 670 35 775
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europea.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Tato vakcína je pouze k intramuskulárnímu podání. Nepodávejte jí intravaskulárně, intradermálně ani subkutánně.
Pokud se Nimenrix podává společně s dalšími vakcínami, je třeba je aplikovat do různých injekčních míst. Nimenrix se nesmí míchat s dalšími vakcínami.
Návod pro rekonstituci vakcíny s rozpouštědlem v ampulce
Nimenrix musí být rekonstituovám přidáním celého obsahu rozpouštědla z ampulky do injekční lahvičky obsahující prášek.
1. Odlomte vrchní část ampulky, nasajte rozpouštědlo injekční stříkačkou a přidejte rozpouštědlo k prášku.
2. Směs je třeba dobře protřepat, dokud se prášek úplně nerozpustí v rozpouštědle.
Rekonstituovaná vakcína je čirý bezbarvý roztok.
Rekonstituovanou vakcínu je třeba zkontrolovat pohledem, zda neobsahuje cizí částice a/nebo odchylky od fyzikálního vzhledu před podáním. V případě pozorování jakýchkoli změn vakcínu znehodnoťte. Po rekonstituci je nutné vakcínu bezodkladně použít. K podání vakcíny je nutné použít novou jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpadní materiál musí být znehodnocen v souladu s místními požadavky.
65
Testováno v GSK laboratořích.