Neuraceq 300 Mbq/Ml
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Neuraceq 300 MBq/ml injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml injekčního roztoku obsahuje florbetabenum (18F) 300 MBq k datu a času kalibrace.
Aktivita v jedné injekční lahvičce je v rozmezí od 300 MBq do 3000 MBq ke dni a času kalibrace.
Fluor (18F) se rozpadá na stabilní kyslík (18O) s poločasem přibližně 110 minut emitováním pozitronového záření 634 keV, následované fotonickým anihilačním zářením 511 keV.
Pomocná látka/pomocné látky se známým účinkem:
Tento léčivý přípravek obsahuje až 1,2 g ethanolu a nejvýše 33 mg sodíku v jedné dávce (viz bod 4.4). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
Čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Tento přípravek je určen pouze k diagnostickým účelům.
Neuraceq je radiofarmakum indikované k použití při pozitronové emisní tomografii (PET) k zobrazování hustoty P-amyloidových neuritických plaků v mozku dospělých pacientů s kognitivní poruchou, kteří jsou hodnoceni pro Alzheimerovu chorobu (AD) a jiné příčiny kognitivních poruch. Neuraceq se používá ve spojení s klinickým hodnocením.
Negativní skenování znamená rozptýlené nebo žádné plaky, což není v souladu s diagnózou AD. Omezení v interpretaci pozitivního skenu naleznete v bodě 4.4 a 5.1.
4.2 Dávkování a způsob podání
PET sken s florbetabenem (18F) by měl být požadován lékaři se zkušenostmi v klinické léčbě neurodegenerativních onemocnění.
Snímky s přípravkem Neuraceq by měli interpretovat pouze odečítatelé vyškolení v interpretaci PET snímků s florbetabenem (18F). V případě nejistoty ohledně lokalizace šedé hmoty a hranice šedé a bílé hmoty na PET skenu (viz bod 4.4 Vyhodnocení snímků s přípravkem Neuraceq) se doporučuje provést novou počítačovou tomografii (CT) nebo magnetickou rezonanci (MR) společně s PET ke spojení snímků v rámci kombinace PET-CT nebo PET-MR.
Dávkování
Doporučená aktivita pro dospělého je 300MBq florbetabenu (18F). Maximální dávka by neměla překročit 360 MBq a nesmí klesnout pod 240 MBq v době podání. Množství injekčně podaného přípravku Neuraceq může být od 0,5 do 10 ml, aby bylo možné zajistit cílovou aktivitu 300 MBq v době intravenózního podání.
Zvláštní _ populace
Starší pacienti
Není nutná úprava dávkování v závislosti na věku.
Porucha funkce ledvin a jater
Je třeba pečlivě zvážit aktivitu, která má být podána, protože může u těchto pacientů dojít ke zvýšení radiační expozice. Viz bod 4.4.
Nebyly provedeny rozsáhlé studie hodnotící rozmezí a úpravy dávek léčivého přípravku v běžné a zvláštní populaci. Farmakokinetika florbetabenu (18F) u pacientů s poškozením ledvin nebo jater nebyla charakterizována.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Neuraceq u pediatrické populace.
Způsob podání
Neuraceq je určen k intravenóznímu podání a pro vícedávkové použití.
Aktivita florbetabenu (18F) se musí měřit aktivimetrem (kalibrátor dávkování) bezprostředně před injekcí.
Florbetaben (18F) se nesmí ředit.
Dávka se podává pomalou intravenózní bolusovou injekcí (6 s/ml) s následným proplachem asi 10 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9 %) pro zajištění aplikace celé dávky. Pokud je objem injekce mezi 0,5 a 1 ml, je třeba používat pouze stříkačky odpovídající velikosti (1 ml) a stříkačku je třeba propláchnout roztokem chloridu sodného (viz bod 12).
Injekce florbetabenu (18F) se musí podávat intravenózně, aby se předešlo ozáření v důsledku lokální extravazace a také rušivým obrazovým artefaktům.
Pořízení snímku
20minutový PET snímek by měl být získán přibližně 90 minut po intravenózním podání florbetabenu (18F).
Pacient by měl být v poloze na břiše s hlavou umístěnou se středem mozku, včetně mozečku, v zorném poli PET skeneru. K omezení pohybu hlavy může být použita páska nebo jiná flexibilní opěrka hlavy. Rekonstrukce by měla zahrnovat zeslabení korekce s výslednou velikostí transaxiálního pixelu mezi 2,0 a 3,0 mm.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Odůvodnění individuálního přínosu/rizika
Pro každého pacienta musí být radiační expozice odůvodněná pravděpodobným přínosem. Podaná aktivita by měla v každém případě být co nejnižší, aby ale byly získány potřebné diagnostické informace.
Porucha funkce ledvin a jater
U těchto pacientů je třeba pečlivě zvážit poměr přínosu a rizika, protože může dojít ke zvýšené radiační expozici. Florbetaben (18F) se vylučuje primárně prostřednictvím hepatobiliárního systému a pacienti s poruchou funkce mají potenciál zvýšené radiační expozice. Viz bod 4.2.
Pediatrická populace
Informace o použití v pediatrické populaci, viz bod 4.2 nebo 5.1.
Interpretace snímků s přípravkem Neuraceq
Snímky s přípravkem Neuraceq by měli interpretovat pouze odečítatelé vyškolení v interpretaci PET snímků s florbetabenem (18F). Negativní sken znamená řídkou nebo žádnou denzitu kortikálních P-amyloidových plaků. Pozitivní sken znamená středně častou až častou denzitu. Byly zaznamenány chyby vyhodnocování snímků při odhadu denzity mozkových neuritických P-amyloidových plaků, včetně falešně negativních a falešně pozitivních výsledků.
PET snímky jsou čteny v transaxiální orientaci pomocí šedé stupnice. Odečítatel by měl porovnat intenzitu signálu kortikální šedé hmoty s maximální intenzitou signálu bílé hmoty. Obrázky je třeba prohlížet systematickým způsobem (obrázek 1) počínaje na úrovni mozečku a posouvání nahoru přes laterální temporální a frontální laloky, potom do oblasti zadního cingulárního kortexu a prekuneu a na závěr k parietálnímu laloku.
Interpretace snímků se provádí vizuálně porovnáním aktivity v kortikální šedé hmotě s aktivitou v přilehlé kortikální bílé hmotě. Každá z těchto oblastí mozku - laterální temporální, frontální, zadní cingulární oblasti, prekuneus a parietální laloky - by měla být systematicky vizuálně posouzena a bodově ohodnocena podle skóre regionálního vychytávání stopovací látky v kortikální oblasti (RCTU) (tabulka 1).
Tabulka 1: Definice regionálního vychytávání stopovací látky v kortikální oblasti (Regional cortical tracer update, RCTU)
|
Hodnocení regionálního vychytávání stopovací látky v kortikální oblasti |
Podmínky pro hodnocení |
|
1 (bez vychytávání stopovací látky) |
Vychytávání stopovací látky (tzn. intenzita signálu) v oblasti šedé hmoty je nižší než v bílé hmotě. |
|
2 (střední vychytávání stopovací látky) |
Menší plocha (plochy) vychytávání stopovací látky se rovná nebo je vyšší než v bílé hmotě: přesahující přes okraj bílé hmoty k vnějšímu kortikálnímu okraji a zahrnující většinu řezů v dané oblasti. |
|
3 (výrazné vychytávání stopovací látky) |
Velká splývající oblast vychytávání stopovací látky se rovná nebo je větší než oblast, která je přítomna v bílé hmotě, přesahující okraj bílé hmoty k zevnímu okraji kortikální oblasti a zahrnující celou oblast včetně většiny řezů v dané oblasti. |
Pozn.: Pro skóre vychytávání stopovací látky v mozkové kůře by měl být nález přítomen na většině řezů v příslušné oblasti.
Obrázek 1: Případy Neuraceq PET ukazují příklady negativního florbetabenového (18F) PET skenu (horní šipka) a pozitivního skenu (dolní šipka).
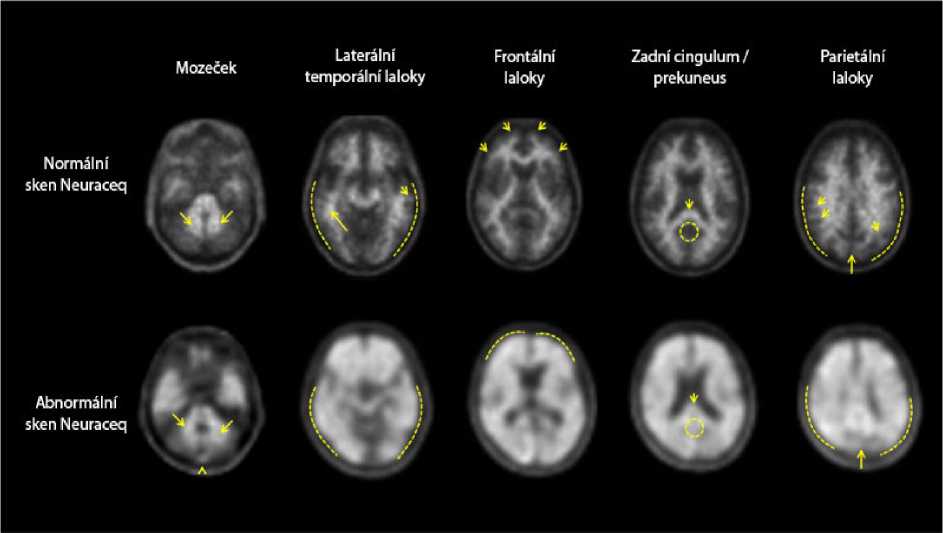
Celkové rozhodování týkající se posouzení vizuálního PET skenu je založeno na subjektu a na binárním výsledku jako „pozitivní“ nebo „negativní“ Subjekt je klasifikován jako „pozitivní" nebo „negativní“ na základě skóre zátěže mozkovými amyloidními plaky (BAPL) (tabulka 2), které je odvozeno z hodnoty RCTU ve čtyřech oblastech mozku (tabulka 1).
Tabulka 2: Definice zatížení mozku amyloidovými plaky (BAPL)
|
Zhodnocení: |
Skóre BAPL |
Pravidlo hodnocení | |
|
Negativní sken |
1 |
Sken bez depozice beta-amyloidu |
Skóre RCTU 1 v každé ze 4 oblastí mozku (laterální temporální laloky, frontální laloky, zadní cingulární / prekuneus, parietální laloky). |
|
Pozitivní sken |
2 |
Sken se střední depozicí beta-amyloidu |
Skóre RCTU 2 v některé ze 4 oblastí mozku a žádné skóre 3 v těchto 4 oblastech mozku. |
|
3 |
Sken s výraznou depozicí beta-amyloidu |
Skóre RCTU 3 minimálně v jedné ze 4 oblastí mozku | |
Omezení použití
Pozitivní sken nestanoví nezávisle diagnózu AD nebo jiné kognitivní poruchy, protože u asymptomatických starších osob a u některých neurodegenerativních demencí (Alzheimerova choroba, nemoc s difúzními Lewyho tělísky, demence při Parkinsonově chorobě) může dojít k depozici neuritického plaku v šedé hmotě.
Omezení použití u pacientů s mírnou kognitivní poruchou (MCI) viz bod 5.1.
Účinnost florbetabenu (18F) na predikci vývoje AD nebo sledování reakce na léčbu nebyla stanovena (viz bod 5.1).
Některé skeny může být obtížné interpretovat kvůli obrazovému šumu, atrofii se ztenčenou kortikální páskou nebo se obraz rozostří, což může vnést do interpretace chyby. V případech, kdy nelze s jistotou na PET skenu stanovit rozmístění šedé hmoty a hranici šedé a bílé hmoty a jsou k dispozici společně zaznamenané snímky CT nebo MR, měl by odečítatel prohlédnout spojené snímky PET-CT nebo PET-MR pro objasnění vztahu PET radioaktivity a anatomie šedé hmoty.
Zvýšené vychytávání bylo zjištěno v extracerebrálních strukturách, jako obličej a kůže hlavy. Někdy je možné pozorovat reziduální aktivitu v středním sagitálním sinu (viz bod 5.2).
Po zákroku
Měl by být omezen těsný kontakt s kojenci a těhotnými ženami v průběhu prvních 24 hodin po aplikaci.
Specifická varování
Tento léčivý přípravek obsahuje až 1,5 mmol (tzn. 33 mg) sodíku na jednu dávku. Tuto skutečnost je třeba vzít v úvahu u pacientů na dietě s kontrolovaným příjmem sodíku.
Tento léčivý přípravek obsahuje až 15 obj. % ethanolu (alkoholu), tzn. maximálně 1,2 g na jednu dávku. To odpovídá 30 ml piva nebo 12,5 ml vína v jedné dávce. Toto může být zdraví škodlivé pro ty osoby, které jsou postižené alkoholismem a je také třeba brát v úvahu těhotné nebo kojící ženy a vysoce rizikovou skupinu, jako jsou pacienti s onemocněním jater nebo epilepsií.
Opatření týkající se environmentálního rizika jsou uvedeny v bodě 6.6.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí in vivo.
V testech vazby radioligandu s použitím širokého panelu zvířecích a lidských receptorů, iontových kanálů a transportérů nebyla nalezena žádná významná vazba.
Studie in vitro využívající mikrozómy z lidských jater neprokázaly žádnou možnost inhibice enzymatického systému cytochromu P450.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Pokud je plánováno podání radiofarmak ženě ve fertilním věku, je důležité stanovit, zda je nebo není těhotná. Jakákoliv žena, u níž došlo k vynechání menstruace, by měla být považována za těhotnou, dokud nebude prokázáno, že těhotná není. Pokud existují pochybnosti o potenciálním těhotenství (pokud došlo k vynechání menstruace, pokud je menstruace velmi nepravidelná atd.), je třeba pacientce navrhnout alternativní techniky, které nevyužívají ionizující záření (pokud nějaké existují).
Radionuklidové postupy prováděné u těhotných žen zahrnují také působení radiační dávky na plod.
V průběhu těhotenství by mělo být prováděno pouze základní vyšetření, pokud předpokládaný přínos daleko převyšuje možná rizika pro matku a plod.
Studie u těhotných žen nebyly prováděny. Nebyly prováděny žádné studie na zvířatech za účelem zkoumání účinků florbetabenu (18F) na reprodukci (viz bod 5.3).
Kojení
Není známo, jestli se florbetaben (18F) vylučuje v průběhu kojení do mateřského mléka. Před podáním radiofarmak kojící matce je třeba zvážit možnost odložení podání radionuklidu do doby, až matka přestane kojit a to, jaké zvolené radiofarmakum je nejvhodnější s ohledem na vylučování aktivity do mateřského mléka. Je-li podání považováno za nutné, mělo by se kojení přerušit na dobu 24 hodin a odstříkané mléko by se mělo zlikvidovat.
Měl by být omezen těsný kontakt s kojenci v průběhu prvních 24 hodin po injekci.
Fertilita
Nebyly provedeny žádné studie fertility.
4.7 Účinky na schopnost řídit a obsluhovat stroje Neuraceq nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Celkový bezpečnostní profil přípravku Neuraceq je založen na údajích z 1090 podání přípravku Neuraceq 872 subjektům a 12 subjektům, kteří dostávali vehikulum. Opakované podávání v ročních intervalech ukázalo, že není rozdíl v bezpečnostním profilu po první, druhé nebo třetí dávce.
Seznam nežádoucích reakcí
Frekvence jsou definované jako velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000) a není známo (z dostupných údajů nelze určit). I když mohou ve skutečnosti nastat při nižší četnosti výskytu, než je uvedeno níže, velikost zdrojové databáze neumožnila zařazení do kategorie četnosti výskytu nižší, než je kategorie „méně časté“ (>1/1000 až <1/100).
Poruchy nervového systému
Méně časté: pálivý pocit, bolest hlavy, neuralgie, tremor
Cévní _ poruchy
Méně časté: zrudnutí, hematom, hypotenze
Gastrointestinální _ poruchy Méně časté: průjem, nauzea
Poruchy _jater a žlučových cest Méně časté: abnormální jaterní funkce
Poruchy kůže a podkožní tkáně
Méně časté: hyperhidróza, vyrážka, toxický kožní výsev
Poruchy svalové a kosterní soustavy a _pojivové tkáně Méně časté: diskomfort končetiny, bolest v končetině
Celkové poruchy a reakce v místě aplikace
Časté: podráždění v místě injekce, bolest v místě injekce, erytém v místě injekce / v místě aplikace Méně časté: bolest v místě katétru, diskomfort v místě injekce, krevní výron v místě injekce, teplo v místě injekce, reakce v místě vpichu, bolest místa punkce cévy, únava, pocit horka, pyrexie
Vyšetření
Méně časté: kreatinin v krvi zvýšený
Vystavení účinkům ionizujícímu záření je spojeno se vznikem rakoviny a s možným vývojem dědičných defektů. Vzhledem k tomu, že při podání maximální doporučené aktivity 300 MBq florbetabenu (18F) je efektivní dávka asi 5,8 mSv, jsou tyto nežádoucí účinky očekávány s nízkou pravděpodobností.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Vzhledem k malému množství florbatebenu (18F) v jedné dávce se nepředpokládá, že by předávkování mělo za následek farmakologické účinky. V případě radiačního předávkování by měla být absorbovaná dávka u pacienta snížena, pokud je to možné, zvýšením eliminace radionuklidu z organismu častým močením a defekací. To by mohlo být užitečné pro odhad efektivní dávky, která byla aplikována.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: diagnostická radiofarmaka, centrální nervový systém;
ATC kód: V09AX06
Mechanismus účinku
Florbetaben (18F) se váže na neuritické P-amyloidové plaky v mozku. Florbetaben (18F) vykazuje in vitro nanomolární vazebnou afinitu k syntetickým vláknům P-amyloidu a k AD homogenátu mozku. Kromě toho byla prokázána vazba florbetabenu (18F) na P-amyloidové plaky v post-mortem řezech mozku s AD pomocí autoradiografie podpořené imunohistochemicky, resp. Bielschowským barvením. In vivo nebyla u pacientů na konci života hodnocena kvantitativní korelace mezi vychytáváním florbetabenu (18F) v šedé hmotě mozkové kortex a depozitech P-amyloidu v pitevních vzorcích. Vazba florbetabenu (18F) in vivo na jiné amyloidní struktury nebo jiné mozkové struktury nebo receptory zůstává neznámá.
Farmakodynamické účinky
Při nízkých chemických koncentracích přítomných u přípravku Neuraceq nemá florbetaben (18F) žádnou detekovatelnou farmakodynamickou aktivitu.
U dokončených klinických studií bylo vychytávání florbetabenu (18F) v 7 předem definovaných kortikálních oblastech mozku (frontální, parietální, laterální a mediální temporální, a okcipitální oblasti, kaudatum a zadní cingulární / prekuneální kortex a přední cingulární gyrus) a mozečkové kůře měřena kvantitativně pomocí standardizovaných hodnot vychytávání (SUV). Kortikální poměry SUV (SUVR, vzhledem k mozečkové kůře) j sou vyšší u pacientů s AD ve srovnání s poměry u zdravých dobrovolníků.
Klinická, účinnost
Pivotní studie u 31 pacientů u konce života byla zaměřena na stanovení diagnostického výkonu florbetabenu (18F) v detekci denzity kortikálních neuritických plaků (žádné nebo řídké proti středně časté až časté) stanovené podle CERAD. Výsledky PET byly srovnány s maximální denzitou neuritických plaků měřené na řezu středního frontálního gyru, horního a středního temporálního gyru, dolního parietálního laloku, hipocampu a dalších mozkových oblastí při pitvě pacienta. Kognitivní stav subjektů nemohl být spolehlivě stanoven. U všech 31 subjektů vedlo zaslepené vizuální odečítání PET na úrovni subjektu 3 zaslepenými odečitateli k převažující senzitivitě odečtu 100% (95% IS: 80,5100 %) a specificitě 85,7 % (95% IS: 67,4-100%). Při post-hoc analýze byla senzitivita a specificita většiny vizuálních odečtů PET na úrovni subjektu proti histopatologii ve větší populaci (74 pacientů)
97,9 % (95% IS: 93,8-100 %) a 88,9 % (95% IS: 77-100%).
Senzitivita a specificita odhadu depozice beta-amyloidu florbetabenem (18F) byla dále hodnocena v jedné dodatečné studii, při níž odlišná skupina 5 elektronicky školených zaslepených odečítatelů interpretovala v pivotní studii snímky od 54 subjektů po pitvě. Histopatologická kritéria neodpovídala kritériím CERAD. Výsledky byly nižší, než výsledky pořízené v pivotní studii: rozsah senzitivity mezi 77,5% až 90 % a rozsah specificity mezi 62,5 až 85,7%. Shoda mezi hodnotícími pomocí hodnot Fleissova kappa byla mezi 0,68 až 0,87. Při srovnání výsledků odečtu PET skenu s histopatologickým hodnocením pro všechny subjekty (stejné, jako byly použity v původní pivotní studii a jejich post-hoc analýza) byla převažující senzitivita a specificita odečtu 100 % (95% IS: 89,4-100 %) resp. 71,4 % (95% IS: 52,1-90,8 %).
V longitudinální studii podstoupilo 45 subjektů s klinickou diagnózou mírné kognitivní poruchy (MCI) výchozí PET skeny s florbetabenem (18F) a subjekty byly dále sledovány po dobu 24 měsíců pro hodnocení vztahu mezi zobrazením florbetabenem (18F) a změnami diagnostického stavu. 29 (64,4 %) pacientů s MCI mělo pozitivní nález na PET skenu s florbetabenem (18F). Během 24 měsíců sledování došlo u 19 (42,2 %) ke konverzi na klinickou AD. Z 29 subjektů s MCI, kteří měli pozitivní PET sken, bylo 19 (65,5 %) klasifikováno klinicky jako konverze na klinickou AD po 24 měsících ve srovnání s
0 (0 %) z 16, kteří měli negativní sken. Senzitivita skenu s florbetabenem (18F) pro zobrazení konverze MCI na AD u 19 pacientů s konverzí byla 100 %, specificita u 26 pacientů bez konverze byla 61,5 % (95% IS: 42,8-80,2 %) a pozitivní věrohodnostní poměr (likelihood ratio) byl 2,60 (1,60 - 4,23). Design této studie neumožňuje odhad rizika progrese MCI do klinické AD.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o odklad povinnosti předložit výsledky studií s florbetabenem (18F) u všech podskupin pediatrické populace, protože onemocnění nebo stav, pro které je specifický léčivý přípravek určen, se objevuje pouze u dospělé populace a specifický léčivý přípravek nepředstavuje významný léčebný přínos oproti stávajícím způsobům léčby pediatrických pacientů.
5.2 Farmakokinetické vlastnosti
Distribuce
Po použití intravenózní bolusové injekce je dosaženo koncentrace radioaktivity 2-3% injekční dávky/l v arteriální plazmě 10 minut po injekci.
Florbetaben (18F) je silně vázán na plazmatické proteiny (>98,5 %).
Vychytávání orgány
Vychytávání radioaktivity v mozku je rychlé, dosahuje asi 6 % injikované radioaktivity po 10 minutách po injekci.
Zdravé kontroly ukazují relativně nízkou úroveň retence florbetabenu (18F) v kortexu. Nejvyšší úroveň vychytávání je v pontu a v dalších oblastech bílé hmoty. Kortikální oblasti a striatální oblasti u subjektů s AD vykazují významně větší vychytávání ve srovnání s kontrolními skupinami. U subjektů s AD, stejně jako u kontrolních skupin, je přítomná vysoká retence v pontu a v dalších oblastech bílé hmoty.
V některých případech bylo vychytávání identifikováno také v extracerebrálních strukturách, jako jsou obličej a pokožce hlavy. Důvod tohoto hromadění není znám, ale možná je to kvůli hromadění florbetabenu (18F) nebo kteréhokoli z jejich radioaktivních metabolitů nebo krevní radioaktivity. Reziduální aktivitu v středním sagitálním sinu je možné někdy pozorovat, pravděpodobně v důsledku přítomnosti stopovací látky v krvi.
Biofyzikální základ retence florbetabenu (18F) v bílé hmotě v živém lidském mozku není možné definitivně vysvětlit. Byla vytvořena hypotéza, že nespecifická vazba radiofarmaka na lipid obsahující myelinové pochvy může přispívat k retenci v bílé hmotě.
Eliminace
Florbetaben (18F) je eliminován z plazmy pacientů s AD s průměrným biologickým poločasem asi
1 hodina. Přibližně 4 hodiny po injekci by neměla být v krvi naměřena žádná radioaktivita. Na základě in vitro experimentů je florbetaben (18F) metabolizován převážně pomocí CYP2J2 a CYP4F2.
12 hodin po injekci se vyloučí močí až cca 30 % injikované radioaktivity. Časové body mimo uvedený časový rámec neumožnily další kvantifikaci aktivity v moči.
Poločas rozpadu
Fluor (18F) má fyzikální poločas rozpadu 110 minut.
12 hodin po injekci je rozloženo 98,93 % aktivity, 24 hodin po injekci je rozloženo 99,99 % aktivity. Porucha funkce ledvin nebo jater
Farmakokinetika u pacientů s poškozením ledvin nebo jater nebyla charakterizována.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po jednom a opakovaném podávání a genotoxicity neodhalily žádné zvláštní riziko pro člověka. Potenciální toxicita byla testována na potkanech a psech po dobu 28 dní opakovaným intravenózním podáváním florbetabenu a zjištěná hladina NOAEL byla minimálně 20násobkem maximální dávky pro člověka.
Chronické studie a studie kancerogenity nebyly provedeny, protože léčivý přípravek není určen k pravidelnému a kontinuálnímu podávání.
Studie na reprodukční toxicitu nebyly prováděny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Kyselina askorbová Bezvodý ethanol Makrogol 400
Natrium-askorbát (k úpravě pH).
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
Maximálně 10 hodin od dokončení syntézy.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
Uchovávání radiofarmaceutických přípravků bude v souladu s národními předpisy o radioaktivních materiálech.
6.5 Druh obalu a obsah balení
Léčivý přípravek se dodává v bezbarvé vícedávkové skleněné injekční lahvičce typ I o objemu 15 ml, uzavřené chlorobutylovou zátkou a hliníkovým uzávěrem.
Každá vícedávkova injekční lahvička obsahuje 1,0 až 10 ml roztoku, což odpovídá 300 až 3000 MBq k datu a času kalibrace (ToC).
V důsledku rozdílů ve výrobním procesu je možné, že se některé injekční lahvičky distribuují s propíchnutými gumovými uzávěry.
Velikost balení: jedna injekční lahvička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Obecná varování
Radiofarmaka by měly získávat, používat a aplikovat pouze autorizované osoby v určených klinických podmínkách. Jejich přijetí, uchovávání, použití, přenos a likvidace podléhají předpisům anebo odpovídajícím licencím kompetentní oficiální organizace.
Radiofarmaka se připravují způsobem, který splňuje požadavky na radiační bezpečnost a požadavky na farmaceutickou kvalitu. Je třeba použít odpovídající aseptická opatření.
Pokud je narušena integrita injekční lahvičky, neměl by být přípravek používán.
Postup podání by měl být proveden způsobem, aby se minimalizovalo riziko kontaminace léčivého přípravku a ozáření obsluhy. Je povinné adekvátní stínění.
Podávání radiofarmak představuje riziko pro další personál (včetně těhotných zdravotnických pracovnic) od vnějšího ozáření nebo kontaminace z úniku moči, zvratků atd. Proto musí být přijaty opatření radiační ochrany v souladu s národními předpisy.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Piramal Imaging Limited Langstone Technology Park Langstone Road, Havant, Hampshire PO9 1SA Velká Británie
e-mail: GRA.Imaging@piramal.com
8. REGISTRAČNÍ ČÍSLO(A)
EU 1/13/906/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
20.února 2014
10. DATUM REVIZE TEXTU
11. DOZIMETRIE
Níže uvedená tabulka ukazuje dozimetrii vypočtenou pomocí software OLINDA (Organ Level INternal Dose Assessment, Hodnocení vnitřní dávky na orgánové úrovni).
Odhadované dávky absorbovaného záření orgány jsou uvedeny v Tabulce 3 a poskytují údaje od zdravých bělošských dobrovolníků (n=17). Dozimetrické výpočty byly přizpůsobeny dospělému modelu (s tělesnou hmotností 70 kg).
Tabulka 3: Odhadovaná dávka absorbovaného záření při intravenózní injekci s přípravkem Neuraceq na bělošských subjektech
|
Orgán |
Dávka absorbovaná dle podané aktivity [mGy/MBq] |
|
Nadledvina |
0,0130 |
|
Mozek |
0,0125 |
|
Prsa |
0,0074 |
|
Žlučník |
0,137 |
|
Gastrointestinální trakt | |
|
Dolní část tlustého střeva |
0,0351 |
|
Tenké střevo |
0,0314 |
|
Žaludek |
0,0116 |
|
Horní část tlustého střeva |
0,0382 |
|
Srdce |
0,0139 |
|
Ledviny |
0,0238 |
|
Játra |
0,0386 |
|
Plíce |
0,0148 |
|
Svaly |
0,00948 |
|
Vaječníky |
0,0156 |
|
Pankreas |
0,0139 |
|
Kostní dřeň |
0,0122 |
|
Osteogenní buňky |
0,0148 |
|
Kůže |
0,00689 |
|
Slezina |
0,0102 |
|
Varlata |
0,00913 |
|
Thymus |
0,00892 |
|
Štítná žláza |
0,00842 |
|
Močový měchýř |
0,0695 |
|
Děloha |
0,0163 |
|
Ostatní orgány |
0,0110 |
|
Efektivní dávka (mSv/MBq) |
0,0193 |
Efektivní dávka vyplývající z podání maximální doporučené aktivity 360 MBq dávky pro dospělého o hmotnosti 70 kg je přibližně 7,0 mSv. Pokud se CT sken provádí současně jako část PET, expozice ionizujícímu záření se zvýší na hodnotu v závislosti na nastavení používaném při získávání CT.
Pro podanou aktivitu 360 MBq je typická dávka radiace do cílového orgánu (mozku) 4,5 mGy.
Pro podanou aktivitu 360 MBq jsou typické dávky radiace dodané do kritických orgánů, žlučníku, močového měchýře, horní části tlustého střeva, dolní části tlustého střeva, tenkého střeva a jater 49,3 mGy, 25,0 mGy, 13,8 mGy, 12,6 mGy, 11,3 mGy a 13,9 mGy.
12. NÁVOD PRO PŘÍPRAVU RADIOFARMAK
Způsob přípravy
Balení musí být před použitím překontrolováno a aktivita přeměřena pomocí aktivimetru.
Náběry se musí provádět za aseptických podmínek. Lahvičky není možné otevřít bez dezinfekce zátky. Roztok by měl být odebrán přes zátku pomocí jednorázové injekční stříkačky s vhodným ochranným krytem a jednorázové sterilní jehly nebo pomocí autorizovaného automatizovaného aplikačního systému. Pokud je narušena integrita lahvičky, nesmí se léčivý přípravek použít.
Přípravek Florbetaben (18F) se nesmí ředit.
Dávka se podává pomalou intravenózní bolusovou injekcí (6 s/ml) následovanou proplachem asi 10 ml roztoku chloridu sodného o koncentraci 9 mg/ml (0,9 %) pro injekce, aby se zajistila plná aplikace dávky. Pokud je objem injekce mezi 0,5 a 1 ml, je třeba používat pouze stříkačky odpovídající velikosti (1 ml) a stříkačky je třeba propláchnout roztokem chloridu sodného.
Injekce florbetabenu (18F) musí být intravenózní, aby se předešlo podráždění v důsledku lokální extravazace a také obrazovým artefaktům.
Kontrola kvality
Roztok je třeba zkontrolovat vizuálně před použitím. Je třeba používat pouze čirý, bezbarvý roztok bez viditelných částic.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE/VÝROBCI ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
ALLIANCE MEDICAL MOLECULAR IMAGING LTD. - GUILDFORD
Unit 19, Quadrum Park, Old Portsmouth Road, Peasmarsh, Guildford, Surrey, GU3 1LU
Velká Británie
BV CYCLOTRON VU - AMSTERDAM De Boelelaan 1081 1081 HV Amsterdam Nizozemsko
CIS BIO INTERNATIONAL - NANCY CHU de Brabois Avenue de Bourgogne 54500 Vandoeuvre les Nancy Francie
CIS BIO INTERNATIONAL - NÍMES Parc scientifique Georges Besse 180 Allée Von Neumann 30000 Nimes Francie
CIS BIO INTERNATIONAL - PARIS 14 rue de la Grange aux Belles 75010 Paris Francie
CIS BIO INTERNATIONAL - RENNES Centre Eugene Marquis
Rue de la Bataille Flandres Dunkerque, CS 44229
35042 Rennes
Francie
CIS BIO INTERNATIONAL - BORDEAUX Hopital Xavier Arnozan Avenue du Haut Léveque 33600 Pessac (Bordeaux)
Francie
Eckert & Ziegler EURO-PET Berlin GmbH - BERLIN Max-Planck-Strasse 4 12489 Berlin Německo
PET Net Muenchen GmbH - MUNICH Marchioninistrasse 15 81377 Munich Německo
Eckert & Ziegler EURO-PET Warszawa Sp. z o.o. - WARSAW ul. Szeligowska 3 05-850 Szeligi Polsko
Eckert & Ziegler EURO-PET Koeln/Bonn GmbH - BONN Spessartstr. 9 53119 Bonn Německo
IBA MOLECULAR ITALY S.R.L. - MONZA
via Pergolesi, 33 20052 Monza Itálie
IBA MOLECULAR ITALY S.R.L. - ROME Viale Oxford 81 (Tor Vergata)
00133 Rome Itálie
IBA MOLECULAR ITALY S.R.L. - UDINE Piazzale Santa Maria della Misericordia, 15 33100 Udine Itálie
IBA MOLECULAR SPAIN, S.A. - SEVILLE Thomas Alba Edison, s/n 41092 Seville Španělsko
IBA MOLECULAR SPAIN, S.A. - MADRID Pol. Ind. Conpisa, C/ Veguillas, 2 Nave 16,
Ajalvir 28864 (Madrid)
Španělsko
Seibersdorf Labor GmbH - SEIBERSDORF Grundstueck Nr. 482/2 EZ 98 KG 2444 Seibersdorf Rakousko
BetaPlus Pharma SA - BRUSSELS Avenue Hippocrate 10 bte 1527 1200 Brussels Belgie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento přípravek do 6 měsíců od jeho registrace. Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento přípravek v souladu
s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik
Před uvedením na trh v každém členském státě musí držitel rozhodnutí o registraci (MAH) dohodnout finální edukační program s národním kompetentním úřadem.
MAH musí zajistit, že po diskuzi a dohodě s národním kompetentním úřadem v každém členském státě, kde bude přípravek NEURACEQ uveden na trh, při uvedení a po uvedení, budou mít všichni lékaři, u nichž se předpokládá, že budou přípravek NEURACEQ používat, přístup do tréninkového programu, aby byla zajištěna přesná a spolehlivá interpretace PET snímků.
Tréninkový program by měl obsahovat následující klíčové elementy:
• Informace o patologii amyloidu u Alzheimerovy choroby .
• Relevantní informace o přípravku NEURACEQ jako sledovací látce pro P-amyloid při PET vyšetření, včetně schválené indikace dle SPC, omezení použití přípravku NEURACEQ, chyb v interpretaci, bezpečnostních informací a výsledků klinických studií informujících o diagnostickém použití přípravku NEURACEQ.
• Kontrola kritérií pro odečet PET zahrnujících metodu prohlížení snímku, kritéria pro interpretaci a snímky ukazující metodu odečtu.
• Tréninkový materiál by měl zahrnovat případy použití přípravku NEURACEQ PET se správnou interpretací PET skenu zkušeným odečítatelem NEURACEQ-PET skenů pro auto-hodnocení a auto-kvalifikační postup, který bude nabídnut každé školené osobě. Trénink by měl zahrnovat dostatečný počet jasně pozitivních a negativních případů a také intermediární případy. Případy by měly být histopatologicky potvrzené, pokud je to možné.
• Je třeba zajistit znalosti a kvalifikaci školených pracovníků.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Neuraceq 300 MBq/ml injekční roztok Florbetabenum (18F)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml injekčního roztoku obsahuje florbetabenum (18F) 300 MBq k datu a času kalibrace.
3. SEZNAM POMOCNÝCH LÁTEK
Kyselina askorbová, bezvodý ethanol, makrogol 400, natrium-askorbát, voda na injekci Další viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
Jedna injekční lahvička pro více dávek Referenční číslo zákazníka
Aktivita: {XXX} MBq v {XX} mL
ToC: {DDMMRRRR} {XX}h{XX} časová zóna
Objem: {XX} ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intravenózní podání.
Vícedávkové balení.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ

Radioaktivní materiál
Alliance Medical Molecular Imaging Ltd., Velká Británie
BV Cyclotron VU, Nizozemsko
Cis Bio International, Nancy, Francie
Cis Bio International, Nimes, Francie
Cis Bio International, Paříž, Francie
Cis Bio International, Rennes, Francie
Cis Bio International, Pessac, Francie
Eckert & Ziegler EURO-PET Berlin GmbH, Německo
PET Net Muenchen GmbH, Německo
Eckert & Ziegler EURO-PET Warszawa Sp. z o.o., Polsko
Eckert & Ziegler EURO-PET Koeln/Bonn GmbH, Německo
IBA Molecular Italy S.R.L., Monza, Itálie
IBA Molecular Italy S.R.L., Rome, Itálie
IBA Molecular Italy S.R.L., Udine, Itálie
IBA Molecular Spain, S.A., Seville, Španělsko
IBA Molecular Spain, S.A., Madrid, Španělsko
Seibersdorf Labor GmbH, Rakousko
BetaPlus Pharma SA, Brussels, Belgie
8. POUŽITELNOST_
EXP {DD/MM/RRRR} {XX}h{XX} časová zóna}
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Všechen nepoužitý přípravek musí být zlikvidován v souladu s národními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Piramal Imaging Ltd., Langstone Tech. Park, Havant PO9 ISA, UK
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/906/001
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Neuraceq 300 MBq/ml injekční roztok. Florbetabenum (18F)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml injekčního roztoku obsahuje florbetabenum (18F) 300 MBq k datu a času kalibrace.
3. SEZNAM POMOCNÝCH LÁTEK
Kyselina askorbová, bezvodý ethanol, makrogol 400, natrium-askorbát, voda na injekci Další viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
Jedna injekční lahvička pro více dávek Aktivita: {XXX} MBq v {XX} mL.
ToC: {DDMMRRRR} {XX}h{XX} časová zóna Objem: {XX} ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Intravenózní podání.
Vícedávkové balení.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ

Radioaktivní materiál
Alliance Medical Molecular Imaging Ltd., Velká Británie
BV Cyclotron VU, Nizozemsko
Cis Bio International, Nancy, Francie
Cis Bio International, Nimes, Francie
Cis Bio International, Paříž, Francie
Cis Bio International, Rennes, Francie
Cis Bio International, Pessac, Francie
Eckert & Ziegler EURO-PET Berlin GmbH, Německo
PET Net Muenchen GmbH, Německo
Eckert & Ziegler EURO-PET Warszawa Sp. z o.o., Polsko
Eckert & Ziegler EURO-PET Koeln/Bonn GmbH, Německo
IBA Molecular Italy S.R.L., Monza, Itálie
IBA Molecular Italy S.R.L., Rome, Itálie
IBA Molecular Italy S.R.L., Udine, Itálie
IBA Molecular Spain, S.A., Seville, Španělsko
IBA Molecular Spain, S.A., Madrid, Španělsko
Seibersdorf Labor GmbH, Rakousko
BetaPlus Pharma SA, Brussels, Belgie
8. POUŽITELNOST_
EXP {DD/MM/RRRR} {XX}h{XX} {časová zóna}
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Piramal Imaging Ltd., Langstone Tech. Park, Havant PO9 ISA, UK
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/906/001
13. ČÍSLO ŠARŽE <, KÓD DÁRCE A KÓD LÉČIVÉHO PŘÍPRAVKU>
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU LAHVIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Neuraceq 300 MBq/ml injekční roztok. Florbetabenum (18F)
Intravenózní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP: ToC + 6h
4. ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
Aktivita: < 3000 MBq v čase ToC (viz vnější obal).
6. JINÉ_

Radioaktivní materiál Alliance Medical Molecular Imaging Ltd., Velká Británie BV Cyclotron VU, Nizozemsko Cis Bio International, Nancy, Francie Cis Bio International, Nimes, Francie Cis Bio International, Paříž, Francie Cis Bio International, Rennes, Francie
Cis Bio International, Pessac, Francie
|
Eckert & Ziegler EURO-PET Berlin GmbH, Německo | ||
|
PET Net Muenchen GmbH, Německo | ||
|
Eckert & Ziegler EURO-PET Warszawa Sp. z o.o., Polsko | ||
Eckert & Ziegler EURO-PET Koeln/Bonn GmbH, Německo
IBA Molecular Italy S.R.L., Monza, Itálie IBA Molecular Italy S.R.L., Rome, Itálie IBA Molecular Italy S.R.L., Udine, Itálie IBA Molecular Spain, S.A., Seville, Španělsko IBA Molecular Spain, S.A., Madrid, Španělsko Seibersdorf Labor GmbH, Rakousko BetaPlus Pharma SA, Brussels, Belgie
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Neuraceq 300 MBq/ml injekční roztok.
Florbetabenum (18F)
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře pro nukleární medicínu, který bude zákroku dohlížet.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři pro nukleární medicínu. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny
v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Neuraceq a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Neuraceq používat
3. Jak se přípravek Neuraceq používá
4. Možné nežádoucí účinky
5. Jak přípravek Neuraceq uchovávat
6. Obsah balení a další informace
1. Co je přípravek Neuraceq a k čemu se používá
Tento lék je radiofarmaceutický přípravek určený pouze k diagnostickým účelům.
Neuraceq obsahuje léčivou látku florbetaben (18F).
Neuraceq je určen osobám s problémy s pamětí, aby mohli lékaři vykonávat druh skenování mozku s názvem PET. Skenovaní PET s použitím přípravku Neuraceq společně s dalšími testy funkce mozku může pomoci Vašemu lékaři určit, zda nemáte v mozku P-amyloidové plaky. Tento léčivý přípravek je určen pouze pro dospělé.
Měl(a) byste projednat výsledky testu s lékařem, který požádal o skenování.
Použití přípravku Neuraceq představuje expozici malým množstvím radioaktivity. Váš lékař a lékař pro nukleární medicínu se domnívají, že klinický přínos tohoto postupu s radiofarmaceutikem převáží riziko vystavení záření.
2. Čemu musíte věnovat pozornost, než začnete přípravek Neuraceq používat Nepoužívejte přípravek Neuraceq
- jestliže jste alergický(á) na florbetaben (18F) nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Poraďte se se svým lékařem pro nukleární medicínu dříve, než Vám bude přípravek Neuraceq podán, jestliže:
- máte potíže s ledvinami
- máte potíže s játry
- j ste těhotná nebo si myslíte, že j ste těhotná
- kojíte
Děti a dospívající
Přípravek Neuraceq není určen pro použití u dětí a dospívajících mladších 18 let Další léčivé přípravky a přípravek Neuraceq
Informujte svého lékaře pro nukleární medicínu o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, protože mohou ovlivnit interpretaci snímků.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem pro nukleární medicínu dříve, než vám bude přípravek Neuraceq podán. Pokud pochybujete, je důležité poradit se s Vaším lékařem pro nukleární medicínu, který bude na zákrok dohlížet.
Jste-li těhotná
Lékař pro nukleární medicínu Vám podá tento léčivý přípravek v průběhu těhotenství v případě, že očekávaný přínos převáží nad riziky.
Pokud kojíte
Musíte přerušit kojení na dobu 24 hodin po injekci. Během tohoto období odstříkávejte mateřské mléko a toto mléko zlikvidujte. Obnovení kojení by měl schválit lékař pro nukleární medicínu, který na celou proceduru bude dohlížet.
Jestliže jste těhotná nebo kojíte, myslíte si, že byste mohla být těhotná nebo plánujete otěhotnět, poraďte se se svým lékařem pro nukleární medicínu dříve, než Vám bude tento přípravek podán.
Řízení dopravních prostředků a obsluha strojů
Přípravek Neuraceq nemá žádné známé účinky na schopnost řídit a používat stroje.
Přípravek Neuraceq obsahuje ethanol a natrium-askorbát
- Tento lék obsahuje 15 obj. % ethanolu (alkoholu) tzn. 1,2 g ethanolu na jednu dávku. To odpovídá 30 ml piva nebo 12,5 ml vína v jedné dávce. To může být zdraví škodlivé pro pacienty postižené alkoholismem a je také třeba brát v úvahu těhotné nebo kojící ženy a vysoce rizikovou skupinu, jako jsou pacienti s onemocněním jater nebo epilepsií.
- Tento lék obsahuje až 1,5 mmol sodíku (tzn. 33 mg) v jedné dávce. Tuto skutečnost je třeba vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
3. Jak se přípravek Neuraceq používá
Existují přísné zákony o použití, manipulaci a likvidaci radiofarmaceutických přípravků. Přípravek Neuraceq se bude používat pouze ve zvláštních kontrolovaných prostorách. S tímto přípravkem budou manipulovat a budou ho podávat pouze profesionálové, kteří jsou vyškolení a kvalifikovaní v jeho bezpečném použití. Tyto osoby budou dávat zvláštní pozor na bezpečné použití tohoto přípravku a budou vás informovat o jeho účincích.
Dávka
Lékař pro nukleární medicínu, který nad zákrokem dohlíží, rozhodne o množství přípravku Neuraceq, které se ve vašem případě použije. Bude to nejmenší množství, které bude nezbytné k dosažení požadovaných informací.
Podané množství, které se obvykle doporučuje pro dospělé osoby, je 300 MBq (megabecquerel je jednotka používaná k vyjádření radioaktivity).
Podávání přípravku Neuraceq a provedení zákroku
Přípravek Neuraceq se podává injekcí do žíly (intravenózní injekce) následované proplachem roztokem chloridu sodného pro zajištění aplikace celé dávky.
Jedna injekce je dostačující k provedení skenu, který lékař potřebuje.
Délka trvání zákroku
Skenování mozku je obvykle prováděno 90 minut po podání přípravku Neuraceq.
Váš lékař pro nukleární medicínu Vás bude informovat o obvyklém trvání zákroku.
Po podání přípravku Neuraceq byste měl(a):
Vyhnout se blízkému kontaktu s malými dětmi a těhotnými ženami po dobu 24 hodin po injekci.
Lékař pro nukleární medicínu Vás bude informovat, zda je třeba, abyste po podání tohoto přípravku prováděl(a) jakákoliv zvláštní opatření. Kontaktujte svého lékaře pro nukleární medicínu, pokud máte nějaké otázky.
Jestliže jste užil(a) více přípravku Neuraceq, než jste měl(a)
Předávkování je nepravděpodobné, protože obdržíte pouze jednu dávku přípravku Neuraceq důkladně kontrolovanou lékařem pro nukleární medicínu, který dohlíží na celý zákrok.
Nicméně, v případě předávkování obdržíte odpovídající léčbu. Lékař pro nukleární medicínu, který má na starosti zákrok, může zejména zajistit zvýšení odchodu moči a stolice s cílem přispět k odstranění radioaktivity z těla.
Máte-li jakékoliv další otázky týkající se užívání tohoto přípravku, zeptejte se prosím lékaře pro nukleární medicínu, který na zákrok dohlíží.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Mezi možné nežádoucí účinky patří:
Časté (mohou postihovat 1 osobu z 10):
- Reakce v místě injekce: podráždění v místě injekce, bolest v místě injekce, zarudnutí kůže v místě injekce (erytém v místě injekce / v místě aplikace)
Méně časté (mohou postihovat až 1 osobu ze 100):
- Pocit pálení, bolest hlavy, neuralgie (intenzivní, obvykle občasná bolest podél průběhu nervu), tremor (mimovolní třes/chvění)
- Cévy: zrudnutí (náhlé zrudnutí obličeje a/nebo krku), hematom (modřina, černá a modrá skvrna), hypotenze (nízký krevní tlak)
- Žaludek: průjem, pocit na zvracení (pocit nevolnosti)
- Játra: abnormální jaterní funkce
- Kůže: hyperhidróza (nadměrné pocení), vyrážka, toxická kožní vyrážka (akutní postižení kůže erytémem (červené zbarvení kůže) podobným spalničkám, případně zahrnujícím puchýře a vředy)
- Svaly a kosti: nepříjemné pocity v končetinách, bolest v končetinách
- Stavy v místě injekce: bolest a nepříjemné pocity v místě injekce, hematom v místě injekce (modřina, modrá až černá skvrna v místě injekce), teplo v místě injekce, únava, pocit horka, pyrexie (zvýšení tělesné teploty, horečka)
- Abnormální krevní testy: zvýšení hladiny kreatininu v krvi (snížení funkce ledvin)
Tento radiofarmaceutický přípravek dodává nízká množství ionizujícího záření spojená s minimálním
rizikem vzniku rakoviny a dědičných abnormalit.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři pro nukleární medicínu. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Neuraceq uchovávat
Tento přípravek nebudete muset uchovávat. Tento přípravek se uchovává na zodpovědnost odborníka v určených prostorách. Uchovávání radiofarmaceutických přípravků bude v souladu s národními předpisy o radioaktivních materiálech.
Následující informace je určena pouze pro odborníky:
- Přípravek Neuraceq se nesmí používat po uplynutí doby použitelnosti, které je uvedeno na obalu za „EXP“.
- Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6. Obsah balení a další informace Co přípravek Neuraceq obsahuje
- Léčivou látkou je florbetabenum (18F). 1 ml injekčního roztoku obsahuje florbetabenum (18F) 300 MBq k datu a času kalibrace.
- Dalšími složkami jsou kyselina askorbová, bezvodý ethanol, makrogol 400, natrium-askorbát a voda na injekci (viz bod 2 „Neuraceq obsahuje ethanol a natrium-askorbát“).
Jak přípravek Neuraceq vypadá a co obsahuje toto balení
Neuraceq je čirý, bezbarvý injekční roztok. Je dodáván v bezbarvé vícedávkové skleněné lahvičce typ I o objemu 15 ml uzavřené chlorobutylovou zátkou a hliníkovým uzávěrem.
Každá vícedávková injekční lahvička obsahuje 1,0 až 10 ml roztoku, což odpovídá 300 až 3000 MBq florbetabenu (18F) k datu a času kalibrace.
Velikost balení 1 injekční lahvička
Držitel rozhodnutí o registraci
Piramal Imaging Limited Langstone Technology Park Langstone Road, Havant, Hampshire PO9 1SA Velká Británie
e-mail: GRA.Imaging@piramal.com Výrobce
Alliance Medical Molecular Imaging Ltd.
Unit 19, Quadrum Park, Old Portsmouth Road Peasmarsh, Guildford, Surrey, GU3 1LU Velká Británie
BV Cyclotron VU De Boelelaan 1081 1081 HV Amsterdam Nizozemsko
CIS Bio International CHU de Brabois Avenue de Bourgogne 54500 Vandoeuvre les Nancy Francie
CIS Bio International
Parc scientifique Georges Besse
180 Allée Von Neumann
30000 Nimes
Francie
Cis Bio International
14, rue de la Grange aux Belles
75010 Paříž
Francie
Cis Bio International Centre Eugene Marquis
Rue de la Bataille Flandres Dunkerque, CS 44229
35042 Rennes
Francie
Cis Bio International Hopital Xavier Arnozan Avenue du Haut Léveque 33600 Pessac (Bordeaux)
Francie
Eckert & Ziegler EURO-PET Berlin GmbH Max-Planck-Strasse 4 12489 Berlin Německo
PET Net Muenchen GmbH
Marchioninistrasse 15 81377 Munich Německo
Eckert & Ziegler EURO-PET Warszawa Sp. z o.o. ul. Szeligowska 3 05-850 Szeligi Polsko
Eckert & Ziegler EURO-PET Koeln/Bonn GmbH Spessartstr. 9 53119 Bonn Německo
IBA Molecular Italy S.R.L. via Pergolesi, 33 20052 Monza Itálie
IBA Molecular Italy S.R.L.
Viale Oxford 81 (Tor Vergata)
00133 Rome Itálie
IBA Molecular Italy S.R.L.
Piazzale Santa Maria della Misericordia, 15
33100 Udine
Itálie
IBA Molecular Spain, S.A.
Thomas Alba Edison, s/n 41092 Seville Španělsko
IBA Molecular Spain, S.A.
Pol. Ind. Conpisa,
C/ Veguillas - 2 Nave 16,
Ajalvir 28864 (Madrid)
Španělsko
Seibersdorf Labor GmbH Grundstueck Nr. 482/2 EZ 98 KG 2444 Seibersdorf Rakousko
BetaPlus Pharma SA Avenue Hippocrate 10 bte 1527 1200 Brussels Belgie
Další informace o tomto léčivém přípravku získáte u držitele rozhodnutí o registraci.
Tato příbalová informace byla naposledy revidována {měsíc RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Kompletní souhrn údajů o přípravku Neuraceq je k dispozici jako samostatný dokument v produktovém balíčku, s cílem poskytnout zdravotníkům další dodatečné vědecké a praktické informace o podávání a použití tohoto radiofarmaka.
Přečtěte si prosím souhrn údajů o přípravku [souhrn údajů o přípravku je součástí krabičky].
35