Mirvaso 3 Mg/G
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Mirvaso 3 mg/g gel.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden gram gelu obsahuje brimonidinum 3,3 mg, což odpovídá brimonidini tartras 5 mg. Pomocné látky se známým účinkem:
Jeden gram gelu obsahuje 1 mg methylparabenu (E218) a 55 mg propylenglykolu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Gel.
Bílý až světle žlutý matný vodný gel.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Mirvaso je indikován k symptomatické léčbě erytému v obličeji při rosacee u dospělých pacientů.
4.2 Dávkování a způsob podání
Dávkování
Jedna aplikace za 24 hodin kdykoliv podle možností pacienta tak dlouho, dokud je erytém v obličeji patrný.
Maximální denní doporučená dávka je celkem 1 g hmotnosti gelu, rozdělená do pěti kousků o velikosti hrášku.
Zvláštní populace Starší pacienti
Zkušenosti s použitím přípravku Mirvaso u pacientů ve věku nad 65 let jsou omezené (viz také bod 4.8).
Pediatrická populace
Bezpečnost a účinnost přípravku Mirvaso u dětí a dospívajících ve věku do 18 let nebyla stanovena. Nejsou dostupné žádné údaje.
Přípravek Mirvaso je u dětí mladších 2 let věku kontraindikován z důvodu závažného celkového bezpečnostního rizika (viz bod 4.3). U věkové skupiny od 2 do 12 let existují rovněž obavy ohledně bezpečnosti kvůli systémové absorpci brimonidinu (viz bod 4.9). Přípravek Mirvaso se nemá používat u dětí ani dospívajících ve věku 2 až 18 let.
Způsob podání
Pouze pro kožní použití.
Kožní aplikace malého množství léčivého přípravku o velikosti hrášku na každou z pěti částí obličeje: čelo, brada, nos, obě tváře.
Mirvaso se má nanášet hladce a rovnoměrně v tenké vrstvě na celý obličej, mimo oblast očí, očních víček, rtů, úst a sliznice uvnitř nosu. Mirvaso se má aplikovat pouze na obličej.
Po aplikaci léčivého přípravku je třeba si okamžitě umýt ruce.
Mirvaso lze použít spolu s ostatními léčivými přípravky pro kožní použití při léčbě zánětlivých lézí při rosacee a spolu s kosmetickými přípravky. Tyto přípravky se nemají aplikovat bezprostředně před podáním přípravku Mirvaso; mohou být aplikovány až poté, kdy přípravek Mirvaso zaschne.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Děti mladší 2 let.
Pacienti, kteří užívají inhibitory monoaminooxidázy (MAO) (např. selegilin nebo moklobemid) a pacienti užívající tricyklická (např. imipramin) nebo tetracyklická (např. maprotilin, mianserin nebo mirtazapin) antidepresiva, která ovlivňují noradrenergní přenos.
4.4 Zvláštní upozornění a opatření pro použití
Mirvaso se nemá aplikovat na podrážděnou kůži nebo otevřené rány. V případě závažného podráždění nebo kontaktní alergie je třeba léčbu léčivým přípravkem přerušit.
Erytém a zrudnutí
Účinek lokálního gelu Mirvaso začíná odeznívat hodiny po aplikaci. U některých pacientů byl hlášen návrat erytému a zrudnutí s vyšší závažností, než jaká byla přítomna na začátku. Většina těchto případů byla pozorována během prvních 2 týdnů od zahájení léčby (viz bod 4.8).
Nástup zrudnutí od podání lokálního gelu Mirvaso se lišil v rozmezí přibližně od 30 minut do několika hodin (viz bod 4.8).
U většiny těchto případů došlo k vymizení erytému a zrudnutí po přerušení podávání lokálního gelu Mirvaso.
V případě zhoršujícího se erytému musí být léčba lokálním gelem Mirvaso přerušena. Ke zmírnění příznaků lze použít symptomatickou léčbu, např. chlazení, NSAID a antihistaminika.
Po opakovaném podání lokálního gelu Mirvaso byla hlášena rekurence zhoršeného erytému a zrudnutí. Proto před opětovným zahájením léčby pozastavené kvůli zhoršenému erytému nebo zrudnutí naneste nejprve zkušební dávku gelu na malou část obličeje alespoň jeden den před aplikací na celý povrch obličeje.
Pacienta je nutné informovat, aby při podávání nepřekračoval předepsané dávkování a četnost: použití v tenké vrstvě jednou denně.
Mirvaso se nemá nanášet do blízkosti očí.
Přípravek Mirvaso nebyl studován u pacientů s poškozením funkce ledvin nebo jater.
Denní množství přípravku ani frekvence aplikace za den se nemají zvyšovat, protože bezpečnost vyšších nebo častějších dávek nebyla stanovena.
Souběžné užívání dalších systémových agonistů alfa adrenergních receptorů může potencovat nežádoucí účinky této třídy léčivých přípravků u pacientů:
- se závažným nebo nestabilním či léčbou neupraveným kardiovaskulárním onemocněním;
- s depresí, mozkovou nebo koronární insuficiencí, Raynaudovým fenoménem, ortostatickou hypotenzí, thromboangiitis obliterans, sklerodermií nebo Sjogrenovým syndromem.
Léčivý přípravek obsahuje methylparaben (E218), který může vyvolat alergické reakce (s možným opožděným nástupem), a propylenglykol, který může způsobit podráždění kůže.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
Přípravek Mirvaso je kontraindikován u pacientů léčených inhibitory monoaminooxidázy (MAO) a u pacientů užívajících tricyklická nebo tetracyklická antidepresiva, která ovlivňují noradrenergní přenos (viz bod 4.3).
Je třeba vzít v úvahu možnost aditivního nebo umocňujícího účinku při podávání s látkami tlumícími centrální nervovou soustavu (alkohol, barbituráty, opiáty, sedativa nebo anestetika).
Nejsou dostupné žádné údaje o hladině cirkulujících katecholaminů po podání přípravku Mirvaso.
U pacientů užívajících látky, které mohou ovlivňovat metabolismus a vychytávání cirkulujících aminů jako např. chlorpromazin, methylfenidát či reserpin, se však doporučuje postupovat s opatrností.
Postupovat s opatrností se doporučuje také při souběžném podávání (nebo změně dávkování) systémové látky (bez ohledu na lékovou formu), která by mohla interagovat s agonisty alfa adrenergních receptorů nebo ovlivňovat jejich působení, tj. agonistů nebo antagonistů adrenergních receptorů (např. isoprenalin, prazosin).
Brimonidin může u některých pacientů vyvolat klinicky nevýznamný pokles krevního tlaku. Doporučuje se proto postupovat s opatrností při současném používání brimonidinu s léčivými přípravky, jako jsou antihypertenziva nebo srdeční glykosidy.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání brimonidinu těhotným ženám jsou omezené nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3). Používání přípravku Mirvaso v těhotenství se z preventivních důvodů nedoporučuje.
Kojení
Není známo, zda se brimonidin/metabolity vylučují do lidského mateřského mléka. Riziko pro kojené novorozence/děti nelze vyloučit. Mirvaso se během kojení nemá používat.
Fertilita
U zvířecích druhů nevykazoval brimonidin žádné zvláštní reprodukční nebo vývojové riziko.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Mirvaso nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Nej častěji hlášenými nežádoucími účinky jsou erytém, pruritus, návaly zrudnutí a pocit pálení kůže, z nichž se každý vyskytoval u 1,2 až 3,3 % pacientů v klinických studiích. Jsou typicky mírně až středně závažné a obvykle nevyžadují přerušení léčby. Mezi populací starších nemocných a pacienty mezi 18 a 65 lety věku nebyly pozorovány žádné významnější rozdíly v bezpečnostním profilu. Po uvedení na trh byl hlášen zhoršující se erytém, zrudnutí a pocit pálení kůže (viz bod 4.4).
Seznam nežádoucích účinků v tabulce
Nežádoucí účinky jsou seřazeny podle třídy orgánových systémů a frekvence, za použití následující konvence: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000), není známo (z dostupných údajů nelze určit) a byly hlášeny u přípravku Mirvaso v klinických studiích (viz Tabulka 1).
Tabulka 1: Nežádoucí účinky
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy nervového systému |
Méně časté |
Bolest hlavy, parestezie |
|
Poruchy oka |
Méně časté |
Edém očního víčka |
|
Cévní poruchy |
Časté |
Návaly zrudnutí |
|
Vzácné |
Hypotenze* | |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté |
Ucpaný nos |
|
Gastrointestinální poruchy |
Méně časté |
Sucho v ústech |
|
Poruchy kůže a podkožní tkáně |
Časté |
Erytém, pruritus, pocit pálení kůže |
|
Méně časté |
Akné, alergická kontaktní dermatitida, bolest kůže, dermatitida, kontaktní dermatitida, kopřivka*, nepříjemný pocit na kůži, otékání obličeje*, papulózní vyrážka, podráždění kůže, rosacea, suchá kůže, teplá kůže | |
|
Vzácné |
Angioedém* | |
|
Celkové poruchy a reakce v místě aplikace |
Méně časté |
Pocit horka, chladná akra končetin |
* Nežádoucí účinky hlášeny po uvedení přípravku na trh.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V případech předávkování jinými alfa2 agonisty po perorálním užití byly hlášeny příznaky jako např. hypotenze, astenie, zvracení, letargie, sedace, bradykardie, arytmie, mióza, apnoe, hypotonie, hypotermie, respirační deprese a křeče.
Léčba perorálního předávkování zahrnuje podpůrnou a symptomatickou léčbu; je třeba udržovat průchodnost dýchacích cest.
Během programu klinického vývoje nebyly hlášeny žádné případy předávkování po perkutánním použití přípravku Mirvaso.
Pediatrická populace
Byly hlášeny závažné nežádoucí účinky po náhodném požití přípravku Mirvaso dvěma malými dětmi jednoho subjektu klinické studie. U těchto dětí se vyskytly příznaky shodné s dříve hlášenými případy perorálního předávkování alfa2 agonisty u malých dětí. U obou dětí bylo hlášeno úplné zotavení do 24 hodin.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiná dermatologika, Jiné dermatologické přípravky, ATC kód:
D11AX21
Mechanismus účinku
Brimonidin je vysoce selektivní agonista alfa2 adrenergních receptorů; je 1000krát selektivnější pro alfa2 adrenergní receptor než pro alfa1 adrenergní receptor.
Farmakodynamické účinky
Kožní aplikace vysoce selektivního agonisty alfa2 adrenergních receptorů na obličej snižuje erytém prostřednictvím přímé kožní vazokonstrikce.
Klinická účinnost a bezpečnost
Účinnost přípravku Mirvaso v léčbě středně závažného až závažného erytému v obličeji při rosacee byla prokázána ve dvou randomizovaných, vehikulem kontrolovaných zaslepených klinických hodnoceních, která měla stejné uspořádání. Středně závažný až závažný erytém byl definován stupněm 3 nebo vyšším na stupnici hodnocení erytému klinickým lékařem (CEA - Clinician Erythema Assessment) i na stupnici hodnocení samotným pacientem (PSA - Patient Self-Assessment). Studie byly provedeny u 553 randomizovaných subjektů starších 18 let, kterým byl podáván buď přípravek Mirvaso, nebo vehikulum jednou denně po dobu 4 týdnů. Do analýzy účinnosti v 29. den bylo zahrnuto 539 těchto subjektů, které dokončily 29 dnů léčby a byla u nich dostupná data pro zahrnutí do analýzy. Většina z nich byli běloši ve věku 18 až 65 let.
Primární cílový parametr účinnosti byl definován jako kombinovaná úspěšnost, tj. pacienti reagující dvoustupňovým snížením jak základního skóre CEA, tak základního skóre PSA v den 29. Výsledky z obou klinických studií prokázaly, že přípravek Mirvaso byl významně účinnější (p < 0,001) ohledně snížení erytému v obličeji při rosacee než gel obsahující pouze vehikulum při aplikaci jednou denně po dobu 29 dnů (primární cílový parametr účinnosti, viz Tabulka 2). V podskupině populace pacientů se závažným výchozím erytémem v 1. den (tj. subjektů s CEA nebo PSA 4. stupně), kteří představovali 26 % randomizovaných subjektů, byly výsledky primárního cílového parametru účinnosti 29. den podobné jako výsledky pozorované v celé populaci (viz tabulka 3) a byly u obou studií společně statisticky významné (p = 0,003). Dále byla pro celou populaci prokázána statistická superiorita (p < 0,001) přípravku Mirvaso oproti gelu obsahujícímu pouze vehikulum z hlediska rychlého úvodního nástupu klinicky významného účinku (zlepšení kombinovaného skóre úspěšnosti o 1 stupeň pro CEA a PSA) ve 30. minutě v 1. den po první aplikaci (sekundární cílový parametr účinnosti 27,9 % proti 6,9 % u studie 1, 28,4 % proti 4,8 % u studie 2) a z hlediska dosažení klinicky významného účinku (zlepšení kombinovaného skóre úspěšnosti o 1 stupeň pro CEA a PSA) ve 29. den (terciární cílový parametr, viz tabulka 4).
CEA a PSA byly definovány následovně:
CEA: Clinician Erythema Assessment, hodnocení lékařem: 0 = čistá kůže bez známek erytému, 1 = téměř čistá kůže, lehké zarudnutí, 2 = mírný erytém, zřetelné zarudnutí, 3 = střední erytém + výrazné zarudnutí a 4 = těžký erytém + ohnivé zarudnutí
PSA: Patient Self-Assessment, hodnocení samotným pacientem: 0 = bez zarudnutí, 1 = velmi mírné zarudnutí, 2 = mírné zarudnutí, 3 = střední zarudnutí a 4 = výrazné zarudnutí
Tabulka 2: Procento subjektů se zlepšením jak CEA, tak PSA o 2 stupně
|
Úspěšnost den 29 |
Studie 1 |
Studie 2 | ||
|
Mirvaso gel n = 127 |
Gel vehikula n = 128 |
Mirvaso gel n = 142 |
Gel vehikula n = 142 | |
|
3 hodiny po aplikaci |
31,5 % |
10,9 % |
25,4 % |
9,2 % |
|
6 hodin po aplikaci |
30,7 % |
9,4 % |
25,4 % |
9,2 % |
|
9 hodin po aplikaci |
26,0 % |
10,2 % |
17,6 % |
10,6 % |
|
12 hodin po aplikaci |
22,8 % |
8,6 % |
21,1 % |
9,9 % |
|
p-hodnota ve 29. den |
< 0,001 |
- |
< 0,001 |
- |
Tabulka 3: Procento subjektů se závažným výchozím erytémem v 1. den (CEA nebo PSA stupně 4) se zlepšením jak CEA, tak PSA o 2 stupně
|
Úspěšnost den 29 |
Studie 1 a 2 | |
|
Mirvaso gel n = 79 |
Gel vehikula n = 63 | |
|
3 hodiny po aplikaci |
22,8 % |
9,5 % |
|
6 hodin po aplikaci |
26,6 % |
7,9 % |
|
9 hodin po aplikaci |
20,3 % |
11,1 % |
|
12 hodin po aplikaci |
21,5 % |
4,8 % |
|
p-hodnota ve 29. den |
0,003 |
- |
Tabulka 4: Procento subjektů se zlepšením jak CEA, tak PSA o 1 stupeň
|
Úspěšnost den 29 |
Studie 1 |
Studie 2 | ||
|
Mirvaso gel n = 127 |
Gel vehikula n = 128 |
Mirvaso gel n = 142 |
Gel vehikula n = 142 | |
|
3 hodiny po aplikaci |
70,9 % |
32,8 % |
71,1 % |
40,1 % |
|
6 hodin po aplikaci |
69,3 % |
32,0 % |
64,8 % |
43,0 % |
|
9 hodin po aplikaci |
63,8 % |
29,7 % |
66,9 % |
39,4 % |
|
12 hodin po aplikaci |
56,7 % |
30,5 % |
53,5 % |
40,1 % |
|
p-hodnota ve 29. den |
< 0,001 |
- |
< 0,001 |
- |
Při používání přípravku Mirvaso po dobu 29 dnů nebyly pozorovány žádné klinicky významné tendence ohledně tachyfylaxe nebo tzv. rebound fenoménu (zhoršení výchozího erytému po přerušení léčby).
Výsledky z dlouhodobé otevřené studie u 449 pacientů s nepřetržitou léčbou trvající až jeden rok potvrdily, že dlouhodobé užívání přípravku Mirvaso je bezpečné a účinné. Každodenní zmenšování erytému v prvním měsíci užívání (měřeno stupnicemi CEA a PSA) bylo podobné zmenšování pozorovanému v kontrolovaných studiích a bylo dosažitelné až po dobu 12 měsíců bez patrné ztráty účinku v průběhu času. Celkové četnosti nežádoucích účinků v této studii jsou uvedeny výše v tabulce 1 s nejvyšší četností objevující se prvních 29 dnů používání. V průběhu času nedocházelo k nárůstu četnosti žádného z nich a nebyly zjištěny žádné důkazy toho, že by dlouhodobé užívání přípravku Mirvaso neslo zvýšené riziko výskytu určitého typu nežádoucího účinku.
Souběžné užívání přípravku Mirvaso s jinými léčivými přípravky na léčbu zánětlivých lézí rosacey nebylo systematicky zkoumáno. Nicméně v dlouhodobé otevřené studii nebyla u dané subpopulace (131/449 pacientů užívajících souběžně léčivé přípravky na rosaceu) účinnost ani bezpečnost přípravku Mirvaso (jak je popsáno výše) ovlivněna souběžným použitím kosmetiky ani dalších léčívých přípravků (např. lokálního metronidazolu, lokální kyseliny azelaové či perorálních tetracyklinů včetně malé dávky doxycyklinu) na léčbu zánětlivých projevů rosacey.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Mirvaso u všech podskupin pediatrické populace v léčbě rosacey (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Absorpce brimonidinu z přípravku Mirvaso byla hodnocena v klinické studii u 24 dospělých subjektů s erytémem v obličeji při rosacee. Všem zařazeným subjektům byl jeden den do oka aplikován 0,2% roztok očních kapek brimonidinu, po čemž následovala kožní aplikace přípravku Mirvaso jednou denně po dobu 29 dnů (intraindividuální srovnání systémové expozice). 1. den studie dostaly všechny subjekty každých 8 hodin po dobu 24 hodin do každého oka 1 kapku 0,2% roztoku očních kapek (celkem tedy 3 dávky).
Po opakované kožní aplikaci přípravku Mirvaso na kůži obličeje nebyla pozorována žádná kumulace léku v plazmě po celou dobu trvání léčby: nejvyšší průměrná (± směrodatná odchylka) plazmatická maximální koncentrace (Cmax) činila 46 ± 62 pg/ml a plocha pod křivkou koncentrace v závislosti na čase od 0 do 24 hodin (AUC0-24h) byla 417 ± 264 pg.h/ml. Tyto hladiny jsou významně nižší (dvojnásobně) než hladiny pozorované po očním podání 0,2% roztoku očních kapek brimonidinu jednou denně.
Distribuce
Vazba brimonidinu na proteiny nebyla studována.
Biotransformace
Brimonidin je ve velké míře metabolizován játry.
Eliminace
Hlavní cestou eliminace brimonidinu a jeho metabolitů je vylučování do moči.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Karbomer
Methylparaben (E218)
Fenoxyethanol Glycerol Oxid titaničitý Propylenglykol Hydroxid sodný Čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Chraňte před mrazem.
6.5 Druh obalu a obsah balení
[2 g]
Polyetylénové (PE)/hliníkové (Al)/polyetylénové (PE) laminované plastové tuby se špičkou z vysokohustotního polyetylénu (HDPE) a polypropylenovým (PP) uzávěrem.
[10 g; 30 g]
Polyetylénové (PE)/hliníkové (Al)/polyetylénové (PE) laminované plastové tuby se špičkou z vysokohustotního polyetylénu (HDPE) a polypropylenovým (PP) dětským bezpečnostním uzávěrem.
Nebo
[2 g]
Polyetylénové (PE)/kopolymerní/hliníkové (Al)/kopolymerní/polyetylénové (PE) vícefóliové plastové tuby (druh laminátu) se špičkou z vysokohustotního polyetylénu (HDPE) a polyetylénovým (PE) dětským bezpečnostním uzávěrem.
[10 g; 30 g]
Polyetylénové (PE)/kopolymerní/hliníkové (Al)/kopolymerní/polyetylénové (PE) vícefóliové plastové tuby (druh laminátu) se špičkou z vysokohustotního polyetylénu (HDPE) a polypropylenovým (PP) dětským bezpečnostním uzávěrem.
Velikost balení: 1 tuba s 2 g, 10 g nebo 30 g.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Galderma International
Tour Europlaza, 20 avenue André Prothin - La Défense 4
La Défense Cedex 92927
Francie
8. REGISTRAČNÍ ČÍSLO(A)
Polyetylénové (PE)/hliníkové (Al)/ polyetylénové (PE) laminované plastové tuby:
EU/1/13/904/001
EU/1/13/904/002
EU/1/13/904/003
Polyetylénové (PE)/kopolymemí/hliníkové (Al)/kopolymemí/polyetylénové (PE) vícefóliové plastové tuby:
EU/1/13/904/004
EU/1/13/904/005
EU/1/13/904/006
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. února 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Laboratoires Galderma Z.I. Montdésir 74540 Alby-sur-Chéran Francie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Opakovaný výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Mirvaso 3 mg/g gel brimonidinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden gram gelu obsahuje 3,3 mg brimonidinu.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: Karbomer, methylparaben (E218), fenoxyethanol, glycerol, oxid titaničitý, propylenglykol, hydroxid sodný, čištěná voda. Viz další údaje v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Gel
2 g 10 g
30 g
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Nepolykejte.
Před použitím si přečtěte příbalovou informaci. Pouze kožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před mrazem.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Galderma International
Tour Europlaza, 20 avenue André Prothin
La Défense 4
92927 La Défense Cedex
Francie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/904/001
EU/1/13/904/002
EU/1/13/904/003
EU/1/13/904/004
EU/1/13/904/005
EU/1/13/904/006
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Mirvaso
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Mirvaso 3 mg/g gel brimonidinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden gram gelu obsahuje 3,3 mg brimonidinu.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: Karbomer, methylparaben (E218), fenoxyethanol, glycerol, oxid titaničitý, propylenglykol, hydroxid sodný, čištěná voda. Viz další údaje v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Gel
30 g
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Nepolykejte.
Před použitím si přečtěte příbalovou informaci. Pouze kožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před mrazem.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/904/003
EU/1/13/904/006
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Mirvaso 3 mg/g gel brimonidinum Kožní podání.
2. ZPŮSOB PODÁNÍ
Nepolykejte.
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
č.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
10 g
6. JINÉ
Uchovávejte mimo dohled a dosah dětí.
Pomocné látky: karbomer, methylparaben (E218), fenoxyethanol, glycerol, oxid titaničitý, propylenglykol, hydroxid sodný, čistěná voda.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Mirvaso 3 mg/g gel brimonidinum Kožní podání.
2. ZPŮSOB PODÁNÍ
Nepolykejte.
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
č.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2 g
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Mirvaso 3 mg/g gel brimonidinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by
jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Mirvaso a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Mirvaso používat
3. Jak se přípravek Mirvaso používá
4. Možné nežádoucí účinky
5. Jak přípravek Mirvaso uchovávat
6. Obsah balení a další informace
1. Co je přípravek Mirvaso a k čemu se používá
Přípravek Mirvaso obsahuje léčivou látku brimonidinum, která patří do skupiny léků známých jako agonisté alfa receptorů.
Nanáší se na obličej a slouží k léčbě zarudnutí tváře při růžovce u dospělých pacientů.
Zarudnutí tváří při růžovce je způsobeno zvýšeným průtokem krve při rozšíření malých krevních cév v kůži na tváři.
Přípravek Mirvaso po nanesení způsobuje zúžení těchto malých krevních cév, čímž dojde ke snížení zvýšeného průtoku krve a redukci zarudnutí.
2. Čemu musíte věnovat pozornost, než začnete přípravek Mirvaso používat
Nepoužívejte přípravek Mirvaso:
- jestliže jste alergický(á) na brimonidinum nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- u dětí mladších 2 let, neboť tyto mohou být vystaveny vyššímu riziku nežádoucích účinků způsobených léčivem absorbovaným přes kůži.
- pokud užíváte určité léky používané na léčbu deprese nebo Parkinsonovy choroby, včetně tzv. inhibitorů monoaminooxidázy (MAO) (např. selegilin nebo moklobemid) nebo tricyklických antidepresiv (např. imipramin) nebo tetracyklických antidepresiv (např. maprotilin, mianserin nebo mirtazapin). Použití těchto přípravků současně s přípravkem
- Mirvaso může mít za následek pokles krevního tlaku.
Upozornění a opatření
Před použitím přípravku Mirvaso se poraďte se svým lékařem, jestliže:
- máte podrážděnou kůži nebo otevřené rány;
- máte potíže se srdcem nebo krevním oběhem;
- máte depresi, snížený průtok krve do mozku nebo srdce, klesá vám krevní tlak, když si stoupnete, máte snížený průtok krve do rukou, chodidel či kůže nebo Sjogrenův syndrom (chronické onemocnění, při kterém přirozený obranný systém těla - imunitní systém - napadá žlázy produkující slzy a sliny);
- máte potíže s ledvinami nebo játry nebo jste těmito obtížemi trpěli v minulosti.
Zhoršení erytému, zrudnutí nebo pocitu pálení kůže:
U některých pacientů dojde ke zhoršení původního stavu erytému. K tomuto zhoršení dochází obvykle během 2 týdnů léčby přípravkem Mirvaso. Po ukončení léčby tento stav spontánně odezní. Ve většině případů zarudnutí postupně vymizí do několika dní. Před opětovným zahájením léčby přípravkem Mirvaso jej otestujte na malé části obličeje, a to v den, kdy můžete zůstat doma. Pokud nedojde ke zhoršení erytému nebo pocitu pálení, můžete zahájit běžnou léčbu (viz bod 3).
V případě zhoršení příznaků nebo neočekávaného zarudnutí léčbu přerušte a obraťte se na svého lékaře.
Pokud se vás cokoliv z výše uvedeného týká, promluvte si se svým lékařem, protože toto léčivo pro vás nemusí být vhodné.
Děti a dospívající
Nedávejte tento léčivý přípravek dětem ani dospívajícím mladším 18 let, protože bezpečnost a účinnost nebyla pro tuto věkovou skupinu stanovena. Pravděpodobnost, že bude jeho použití bezpečné, je ještě nižší u dětí mladších 2 let (viz odstavec „NEPOUŽÍVEJTE přípravek Mirvaso“).
Další léčivé přípravky a přípravek Mirvaso
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, neboť by tyto léky mohly ovlivnit léčbu přípravkem Mirvaso nebo by přípravek Mirvaso mohl ovlivnit léčbu těmito léky.
Neužívejte přípravek Mirvaso se selegilinem, moklobemidem, imipraminem, mianserinem ani maprotilinem (léčiva používaná na depresi a Parkinsonovu chorobu), neboť by mohlo dojít ke snížení účinnosti přípravku Mirvaso nebo ke zvýšení rizika výskytu nežádoucích účinků, jako je snížení krevního tlaku (viz část „Nepoužívejte přípravek Mirvaso“).
Svého lékaře také informujte, pokud užíváte některé z následujících léků:
- léky používané k léčbě bolestí, poruch spánku nebo úzkostných poruch;
- léky používané k léčbě psychiatrických poruch (chlorpromazin), hyperaktivity (methylfenidát) nebo vysokého krevního tlaku (reserpin);
- léky, které působí stejným způsobem jako Mirvaso (další alfa-agonisty, např. klonidin; tzv. alfablokátory nebo alfa-antagonisty, např. prazosin, isoprenalin, které jsou nej častěji podávány k léčbě vysokého krevního tlaku, pomalého srdečního rytmu nebo astmatu);
- srdeční glykosidy (např. digoxin) k léčbě problémů se srdcem;
- léky na snížení krevního tlaku, jako jsou betablokátory nebo blokátory kalciového kanálu (např. propranolol, amlodipin).
Pokud se Vás něco z výše uvedených možností týká nebo si nejste jistý(á), poraďte se se svým lékařem.
Přípravek Mirvaso s alkoholem
Informujte svého lékaře, pokud pravidelně požíváte alkohol; mohlo by to ovlivnit léčbu tímto lékem.
Těhotenství a kojení
Užívání přípravku Mirvaso v těhotenství se nedoporučuje. Důvodem je skutečnost, že účinky přípravku na nenarozené dítě nejsou známé. Nepoužívejte přípravek Mirvaso během kojení.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat.
Řízení dopravních prostředků a obsluha strojů
Mirvaso nemá výrazný vliv na schopnost řídit nebo obsluhovat stroje.
Přípravek Mirvaso obsahuje
- methylparaben, který může vyvolat alergické reakce (s možným opožděným nástupem).
- propylenglykol, který může způsobit podráždění kůže.
3. Jak se přípravek Mirvaso používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Důležité: Přípravek Mirvaso je určen pro dospělé a pouze k ošetření tváře. Neaplikujte tento přípravek na jiné části těla, především ne na vlhké tělní povrchy, např. do očí, úst, nosu nebo pochvy. Nepolykejte.
Uchovávejte Mirvaso gel mimo dohled a dosah dětí.
Přípravek Mirvaso se doporučuje nanášet na kůži obličeje pouze jednou denně. Aplikujte malé množství přípravku o velikosti hrášku na čelo, bradu, nos a obě tváře a poté v tenké vrstvě hladce a rovnoměrně rozetřete. Nepřekračujte doporučenou denní dávku (5 kapek o velikosti hrášku). Při aplikaci se vyhněte očím, očním víčkům, rtům, ústům a vnitřku nosu. Pokud dojde ke kontaktu přípravku s těmito oblastmi, opláchněte je ihned větším množstvím vody. Pokud dojde ke zhoršení erytému nebo pálení, přestaňte přípravek Mirvaso používat a promluvte si v případě potřeby se svým lékařem.
Jiné kožní léky nebo kosmetické přípravky neaplikujte bezprostředně před denní aplikací přípravku Mirvaso. Tyto přípravky použijte teprve až poté, kdy dojde k zaschnutí přípravku Mirvaso.
Po aplikaci přípravku si ihned omyjte ruce.
[EU/1/13/904/001-003]
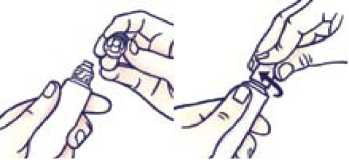
Jak otevřít tubu s dětským bezpečnostním uzávěrem
Aby nedošlo k úniku gelu, nestlačujte tubu během otevírání či zavírání.
Stlačte uzávěr a otočte jím proti směru hodinových ručiček (o čtvrtinu otáčky doleva). Poté uzávěr sejměte.

Jak zavřít tubu s dětským bezpečnostním uzávěrem
Nastavte drážky na uzávěru a tubě proti sobě. Stlačte uzávěr a otočte jím ve směru hodinových ručiček (o čtvrtinu otáčky doprava).
[EU/1/13/904/004-006]
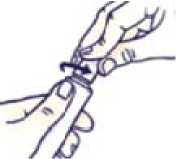
Jak otevřít tubu s dětským bezpečnostním uzávěrem
Aby nedošlo k úniku gelu, nestlačujte tubu během otevírání či zavírání.
Stlačte uzávěr a otočte jím proti směru hodinových ručiček (doleva). Poté uzávěr sejměte.

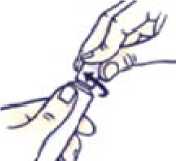
Jak zavřít tubu s dětským bezpečnostním uzávěrem
Stlačte uzávěr a otočte jím ve směru hodinových ručiček (doprava).
Jestliže jste použil(a) více přípravku Mirvaso, než jste měl(a)
Pokud použijete během 24hodinového období větší množství, než je denní doporučená dávka, mohlo by to vést k podráždění kůže nebo jiným nežádoucím účinkům v místě aplikace. Opakované dávky podané během jednoho 24hodinového období by mohly vyvolat nežádoucí účinky jako např. nízký krevní tlak, netečnost nebo ospalost.
Obraťte se prosím na svého lékaře, který Vám doporučí, jak postupovat.
Pokud někdo, zvláště dítě, náhodně požije přípravek Mirvaso, může dojít ke vzniku závažných nežádoucích účinků vyžadujících léčbu za hospitalizace.
Okamžitě vyhledejte svého lékaře nebo pohotovost, pokud Vy, dítě nebo kdokoliv jiný požije tento přípravek a objeví se kterýkoliv z následujících příznaků: pocit závratě z nízkého krevního tlaku, zvracení, únava, ospalost, zpomalený nebo nepravidelný tep, malé zornice (stažení zornic), potíže s dýcháním nebo nízká dechová frekvence, svalová ochablost, nízká tělesná teplota a křeče. Vezměte si s sebou balení léku, aby lékař věděl, co jste užil(a).
Jestliže jste zapomněl(a) použít přípravek Mirvaso
Mirvaso působí každý den, počínaje prvním dnem léčby. Pokud vynecháte denní dávku, zarudnutí se v tento den nesníží. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek Mirvaso
Než s léčbou přestanete, poraďte se se svým lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto léku, zeptejte se svého lékaře nebo lékárníka.
Možné nežádoucí účinky
4.
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u Vás objeví závažné podráždění, kontaktní alergie (např. alergická reakce, vyrážka) nebo méně časté nežádoucí účinky, přestaňte přípravek Mirvaso používat a obraťte se na svého lékaře.
V některých případech mohou příznaky sahat i mimo léčenou oblast.
Mirvaso může také vyvolat následující další nežádoucí účinky:
Časté nežádoucí účinky (mohou postihnout až 1 osobu z 10):
- zarudnutí kůže, pocit pálení nebo svědění kůže
- zrudnutí
Méně časté nežádoucí účinky (mohou postihnout až 1 osobu ze 100):
- akné
- bolest hlavy
- kopřivka
- kožní vyrážka, bolesti nebo nepříjemný pocit na kůži, podráždění nebo zánět kůže, suchá kůže, pocit tepla na kůži, mravenčení nebo pocit píchání v místě aplikace
- otékání obličeje
- otok očního víčka
- pocit chladu v rukou a nohou
- pocit horka
- sucho v ústech
- ucpaný nos
- zhoršení rosacey
Vzácné nežádoucí účinky (mohou postihnout až 1 osobu z 1000):
- angioedém (závažná alergická reakce obvykle doprovázená otokem obličeje, úst nebo jazyka). Pokud se objeví tyto příznaky, přestaňte s léčbou.
- hypotenze (snížení krevního tlaku), závrať
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Mirvaso uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a tubě za slovy „Použitelné do:“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento lék nevyžaduje žádné zvláštní podmínky uchovávání.
Chraňte před mrazem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Obsah balení a další informace
6.
Co přípravek Mirvaso obsahuje
- Léčivou látkou je brimonidinum. Jedem gram gelu obsahuje 3,3 mg brimonidinu, což odpovídá 5 mg brimonidini tartras.
- Dalšími složkami jsou karbomer, methylparaben (E218), fenoxyethanol, glycerol, oxid titaničitý, propylenglykol, hydroxid sodný, čištěná voda. Informace týkající se methylparabenu a propylenglykolu viz konec bodu 2.
Jak přípravek Mirvaso vypadá a co obsahuje toto balení
Mirvaso je bílý až světle žlutý matný gel. Dodává se v tubách obsahujících 2, 10 nebo 30 gramů gelu. Velikost balení 1 tuba.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci Galderma International
Tour Europlaza, 20 avenue André Prothin - La Défense 4
La Défense Cedex 92927
Francie
Výrobce
Laboratoires Galderma Z.I. Montdésir 74540 Alby-sur-Chéran Francie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Osterreich
Galderma Austria GmbH Tel: 0043 732 715 993 e-mail: austria@galderma.com
Belgie/Belgique/Belgien
Luxembourg/Luxemburg
Galderma Benelux BV Tél/Tel: +31 183691919 e-mail: info.be@galderma.com
Bt^rapnn
EnaHa OapM OOfl Co^ua, yn.“nnaHKOBH^“9, eT.3 Ten.: + 359 2 962 15 26 e-mail: office@elanapharm.com
Česká republika Slovenská republika
Galderma-Spirig Česká a Slovenská republika a.s.
Tel: +421 2 49 10 90 10 e-mail: czsk@galderma.com
Latvija
H. Abbe Pharma GmbH Tel: +371/67/103205 e-mail: birojs.habbe@apollo.lv
Lietuva
H. Abbe Pharma GmbH atstovybé Tel: +370/52/711710 e-mail: info@abbepharma.lt
Magyarország
Ewopharma Hungary Kft.
Tel.: +36 1 200 4650 e-mail: info@ewopharma.hu
France
Galderma International Tél: +33 (0)8 20 20 45 46
Danmark
Norge
Island
Suomi/Finland
Sverige
Galderma Nordic AB Tlf/Sími/Puh/Tel: + 46 18 444 0330 e-mail: nordic@galderma.com
Deutschland
Galderma Laboratorium GmbH
Tel: + 49 (0) 800 - 5888850
e-mail: patientenservice@galderma.com
Eesti
H. Abbe Pharma GmbH Tel: + 372/6/460980 e-mail: info@habbepharma.ee
EXlába
Kúnpoq
Galderma ETAág A.E.
Tr(k: + 30 210 8104190
e-mail: galderma.hellas@galderma.com
Espaňa
Laboratorios Galderma SA
Tel: + 34 902 02 75 95
e-mail: Regulatory Spain@galderma.com
Malta
Collis Williams Limited Tel: + 356 21244847, 21224104 e-mail: info@colliswilliams.com
Nederland
Galderma Benelux BV Tel: + 31 183691919 e-mail: info.nl@galderma.com
Polska
Galderma Polska Sp. z o.o.
Tel.: + 48 22 331 21 80
e-mail: info.poland@galderma.com
Portugal
Laboratorios Galderma, SA - Sucursal em Portugal
Tel: + 351 21 315 19 40
e-mail: galderma.portugal@galderma.com
Románia
NEOLA PHARMA
Tel: + 40 21 233 17 81
e-mail: e-mail: office@neolapharma.ro
Slovenija
Medical Intertrade d.o.o.
T: +386 1 2529 113 F: +386 1 2529 114 e-mail: info@medical-intertrade.si
United Kingdom Ireland
Galderma (UK) Ltd.
Tel: + 44 (0) 1923 208950
Tato příbalová informace byla naposledy revidována XX/XXXX.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/
PŘÍLOHA IV
VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O
REGISTRACI
Vědecké závěry
S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) brimonidinu (pouze centralizovaně registrovaného přípravku) dospěl výbor CHMP k těmto vědeckým závěrům:
Hemodynamické účinky
Přestože v průběhu vykazovaného období nebyly zaznamenány žádné nové případy, byly poskytnuty bližší informace o některých dříve zaznamenaných případech. Pokud by se objevily přinejmenším tři případy s implikovaným postižením, které silně připomíná hemodynamický účinek (zejména hypotenze a související příznaky) spojený s aplikací přípravku Mirvaso, stejně jako jiné připomínající případy, bude to považováno za dostatečný důkaz k oprávnění aktualizovat údaje o přípravku tak, aby předepisující osoby a pacienti byli informováni o nebezpečí hemodynamických účinků přípravku Mirvaso.
Angioedém
V průběhu vykazovaného období byly zaznamenány dva případy otoku obličeje nebo jazyka ve spojení s dalšími příznaky připomínajícími systémovou alergickou reakci. V předchozím vykazovaném období byly zaznamenány 4 případy otoku rtu anebo jazyka, těsnosti v hrdle nebo hrudníku nebo ztíženého dýchání, které připomínaly angioedém. Přestože termín angioedém nebyl výslovně hlášen v žádném z případů, zastává výbor PRAC stanovisko, že příčinný vztah mezi přípravkem Mirvaso a nežádoucí příhodou je přinejmenším důvodně možný. Dodnes bylo zaznamenáno celkem 6 případů, kdy vykazované vlastnosti silně připomínaly angioedém.
S ohledem na dostupné údaje o hemodynamických účincích a angioedému zastává výbor PRAC stanovisko, že změny údajů o přípravku byly oprávněné.
Výbor CHMP souhlasí s vědeckými závěry, k jakým dospěl výbor PRAC.
Zdůvodnění doporučující změnu podmínek rozhodnutí o registraci
Na základě vědeckých závěrů týkajících se brimonidinu (pouze centralizovaně registrovaného přípravku) zastává výbor CHMP stanovisko, že poměr přínosů a rizik léčivého přípravku obsahujícího brimonidin (pouze centralizovaně registrovaného přípravku) je příznivý pod podmínkou, že v údajích o přípravku budou provedeny navržené změny Výbor CHMP doporučuje změnit podmínky rozhodnutí o registraci.
30