Luveris 75 Iu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Luveris 75 IU prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje 75 IU lutropinum alfa (rekombinantní lidský luteinizační hormon (r-hLH). Lutropinum alfa se vyrábí z buněk vaječníků čínského křečka modifikovaných genetickým inženýrstvím.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Vzhled prášku: bílé lyofilizované pelety Vzhled rozpouštědla: čirý bezbarvý roztok
pH rozpuštěného roztoku je 7,5-8,5.
Pro aplikaci přípravku pacienty je třeba zvážit jiné formy než jsou ampule.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Luveris spolu s přípravkem obsahujícím folikuly stimulující hormon (FSH) se doporučuje ke stimulaci vývoje folikulů u dospělých žen s vážnou nedostatečností luteinizačního hormonu (LH) a FSH.
V klinických studiích byly tyto pacientky definovány endogenní hladinou LH v séru <1,2 IU/l.
4.2 Dávkování a způsob podání
Léčba přípravkem Luveris by měla být zahájena pod dohledem lékaře se zkušenostmi s léčbou problémů fertility.
Dávkování
U žen s nedostatečností LH a FSH je cílem léčby přípravkem Luveris spolu s FSH vznik jednoho zralého Graafova folikulu, ze kterého se po podání lidského choriového gonadotropinu (hCG) uvolní oocyt. Luveris by se měl podávát každý den v injekci společně s FSH. Jelikož tyto pacientky trpí amenoreou a mají nízkou sekreci endogenního estrogenu, může být léčba zahájena kdykoli.
Luveris by měl být podáván současně s follitropinem alfa.
Léčba by se měla upravit dle individuální odpovědi pacientky na základě měření velikosti folikulu ultrazvukem a estrogenní odpovědi. Doporučená léčba se zahajuje podáním 75 IU lutropinu alfa (tj. jedna injekční lahvička přípravku Luveris) denně spolu se 75-150 IU FSH.
V klinických studiích zvyšoval Luveris citlivost vaječníků na follitropin alfa. Pokud se zdá, že by bylo třeba zvýšit dávku FSH, měla by se úprava provádět v intervalu 7-14 dní po dávkách 37,5 IU-75 IU.
Je možno prodloužit délku stimulace v jednom cyklu až na 5 týdnů.
Po dosažení optimální odpovědi by měla být podána jednorázová injekce 250 mikrogramů r-hCH nebo 5 000 až 10 000 IU hCG 24-48 hodin po poslední injekci přípravku Luveris a FSH. Pacientka by pak
měla mít pohlavní styk v den podání hCG a následující den.
Případně může být provedeno nitroděložní oplodnění.
Lze uvažovat i o podpoře luteální fáze, jelikož nedostatek látek s luteotropní aktivitou (LH/hCG) po ovulaci může vést k předčasnému zániku žlutého tělíska.
V případě nadměrné odpovědi by se měla léčba přerušit a hCG nepodávat. Léčba by měla být znovu zahájena v následujícím cyklu s nižšími dávkami FSH než v cyklu předchozím.
Zvláštní populace
Starší lidé
Neexistuje žádné relevantní použití přípravku Luveris u starší populace. Bezpečnost a účinnost přípravku Luveris u starších pacientek nebyla stanovena.
Porucha funkce ledvin a jater
Bezpečnost, účinnost a farmakokinetika přípravku Luveris u pacientek s nedostatečnou funkcí ledvin nebo jater nebyla stanovena.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Luveris u pediatrické populace.
Způsob podání
Luveris je určen k subkutánnímu podání. První injekce přípravku Luveris by měla být podána pod přímým dohledem lékaře. Prášek rozpusťte bezprostředně před použitím pomocí přiloženého rozpouštědla. Samostatné podávání tohoto léčivého přípravku mohou provádět pouze pacientky, které jsou správně motivované, dostatečně proškolené a v případě potřeby mají přístup k odborné pomoci.
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Luveris je kontraindikován u pacientek s:
• hypersensitivitou na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• nádorem hypotalamu a hypofýzy,
• zvětšením vaječníků nebo ovariálními cystami neznámého původu, nesouvisejícími s polycystickým ovariálním onemocněním,
• gynekologickým krvácením neznámého původu,
• rakovinou vaječníků, dělohy nebo prsu
Luveris se nesmí používat v případě, že se u pacientky vyskytují stavy znemožňující normální těhotenství, jako je například:
• primární selhání vaječníků,
• novotvary pohlavních orgánů neslučitelné s těhotenstvím,
• fibroidní nádory dělohy neslučitelné s těhotenstvím.
4.4 Zvláštní upozornění a opatření pro použití
Před zahájením léčby by měla být neplodnost páru zhodnocena jako vhodná pro tento typ léčby a měly by být zváženy možné kontraindikace otěhotnění. Před zahájením léčby by pacientky měly být navíc vyšetřeny na hypotyreózu, nedostatečnost kůry nadledvin a hyperprolaktinemii a měly by absolvovat jejich vhodnou léčbu.
Porfyrie
U pacientek s porfyrií nebo s rodinnou anamnézou porfyrie může přípravek Luveris zvyšovat riziko akutní ataky. Poruchy nebo prvotní příznaky tohoto stavu mohou vyžadovat přerušení léčby.
Ovariální hvperstimulační syndrom (OHSS)
Očekávaným účinkem řízení ovariální stimulace je určité zvětšení vaječníků. Častěji bývá pozorován u žen trpících polycystickým ovariálním syndromem a obvykle vymizí bez nutnosti léčby.
Na rozdíl od nekomplikovaného zvětšení vaječníků je OHSS stav, který se může projevovat sám o sobě a to v různém stupni závažnosti. Sestává ze zjevného zvětšení vaječníků, vysoké hladiny pohlavních steroidů v séru a zvýšené vaskulární permeability, která může mít za následek hromadění tekutin v peritoneální a pleurální dutině a zřídka i v dutině perikardiální.
Mírné projevy OHSS mohou zahrnovat bolest břicha, břišní nevolnost či distenzi nebo zvětšení vaječníků. Středně závažný OHSS se může projevovat ještě nevolností, zvracením nebo přítomností volné tekutiny v dutině břišní (ascitem) či zjevným zvětšením vaječníků prokazatelným při vyšetření ultrazvukem.
Závažný OHSS dále zahrnuje například výrazné zvětšení vaječníků, nárůst hmotnosti, dyspnoe nebo oligurii. Klinickým vyšetřením lze odhalit například hypovolemii, hemokoncentraci, nerovnováhu elektrolytů, přítomnost ascitu, pleurální výpotek nebo akutní dechovou tíseň. Velmi vzácně může být OHSS komplikován přetočením vaječníku nebo tromboembolickými příhodami, například plicní embolií, ischemickou příhodou nebo infarktem myokardu.
Mezi nezávislé rizikové faktory pro vznik OHSS patří mladý věk, malá tělesná hmotnost, polycystický ovariální syndrom, vyšší dávky exogenních gonadotropinů, vysoká nebo rychle vzrůstající absolutní hladina sérového estradiolu a dřívější výskyty OHSS, vysoký počet vznikajících ovariálních folikulů a vysoký počet oocytů odebraných během cyklů metody asistované reprodukce.
Přesným dodržováním doporučeného dávkování přípravku Luveris a FSH a způsobu podání lze minimalizovat riziko ovariální hyperstimulace. Z důvodu časné identifikace rizikových faktorů se doporučuje sledovat cykly stimulace pomocí ultrazvuku a provádět měření hladiny estradiolu.
Na základě ověřených důkazů lze předpokládat, že hCG hraje klíčovou roli pro spouštění OHSS a dojde-li k otěhotnění, může být tento syndrom závažnější a může mít delší trvání. Z toho důvodu se doporučuje, aby v případě, že jsou zjištěny známky ovariální hyperstimulace, nebyl podán hCG. Zároveň by se mělo pacientce doporučit, aby se zdržela pohlavního styku nebo používala bariérové metody antikoncepce po dobu nejméně 4 dní. Protože OHSS se může rozvinout velmi rychle (během 24 hodin) nebo v průběhu několika dní až na velmi vážný zdravotní stav, je třeba pacientky sledovat nejméně dva týdny po podání hCG.
Mírný nebo středně závažný OHSS obvykle vymizí samovolně. Dojde-li k výskytu vážného OHSS, doporučuje se v případě probíhající léčby gonadotropiny podávání gonadotropinů zastavit, pacientku hospitalizovat a zahájit vhodnou léčbu.
Přetočení vaječníků
Přetočení vaječníků bylo zaznamenáno po léčbě jinými gonadotropiny. Může souviset s jinými rizikovými faktory, jako je OHSS, těhotenství, předchozí chirurgický zákrok v oblasti břišní, předchozí případ přetočení vaječníků, předchozí nebo aktuální ovariální cysty a polycystický ovariální syndrom. Poškození vaječníků v důsledku sníženého přísunu krve lze omezit včasnou diagnózou a okamžitým přetočením do správné polohy.
Vícečetné těhotenství
U pacientek podstupujících indukci ovulace se výskyt vícečetných těhotenství ve srovnání s přirozeným početím zvyšuje. Většinu vícečetných těhotenství tvoří dvojčetná těhotenství. Vícečetná těhotenství, zejména s větším počtem plodů, nesou vyšší riziko pro matku i riziko ukončení těhotenství v perinatálním období.
K minimalizaci rizika vícečetného těhotenství s vyšším počtem plodů se doporučuje pečlivé sledování ovariální odpovědi.
U pacientek, které podstupují proces asistované reprodukce, souvisí riziko vzniku vícečetného těhotenství zejména s počtem zavedených embryí, jejich kvalitou a věkem pacientky.
Samovolný potrat
U pacientek, které podstupují stimulaci tvorby folikulů pro navození ovulace, je výskyt samovolných potratů a předčasných ukončení těhotenství vyšší než v případě početí přirozenou cestou.
Mimoděložní těhotenství
U žen s onemocněním vejcovodů v anamnéze existuje riziko mimoděložního těhotenství, ať už k otěhotnění došlo přirozeným početím nebo metodou asistované reprodukce. Výskyt mimoděložního těhotenství po asistované reprodukci je dle ověřených údajů vyšší než u běžné populace.
Vrozené malformace
Po použití metod asistované reprodukce může být oproti přirozenému početí mírně zvýšený výskyt vrozených malformací. To může být důsledkem rodičovských faktorů (například věk rodičky, genetické faktory), s metodami asistované reprodukce nebo vícečetnými těhotenstvími.
Tromboembolické příhody
U žen, které nedávno prodělaly nebo aktuálně prodělávají tromboembolické onemocnění nebo vykazují obecně známé rizikové faktory vzniku tromboembolických příhod, například individuální nebo rodinnou anamnézu, trombofilie nebo těžká obezita (body mass index > 30 kg/m2), může léčba gonadotropiny ještě zvyšovat riziko zhoršení stavu nebo výskytu těchto příhod. V těchto případech je zapotřebí zvážit přínos podávání gonadotropinů v porovnání s možnými riziky. Je však nutné poznamenat, že samotné těhotenství, stejně jako OHSS, také přináší zvýšené riziko tromboembolických příhod.
Novotvary reprodukčního systému
U žen, které podstoupily různé režimy léčby neplodnosti, byly hlášeny benigní i maligní novotvary vaječníků a dalších reprodukčních orgánů. Dosud nebylo zjištěno, jestli léčba gonadotropiny zvyšuje riziko vzniku těchto nádorů u neplodných žen.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
Luveris by se neměl podávat ve směsi s jinými léčivými přípravky, ve stejné injekci, s výjimkou follitropinu alfa, u kterého studie ukázaly, že současné podání nemění významně účinnost, stabilitu, farmakokinetické ani farmakodynamické vlastnosti účinných látek.
4.6 Fertilita, těhotenství a kojení
K podávání přípravku Luveris během těhotenství není důvod.
Údaje u omezeného počtu těhotenství, během kterých byl lék užíván, po řízené ovariální stimulaci ukazují, že gonadotropiny nemají nežádoucí účinky na těhotenství, vývoj embryí nebo plodů, porod nebo postnatální vývoj. Ve studiích na zvířatech nebyly zjištěny teratogenní účinky přípravku Luveris. Nejsou k dispozici dostatečná klinická data, která by vylučovala teratogenní účinky přípravku Luveris v případě jeho užívání během těhotenství.
Kojení
V době kojení není přípravek Luveris indikován.
Fertilita
Přípravek Luveris je indikován společně s FSH na stimulaci vývoje folikulů (viz bod 4.1).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Luveris nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Přípravek Luveris se používá ke stimulaci tvorby folikulů spolu s follitropinem alfa. Proto je obtížné přiřadit nežádoucí účinky jedné z používaných látek.
V klinických studiích byly zaznamenány mírné a středně vážné reakce v místě vpichu injekce (podlitiny, bolest, zarudnutí, svědění či otok) u 7,4 % a 0,9 % injekcí. Žádné závažné reakce v místě vpichu injekce nebyly zaznamenány.
U méně než 6 % pacientek léčených přípravkem Luveris byl pozorován syndrom OHSS. Žádný závažný případ syndromu ovariální hyperstimulace nebyl zaznamenán (bod 4.4).
Vzácně vedla léčba lidským menopauzálním gonadotropinem k adnexální torzi (komplikace při zvětšení vaječníků) a hemoperitoneu. Ačkoli nebyly tyto nežádoucí účinky pozorovány, je možné, že by se mohly vyskytnout i při léčbě přípravkem Luveris.
Může se vyskytnout i mimoděložní těhotenství, zvláště u žen s anamnézou onemocnění vejcovodů. Seznam nežádoucích účinků
Terminologie pro určení četnosti výskytu se držela následující definované konvence: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
Po podání přípravku Luveris se mohou vyskytnout následující nežádoucí účinky.
Poruchy imunitního systému
Velmi vzácné: mírné až vážné hypersenzitivní reakce včetně anafylaktických reakcí a šoku.
Poruchy nervového systému Časté: bolest hlavy.
Cévní poruchy
Velmi vzácné: tromboembolismus, obvykle ve spojení se závažným ovariálním hyperstimulačním syndromem (OHSS).
Gastrointestinální poruchy
Časté: bolesti břicha, nevolnost, nauzea, zvracení, průjem.
Poruchy reprodukčního systému a prsu
Časté: mírný nebo středně závažný syndrom ovariální hyperstimulace (včetně souvisejících symptomů), ovariální cysta, bolesti prsou, bolest v podbřišku.
Celkové poruchy a reakce v místě aplikace
Časté: reakce v místě vpichu (například bolest, erytém, hematom, otok anebo podráždění v místě vpichu).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Účinky předávkování přípravkem Luveris nejsou známy. Existuje nicméně možnost, že by mohlo dojít ke vzniku OHSS, který je detailněji popsán v bodě 4.4.
Jednotlivé dávky do 40 000 IU lutropinu alfa byly podávány zdravým dobrovolnicím bez vážných nežádoucích účinků a byly dobře snášeny.
Léčba
Léčba je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pohlavní hormony a modulátory pohlavního systému, gonadotropiny. ATC kód: G03GA07.
Lutropinum alfa je rekombinantní lidský luteinizační hormon (r-hLH), glykoprotein tvořený nekovalentně vázanými podjednotkami a a p. Luteinizační hormon (LH) se váže na buňky pouzdra vaječníkového folikulu a na vnitřní buněčnou vrstvu folikulu a testikulární Leydigovy buňky přes receptor společný s lidským choriovým gonadotropinem (hCG). Tento transmembránový receptor LH/CG patří do velké skupiny receptorů spojených s G proteinem; má rozsáhlou mimobuněčnou doménu. In vitro se afinita vazby rekombinantního hLH na LH/CG receptor na Leydigových nádorových buňkách (MA-10) nachází mezi afinitou hCG a hypofyzárního hLH, ale při stejném pořadí důležitosti.
V ovariích stimuluje LH během folikulární fáze buňky theca folliculi k produkci androgenů, které jsou substrátem pro enzym aromatázu v buňkách granulózy. Výsledkem je produkce estradiolu, který podporuje vývoj folikulů vyvolaný FSH. Uprostřed cyklu spouští vysoké hladiny LH ovulaci a vznik corpus luteum. Po ovulaci LH stimuluje tvorbu progesteronu v corpus luteum zvýšením přeměny cholesterolu na pregnenolon.
Při stimulaci vývoje folikulu u žen s anovulací s nedostatečností LH a FSH je primárním účinkem po podání lutropinu alfa zvýšení sekrece estradiolu folikuly, jejichž růst je stimulován FSH.
V klinických studiích byly pacientky definovány hladinami endogenního LH v séru <1,2 IU/l po změření v centrální laboratoři. Je však třeba počítat s rozdíly mezi měřením LH v různých laboratořích.
V těchto studiích bylo procento ovulací v jednom cyklu 70-75 %.
5.2 Farmakokinetické vlastnosti
Farmakokinetika lutropinu alfa byla sledována na dobrovolnicích po znecitlivění hypofýzy při dávkách 75 IU až 40 000 IU. Farmakokinetický profil lutropinu alfa je podobný hLH získanému z moči.
Absorpce
Po subkutánním podání je absolutní biologická dostupnost přibližně 60 %.
Distribuce
Po intravenózním podání se lutropin alfa rychle distribuuje s úvodním poločasem přibližně jedna hodina. Distribuční objem v rovnovážném stavu je asi 10-14 litrů. Průměrná doba, po kterou přípravek zůstává v organismu, je přibližně 5 hodin.
Lutropin alfa má lineární farmakokinetiku dle plochy pod křivkou (AUC), která je přímo úměrná podané dávce. Farmakokinetika lutropinu alfa po jednorázovém a opakovaném podání přípravku Luveris je srovnatelná a procento kumulace lutropinu alfa je minimální. Při současném podání nedochází k farmakokinetické interakci s follitropinem alfa.
Eliminace
Po subkutánním podání přípravku Luveris se lutropin alfa eliminuje z těla s terminálním poločasem přibližně 10-12 hodin. Po subkutánním podání je terminální poločas mírně prodloužený. Celková tělesná clearance je asi 2 l/h s méně než 5 % podané dávky vyloučené močí.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Jak lze očekávat z heterogenní proteinové povahy hormonu, lutropinum alfa zvýšil protilátkovou odpověď u pokusných zvířat po určité době, která snížila měřitelné sérové hladiny LH, ale nezabránila zcela jeho biologickému účinku. Nebyla pozorována žádná toxicita z důvodu protilátek na lutropinum alfa.
V dávkách 10 IU/kg/den a vyšších způsobilo opakované podání lutropinu alfa březím potkanům a králičím samicím poškození reprodukční funkce včetně resorpce plodů a snížení váhového přírůstku matky. Na žádném zvířecím modelu však nebyla pozorována teratogeneze související s přípravkem. Další studie prokázaly, že lutropinum alfa není mutagenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
sacharosa
dihydrát hydrogenfosorečnanu sodného monohydrát dihydrogenfosforečnanu sodného polysorbát 20
koncentrovaná kyselina fosforečná (pro úpravu pH) hydroxid sodný (pro úpravu pH)
L-methionin
dusík
Rozpouštědlo: voda na injekce
6.2 Inkompatibility
Tento přípravek se nesmí podávat ve formě směsi s jinými léčivými přípravky v téže injekci vyjma follitropinu alfa.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Prášek je balen v 3 ml injekčních lahvičkách z neutrálního bezbarvého skla (typ I), uzavřených brombutylovou zátkou chráněnou Al pertlí a odtrhovacími víčky. Rozpouštědlo je baleno v 2 ml nebo 3 ml injekčních lahvičkách z neutrálního bezbarvého skla (typ I), uzavřených teflonem potaženou pryžovou zátkou nebo v 2 ml ampulkách z neutrálního bezbarvého skla (typ I).
Balení po 1, 3 nebo 10 injekčních lahvičkách s odpovídajícím počtem injekčních lahviček či ampulek rozpouštědla. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
K okamžitému a jednorázovému použití po prvním otevření a rozpuštění.
Prášek se musí před použitím rozpustit v dodaném rozpouštědle jemným krouživým pohybem. Rozpuštěný roztok by se neměl používat, obsahuje-li pevné částice nebo není-li čirý.
Luveris lze smísit s follitropinem alfa a podávat spolu s ním v jedné injekci.
V takovém případě je třeba Luveris rozpustit jako první a vzniklý roztok pak použít k rozpuštění prášku follitropinu alfa.
Aby se injekčně nepodával velký objem roztoku, lze rozpustit jednu injekční lahvičku přípravku Luveris spolu s jednou či dvěma ampulkami follitropinu alfa 37,5 IU, 75 IU nebo 150 IU v 1 ml rozpouštědla.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56 Marsh Wall London E14 9TP Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/00/155/001 (1 injekční lahvička/1 ampulka) EU/1/00/155/002 (3 injekční lahvičky/3 ampulky) EU/1/00/155/003 (10 injekčních lahviček/10 ampulek) EU/1/00/155/004 (1 injekční lahvička/1 injekční lahvička) EU/1/00/155/005 (3 injekční lahvičky/3 injekční lahvičky) EU/1/00/155/006 (10 injekčních lahviček/10 injekčních lahviček)
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 29/11/2000.
Datum posledního prodloužení registrace: 30/11/2005.
10. DATUM REVIZE TEXTU {MM.RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky Merck Serono S.A.
CH-1170 Aubonne Švýcarsko
Název a adresa výrobce odpovědného za propouštění šarží Merck Serono S.p.A.
Via delle Magnolie 15 (Zona industriale)
I-70026 Modugno (Bari)
Itálie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Luveris 75 IU, prášek a rozpouštědlo pro injekční roztok Lutropinum alfa
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna injekční lahvička s práškem obsahuje: lutropinum alfa 75 IU.
3. SEZNAM POMOCNÝCH LÁTEK
Další složky: polysorbát 20, sacharosa, monohydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, kyselina fosforečná koncentrovaná, hydroxid sodný, L-methionin a dusík.
Jedna ampulka rozpouštědla obsahuje: 1 ml vody na injekce. (EU/1/00/155/001-003) Jedna injekční lahvička rozpouštědla obsahuje: 1 ml vody
4. LÉKOVÁ FORMA A OBSAH BALENÍ
1 injekční lahvička prášku k přípravě injekčního roztoku / 1 ampulka s rozpouštědlem.
3 injekční lahvičky prášku k přípravě injekčního roztoku / 3 ampulky s rozpouštědlem.
10 injekčních lahviček prášku k přípravě injekčního roztoku / 10 ampulek s rozpouštědlem.
1 injekční lahvička prášku k přípravě injekčního roztoku / 1 injekční lahvička s rozpouštědlem.
3 injekční lahvičky prášku k přípravě injekčního roztoku / 3 injekční lahvičky s rozpouštědlem.
10 injekčních lahviček prášku k přípravě injekčního roztoku / 10 injekčních lahviček s rozpouštědlem
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Neuchovávejte při teplotě nad 25 °C.. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56 Marsh Wall London E14 9TP Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/00/155/001 (1 injekční lahvička/ 1 ampulka) EU/1/00/155/002 (3 injekční lahvičky/ 3 ampulky) EU/1/00/155/003 (10 injekčních lahviček/ 10 ampulek) EU/1/00/155/004 (1 injekční lahvička/ 1 injekční lahvička) EU/1/00/155/005 (3 injekční lahvičky/ 3 injekční lahvičky) EU/1/00/155/006 (10 injekčních lahviček/ 10 injekčních lahviček)
13. ČÍSLO ŠARŽE
Č. š.:
Č. š. rozpouštědla:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
luveris 75 iu
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Luveris 75 IU Prášek na injekci. Lutropinum alfa Subkutánní podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
75 IU
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro Luveris
Voda na injekce
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro Luveris
Voda na injekce
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Rozpouštědlo v ampulkách
Luveris 75 IU, prášek a rozpouštědlo pro injekční roztok
Lutropinum alfa
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám, nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Luveris a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Luveris používat
3. Jak se Luveris používá
4. Možné nežádoucí účinky
5. Jak Luveris uchovávat
6. Obsah balení a další informace
1. Co je Luveris a k čemu se používá Co je Luveris
Luveris je přípravek obsahující lutropinum alfa, rekombinantní luteinizační hormon (LH), který se velice podobá hormonu přirozeně se nacházejícímu v lidském těle, je však vyroben biotechnologickým procesem. Patří do skupiny hormonů nazývaných gonadotropiny, které se podílí na přirozeném řízení reprodukce.
K čemu se Luveris používá
Luveris se doporučuje k léčbě dospělých žen, které vykazují velmi nízké hladiny určitých hormonů podílejících se na přirozeném reprodukčním cyklu. Lék se používá dohromady s dalším hormonem, který se nazývá folikuly stimulující hormon (FSH), ke spuštění rozvoje folikulů, struktur, které se nacházejí ve vaječníku a v nichž dozrávají vajíčka. Následuje podání jednorázové dávky lidského choriového gonadotropinu (hCG), což vede k uvolnění vajíčka z folikulu (ovulace).
2. Čemu musíte věnovat pozornost, než začnete Luveris používat
Nepoužívejte Luveris:
• jestliže jste alergická na gonadotropiny (například luteinizační hormon, folikuly stimulující hormon nebo lidský choriogonadotropin) nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• byla-li u Vás zjištěna rakovina vaječníku, dělohy či prsu.
• byl-li u Vás zjištěn mozkový nádor.
• máte-li zvětšené vaječníky nebo ovariální cysty (váčky uvnitř vaječníků naplněné tekutinou) neznámého původu.
• trpíte-li nevyjasněným krvácením z pochvy.
Nepoužívejte přípravek Luveris, můžete-li kladně odpovědět na kteroukoli z výše uvedených obtíží.
Pokud máte pochybnosti, obraťte se před užíváním tohoto přípravku na svého lékaře nebo lékárníka.
Upozornění a opatření
Před použitím přípravku Luveris se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou. Před léčbou je nutné posoudit Vaši plodnost a plodnost Vašeho partnera.
Doporučuje se přípravek Luveris nepoužívat, vykazujete-li jakýkoli stav, který obvykle brání normálnímu těhotenství, jako jsou nefunkční vaječníky v důsledku onemocnění zvaného primární selhání vaječníků nebo malformací pohlavních orgánů.
Porfyrie
Pokud Vy nebo některý člen Vaší rodiny trpí porfyrií (choroba projevující se neschopností štěpit porfyriny, která je přenosná z rodičů na potomky), oznamte to svému lékaři před zahájením léčby.
Ovariální hyperstimulační syndrom (OHSS)
Tento lék stimuluje Vaše vaječníky. Tím se zvyšuje riziko rozvoje stavu, kterému se říká syndrom ovariální hyperstimulace nebo OHSS. Dochází k němu, když se folikuly vyvinou příliš a stanou se z nich velké cysty. Pokud budete pociťovat bolest v podbřišku, začnete rychle nabývat na hmotnosti, dostaví se nevolnosti, zvracení nebo dýchací potíže, neprodleně informujte svého lékaře, který Vám může podávání léku pozastavit (viz v bodě 4 „Závažné nežádoucí účinky“).
V případě, že nedochází k ovulaci a dodržuje se doporučené dávkování a harmonogram podávání přípravku, vznik OHSS je méně pravděpodobný. Léčba přípravkem Luveris zřídka vede
k významnému OHSS. Ten je pravděpodobnější, pokud se podá lék na vyvolání konečného zrání folikulu (obsahující lidský choriogonadotropin, hCG) (pro podrobnosti viz v bodě 3 „Jaké množství použít“). Pokud se začne rozvíjet OHSS, lékař Vám v tomto léčebném cyklu nepodá hCG a požádá Vás, abyste se zdržela pohlavního styku nebo používala bariérové antikoncepční prostředky po dobu nejméně čtyř dní.
Váš lékař zajistí pečlivé sledování odpovědi vaječníků vyšetřením ultrazvukem a pomocí krevních testů před léčbou i během léčby.
Vícečetné těhotenství
Při užívání přípravku Luveris existuje v porovnání s přirozeným početím vyšší riziko „vícečetného těhotenství“, tj. těhotenství, kdy žena současně nosí více než jedno dítě, nejčastěji se jedná o dvojčata. Vícečetné těhotenství může vést ke zdravotním komplikacím, ohrožujících Vás i Vaše děti. Riziko vzniku vícečetného těhotenství lze omezit užíváním správné dávky přípravku Luveris v příslušnou dobu. Při podstoupení metody asistované reprodukce souvisí riziko vzniku vícečetného těhotenství s Vaším věkem a s kvalitou a počtem zavedených oplodněných vajíček nebo embryí.
Samovolný potrat
V případě, že podstupujete metodu asistované reprodukce nebo stimulaci vaječníků ke tvorbě vajíček, je oproti průměrné ženě vyšší pravděpodobnost, že může dojít k samovolnému potratu.
Mimoděložní těhotenství
U žen s onemocněním vejcovodů v anamnéze existuje riziko mimoděložního těhotenství (embryo je usazeno mimo dělohu), ať už k otěhotnění došlo přirozeným početím nebo metodou asistované reprodukce.
Potíže se srážlivostí krve (tromboembolické příhody)
Informujte svého lékaře před použitím přípravku Luveris v případě, že se u Vás nebo ve Vaší rodině vyskytly krevní sraženiny v nohách nebo v plicích, infarkt myokardu nebo mrtvice. Při léčbě přípravkem Luveris můžete mít vyšší riziko závažných krevních sraženin nebo se stávající sraženiny mohou zhoršit.
Nádory pohlavních orgánů
U žen, které podstoupily různé léčebné režimy na léčbu neplodnosti, byly hlášeny benigní i maligní novotvary vaječníků a dalších pohlavních orgánů.
Vrozené vady
Po použití metod asistované reprodukce může být oproti přirozenému početí mírně zvýšený výskyt vrozených vad. To může být buď důsledkem odchylek spojených s neplodností rodičovského páru, jako je věk rodičky, genetické faktory, anebo souviset se zákroky asistované reprodukce nebo vícečetným těhotenstvím.
Děti a dospívající
Přípravek Luveris není určen k použití u dětí a dospívajících do 18 let věku.
Další léčivé přípravky a přípravek Luveris
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užívala nebo které možná budete užívat.
Neužívejte přípravek Luveris jako směs s jinými léky ve stejné injekci, kromě follitropinu alfa, pokud byl předepsán vaším lékařem.
Těhotenství a kojení
Neužívejte přípravek Luveris během těhotenství či kojení.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete jakýkoliv přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Přípravek Luveris nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje. Důležité informace o některých složkách přípravku Luveris
Luveris obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce. Je v podstatě „bez sodíku“.
3. Jak se Luveris používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem.
Užívání tohoto léku
Dávku a rozvrh podávání určí lékař tak, jak pro Vás bude v daném cyklu léčby nejvhodnější.
Pro aplikaci přípravku pacienty doma jsou k dispozici uživatelsky vhodnější formy. Poraďte se se svým lékařem, abyste zjistili, zda pro Vás mohou být k dispozici vhodnější alternativy.
Jaké množství použít
Luveris se obvykle podává každý den po dobu až 3 týdnů společně s injekcí FSH.
• Obvyklou úvodní dávkou je 75 IU (1 injekční lahvička) přípravku Luveris společně se 75 IU nebo 150 IU FSH.
• Podle Vaší odpovědi může lékař zvýšit dávku FSH nejlépe o 37,5-75 IU v 7 až 14denních intervalech.
Lékař může rozhodnout o prodloužení léčby až na 5 týdnů.
Po dosažení požadované odpovědi se podá jedna injekce hCG 24 až 48 hodin po poslední injekci přípravku Luveris a FSH. Ten samý den a den následující po injekci hCG byste měla mít pohlavní styk. Případně může být provedeno nitroděložní oplodnění (vstříknutí spermatu do dělohy).
V případě nadměrné odpovědi by se měla léčba ukončit a injekce hCG by se neměla podávat (viz bod „Možné nežádoucí účinky“). V následujícím cyklu Vám lékař předepíše nižší dávku FSH než v cyklu předchozím.
Způsob podání
Luveris je určen k subkutánnímu podání, to znamená, že se podává injekcí pod kůži. Každá injekční lahvička je určena k jednorázovému použití.
Pokud si sama podáváte Luveris, pozorně si přečtěte následující pokyny:
• Umyjte si ruce. Je důležité, aby ruce a všechny používané prostředky byly co nejčistší.
• Připravte si vše, co budete potřebovat. Najděte si čisté místo, na které vše položíte:
- 1 injekční lahvičku přípravku Luveris,
- 1 ampulku rozpouštědla,
- dva tampónky napuštěné alkoholem,
- jednu injekční stříkačku,
- jednu jehlu na rozpouštění k naředění prášku rozpouštědlem,
- tenkou jehlu k podkožní injekci,
- pevnou nádobu na vyhození skla a jehel.
• Natažení Otevřete ampulku rozpouštědla: Na vrchu ampulky uvidíte malou barevnou tečku.

Přímo pod ní je místo, kde je hrdlo ampulky snadno rozlomitelné. Jemně klepněte do vrchního oddílu ampulky tak, aby veškerá tekutina stekla do spodní části. Nyní pevně stiskněte hrdlo ampulky a rozlomte ampulku směrem od barevné tečky. Opatrně postavte otevřenou ampuli na pracovní místo.
• Natažení rozpouštědla: Připojte jehlu na rozpouštění ke stříkačce, se stříkačkou v jedné ruce
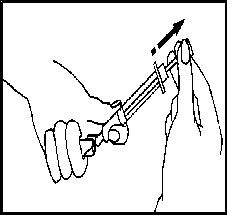
vezměte otevřenou ampulku, vložte do ní jehlu a natáhněte veškerý obsah rozpouštědla. Opatrně položte injekční stříkačku na pracovní místo, dávejte pozor, abyste se nedotkla jehly.
Připravte si injekční roztok: Odstraňte ochranné víčko z injekční lahvičky s práškem Luveris,
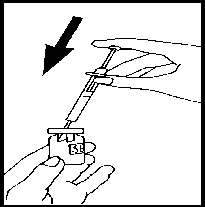
zdvihněte injekční stříkačku a pomalu vstříkněte rozpouštědlo do injekční lahvičky s přípravkem Luverisem. Opatrně zakružte, aniž byste vyjmula injekční stříkačku. Netřepejte.
Po rozpuštění prášku (ke kterému obvykle dochází okamžitě) zkontrolujte, zda je výsledný
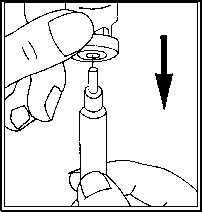
roztok čirý a zda neobsahuje žádné částice. Otočte injekční lahvičku dnem vzhůru a jemně natáhněte roztok zpět do injekční stříkačky.
Případně můžete smísit Luveris a follitropin alfa místo aplikace každého přípravku zvlášť.
Po rozpuštění prášku Luveris natáhněte roztok zpět do injekční stříkačky a opět jej vstříkněte do injekční lahvičky s práškem follitropinu alfa. Po rozpuštění prášku natáhněte roztok zpět do injekční stříkačky. Opět zkontrolujte částice a nepoužívejte roztok, není-li čirý.
V 1 ml rozpouštědla mohou být rozpuštěny až 3 injekční lahvičky prášku.
• Vyměňte jehlu za tenkou injekční jehlu a odstraňte vzduchové bubliny: pokud uvidíte
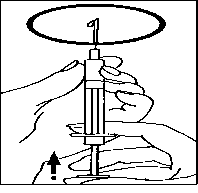
vzduchové bubliny v injekční stříkačce, podržte injekční stříkačku s jehlou mířící vzhůru a jemně poklepávejte na injekční stříkačku, dokud se všechny vzduchové bubliny neshromáždí na povrchu. Pomalu tlačte píst proti bublinám, až všechny odstraníte.
Roztok okamžitě aplikujte: Lékař nebo zdravotní sestra Vám již poradili, kam injekci podat
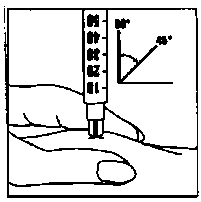
(např. břicho, přední část stehna). Očistěte zvolené místo alkoholovým tampónem. Pevně stiskněte kůži k sobě a vpíchněte jehlu pod úhlem 45° až 90° pohybem jako při hodu šipky. Vstříkněte obsah injekční stříkačky pod kůži, jak jste byla poučena. Nevpichujte přímo do žíly. Vstřikujte pomalu celý obsah roztoku. Poté jehlu ihned vyjměte a očistěte místo injekce alkoholovým tampónem krouživým pohybem.
• Vyhoďte všechny použité potřeby: Po dokončení injekce ihned vyhoďte všechny jehly a prázdné injekční lahvičky do pevné nádoby, kterou jste k tomuto účelu dostala. Všechen nespotřebovaný roztok musí být vyhozen.
Jestliže jste použila více přípravku Luveris, než jste měla
Účinek předávkování přípravkem Luveris není znám, je však možný výskyt syndromu ovariální hyperstimulace, který je podrobněji popsán v odstavci „Možné nežádoucí účinky“. Může k němu však dojít, pouze byl-li podán hCG (viz bod „Upozornění a opatření“).
Jestliže jste zapomněla použít přípravek Luveris
Nezdvojnásobujte následující dávku, abyste nahradila vynechanou dávku. Prosím, kontaktujte svého lékaře.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Závážné nežádoucí účinky
Kontaktujte ihned svého lékaře, pokud si všimnete jakýchkoli níže uvedených nežádoucích účinků. Lékař Vás může požádat, abyste ukončila užívání přípravku Luveris.
Alergická reakce
Alergické reakce, například vyrážka, zarudnutí kůže, kopřivka, otoky v obličeji spojené s dýchacími
obtížemi, které mohou někdy být i velmi vážné. Tento nežádoucí účinek je velmi vzácný (může se vyskytnout u méně než 1 z 10 000 osob).
Ovariální hyperstimulační syndrom
• Bolesti v podbřišku provázené nevolností a zvracením. Mohou být projevem ovariálního hyperstimulačního syndromu (OHSS). Vaše vaječníky mohou reagovat nadměrně na léčbu a mohou se vytvořit velké váčky tekutiny nebo cysty (viz také v bodě 2 „Ovariální hyperstimulační syndrom“). Tento nežádoucí účinek je častý (může se vyskytnout u méně než 1 z 10 osob). Pokud se objeví, váš lékař Vás bude muset co možná nejdříve vyšetřit.
• Vážné potíže se srážlivostí krve (tromboembolické příhody) obvykle spojené s vážným OHSS se vyskytují velmi vzácně. Mohou vyvolávat bolest na hrudi, dušnost, mrtvici nebo infarkt myokardu (viz také v bodě 2 „Potíže se srážlivostí krve“),
Další časté nežádoucí účinky
• bolest hlavy
• nevolnost, zvracení, průjem, břišní nevolnost nebo bolesti břicha
• váčky tekutiny ve vaječnících (ovariální cysty), bolest na hrudi a v oblasti pánve
• lokální reakce v místě aplikace, například bolest, svědění, podlitiny, otok nebo podráždění.
Torze vaječníků a krvácení do dutiny břišní nebyly u přípravku Luveris zaznamenány, vzácně se však uvedené případy vyskytly při léčbě lidským menopauzálním gonadotropinem (hMG), což je přípravek obsahující LH získaný extrakcí z moči menopauzálních žen.
Mimoděložní těhotenství (usazení embrya mimo dělohu) se může vyskytnout zvláště u žen, které mají v anamnéze onemocnění vejcovodů.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Luveris uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na injekčních lahvičkách za „Použitelné do“ / „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Neuchovávejte při teplotě nad 25 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Nepoužívejte tento přípravek, pokud si všimnete jakékoli viditelné známky poškození jako zbarvení prášku nebo poškození obalu.
Lék by měl být podán okamžitě po rozpuštění dodaným rozpouštědlem.
Roztok se nesmí použít, obsahuje-li pevné částice nebo není-li čirý.
Nevhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Luveris obsahuje
• Léčivou látkou přípravku je lutropinum alfa. Jedna injekční lahvička prášku na injekci obsahuje 75 IU (mezinárodní jednotky).
• Lutropinum alfa je rekombinantní lidský luteinizační hormon (r-hLH) vytvořený rekombinantní DNA technologií.
• Dalšími složkami prášku jsou polysorbát 20, sacharóza, monohydrát dihydrogenfosforečnanu sodného, dihydrát fosforečnanu sodného, koncentrovaná kyselina fosforečná, hydroxid sodný, L-methionin a dusík.
• Rozpouštědlem je voda na injekce.
Jak Luveris vypadá a co obsahuje toto balení
• Luveris se dodává ve formě prášku a rozpouštědla pro injekční roztok.
• Dodává se v baleních obsahujících 1, 3 nebo 10 injekčních lahviček s práškem spolu se stejným počtem ampulek rozpouštědla.
• Jedna injekční lahvička prášku obsahuje 75 IU lutropinu alfa a jedna ampulka rozpouštědla obsahuje 1 ml vody na injekce.
Držitel rozhodnutí o registraci
Merck Serono Europe Limited
56 Marsh Wall
Londýn E14 9TP
Velká Británie
Výrobce
Merck Serono S.p.A.
Via delle Magnolie 15 (Zona industriale) I-70026 Modugno (Bari) Itálie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
Merck Serono UAB Tel: +370 37320603
Belgie/Belgique/Belgien
MERCK NV/SA Tél/Tel: +32-2-686 07 11
Btnrapuu
„MepK Etnrapna“ EAfl Ten.: +359 24461 111
Luxembourg/Luxemburg
MERCK NV/SA, Belgique/Belgien Tél/Tel: +32-2-686 07 11
Česká republika
Merck spol.s.r.o
Tel. +420 272084211
Danmark
Merck A/S Tlf: +45 35253550
Malta
Cherubino Ltd
Tel: +356-21-343270/1/2/3/4
Norge
Eesti
Merck Serono OU Tel: +372 682 5882
Merck Serono Norge Tlf: +47 67 90 35 90
|
EAAáSa Merck A.E. T^A: +30-210-61 65 100 |
Osterreich Merck GesmbH. Tel: +43 1 57600-0 |
|
Espaňa Merck S.L. Línea de Información: 900 200 400 Tel: +34-91-745 44 00 |
Polska Merck Sp. z o.o. Tel.: +48 22 53 59 700 |
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Románia MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nanaAorZou AtS T^A.: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
Tato příbalová informace byla naposledy revidována {MM.YYYY}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
Rozpouštědlo v injekčních lahvičkách
Luveris 75 IU, prášek a rozpouštědlo pro injekční roztok
Lutropinum alfa
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám, nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Luveris a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Luveris používat
3. Jak se Luveris používá
4. Možné nežádoucí účinky
5. Jak Luveris uchovávat
6. Obsah balení a další informace
1. Co je Luveris a k čemu se používá Co je Luveris
Luveris je přípravek obsahující lutropinum alfa, rekombinantní luteinizační hormon (LH), který se velice podobá hormonu přirozeně se nacházejícímu v lidském těle, je však vyroben biotechnologickým procesem. Patří do skupiny hormonů nazývaných gonadotropiny, které se podílí na přirozeném řízení reprodukce.
K čemu se Luveris používá
Luveris se doporučuje k léčbě dospělých žen, které vykazují velmi nízké hladiny určitých hormonů podílejících se na přirozeném reprodukčním cyklu. Lék se používá dohromady s dalším hormonem, který se nazývá folikuly stimulující hormon (FSH), ke spuštění rozvoje folikulů, struktur, které se nacházejí ve vaječníku a v nichž dozrávají vajíčka. Následuje podání jednorázové dávky lidského choriového gonadotropinu (hCG), což vede k uvolnění vajíčka z folikulu (ovulace).
2. Čemu musíte věnovat pozornost, než začnete Luveris používat
Nepoužívejte Luveris:
• jestliže jste alergická na gonadotropiny (například luteinizační hormon, folikuly stimulující hormon nebo lidský choriogonadotropin) nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• byla-li u Vás zjištěna rakovina vaječníku, dělohy či prsu.
• byl-li u Vás zjištěn mozkový nádor.
• máte-li zvětšené vaječníky nebo ovariální cysty (váčky uvnitř vaječníků naplněné tekutinou) neznámého původu.
• trpíte-li nevyjasněným krvácením z pochvy.
Nepoužívejte přípravek Luveris, pokud můžete kladně odpovědět na kteroukoli z výše uvedených
obtíží. Pokud máte pochybnosti, obraťte se před užíváním tohoto přípravku na svého lékaře
nebo lékárníka.
Upozornění a opatření
Před použitím přípravku Luveris se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou. Před léčbou je nutné posoudit Vaši plodnost a plodnost Vašeho partnera.
Doporučuje se přípravek Luveris nepoužívat, vykazujete-li jakýkoli stav, který obvykle brání normálnímu těhotenství, jako jsou nefunkční vaječníky v důsledku onemocnění zvaného primární selhání vaječníků nebo malformace pohlavních orgánů.
Porfyrie
Pokud Vy nebo některý člen Vaší rodiny trpí porfyrií (choroba projevující se neschopností štěpit porfyriny, která je přenosná z rodičů na potomky), oznamte to svému lékaři před zahájením léčby.
Ovariální hyperstimulační syndrom (OHSS)
Tento lék stimuluje Vaše vaječníky. Tím se zvyšuje riziko rozvoje stavu, kterému se říká syndrom ovariální hyperstimulace nebo OHSS. Dochází k němu, když se folikuly vyvinou příliš a stanou se z nich velké cysty. Pokud budete pociťovat bolest v podbřišku, začnete rychle nabývat na hmotnosti, dostaví se nevolnost, zvracení nebo dýchací potíže, neprodleně informujte svého lékaře, který Vám může podávání léku pozastavit (viz v bodě 4 „Závažné nežádoucí účinky“).
V případě, že nedochází k ovulaci a dodržuje se doporučené dávkování a harmonogram podávání přípravku, vznik OHSS je méně pravděpodobný. Léčba přípravkem Luveris zřídka vede
k významnému OHSS. Ten je pravděpodobnější, pokud se podá lék na vyvolání konečného zrání folikulu (obsahující lidský choriogonadotropin, hCG) (pro podrobnosti viz v bodě 3 „Jaké množství použít“). Pokud se začne rozvíjet OHSS, lékař Vám v tomto léčebném cyklu nepodá hCG a požádá Vás, abyste se zdržela pohlavního styku nebo používala bariérové antikoncepční prostředky po dobu nejméně čtyř dní.
Váš lékař zajistí pečlivé sledování odpovědi vaječníků vyšetřením ultrazvukem a pomocí krevních testů před léčbou i během léčby.
Vícečetné těhotenství
Při užívání přípravku Luveris existuje v porovnání s přirozeným početím vyšší riziko „vícečetného těhotenství“, tj. těhotenství, kdy žena současně nosí více než jedno dítě, nejčastěji se jedná o dvojčata. Vícečetné těhotenství může vést ke zdravotním komplikacím, ohrožujících Vás i Vaše děti. Riziko vzniku vícečetného těhotenství lze omezit užíváním správné dávky přípravku Luveris v příslušnou dobu. Při podstoupení metody asistované reprodukce souvisí riziko vzniku vícečetného těhotenství s Vaším věkem a s kvalitou a počtem zavedených oplodněných vajíček nebo embryí.
Samovolný potrat
V případě, že podstupujete metodu asistované reprodukce nebo stimulaci vaječníků ke tvorbě vajíček, je oproti průměrné ženě vyšší pravděpodobnost, že může dojít k samovolnému potratu.
Mimoděložní těhotenství
U žen s onemocněním vejcovodů v anamnéze existuje riziko mimoděložního těhotenství (embryo je usazeno mimo dělohu), ať už k otěhotnění došlo přirozeným početím nebo metodou asistované reprodukce.
Potíže se srážlivostí krve (tromboembolické příhody)
Informujte svého lékaře před použitím přípravku Luveris v případě, že se u Vás nebo ve Vaší rodině vyskytly krevní sraženiny v nohách nebo v plicích, infarkt myokardu nebo mrtvice. Při léčbě přípravkem Luveris můžete mít vyšší riziko závažných krevních sraženin nebo se stávající sraženiny mohou zhoršit.
Nádory pohlavních orgánů
U žen, které podstoupily různé léčebné režimy na léčbu neplodnosti, byly hlášeny benigní i maligní novotvary vaječníků a dalších pohlavních orgánů.
Vrozené vady
Po použití metod asistované reprodukce může být oproti přirozenému početí mírně zvýšený výskyt vrozených vad. To může být buď důsledkem odchylek spojených s neplodností rodičovského páru, jako je věk rodičky, genetické faktory, anebo souviset se zákroky asistované reprodukce nebo vícečetným těhotenstvím.
Děti a dospívající
Přípravek Luveris není určen k použití u dětí a dospívajících do 18 let věku.
Další léčivé přípravky a přípravek Luveris
Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užívala nebo které možná budete užívat.
Neužívejte přípravek Luveris jako směs s jinými léky ve stejné injekci, kromě follitropinu alfa, pokud byl předepsán vaším lékařem.
Těhotenství a kojení
Neužívejte přípravek Luveris během těhotenství či kojení.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete jakýkoliv přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Přípravek Luveris nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje. Důležité informace o některých složkách přípravku Luveris
Luveris obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce. Je v podstatě „bez sodíku“.
3. Jak se Luveris používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem nebo lékárníkem.
Užívání tohoto léku
Dávku a rozpis podávání určí lékař tak, jak pro Vás bude v daném cyklu léčby nejvhodnější.
Jaké množství použít
Luveris se obvykle podává každý den po dobu až 3 týdnů společně s injekcí FSH.
• Obvyklou úvodní dávkou je 75 IU přípravku Luveris (1 injekční lahvička) společně se 75 IU nebo 150 IU FSH.
• Podle Vaší odpovědi může lékař zvýšit dávku FSH nejlépe o 37,5-75 IU v 7 až 14 denních intervalech.
Lékař může rozhodnout o prodloužení Vaší léčby až na 5 týdnů.
Po dosažení požadované odpovědi se podá jedna injekce hCG 24 až 48 hodin po poslední injekci přípravku Luveris a FSH. Ten samý den a den následující po injekci hCG byste měla mít pohlavní styk. Případně může být provedeno nitroděložní oplodnění (vstříknutí spermatu do dělohy).
V případě dosažení nadměrné odpovědi by se měla léčba ukončit a injekce hCG by se neměla podávat (viz bod „Možné nežádoucí účinky“). V následujícím cyklu Vám lékař předepíše nižší dávku FSH než v cyklu předchozím.
Způsob podání
Luverisje určen k subkutánnímu podání, to znamená, že se podává injekcí pod kůži. Každá injekční lahvička je určena k jednorázovému použití.
Pokud si sama podáváte Luveris, pozorně si přečtěte následující pokyny:
• Umyjte si ruce. Je důležité, aby Vaše ruce a všechny používané prostředky byly co nejčistší.
• Připravte si vše, co budete potřebovat. Najděte si čisté místo, na které vše položíte:
- 1 injekční lahvičku přípravku Luverisu,
- 1 injekční lahvičku rozpouštědla,
- dva tampónky napuštěné alkoholem,
- jednu injekční stříkačku,
- jednu jehlu na rozpouštění k naředění prášku rozpouštědlem,
- tenkou jehlu k podkožní injekci,
- pevnou nádobu na vyhození skla a jehel.
• Odstraňte ochranný kryt z injekční lahvičky s rozpouštědlem. Připevněte jehlu na
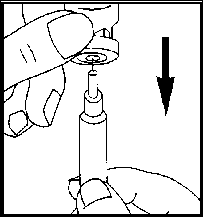
rozpouštění k injekční stříkačce a nasajte do ní vzduch vytažením pístu přibližně ke značce 1 ml. Potom zaveďte jehlu do injekční lahvičky a stlačením pístu vytlačte do ní vzduch. Obraťte injekční lahvičku vzhůru dnem a opatrně natáhněte rozpouštědlo.
Opatrně položte injekční stříkačku na pracovní místo tak, abyste se nedotkli jehly.
• Připravte si injekční roztok: Odstraňte ochranné víčko z injekční lahvičky s práškem Luveris
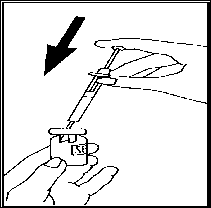
zdvihněte injekční stříkačku a pomalu vstříkněte rozpouštědlo do injekční lahvičky s přípravkem Luveris. Opatrně zakružte, aniž byste vyjmula injekční stříkačku. Netřepejte.
Po rozpuštění prášku (ke kterému obvykle dochází okamžitě) zkontrolujte, zda je výsledný roztok čirý a zda neobsahuje žádné částice. Otočte injekční lahvičku dnem vzhůru a jemně natáhněte roztok zpět do injekční stříkačky.
Případně můžete smísit Luveris a follitropin alfa místo aplikace každého přípravku zvlášť. Po rozpuštění prášku Luveris natáhněte roztok zpět do injekční stříkačky, a opět jej vstříkněte do injekční lahvičky s práškem follitropinu alfa. Po rozpuštění prášku natáhněte roztok zpět do injekční stříkačky. Opět zkontrolujte částice a nepoužívejte roztok, není-li čirý.
V 1 ml rozpouštědla mohou být rozpuštěny až 3 injekční lahvičky prášku.
• Vyměňte jehlu za tenkou injekční jehlu a odstraňte vzduchové bubliny: pokud uvidíte
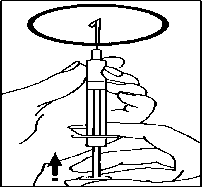
vzduchové bubliny v injekční stříkačce, podržte injekční stříkačku s jehlou mířící vzhůru a jemně poklepávejte na injekční stříkačku, dokud se všechny vzduchové bubliny neshromáždí na povrchu. Pomalu tiskněte píst proti těmto bublinám, dokud nezmizí.
• Roztok okamžitě aplikujte: Lékař nebo zdravotní sestra Vám již poradili, kam injekci podat
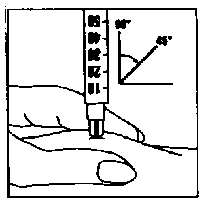
(např. břicho, přední část stehna). Očistěte zvolené místo alkoholovým tampónem. Pevně stiskněte kůži k sobě a vpíchněte jehlu pod úhlem 45° až 90° pohybem jako při hodu šipky. Vstříkněte obsah injekční stříkačky pod kůži, jak jste byla poučena. Nevpichujte přímo do žíly. Vstřikujte roztok jemným tlakem na píst. Poté jehlu ihned vyjměte a očistěte místo injekce alkoholovým tampónem krouživým pohybem.
• Vyhoďte všechny použité potřeby: Po dokončení injekce ihned vyhoďte všechny jehly a prázdné injekční lahvičky do pevné nádoby, kterou jste k tomuto účelu dostala. Všechen nespotřebovaný roztok musí být vyhozen.
Jestliže jste použila více přípravku Luveris, než jste měla
Účinek předávkování přípravkem Luveris není znám, je však možný výskyt syndromu ovariální hyperstimulace, který je podrobněji popsán v bodu „Možné nežádoucí účinky“. Může k němu však dojít, pouze byl-li podán hCG (viz bod „Upozornění a opatření“).
Jestliže jste zapomněla použít přípravek Luveris
Nezdvojnásobujte následující dávku, abyste nahradila vynechanou dávku. Kontaktujte svého lékaře.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
T-W r V r Vil r r v» 1
Závažné nežádoucí účinky
Kontaktujte ihned svého lékaře, pokud si všimnete jakýchkoli níže uvedených nežádoucích účinků. Lékař Vás může požádat, abyste ukončila užívání přípravku Luveris.
Alergická reakce
Alergické reakce, například vyrážka, zarudnutí kůže, kopřivka, otoky v obličeji spojené s dýchacími obtížemi, které mohou někdy být i velmi vážné. Tento nežádoucí účinek je velmi vzácný (může se vyskytnout u méně než 1 z 10 000 osob).
Ovariální hyperstimulační syndrom
• Bolesti v podbřišku provázené nevolností a zvracením. Mohou být projevem ovariálního hyperstimulačního syndromu (OHSS). Vaše vaječníky mohou reagovat nadměrně na léčbu a mohou se vytvořit velké váčky tekutiny nebo cysty (viz také v bodě 2 „Ovariální hyperstimulační syndrom“). Tento nežádoucí účinek je častý (může se vyskytnout u méně než 1 z 10 osob). Pokud se objeví, Váš lékař Vás bude muset co možná nejdříve vyšetřit.
• Vážné potíže se srážlivostí krve (tromboembolické příhody) obvykle spojené s vážným OHSS se vyskytují velmi vzácně. Mohou vyvolávat bolest na hrudi, dušnost, mrtvici nebo infarkt myokardu (viz také v bodě 2 „Potíže se srážlivostí krve“).
Další časté nežádoucí účinky
• bolest hlavy,
• nevolnost, zvracení, průjem, břišní nevolnost nebo bolesti břicha,
• váčky tekutiny ve vaječnících (ovariální cysty), bolest na hrudi a v oblasti pánve,
• lokální reakce v místě aplikace, například bolest, svědění, podlitiny, otok nebo podráždění.
Torze vaječníků a krvácení do dutiny břišní nebyly u přípravku Luveris zaznamenány, vzácně se však uvedené případy vyskytly při léčbě lidským menopauzálním gonadotropinem (hMG), což je přípravek obsahující LH získaný extrakcí z moči menopauzálních žen.
Mimoděložní těhotenství (usazení embrya mimo dělohu) se může vyskytnout zvláště u žen, které mají v anamnéze onemocnění vejcovodů.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Luveris uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na injekčních lahvičkách za „Použitelné do“ / „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Neuchovávejte při teplotě nad 25 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Nepoužívejte tento přípravek, pokud si všimnete jakékoli viditelné známky poškození, jako je zbarvení prášku nebo poškození obalu.
Lék by měl být podán okamžitě po rozpuštění dodaným rozpouštědlem.
Roztok se nesmí použít, obsahuje-li pevné částice nebo není-li čirý.
Nevhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Luveris obsahuje
• Léčivou látkou přípravku je lutropinum alfa. Jedna injekční lahvička prášku na injekci obsahuje 75 IU (mezinárodní jednotky).
• Lutropinum alfa je rekombinantní lidský luteinizační hormon (r-hLH) vytvořený rekombinantní DNA technologií.
• Dalšími složkami prášku jsou polysorbát 20, sacharóza, monohydrát dihydrogenfosforečnanu sodného, dihydrát fosforečnanu sodného, koncentrovaná kyselina fosforečná, hydroxid sodný, L-methionin a dusík.
• Rozpouštědlem je voda na injekce.
Jak Luveris vypadá a co obsahuje toto balení
• Luveris se dodává ve formě prášku a rozpouštědla pro injekční roztok.
• Dodává se v baleních obsahujících 1, 3 nebo 10 injekčních lahviček s práškem spolu se stejným počtem injekčních lahviček rozpouštědla.
• Jedna injekční lahvička prášku obsahuje 75 IU lutropinum alfa a jedna injekční lahvička rozpouštědla obsahuje 1 ml vody na injekce.
Držitel rozhodnutí o registraci
Merck Serono Europe Limited 56 Marsh Wall Londýn E14 9TP Velká Británie
Výrobce
Merck Serono S.p.A.
Via delle Magnolie 15 (Zona industriale)
I-70026 Modugno (Bari)
Itálie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien MERCK NV/SA Tél/Tel: +32-2-686 07 11 |
Lietuva Merck Serono UAB Tel: +370 37320603 |
|
Btarapna „MepK EtnrapHa“ EAfl Ten.: +359 24461 111 |
Luxembourg/Luxemburg MERCK NV/SA, Belgique/Belgien Tél/Tel: +32-2-686 07 11 |
|
Česká republika Merck spol.s.r.o Tel. +420 272084211 |
Magyarország Merck Kft. Tel: +36-1-463-8100 |
|
Danmark Merck A/S Tlf: +45 35253550 |
Malta Cherubino Ltd Tel: +356-21-343270/1/2/3/4 |
|
Deutschland Merck Serono GmbH Tel: +49-6151-6285-0 |
Nederland Merck BV Tel: +31-20-6582800 |
|
Eesti Merck Serono OU Tel: +372 682 5882 |
Norge Merck Serono Norge Tlf: +47 67 90 35 90 |
|
EXXáSa Merck A.E. T^V +30-210-61 65 100 |
Osterreich Merck GesmbH. Tel: +43 1 57600-0 |
|
Espaňa Merck S.L. Línea de Información: 900 200 400 Tel: +34-91-745 44 00 |
Polska Merck Sp. z o.o. Tel.: +48 22 53 59 700 |
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Románia MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nana^or^ou AtS TqA..: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
Tato příbalová informace byla naposledy revidována {MM.RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
36