Lonsurf 20 Mg/8,19 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Lonsurf 15 mg/6,14 mg potahované tablety Lonsurf 20 mg/8,19 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Lonsurf 15 mg/6,14 mg potahované tablety
Jedna potahovaná tableta obsahuje trifluridinum 15 mg a tipiracilum 6,14 mg (jako tipiracili hydrochloridum).
Pomocná látka se známým účinkem
Jedna potahovaná tableta obsahuje monohydrát laktosy 90,735 mg.
Lonsurf 20 mg/8,19 mg potahované tablety
Jedna potahovaná tableta obsahuje trifluridinum 20 mg a tipiracilum 8,19 mg (jako tipiracili hydrochloridum).
Pomocná látka se známým účinkem
Jedna potahovaná tableta obsahuje monohydrát laktosy 120,980 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta (tableta).
Lonsurf 15 mg/6,14 mg potahované tablety
Bílá, bikonvexní, kulatá potahovaná tableta o průměru 7,1 mm a tloušťce 2,7 mm, s šedým potiskem „15“ na jedné straně a „102“ a „15 mg“ na druhé straně.
Lonsurf 20 mg/8,19 mg potahované tablety
Světle červená, bikonvexní, kulatá potahovaná tableta o průměru 7,6 mm a tloušťce 3,2 mm, s šedým potiskem „20“ na jedné straně a „102“ a „20 mg“ na druhé straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Lonsurf je indikován k léčbě dospělých pacientů s metastazujícím kolorektálním karcinomem (CRC), kteří byli v minulosti léčeni nebo nejsou vhodnými kandidáty pro dostupné terapie zahrnující chemoterapie založené na fluoropyrimidinu, oxaliplatině a irinotekanu, anti-VEGF látek a anti-EGFR látek.
4.2 Dávkování a způsob podání
Přípravek Lonsurf má být předepsán lékaři, kteří mají zkušenostmi s podáváním protinádorové terapie. Dávkování
Doporučená úvodní dávka přípravku Lonsurf u dospělých je 35 mg/m2/dávku, podávaných perorálně dvakrát denně 1. až 5. den a 8. až 12. den každého 28denního cyklu tak dlouho, dokud je pozorován přínos léčby nebo dokud se nevyskytne nepřijatelná toxicita (viz bod 4.4).
Dávkování přípravku se počítá podle plochy povrchu těla (BSA) (viz tabulka 1). Dávkování musí být zaokrouhleno na nejbližší 5mg přírůstek. Dávkování nesmí překročit 80 mg v 1 dávce.
Pokud jsou dávky zapomenuty nebo odloženy, pacient nesmí vynechané dávky nahrazovat.
Tabulka 1 - Výpočet úvodní dávky podle plochy povrchu těla (BSA)
|
Úvodní dávka |
BSA (m2) |
Dávka v mg (2x denně) |
Počet tablet na dávku |
Celková denní dávka (mg) | |
|
15 mg |
20 mg | ||||
|
35 mg/m2 |
< 1,07 |
35 |
1 |
1 |
70 |
|
1,07 - 1,22 |
40 |
0 |
2 |
80 | |
|
1,23 - 1,37 |
45 |
3 |
0 |
90 | |
|
1,38 - 1,52 |
50 |
2 |
1 |
100 | |
|
1,53 - 1,68 |
55 |
1 |
2 |
110 | |
|
1,69 - 1,83 |
60 |
0 |
3 |
120 | |
|
1,84 - 1,98 |
65 |
3 |
1 |
130 | |
|
1,99 - 2,14 |
70 |
2 |
2 |
140 | |
|
2,15 - 2,29 |
75 |
1 |
3 |
150 | |
|
> 2,30 |
80 |
0 |
4 |
160 | |
Doporučené úpravy dávkování
Úpravy dávkování mohou být zapotřebí podle individuální bezpečnosti a snášenlivosti.
Jsou povoleny maximálně 3 snížení dávky na minimální hodnotu dávky 20 mg/m2 dvakrát denně. Zvýšení dávky není povoleno poté, co byla snížena.
V případě hematologické a/nebo nehematologické toxicity mají pacienti dodržovat kritéria pro přerušení dávkování, opětovné zahájení léčby a snížení dávky uvedená v tabulce 2, tabulce 3 a tabulce 4.
Tabulka 2 - Kritéria pro přerušení a opětovné zahájení dávkování pro hematologické toxicity
související s myelosupresí
|
Parametr |
Kritéria pro přerušení léčby |
Kritéria pro opětovné zahájení léčbya |
|
Neutrofily |
< 0,5 x 109/l |
> 1,5 x 109/l |
|
Trombocyty |
< 50 x 109/l |
> 75 x 109/l |
a Kritéria pro opětovné zahájení léčby platí pro začátek dalšího cyklu u všech pacientů bez ohledu na to, jestli byla splněna kritéria pro přerušení léčby nebo nikoli.
Tabulka 3 - Doporučené úpravy dávkování přípravku Lonsurf v případě hematologických a
nehematologických nežádoucích účinků
|
Nežádoucí účinek |
Doporučené úpravy dávkování |
|
• Febrilní neutropenie • CTCAE* neutropenie stupně 4 (< 0,5 x 109/l) nebo trombocytopenie stupně 4 (< 25 x 109/l), která způsobí zpoždění zahájení dalšího cyklu o více než 1 týden • CTCAE* nehematologické nežádoucí účinky stupně 3 nebo stupně 4, kromě nauzey a/nebo zvracení stupně 3 kontrolovaného antiemetickou terapií nebo průjmu odpovídajícího na léky proti průjmu. |
• Přerušte dávkování do zlepšení na stupeň 1 nebo do obnovení základního stavu. • Při opětovném zahájení léčby snižte dávku o 5 mg/m2 na dávku proti předchozímu dávkování (tabulka 4). • Je povoleno snížení dávky na minimální dávku 20 mg/m2 v jedné dávce podávanou dvakrát denně. • Nezvyšujte dávku poté, co byla snížena. |
* Standardní terminologická kritéria pro nežádoucí příhody
Tabulka 4 - Snižování dávky podle plochy povrchu těla (BSA)
|
Snížená dávka |
BSA (m2) |
Dávka v mg (2x denně) |
Počet tablet na dávku (2x denně) |
Celková denní dávka (mg) | |
|
15 mg |
20 mg | ||||
|
První stupeň snížení dávky: z 35 mg/m2 na 30 mg/m2 | |||||
|
30 mg/m2 |
< 1,09 |
30 |
2 |
0 |
60 |
|
1,09 - 1,24 |
35 |
1 |
1 |
70 | |
|
1,25 - 1,39 |
40 |
0 |
2 |
80 | |
|
1,40 - 1,54 |
45 |
3 |
0 |
90 | |
|
1,55 - 1,69 |
50 |
2 |
1 |
100 | |
|
1,70 - 1,94 |
55 |
1 |
2 |
110 | |
|
1,95 - 2,09 |
60 |
0 |
3 |
120 | |
|
2,10 - 2,28 |
65 |
3 |
1 |
130 | |
|
> 2,29 |
70 |
2 |
2 |
140 | |
|
Druhý stupeň snížení dávky: z 30 mg/m2 na 25 mg/m2 | |||||
|
25 mg/m2 |
< 1,10 |
25a |
2a |
1a |
50a |
|
1,10 - 1,29 |
30 |
2 |
0 |
60 | |
|
1,30 - 1,49 |
35 |
1 |
1 |
70 | |
|
1,50 - 1,69 |
40 |
0 |
2 |
80 | |
|
1,70 - 1,89 |
45 |
3 |
0 |
90 | |
|
1,90 - 2,09 |
50 |
2 |
1 |
100 | |
|
2,10 - 2,29 |
55 |
1 |
2 |
110 | |
|
> 2,30 |
60 |
0 |
3 |
120 | |
|
Třetí stupeň snížení dávky: z 25 mg/m2 na 20 mg/m2 | |||||
|
20 mg/m2 |
< 1,14 |
20 |
0 |
1 |
40 |
|
1,14 - 1,34 |
25a |
2a |
1a |
50a | |
|
1,35 - 1,59 |
30 |
2 |
0 |
60 | |
|
1,60 - 1,94 |
35 |
1 |
1 |
70 | |
|
1,95 - 2,09 |
40 |
0 |
2 |
80 | |
|
2,10 - 2,34 |
45 |
3 |
0 |
90 | |
|
> 2,35 |
50 |
2 |
1 |
100 |
a Při celkové denní dávce 50 mg má pacient užívat jednu 20 mg tabletu ráno a dvě 15 mg tablety večer.
Zvláštní populace
Porucha funkce ledvin
• Lehká porucha funkce ledvin (CrCl 60 až 89 ml/min) nebo středně těžká porucha funkce ledvin (CrCl 30 až 59 ml/min)
U pacientů s lehkou nebo středně těžkou poruchou funkce ledvin se nedoporučuje žádná úprava úvodní dávky (viz body 4.4 a 5.2).
• Těžká porucha funkce ledvin (CrCl nižší než 30 ml/min) nebo terminální stadium renálního onemocnění
Podávání přípravku se u pacientů s těžkou poruchou funkce ledvin nebo terminální stadiem renálního onemocnění nedoporučuje, neboť pro tyto pacienty nejsou dostupné žádné údaje (viz bod 4.4).
Porucha funkce jater
• Lehká porucha funkce jater
U pacientů s lehkou poruchou funkce jater se nedoporučuje žádná úprava úvodní dávky.
• Středně těžká nebo těžká porucha funkce jater
Podávání přípravku se u pacientů se středně těžkou nebo těžkou poruchou funkce jater nedoporučuje, neboť pro tyto pacienty nejsou dostupné žádné údaje (viz body 4.4 a 5.2).
Starší pacienti
U pacientů ve věku > 65 let není nutná žádná úprava dávkování (viz body 4.8, 5.1 a 5.2). U pacientů starších 75 let jsou údaje o bezpečnosti a účinnosti přípravku omezené.
Pediatrická populace
Použití přípravku Lonsurf u pediatrické populace není při indikaci metastazujícího kolorektálního karcinomu relevantní.
Rasa
Není nutná úprava úvodní dávky na základě rasové příslušnosti pacienta (viz body 5.1 a 5.2).
K dispozici jsou jen omezené údaje o přípravku Lonsurf u černošské populace/Afroameričanů, nicméně z biologického hlediska není důvod očekávat jakékoli rozdíly mezi touto podskupinou a celkovou populací.
Způsob podání
Přípravek Lonsurf je určen k perorálnímu podání. Tablety se musí užít se sklenicí vody do 1 hodiny po ranním a večerním jídle.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Útlum kostní dřeně
Přípravek Lonsurf zvyšoval incidenci myelosuprese včetně anémie, neutropenie, leukopenie a trombocytopenie.
Před zahájením terapie, a dále v intervalech potřebných k monitorování toxicity je nutno provádět vyšetření kompletního krevního obrazu, minimálně však před každým léčebným cyklem.
Léčba nesmí být zahájena, je-li absolutní počet neutrofilů < 1,5 x 109/l, počet trombocytů < 75 x 109/l, nebo pokud má pacient nevyřešenou klinicky významnou nehematologickou toxicitu stupně 3 nebo 4 z předchozí léčby.
Po léčbě přípravkem Lonsurf byly hlášeny závažné infekce (viz bod 4.8). Vzhledem k tomu, že většina případů byla hlášena v souvislosti s myelosupresí, stav pacienta je třeba pečlivě sledovat a, je-li to klinicky indikováno, mají být nasazena adekvátní opatření, jako antimikrobiální látky a faktor stimulující růst kolonie granulocytů (G-CSF). Ve studii RECOURSE dostávalo G-CSF 9,4 % pacientů ve skupině léčené přípravkem Lonsurf především k léčebnému užití.
Gastrointestinální toxicita
Přípravek Lonsurf způsobuje zvýšení incidence gastrointestinální toxicity včetně nauzey, zvracení a průjmu.
Pacienti s nauzeou, zvracením, průjmem a dalšími projevy gastrointestinální toxicity mají být pečlivě sledování a, je-li to klinicky indikováno, mají u nich být nasazena antiemetika, léky proti průjmu a další opatření, jako substituce tekutin/elektrolytů. Úpravy dávkování (odložení a/nebo snížení) se mají aplikovat tak, jak je třeba (viz bod 4.2).
Porucha funkce ledvin
Přípravek Lonsurf se nedoporučuje k použití u pacientů s těžkou poruchou funkce ledvin nebo terminálním stadiem onemocnění ledvin (s clearance kreatininu [CrCl] < 30 ml/min nebo vyžadujících dialýzu), jelikož přípravek Lonsurf nebyl u těchto pacientů hodnocen (viz bod 5.2).
Pacienti se středně těžkou poruchou funkce ledvin (CrCl = 30 až 59 ml/min) mají vyšší incidenci (definovanou jako rozdíl o nejméně 5 %) nežádoucích příhod (AE) stupně > 3, závažných AE a odložení a snížení dávky ve srovnání s pacienty s normální funkcí ledvin (CrCl > 90 ml/min) nebo lehkou poruchou funkce ledvin (CrCl = 60 až 89 ml/min). Kromě toho byla u pacientů se středně těžkou poruchou funkce ledvin pozorována vyšší expozice trifluridinu a tipiracilu ve srovnání s pacienty s normální funkcí ledvin nebo s pacienty s lehkou poruchou funkce ledvin (viz bod 5.2). Pacienti se středně těžkou poruchou funkce ledvin by měli být častěji monitorováni kvůli hematologické toxicitě.
Porucha funkce jater
Přípravek Lonsurf se nedoporučuje k použití u pacientů se středně těžkou nebo těžkou poruchou funkce jater (skupina C a D dle kritérií Národního institutu pro onkologická onemocnění (National Cancer Institute - NCI), jelikož přípravek Lonsurf nebyl u těchto pacientů hodnocen (viz bod 5.2).
Proteinurie
Doporučuje se sledovat proteinurii za pomoci diagnostického proužku pro analýzu moči před zahájením a během léčby (viz bod 4.8)
Intolerance laktosy
Přípravek Lonsurf obsahuje laktosu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným nedostatkem laktázy nebo malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
In vitro studie ukázaly, že trifluridin, tipiracil-hydrochlorid a 5-[trifluoromethyl]uracil (FTY) neinhibuje aktivitu isoforem lidského cytochromu P450 (CYP). Hodnocení in vitro ukazuje, že trifluridin a FTY nemají induktivní účinek na lidské CYP izoformy (viz bod 5.2). Induktivní účinek tipiracilu na lidské CYP izoformy nelze vyloučit.
In vitro studie ukázaly, že trifluridin je substrát pro nukleosidové transportéry CNT1, ENT1 a ENT2. Proto je vyžadována opatrnost, pokud se užívají léky, které tyto transportéry ovlivňují. Tipiracil-hydrochlorid byl substrátem pro OCT2 a MATE1, proto při souběžném podávání přípravku Lonsurf s inhibitory OCT2 nebo MATE1 může dojít ke zvýšení jeho koncentrace.
Opatrnosti je zapotřebí při používání léčivých přípravků, které jsou substráty lidské thymidin-kinázy, např. zidovudinu. Při souběžném podávání s přípravkem Lonsurf mohou tyto léčivé přípravky soutěžit s efektorem, trifluridinem, při aktivaci prostřednictvím thymidin-kináz. Proto je třeba při používání antivirotik, které jsou substráty lidské thymidin-kinázy, sledovat, jestli nedochází ke snížení účinnosti antivirotika, a zvážit přechod na jiné antivirotikum, které není substrátem pro lidskou thymidin-kinázu, např. lamivudin, zalcitabin, didanosin a abakavir (viz bod 5.1).
Není známo, jestli přípravek Lonsurf může snížit účinnost hormonálních kontraceptiv. Ženy používající hormonální kontraceptiva proto musí také používat bariérovou antikoncepční metodu.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku/Antikoncepce u mužů a žen
Na základě výsledků zjištěných u zvířat, trifluridin může způsobovat poškození plodu, pokud je podán těhotným ženám. Ženy by se měly chránit před otěhotněním v průběhu léčby přípravkem Lonsurf a ještě 6 měsíců po ukončení léčby. Proto ženy ve fertilním věku musí používat vysoce účinné antikoncepční metody, pokud užívají přípravek Lonsurf a ještě 6 měsíců po ukončení léčby.
V současné době není známo, zda přípravek Lonsurf může snižovat účinnost hormonální antikoncepce, proto by ženy užívající hormonální antikoncepci měly přidat bariérovou antikoncepční metodu.
Muži, kteří mají partnerku ve fertilním věku, musí používat účinnou antikoncepci v průběhu léčby a ještě 6 měsíců po ukončení léčby.
Údaje o podávání přípravku Lonsurf těhotným ženám nejsou k dispozici. Na základě mechanismu účinku trifluridinu je podezření, že způsobuje vrozené vady, pokud je podáván v těhotenství. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Přípravek Lonsurf lze v těhotenství použít pouze tehdy, když klinický stav ženy vyžaduje léčbu přípravkem Lonsurf.
Kojení
Není známo, zda se přípravek Lonsurf nebo jeho metabolity vylučují do lidského mateřského mléka. Studie na zvířatech prokázaly vylučování trifluridinu, tipiracil hydrochloridu a/nebo jejich metabolitů do mateřského mléka (viz bod 5.3). Riziko pro kojené dítě nelze vyloučit, proto by mělo být kojení během užívání přípravku Lonsurf přerušeno.
Fertilita
Nejsou k dispozici žádné údaje o vlivu přípravku Lonsurf na lidskou fertilitu. Výsledky studií na zvířatech neprokázaly účinek přípravku Lonsurf na ženskou ani mužskou fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Lonsurf má malý vliv na schopnost řídit a obsluhovat stroje. Během léčby může být pozorována únava, závratě nebo malátnost (viz bod 4.8.).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejzávažnějšími zaznamenanými nežádoucími účinky u pacientů užívajících přípravek Lonsurf jsou myelosuprese a gastrointestinální toxicita (viz bod 4.4).
Nejčastějšími zaznamenanými nežádoucími účinky (> 30 %) u pacientů užívajících přípravek Lonsurf jsou neutropenie (54 % [35 % > stupeň 3]), nauzea (39 % [1 % > stupeň 3]), únava (35 % [4 % > stupeň 3]), anémie (32 % [13 % > stupeň 3]) a leukopenie (31 % [12 % > stupeň 3]).
Nejčastějšími nežádoucími účinky u pacientů užívajících přípravek Lonsurf, které vedly k ukončení léčby, snížení dávky, odložení dávky nebo přerušení léčby byly neutropenie, celkové zhoršení zdravotního stavu, anémie, febrilní neutropenie, únava, průjem a dušnost.
Seznam nežádoucích účinků v tabulce
Nežádoucí účinky zaznamenané u 533 pacientů s metastazujícím kolorektálním karcinomem, kteří byli léčeni úvodní dávkou 35 mg/m2/dávku přípravku Lonsurf v placebem kontrolované klinické studii III. fáze (RECOURSE), ukazuje tabulka 5. Jsou klasifikovány podle třídy orgánových systémů (Systém Organ Class - SOC) a k popisu určitého účinku, jeho synonym a přidružených stavů se používá nejvhodnější termín MedDRA (Medical Dictionary for Regulatory).
Nežádoucí účinky jsou seskupeny dle četnosti výskytu. Skupiny četnosti jsou definovány podle následující konvence: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (>1/1000 až <
1/100).
V každé skupině četnosti jsou nežádoucí účinky řazeny podle klesající závažnosti.
Tabulka 5: Nežádoucí účinky hlášené u pacientů s metastazujícím kolorektálním karcinomem léčených přípravkem Lonsurf v klinické studii III. fáze (RECOURSE)
|
Třídy orgánových systémů (MedDRA)a |
Velmi časté |
Časté |
Méně časté |
|
Infekce a infestace |
Infekce dolních cest dýchacích Infekce horních cest dýchacích |
Septický šokb Střevní infekce Plicní infekce Infekce žlučových cest Chřipka Infekce močových cest Infekce dásní Herpes zoster Tinea pedis Kandidóza Bakteriální infekce Infekce |
|
Třídy orgánových systémů (MedDRA)a |
Velmi časté |
Časté |
Méně časté |
|
Novotvary benigní, maligní a nespecifikované (včetně cyst a polypů) |
Nádorová bolest | ||
|
Poruchy krve a lymfatického systému |
Neutropenie Leukopenie Trombocytopenie |
Febrilní neutropenie Lymfopenie Monocytóza |
Pancytopenie Granulocytopenie Monocytopenie Erytropenie Leukocytóza |
|
Poruchy metabolismu a výživy |
Snížená chuť k jídlu |
Hypalbuminémie |
Dehydratace Hyperglykémie Hyperkalémie Hypokalémie Hypofosfatémie Hypernatrémie Hyponatrémie Hypokalcémie Dna |
|
Psychiatrické poruchy |
Insomnie |
Úzkost | |
|
Poruchy nervového systému |
Dysgeuzie Periferní neuropatie Závrať Bolest hlavy |
Neurotoxicita Dysestézie Hyperestézie Hypestézie Synkopa Parestézie Pocit pálení Letargie | |
|
Poruchy oka |
Snížení zrakové ostrosti Rozostřené vidění Diplopie Katarakta Konjunktivitida Suché oči | ||
|
Poruchy ucha a labyrintu |
Ušní dyskomfort | ||
|
Srdeční poruchy |
Angina pectoris Palpitace | ||
|
Cévní poruchy |
Zčervenání |
Embolie Hypertenze | |
|
Respirační, hrudní a mediastinální poruchy |
Plicní embolie Pleurální výpotek Rinorea Dysfonie Orofaryngeální bolest Epistaxe |
|
Třídy orgánových systémů (MedDRA)a |
Velmi časté |
Časté |
Méně časté |
|
Gastrointestinální poruchy |
Bolest břicha Zácpa Stomatitida Orální poruchy |
Hemoragická enterokolitida Gastrointestinální krvácení Akutní pankreatitida Ascites Ileus Subileus Kolitida Gastritida Refluxní gastritida Ezofagitida Porucha vyprazdňování žaludku Abdominální distenze Anální zánět Ulcerace v ústech Dyspepsie Gastroesofageální refluxní nemoc Proktalgie Bukální polyp Krvácení dásní Glositida Periodontální nemoc Onemocnění zubu Říhání Flatulence Zápach z úst | |
|
Poruchy jater a žlučových cest |
Hyperbilirubinémie |
Hepatotoxicita Biliární dilatace | |
|
Poruchy kůže a podkožní tkáně |
Syndrom palmoplantární erytrodysestéziec Alopecie Pruritus Suchá kůže |
Olupování kůže Kopřivka Fotosenzitivní reakce Erytém Akné Hyperhidróza Puchýře Porucha nehtů | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Otok kloubů Artralgie Bolest kostí Myalgie Svalová a kosterní bolest Svalová slabost Svalové křeče Bolest končetin Pocit tíhy | ||
|
Poruchy ledvin a močových cest |
Proteinurie |
Renální selhání Neinfekční cystitida Porucha mikce Hematurie Leukocyturie | |
|
Poruchy reprodukčního systému a prsu |
Menstruační porucha |
|
Třídy orgánových systémů (MedDRA)a |
Velmi časté |
Časté |
Méně časté |
|
Celkové poruchy a reakce v místě aplikace |
Únava |
Pyrexie Edém Zánět sliznic Malátnost |
Zhoršení celkového tělesného zdravotního stavu Bolest Pocit změn tělesné teploty Xeróza |
|
Vyšetření |
Zvýšená hladina jaterních enzymů Zvýšená hladina alkalické fosfatázy v krvi Snížení tělesné hmotnosti |
Zvýšená hladina kreatininu v krvi Elektrokardiogram: prodloužený interval QT Zvýšení Mezinárodního normalizačního poměru (INR) Prodloužení aktivovaného parciálního tromboplastinového času Zvýšená hladina urey v krvi Zvýšená hladina laktát-dehydrogenázy v krvi Pokles celkové hladiny proteinů Vzestup C-reaktivního proteinu Pokles hematokritu |
a. Různé MedDRA preferované termíny, které byly považovány za klinicky podobné, byly sdruženy
do jednoho termínu.
b. Hlášeny byly i fatální případy.
c. Kožní reakce na rukou a nohou.
Starší pacienti
Pacienti ve věku 65 let a starší, kteří užívali přípravek Lonsurf, měli vyšší incidenci následujících příhod ve srovnání s pacienty mladšími než 65 let: neutropenie stupně 3 nebo 4 (48 % vs. 30 %), anémie stupně 3 (26 % vs. 12 %), leukopenie stupně 3 nebo 4 (26 % vs. 18 %) a trombocytopenie stupně 3 nebo 4 (9 % vs. 2 %).
Infekce
V klinické studii III. fáze (RECOURSE) se infekce související s léčbou vyskytla častěji u pacientů léčených přípravkem Lonsurf (5,6 %), v porovnání s těmi, kteří dostávali placebo (1,9 %).
Proteinurie
V klinické studii RECOURSE se proteinurie související s léčbou vyskytla častěji u pacientů léčených přípravkem Lonsurf (2,8 %), v porovnání s těmi, kteří dostávali placebo (1,5 %), u všech se vyskytl 1. nebo 2. stupeň závažnosti proteinurie (viz bod 4.4.).
Radioterapie
U pacientů, kteří dostávali předchozí radioterapii, byl mírně vyšší výskyt celkových hematologických nežádoucích účinků a nežádoucích účinků spojených s myelosupresí ve srovnání s pacienty bez předchozí radioterapie ve studii RECOURSE (54, 6 % vs. 49,2 %), významná febrilní neutropenie byla vyšší u pacientů užívajících přípravek Lonsurf, kteří dostali předchozí radioterapii ve srovnání s pacienty bez předchozí radioterapie.
Zkušenosti po uvedení na trh u pacientů s neresekovatelným pokročilým nebo rekurentním kolorektálním karcinomem
V Japonsku byly po registraci hlášeny případy intersticiálního plicního onemocnění u pacientů užívajících přípravek Lonsurf.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nejvyšší dávka přípravku Lonsurf podávaná v klinických studiích byla 180 mg/m2 denně.
Nežádoucí účinky hlášení ve spojitosti s předávkováním přípravku odpovídaly známému profilu bezpečnosti.
Primární očekávanou komplikací předávkování je útlum kostní dřeně.
Neexistuje známé antidotum při předávkování přípravkem Lonsurf.
Léčba předávkování má zahrnovat standardní terapeutická a podpůrná lékařská opatření zaměřená na korekci přítomných klinických projevů a prevenci jejich možných komplikací.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatika, antimetabolity, ATC kód: L01BC59 Mechanismus účinku
Přípravek Lonsurf obsahuje antineoplastický analog nukleosidů založený na thymidinu, trifluridin a inhibitor thymidin-fosforylázy (TPáza), tipiracil-hydrochlorid, v molárním poměru 1:0,5 (hmotnostní poměr, 1:0,471).
Po zachycení nádorovými buňkami je trifluridin fosforylován thymidin-kinázou, dále metabolizován v buňkách na substrát kyseliny deoxyribonukleové (DNA) a přímo inkorporován do DNA, čímž narušuje funkci DNA a brání proliferaci buněk.
Po perorálním podání je však trifluridin rychle rozkládán TPázou a ihned metabolizován efektem prvního průchodu, proto je do složení přidán inhibitor TPázy, tipiracil-hydrochlorid.
V neklinických studiích prokázal trifluridin/tipiracil-hydrochlorid protinádorovou aktivitu proti buněčným liniím kolorektálního karcinomu citlivým i rezistentním vůči 5-fluorouracilu (5-FU).
Cytotoxická aktivita kombinace trifluridin/tipiracil-hydrochlorid proti několika humánním nádorovým xenograftům vysoce korelovala s množstvím trifluridinu inkorporovaným do DNA, to naznačuje, že se jedná o primární mechanismus účinku.
Farmakodynamické účinky
Přípravek Lonsurf neměl žádný klinicky relevantní účinek na prodloužení QT/QTc v porovnání s placebem v otevřené studii u pacientů s pokročilými solidními nádory.
Klinická účinnost a bezpečnost
Klinická účinnost a bezpečnost přípravku Lonsurf byla hodnocena v mezinárodní, randomizované, dvojitě zaslepené, placebem kontrolované studii III. fáze (RECOURSE) u pacientů s dříve léčeným metastazujícím kolorektálním karcinomem. Primárním cílovým parametrem účinnosti bylo celkové přežití (OS) a podpůrným cílovým parametrem účinnosti bylo přežití bez progrese (PFS), celková míra odpovědí (ORR) a míra kontroly onemocnění (DCR).
Celkem bylo randomizováno 800 pacientů v poměru 2:1 k léčbě přípravkem Lonsurf (N = 534) současně s nejlepší podpůrnou péčí (BSC) nebo k podání placeba (N = 266) současně s BSC. Dávkování přípravku Lonsurf bylo založeno na BSA s úvodní dávkou 35 mg/m2/dávku.
Léčba ve studii byla podávána perorálně dvakrát denně po ranním a večerním jídle po dobu 5 dnů v týdnu s 2denní přestávkou bez léčby po dobu 2 týdnů, následovaných 14 dny bez léčby, což se opakovalo každé 4 týdny. Pacienti pokračovali v léčbě až do progrese onemocnění nebo nepřijatelné toxicity (viz bod 4.2).
Z 800 randomizovaných pacientů s mediánem věku 63 let bylo 61 % mužů, 58 % představovala evropská/bělošská populace, 35 % bylo Asiatů/Orientálců a 1 % černochů/Afroameričanů a všichni pacienti měli výchozí výkonnostní stav (PS) dle Eastern Cooperative Oncology Group (ECOG) 0 nebo 1. Primárním místem nemoci bylo tlusté střevo (62 %) nebo rektum (38 %). Stav genu KRAS byl nemutovaný (wild type) (49 %) nebo mutovaný (51 %) při vstupu do studie. Medián počtu předchozích linií léčby metastazujícího onemocnění byl 3. Všichni pacienti byli v minulosti léčeni chemoterapií založenou na fluoropyrimidinu, oxaliplatině a irinotekanu. Všichni pacienti kromě jednoho dostávali bevacizumab a všichni pacienti kromě dvou s nádory nemutovaného (wild type) onkogenu KRAS dostávali panitumumab nebo cetuximab. Obě léčebné skupiny byly srovnatelné z hlediska demografických a vstupních charakteristik onemocnění.
Analýza celkového přežití (OS) ve studii provedená dle plánu u 72 % (N = 574) příhod prokázala klinicky významný a statisticky signifikantní přínos pro přežití u přípravku Lonsurf plus BSC ve srovnání s placebem plus BSC (poměr rizik: 0,68; 95% interval spolehlivosti [CI] [0,58 až 0,81] ; p < 0,0001) s mediánem celkového přežití (OS) 7,1 měsíce vs. 5,3 měsíce a přežitím po jednom roce 26,6 % vs. 17,6 %. PFS se signifikantně zlepšilo u pacientů léčených přípravkem Lonsurf plus BSC (poměr rizik: 0,48; 95% CI [0,41 až 0,57]; p < 0,0001) (viz tabulka 6, obr. 1 a obr. 2).
Tabulka 6: Výsledky účinnosti z klinické studie III. fáze (RECOURSE)
|
Lonsurf plus BSC (N=534) |
Placebo plus BSC (N=266) | |
|
Celkové přežití | ||
|
Počet úmrtí, N (%) |
364 (68,2) |
210 (78,9) |
|
Medián OS (měsíců)3 [95% CI]b |
7,1 [6,5, 7,8] |
5,3 [4,6, 6,0] |
|
Poměr rizik [95% CI] |
0,68 [0,58, 0,81] | |
|
P-hodnotac |
< 0,0001 (jednostranná a dvoustranná) | |
|
Přežití bez progrese | ||
|
Počet progresí nebo úmrtí, N (%) |
472 (88,4) |
251 (94,4) |
|
Medián PFS (měsíců)a [95% CI]b |
2,0 [1,9, 2,1] |
1.7 [1,7, 1,8] |
|
Poměr rizik [95% CI] |
0,48 [0,41, 0,57] | |
|
P-hodnotac |
< 0,0001 (jednostranná a dvoustranná) | |
a Kaplan-Meierovy odhady b Metodika Brookmeyera a Crowleyho
c Stratifikovaný log-rank test (strata: KRAS status, čas od diagnózy do první metastázy, region)
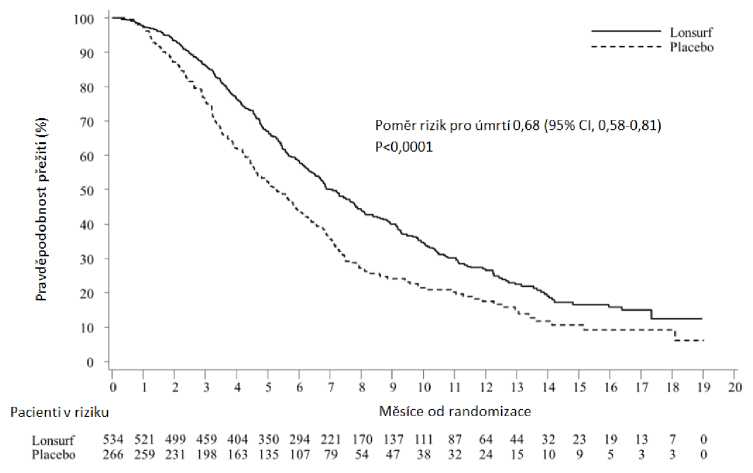
Obr. 2 - Kaplan-Meierovy křivky přežití bez progrese
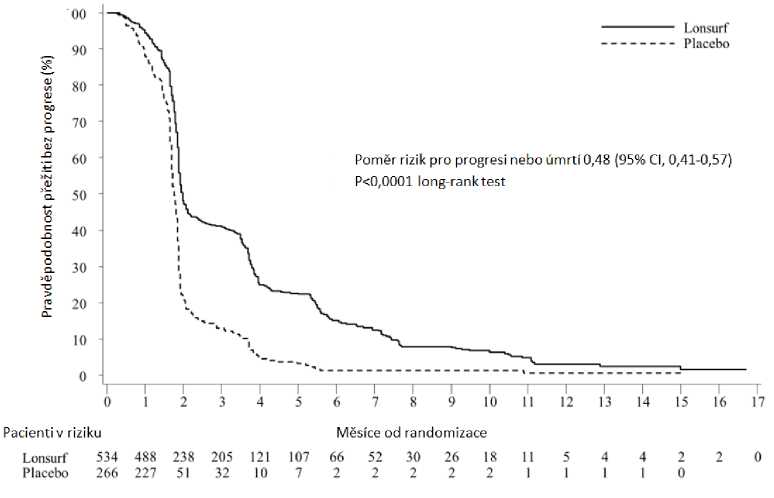
Aktualizovaná analýza celkového přežití provedená u 89 % (N = 712) příhod potvrdila klinicky významný a statisticky signifikantní přínos pro přežití u přípravku Lonsurf plus BSC ve srovnání s placebem plus BSC (poměr rizik: 0,69; 95% CI [0,59 až 0,81]; p < 0,0001) a medián OS 7,2 měsíce vs. 5.2 měsíce; procento přežití po 1 roce 27,1 % a 16,6 %.
Přínos pro OS a PFS byl pozorován konzistentně u všech relevantních, předem specifikovaných podskupin, včetně rasy, geografického regionu a věku (< 65; > 65), pohlaví, ECOG PS, KRAS statusu, času od diagnózy do první metastázy, počtu metastazujících míst a primárního místa nádoru.
Přínos přípravku Lonsurf pro přežití se uchoval po úpravě na všechny signifikantní prognostické faktory, zejména času od diagnózy do první metastázy, ECOG PS a počtu metastazujících míst (poměr rizik: 0,69; 95% CI [0,58 až 0,81]).
Šedesát jedna procent (61 %, N = 485) ze všech randomizovaných pacientů dostávalo fluoropyrimidin jako součást posledního léčebného režimu před randomizací, a z nich 455 (94 %) bylo v této době rezistentních vůči fluoropyrimidinu. U těchto pacientů se přínos přípravku Lonsurf pro OS uchoval (poměr rizik: 0,75, 95% CI [0,59 až 0,94]).
Osmnáct procent (18 %, N = 144) ze všech randomizovaných pacientů dostávalo regorafenib před randomizací. Přínos přípravku Lonsurf pro OS byl u těchto pacientů zachován (poměr rizik: 0,69, 95% CI [0,45 až 1,05]). Účinek se udržel i u pacientů dříve neléčených regorafenibem (poměr rizik: 0,69, 95% CI [0,57 až 0,83]).
DCR (kompletní odpověď nebo částečná odpověď nebo stabilizace onemocnění) byla signifikantně vyšší u pacientů léčených přípravkem Lonsurf (44 % vs. 16 %, p < 0,0001).
Léčba přípravkem Lonsurf plus BSC vedla ke statisticky signifikantnímu prodloužení PS <2 ve srovnání s placebem plus BSC. Střední doba do PS > 2 ve skupině léčené přípravkem Lonsurf byla 5,7 měsíce a ve skupině léčené placebem 4,0 měsíce, s poměrem rizik 0,66 (95% CI: [0,56, 0,78]), p < 0,0001.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Lonsurf u všech podskupin pediatrické populace v indikaci refrakterního metastazujícího kolorektálního karcinomu (informace o použití u dětí viz bod 4.2).
Starší pacienti
Existují omezené údaje u pacientů mezi 75-84 lety (N = 60). Pacienti starší 85 let se studie RECOURSE ani II. fáze japonské studie se neúčastnili. Účinek přípravku Lonsurf na celkové přežití byl podobný u pacientů < 65 let a > 65 let.
5.2 Farmakokinetické vlastnosti
Absorpce
Po perorálním podání přípravku Lonsurf s [14C]-trifluridinem se absorbovalo nejméně 57 % podaného trifluridinu a pouze 3 % dávky se vyloučila stolicí. Po perorálním podání přípravku Lonsurf s [14C]-tipiracil-hydrochloridem se absorbovalo nejméně 27 % podaného tipiracil-hydrochloridu a 50 % dávky celkové radioaktivity bylo zjištěno ve stolici, což nasvědčuje střední míře gastrointestinální absorpce tipiracil-hydrochloridu.
Po jednorázové dávce přípravku Lonsurf (35 mg/m2) u pacientů s pokročilými solidními nádory byla průměrná doba do dosažení vrcholové plazmatické koncentrace (tmax) asi 2 hodiny u trifluridinu a asi 3 hodiny u tipiracil-hydrochloridu.
Ve farmakokinetických (FK) analýzách podávání opakovaných dávek přípravku Lonsurf (35 mg/m2/dávku, dvakrát denně po dobu 5 dnů s 2denní přestávkou v léčbě během 2 týdnů, následovaných 14denním obdobím bez léčby, s opakováním každé 4 týdny) byla plocha pod křivkou koncentrace a času trifluridinu od času 0 do poslední měřitelné koncentrace (AUC0-last) přibližně 3* vyšší a maximální koncentrace (Cmax) byla přibližně 2* vyšší po podání opakovaných dávek (12. den 1. cyklu) přípravku Lonsurf než po jednorázové dávce (1. den 1. cyklu).
Nedocházelo však ke kumulaci tipiracil-hydrochloridu a další kumulaci trifluridinu v následných cyklech (12. den 2. a 3. cyklu) po podání přípravku Lonsurf. Po opakovaných dávkách přípravku Lonsurf (35 mg/m2/dávku dvakrát denně) u pacientů s pokročilými solidními nádory byla průměrná doba do dosažení vrcholové plazmatické koncentrace (tmax) asi 2 hodiny u trifluridinu a 3 hodiny u tipiracil-hydrochloridu.
Podíl tipiracil-hydrochloridu
Podání jednorázové dávky přípravku Lonsurf (35 mg/m2/dávku) zvýšilo průměrnou AUC0-iast trifluridinu 37* a Cmax 22* při snížení variability v porovnání se samotným trifluridinem (35 mg/m2/dávku).
Vliv jídla
Po podání přípravku Lonsurf v jednorázové dávce 35 mg/m2 14 pacientům se solidními nádory po standardizovaném jídle s vysokým obsahem tuku a vysokým kalorickým obsahem se plocha pod křivkou koncentrace a času (AUC) trifluridinu nezměnila, ale došlo ke snížení Cmax a AUC tipiracil-hydrochloridu přibližně o 40 % v porovnání s podáváním nalačno. V klinických studiích byl přípravek Lonsurf podáván do 1 hodiny po ranním a večerním jídle (viz bod 4.2).
Distribuce
Vazba trifluridinu na proteiny lidské krevní plazmy dosahovala více než 96 % a vázal se zejména na lidský sérový albumin. Vazba tipiracil-hydrochloridu na proteiny lidské krevní plazmy byla méně než 8 %. Po jednorázové dávce přípravku Lonsurf (35 mg/m2) u pacientů s pokročilými solidními nádory byl zdánlivý distribuční objem (Vd/F) trifluridinu 21 litrů a tipiracil-hydrochloridu 333 litrů.
Biotransformace
Trifluridin byl eliminován metabolismem prostřednictvím TPázy za vzniku inaktivního metabolitu, FTY. Absorbovaný trifluridin byl metabolizován a vyloučen močí jako FTY a glukuronidy trifluridinu. Zjištěny byly i další metabolity, a to 5-karboxyuracil a 5-karboxy-2’-deoxyuridin, ale jejich množství v plazmě a moči dosahovalo nízkých nebo stopových hladin.
Tipiracil-hydrochlorid nebyl metabolizován v lidských jaterních S9 nebo kryonizovaných lidských hepatocytech. Tipiracil-hydrochlorid byl hlavní složkou a 6-hydroxymethyluracil byl hlavním metabolitem v lidské plazmě, moči i stolici.
Eliminace
Po podání opakovaných dávek přípravku Lonsurf v doporučeném dávkovém režimu byl průměrný eliminační poločas (t1/2) trifluridinu 1. den prvního cyklu 1,4 hodiny a 12. den prvního cyklu 2,1 hodiny. Průměrné hodnoty tJ/2 tipiracil-hydrochloridu byly 1. den prvního cyklu 2,1 hodiny a 12. den prvního cyklu 2,4 hodiny.
Po jednorázové dávce přípravku Lonsurf (35 mg/m2) u pacientů s pokročilými solidními nádory byla perorální clearance (CL/F) trifluridinu a tipiracil-hydrochloridu 10,5 l/hod a 109 l/hod, v daném pořadí. Po jednorázovém perorálním podání přípravku Lonsurf s [14C]-trifluridinem byla celková kumulativní exkrece radioaktivity 60 % podané dávky. Většina získané radioaktivity byla eliminována močí (55 % dávky) během 24 hodin a exkrece stolicí a vydechovaným vzduchem byla méně než 3 % u obou. Po jednorázovém perorálním podání přípravku Lonsurf s [14C]-tipiracil-hydrochloridem byla získaná radioaktivita 77 % dávky a sestávala se z 27% exkrece močí a 50% exkrece stolicí.
Linearita/nelinearita
Ve studii zjišťující dávku (15 až 35 mg/m2 dvakrát denně) měla AUC od času 0 do 10 hodin (AUC0.J0) trifluridinu tendence k výraznějšímu vzestupu, než by bylo očekáváno na základě zvýšení dávky, nicméně perorální clearance (CL/F) a zdánlivý distribuční objem (Vd/F) trifluridinu byly obecně konstantní v dávkovém rozmezí 20 až 35 mg/m2. Ostatní expoziční parametry trifluridinu a tipiracil-hydrochloridu se zdály být úměrné dávce.
Farmakokinetika u zvláštních populací
Věk, pohlaví a rasa
Na základě populační FK analýzy nemá věk, pohlaví nebo rasa klinicky relevantní vliv na FK trifluridinu nebo tipiracil-hydrochloridu.
Porucha funkce ledvin
Z 533 pacientů ve studii RECOURSE, kteří dostávali přípravek Lonsurf, mělo 306 (57 %) pacientů normální renální funkci (CrCl > 90 ml/min), 178 (33 %) pacientů mělo lehkou poruchu funkce ledvin (CrCl 60 až 89 ml/min) a 47 (9 %) mělo středně těžkou poruchu funkce ledvin (CrCl 30 až 59 ml/min), údaje chyběly od dvou pacientů. Pacienti s těžkou poruchou funkce ledvin nebyli do studie zařazováni.
Na základě populační FK analýzy byla expozice přípravku Lonsurf u pacientů s lehkou poruchou funkce ledvin (CrCl = 60 až 89 ml/min) podobná jako u pacientů s normální funkcí ledvin (CrCl > 90ml/min). Vyšší expozice přípravku Lonsurf byla pozorována u středně těžké poruchy funkce ledvin (CrCl = 30 až 59 ml/min). Odhadovaná clearance kreatininu (CrCl) byla signifikantním kovariátem pro CL/F u obou finálních modelů trifluridinu a tipiracil-hydrochloridu. Průměrný relativní poměr AUC u pacientů s lehkou (n=38) a středně těžkou (n=16) poruchou funkce ledvin v porovnání s pacienty s normální funkcí ledvin (n=84) byl 1,31 a 1,43 pro trifluridin, a 1,34 a 1,65 pro tipiracil-hydrochlorid. FK trifluridinu a tipiracil-hydrochloridu nebyla studována u pacientů s těžkou poruchou funkce ledvin nebo terminálním stadiem renálního onemocnění (viz bod 4.4).
Porucha funkce jater
Na základě populační FK analýzy nebyly parametry funkce jater včetně alkalické fosfatázy (ALP, 362322 U/l) aspartátaminotransferázy (AST, 11-197 U/l), alaninaminotransferázy (ALT, 5-182 U/l) a celkového bilirubinu (0,17-3,20 mg/dl) signifikantními kovariáty pro FK parametry trifluridinu nebo tipiracil-hydrochloridu. FK trifluridinu a tipiracil-hydrochloridu nebyla studována u pacientů se středně těžkou nebo těžkou poruchou funkce jater (skupina C a D dle kritérií NCI) (viz bod 4.4). Bylo zjištěno, že sérový albumin významně ovlivní clearance trifuridinu s negativní korelací. Pro nízké hodnoty albuminu v rozmezí od 2,2 do 3,5 g/dl, odpovídají hodnoty clearance v rozmezí od 4,2 do 3,1 l/h.
Gastrektomie
Vliv gastrektomie na FK parametry nebylo možné vyšetřit v populační FK analýze, protože gastrektomii podstoupilo jen málo pacientů (celkem 1 %).
Studie interakcí in vitro
Trifluridin je substrátem TPázy, není však metabolizován cytochromem P450 (CYP). Tipiracil-hydrochlorid není metabolizován lidskými jaterními S9 nebo kryonizovanými hepatocyty.
In vitro studie ukázaly, že trifluridin, tipiracil-hydrochlorid a FTY (inaktivní metabolit trifluridinu) neinhiboval testované isoformy CYP (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 a CYP3A4/5). In vitro hodnocení ukázalo, že trifluridin, a FTY neměly indukční účinek na lidský CYP1A2, CYP2B6 nebo CYP3A4/5. Tudíž se neočekává, že by trifluridin způsoboval nebo podléhal signifikantním interakcím s léčivými přípravky zprostředkované CYP. Induktivní účinek tipiracilu na lidské CYP izoformy nelze vyloučit.
In vitro hodnocení trifluridinu a tipiracil-hydrochloridu bylo prováděno za použití lidských transportérů vychytávání a efluxu (trifluridin s MDR1, OATP1B1, OATP1B3 a BCRP; tipiracil-hydrochlorid s OAT1, OAT3, OCT2, MATE1, MDR1 a BCRP). Trifluridin ani tipiracil-hydrochlorid nebyly inhibitory nebo substráty pro lidské transportéry vychytávání a efluxu v in vitro studiích, kromě OCT2 a MATE1. Tipiracil-hydrochlorid byl inhibitorem OCT2 a MATE1 in vitro, ale při koncentracích významně vyšších než Cmax v lidské plazmě v ustáleném stavu. Je proto nepravděpodobné, že by docházelo k interakcím s jinými léčivými přípravky v doporučených dávkách z důvodu inhibice OCT2 a MATE1. Transport tipiracil-hydrochloridu prostřednictvím OCT2 a MATE1 může být ovlivněn, je-li přípravek Lonsurf podáván souběžně s inhibitory OCT2 a MATE1.
Farmakokinetickv/farmakodvnamickv vztah
Účinnost a bezpečnost přípravku Lonsurf byla porovnána mezi skupinou s vysokou expozicí (>medián) a skupinou s nízkou expozicí (<medián) na základě hodnoty mediánu AUC trifluridinu. Více příznivý OS se objevil ve skupině s vysokou hodnotou AUC v porovnání se skupinou s nízkou hodnotou AUC (medián OS z 9,3 vs. 8,1 měsíce). Všechny AUC skupiny dosahovaly lepších výsledků než placebo po celou dobu sledovaného období. Incidence neutropenie stupně >3 byla vyšší u skupiny s vysokou hodnotou AUC trifluridinu (47,8 %) v porovnání se skupinou s nízkou hodnotou AUC trifluridinu (30, 4 %).
5.3 Předklinické údaje vztahující se k bezpečnosti
Toxicita opakovaných dávek
Toxikologické hodnocení trifluridinu/tipiracil-hydrochloridu bylo provedeno na potkanech, psech a opicích. Zjištěnými cílovými orgány byly lymfatický a hematopoetický systém a gastrointestinální trakt. Všechny změny, tj. leukopenie, anémie, hypoplázie kostní dřeně a atrofické změny v lymfatické a hematopoetické tkáni a gastrointestinálním traktu byly reverzibilní během 9 týdnů po vysazení léčby. Na zubech potkanů léčených kombinací trifluridin/tipiracil-hydrochlorid bylo pozorováno zbělení, lámání a malokluze, tyto účinky jsou považovány za typické pro daný druh a nerelevantní pro člověka.
Kancerogeneze a mutageneze
Dlouhodobé studie hodnotící kancerogenní potenciál trifluridinu/tipiracil-hydrochloridu u zvířat nebyly provedeny. Při testu reverzních mutací u baktérií, testu chromozomálních aberací na kulturách savčích buněk a mikronukleárním testu u myší bylo zjištěno, že trifluridin je genotoxický. Proto je s přípravkem Lonsurf třeba nakládat jako s potenciálním kancerogenem.
Reprodukční toxicita
Výsledky studií na zvířatech neukázaly vliv trifluridinu a tipiracil-hydrochloridu na fertilitu samců a samic potkanů. Zvýšení počtu žlutého tělíska a počtu implantovaných embryí pozorované u samic potkanů ve vysokých dávkách nebylo považováno za nežádoucí (viz bod 4.6). Bylo zjištěno, že přípravek Lonsurf způsobuje embryofetální letalitu a embryofetální toxicitu u březích potkanů při podávání v dávkách nižších než při klinické expozici. Studie peri/postnatální vývojové toxicity nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Jádro tablety
Monohydrát laktosy Předbobtnalý kukuřičný škrob Kyselina stearová
Potahová vrstva
Lonsurf 15 mg/6,14 mg potahované tablety
Hypromelosa
Makrogol 8000
Oxid titaničitý (E171)
Magnesium-stearát
Lonsurf 20 mg/8,19 mg potahované tablety
Hypromelosa
Makrogol 8000
Oxid titaničitý (E171)
Červený oxid železitý (E172)
Magnesium-stearát
Inkoust na potisku
Šelak
Červený oxid železitý (E172)
Žlutý oxid železitý (E172)
Oxid titaničitý (E171)
Hlinitý lak indigokarmínu (E132)
Karnaubský vosk Mastek
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
30 měsíců
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Aluminium/Aluminium blistr s vrstvou vysoušedla (oxid vápenatý) obsahující 10 tablet. Balení obsahuje 20, 40 nebo 60 potahovaných tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Po manipulaci s tabletami je nutno umýt si ruce.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Les Laboratoires Servier 50 rue Carnot 92284 Suresnes Cedex Francie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/16/1096/001-006
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
10. DATUM REVIZE TEXTU MM/RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
AndersonBrecon (UK) Limited, (Trading as PCI)
Units 2-7, Wye Valley Business Park Brecon Road, Hay-on-Wye,
Hereford HR3 5PG Velké Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl.
107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Lonsurf 15 mg/6,14 mg potahované tablety trifluridinum/tipiracilum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna potahovaná tableta obsahuje trifluridinum 15 mg a tipiracilum 6,14 mg (jako tipiracili hydrochloridum).
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje monohydrát laktosy, více informací viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
20 potahovaných tablet 40 potahovaných tablet 60 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Cytotoxický
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Les Laboratoires Servier 50 rue Carnot 92284 Suresnes Cedex Francie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/16/1096/001 20 potahovaných tablet EU/1/16/1096/002 40 potahovaných tablet EU/1/16/1096/003 60 potahovaných tablet
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Lonsurf 15 mg/6,14 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Lonsurf 15 mg/6,14 mg tablety trifluridinum/tipiracilum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Les Laboratoires Servier
3. POUŽITELNOST
EXP
4. ČÍSLO SARZE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Lonsurf 20 mg/8,19 mg potahované tablety trifluridinum/tipiracilum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna potahovaná tableta obsahuje trifluridinum 20 mg a tipiracilum 8,19 mg (jako tipiracili hydrochloridum).
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje monohydrát laktosy, více informací viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
20 potahovaných tablet 40 potahovaných tablet 60 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Cytotoxický
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Les Laboratoires Servier 50 rue Carnot 92284 Suresnes Cedex Francie
12. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/16/1096/004 20 potahovaných tablet EU/1/16/1096/005 40 potahovaných tablet EU/1/16/1096/006 60 potahovaných tablet
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Lonsurf 20 mg/8,19 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Lonsurf 20 mg/8,19 mg tablety trifluridinum/tipiracilum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Les Laboratoires Servier
3. POUŽITELNOST
EXP
4. ČÍSLO SARZE
Lot
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Lonsurf 15 mg/6,14 mg potahované tablety Lonsurf 20 mg/8,19 mg potahované tablety
trifluridinum/tipiracilum
▼ Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Lonsurf a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Lonsurf užívat
3. Jak se přípravek Lonsurf užívá
4. Možné nežádoucí účinky
5 Jak přípravek Lonsurf uchovávat
6. Obsah balení a další informace
1. Co je přípravek Lonsurf a k čemu se používá
Přípravek Lonsurf je druhem protinádorové chemoterapie, který patří do skupiny přípravků nazývaných „cytostatické antimetabolické léky“.
Přípravek Lonsurf obsahuje dvě různé léčivé látky: trifluridin a tipiracil.
• Trifluridin zabraňuje růstu rakovinné buňky
• Tipiracil brání rozkladu trifluridinu v těle, pomáhá trifluridinu pracovat déle.
Přípravek Lonsurf se používá k léčbě dospělých s rakovinou tlustého střeva nebo konečníku - také nazývanou kolorektální karcinom.
• Používá se, když se rakovina rozšíří do jiných částí těla.
• Používá se, když jiné způsoby léčby neúčinkují - nebo pokud pro Vás jiné způsoby léčby nej sou vhodné.
2. Čemu musíte věnovat pozornost, než začnete přípravek Lonsurf užívat Neužívejte přípravek Lonsurf:
• jestliže jste alergický(á) na trifluridin nebo tipiracil nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Neužívejte přípravek Lonsurf, jestliže se Vás týká informace uvedena výše. Pokud si nejste jistý(á), před užíváním přípravku Lonsurf se poraďte se svým lékařem.
Upozornění a opatření
Před užitím přípravku Lonsurf se poraďte se svým lékařem nebo lékárníkem, jestliže:
• máte problémy s ledvinami
• máte problémy s j átry
Pokud si nejste jistý(á), před užíváním přípravku Lonsurf se poraďte se svým lékařem nebo lékárníkem.
Léčba může vést k následujícím nežádoucím účinkům (viz bod 4):
• snížení počtu určitých typů bílých krvinek (neutropenie), které jsou důležité pro ochranu těla proti bakteriím nebo plísňovým infekcím. V důsledku neutropenie se může vyskytnout horečka (febrilní neutropenie) a infekce krve (septický šok)
• snížení počtu červených krvinek (anémie)
• snížení počtu krevních destiček v krvi (trombocytopenie), které jsou důležité pro zastavení krvácení a to tak, že shlukují a sráží krev poraněných cév
• gastrointestinální problémy (týkající se žaludku a střev).
Testy a vyšetření
Lékař Vám před každým cyklem léčby přípravkem Lonsurf provede krevní testy. Nový cyklus zahájíte každé 4 týdny. Tyto testy jsou nutné, neboť přípravek Lonsurf může někdy ovlivnit Vaše krevní buňky.
Děti a dospívající
Tento lék není určen pro děti a dospívající do 18 let. Nemusí u nich totiž působit nebo být bezpečný. Další léčivé přípravky a přípravek Lonsurf
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval/a nebo které možná budete užívat. Týká se to i léků volně prodejných a rostlinných léků. Přípravek Lonsurf totiž může ovlivnit působení jiných léků. Některé léky zase mohou ovlivnit působení přípravku Lonsurf.
Zejména sdělte svému lékaři nebo lékárnikovi, jestliže užíváte některé léky k léčbě HIV infekce, např. zidovudin. Zidovudin totiž může mít slabší účinek, pokud současně užíváte přípravek Lonsurf.
Poraďte se s lékařem, jestli nemáte přejít na jiný lék k léčbě HIV.
Pokud se Vás cokoli z uvedeného týká (nebo pokud si nejste jistý(á)), před užíváním přípravku Lonsurf se poraďte se svým lékařem nebo lékárníkem.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Přípravek Lonsurf může poškodit Vaše nenarozené dítě. Jestliže otěhotníte, společně se svým lékařem budete muset rozhodnout, jestli přínos přípravku Lonsurf je vyšší než riziko poškození dítěte.
Jestliže užíváte přípravek Lonsurf, nesmíte kojit, neboť není známo, jestli přípravek Lonsurf přechází do mateřského mléka.
Ochrana proti početí
Během užívání tohoto přípravku nesmíte otěhotnět. Může totiž poškodit Vaše nenarozené dítě.
Je nutné, abyste během užívání tohoto přípravku Vy a Váš partner užívali spolehlivé metody ochrany proti početí. V používání ochrany proti početí je nutné pokračovat ještě 6 měsíců po ukončení léčby tímto přípravkem. Pokud v této době otěhotníte nebo otěhotní Vaše partnerka, je nutné, abyste o tom neprodleně informoval(a) svého lékaře nebo lékárníka.
Řízení dopravních prostředků a obsluha strojů
Není známo, zda přípravek Lonsurf ovlivňuje schopnost řídit nebo obsluhovat stroje. Neřiďte ani neobsluhujte žádné přístroje nebo stroje, pokud se u Vás objeví příznaky, které ovlivní Vaši schopnost soustředit se a reagovat.
Přípravek Lonsurf obsahuje laktosu
Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Jaká dávka se užívá
• Váš lékař určí dávku, která je pro Vás vhodná - dávka závisí na Vaší tělesné hmotnosti a výšce.
• Lékař Vám sdělí, kolik tablet máte kdy užívat.
• Dávku budete užívat dvakrát denně.
Jak se přípravek užívá
Přípravek Lonsurf budete užívat 10 dnů během prvních 2 týdnů, a poté budete mít 2 týdny bez léčby. Tomu se říká cyklus. Rozpis dávkování je následující:
• 1. týden
- užívejte 2 dávky denně po dobu 5 dnů
- poté následují 2 dny bez léčby
• 2. týden
- užívejte 2 dávky denně po dobu 5 dnů
- poté následují 2 dny bez léčby
• 3. týden
- žádná léčba
• 4. týden
- žádná léčba
Poté zahájíte další 4týdenní cyklus podle výše uvedeného postupu.
Přípravek Lonsurf je dostupný ve dvou silách. Lékař Vám může pro předepsanou dávku předepsat obě síly.
Způsob použití přípravku
• Tento přípravek se užívá ústy.
• Tablety polykejte celé a zapijte je sklenicí vody.
• Tablety užívejte do 1 hodiny po ranním a večerním jídle.
• Po zacházení s přípravkem si umyjte ruce.
Jestliže jste užil(a) více přípravku Lonsurf, než jste měl(a)
Jestliže jste užil(a) více přípravku Lonsurf, než jste měl(a), poraďte se s lékařem nebo ihned jděte do nemocnice. Vezměte s sebou Vaše balení přípravku.
Jestliže jste zapomněl(a) užít přípravek Lonsurf
• Jestliže si zapomenete vzít dávku, poraďte se se svým lékařem nebo lékárníkem.
• Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Při užívání tohoto přípravku se mohou vyskytnout následující nežádoucí účinky:
T-W r V r Vil r r v» 1
Závažné nežádoucí účinky
Ihned informujte svého lékaře, jestliže zaznamenáte kterýkoli z následujících závažných nežádoucích účinků (mnoho nežádoucích účinků bylo prokázáno při laboratorních vyšetřeních, např. ty které ovlivňují krevní buňky):
• Neutropenie (snížený počet bílých krvinek) (velmi časté), febrilní neutropie (časté) a septický šok (méně časté). K projevům patří zimnice, horečka, pocení nebo jiné známky infekce (viz bod 2).
• Anémie (snížený počet červených krvinek) (velmi časté). K projevům patří pocit dušnosti, únava nebo bledost kůže (viz bod 2).
• Zvracení (velmi časté) a průjem (velmi časté), pokud jsou tyto projevy závažné nebo přetrvávají delší dobu, mohou vést k dehydrataci (nedostatek tekutin v těle).
• Závažné gastrointestální problémy: bolest břicha (časté), hromadění tekutiny v břiše (méně časté), zánět tlustého střeva (méně časté), akutní zánět slinivky břišní (méně časté), střevní neprůchodnost (méně časté) a částečná střevní neprůchodnost (méně časté). K projevům patří silná bolest žaludku nebo bolest břicha, které mohou být spojeny se zvracením, částečnou nebo úplnou zácpou, horečkou nebo otokem břicha.
• Trombocytopenie (snížený počet krevních destiček) (velmi časté). K projevům patří neobvyklá tvorba modřin nebo krvácení (viz bod 2).
• Plicní embolie (méně časté): krevní sraženiny v plicích. K projevům patří dušnost a bolest na hrudi nebo bolest nohou.
Některé z těchto závažných nežádoucích účinků mohou vést k úmrtí.
Další nežádoucí účinky
Informujte svého lékaře, pokud zaznamenáte kterýkoli z uvedených nežádoucích účinků. Mnohé z nežádoucích účinků jsou zjištěny při laboratorních vyšetřeních - např. ty, které ovlivňují krevní buňky. Lékař bude sledovat výskyt těchto nežádoucích účinků ve výsledcích Vašich testů.
Velmi časté: mohou postihnout více než 1 z 10 pacientů:
• snížení chuti k jídlu
• pocit velké únavy
• nevolnost (pocit na zvracení)
• snížený počet bílých krvinek nazývaných „leukocyty“ - což může zvýšit riziko infekce
Časté: mohou postihnout až 1 z 10 pacientů:
• horečka
• vypadávání vlasů
• snížení tělesné hmotnosti
• změny chuti
• zácpa
• závrať, bolest hlavy
• malátnost
• nízké hladiny albuminu nebo celkové bílkoviny v krvi
• zvýšená hladina bilirubinu v krvi - což může způsobit zežloutnutí kůže nebo očí
• zvýšený počet bílých krvinek nazývaných „monocyty“
• snížený počet bílých krvinek nazývaných „lymfocyty“ - což může zvýšit riziko infekce
• otok rukou, nohou nebo chodidel
• zčervenání, otok a bolest dlaní a chodidel („syndrom ruka-noha“)
• pocit necitlivosti nebo mravenčení v rukou nebo nohou
• bolest nebo obtíže v ústech,
• otok sliznic - např. uvnitř nosu, úst, krku, v očích, pochvě, plicích nebo ve střevě
• vze stup j aterních enzymů
• bílkovina v moči
• vyrážka, svědění nebo olupování kůže, zčervenání kůže
• kašel, dušnost, infekce nosních dutin, krku, dýchacích cest nebo plic, hrudní infekce
problémy se spaním nebo usínáním
Méně časté: mohou postihnout až 1 ze 100 pacientů
• nízký nebo vysoký krevní tlak
• krevní sraženiny, např. v mozku nebo v nohách
• výsledky krevních testů prokazující problémy se srážlivostí, kvůli kterým můžete snadněji krvácet
• bušení srdce, bolest na hrudi
• neobvyklé zvýšení nebo snížení srdečního tepu
• změny na záznamu srdeční aktivity (EKG - elektrokardiogram)
• zvýšený počet bílých krvinek
• zvýšení hladiny laktátdehydrogenázy ve Vaší krvi
• nízké hladiny fosfátů, sodíku, draslíku nebo vápníku ve Vaší krvi
• snížený počet bílých krvinek nazývaných „granulocyty“ nebo „monocyty“ - což může zvýšit riziko infekce
• vysoká hladina cukru (hyperglykémie), zvýšená hladina solí, močoviny, kreatininu a draslíku v krvi
• výsledky krevních testů prokazující zánět (zvýšení C reaktivního proteinu)
• bolest ucha
• pocit točení hlavy (závrať)
• rýma nebo krvácení z nosu, problémy s nosními dutinami
• bolest v krku, chrapot, problémy s hlasem
• zčervenání, svědění očí, oční infekce, slzení očí
• suchost očí
• zrakové problémy jako rozostřené vidění, dvojité vidění, zhoršené vidění, šedý zákal
• dehydratace (nedostatek tekutin v těle)
• nadýmání, plynatost, zažívací obtíže
• bolest nebo zánět v horní nebo dolní části trávicího traktu
• zánět, otok nebo krvácení ve střevě
• zánět střeva a střevní infekce
• zánět nebo zvýšený obsah kyseliny v žaludku nebo jícnu, reflux (zpětný tok kyselého žaludečního obsahu do jícnu)
• bolestivý jazyk, polypy v ústní dutině, vředy v ústní dutině, říhání
• zápach z úst, zubní kaz, problémy se zuby nebo dásněmi, krvácení dásní, infekce dásní
• suchost kůže
• otok nebo bolest kloubů nebo palců
• bolest nebo pocit tíhy rukou nebo nohou
• bolest včetně nádorové bolesti
• bolest kostí, bolest svalů, svalová slabost nebo křeče, bolest šlach, nervů nebo vazů
• pocit zimy
• opar (bolest a puchýřovitá vyrážka na kůži podél nervových cest způsobená zánětem nervů v důsledku viru herpes zoster)
• porucha jater
• zánět nebo infekce žlučových cest, zvětšení průměru žlučovodu
• selhání ledvin
• infekce: bakteriální, virové nebo plísňové
• zánět nebo infekce močového měchýře
• změny ve vyšetření moči, krev v moči
• problémy s močením (zadržování moči), ztráta kontroly močového měchýře (inkontinence)
• atletická noha - plísňová infekce nohou, kvasinkové infekce
• hromadění tekutiny v plicích
• změny menstruačního cyklu
• úzkost
• mdloby
• pocit pálení, nepříjemné, zvýšené pocity nebo ztráta vnímání hmatu a jiné nezávažné neurologické potíže
• vystupující svědivá vyrážka, zčervenání kůže, puchýře, olupování kůže, kopřivka, akné
• neobvykle zvýšené pocení, citlivost na světlo, problémy s nehty
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Lonsurf uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a blistru za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Lonsurf obsahuje
Přípravek Lonsurf 15 mg, tableta
• Léčivými látkami jsou trifluridinum a tipiracilum. Jedna tableta obsahuje trifluridinum 15 mg a tipiracilum 6,14 mg.
• Pomocnými látkami jsou:
- Jádro tablety: monohydrát laktosy, předbobtnalý kukuřičný škrob, kyselina stearová.
- Potah tablety: hypromelosa, makrogol 8000, oxid titaničitý (E171), magnesium-stearát.
- Inkoust na potisku: šelak, červený oxid železitý (E172), žlutý oxid železitý (E172), oxid titaničitý (E171), hlinitý lak indigokarmínu (E132), karnaubský vosk, mastek.
Přípravek Lonsurf 20 mg, tableta
• Léčivými látkami jsou trifluridinum a tipiracilum. Jedna tableta obsahuje trifluridinum 20 mg a tipiracilum 8,19 mg.
• Pomocnými látkami jsou:
- Jádro tablety: monohydrát laktosy, předbobtnalý kukuřičný škrob, kyselina stearová.
- Potah tablety: hypromelosa, makrogol 8000, oxid titaničitý (E171), červený oxid železitý (E172), magnesium-stearát.
- Inkoust na potisku: šelak, červený oxid železitý (E172), žlutý oxid železitý (E172), oxid titaničitý (E171), hlinitý lak indigokarmínu (E132), karnaubský vosk, mastek.
Jak přípravek Lonsurf vypadá a co obsahuje toto balení
Lonsurf 15 mg je bílá, bikonvexní, kulatá potahovaná tableta s šedým potiskem „15“ na jedné straně a „102“ a „15 mg“ na druhé straně.
Lonsurf 20 mg je světle červená, bikonvexní, kulatá potahovaná tableta s šedým potiskem „20“ na jedné straně a „102“ a „20 mg“ na druhé straně.
Balení obsahuje 20 potahovaných tablet (2 blistry po 10 tabletách) nebo 40 potahovaných tablet (4 blistry po 10 tabletách) nebo 60 potahovaných tablet (6 blistrů po 10 tabletách).
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Les Laboratoires Servier 50 rue Carnot 92284 Suresnes Cedex Francie
Výrobce
AndersonBrecon (UK) Limited, (Trading as PCI)
Units 2-7, Wye Valley Business Park Brecon Road, Hay-on-Wye,
Hereford HR3 5PG Velká Británie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien S.A. Servier Benelux N.V. Tel: +32 (0)2 529 43 11 |
Lietuva UAB “SERVIER PHARMA” Tel: +370 (5) 2 63 86 28 |
|
BtnrapHH CepBue MeguKaa EOOfl Ten.: +359 2 921 57 00 |
Luxembourg/Luxemburg S.A. Servier Benelux N.V. Tel: +32 (0)2 529 43 11 |
|
Česká republika Servier s.r.o. Tel: +420 222 118 111 |
Magyarország Servier Hungaria Kft. Tel: +36 1 238 7799 |
|
Danmark Servier Danmark A/S Tlf: +45 36 44 22 60 |
Malta GALEPHARMA Ltd Tel: +(356) 21 247 082 |
|
Deutschland Servier Deutschland GmbH Tel: +49 (0)89 57095 01 |
Nederland Servier Nederland Farma B.V. Tel: +31 (0)71 5246700 |
|
Eesti Servier Laboratories OU Tel:+ 372 664 5040 |
Norge Servier Danmark A/S Tlf: +45 36 44 22 60 |
|
EXlába IEPBIE EAAAI OAPMAKEYTIKH EnE TpA,: +30 210 939 1000 |
Osterreich Servier Austria GmbH Tel: +43 (1) 524 39 99 |
|
Espaňa Laboratorios Servier S.L. Tel: +34 91 748 96 30 |
Polska Servier Polska Sp. z o.o. Tel: +48 (0) 22 594 90 00 |
|
France Les Laboratoires Servier |
Portugal Servier Portugal, Lda |
|
Tel: +33 (0)1 55 72 60 00 |
Tel.: +351 21 312 20 00 |
|
Hrvatska |
Románia |
|
Servier Pharma, d. o. o. |
Servier Pharma SRL |
|
Tel.: +385 (0)1 3016 222 |
Tel: +4 021 528 52 80 |
|
Ireland |
Slovenija |
|
Servier Laboratories (Ireland) Ltd. |
Servier Pharma d. o. o. |
|
Tel: +353 (0)1 663 8110 |
Tel.: +386 (0)1 563 48 11 |
|
Ísland |
Slovenská republika |
|
Servier Laboratories |
Servier Slovensko spol. s r.o. |
|
c/o Icepharma hf Sími: +354 540 8000 |
Tel.:+421 (0) 2 5920 41 11 |
|
Italia |
Suomi/Finland |
|
Servier Italia S.p.A. |
Servier Finland Oy |
|
Tel: +39 06 669081 |
P. /Tel: +358 (0)9 279 80 80 |
|
Kónpoq |
Sverige |
|
C.A. Papaellinas Ltd. |
Servier Sverige AB |
|
TpT.: +357 22741741 |
Tel : +46 (0)8 522 508 00 |
|
Latvija |
United Kingdom |
|
SIA Servier Latvia |
Servier Laboratories Ltd |
|
Tel: +371 67502039 |
Tel: +44 (0)1753 666409 |
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
39