Liprolog Mix25 100 Iu/Ml Kwikpen
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Liprolog 100 IU/ml, injekční roztok v injekční lahvičce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog je sterilní, čirý, bezbarvý vodný roztok.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli). Jeden obal obsahuje 10 ml, což odpovídá 1 000 U insulinum lisprum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog je určen k léčbě dospělých a dětí s diabetem mellitus, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Rovněž je indikován k iniciální stabilizaci diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem, v souladu s potřebami pacienta.
Liprolog může být podán krátce před jídlem nebo po jídle. Liprolog by měl být aplikován pouze subkutánní injekcí nebo kontinuální subkutánní infúzí pomocí pumpy (viz bod 4.2), avšak může být, i když to není doporučováno, podán také intramuskulárně. V případě potřeby může být podán i intravenózně, např. je-li třeba kontrolovat glykémii při ketoacidóze, akutních onemocněních nebo během operace či v pooperačním období.
Místy subkutánního podání by měly být horní části paží, stehna, hýždě nebo břicho.Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprologu je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy.
Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Liprolog účinkuje po subkutánním podání rychle a kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce Liprologu (nebo bolusu Liprologu v případě kontinuální subkutánní infuze) velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu. Stejně jako u všech inzulinových přípravků závisí trvání účinku Liprologu na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
Liprolog může být dle rady lékaře aplikován v kombinaci s déle působícím inzulinem nebo s deriváty sulfonylurey.
Užití Liprologu v inzulínových infúzních pumpách
K infúzím inzulinu lispro je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infuzí inzulinu lispro je potřeba prostudovat instrukce výrobce, abyste se ujistili o vhodnosti dané pumpy. Řiďte se návodem k používání infuzní pumpy. Spolu s pumpou používejte správný zásobník a správný katetr. Infúzní set (katetr a kanyla) má být vyměňován podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem. V případě hypoglykémie by měla být infuze přerušena až do odeznění hypoglykémie. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi inzulinu zpomalit či zastavit. Porucha pumpy nebo zneprůchodnění infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře. Při používání inzulinové infúzní pumpy nesmí být Liprolog mísen s jinými inzuliny.
Intravenózní aplikace inzulinu.
Intravenózní aplikace insulinu lispro má být prováděna podle běžné klinické praxe, např. intravenózním bolusem nebo infuzí. Je nutná častá kontrola hladiny glukózy v krvi.
Infuzní roztok o koncentraci od 0,1 IU/ml do 1,0 IU/ml insulinu lispro v 0,9% NaCl nebo 5% sacharóze je stabilní za pokojové teploty po dobu 48 hodin. Před zahájením infuze je doporučeno infuzní soupravu prostříknout.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky ( výrobce), typu (regular, NPH, lente, aj.),druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Krátkodobě působící Liprolog natáhněte do stříkačky jako první, aby se zabránilo kontaminaci lahvičky déle působícím inzulinem. Inzuliny smějí být míseny do zásoby nebo bezprostředně před použitím pouze na doporučení lékaře. Pokaždé postupujte stejným způsobem.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulínu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie. Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulínu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulínu.
Liprolog by měl být u dětí přednostně použit pouze v případě, kdy je přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
Kombinace přípravku Liprolog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog.
Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako j sou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Při užívání jiných léčiv podávaných současně s Liprologem by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojící diabetičky mohou potřebovat úpravu dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být porušena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
Nejčastějším nežádoucím účinkem inzulínové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti. Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000),ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon by měl být aplikován intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: rychle působící analog humánního inzulínu. ATC kód: A10AB04. Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Insulin lispro má rychlý nástup účinku (přibližně 15 minut) a tím umožňuje v porovnání s normálním inzulinem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Stejně jako u všech inzulinových přípravků může být časový průběh aktivity inzulinu lispro odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
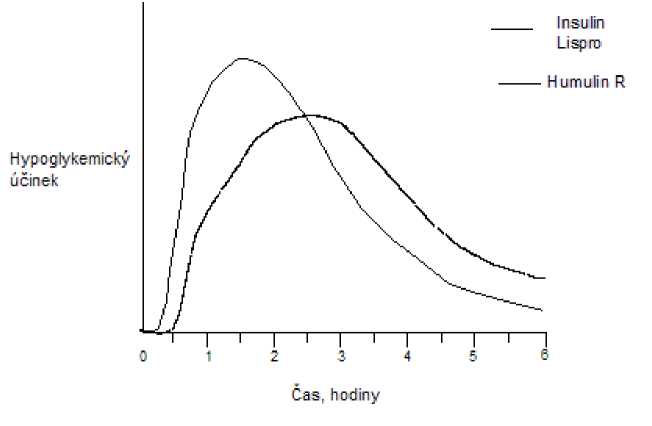
Graf odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plasmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem efektu těchto inzulinů na glukózový metabolismus v průběhu času.
Byly provedeny klinické studie u dětí (61 dětí ve věku 2 až 11 let) a u dětí a mladistvých (481 pacientů ve věku 9 až 19 let ) srovnávající inzulin lispro a normální lidský inzulin. Farmakodynamický profil inzulinu lispro u dětí je podobný jako farmakodynamický profil pozorovaný u dospělých.
Podávání insulinu lispro subkutánní infuzní pumpou způsobuje nižší hladiny glykovaného hemoglobinu než při užití normálního lidského inzulinu. V dvojitě slepé překřížené studii došlo ke snížení hladiny glykovaného hemoglobinu po 12 týdnech o 0,37 procentního bodu u inzulinu lispro ve srovnání se snížením o 0,03 procentního bodu u normálního lidského inzulinu (p=0,004).
U pacientů s diabetem typu 2 s maximálními dávkami derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání se samotnou sulfonylureou. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika insulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších plasmatických hladin v době od 30 do 70 minut po subkutánní injekci. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol [3,15 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Liprolog nesmí být mísen se zvířecími inzuliny nebo inzuliny jiného výrobce.
Liprolog nesmí být mísen s jinými přípravky kromě těch, které jsou uvedeny v bodě 6.6.
Neotevřená lahvička 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Neotevřená lahvička
Uchovávejte v chladničce (2°C - 8°C ).
Po _prvním užití
Uchovávejte v chladničce (2°C - 8°C ) nebo při teplotě do 30°C.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Roztok je plněn do injekčních lahviček z křemenného skla typ I utěsněných butylovou nebo halobutylovou zátkou a zabezpečených hliníkovým krytem. K ošetření zátky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
1x10 ml Liprolog injekční lahvička.
2x10 ml Liprolog injekční lahvička.
5x(1x10) ml Liprolog injekční lahvička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Injekční lahvičku používejte s vhodnou stříkačkou označenou 100 U.
a) Příprava dávky
Zkontrolujte Liprolog. Měl by být čirý a bezbarvý. Nepoužívejte Liprolog, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
i) Liprolog
1. Umyjte si ruce.
2. Načínáte-li novou injekční lahvičku, odstraňte ochranný plastový kryt, ale neodstraňujte zátku.
3. Jestliže léčebný režim vyžaduje injekci bazálního inzulinu i Liprologu zároveň, mohou být tyto dva inzuliny smíchány v injekční stříkačce. Pokud inzuliny mícháte, sledujte instrukce pro mísení, které následují v bodě ii a 6.2.
4. Do stříkačky natáhněte množství vzduchu shodné s množstvím Liprologu, které budete aplikovat. Horní část injekční lahvičky otřete tamponem napuštěným v lihu. Jehlu vbodněte do gumové horní části lahvičky Liprologu a vzduch ze stříkačky vtlačte do lahvičky.
5. Lahvičku se stříkačkou otočte dnem vzhůru. Držte j e pevně v j edné ruce.
6. Přesvědčte se, že je špička jehly v Liprologu a potřebnou dávku natáhněte do stříkačky.
7. Předtím, než vytáhnete jehlu z lahvičky, se přesvědčte, zda ve stříkačce nejsou vzduchové bubliny, které snižují množství Liprologu v ní. Pokud jsou bubliny přítomny držte stříkačku vzhůru a poklepávejte na její stěnu, dokud bubliny nevyplavou nahoru. Vytlačte je ze stříkačky pístem ven a natáhněte správnou dávku.
8. Vytáhněte jehlu z lahvičky a položte ji tak, aby se jehla ničeho nedotýkala.
ii) Míchání Liprologu s déle působícími humánními inzuliny (viz bod 6.2).
1. Liprolog smí být mísen s déle působícími humánními inzuliny pouze na doporučení lékaře.
2. Do stříkačky natáhněte množství vzduchu odpovídající dávce déle působícího inzulinu. Vbodněte jehlu do lahvičky s déle působícím inzulinem a injikujte vzduch dovnitř. Jehlu vytáhněte ven.
3. Nyní stejným způsobem injikujte vzduch do lahvičky s Liprologem, ale nevytahujte jehlu.
4. Otočte lahvičku i se stříkačkou dnem vzhůru.
5. Ujistěte se, že špička jehly je v Liprologu a natáhněte správnou dávku do stříkačky.
6. Předtím, než vytáhnete jehlu z lahvičky, se přesvědčte, zda ve stříkačce nejsou vzduchové bubliny, které snižují množství Liprologu v ní. Pokud jsou bubliny přítomny držte stříkačku vzhůru a poklepávejte na její stěnu, dokud bubliny nevyplavou nahoru. Vytlačte je ze stříkačky ven a natáhněte správnou dávku.
7. Vytáhněte jehlu z lahvičky s Liprologem a vbodněte ji do lahvičky s déle působícím inzulinem. Otočte lahvičku i se stříkačkou dnem vzhůru. Lahvičku i stříkačku držte pevně v jedné ruce
a lehce jimi potřásejte. Ujistěte se, že špička jehly je ponořena v inzulinu a poté natáhněte dávku déle působícího inzulinu.
8. Vytáhněte jehlu z lahvičky a položte stříkačku tak, aby se jehla ničeho nedotýkala.
b) Aplikace dávky
1. Vyberte místo vpichu.
2. Očistěte kůži podle instrukcí.
3. Stabilizujte kůži tak, že ji buďto napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte do kůže a aplikujte Liprolog podle instrukce.
4. Vytáhněte jehlu a místo vpichu několik sekund jemně tiskněte. Místo nemasírujte.
5. Jehlu a stříkačku bezpečně znehodnoťte.
6. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru vícekrát než jednou za měsíc.
c) Mísení inzulínů
Nemíchejte inzulin v lahvičkách s inzulinem v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/001 1x10 ml Liprolog injekční lahvička
EU/1/01/195/008 2x10 ml Liprolog injekční lahvička
EU/1/01/195/009 5x(1x10 ml) Liprolog injekční lahvička
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1. srpna 2001 Datum prodloužení registrace: 1. srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog 100 IU/ml, injekční roztok v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog je sterilní, čirý, bezbarvý vodný roztok.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli). Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog je určen k léčbě dospělých a dětí s diabetem mellitus, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Rovněž je indikován k iniciální stabilizaci diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem, v souladu s potřebami pacienta.
Liprolog může být podán krátce před jídlem nebo po jídle. Liprolog by měl být aplikován pouze subkutánní injekcí nebo kontinuální subkutánní infúzí pomocí pumpy (viz bod 4.2), avšak může být, i když to není doporučováno, podán také intramuskulárně. V případě potřeby může být podán i intravenózně, např. je-li třeba kontrolovat glykémii při ketoacidózy, akutních onemocněních nebo během operace či v pooperačním období.
Místy subkutánního podání by měly být horní části paží, stehna, hýždě nebo břicho.Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprologu je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy.
Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Liprolog účinkuje po subkutánním podání rychle a kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce Liprologu (nebo bolusu Liprologu v případě kontinuální subkutánní infuze) velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu. Stejně jako u všech inzulinových přípravků závisí trvání účinku Liprologu na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
Liprolog může být dle rady lékaře aplikován v kombinaci s déle působícím inzulinem nebo s deriváty sulfonylurey.
Užití Liprologu v inzulínových infúzních pumpách
K infúzím inzulinu lispro je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infuzí inzulinu lispro je třeba prostudovat instrukce výrobce, abyste se ujistili o vhodnosti dané pumpy. Řiďte se návodem k používání infuzní pumpy. Spolu s pumpou používejte správný zásobník a správný katetr Infúzní set (katetr a kanyla) má být vyměňován podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem. V případě hypoglykémie by měla být infuze přerušena až do odeznění hypoglykémie. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi inzulinu zpomalit či zastavit. Porucha pumpy nebo zneprůchodnění infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře. Při používání inzulinové infúzní pumpy nesmí být Liprolog mísen s jinými inzuliny.
Intravenózní aplikace inzulinu.
Intravenózní aplikace insulinu lispro má být prováděna podle běžné klinické praxe, např. intravenózním bolusem nebo infuzí. Je nutná častá kontrola hladiny glukózy v krvi.
Infuzní roztok o koncentraci od 0,1 IU/ml do 1,0 IU/ml insulinu lispro v 0,9% NaCl nebo 5% sacharóze je stabilní za pokojové teploty po dobu 48 hodin. Před zahájením infuze je doporučeno infuzní soupravu prostříknout.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky ( výrobce), typu (regular, NPH, lente, aj.),druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie.
Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulínu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulínu.
Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte insulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
Liprolog by měl být u dětí přednostně použit pouze v případě, kdy je přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
Kombinace přípravku Liprolog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog.
Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Při užívání jiných léčiv podávaných současně s Liprologem by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojící diabetičky mohou potřebovat úpravu dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být porušena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon by měl být aplikován intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: rychle působící analog humánního inzulínu. ATC kód: A10A B04
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Insulin lispro má rychlý nástup účinku (přibližně 15 minut) a tím umožňuje v porovnání s normálním inzulinem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Stejně jako u všech inzulinových přípravků může být časový průběh aktivity inzulinu lispro odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
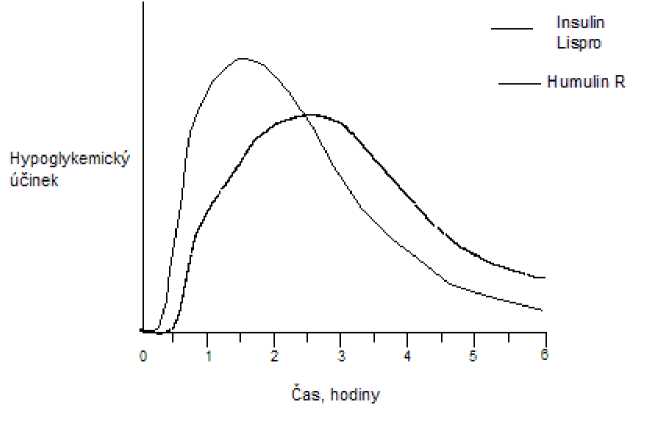
Graf odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plasmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem efektu těchto inzulinů na glukózový metabolismus v průběhu času.
Byly provedeny klinické studie u dětí (61 dětí ve věku 2 až 11 let) a u dětí a mladistvých (481 pacientů ve věku 9 až 19 let ) srovnávající inzulin lispro a normální lidský inzulin. Farmakodynamický profil inzulinu lispro u dětí je podobný jako farmakodynamický profil pozorovaný u dospělých.
Podávání insulinu lispro subkutánní infuzní pumpou způsobuje nižší hladiny glykovaného hemoglobinu než při užití normálního lidského inzulinu. V dvojitě slepé překřížené studii došlo ke snížení hladiny glykovaného hemoglobinu po 12 týdnech o 0,37 procentního bodu u inzulinu lispro ve srovnání se snížením o 0,03 procentního bodu u normálního lidského inzulinu (p=0,004).
U pacientů s diabetem typu 2 s maximálními dávkami derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání se samotnou sulfonylureou. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika insulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších plasmatických hladin v době od 30 do 70 minut po subkutánní injekci. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol [3,15 mg/ml]
glycerol, heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Liprolog nesmí být mísen se zvířecími inzuliny nebo inzuliny jiného výrobce.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 3 roky.
Po založení zásobní vložky 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Roztok je plněn do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog zásobní vložky pro 3ml pero 2x(5x3 ml) Liprolog zásobní vložky pro 3ml pero
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Liprolog zásobní vložky mají být používány s pery označenými CE na doporučení výrobce pera.
a) Příprava dávky
Zkontrolujte Liprolog. Měl by být čirý a bezbarvý. Nepoužívejte Liprolog, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži podle instrukcí.
4. Odstraňte vněj ší ochranný kryt j ehly.
5. Stabilizujte kůži tak, že ji buďto napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik sekund jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího ochranného krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
c) Mísení inzulinů
Nemíchejte inzulin v lahvičkách s inzulinem v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/002 5x3 ml Liprolog zásobní vložky pro 3ml pero
EU/1/01/195/010 2x(5x3 ml) Liprolog zásobní vložky pro 3ml pero
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1. srpna 2001 Datum prodloužení registrace: 1. srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog Mix25 100 IU/ml injekční suspenze v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog Mix25 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Liprolog Mix25 obsahuje 25% roztoku insulinum lisprum a 75% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog Mix25 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Liprolog Mix25 může být podán krátce před jídlem, v případě nutnosti může být Liprolog Mix25 podán i bezprostředně po jídle. Liprolog Mix25 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Liprolog Mix25 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprolog Mix25 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Liprolog Mix25 dochází k rychlému nástupu účinku Liprologu a časnému dosažení jeho vrcholu. To umožňuje podání Liprolog Mix25 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Liprolog Mix25 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Liprolog Mix25 na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Liprolog Mix25 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Liprolog Mix25 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog Mix25. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Liprolog Mix25 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Liprolog Mix25 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04.
Liprolog Mix25 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Liprolog Mix25 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Liprolog BASAL je velice podobný účinku bazálního inzulinu (NPH) po dobu přibližně 15 hodin.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u Liprologu Mix25 ve srovnání se směsí normálního lidského inzulinu 30/70. V jedné klinické studii došlo k malému (0,38 mmol/l) zvýšení noční hladiny glukózy v krvi ( 3:00).
Na následujícím obrázku je zobrazena farmakodynamika Liprologu Mix25 a Liprolog BASAL.
Hypoglykemická
aktivita
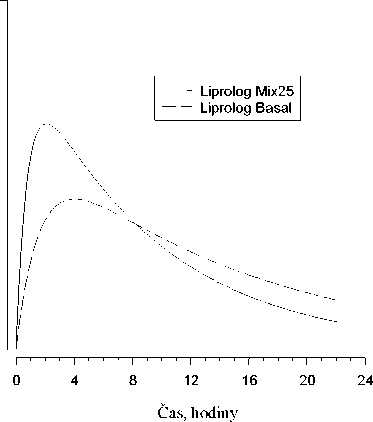
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
Ve dvou 8měsíčních otevřených zkřížených studiích u pacientůs diabetem 2. typu, kteří dosud nebyli léčeni inzulinem, nebo si již aplikovali inzulin jednou nebo dvakrát denně, byli pacienti randomizováni ke 4 měsícům léčby Liprologem Mix25 (užívaným dvakrát denně s metforminem) a inzulinem glargin (užívaným jednou denně s metforminem) v náhodném pořadí. Detailní informace lze nalézt v následující tabulce.
|
Pacienti dosud neléčení inzu n=78 |
Paci enti již dříve léčení inzul n=97 | |
|
Průměrná celková denní dávka inzuli: ukončení léčby |
0,63 U/kg |
0,42 U/kg |
|
Redukce hemoglobinu A1c1 |
1,30% (průměr při zahájení léčby 8 |
1,00% (průměr při zahájení léčby 8 |
|
Redukce průměrné kombinované raní /večerní 2hodinové postprandiální glykémie1 |
3,46 mM |
2,48 mM |
|
Redukce průměrné glykémie nalačno |
0,55 mM |
0,65 mM |
|
Výskyt hypoglykémie při ukončení lé |
25% |
25% |
|
Váhový přírůstek2 |
2,33 kg |
0,96 kg |
1
2
od výchozího stavu do ukončení léčby přípravkem Liprolog Mix25
u pacientů užívajících přípravek Liprolog Mix25 v průběhu první fáze překřížené léčby
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Liprolog Mix25 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát
metakresol [1,76 mg/ml]
fenol [0,80 mg/ml], glycerol
heptahydrát hydrogenfosforečnanu sodného
oxid zinečnatý
voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Liprolog Mix25 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 3 roky.
Po založení do zásobní vložky 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x 3 ml Liprolog Mix25 zásobní vložky do 3ml pera 2x(5x3 ml) Liprolog Mix25 zásobní vložky do 3ml pera
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Liprolog Mix25 zásobní vložky mají být používány s pery označenými CE na doporučení výrobce pera.
a) Příprava dávky
Bezprostředně před použitím by zásobní vložky obsahující Liprolog Mix25 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
V zásobní vložce nelze míchat Liprolog Mix25 s jinými inzuliny. Vložky nelze znovu plnit.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži, jak jste byli poučeni.
4. Odstraňte vněj ší kryt j ehly.
5. Stabilizujte kůži tak, že ji buď napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik vteřin jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/003 5x3 ml Liprolog Mix25 zásobní vložky do 3ml pera
EU/1/01/195/011 2x(5x3 ml) Liprolog Mix25 zásobní vložky do 3ml pera
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1.srpna 2001 Datum prodloužení registrace: 1.srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog Mix50 100 IU/ml injekční suspenze v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog Mix50 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Liprolog Mix50 obsahuje 50% roztoku insulinum lisprum a 50% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog Mix50 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Liprolog Mix50 může být podán krátce před jídlem, v případě nutnosti může být Liprolog Mix50 podán i bezprostředně po jídle. Liprolog Mix50 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Liprolog Mix50 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprolog Mix50 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Liprolog Mix50 dochází k rychlému nástupu účinku Liprologu a časnému dosažení jeho vrcholu. To umožňuje podání Liprolog Mix50 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Liprolog Mix50 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Liprolog Mix50 na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Liprolog Mix50 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Liprolog Mix50 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog Mix50. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Liprolog Mix50 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Liprolog Mix50 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04.
Liprolog Mix50 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Liprolog Mix50 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Liprolog BASAL je velice podobný účinku bazálního inzulinu (NPH) po dobu přibližně 15 hodin.
Na následujícím obrázku je zobrazena farmakodynamika Liprologu Mix50 a Liprologu BASAL.
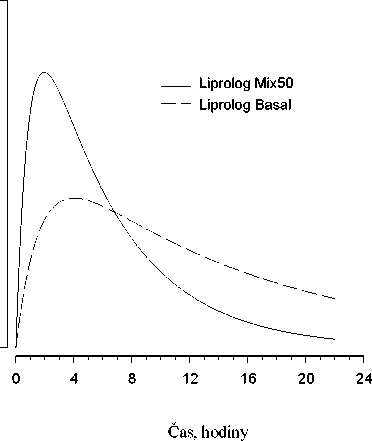
Hypoglykemická
aktivita
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Liprolog Mix50 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bodl 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [2,20 mg/ml] fenol [1,00 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Liprolog Mix50 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 3 roky.
Po založení zásobní vložky 28
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog Mix50 zásobní vložky do 3ml pera 2x(5x3 ml) Liprolog Mix50 zásobní vložky do 3ml pera
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Liprolog Mix50 zásobní vložky mají být používány s pery označenými CE na doporučení výrobce pera.
a) Příprava dávky
Bezprostředně před použitím by zásobní vložky obsahující Liprolog Mix50 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
V zásobní vložce nelze míchat Liprolog Mix50 s jinými inzuliny. Vložky nelze znovu plnit.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži, jak jste byli poučeni.
4. Odstraňte vněj ší kryt j ehly.
5. Stabilizujte kůži tak, že ji buď napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik vteřin jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/004 5x3 ml Liprolog Mix50 zásobní vložky do 3ml pera
EU/1/01/195/012 2x(5x3 ml) Liprolog Mix50 zásobní vložky do 3ml pera
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: l.srpna 2001 Datum prodloužení registrace: l.srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog BASAL 100 IU/ml injekční suspenze v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog BASAL je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Liprolog BASAL obsahuje suspenzi insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog BASAL je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Liprolog BASAL může být míchán nebo podán v kombinaci s Liprologem. Liprolog BASAL má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Liprolog BASAL podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprolog BASAL je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Trvání účinku Liprologu BASAL je velice podobné účinku bazálního inzulinu (NPH) přibližně po dobu 15 hod. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulinových přípravků závisí trvání účinku Liprologu BASAL na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Liprolog BASAL nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Liprolog BASAL s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog BASAL. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulínu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Liprologu BASAL s jinými inzuliny než Liprolog nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Liprologem BASAL by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: střednědobě působící analog humánního inzulinu.
ATC kód: A10AC04.
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Profil účinku přípravku Liprolog BASAL je velice podobný účinku bazálního inzulinu (NPH) po dobu přibližně 15 hodin.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Liprolog BASAL má prodloužený absorpční profil, kdy je maximální koncentrace inzulinu dosaženo přibližně 6 hodin po podání. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy.
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [1,76 mg/ml] fenol [0,80 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Liprologu BASAL s jinými inzuliny než Liprolog nebylo zkoumáno. Tento přípravek nesmí být mísen s jinými léky než je Liprolog.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 2 roky.
Po založení zásobní vložky 21 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog BASAL zásobní vložky do 3ml pera 2x (5x3 ml) Liprolog BASAL zásobní vložky do 3ml pera
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem,a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Liprolog BASAL zásobní vložky mají být používány s pery označenými CE podle doporučení výrobce pera.
a) Příprava dávky
Bezprostředně před použitím by zásobní vložky obsahující Liprolog BASAL měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
V zásobní vložce nelze míchat Liprolog BASAL s jinými inzuliny. Vložky nelze znovu plnit.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži, jak jste byli poučeni.
4. Odstraňte vněj ší kryt j ehly.
5. Stabilizujte kůži tak, že ji buď napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik vteřin jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
c) Míchání inzulínů
Inzulíny v injekčních lahvičkách nemíchejte s inzuliny v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/022 5x3 ml Liprolog BASAL zásobní vložky do 3ml pera
EU/1/01/195/023 2x (5x3 ml) Liprolog BASAL zásobní vložky do 3ml pera
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1. srpna 2001 Datum prodloužení registrace: 1. srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog KwikPen 100 IU/ml, injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog KwikPen je sterilní, čirý, bezbarvý vodný roztok.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli). Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog KwikPen je určen k léčbě dospělých a dětí s diabetem mellitus, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Liprolog KwikPen je rovněž indikován k iniciální stabilizaci diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem, v souladu s potřebami pacienta.
Liprolog může být podán krátce před jídlem nebo po jídle. Liprolog by měl být aplikován pouze subkutánní injekcí nebo kontinuální subkutánní infúzí pomocí pumpy (viz bod 4.2), avšak může být, i když to není doporučováno, podán také intramuskulárně. V případě potřeby může být podán i intravenózně, např. je-li třeba kontrolovat glykémii při ketoacidózy, akutních onemocněních nebo během operace či v pooperačním období.
Místy subkutánního podání by měly být horní části paží, stehna, hýždě nebo břicho.Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprologu KwikPen je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Liprolog KwikPen účinkuje po subkutánním podání rychle a kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce Liprologu (nebo bolusu Liprologu v případě kontinuální subkutánní infúze) velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu. Stejně jako u všech inzulínových přípravků závisí trvání účinku Liprologu KwikPen na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
Liprolog může být dle rady lékaře aplikován v kombinaci s déle působícím inzulinem nebo s deriváty sulfonylurey.
Užití Liprologu v inzulinových infúzních pumpách
K infúzím inzulinu lispro je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infuzí inzulinu lispro je třeba prostudovat instrukce výrobce, abyste se ujistili o vhodnosti dané pumpy. Řiďte se návodem k používání infuzní pumpy. Spolu s pumpou používejte správný zásobník a správný katetr. Infúzní set (katetr a kanyla) má být vyměňován podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem. V případě hypoglykémie by měla být infuze přerušena až do odeznění hypoglykémie. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi inzulinu zpomalit či zastavit. Porucha pumpy nebo zneprůchodnění infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře. Při používání inzulinové infúzní pumpy nesmí být Liprolog mísen s jinými inzuliny.
Intravenózní aplikace inzulinu
Intravenózní aplikace insulinu lispro má být prováděna podle běžné klinické praxe, např. intravenózním bolusem nebo infuzí. Je nutná častá kontrola hladiny glukózy v krvi.
Infuzní roztok o koncentraci od 0,1 IU/ml do 1,0 IU/ml insulinu lispro v 0,9% NaCl nebo 5% sacharóze je stabilní za pokojové teploty po dobu 48 hodin. Před zahájením infuze je doporučeno infuzní soupravu prostříknout.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky ( výrobce), typu (regular, NPH, lente, aj.),druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie. Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulínu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulínu.
Liprolog by měl být u dětí přednostně použit pouze v případě, kdy je přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
Kombinace přípravku Liprolog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog.
Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Při užívání jiných léčiv podávaných současně s Liprologem KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojící diabetičky mohou potřebovat úpravu dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být porušena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000),ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon by měl být aplikován intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: rychle působící analog humánního inzulínu. ATC kód: A10AB04. Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Insulin lispro má rychlý nástup účinku (přibližně 15 minut) a tím umožňuje v porovnání s normálním inzulinem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Stejně jako u všech inzulinových přípravků může být časový průběh aktivity inzulinu lispro odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
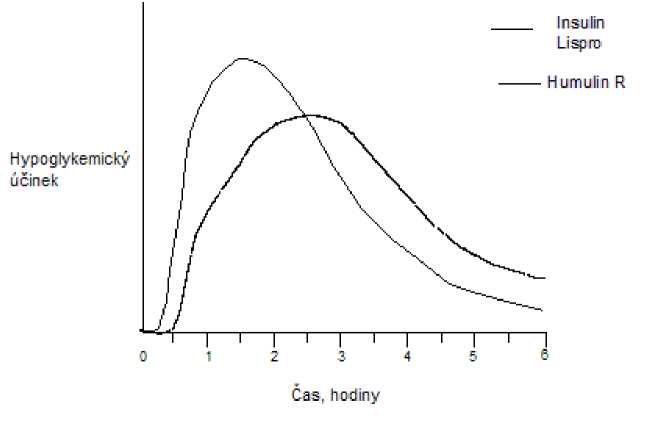
Graf odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plasmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem efektu těchto inzulinů na glukózový metabolismus v průběhu času.
Byly provedeny klinické studie u dětí (61 dětí ve věku 2 až 11 let) a u dětí a mladistvých (481 pacientů ve věku 9 až 19 let ) srovnávající inzulin lispro a normální lidský inzulin. Farmakodynamický profil inzulinu lispro u dětí je podobný jako farmakodynamický profil pozorovaný u dospělých.
Podávání insulinu lispro subkutánní infuzní pumpou způsobuje nižší hladiny glykovaného hemoglobinu než při užití normálního lidského inzulinu. V dvojitě slepé překřížené studii došlo ke snížení hladiny glykovaného hemoglobinu po 12 týdnech o 0,37 procentního bodu u inzulinu lispro ve srovnání se snížením o 0,03 procentního bodu u normálního lidského inzulinu (p=0,004).
U pacientů s diabetem typu 2 s maximálními dávkami derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání se samotnou sulfonylureou. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika insulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších plasmatických hladin v době od 30 do 70 minut po subkutánní injekci. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol [3,15 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Liprolog nesmí být mísen se zvířecími inzuliny nebo inzuliny jiného výrobce.
6.3 Doba použitelnosti
Nepoužité předplněné pero 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité předplněné pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Roztok je plněn do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
3 ml zásobní vložky jsou součástí předplněného dávkovače k jednorázovému užití. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog KwikPen 100 IU/ml 2x(5x3 ml) Liprolog KwikPen 100 IU/ml
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Zkontrolujte Liprolog KwikPen injekční roztok. Měl by být čirý a bezbarvý. Nepoužívejte Liprolog KwikPen, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
a) Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
b) Mísení inzulínů
Nemíchejte inzulin v lahvičkách s inzulinem v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/016 5 x 3 ml Liprolog 100 IU/ml Kwik Pen
EU/1/01/195/017 2 x (5 x 3 ml) Liprolog 100 IU/ml Kwik Pen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1.srpna 2001 Datum prodloužení registrace: 1.srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog Mix25 100 IU/ml KwikPen injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog Mix25 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Liprolog Mix25 obsahuje 25% roztoku insulinum lisprum a 75% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog Mix25 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Liprolog Mix25 může být podán krátce před jídlem, v případě nutnosti může být Liprolog Mix25 podán i bezprostředně po jídle. Liprolog Mix25 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Liprolog Mix25 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprolog Mix25 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Liprolog Mix25 dochází k rychlému nástupu účinku Liprologu a časnému dosažení jeho vrcholu. To umožňuje podání Liprolog Mix25 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Liprolog Mix25 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Liprolog Mix25 na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Liprolog Mix25 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Liprolog Mix25 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog Mix25. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Liprolog Mix25 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Liprolog Mix25 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04.
Liprolog Mix25 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Liprolog Mix25 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Liprolog BASAL je velice podobný účinku bazálního inzulinu (NPH) po dobu přibližně 15 hodin.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u Liprologu Mix25 ve srovnání se směsí normálního lidského inzulinu 30/70. V jedné klinické studii došlo k malému (0,38 mmol/l) zvýšení noční hladiny glukózy v krvi ( 3:00).
Na následujícím obrázku je zobrazena farmakodynamika Liprologu Mix25 a Liprologu BASAL.
Hypoglykemická
aktivita
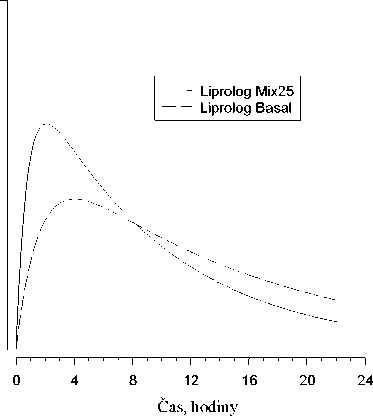
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
Ve dvou 8měsíčních otevřených zkřížených studiích u pacientůs diabetem 2. typu, kteří dosud nebyli léčeni inzulinem, nebo si již aplikovali inzulin jednou nebo dvakrát denně, byli pacienti randomizováni ke 4 měsícům léčby Liprologem Mix25 (užívaným dvakrát denně s metforminem) a inzulinem glargin (užívaným jednou denně s metforminem) v náhodném pořadí. Detailní informace lze nalézt v následující tabulce.
|
Pacienti dosud neléčení inzul n=78 |
Pacienti již dříve léčení inzulin n=97 | |
|
Průměrná celková denní dávka inzuli: ukončení léčby |
0,63 U/kg |
0,42 U/kg |
|
Redukce hemoglobinu A1c1 |
1,30% (průměr při zahájení léčby 8 |
1,00% (průměr při zahájení léčby 8,5 |
|
Redukce průměrné kombinované raní /večerní 2hodinové postprandiální glykémie1 |
3,46 mM |
2,48 mM |
|
Redukce průměrné glykémie nalačno |
0,55 mM |
0,65 mM |
|
Výskyt hypoglykémie při ukončení lé |
25% |
25% |
|
Váhový přírůstek2 |
2,33 kg |
0,96 kg |
od výchozího stavu do ukončení léčby přípravkem Liprolog Mix25
u pacientů užívajících přípravek Liprolog Mix25 v průběhu první fáze překřížené léčby
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulín lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Liprolog Mix25 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [1,76 mg/ml] fenol [0,80 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Liprolog Mix25 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 3 roky.
Po prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité předplněné pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3 ml zásobní vložky jsou součástí pera k jednorázovému užití, nazývaného “Pen”. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog Mix25 100 IU/ml KwikPen 2x(5x3 ml) Liprolog Mix25 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Bezprostředně před použitím by dávkovač KwikPen měl být desetkrát promíchán válením v dlaních a desetkrát převrácen o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/018 5 x 3 ml Liprolog Mix25 100 IU/ml KwikPen
EU/1/01/195/019 2 x (5 x 3ml) Liprolog Mix25 100 IU/ml KwikPen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: l.srpna 2001 Datum prodloužení registrace: l.srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog Mix50 100 IU/ml KwikPen injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog Mix50 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Liprolog Mix50 obsahuje 50% roztoku insulinum lisprum a 50% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog Mix50 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Liprolog Mix50 může být podán krátce před jídlem, v případě nutnosti může být Liprolog Mix50 podán i bezprostředně po jídle. Liprolog Mix50 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Liprolog Mix50 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprolog Mix50 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Liprolog Mix50 dochází k rychlému nástupu účinku Liprologu a časnému dosažení jeho vrcholu. To umožňuje podání Liprolog Mix50 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Liprolog Mix50 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Liprolog Mix50 na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Liprolog Mix50 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Nekontrolované hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Liprolog Mix50 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog Mix50. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Liprolog Mix50 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Liprolog Mix50 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04.
Liprolog Mix50 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Liprolog Mix50 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Liprolog BASAL je velice podobný účinku bazálního inzulinu (NPH) po dobu přibližně 15 hodin.
Na následujícím obrázku je zobrazena farmakodynamika Liprologu Mix50 a Liprologu BASAL.

Hypoglykemická
aktivita
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Liprolog Mix50 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [2,20 mg/ml] fenol [1,00 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Liprolog Mix50 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3 ml zásobní vložky jsou součástí pera k jednorázovému užití, nazývaného “Pen”. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog Mix50 100 IU/ml KwikPen 2x(5x3 ml) Liprolog Mix50 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Bezprostředně před použitím by dávkovač KwikPen měl být desetkrát promíchán válením v dlaních a desetkrát převrácen o 180° k promísení inzulínu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/020 5 x 3 ml Liprolog Mix50 100 IU/ml KwikPen
EU/1/01/195/021 2 x (5 x 3 ml) Liprolog Mix50 100 IU/ml KwikPen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1. srpna 2001 Datum prodloužení registrace: 1. srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog BASAL 100 IU/ml KwikPen injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Liprolog BASAL je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Liprolog BASAL obsahuje suspenzi insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog BASAL je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Liprolog BASAL může být míchán nebo podán v kombinaci s Liprologem. Liprolog BASAL má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Liprolog BASAL podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Liprologu BASAL je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Trvání účinku Liprologu BASAL je velice podobné účinku bazálního inzulinu (NPH) přibližně po dobu 15 hod. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulinových přípravků závisí trvání účinku Liprologu BASAL na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Liprolog BASAL nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Liprolog BASAL s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog BASAL. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulínu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Liprologu BASAL s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Liprologem BASAL 100 IU/ml KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000)ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: střednědobě působící analog humánního inzulinu. ATC kód: A10AC04 Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Profil účinku přípravku Liprolog BASAL je velice podobný účinku bazálního inzulinu (NPH) po dobu přibližně 15 hodin.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Liprolog BASAL má prodloužený absorpční profil, kdy je maximální koncentrace inzulinu dosaženo přibližně 6 hodin po podání. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy.
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [1,76 mg/ml] fenol [0,80 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Liprologu BASAL s jinými inzuliny než Liprolog nebylo zkoumáno. Tento přípravek nesmí být mísen s jinými léky než je Liprolog.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 2 roky.
Po prvním užití 21 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3 ml zásobní vložky jsou součástí pera k jednorázovému užití, nazývaného „KwikPen“. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Liprolog BASAL 100 IU/ml KwikPen 2x (5x3 ml) Liprolog BASAL 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Bezprostředně před použitím by dávkovač KwikPen měl být desetkrát promíchán válením v dlaních a desetkrát převrácen o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/026 5x3 ml Liprolog BASAL 100 IU/ml KwikPen
EU/1/01/195/027 2x (5x3 ml) Liprolog BASAL 100 IU/ml KwikPen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1. srpna 2001 Datum prodloužení registrace: 1. srpna 2006
10. DATUM REVIZE TEXTU
1. NÁZEV PŘÍPRAVKU
Liprolog 200 jednotek /ml injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje 200 jednotek (odpovídá 6,9 mg) insulinům lisprum*. Jedno pero obsahuje 600 jednotek inzulinu lispro ve 3 ml roztoku.
* produkováno E. coli technologií rekombinantní DNA.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok. KwikPen. Čirý, bezbarvý vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Liprolog KwikPen je určen k léčbě dospělých s diabetem mellitem, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Liprolog 200 jednotek/ml KwikPen je rovněž indikován k iniciální stabilizaci onemocnění diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování
Dávkování musí být určeno lékařem, v souladu s potřebami pacienta.
Liprolog může být podán krátce před jídlem. V případě nutnosti může být Liprolog podán záhy po jídle.
Liprolog účinkuje po subkutánním podání rychle a po kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce přípravku Liprolog velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu.Trvání účinku přípravku Liprolog závisí na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
Liprolog může být dle doporučení lékaře aplikován v kombinaci s déle působícím inzulinem nebo s léčivými přípravky obsahujícími sulfonylureu.
Liprolog 100 jednotek/ml KwikPen a Liprolog 200 jednotek/ml KwikPen
Liprolog KwikPen je k dispozici ve dvou silách, U obou se požadovaná dávka nastavuje v jednotkách. Obě předplněná pera Liprolog 100 jednotek/ml KwikPen a Liprolog 200 jednotek/ml KwikPen aplikují v jedné injekci od 1 do 60 jednotek po jedné jednotce. Počet jednotek se zobrazuje v dávkovacím okénku pera bez ohledu na sílu přípravku a při převodu pacienta na novou sílu není potřeba žádná konverze dávky.
Liprolog 200 jednotek/ml by měl být vyhrazen pro léčbu pacientů s diabetem, kteří potřebují denní dávky vyšší než 20 jednotek rychle účinkujícího inzulinu. Roztok inzulinu lispro s obsahem 200 jednotek/ml nesmí být přetahován z předplněného pera (pero KwikPen) nebo mísen s jakýmkoliv jiným inzulínem (viz bod 4.4 a bod 6.2).
Zvláštní skupiny pacientů
Renální insufícience
Potřeba inzulínu může být při renální insuficienci snížena.
Jaterní insuficience
Potřeba inzulinu může být snížena u pacientů s jatemí insuficiencí z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Způsob podání
Liprolog 200 jednotek/ml KwikPen injekční roztok se podává subkutánně.
Místy subkutánního podání jsou horní části paží, stehna, hýždě nebo břicho. Místa vpichu je třeba měnit rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci přípravku Liprolog je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nesmí masírovat. Pacient musí být řádně poučen o správné technice aplikace.
Liprolog 200 jednotek/ml KwikPen injekční roztok se nesmí používat v inzulinové infúzní pumpě. Liprolog 200 jednotek/ml KwikPen injekční roztok se nesmí používat intravenózně.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Hypoglykémie a hyperglykémie
Dlouhodobá léčba diabetu, intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání léčivých přípravků, jako jsou betablokátory, mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od příznaků, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu a úprava dávky
Potřeba inzulinu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají větší fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie. Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulinu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulinu.
Kombinace přípravku Liprolog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tuto skutečnost je třeba vzít v úvahu, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Liprolog.
Pokud se podává kombinovaná léčba, u pacientů je třeba sledovat, zda se neobjevují známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčbu pioglitazonem je třeba přerušit, pokud dojde k jakémukoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Předcházení chybám v medikaci při užívání inzulinu lispro (200 jednotek/ml) v předplněném peru: Injekční roztok inzulinu lispro o obsahu 200 jednotek/ml nesmí být z předplněného pera KwikPen přenášen do injekční stříkačky. Značení na inzulinové stříkačce nebude měřit dávku správně. Předávkování může způsobit závažnou hypoglykémii. Injekční roztok inzulinu lispro o koncentraci 200 jednotek/ml nesmí být z předplněného pera KwikPen přetahován do žádné jiné inzulinové aplikační pomůcky včetné inzulinových infúzních pump.
Pacient musí být poučen a nutnosti vždy před každou aplikací injekce zkontrolovat štítek inzulinu, aby se vyloučila nechtěná záměna rozdílných sil přípravku Liprolog a jiných inzulinových přípravků.
Pomocné látky
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedná dávce, tj. „zanedbatelné množství sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (například ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta-blokátory, oktreotid nebo alkohol.
Při užívání jiných léčivých přípravků podávaných současně s Liprologem 200 jednotek/ml KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem je třeba poučit o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojení
Kojící diabetičky mohou potřebovat úpravu dávky inzulínu, diety nebo obojího.
Fertilita
Ve studiích na zvířatech inzulin lispro nezpůsoboval zhoršení fertility (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být narušena v důsledku hypoglykémie. To může představovat riziko v situacích specielně vyžadujících výše uvedené schopnosti (např. schopnost řídit nebo obsluhovat stroje).
Pacienta je třeba poučit o nutnosti zabránit hypoglykémii během řízení. To je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté epizody hypoglykémie. Za těchto okolností je třeba pečlivě zvážit vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastějším nežádoucím účinkem terapie inzulinem lispro u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů, jako je intenzita tělesné námahy nebo dieta, není uvedena četnost výskytu hypoglykémie.
Tabulkový přehled nežádoucích účinků
V níže uvedené tabulce jsou shrnuty nežádoucí účinky z klinických studií v terminologii preferované MedDRA dle orgánových tříd a řazeny sestupně podle frekvence výskytu (velmi časté: >1/10; časté: >1/100 až <1/10; méně časté: >1/1000 až <1/100; vzácné: >1/10000 až <1/1000; velmi vzácné: <1/10000).
U každé skupiny frekvence výskytu jsou nežádoucí účinky řazeny sestupně podle míry závažnosti.
Orgánová třída Velmi časté Časté Méně časté Vzácné Velmi vzá MedDRA
Poruchy imunitního systému
Poruchy kůže a podkožní tkáně
Popis vybraných nežádoucích účinků
Lokální přecitlivělost
Lokální přecitlivělost je u pacientů častá. Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů. V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou.
Systémová alergie
Systémová alergie, která je vzácná, ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit výsev vyrážky po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie
Lipodystrofie v místě aplikace injekce je méně častá.
Edém
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon je třeba aplikovat intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: léčiva k terapii diabetu, inzuliny a analogy k injekční aplikaci, rychle působící, ATC kód: A10AB04.
Primárním účinkem inzulinu lispro je regulace metabolismu glukózy.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Insulin lispro má rychlý nástup účinku (přibližně 15 minut), a tím umožňuje v porovnání s normálním inzulínem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Časový průběh aktivity inzulinu lispro může být odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
Obrázek 1:

Graf (obrázek 1) odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plazmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem účinku těchto inzulinů (100 jednotek/ml) na metabolismus glukózy v průběhu času.
Farmakodynamické odpovědi inzulinu lispro u injekčního roztoku 200 jednotek/ml jsou podobné odpovědím pro injekční roztok inzulinu lispro 100 jednotek/ml po subkutanním podání jednorázové dávky 20 jednotek zdravým subjektům, jak je ukázáno v grafu níže (obrázek 2).

Čas (hod)
Obrázek 2: Průměrná aritmetická rychlost infúze glukózy oproti časovému profilu po subkutánním podání 20 jednotek inzulínu lispro 200 jednotek/ml nebo inzulínu lispro 100 jednotek/ml
U pacientů s diabetem typu 2 užívajícím maximální dávky derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání s užívaním samotné sulfonylurey. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu se neměnily v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika insulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších hladin v plazmě v době od 30 do 70 minut po subkutánním podání. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí se farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem neměnily a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
Po subkutánním podání jednorázové dávky 20 jednotek byl u zdravých subjektů injekční roztok inzulinu lispro 200 jednotek/ml bioekvivalentní injekčnímu roztoku inzulinu lispro 100 jednotek/ml. U obou sil byl podobný také čas dosažení maximální koncentrace.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulínové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulínu lispro na inzulínový receptor je totožná s humánním inzulínem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Ve studiích na zvířatech inzulin lispro nezpůsoboval zhoršení fertility, nebyl embryotoxický a teratogenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol glycerol trometamol oxid zinečnatý voda na injekci
kyselina chlorovodíková a hydroxid sodný (k úpravě pH).
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s žádným jiným inzulinem nebo jiným léčivým přípravkem. Injekční roztok nesmí být ředěn.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 3 roky.
Po _ prvním _ použití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2 °C - 8 °C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _ prvním _ použití
Uchovávejte při teplotě do 30 °C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a obsah balení
Zásobní vložky ze skla typu I utěsněné chlorobutylovou diskovitou zátkou a pístem a zabezpečené hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3ml zásobní vložky, které obsahují 600 jednotek inzulinu lispro (200 jednotek/ml) jsou součástí předplněného dávkovače k jednorázovému použití, nazývaného „KwikPen“. Jehly nejsou obsaženy.
5 předplněných per 3 ml
Multipak obsahující 10 (2 balení po 5) předplněných per 3 ml Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Injekční roztok přípravku Liprolog by měl by být čirý a bezbarvý. Přípravek Liprolog se nesmí používat, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/01/195/028
EU/1/01/195/029
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 1. srpna 2001 Datum prodloužení registrace: 1. srpna 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky
Fermentation: Eli Lilly and Company, Lilly Technology Center Building 333 and 324, Indianapolis, Indiana, USA
Lilly del Caribe, Inc., Puerto Rico Industrial Park, 12.3 KM (PR05), 65th Infantry Road, Carolina, Puerto Rico 00985
Granule Recovery: Eli Lilly and Company, Lilly Technology Center Building 130, Indianapolis, Indiana, USA
Lilly del Caribe, Inc., Puerto Rico Industrial Park, 12.3 KM (PR05), 65th Infantry Road, Carolina, Puerto Rico 00985
Název a adresa výrobců odpovědného za propouštění šarží Injekční lahvičky
Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Zásobní vložky
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Zásobní vložky kromě přípravků Liprolog BASAL
Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Pera „KwikPen" (100 jednotek/ml)
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Pera „KwikPen" (100 jednotek/ml) mimo přípravků Liprolog BASAL KwikPen
Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Pera ..KwikPen" (200 jednotek/ml)
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik (Liprolog 200 jednotek/ml)
Před uvedením přípravku na trh poskytne držitel rozhodnutí o registraci všem cílovým lékařům, sestrám, u kterých se předpokládá účast v léčbě diabetických pacientů, a v případě potřeby i lékárníkům s předpokladem vydávání přípravku Liprolog edukační materiál pro zdravotnické pracovníky (DHPC) a Edukační materiál pro pacienty.
Cílová skupina komunikace a podmínky distribuce těchto materiálů budou odsouhlaseny na úrovni členského státu. Před uvedením přípravku na trh musí držitel rozhodnutí o registraci dohodnout s národní autoritou členského státu konečný text Edukačního materiálu pro zdravotnické pracovníky (DHCP) a obsah Edukačního materiálu pro pacienty včetně způsobu předání těchto informací.
DHPC a Edukační materiál pro pacienty jsou určeny ke zdůraznění skutečnosti, že přípravek Liprolog je nyní dostupný ve dvou silách a bude popisovat klíčové rozdíly v designu balení a předplněného pera, aby se minimalizovalo riziko chyby v medikaci a záměně mezi rozdílnými silami přípravku Liprolog.
Držitel rozhodnutí o registraci zajistí, aby zdravotničtí pracovníci byli informováni, o nutnosti proškolit všechny pacienti, kterým byl přípravek Liprolog předepsán, ve správném používání předplněného pera dříve, než je jim přípravek Liprolog předepsán nebo vydán.
DHPC by měl zdůraznit tyto klíčové prvky:
• Liprolog je nyní dostupný ve 2 silách
• Klíčové znaky designu balení a předplněného pera
• Při předepisování přípravku nutnost ověření, že na lékařském předpisu je uvedena správná síla přípravku
• Liprolog nesmí být použán mimo předplněné pero
• Při převádění z přípravku Liprolog 100 jednotek na 200 jednotek nedochází ke konverzi dávky
• Chyby v medikaci nebo jakékoli nežádoucí účinky mají být hlášeny
Edukační materiál pro pacienty by měl zdůraznit tyto klíčové prvky:
• Liprolog je nyní dostupný ve 2 silách
• Klíčové znaky designu balení a předplněného pera
• Liprolog nesmí být použán mimo předplněné pero
• Při převádění z přípravku Liprolog 100 jednotek na 200 jednotek nedochází ke konverzi dávky
• Před každou inj ekcí j e nutné zkontrolovat počet nastavených jednotek
• Při vyzvednutí v lékárně je nutné zkontrolovat název, typ a sílu inzulinu
Chyby v medikaci nebo jakékoli nežádoucí účinky mají být hlášeny
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
SKLÁDAČKA TEXT (1 LAHVIČKA)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Liprolog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
injekční lahvičce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 1x10 ml injekční lahvička
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/001 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis. 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
SKLÁDAČKA TEXT (2 LAHVIČKY)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Liprolog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
injekční lahvičce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 2x10 ml injekční lahvička
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIM<
DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/008 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis. 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
SKLÁDAČKA TEXT (5X1 LAHVIČKA)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Liprolog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
injekční lahvičce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok Součást multipaku 5x(1x10 ml) injekční lahvička. Neprodávat jednotlivě.
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIM<
DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/009 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Liprolog 100 IU/ml, injekční roztok v injekční lahvičce
Insulinům lisprum
Podkožní nebo nitrožilní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
10 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Liprolog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
zásobní vložce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 5x3 ml zásobní vložky
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte inzulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/002 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ (Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog
SKLÁDAČKA TEXT (2 x 5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog 100 IU/ml, injekční roztok v zásobní vložce insulinům lisprum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
insulinum lisprum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok
Součást multipaku 2x(5x3 ml) zásobní vložky. Neprodávat jednotlivě.
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte inzulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/010 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ (Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Liprolog 100 IU/ml, injekční roztok v zásobní vložce
Insulinům lisprum
Podkožní nebo nitrožilní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix25 100 IU/ml injekční suspenze v zásobní vložce
25% insulinum lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 5x3 ml v zásobní vložce
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/003
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix25
SKLÁDAČKA TEXT (2 x 5 x 3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix25 100 IU/ml injekční suspenze v zásobní vložce
25% insulinum lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást dvojitého balení 2x(5x3 ml) zásobní vložky. Neprodávat odděleně.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/011
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix25
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Liprolog Mix25 100 IU/ml injekční suspenze v zásobní vložce 25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix50 100 IU/ml injekční suspenze v zásobní vložce
50% insulinum lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 5x3 ml v zásobní vložce
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/004
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix50
SKLÁDAČKA TEXT (2 x 5 x 3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix50 100 IU/ml injekční suspenze v zásobní vložce
50% insulinum lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást dvojitého balení 2x(5x3 ml) zásobní vložky. Neprodávat odděleně.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/012
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix50
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Liprolog Mix50 100 IU/ml injekční suspenze v zásobní vložce 50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA (5x3 ml zásobní vložky)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog BASAL 100 IU/ml injekční suspenze v zásobní vložce suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 5x3 ml zásobní vložky
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 21 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/022
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog BASAL
SKLÁDAČKA (2x 5x3 ml zásobní vložky)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog BASAL 100 IU/ml injekční suspenze v zásobní vložce suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) zásobní vložky. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3ml perech.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 21 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/023
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog BASAL
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Liprolog BASAL 100 IU/ml injekční suspenze v zásobní vložce suspenze insulinům lisprum isophanum (původem z rDNA) subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4. ČÍSLO SARZE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog KwikPen 100 IU/ml, injekční roztok insulinům lisprum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100U/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 5x3 ml předplněná pera
5. ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8. POUŽITELNOST
EXP {MM/RRRR}
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/016 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog KwikPen
SKLÁDAČKA TEXT (2x 5 x 3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog KwikPen 100 IU/ml, injekční roztok insulinům lisprum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100U/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8. POUŽITELNOST
EXP {MM/RRRR}
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/017 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Liprolog KwikPen 100 IU/ml, injekční roztok
Insulinům lisprum
Podkožní nebo nitrožilní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix25 100 IU/ml KwikPen injekční suspenze
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| 5x3 ml předplněná pera
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/018 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix25 KwikPen
SKLÁDAČKA TEXT (2 x 5 x 3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix25 100 IU/ml KwikPen injekční suspenze
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinům lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/019 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix25 KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Liprolog Mix25 100 IU/ml KwikPen injekční suspenze
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum
subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix50 100 IU/ml KwikPen injekční suspenze
50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinům lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| 5x3 ml předplněná pera
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/020 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix50 KwikPen
SKLÁDAČKA TEXT (2 x 5 x 3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog Mix50 100 IU/ml KwikPen injekční suspenze
50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinům lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/021 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog Mix50 KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Liprolog Mix50 100 IU/ml KwikPen injekční suspenze
50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum
subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA (5x3 ml pera)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog BASAL 100 IU/ml KwikPen injekční suspenze suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| 5x3 ml předplněná pera
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Pečlivě promíchejte. Viz vložená příbalová informace.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno 21 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/026 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog BASAL KwikPen
SKLÁDAČKA (2 x 5x3 ml pera)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog BASAL 100 IU/ml KwikPen injekční suspenze suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin-sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Pečlivě promíchejte. Viz vložená příbalová informace.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno 21 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/01/195/027 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Liprolog BASAL KwikPen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Liprolog BASAL 100 IU/ml KwikPen injekční suspenze suspenze insulinům lisprum isophanum (původem z rDNA) subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4. ČÍSLO SARZE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA KwikPen, balení obsahující 5 per
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog 200 jednotek/ml injekční roztok v předplněném peru insulinům lisprum
2 OBSAH LÉČIVÉ LÁTKY
Jeden ml roztoku obsahuje 200 jednotek insulinům lisprum (odpovídá 6,9 mg)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, trometamol, metakresola vodu na injekci. Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen 5 per 3 ml
5. ZPŮSOB A CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze v tomto peru, jinak může dojít k závažnému předávkování.
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být používáno až 28 dnů. Používané pero uchovávejte při teplotě do 30 °C a chraňte před chladem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PRÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/01/195/028
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15 NÁVOD K POUŽITÍ 16 INFORMACE V BRAILLOVĚ PÍSMU
Liprolog 200 jednotek/ml
VNITŘNÍ KRABIČKA (bez blue boxu) součást multipacku - KwikPen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog 200 jednotek/ml injekční roztok v předplněném peru insulinům lisprum
2 OBSAH LÉČIVÉ LÁTKY
Jeden ml roztoku obsahuje 200 jednotek insulinům lisprum (odpovídá 6,9 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, trometamol, metakresola vodu na injekci. Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen.
Multipak: 5 per 3 ml. Součást multipaku, neprodávat zvlášť.
5. ZPŮSOB A CESTY PODÁNÍ
Před použití si přečtěte příbalovou informaci. Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze v tomto peru, jinak může dojít k závažnému předávkování.
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být používáno až 28 dnů. Používané pero uchovávejte při teplotě do 30 °C a chraňte před chladem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PRÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/01/195/029
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
Liprolog 200 jednotek/ml
VNĚJŠÍ KARBIČKA (s blue boxem) multipack - KwikPen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Liprolog 200 jednotek/ml injekční roztok v předplněném peru insulinům lisprum
2 OBSAH LÉČIVÉ LÁTKY
Jeden ml roztoku obsahuje 200 jednotek insulinům lisprum (odpovídá 6,9 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, trometamol, metakresola vodu na injekci. Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen.
Multipak: 10 (2 balení po 5) per 3 ml.
5. ZPŮSOB A CESTY PODÁNÍ
Před použití si přečtěte příbalovou informaci. Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN M DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze v tomto peru, jinak může dojít k závažnému předávkování.
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být používáno až 28 dnů. Používané pero uchovávejte při teplotě do 30 °C a chraňte před chladem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PRÍPRA NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/01/195/029
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
Liprolog 200 jednotek/ml
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITRNÍM OBALU ŠTÍTEK na peru
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Liprolog 200 jednotek/ml KwikPen, injekční roztok Insulinům lisprum Subkutánní podání
2 ZPŮSOB PODÁNÍ 3 POUŽITELNOST
EXP
4. ČÍSLO SARZE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK 3 ml
6. JINÉ
POUŽÍVEJTE POUZE V TOMTO PERU, JINAK MŮŽE DOJÍT K ZÁVAŽNÉMU PŘEDÁVKOVÁNÍ.
Liprolog 100 IU/ml, injekční roztok v injekční lahvičce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog užívat
3. Jak se přípravek Liprolog užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog a k čemu se používá
Přípravek Liprolog se používá k léčbě diabetu. Díky lehce pozměněné molekule inzulinu má přípravek Liprolog rychlejší účinek než normální lidský inzulin.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí přípravek Liprolog velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Liprolog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
Liprolog je vhodný pro děti a dospělé. Liprolog může být u dětí použit v případě, kdy je oproti normálnímu lidskému inzulinu přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog užívat
NEUŽÍVEJTE přípravek Liprolog
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Liprolog užívá
3.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený
na krabičce a lahvičce. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog.
Vždy užívejte přípravek Liprolog přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte
se se svým lékařem.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog v rozmezí 15 minut kolem jídla.
V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog podávejte podkožně. Nitrosvalové podání je možné pouze po doporučení lékařem.
Příprava Liprologu
• Liprolog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací lahvičku zkontrolujte.
Aplikace Liprologu
• Nejprve si umyjte ruce.
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Očistěte gumový uzávěr lahvičky, ale neodstraňujte ho.
• Použijte čistou sterilní stříkačku a jehlu. Jehlu vbodněte do lahvičky a natáhněte potřebné množství Liprologu podle instrukce lékaře. Jehly a stříkačky s nikým nesdílejte.
• Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, zadek nebo břicho. Liprolog vždy účinkuje rychleji než normální lidský inzulin.
• Váš lékař vás informuje, zda si máte Liprolog míchat s jiným lidským inzulinem. Pokud si musíte aplikovat směs, natáhněte Liprolog do stříkačky jako první před déle působícím inzulinem. Směs si aplikujte ihned po přípravě. Postupujte vždy stejným způsobem.
Za normálních okolností byste neměli míchat Liprolog s jinou směsí lidského inzulinu. Nikdy byste neměli Liprolog míchat s inzuliny jiného výrobce nebo se zvířecími inzuliny.
• Liprolog si nesmíte aplikovat nitrožilně. Aplikujte si ho dle rady lékaře či sestry. Nitrožilně vám může Liprolog podat pouze lékař. Udělá to jen za zvláštních okolností jako je chirurgický výkon nebo v případě, že jste nemocní a hladina glukózy ve vaší krvi je velmi vysoká.
Použití Liprologu v infúzních pumpách
• K infúzím Liprologu je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infúzí inzulinu lispro si v instrukcích výrobce ověřte vhodnost infúzní pumpy. Při jejich používání se řiďte návodem k obsluze inzulinové pumpy.
• Spolu s pumpou používejte správný zásobník a katetr.
• Výměna infúzního setu (katetru a kanyly) musí být provedena podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem.
• V případě hypoglykémie by měla být infúze přerušena až do jejího odeznění. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi zpomalit či zastavit.
• Porucha pumpy nebo ucpání infúzního setu může způsobit náhlý vzestup hladiny glukózy.
V případě podezření, že je průtok inzulínu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře.
• Při používání infuzní pumpy by neměl být Liprolog mísen s jinými inzulíny.
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii.
Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Liprologu.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie: Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie: Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprologu, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprologu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulínu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Liprolog uchovávat
Před prvním použitím uchovávejte přípravek Liprolog v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem. Používanou lahvičku uchovávejte v chladničce (2°C - 8°C) nebo při pokojové teplotě do 30°C a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte Liprolog, pokud je zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog 100 IU/ml, injekční roztok v injekční lahvičce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami j sou metakresol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog vypadá a co obsahuje toto balení
Přípravek Liprolog 100 IU/ml, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje
100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml). Jedna lahvička obsahuje
1 000 jednotek (10 mililitrů). Liprolog 100 IU/ml, injekční roztok v lahvičkách je balen po 1 nebo
2 lahvičkách nebo v multipaku po 5x1 lahvičce. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog 100 IU/ml, injekční roztok v lahvičkách jsou:
• Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht,
Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgique/Belgie/Belgien Lietuva
Eli Lilly Benelux S.A./N.V. Eli Lilly Holdings Limited atstovybé
Tél/Tel: + 32-(0)2 548 84 84 Tel. +370 (5) 2649600
|
Btarapna Tn "Ean Ruru HegepaaHg" E.B. - Etarapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tr^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tr^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropskéagentury pro léčivé přípravky: http://www.ema.europa.eu/
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog 100 IU/ml, injekční roztok v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vykytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog užívat
3. Jak se přípravek Liprolog užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog a k čemu se používá
Přípravek Liprolog se používá k léčbě diabetu. Díky lehce pozměněné molekule inzulinu má přípravek Liprolog rychlejší účinek než normální lidský inzulin.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí přípravek Liprolog velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Liprolog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
Liprolog je vhodný pro děti a dospělé. Liprolog může být u dětí použit v případě, kdy je oproti normálnímu lidskému inzulinu přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog užívat
NEUŽÍVEJTE přípravek Liprolog
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte insulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Liprolog užívá
3.
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5 ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený
na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog.
Vždy užívejte přípravek Liprolog přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte
se se svým lékařem. Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze
Vámi, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog v rozmezí 15 minut kolem jídla.
V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog podávejte podkožně. Nitrosvalové podání je možné pouze po doporučení lékařem.
Příprava Liprologu
• Liprolog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací lahvičku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Liprologu smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Liprolog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Liprologu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Liprologu
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, zadek nebo břicho. Liprolog vždy účinkuje rychleji než normální lidský inzulin.
• Liprolog si nesmíte aplikovat nitrožilně. Aplikujte si ho dle rady lékaře či sestry. Nitrožilně vám může Liprolog podat pouze lékař. Udělá to jen za zvláštních okolností jako je chirurgický výkon nebo v případě, že jste nemocní a hladina glukózy ve vaší krvi je velmi vysoká.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Liprolog sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus, dokud nevyjde kapka Liprologu z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Liprologu vám zbývá. Vzdálenost mezi jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Liprolog. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Použití Liprologu v infúzních pumpách
• K infúzím Liprologu je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infúzí inzulinu lispro si v instrukcích výrobce ověřte vhodnost infúzní pumpy. Při jejich používání se řiďte návodem k obsluze.
• Spolu s pumpou používejte správný zásobník a katetr.
• Výměna infúzního setu (katetru a kanyly) musí být provedena podle pokynů uvedených v informaci o produktu dodané společně s infúzním setem.
• V případě hypoglykémie by měla být infuze přerušena až do jejího odeznění. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi zpomalit či zastavit.
• Porucha pumpy nebo ucpání infúzního setu může způsobit náhlý vzestup hladiny glukózy.
V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře.
• Při používání infúzní pumpy by neměl být Liprolog mísen s jinými inzuliny.
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii.
Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Liprologu nebo náhradní pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
Možné nežádoucí účinky
4.
Podobně jako všechny léky, může mít i přípravek Liprolog nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie: Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie: Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprologu, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetu
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprologu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Liprolog uchovávat
Před prvním použitím uchovávejte přípravek Liprolog v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15°- 30°C) a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte Liprolog, pokud je zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog 100 IU/ml, injekční roztok v zásobní vložce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou metakresol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog vypadá a co obsahuje toto balení
Přípravek Liprolog 100 IU/ml, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje 100 mezinárodních jednotek inzulínu lispro v jednom mililitru (100 IU/ml) injekčního roztoku. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog 100 IU/ml, injekční roztok v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Eunrapnu
Tn "Enn ^huh HegepnaHg" E.B. - Etnrapna Ten. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0
Eesti
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280
EkXúda
OAPMAIEPB-AIAAY A.E.B.E.
Tr|^: +30 210 629 4600
Espaňa Lilly S.A.
Tel: + 34-91 663 50 00 France
Lilly France S.A.S.
Tél: +33-(0) 1 55 49 34 34
Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Osterreich
Eli Lilly Ges. m.b.H.
Tel: + 43-(0) 1 711 780
Polska
Eli Lilly Polska Sp. z o.o.
Tel: +48 (0) 22 440 33 00
Portugal
Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600
Suomi/Finland
Italia
Eli Lilly Italia S.p.A. Tel: + 39- 055 42571
Sími + 354 540 8000
Tel: + 421 220 663 111
Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250
Latvija United Kingdom
Eli Lilly Holdings Limited parstavmeciba Latvija Eli Lilly and Company Limited
Tel: +371 67364000 Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog Mix25 100 IU/ml, injekční suspenze v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog Mix25 a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix25 užívat
3. Jak se přípravek Liprolog Mix25 užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog Mix25 uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog Mix25 a k čemu se používá
Přípravek Liprolog Mix25 se používá k léčbě diabetu. Liprolog Mix25 je předmísená suspenze. Její účinnou látkou je inzulin lispro. 25% inzulinu lispro obsaženého v Liprologu Mix25 je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin.
75% inzulinu lispro v Liprologu Mix25 je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog Mix25 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Liprolog Mix25 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Liprolog Mix25 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog Mix25 v kombinaci s déle působícím inzulinem.
U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix25 užívat
NEUŽÍVEJTE přípravek Liprolog Mix25
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog Mix25, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulín, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
•
Další léčivé přípravky a přípravek Liprolog Mix25
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Liprolog Mix25 užívá
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5 ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog Mix25.
Vždy užívejte přípravek Liprolog Mix25 přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze Vámi, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog Mix25 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog Mix25 podávejte podkožně. Jinou cestu aplikace byste neměli používat.
Za žádných okolností nesmí být Liprolog Mix25 podán nitrožilně.
Příprava Liprolog Mix25
• Bezprostředně před použitím by zásobní vložky obsahující Liprolog Mix25 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Liprolog Mix25 smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Liprolog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Liprologu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Liprolog Mix25
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Liprolog Mix25 sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero.
Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus, dokud nevyjde kapka Liprolog Mix25 z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Liprologu vám zbývá. Vzdálenost mezi jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Liprolog Mix25. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Jestliže jste užil(a) více přípravku Liprolog Mix25, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog Mix25, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog Mix25
Jestliže si podáte menší dávku přípravku Liprolog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní pero a zásobní vložky Liprolog Mix25 pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog Mix25
Jestliže si podáte menší dávku přípravku Liprolog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog Mix25 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie: Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie: Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprolog Mix25, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprolog Mix25 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulínu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Liprolog Mix25 uchovávat
Před prvním použitím uchovávejte přípravek Liprolog Mix25 v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15°- 30°C) a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Liprolog Mix25, tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog Mix25 100 IU/ml injekční suspenze v zásobní složce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodnýnebo kyselina chlorovodíková.
Jak přípravek Liprolog Mix25 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Liprolog Mix25 100 IU/ml je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekční suspenze. 25% inzulinu lispro obsaženého v Liprologu Mix25 je rozpuštěno ve vodě. 75% inzulinu lispro v Liprologu Mix25 je ve formě suspenze s protamin-sulfátem. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog Mix25 100 IU/ml, injekční suspenze v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgique/Belgie/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tq^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Latvija United Kingdom
Eli Lilly Holdings Limited parstavnieciba Latvija Eli Lilly and Company Limited Tel: +371 67364000 Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky : http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog Mix50 100 IU/ml, injekční suspenze v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog Mix50 a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix50 užívat
3. Jak se přípravek Liprolog Mix50 užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog Mix50 uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog Mix50 a k čemu se používá
Přípravek Liprolog Mix50 se používá k léčbě diabetu. Liprolog Mix50 je předmísená suspenze. Její účinnou látkou je inzulin lispro. 50% inzulinu lispro obsaženého v Liprologu Mix50 je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin.
50% inzulinu lispro v Liprologu Mix50 je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog Mix50 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Liprolog Mix50 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Liprolog Mix50 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog Mix50 v kombinaci s déle působícím inzulinem.
U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix50 užívat
NEUŽÍVEJTE přípravek Liprolog Mix50
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog Mix50, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulín, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog Mix 50
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Liprolog Mix50 užívá
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5 ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog Mix50.
Vždy užívejte přípravek Liprolog Mix50 přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze Vámi, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog Mix50 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog Mix50 podávejte podkožně. Jinou cestu aplikace byste neměli používat.
Za žádných okolností nesmí být Liprolog Mix50 podán nitrožilně.
Příprava Liprolog Mix50
• Bezprostředně před použitím by zásobní vložky obsahující Liprolog Mix50 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Liprolog Mix50 smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Liprolog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Liprologu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Liprolog Mix50
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Liprolog Mix50 sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus, dokud nevyjde kapka Liprolog Mix50 z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Liprologu vám zbývá. Vzdálenost mezi jednotlivými znaménky
na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Liprolog Mix50. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Jestliže jste užil(a) více přípravku Liprolog Mix50, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog Mix50, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog Mix50
Jestliže si podáte menší dávku přípravku Liprolog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní pero a zásobní vložky Liprolog Mix50 nebo pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog Mix50
Jestliže si podáte menší dávku přípravku Liprolog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog Mix50 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie: Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie: Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprolog Mix50, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprolog Mix50 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulínu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Liprolog Mix50 uchovávat
Před prvním použitím uchovávejte přípravek Liprolog Mix50 v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15°- 30°C) a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Liprolog Mix50, tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog Mix50 100 IU/ml injekční suspenze v zásobní složce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog Mix50 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Liprolog Mix50 100 IU/ml je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekční suspenze. 50% inzulinu lispro obsaženého v Liprologu Mix50 je rozpuštěno ve vodě. 50% inzulinu lispro v Liprologu Mix50 je ve formě suspenze s protamin-sulfátem. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog Mix50 100 IU/ml, injekční suspenze v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgique/Belgie/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. Tq^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Latvija United Kingdom
Eli Lilly Holdings Limited parstavnieciba Latvija Eli Lilly and Company Limited Tel: +371 67364000 Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog BASAL 100 IU/ml, injekční suspenze v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog BASAL a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog BASAL užívat
3. Jak se přípravek Liprolog BASAL užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog BASAL uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog BASAL a k čemu se používá
Přípravek Liprolog BASAL se používá k léčbě diabetu. Její účinnou látkou je inzulin lispro. Inzulin lispro v Liprologu BASAL je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog BASAL je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Liprolog BASAL dlouhodobější účinek.
Je možné, že vám lékař doporučí užívat Liprolog BASAL v kombinaci s rychle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog BASAL užívat
NEUŽÍVEJTE přípravek Liprolog BASAL
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog BASAL, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog BASAL
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Liprolog BASAL užívá
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5 ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog BASAL.
Vždy užívejte přípravek Liprolog BASAL přesně podle pokynů svého lékaře. Pokud si nejste jistý/á,
poraďte se se svým lékařem nebo lékárníkem. Pro prevenci přenosu infekce musí být jedna zásobní
vložka používána pouze Vámi, a to i v případě, že je jehla měněna při každém použití aplikační
pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog BASAL jako svůj bazální inzulin. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog BASAL podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Liprolog BASAL podán nitrožilně.
Příprava Liprolog BASAL
• Bezprostředně před použitím by zásobní vložky obsahující Liprolog BASAL měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Liprolog BASAL smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Liprolog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Liprologu BASAL nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Liprolog BASAL
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Liprolog BASAL sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus, dokud nevyjde kapka Liprolog BASAL z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Liprologu vám zbývá. Vzdálenost mezi jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Liprolog BASAL. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Jestliže jste užil(a) více přípravku Liprolog BASAL, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog BASAL, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog BASAL
Jestliže si podáte menší dávku přípravku Liprolog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Liprologu BASAL nebo náhradní pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog BASAL
Jestliže si podáte menší dávku přípravku Liprolog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog BASAL nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprolog BASAL, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprolog BASAL nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
Jak přípravek Liprolog BASAL uchovávat
5.
Před prvním použitím uchovávejte přípravek Liprolog BASAL v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15°- 30°C) a po 21 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Liprolog BASAL nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Liprolog BASAL, tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog BASAL 100 IU/ml injekční suspenze v zásobní složce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog BASAL 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Liprolog BASAL 100 IU/ml je bílá, sterilní injekční suspenze obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. Inzulin lispro v Liprologu BASAL je ve formě suspenze s protamin-sulfátem. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog BASAL 100 IU/ml, injekční suspenze v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci. Belgique/Belgie/Belgien Lietuva
Eli Lilly Benelux S.A./N.V. Eli Lilly Holdings Limited atstovybé
Tél/Tel: + 32-(0)2 548 84 84 Tel. +370 (5) 2649600
|
Btarapna Tn "Ean Ruru HegepaaHg" E.B. - Etarapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tr^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúrcpog Phadisco Ltd Tr^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog KwikPen 100 IU/ml, injekční roztok insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog KwikPen užívat
3. Jak se přípravek Liprolog KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog KwikPen a k čemu se používá
Přípravek Liprolog KwikPen se používá k léčbě diabetu. Díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Liprolog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog KwikPen v kombinaci s déle působícím inzulinem.
U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
Liprolog je vhodný pro děti a dospělé. Liprolog může být u dětí použit v případě, kdy je oproti normálnímu lidskému inzulinu přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog KwikPen užívat
NEUŽÍVEJTE přípravek Liprolog KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Liprolog KwikPen užívá
3.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a přepdlněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog KwikPen.
Vždy užívejte přípravek Liprolog KwikPen přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog v rozmezí 15 minut kolem jídla.
V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog podávejte podkožně. Nitrosvalové podání je možné pouze po doporučení lékařem.
Příprava Liprolog KwikPen
• Liprolog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací lahvičku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod, jak užívat předplněná inzulinová pera. Řiďte se pečlivě pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné. Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Liprolog KwikPen
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, zadek nebo břicho. Liprolog vždy účinkuje rychleji než normální lidský inzulin.
• Liprolog si nesmíte aplikovat nitrožilně. Aplikujte si ho dle rady lékaře či sestry. Nitrožilně vám může Liprolog podat pouze lékař. Udělá to jen za zvláštních okolností jako je chirurgický výkon nebo v případě, že jste nemocní a hladina glukózy ve vaší krvi je velmi vysoká.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu.Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou vzhůru, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá.
Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Použití Liprologu v infúzních pumpách
• K infuzím Liprologu je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infuzí inzulinu lispro si v instrukcích výrobce ověřte vhodnost infúzní pumpy. Při jejich používání se řiďte návodem k obsluze.
• Spolu s pumpou používejte správný zásobník a katetr.
• Výměna infúzního setu (katetru a kanyly) musí být provedena podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem.
• V případě hypoglykémie by měla být infúze přerušena až do jejího odeznění. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi zpomalit či zastavit.
• Porucha pumpy nebo ucpání infúzního setu může způsobit náhlý vzestup hladiny glukózy.
V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře.
• Při používání infúzní pumpy by neměl být Liprolog mísen s jinými inzuliny.
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii.
Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Liprologu nebo náhradní pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprologu, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprologu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo • máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Liprolog KwikPen uchovávat
Před prvním použitím uchovávejte přípravek Liprolog KwikPen v chladničce (2°C - 8°C). Chraňte před mrazem.
Používané pero Liprolog KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero KwikPen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Liprolog KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte Liprolog KwikPen, pokud je zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog KwikPen 100 IU/ml, injekční roztok obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou metakresol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog KwikPen vypadá a co obsahuje toto balení
Přípravek Liprolog 100 IU/ml, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje
100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml). Jedno pero Liprolog
KwikPen obsahuje 300 jednotek (3 mililitry). Liprolog KwikPen je balen po 5 nebo v multipaku po
2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Liprolog v předplněném peru
je stejný jako Liprolog zásobní vložky. V předplněném peru je zásobní vložka zabudována. Předplněné pero nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog KwikPen 100 IU/ml, injekční roztok:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgique/Belgie/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
EtnrapHH Tn "Enn ^huh HegepnaHg" E.B. - Etnrapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. TpA.: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
Suomi/Finland
Italia
Eli Lilly Italia S.p.A. Tel: + 39- 055 42571
Sími + 354 540 8000
Tel: + 421 220 663 111
Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250
T r(k: +357 22 715000
Tel: +371 67364000
United Kingdom
Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog Mix25 100 IU/ml KwikPen, injekční suspenze insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog Mix25 KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix25 KwikPen užívat
3. Jak se přípravek Liprolog Mix25 KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog Mix25 KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog Mix25 KwikPen a k čemu se používá
Přípravek Liprolog Mix25 se používá k léčbě diabetu. Liprolog Mix25 KwikPen je předmísená suspenze. Její účinnou látkou je inzulin lispro. 25% inzulinu lispro obsaženého v Liprologu Mix25 KwikPen je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 75% inzulinu lispro v Liprologu Mix25 KwikPen je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog Mix25 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Liprolog Mix25 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Liprolog Mix25 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog Mix25 KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix25 KwikPen užívat
NEUŽÍVEJTE přípravek Liprolog Mix25 KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog Mix25 KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Liprolog Mix25 KwikPen užívá
3.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a na předplněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog Mix25 KwikPen.
Vždy užívejte přípravek Liprolog Mix25 KwikPen přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog Mix25 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog Mix25 podávejte podkožně. Jinou cestu aplikace byste neměli používat.
Za žádných okolností nesmí být Liprolog Mix25 podán nitrožilně.
Příprava Liprolog Mix25 KwikPen
• Bezprostředně před použitím by pero mělo být desetkrát převaleno v dlaních a desetkrát převráceno o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod, jak užívat předplněná inzulinová pera. Řiďte se pečlivě pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné. Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Liprolog Mix25
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly.
Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu. Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou dolů, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá.
Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Liprolog Mix25, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog Mix25, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog Mix25
Jestliže si podáte menší dávku přípravku Liprolog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní pero a zásobní vložky Liprolog Mix25 nebo pro případ, že se vaše pero nebo zásobní složky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog Mix25
Jestliže si podáte menší dávku přípravku Liprolog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog Mix25 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprolog Mix25, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprolog Mix25 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho
|
hodin nebo dní. Příznaky mohou být následující: • ospalost |
• | |
|
• zarudnutí v obličeji |
• |
ovocná příchuť dechu |
|
• žízeň |
• |
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
Jak přípravek Liprolog Mix25 KwikPen uchovávat
5.
Před prvním použitím uchovávejte přípravek Liprolog Mix25 KwikPen v chladničce (2°C - 8°C). Chraňte před mrazem.
Používané pero Liprolog Mix25 KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero Kwikpen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Liprolog Mix25 KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Liprolog Mix25 KwikPen, tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog Mix25 100 IU/ml KwikPen, injekční suspenze obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog Mix25 100 IU/ml KwikPen, injekční suspenze vypadá a co obsahuje toto balení
Přípravek Liprolog Mix25 100 IU/ml KwikPen je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekční suspenze.
25% inzulinu lispro obsaženého v Liprologu Mix25 je rozpuštěno ve vodě. 75% inzulinu lispro v Liprologu Mix25 je ve formě suspenze s protamin-sulfátem. Jedno pero Liprolog Mix25 KwikPen obsahuje 300 jednotek (3 mililitry). Liprolog Mix25 KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Liprolog Mix25 v předplněném peru je stejný jako Liprolog Mix25 zásobní vložky. V přeplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog Mix25 100 IU/ml KwikPen, injekční suspenze jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapnn Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. Tr|A,: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Tel: +371 67364000
T r(k: +357 22 715000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropskéagentury pro léčivé přípravky : http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog Mix50 100 IU/ml KwikPen, injekční suspenze insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog Mix50 KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix50 KwikPen užívat
3. Jak se přípravek Liprolog Mix50 KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog Mix50 KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog Mix50 KwikPen a k čemu se používá
Přípravek Liprolog Mix50 se používá k léčbě diabetu. Liprolog Mix50 KwikPen je předmísená suspenze. Její účinnou látkou je inzulin lispro. 50% inzulinu lispro obsaženého v Liprologu Mix50 KwikPen je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 50% inzulinu lispro v Liprologu Mix50 KwikPen je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog Mix50 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Liprolog Mix50 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Liprolog Mix50 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog Mix50 KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog Mix50 KwikPen užívat
NEUŽÍVEJTE přípravek Liprolog Mix50 KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog Mix50, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• Upozornění a opatřeníJe-li hladina cukru ve vaší krvi dobře udržována současnou léčbou
inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulín, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog Mix50 KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Liprolog Mix50 KwikPen užívá
3.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a na předplněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog Mix50 KwikPen.
Vždy užívejte přípravek Liprolog Mix50 KwikPen přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog Mix50 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog Mix50 podávejte podkožně. Jinou cestu aplikace byste neměli používat.
Za žádných okolností nesmí být Liprolog Mix50 podán nitrožilně.
Příprava Liprolog Mix50 KwikPen
• Bezprostředně před použitím by pero KwikPen mělo být desetkrát převaleno v dlaních a desetkrát převráceno o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod, jak užívat předplněná inzulinová pera. Řiďte se pečlivě pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné. Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Liprolog Mix50
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu. Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou dolů, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá.
Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Liprolog Mix50, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog Mix50, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog Mix50
Jestliže si podáte menší dávku přípravku Liprolog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní pero a zásobní vložky Liprolog Mix50 nebo pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog Mix50
Jestliže si podáte menší dávku přípravku Liprolog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog Mix50 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprolog Mix50, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprolog Mix50 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho
|
hodin nebo dní. Příznaky mohou být následující: • ospalost |
• | |
|
• zarudnutí v obličeji |
• |
ovocná příchuť dechu |
|
• žízeň |
• |
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
Jak přípravek Liprolog Mix50 KwikPen uchovávat
5.
Před prvním použitím uchovávejte přípravek Liprolog Mix50 KwikPen v chladničce (2°C - 8°C). Chraňte před mrazem.
Používané pero Liprolog Mix50 KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero Kwikpen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Liprolog Mix50 KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Liprolog Mix50 KwikPen, tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog Mix50 100 IU/ml KwikPen, injekční suspenze obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog Mix50 100 IU/ml KwikPen, injekční suspenze vypadá a co obsahuje toto balení
Přípravek Liprolog Mix50 100 IU/ml KwikPen je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekční suspenze.
50% inzulinu lispro obsaženého v Liprologu Mix50 je rozpuštěno ve vodě. 50% inzulinu lispro v Liprologu Mix50 je ve formě suspenze s protamin-sulfátem. Jedno pero Liprolog Mix50 KwikPen obsahuje 300 jednotek (3 mililitry). Liprolog Mix50 KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Liprolog Mix50 v předplněném peru je stejný jako Liprolog Mix50 zásobní vložky. V přeplněném peru je zásobní vložka zabudována. Předplněné pero nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog Mix50 100 IU/ml KwikPen, injekční suspenze jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapnn Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. Tr|A,: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Tel: +371 67364000
T r(k: +357 22 715000
Tato příbalová informace byla naposledy s revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Liprolog BASAL 100 IU/ml KwikPen , injekční suspenze insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradněVám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog BASAL KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog BASAL KwikPen užívat
3. Jak se přípravek Liprolog BASAL KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog BASAL KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog BASAL KwikPen a k čemu se používá
Přípravek Liprolog BASAL KwikPen se používá k léčbě diabetu. Její účinnou látkou je inzulin lispro. Inzulin lispro v Liprologu BASAL KwikPen je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog BASAL je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Liprolog BASAL dlouhodobější účinek.
Je možné, že vám lékař doporučí užívat Liprolog BASAL v kombinaci s rychle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog BASAL KwikPen užívat
NEUŽÍVEJTE přípravek Liprolog BASAL KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog BASAL, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog BASAL
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Liprolog BASAL KwikPen užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na předplněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Liprolog BASAL KwikPen.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog BASAL jako svůj bazální inzulin. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog BASAL podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Liprolog BASAL podán nitrožilně.
Příprava Liprolog BASAL KwikPen
• Bezprostředně před použitím by pero KwikPen mělo být desetkrát převaleno v dlaních a desetkrát převráceno o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod, jak užívat předplněná inzulinová pera. Řiďte se pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste z pera KwikPen odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné. Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Liprolog BASAL
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím zajistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu. Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou dolů, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá. Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Liprolog BASAL, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog BASAL, než jste měl(a), může dojít ke snížení hladiny
cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky, jak vám poradil lékař, a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog BASAL
Jestliže si podáte menší dávku přípravku Liprolog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Liprologu BASAL nebo náhradní pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog BASAL
Jestliže si podáte menší dávku přípravku Liprolog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Liprolog BASAL nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprolog BASAL, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení
nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprolog BASAL nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
Jak přípravek Liprolog BASAL KwikPen uchovávat
5.
Před prvním použitím uchovávejte přípravek Liprolog BASAL KwikPen v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používané pero Liprolog BASAL KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero Kwikpen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Liprolog BASAL KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Liprolog BASAL KwikPen, tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog BASAL 100 IU/ml KwikPen , injekční suspenze obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog BASAL 100 IU/ml KwikPen , injekční suspenze vypadá a co obsahuje toto balení
Přípravek Liprolog BASAL 100 IU/ml KwikPen je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. Inzulin lispro v Liprologu BASAL je ve formě suspenze s protamin-sulfátem. Jedno pero Liprolog BASAL KwikPen obsahuje 300 jednotek (3 mililitry). Liprolog BASAL KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Liprolog BASAL KwikPen v předplněném peru je stejný jako Liprolog BASAL zásobní vložky. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero KwikPen nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Liprolog BASAL 100 IU/ml KwikPen, injekční suspenze jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapnn Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Berlin-Chemie AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. Tr|A,: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Tel: +371 67364000
T r(k: +357 22 715000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
KwikPen™
INZULÍNOVÉ PEROInzulinové pero

Lilly
PŘED POUŽITÍM SI PROSÍM PŘEČTĚTE TENTO NÁVOD
Úvod
Pero KwikPen™ je navrženo pro jednoduché použití. Je to jednorázové pero obsahující 3 ml (300 jednotek) inzulínu 100 IU/ml. V jedné injekci můžete aplikovat dávku od 1 do 60 jednotek inzulínu. Dávku můžete nastavovat po jedné jednotce. V případě, že nastavíte příliš mnoho jednotek inzulínu, můžete dávku opravit, aniž by při tom došlo ke ztrátě inzulínu.
Před používáním pera KwikPen si pečlivě přečtěte celý návod k použití a řiďte se pečlivě jeho pol V případě nedodržení přesného postupu si můžete aplikovat příliš velkou nebo příliš malou dávku inzulínu.
Vaše pero KwikPen můžete pro aplikaci injekce používat pouze Vy osobně. Své pero ani jehly nikým nesdílejte, jinak se vystavujete riziku přenosu nákaz. Pro každou injekci použijte novou je
Jestliže se Vám zdá pero nebo některá jeho část poškozená, pero NEPOUŽÍVEJTE. Vždy s set noste náhradní pero pro případ ztráty nebo poškození.
Pero není určeno osobám nevidomým nebo osobám s poškozeným zrakem, pokud jim nemůže po
osoba, která je s obsluhou pera seznámena.
Příprava pera KwikPen
Důležitá upozornění
• Čtěte a dodržujte pokyny z příbalové informace inzulínu.
Před každou injekcí na etiketě zkontrolujte dobu použitelnosti pera a přesvědčte se, že používáte správný typ inzulínu. Etiketu z pera neodstraňujte.
Poznámka: Barva dávkovacího tlačítka Vašeho pera KwikPen odpovídá barevnému označení na etiketě a je specifická pro jednotlivé typy inzulinu. V tomto návodu je dávkovací tlačítko zobrazeno jako šedé. Tělo pera je modré a označuje, že pero obsahuje některý z přípravků Liprolog.
Rozlišení barvy dávkovacího tlačítka podle typu:
|
• |
G |
• |
• |
|
Liprolog |
Liprolog Mix25 |
Liprolog Mix50 |
Liprolog Basal |
• Ošetřující lékař vám předepsal inzulin, který je pro vás nejvhodnější. Jakékoliv změny v inzulínové léčbě by měly být prováděny pouze pod dohledem lékaře.
• Pro použití s perem KwikPen jsou doporučeny jehly firmy Becton, Dickinson and Company (BD).
• Před použitím pera se ujistěte, že je jehla úplně dotažena.
• Pro případ potřeby si tyto pokyny uschovejte.
Často kladené otázky týkající se přípravy pera KwikPen
• Jak by můj inzulin měl vypadat? Některé inzulíny jsou zakalené, zatímco jiné jsou čiré. Kontrolu svého konkrétního inzulínu proveďte podle jeho popisu v příbalovém letáku.
• Co bych měl/a dělat v případě, že je moje předepsaná dávka vyšší než 60 jednotek? Pokud je vaše předepsaná dávka vyšší než 60 jednotek inzulinu, může být zapotřebí více injekcí, nebo se můžete spojit se svým lékařem.
• Proč bych měl/a pro každou injekci použít novou jehlu? Jestliže je jehla používána opakovaně, můžete si podat chybnou dávku inzulínu, ucpat jehlu, ucpat pero nebo získat infekci, protože není zajištěna sterilita.
• Co bych měl/a dělat v případě, že si nejsem jistý/á, kolik v náplni zbývá inzulinu? Obraťte pero dolů koncem, na který se připojuje jehla.Stupnice na průhledné části držáku náplně vám ukáže přibližný počet zbývajících jednotek. Tento údaj NEPOUŽÍVEJTE k odměření dávky inzulinu.
• Co bych měl/a dělat, když nemohu sundat kryt pera? Kryt pera sundejte přímým tahem. Jestliže máte potíže se sundáním krytu, jemně krytem pro srovnání pootočte tam a zpět a potom kryt sundejte přímým tahem.
Prostříknutí pera KwikPen
Důležitá upozornění
• Pero před každou injekcí prostříkněte. Aby bylo pero připraveno k podání dávky, musí být před každou injekcí prostříknuto tak, aby byl zjevný vytékající proud inzulínu.
• Jestliže pero neprostříknete tak, aby byl zjevný vytékající proud inzulinu, můžete si aplikovat příliš velkou nebo příliš malou dávku inzulínu.
Často kladené otázky týkající se prostříknutí pera
• Proč bych měl prostříknout pero před každou injekcí?
1. Zajišťuje, že pero je správně připraveno.
2. Ověřuje, že po zmáčknutí dávkovacího tlačítka bude z jehly vytékat proud inzulínu.
3. Odstraňuje vzduch, který se v průběhu normálního používání mohl nahromadit v jehle nebo v izásobní vložce s inzulínem.
• Co bych měl/a udělat, pokud nemohu při prostřikování pera KwikPen úplně zmáčknout dávkovací tlačítko?
1. Nasaďte novou jehlu.
2. Prostříkněte pero.
• Co bych měl/a udělat, pokud v zásobní vložce vidím vzduchové bubliny? Potřebujete prostříknout pero. Neuchovávejte pero s nasazenou jehlou, může to způsobit hromadění vzduchových bublin v zásobní vložce s inzulínem. Malá vzduchová bublinka neovlivní dávku a můžete pokračovat v aplikaci dávky jako obvykle.
Podání dávky
Důležitá upozornění
• Dodržujte pokyny správné injekční techniky doporučené vaším ošetřujícím lékařem.
• Podání úplné dávky zajistíte tak, že stisknete dávkovací tlačítko a před vytažením jehly z kůže je držíte stisknuté, dokud pomalu nenapočítáte do 5. Pokud z pera vytéká inzulin, nebyla jehla
v kůži držena dostatečně dlouho.
• Kapka inzulinu na špičce jehly je normální. Neovlivní velikost dávky.
• Pero neumožňuje nastavit vyšší dávka, než je množství inzulínu zbývající v peru.
• Pokud si nejste jisti, zda jste si podali celou dávku, nepodávejte si další dávku. Kontaktujte společnost Lilly nebo svého lékaře
• Pokud je vaše předepsaná dávka vyšší než počet jednotek zbývajících v peru, můžete si buď podat množství zbývající v současném peru a pro podání další části dávky použít nové pero nebo podat celou dávku novým perem.
• Nezkoušejte si podat dávku otáčením dávkovacího tlačítka. Dávku si NEPODÁTE otáčením dávkovacího tlačítka. Aby byla dávka podána, musíte ZMÁČKNOUT injekční tlačítko kolmo dolů.
• V průběhu aplikace se nepokoušejte změnit nastavenou dávku.
• Zde popsané způsoby zacházení s jehlami nenahrazují místní normy pro zacházení s tímto materiálem.
• Po ukončení každé injekce odstraňte jehlu.
Často kladené otázky týkající se podání dávky
• Proč je obtížné stlačit injekční tlačítko při aplikaci injekce?
1. Jehla může být ucpaná. Zkuste nasadit novou jehlu. Když to uděláte, můžete vidět z jehly vytékat inzulín. Prostříkněte pero.
2. Při rychlém stlačení injekčního tlačítka se může toto tlačítko mačkat obtížněji. Pomalejší stlačení může být snadnější.
3. Při použití jehly s větším průměrem jde injekční tlačítko zmáčknout snadněji. Poraďte se se svým lékařem, jaké jehly jsou pro vás nejlepší.
4. Jestliže žádný z těchto postupů nepomůže, může být nutné pero vyměnit.
• Co bych měl/a udělat, pokud je pero KwikPen ucpané? Pero je ucpané, pokud je obtížné aplikovat nebo nastavit dávku. Pro zprůchodnění pera:
1. Nasaďte novou jehlu. Když to uděláte, můžete vidět z jehly vytékat inzulín.
2. Prostříkněte pero.
3. Nastavte dávku a aplikujte ji.
Nepokoušejte se pero promazat, mohl by se poškodit jeho mechanismus.
Dávkovací tlačítko může jít zmáčknout těžce tehdy, jestliže je vnitřek pera znečištěn cizorodými látkami (nečistoty, prach, jídlo, inzulin nebo jiné tekutiny). Vyvarujte se znečištění vnitřku pera cizorodými látkami.
• Proč inzulin vytéká z jehly po ukončení aplikace dávky? Mohl/a jste vytáhnout jehlu z kůže příliš rychle.
1. Ujistěte se, že v dávkovacím okénku vidíte symbol 0.
2. Při aplikaci příští dávky injekční tlačítko držte pevně stlačené a před vytažením jehly pomalu počítejte do 5.
• Co bych měl/a udělat, pokud je nastavena dávka a dávkovací tlačítko bylo nedopatřením zmáčknuto bez nasazené jehly?
1. Nastavte pero zpět na nulu.
2. Nasaďte novou jehlu.
3. Prostříkněte pero.
4. Nastavte dávku a aplikujte ji.
• Co bych měl/a dělat, pokud jsem nastavil/a chybnou dávku (příliš vysokou nebo příliš nízkou)? Otočením dávkovacího tlačítka tam nebo zpět dávku opravíte.
• Co bych měl/a dělat, pokud z jehly vytéká inzulin v průběhu nastavování nebo opravování dávky? Dávku si neaplikujte, protože nemusí být kompletní. Nastavte pero zpět na 0 a znovu jej prostříkněte (viz Běžné užívání část “Prostříknutí pera KwikPen”, kroky 2 B-D). Nastavte dávku a aplikujte ji.
• Co bych měl/a dělat, pokud nemohu nastavit celou předepsanou dávku? Pero neumožňuje nastavení větší dávky, než je zbývající počet jednotek inzulínu v zásobní vložce. Např., pokud budete potřebovat 31 jednotek a v zásobní vložce jich zbývá pouze 25, více než 25 jednotek nebudete moci nastavit. Nesnažte se nastavit pero za tuto hodnotu. Pokud v peru zůstává pouze neúplná dávka, máte tyto možnosti:
1. Podat část dávky a pro podání zbývající dávky použít nové pero.
nebo
2. Použít nové pero na podání celé dávky.
• Proč nemohu nastavit dávku a použít malé množství inzulínu, které zůstává v zásobní vložce? Pero je navrženo k podání nejméně 300 jednotek inzulínu. Konstrukce pera nedovoluje zásobní vložku zcela vyprázdnit, protože zbývající malé množství inzulínu nemůže být podáno přesně.
Uchovávání a likvidace
Důležitá upozornění
• Před prvním použitím uchovávejte pero v ledničce (2°C - 8°C). Nepoužívejte pero, pokud bylo zmrazeno.
• Pero uchovávejte při pokojové teplotě a chraňte je před teplem a světlem.
• Neuchovávejte pero s nasazenou jehlou. Pokud je jehla ponechána na peru, inzulin může z pera vytékat, vysrážet se v jehle, a tím ji ucpat, nebo se v zásobní vložce mohou tvořit vzduchové bubliny.
• Úplné pokyny k uchovávání inzulínu naleznete v příbalové informaci.
• Po prvním použití by pero nemělo být použito po uplynutí doby uvedené v příbalové informaci.
• Použité jehly vyhoďte do uzavíratelné nádoby, která nejde propíchnout, nebo podle pokynů lékaře.
• Použitá pera znehodnoťte bez nasazené jehly podle pokynů lékaře.
• Plnou nádobku na jehly nevyhazujte do nádoby na recyklovatelný odpad.
• Informujte se u svého lékaře nebo lékárníka o místních možnostech, jak nádobku správně zlikvidovat.
• Zde popsané způsoby zacházení s jehlami nenahrazují místní normy pro zacházení s tímto materiálem
• Pero uchovávejte mimo dosah dětí.
Jestliže máte jakékoliv dotazy nebo problémy se svým perem KwikPen, kontaktujte svého
lékaře.
Příprava
Části pera
Komplet pera KwikPen a jehly * prodáváno zvlášť

Vnější kryt Vnitřní Jehla jehly kryt jehly
Spona krytu
Etiketa pera Ukazatel

Kryt pera Pryžový uzávěr
Držák zásobní Tělo vložky pera
Části jehly
(Jehly nejsou součástí balení)
Papírová
fólie
Části pera KwikPen
Dávko-vací tlačítko Dávkovací okénko
Rozlišení barvy dávkovacího tlačítka podle typu:
|
• |
G |
• |
$ |
|
Liprolog |
Liprolog Mix25 |
Liprolog Mix50 |
Liprolog Basal |

Přímým tahem odstraňte pera. Krytem neotáčejte Neodtraňujte z pera etiketu.
Ujistěte se, že jste zkontroloval/a:
• typ inzulínu
• datum použitelnosti
• vzhled

Pouze pro zakal inzulíny:
10x pero zlehka poválejte v dlaní Dále pero 10x převraťte. Prom odstraňte papírov je důležité a zaji fólii. že si aplikujete
správnou dávku. Otřete malý pryž< Inzulín by měl uzávěr na konci vypadat rovnom< držáku zásobní promísený. vložky tamponem s desinfekcí.
D.

Jehlu našroubujte c dotažení.
Upozornění: Vždy zkontrolujte etiketu pera a ujistěte se, že používáte správný typ inzulinu.
2. Prostříknutí pera KwikPen
Upozornění: Pokud neprostříknete pero před každou injekcí tak, aby byl zjevný vytékající proud inzulin můžete si aplikovat příliš velkou nebo příliš malou dávku inzulínu.
A.

B.

C.

Odstraňte vnější kr jehly. Nevyhazují*
Odstraňte vnitřní k jehly a vyhoďte jej
Otáčením dávkova tlačítka nastavte 2 jednotky.
Oto čte pero jehlou nahoru.
Poklepávejte na dr zásobní vložky tak se vzduch shromáž nahoře.
D.
• S jehlou směrem nahoru stiskněte dávkovací tlač nadoraz až se v dávkov okénku objeví 0.
• Držte dávkovací tlačítko pomalu počítejte do 5.
• Prostříknutí je dokončer pokud ze špičky jehly vytéká proud inzulínu.
• Pokud se proud inzulínu neobjeví, opakujte až čtyřikrát kroky 2B až 2

Pozn: Pokud nevidíte vyték proud inzulínu ze špičky jel nastavení pera je obtížnější, vyměňte jehlu a prostříknět pero.
3.Podání dávky A.

B.


C.

^_J

Nastavte požadovanou dávku otáčením dávkovacího tlačítka. Jestliže nastavíte příliš vysokou dávku, můžet opravit otočením dávkovacího tlačítka z
Proveďte vpich injekči technikou podle pouče vašeho lékaře.
Pro podání celé dávky i tlačítko zmáčknuté a pomalu počítejte do 5
Vytáhněte jehlu z kůže
Na jehlu opatrně nasaďte vnější kryt.
Jehlu s nasazeným krytem odstraňte odšroubováním a znehodnoťte ji podl rady vašeho lékaře.
Přiložte palec na injekč tlačítko a pevně je stiskněte, dokud se nezastaví.
Pozn.: Zkontrolováním číslice 0 v dávkovacím okénku se ujistěte, že j: podal/a celou dávku.
Pozn: Po každé inje odstraňte jehlu, předejdete tím vnik vzduchu do zásobn vložky.
Neuchovávejte pere nasazenou jehlou.

Nasaďte zpět kryt p přímým zatlačením.
Příklad: 10 jednotek.

Příklad: 15 jednotek.

Pozn: pero neumožňuje nastavení vyšší dávky je zbývající počet jednotek v peru.
Pokud si nejste jisti, zda jste si podali celou dávku, nepodávejte si další dávku.
Sudé hodnoty jsou zobrazeny na tlačítku. Liché hodnoty jsou zobrazeny jako celé čáry mezi sudými čísly.
Datum revize textu:
Příbalová informace: informace pro uživatele
Liprolog 200 jednotek/ml, injekční roztok v předplněném peru insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Liprolog 200 jednotek/ml KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog 200 jednotek/ml KwikPen užívat
3. Jak se přípravek Liprolog 200 jednotek/ml KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Liprolog 200 jednotek/ml KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Liprolog 200 jednotek/ml KwikPen a k čemu se používá
Přípravek Liprolog 200 jednotek/ml KwikPen se používá k léčbě diabetu. Díky lehce pozměněnému inzulinu lispro oproti normálnímu lidskému inzulinu má Liprolog rychlejší účinek. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
Pokud Vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Liprolog je náhražkou Vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Liprolog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Liprolog 200 jednotek/ml KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem.
Liprolog 200 jednotek/ml by měl být vyhrazen pro léčbu dospělých pacientů s diabetem, kteří potřebují denní dávky vyšší než 20 jednotek rychle účinkujícího inzulinu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Liprolog 200 jednotek/ml KwikPen užívat
NEUŽÍVEJTE přípravek Liprolog 200 jednotek/ml KwikPen
- jestliže jste alergický(á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat. (viz bod 3 Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a).
Upozornění a opatření
• Injekční roztok Liprolog 200 jednotek/ml v předplněném peru (KwikPen) musí být aplikován POUZE tímto předplněným perem. Nepřenášejte inzulin lispro ze svého přípravku Liprolog 200 jednotek/ml KwikPen do injekční stříkačky. Značení na inzulínové stříkačce nebude měřit dávku správně. Může pak dojít k závažnému předávkování, které způsobí snížení hladiny cukru v krvi a může ohrozit Váš život. Nepřenášejte inzulin ze svého přípravku Liprolog 200 jednotek/ml KwikPen do žádného jiného prostředku k dávkování inzulinu, jako jsou inzulínové pumpy.
• NEMÍCHEJTE přípravek Liprolog 200 jednotek/ml injekční roztok v předplněném peru (KwikPen) s žádným jiným inzulinem nebo jiným léčivým přípravkem. Injekční roztok přípravku Liprolog 200 jednotek/ml nesmí být ředěn.
• Je-li hladina cukru ve Vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete v bodě 4 této příbalové informace. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle?
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u Vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost nebo rychlý nárůst tělesné hmotnosti nebo místní otoky.
Další léčivé přípravky a přípravek Liprolog 200 jednotek/ml KwikPen
Vaše potřeba inzulinu může být změněna, pokud užíváte
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika (např. metformin, akarboza, sloučeniny sulfonylmočoviny, pioglitazon, empagliflozin, inhibitory DPP-4, jako je sitagliptin nebo saxagliptin),
• kyselinu acetylsalicylovou (Acylpyrin, Anopyrin apod.),
• sulfonamidy,
• analoga somatodtatinu (jako je oktreotid, používaný k léčbě vzácných stavů, při kterých tělo produkuje příliš mnoho růstového hormonu),
• „beta-2 mimetika”, jako je salbutamol nebo terbutalin, určená k léčbě astmatu, nebo ritodrin, používaný pro zastavení předčasného porodu,
• beta-blokátory k léčbě vysokého tlaku, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol (přípravek ovlivňující ovulaci),
• některé inhibitory angiotenzin konvertujícího enzymu (ACE), které se používají k léčbě některých srdečních onemocnění nebo k léčbě vysokého krevního tlaku (např. kaptopril, enalapril) a
• specifické léčivé přípravky užívané k léčbě vysokého krevního tlaku, poškození ledvin z důvodu diabetu a některých srdečních potíží (blokátory receptorů angiotenzinu II).
Prosím, informujte svého lékaře o všech lécích, které užíváte, které jste užíval(a) v nedávné době, nebo které možná budete užívat (viz také bod „Upozornění a opatření “).
Přípravek Liprolog s alkoholem
Hladiny cukru v krvi mohou po požití alkoholu buď stoupat, nebo klesat. Z tohoto důvodu se může měnit množství inzulinu, které potřebujete.
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro Vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizelé
3. Jak se přípravek Liprolog 200 jednotek/ml KwikPen užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a přepdlněném peru. Ujistěte se, že jste obdrželi lékařem předepsaný Liprolog 200 jednotek/ml KwikPen.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Liprolog 200 jednotek/ml je určen pro pacienty, kteří užívají denní dávku rychle účinkujícího inzulinu vyšší než 20 jednotek.
Nepřenášejte inzulin lispro ze svého přípravku Liprolog 200 jednotek/ml KwikPen do injekční stříkačky. Značení na inzulinové stříkačce nebude měřit dávku správně. Může pak dojít k závažnému předávkování, které způsobí snížení hladiny cukru v krvi a může ohrozit Váš život.
Nepoužívejte přípravek Liprolog 200 jednotek/ml Kwikpen injekční roztok v inzulinové infuzní pumpě.
Dávkování
• Za normálních okolností byste si měli aplikovat Liprolog v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Liprolog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Liprolog podávejte podkožně (subkutánně).
Příprava Liprolog 200 jednotek/ml KwikPen
• Liprolog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho, pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací injekci zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod, jak používat toto předplněné inzulínové pero. Řiďte se pečlivě pokyny v návodu. Následují některá upozornění.
• Používejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné .Jsou-li však bubliny velké, mohou ovlivnit velikost dávky inzulinu.
Aplikace přípravku Liprolog KwikPen
• Před aplikací injekce dobře očistěte kůži, jak Vám bylo ukázáno. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace, a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, hýždě nebo břicho. Liprolog vždy účinkuje rychleji než normální lidský inzulin.
• Nepodávejte přípravek Liprolog 200 jednotek/ml KwikPen injekční roztok přímo do žíly (intravenózně).
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte jehlu pomocí vnějšího krytu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém použití pera KwikPen použijte novou jehlu.Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou vzhůru, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá.
• Je-li pero KwikPen prázdné, znovu ho nepoužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a)
Jestliže jste užil(a) více přípravku Liprolog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se Váš stav zhorší, začne se Vám hůře dýchat a Vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog, než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, pocit nevolnosti, zvracení, ztrátu tekutin (dehydrataci), bezvědomí, kóma nebo dokonce smrt (viz bod 4 „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Liprologu 100 jednotek/ml nebo pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy u sebe noste cukr.
Jestliže jste přestal(a) užívat přípravek Liprolog
Jestliže si podáte menší dávku přípravku Liprolog, než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Závažná alergie je vzácná (může se vyskytnout až u 1 z 1000 pacientů). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• dušnost • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Liprologu, okamžitě kontaktujte lékaře.
Místní alergie je častá (může se vyskytnout až i 1 z 10 pacientů). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Lipodystrofie (ztlušťování nebo dolíčkování kůže) je méně častá (může se vyskytnout až u 1 ze 100 pacientů). Všimnete-li si ztluštění nebo dolíčkování kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny otoky (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetu
Hypoglykémie
Hypoglykémie ("hypo”- nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Liprologu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se změnila Vaše potřeba inzulinu; nebo
• zhorší-li se Vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi (viz bod 2).
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, jako je řízení vozidla, ve kterých by hypoglykémie ohrožovala Vás nebo ostatní.
Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”- příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Liprolog nebo jiný inzulin;
• podáte-li si méně inzulinu, než vám lékař doporučil;
• pokud jíte mnohem více, než vám dieta povoluje, nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První příznaky nastupují pomalu, po mnoho
|
hodin nebo dní. Příznaky mohou být následující: • ospalost |
• | |
|
• zarudnutí v obličeji |
• |
ovocný zápach dechu |
|
• žízeň |
• |
Závažnými příznaky jsou dušnost a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Liprolog 200 jednotek/ml KwikPen uchovávat
Přípravek uchovávejte mimo dohled a dosah dětí.
Přípravek Liprolog 200 jednotek/ml KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Před prvním použitím uchovávejte přípravek Liprolog 200 jednotek/ml KwikPen v chladničce při teplotě (2 °C - 8 °C). Chraňte před mrazem.
Používané pero Liprolog 200 jednotek/ml KwikPen uchovávejte při pokojové teplotě (15 °C - 30 °C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero KwikPen neuchovávejte v chladničce (chraňte před chladem). Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Nepoužívejte Liprolog 200 jednotek/ml KwikPen, pokud je roztok zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho, pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Liprolog KwikPen 200 jednotek/ml, injekční roztok obsahuje
- Léčivou látkou je inzulin lispro. Jeden ml roztoku obsahuje 200 jednotek (IU) inzulínu lispro. Jedno předplněné pero (3 ml) obsahuje 600 jednotek (IU) inzulinu lispro.
- Pomocnými látkami přípravku Liprolog 200 jednotek/ml KwikPen jsou metakresol, glycerol, trometamol, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Liprolog 200 jednotek/ml KwikPen vypadá a co obsahuje toto balení
Přípravek Liprolog 200 jednotek/ml KwikPen, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje 200 mezinárodních jednotek inzulinu lispro v jednom mililitru (200 jednotek/ml). Jedno pero Liprolog 200 jednotek/ml KwikPen obsahuje 600 jednotek (3 mililitry). Liprolog 200 jednotek/ml KwikPen je balen 5 předplněných perech nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Výrobce
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Etarapnu
Tn "Eau Hunu HegepaaHg" E.B. - Etarapua Tea. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
BERLIN-CHEMIE AG Postfach 1108, 12474 Berlin Tel.: 030/6707-0
Eesti Norge
Eli Lilly Holdings Limited Eesti filiaal Eli Lilly Norge A.S.
Tel: +372 6817 280 Tlf: + 47 22 88 18 00
ELXába Osterreich
OAPMAIEPB-AIAAY A.E.B.E. Eli Lilly Ges. m.b.H.
Tr|^: +30 210 629 4600 Tel: + 43-(0) 1 711 780
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tr|k: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
NÁVOD K OBSLUZE
Liprolog 200 jednotek/ml injekční roztok v předplněném peru
Insulinům lisprum

PŘED POUŽITÍM SI PROSÍM PŘEČTĚTE TENTO NÁVOD
A POUŽÍVEJTE POUZE V TOMTO PERU, JINAK MŮŽE DOJÍT K ZÁVAŽNÉMU PŘEDÁVKOVÁNÍ
Před použitím přípravku Liprolog 200 jednotek/ml KwikPen injekční roztok si pečlivě přečtěte návod k obsluze a přečtěte si jej pokaždé, když dostanete další přípravek Liprolog 200 jednotek/ml KwikPen. Může obsahovat nové informace. Tyto informace nenahrazují konzultaci s Vaším lékařem o Vašem zdravotním stavu nebo Vaší léčbě.
Liprolog® 200 jednotek/ml KwikPen (“pero”) je jednorázové předplněné pero obsahující 3 ml (600 jednotek, 200 jednotek/ml) injekčního roztoku inzulinu lispro. Jedním perem si můžete podat více dávek. Dávka na peru se nastavuje po jedné jednotce. V jedné injekci můžete aplikovat dávku od 1 do 60 jednotek. Je-li Vaše dávka vyšší než 60 jednotek, budete si potřebovat podat víc než jednu injekci. Při podání injekce se píst pohybuje jen velmi málo a vy jeho pohyb nemusíte zaznamenat. Píst se dostane na konec zásobní vložky pouze v případě, že využíváte všech 600 jednotek v peru.
Toto pero je konstruováno tak, že Vám umožní podat si více dávek než jiná pera, která jste možná v minulosti používal(a). Nastavte si svoji obvyklou dávku tak, jak Vás instruoval Váš lékař.
Liprolog KwikPen je dostupné ve dvou silách, 100 jednotek/ml and 200 jednotek/ml. Aplikujte si Liprolog 200 jednotek/ml POUZE svým perem. NEPŘENÁŠEJTE inzulin ze svého pera do jiné inzulínové aplikační pomůcky. Injekční stříkačky a inzulinové pumpy nebudou dávkovat inzulin 200 jednotek/ml správně. Může dojít k závažnému předávkování, které zapříčiní velmi nízké hladiny cukru v krvi, které mohou ohrozit Váš život.
Své pero nesdílejte s jinými osobami ani v případě, že jste vyměnil(a) jehlu. Jehly nepoužívejte opakovaně ani je nesdílejte s jinými osobami. Mohl(a) byste na ně přenést infekci nebo od nich infekci dostat.
Pero není určeno osobám nevidomým nebo osobám s poškozeným zrakem, pokud jim nemůže pomoci osoba, která je s obsluhou pera seznámena.
Části pera KwikPen
Kryt pera

Držák zásobní vložky Štítek
Ukazatel dávky
Spona krytu P ryžový uzávěr

Části jehly
(Jehly nejsou součástí balení) Jehla
Dávkovací tlačítko s vínově červeným kroužkem


Jak rozlišíte Vaše pero Liprolog 200 jednotek/ml KwikPen:
- Barva pera: Tmavě šedá
- Dávkovací tlačítko: Tmavě šedé s koncovým vínově červeným kroužkem
- Štítek: Vínově červený, “200 jednotek/ml” ve žlutém poli
Žluté varování na držáku zásobní vložky
K podání injekce potřebujete:
• Liprolog 200 jednotek/ml KwikPen
• Jehlu kompatibilní s perem KwikPen (doporučeny jsou jehly BD [Becton, Dickinson and Company]).
• Tampon s dezinfekcí
Jehly a tampon s dezinfekcí nejsou součástí balení.
Příprava pera
• Umyjte si ruce mýdlem a vodou.
• Zkontrolujte štítek pera a přesvědčte se, že používáte správný typ inzulinu. Je to zvlášť důležité, používáte-li víc než 1 typ inzulinu.
• Nepoužívejte pero, pokud již uplynula doba jeho použitelnosti uvedená na štítku pera nebo pokud uplynulo vice než 28 dní od jeho prvního použití.
• Pro každou injekci použijte novou jehlu. Tím pomůžete předejít infekcím a případnému ucpání jehel.
Přímým tahem odstraňte kryt pera.
• Neodstraňujte z pera štítek.
Tamponem s dezinfekcí otřete pryžový uzávěr.
Přípravek Liprolog 200 jednotek/ml injekční roztok by měl být čirý a bezbarvý. Nepoužívejte jej, jestliže je zakalený, zbarvený nebo obsahuje částice nebo shluky.

POUŽÍVEJTE POUZE V TOMTO PERU, JINAK MŮŽE DOJÍT K ZÁVAŽNÉMU PŘEDÁVKOVÁNÍ
V ezměte novou j ehlu.
Z vnějšího krytu jehly odstraňte papírovou fólii.


r

Ponechte Vyhoďte
V___J
Prostříknutí pera
Pero prostříkněte před každou injekcí.
• Prostříknutí pera odstraní vzduch z jehly a ze zásobní vložky, který se tam mohl
nahromadit v průběhu normálního používání a zajistí správné fungování pera.
• Pokud neprostříknete pero před každou injekcí, můžete si aplikovat příliš velkou nebo příliš
malou dávku inzulinu.
K prostříknutí pera nastavte otáčením dávkovacího tlačítka 2 jednotky.

Otočte pero jehlou nahoru. Poklepávejte jemně na držák zásobní vložky tak, aby se vzduch shromáždil nahoře.

S jehlou směrem nahoru stiskněte dávkovací tlačítko nadoraz, až se v dávkovacím okénku objeví „0”. Držte dávkovací tlačítko stlačené a pomalu počítejte do 5.
• Na špičce jehly byste měl(a) vidět inzulin.
- Pokud nevidíte inzulin, opakujte kroky prostříknutí, ale ne víc než 8 krát.
- Pokud stále nevidíte inzulin, vyměňte jehlu a opakujte kroky prostříknutí.
Malé vzduchové bublinky jsou normální a neovlivní velikost Vaší dávky.


Nastavení dávky
Toto pero bylo zkonstruováno tak, aby se podávaná dávka ukazovala v dávkovacím okénku. Nastavte si svoji obvyklou dávku tak, jak Vás instruoval Váš lékař.
• V jedné injekci můžete aplikovat dávku od 1 do 60 jednotek.
• Potřebujete-li dávku vyšší než je 60 jednotek, budete si muset podat více než jednu injekci.
- Potřebujete-li pomoc s rozhodnutím, jak svou dávku rozdělit, zeptejte se svého lékaře.
- Pro každou injekci použijte novou jehlu a zopakujte prostříknutí pera.
Krok 8:
Nastavte požadovanou dávku otáčením dávkovacího tlačítka. Ukazatel dávky by měl zobrazovat Vaši dávku.
• Dávka na peru se nastavuj e po j edné jednotce.
• Při otáčení dávkovací tlačítko slyšitelně kliká.
• NENASTAVUJTE si velikost dávky počítáním kliků, mohl(a) byste si nastavit špatnou dávku.
• Dávka může být opravena otáčením dávkovacího tlačítka oběma směry, dokud není nastavena správná dávka, která se zobrazí na ukazateli dávky.
• Sudé hodnoty j sou na číselníku natištěny.
• Liché hodnoty jsou po čísle 1 zobrazeny jako celé čáry.
Číslici v dávkovacím okénku vždy zkontrolujte, abyste se ujistil(a), že jste si nastavil(a) správnou dávku.


(Příklad: v dávkovacím okénku je 12 jednotek)

(Příklad: v dávkovacím okénku je 25 jednotek)
• Pero neumožňuje nastavení větší dávky, než je zbývající počet jednotek v peru.
• Potřebujete-li si podat dávku vyšší, než je zbývající počet jednotek v peru, můžete buď:
- podat si množství, které ve Vašem peru zbývá, a pro podání zbývající dávky použít nové pero, nebo
- použít nové pero na podání celé dávky.
Podání dávky
• Injekci inzulinu podejte tak, jak Vám to ukázal Váš lékař.
• S každou injekcí měňte (rotujte) místo vpichu, kam injekci podáváte.
• Nepokoušejte se o úpravu dávky v průběhu jejího podání.
Vyberte místo vpichu.
Přípravek Liprolog 200 jednotek/ml injekční roztok se podává v injekci pod kůži (subkutánně) do oblasti břicha, hýždí, stehen nebo horní části paží.
Před aplikací injekce si otřete kůži tamponem s dezinfekcí a než si podáte injekci nechte kůži oschnout.

Vpíchněte jehlu do kůže.
Stiskněte dávkovací tlačítko a dokud se pohybuje, tiskněte jej.

Dávkovací tlačítko držte stále zmáčknuté a pomalu napočítejte do
5, teprve pak jehlu vytáhněte.
Nesnažte se podat si inzulin otáčením dávkovacího tlačítka. K podání inzulinu otáčením dávkovacího tlačítka NEDOJDE.
Vytáhněte jehlu z kůže.
• Kapka inzulinu na špičce j ehly j e normální. Velikost Vaší dávky neovlivní.Vidíte-li v dávkovacím okénku „0”, podal(a) jste si celou dávku, kterou jste si nastavil(a).
• Pokud v dávkovacím okénku číslici „0” nevidíte, nenastavujte novou dávku. Vpíchněte jehlu do kůže a dokončete injekci.
• Pokud se stále domníváte, že jste si nepodal(a) celou dávku, kterou jste pro injekci nastavil(a), nezačínejte znovu ani tuto injekci neopakujte. Sledujte svou hladinu cukru tak, jak Vás instruoval Váš lékař.
Při podání injekce se píst pohybuje jen velmi


málo a vy jeho pohyb nemusíte zaznamenat.
Obj eví-li se na kůži po vytažení jehly krev, jemně stlačte místo vpichu kouskem gázy nebo tamponem s dezinfekcí. Místo netřete.
Opatrně vraťte na jehlu vnější kryt jehly.

Krok 13:
Jehlu s nasazeným krytem odstraňte odšroubováním a znehodnoťte ji podle pokynů níže (viz bod Likvidace per a jehel).
Neuchovávejte pero s nasazenou jehlou, předejdete tím vytékání, ucpání jehly a vnikání vzduchu do pera.

Sponu krytu s ukazatelem dávky natočte do zákrytu a přímým zatlačením nasaďte zpět kryt pera.

Likvidace per a jehel
• Použité jehly vyhoďte do nádoby na ostré předměty nebo do nádoby z tvrdého plastu s bezpečnostním víčkem. Jehly nevyhazujte přímo do domovního odpadu.
• Použité pero můžete po odstranění jehly vyhodit do domovního odpadu.
• Nádobu na j ehly nerecyklujte.
• Zeptejte se svého lékaře nebo lékárníka na možnosti správné likvidace nádoby s jehlami.
• Pokyny pro zacházení s jehlami nemají nahrazovat místní, zdravotnické nebo institucionální předpisy.
Uchovávání pera Nepoužívaná pera
• Nepoužitá pera uchovávejte v chladničce od 2 °C do 8 °C.
• Chraňte přípravek Liprolog 200 jednotek/ml injekční roztok před mrazem. Pokud došlo k jeho zmrznutí, nepoužívejte jej .
• Nepoužitá pera můžete použít do data použitelnosti, uvedeného na obalu, pokud bylo pero uchováváno v chladničce.
Používané pero
• Pero, které právě používáte, uchovávejte při pokojové teplotě (do 30 °C) mimo přímé teplo a světlo.
• Po 28 dnech používané pero zlikvidujte, a to i v případě, že je v něm ještě inzulin.
Obecné informace o bezpečném a účinném používání Vašeho pera
• Uchovávejte pero a jehly mimo dohled a dosah dětí.
• Pero nepoužívejte, vypadá-li pero nebo některá jeho část rozbitá či zničená.
• Vždy při sobě noste náhradní pero pro případ ztráty nebo poruchy Vašeho pera.
Řešení problémů
• Nemůžete-li sundat z pera kryt, jemně krytem pera otáčejte tam a zpět a pak kryt sundejte přímým tahem.
• Jde-li dávkovací tlačítko stlačit těžce;
- Pomalejší stlačování dávkovacího tlačítka injekci usnadní.
- Jehla může být ucpaná. Nasaďte novou jehlu a pero prostříkněte.
- Do vnitřku pera se mohl dostat prach, jídlo nebo kapalina. Pero zlikvidujte a vezměte si pero nové.
• Nepřenášejte inzulin z pera do injekční stříkačky nebo do inzulínové pumpy. Může dojít k závažnému předávkování.
Máte-li nějaké otázky nebo problémy s přípravkem Liprolog 200 jednotek/ml KwikPen, pro pomoc kontaktujte svého lékaře nebo místní zastoupení společnosti Lilly.
Datum revize textu:
236