Levemir 100 Jednotek/Ml
souhrn údajů o přípravku
příloha i
Levemir 100 jednotek/ml injekční roztok v zásobní vložce
2. kvalitativní a kvantitativní složení
1 ml roztoku obsahuje 100 jednotek insulinům detemirum* (ekvivalentní 14,2 mg), 1 zásobní vložka obsahuje 3 ml odpovídající 300 jednotkám.
*Inzulin detemir je vyráběn rekombinantní DNA technologií v Saccharomyces cerevisiae,
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok v zásobní vložce, Penfill,
Vodný roztok je čirý a bezbarvý,
4. klinické údaje
4.1 Terapeutické indikace
Levemir je indikován k léčbě diabetes mellitus u dospělých, dospívajících a dětí ve věku od 1 roku,
4.2 Dávkování a způsob podání
Dávkování
Účinnost inzulinových analogů, včetně inzulinu detemir, se vyjadřuje v jednotkách, zatímco účinnost humánních inzulinů se vyjadřuje v mezinárodních jednotkách. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
Levemir může být použit samostatně jako bazální inzulin nebo v kombinaci s bolusovým inzulinem. Může být také používán v kombinaci s perorálními antidiabetiky a/nebo agonisty receptoru GLP-1.
Pokud je Levemir používán v kombinaci s perorálními antidiabetiky či pokud je přidáván k agonistům receptoru GLP-1, je doporučeno užívat Levemir jednou denně s počáteční dávkou 0,1 -0,2 jednotky/kg nebo 10 jednotek u dospělých pacientů. Dávka přípravku Levemir má být upravena titrováním na základě individuálních potřeb pacienta.
Pokud jsou agonisté receptoru GLP-1 přidáváni k přípravku Levemir, doporučuje se snížit dávku přípravku Levemir o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně má být individuálně upraveno dávkování.
Pro individuální úpravu dávky jsou pro dospělé doporučovány dva následující titrační postupy. Titrační postup pro dospělé s diabetem 1. typu a 2. typu
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 jednotek |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 jednotek |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 jednotky |
ucose)
|
7,l-8,0 mmol/l (127-144 mg/dl) |
+ 2 jednotky |
|
6,1-7,0 mmol/l (109-126 mg/dl) |
+ 2 jednotky |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
3,1-4,0 mmol/l (56-72 mg/dl) |
- 2 jednotky |
|
<3,1 mmol/l (<56 mg/dl) |
- 4 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma G
Jednoduchý postup pro dospělé s diabetem 2. typu při provádění titrace pacientem
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 6,1 mmol/l (>110 mg/dl) |
+ 3 jednotky |
|
4,4-6,1 mmol/l (80-110 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
<4,4 mmol/l (<80 mg/dl) |
- 3 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma G
ucose)
Je-li Levemir užíván jako část inzulinového režimu bazal-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientově potřebě. Dávkování přípravku Levemir má být upraveno individuálně.
Úprava dávky může být nutná, pokud pacienti podstupují zvýšenou fyzickou aktivitu, mění svou obvyklou dietu nebo během souběžného onemocnění.
Pokud si pacienti upravují dávku z důvodu zlepšení kontroly hladiny glukózy, musí být poučeni o tom, že je nutno si všímat příznaků hypoglykemie.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Levemir může být používán staršími pacienty. Monitorování glukózy u starších pacientů má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Poškození ledvin a jater
Poškození ledvin nebo jater může snížit pacientovu potřebu inzulinu.
Monitorování glukózy u pacientů s poškozením ledvin nebo jater má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Pediatrická populace
Levemir lze používat u dospívajících a dětí ve věku od 1 roku (viz bod 5.1). Při převodu z bazálního inzulinu na Levemir je zapotřebí zvážit na individuálním základě snížení dávky bazálního a bolusového inzulinu, aby se minimalizovalo riziko hypoglykemie (viz bod 4.4).
Monitorování glukózy u dětí a dospívajících má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla stanovena.
Nejsou dostupné žádné údaje.
Přechod z jiných inzulínových léčivých přípravků:
Při přechodu z jiných intermediárně nebo dlouhodobě působících inzulinových léčivých přípravků může být nutná úprava dávky a načasování podávání (viz bod 4.4).
Během přechodu a několik týdnů poté je doporučeno důkladné monitorování glukózy (viz bod 4.4).
Je možné, že bude třeba upravit souběžnou antidiabetickou léčbu (dávku a/nebo načasování podávání perorálních antidiabetik nebo souběžně podávaných krátkodobě/rychle působících inzulínových léčivých přípravků).
Způsob podání
Levemir je dlouhodobě působící inzulinový analog používaný jako bazální inzulin. Levemir je určen pouze pro subkutánní podání. Levemir nesmí být podáván intravenózně, neboť to může vést k těžké hypoglykemii. Vyvarujte se také intramuskulárního podání. Levemir není určen pro použití v inzulinových infuzních pumpách.
Levemir se aplikuje subkutánní injekcí do břišní stěny, stehna, horní části paže, oblasti deltového svalu nebo oblasti hýždí. Místa vpichu mají být vždy obměňována v rámci téže oblasti, aby se snížilo riziko lipodystrofie. Trvání účinku se bude lišit v závislosti na dávce, místě vpichu, prokrvení, teplotě a fyzické aktivitě. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladiny glukózy v krvi dávkování dvakrát denně, může být večerní dávka podána večer nebo před spaním.
Podání aplikátorem inzulínu
Levemir Penfill je určen k použití spolu s aplikátory Novo Nordisk a jehlami NovoFine nebo NovoTwist.
K přípravku Levemir Penfill je přiložena příbalová informace s podrobným návodem k použití, který má být dodržován.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Před cestou mezi různými časovými pásmy se má pacient poradit s lékařem. Cestování mezi různými časovými pásmy může totiž znamenat, že pacient bude muset užívat inzulin a přijímat jídla v odlišných časech.
Hyperglykemie
Nedostatečné dávkování nebo přerušovaná léčba, zejména u diabetu 1. typu, může vést k hyperglykemii a diabetické ketoacidóze. První symptomy hyperglykemie se obvykle v průběhu hodin nebo dní stupňují. Mezi ně patří žízeň, zvýšená frekvence močení, nauzea, zvracení, ospalost, zarudlá suchá kůže, sucho v ústech, ztráta chuti k jídlu, či acetonový zápach dechu. U diabetu 1. typu mohou vést neléčené hyperglykemické stavy až k diabetické ketoacidóze, která je potenciálně letální.
Hypoglykemie
Vynechání jídla nebo neplánovaná namáhavá fyzická zátěž mohou vést k hypoglykemii.
U dětí je třeba dbát na to, aby dávky inzulinu (zvláště v režimu bazál-bolus) odpovídaly příjmu jídla a fyzické aktivitě a tím bylo minimalizováno riziko hypoglykemie.
Hypoglykemie se může objevit, pokud je dávka inzulinu příliš vysoká ve vztahu k potřebě inzulinu.
V případě hypoglykemie či v případě podezření na hypoglykemii nesmí být Levemir podán. Poté, co u pacienta dojde ke stabilizaci hladiny glukózy v krvi, má být zvážena úprava dávky (viz body 4.8 a 4.9).
Pacienti, kterým se regulace hladiny glukózy v krvi významně zlepšila, např. zintenzívněnou inzulinovou terapií, mohou zpozorovat změnu v obvyklých varovných symptomech hypoglykemie a mají být o tom adekvátně informováni. U pacientů s dlouholetým diabetem mohou běžné varovné symptomy vymizet.
Souběžná nemoc, především infekce a horečnaté stavy, obvykle zvyšuje pacientovu potřebu inzulinu. Přidružené onemocnění ledvin, jater či onemocnění postihující nadledviny, podvěsek mozkový nebo štítnou žlázu může vyžadovat změny v dávce inzulinu.
Pokud je pacient převeden na jiný typ inzulinových léčivých přípravků, může dojít ke změně či potlačení časných varovných příznaků hypoglykemie oproti těm, které se u pacienta projevovaly u předchozího inzulinu.
Převedení z jiných inzulínových léčivých přípravků
Převod pacienta na jiný typ nebo značku inzulinu má probíhat pod přísným lékařským dozorem. Změny v síle, značce (výrobce), typu, původu (zvířecí inzulin, humánní inzulin či analog inzulinu) a/nebo metodě výroby (rekombinantní DNA versus inzulin ze zvířecích zdrojů) mohou vést k potřebě změnit dávkování. Pacienti převádění na přípravek Levemir z jiných typů inzulinu mohou vyžadovat změnu dávkování oproti jejich běžnému inzulinovému léčivému přípravku. Pokud je potřeba přizpůsobit dávkování, může k tomu dojít při první dávce nebo během prvních týdnů či měsíců.
Reakce v místě vpichu
Tak jako při každé léčbě inzulinem se mohou objevit reakce v místě vpichu, které se projevují bolestivostí, zarudnutím, kopřivkou, zánětem, modřinami, otoky a svěděním. Pravidelné obměňování injekčního místa v rámci jedné oblasti může napomoci tyto reakce omezit nebo jim zabránit. Reakce obvykle vymizí do několika dnů nebo týdnů. Ve vzácných případech si mohou reakce v místě vpichu vyžádat vysazení přípravku Levemir.
Hypoalbuminemie
O pacientech s těžkou hypoalbuminémií jsou k dispozici jen omezené údaje. U těchto pacientů je doporučeno důkladné monitorování.
Kombinace přípravku Levemir s pioglitazonem
Pokud byl pioglitazon užíván v kombinaci s inzulinem, byly hlášeny případy srdečního selhání a to zvláště u pacientů s rizikovými faktory pro vznik srdečního selhání. Tuto skutečnost je nutno vzít v úvahu, pokud je zvažována léčba pioglitazonem v kombinaci s přípravkem Levemir. Pokud je tato kombinace použita, mají být pacienti sledováni s ohledem na známky a příznaky srdečního selhání, zvýšení hmotnosti a edém. Pioglitazon má být vysazen, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Je známa řada léčivých přípravků, které ovlivňují metabolismus glukózy.
Následující látky mohou snížit pacientovu potřebu inzulinu:
Perorální antidiabetické léčivé přípravky, agonisté receptoru GLP-1, inhibitory monoaminooxidázy (IMAO), beta-blokátory, inhibitory angiotensin konvertujícího enzymu (ACE), salicyláty, anabolické steroidy a sulfonamidy.
Následující látky mohou zvýšit pacientovu potřebu inzulinu:
Perorální antikoncepce, thiazidy, glukokortikoidy, thyreoidální hormony, sympatomimetika, růstový hormon a danazol.
Betablokátory mohou skrýt hypoglykemické symptomy.
Oktreotid/lanreotid může jak zvýšit, tak snížit potřebu inzulínu. Alkohol může zesílit nebo snížit hypoglykemický účinek inzulinu.
4.6 Fertilita, těhotenství a kojení Těhotenství
Během těhotenství může být zvažována léčba přípravkem Levemir. Každý potencionální přínos však musí být zvážen proti možnému zvýšenému riziku nepříznivého dopadu na těhotenství.
Všeobecně se doporučuje u těhotných žen s diabetem zvýšená kontrola a monitorování glukózy v krvi během těhotenství a při plánování těhotenství. Potřeba inzulinu obvykle v prvním trimestru klesá a zvyšuje se následně během druhého a třetího trimestru. Po porodu se potřeba inzulinu za normálních okolností rychle vrátí k hodnotám před těhotenstvím.
V otevřené randomizované kontrolované klinické studii byly těhotné ženy s diabetem 1. typu (n = 310) léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid. Primárním cílem této studie bylo posouzení vlivu přípravku Levemir na regulaci hladiny glukózy v krvi u těhotných diabetiček (viz bod 5.1).
Celková frekvence výskytu nežádoucích účinků během těhotenství byla u skupin pacientek léčených přípravkem Levemir či inzulinem NPH podobná, avšak u přípravku Levemir byla ve srovnání s NPH inzulinem pozorována početně vyjádřeno vyšší frekvence závažných nežádoucích účinků u matek (61 (40%) oproti 49 (31 %)) i u novorozenců (36 (24 %) oproti 32 (20 %)). Počet živě narozených dětí byl u žen, jež otěhotněly po zařazení do studie, v případě přípravku Levemir 50 (83 %) a 55 (89 %) v případě inzulinu NPH. Frekvence výskytu kongenitálních malformací byla u přípravku Levemir 4 (5 %) a u inzulinu NPH 11 (7 %), a to se 3 (4 %) závažnými malformacemi u přípravku Levemir a se 3 (2 %) závažnými malformacemi u inzulinu NPH.
Postmarketingové údaje u dalších 250 těhotných žen, které byly vystaveny léčbě přípravkem Levemir, nenaznačují žádné nežádoucí účinky inzulinu detemir na těhotenství a žádnou malformační nebo feto/neonatální toxicitu inzulinu detemir.
Studie na zvířatech neprokázaly reprodukční toxicitu (viz bod 5.3).
Kojení
Není známo, zda se inzulin detemir vylučuje do lidského mateřského mléka. Nepředpokládají se žádné metabolické účinky požitého inzulinu detemir na kojeného novorozence/dítě, protože inzulin detemir je jako peptid v lidském gastrointestinálním traktu rozložen na aminokyseliny.
Kojící ženy mohou vyžadovat úpravu dávkování inzulinu a diety.
Fertilita
Studie prováděné na zvířatech nenaznačují škodlivé účinky na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost pacienta koncentrovat se a reagovat může být narušena jako důsledek hypoglykemie. To může představovat riziko v situacích, kdy tato schopnost nabývá zvláštní důležitosti (např. řízení nebo obsluhování strojů).
Pacienti mají být upozorněni na to, aby byli opatrní a vyvarovali se řízení při hypoglykemii. To je obzvláště důležité u těch, kteří mají sníženou nebo chybějící citlivost vůči příznakům hypoglykemie nebo mají časté epizody hypoglykemie. Zda je vhodné řídit, má být za těchto okolností zváženo.
4.8 Nežádoucí účinky
a. Souhrn bezpečnostního profilu
Nežádoucí účinky pozorované u pacientů užívajících Levemir jsou především způsobené farmakologickým účinkem inzulinu. Celkový procentuální podíl léčených pacientů, u nichž se očekávají nežádoucí účinky, se odhaduje na 12 %.
Nejčastěji hlášeným nežádoucím účinkem během léčby je hypoglykemie, viz bod c níže.
Z klinických průzkumů je známo, že významná hypoglykemie, definovaná nutností intervence třetí strany, se vyskytuje zhruba u 6% pacientů léčených přípravkem Levemir.
Reakce v místě vpichu se během léčby přípravkem Levemir vyskytují častěji, než je tomu u humánních inzulinových přípravků. Tyto reakce zahrnují bolestivost, zarudnutí, kopřivku, zánět, modřiny, otoky a svědění v místě vpichu. Většina těchto reakcí v místě vpichu je nezávazných a přechodné povahy, tj. normálně během pokračující léčby vymizí, a to v několika dnech nebo týdnech.
Na počátku inzulinové léčby se mohou vyskytnout poruchy refrakce a edém. Tyto reakce jsou obvykle přechodné povahy. Rychlé zlepšení kontroly hladiny glukózy v krvi může být spojeno s akutní bolestivou neuropatií, která je obvykle reverzibilní. Intenzifikace inzulinové terapie s prudkým zlepšením glykemické kontroly může být spojena s přechodným zhoršením diabetické retinopatie, zatímco dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie.
b. Seznam nežádoucích účinků v tabulce
Nežádoucí účinky uvedené níže jsou založeny na údajích z klinických studií a jsou klasifikovány podle MedDRA frekvence výskytu a třídy orgánových systémů. Frekvence výskytu jsou definovány podle následující konvence: Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Poruchy imunitního systému |
Méně časté - alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce1 |
|
Velmi vzácné - anafylaktické reakce1 | |
|
Poruchy metabolismu a výživy |
Velmi časté - hypoglykemie1 |
|
Poruchy nervového systému |
Vzácné - periferní neuropatie (bolestivá neuropatie) |
|
Poruchy oka |
Méně časté - refrakční poruchy |
|
Méně časté - diabetická retinopatie | |
|
Poruchy kůže a podkožní tkáně |
Méně časté - Lipodystrofie1 |
|
Celkové poruchy a reakce v místě aplikace |
Časté - reakce v místě vpichu |
|
Méně časté - edém |
* viz bod c
c. Popis vybraných nežádoucích účinků
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka a erupce jsou méně časté, pokud je Levemir používán v režimu bazál-bolus. Pokud je však užíván v kombinaci s perorálními antidiabetiky, byl ve třech klinických studiích pozorován výskyt alergických reakcí a potenciálně alergických reakcí s frekvencí 2,2 %.
Anafylaktické reakce
Výskyt generalizovaných hypersenzitivních reakcí (včetně generalizované vyrážky, svědění, pocení, gastrointestinální nevolnosti, angioneurotického edému, dechových obtíží, palpitace a snížení krevního tlaku) je velmi vzácný, ale může být potenciálně život ohrožující.
Hypoglykemie
Nejčastěji hlášeným nežádoucím účinkem je hypoglykemie. Může se objevit v případě, že dávka inzulinu je příliš vysoká oproti potřebě inzulinu. Těžká hypoglykemie může vést k bezvědomí a/nebo křečím a může vyústit v přechodné nebo trvalé poškození mozkové funkce nebo dokonce k úmrtí. Symptomy hypoglykemie se obvykle objevují náhle. Mohou zahrnovat studený pot, chladnou bledou pokožku, únavu, nervozitu nebo třes, úzkost, neobvyklou vyčerpanost nebo slabost, zmatenost, problémy s koncentrací, ospalost, přílišný hlad, změny vidění, bolest hlavy, nauzeu a palpitace.
Lipodystrofie
V místě vpichu může vzniknout lipodystrofie (včetně lipohypertrofie, lipoatrofie). Průběžná cyklická změna místa vpichu v dané oblasti snižuje riziko vzniku takovýchto reakcí.
d. Pediatrická populace
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u pediatrické populace jakékoliv rozdíly oproti širším zkušenostem v obecné diabetické populaci.
e. Další populační specifika
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u starších pacientů a u pacientů s poškozením ledvin či jater jakékoliv rozdíly oproti širším zkušenostem v obecné populaci.
f. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkovánf
Přesnou nadměrnou dávku inzulinu nelze definovat, neboť hypoglykemie se může vyvíjet postupně přes jednotlivá stádia, pokud jsou podávány příliš vysoké dávky oproti pacientovým potřebám: 1
5. farmakologické vlastnosti
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: léčiva k terapii diabetů. Inzulíny a analoga pro injekci, dlouhodobě působící: ATC kód: A10AE05.
Mechanismus účinku a farmakodynamické účinky
Levemir je rozpustný dlouhodobě působící inzulinový analog s prodlouženým trváním účinku, který se používá jako bazální inzulin.
Účinek přípravku Levemir na snížení hladiny glukózy v krvi je způsoben usnadněným vychytáváním glukózy, které následuje po navázání inzulinu na receptory svalových a tukových buněk, a současnou inhibicí výdeje glukózy z jater.
Profil působení přípravku Levemir v čase je statisticky významně méně variabilní, a proto lépe předvídatelný, než u inzulinu NPH (Neutral Protamine Hagedorn), jak je patrné z koeficientů intraindividuální variability (CV) u pacienta pro celkový a maximální farmakodynamický účinek (v tabulce 1).
Tabulka 1. Intraindividuální variabilita profilu působení přípravku Levemir a NPH u pacienta
v čase
|
Farmakodynamický bod obratu |
Levemir CV (%) |
Inzulin NPH CV (%) |
|
UACGIR,0-24h1 |
27 |
68 |
|
GIRmax** |
23 |
46 |
*Plocha pod křivkou **Pro rychlost infúze glukózy p < 0,001 pro všechna srovnání
s přípravkem Levemir
Prodloužený účinek přípravku Levemir je zprostředkován silným sdružováním molekul inzulinu detemir v místě vpichu a vazbou na albumin prostřednictvím postranních řetězců mastných kyselin. Inzulin detemir je ve srovnání s inzulinem NPH distribuován do periferních cílových tkání pomaleji. Tyto kombinované mechanismy prodloužení délky účinku poskytují lépe reprodukovatelný profil absorpce a účinku u inzulinu detemir ve srovnání s inzulinem NPH.
Farmakodynamické parametry pro Levemir a NPH
|
Levemir |
NPH | ||||
|
j./kg |
j/kg |
j/kg |
m.j./kg | ||
|
Doba působení (hod) |
12 |
17Ť |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4Ť |
1.7 |
1.6 | |
Todhadované hodnoty
I
O)
X O)
£ 4-
Proporcionalita dávky ve farmakodynamické odezvě (maximální účinek, trvání účinku, celkový účinek) je pozorována po subkutánním podání.
V dlouhodobých klinických studiích byla prokázána nižší variabilita hladin plazmatické glukózy nalačno mezi jednotlivými dny při léčbě přípravkem Levemir ve srovnání s inzulinem NPH.
Studie u pacientů s diabetem 2. typu léčených bazálním inzulinem v kombinaci s perorálními antidiabetiky prokázaly, že glykemická kontrola (HbA1c) přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem glargin a je spojená s menším hmotnostním přírůstkem (viz tabulka 2 níže). Ve srovnávací studii s inzulinem glargin bylo možno podávat Levemir jednou nebo dvakrát denně, zatímco inzulin glargin byl podáván jednou denně. 55 % pacientů léčených přípravkem Levemir dokončilo léčbu trvající 52 týdnů v režimu dvou podání denně.
Tabulka 2. Změny v tělesné hmotnosti po inzulínové léčbě
|
Trvání studie |
Levemir jednou denně |
Levemir dvakrát denně |
NPH inzulin |
Inzulin glargin |
|
20 týdnů |
+0,7 kg |
+1,6 kg | ||
|
26 týdnů |
+1,2 kg |
+2,8 kg | ||
|
52 týdnů |
+2,3 kg |
+3,7 kg |
+4,0 kg |
Ze studií hodnotících užívání perorálních antidiabetik vyplynulo, že při kombinované léčbě s přípravkem Levemir existuje nižší riziko lehkých nočních hypoglykémií ve srovnání s inzulinem NPH a to o 61-65 %.
Byla provedena otevřená randomizovaná klinická studie u pacientů s diabetes mellitus 2. typu, kteří nedosáhli cílových hodnot perorálními antidiabetiky. Klinická studie byla zahájena 12týdenním přípravným obdobím s kombinací liraglutidu s metforminem, během něhož 61 % pacientů dosáhlo HbA1c<7 %. U 39 % pacientů, kteří cílových hodnot nedosáhli, byla provedena randomizace tak, že jim buď byla přidána léčba přípravkem Levemir podávaným 1x denně nebo pokračovali s léčbou liraglutidem s metforminem po dobu 52 týdnů. Přidání přípravku Levemir se po 52 týdnech projevilo dalším snížením HbA1c z 7,6 % na 7,1 %. Nedošlo k závažným hypoglykemickým příhodám. Závažná hypoglykemická příhoda je definována jako příhoda, kde pacient nebyl schopen zvládnout léčbu hypoglykemie sám a jestliže bylo nutno podat glukagon nebo intravenózně glukózu. Viz tabulka 3.
|
Tabulka 3. Data získaná z klinické studie - Levemir přidán |
í liraglutidu+metforminu | |||
|
Týden studie |
Větev Levemir + liraglutid + metformin N = 160 |
Větev Liraglutid + metformin N = 149 |
P-hodnota | |
|
Průměrná změna HbA1c oproti výchozímu stavu (%) |
Týdny 0-26 |
-0,51 |
+0,02 |
<0,0001 |
|
Týdny 0-52 |
-0,50 |
0,01 |
<0,0001 | |
|
Podíl pacientů, kteří dosáhli cílové hodnoty HbA1c <7% (%) |
Týdny 0-26 |
43,1 |
16,8 |
<0,0001 |
|
Týdny 0-52 |
51,9 |
21,5 |
<0,0001 | |
|
Změna tělesné hmotnosti oproti výchozímu stavu (kg) |
Týdny 0-26 |
-0,16 |
-0,95 |
0,0283 |
|
Týdny 0-52 |
-0,05 |
-1,02 |
0,0416 | |
|
Lehké hypoglykemické příhody (na pacienta a rok) |
Týdny 0-26 |
0,286 |
0,029 |
0,0037 |
|
Týdny 0-52 |
0,228 |
0,034 |
0,0011 | |
Byla prováděna 26týdenní, dvojitě zaslepená, randomizovaná klinická studie u pacientů s diabetem 2. typu nedostatečně kompenzovaných léčbou bazálním inzulinem s nebo bez metforminu za účelem stanovení účinnosti a bezpečnosti při přidání liraglutidu (v dávce 1,8 mg) oproti placebu. U pacientů s výchozí hodnotou HbA1c < 8,0 % byla dávka inzulinu snížena o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně si pacienti mohli titrovat dávku inzulínu až k dávkám nepřevyšujícím dávku před randomizací. Levemir byl použit jako bazální inzulin u 33 % pacientů (N = 147) (97,3 % užívalo metformin). Přidání liraglutidu u těchto pacientů vedlo k většímu poklesu HbA1c ve srovnání s přidáním placeba (na 6,93 % oproti 8,24 %), k výraznějšímu snížení plazmatické hladiny glukózy nalačno (na 7,20 mmol/l oproti 8,13 mmol/l) a k většímu hmotnostnímu úbytku (-3,47 kg oproti -0,43 kg). Výchozí hodnoty pro tyto parametry byly podobné u obou skupin. V obou skupinách byl pozorovaný počet lehkých hypoglykemických příhod podobný. V žádné skupině nebyly pozorovány závažné hypoglykemické příhody.
V dlouhodobých studiích u pacientů s diabetem 1. typu se při inzulinové terapii bazál-bolus přípravkem Levemir plazmatická hladina glukózy nalačno zlepšila ve srovnání s pacienty léčenými inzulinem NPH. Kontrola glykemie (HbA1c) s přípravkem Levemir byla srovnatelná s inzulinem NPH, s menším rizikem nočních hypoglykemií a bez přidruženého přírůstku tělesné hmotnosti.
V klinických studiích užívajících inzulinovou terapii bazál-bolus byla celková míra hypoglykemie při aplikaci přípravku Levemir a inzulinu NPH podobná. Analýzy nočních hypoglykemií u pacientů s diabetem 1. typu prokázaly signifikantně nižší riziko méně závažné noční hypoglykemie (se schopností samoléčby potvrzené glukózou v kapilárách nižší než 2,8 nebo 3,1 mmol/l, pokud je vyjádřena jako glukóza v plazmě) oproti inzulinu NPH, přičemž u diabetu 2. typu nebyly pozorovány žádné rozdíly.
Při použití přípravku Levemir byl pozorován vznik protilátek. Neukázalo se však, že by tato skutečnost měla vliv na glykemickou kontrolu.
Levemir byl studován v otevřené randomizované kontrolované klinické studii u těhotných žen s diabetem 1. typu (n = 310), kde tyto ženy byly léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid (viz bod 4.6). Ve 36. týdnu těhotenství (GW) byly výsledky u přípravku Levemir a inzulinu NPH srovnatelné (měřeno hodnotou HbA1c ) a snížení průměrného HbA1c během těhotenství bylo podobné (viz Tabulka 4).
Tabulka 4. Kontrola glykémie v těhotenství
|
Levemir |
NPH |
Rozdíl/Poměr pravděpodobností/ Relativní riziko 95% CI | |
|
Průměrný HbA1c (%) v GW 36 |
6,27 |
6,33 |
Rozdíl: -0,06 [-0,21; 0,08] |
|
Průměrná hodnota FPG v GW 36 (mmol/l) |
4,76 |
5,41 |
Rozdíl: -0,65 [-1,19; -0,12] |
|
Poměr pacientek, které dosáhly cílových hodnot HbA1c <6% v GW 24 a v GW 36 (%) |
41% |
32% |
Poměr pravděpodobností: 1,36 [0,78; 2,37] |
|
Celkový počet závažných hypoglykemických příhod v průběhu těhotenství (na pacientku a rok) |
1,1 |
1,2 |
Relativní riziko: 0,82 [0,39; 1,75] |
Pediatrická populace
Účinnost a bezpečnost přípravku Levemir byly studovány po dobu 12 měsíců ve třech randomizovaných kontrolovaných klinických studiích u dospívajících a dětí (n= celkem 1 045). Studie zahrnovaly celkem 167 dětí ve věku 1 - 5 let. Studie prokázaly, že kontrola glykemie (HbA1c) při léčbě přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem degludek, pokud je Levemir podáván formou bazál-bolus terapie, při toleranci 0,4 %. Ve studii srovnávající Levemir s inzulínem degludek byl výskyt hyperglykemických příhod s ketoacidózou u přípravku Levemir významně vyšší (1,09 oproti 0,68 příhod na pacientorok léčby). Při léčbě přípravkem Levemir byl pozorován nižší hmotnostní přírůstek (SD skóre, hmotnost korigována na pohlaví a věk) v porovnání s inzulinem NPH.
Klinická studie zahrnující děti starší dvou let byla prodloužena o dalších 12 měsíců (byla získána data za celkem 24 měsíců) za účelem posoudit tvorbu protilátek po dlouhodobé léčbě přípravkem Levemir. Po počátečním nárůstu protilátek vůči inzulinu v průběhu prvního roku hladina protilátek vůči inzulinu během druhého roku poklesla na úroveň mírně vyšší, než byla před začátkem studie. Výsledky naznačují, že tvorba protilátek nemá negativní vliv na kontrolu glykémie a dávku přípravku Levemir.
Údaje týkající se účinnosti a bezpečnosti pro dospívající pacienty s diabetes mellitus 2. typu byly extrapolovány z údajů pro děti, dospívající a dospělé pacienty s diabetes mellitus 1. typu a pro dospělé pacienty s diabetes mellitus 2. typu. Výsledky podporují použití přípravku Levemir u dospívajících pacientů s diabetes mellitus 2. typu.
5.2 Farmakokinetické vlastnosti
Absorpce
Maximální sérová koncentrace je dosažena za 6 až 8 hodin po podání. Při podání dvakrát denně je dosaženo rovnovážného stavu sérových koncentrací po aplikaci 2-3 dávek. Variabilita v absorpci u pacientů je nižší u přípravku Levemir než u ostatních bazálních inzulinových preparátů.
Absolutní biologická dostupnost inzulinu detemir při subkutánním podání je cca 60%.
Distribuce
Zdánlivý distribuční objem přípravku Levemir (cca 0,1 l/kg) značí, že v krvi cirkuluje vysoká frakce inzulinu detemir.
Výsledky in vitro a in vivo studií vazeb na bílkoviny naznačují, že neexistuje klinicky relevantní interakce mezi inzulinem detemir a jinými léčivými přípravky, které se vážou na mastné kyseliny nebo proteiny.
Biotransformace
Odbourávání inzulinu detemir je podobné jako u humánního inzulinu; všechny vytvořené metabolity jsou inaktivní.
Eliminace
Terminální poločas po subkutánním podání je určen rychlostí absorpce z podkožní tkáně. Terminální poločas je 5 až 7 hodin v závislosti na dávce.
Linearita
Po subkutánním podání lze v terapeutickém rozmezí dávky sledovat proporcionalitu se sérovými koncentracemi (maximální koncentrace, stupeň absorpce).
Při podání jednorázové dávky přípravku Levemir 0,5 jednotky/kg s liraglutidem v dávce 1,8 mg pacientům s diabetem 2. typu nebyly v ustáleném stavu pozorovány žádné farmakokinetické nebo farmakodynamické interakce mezi liraglutidem a přípravkem Levemir.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi staršími a mladými lidmi.
Poškození ledvin a jater
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi lidmi s poruchou ledvin nebo jater a zdravými lidmi. Protože u těchto skupin pacientů nebyly provedeny rozsáhlé studie farmakokinetiky přípravku Levemir, doporučuje se u nich důkladně monitorovat glukózu v plazmě.
Pohlaví
Ve farmakokinetických vlastnostech přípravku Levemir neexistují žádné klinicky relevantní rozdíly mezi pohlavími.
Pediatrická populace
Farmakokinetické vlastnosti přípravku Levemir byly zkoumány u malých dětí (1 - 5 let), u dětí (6 -12 let) a dospívajících (13 - 17 let) a byly srovnávány s dospělými s diabetem 1. typu. Ve farmakokinetických vlastnostech nebyly klinicky relevantní rozdíly mezi malými dětmi, dětmi, dospívajícími a dospělými.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka. Údaje o afinitě k receptorům a in vitro testy mitogenicity neodhalily žádný důkaz zvýšeného mitogenního potenciálu ve srovnání s humánním inzulinem.
6. farmaceutické údaje
6.1 Seznam pomocných látek
Glycerol Fenol Metakresol Octan zinečnatý
Dihydrát hydrogenfosforečnanu sodného Chlorid sodný
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Léčivé látky přidané k přípravku Levemir mohou způsobit odbourávání inzulinu detemir, např. léčivé přípravky obsahující thioly nebo siřičitany. Levemir se nemá přidávat do infuzních roztoků.
Tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
Před otevřením: 30 měsíců.
Během používání, nebo pokud Levemir nosíte jako zásobní: přípravek smí být uchováván maximálně 6 týdnů.
6.4 Zvláštní opatření pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C - 8°C). Neuchovávejte v blízkosti chladicího zařízení. Chraňte před mrazem.
Během používání, nebo pokud Levemir nosíte jako zásobní: uchovávejte při teplotě do 30°C. Chraňte před chladem. Chraňte před mrazem.
Uchovávejte zásobní vložku v krabičce, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
3 ml roztoku v zásobní vložce (sklo třídy 1), s pístem (bromobutyl) a pryžovou zátkou (bromobutyl/polyisopren).
Velikost balení po 1, 5 a 10 zásobních vložkách. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Jehly a Levemir Penfill nesmí být s nikým sdíleny. Zásobní vložka se nesmí znovu naplňovat. Nepoužívejte tento léčivý přípravek, pokud zjistíte, že roztok není čirý, bezbarvý a vodný. Levemir, který byl zmražen, nesmí být použit.
Pacient má být poučen, aby po každé aplikaci zlikvidoval jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. držitel rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
8. registrační čísla
EU/1/04/278/001
EU/1/04/278/002
EU/1/04/278/003
9. datum první registrace/prodloužení registrace
Datum první registrace: 1. června 2004 Prodloužení registrace: 16. dubna 2009
io. datum revize textu
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu název přípravku
1.
Levemir 100 jednotek/ml injekční roztok v předplněném peru.
2. kvalitativní a kvantitativní složení
1 ml roztoku obsahuje 100 jednotek insulinum detemirum* (ekvivalentní 14,2 mg). 1 předplněné pero obsahuje 3 ml odpovídající 300 jednotkám.
*Inzulin detemir je vyráběn rekombinantní DNA technologií v Saccharomyces cerevisiae.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok pro injekce v předplněném peru. FlexPen.
Vodný roztok je čirý a bezbarvý.
4. klinické údaje
4.1 Terapeutické indikace
Levemir je indikován k léčbě diabetes mellitus u dospělých, dospívajících a dětí ve věku od 1 roku.
4.2 Dávkování a způsob podání
Dávkování
Účinnost inzulinových analogů, včetně inzulinu detemir, se vyjadřuje v jednotkách, zatímco účinnost humánních inzulinů se vyjadřuje v mezinárodních jednotkách. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
Levemir může být použit samostatně jako bazální inzulin nebo v kombinaci s bolusovým inzulinem. Může být také používán v kombinaci s perorálními antidiabetiky a/nebo agonisty receptoru GLP-1.
Pokud je Levemir používán v kombinaci s perorálními antidiabetiky či pokud je přidáván k agonistům receptoru GLP-1, je doporučeno užívat Levemir jednou denně s počáteční dávkou 0,1 -0,2 jednotky/kg nebo 10 jednotek u dospělých pacientů. Dávka přípravku Levemir má být upravena titrováním na základě individuálních potřeb pacienta.
Pokud jsou agonisté receptoru GLP-1 přidáváni k přípravku Levemir, doporučuje se snížit dávku přípravku Levemir o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně má být individuálně upraveno dávkování.
Pro individuální úpravu dávky jsou pro dospělé doporučovány dva následující titrační postupy. Titrační postup pro dospělé s diabetem 1. typu a 2. typu
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 jednotek |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 jednotek |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 jednotky |
|
7,1-8,0 mmol/l (127-144 mg/dl) |
+ 2jednotky |
|
6,l-7,0 mmol/1 (109-126 mg/dl) |
+ 2 jednotky |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
3,1-4,0 mmol/1 (56-72 mg/dl) |
- 2 jednotky |
|
<3,1 mmol/1 (<56 mg/dl) |
- 4 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma Glucose)
Jednoduchý postup pro dospělé s diabetem 2. typu při provádění titrace pacientem
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 6,1 mmol/1 (>110 mg/dl) |
+ 3 jednotky |
|
4,4-6,1 mmol/1 (80-110 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
<4,4 mmol/1 (<80 mg/dl) |
- 3 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma G
ucose)
Je-li Levemir užíván jako část inzulinového režimu bazal-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientově potřebě. Dávkování přípravku Levemir má být upraveno individuálně.
Úprava dávky může být nutná, pokud pacienti podstupují zvýšenou fyzickou aktivitu, mění svou obvyklou dietu nebo během souběžného onemocnění.
Pokud si pacienti upravují dávku z důvodu zlepšení kontroly hladiny glukózy, musí být poučeni o tom, že je nutno si všímat příznaků hypoglykemie.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Levemir může být používán staršími pacienty. Monitorování glukózy u starších pacientů má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Poškození ledvin a jater
Poškození ledvin nebo jater může snížit pacientovu potřebu inzulinu.
Monitorování glukózy u pacientů s poškozením ledvin nebo jater má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Pediatrická populace
Levemir lze používat u dospívajících a dětí ve věku od 1 roku (viz bod 5.1). Při převodu z bazálního inzulinu na Levemir je zapotřebí zvážit na individuálním základě snížení dávky bazálního a bolusového inzulinu, aby se minimalizovalo riziko hypoglykemie (viz bod 4.4).
Monitorování glukózy u dětí a dospívajících má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla stanovena.
Nejsou dostupné žádné údaje.
Přechod z jiných inzulínových léčivých přípravků:
Při přechodu z jiných intermediárně nebo dlouhodobě působících inzulinových léčivých přípravků může být nutná úprava dávky a načasování podávání (viz bod 4.4).
Během přechodu a několik týdnů poté je doporučeno důkladné monitorování glukózy (viz bod 4.4).
Je možné, že bude třeba upravit souběžnou antidiabetickou léčbu (dávku a/nebo načasování podávání perorálních antidiabetik nebo souběžně podávaných krátkodobě/rychle působících inzulinových léčivých přípravků).
Způsob podání
Levemir je dlouhodobě působící inzulínový analog používaný jako bazální inzulin. Levemir je určen pouze pro subkutánní podání. Levemir nesmí být podáván intravenózně, neboť to může vést k těžké hypoglykemii. Vyvarujte se také intramuskulárního podání. Levemir není určen pro použití v inzulinových infuzních pumpách.
Levemir se aplikuje subkutánní injekcí do břišní stěny, stehna, horní části paže, oblasti deltového svalu nebo oblasti hýždí. Místa vpichu mají být vždy obměňována v rámci téže oblasti, aby se snížilo riziko lipodystrofie. Trvání účinku se bude lišit v závislosti na dávce, místě vpichu, prokrvení, teplotě a fyzické aktivitě. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladiny glukózy v krvi dávkování dvakrát denně, může být večerní dávka podána večer nebo před spaním.
Podání aplikátorem inzulínu FlexPen
Levemir FlexPen je předplněné pero, které je určeno k použití spolu s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm. Dávky lze nastavit od 1 do 60 jednotek v přírůstcích po 1 jednotce.
Levemir FlexPen je barevně kódován a je k němu přiložena příbalová informace s podrobným návodem k použití, jenž má být dodržován.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Před cestou mezi různými časovými pásmy se má pacient poradit s lékařem. Cestování mezi různými časovými pásmy může totiž znamenat, že pacient bude muset užívat inzulin a přijímat jídla v odlišných časech.
Hyperglykemie
Nedostatečné dávkování nebo přerušovaná léčba, zejména u diabetu 1. typu, může vést k hyperglykemii a diabetické ketoacidóze. První symptomy hyperglykemie se obvykle v průběhu hodin nebo dní stupňují. Mezi ně patří žízeň, zvýšená frekvence močení, nauzea, zvracení, ospalost, zarudlá suchá kůže, sucho v ústech, ztráta chuti k jídlu, či acetonový zápach dechu. U diabetu 1. typu mohou vést neléčené hyperglykemické stavy až k diabetické ketoacidóze, která je potenciálně letální.
Hypoglykemie
Vynechání jídla nebo neplánovaná namáhavá fyzická zátěž mohou vést k hypoglykemii.
U dětí je třeba dbát na to, aby dávky inzulinu (zvláště v režimu bazál-bolus) odpovídaly příjmu jídla a fyzické aktivitě a tím bylo minimalizováno riziko hypoglykemie.
Hypoglykemie se může objevit, pokud je dávka inzulinu příliš vysoká ve vztahu k potřebě inzulinu.
V případě hypoglykemie či v případě podezření na hypoglykemii nesmí být Levemir podán. Poté, co u pacienta dojde ke stabilizaci hladiny glukózy v krvi, má být zvážena úprava dávky (viz body 4.8 a 4.9).
Pacienti, kterým se regulace hladiny glukózy v krvi významně zlepšila, např. zintensivněnou inzulinovou terapií, mohou zpozorovat změnu v obvyklých varovných symptomech hypoglykemie a mají být o tom adekvátně informováni. U pacientů s dlouholetým diabetem mohou běžné varovné symptomy vymizet.
Souběžná nemoc, především infekce a horečnaté stavy, obvykle zvyšuje pacientovu potřebu inzulínu. Přidružené onemocnění ledvin, jater či onemocnění postihující nadledviny, podvěsek mozkový nebo štítnou žlázu může vyžadovat změny v dávce inzulinu.
Pokud je pacient převeden na jiný typ inzulinových léčivých přípravků, může dojít ke změně či potlačení časných varovných příznaků hypoglykemie oproti těm, které se u pacienta projevovaly u předchozího inzulinu.
Převedení z jiných inzulínových léčivých přípravků
Převod pacienta na jiný typ nebo značku inzulinu má probíhat pod přísným lékařským dozorem. Změny v síle, značce (výrobce), typu, původu (zvířecí inzulin, humánní inzulin či analog inzulinu) a/nebo metodě výroby (rekombinantní DNA versus inzulin ze zvířecích zdrojů) mohou vést k potřebě změnit dávkování. Pacienti převádění na přípravek Levemir z jiných typů inzulinu mohou vyžadovat změnu dávkování oproti jejich běžnému inzulinovému léčivému přípravku. Pokud je potřeba přizpůsobit dávkování, může k tomu dojít při první dávce nebo během prvních týdnů či měsíců.
Reakce v místě vpichu
Tak jako při každé léčbě inzulinem se mohou objevit reakce v místě vpichu, které se projevují bolestivostí, zarudnutím, kopřivkou, zánětem, modřinami, otoky a svěděním. Pravidelné obměňování injekčního místa v rámci jedné oblasti může napomoci tyto reakce omezit nebo jim zabránit. Reakce obvykle vymizí do několika dnů nebo týdnů. Ve vzácných případech si mohou reakce v místě vpichu vyžádat vysazení přípravku Levemir.
Hypoalbuminemie
O pacientech s těžkou hypoalbuminémií jsou k dispozici jen omezené údaje. U těchto pacientů je doporučeno důkladné monitorování.
Kombinace přípravku Levemir s pioglitazonem
Pokud byl pioglitazon užíván v kombinaci s inzulinem, byly hlášeny případy srdečního selhání a to zvláště u pacientů s rizikovými faktory pro vznik srdečního selhání. Tuto skutečnost je nutno vzít v úvahu, pokud je zvažována léčba pioglitazonem v kombinaci s přípravkem Levemir. Pokud je tato kombinace použita, mají být pacienti sledováni s ohledem na známky a příznaky srdečního selhání, zvýšení hmotnosti a edém. Pioglitazon má být vysazen, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Je známa řada léčivých přípravků, které ovlivňují metabolismus glukózy.
Následující látky mohou snížit pacientovu potřebu inzulinu:
Perorální antidiabetické léčivé přípravky, agonisté receptoru GLP-1, inhibitory monoaminooxidázy (IMAO), beta-blokátory, inhibitory angiotensin konvertujícího enzymu (ACE), salicyláty, anabolické steroidy a sulfonamidy.
Následující látky mohou zvýšit pacientovu potřebu inzulinu:
Perorální antikoncepce, thiazidy, glukokortikoidy, thyreoidální hormony, sympatomimetika, růstový hormon a danazol.
Betablokátory mohou skrýt hypoglykemické symptomy.
Oktreotid/lanreotid může jak zvýšit, tak snížit potřebu inzulinu.
Alkohol může zesílit nebo snížit hypoglykemický účinek inzulinu.
4.6 Fertilita, těhotenství a kojení
Během těhotenství může být zvažována léčba přípravkem Levemir. Každý potencionální přínos však musí být zvážen proti možnému zvýšenému riziku nepříznivého dopadu na těhotenství.
Všeobecně se doporučuje u těhotných žen s diabetem zvýšená kontrola a monitorování glukózy v krvi během těhotenství a při plánování těhotenství. Potřeba inzulinu obvykle v prvním trimestru klesá a zvyšuje se následně během druhého a třetího trimestru. Po porodu se potřeba inzulinu za normálních okolností rychle vrátí k hodnotám před těhotenstvím.
V otevřené randomizované kontrolované klinické studii byly těhotné ženy s diabetem 1. typu (n = 310) léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid. Primárním cílem této studie bylo posouzení vlivu přípravku Levemir na regulaci hladiny glukózy v krvi u těhotných diabetiček (viz bod 5.1).
Celková frekvence výskytu nežádoucích účinků během těhotenství byla u skupin pacientek léčených přípravkem Levemir či inzulinem NPH podobná, avšak u přípravku Levemir byla ve srovnání s NPH inzulinem pozorována početně vyjádřeno vyšší frekvence závažných nežádoucích účinků u matek (61 (40%) oproti 49 (31 %)) i u novorozenců (36 (24 %) oproti 32 (20 %)). Počet živě narozených dětí byl u žen, jež otěhotněly po zařazení do studie, v případě přípravku Levemir 50 (83 %) a 55 (89 %) v případě inzulinu NPH. Frekvence výskytu kongenitálních malformací byla u přípravku Levemir 4 (5 %) a u inzulinu NPH 11 (7 %), a to se 3 (4 %) závažnými malformacemi u přípravku Levemir a se 3 (2 %) závažnými malformacemi u inzulinu NPH.
Postmarketingové údaje u dalších 250 těhotných žen, které byly vystaveny léčbě přípravkem Levemir, nenaznačují žádné nežádoucí účinky inzulinu detemir na těhotenství a žádnou malformační nebo feto/neonatální toxicitu inzulinu detemir.
Studie na zvířatech neprokázaly reprodukční toxicitu (viz bod 5.3).
Kojení
Není známo, zda se inzulin detemir vylučuje do lidského mateřského mléka. Nepředpokládají se žádné metabolické účinky požitého inzulinu detemir na kojeného novorozence/dítě, protože inzulin detemir je jako peptid v lidském gastrointestinálním traktu rozložen na aminokyseliny.
Kojící ženy mohou vyžadovat úpravu dávkování inzulinu a diety.
Fertilita
Studie prováděné na zvířatech nenaznačují škodlivé účinky na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost pacienta koncentrovat se a reagovat může být narušena jako důsledek hypoglykemie. To může představovat riziko v situacích, kdy tato schopnost nabývá zvláštní důležitosti (např. řízení nebo obsluhování strojů).
Pacienti mají být upozorněni na to, aby byli opatrní a vyvarovali se řízení při hypoglykemii. To je obzvláště důležité u těch, kteří mají sníženou nebo chybějící citlivost vůči příznakům hypoglykemie nebo mají časté epizody hypoglykemie. Zda je vhodné řídit, má být za těchto okolností zváženo.
4.8 Nežádoucí účinky
a. Souhrn bezpečnostního profilu
Nežádoucí účinky pozorované u pacientů užívajících Levemir jsou především způsobené farmakologickým účinkem inzulinu. Celkový procentuální podíl léčených pacientů, u nichž se očekávají nežádoucí účinky, se odhaduje na 12 %.
Nejčastěji hlášeným nežádoucím účinkem během léčby je hypoglykemie, viz bod c níže.
Z klinických průzkumů je známo, že významná hypoglykemie, definovaná nutností intervence třetí strany, se vyskytuje zhruba u 6% pacientů léčených přípravkem Levemir,
Reakce v místě vpichu se během léčby přípravkem Levemir vyskytují častěji, než je tomu u humánních inzulinových přípravků, Tyto reakce zahrnují bolestivost, zarudnutí, kopřivku, zánět, modřiny, otoky a svědění v místě vpichu. Většina těchto reakcí v místě vpichu je nezávažných a přechodné povahy, tj. normálně během pokračující léčby vymizí, a to v několika dnech nebo týdnech.
Na počátku inzulinové léčby se mohou vyskytnout poruchy refrakce a edém. Tyto reakce jsou obvykle přechodné povahy. Rychlé zlepšení kontroly hladiny glukózy v krvi může být spojeno s akutní bolestivou neuropatií, která je obvykle reverzibilní. Intenzifikace inzulinové terapie s prudkým zlepšením glykemické kontroly může být spojena s přechodným zhoršením diabetické retinopatie, zatímco dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie.
b. Seznam nežádoucích účinků v tabulce
Nežádoucí účinky uvedené níže jsou založeny na údajích z klinických studií a jsou klasifikovány podle MedDRA frekvence výskytu a třídy orgánových systémů. Frekvence výskytu jsou definovány podle následující konvence: Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Poruchy imunitního systému |
Méně časté - alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce* |
|
Velmi vzácné - anafylaktické reakce* | |
|
Poruchy metabolismu a výživy |
Velmi časté - hypoglykemie* |
|
Poruchy nervového systému |
Vzácné - periferní neuropatie (bolestivá neuropatie) |
|
Poruchy oka |
Méně časté - refrakční poruchy |
|
Méně časté - diabetická retinopatie | |
|
Poruchy kůže a podkožní tkáně |
Méně časté - Lipodystrofie* |
|
Celkové poruchy a reakce v místě aplikace |
Časté - reakce v místě vpichu |
|
Méně časté - edém |
* viz bod c
c. Popis vybraných nežádoucích účinků
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka a erupce jsou méně časté, pokud je Levemir používán v režimu bazál-bolus. Pokud je však užíván v kombinaci s perorálními
antidiabetiky, byl ve třech klinických studiích pozorován výskyt alergických reakcí a potenciálně alergických reakcí s frekvencí 2,2 %.
Anafylaktické reakce
Výskyt generalizovaných hypersenzitivních reakcí (včetně generalizované vyrážky, svědění, pocení, gastrointestinální nevolnosti, angioneurotického edému, dechových obtíží, palpitace a snížení krevního tlaku) je velmi vzácný, ale může být potenciálně život ohrožující.
Hypoglykemie
Nejčastěji hlášeným nežádoucím účinkem je hypoglykemie. Může se objevit v případě, že dávka inzulinu je příliš vysoká oproti potřebě inzulinu. Těžká hypoglykemie může vést k bezvědomí a/nebo křečím a může vyústit v přechodné nebo trvalé poškození mozkové funkce nebo dokonce k úmrtí. Symptomy hypoglykemie se obvykle objevují náhle. Mohou zahrnovat studený pot, chladnou bledou pokožku, únavu, nervozitu nebo třes, úzkost, neobvyklou vyčerpanost nebo slabost, zmatenost, problémy s koncentrací, ospalost, přílišný hlad, změny vidění, bolest hlavy, nauzeu a palpitace.
Lipodystrofie
V místě vpichu může vzniknout lipodystrofie (včetně lipohypertrofie, lipoatrofie). Průběžná cyklická změna místa vpichu v dané oblasti snižuje riziko vzniku takovýchto reakcí.
d. Pediatrická populace
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u pediatrické populace jakékoliv rozdíly oproti širším zkušenostem v obecné diabetické populaci.
e. Další populační specifika
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u starších pacientů a u pacientů s poškozením ledvin či jater jakékoliv rozdíly oproti širším zkušenostem v obecné populaci.
f. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkovánf
Přesnou nadměrnou dávku inzulinu nelze definovat, neboť hypoglykemie se může vyvíjet postupně přes jednotlivá stádia, pokud jsou podávány příliš vysoké dávky oproti pacientovým potřebám:
• Mírné hypoglykemické epizody se mohou léčit podáním glukózy nebo výrobků obsahujících cukr perorálně. Proto se doporučuje, aby měl diabetik vždy u sebe výrobky obsahující cukr.
• Těžké epizody hypoglykemie, kdy pacient upadl do bezvědomí, mohou být léčeny glukagonem (0,5 až 1 mg), aplikovaným nitrosvalově nebo subkutánně, školenou osobou nebo glukózou podanou intravenózně kvalifikovaným zdravotníkem. Pokud pacient neodpovídá na glukagon do 10 až 15 minut, musí být podána glukóza intravenózně. Po dosažení vědomí je doporučováno podávat pacientovi uhlohydráty perorálně, aby se zabránilo relapsu.
5. farmakologické vlastnosti
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: léčiva k terapii diabetů. Inzulíny a analoga pro injekci, dlouhodobě působící: ATC kód: A10AE05.
Mechanismus účinku a farmakodynamické účinky
Levemir je rozpustný dlouhodobě působící inzulinový analog s prodlouženým trváním účinku, který se používá jako bazální inzulin.
Účinek přípravku Levemir na snížení hladiny glukózy v krvi je způsoben usnadněným vychytáváním glukózy, které následuje po navázání inzulinu na receptory svalových a tukových buněk, a současnou inhibicí výdeje glukózy z jater.
Profil působení přípravku Levemir v čase je statisticky významně méně variabilní, a proto lépe předvídatelný, než u inzulinu NPH (Neutral Protamine Hagedorn), jak je patrné z koeficientů intraindividuální variability (CV) u pacienta pro celkový a maximální farmakodynamický účinek (v tabulce 1).
Tabulka 1. Intraindividuální variabilita profilu působení přípravku Levemir a NPH u pacienta
v čase
|
Farmakodynamický bod obratu |
Levemir CV (%) |
Inzulin NPH CV (%) |
|
AUCGIR,0-24h* |
27 |
68 |
|
GIRmax** |
23 |
46 |
*Plocha pod křivkou **Pro rychlost infúze glukózy p < 0,001 pro všechna srovnání s přípravkem Levemir
Prodloužený účinek přípravku Levemir je zprostředkován silným sdružováním molekul inzulinu detemir v místě vpichu a vazbou na albumin prostřednictvím postranních řetězců mastných kyselin. Inzulin detemir je ve srovnání s inzulinem NPH distribuován do periferních cílových tkání pomaleji. Tyto kombinované mechanismy prodloužení délky účinku poskytují lépe reprodukovatelný profil absorpce a účinku u inzulinu detemir ve srovnání s inzulinem NPH.
Farmakodynamické parametry pro Levemir a NPH
|
Levemir |
NPH | ||||
|
j./kg |
j/kg |
j/kg |
m.j./kg | ||
|
Doba působení (hod) |
12 |
17Ť |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4Ť |
1.7 |
1.6 | |
Todhadované hodnoty
s 4-
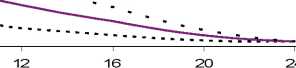
Čas od okamžiku vpíchnutí inzulinu (v hodinách) Levemir ..... 0,2 j./kg 0,3 j./kg . . . .0,4 j./kg
Obrázek 1 Profily účinku přípravku Levemir u pacientů s diabetem 1. typu.
Trvání účinku je až 24 hodin v závislosti na dávce, což umožňuje podávání jednou až dvakrát denně. Pokud se podává dvakrát denně, nastane ustálený stav po podání 2-3 dávek. U dávek v intervalu 0,20,4 jednotky/kg dosáhne Levemir více než 50% svého maximálního účinku od 3-4 hodin do zhruba 14 hodin po podání dávky.
Proporcionalita dávky ve farmakodynamické odezvě (maximální účinek, trvání účinku, celkový účinek) je pozorována po subkutánním podání.
V dlouhodobých klinických studiích byla prokázána nižší variabilita hladin plazmatické glukózy nalačno mezi jednotlivými dny při léčbě přípravkem Levemir ve srovnání s inzulínem NPH.
Studie u pacientů s diabetem 2. typu léčených bazálním inzulinem v kombinaci s perorálními antidiabetiky prokázaly, že glykemická kontrola (HbA1c) přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem glargin a je spojená s menším hmotnostním přírůstkem (viz tabulka 2 níže). Ve srovnávací studii s inzulinem glargin bylo možno podávat Levemir jednou nebo dvakrát denně, zatímco inzulin glargin byl podáván jednou denně. 55 % pacientů léčených přípravkem Levemir dokončilo léčbu trvající 52 týdnů v režimu dvou podání denně.
Tabulka 2. Změny v tělesné hmotnosti po inzulínové léčbě
|
Trvání studie |
Levemir jednou denně |
Levemir dvakrát denně |
NPH inzulin |
Inzulin glargin |
|
20 týdnů |
+0,7 kg |
+1,6 kg | ||
|
26 týdnů |
+1,2 kg |
+2,8 kg | ||
|
52 týdnů |
+2,3 kg |
+3,7 kg |
+4,0 kg |
Ze studií hodnotících užívání perorálních antidiabetik vyplynulo, že při kombinované léčbě s přípravkem Levemir existuje nižší riziko lehkých nočních hypoglykémií ve srovnání s inzulinem NPH a to o 61-65 %.
Byla provedena otevřená randomizovaná klinická studie u pacientů s diabetes mellitus 2. typu, kteří nedosáhli cílových hodnot perorálními antidiabetiky. Klinická studie byla zahájena 12týdenním přípravným obdobím s kombinací liraglutidu s metforminem, během něhož 61 % pacientů dosáhlo HbA1c<7 %. U 39 % pacientů, kteří cílových hodnot nedosáhli, byla provedena randomizace tak, že jim buď byla přidána léčba přípravkem Levemir podávaným 1x denně nebo pokračovali s léčbou liraglutidem s metforminem po dobu 52 týdnů. Přidání přípravku Levemir se po 52 týdnech projevilo dalším snížením HbA1c z 7,6 % na 7,1 %. Nedošlo k závažným hypoglykemickým příhodám. Závažná hypoglykemická příhoda je definována jako příhoda, kde pacient nebyl schopen zvládnout léčbu hypoglykemie sám a jestliže bylo nutno podat glukagon nebo intravenózně glukózu. Viz tabulka 3.
|
Tabulka 3. Data získaná z klinické studie - Levemir přidán |
í liraglutidu+metforminu | |||
|
Týden studie |
Větev Levemir + liraglutid + metformin N = 160 |
Větev Liraglutid + metformin N = 149 |
P-hodnota | |
|
Průměrná změna HbAJc oproti výchozímu stavu (%) |
Týdny 0-26 |
-0,51 |
+0,02 |
<0,0001 |
|
Týdny 0-52 |
-0,50 |
0,01 |
<0,0001 | |
|
Podíl pacientů, kteří dosáhli cílové hodnoty HbA1c <7% (%) |
Týdny 0-26 |
43,1 |
16,8 |
<0,0001 |
|
Týdny 0-52 |
51,9 |
21,5 |
<0,0001 | |
|
Změna tělesné hmotnosti oproti výchozímu stavu (kg) |
Týdny 0-26 |
-0,16 |
-0,95 |
0,0283 |
|
Týdny 0-52 |
-0,05 |
-1,02 |
0,0416 | |
|
Lehké hypoglykemické příhody (na pacienta a rok) |
Týdny 0-26 |
0,286 |
0,029 |
0,0037 |
|
Týdny 0-52 |
0,228 |
0,034 |
0,0011 | |
Byla prováděna 26týdenní, dvojitě zaslepená, randomizovaná klinická studie u pacientů s diabetem 2. typu nedostatečně kompenzovaných léčbou bazálním inzulinem s nebo bez metforminu za účelem stanovení účinnosti a bezpečnosti při přidání liraglutidu (v dávce 1,8 mg) oproti placebu. U pacientů s výchozí hodnotou HbA1c < 8,0 % byla dávka inzulinu snížena o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně si pacienti mohli titrovat dávku inzulinu až k dávkám nepřevyšujícím dávku před randomizací. Levemir byl použit jako bazální inzulin u 33 % pacientů (N = 147) (97,3 % užívalo metformin). Přidání liraglutidu u těchto pacientů vedlo k většímu poklesu HbA1c ve srovnání s přidáním placeba (na 6,93 % oproti 8,24 %), k výraznějšímu snížení plazmatické hladiny glukózy nalačno (na 7,20 mmol/l oproti 8,13 mmol/l) a k většímu hmotnostnímu úbytku (-3,47 kg oproti -0,43 kg). Výchozí hodnoty pro tyto parametry byly podobné u obou skupin. V obou skupinách byl pozorovaný počet lehkých hypoglykemických příhod podobný. V žádné skupině nebyly pozorovány závažné hypoglykemické příhody.
V dlouhodobých studiích u pacientů s diabetem 1. typu se při inzulinové terapii bazál-bolus přípravkem Levemir plazmatická hladina glukózy nalačno zlepšila ve srovnání s pacienty léčenými inzulinem NPH. Kontrola glykemie (HbA1c) s přípravkem Levemir byla srovnatelná s inzulinem NPH, s menším rizikem nočních hypoglykemií a bez přidruženého přírůstku tělesné hmotnosti.
V klinických studiích užívajících inzulinovou terapii bazál-bolus byla celková míra hypoglykemie při aplikaci přípravku Levemir a inzulinu NPH podobná. Analýzy nočních hypoglykemií u pacientů s diabetem 1. typu prokázaly signifikantně nižší riziko méně závažné noční hypoglykemie (se schopností samoléčby potvrzené glukózou v kapilárách nižší než 2,8 nebo 3,1 mmol/l, pokud je vyjádřena jako glukóza v plazmě) oproti inzulinu NPH, přičemž u diabetu 2. typu nebyly pozorovány žádné rozdíly.
Při použití přípravku Levemir byl pozorován vznik protilátek. Neukázalo se však, že by tato skutečnost měla vliv na glykemickou kontrolu.
Levemir byl studován v otevřené randomizované kontrolované klinické studii u těhotných žen s diabetem 1. typu (n = 310), kde tyto ženy byly léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid (viz bod 4.6). Ve 36. týdnu těhotenství (GW) byly výsledky u přípravku Levemir a inzulinu NPH srovnatelné (měřeno hodnotou HbA1c ) a snížení průměrného HbA1c během těhotenství bylo podobné (viz Tabulka 4).
Tabulka 4. Kontrola glykémie v těhotenství
|
Levemir |
NPH |
Rozdíl/Poměr pravděpodobností/ Relativní riziko 95% CI | |
|
Průměrný HbA1c (%) v GW 36 |
6,27 |
6,33 |
Rozdíl: -0,06 [-0,21; 0,08] |
|
Průměrná hodnota FPG v GW 36 (mmol/l) |
4,76 |
5,41 |
Rozdíl: -0,65 [-1,19; -0,12] |
|
Poměr pacientek, které dosáhly cílových hodnot HbA1c <6% v GW 24 a v GW 36 (%) |
41% |
32% |
Poměr pravděpodobností: 1,36 [0,78; 2,37] |
|
Celkový počet závažných hypoglykemických příhod v průběhu těhotenství (na pacientku a rok) |
1,1 |
1,2 |
Relativní riziko: 0,82 [0,39; 1,75] |
Pediatrická populace
Účinnost a bezpečnost přípravku Levemir byly studovány po dobu 12 měsíců ve třech randomizovaných kontrolovaných klinických studiích u dospívajících a dětí (n= celkem 1 045). Studie zahrnovaly celkem 167 dětí ve věku 1 - 5 let. Studie prokázaly, že kontrola glykemie (HbA1c) při léčbě přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem degludek, pokud je Levemir podáván formou bazál-bolus terapie, při toleranci 0,4 %. Ve studii srovnávající Levemir s inzulinem degludek byl výskyt hyperglykemických příhod s ketoacidózou u přípravku Levemir významně vyšší (1,09 oproti 0,68 příhod na pacientorok léčby). Při léčbě přípravkem Levemir byl pozorován nižší hmotnostní přírůstek (SD skóre, hmotnost korigována na pohlaví a věk) v porovnání s inzulinem NPH.
Klinická studie zahrnující děti starší dvou let byla prodloužena o dalších 12 měsíců (byla získána data za celkem 24 měsíců) za účelem posoudit tvorbu protilátek po dlouhodobé léčbě přípravkem Levemir. Po počátečním nárůstu protilátek vůči inzulinu v průběhu prvního roku hladina protilátek vůči inzulinu během druhého roku poklesla na úroveň mírně vyšší, než byla před začátkem studie. Výsledky naznačují, že tvorba protilátek nemá negativní vliv na kontrolu glykémie a dávku přípravku Levemir.
Údaje týkající se účinnosti a bezpečnosti pro dospívající pacienty s diabetes mellitus 2. typu byly extrapolovány z údajů pro děti, dospívající a dospělé pacienty s diabetes mellitus 1. typu a pro dospělé pacienty s diabetes mellitus 2. typu. Výsledky podporují použití přípravku Levemir u dospívajících pacientů s diabetes mellitus 2. typu.
5.2 Farmakokinetické vlastnosti
Absorpce
Maximální sérová koncentrace je dosažena za 6 až 8 hodin po podání. Při podání dvakrát denně je dosaženo rovnovážného stavu sérových koncentrací po aplikaci 2-3 dávek. Variabilita v absorpci u pacientů je nižší u přípravku Levemir než u ostatních bazálních inzulinových preparátů.
Absolutní biologická dostupnost inzulinu detemir při subkutánním podání je cca 60%.
Distribuce
Zdánlivý distribuční objem přípravku Levemir (cca 0,1 l/kg) značí, že v krvi cirkuluje vysoká frakce inzulinu detemir.
Výsledky in vitro a in vivo studií vazeb na bílkoviny naznačují, že neexistuje klinicky relevantní interakce mezi inzulinem detemir a jinými léčivými přípravky, které se vážou na mastné kyseliny nebo proteiny.
Biotransformace
Odbourávání inzulinu detemir je podobné jako u humánního inzulinu; všechny vytvořené metabolity jsou inaktivní.
Eliminace
Terminální poločas po subkutánním podání je určen rychlostí absorpce z podkožní tkáně. Terminální poločas je 5 až 7 hodin v závislosti na dávce.
Linearita
Po subkutánním podání lze v terapeutickém rozmezí dávky sledovat proporcionalitu se sérovými koncentracemi (maximální koncentrace, stupeň absorpce).
Při podání jednorázové dávky přípravku Levemir 0,5 jednotky/kg s liraglutidem v dávce 1,8 mg pacientům s diabetem 2. typu nebyly v ustáleném stavu pozorovány žádné farmakokinetické nebo farmakodynamické interakce mezi liraglutidem a přípravkem Levemir.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi staršími a mladými lidmi.
Poškození ledvin a jater
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi lidmi s poruchou ledvin nebo jater a zdravými lidmi. Protože u těchto skupin pacientů nebyly provedeny rozsáhlé studie farmakokinetiky přípravku Levemir, doporučuje se u nich důkladně monitorovat glukózu v plazmě.
Pohlaví
Ve farmakokinetických vlastnostech přípravku Levemir neexistují žádné klinicky relevantní rozdíly mezi pohlavími.
Pediatrická populace
Farmakokinetické vlastnosti přípravku Levemir byly zkoumány u malých dětí (1 - 5 let), u dětí (6 -12 let) a dospívajících (13 - 17 let) a byly srovnávány s dospělými s diabetem 1. typu. Ve farmakokinetických vlastnostech nebyly klinicky relevantní rozdíly mezi malými dětmi, dětmi, dospívajícími a dospělými.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka. Údaje o afinitě k receptorům a in vitro testy mitogenicity neodhalily žádný důkaz zvýšeného mitogenního potenciálu ve srovnání s humánním inzulinem.
6. farmaceutické údaje
6.1 Seznam pomocných látek
Glycerol Fenol Metakresol Octan zinečnatý
Dihydrát hydrogenfosforečnanu sodného Chlorid sodný
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Léčivé látky přidané k přípravku Levemir mohou způsobit odbourávání inzulinu detemir, např. léčivé přípravky obsahující thioly nebo siřičitany. Levemir se nemá přidávat do infuzních roztoků.
Tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
Před otevřením: 30 měsíců.
Během používání, nebo pokud Levemir nosíte jako zásobní: přípravek smí být uchováván maximálně 6 týdnů.
6.4 Zvláštní opatření pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C - 8°C). Neuchovávejte v blízkosti chladicího zařízení. Chraňte před mrazem.
Během používání, nebo pokud Levemir nosíte jako zásobní: uchovávejte při teplotě do 30°C. Chraňte před chladem. Chraňte před mrazem.
Uchovávejte FlexPen uzavřený uzávěrem, aby byl chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
3 ml roztoku v zásobní vložce (sklo třídy 1), s pístem (bromobutyl) a pryžovou zátkou (bromobutyl/polyisopren), obsažené v jednorázovém multidávkovacím předplněném peru zhotoveném z polypropylenu.
Velikosti balení jsou 1 předplněné pero (včetně jehel nebo bez jehel), 5 (bez jehel) a 10 (bez jehel) předplněných per. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Jehly a Levemir FlexPen nesmí být s nikým sdíleny. Zásobní vložka se nesmí znovu naplňovat. Nepoužívejte tento léčivý přípravek, pokud zjistíte, že roztok není čirý, bezbarvý a vodný.
Levemir, který byl zmražen, nesmí být použit.
Pacient má být poučen, aby po každé aplikaci zlikvidoval jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. držitel rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
8. registrační čísla
EU/1/04/278/004
EU/1/04/278/005
EU/1/04/278/006
EU/1/04/278/010
EU/1/04/278/011
9. datum první registrace/prodloužení registrace
Datum první registrace: 1. června 2004 Prodloužení registrace: 16. dubna 2009
io. datum revize textu
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu název přípravku
1.
Levemir 100 jednotek/ml injekční roztok v předplněném peru.
2. kvalitativní a kvantitativní složení
1 ml roztoku obsahuje 100 jednotek insulinum detemirum* (ekvivalentní 14,2 mg). 1 předplněné pero obsahuje 3 ml odpovídající 300 jednotkám.
*Inzulin detemir je vyráběn rekombinantní DNA technologií v Saccharomyces cerevisiae.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok pro injekce v předplněném peru. InnoLet.
Vodný roztok je čirý a bezbarvý.
4. klinické údaje
4.1 Terapeutické indikace
Levemir je indikován k léčbě diabetes mellitus u dospělých, dospívajících a dětí ve věku od 1 roku.
4.2 Dávkování a způsob podání
Dávkování
Účinnost inzulinových analogů, včetně inzulinu detemir, se vyjadřuje v jednotkách, zatímco účinnost humánních inzulinů se vyjadřuje v mezinárodních jednotkách. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
Levemir může být použit samostatně jako bazální inzulin nebo v kombinaci s bolusovým inzulinem. Může být také používán v kombinaci s perorálními antidiabetiky a/nebo agonisty GLP-1 receptoru.
Pokud je Levemir používán v kombinaci s perorálními antidiabetiky či pokud je přidáván k agonistům receptoru GLP-1 , je doporučeno užívat Levemir jednou denně s počáteční dávkou 0,1 -0,2 jednotky/kg nebo 10 jednotek u dospělých pacientů. Dávka přípravku Levemir má být upravena titrováním na základě individuálních potřeb pacienta.
Pokud jsou agonisté receptoru GLP-1 přidáváni k přípravku Levemir, doporučuje se snížit dávku přípravku Levemir o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně má být individuálně upraveno dávkování.
Pro individuální úpravu dávky jsou pro dospělé doporučovány dva následující titrační postupy. Titrační postup pro dospělé s diabetem 1. typu a 2. typu
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 jednotek |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 jednotek |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 jednotky |
|
7,1-8,0 mmol/l (127-144 mg/dl) |
+ 2jednotky |
|
6,l-7,0 mmol/1 (109-126 mg/dl) |
+ 2 jednotky |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
3,1-4,0 mmol/1 (56-72 mg/dl) |
- 2 jednotky |
|
<3,1 mmol/1 (<56 mg/dl) |
- 4 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma Glucose)
Jednoduchý postup pro dospělé s diabetem 2. typu při provádění titrace pacientem
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 6,1 mmol/1 (>110 mg/dl) |
+ 3 jednotky |
|
4,4-6,1 mmol/1 (80-110 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
<4,4 mmol/1 (<80 mg/dl) |
- 3 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma G
ucose)
Je-li Levemir užíván jako část inzulinového režimu bazal-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientově potřebě. Dávkování přípravku Levemir má být upraveno individuálně.
Úprava dávky může být nutná, pokud pacienti podstupují zvýšenou fyzickou aktivitu, mění svou obvyklou dietu nebo během souběžného onemocnění.
Pokud si pacienti upravují dávku z důvodu zlepšení kontroly hladiny glukózy, musí být poučeni o tom, že je nutno si všímat příznaků hypoglykemie.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Levemir může být používán staršími pacienty. Monitorování glukózy u starších pacientů má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Poškození ledvin a jater
Poškození ledvin nebo jater může snížit pacientovu potřebu inzulinu.
Monitorování glukózy u pacientů s poškozením ledvin nebo jater má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Pediatrická populace
Levemir lze používat u dospívajících a dětí ve věku od 1 roku (viz bod 5.1). Při převodu z bazálního inzulinu na Levemir je zapotřebí zvážit na individuálním základě snížení dávky bazálního a bolusového inzulinu, aby se minimalizovalo riziko hypoglykemie (viz bod 4.4).
Monitorování glukózy u dětí a dospívajících má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla stanovena.
Nejsou dostupné žádné údaje.
Přechod z jiných inzulínových léčivých přípravků:
Při přechodu z jiných intermediárně nebo dlouhodobě působících inzulinových léčivých přípravků může být nutná úprava dávky a načasování podávání (viz bod 4.4).
Během přechodu a několik týdnů poté je doporučeno důkladné monitorování glukózy (viz bod 4.4).
Je možné, že bude třeba upravit souběžnou antidiabetickou léčbu (dávku a/nebo načasování podávání perorálních antidiabetik nebo souběžně podávaných krátkodobě/rychle působících inzulinových léčivých přípravků).
Způsob podání
Levemir je dlouhodobě působící inzulínový analog používaný jako bazální inzulin. Levemir je určen pouze pro subkutánní podání. Levemir nesmí být podáván intravenózně, neboť to může vést k těžké hypoglykemii. Vyvarujte se také intramuskulárního podání. Levemir není určen pro použití v inzulinových infuzních pumpách.
Levemir se aplikuje subkutánní injekcí do břišní stěny, stehna, horní části paže, oblasti deltového svalu nebo oblasti hýždí. Místa vpichu mají být vždy obměňována v rámci téže oblasti, aby se snížilo riziko lipodystrofie. Trvání účinku se bude lišit v závislosti na dávce, místě vpichu, prokrvení, teplotě a fyzické aktivitě. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladiny glukózy v krvi dávkování dvakrát denně, může být večerní dávka podána večer nebo před spaním.
Podání aplikátorem inzulínu InnoLet
Levemir InnoLet je předplněné pero, které je určeno k použití spolu s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm. Dávky lze nastavit od 1 do 50 jednotek v přírůstcích po 1 jednotce.
Levemir InnoLet je opatřen příbalovou informací s podrobným návodem k použití, jenž má být dodržován.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Před cestou mezi různými časovými pásmy se má pacient poradit s lékařem. Cestování mezi různými časovými pásmy může totiž znamenat, že pacient bude muset užívat inzulin a přijímat jídla v odlišných časech.
Hyperglykemie
Nedostatečné dávkování nebo přerušovaná léčba, zejména u diabetu 1. typu, může vést k hyperglykemii a diabetické ketoacidóze. První symptomy hyperglykemie se obvykle v průběhu hodin nebo dní stupňují. Mezi ně patří žízeň, zvýšená frekvence močení, nauzea, zvracení, ospalost, zarudlá suchá kůže, sucho v ústech, ztráta chuti k jídlu, či acetonový zápach dechu. U diabetu 1. typu mohou vést neléčené hyperglykemické stavy až k diabetické ketoacidóze, která je potenciálně letální.
Hypoglykemie
Vynechání jídla nebo neplánovaná namáhavá fyzická zátěž mohou vést k hypoglykemii.
U dětí je třeba dbát na to, aby dávky inzulinu (zvláště v režimu bazál-bolus) odpovídaly příjmu jídla a fyzické aktivitě a tím bylo minimalizováno riziko hypoglykemie.
Hypoglykemie se může objevit, pokud je dávka inzulinu příliš vysoká ve vztahu k potřebě inzulinu.
V případě hypoglykemie či v případě podezření na hypoglykemii nesmí být Levemir podán. Poté, co u pacienta dojde ke stabilizaci hladiny glukózy v krvi, má být zvážena úprava dávky (viz body 4.8 a 4.9).
Pacienti, kterým se regulace hladiny glukózy v krvi významně zlepšila, např. zintenzívněnou inzulinovou terapií, mohou zpozorovat změnu v obvyklých varovných symptomech hypoglykemie a mají být o tom adekvátně informováni. U pacientů s dlouholetým diabetem mohou běžné varovné symptomy vymizet.
Souběžná nemoc, především infekce a horečnaté stavy, obvykle zvyšuje pacientovu potřebu inzulínu. Přidružené onemocnění ledvin, jater či onemocnění postihující nadledviny, podvěsek mozkový nebo štítnou žlázu může vyžadovat změny v dávce inzulinu.
Pokud je pacient převeden na jiný typ inzulinových léčivých přípravků, může dojít ke změně či potlačení časných varovných příznaků hypoglykemie oproti těm, které se u pacienta projevovaly u předchozího inzulinu.
Převedení z jiných inzulínových léčivých přípravků
Převod pacienta na jiný typ nebo značku inzulinu má probíhat pod přísným lékařským dozorem. Změny v síle, značce (výrobce), typu, původu (zvířecí inzulin, humánní inzulin či analog inzulinu) a/nebo metodě výroby (rekombinantní DNA versus inzulin ze zvířecích zdrojů) mohou vést k potřebě změnit dávkování. Pacienti převádění na přípravek Levemir z jiných typů inzulinu mohou vyžadovat změnu dávkování oproti jejich běžnému inzulinovému léčivému přípravku. Pokud je potřeba přizpůsobit dávkování, může k tomu dojít při první dávce nebo během prvních týdnů či měsíců.
Reakce v místě vpichu
Tak jako při každé léčbě inzulinem se mohou objevit reakce v místě vpichu, které se projevují bolestivostí, zarudnutím, kopřivkou, zánětem, modřinami, otoky a svěděním. Pravidelné obměňování injekčního místa v rámci jedné oblasti může napomoci tyto reakce omezit nebo jim zabránit. Reakce obvykle vymizí do několika dnů nebo týdnů. Ve vzácných případech si mohou reakce v místě vpichu vyžádat vysazení přípravku Levemir.
Hypoalbuminemie
O pacientech s těžkou hypoalbuminémií jsou k dispozici jen omezené údaje. U těchto pacientů je doporučeno důkladné monitorování.
Kombinace přípravku Levemir s pioglitazonem
Pokud byl pioglitazon užíván v kombinaci s inzulinem, byly hlášeny případy srdečního selhání a to zvláště u pacientů s rizikovými faktory pro vznik srdečního selhání. Tuto skutečnost je nutno vzít v úvahu, pokud je zvažována léčba pioglitazonem v kombinaci s přípravkem Levemir. Pokud je tato kombinace použita, mají být pacienti sledováni s ohledem na známky a příznaky srdečního selhání, zvýšení hmotnosti a edém. Pioglitazon má být vysazen, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Je známa řada léčivých přípravků, které ovlivňují metabolismus glukózy.
Následující látky mohou snížit pacientovu potřebu inzulinu:
Perorální antidiabetické léčivé přípravky, agonisté receptoru GLP-1 , inhibitory monoaminooxidázy (IMAO), beta-blokátory, inhibitory angiotensin konvertujícího enzymu (ACE), salicyláty, anabolické steroidy a sulfonamidy.
Následující látky mohou zvýšit pacientovu potřebu inzulinu:
Perorální antikoncepce, thiazidy, glukokortikoidy, thyreoidální hormony, sympatomimetika, růstový hormon a danazol.
Betablokátory mohou skrýt hypoglykemické symptomy.
Oktreotid/lanreotid může jak zvýšit, tak snížit potřebu inzulinu.
Alkohol může zesílit nebo snížit hypoglykemický účinek inzulinu.
4.6 Fertilita, těhotenství a kojení
Během těhotenství může být zvažována léčba přípravkem Levemir. Každý potencionální přínos však musí být zvážen proti možnému zvýšenému riziku nepříznivého dopadu na těhotenství.
Všeobecně se doporučuje u těhotných žen s diabetem zvýšená kontrola a monitorování glukózy v krvi během těhotenství a při plánování těhotenství. Potřeba inzulinu obvykle v prvním trimestru klesá a zvyšuje se následně během druhého a třetího trimestru. Po porodu se potřeba inzulinu za normálních okolností rychle vrátí k hodnotám před těhotenstvím.
V otevřené randomizované kontrolované klinické studii byly těhotné ženy s diabetem 1. typu (n = 310) léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid. Primárním cílem této studie bylo posouzení vlivu přípravku Levemir na regulaci hladiny glukózy v krvi u těhotných diabetiček (viz bod 5.1).
Celková frekvence výskytu nežádoucích účinků během těhotenství byla u skupin pacientek léčených přípravkem Levemir či inzulinem NPH podobná, avšak u přípravku Levemir byla ve srovnání s NPH inzulinem pozorována početně vyjádřeno vyšší frekvence závažných nežádoucích účinků u matek (61 (40%) oproti 49 (31 %)) i u novorozenců (36 (24 %) oproti 32 (20 %)). Počet živě narozených dětí byl u žen, jež otěhotněly po zařazení do studie, v případě přípravku Levemir 50 (83 %) a 55 (89 %) v případě inzulinu NPH. Frekvence výskytu kongenitálních malformací byla u přípravku Levemir 4 (5 %) a u inzulinu NPH 11 (7 %), a to se 3 (4 %) závažnými malformacemi u přípravku Levemir a se 3 (2 %) závažnými malformacemi u inzulinu NPH.
Postmarketingové údaje u dalších 250 těhotných žen, které byly vystaveny léčbě přípravkem Levemir, nenaznačují žádné nežádoucí účinky inzulinu detemir na těhotenství a žádnou malformační nebo feto/neonatální toxicitu inzulinu detemir.
Studie na zvířatech neprokázaly reprodukční toxicitu (viz bod 5.3).
Kojení
Není známo, zda se inzulin detemir vylučuje do lidského mateřského mléka. Nepředpokládají se žádné metabolické účinky požitého inzulinu detemir na kojeného novorozence/dítě, protože inzulin detemir je jako peptid v lidském gastrointestinálním traktu rozložen na aminokyseliny.
Kojící ženy mohou vyžadovat úpravu dávkování inzulinu a diety.
Fertilita
Studie prováděné na zvířatech nenaznačují škodlivé účinky na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost pacienta koncentrovat se a reagovat může být narušena jako důsledek hypoglykemie. To může představovat riziko v situacích, kdy tato schopnost nabývá zvláštní důležitosti (např. řízení nebo obsluhování strojů).
Pacienti mají být upozorněni na to, aby byli opatrní a vyvarovali se řízení při hypoglykemii. To je obzvláště důležité u těch, kteří mají sníženou nebo chybějící citlivost vůči příznakům hypoglykemie nebo mají časté epizody hypoglykemie. Zda je vhodné řídit, má být za těchto okolností zváženo.
4.8 Nežádoucí účinky
a. Souhrn bezpečnostního profilu
Nežádoucí účinky pozorované u pacientů užívajících Levemir jsou především způsobené farmakologickým účinkem inzulinu. Celkový procentuální podíl léčených pacientů, u nichž se očekávají nežádoucí účinky, se odhaduje na 12 %.
Nejčastěji hlášeným nežádoucím účinkem během léčby je hypoglykemie, viz bod c níže.
Z klinických průzkumů je známo, že významná hypoglykemie, definovaná nutností intervence třetí strany, se vyskytuje zhruba u 6% pacientů léčených přípravkem Levemir.
Reakce v místě vpichu se během léčby přípravkem Levemir vyskytují častěji, než je tomu u humánních inzulinových přípravků. Tyto reakce zahrnují bolestivost, zarudnutí, kopřivku, zánět, modřiny, otoky a svědění v místě vpichu. Většina těchto reakcí v místě vpichu je nezávažných a přechodné povahy, tj. normálně během pokračující léčby vymizí, a to v několika dnech nebo týdnech.
Na počátku inzulinové léčby se mohou vyskytnout poruchy refrakce a edém. Tyto reakce jsou obvykle přechodné povahy. Rychlé zlepšení kontroly hladiny glukózy v krvi může být spojeno s akutní bolestivou neuropatií, která je obvykle reverzibilní. Intenzifikace inzulinové terapie s prudkým zlepšením glykemické kontroly může být spojena s přechodným zhoršením diabetické retinopatie, zatímco dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie.
b. Seznam nežádoucích účinků v tabulce
Nežádoucí účinky uvedené níže jsou založeny na údajích z klinických studií a jsou klasifikovány podle MedDRA frekvence výskytu a třídy orgánových systémů. Frekvence výskytu jsou definovány podle následující konvence: Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Poruchy imunitního systému |
Méně časté - alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce* |
|
Velmi vzácné - anafylaktické reakce* | |
|
Poruchy metabolismu a výživy |
Velmi časté - hypoglykemie* |
|
Poruchy nervového systému |
Vzácné - periferní neuropatie (bolestivá neuropatie) |
|
Poruchy oka |
Méně časté - refrakční poruchy |
|
Méně časté - diabetická retinopatie | |
|
Poruchy kůže a podkožní tkáně |
Méně časté - Lipodystrofie* |
|
Celkové poruchy a reakce v místě aplikace |
Časté - reakce v místě vpichu |
|
Méně časté - edém |
* viz bod c
c. Popis vybraných nežádoucích účinků
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka a erupce jsou méně časté, pokud je Levemir používán v režimu bazál-bolus. Pokud je však užíván v kombinaci s perorálními
antidiabetiky, byl ve třech klinických studiích pozorován výskyt alergických reakcí a potenciálně alergických reakcí s frekvencí 2,2 %.
Anafylaktické reakce
Výskyt generalizovaných hypersenzitivních reakcí (včetně generalizované vyrážky, svědění, pocení, gastrointestinální nevolnosti, angioneurotického edému, dechových obtíží, palpitace a snížení krevního tlaku) je velmi vzácný, ale může být potenciálně život ohrožující.
Hypoglykemie
Nejčastěji hlášeným nežádoucím účinkem je hypoglykemie. Může se objevit v případě, že dávka inzulinu je příliš vysoká oproti potřebě inzulinu. Těžká hypoglykemie může vést k bezvědomí a/nebo křečím a může vyústit v přechodné nebo trvalé poškození mozkové funkce nebo dokonce k úmrtí. Symptomy hypoglykemie se obvykle objevují náhle. Mohou zahrnovat studený pot, chladnou bledou pokožku, únavu, nervozitu nebo třes, úzkost, neobvyklou vyčerpanost nebo slabost, zmatenost, problémy s koncentrací, ospalost, přílišný hlad, změny vidění, bolest hlavy, nauzeu a palpitace.
Lipodystrofie
V místě vpichu může vzniknout lipodystrofie (včetně lipohypertrofie, lipoatrofie). Průběžná cyklická změna místa vpichu v dané oblasti snižuje riziko vzniku takovýchto reakcí.
d. Pediatrická populace
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u pediatrické populace jakékoliv rozdíly oproti širším zkušenostem v obecné diabetické populaci.
e. Další populační specifika
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u starších pacientů a u pacientů s poškozením ledvin či jater jakékoliv rozdíly oproti širším zkušenostem v obecné populaci.
f. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkovánf
Přesnou nadměrnou dávku inzulinu nelze definovat, neboť hypoglykemie se může vyvíjet postupně přes jednotlivá stádia, pokud jsou podávány příliš vysoké dávky oproti pacientovým potřebám:
• Mírné hypoglykemické epizody se mohou léčit podáním glukózy nebo výrobků obsahujících cukr perorálně. Proto se doporučuje, aby měl diabetik vždy u sebe výrobky obsahující cukr.
• Těžké epizody hypoglykemie, kdy pacient upadl do bezvědomí, mohou být léčeny glukagonem (0,5 až 1 mg), aplikovaným nitrosvalově nebo subkutánně, školenou osobou nebo glukózou podanou intravenózně kvalifikovaným zdravotníkem. Pokud pacient neodpovídá na glukagon do 10 až 15 minut, musí být podána glukóza intravenózně. Po dosažení vědomí je doporučováno podávat pacientovi uhlohydráty perorálně, aby se zabránilo relapsu.
5. farmakologické vlastnosti
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: léčiva k terapii diabetů. Inzulíny a analoga pro injekci, dlouhodobě působící: ATC kód: A10AE05.
Mechanismus účinku a farmakodynamické účinky
Levemir je rozpustný dlouhodobě působící inzulinový analog s prodlouženým trváním účinku, který se používá jako bazální inzulin.
Účinek přípravku Levemir na snížení hladiny glukózy v krvi je způsoben usnadněným vychytáváním glukózy, které následuje po navázání inzulinu na receptory svalových a tukových buněk, a současnou inhibicí výdeje glukózy z jater.
Profil působení přípravku Levemir v čase je statisticky významně méně variabilní, a proto lépe předvídatelný, než u inzulinu NPH (Neutral Protamine Hagedorn), jak je patrné z koeficientů intraindividuální variability (CV) u pacienta pro celkový a maximální farmakodynamický účinek (v tabulce 1).
Tabulka 1. Intraindividuální variabilita profilu působení přípravku Levemir a NPH u pacienta
v čase
|
Farmakodynamický bod obratu |
Levemir CV (%) |
Inzulin NPH CV (%) |
|
AUCGIR,0-24h* |
27 |
68 |
|
GIRmax** |
23 |
46 |
*Plocha pod křivkou **Pro rychlost infúze glukózy p < 0,001 pro všechna srovnání s přípravkem Levemir
Prodloužený účinek přípravku Levemir je zprostředkován silným sdružováním molekul inzulinu detemir v místě vpichu a vazbou na albumin prostřednictvím postranních řetězců mastných kyselin. Inzulin detemir je ve srovnání s inzulinem NPH distribuován do periferních cílových tkání pomaleji. Tyto kombinované mechanismy prodloužení délky účinku poskytují lépe reprodukovatelný profil absorpce a účinku u inzulinu detemir ve srovnání s inzulinem NPH.
Farmakodynamické parametry pro Levemir a NPH
|
Levemir |
NPH | ||||
|
j./kg |
j/kg |
j/kg |
m.j./kg | ||
|
Doba působení (hod) |
12 |
17Ť |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4Ť |
1.7 |
1.6 | |
Todhadované hodnoty
s 4-
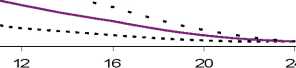
Čas od okamžiku vpíchnutí inzulinu (v hodinách) Levemir ..... 0,2 j./kg 0,3 j./kg . . . .0,4 j./kg
Obrázek 1 Profily účinku přípravku Levemir u pacientů s diabetem 1. typu.
Trvání účinku je až 24 hodin v závislosti na dávce, což umožňuje podávání jednou až dvakrát denně. Pokud se podává dvakrát denně, nastane ustálený stav po podání 2-3 dávek. U dávek v intervalu 0,20,4 jednotky/kg dosáhne Levemir více než 50% svého maximálního účinku od 3-4 hodin do zhruba 14 hodin po podání dávky.
Proporcionalita dávky ve farmakodynamické odezvě (maximální účinek, trvání účinku, celkový účinek) je pozorována po subkutánním podání.
V dlouhodobých klinických studiích byla prokázána nižší variabilita hladin plazmatické glukózy nalačno mezi jednotlivými dny při léčbě přípravkem Levemir ve srovnání s inzulínem NPH.
Studie u pacientů s diabetem 2. typu léčených bazálním inzulinem v kombinaci s perorálními antidiabetiky prokázaly, že glykemická kontrola (HbA1c) přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem glargin a je spojená s menším hmotnostním přírůstkem (viz tabulka 2 níže). Ve srovnávací studii s inzulinem glargin bylo možno podávat Levemir jednou nebo dvakrát denně, zatímco inzulin glargin byl podáván jednou denně. 55 % pacientů léčených přípravkem Levemir dokončilo léčbu trvající 52 týdnů v režimu dvou podání denně.
Tabulka 2. Změny v tělesné hmotnosti po inzulínové léčbě
|
Trvání studie |
Levemir jednou denně |
Levemir dvakrát denně |
NPH inzulin |
Inzulin glargin |
|
20 týdnů |
+0,7 kg |
+1,6 kg | ||
|
26 týdnů |
+1,2 kg |
+2,8 kg | ||
|
52 týdnů |
+2,3 kg |
+3,7 kg |
+4,0 kg |
Ze studií hodnotících užívání perorálních antidiabetik vyplynulo, že při kombinované léčbě s přípravkem Levemir existuje nižší riziko lehkých nočních hypoglykémií ve srovnání s inzulinem NPH a to o 61-65 %.
Byla provedena otevřená randomizovaná klinická studie u pacientů s diabetes mellitus 2. typu, kteří nedosáhli cílových hodnot perorálními antidiabetiky. Klinická studie byla zahájena 12týdenním přípravným obdobím s kombinací liraglutidu s metforminem, během něhož 61 % pacientů dosáhlo HbA1c<7 %. U 39 % pacientů, kteří cílových hodnot nedosáhli, byla provedena randomizace tak, že jim buď byla přidána léčba přípravkem Levemir podávaným 1x denně nebo pokračovali s léčbou liraglutidem s metforminem po dobu 52 týdnů. Přidání přípravku Levemir se po 52 týdnech projevilo dalším snížením HbA1c z 7,6 % na 7,1 %. Nedošlo k závažným hypoglykemickým příhodám. Závažná hypoglykemická příhoda je definována jako příhoda, kde pacient nebyl schopen zvládnout léčbu hypoglykemie sám a jestliže bylo nutno podat glukagon nebo intravenózně glukózu. Viz tabulka 3.
|
Tabulka 3. Data získaná z klinické studie - Levemir přidán |
í liraglutidu+metforminu | |||
|
Týden studie |
Větev Levemir + liraglutid + metformin N = 160 |
Větev Liraglutid + metformin N = 149 |
P-hodnota | |
|
Průměrná změna HbAJc oproti výchozímu stavu (%) |
Týdny 0-26 |
-0,51 |
+0,02 |
<0,0001 |
|
Týdny 0-52 |
-0,50 |
0,01 |
<0,0001 | |
|
Podíl pacientů, kteří dosáhli cílové hodnoty HbA1c <7% (%) |
Týdny 0-26 |
43,1 |
16,8 |
<0,0001 |
|
Týdny 0-52 |
51,9 |
21,5 |
<0,0001 | |
|
Změna tělesné hmotnosti oproti výchozímu stavu (kg) |
Týdny 0-26 |
-0,16 |
-0,95 |
0,0283 |
|
Týdny 0-52 |
-0,05 |
-1,02 |
0,0416 | |
|
Lehké hypoglykemické příhody (na pacienta a rok) |
Týdny 0-26 |
0,286 |
0,029 |
0,0037 |
|
Týdny 0-52 |
0,228 |
0,034 |
0,0011 | |
Byla prováděna 26týdenní, dvojitě zaslepená, randomizovaná klinická studie u pacientů s diabetem 2. typu nedostatečně kompenzovaných léčbou bazálním inzulinem s nebo bez metforminu za účelem stanovení účinnosti a bezpečnosti při přidání liraglutidu (v dávce 1,8 mg) oproti placebu. U pacientů s výchozí hodnotou HbA1c < 8,0 % byla dávka inzulinu snížena o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně si pacienti mohli titrovat dávku inzulinu až k dávkám nepřevyšujícím dávku před randomizací. Levemir byl použit jako bazální inzulin u 33 % pacientů (N = 147) (97,3 % užívalo metformin). Přidání liraglutidu u těchto pacientů vedlo k většímu poklesu HbA1c ve srovnání s přidáním placeba (na 6,93 % oproti 8,24 %), k výraznějšímu snížení plazmatické hladiny glukózy nalačno (na 7,20 mmol/l oproti 8,13 mmol/l) a k většímu hmotnostnímu úbytku (-3,47 kg oproti -0,43 kg). Výchozí hodnoty pro tyto parametry byly podobné u obou skupin. V obou skupinách byl pozorovaný počet lehkých hypoglykemických příhod podobný. V žádné skupině nebyly pozorovány závažné hypoglykemické příhody.
V dlouhodobých studiích u pacientů s diabetem 1. typu se při inzulinové terapii bazál-bolus přípravkem Levemir plazmatická hladina glukózy nalačno zlepšila ve srovnání s pacienty léčenými inzulinem NPH. Kontrola glykemie (HbA1c) s přípravkem Levemir byla srovnatelná s inzulinem NPH, s menším rizikem nočních hypoglykemií a bez přidruženého přírůstku tělesné hmotnosti.
V klinických studiích užívajících inzulinovou terapii bazál-bolus byla celková míra hypoglykemie při aplikaci přípravku Levemir a inzulinu NPH podobná. Analýzy nočních hypoglykemií u pacientů s diabetem 1. typu prokázaly signifikantně nižší riziko méně závažné noční hypoglykemie (se schopností samoléčby potvrzené glukózou v kapilárách nižší než 2,8 nebo 3,1 mmol/l, pokud je vyjádřena jako glukóza v plazmě) oproti inzulinu NPH, přičemž u diabetu 2. typu nebyly pozorovány žádné rozdíly.
Při použití přípravku Levemir byl pozorován vznik protilátek. Neukázalo se však, že by tato skutečnost měla vliv na glykemickou kontrolu.
Levemir byl studován v otevřené randomizované kontrolované klinické studii u těhotných žen s diabetem 1. typu (n = 310), kde tyto ženy byly léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid (viz bod 4.6). Ve 36. týdnu těhotenství (GW) byly výsledky u přípravku Levemir a inzulinu NPH srovnatelné (měřeno hodnotou HbA1c ) a snížení průměrného HbA1c během těhotenství bylo podobné (viz Tabulka 4).
Tabulka 4. Kontrola glykémie v těhotenství
|
Levemir |
NPH |
Rozdíl/Poměr pravděpodobností/ Relativní riziko 95% CI | |
|
Průměrný HbA1c (%) v GW 36 |
6,27 |
6,33 |
Rozdíl: -0,06 [-0,21; 0,08] |
|
Průměrná hodnota FPG v GW 36 (mmol/l) |
4,76 |
5,41 |
Rozdíl: -0,65 [-1,19; -0,12] |
|
Poměr pacientek, které dosáhly cílových hodnot HbA1c <6% v GW 24 a v GW 36 (%) |
41% |
32% |
Poměr pravděpodobností: 1,36 [0,78; 2,37] |
|
Celkový počet závažných hypoglykemických příhod v průběhu těhotenství (na pacientku a rok) |
1,1 |
1,2 |
Relativní riziko: 0,82 [0,39; 1,75] |
Pediatrická populace
Účinnost a bezpečnost přípravku Levemir byly studovány po dobu 12 měsíců ve třech randomizovaných kontrolovaných klinických studiích u dospívajících a dětí (n= celkem 1 045). Studie zahrnovaly celkem 167 dětí ve věku 1 - 5 let. Studie prokázaly, že kontrola glykemie (HbA1c) při léčbě přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem degludek, pokud je Levemir podáván formou bazál-bolus terapie, při toleranci 0,4 %. Ve studii srovnávající Levemir s inzulinem degludek byl výskyt hyperglykemických příhod s ketoacidózou u přípravku Levemir významně vyšší (1,09 oproti 0,68 příhod na pacientorok léčby). Při léčbě přípravkem Levemir byl pozorován nižší hmotnostní přírůstek (SD skóre, hmotnost korigována na pohlaví a věk) v porovnání s inzulinem NPH.
Klinická studie zahrnující děti starší dvou let byla prodloužena o dalších 12 měsíců (byla získána data za celkem 24 měsíců) za účelem posoudit tvorbu protilátek po dlouhodobé léčbě přípravkem Levemir. Po počátečním nárůstu protilátek vůči inzulinu v průběhu prvního roku hladina protilátek vůči inzulinu během druhého roku poklesla na úroveň mírně vyšší, než byla před začátkem studie. Výsledky naznačují, že tvorba protilátek nemá negativní vliv na kontrolu glykémie a dávku přípravku Levemir.
Údaje týkající se účinnosti a bezpečnosti pro dospívající pacienty s diabetes mellitus 2. typu byly extrapolovány z údajů pro děti, dospívající a dospělé pacienty s diabetes mellitus 1. typu a pro dospělé pacienty s diabetes mellitus 2. typu. Výsledky podporují použití přípravku Levemir u dospívajících pacientů s diabetes mellitus 2. typu.
5.2 Farmakokinetické vlastnosti
Absorpce
Maximální sérová koncentrace je dosažena za 6 až 8 hodin po podání. Při podání dvakrát denně je dosaženo rovnovážného stavu sérových koncentrací po aplikaci 2-3 dávek. Variabilita v absorpci u pacientů je nižší u přípravku Levemir než u ostatních bazálních inzulinových preparátů.
Absolutní biologická dostupnost inzulinu detemir při subkutánním podání je cca 60%.
Distribuce
Zdánlivý distribuční objem přípravku Levemir (cca 0,1 l/kg) značí, že v krvi cirkuluje vysoká frakce inzulinu detemir.
Výsledky in vitro a in vivo studií vazeb na bílkoviny naznačují, že neexistuje klinicky relevantní interakce mezi inzulinem detemir a jinými léčivými přípravky, které se vážou na mastné kyseliny nebo proteiny.
Biotransformace
Odbourávání inzulinu detemir je podobné jako u humánního inzulinu; všechny vytvořené metabolity jsou inaktivní.
Eliminace
Terminální poločas po subkutánním podání je určen rychlostí absorpce z podkožní tkáně. Terminální poločas je 5 až 7 hodin v závislosti na dávce.
Linearita
Po subkutánním podání lze v terapeutickém rozmezí dávky sledovat proporcionalitu se sérovými koncentracemi (maximální koncentrace, stupeň absorpce).
Při podání jednorázové dávky přípravku Levemir 0,5 jednotky/kg s liraglutidem v dávce 1,8 mg pacientům s diabetem 2. typu nebyly v ustáleném stavu pozorovány žádné farmakokinetické nebo farmakodynamické interakce mezi liraglutidem a přípravkem Levemir.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi staršími a mladými lidmi.
Poškození ledvin a jater
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi lidmi s poruchou ledvin nebo jater a zdravými lidmi. Protože u těchto skupin pacientů nebyly provedeny rozsáhlé studie farmakokinetiky přípravku Levemir, doporučuje se u nich důkladně monitorovat glukózu v plazmě.
Pohlaví
Ve farmakokinetických vlastnostech přípravku Levemir neexistují žádné klinicky relevantní rozdíly mezi pohlavími.
Pediatrická populace
Farmakokinetické vlastnosti přípravku Levemir byly zkoumány u malých dětí (1 - 5 let), u dětí (6 -12 let) a dospívajících (13 - 17 let) a byly srovnávány s dospělými s diabetem 1. typu. Ve farmakokinetických vlastnostech nebyly klinicky relevantní rozdíly mezi malými dětmi, dětmi, dospívajícími a dospělými.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka. Údaje o afinitě k receptorům a in vitro testy mitogenicity neodhalily žádný důkaz zvýšeného mitogenního potenciálu ve srovnání s humánním inzulinem.
6. farmaceutické údaje
6.1 Seznam pomocných látek
Glycerol Fenol Metakresol Octan zinečnatý
Dihydrát hydrogenfosforečnanu sodného Chlorid sodný
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Léčivé látky přidané k přípravku Levemir mohou způsobit odbourávání inzulinu detemir, např. léčivé přípravky obsahující thioly nebo siřičitany. Levemir se nemá přidávat do infuzních roztoků.
Tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
Před otevřením: 30 měsíců.
Během používání, nebo pokud Levemir nosíte jako zásobní: přípravek smí být uchováván maximálně 6 týdnů.
6.4 Zvláštní opatření pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C - 8°C). Neuchovávejte v blízkosti chladicího zařízení. Chraňte před mrazem.
Během používání, nebo pokud Levemir nosíte jako zásobní: uchovávejte při teplotě do 30°C. Chraňte před chladem. Chraňte před mrazem.
Uchovávejte InnoLet uzavřený uzávěrem, aby byl chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
3 ml roztoku v zásobní vložce (sklo třídy 1), s pístem (bromobutyl) a pryžovou zátkou (bromobutyl/polyisopren), obsažené v jednorázovém multidávkovacím předplněném peru zhotoveném z polypropylenu.
Velikosti balení po 1, 5 a 10 předplněných perech. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Jehly a Levemir InnoLet nesmí být s nikým sdíleny. Zásobní vložka se nesmí znovu naplňovat. Nepoužívejte tento léčivý přípravek, pokud zjistíte, že roztok není čirý, bezbarvý a vodný.
Levemir, který byl zmražen, nesmí být použit.
Pacient má být poučen, aby po každé aplikaci zlikvidoval jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. držitel rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
8. registrační čísla
EU/1/04/278/007
EU/1/04/278/008
EU/1/04/278/009
9. datum první registrace/prodloužení registrace
Datum první registrace: 1. června 2004 Prodloužení registrace: 16. dubna 2009
io. datum revize textu
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/ název přípravku
1.
Levemir 100 jednotek/ml injekční roztok v předplněném peru.
2. kvalitativní a kvantitativní složení
1 ml roztoku obsahuje 100 jednotek insulinum detemirum* (ekvivalentní 14,2 mg). 1 předplněné pero obsahuje 3 ml odpovídající 300 jednotkám.
*Inzulin detemir je vyráběn rekombinantní DNA technologií v Saccharomyces cerevisiae.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok pro injekce v předplněném peru. FlexTouch.
Vodný roztok je čirý a bezbarvý.
4. klinické údaje
4.1 Terapeutické indikace
Levemir je indikován k léčbě diabetes mellitus u dospělých, dospívajících a dětí ve věku od 1 roku.
4.2 Dávkování a způsob podání
Dávkování
Účinnost inzulinových analogů, včetně inzulinu detemir, se vyjadřuje v jednotkách, zatímco účinnost humánních inzulinů se vyjadřuje v mezinárodních jednotkách. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
Levemir může být použit samostatně jako bazální inzulin nebo v kombinaci s bolusovým inzulinem. Může být také používán v kombinaci s perorálními antidiabetiky a/nebo agonisty receptoru GLP-1.
Pokud je Levemir používán v kombinaci s perorálními antidiabetiky či pokud je přidáván k agonistům receptoru GLP-1, je doporučeno užívat Levemir jednou denně s počáteční dávkou 0,1 -0,2 jednotky/kg nebo 10 jednotek u dospělých pacientů. Dávka přípravku Levemir má být upravena titrováním na základě individuálních potřeb pacienta.
Pokud jsou agonisté receptoru GLP-1 přidáváni k přípravku Levemir, doporučuje se snížit dávku přípravku Levemir o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně má být individuálně upraveno dávkování.
Pro individuální úpravu dávky jsou pro dospělé doporučovány dva následující titrační postupy. Titrační postup pro dospělé s diabetem 1. typu a 2. typu
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 10,0 mmol/1 (180 mg/dl) |
+ 8 jednotek |
|
9,1-10,0 mmol/1 (163-180 mg/dl) |
+ 6 jednotek |
|
8,1 -9,0 mmol/1 (145-162 mg/dl) |
+ 4 jednotky |
|
7,l-8,0 mmol/1 (127-144 mg/dl) |
+ 2 jednotky |
|
6,1-7,0 mmol/1 (109-126 mg/dl) |
+ 2jednotky |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
3,1-4,0 mmol/1 (56-72 mg/dl) |
- 2 jednotky |
|
<3,1 mmol/1 (<56 mg/dl) |
- 4 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma Glucose)
Jednoduchý postup pro dospělé s diabetem 2. typu při provádění titrace pacientem
|
Průměrná SMPG* před snídaní |
Úprava dávky přípravku Levemir |
|
> 6,1 mmol/1 (>110 mg/dl) |
+ 3 jednotky |
|
4,4-6,1 mmol/1 (80-110 mg/dl) |
Žádná změna dávky (cílová hodnota) |
|
<4,4 mmol/1 (<80 mg/dl) |
- 3 jednotky |
*Plasmatická koncentrace glukózy stanovená pacientem (Self Monitored Plasma G
ucose)
Je-li Levemir užíván jako část inzulinového režimu bazal-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientově potřebě. Dávkování přípravku Levemir má být upraveno individuálně.
Úprava dávky může být nutná, pokud pacienti podstupují zvýšenou fyzickou aktivitu, mění svou obvyklou dietu nebo během souběžného onemocnění.
Pokud si pacienti upravují dávku z důvodu zlepšení kontroly hladiny glukózy, musí být poučeni o tom, že je nutno si všímat příznaků hypoglykemie.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Levemir může být používán staršími pacienty. Monitorování glukózy u starších pacientů má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Poškození ledvin a jater
Poškození ledvin nebo jater může snížit pacientovu potřebu inzulinu.
Monitorování glukózy u pacientů s poškozením ledvin nebo jater má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Pediatrická populace
Levemir lze používat u dospívajících a dětí ve věku od 1 roku (viz bod 5.1). Při převodu z bazálního inzulinu na Levemir je zapotřebí zvážit na individuálním základě snížení dávky bazálního a bolusového inzulinu, aby se minimalizovalo riziko hypoglykemie (viz bod 4.4).
Monitorování glukózy u dětí a dospívajících má být intenzivnější a dávkování přípravku Levemir má být upraveno individuálně.
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla stanovena.
Nejsou dostupné žádné údaje.
Přechod z jiných inzulínových léčivých přípravků:
Při přechodu z jiných intermediárně nebo dlouhodobě působících inzulinových léčivých přípravků může být nutná úprava dávky a načasování podávání (viz bod 4.4).
Během přechodu a několik týdnů poté je doporučeno důkladné monitorování glukózy (viz bod 4.4).
Je možné, že bude třeba upravit souběžnou antidiabetickou léčbu (dávku a/nebo načasování podávání perorálních antidiabetik nebo souběžně podávaných krátkodobě/rychle působících inzulínových léčivých přípravků).
Způsob podání
Levemir je dlouhodobě působící inzulinový analog používaný jako bazální inzulin. Levemir je určen pouze pro subkutánní podání. Levemir nesmí být podáván intravenózně, neboť to může vést k těžké hypoglykemii. Vyvarujte se také intramuskulárního podání. Levemir není určen pro použití v inzulinových infuzních pumpách.
Levemir se aplikuje subkutánní injekcí do břišní stěny, stehna, horní části paže, oblasti deltového svalu nebo oblasti hýždí. Místa vpichu mají být vždy obměňována v rámci téže oblasti, aby se snížilo riziko lipodystrofie. Trvání účinku se bude lišit v závislosti na dávce, místě vpichu, prokrvení, teplotě a fyzické aktivitě. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladiny glukózy v krvi dávkování dvakrát denně, může být večerní dávka podána večer nebo před spaním.
Podání aplikátorem inzulínu FlexTouch
Levemir FlexTouch je předplněné pero, které je určeno k použití spolu s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm. Dávky lze nastavit od 1 do 80 jednotek v přírůstcích po 1 jednotce.
Levemir FlexTouch je barevně kódován a je k němu přiložena příbalová informace s podrobným návodem k použití, jenž má být dodržován.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Před cestou mezi různými časovými pásmy se má pacient poradit s lékařem. Cestování mezi různými časovými pásmy může totiž znamenat, že pacient bude muset užívat inzulin a přijímat jídla v odlišných časech.
Hyperglykemie
Nedostatečné dávkování nebo přerušovaná léčba, zejména u diabetu 1. typu, může vést k hyperglykemii a diabetické ketoacidóze. První symptomy hyperglykemie se obvykle v průběhu hodin nebo dní stupňují. Mezi ně patří žízeň, zvýšená frekvence močení, nauzea, zvracení, ospalost, zarudlá suchá kůže, sucho v ústech, ztráta chuti k jídlu, či acetonový zápach dechu. U diabetu 1. typu mohou vést neléčené hyperglykemické stavy až k diabetické ketoacidóze, která je potenciálně letální.
Hypoglykemie
Vynechání jídla nebo neplánovaná namáhavá fyzická zátěž mohou vést k hypoglykemii.
U dětí je třeba dbát na to, aby dávky inzulinu (zvláště v režimu bazál-bolus) odpovídaly příjmu jídla a fyzické aktivitě a tím bylo minimalizováno riziko hypoglykemie.
Hypoglykemie se může objevit, pokud je dávka inzulinu příliš vysoká ve vztahu k potřebě inzulinu.
V případě hypoglykemie či v případě podezření na hypoglykemii nesmí být Levemir podán. Poté, co u pacienta dojde ke stabilizaci hladiny glukózy v krvi, má být zvážena úprava dávky (viz body 4.8 a 4.9).
Pacienti, kterým se regulace hladiny glukózy v krvi významně zlepšila, např. zintensivněnou inzulinovou terapií, mohou zpozorovat změnu v obvyklých varovných symptomech hypoglykemie a mají být o tom adekvátně informováni. U pacientů s dlouholetým diabetem mohou běžné varovné symptomy vymizet.
Souběžná nemoc, především infekce a horečnaté stavy, obvykle zvyšuje pacientovu potřebu inzulinu. Přidružené onemocnění ledvin, jater či onemocnění postihující nadledviny, podvěsek mozkový nebo štítnou žlázu může vyžadovat změny v dávce inzulinu.
Pokud je pacient převeden na jiný typ inzulinových léčivých přípravků, může dojít ke změně či potlačení časných varovných příznaků hypoglykemie oproti těm, které se u pacienta projevovaly u předchozího inzulinu.
Převedení z jiných inzulínových léčivých přípravků
Převod pacienta na jiný typ nebo značku inzulinu má probíhat pod přísným lékařským dozorem. Změny v síle, značce (výrobce), typu, původu (zvířecí inzulin, humánní inzulin či analog inzulinu) a/nebo metodě výroby (rekombinantní DNA versus inzulin ze zvířecích zdrojů) mohou vést k potřebě změnit dávkování. Pacienti převádění na přípravek Levemir z jiných typů inzulinu mohou vyžadovat změnu dávkování oproti jejich běžnému inzulinovému léčivému přípravku. Pokud je potřeba přizpůsobit dávkování, může k tomu dojít při první dávce nebo během prvních týdnů či měsíců.
Reakce v místě vpichu
Tak jako při každé léčbě inzulinem se mohou objevit reakce v místě vpichu, které se projevují bolestivostí, zarudnutím, kopřivkou, zánětem, modřinami, otoky a svěděním. Pravidelné obměňování injekčního místa v rámci jedné oblasti může napomoci tyto reakce omezit nebo jim zabránit. Reakce obvykle vymizí do několika dnů nebo týdnů. Ve vzácných případech si mohou reakce v místě vpichu vyžádat vysazení přípravku Levemir.
Hypoalbuminemie
O pacientech s těžkou hypoalbuminémií jsou k dispozici jen omezené údaje. U těchto pacientů je doporučeno důkladné monitorování.
Kombinace přípravku Levemir s pioglitazonem
Pokud byl pioglitazon užíván v kombinaci s inzulinem, byly hlášeny případy srdečního selhání a to zvláště u pacientů s rizikovými faktory pro vznik srdečního selhání. Tuto skutečnost je nutno vzít v úvahu, pokud je zvažována léčba pioglitazonem v kombinaci s přípravkem Levemir. Pokud je tato kombinace použita, mají být pacienti sledováni s ohledem na známky a příznaky srdečního selhání, zvýšení hmotnosti a edém. Pioglitazon má být vysazen, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Je známa řada léčivých přípravků, které ovlivňují metabolismus glukózy.
Následující látky mohou snížit pacientovu potřebu inzulinu:
Perorální antidiabetické léčivé přípravky, agonisté receptoru GLP-1, inhibitory monoaminooxidázy (IMAO), beta-blokátory, inhibitory angiotensin konvertujícího enzymu (ACE), salicyláty, anabolické steroidy a sulfonamidy.
Následující látky mohou zvýšit pacientovu potřebu inzulinu:
Perorální antikoncepce, thiazidy, glukokortikoidy, thyreoidální hormony, sympatomimetika, růstový hormon a danazol.
Betablokátory mohou skrýt hypoglykemické symptomy.
Oktreotid/lanreotid může jak zvýšit, tak snížit potřebu inzulínu. Alkohol může zesílit nebo snížit hypoglykemický účinek inzulinu.
4.6 Fertilita, těhotenství a kojení Těhotenství
Během těhotenství může být zvažována léčba přípravkem Levemir. Každý potencionální přínos však musí být zvážen proti možnému zvýšenému riziku nepříznivého dopadu na těhotenství.
Všeobecně se doporučuje u těhotných žen s diabetem zvýšená kontrola a monitorování glukózy v krvi během těhotenství a při plánování těhotenství. Potřeba inzulinu obvykle v prvním trimestru klesá a zvyšuje se následně během druhého a třetího trimestru. Po porodu se potřeba inzulinu za normálních okolností rychle vrátí k hodnotám před těhotenstvím.
V otevřené randomizované kontrolované klinické studii byly těhotné ženy s diabetem 1. typu (n = 310) léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid. Primárním cílem této studie bylo posouzení vlivu přípravku Levemir na regulaci hladiny glukózy v krvi u těhotných diabetiček (viz bod 5.1).
Celková frekvence výskytu nežádoucích účinků během těhotenství byla u skupin pacientek léčených přípravkem Levemir či inzulinem NPH podobná, avšak u přípravku Levemir byla ve srovnání s NPH inzulinem pozorována početně vyjádřeno vyšší frekvence závažných nežádoucích účinků u matek (61 (40%) oproti 49 (31 %)) i u novorozenců (36 (24 %) oproti 32 (20 %)). Počet živě narozených dětí byl u žen, jež otěhotněly po zařazení do studie, v případě přípravku Levemir 50 (83 %) a 55 (89 %) v případě inzulinu NPH. Frekvence výskytu kongenitálních malformací byla u přípravku Levemir 4 (5 %) a u inzulinu NPH 11 (7 %), a to se 3 (4 %) závažnými malformacemi u přípravku Levemir a se 3 (2 %) závažnými malformacemi u inzulinu NPH.
Postmarketingové údaje u dalších 250 těhotných žen, které byly vystaveny léčbě přípravkem Levemir, nenaznačují žádné nežádoucí účinky inzulinu detemir na těhotenství a žádnou malformační nebo feto/neonatální toxicitu inzulinu detemir.
Studie na zvířatech neprokázaly reprodukční toxicitu (viz bod 5.3).
Kojení
Není známo, zda se inzulin detemir vylučuje do lidského mateřského mléka. Nepředpokládají se žádné metabolické účinky požitého inzulinu detemir na kojeného novorozence/dítě, protože inzulin detemir je jako peptid v lidském gastrointestinálním traktu rozložen na aminokyseliny.
Kojící ženy mohou vyžadovat úpravu dávkování inzulinu a diety.
Fertilita
Studie prováděné na zvířatech nenaznačují škodlivé účinky na fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost pacienta koncentrovat se a reagovat může být narušena jako důsledek hypoglykemie. To může představovat riziko v situacích, kdy tato schopnost nabývá zvláštní důležitosti (např. řízení nebo obsluhování strojů).
Pacienti mají být upozorněni na to, aby byli opatrní a vyvarovali se řízení při hypoglykemii. To je obzvláště důležité u těch, kteří mají sníženou nebo chybějící citlivost vůči příznakům hypoglykemie nebo mají časté epizody hypoglykemie. Zda je vhodné řídit, má být za těchto okolností zváženo.
4.8 Nežádoucí účinky
a. Souhrn bezpečnostního profilu
Nežádoucí účinky pozorované u pacientů užívajících Levemir jsou především způsobené farmakologickým účinkem inzulinu. Celkový procentuální podíl léčených pacientů, u nichž se očekávají nežádoucí účinky, se odhaduje na 12 %.
Nejčastěji hlášeným nežádoucím účinkem během léčby je hypoglykemie, viz bod c níže.
Z klinických průzkumů je známo, že významná hypoglykemie, definovaná nutností intervence třetí strany, se vyskytuje zhruba u 6% pacientů léčených přípravkem Levemir.
Reakce v místě vpichu se během léčby přípravkem Levemir vyskytují častěji, než je tomu u humánních inzulinových přípravků. Tyto reakce zahrnují bolestivost, zarudnutí, kopřivku, zánět, modřiny, otoky a svědění v místě vpichu. Většina těchto reakcí v místě vpichu je nezávazných a přechodné povahy, tj. normálně během pokračující léčby vymizí, a to v několika dnech nebo týdnech.
Na počátku inzulinové léčby se mohou vyskytnout poruchy refrakce a edém. Tyto reakce jsou obvykle přechodné povahy. Rychlé zlepšení kontroly hladiny glukózy v krvi může být spojeno s akutní bolestivou neuropatií, která je obvykle reverzibilní. Intenzifikace inzulinové terapie s prudkým zlepšením glykemické kontroly může být spojena s přechodným zhoršením diabetické retinopatie, zatímco dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie.
b. Seznam nežádoucích účinků v tabulce
Nežádoucí účinky uvedené níže jsou založeny na údajích z klinických studií a jsou klasifikovány podle MedDRA frekvence výskytu a třídy orgánových systémů. Frekvence výskytu jsou definovány podle následující konvence: Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Poruchy imunitního systému |
Méně časté - alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce2 |
|
Velmi vzácné - anafylaktické reakce2 | |
|
Poruchy metabolismu a výživy |
Velmi časté - hypoglykemie2 |
|
Poruchy nervového systému |
Vzácné - periferní neuropatie (bolestivá neuropatie) |
|
Poruchy oka |
Méně časté - refrakční poruchy |
|
Méně časté - diabetická retinopatie | |
|
Poruchy kůže a podkožní tkáně |
Méně časté - Lipodystrofie2 |
|
Celkové poruchy a reakce v místě aplikace |
Časté - reakce v místě vpichu |
|
Méně časté - edém |
* viz bod c
c. Popis vybraných nežádoucích účinků
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka, erupce
Alergické reakce, potenciálně alergické reakce, kopřivka, vyrážka a erupce jsou méně časté, pokud je Levemir používán v režimu bazál-bolus. Pokud je však užíván v kombinaci s perorálními antidiabetiky, byl ve třech klinických studiích pozorován výskyt alergických reakcí a potenciálně alergických reakcí s frekvencí 2,2 %.
Anafylaktické reakce
Výskyt generalizovaných hypersenzitivních reakcí (včetně generalizované vyrážky, svědění, pocení, gastrointestinální nevolnosti, angioneurotického edému, dechových obtíží, palpitace a snížení krevního tlaku) je velmi vzácný, ale může být potenciálně život ohrožující.
Hypoglykemie
Nejčastěji hlášeným nežádoucím účinkem je hypoglykemie. Může se objevit v případě, že dávka inzulinu je příliš vysoká oproti potřebě inzulinu. Těžká hypoglykemie může vést k bezvědomí a/nebo křečím a může vyústit v přechodné nebo trvalé poškození mozkové funkce nebo dokonce k úmrtí. Symptomy hypoglykemie se obvykle objevují náhle. Mohou zahrnovat studený pot, chladnou bledou pokožku, únavu, nervozitu nebo třes, úzkost, neobvyklou vyčerpanost nebo slabost, zmatenost, problémy s koncentrací, ospalost, přílišný hlad, změny vidění, bolest hlavy, nauzeu a palpitace.
Lipodystrofie
V místě vpichu může vzniknout lipodystrofie (včetně lipohypertrofie, lipoatrofie). Průběžná cyklická změna místa vpichu v dané oblasti snižuje riziko vzniku takovýchto reakcí.
d. Pediatrická populace
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u pediatrické populace jakékoliv rozdíly oproti širším zkušenostem v obecné diabetické populaci.
e. Další populační specifika
Na základě zdrojů z postmarketingového sledování a z klinických studií nenaznačují frekvence, typ a závažnost nežádoucích účinků pozorovaných u starších pacientů a u pacientů s poškozením ledvin či jater jakékoliv rozdíly oproti širším zkušenostem v obecné populaci.
f. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkovánf
Přesnou nadměrnou dávku inzulinu nelze definovat, neboť hypoglykemie se může vyvíjet postupně přes jednotlivá stádia, pokud jsou podávány příliš vysoké dávky oproti pacientovým potřebám: 2
5. farmakologické vlastnosti
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: léčiva k terapii diabetů. Inzulíny a analoga pro injekci, dlouhodobě působící: ATC kód: A10AE05.
Mechanismus účinku a farmakodynamické účinky
Levemir je rozpustný dlouhodobě působící inzulinový analog s prodlouženým trváním účinku, který se používá jako bazální inzulin.
Účinek přípravku Levemir na snížení hladiny glukózy v krvi je způsoben usnadněným vychytáváním glukózy, které následuje po navázání inzulinu na receptory svalových a tukových buněk, a současnou inhibicí výdeje glukózy z jater.
Profil působení přípravku Levemir v čase je statisticky významně méně variabilní, a proto lépe předvídatelný, než u inzulinu NPH (Neutral Protamine Hagedorn), jak je patrné z koeficientů intraindividuální variability (CV) u pacienta pro celkový a maximální farmakodynamický účinek (v tabulce 1).
Tabulka 1. Intraindividuální variabilita profilu působení přípravku Levemir a NPH u pacienta
v čase
|
Farmakodynamický bod obratu |
Levemir CV (%) |
Inzulin NPH CV (%) |
|
AUCGIR,0-24h2 |
27 |
68 |
|
GIRmax** |
23 |
46 |
*Plocha pod křivkou **Pro rychlost infúze glukózy p < 0,001 pro všechna srovnání s
přípravkem Levemir
Prodloužený účinek přípravku Levemir je zprostředkován silným sdružováním molekul inzulinu detemir v místě vpichu a vazbou na albumin prostřednictvím postranních řetězců mastných kyselin. Inzulin detemir je ve srovnání s inzulinem NPH distribuován do periferních cílových tkání pomaleji. Tyto kombinované mechanismy prodloužení délky účinku poskytují lépe reprodukovatelný profil absorpce a účinku u inzulinu detemir ve srovnání s inzulinem NPH.
Farmakodynamické parametry pro Levemir a NPH
|
Levemir |
NPH | ||||
|
j./kg |
j/kg |
j/kg |
m.j./kg | ||
|
Doba působení (hod) |
12 |
17Ť |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4Ť |
1.7 |
1.6 | |
Todhadované hodnoty
I
O)
X O)
£ 4-
Proporcionalita dávky ve farmakodynamické odezvě (maximální účinek, trvání účinku, celkový účinek) je pozorována po subkutánním podání.
V dlouhodobých klinických studiích byla prokázána nižší variabilita hladin plazmatické glukózy nalačno mezi jednotlivými dny při léčbě přípravkem Levemir ve srovnání s inzulinem NPH.
Studie u pacientů s diabetem 2. typu léčených bazálním inzulinem v kombinaci s perorálními antidiabetiky prokázaly, že glykemická kontrola (HbA1c) přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem glargin a je spojená s menším hmotnostním přírůstkem (viz tabulka 2 níže). Ve srovnávací studii s inzulinem glargin bylo možno podávat Levemir jednou nebo dvakrát denně, zatímco inzulin glargin byl podáván jednou denně. 55 % pacientů léčených přípravkem Levemir dokončilo léčbu trvající 52 týdnů v režimu dvou podání denně.
Tabulka 2. Změny v tělesné hmotnosti po inzulínové léčbě
|
Trvání studie |
Levemir jednou denně |
Levemir dvakrát denně |
NPH inzulin |
Inzulin glargin |
|
20 týdnů |
+0,7 kg |
+1,6 kg | ||
|
26 týdnů |
+1,2 kg |
+2,8 kg | ||
|
52 týdnů |
+2,3 kg |
+3,7 kg |
+4,0 kg |
Ze studií hodnotících užívání perorálních antidiabetik vyplynulo, že při kombinované léčbě s přípravkem Levemir existuje nižší riziko lehkých nočních hypoglykémií ve srovnání s inzulinem NPH a to o 61-65 %.
Byla provedena otevřená randomizovaná klinická studie u pacientů s diabetes mellitus 2. typu, kteří nedosáhli cílových hodnot perorálními antidiabetiky. Klinická studie byla zahájena 12týdenním přípravným obdobím s kombinací liraglutidu s metforminem, během něhož 61 % pacientů dosáhlo HbA1c<7 %. U 39 % pacientů, kteří cílových hodnot nedosáhli, byla provedena randomizace tak, že jim buď byla přidána léčba přípravkem Levemir podávaným 1x denně nebo pokračovali s léčbou liraglutidem s metforminem po dobu 52 týdnů. Přidání přípravku Levemir se po 52 týdnech projevilo dalším snížením HbA1c z 7,6 % na 7,1 %. Nedošlo k závažným hypoglykemickým příhodám. Závažná hypoglykemická příhoda je definována jako příhoda, kde pacient nebyl schopen zvládnout léčbu hypoglykemie sám a jestliže bylo nutno podat glukagon nebo intravenózně glukózu. Viz tabulka 3.
|
Tabulka 3. Data získaná z klinické studie - Levemir přidán |
í liraglutidu+metforminu | |||
|
Týden studie |
Větev Levemir + liraglutid + metformin N = 160 |
Větev Liraglutid + metformin N = 149 |
P-hodnota | |
|
Průměrná změna HbA1c oproti výchozímu stavu (%) |
Týdny 0-26 |
-0,51 |
+0,02 |
<0,0001 |
|
Týdny 0-52 |
-0,50 |
0,01 |
<0,0001 | |
|
Podíl pacientů, kteří dosáhli cílové hodnoty HbA1c <7% (%) |
Týdny 0-26 |
43,1 |
16,8 |
<0,0001 |
|
Týdny 0-52 |
51,9 |
21,5 |
<0,0001 | |
|
Změna tělesné hmotnosti oproti výchozímu stavu (kg) |
Týdny 0-26 |
-0,16 |
-0,95 |
0,0283 |
|
Týdny 0-52 |
-0,05 |
-1,02 |
0,0416 | |
|
Lehké hypoglykemické příhody (na pacienta a rok) |
Týdny 0-26 |
0,286 |
0,029 |
0,0037 |
|
Týdny 0-52 |
0,228 |
0,034 |
0,0011 | |
Byla prováděna 26týdenní, dvojitě zaslepená, randomizovaná klinická studie u pacientů s diabetem 2. typu nedostatečně kompenzovaných léčbou bazálním inzulinem s nebo bez metforminu za účelem stanovení účinnosti a bezpečnosti při přidání liraglutidu (v dávce 1,8 mg) oproti placebu. U pacientů s výchozí hodnotou HbA1c < 8,0 % byla dávka inzulinu snížena o 20 %, aby se minimalizovalo riziko hypoglykemie. Následně si pacienti mohli titrovat dávku inzulínu až k dávkám nepřevyšujícím dávku před randomizací. Levemir byl použit jako bazální inzulin u 33 % pacientů (N = 147) (97,3 % užívalo metformin). Přidání liraglutidu u těchto pacientů vedlo k většímu poklesu HbA1c ve srovnání s přidáním placeba (na 6,93 % oproti 8,24 %), k výraznějšímu snížení plazmatické hladiny glukózy nalačno (na 7,20 mmol/l oproti 8,13 mmol/l) a k většímu hmotnostnímu úbytku (-3,47 kg oproti -0,43 kg). Výchozí hodnoty pro tyto parametry byly podobné u obou skupin. V obou skupinách byl pozorovaný počet lehkých hypoglykemických příhod podobný. V žádné skupině nebyly pozorovány závažné hypoglykemické příhody.
V dlouhodobých studiích u pacientů s diabetem 1. typu se při inzulinové terapii bazál-bolus přípravkem Levemir plazmatická hladina glukózy nalačno zlepšila ve srovnání s pacienty léčenými inzulinem NPH. Kontrola glykemie (HbA1c) s přípravkem Levemir byla srovnatelná s inzulinem NPH, s menším rizikem nočních hypoglykemií a bez přidruženého přírůstku tělesné hmotnosti.
V klinických studiích užívajících inzulinovou terapii bazál-bolus byla celková míra hypoglykemie při aplikaci přípravku Levemir a inzulinu NPH podobná. Analýzy nočních hypoglykemií u pacientů s diabetem 1. typu prokázaly signifikantně nižší riziko méně závažné noční hypoglykemie (se schopností samoléčby potvrzené glukózou v kapilárách nižší než 2,8 nebo 3,1 mmol/l, pokud je vyjádřena jako glukóza v plazmě) oproti inzulinu NPH, přičemž u diabetu 2. typu nebyly pozorovány žádné rozdíly.
Při použití přípravku Levemir byl pozorován vznik protilátek. Neukázalo se však, že by tato skutečnost měla vliv na glykemickou kontrolu.
Levemir byl studován v otevřené randomizované kontrolované klinické studii u těhotných žen s diabetem 1. typu (n = 310), kde tyto ženy byly léčeny v režimu bazál-bolus buď přípravkem Levemir (n = 152) nebo inzulinem NPH (n = 158) jako bazálním inzulinem, v obou případech v kombinaci s přípravkem NovoRapid (viz bod 4.6). Ve 36. týdnu těhotenství (GW) byly výsledky u přípravku Levemir a inzulinu NPH srovnatelné (měřeno hodnotou HbA1c ) a snížení průměrného HbA1c během těhotenství bylo podobné (viz Tabulka 4).
Tabulka 4. Kontrola glykémie v těhotenství
|
Levemir |
NPH |
Rozdíl/Poměr pravděpodobností/ Relativní riziko 95% CI | |
|
Průměrný HbA1c (%) v GW 36 |
6,27 |
6,33 |
Rozdíl: -0,06 [-0,21; 0,08] |
|
Průměrná hodnota FPG v GW 36 (mmol/l) |
4,76 |
5,41 |
Rozdíl: -0,65 [-1,19; -0,12] |
|
Poměr pacientek, které dosáhly cílových hodnot HbA1c <6% v GW 24 a v GW 36 (%) |
41% |
32% |
Poměr pravděpodobností: 1,36 [0,78; 2,37] |
|
Celkový počet závažných hypoglykemických příhod v průběhu těhotenství (na pacientku a rok) |
1,1 |
1,2 |
Relativní riziko: 0,82 [0,39; 1,75] |
Pediatrická populace
Účinnost a bezpečnost přípravku Levemir byly studovány po dobu 12 měsíců ve třech randomizovaných kontrolovaných klinických studiích u dospívajících a dětí (n= celkem 1 045). Studie zahrnovaly celkem 167 dětí ve věku 1 - 5 let. Studie prokázaly, že kontrola glykemie (HbA1c) při léčbě přípravkem Levemir je srovnatelná s inzulinem NPH a inzulinem degludek, pokud je Levemir podáván formou bazál-bolus terapie, při toleranci 0,4 %. Ve studii srovnávající Levemir s inzulínem degludek byl výskyt hyperglykemických příhod s ketoacidózou u přípravku Levemir významně vyšší (1,09 oproti 0,68 příhod na pacientorok léčby). Při léčbě přípravkem Levemir byl pozorován nižší hmotnostní přírůstek (SD skóre, hmotnost korigována na pohlaví a věk) v porovnání s inzulinem NPH.
Klinická studie zahrnující děti starší dvou let byla prodloužena o dalších 12 měsíců (byla získána data za celkem 24 měsíců) za účelem posoudit tvorbu protilátek po dlouhodobé léčbě přípravkem Levemir. Po počátečním nárůstu protilátek vůči inzulinu v průběhu prvního roku hladina protilátek vůči inzulinu během druhého roku poklesla na úroveň mírně vyšší, než byla před začátkem studie. Výsledky naznačují, že tvorba protilátek nemá negativní vliv na kontrolu glykémie a dávku přípravku Levemir.
Údaje týkající se účinnosti a bezpečnosti pro dospívající pacienty s diabetes mellitus 2. typu byly extrapolovány z údajů pro děti, dospívající a dospělé pacienty s diabetes mellitus 1. typu a pro dospělé pacienty s diabetes mellitus 2. typu. Výsledky podporují použití přípravku Levemir u dospívajících pacientů s diabetes mellitus 2. typu.
5.2 Farmakokinetické vlastnosti
Absorpce
Maximální sérová koncentrace je dosažena za 6 až 8 hodin po podání. Při podání dvakrát denně je dosaženo rovnovážného stavu sérových koncentrací po aplikaci 2-3 dávek. Variabilita v absorpci u pacientů je nižší u přípravku Levemir než u ostatních bazálních inzulinových preparátů.
Absolutní biologická dostupnost inzulinu detemir při subkutánním podání je cca 60%.
Distribuce
Zdánlivý distribuční objem přípravku Levemir (cca 0,1 l/kg) značí, že v krvi cirkuluje vysoká frakce inzulinu detemir.
Výsledky in vitro a in vivo studií vazeb na bílkoviny naznačují, že neexistuje klinicky relevantní interakce mezi inzulinem detemir a jinými léčivými přípravky, které se vážou na mastné kyseliny nebo proteiny.
Biotransformace
Odbourávání inzulinu detemir je podobné jako u humánního inzulinu; všechny vytvořené metabolity jsou inaktivní.
Eliminace
Terminální poločas po subkutánním podání je určen rychlostí absorpce z podkožní tkáně. Terminální poločas je 5 až 7 hodin v závislosti na dávce.
Linearita
Po subkutánním podání lze v terapeutickém rozmezí dávky sledovat proporcionalitu se sérovými koncentracemi (maximální koncentrace, stupeň absorpce).
Při podání jednorázové dávky přípravku Levemir 0,5 jednotky/kg s liraglutidem v dávce 1,8 mg pacientům s diabetem 2. typu nebyly v ustáleném stavu pozorovány žádné farmakokinetické nebo farmakodynamické interakce mezi liraglutidem a přípravkem Levemir.
Zvláštní skupiny pacientů
Starší pacienti (>65 let)
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi staršími a mladými lidmi.
Poškození ledvin a jater
Není klinicky relevantní rozdíl ve farmakokinetice přípravku Levemir mezi lidmi s poruchou ledvin nebo jater a zdravými lidmi. Protože u těchto skupin pacientů nebyly provedeny rozsáhlé studie farmakokinetiky přípravku Levemir, doporučuje se u nich důkladně monitorovat glukózu v plazmě.
Pohlaví
Ve farmakokinetických vlastnostech přípravku Levemir neexistují žádné klinicky relevantní rozdíly mezi pohlavími.
Pediatrická populace
Farmakokinetické vlastnosti přípravku Levemir byly zkoumány u malých dětí (1 - 5 let), u dětí (6 -12 let) a dospívajících (13 - 17 let) a byly srovnávány s dospělými s diabetem 1. typu. Ve farmakokinetických vlastnostech nebyly klinicky relevantní rozdíly mezi malými dětmi, dětmi, dospívajícími a dospělými.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka. Údaje o afinitě k receptorům a in vitro testy mitogenicity neodhalily žádný důkaz zvýšeného mitogenního potenciálu ve srovnání s humánním inzulinem.
6. farmaceutické údaje
6.1 Seznam pomocných látek
Glycerol Fenol Metakresol Octan zinečnatý
Dihydrát hydrogenfosforečnanu sodného Chlorid sodný
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Léčivé látky přidané k přípravku Levemir mohou způsobit odbourávání inzulinu detemir, např. léčivé přípravky obsahující thioly nebo siřičitany. Levemir se nemá přidávat do infuzních roztoků.
Tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
Před otevřením: 30 měsíců.
Během používání, nebo pokud Levemir nosíte jako zásobní: přípravek smí být uchováván maximálně 6 týdnů.
6.4 Zvláštní opatření pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C - 8°C). Neuchovávejte v blízkosti chladicího zařízení. Chraňte před mrazem.
Během používání, nebo pokud Levemir nosíte jako zásobní: uchovávejte při teplotě do 30°C. Chraňte před chladem. Chraňte před mrazem.
Uchovávejte FlexTouch uzavřený uzávěrem, aby byl chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
3 ml roztoku v zásobní vložce (sklo třídy 1), s pístem (bromobutyl) a pryžovou zátkou (bromobutyl/polyisopren), obsažené v jednorázovém multidávkovacím předplněném peru zhotoveném z polypropylenu.
Velikosti balení jsou 1 předplněné pero (včetně jehel nebo bez jehel), 5 (bez jehel) nebo skupinové balení 2 x 5 (bez jehel) předplněných per o objemu 3 ml. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Jehly a Levemir FlexTouch nesmí být s nikým sdíleny. Zásobní vložka se nesmí znovu naplňovat. Nepoužívejte tento léčivý přípravek, pokud zjistíte, že roztok není čirý, bezbarvý a vodný.
Levemir, který byl zmražen, nesmí být použit.
Pacient má být poučen, aby po každé aplikaci zlikvidoval jehlu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. držitel rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
8. registrační čísla
EU/1/04/278/012
EU/1/04/278/013
EU/1/04/278/014
EU/1/04/278/015
EU/1/04/278/016
9. datum první registrace/prodloužení registrace
Datum první registrace: 1. června 2004 Prodloužení registrace: 16. dubna 2009
io. datum revize textu
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
a. výrobci biologické léčivé látky a výrobci odpovědní za propouštění šarží
b. podmínky nebo omezení výdeje a použití
c. další podmínky a požadavky registrace
d. podmínky nebo omezení s ohledem na bezpečné a účinné používání léčivého přípravku
a výrobci biologické léčivé látky a výrobci odpovědní za propouštění šarží
Název a adresa výrobců biologické léčivé látky
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
Novo Nordisk A/S Hallas Allé DK-4400 Kalundborg Dánsko
Název a adresa výrobců odpovědných za propouštění šarží
Levemir InnoLet a FlexTouch
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
Levemir Penfill a FlexPen
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dánsko
Novo Nordisk Production SAS 45, Avenue ďOrléans F-28000 Chartres Francie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
b podmínky nebo omezení výdeje a použití
Výdej léčivého přípravku je vázán na lékařský předpis.
c. další podmínky a požadavky registrace
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
d. podmínky nebo omezení s ohledem na bezpečné a účinné používání léčivého přípravku
Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
označení na obalu a příbalová informace
a. označení na obalu
i. název léčivého přípravku
Levemir 100 jednotek/ml Injekční roztok v zásobní vložce Insulinům detemirum
2 obsah léčivé látky
1 ml roztoku obsahuje 100 jednotek insulinum detemirum (odpovídající 14,2 mg). 1 zásobní vložka obsahuje 3 ml (odpovídá 300 jednotkám),
3. seznam pomocných látek
glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselinu chlorovodíkovou/hydroxid sodný pro úpravu pH a vodu na injekci
4. léková forma a obsah balení
Injekční roztok v zásobní vložce. Penfill.
1 x 3 ml zásobní vložka 5 x 3 ml zásobní vložky 10 x 3 ml zásobní vložky
5. způsob a cesta podání
Před použitím si přečtěte příbalovou informaci Subkutánní podání
6. zvláštní upozornění, že léčivý přípravek musí být uchováván mimo dohled a dosah dětí
Uchovávejte mimo dohled a dosah dětí
7. další zvláštní upozornění, pokud je potřebné
Používejte pouze, pokud je roztok čirý, bezbarvý a vodný K použití pouze jednou osobou
8. použitelnost
Použitelné do
Během používání: spotřebujte do 6 týdnů
9 zvláštní podmínky pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C až 8°C)
Během používání: chraňte před chladem. Uchovávejte při teplotě do 30°C Chraňte před mrazem
Uchovávejte zásobní vložku v krabičce, aby byl přípravek chráněn před světlem
Ta zvláštní opatření pro likvidaci nepoužitých léčivých přípravků nebo odpadu z nich, pokud je to vhodné_
Po každé injekci odstraňte jehlu
tt. název a adresa držitele rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
T2 registrační čísla
EU/1/04/278/001 1 zásobní vložka o obsahu 3 ml EU/1/04/278/002 5 zásobních vložek o obsahu 3 ml EU/1/04/278/003 10 zásobních vložek o obsahu 3 ml
T3. ČÍSLO ŠARŽE č.S.
t4. klasifikace pro výdej
Výdej léčivého přípravku vázán na lékařský předpis
t5. návod k použití tó. informace v braillove písmu
Levemir Penfill
i název léčivého přípravku a cesta podání
Levemir 100 jednotek/ml Injekční roztok Insulinům detemirum Subkutánní podání
2 způsob podání
Penfill
3. použitelnost
Použitelné do
4. ČÍSLO ŠARŽE č.S.
5. obsah udaný jako hmotnost, objem nebo počet
3 ml
6. JINÉ
Novo Nordisk A/S
i. název léčivého přípravku
Levemir 100 jednotek/ml Injekční roztok v předplněném peru Insulinům detemirum
2. obsah léčivé látky
1 ml roztoku obsahuje 100 jednotek insulinům detemirum (odpovídající 14,2 mg). 1 předplněné pero obsahuje 3 ml (odpovídá 300 jednotkám),
3. seznam pomocných látek
glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselinu chlorovodíkovou/hydroxid sodný pro úpravu pH a vodu na injekci
4. léková forma a obsah balení
Injekční roztok v předplněném peru. FlexPen.
1 x 3 ml předplněné pero 5 x 3 ml předplněná pera 10 x 3 ml předplněná pera 1 x 3 ml předplněné pero + 7 jehel NovoFine 1 x 3 ml předplněné pero + 7 jehel NovoTwist
5. způsob a cesta podání
Jehly nejsou součástí balení
Před použitím si přečtěte příbalovou informaci
Subkutánní podání
6. zvláštní upozornění, ze léčivý přípravek musí být uchováván mimo dohled a dosah dětí
Uchovávejte mimo dohled a dosah dětí
7. další zvláštní upozornění, pokud je potřebné
Používejte pouze, pokud je roztok čirý, bezbarvý a vodný K použití pouze jednou osobou
Určeno pro použití s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm
8. použitelnost
Použitelné do
Během používání: spotřebujte do 6 týdnů 9. zvláštní podmínky pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C až 8°C)
Během používání: chraňte před chladem. Uchovávejte při teplotě do 30°C Chraňte před mrazem
Uzávěr pera nechávejte neustále nasazený, aby byl přípravek chráněn před světlem
io. zvláštní opatření pro likvidaci nepoužitých léčivých přípravku nebo odpadu z nich, pokud je to vhodné_
Po každé injekci odstraňte jehlu
Tu název a adresa držitele rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko i2. registrační čísla
EU/1/04/278/004
EU/1/04/278/005
EU/1/04/278/006
EU/1/04/278/010
EU/1/04/278/011
1 pero o obsahu 3 ml 5 per o obsahu 3 ml 10 per o obsahu 3 ml 1 pero o obsahu 3 ml a 7 jehel NovoFine 1 pero o obsahu 3 ml a 7 jehel NovoTwist
13. ČÍSLO ŠARŽE
č.S.
14. klasifikace pro výdej
Výdej léčivého přípravku vázán na lékařský předpis 15. návod k použití 16. informace v braillove písmu
Levemir FlexPen
i název léčivého přípravku a cesta podání
Levemir 100 jednotek/ml Injekční roztok Insulinům detemirum Subkutánní podání
2 způsob podání
FlexPen
3. použitelnost
Použitelné do
4. ČÍSLO ŠARŽE č.S.
5. obsah udaný jako hmotnost, objem nebo počet
3 ml
6. JINÉ
Novo Nordisk A/S
i. název léčivého přípravku
Levemir 100 jednotek/ml Injekční roztok v předplněném peru Insulinům detemirum
2. obsah léčivé látky
1 ml roztoku obsahuje 100 jednotek insulinům detemirum (odpovídající 14,2 mg). 1 předplněné pero obsahuje 3 ml (odpovídá 300 jednotkám),
3. seznam pomocných látek
glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselinu chlorovodíkovou/hydroxid sodný pro úpravu pH a vodu na injekci
4. léková forma a obsah balení
Injekční roztok v předplněném peru. InnoLet.
1 x 3 ml předplněné pero 5 x 3 ml předplněná pera 10 x 3 ml předplněná pera
5. způsob a cesta podání
Jehly nejsou součástí balení
Před použitím si přečtěte příbalovou informaci
Subkutánní podání
6. zvláštní upozornění, ze léčivý přípravek musí být uchováván mimo dohled a dosah dětí
Uchovávejte mimo dohled a dosah dětí
7. další zvláštní upozornění, pokud je potřebné
Používejte pouze, pokud je roztok čirý, bezbarvý a vodný K použití pouze jednou osobou
Určeno pro použití s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm
8. použitelnost
Použitelné do
Během používání: spotřebujte do 6 týdnů 9 zvláštní podmínky pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C až 8°C)
Během používání: chraňte před chladem. Uchovávejte při teplotě do 30°C Chraňte před mrazem
Uzávěr pera nechávejte neustále nasazený, aby byl přípravek chráněn před světlem
io. zvláštní opatření pro likvidaci nepoužitých léčivých přípravku nebo odpadu z nich, pokud je to vhodné_
Po každé injekci odstraňte jehlu
1L název a adresa držitele rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko 12. registrační čísla
EU/1/04/278/007 1 pero o obsahu 3 ml EU/1/04/278/008 5 per o obsahu 3 ml EU/1/04/278/009 10 per o obsahu 3 ml
13. ČÍSLO ŠARŽE č.S.
14. klasifikace pro výdej
Výdej léčivého přípravku vázán na lékařský předpis
15. návod k použití 16. informace v braillove písmu
Levemir InnoLet
i název léčivého přípravku a cesta podání
Levemir 100 jednotek/ml Injekční roztok Insulinům detemirum Subkutánní podání
2 způsob podání
InnoLet
3. použitelnost
Použitelné do
4. ČÍSLO ŠARŽE č.S.
5. obsah udaný jako hmotnost, objem nebo počet
3 ml
6. JINÉ
Novo Nordisk A/S
i. název léčivého přípravku
Levemir 100 jednotek/ml Injekční roztok v předplněném peru Insulinům detemirum
2. obsah léčivé látky
1 ml roztoku obsahuje 100 jednotek insulinům detemirum (odpovídající 14,2 mg). 1 předplněné pero obsahuje 3 ml (odpovídá 300 jednotkám),
3. seznam pomocných látek
glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselinu chlorovodíkovou/hydroxid sodný pro úpravu pH a vodu na injekci
4. léková forma a obsah balení
Injekční roztok v předplněném peru. FlexTouch
1 x 3 ml předplněné pero 5 x 3 ml předplněná pera 2x (5 x 3ml) předplněná pera 1 x 3 ml předplněné pero + 7 jehel NovoFine 1 x 3 ml předplněné pero + 7 jehel NovoTwist
5. způsob a cesta podání
Jehly nejsou součástí balení
Před použitím si přečtěte příbalovou informaci
Subkutánní podání
6. zvláštní upozornění, ze léčivý přípravek musí být uchováván mimo dohled a dosah dětí
Uchovávejte mimo dohled a dosah dětí
7. další zvláštní upozornění, pokud je potřebné
Používejte pouze, pokud je roztok čirý, bezbarvý a vodný K použití pouze jednou osobou
Určeno pro použití s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm
8. použitelnost
Použitelné do
Během používání: spotřebujte do 6 týdnů 9. zvláštní podmínky pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C až 8°C)
Během používání: chraňte před chladem. Uchovávejte při teplotě do 30°C Chraňte před mrazem
Uzávěr pera nechávejte neustále nasazený, aby byl přípravek chráněn před světlem
io. zvláštní opatření pro likvidaci nepoužitých léčivých přípravku nebo odpadu z nich, pokud je to vhodné_
Po každé injekci odstraňte jehlu
11. název a adresa držitele rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
12. registrační čísla
EU/1/04/278/012 EU/1/04/278/013 EU/1/04/278/014 jednotlivých per. EU/1/04/278/015 EU/1/04/278/016
1 pero o obsahu 3 ml 5 per o obsahu 3 ml
5 per o obsahu 3 ml. Toto je část skupinového balení 10 per a není určeno k prodeji
1 pero o obsahu 3 ml a 7 jehel NovoFine 1 pero o obsahu 3 ml a 7 jehel NovoTwist
13. CíSLO ŠARŽE
č.S.
14. klasifikace pro výdej
Výdej léčivého přípravku vázán na lékařský předpis 15. návod k použití 16. informace v braillove písmu
Levemir FlexTouch
údaje uváděné na vnějším obalu
Štítek balíčku složeného ze samostatných výrobků (FlexTouch)
i. název léčivého přípravku
Levemir 100 jednotek/ml Injekční roztok v předplněném peru Insulinům detemirum Subkutánní podání
2. obsah léčivé látky
1 ml roztoku obsahuje 100 jednotek insulinum detemirum (odpovídající 14,2 mg). 1 předplněné pero obsahuje 3 ml (odpovídá 300 jednotkám),
3. seznam pomocných látek
glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselinu chlorovodíkovou/hydroxid sodný pro úpravu pH a vodu na injekci
4. léková forma a velikost balení
Injekční roztok v předplněném peru. FlexTouch.
2 x (5 x 3 ml). Toto je skupinové balení 10 předplněných per, které není určeno pro prodej jednotlivých předplněných per
5. způsob a cesta podání
Jehly nejsou součástí balení
Před použitím si přečtěte příbalovou informaci
Subkutánní podání
6. zvláštní upozornění, že léčivý přípravek musí být uchováván mimo dohled a dosah dětí
Uchovávejte mimo dohled a dosah dětí
7. další zvláštní upozornění, pokud je potřebné
Používejte pouze, pokud je roztok čirý, bezbarvý a vodný K použití pouze jednou osobou
Určeno pro použití s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm
8. použitelnost
Použitelné do
Během používání: spotřebujte do 6 týdnů
9 zvláštní podmínky pro uchovávání
Před otevřením: uchovávejte v chladničce (2°C až 8°C)
Během používání: chraňte před chladem. Uchovávejte při teplotě do 30°C Chraňte před mrazem
Uzávěr pera nechávejte neustále nasazený, aby byl přípravek chráněn před světlem
io. zvláštní opatření pro likvidaci nepoužitých léčivých přípravku nebo odpadu z nich, pokud je to vhodné_
Po každé injekci odstraňte jehlu
1L název a adresa držitele rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
12. registrační číslo
EU/1/04/278/014
13. ČÍSLO ŠARŽE
č.š.
14. klasifikace pro výdej
Výdej léčivého přípravku vázán na lékařský předpis
15. návod k použití
16 informace v braillově písmu
Levemir FlexTouch
i název léčivého přípravku a cesta podání
Levemir 100 jednotek/ml Injekční roztok Insulinům detemirum Subkutánní podání
2 způsob podání
FlexTouch
3. použitelnost
Použitelné do
4. ČÍSLO ŠARŽE č.S.
5. obsah udaný jako hmotnost, objem nebo počet
3 ml
6. JINÉ
Novo Nordisk A/S
Levemir 100 jednotek/ml injekční roztok v zásobní vložce
Insulinům detemirum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, zdravotní sestry nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Levemir a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat
3. Jak se přípravek Levemir používá
4. Možné nežádoucí účinky
5. Jak přípravek Levemir uchovávat
6. Obsah balení a další informace
1. Co je přípravek Levemir a k čemu se používá
Levemir je moderní inzulin (analog inzulinu) s dlouhodobě působícím účinkem. Moderní inzulinové přípravky jsou zdokonalené verze lidského inzulinu.
Levemir je používán ke snižování vysoké hladiny cukru v krvi u dospělých, dospívajících a dětí ve věku od 1 roku s diabetes mellitus (cukrovkou). Diabetes je onemocnění, při němž tělo neprodukuje dostatek inzulinu ke kontrole hladiny cukru v krvi.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetu a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Levemir má dlouhodobý a stabilní účinek na snížení hladiny krevního cukru, jenž nastupuje během 3 až 4 hodin po aplikaci. Levemir zajišťuje základní potřebu inzulinu po dobu až 24 hodin.
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat
Neužívejte Levemir
► Jestliže j ste alergický(á) na inzulin detemir nebo na kteroukoli další složku tohoto přípravku (viz bod 6, Obsah balení a další informace).
► Jestliže máte podezření, že nastupuje hypoglykemie (nízká hladina krevního cukru) (viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4).
► V inzulinových infuzních pumpách.
► Pokud zásobní vložka nebo zařízení obsahující zásobní vložku upadly, j sou poškozené nebo promáčklé.
► Jestliže nebyl správně skladován nebo byl zmražen (viz bod 5, Jak přípravek Levemir uchovávat).
► Jestliže inzulin není čirý, bezbarvý a vodný.
Pokud platí něco z výše uvedeného, Levemir neužívejte. Požádejte o radu lékaře, zdravotní sestru nebo lékárníka.
Než začnete Levemir používat
► Zkontrolujte štítek a ujistěte se, že se jedná o správný typ inzulínu,
► Vždy zkontrolujte zásobní vložku, včetně gumového pístu na spodní straně zásobní vložky, Nikdy ji nepoužívejte, pokud je patrné jakékoliv poškození nebo pokud byl gumový píst vytažen nad bílý kódovací proužek na spodní straně zásobní vložky, Může to být důsledek úniku inzulinu. Máte-li podezření, že je zásobní vložka poškozena, vraťte ji svému dodavateli, Další pokyny najdete ve své příručce k používání injekčního pera,
► Pro každou aplikaci použijte vždy novou jehlu, aby se zabránilo kontaminaci.
► Jehly a Levemir Penfill nesmíte nikomu půjčovat,
Upozornění a opatření
Některé stavy a činnosti mohou ovlivnit vaši potřebu inzulinu. Poraďte se s lékařem:
► jestliže máte obtíže s ledvinami nebo játry či nadledvinami, podvěskem mozkovým nebo štítnou žlázou
► jestliže vykonáváte tělesná cvičení ve větším rozsahu než obvykle nebo pokud chcete učinit změnu ve své běžné dietě, neboť to může ovlivnit hladinu cukru v krvi
► pokud jste nemocný(á), pokračujte v aplikaci inzulinu a poraďte se s lékařem
► pokud cestujete do zahraničí, cestování přes časové zóny může ovlivnit vaši potřebu inzulinu a načasování injekcí,
► pokud máte velmi nízkou hladinu albuminu, bude třeba pečlivě sledovat vaši hladinu cukru v krvi. Poraďte se se svým lékařem.
Děti a dospívající
Levemir lze podávat dospívajícím a dětem ve věku od 1 roku,
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla dosud stanovena.
Nejsou dostupné žádné údaje.
Další léčivé přípravky a přípravek Levemir
Informujte svého lékaře, zdravotní sestru nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat,
Některé léčivé přípravky ovlivňují hladinu krevního cukru, což může znamenat, že vaše dávka inzulinu musí být změněna. Seznam nejběžnějších léčivých přípravků, které mohou ovlivnit vaši léčbu inzulinem, je uveden níže.
Vaše hladina krevního cukru může být snížena (hypoglykemie), pokud užíváte:
• jiné přípravky k léčbě cukrovky
• inhibitory monoaminooxidázy (IMAO) (používané k léčbě deprese)
• beta-blokátory (používané k léčbě vysokého krevního tlaku)
• inhibitory angiotensin konvertujícího enzymu (ACE) (používané k léčbě některých srdečních onemocnění nebo vysokého krevního tlaku)
• salicyláty (používané k úlevě od bolesti nebo ke snížení horečky)
• anabolické steroidy (jako například testosteron)
• sulfonamidy (používané k léčbě infekcí),
Vaše hladina krevního cukru může být zvýšena (hyperglykemie), pokud užíváte:
• perorální antikoncepci (používaná ke kontrole početí)
• thiazidy (používané k léčbě vysokého krevního tlaku nebo nadměrného zadržování tekutin)
• glukokortikoidy (jako například „kortison“ používaný k léčbě zánětů)
• hormony štítné žlázy (používané k léčbě poruch štítné žlázy)
• sympatomimetika (jako například epinefrin [adrenalin] nebo salbutamol, terbutalin používané k léčbě astmatu)
• růstový hormon (lék ke stimulaci skeletálního a somatického růstu a mající vliv na metabolické procesy v těle)
• danazol (lék ovlivňující ovulaci).
Oktreotid a lanreotid (používané k léčbě akromegalie - vzácné hormonální poruchy, která se obvykle objevuje u dospělých středního věku a je způsobena nadměrnou produkcí růstového hormonu podvěskem mozkovým) mohou hladinu cukru v krvi buď zvyšovat, nebo snižovat.
Beta-blokátory (používané k léčbě vysokého krevního tlaku) mohou oslabit nebo zcela potlačit první varovné příznaky umožňující rozpoznat nízkou hladinu cukru v krvi.
Pioglitazon (tablety používané k léčbě diabetu 2. typu)
U některých pacientů s dlouhodobým onemocněním diabetem 2. typu a srdečním onemocněním či prodělanou cévní mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Informujte ošetřujícího lékaře, jakmile to bude možné, pokud pocítíte příznaky srdečního selhání, jako jsou neobvyklá dušnost nebo rychlý nárůst hmotnosti či lokalizovaný otok (edém).
Pokud užíváte kterýkoli ze zde zmíněných léků, sdělte to lékaři, sestře nebo lékárníkovi.
Přípravek Levemir s alkoholem
► Pokud pijete alkohol, může se vaše potřeba inzulinu změnit, protože hladina cukru v krvi se může jak zvýšit, tak snížit. Je doporučena pečlivá kontrola.
Těhotenství a kojení
► Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Vaše dávka inzulinu může během těhotenství a po porodu vyžadovat změnu. Pečlivá kompenzace cukrovky, zvláště prevence hypoglykemie, je důležitá pro zdraví vašeho dítěte.
► Pokud kojíte, poraďte se se svým lékařem, neboť vaše dávka inzulinu může vyžadovat úpravu.
Pokud jste těhotná či kojíte, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
► Zeptejte se, prosím, svého lékaře, zda můžete řídit auto nebo obsluhovat stroje, pokud:
• máte časté hypoglykemie
• je pro vás obtížné hypoglykemii rozeznat.
Pokud máte hladinu krevního cukru příliš nízkou nebo vysokou, může to ovlivnit vaše soustředění a schopnost reagovat a tím také vaši schopnost řídit nebo obsluhovat stroje. Mějte na paměti, že byste mohl(a) ohrozit sebe nebo ostatní.
Důležitá informace o některých pomocných látkách přípravku Levemir
Levemir obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Levemir používá Dávkování inzulinu a kdy inzulin užívat
Vždy užívejte inzulin a upravujte jeho dávku přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Levemir lze používat s rychle působícími inzulínovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetu a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Svůj inzulin neměňte, pokud vám to lékař neřekne.
Úprava vaší dávky lékařem může být nutná jestliže:
• vás lékař převedl z jednoho typu nebo značky inzulinu na jiný, nebo
• vám lékař přidal k léčbě přípravkem Levemir další přípravek k léčbě cukrovky
Použití u dětí a dospívajících
Levemir může být používán dospívajícími a dětmi ve věku od 1 roku.
Neexistují zkušenosti s použitím přípravku Levemir u dětí ve věku do 1 roku.
Použití u zvláštních skupin pacientů
Máte-li sníženou funkci ledvin nebo jater, či pokud je vám více než 65 let, bude u vás nutno sledovat hladinu cukru v krvi intenzivněji a konzultovat změny v dávkování inzulinu s lékařem.
Jak často si aplikovat injekci
Pokud je Levemir používán v kombinaci s tabletami k léčbě diabetu a/nebo v kombinaci s injekčními přípravky k léčbě diabetu, j inými než j e inzulin, má být podáván jednou denně. Pokud j e Levemir používán jako součást inzulinového režimu bazál-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientových potřebách. Dávkování má být upraveno individuálně. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladin cukru v krvi podání dvakrát denně, má být večerní dávka aplikována večer nebo před spaním.
Jak a kam si aplikovat injekci
Levemir je určen k injekční aplikaci do podkoží (subkutánně). Nikdy si nesmíte aplikovat Levemir přímo do žíly (intravenózně) nebo svalu (intramuskulárně).
Při každé injekci střídejte místa vpichu v rámci té oblasti, kterou právě k aplikaci používáte. To může snižovat riziko tvorby bouliček nebo důlků v kůži (viz bod 4, Možné nežádoucí účinky). Nejlepší místa k aplikaci jsou: přední strana stehen, přední část pasu (břicho) nebo horní část paže. Vždy byste si měl(a) pravidelně měřit hladinu cukru v krvi.
► Nenaplňujte znovu zásobní vložku.
► Zásobní vložky Levemir Penfill jsou navrženy k použití s aplikátory Novo Nordisk a jehlami NovoFine nebo NovoTwist.
► Jestliže j ste léčen(a) přípravkem Levemir Penfill a zároveň jiným inzulinem v zásobních vložkách Penfill, měl(a) byste používat dva aplikátory, pro každý typ inzulinu jeden.
► Vždy noste náhradní zásobní vložku Penfill pro případ, že byste tu, kterou právě používáte, ztratil(a) nebo by došlo k jejímu poškození.
Jak si aplikovat injekci přípravku Levemir
► Vstříkněte inzulin do podkoží. Použijte techniku, kterou vám doporučil lékař nebo zdravotní sestra a která je popsána v příručce k injekčnímu peru.
► Ponechte jehlu v podkoží nejméně 6 sekund. Dávkovači tlačítko držte zcela stlačené, dokud jehlu nevytáhnete z kůže. To zaručí podání správné dávky a omezí možné proniknutí krve do jehly nebo inzulínové zásobní vložky.
► Po každé aplikaci se ujistěte, že j ste odstranil(a) a vyhodil(a) jehlu a že skladujete Levemir bez nasazené jehly. Jinak by mohla unikat tekutina, což může způsobit nepřesné dávkování.
Jestliže jste užil(a) více inzulínu, než jste měl(a)
Pokud jste užil(a) příliš inzulinu, vaše hladina cukru v krvi se může příliš snížit (hypoglykemie). Viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4.
Jestliže jste zapomněl(a) užít inzulín
Jestliže jste zapomněl(a) užít inzulin, vaše hladina krevního cukru může stoupnout příliš vysoko (hyperglykemie). Viz část c) Důsledky diabetu v bodě 4.
Jestliže jste přestal(a) užívat inzulín
Inzulin nepřestávejte užívat bez porady s lékařem, který vám poradí, co je třeba dělat. Mohlo by to vést k velmi vysoké hladině krevního cukru (těžké hyperglykemii) a ketoacidóze (viz část c) Důsledky diabetu v bodě 4. ).
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
a) Souhrn závažných a velmi častých nežádoucích účinků
Nízká hladina cukru v krvi (hypoglykemie) je velmi častý nežádoucí účinek. Může se projevit u více než 1 pacienta z 10.
Nízká hladina cukru může nastat, pokud:
• si aplikujete příliš mnoho inzulinu
• jíte příliš málo nebo vynecháte-li jídlo
• cvičíte více než obvykle
• pijete alkohol (viz bod 2, Přípravek Levemir s alkoholem).
Příznaky nízké hladiny cukru v krvi: studený pot, chladná bledá pokožka, bolest hlavy, rychlý srdeční rytmus, pocit nevolnosti, pocit velkého hladu, dočasné změny vidění, ospalost, neobvyklá vyčerpanost a slabost, nervozita nebo třes, pocit úzkosti, pocit zmatenosti, potíže s koncentrací.
Velmi nízká hladina cukru v krvi může vést k bezvědomí. Pokud déletrvající nízká hladina cukru v krvi není léčena, může způsobit poškození mozku (dočasné nebo trvalé) a dokonce úmrtí. Z bezvědomí se můžete zotavit rychleji, pokud vám někdo, kdo ví, jak jej použít, aplikuje hormon glukagon. Pokud dostanete glukagon, budete potřebovat glukózu nebo sladkou přesnídávku ihned poté, co nabudete vědomí. Pokud nereagujete na léčbu glukagonem, budete muset být léčen(a) v nemocnici.
Co dělat, pokud pocítíte příznaky nízké hladiny cukru v krvi:
► Pokud pocítíte příznaky nízké hladiny cukru v krvi, vezměte si glukózové tablety nebo jinou přesnídávku s vysokým obsahem cukru (např. sladkosti, sušenky, ovocnou šťávu). Pokud je to možné, změřte si hladinu cukru v krvi a odpočívejte. Vždy s sebou pro případ potřeby noste glukózové tablety nebo sladkosti s vysokým obsahem cukru.
Poté, co příznaky nízké hladiny cukru v krvi ustoupí nebo se u vás stabilizuje hladina cukru v krvi, pokračujte s inzulínovou léčbou jako obvykle.
►
► Míváte-li tak nízkou hladinu cukru v krvi, že omdlíváte, pokud jste potřeboval(a) aplikovat glukagon nebo pokud míváte nízkou hladinu cukru v krvi často, pohovořte si se svým lékařem. Možná bude potřeba upravit množství nebo časové intervaly podání inzulinu, jídla nebo cvičení.
Řekněte lidem ve svém okolí, že máte diabetes, a seznamte je s jeho důsledky včetně rizika, že omdlíte (upadnete do bezvědomí) z důvodu nízké hladiny cukru v krvi. Řekněte jim, že pokud omdlíte, musí vás položit na bok a okamžitě zajistit lékařskou pomoc. Nesmějí vám dávat najíst ani napít, protože byste se mohl(a) zadusit.
Závažné alergické reakce na Levemir nebo na některou z jeho pomocných látek (tzv. systémová alergická reakce) je velmi vzácný nežádoucí účinek. Může být však potenciálně život ohrožující.
Může se projevit u méně než 1 pacienta z 10 000.
Vyhledejte ihned lékařskou pomoc:
• Pokud se příznaky alergie rozšíří na další části těla.
• Pokud se náhle necítíte dobře a začnete se potit, začnete zvracet, máte dýchací potíže, zrychlený tep a točí se vám hlava.
► Pokud zaznamenáte některé z těchto příznaků, okamžitě vyhledejte lékaře.
b) Souhrn ostatních nežádoucích účinků
Méně časté nežádoucí účinky
Mohou se projevit u méně než 1 pacienta ze 100.
Příznaky alergie: v místě vpichu se mohou projevit místní alergické reakce (bolest, zarudnutí, kopřivka, zánět, modřiny, otok a svědění). Obvykle odezní po několika týdnech podávání inzulinu. Pokud nezmizí nebo pokud se rozšíří na další části těla, vyhledejte okamžitě svého lékaře. Viz též Závažné alergické reakce výše.
Problémy s viděním: když poprvé začnete svou léčbu inzulinem, můžete pocítit poruchy zraku, tyto poruchy jsou však obvykle přechodného rázu.
Změny v místě vpichu (lipodystrofie): tuková tkáň pod kůží se může v místě vpichu ztenčit (lipoatrofie) nebo zesílit (lipohypertrofie). Obměňování míst vpichu při každé injekci snižuje riziko takových změn kůže. Pokud zjistíte, že vaše kůže má v místě vpichu dolíčky nebo zesílení, informujte svého lékaře nebo zdravotní sestru. Tyto reakce se totiž mohou zhoršit nebo mohou změnit absorpci inzulinu, pokud si do tohoto místa inzulin aplikujete.
Otoky kloubů: když začínáte brát inzulin, zadržování vody může způsobit otoky kolem kotníků a dalších kloubů. Za normálních okolností však brzy vymizí. Pokud ne, oznamte to svému lékaři.
Diabetická retinopatie (oční onemocnění spojené s cukrovkou, které může vést ke ztrátě zraku): jestliže trpíte diabetickou retinopatií a hladina vašeho krevního cukru se velmi rychle zlepší, může dojít ke zhoršení retinopatie. Poraďte se o tom se svým lékařem.
Vzácné nežádoucí účinky
Mohou se projevit u méně než 1 pacienta z 1 000.
Bolestivá neuropatie (bolest způsobená poškozením nervů): jestliže se hladina vašeho krevního cukru velmi rychle zlepší, může se dostavit bolest nervového původu nazvaná akutní bolestivá neuropatie; obvykle se jedná o přechodný stav.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
c) Důsledky diabetů
Vysoká hladina cukru v krvi (hyperglykemie)
Vysoká hladina cukru může nastat, pokud:
• jste si neaplikoval(a) dostatečné množství inzulinu
• zapomněl(a) jste si aplikovat inzulin nebo jste ho přestal(a) užívat
• opakovaně užíváte menší dávky inzulinu, než je třeba
• máte infekci a/nebo horečku
• jíte více než obvykle
• cvičíte méně než obvykle.
Varovné příznaky vysoké hladiny cukru v krvi:
Varovné příznaky se objevují postupně. Zahrnují: častější močení, pocit žízně, ztrátu chuti k jídlu, pocit nevolnosti (pocit na zvracení nebo zvracení), pocit ospalosti nebo únavy, zarudlou, suchou pokožku, sucho v ústech a ovocný (acetonový) zápach dechu.
Co dělat, pokud pocítíte příznaky vysoké hladiny cukru v krvi:
► Pokud zaznamenáte některé z výše uvedených příznaků: zkontrolujte si hladinu krevního cukru, otestuje si moč na ketony, máte-li možnost, a potom ihned vyhledejte lékařskou pomoc.
► Mohou to být příznaky velmi závažného stavu nazývaného diabetická ketoacidóza (hromadění kyseliny v krvi, protože tělo odbourává místo cukru tuk). Pokud jej neléčíte, může vést až k diabetickému kómatu a případně k úmrtí.
5. Jak přípravek Levemir uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na štítku zásobní vložky a na krabičce za „Použitelné do“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Vždy uchovávejte zásobní vložku v krabičce, pokud přípravek nepoužíváte, aby byl chráněn před světlem.
Levemir musí být chráněn před nadměrným teplem a světlem.
Před otevřením: Levemir Penfill, který není používán, má být uchováván v chladničce (2°C až 8°C), mimo chladicí zařízení. Chraňte před mrazem.
Během používání či pohotovostně nošený: používaný či pohotovostně nošený Levemir Penfill nemá být uchováván v chladničce. Můžete jej nosit s sebou a uchovávat jej při pokojové teplotě (do 30°C) maximálně po dobu 6 týdnů.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co Levemir obsahuje
• Léčivou látkou je inzulin detemir. 1 ml obsahuje 100 jednotek inzulinu detemir. 1 zásobní
vložka obsahuje 300 jednotek inzulinu detemir ve 3 ml injekčního roztoku. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
Pomocnými látkami jsou glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselina chlorovodíková, hydroxid sodný a voda na injekci.
Jak Levemir vypadá a co obsahuje toto balení
Levemir je dodáván jako injekční roztok.
Velikosti balení jsou 1, 5 a 10 zásobních vložek po 3 ml. Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko Výrobce
Výrobce může být identifikován pomocí čísla šarže vytištěného na záložce krabičky a na štítku:
- Jsou-li druhý a třetí znak S6, P5, K7, R7, VG, FG nebo ZF, pak je výrobcem Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
- Jsou-li druhý a třetí znak H7 nebo T6, pak je výrobcem Novo Nordisk Production SAS, 45 Avenue ďOrléans F-28000 Chartres, Francie
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu
Přfbalová informace: informace pro uživatele
Levemir 100 jednotek/ml injekční roztok v předplněném peru
Insulinům detemirum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, zdravotní sestry nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Levemir a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat
3. Jak se přípravek Levemir používá
4. Možné nežádoucí účinky
5. Jak přípravek Levemir uchovávat
6. Obsah balení a další informace
1. Co je přípravek Levemir a k čemu se používá
Levemir je moderní inzulin (analog inzulinu) s dlouhodobě působícím účinkem. Moderní inzulinové přípravky jsou zdokonalené verze lidského inzulinu.
Levemir je používán ke snižování vysoké hladiny cukru v krvi u dospělých, dospívajících a dětí ve věku od 1 roku s diabetes mellitus (cukrovkou). Diabetes je onemocnění, při němž tělo neprodukuje dostatek inzulinu ke kontrole hladiny cukru v krvi.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetu a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Levemir má dlouhodobý a stabilní účinek na snížení hladiny krevního cukru, jenž nastupuje během 3 až 4 hodin po aplikaci. Levemir zajišťuje základní potřebu inzulinu po dobu až 24 hodin.
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat Neužívejte Levemir
► Jestliže j ste alergický(á) na inzulin detemir nebo na kteroukoli další složku tohoto přípravku (viz bod 6, Obsah balení a další informace).
► Jestliže máte podezření, že nastupuje hypoglykemie (nízká hladina krevního cukru) (viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4).
► V inzulinových infuzních pumpách.
► Pokud pero FlexPen upadlo, je poškozené nebo promáčklé.
► Jestliže nebyl správně skladován nebo byl zmražen (viz bod 5, Jak přípravek Levemir uchovávat).
► Pokud inzulin není čirý, bezbarvý a vodný.
Pokud platí něco z výše uvedeného, Levemir neužívejte. Požádejte o radu lékaře, zdravotní sestru nebo lékárníka.
Než začnete Levemir používat
► Zkontrolujte štítek a ujistěte se, že se jedná o správný typ inzulínu,
► Pro každou aplikaci použijte vždy novou jehlu, aby se zabránilo kontaminaci.
► Jehly a Levemir FlexPen nesmíte nikomu půjčovat,
Upozornění a opatření
Některé stavy a činnosti mohou ovlivnit vaši potřebu inzulinu. Poraďte se s lékařem:
► jestliže máte obtíže s ledvinami nebo játry či nadledvinami, podvěskem mozkovým nebo štítnou žlázou
► jestliže vykonáváte tělesná cvičení ve větším rozsahu než obvykle nebo pokud chcete učinit změnu ve své běžné dietě, neboť to může ovlivnit hladinu cukru v krvi
► pokud jste nemocný(á), pokračujte v aplikaci inzulinu a poraďte se s lékařem
► pokud cestujete do zahraničí, cestování přes časové zóny může ovlivnit vaši potřebu inzulinu a načasování injekcí.
► pokud máte velmi nízkou hladinu albuminu, bude třeba pečlivě sledovat vaši hladinu cukru v krvi. Poraďte se se svým lékařem.
Děti a dospívající
Levemir lze podávat dospívajícím a dětem ve věku od 1 roku,
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla dosud stanovena.
Nejsou dostupné žádné údaje.
Další léčivé přípravky a přípravek Levemir
Informujte svého lékaře, zdravotní sestru nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat,
Některé léčivé přípravky ovlivňují hladinu krevního cukru, což může znamenat, že vaše dávka inzulinu musí být změněna. Seznam nejběžnějších léčivých přípravků, které mohou ovlivnit vaši léčbu inzulinem, je uveden níže.
Vaše hladina krevního cukru může být snížena (hypoglykemie), pokud užíváte:
• jiné přípravky k léčbě cukrovky
• inhibitory monoaminooxidázy (IMAO) (používané k léčbě deprese)
• beta-blokátory (používané k léčbě vysokého krevního tlaku)
• inhibitory angiotensin konvertujícího enzymu (ACE) (používané k léčbě některých srdečních onemocnění nebo vysokého krevního tlaku)
• salicyláty (používané k úlevě od bolesti nebo ke snížení horečky)
• anabolické steroidy (jako například testosteron)
• sulfonamidy (používané k léčbě infekcí),
Vaše hladina krevního cukru může být zvýšena (hyperglykemie), pokud užíváte:
• perorální antikoncepci (používaná ke kontrole početí)
• thiazidy (používané k léčbě vysokého krevního tlaku nebo nadměrného zadržování tekutin)
• glukokortikoidy (jako například „kortison“ používaný k léčbě zánětů)
• hormony štítné žlázy (používané k léčbě poruch štítné žlázy)
• sympatomimetika (jako například epinefrin [adrenalin] nebo salbutamol, terbutalin používané k léčbě astmatu)
• růstový hormon (lék ke stimulaci skeletálního a somatického růstu a mající vliv na metabolické procesy v těle)
• danazol (lék ovlivňující ovulaci),
Oktreotid a lanreotid (používané k léčbě akromegalie - vzácné hormonální poruchy, která se obvykle objevuje u dospělých středního věku a je způsobena nadměrnou produkcí růstového hormonu podvěskem mozkovým) mohou hladinu cukru v krvi buď zvyšovat, nebo snižovat.
Beta-blokátory (používané k léčbě vysokého krevního tlaku) mohou oslabit nebo zcela potlačit první varovné příznaky umožňující rozpoznat nízkou hladinu cukru v krvi.
Pioglitazon (tablety používané k léčbě diabetu 2. typu)
U některých pacientů s dlouhodobým onemocněním diabetem 2. typu a srdečním onemocněním či prodělanou cévní mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Informujte ošetřujícího lékaře, jakmile to bude možné, pokud pocítíte příznaky srdečního selhání, jako jsou neobvyklá dušnost nebo rychlý nárůst hmotnosti či lokalizovaný otok (edém).
Pokud užíváte kterýkoli ze zde zmíněných léků, sdělte to lékaři, sestře nebo lékárníkovi.
Přípravek Levemir s alkoholem
► Pokud pijete alkohol, může se vaše potřeba inzulinu změnit, protože hladina cukru v krvi se může jak zvýšit, tak snížit. Je doporučena pečlivá kontrola.
Těhotenství a kojení
► Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Vaše dávka inzulinu může během těhotenství a po porodu vyžadovat změnu. Pečlivá kompenzace cukrovky, zvláště prevence hypoglykemie, je důležitá pro zdraví vašeho dítěte.
► Pokud kojíte, poraďte se se svým lékařem, neboť vaše dávka inzulinu může vyžadovat úpravu.
Pokud jste těhotná či kojíte, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
► Zeptejte se, prosím, svého lékaře, zda můžete řídit auto nebo obsluhovat stroje, pokud:
• máte časté hypoglykemie
• je pro vás obtížné hypoglykemii rozeznat.
Pokud máte hladinu krevního cukru příliš nízkou nebo vysokou, může to ovlivnit vaše soustředění a schopnost reagovat a tím také vaši schopnost řídit nebo obsluhovat stroje. Mějte na paměti, že byste mohl(a) ohrozit sebe nebo ostatní.
Důležitá informace o některých pomocných látkách přípravku Levemir
Levemir obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Levemir používá Dávkování inzulinu a kdy inzulin užívat
Vždy užívejte inzulin a upravujte jeho dávku přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetů a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Svůj inzulin neměňte, pokud vám to lékař neřekne.
Úprava vaší dávky lékařem může být nutná jestliže:
• vás lékař převedl z jednoho typu nebo značky inzulinu na jiný, nebo
• vám lékař přidal k léčbě přípravkem Levemir další přípravek k léčbě cukrovky.
Použití u dětí a dospívajících
Levemir může být používán dospívajícími a dětmi ve věku od 1 roku.
Neexistují zkušenosti s použitím přípravku Levemir u dětí ve věku do 1 roku.
Použití u zvláštních skupin pacientů
Máte-li sníženou funkci ledvin nebo jater, či pokud je vám více než 65 let, bude u vás nutno sledovat hladinu cukru v krvi intenzivněji a konzultovat změny v dávkování inzulinu s lékařem.
Jak často si aplikovat injekci
Pokud je Levemir používán v kombinaci s tabletami k léčbě diabetu a/nebo v kombinaci s injekčními přípravky k léčbě diabetu, j inými než j e inzulin, má být podáván jednou denně. Pokud j e Levemir používán jako součást inzulinového režimu bazál-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientových potřebách. Dávkování má být upraveno individuálně. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladin cukru v krvi podání dvakrát denně, má být večerní dávka aplikována večer nebo před spaním.
Jak a kam si aplikovat injekci
Levemir je určen k injekční aplikaci do podkoží (subkutánně). Nikdy si nesmíte aplikovat Levemir přímo do žíly (intravenózně) nebo svalu (intramuskulárně).
Při každé injekci střídejte místa vpichu v rámci té oblasti, kterou právě k aplikaci používáte. To může snižovat riziko tvorby bouliček nebo důlků v kůži (viz bod 4, Možné nežádoucí účinky). Nejlepší místa k aplikaci jsou: přední strana stehen, přední část pasu (břicho), horní část paže. Vždy byste si měl(a) pravidelně měřit hladinu cukru v krvi.
Jak zacházet s přípravkem Levemir FlexPen
Levemir FlexPen je předplněné barevně označené pero na jedno použití obsahující inzulin detemir.
Přečtěte si pečlivě instrukce pro použití, které jsou součástí této příbalové informace. Pero musíte používat tak, jak je uvedeno v Instrukcích pro použití.
Před každou aplikací inzulinu se vždy ujistěte, že používáte správné pero.
Jestliže jste užil(a) více inzulinu, než jste měl(a)
Pokud jste užil(a) příliš inzulinu, vaše hladina cukru v krvi se může příliš snížit (hypoglykemie). Viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4.
Jestliže jste zapomněl(a) užít inzulin
Jestliže jste zapomněl(a) užít inzulin, vaše hladina krevního cukru může stoupnout příliš vysoko (hyperglykemie). Viz část c) Důsledky diabetu v bodě 4.
Jestliže jste přestal(a) užívat inzulín
Inzulin nepřestávejte užívat bez porady s lékařem, který vám poradí, co je třeba dělat. Mohlo by to vést k velmi vysoké hladině krevního cukru (těžké hyperglykemii) a ketoacidóze (viz část c) Důsledky diabetu v bodě 4.).
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
a) Souhrn závažných a velmi častých nežádoucích účinků
Nízká hladina cukru v krvi (hypoglykemie) je velmi častý nežádoucí účinek. Může se projevit u více než 1 pacienta z 10.
Nízká hladina cukru může nastat, pokud:
• si aplikujete příliš mnoho inzulinu
• jíte příliš málo nebo vynecháte-li jídlo
• cvičíte více než obvykle
• pijete alkohol (viz bod 2, Přípravek Levemir s alkoholem).
Příznaky nízké hladiny cukru v krvi: studený pot, chladná bledá pokožka, bolest hlavy, rychlý srdeční rytmus, pocit nevolnosti, pocit velkého hladu, dočasné změny vidění, ospalost, neobvyklá vyčerpanost a slabost, nervozita nebo třes, pocit úzkosti, pocit zmatenosti, potíže s koncentrací.
Velmi nízká hladina cukru v krvi může vést k bezvědomí. Pokud déletrvající nízká hladina cukru v krvi není léčena, může způsobit poškození mozku (dočasné nebo trvalé) a dokonce úmrtí. Z bezvědomí se můžete zotavit rychleji, pokud vám někdo, kdo ví, jak jej použít, aplikuje hormon glukagon. Pokud dostanete glukagon, budete potřebovat glukózu nebo sladkou přesnídávku ihned poté, co nabudete vědomí. Pokud nereagujete na léčbu glukagonem, budete muset být léčen(a) v nemocnici.
Co dělat, pokud pocítíte příznaky nízké hladiny cukru v krvi:
► Pokud pocítíte příznaky nízké hladiny cukru v krvi, vezměte si glukózové tablety nebo jinou přesnídávku s vysokým obsahem cukru (např. sladkosti, sušenky, ovocnou šťávu). Pokud je to možné, změřte si hladinu cukru v krvi a odpočívejte. Vždy s sebou pro případ potřeby noste glukózové tablety nebo sladkosti s vysokým obsahem cukru.
► Poté, co příznaky nízké hladiny cukru v krvi ustoupí nebo se u vás stabilizuje hladina cukru v krvi, pokračujte s inzulinovou léčbou jako obvykle.
► Míváte-li tak nízkou hladinu cukru v krvi, že omdlíváte, pokud jste potřeboval(a) aplikovat glukagon nebo pokud míváte nízkou hladinu cukru v krvi často, pohovořte si se svým lékařem. Možná bude potřeba upravit množství nebo časové intervaly podání inzulinu, jídla nebo cvičení.
Řekněte lidem ve svém okolí, že máte diabetes, a seznamte je s jeho důsledky včetně rizika, že omdlíte (upadnete do bezvědomí) z důvodu nízké hladiny cukru v krvi. Řekněte jim, že pokud omdlíte, musí vás položit na bok a okamžitě zajistit lékařskou pomoc. Nesmějí vám dávat najíst ani napít, protože byste se mohl(a) zadusit.
Závažné alergické reakce na Levemir nebo na některou z jeho pomocných látek (tzv. systémová alergická reakce) je velmi vzácný nežádoucí účinek. Může být však potenciálně život ohrožující.
Může se projevit u méně než 1 pacienta z 10 000.
Vyhledejte ihned lékařskou pomoc:
• Pokud se příznaky alergie rozšíří na další části těla.
• Pokud se náhle necítíte dobře a začnete se potit, začnete zvracet, máte dýchací potíže, zrychlený tep a točí se vám hlava.
► Pokud zaznamenáte některé z těchto příznaků, okamžitě vyhledejte lékaře.
b) Souhrn ostatních nežádoucích účinků
Méně časté nežádoucí účinky
Mohou se projevit u méně než 1 pacienta ze 100.
Příznaky alergie: v místě vpichu se mohou projevit místní alergické reakce (bolest, zarudnutí, kopřivka, zánět, modřiny, otok a svědění). Obvykle odezní po několika týdnech podávání inzulinu. Pokud nezmizí nebo pokud se rozšíří na další části těla, vyhledejte okamžitě svého lékaře. Viz též Závažné alergické reakce výše.
Problémy s viděním: když poprvé začnete svou léčbu inzulinem, můžete pocítit poruchy zraku, tyto poruchy jsou však obvykle přechodného rázu.
Změny v místě vpichu (lipodystrofie): tuková tkáň pod kůží se může v místě vpichu ztenčit (lipoatrofie) nebo zesílit (lipohypertrofie). Obměňování míst vpichu při každé injekci snižuje riziko takových změn kůže. Pokud zjistíte, že vaše kůže má v místě vpichu dolíčky nebo zesílení, informujte svého lékaře nebo zdravotní sestru. Tyto reakce se totiž mohou zhoršit nebo mohou změnit absorpci inzulinu, pokud si do tohoto místa inzulin aplikujete.
Otoky kloubů: když začínáte brát inzulin, zadržování vody může způsobit otoky kolem kotníků a dalších kloubů. Za normálních okolností však brzy vymizí. Pokud ne, oznamte to svému lékaři.
Diabetická retinopatie (oční onemocnění spojené s cukrovkou, které může vést ke ztrátě zraku): jestliže trpíte diabetickou retinopatií a hladina vašeho krevního cukru se velmi rychle zlepší, může dojít ke zhoršení retinopatie. Poraďte se o tom se svým lékařem.
Vzácné nežádoucí účinky
Mohou se projevit u méně než 1 pacienta z 1 000.
Bolestivá neuropatie (bolest způsobená poškozením nervů): jestliže se hladina vašeho krevního cukru velmi rychle zlepší, může se dostavit bolest nervového původu nazvaná akutní bolestivá neuropatie; obvykle se jedná o přechodný stav.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
c) Důsledky diabetů
Vysoká hladina cukru v krvi (hyperglykemie)
Vysoká hladina cukru může nastat, pokud:
• jste si neaplikoval(a) dostatečné množství inzulinu
• zapomněl(a) jste si aplikovat inzulin nebo jste ho přestal(a) užívat
• opakovaně užíváte menší dávky inzulinu, než je třeba
• máte infekci a/nebo horečku
• jíte více než obvykle
cvičíte méně než obvykle.
Varovné příznaky vysoké hladiny cukru v krvi:
Varovné příznaky se objevují postupně. Zahrnují: častější močení, pocit žízně, ztrátu chuti k jídlu, pocit nevolnosti (pocit na zvracení nebo zvracení), pocit ospalosti nebo únavy, zarudlou, suchou pokožku, sucho v ústech a ovocný (acetonový) zápach dechu.
Co dělat, pokud pocítíte příznaky vysoké hladiny cukru v krvi:
► Pokud zaznamenáte některé z výše uvedených příznaků: zkontrolujte si hladinu krevního cukru, otestuje si moč na ketony, máte-li možnost, a potom ihned vyhledejte lékařskou pomoc.
► Mohou to být příznaky velmi závažného stavu nazývaného diabetická ketoacidóza (hromadění kyseliny v krvi, protože tělo odbourává místo cukru tuk). Pokud jej neléčíte, může vést až k diabetickému kómatu a případně k úmrtí.
5. Jak přípravek Levemir uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na štítku pera FlexPen a na krabičce za „Použitelné do“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Nasaďte na pero FlexPen uzávěr vždy, když je nepoužíváte, chráníte je tak před světlem.
Levemir musí být chráněn před nadměrným teplem a světlem.
Před otevřením: Levemir FlexPen, který se nepoužívá, má být uchováván v chladničce (2°C až 8°C), mimo chladicí zařízení. Chraňte před mrazem.
Během používání či pohotovostně nošený: Používaný či pohotovostně nošený Levemir FlexPen nemá být uchováván v chladničce. Můžete jej nosit s sebou a uchovávat jej při pokojové teplotě (do 30°C) maximálně po dobu 6 týdnů.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Levemir obsahuje
• Léčivou látkou je inzulin detemir. 1 ml obsahuje 100 jednotek inzulinu detemir. 1 předplněné pero obsahuje 300 jednotek inzulinu detemir ve 3 ml injekčního roztoku. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
• Pomocnými látkami jsou glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselina chlorovodíková, hydroxid sodný a voda na injekci.
Jak Levemir vypadá a co obsahuje toto balení
Levemir je dodáván jako injekční roztok.
Velikosti balení jsou 1 předplněné pero (včetně jehel nebo bez jehel), 5 (bez jehel) a 10 (bez jehel)
předplněných per po 3 ml. Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko Výrobce
Výrobce může být identifikován pomocí čísla šarže vytištěného na záložce krabičky a na štítku:
- Jsou-li druhý a třetí znak S6, P5, K7, R7, VG, FG nebo ZF, pak je výrobcem Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
- Jsou-li druhý a třetí znak H7 nebo T6, pak je výrobcem Novo Nordisk Production SAS, 45 Avenue ďOrléans F-28000 Chartres, Francie
Pro informaci o tom, jak používat FlexPen, nyní obraťte.
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu
Instrukce pro použití přípravku LEVEMIR injekční roztok v peru FlexPen.
Před použitím pera FlexPen si pečlivě přečtěte dále uvedené pokyny. Pokud nebudete tyto pokyny pečlivě dodržovat, můžete si aplikovat inzulínu příliš málo nebo příliš mnoho, což může vést k příliš vysoké či příliš nízké hladině cukru v krvi.
FlexPen je předplněné inzulinové pero s možností nastavení dávky. Dávky lze nastavit od 1 do 60 jednotek v přírůstcích po 1 jednotce. FlexPen je určen pro použití s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm. Vždy noste náhradní inzulinový aplikátor pro případ, že pero FlexPen, které právě používáte, ztratíte nebo bude poškozeno.
Levemir FlexPen
Uzávěr pera
Stupnice ukazatele
zbývajícího množství
Volič
dávky Dávkovači tlačítko

Jehla (příklad)
Velký vnější

Vnitřní kryt jehly
Papírový
kryt
Péče o pero
FlexPen vyžaduje opatrné zacházení.
Jestliže pero FlexPen spadlo, je poškozené nebo bylo vystaveno nárazu, pak vzniká riziko úniku inzulinu. To může způsobit nepřesné dávkování, což může vést k příliš vysoké nebo příliš nízké hladině cukru v krvi.
Vnější povrch pera FlexPen můžete očistit otřením desinfekčním tamponem. Nenamáčejte jej, neomývejte jej ani jej nemažte, protože byste ho tím mohl(a) poškodit.
FlexPen znovu nenaplňujte.
Příprava pera Levemir FlexPen
Zkontrolujte název a barevný štítek pera, abyste se ujistil(a), že obsahuje správný typ inzulinu.
To je obzvlášť důležité, pokud užíváte více než jeden typ inzulinu. Pokud si aplikujete špatný typ inzulinu, může Vám hladina cukru v krvi příliš stoupnout nebo příliš klesnout.
A
Sejměte uzávěr pera.

B
Z nové jednorázové jehly odtrhněte papírový kryt. Našroubujte jehlu rovně a pevně na FlexPen.

C
Sejměte z jehly velký vnější kryt a uchovejte ho pro pozdější potřebu.
d
Sejměte z jehly vnitřní kryt a vyhoďte ho.
Nikdy se nepokoušejte vnitřní kryt jehly opět nasadit na jehlu. Mohl(a) byste se o jehlu píchnout.

A Pro každou aplikaci použijte vždy novou jehlu. Tím se sníží riziko kontaminace, infekce, úniku inzulinu, ucpání jehel a nepřesného dávkování.
A Dbejte, abyste jehlu před použitím neohnul(a), nebo jinak nepoškodil(a).
Ověření funkčnosti
Před každou injekcí se během normálního používání může v zásobní vložce nahromadit malé množství vzduchu. Abyste zabránil(a) vpíchnutí vzduchu a zajistil(a) správné dávkování:
E
Otočte voličem dávky tak, abyste nastavil(a) 2 jednotky.

F
Držte FlexPen jehlou směrem nahoru a jemně na zásobní vložku několikrát poklepte prstem, aby se v horní části zásobní vložky nahromadily případné vzduchové bubliny.

Držte jehlu stále směrem vzhůru a stlačte úplně dávkovací tlačítko. Volič dávky se vrátí na 0.
Na hrotu jehly se musí objevit kapka inzulinu. Jestliže se neobjeví, vyměňte jehlu a celý postup zopakujte, nejvíce však 6krát.
Jestliže se kapka inzulinu ani potom neobjeví, je pero vadné a musíte použít jiné.

A Vždy před podáním injekce zkontrolujte, zda se na špičce jehly objeví kapka. Tím se ujistíte, že inzulin protéká perem. Pokud se neobjeví žádná kapka, neaplikoval(a) byste si žádný inzulin, i když by se volič dávky pohyboval. Může to znamenat, že je jehla ucpaná nebo poškozená.
A Před aplikací vždy ověřte průtok. Pokud průtok neověříte, můžete si aplikovat inzulinu příliš málo, nebo si neaplikujete inzulin vůbec žádný. Může to vést k příliš vysoké hladině cukru v krvi.
Nastavení dávky
Zkontrolujte, zda je volič dávky nastaven na 0.
h
Otáčením voliče dávky nastavte požadovaný počet jednotek.
Dávku lze zmenšit nebo zvětšit otáčením voliče dávky příslušným směrem tak, aby správná dávka
byla proti značce v okénku ukazatele dávky. Při otáčení voličem dávky dbejte na to, abyste nestiskl(a)
dávkovací tlačítko, protože by inzulin unikal z pera.
Nemůžete nastavit vyšší dávku, než je počet jednotek zbývajících v zásobní vložce.

A Před aplikací inzulinu vždy pomocí voliče dávky a ukazatele dávky zkontrolujte, kolik jednotek jste zvolil(a).
A Nepočítejte cvakání pera. Pokud si zvolíte a aplikujete nesprávnou dávku, může Vám hladina cukru v krvi příliš stoupnout nebo příliš klesnout. Nepoužívejte stupnici ukazatele zbývajícího množství inzulinu - ukazuje pouze přibližné množství inzulinu zbývající ve vašem peru.
Aplikace injekce
Vpíchněte jehlu do kůže. Použijte injekční techniku, kterou vám doporučil váš lékař nebo
zdravotní sestra.
I
Dávku si vpíchněte stlačením dávkovacího tlačítka zcela dolů, až se v okénku ukazatele dávky objeví
proti značce 0. Dávejte pozor, abyste při vpichování injekce stiskl(a) pouze dávkovací tlačítko.
Otočením voliče dávky k aplikaci inzulínu nedojde.

J
Držte dávkovací tlačítko zcela stlačené a nechte jehlu pod kůží alespoň po dobu 6 sekund. Zajistíte tak, že bude podána celá dávka.
Vytáhněte jehlu z kůže a potom uvolněte dávkovací tlačítko.
Po aplikaci se vždy ujistěte, že se volič dávky vrátil na 0. Pokud se volič dávky zastaví dříve, než se vrátí na 0, nebyla aplikována celá dávka. To může mít za následek příliš vysokou hladinu cukru v krvi.

Jehlu zasuňte do velkého vněj šího krytu j ehly, aniž byste se ho dotkl(a). Jakmile je j ehla uvnitř, opatrně velký vnější kryt jehly zcela dotlačte a poté odšroubujte jehlu.
Opatrně ji vyhoďte a na pero FlexPen nasaďte zpět uzávěr pera.

A Po každé injekci jehlu vždy odstraňte a FlexPen skladujte bez nasazené jehly. Tím se sníží riziko kontaminace, infekce, úniku inzulinu, ucpání jehel a nepřesného dávkování.
Další důležité informace
A Pečující osoby musí být při manipulaci s použitými jehlami velice opatrné, aby se snížilo riziko poranění jehlou a přenesení infekce.
A Použitý FlexPen opatrně zlikvidujte bez připojené jehly.
A Pero ani jehly s nikým nesdílejte. Může to vést k přenosu infekce.
A Nikdy pero nesdílejte s dalšími osobami. Váš lék může jejich zdraví poškodit.
A Pero a jehly vždy uchovávejte mimo dohled a dosah ostatních, hlavně dětí.
Přfbalová informace: informace pro uživatele
Levemir 100 jednotek/ml injekční roztok v předplněném peru
Insulinům detemirum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, zdravotní sestry nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Levemir a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat
3. Jak se přípravek Levemir používá
4. Možné nežádoucí účinky
5. Jak přípravek Levemir uchovávat
6. Obsah balení a další informace
1. Co je přípravek Levemir a k čemu se používá
Levemir je moderní inzulin (analog inzulinu) s dlouhodobě působícím účinkem. Moderní inzulinové přípravky jsou zdokonalené verze lidského inzulinu.
Levemir je používán ke snižování vysoké hladiny cukru v krvi u dospělých, dospívajících a dětí ve věku od 1 roku s diabetes mellitus (cukrovkou). Diabetes je onemocnění, při němž tělo neprodukuje dostatek inzulinu ke kontrole hladiny cukru v krvi.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetu a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Levemir má dlouhodobý a stabilní účinek na snížení hladiny krevního cukru, jenž nastupuje během 3 až 4 hodin po aplikaci. Levemir zajišťuje základní potřebu inzulinu po dobu až 24 hodin.
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat Neužívejte Levemir
► Jestliže jste alergický(á) na inzulin detemir nebo na kteroukoli další složku tohoto přípravku (viz bod 6, Obsah balení a další informace).
► Jestliže máte podezření, že nastupuje hypoglykemie (nízká hladina krevního cukru) (viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4).
► V inzulinových infuzních pumpách.
► Pokud pero InnoLet upadlo, je poškozené nebo promáčklé.
► Jestliže nebyl správně skladován nebo byl zmražen (viz bod 5, Jak přípravek Levemir uchovávat).
► Jestliže inzulin není čirý, bezbarvý a vodný.
Pokud platí něco z výše uvedeného, Levemir neužívejte. Požádejte o radu lékaře, zdravotní sestru nebo lékárníka.
Než začnete Levemir používat
► Zkontrolujte štítek a ujistěte se, že se jedná o správný typ inzulínu,
► Pro každou aplikaci použijte vždy novou jehlu, aby se zabránilo kontaminaci.
► Jehly a Levemir InnoLet nesmíte nikomu půjčovat,
Upozornění a opatření
Některé stavy a činnosti mohou ovlivnit vaši potřebu inzulinu. Poraďte se s lékařem:
► jestliže máte obtíže s ledvinami nebo játry či nadledvinami, podvěskem mozkovým nebo štítnou žlázou
► jestliže vykonáváte tělesná cvičení ve větším rozsahu než obvykle nebo pokud chcete učinit změnu ve své běžné dietě, neboť to může ovlivnit hladinu cukru v krvi
► pokud jste nemocný(á), pokračujte v aplikaci inzulinu a poraďte se s lékařem
► pokud cestujete do zahraničí, cestování přes časové zóny může ovlivnit vaši potřebu inzulinu a načasování injekcí.
► pokud máte velmi nízkou hladinu albuminu, bude třeba pečlivě sledovat vaši hladinu cukru v krvi. Poraďte se se svým lékařem.
Děti a dospívající
Levemir lze podávat dospívajícím a dětem ve věku od 1 roku,
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla dosud stanovena.
Nejsou dostupné žádné údaje.
Další léčivé přípravky a přípravek Levemir
Informujte svého lékaře, zdravotní sestru nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat,
Některé léčivé přípravky ovlivňují hladinu krevního cukru, což může znamenat, že vaše dávka inzulinu musí být změněna. Seznam nejběžnějších léčivých přípravků, které mohou ovlivnit vaši léčbu inzulinem, je uveden níže.
Vaše hladina krevního cukru může být snížena (hypoglykemie), pokud užíváte:
• jiné přípravky k léčbě cukrovky
• inhibitory monoaminooxidázy (IMAO) (používané k léčbě deprese)
• beta-blokátory (používané k léčbě vysokého krevního tlaku)
• inhibitory angiotensin konvertujícího enzymu (ACE) (používané k léčbě některých srdečních onemocnění nebo vysokého krevního tlaku)
• salicyláty (používané k úlevě od bolesti nebo ke snížení horečky)
• anabolické steroidy (jako například testosteron)
• sulfonamidy (používané k léčbě infekcí),
Vaše hladina krevního cukru může být zvýšena (hyperglykemie), pokud užíváte:
• perorální antikoncepci (používaná ke kontrole početí)
• thiazidy (používané k léčbě vysokého krevního tlaku nebo nadměrného zadržování tekutin)
• glukokortikoidy (jako například „kortison“ používaný k léčbě zánětů)
• hormony štítné žlázy (používané k léčbě poruch štítné žlázy)
• sympatomimetika (jako například epinefrin [adrenalin] nebo salbutamol, terbutalin používané k léčbě astmatu)
• růstový hormon (lék ke stimulaci skeletálního a somatického růstu a mající vliv na metabolické procesy v těle)
• danazol (lék ovlivňující ovulaci),
Oktreotid a lanreotid (používané k léčbě akromegalie - vzácné hormonální poruchy, která se obvykle objevuje u dospělých středního věku a je způsobena nadměrnou produkcí růstového hormonu podvěskem mozkovým) mohou hladinu cukru v krvi buď zvyšovat, nebo snižovat.
Beta-blokátory (používané k léčbě vysokého krevního tlaku) mohou oslabit nebo zcela potlačit první varovné příznaky umožňující rozpoznat nízkou hladinu cukru v krvi.
Pioglitazon (tablety antidiabetikum používané k léčbě diabetu 2. typu)
U některých pacientů s dlouhodobým onemocněním diabetem 2. typu a srdečním onemocněním či prodělanou cévní mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Informujte ošetřujícího lékaře, jakmile to bude možné, pokud pocítíte příznaky srdečního selhání, jako jsou neobvyklá dušnost nebo rychlý nárůst hmotnosti či lokalizovaný otok (edém).
Pokud užíváte kterýkoli ze zde zmíněných léků, sdělte to lékaři, sestře nebo lékárníkovi.
Přípravek Levemir s alkoholem
► Pokud pijete alkohol, může se vaše potřeba inzulinu změnit, protože hladina cukru v krvi se může jak zvýšit, tak snížit. Je doporučena pečlivá kontrola.
Těhotenství a kojení
► Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Vaše dávka inzulinu může během těhotenství a po porodu vyžadovat změnu. Pečlivá kompenzace cukrovky, zvláště prevence hypoglykemie, je důležitá pro zdraví vašeho dítěte.
► Pokud kojíte, poraďte se se svým lékařem, neboť vaše dávka inzulinu může vyžadovat úpravu.
Pokud jste těhotná či kojíte, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
► Zeptejte se, prosím, svého lékaře, zda můžete řídit auto nebo obsluhovat stroje, pokud:
• máte časté hypoglykemie
• je pro vás obtížné hypoglykemii rozeznat.
Pokud máte hladinu krevního cukru příliš nízkou nebo vysokou, může to ovlivnit vaše soustředění a schopnost reagovat a tím také vaši schopnost řídit nebo obsluhovat stroje. Mějte na paměti, že byste mohl(a) ohrozit sebe nebo ostatní.
Důležitá informace o některých pomocných látkách přípravku Levemir
Levemir obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Levemir používá Dávkování inzulinu a kdy inzulin užívat
Vždy užívejte inzulin a upravujte jeho dávku přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetů a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Svůj inzulin neměňte, pokud vám to lékař neřekne.
Úprava vaší dávky lékařem může být nutná jestliže:
• vás lékař převedl z jednoho typu nebo značky inzulinu na jiný, nebo
• vám lékař přidal k léčbě přípravkem Levemir další přípravek k léčbě cukrovky.
Použití u dětí a dospívajících
Levemir může být používán dospívajícími a dětmi ve věku od 1 roku.
Neexistují zkušenosti s použitím přípravku Levemir u dětí ve věku do 1 roku.
Použití u zvláštních skupin pacientů
Máte-li sníženou funkci ledvin nebo jater, či pokud je vám více než 65 let, bude u vás nutno sledovat hladinu cukru v krvi intenzivněji a konzultovat změny v dávkování inzulinu s lékařem.
Jak často si aplikovat injekci
Pokud je Levemir používán v kombinaci s tabletami k léčbě diabetu a/nebo v kombinaci s injekčními přípravky k léčbě diabetu, j inými než j e inzulin, má být podáván jednou denně. Pokud j e Levemir používán jako součást inzulinového režimu bazál-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientových potřebách. Dávkování má být upraveno individuálně. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladin cukru v krvi podání dvakrát denně, má být večerní dávka aplikována večer nebo před spaním.
Jak a kam si aplikovat injekci
Levemir je určen k injekční aplikaci do podkoží (subkutánně). Nikdy si nesmíte aplikovat Levemir přímo do žíly (intravenózně) nebo svalu (intramuskulárně).
Při každé injekci střídejte místa vpichu v rámci té oblasti, kterou právě k aplikaci používáte. To může snižovat riziko tvorby bouliček nebo důlků v kůži (viz bod 4, Možné nežádoucí účinky). Nejlepší místa k aplikaci jsou: přední strana stehen, přední část pasu (břicho), horní část paže. Vždy byste si měl(a) pravidelně měřit hladinu cukru v krvi.
Jak zacházet s přípravkem Levemir InnoLet
Levemir InnoLet je předplněné pero na jedno použití obsahující inzulin detemir.
Přečtěte si pečlivě instrukce pro použití, které jsou součástí této příbalové informace. Pero musíte používat tak, jak je uvedeno v Instrukcích pro použití.
Před každou aplikací inzulinu se vždy ujistěte, že používáte správné pero.
Jestliže jste užil(a) více inzulinu, než jste měl(a)
Pokud jste užil(a) příliš inzulinu, vaše hladina cukru v krvi se může příliš snížit (hypoglykemie). Viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4.
Jestliže jste zapomněl(a) užít inzulin
Jestliže jste zapomněl(a) užít inzulin, vaše hladina krevního cukru může stoupnout příliš vysoko (hyperglykemie). Viz část c) Důsledky diabetu v bodě 4.
Jestliže jste přestal(a) užívat inzulín
Inzulin nepřestávejte užívat bez porady s lékařem, který vám poradí, co je třeba dělat. Mohlo by to vést k velmi vysoké hladině krevního cukru (těžké hyperglykemii) a ketoacidóze (viz část c) Důsledky diabetu v bodě 4.).
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
a) Souhrn závažných a velmi častých nežádoucích účinků
Nízká hladina cukru v krvi (hypoglykemie) je velmi častý nežádoucí účinek. Může se projevit u více než 1 pacienta z 10.
Nízká hladina cukru může nastat, pokud:
• si aplikujete příliš mnoho inzulinu
• jíte příliš málo nebo vynecháte-li jídlo
• cvičíte více než obvykle
• pijete alkohol (viz bod 2, Přípravek Levemir s alkoholem).
Příznaky nízké hladiny cukru v krvi: studený pot, chladná bledá pokožka, bolest hlavy, rychlý srdeční rytmus, pocit nevolnosti, pocit velkého hladu, dočasné změny vidění, ospalost, neobvyklá vyčerpanost a slabost, nervozita nebo třes, pocit úzkosti, pocit zmatenosti, potíže s koncentrací.
Velmi nízká hladina cukru v krvi může vést k bezvědomí. Pokud déletrvající nízká hladina cukru v krvi není léčena, může způsobit poškození mozku (dočasné nebo trvalé) a dokonce úmrtí. Z bezvědomí se můžete zotavit rychleji, pokud vám někdo, kdo ví, jak jej použít, aplikuje hormon glukagon. Pokud dostanete glukagon, budete potřebovat glukózu nebo sladkou přesnídávku ihned poté, co nabudete vědomí. Pokud nereagujete na léčbu glukagonem, budete muset být léčen(a) v nemocnici.
Co dělat, pokud pocítíte příznaky nízké hladiny cukru v krvi:
► Pokud pocítíte příznaky nízké hladiny cukru v krvi, vezměte si glukózové tablety nebo jinou přesnídávku s vysokým obsahem cukru (např. sladkosti, sušenky, ovocnou šťávu). Pokud je to možné, změřte si hladinu cukru v krvi a odpočívejte. Vždy s sebou pro případ potřeby noste glukózové tablety nebo sladkosti s vysokým obsahem cukru.
► Poté, co příznaky nízké hladiny cukru v krvi ustoupí nebo se u vás stabilizuje hladina cukru v krvi, pokračujte s inzulinovou léčbou jako obvykle.
► Míváte-li tak nízkou hladinu cukru v krvi, že omdlíváte, pokud jste potřeboval(a) aplikovat glukagon nebo pokud míváte nízkou hladinu cukru v krvi často, pohovořte si se svým lékařem. Možná bude potřeba upravit množství nebo časové intervaly podání inzulinu, jídla nebo cvičení.
Řekněte lidem ve svém okolí, že máte diabetes, a seznamte je s jeho důsledky včetně rizika, že omdlíte (upadnete do bezvědomí) z důvodu nízké hladiny cukru v krvi. Řekněte jim, že pokud omdlíte, musí vás položit na bok a okamžitě zajistit lékařskou pomoc. Nesmějí vám dávat najíst ani napít, protože byste se mohl(a) zadusit.
Závažné alergické reakce na Levemir nebo na některou z jeho pomocných látek (tzv. systémová alergická reakce) je velmi vzácný nežádoucí účinek. Může být však potenciálně život ohrožující.
Může se projevit u méně než 1 pacienta z 10 000.
Vyhledejte ihned lékařskou pomoc:
• Pokud se příznaky alergie rozšíří na další části těla.
• Pokud se náhle necítíte dobře a začnete se potit, začnete zvracet, máte dýchací potíže, zrychlený tep a točí se vám hlava.
► Pokud zaznamenáte některé z těchto příznaků, okamžitě vyhledejte lékaře.
b) Souhrn ostatních nežádoucích účinků
Méně časté nežádoucí účinky
Mohou se projevit u méně než 1 pacienta ze 100.
Příznaky alergie: v místě vpichu se mohou projevit místní alergické reakce (bolest, zarudnutí, kopřivka, zánět, modřiny, otok a svědění). Obvykle odezní po několika týdnech podávání inzulinu. Pokud nezmizí nebo pokud se rozšíří na další části těla, vyhledejte okamžitě svého lékaře. Viz též Závažné alergické reakce výše.
Problémy s viděním: když poprvé začnete svou léčbu inzulinem, můžete pocítit poruchy zraku, tyto poruchy jsou však obvykle přechodného rázu.
Změny v místě vpichu (lipodystrofie): tuková tkáň pod kůží se může v místě vpichu ztenčit (lipoatrofie) nebo zesílit (lipohypertrofie). Obměňování míst vpichu při každé injekci snižuje riziko takových změn kůže. Pokud zjistíte, že vaše kůže má v místě vpichu dolíčky nebo zesílení, informujte svého lékaře nebo zdravotní sestru. Tyto reakce se totiž mohou zhoršit nebo mohou změnit absorpci inzulinu, pokud si do tohoto místa inzulin aplikujete.
Otoky kloubů: když začínáte brát inzulin, zadržování vody může způsobit otoky kolem kotníků a dalších kloubů. Za normálních okolností však brzy vymizí. Pokud ne, oznamte to svému lékaři.
Diabetická retinopatie (oční onemocnění spojené s cukrovkou, které může vést ke ztrátě zraku): jestliže trpíte diabetickou retinopatií a hladina vašeho krevního cukru se velmi rychle zlepší, může dojít ke zhoršení retinopatie. Poraďte se o tom se svým lékařem.
Vzácné nežádoucí účinky
Mohou se projevit u méně než 1 pacienta z 1 000.
Bolestivá neuropatie (bolest způsobená poškozením nervů): jestliže se hladina vašeho krevního cukru velmi rychle zlepší, může se dostavit bolest nervového původu nazvaná akutní bolestivá neuropatie; obvykle se jedná o přechodný stav.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
c) Důsledky diabetů
Vysoká hladina cukru v krvi (hyperglykemie)
Vysoká hladina cukru může nastat, pokud:
• jste si neaplikoval(a) dostatečné množství inzulinu
• zapomněl(a) jste si aplikovat inzulin nebo jste ho přestal(a) užívat
• opakovaně užíváte menší dávky inzulinu, než je třeba
• máte infekci a/nebo horečku
• jíte více než obvykle
cvičíte méně než obvykle.
Varovné příznaky vysoké hladiny cukru v krvi:
Varovné příznaky se objevují postupně. Zahrnují: častější močení, pocit žízně, ztrátu chuti k jídlu, pocit nevolnosti (pocit na zvracení nebo zvracení), pocit ospalosti nebo únavy, zarudlou, suchou pokožku, sucho v ústech a ovocný (acetonový) zápach dechu.
Co dělat, pokud pocítíte příznaky vysoké hladiny cukru v krvi:
► Pokud zaznamenáte některé z výše uvedených příznaků: zkontrolujte si hladinu krevního cukru, otestuje si moč na ketony, máte-li možnost, a potom ihned vyhledejte lékařskou pomoc.
► Mohou to být příznaky velmi závažného stavu nazývaného diabetická ketoacidóza (hromadění kyseliny v krvi, protože tělo odbourává místo cukru tuk). Pokud jej neléčíte, může vést až k diabetickému kómatu a případně k úmrtí.
5. Jak přípravek Levemir uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na štítku pera InnoLet a na krabičce za „Použitelné do“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Nasaďte na pero InnoLet uzávěr vždy, když je nepoužíváte, chráníte je tak před světlem.
Levemir musí být chráněn před nadměrným teplem a světlem.
Před otevřením: Nepoužívaný Levemir InnoLet uchovávejte v chladničce (2°C až 8°C), mimo chladicí zařízení. Chraňte před mrazem.
Během používání či pohotovostně nošený: Používaný nebo pohotovostně nošený Levemir InnoLet nesmí být uchováván v chladničce. Můžete jej nosit s sebou a uchovávat jej při pokojové teplotě (do 30°C) maximálně po dobu 6 týdnů.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Levemir obsahuje
• Léčivou látkou je inzulin detemir. 1 ml obsahuje 100 jednotek inzulinu detemir. 1 předplněné pero obsahuje 300 jednotek inzulinu detemir ve 3 ml injekčního roztoku. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
• Pomocnými látkami jsou glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselina chlorovodíková, hydroxid sodný a voda na injekci.
Jak Levemir vypadá a co obsahuje toto balení
Levemir je dodáván jako injekční roztok.
Velikosti balení jsou 1, 5 a 10 předplněných per po 3 ml. Na trhu nemusí být k dispozici všechny
velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
Pro informaci o tom, jak používat InnoLet, nyní obraťte.
Tato přfbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu
Instrukce pro použití přípravku LEVEMIR injekční roztok v peru InnoLet.
Před použitím pera InnoLet si pozorně přečtěte následující informace. Pokud nebudete tyto pokyny pečlivě dodržovat, můžete si aplikovat inzulínu příliš málo nebo příliš mnoho, což může vést k příliš vysoké či příliš nízké hladině cukru v krvi.
InnoLet je jednoduché kompaktní předplněné pero, schopné aplikovat od 1 do 50 jednotek se zvyšováním dávky po jedné jednotce. InnoLet je navržen k použití s jednorázovými jehlami NovoFine nebo NovoTwist do délky 8 mm. Jako preventivní opatření vždy při sobě noste náhradní inzulinový aplikátor pro případ, že pero InnoLet, které právě používáte, ztratíte nebo bude poškozeno.
Stupnice ukazatele zbývajícího množství i inzulinu

Příprava
Zkontrolujte název a barevný štítek Vašeho pera InnoLet, abyste se ujistil(a), že obsahuje správný typ inzulinu. To je obzvlášť důležité, pokud užíváte více než jeden typ inzulinu. Pokud si aplikujete špatný typ inzulinu, může Vám hladina cukru v krvi příliš stoupnout nebo příliš klesnout. Sundejte uzávěr pera.
Nasazení jehly
• Pro každou aplikaci použijte vždy novou jehlu. Tím se sníží riziko kontaminace, infekce, úniku inzulinu, ucpání jehel a nepřesného dávkování.
• Dbejte, abyste jehlu před použitím neohnul(a) nebo jinak nepoškodil(a).
• Z nové jednorázové jehly odtrhněte papírový kryt.
• Našroubujte jehlu rovně a pevně na InnoLet (obrázek A).
• Sejměte velký vnější kryt jehly a vnitřní kryt jehly. Velký vnější kryt jehly můžete uložit do pouzdra na jehly.
Nikdy se nepokoušejte vnitřní kryt jehly opět nasadit na jehlu. Mohl(a) byste se o jehlu píchnout.

Před každým vstřfknutfm nejprve vytlačte vzduch
Během normálního použití se mohou v jehle a zásobní vložce nahromadit malá množství vzduchu.
Abyste se vyvaroval(a) vstříknutí vzduchu a zajistil(a) adekvátní dávkování:
• Nastavte 2 jednotky otočením voliče dávky po směru hodinových ručiček.
• Podržte InnoLet tak, aby jehla směřovala vzhůru, a několikrát jemně prsty poklepejte na zásobní vložku (obrázek B), aby se všechny vzduchové bubliny shromáždily v horní části zásobní vložky.
• Ponechejte jehlu směrem vzhůru, stiskněte dávkovači tlačítko, aby se volič dávky vrátil na
0.
• Před každou aplikací vždy zkontrolujte, že se na hrotu jehly objevila kapka inzulinu (viz obrázek b). Tím se ujistíte, že inzulin protéká perem. Pokud ne, vyměňte jehlu a zopakujte celou proceduru, ne však více než 6krát.
Pokud se stále ještě neobjevila kapka inzulinu, zařízení je vadné a nesmí být používáno.
• Pokud se neobjeví žádná kapka, neaplikoval(a) byste si žádný inzulin, i když by se volič dávky pohyboval. Může to znamenat, že je jehla ucpaná nebo poškozená.
• Před aplikací vždy InnoLet vyzkoušejte. Pokud ověření neprovedete, můžete si aplikovat inzulinu příliš málo, nebo si neaplikujete inzulin vůbec žádný. Může to vést k příliš vysoké hladině cukru v krvi.

Nastavení dávky
• Vždy si zkontrolujte, že dávkovací tlačítko je úplně stlačené a volič dávky je nastaven na 0.
• Nastavte požadovaný počet jednotek otáčením voliče dávky po směru hodinových ručiček (obrázek C).
• U každé nastavované jednotky uslyšíte cvaknutí. Dávka může být upravena otočením voliče jedním nebo druhým směrem. Pokud je jehla vpíchnuta do kůže, neotáčejte voličem dávky ani
neopravujte dávku. To může vést k nepřesnému dávkování, což může hladinu cukru v krvi příliš zvýšit či příliš snížit.
Před aplikací inzulinu vždy pomocí stupnice dávkovače a voliče dávky zkontrolujte, kolik jednotek jste zvolil(a). Nepočítejte cvakání pera. Pokud si zvolíte a aplikujete nesprávnou dávku, může Vám hladina cukru v krvi příliš stoupnout nebo příliš klesnout. Nepoužívejte stupnici ukazatele zbývajícího množství inzulinu - ukazuje pouze přibližné množství inzulinu zbývající ve vašem peru.
Nelze nastavit větší dávku, než je počet jednotek, které zbývají v zásobní vložce.

Aplikace inzulinu
• Vpfchněte jehlu do kůže. Použijte injekční techniku, kterou vám poradil váš lékař.
• Aplikujte dávku stisknutím dávkovacího tlačítka úplně dolů (obrázek D). Při návratu voliče dávky k nule uslyšíte cvakání.
• Po injekci by měla jehla zůstat pod kůží nejméně 6 sekund, aby bylo zajištěno, že byla aplikována plná dávka.
• Ujistěte se, že při aplikaci není volič dávky zablokován, protože volič dávky musí mít po stisknutí dávkovacího tlačítka možnost vrátit se na 0. Po aplikaci se vždy ujistěte, že se volič dávky vrátil na 0. Pokud se volič dávky zastaví dříve, než se vrátí na 0, nebyla aplikována celá dávka. To může mít za následek příliš vysokou hladinu cukru v krvi.
• Po každé inj ekci jehlu zlikvidujte.

Odstranění jehly
• Nasaďte zpět velký vnější kryt jehly a jehlu odšroubujte (obrázek E). Opatrně ji odstraňte.
• Nasaďte na InnoLet zpět uzávěr pera, aby byl inzulin chráněn před světlem.

Pro každou injekci použijte vždy novou jehlu. Po každé injekci vždy odstraňte a zlikvidujte jehlu a skladujte InnoLet bez nasazené jehly. Tím se sníží riziko kontaminace, infekce, úniku inzulínu, ucpání jehel a nepřesného dávkování.
Další důležité informace
Pečující osoby musí být při manipulaci s použitými jehlami velice opatrné, aby se snížilo riziko poranění jehlou a přenosu infekce.
Použitý InnoLet opatrně zlikvidujte bez připojené jehly.
Pero ani jehly s nikým nesdílejte. Může to vést k přenosu infekce.
Nikdy pero nesdílejte s dalšími osobami. Váš lék může jejich zdraví poškodit.
InnoLet a jehly vždy uchovávejte mimo dohled a dosah ostatních, hlavně dětí.
Údržba
InnoLet je navržen tak, aby fungoval přesně a bezpečně. Musíte s ním zacházet opatrně. Pokud spadl, je poškozený nebo promáčknutý, existuje riziko unikání inzulinu. To může způsobit nepřesné dávkování, což může vést k příliš vysoké nebo příliš nízké hladině cukru v krvi.
InnoLet můžete čistit otřením dezinfekčním tamponem. Nenamáčejte jej , ani jej neumývejte či nepromazávejte. Mohlo by to poškodit jeho mechanismus. To může vést k nepřesnému dávkování, což může hladinu cukru v krvi příliš zvýšit či příliš snížit.
InnoLet znovu nenaplňujte.
Přfbalová informace: informace pro uživatele
Levemir 100 jednotek/ml injekční roztok v předplněném peru
Insulinům detemirum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, zdravotní sestry nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Levemir a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat
3. Jak se přípravek Levemir používá
4. Možné nežádoucí účinky
5. Jak přípravek Levemir uchovávat
6. Obsah balení a další informace
1. Co je přípravek Levemir a k čemu se používá
Levemir je moderní inzulin (analog inzulinu) s dlouhodobě působícím účinkem. Moderní inzulinové přípravky jsou zdokonalené verze lidského inzulinu.
Levemir je používán ke snižování vysoké hladiny cukru v krvi u dospělých, dospívajících a dětí ve věku od 1 roku s diabetes mellitus (cukrovkou). Diabetes je onemocnění, při němž tělo neprodukuje dostatek inzulinu ke kontrole hladiny cukru v krvi.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetu a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Levemir má dlouhodobý a stabilní účinek na snížení hladiny krevního cukru, jenž nastupuje během 3 až 4 hodin po aplikaci. Levemir zajišťuje základní potřebu inzulinu po dobu až 24 hodin.
2. Čemu musíte věnovat pozornost, než začnete přípravek Levemir používat Neužívejte Levemir
► Jestliže j ste alergický(á) na inzulin detemir nebo na kteroukoli další složku tohoto přípravku (viz bod 6, Obsah balení a další informace).
► Jestliže máte podezření, že nastupuje hypoglykemie (nízká hladina krevního cukru) (viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4).
► V inzulinových infuzních pumpách.
► Pokud pero FlexTouch upadlo, je poškozené nebo promáčklé.
► Jestliže nebyl správně skladován nebo byl zmražen (viz bod 5, Jak přípravek Levemir uchovávat).
► Pokud inzulin není čirý, bezbarvý a vodný.
Pokud platí něco z výše uvedeného, Levemir neužívejte. Požádejte o radu lékaře, zdravotní sestru nebo lékárníka.
Než začnete Levemir používat
► Zkontrolujte štítek a ujistěte se, že se jedná o správný typ inzulínu,
► Pro každou aplikaci použijte vždy novou jehlu, aby se zabránilo kontaminaci.
► Jehly a Levemir FlexTouch nesmíte nikomu půjčovat,
Upozornění a opatření
Některé stavy a činnosti mohou ovlivnit vaši potřebu inzulinu. Poraďte se s lékařem:
► jestliže máte obtíže s ledvinami nebo játry či nadledvinami, podvěskem mozkovým nebo štítnou žlázou
► jestliže vykonáváte tělesná cvičení ve větším rozsahu než obvykle nebo pokud chcete učinit změnu ve své běžné dietě, neboť to může ovlivnit hladinu cukru v krvi
► pokud jste nemocný(á), pokračujte v aplikaci inzulinu a poraďte se s lékařem
► pokud cestujete do zahraničí, cestování přes časové zóny může ovlivnit vaši potřebu inzulinu a načasování injekcí.
► pokud máte velmi nízkou hladinu albuminu, bude třeba pečlivě sledovat vaši hladinu cukru v krvi. Poraďte se se svým lékařem.
Děti a dospívající
Levemir lze podávat dospívajícím a dětem ve věku od 1 roku,
Bezpečnost a účinnost přípravku Levemir u dětí ve věku do 1 roku nebyla dosud stanovena.
Nejsou dostupné žádné údaje.
Další léčivé přípravky a přípravek Levemir
Informujte svého lékaře, zdravotní sestru nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat,
Některé léčivé přípravky ovlivňují hladinu krevního cukru, což může znamenat, že vaše dávka inzulinu musí být změněna. Seznam nejběžnějších léčivých přípravků, které mohou ovlivnit vaši léčbu inzulinem, je uveden níže.
Vaše hladina krevního cukru může být snížena (hypoglykemie), pokud užíváte:
• jiné přípravky k léčbě cukrovky
• inhibitory monoaminooxidázy (IMAO) (používané k léčbě deprese)
• beta-blokátory (používané k léčbě vysokého krevního tlaku)
• inhibitory angiotensin konvertujícího enzymu (ACE) (používané k léčbě některých srdečních onemocnění nebo vysokého krevního tlaku)
• salicyláty (používané k úlevě od bolesti nebo ke snížení horečky)
• anabolické steroidy (jako například testosteron)
• sulfonamidy (používané k léčbě infekcí),
Vaše hladina krevního cukru může být zvýšena (hyperglykemie), pokud užíváte:
• perorální antikoncepci (používaná ke kontrole početí)
• thiazidy (používané k léčbě vysokého krevního tlaku nebo nadměrného zadržování tekutin)
• glukokortikoidy (jako například ‘„kortison“ používaný k léčbě zánětů)
• hormony štítné žlázy (používané k léčbě poruch štítné žlázy)
• sympatomimetika (jako například epinefrin [adrenalin] nebo salbutamol, terbutalin používané k léčbě astmatu)
• růstový hormon (lék ke stimulaci skeletálního a somatického růstu a mající vliv na metabolické procesy v těle)
• danazol (lék ovlivňující ovulaci),
Oktreotid a lanreotid (používané k léčbě akromegalie - vzácné hormonální poruchy, která se obvykle objevuje u dospělých středního věku a je způsobena nadměrnou produkcí růstového hormonu podvěskem mozkovým) mohou hladinu cukru v krvi buď zvyšovat, nebo snižovat.
Beta-blokátory (používané k léčbě vysokého krevního tlaku) mohou oslabit nebo zcela potlačit první varovné příznaky umožňující rozpoznat nízkou hladinu cukru v krvi.
Pioglitazon (tablety antidiabetikum používané k léčbě diabetu 2. typu)
U některých pacientů s dlouhodobým onemocněním diabetem 2. typu a srdečním onemocněním či prodělanou cévní mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Informujte ošetřujícího lékaře, jakmile to bude možné, pokud pocítíte příznaky srdečního selhání, jako jsou neobvyklá dušnost nebo rychlý nárůst hmotnosti či lokalizovaný otok (edém).
Pokud užíváte kterýkoli ze zde zmíněných léků, sdělte to lékaři, sestře nebo lékárníkovi.
Přípravek Levemir s alkoholem
► Pokud pijete alkohol, může se vaše potřeba inzulinu změnit, protože hladina cukru v krvi se může jak zvýšit, tak snížit. Je doporučena pečlivá kontrola.
Těhotenství a kojení
► Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Vaše dávka inzulinu může během těhotenství a po porodu vyžadovat změnu. Pečlivá kompenzace cukrovky, zvláště prevence hypoglykemie, je důležitá pro zdraví vašeho dítěte.
► Pokud kojíte, poraďte se se svým lékařem, neboť vaše dávka inzulinu může vyžadovat úpravu.
Pokud jste těhotná či kojíte, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
► Zeptejte se, prosím, svého lékaře, zda můžete řídit auto nebo obsluhovat stroje, pokud:
• máte časté hypoglykemie
• je pro vás obtížné hypoglykemii rozeznat.
Pokud máte hladinu krevního cukru příliš nízkou nebo vysokou, může to ovlivnit vaše soustředění a schopnost reagovat a tím také vaši schopnost řídit nebo obsluhovat stroje. Mějte na paměti, že byste mohl(a) ohrozit sebe nebo ostatní.
Důležitá informace o některých pomocných látkách přípravku Levemir
Levemir obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Levemir používá Dávkování inzulinu a kdy inzulin užívat
Vždy užívejte inzulin a upravujte jeho dávku přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Levemir lze používat s rychle působícími inzulinovými léčivými přípravky podávanými před, během nebo po jídle.
Při léčbě diabetes mellitus 2. typu může být Levemir užíván rovněž v kombinaci s tabletami k léčbě diabetů a/nebo s injekčními přípravky k léčbě diabetu, jinými než je inzulin.
Svůj inzulin neměňte, pokud vám to lékař neřekne.
Úprava vaší dávky lékařem může být nutná jestliže:
• vás lékař převedl z jednoho typu nebo značky inzulinu na jiný, nebo
• vám lékař přidal k léčbě přípravkem Levemir další přípravek k léčbě cukrovky
Použití u dětí a dospívajících
Levemir může být používán dospívajícími a dětmi ve věku od 1 roku.
Neexistují zkušenosti s použitím přípravku Levemir u dětí ve věku do 1 roku.
Použití u zvláštních skupin pacientů
Máte-li sníženou funkci ledvin nebo jater, či pokud je vám více než 65 let, bude u vás nutno sledovat hladinu cukru v krvi intenzivněji a konzultovat změny v dávkování inzulinu s lékařem.
Jak často si aplikovat injekci
Pokud je Levemir používán v kombinaci s tabletami k léčbě diabetu a/nebo v kombinaci s injekčními přípravky k léčbě diabetu, j inými než j e inzulin, má být podáván jednou denně. Pokud j e Levemir používán jako součást inzulinového režimu bazál-bolus, má být podáván jednou nebo dvakrát denně v závislosti na pacientových potřebách. Dávkování má být upraveno individuálně. Injekce může být aplikována kdykoliv během dne, avšak každý den ve stejnou dobu. Pacientům, kteří vyžadují k optimalizaci hladin cukru v krvi podání dvakrát denně, má být večerní dávka aplikována večer nebo před spaním.
Jak a kam si aplikovat injekci
Levemir je určen k injekční aplikaci do podkoží (subkutánně). Nikdy si nesmíte aplikovat Levemir přímo do žíly (intravenózně) nebo svalu (intramuskulárně).
Při každé injekci střídejte místa vpichu v rámci té oblasti, kterou právě k aplikaci používáte. To může snižovat riziko tvorby bouliček nebo důlků v kůži (viz bod 4, Možné nežádoucí účinky). Nejlepší místa k aplikaci jsou: přední strana stehen, přední část pasu (břicho), horní část paže. Vždy byste si měl(a) pravidelně měřit hladinu cukru v krvi.
Jak zacházet s přípravkem Levemir FlexTouch
Levemir FlexTouch je předplněné barevně označené pero na jedno použití obsahující inzulin detemir.
Přečtěte si pečlivě instrukce pro použití, které jsou součástí této příbalové informace. Pero musíte používat tak, jak je uvedeno v Instrukcích pro použití.
Před každou aplikací inzulinu se vždy ujistěte, že používáte správné pero.
Jestliže jste užil(a) více inzulinu, než jste měl(a)
Pokud jste užil(a) příliš inzulinu, vaše hladina cukru v krvi se může příliš snížit (hypoglykemie). Viz část a) Souhrn závažných a velmi častých nežádoucích účinků v bodě 4.
Jestliže jste zapomněl(a) užít inzulin
Jestliže jste zapomněl(a) užít inzulin, vaše hladina krevního cukru může stoupnout příliš vysoko (hyperglykemie). Viz část c) Důsledky diabetu v bodě 4.
Jestliže jste přestal(a) užívat inzulín
Inzulin nepřestávejte užívat bez porady s lékařem, který vám poradí, co je třeba dělat. Mohlo by to vést k velmi vysoké hladině krevního cukru (těžké hyperglykemii) a ketoacidóze (viz část c) Důsledky diabetu v bodě 4).
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
a) Souhrn závažných a velmi častých nežádoucích účinků
Nízká hladina cukru v krvi (hypoglykemie) je velmi častý nežádoucí účinek. Může se projevit u více než 1 pacienta z 10.
Nízká hladina cukru může nastat, pokud:
• si aplikujete příliš mnoho inzulinu
• jíte příliš málo nebo vynecháte-li jídlo
• cvičíte více než obvykle
• pijete alkohol (viz bod 2, Přípravek Levemir s alkoholem).
Příznaky nízké hladiny cukru v krvi: studený pot, chladná bledá pokožka, bolest hlavy, rychlý srdeční rytmus, pocit nevolnosti, pocit velkého hladu, dočasné změny vidění, ospalost, neobvyklá vyčerpanost a slabost, nervozita nebo třes, pocit úzkosti, pocit zmatenosti, potíže s koncentrací.
Velmi nízká hladina cukru v krvi může vést k bezvědomí. Pokud déletrvající nízká hladina cukru v krvi není léčena, může způsobit poškození mozku (dočasné nebo trvalé) a dokonce úmrtí. Z bezvědomí se můžete zotavit rychleji, pokud vám někdo, kdo ví, jak jej použít, aplikuje hormon glukagon. Pokud dostanete glukagon, budete potřebovat glukózu nebo sladkou přesnídávku ihned poté, co nabudete vědomí. Pokud nereagujete na léčbu glukagonem, budete muset být léčen(a) v nemocnici.
Co dělat, pokud pocítíte příznaky nízké hladiny cukru v krvi:
► Pokud pocítíte příznaky nízké hladiny cukru v krvi, vezměte si glukózové tablety nebo jinou přesnídávku s vysokým obsahem cukru (např. sladkosti, sušenky, ovocnou šťávu). Pokud je to možné, změřte si hladinu cukru v krvi a odpočívejte. Vždy s sebou pro případ potřeby noste glukózové tablety nebo sladkosti s vysokým obsahem cukru.
► Poté, co příznaky nízké hladiny cukru v krvi ustoupí nebo se u vás stabilizuje hladina cukru v krvi, pokračujte s inzulinovou léčbou jako obvykle.
► Míváte-li tak nízkou hladinu cukru v krvi, že omdlíváte, pokud jste potřeboval(a) aplikovat glukagon nebo pokud míváte nízkou hladinu cukru v krvi často, pohovořte si se svým lékařem. Možná bude potřeba upravit množství nebo časové intervaly podání inzulinu, jídla nebo cvičení.
Řekněte lidem ve svém okolí, že máte diabetes, a seznamte je s jeho důsledky včetně rizika, že omdlíte (upadnete do bezvědomí) z důvodu nízké hladiny cukru v krvi. Řekněte jim, že pokud omdlíte, musí vás položit na bok a okamžitě zajistit lékařskou pomoc. Nesmějí vám dávat najíst ani napít, protože byste se mohl(a) zadusit.
Závažné alergické reakce na Levemir nebo na některou z jeho pomocných látek (tzv. systémová alergická reakce) je velmi vzácný nežádoucí účinek. Může být však potenciálně život ohrožující.
Může se projevit u méně než 1 pacienta z 10 000.
Vyhledejte ihned lékařskou pomoc:
• Pokud se příznaky alergie rozšíří na další části těla.
• Pokud se náhle necítíte dobře a začnete se potit, začnete zvracet, máte dýchací potíže, zrychlený tep a točí se vám hlava.
► Pokud zaznamenáte některé z těchto příznaků, okamžitě vyhledejte lékaře.
b) Souhrn ostatních nežádoucích účinků
Méně časté nežádoucí účinky
Mohou se projevit u méně než 1 pacienta ze 100.
Příznaky alergie: v místě vpichu se mohou projevit místní alergické reakce (bolest, zarudnutí, kopřivka, zánět, modřiny, otok a svědění). Obvykle odezní po několika týdnech podávání inzulinu. Pokud nezmizí nebo pokud se rozšíří na další části těla, vyhledejte okamžitě svého lékaře. Viz též Závažné alergické reakce výše.
Problémy s viděním: když poprvé začnete svou léčbu inzulinem, můžete pocítit poruchy zraku, tyto poruchy jsou však obvykle přechodného rázu.
Změny v místě vpichu (lipodystrofie): tuková tkáň pod kůží se může v místě vpichu ztenčit (lipoatrofie) nebo zesílit (lipohypertrofie). Obměňování míst vpichu při každé injekci snižuje riziko takových změn kůže. Pokud zjistíte, že vaše kůže má v místě vpichu dolíčky nebo zesílení, informujte svého lékaře nebo zdravotní sestru. Tyto reakce se totiž mohou zhoršit nebo mohou změnit absorpci inzulinu, pokud si do tohoto místa inzulin aplikujete.
Otoky kloubů: když začínáte brát inzulin, zadržování vody může způsobit otoky kolem kotníků a dalších kloubů. Za normálních okolností však brzy vymizí. Pokud ne, oznamte to svému lékaři.
Diabetická retinopatie (oční onemocnění spojené s cukrovkou, které může vést ke ztrátě zraku): jestliže trpíte diabetickou retinopatií a hladina vašeho krevního cukru se velmi rychle zlepší, může dojít ke zhoršení retinopatie. Poraďte se o tom se svým lékařem.
Vzácné nežádoucí účinky
Mohou se projevit u méně než 1 pacienta z 1 000.
Bolestivá neuropatie (bolest způsobená poškozením nervů): jestliže se hladina vašeho krevního cukru velmi rychle zlepší, může se dostavit bolest nervového původu nazvaná akutní bolestivá neuropatie; obvykle se jedná o přechodný stav.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
c) Důsledky diabetů
Vysoká hladina cukru v krvi (hyperglykemie)
Vysoká hladina cukru může nastat, pokud:
• jste si neaplikoval(a) dostatečné množství inzulinu
• zapomněl(a) jste si aplikovat inzulin nebo jste ho přestal(a) užívat
• opakovaně užíváte menší dávky inzulinu, než je třeba
• máte infekci a/nebo horečku
• jíte více než obvykle
cvičíte méně než obvykle.
Varovné příznaky vysoké hladiny cukru v krvi:
Varovné příznaky se objevují postupně. Zahrnují: častější močení, pocit žízně, ztrátu chuti k jídlu, pocit nevolnosti (pocit na zvracení nebo zvracení), pocit ospalosti nebo únavy, zarudlou, suchou pokožku, sucho v ústech a ovocný (acetonový) zápach dechu.
Co dělat, pokud pocítíte příznaky vysoké hladiny cukru v krvi:
► Pokud zaznamenáte některé z výše uvedených příznaků: zkontrolujte si hladinu krevního cukru, otestuje si moč na ketony, máte-li možnost, a potom ihned vyhledejte lékařskou pomoc.
► Mohou to být příznaky velmi závažného stavu nazývaného diabetická ketoacidóza (hromadění kyseliny v krvi, protože tělo odbourává místo cukru tuk). Pokud jej neléčíte, může vést až k diabetickému kómatu a případně k úmrtí.
5. Jak přípravek Levemir uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na štítku pera FlexTouch a na krabičce za „Použitelné do“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Nasaďte na pero FlexTouch uzávěr vždy, když je nepoužíváte, chráníte je tak před světlem.
Levemir musí být chráněn před nadměrným teplem a světlem.
Před otevřením: Levemir FlexTouch, který se nepoužívá, má být uchováván v chladničce (2°C až 8°C), mimo chladicí zařízení. Chraňte před mrazem.
Během používání či pohotovostně nošený: Používaný či pohotovostně nošený Levemir FlexTouch nemá být uchováván v chladničce. Můžete jej nosit s sebou a uchovávat jej při pokojové teplotě (do 30°C) maximálně po dobu 6 týdnů.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Levemir obsahuje
• Léčivou látkou je inzulin detemir. 1 ml obsahuje 100 jednotek inzulinu detemir. 1 předplněné pero obsahuje 300 jednotek inzulinu detemir ve 3 ml injekčního roztoku. 1 jednotka inzulinu detemir odpovídá 1 mezinárodní jednotce humánního inzulinu.
• Pomocnými látkami jsou glycerol, fenol, metakresol, octan zinečnatý, dihydrát hydrogenfosforečnanu sodného, chlorid sodný, kyselina chlorovodíková, hydroxid sodný a voda na injekci.
Jak Levemir vypadá a co obsahuje toto balení
Levemir je dodáván jako injekční roztok.
Velikosti balení jsou 1 předplněné pero (včetně jehel nebo bez jehel), 5 (bez jehel) nebo skupinové
balení 2 x 5 (bez jehel) předplněných per po 3 ml. Na trhu nemusí být k dispozici všechny velikosti
balení.
Držitel rozhodnutí o registraci a výrobce
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dánsko
Pro informaci o tom, jak používat FlexTouch, nyní obraťte.
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu
Instrukce pro použití přípravku Levemir 100 jednotek/ml injekční roztok v předplněném peru (FlexTouch)
Před použitím předplněného pera FlexTouch si pečlivě přečtěte dále uvedené pokyny. Pokud nebudete tyto pokyny pečlivě dodržovat, můžete si aplikovat inzulínu příliš málo nebo příliš mnoho, což může vést k příliš vysoké či příliš nízké hladině cukru v krvi.
Pero nepoužívejte bez důkladného proškolení lékařem či zdravotní sestrou.
Nejdříve se ujistěte, že vaše pero obsahuje Levemir 100 jednotek/ml. Poté si prohlédněte obrázky vpravo, abyste se seznámil(a) s různými částmi pera a jehly.
Pokud jste nevidomý(á) či slabozraký(á) a nemůžete přečíst údaje na počítadle dávky, nepoužívejte toto pero bez pomoci. Požádejte o pomoc osobu s dobrým zrakem, která je seznámena s použitím předplněného pera FlexTouch.
Levemir FlexTouch je předplněné inzulinové pero. Levemir FlexTouch obsahuje 300 jednotek inzulinu s možností nastavení dávky od 1 do 80 jednotek v přírůstcích po 1 jednotce.
Levemir FlexTouch je určen pro použití s jednorázovými jehlami NovoFine nebo NovoTwist o délce do 8 mm.
Levemir FlexTouch
Uzávěr pera

Štítek pera Počítadlo Ukazatel Volič dávky dávky dávky

Dávkovací
tlačítko
Jehla (příklad)
Jehla
Vnější kryt jehly

Vnitřní kryt jehly

Papírový
kryt

Příprava pera Levemir FlexTouch
Zkontrolujte název a barevný štítek na peru Levemir FlexTouch, abyste se ujistil(a), že obsahuje typ inzulinu, který potřebujete. To je obzvlášť důležité, pokud užíváte více než jeden typ inzulinu.
Pokud si aplikujete špatný typ inzulínu, může Vám hladina cukru v krvi příliš stoupnout nebo příliš klesnout.
A Sejměte uzávěr pera.

B Pohledem skrz inzulinové okénko zkontrolujte, že inzulin ve vašem peru je čirý a bezbarvý. Pokud je inzulin zakalený, pero nepoužívejte.

C V ezměte si novou j ednorázovou j ehlu a odtrhněte papírový kryt.

D Jehlu pevně našroubujte na pero. Ujistěte se, že jehla je nasazena opravdu pevně.

E Sejměte vnější kryt jehly a uschovejte jej. Po injekci ho budete potřebovat, abyste správně odstranil(a) jehlu z pera.
Sejměte vnitřní kryt jehly a vyhoďte jej. Pokud byste se ho snažil(a) nasadit zpátky, mohl(a) byste se neúmyslně píchnout jehlou.
Na špičce jehly se může objevit kapka inzulinu. To je normální.
Vždy pro každou injekci použijte novou jehlu. Tím se sníží riziko kontaminace, infekce, úniku inzulínu, ucpání jehel a nepřesného dávkování.
A
A

Nikdy nepoužívejte jehlu ohnutou nebo poškozenou.
Ověření průtoku inzulinu
Před každým navolením a aplikací dávky se ujistěte ověřením průtoku inzulinu, že dostanete úplnou dávku inzulinu.
F Otočte voličem dávky tak, abyste nastavil(a) 2 jednotky.

G Držte pero jehlou směřující vzhůru.
Poklepejte prstem několikrát na horní část pera, aby se vzduchové bubliny nashromáždily nahoře.

H Stiskněte palcem dávkovací tlačítko, dokud se počítadlo dávky nevrátí na 0. Číslice 0 musí být proti ukazateli dávky. Na hrotu jehly se objeví kapka inzulinu.
Pokud se kapka neobjeví, opakujte kroky F až H až šestkrát. Pokud se kapka neobjeví ani po těchto dalších pokusech, vyměňte jehlu a opakujte kroky F až H ještě jednou.
Pokud se kapka inzulinu stále ještě neobjevila, pero nepoužívejte.

A Před injekcí se vždy ujistěte, že se na hrotu jehly objevila kapka. Tím se ujistíte, že inzulin
protéká perem. Pokud se neobjeví žádná kapka, neaplikoval(a) byste si žádný inzulin, i když by se počítadlo dávky pohybovalo. Může to znamenat, že je jehla ucpaná nebo poškozená.
A Před aplikací vždy ověřte průtok. Pokud průtok neověříte, můžete si aplikovat inzulínu příliš málo, nebo si neaplikujete inzulin vůbec žádný. Může to vést k příliš vysoké hladině cukru v krvi.
Nastavení dávky
K nastavení dávky používejte volič dávky na peru Levemir FlexTouch. Na jednu dávku můžete nastavit až 80 jednotek.
I Nastavte potřebnou dávku. Voličem dávky můžete otáčet tam nebo zpět. Přestaňte s otáčením, až se správný počet jednotek objeví proti ukazateli dávky.
Volič dávky vydává odlišný zvuk při otáčení tam, zpět či při dosažení počtu zbývajících jednotek.
Pokud pero obsahuje méně než 80 jednotek, počítadlo dávky se zastaví na počtu jednotek zbývajících v peru.

A Před aplikací inzulínu vždy pomocí počítadla dávky a ukazatele dávky zkontrolujte, kolik jednotek jste zvolil(a).
Nepočítejte cvakání pera. Pokud si zvolíte a aplikujete nesprávnou dávku, může Vám hladina cukru v krvi příliš stoupnout nebo příliš klesnout.
Nepoužívejte stupnici ukazatele zbývajícího množství inzulinu - ukazuje pouze přibližné množství inzulinu zbývající ve vašem peru.
CD Kolik inzulinu zbývá?
Stupnice inzulinu ukazuje pouze přibližné množství inzulinu zbývající v peru.

Abyste zjistil(a) přesné množství zbývajícího inzulinu, používejte počítadlo dávky: Otáčejte voličem dávky, dokud se počítadlo dávky nezastaví. Pokud se objeví číslo 80, pak v peru zůstává alespoň 80 jednotek.
Pokud se objeví číslo menší než 80, znamená toto číslo počet jednotek, který zůstává v peru. Otáčejte voličem dávky zpět, dokud počítadlo dávky neukazuje 0.
Pokud potřebujete více inzulínu, než je počet jednotek zbývajících v peru, můžete svou dávku rozdělit mezi dvě pera.

Příklad Počítadlo dávky se zastavilo: zbývá 52 jednotek

Á Při dělení dávky buďte velmi opatrní.
Pokud máte pochybnosti, aplikujte si celou dávku novým perem. Pokud byste dávku rozdělil(a) špatně, aplikoval(a) byste si inzulinu příliš málo nebo příliš mnoho, což by mohlo vést k příliš vysoké nebo příliš nízké hladině cukru v krvi.
Aplikace dávky
Používáním správné injekční techniky si zajistíte aplikaci úplné dávky.
J Vpíchněte jehlu do kůže tak, jak vám ukázali lékař nebo zdravotní sestra. Ujistěte se, že vidíte na počítadlo dávky. Nedotýkejte se počítadla dávky prsty. Mohlo by to přerušit aplikaci.
Stiskněte dávkovací tlačítko, až se počítadlo dávky vrátí na 0. Číslice 0 má být proti ukazateli dávky. Poté můžete uslyšet či pocítit cvaknutí.
® Poté, co se počítadlo dávky vrátí na 0, nechte jehlu pod kůží minimálně 6 sekund, abyste zajistil(a) aplikaci celé dávky.

K V ytáhněte j ehlu z kůže.
Poté, co jste jehlu vytáhl(a), může se na hrotu jehly objevit kapka inzulinu. To je normální a nemá to vliv na právě aplikovanou dávku.

Vždy po každé injekci zlikvidujte jehlu. Tím se sníží riziko kontaminace, infekce, úniku inzulínu, ucpání jehel a nepřesného dávkování. Pokud je jehla ucpaná, neaplikujete žádný inzulín,
L Na rovném povrchu zasuňte hrot jehly do vnějšího krytu jehly. Jehly ani krytu jehly se
nedotýkejte,
Jakmile je jehla uvnitř, opatrně vnější kryt jehly zcela dotlačte a poté odšroubujte jehlu. Opatrně ji vyhoďte a po každém použití na pero nasaďte uzávěr.
Když je pero prázdné, vyhoďte ho bez připojené jehly tak, jak vám doporučili lékař, zdravotní sestra či lékárník v souladu s místními předpisy.

A
A
A
Péče
Vždy sledujte počítadlo dávky, abyste se ujistil(a), kolik jednotek si aplikujete. Počítadlo dávky vám ukáže přesný počet jednotek. Nepočítejte cvakání pera,
Držte dávkovací tlačítko, dokud se po aplikaci nevrátí počítadlo dávky na 0. Pokud se volič dávky zastaví dříve, než se vrátí na 0, nebyla aplikována celá dávka. To může mít za následek příliš vysokou hladinu cukru v krvi,
Nikdy na jehlu nezkoušejte nasadit zpět vnitřní kryt jehly, Mohl(a) byste se o jehlu píchnout,
Po každé aplikaci vždy odstaňte jehlu a uchovávejte pero bez nasazené jehly. Tím se sníží riziko kontaminace, infekce, úniku inzulinu, ucpání jehel a nepřesného dávkování.
o pero
O pero se musíte starat. Nešetrné zacházení či špatné používání může způsobit nepřesné dávkování, což může vést k příliš vysoké nebo příliš nízké hladině cukru v krvi,
• Nikdy nenechávejte pero v autě nebo na jiném místě, kde by mohlo být vystaveno příliš vysoké nebo příliš nízké teplotě.
• Nevystavujte pero prachu, nečistotě nebo jakýmkoliv kapalinám.
• Pero nemyjte, nenamáčejte ani nepromazávejte. Pokud je to nutné, očistěte ho hadříkem navlhčeným jemným saponátem,
• Nikdy pero nenechte spadnout na tvrdý povrch ani s ním o tento povrch neklepejte. Pokud ho upustíte nebo máte podezření, že se porouchalo, našroubujte na něj novou jehlu a zkontrolujte před aplikací průtok inzulinu.
• Pero nezkoušejte znovu naplnit. Jakmile je prázdné, musí být zlikvidováno.
• Pero nezkoušejte opravit ani ho nerozebírejte.
A Důležité informace
• Pero noste vždy s sebou.
• Vždy s sebou noste náhradní pero a nové jehly, pro případ ztráty nebo poškození.
• Vždy ponechávejte pero a jehly mimo dohled a dosah ostatních, zejména dětí.
• Pero ani jehly nesmíte nikomu půjčovat. Může to vést k přenosu infekce.
• Pero nikomu dalšímu nepůjčujte. Váš lék by mohl poškodit jejich zdraví.
• Ošetřující osoby by měly být při manipulaci s použitými jehlami nanejvýš opatrné, aby se
snížilo riziko poranění jehlou a přenosu infekce.
120
Mírné hypoglykemické epizody se mohou léčit podáním glukózy nebo výrobků obsahujících cukr perorálně. Proto se doporučuje, aby měl diabetik vždy u sebe výrobky obsahující cukr.
• Těžké epizody hypoglykemie, kdy pacient upadl do bezvědomí, mohou být léčeny glukagonem (0,5 až 1 mg), aplikovaným nitrosvalově nebo subkutánně, školenou osobou, nebo glukózou podanou intravenózně kvalifikovaným zdravotníkem. Pokud pacient neodpovídá na glukagon do 10 až 15 minut, musí být podána glukóza intravenózně. Po dosažení vědomí je doporučováno podávat pacientovi uhlohydráty perorálně, aby se zabránilo relapsu.
Čas od okamžiku vpíchnutí inzulinu (v hodinách) Levemir ..... 0,2 j./kg 0,3 j./kg . . . .0,4 j./kg
Obrázek 1 Profily účinku přípravku Levemir u pacientů s diabetem 1. typu.
Trvání účinku je až 24 hodin v závislosti na dávce, což umožňuje podávání jednou až dvakrát denně. Pokud se podává dvakrát denně, nastane ustálený stav po podání 2-3 dávek. U dávek v intervalu 0,20,4 jednotky/kg dosáhne Levemir více než 50% svého maximálního účinku od 3-4 hodin do zhruba 14 hodin po podání dávky.
Mírné hypoglykemické epizody se mohou léčit podáním glukózy nebo výrobků obsahujících cukr perorálně. Proto se doporučuje, aby měl diabetik vždy u sebe výrobky obsahující cukr.
• Těžké epizody hypoglykemie, kdy pacient upadl do bezvědomí, mohou být léčeny glukagonem (0,5 až 1 mg), aplikovaným nitrosvalově nebo subkutánně, školenou osobou nebo glukózou podanou intravenózně kvalifikovaným zdravotníkem. Pokud pacient neodpovídá na glukagon do 10 až 15 minut, musí být podána glukóza intravenózně. Po dosažení vědomí je doporučováno podávat pacientovi uhlohydráty perorálně, aby se zabránilo relapsu.
Čas od okamžiku vpíchnutí inzulinu (v hodinách) Levemir ..... 0,2 j./kg 0,3 j./kg . . . .0,4 j./kg
Obrázek 1 Profily účinku přípravku Levemir u pacientů s diabetem 1. typu.
Trvání účinku je až 24 hodin v závislosti na dávce, což umožňuje podávání jednou až dvakrát denně. Pokud se podává dvakrát denně, nastane ustálený stav po podání 2-3 dávek. U dávek v intervalu 0,20,4 jednotky/kg dosáhne Levemir více než 50% svého maximálního účinku od 3-4 hodin do zhruba 14 hodin po podání dávky.