Kentera
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Kentera 3,9 mg/24 hodin, transdermální náplast
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna transdermální náplast obsahuje 36 mg oxybutyninum. Plocha náplasti je 39 cm2 a uvolňuje nominálně 3,9 mg oxybutyninu za 24 hodin.
Úplný seznam pomocných látek viz 6.1.
3. LÉKOVÁ FORMA
Transdermální náplast. Náplast sestává z průhledné umělé hmoty s lepivým podkladem chráněným krycí fólií, kterou je nutno před aplikací odstranit.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba urgentní inkontinence a/nebo vyšší frekvence mikce a nutkání na močení vyskytující se u dospělých pacientů s nestabilním močovým měchýřem.
4.2 Dávkování a způsob podání
Náplast je třeba aplikovat na suchou neporušenou kůži břicha, kyčle nebo hýždě ihned po vyjmutí z ochranného sáčku. Každou novou náplast je třeba aplikovat na jiné místo, aby se zabránilo aplikaci na stejné místo během 7 dnů.
Doporučená dávka je jedna 3,9 mg transdermální náplast aplikovaná dvakrát týdně (každé 3 až 4 dny). Nejsou žádné zkušenosti s podáváním u dětí.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku.
Kentera je kontraindikován u pacientů s močovou retencí, těžkým gastrointestinálním onemocněním, s myasthenia gravis, s glaukomem úzkého úhlu a u pacientů, u nichž je riziko vzniku těchto onemocnění.
4.4 Zvláštní upozornění a opatření pro použití
Kentera by měl být podáván opatrně pacientům s poruchou funkce jater nebo ledvin. Použití Kentera u pacientů s poruchou jaterních funkcí musí být pečlivě sledováno. Před léčbou Kentera je třeba posoudit výskyt jiných příčin častého močení (srdeční selhávání nebo renální onemocnění). Pokud je přítomna infekce močového traktu, měla by být zahájena příslušná antibakteriální terapie.
Močová retence: Přípravky obsahující anticholinergika by měly být podávány opatrně pacientům s klinicky signifikantní obstrukcí vyprazdňování měchýře kvůli riziku močové retence.
Kentera by měl být používán obezřetně u starších pacientů, kteří mohou být senzitivnější k účinkům centrálně působících anticholinergik a může u nich docházet k odchylkám ve farmakokinetických parametrech.
Zkušenosti s perorálním podáváním oxybutyninu mohou vyžadovat následující upozornění; tyto příhody však nebyly během klinických studií s Kentera pozorovány.
Gastrointestinální onemocnění: Léčivé přípravky s obsahem anticholinergik mohou snížit gastrointestinální motilitu a měly by být podávány opatrně pacientům s gastrointestinální obstrukcí z důvodů rizika zástavy pasáže. To platí rovněž u stavů, jako je ulcerózní kolitida a intestinální atonie. Léčivé přípravky s obsahem anticholinergik by měly být používány opatrně u pacientů s hiátovou hernií, s gastroesofageálním refluxem a u pacientů, kteří současně užívají přípravky (jako jsou bisfosfonáty), které mohou vyvolat esofagitidu nebo vést k její exacerbaci.
Léčivé přípravky s obsahem anticholinergik by měly být používány opatrně u pacientů s autonomní neuropatií, s kognitivní poruchou nebo s Parkinsonovou chorobou.
Pacienti by měli být informováni, že pokud jsou anticholinergika, jako je oxybutynin, používána v horkém prostředí, může nastat přehřátí (horečka a tepelný šok kvůli sníženému pocení).
Oxybutynin může vést k exacerbaci symptomů hyperthyreoidismu, ischemické choroby srdeční, městnavého srdečního selhání, srdečních arytmií, tachykardie, hypertenze a hypertrofie prostaty.
Oxybutynin může vést k potlačení sekrece slin, což může navodit vznik zubního kazu, paradentózy nebo kandidózy v dutině ústní.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné podávání oxybutyninu s jinými léčivými přípravky s obsahem anticholinergik nebo s jinými látkami, které jsou metabolizovány enzymem CYP3A4, mohou zvýšit výskyt nebo intenzitu sucha v ústech, zácpy a závratí.
Anticholinergika mohou potenciálně ovlivnit absorpci některých současně podávaných léčivých přípravků vzhledem k jejich anticholinergickému účinku na gastrointestinální motilitu. Vzhledem k tomu, že je oxybutynin metabolizován izoenzymem CYP 3A4 cytochromu P 450, nelze vyloučit interakce s léčivými přípravky, které tento izoenzym inhibují. To je třeba mít na paměti při použití azolových antimykotik (např. ketokonazolu) nebo makrolidových antibiotik (např. erythromycinu) společně s oxybutyninem.
Anticholinergní aktivita oxybutyninu je zvýšena současným použitím jiných anticholinergik nebo léčivých přípravků s anticholinergní aktivitou, jako je amantadin a jiná anticholinergní antiparkinsonika (např. biperiden, levodopa), antihistaminika, antipsychotika (např. fenothiaziny, butyrofenony, klozapin), chinidin, tricyklická antidepresiva, atropin a příbuzné látky, jako atropinová spazmolytika a dipyridamol.
Pacienti by měli být informováni, že alkohol může zvýšit ospalost vyvolanou anticholinergními látkami, mezi které oxybutynin patří (viz bod 4.7).
Oxybutynin může antagonizovat prokinetickou terapii.
4.6 Těhotenství a kojení
Adekvátní údaje o použití transdermální náplasti oxybutyninu u těhotných žen nejsou k dispozici. Studie na zvířatech prokázaly mírnou reprodukční toxicitu (viz 5.3). Kentera by neměl být během těhotenství podáván, pokud to není nezbytně nutné.
Při použití oxybutyninu během kojení se jeho malé množství vylučuje do mateřského mléka. Užívání oxybutyninu během kojení se proto nedoporučuje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny.
Protože Kentera může vyvolat ospalost, somnolenci nebo zamlžené vidění, mělo by se pacientům doporučit, aby během řízení nebo obsluhy strojů postupovali opatrně (viz bod 4.5).
4.8 Nežádoucí účinky
Nejčastěji hlášené nežádoucí účinky byly reakce v místě aplikace, které se vyskytly u 23,1 % pacientů. Další hlášené často se vyskytující nežádoucí účinky byly sucho v ústech (8,6%), zácpa (3,9 %), průjem (3,2 %), bolesti hlavy (3,0 %), závratě (2,3 %) a zamlžené vidění (2,3 %).
Nežádoucí reakce, známé ve spojení s anticholinergní terapií, které však nebyly pozorovány v klinických studiích s Kentera, jsou anorexie, zvracení, esofageální reflux, snížené pocení, tepelný šok, snížené slzení, mydriáza, tachykardie, arytmie, dezorientace, zhoršení schopnosti soustředění, únava, noční děsy, neklid, křeče, nitrooční hypertenze a rozvoj glaukomu, zmatenost, úzkost, paranoia, halucinace, fotosenzitivita a erektilní dysfunkce.
Níže uvedené nežádoucí reakce jsou seřazeny podle frekvence výskytu následujícím způsobem:
• Velmi časté (> 1/10)
• Časté (> 1/100 až < 1/10)
• Méně časté (> 1/1 000 až < 1/100)
Infekce a infestace Časté:
- infekce močových cest Méně časté:
- infekce horních dýchacích cest, mykózy
Poruchy oka Časté:
- rozmazané vidění
Poruchy ucha a labyrintu Časté:
závratě
Srdeční poruchy Méně časté:
palpitace
Cévní poruchy Méně časté:
kopřivka, návaly horka
Gastrointestinální poruchy Časté:
- sucho v ústech, zácpa, průjem, nauzea, bolest břicha Méně časté:
- břišní dyskomfort, dyspepsie
Poruchy svalové a kosterní soustavy a pojivové tkáně Méně časté:
- bolest zad
Poruchy ledvin a močových cest Méně časté:
- retence moči, dysurie
Celkové poruchy a reakce v místě aplikace Velmi časté:
- svědění v místě aplikace
Časté:
- erytém v místě aplikace, reakce v místě aplikace, vyrážka v místě aplikace, bolest hlavy, somnolence
Méně časté:
- rhinitida
Poranění, otravy a procedurální komplikace Méně časté:
- způsobené poranění Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Koncentrace oxybutyninu v plazmě klesá během 1 až 2 hodin po odstranění transdermálního systému. Pacienti by měli být sledováni až do vymizení symptomů. Předávkování oxybutyninem bylo doprovázeno anticholinergními účinky včetně excitace centrálního nervového systému (CNS), návalů, horečky, dehydratace, srdeční arytmie, zvracení a retence moči. Perorální požití 100 mg chloridu oxybutyninu společně s alkoholem bylo hlášeno u třináctiletého chlapce, u něhož došlo ke ztrátě paměti, a u třicetičtyřleté ženy, u které došlo ke vzniku stuporu s následnou dezorientací a agitací při probuzení, rozšířením zornic, suchostí kůže, srdeční arytmií a retencí moči. U obou pacientů došlo po symptomatické léčbě k úplnému návratu k normálu.
U Kentera nebyl hlášen žádný případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: močová spazmolytika, ATC kód: G04B D04.
Mechanismus účinku: oxybutynin účinkuje jako kompetitivní antagonista acetylcholinu na postgangliových muskarinových receptorech s následkem relaxace hladké svaloviny močového měchýře.
Farmakodynamické účinky:
U pacientů s dráždivým měchýřem, charakterizovaným nestabilitou detruzoru nebo hyperreflexií, cystometrické studie prokázaly, že oxybutynin zvyšuje maximální močovou kapacitu měchýře a zvyšuje objem nutný k první kontrakci detruzoru. Oxybutynin tak snižuje nucení na močení a častost epizod inkontinence i volního močení.
Oxybutynin je racemická směs (50:50) R- a S- izomerů. Antimuskarinová aktivita spočívá především v R- izomeru. R-izomer oxybutyninu vykazuje vyšší selektivitu k M1 a M3 muskarinovým subtypům (které převažují v detruzoru močového měchýře a příušní žláze) ve srovnání s M2 subtypem (převažuje v srdeční tkáni). Aktivní metabolit, N-desethyloxybutynin, má farmakologické účinky na svalovou tkáň lidského detruzoru, které jsou podobné účinku oxybutyninu ve studiích in vitro, avšak má vyšší vazebnou aktivitu k tkáni příušní žlázy než oxybutynin. Forma volné báze oxybutyninu je farmakologicky ekvivalentní hydrochloridu oxybutyninu.
Klinická, účinnost
Celkem 957 pacientů s urgentní močovou inkontinencí bylo hodnoceno ve třech kontrolovaných studiích porovnávajících Kentera s placebem, perorálním oxybutyninem anebo s dlouhodobě působícími tobolkami tolterodinu. Byl hodnocen týdenní pokles epizod inkontinence, četnosti močení a vymočeného objemu. Kentera vedl v porovnání s placebem ke konzistentnímu zlepšení symptomů dráždivého měchýře.
5.2 Farmakokinetické vlastnosti
Absorpce:
Kentera obsahuje koncentrace oxybutyninu dostatečné pro udržení trvalého transportu pro interval dávkování 3 až 4 dny. Oxybutynin je transportován intaktní kůží do systémové cirkulace pasivní difúzí přes stratum corneum. Po aplikaci Kentera stoupají plazmatické koncentrace oxybutyninu po dobu přibližně 24 až 48 hodin a dosahují průměrné maximální koncentrace 3 až 4 ng/ml. Rovnovážného stavu je dosaženo během druhé aplikace transdermální náplasti. Poté se stálé koncentrace udržují po dobu až 96 hodin. Rozdíl AUC a Cmax oxybutyninu a aktivního metabolitu N-desethyloxybutyninu po transdermální aplikaci Kentera v oblasti břicha, hýždí nebo kyčle není klinicky relevantní.
Distribuce:
Oxybutynin je široce distribuován do tělních tkání po systémové absorpci. Distribuční objem byl odhadnut na 193 l po intravenózním podání 5 mg hydrochloridu oxybutyninu.
Metabolizmus:
Perorálně podaný oxybutynin je primárně metabolizován enzymovými systémy cytochromu P450, zejména CYP3A4, který se nachází převážně v játrech a střevní stěně. Metabolity zahrnují kyselinu fenylcyklohexylglykolovou, která je farmakologicky neaktivní, a N-desethyloxybutynin, který je farmakologicky aktivní. Transdermální podání oxybutyninu obchází první průchod játry a gastrointestinálním systémem za snížení tvorby N-desethyl metabolitu.
Vylučování:
Oxybutynin je ve velké míře metabolizován v játrech, viz výše, kdy je do moči vylučováno beze změny méně než 0,1 % podávané dávky. Rovněž je vylučováno méně než 0,1 % podávané dávky jako metabolit N-desethyloxybutynin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje získané na základě studií akutní toxicity, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a lokální toxicity neodhalily žádné zvláštní riziko pro člověka. Při koncentraci 0,4 mg/kg/den oxybutyninu podávaného subkutánně došlo k významnému zvýšení výskytu orgánových anomálií, ale toto zvýšení je pozorováno pouze v případě toxicity pro mateřský organismus. Při aplikaci Kentera se absorbuje přibližně 0,08 mg/kg/den. Protože však není dostatek informací o vztahu mezi toxicitou pro mateřský organismus a vlivem na vývoj plodu, nelze stanovit význam pro bezpečnost u lidí. Ve studii fertility u potkanů při subkutánním podávání docházelo k poškození fertility samic, zatímco u samců nebyly hlášeny žádné účinky, a byla stanovena NOAEL (úroveň, kdy není pozorován nežádoucí účinek) 5 mg/kg.
Posouzení rizika pro životní prostředí
Léčivá látka oxybutyninu přetrvává v životním prostředí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Podkladová fólie
Průhledný polyester/ethylen-vinyl-acetát (PET/EVA)
Střední vrstva Triacetin
Roztok akrylátového kopolymeru adhezívní látky obsahující složky 2-ethylhexyl-akrylát N-vinyl pyrrolidon a polymer hexamethylenglykoldimethakrylátu.
Krycí fólie:
Silikonizovaný polyester
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Chraňte před chladem nebo mrazem.
6.5 Druh obalu a velikost balení
Transdermální náplasti jsou baleny jednotlivě do sáčků vyrobených z LDPE/vrstveného papíru a dodávány v baleních po 2, 8 nebo 24 náplastech.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Aplikujte bezprostředně po vyjmutí z ochranného sáčku. Po použití náplast stále obsahuje značné množství aktivních látek. Zbývající aktivní látky v náplasti mohou mít škodlivé účinky, pokud se dostanou do vodního prostředí. Proto se po odstranění musí použitá náplast přeložit na polovinu přilnavou stranou dovnitř, aby byla zakryta uvolňovací fólie, vložit do původního sáčku a odstranit mimo dosah dětí. Jakékoliv použité či nepoužité náplasti se musí zlikvidovat v souladu s místními požadavky anebo vrátit do lékárny. Použité náplasti nesplachujte do WC ani do zařízení pro čištění tekutých odpadů.
Činnosti, které mohou vyvolávat nadměrné pocení, vést k expozici vůči vodě nebo extrémní teplotě, mohou způsobit problémy s přilnavostí náplasti. Nevystavujte náplast působení slunečních paprsků.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/03/270/001 8 transdermálních náplastí
EU/1/03/270/002 24 transdermálních náplastí
EU/1/03/270/003 2 transdermální náplasti
9. DATUM PRVNÍ REGISTRACE
Datum první registrace: 15/06/2004 Datum posledního prodloužení: 15/06/2009
10. DATUM REVIZE TEXTU
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu/.
NÁZEV PŘÍPRAVKU
1.
Kentera 90,7 mg/g gel v sáčku
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden sáček s 1 gramem gelu obsahuje 90,7 mg oxybutyninum (jako 100 mg oxybutynini hydrochloridum), což dodává nominální dávku přibližně 4 mg/den.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Gel v sáčku.
Rychleschnoucí, čirý, jemný a bezbarvý hydroalkoholový gel bez zápachu.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavého nucení na močení vyskytujících se u dospělých pacientů s nestabilním močovým měchýřem
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka je jeden sáček aplikovaný jednou denně, což odpovídá dodané dávce přibližně 4 mg.
Starší populace
Přípravek Kentera by měl být používán opatrně u starších pacientů, kteří mohou být citlivější k účinkům centrálně působících anticholinergik a u kterých se mohou vyskytovat rozdíly ve farmakokinetice.
Ze 496 pacientů, kterým byl přípravek Kentera podáván v randomizované, dvojitě zaslepené, placebem kontrolované 12týdenní studii a ve 14týdenní rozšířené studii hodnotící bezpečnost, bylo 188 pacientů (38%) ve věku 65 let a starších. Nebyly pozorovány žádné celkové rozdíly mezi těmito pacienty a mladšími pacienty ohledně bezpečnosti nebo účinnosti, a proto není úprava dávky u starších pacientů nutná.
Porucha funkce ledvin
Nejsou žádné zkušenosti s podáváním přípravku Kentera pacientům s poruchou funkce ledvin.
Porucha funkce jater
Nejsou žádné zkušenosti s podáváním přípravku Kentera pacientům s poruchou funkce jater.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Kentera u dětí nebo dospívajících pacientů do 18 let věku.
Způsob podání
Kentera se má aplikovat na suchou, neporušenou kůži břicha, nadloktí/ramen nebo stehen. Místa aplikace je třeba střídat. V po sobě následujících dnech by pro aplikaci nemělo být použito stejné místo.
Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci (viz bod 4.4).
Po zaschnutí gelu se doporučuje místo aplikace zakrýt oděvem.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
Přípravek Kentera je kontraindikován u pacientů s retencí moči, těžkým gastrointestinálním onemocněním, myasthenia gravis nebo glaukomem s úzkým úhlem a u pacientů, u kterých existuje riziko vzniku těchto onemocnění.
4.4 Zvláštní upozornění a opatření pro použití
Jelikož faktorem omezujícím rychlost transdermálního dodání je stratum comeum, jakékoli jeho narušení by umožnilo přímý přístup k epidermis, což by mohlo zvýšit penetraci a usnadnit vstup léčivého přípravku do krevního oběhu. Proto se Kentera nemá aplikovat na čerstvě oholený nebo porušený povrch kůže.
Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci.
Po zaschnutí přípravku Kentera se doporučuje místo aplikace zakrýt oděvem.
Vliv horečky, vystavení vnějším zdrojům tepla, opalování a sauny na parametry absorpce přípravku Kentera nebyl zkoumán.
Poruchy metabolismu
Přípravek Kentera by měl být používán opatrně u pacientů s poruchou funkce jater nebo ledvin. Používání přípravku Kentera u pacientů s poruchou funkce jater je třeba pečlivě sledovat, jelikož oxybutynin je extenzivně metabolizován v játrech. Před léčbou přípravkem Kentera by měly být zváženy jiné příčiny častého močení (srdeční selhání nebo onemocnění ledvin). Pokud je přítomna infekce močových cest, měla by být zahájena příslušná antibakteriální léčba.
Močová retence
Anticholinergní léčivé přípravky by měly být podávány opatrně pacientům s klinicky významnou obstrukcí výtoku z močového měchýře z důvodu rizika retence moči.
Perorální podávání oxybutyninu může vyžadovat následující upozornění, i když tyto příhody nebyly během klinických hodnocení s přípravkem Kentera pozorovány:
Gastrointestinální poruchy
Anticholinergní léčivé přípravky mohou snižovat gastrointestinální motilitu a měly by být používány opatrně u pacientů s gastrointestinální obstrukcí z důvodu rizika žaludeční retence a při onemocněních jako např. ulcerózní kolitida a střevní atonie. Anticholinergní léčivé přípravky by se měly používat opatrně u pacientů s hiátovou hernií / gastroezofageálním refluxem a/nebo u pacientů současně užívajících léčivé přípravky (jako např. bisfosfonáty), které mohou vyvolat nebo exacerbovat ezofagitidu.
Anticholinergní léčivé přípravky by se měly používat opatrně u pacientů s autonomní neuropatií, kognitivní poruchou nebo Parkinsonovou chorobou.
Pacienti by měli být informováni, že pokud jsou anticholinergika, jako je oxybutynin, používána v horkém prostředí, může nastat přehřátí (horečka a tepelný šok následkem sníženého pocení).
Oxybutynin může exacerbovat symptomy hypertyreózy, ischemické choroby srdeční, městnavého srdečního selhání, srdečních arytmií, tachykardie, hypertenze a hypertrofie prostaty.
Oxybutynin může vést k potlačení sekrece slin, což může navodit vznik zubního kazu, paradentózy nebo orální kandidózy.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné používání oxybutyninu s jinými anticholinergiky nebo s jinými léčivými látkami, které kompetují o metabolismus prostřednictvím enzymu CYP3A4, může zvýšit výskyt nebo závažnost sucha v ústech, zácpy a ospalosti. Protože je oxybutynin metabolizován izoenzymem CYP 3A4 cytochromu P450, nelze vyloučit interakce s léčivými přípravky, které tento izoenzym inhibují, nebo se známými induktory CYP 3A4. To je třeba mít na paměti při současném podávání oxybutyninu a azolových antimykotik (např. ketokonazolu) nebo makrolidových antibiotik (např. erytromycinu). Na metabolismus oxybutyninu může mít také vliv pití grapefruitové šťávy.
Anticholinergní léčivé přípravky mohou potenciálně ovlivnit absorpci některých současně podávaných léčivých přípravků z důvodu anticholinergních účinků na gastrointestinální motilitu.
Anticholinergní aktivita oxybutyninu je zvýšena současným použitím jiných anticholinergik nebo léčivých přípravků s anticholinergní aktivitou, jako jsou amantadin a jiná anticholinergní antiparkinsonika (např. biperiden, levodopa), antihistaminika, antipsychotika (např. fenothiaziny, butyrofenony, klozapin), chinidin, tricyklická antidepresiva, atropin a příbuzné látky, jako atropinová spasmolytika, a dipyridamol.
Oxybutynin může vyvolat ospalost nebo rozmazané vidění. Ospalost může být zvýšena po požití alkoholu. Jelikož Kentera může vyvolat ospalost, somnolenci nebo rozmazané vidění, pacienty je třeba poučit, aby při řízení nebo obsluhování strojů postupovali opatrně (viz bod 4.7).
Oxybutynin může antagonizovat účinek prokinetik, jako např. cisapridu a metoklopramidu, a neměl by být podáván při snížené gastrointestinální motilitě.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku / Antikoncepce u mužů a žen
U žen ve fertilním věku by měl být před zahájením léčby proveden těhotenský test a během léčby by měla být používána nějaká forma antikoncepce.
Adekvátní údaje o podávání oxybutyninu ve formě lokálního gelu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly mírnou reprodukční toxicitu (viz bod 5.3). Přípravek Kentera by neměl být během těhotenství podáván, pokud to není nezbytně nutné.
Kojení
Dostupné informace ukazují, že se oxybutynin vylučuje do mléka potkanů, avšak není známo, zda se oxybutynin vylučuje do lidského mateřského mléka. Podávání oxybutyninu během kojení se nedoporučuje.
Fertilita
Údaje o možných účincích podávání oxybutyninu na mužskou a ženskou fertilitu nejsou k dispozici. Studie fertility u potkanů naznačují 6násobné bezpečnostní rozpětí u dospělých chovných samců i samic, pokud je přípravek Kentera podáván tak, jak je předepsáno (viz bod 5.3).
Pacienti léčení přípravkem Kentera by měli při styku s kojícími nebo těhotnými ženami nebo kojenci místa aplikace zakrýt oděvem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Kentera má malý vliv na schopnost řídit nebo obsluhovat stroje. Jelikož Kentera může vyvolat ospalost, somnolenci nebo rozmazané vidění, pacienty je třeba poučit, aby při řízení nebo obsluhování strojů postupovali opatrně (viz bod 4.5).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Bezpečnost přípravku Kentera byla hodnocena u pacientů s urgentní močovou inkontinencí v randomizované, dvojitě zaslepené, placebem kontrolované studii fáze 3 s paralelními skupinami, která zahrnovala 789 pacientů (z nichž 389 pacientů dostávalo přípravek Kentera a 400 pacientů placebo).
Nejčastěji hlášeným nežádoucím účinkem bylo sucho v ústech (Kentera 6,9%; placebo 2,8%).
Dalšími hlášenými nežádoucími účinky byly svědění v místě aplikace (Kentera 2,1%; placebo 0,8%), dermatitida v místě aplikace (Kentera 1,8%; placebo 0,3%), závrať (Kentera 1,5%; placebo 0,5%), bolest hlavy (Kentera 1,5%; placebo 2,8%), zácpa (Kentera 1,3%; placebo 1,0%) a svědění (Kentera 1,3%; placebo 1,3%).
Tabulkový seznam nežádoucích účinků
V tabulce níže jsou uvedeny nežádoucí účinky hlášené během dvojitě zaslepeného období studie fáze 3, seřazené podle třídy orgánových systémů a frekvence podle MedDRA: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000).
Nežádoucí účinky hlášené během dvojitě zaslepeného období studie fáze 3
|
Třída orgánových systémů |
Časté (>1/100 až <1/10) |
Méně časté (>1/1000 až <1/100) |
|
Infekce a infestace |
Infekce močových cest | |
|
Poruchy metabolismu a výživy |
Hypokalémie | |
|
Psychiatrické poruchy |
Úzkost | |
|
Poruchy nervového systému |
Bolest hlavy Závrať |
Somnolence Dysgeuzie Snížená kvalita spánku Tremor |
|
Poruchy oka |
Suchost oka | |
|
Poruchy ucha a labyrintu | ||
|
Srdeční poruchy |
Fibrilace síní Flutter síní Sinusová arytmie | |
|
Cévní poruchy |
Zrudnutí | |
|
Respirační, hrudní a mediastinální poruchy |
Zvýšená sekrece horních cest dýchacích | |
|
Gastrointestinální poruchy |
Sucho v ústech Zácpa |
Hemoroidy |
|
Poruchy kůže a podkožní tkáně |
Pruritus | |
|
Poruchy ledvin a močových cest |
Dysurie Hematurie Renální bolest Močová retence | |
|
Celkové poruchy a reakce v místě aplikace |
Pruritus v místě aplikace Dermatitida v místě aplikace |
Únava Periferní edém Papuly v místě aplikace Anestezie v místě aplikace Erytém v místě aplikace Podráždění v místě aplikace Bolest v místě aplikace Pustuly v místě aplikace |
|
Vyšetření |
Aabnormální elektrokardiogram Změny na elektrokardiogramu Zvýšení hladiny chloridů v krvi |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Předávkování oxybutyninem je spojováno s anticholinergními účinky včetně excitace CNS, návalů horka, horečky, dehydratace, srdeční arytmie, zvracení a retence moči. Pacienti by měli být sledováni až do vymizení symptomů. Plazmatické koncentrace oxybutyninu začínají klesat 24 hodin po aplikaci přípravku Kentera. Bylo hlášeno požití 100 mg perorálního oxybutyninu spolu s alkoholem u 13letého chlapce, u něhož došlo ke ztrátě paměti, a u 34leté ženy, u níž se objevil stupor s následnou dezorientací a agitovaností po probuzení, rozšířením zornic, suchostí kůže, srdeční arytmií a retencí moči. U obou pacientů došlo po symptomatické léčbě k úplnému zotavení.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Urologika, močová spasmolytika, ATC kód: G04B D04. Mechanismus účinku
Oxybutynin působí jako kompetitivní antagonista acetylcholinu na postgangliových muskarinových receptorech, což vede k relaxaci hladké svaloviny močového měchýře.
Farmakodynamické účinky
Cystometrické studie u pacientů s hyperaktivním močovým měchýřem, charakterizovaným nestabilitou nebo hyperreflexií svalu detruzoru, prokázaly, že oxybutynin zvyšuje maximální kapacitu močového měchýře a zvyšuje objem dosažený před první kontrakcí detruzoru. Oxybutynin tak snižuje nucení na močení a frekvenci jak epizod inkontinence, tak i volního močení.
Oxybutynin je racemická směs (50:50) R- a S-izomerů. Antimuskarinový účinek má především R-izomer. R-izomer oxybutyninu vykazuje vyšší selektivitu k muskarinovým receptorům subtypu M1 a M3 (které převažují v detruzoru močového měchýře a příušní žláze) ve srovnání se subtypem M2 (převažujícím v srdeční tkáni). Aktivní metabolit, N-desethyloxybutynin, má farmakologické účinky na detruzor u člověka, které se podobají účinkům oxybutyninu ve studiích in vitro, avšak má vyšší vazebnou afinitu ke tkáni příušní žlázy než oxybutynin. Forma volné báze oxybutyninu je farmakologicky ekvivalentní hydrochloridu oxybutyninu.
Klinická, účinnost
Účinnost a bezpečnost přípravku Kentera byly hodnoceny u pacientů s urgentní močovou inkontinencí v jedné studii fáze 3.
Tato studie fáze 3 byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s paralelními skupinami, které se účastnilo 789 pacientů. Dvanáctitýdenní dvojitě zaslepená léčba sestávala z denních aplikací přípravku Kentera nebo odpovídajícího placebového gelu. Pacienti, kteří ukončili dvojitě zaslepené období, měli možnost účastnit se 14týdenní otevřené léčby. Většina pacientů byla bílé rasy (86,3%) a ženského pohlaví (89,2%), průměrný věk byl 59,4 roku (rozmezí: 18 až 88 let). Přibližně 75% pacientů nepodstoupilo dříve žádnou farmakologickou léčbu inkontinence.
U pacientů léčených přípravkem Kentera bylo na konci léčby zaznamenáno vysoce statisticky významné snížení počtu epizod močové inkontinence za den oproti výchozím hodnotám (primární cílový parametr účinnosti) ve srovnání s placebem (p<0,0001), jakož i statisticky významné rozdíly v sekundárních cílových parametrech: snížení průměrné denní frekvence močení (p=0,0017) a zvýšení průměrného objemu vyloučené moči na jedno močení (p=0,0018). U přípravku Kentera bylo také pozorováno významné zlepšení parametrů kvality života měřených během studie.
Tabulka níže shrnuje průměrnou změnu a medián změny od výchozí hodnoty v počtu epizod inkontinence za den (primární cílový parametr), ve frekvenci močení a v objemu vyloučené moči ve skupině dostávající placebo oproti skupině dostávající aktivní lék.
Průměrná změna a medián změny počtu epizod inkontinence, frekvence močení a objemu vyloučené moči ve 12. týdnu oproti výchozím hodnotám (LOCF [použita poslední naměřená hodnota])
|
Parametr |
Kentera (N=389) Průměr (SD) Medián |
Placebo (N=400) Průměr (SD) Medián | ||
|
Počet epizod inkontinence za den | ||||
|
Vstupní hodnota |
5,4 (3,26) |
4,7 |
5,4 (3,28) |
4,7 |
|
Změna od vstupní hodnoty |
-3,0 (2,73) |
-2,7 |
-2,5 (3,06) |
-2,0 |
|
P-hodnota vs. placebo |
<0,0001 |
-- | ||
|
Denní frekvence močení | ||||
|
Vstupní hodnota |
12,4 (3,34) |
11,7 |
12,2 (3,32) |
11,3 |
|
Změna od vstupní hodnoty |
-2,7 (3,21) |
-2,7 |
-2,0 (2,82) |
-1,7 |
|
P-hodnota vs. placebo |
0,0017 |
-- | ||
|
Objem vyloučené moči (ml) | ||||
|
Vstupní hodnota |
163,4 (65,85) |
160,1 |
167,9 (68,40) |
160,6 |
|
Změna od vstupní hodnoty |
21,0 (65,33) |
11,5 |
3,8 (53,79) |
0,0 |
|
P-hodnota vs. placebo |
0,0018 |
-- | ||
|
Počet epizod nykturie za den | ||||
|
Vstupní hodnota |
2,5 (1,61) |
2,3 |
2,5 (1,71) |
2,3 |
|
Změna od vstupní hodnoty |
-0,7 (1,40) |
-0,7 |
-0,7 (1,32) |
-0,7 |
|
P-hodnota vs. placebo |
0,1372 |
-- | ||
Během dvojitě zaslepené léčby byl u přípravku Kentera zaznamenán významný pozitivní vliv na kvalitu života podle dotazníku k vyhodnocování vlivu inkontinence na kvalitu života „Incontinence Impact Questionnaire“ (IIQ). Tyto výsledky byly zřejmé po prvním měsíci léčby a přetrvávaly po celou dobu dvojitě zaslepené léčby, jak ukazuje tabulka níže.
|
Skóre |
Kentera (N=389) |
Placebo (N=400) |
P-hodnota (Kentera vs. placebo) |
|
Celkové skóre |
-72,1 (80,01) |
-49,5 (76,59) |
0,0005 |
|
Podstupnice pro cestování |
-20,9 (25,55) |
-15,1 (24,82) |
0,0068 |
|
Podstupnice pro fyzickou aktivitu |
-18,0 (23,23) |
-13,0 (21,68) |
0,0078 |
|
Podstupnice pro společenské vztahy |
-15,2 (20,07) |
-9,7 (19,27) |
0,0019 |
|
Podstupnice pro emocionální zdraví |
-18,1 (21,96) |
-11,8 (20,64) |
0,0002 |
Významný pozitivní vliv byl také zaznamenán pro oblast každé podstupnice dotazníku IIQ a pro šest z deseti oblastí kvality života, včetně oblasti důsledků inkontinence, v dotazníku King’s Health Questionnaire (KHQ), jak je ukázáno v tabulce níže.
|
Oblast |
Kentera (N=389) |
Placebo (N=400) |
P-hodnota (Kentera vs. placebo) |
|
Celkové vnímání zdravotního stavu |
0,4 (12,23) |
0,1 (11,94) |
0,6528 |
|
Důsledky inkontinence |
-27,9 (30,02) |
-21,3 (27,05) |
0,0023 |
|
Závažnost příznaků |
-20,6 (22,90) |
-15,8 (21,84) |
0,0024 |
|
Omezení v každodenních činnostech |
-27,1 (29,24) |
-21,3 (27,16) |
0,0133 |
|
Fyzické omezení |
-20,2 (30,04) |
-16,8 (28,12) |
0,1064 |
|
Sociální omezení |
-11,5 (24,40) |
-10,3 (23,46) |
0,4468 |
|
Osobní vztahy |
-11,2 (24,96) |
-6,2 (19,77) |
0,0489 |
|
Emoce |
-11,7 (24,59) |
-8,4 (24,89) |
0,0649 |
|
Spánek a energie |
-15,6 (24,18) |
-10,3 (22,42) |
0,0061 |
|
Závažnost opatření vyvíjených k vyrovnání se s obtížemi |
-15,3 (21,40) |
-11,1 (19,16) |
0,0058 |
5.2 Farmakokinetické vlastnosti
Absorpce
Přípravek Kentera je formulován pro denní aplikaci a je schopen udržovat terapeutické hladiny oxybutyninu v krvi. Oxybutynin je transportován přes neporušenou kůži a do systémového oběhu pasivní difuzí přes stratum corneum. Po aplikaci přípravku Kentera plazmatická koncentrace oxybutyninu stoupá během přibližně 7 dnů a dosahuje průměrné maximální koncentrace 4 až 5 ng/ml. Rovnovážného stavu je dosaženo po sedmém dni podávání. Rozdíl mezi AUC a Cmax oxybutyninu a jeho aktivního metabolitu N-desethyloxybutyninu po transdermální aplikaci přípravku Kentera v oblasti břicha, nadloktí/ramen a stehen není klinicky relevantní.
Distribuce
Po systémové absorpci je oxybutynin široce distribuován do tělesných tkání. Distribuční objem po intravenózním podání 5 mg hydrochloridu oxybutyninu byl odhadnut na 193 l.
Biotransformace
Perorálně podaný oxybutynin je primárně metabolizován enzymovými systémy cytochromu P450, zejména CYP3A4, který se nachází převážně v játrech a ve střevní stěně. V důsledku genetického polymorfismu se může exprese CYP3A a CYP3A4 lišit až 40krát. Metabolity zahrnují kyselinu fenylcyklohexylglykolovou, která je farmakologicky neaktivní, a N-desethyloxybutynin, který je farmakologicky aktivní. Transdermální podání oxybutyninu se vyhýbá metabolismu prvního průchodu gastrointestinálním traktem a játry, a snižuje tak tvorbu N-desethylového metabolitu.
Exkrece
Oxybutynin je ve velké míře metabolizován v játrech, viz výše; do moči je v nezměněné podobě vylučováno méně než 0,1% podané dávky. Rovněž méně než 0,1% podané dávky je vylučováno jako metabolit N-desethyloxybutynin.
Přenos z osoby na osobu
Potenciál dermálního přenosu oxybutyninu z léčené osoby na osobu neléčenou byl hodnocen ve studii s jednorázovou dávkou, ve které byly subjekty léčené přípravkem Kentera v intenzivním kontaktu s neléčeným partnerem po dobu 15 minut, buď s místem aplikace zakrytým oděvem (N=14 párů) nebo s nezakrytým místem aplikace (N=12 párů). U neléčených partnerů nechráněných oděvem byly prokázány detekovatelné plazmatické koncentrace oxybutyninu (průměrná Cmax = 0,94 ng/ml). Ve skupině s místem aplikace chráněným oděvem byly měřitelné plazmatické koncentrace oxybutyninu (Cmax < 0,1 ng/ml) během 48 hodin po kontaktu s léčenými subjekty zaznamenány u dvou ze 14 neléčených subjektů; u zbývajících 12 neléčených subjektů nebyl oxybutynin detekovatelný.
Vliv sprchování
Vliv sprchování na absorpci oxybutyninu byl hodnocen v randomizované zkřížené studii při rovnovážném stavu za podmínek bez sprchování, nebo se sprchováním za 1, 2 nebo 6 hodin po aplikaci přípravku Kentera (N=20). Výsledky studie naznačují, že sprchování jednu hodinu po aplikaci nemá na celkovou systémovou expozici oxybutyninu vliv.
Používání s opalovacím krémem
Vliv opalovacího krému aplikovaného 30 minut před aplikací přípravku Kentera nebo 30 minut po ní na absorpci oxybutyninu byl hodnocen v randomizované zkřížené studii s jednorázovou dávkou (N=16). Souběžná aplikace opalovacího krému, jak před aplikací přípravku Kentera, tak po ní, neměla žádný vliv na systémovou expozici oxybutyninu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě studií akutní toxicity, toxicity po opakovaném podávání, genotoxicity, kancerogenity a lokální toxicity neodhalily žádné zvláštní riziko pro člověka. Nežádoucí účinky byly pozorovány ve studiích embryotoxicity u králíka. Při koncentraci 0,4 mg/kg/den oxybutyninu podávaného subkutánně dochází k významnému zvýšení výskytu orgánových anomálií, které je však pozorováno pouze v případě toxicity pro matku. Nicméně jelikož vztah mezi toxicitou pro matku a účinky na embryonální vývoj není znám, význam pro bezpečnost u člověka nelze stanovit. Ve studii fertility u potkanů při subkutánním podání byly u samic zaznamenány poruchy fertility, zatímco u samců nebyly hlášeny žádné účinky, a byla stanovena hodnota NOAEL (No ObservedAdverse EffectLevel, hladina, při níž nejsou pozorovány žádné nežádoucí účinky) 5 mg/kg.
Posouzení rizika pro životní prostředí
Léčivá látka oxybutyninu přetrvává v životním prostředí.
6 FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Ethanol (96%)
Glycerol
Hydroxypropylcelulóza Hydroxid sodný (na úpravu pH)
Čištěná voda
6.3 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Chraňte před chladem nebo mrazem.
Přípravek Kentera obsahuje alkohol a považuje se za hořlavý a nesmí přijít do styku s otevřeným ohněm.
6.5 Druh obalu a velikost balení
Sáček je vyroben z vícevrstvého fóliového laminovaného materiálu na vaky (kopolymer polymethakrylátu / akrylonitrilu / lepidlo / hliník / nízkohustotní polyethylen / papír).
Jeden sáček obsahuje 1 g gelu.
Krabičky s 30 sáčky.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Po otevření sáčku a vytlačení obsahu by měl být gel použit okamžitě.
Okamžitě po aplikaci gelu je třeba si důkladně umýt ruce mýdlem a vodou. Po zaschnutí gelu se doporučuje místo aplikace zakrýt oděvem. Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/03/270/004 30 sáčků
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15/06/2004 Datum posledního prodloužení: 15/06/2009
Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky http://www.ema.europa.eu
Kentera 90,7 mg/g gel v dávkovači pumpě
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna odměřená dávka 1 gramu gelu obsahuje 90,7 mg oxybutyninum (jako 100 mg oxybutynini hydrochloridum), což dodává nominální dávku přibližně 4 mg/den.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Gel v dávkovací pumpě.
Rychleschnoucí, čirý, jemný a bezbarvý hydroalkoholový gel bez zápachu.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavého nucení na močení vyskytujících se u dospělých pacientů s nestabilním močovým měchýřem
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka je jedna odměřená dávka z dávkovací pumpy aplikovaná jednou denně, což odpovídá dodané dávce přibližně 4 mg.
Starší populace
Přípravek Kentera by měl být používán opatrně u starších pacientů, kteří mohou být citlivější k účinkům centrálně působících anticholinergik a u kterých se mohou vyskytovat rozdíly ve farmakokinetice.
Ze 496 pacientů, kterým byl přípravek Kentera podáván v randomizované, dvojitě zaslepené, placebem kontrolované 12týdenní studii a ve 14týdenní rozšířené studii hodnotící bezpečnost, bylo 188 pacientů (38%) ve věku 65 let a starších. Nebyly pozorovány žádné celkové rozdíly mezi těmito pacienty a mladšími pacienty ohledně bezpečnosti nebo účinnosti, a proto není úprava dávky u starších pacientů nutná.
Porucha funkce ledvin
Nejsou žádné zkušenosti s podáváním přípravku Kentera pacientům s poruchou funkce ledvin.
Porucha funkce jater
Nejsou žádné zkušenosti s podáváním přípravku Kentera pacientům s poruchou funkce jater.
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Kentera u dětí nebo dospívajících pacientů do 18 let věku.
Způsob podání
Kentera se má aplikovat na suchou, neporušenou kůži břicha, nadloktí/ramen nebo stehen. Místa aplikace je třeba střídat. V po sobě následujících dnech by pro aplikaci nemělo být použito stejné místo.
Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci (viz bod 4.4).
Po zaschnutí gelu se doporučuje místo aplikace zakrýt oděvem.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
Přípravek Kentera je kontraindikován u pacientů s retencí moči, těžkým gastrointestinálním onemocněním, myasthenia gravis nebo glaukomem s úzkým úhlem a u pacientů, u kterých existuje riziko vzniku těchto onemocnění.
4.4 Zvláštní upozornění a opatření pro použití
Jelikož faktorem omezujícím rychlost transdermálního dodání je stratum corneum, jakékoli jeho narušení by umožnilo přímý přístup k epidermis, což by mohlo zvýšit penetraci a usnadnit vstup léčivého přípravku do krevního oběhu. Proto se Kentera nemá aplikovat na čerstvě oholený nebo porušený povrch kůže.
Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci.
Po zaschnutí přípravku Kentera se doporučuje místo aplikace zakrýt oděvem.
Vliv horečky, vystavení vnějším zdrojům tepla, opalování a sauny na parametry absorpce přípravku Kentera nebyl zkoumán.
Poruchy metabolismu
Přípravek Kentera by měl být používán opatrně u pacientů s poruchou funkce jater nebo ledvin. Používání přípravku Kentera u pacientů s poruchou funkce jater je třeba pečlivě sledovat, jelikož oxybutynin je extenzivně metabolizován v játrech. Před léčbou přípravkem Kentera by měly být zváženy jiné příčiny častého močení (srdeční selhání nebo onemocnění ledvin). Pokud je přítomna infekce močových cest, měla by být zahájena příslušná antibakteriální léčba.
Močová retence
Anticholinergní léčivé přípravky by měly být podávány opatrně pacientům s klinicky významnou obstrukcí výtoku z močového měchýře z důvodu rizika retence moči.
Perorální podávání oxybutyninu může vyžadovat následující upozornění, i když tyto příhody nebyly během klinických hodnocení s přípravkem Kentera pozorovány.
Gastrointestinální poruchy
Anticholinergní léčivé přípravky mohou snižovat gastrointestinální motilitu a měly by být používány opatrně u pacientů s gastrointestinální obstrukcí z důvodu rizika žaludeční retence a při onemocněních jako např. ulcerózní kolitida a střevní atonie. Anticholinergní léčivé přípravky by se měly používat opatrně u pacientů s hiátovou hernií / gastroezofageálním refluxem a/nebo u pacientů současně užívajících léčivé přípravky (jako např. bisfosfonáty), které mohou vyvolat nebo exacerbovat ezofagitidu.
Anticholinergní léčivé přípravky by se měly používat opatrně u pacientů s autonomní neuropatií, kognitivní poruchou nebo Parkinsonovou chorobou.
Pacienti by měli být informováni, že pokud jsou anticholinergika, jako je oxybutynin, používána v horkém prostředí, může nastat přehřátí (horečka a tepelný šok následkem sníženého pocení).
Oxybutynin může exacerbovat symptomy hypertyreózy, ischemické choroby srdeční, městnavého srdečního selhání, srdečních arytmií, tachykardie, hypertenze a hypertrofie prostaty.
Oxybutynin může vést k potlačení sekrece slin, což může navodit vznik zubního kazu, paradentózy nebo orální kandidózy.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné používání oxybutyninu s jinými anticholinergiky nebo s jinými léčivými látkami, které kompetují o metabolismus prostřednictvím enzymu CYP3A4, může zvýšit výskyt nebo závažnost sucha v ústech, zácpy a ospalosti. Protože je oxybutynin metabolizován izoenzymem CYP 3A4 cytochromu P450, nelze vyloučit interakce s léčivými přípravky, které tento izoenzym inhibují, nebo se známými induktory CYP 3A4. To je třeba mít na paměti při současném podávání oxybutyninu a azolových antimykotik (např. ketokonazolu) nebo makrolidových antibiotik (např. erytromycinu). Na metabolismus oxybutyninu může mít také vliv pití grapefruitové šťávy.
Anticholinergní léčivé přípravky mohou potenciálně ovlivnit absorpci některých současně podávaných léčivých přípravků z důvodu anticholinergních účinků na gastrointestinální motilitu.
Anticholinergní aktivita oxybutyninu je zvýšena současným použitím jiných anticholinergik nebo léčivých přípravků s anticholinergní aktivitou, jako jsou amantadin a jiná anticholinergní antiparkinsonika (např. biperiden, levodopa), antihistaminika, antipsychotika (např. fenothiaziny, butyrofenony, klozapin), chinidin, tricyklická antidepresiva, atropin a příbuzné látky, jako atropinová spasmolytika, a dipyridamol.
Oxybutynin může vyvolat ospalost nebo rozmazané vidění. Ospalost může být zvýšena po požití alkoholu. Jelikož Kentera může vyvolat ospalost, somnolenci nebo rozmazané vidění, pacienty je třeba poučit, aby při řízení nebo obsluhování strojů postupovali opatrně (viz bod 4.7).
Oxybutynin může antagonizovat účinek prokinetik, jako např. cisapridu a metoklopramidu, a neměl by být podáván při snížené gastrointestinální motilitě.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku / Antikoncepce u mužů a žen
U žen ve fertilním věku by měl být před zahájením léčby proveden těhotenský test a během léčby by měla být používána nějaká forma antikoncepce.
Adekvátní údaje o podávání oxybutyninu ve formě lokálního gelu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly mírnou reprodukční toxicitu (viz bod 5.3). Přípravek Kentera by neměl být během těhotenství podáván, pokud to není nezbytně nutné.
Kojení
Dostupné informace ukazují, že se oxybutynin vylučuje do mléka potkanů, avšak není známo, zda se oxybutynin vylučuje do lidského mateřského mléka. Podávání oxybutyninu během kojení se nedoporučuje.
Fertilita
Údaje o možných účincích podávání oxybutyninu na mužskou a ženskou fertilitu nejsou k dispozici. Studie fertility u potkanů naznačují 6násobné bezpečnostní rozpětí u dospělých chovných samců i samic, pokud je přípravek Kentera podáván tak, jak je předepsáno (viz bod 5.3).
Pacienti léčení přípravkem Kentera by měli při styku s kojícími nebo těhotnými ženami nebo kojenci místa aplikace zakrýt oděvem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Kentera má malý vliv na schopnost řídit nebo obsluhovat stroje. Jelikož Kentera může vyvolat ospalost, somnolenci nebo rozmazané vidění, pacienty je třeba poučit, aby při řízení nebo obsluhování strojů postupovali opatrně (viz bod 4.5).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Bezpečnost přípravku Kentera byla hodnocena u pacientů s urgentní močovou inkontinencí v randomizované, dvojitě zaslepené, placebem kontrolované studii fáze 3 s paralelními skupinami, která zahrnovala 789 pacientů (z nichž 389 pacientů dostávalo přípravek Kentera a 400 pacientů placebo).
Nejčastěji hlášeným nežádoucím účinkem bylo sucho v ústech (Kentera 6,9%; placebo 2,8%).
Dalšími hlášenými nežádoucími účinky byly svědění v místě aplikace (Kentera 2,1%; placebo 0,8%), dermatitida v místě aplikace (Kentera 1,8%; placebo 0,3%), závrať (Kentera 1,5%; placebo 0,5%), bolest hlavy (Kentera 1,5%; placebo 2,8%), zácpa (Kentera 1,3%; placebo 1,0%) a svědění (Kentera 1,3%; placebo 1,3%).
Tabulkový seznam nežádoucích účinků
V tabulce níže jsou uvedeny nežádoucí účinky hlášené během dvojitě zaslepeného období studie fáze 3, seřazené podle třídy orgánových systémů a frekvence podle MedDRA: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000).
Nežádoucí účinky hlášené během dvojitě zaslepeného období studie fáze 3
|
Třída orgánových systémů |
Časté (>1/100 až <1/10) |
Méně časté (>1/1000 až <1/100) |
|
Infekce a infestace |
Infekce močových cest | |
|
Poruchy metabolismu a výživy |
Hypokalémie | |
|
Psychiatrické poruchy |
Úzkost | |
|
Poruchy nervového systému |
Bolest hlavy Závrať |
Somnolence Dysgeuzie Snížená kvalita spánku Tremor |
|
Poruchy oka |
Suchost oka | |
|
Poruchy ucha a labyrintu | ||
|
Srdeční poruchy |
Fibrilace síní Flutter síní Sinusová arytmie | |
|
Cévní poruchy |
Zrudnutí | |
|
Respirační, hrudní a mediastinální poruchy |
Zvýšená sekrece horních cest dýchacích | |
|
Gastrointestinální poruchy |
Sucho v ústech Zácpa |
Hemoroidy |
|
Poruchy kůže a podkožní tkáně |
Pruritus | |
|
Poruchy ledvin a močových cest |
Dysurie Hematurie Renální bolest Močová retence | |
|
Celkové poruchy a reakce v místě aplikace |
Pruritus v místě aplikace Dermatitida v místě aplikace |
Únava Periferní edém Papuly v místě aplikace Anestezie v místě aplikace Erytém v místě aplikace Podráždění v místě aplikace Bolest v místě aplikace Pustuly v místě aplikace |
|
Vyšetření |
Abnormální elektrokardiogram Změny na elektrokardiogramu Zvýšení hladiny chloridů v krvi |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Předávkování oxybutyninem je spojováno s anticholinergními účinky včetně excitace CNS, návalů horka, horečky, dehydratace, srdeční arytmie, zvracení a retence moči. Pacienti by měli být sledováni až do vymizení symptomů. Plazmatické koncentrace oxybutyninu začínají klesat 24 hodin po aplikaci přípravku Kentera. Bylo hlášeno požití 100 mg perorálního oxybutyninu spolu s alkoholem u 13letého chlapce, u něhož došlo ke ztrátě paměti, a u 34leté ženy, u níž se objevil stupor s následnou dezorientací a agitovaností po probuzení, rozšířením zornic, suchostí kůže, srdeční arytmií a retencí moči. U obou pacientů došlo po symptomatické léčbě k úplnému zotavení.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Urologika, močová spasmolytika, ATC kód: G04B D04. Mechanismus účinku
Oxybutynin působí jako kompetitivní antagonista acetylcholinu na postgangliových muskarinových receptorech, což vede k relaxaci hladké svaloviny močového měchýře.
Farmakodynamické účinky
Cystometrické studie u pacientů s hyperaktivním močovým měchýřem, charakterizovaným nestabilitou nebo hyperreflexií svalu detruzoru, prokázaly, že oxybutynin zvyšuje maximální kapacitu močového měchýře a zvyšuje objem dosažený před první kontrakcí detruzoru. Oxybutynin tak snižuje nucení na močení a frekvenci jak epizod inkontinence, tak i volního močení.
Oxybutynin je racemická směs (50:50) R- a S-izomerů. Antimuskarinový účinek má především R-izomer. R-izomer oxybutyninu vykazuje vyšší selektivitu k muskarinovým receptorům subtypu M1 a M3 (které převažují v detruzoru močového měchýře a příušní žláze) ve srovnání se subtypem M2 (převažujícím v srdeční tkáni). Aktivní metabolit, N-desethyloxybutynin, má farmakologické účinky na detruzor u člověka, které se podobají účinkům oxybutyninu ve studiích in vitro, avšak má vyšší vazebnou afinitu ke tkáni příušní žlázy než oxybutynin. Forma volné báze oxybutyninu je farmakologicky ekvivalentní hydrochloridu oxybutyninu.
Klinická účinnost
Účinnost a bezpečnost přípravku Kentera byly hodnoceny u pacientů s urgentní močovou inkontinencí v jedné studii fáze 3.
Tato studie fáze 3 byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s paralelními skupinami, které se účastnilo 789 pacientů. Dvanáctitýdenní dvojitě zaslepená léčba sestávala z denních aplikací přípravku Kentera nebo odpovídajícího placebového gelu. Pacienti, kteří ukončili dvojitě zaslepené období, měli možnost účastnit se 14týdenní otevřené léčby. Většina pacientů byla bílé rasy (86,3%) a ženského pohlaví (89,2%), průměrný věk byl 59,4 roku (rozmezí: 18 až 88 let). Přibližně 75% pacientů nepodstoupilo dříve žádnou farmakologickou léčbu inkontinence.
U pacientů léčených přípravkem Kentera bylo na konci léčby zaznamenáno vysoce statisticky významné snížení počtu epizod močové inkontinence za den oproti výchozím hodnotám (primární cílový parametr účinnosti) ve srovnání s placebem (p<0,0001), jakož i statisticky významné rozdíly v sekundárních cílových parametrech: snížení průměrné denní frekvence močení (p=0,0017) a zvýšení průměrného objemu vyloučené moči na jedno močení (p=0,0018). U přípravku Kentera bylo také pozorováno významné zlepšení parametrů kvality života měřených během studie.
Tabulka níže shrnuje průměrnou změnu a medián změny od výchozí hodnoty v počtu epizod inkontinence za den (primární cílový parametr), ve frekvenci močení a v objemu vyloučené moči ve skupině dostávající placebo oproti skupině dostávající aktivní lék.
Průměrná změna a medián změny počtu epizod inkontinence, frekvence močení a objemu vyloučené moči ve 12. týdnu oproti výchozím hodnotám (LOCF [použita poslední naměřená hodnota])
|
Parametr |
Kentera (N=389) Průměr (SD) Medián |
Placebo (N=400) Průměr (SD) Medián | ||
|
Počet epizod inkontinence za den | ||||
|
Vstupní hodnota |
5,4 (3,26) |
4,7 |
5,4 (3,28) |
4,7 |
|
Změna od vstupní hodnoty |
-3,0 (2,73) |
-2,7 |
-2,5 (3,06) |
-2,0 |
|
P-hodnota vs. placebo |
<0,0001 |
-- | ||
|
Denní frekvence močení | ||||
|
Vstupní hodnota |
12,4 (3,34) |
11,7 |
12,2 (3,32) |
11,3 |
|
Změna od vstupní hodnoty |
-2,7 (3,21) |
-2,7 |
-2,0 (2,82) |
-1,7 |
|
P-hodnota vs. placebo |
0,0017 |
-- | ||
|
Objem vyloučené moči (ml) | ||||
|
Vstupní hodnota |
163,4 (65,85) |
160,1 |
167,9 (68,40) |
160,6 |
|
Změna od vstupní hodnoty |
21,0 (65,33) |
11,5 |
3,8 (53,79) |
0,0 |
|
P-hodnota vs. placebo |
0,0018 |
-- | ||
|
Počet epizod nykturie za den | ||||
|
Vstupní hodnota |
2,5 (1,61) |
2,3 |
2,5 (1,71) |
2,3 |
|
Změna od vstupní hodnoty |
-0,7 (1,40) |
-0,7 |
-0,7 (1,32) |
-0,7 |
|
P-hodnota vs. placebo |
0,1372 |
-- | ||
Během dvojitě zaslepené léčby byl u přípravku Kentera zaznamenán významný pozitivní vliv na kvalitu života podle dotazníku k vyhodnocování vlivu inkontinence na kvalitu života „Incontinence Impact Questionnaire“ (IIQ). Tyto výsledky byly zřejmé po prvním měsíci léčby a přetrvávaly po celou dobu dvojitě zaslepené léčby, jak ukazuje tabulka níže.
|
Skóre |
Kentera (N=389) |
Placebo (N=400) |
P-hodnota (Kentera vs. placebo) |
|
Celkové skóre |
-72,1 (80,01) |
-49,5 (76,59) |
0,0005 |
|
Podstupnice pro cestování |
-20,9 (25,55) |
-15,1 (24,82) |
0,0068 |
|
Podstupnice pro fyzickou aktivitu |
-18,0 (23,23) |
-13,0 (21,68) |
0,0078 |
|
Podstupnice pro společenské vztahy |
-15,2 (20,07) |
-9,7 (19,27) |
0,0019 |
|
Podstupnice pro emocionální zdraví |
-18,1 (21,96) |
-11,8 (20,64) |
0,0002 |
Významný pozitivní vliv byl také zaznamenán pro oblast každé podstupnice dotazníku IIQ a pro šest z deseti oblastí kvality života, včetně oblasti důsledků inkontinence, v dotazníku King’s Health Questionnaire (KHQ), jak je ukázáno v tabulce níže.
|
Oblast |
Kentera (N=389) |
Placebo (N=400) |
P-hodnota (Kentera vs. placebo) |
|
Celkové vnímání zdravotního stavu |
0,4 (12,23) |
0,1 (11,94) |
0,6528 |
|
Důsledky inkontinence |
-27,9 (30,02) |
-21,3 (27,05) |
0,0023 |
|
Závažnost příznaků |
-20,6 (22,90) |
-15,8 (21,84) |
0,0024 |
|
Omezení v každodenních činnostech |
-27,1 (29,24) |
-21,3 (27,16) |
0,0133 |
|
Fyzické omezení |
-20,2 (30,04) |
-16,8 (28,12) |
0,1064 |
|
Sociální omezení |
-11,5 (24,40) |
-10,3 (23,46) |
0,4468 |
|
Osobní vztahy |
-11,2 (24,96) |
-6,2 (19,77) |
0,0489 |
|
Emoce |
-11,7 (24,59) |
-8,4 (24,89) |
0,0649 |
|
Spánek a energie |
-15,6 (24,18) |
-10,3 (22,42) |
0,0061 |
|
Závažnost opatření vyvíjených k vyrovnání se s obtížemi |
-15,3 (21,40) |
-11,1 (19,16) |
0,0058 |
5.2 Farmakokinetické vlastnosti
Absorpce
Přípravek Kentera je formulován pro denní aplikaci a je schopen udržovat terapeutické hladiny oxybutyninu v krvi. Oxybutynin je transportován přes neporušenou kůži a do systémového oběhu pasivní difuzí přes stratum corneum. Po aplikaci přípravku Kentera plazmatická koncentrace oxybutyninu stoupá během přibližně 7 dnů a dosahuje průměrné maximální koncentrace 4 až 5 ng/ml. Rovnovážného stavu je dosaženo po sedmém dni podávání. Rozdíl mezi AUC a Cmax oxybutyninu a jeho aktivního metabolitu N-desethyloxybutyninu po transdermální aplikaci přípravku Kentera v oblasti břicha, nadloktí/ramen a stehen není klinicky relevantní.
Distribuce
Po systémové absorpci je oxybutynin široce distribuován do tělesných tkání. Distribuční objem po intravenózním podání 5 mg hydrochloridu oxybutyninu byl odhadnut na 193 l.
Biotransformace
Perorálně podaný oxybutynin je primárně metabolizován enzymovými systémy cytochromu P450, zejména CYP3A4, který se nachází převážně v játrech a ve střevní stěně. V důsledku genetického polymorfismu se může exprese CYP3A a CYP3A4 lišit až 40krát. Metabolity zahrnují kyselinu fenylcyklohexylglykolovou, která je farmakologicky neaktivní, a N-desethyloxybutynin, který je farmakologicky aktivní. Transdermální podání oxybutyninu se vyhýbá metabolismu prvního průchodu gastrointestinálním traktem a játry, a snižuje tak tvorbu N-desethylového metabolitu.
Exkrece
Oxybutynin je ve velké míře metabolizován v játrech, viz výše; do moči je v nezměněné podobě vylučováno méně než 0,1% podané dávky. Rovněž méně než 0,1% podané dávky je vylučováno jako metabolit N-desethyloxybutynin.
Přenos z osoby na osobu
Potenciál dermálního přenosu oxybutyninu z léčené osoby na osobu neléčenou byl hodnocen ve studii s jednorázovou dávkou, ve které byly subjekty léčené přípravkem Kentera v intenzivním kontaktu s neléčeným partnerem po dobu 15 minut, buď s místem aplikace zakrytým oděvem (N=14 párů) nebo s nezakrytým místem aplikace (N=12 párů). U neléčených partnerů nechráněných oděvem byly prokázány detekovatelné plazmatické koncentrace oxybutyninu (průměrná Cmax = 0,94 ng/ml). Ve skupině s místem aplikace chráněným oděvem byly měřitelné plazmatické koncentrace oxybutyninu (Cmax < 0,1 ng/ml) během 48 hodin po kontaktu s léčenými subjekty zaznamenány u dvou ze 14 neléčených subjektů; u zbývajících 12 neléčených subjektů nebyl oxybutynin detekovatelný.
Vliv sprchování
Vliv sprchování na absorpci oxybutyninu byl hodnocen v randomizované zkřížené studii při rovnovážném stavu za podmínek bez sprchování, nebo se sprchováním za 1, 2 nebo 6 hodin po aplikaci přípravku Kentera (N=20). Výsledky studie naznačují, že sprchování jednu hodinu po aplikaci nemá na celkovou systémovou expozici oxybutyninu vliv.
Používání s opalovacím krémem
Vliv opalovacího krému aplikovaného 30 minut před aplikací přípravku Kentera nebo 30 minut po ní na absorpci oxybutyninu byl hodnocen v randomizované zkřížené studii s jednorázovou dávkou (N=16). Souběžná aplikace opalovacího krému, jak před aplikací přípravku Kentera, tak po ní, neměla žádný vliv na systémovou expozici oxybutyninu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě studií akutní toxicity, toxicity po opakovaném podávání, genotoxicity, kancerogenity a lokální toxicity neodhalily žádné zvláštní riziko pro člověka.
Nežádoucí účinky byly pozorovány ve studiích embryotoxicity u králíka. Při koncentraci 0,4 mg/kg/den oxybutyninu podávaného subkutánně dochází k významnému zvýšení výskytu orgánových anomálií, které je však pozorováno pouze v případě toxicity pro matku. Nicméně jelikož vztah mezi toxicitou pro matku a účinky na embryonální vývoj není znám, význam pro bezpečnost u člověka nelze stanovit. Ve studii fertility u potkanů při subkutánním podání byly u samic zaznamenány poruchy fertility, zatímco u samců nebyly hlášeny žádné účinky, a byla stanovena hodnota NOAEL (No ObservedAdverse EffectLevel, hladina, při níž nejsou pozorovány žádné nežádoucí účinky) 5 mg/kg.
Posouzení rizika pro životní prostředí
Léčivá látka oxybutyninu přetrvává v životním prostředí.
FARMACEUTICKÉ ÚDAJE
6
6.1 Seznam pomocných látek
Ethanol (96%)
Glycerol
Hydroxypropylcelulóza Hydroxid sodný (na úpravu pH)
Čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Chraňte před chladem nebo mrazem. Uchovávejte pumpu ve svislé poloze.
Přípravek Kentera obsahuje alkohol a považuje se za hořlavý a nesmí přijít do styku s otevřeným ohněm.
6.5 Druh obalu a velikost balení
Dávkovací pumpa se skládá ze zevní polypropylenové lahve s vložkou z nízkohustotního polyethylenu (LDPE), polypropylenové dávkovací pumpy, s těsněními z ethylen-propylen-dien monomeru (EPDM), a polypropylenového uzávěru.
Jedna dávkovací pumpa obsahuje nejméně 30 gramů přípravku Kentera a vydá 30 odměřených dávek po 1 gramu.
Přípravek Kentera je balen v krabičce obsahující 1 dávkovací pumpu.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Před prvním použitím je třeba dávkovací pumpu naplnit. Pumpu naplňte opakovaným úplným stlačením pumpovacího mechanismu, dokud se neobjeví gel, poté pumpu ještě jednou stlačte a takto vytlačené množství léčivého přípravku zlikvidujte, aby bylo zajištěno přesné odměření dávky.
Pumpa je nyní naplněna a připravena k použití. Po ukončení kroku naplnění v pumpě zbývá 30 plných dávek. Odměřenou dávku je třeba ihned aplikovat.
Po každém použití vždy pevně nasaďte malý ochranný uzávěr zpět na špičku trysky a velký kryt pumpy na horní část pumpy. Pokud se pumpovací mechanismus během používání vyprázdní (stlačení pumpy nevede k vydání gelu), zopakujte výše popsaný postup, aby se pumpa znovu naplnila.
Okamžitě po aplikaci gelu je třeba si důkladně umýt ruce mýdlem a vodou. Po zaschnutí gelu se doporučuje místo aplikace zakrýt oděvem. Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci.
Prázdná dávkovací pumpa musí být zlikvidována v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/03/270/005 1 dávkovací pumpa
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15/06/2004 Datum posledního prodloužení: 15/06/2009
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY REGISTRACE
A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Nicobrand Limited 189 Castleroe Road,
Coleraine BT51 3RP Northern Ireland
B PODMÍNKY REGISTRACE
• PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ, KLADENÉ NA DRŽITELE ROZHODNUTÍ O REGISTRACI
Výdej léčivého přípravku je vázán na lékařský předpis.
• PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Neuplatňuje se.
• DALŠÍ PODMÍNKY
Systém farmakovigilance:
Držitel rozhodnutí o registraci musí zajistit, aby byl zaveden funkční systém farmakovigilance, tak jak je uveden v Modulu 1.8.1 schválené registrace, předtím, než bude přípravek uveden na trh, a dále po celou dobu, kdy bude přípravek na trhu.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
PAPÍROVÁ KRABIČKA (obsahuje 2, 8 a 24 transdermálních náplastí)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Kentera 3,9 mg/24 hodin, transdermální náplast oxybutyninum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna transdermální náplast uvolňuje 3,9 mg oxybutyninu za 24 hodin. Jedna náplast o ploše 39 cm2 obsahuje 36 mg oxybutyninu.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: triacetin; akrylátová adhezívní látka (obsahující složky 2-ethylhexyl-akrylát; N-vinyl pyrrolidon a polymer hexamethylenglykoldimethakrylátu).
Podklad: polyester/ethylen-vinyl-acetát fólie; fólie ze silikonizovaného polyesteru.
4. LÉKOVÁ FORMA A VELIKOST BALENÍ
2 transdermální náplasti 8 transdermálních náplastí 24 transdermálních náplastí
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze pro transdermální podání.
Nepoužívejte, je-li utěsnění na sáčku porušené.
Aplikujte bezprostředně po vyjmutí ze sáčku.
Před použitím si přečtěte příbalovou informaci.
Ne/St
Po/Čt
Út/Pá
St/So
Čt/Ne
Pá/Po
So/Út
Aplikujte novou náplast Kentera dvakrát týdně (každé 3 až 4 dny).
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí.
8. POUŽITELNOST
EXP:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem nebo mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/03/270/001 <8 transdermálních náplastí> EU/1/03/270/002 <24 transdermálních náplastí> EU/1/03/270/003 <2 transdermální náplasti>
13. ČÍSLO ŠARŽE
Lot:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
kentera
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Kentera 3,9 mg/24 hodin, transdermální náplast oxybutyninum
Pouze pro transdermální podání.
2. ZPŮSOB PODÁNÍ
Aplikujte bezprostředně po vyjmutí ze sáčku.
Před použitím si přečtěte informace v příbalovém letáku.
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
Obsahuje 1 transdermální náplast.
6. JINÉ
Chraňte před chladem nebo mrazem.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (Obsahující 30 sáčků)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Kentera 90,7 mg/g gel v sáčku oxybutyninum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden sáček s 1 gramem gelu obsahuje 90,7 mg oxybutyninum (jako hydrochlorid), což dodává nominální dávku přibližně 4 mg/den.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: ethanol (96%), glycerol, hydroxypropylcelulóza, hydroxid sodný (na úpravu pH) a čištěná voda.
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A VELIKOST BALENÍ
Gel
30 sáčků po 1 gramu.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Aplikujte bezprostředně po otevření.
Před použitím si přečtěte příbalovou informaci. Pouze ke kožnímu podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
Chraňte před chladem nebo mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH
PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/03/270/004 < 30 sáčků >
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
kentera gel
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Kentera 90,7 mg/g gel v sáčku
oxybutyninum
Kožní podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 gram
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITRNÍM OBALU DÁVKOVACÍ PUMPA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Kentera 90,7 mg/g gel v dávkovači pumpě oxybutyninum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna odměřená dávka 1 gramu gelu obsahuje 90,7 mg oxybutyninum (jako hydrochlorid), což dodává nominální dávku přibližně 4 mg/den.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: ethanol (96%), glycerol, hydroxypropylcelulóza, hydroxid sodný (na úpravu pH) a čištěná voda.
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A VELIKOST BALENÍ
Gel
1 dávkovací pumpa o obsahu 30 gramů
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Aplikujte bezprostředně po vytlačení gelu z pumpy. Před použitím si přečtěte příbalovou informaci. Pouze ke kožnímu podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
Chraňte před chladem nebo mrazem. Uchovávejte pumpu ve svislé poloze.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH
PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/03/270/005 < 1 dávkovací pumpa >
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
kentera gel
Kentera 3,9 mg / 24 hodin transdermální náplast
Oxybutynin
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete náplast Kentera používat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li případně další otázky, zeptejte se, prosím, svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako vy.
- Pokud se kterýkoli z nežádoucích účinků vyskytne v závažné míře, nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, prosím, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
V příbalovém letáku naleznete:
1. Co je Kentera a k čemu se používá.
2. Čemu musíte věnovat pozornost, než začnete Kentera užívat.
3. Jak se Kentera užívá.
4. Možné nežádoucí účinky.
5. Jak přípravek Kentera uchovávat.
6. Další informace.
1. CO JE KENTERA A K ČEMU SE POUŽÍVÁ
Kentera se používá u dospělých osob ke kontrole příznaků urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavého nucení na močení.
Kentera působí tím, že umožňuje roztažení močového měchýře, který tak udrží více moči.
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE KENTERA POUŽÍVAT
Neužívejte Kentera:
- Jestliže jste přecitlivělý(á) (alergický(á) na oxybutynin nebo na kteroukoliv další složku Kentera.
- Jestliže trpíte vzácným onemocněním zvaným myasthenia gravis, které vede k tomu, že svaly v těle oslabují a snadno se unavují.
- Pokud trpíte neúplným vyprazdňováním močového měchýře při močení, použití oxybutyninu může tento problém zhoršit. Tuto záležitost musíte projednat se svým lékařem ještě před použitím Kentera.
- Máte-li trávicí obtíže způsobené sníženým vyprazdňováním žaludku po jídle, musíte o tom informovat svého lékaře ještě před použitím Kentera.
- Jestliže trpíte glaukomem nebo se glaukom vyskytoval ve vaší rodině, oznamte to svému lékaři.
Zvláštní opatrnosti při použití Kentera je zapotřebí:
Jestliže trpíte kterýmkoliv z následujících onemocnění:
- poruchami jater
- poruchami ledvin
- potížemi s močením
- ucpáním střev
- krvavými stolicemi
- generalizovanou svalovou slabostí
- bolestí při polykání
Protože léčba oxybutyninem může vést ke sníženému pocení, existuje zvýšené riziko horečky a tepelného šoku, budete-li vystaveni vyšším teplotám prostředí.
Podávání Kentera se nedoporučuje u dětí a mladistvých.
Vzájemné působení s dalšími léčivými přípravky
Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Aplikace náplasti Kentera současně s užíváním léků, které mají podobné nežádoucí účinky, jako např. sucho v ústech, zácpa a ospalost, může zvýšit četnost a závažnost těchto nežádoucích účinků.
Oxybutynin může zpomalit činnost trávicího traktu a tímto ovlivnit vstřebávání jiných perorálních léků, nebo může užívání tohoto léku spolu s jinými léky zvýšit účinek oxybutyninu. Mezi takové léky patří především:
- ketokonazol, itrakonazol nebo flukonazol (užívané k léčbě mykotických infekcí);
- erytromycin, makrolidové antibiotikum (užívané k léčbě bakteriálních infekcí);
- biperiden, levodopa nebo amantadin (užívané k léčbě Parkinsonovy nemoci);
- antihistaminy (užívané k léčbě alergií, jako je např. senná rýma);
- fenothiaziny nebo klozapin (užívané k léčbě duševních onemocnění);
- tricyklická antidepresiva (užívaná k léčbě deprese);
- dipyridamol (užívaný k léčbě poruch srážení krve);
- atropin a další anticholinergní léky (užívané k léčbě poruch zažívacího ústrojí, jakou je např. syndrom dráždivého tračníku).
Užívání Kentera s jídlem a pitím
Oxybutynin může vyvolávat ospalost nebo zamlžené vidění. Ospalost se může zvýšit po požití alkoholu.
Těhotenství a kojení
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Kentera nesmí být podáván v těhotenství, pokud to není nezbytně nutné.
Při užívání oxybutyninu během kojení je malé množství vylučováno do mateřského mléka. Proto se užívání oxybutyninu během kojení nedoporučuje.
Řízení dopravních prostředků a obsluha strojů
Protože Kentera může vyvolat ospalost, spavost nebo zamlžené vidění, mělo by se pacientům doporučit, aby při řízení nebo obsluhování strojů zachovávali opatrnost.
48
3. JAK SE KENTERA UŽÍVÁ
Vždy užívejte Kentera přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Aplikujte novou náplast Kentera dvakrát týdně (každé 3 až 4 dny) podle návodu k použití. Měňte náplast ve dva stejné dny každý týden, například každou neděli a středu nebo každé pondělí a čtvrtek. Na vnitřní straně obalu Kentera naleznete kalendář Kentera, který vám pomůže zapamatovat si časový harmonogram dávkování. Vyznačte si v něm svůj naplánovaný časový harmonogram a nezapomeňte si každý týden měnit náplast vždy ve stejné dva dny, které jste si ve svém kalendáři vybrali. Dbejte na to, abyste měli vždy nalepenu pouze jednu náplast a noste ji trvale, dokud nenastane doba k aplikaci nové náplasti.
Kde náplast aplikovat
Náplast aplikujte na čistou, suchou, hladkou plochu kůže v krajině břišní, na kyčlích nebo na hýždích. Neumisťujte náplast v oblasti pasu, kde by mohlo těsné oblečení náplast uvolnit. Nevystavujte náplast působení slunečních paprsků. Umístěte náplast pod oblečení. Při každém použití střídejte místo aplikace. Neaplikujte náplast na stejné místo na svém těle nejméně po dobu 1 týdne.
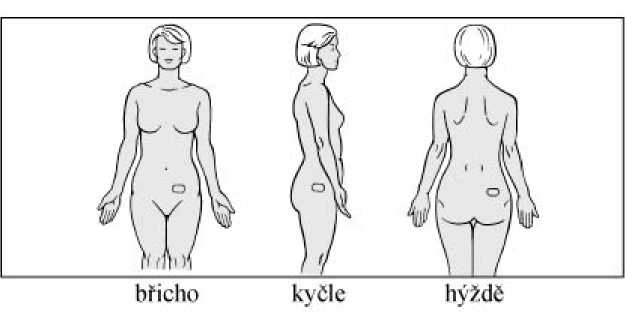
Jak náplast aplikovat
Každá náplast je jednotlivě uzavřena v ochranném sáčku. Přečtěte si, prosím, pozorně celou příbalovou informaci dříve, než začnete Kentera používat.
Použití Kentera:
Krok 1: Vyberte místo pro náplast, které je
- čerstvě omyté, ale suché a studené (po horké koupeli či sprše vyčkejte několik minut).
- zbaveno zbytků tělového pudru, tělového mléka či oleje.
- bez oděrek, vyrážek nebo jakéhokoliv dalšího podráždění kůže.
Krok 2: Otevřete sáček s náplastí
- Roztrhněte sáček podél šipek nakreslených na pravé straně sáčku, jak je zobrazeno na následujícím obrázku.
- Nerozstřihujte sáček nůžkami, mohli byste poškodit náplast uvnitř.
- Vyjměte náplast.
- Okamžitě aplikujte na kůži. Nenechávejte náplast ani ji neskladujte mimo uzavřený sáček.
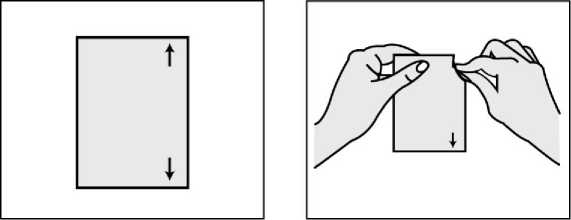
Krok 3: Aplikujte první polovinu náplasti na kůži
- Jemně ohněte náplast a odstraňte první díl ochranné fólie, která pokrývá lepivý povrch náplasti.
- Aniž byste se dotkli lepivého povrchu, pevně přitiskněte náplast přilnavou stranou dolů na tu část břicha, kyčlí nebo hýždí, kterou jste si pro aplikaci zvolili.
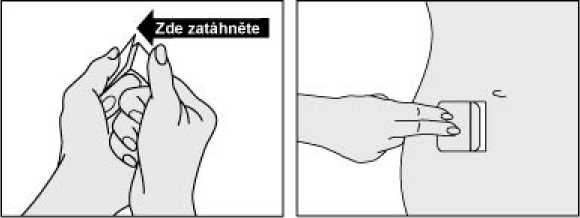
Krok 4: Aplikujte druhou polovinu náplasti na kůži
- Přehněte náplast a pevně zatlačte na ochrannou fólii.
- Mírně vytlačte fólii směrem dopředu, abyste uvolnili okraj.
- Uchopte volný konec v kterémkoliv rohu a sloupněte druhý kus fólie. Snažte se nedotknout lepivého povrchu náplasti.
- Pevně přitlačte konečky prstů celou náplast na kůži. Podržte nejméně 10 sekund, abyste měli jistotu, že náplast zůstane na svém místě. Dbejte na to, aby celá přilnula ke kůži, dokonce i v rozích.
- Vyhoďte ochrannou fólii do odpadu.
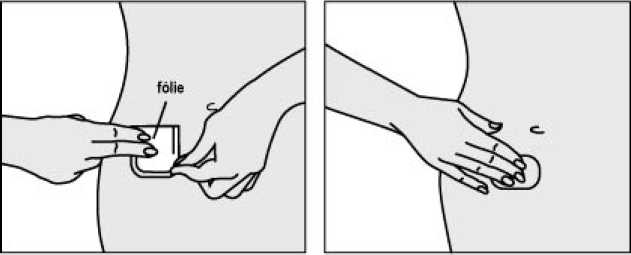
Koupání, sprchování, plavání a cvičení:
Každou náplast musíte nosit po celou dobu, než si nasadíte novou. Koupání, sprchování, plavání ani cvičení by nemělo náplast poškodit, pokud ji nebudete při mytí třít. Nekoupejte se dlouho v horké vodě, náplast by se mohla odlepit.
Jestliže se náplast odlepí:
Jestliže se začne náplast od pokožky odlepovat, přitlačte ji prsty. Náplast je vyrobena tak, aby se znovu přilepila. Velmi zřídka se náplast odlepí úplně. Pokud k tomu dojde, pokuste se přilepit tutéž náplast zpět na stejné místo. Přilepí-li se pevně po celé ploše, ponechte ji tak. Pokud se již nepřilepí, sejměte ji a nasaďte novou náplast na jiné místo. Bez ohledu na to, kdy k odlepení došlo, dodržujte harmonogram výměny po stejné dva dny v týdnu, které jste si vyznačili v kalendáři.
Pokud si zapomenete náplast po 3 - 4 dnech vyměnit:
Jakmile si vzpomenete, odstraňte starou náplast a použijte novou na jiném místě v oblasti břicha, kyčlí nebo hýždí. Bez ohledu na to, kdy k této výměně dojde, dodržte u příští aplikace naplánovaný harmonogram výměny dvakrát týdně, a to i tehdy, budete-li muset aplikovat novou náplast ještě před uplynutím 3 - 4 dnů.
Jak náplast odstranit
Při výměně náplasti odstraňujte starou náplast pomalým pohybem. Přeložte ji napůl (lepivými částmi k sobě) a uložte ji mimo dosah dětí a domácích zvířat. Na místě aplikace se může objevit mírné zarudnutí. Toto zarudnutí by mělo zmizet během několika hodin po odstranění náplasti. Pokud podráždění přetrvává, obraťte se na svého lékaře.
Jemně omyjte místo aplikace teplou vodou a jemným mýdlem, abyste odstranili lepidlo, které zůstane na pokožce po odstranění náplasti. K odstranění jakýchkoliv zbytků můžete rovněž použít malé množství dětského oleje. Místa s lepidlem pokrytým nečistotou můžete odstranit tampóny pro odstraňování lékařského lepidla, které zakoupíte v lékárně. Alkohol nebo jiná silná rozpouštědla mohou způsobit podráždění pokožky, a proto je nepoužívejte.
Po použití obsahuje náplast stále značné množství aktivních látek. Zbývající aktivní látky v náplasti mohou mít škodlivé účinky, pokud se dostanou do vodního prostředí. Proto se po odstranění musí použitá náplast přeložit na polovinu přilnavou stranou dovnitř tak, aby se skryla uvolňovací fólie, vložit do původního sáčku a uložit do odpadu mimo dosah dětí. Jakékoliv použité či nepoužité náplasti se musí uložit do odpadu v souladu s místními předpisy nebo vrátit do lékárny. Použité náplasti nesplachujte do toalety ani je nevyhazujte do zařízení pro čištění tekutých odpadů.
Jestliže jste použila více přípravku Kentera, než jste měl(a)
Pacient by neměl aplikovat více než jednu náplast najednou.
Jestliže jste zapomněl(a) použít přípravek Kentera
Aplikujte náplast Kentera, jakmile jste si uvědomil(a), že náplast nemáte, nebo jestliže jste vynechal(a) plánovaný den aplikace.
Jestliže jste přestal(a) používat přípravek Kentera
Jestliže se rozhodnete přestat náplast používat, je možné, že u Vás dojde k návratu urgentní inkontinence a že se zvýší častost močení. Pokračujte s používáním přípravku Kentera tak dlouho, jak stanoví Váš lékař.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky může mít i Kentera nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Četnost výskytu níže uvedených možných nežádoucích účinků je definována pomocí následující konvence:
- Velmi časté (postihují více než 1 uživatele z 10)
- Časté (postihují 1 až 10 uživatelů ze 100)
- Méně časté (postihují 1 až 10 uživatelů z 1 000)
- Vzácné (postihují 1 až 10 uživatelů z 10 000)
- Velmi vzácné (postihují méně než 1 uživatele z 10 000)
- Není známo (z dostupných údajů nelze určit)
Velmi častý nežádoucí účinek:
- svědění kolem místa aplikace náplasti.
Časté nežádoucí účinky:
- zarudnutí nebo vyrážka v místě aplikace náplasti,
- sucho v ústech,
- zácpa,
- průjem,
- nevolnost žaludku,
- bolest žaludku,
- bolest hlavy nebo ospalost,
- infekce močových cest,
- rozmazané vidění,
- závrať.
Méně časté nežádoucí účinky:
- infekce horních dýchacích cest nebo mykotické infekce,
- palpitace,
- návaly horka,
- bolest zad,
- retence moči,
- potíže při močení,
- běžná rýma,
- náhodné poranění.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. JAK PŘÍPRAVEK KENTERA UCHOVÁVAT
Uchovávejte mimo dosah a dohled dětí.
Přípravek Kentera nepoužívejte po uplynutí doby použitelnosti, uvedené na sáčku a na krabičce. Chraňte před chladem nebo mrazem.
Použité náplasti by měly být přeloženy na polovinu lepivou stranou dovnitř, aby byla zakryta uvolňovací vrstva, vloženy do původního sáčku a zlikvidovány bezpečným způsobem mimo dosah dětí. Všechny použité nebo nepoužité náplasti musí být zlikvidovány v souladu s místními požadavky nebo vráceny do lékárny. Použité náplasti by se neměly splachovat do WC ani vyhazovat do systémů likvidace tekutých odpadů.
6. DALŠÍ INFORMACE Co Kentera obsahuje
Léčivou látkou je oxybutynin. Jedna transdermální náplast uvolňuje 3,9 mg oxybutyninu za 24 hodin. Jedna náplast o ploše 39 cm2 obsahuje 36 mg oxybutyninu.
Pomocnými látkami jsou: každá náplast obsahuje triacetin a akrylový lepící roztok. Průhledná podkladová fólie z PET/EVA je potažena oxybutyninem, triacetinem a akrylovým lepidlem, které jsou poté pokryty krycí fólií ze silikonizovaného polyesteru.
Jak Kentera vypadá a co obsahuje toto balení
Kentera je transdermální náplast a je balena v krabičkách obsahujících 2, 8 a 24 náplastí. Každá náplast sestává z průhledné podkladové fólie potažené farmaceutickými látkami na straně obsahující ochrannou krycí fólii. Tuto krycí fólii je nutno před aplikací náplasti odstranit.
Držitel rozhodnutí o registraci a výrobce
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien Eurocept BV Tél/Tel: +31 (0) 35 528 8377 |
Luxembourg/Luxemburg Eurocept BV Tél/Tel: +31 (0) 35 528 8377 |
|
Btarapnu Nicobrand Limited BenHKo6pHTaHHH (06egnHeHOTO KpancTBo) Ten.: +44 (0) 28 7086 8733 |
Magyarország Nicobrand Limited Nagy-Britannia Tel.: +44 (0) 28 7086 8733 |
|
Česká republika Herbacos Recordati s.r.o. Tel: +420 466 741 915 |
Malta Nicobrand Limited Ir-Renju Unit Tel: +44 (0) 28 7086 8733 |
|
Danmark Orion Pharma A/S Tlf: +45 49 12 66 00 |
Nederland Eurocept BV Tel: +31 (0) 35 528 8377 |
|
Deutschland Recordati Pharma GmbH Tel: +49 (0) 731 7047 0 |
Norge Orion Pharma AS Tlf: +47 40 00 42 10 |
|
Eesti Nicobrand Limited Ůhendkuningriik Tel: +44 (0) 28 7086 8733 |
Osterreich Haemo- Pharma Consult GmbH Tel: +43 (0) 2689 3116 0 |
|
EkkáSa Recordati Hellas Pharmaceuticals A.E. Tr(k: +30 210-6773822 |
Polska Nicobrand Limited Wielka Brytania Tel.: +44 (0) 28 7086 8733 |
|
Espaňa Laboratorios Gebro Pharma, S.A. Tel: +34 93 205 86 86 |
Portugal Jaba Recordati S.A. Tel: +351 21 4329 500 |
|
France Laboratoires BOUCHARA-RECORDATI Tél: +33 (0) 1 45 19 10 00 |
Románia Nicobrand Limited Marea Britanie Tel: +44 (0) 28 7086 8733 |
|
Ireland Recordati Ireland Ltd. Tel: +353 (0) 21 4379400 |
Slovenija Nicobrand Limited Velika Britanija Tel: +44 (0) 28 7086 8733 |
|
Island Nicobrand Limited Bretland Sími: +44 (0) 28 7086 8733 |
Slovenská republika Herbacos Recordati s.r.o. Česká republika Tel: +420 466 741 915 |
|
Italia Innova Pharma S.p.A. Tel: +39 02 48787.1 |
Suomi/Finland Orion Corporation Puh/Tel: +358 10 4261 |
|
Kúnpoq Recordati Hellas Pharmaceuticals A.E. EkkáSa T nk: +30 210-6773822 |
Sverige Orion Pharma AB Tel: +46 8 623 64 40 |
|
Latvija Nicobrand Limited Lielbritánija Tel: +44 (0) 28 7086 8733 |
United Kingdom Orion Pharma (UK) Ltd Tel: +44 (0) 1635 520300 |
|
Lietuva Nicobrand Limited Jungtiné Karalysté Tel: +44 (0) 28 7086 8733 |
Hrvatska Nicobrand Limited Ujedinjeno Kraljevstvo Tel: +44 (0) 28 7086 8733 |
Tato příbalová informace byla naposledy schválena
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury (EMA): http://www.ema.europa.eu
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Kentera 90,7 mg/g gel v sáčku
Oxybutyninum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete přípravek Kentera používat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako Vy.
- Pokud se kterýkoli z nežádoucích účinků vyskytne v závažné míře, nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, prosím, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
V příbalové informaci naleznete:
1. Co je Kentera a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Kentera používat
3. Jak se Kentera používá
4. Možné nežádoucí účinky
5. Jak přípravek Kentera uchovávat
6. Další informace
1. CO JE KENTERA A K ČEMU SE POUŽÍVÁ
Kentera obsahuje léčivou látku oxybutynin a používá se u dospělých osob ke kontrole příznaků urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavého nucení na močení.
Kentera působí tím, že umožňuje roztažení močového měchýře, který tak udrží více moči.
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK KENTERA POUŽÍVAT
Nepoužívejte Kentera
- jestliže jste přecitlivělý/á (alergický/á) na oxybutynin nebo na kteroukoli další složku přípravku Kentera.
- jestliže trpíte vzácným onemocněním zvaným myasthenia gravis, které vede k tomu, že svaly v těle oslabují a snadno se unavují.
- jestliže trpíte glaukomem nebo se glaukom vyskytoval ve Vaší rodině, sdělte to svému lékaři.
- jestliže máte potíže s vyprazdňováním močového měchýře.
- jestliže u Vás nedochází k úplnému vyprázdnění stolice.
Zvláštní opatrnosti při použití přípravku Kentera je zapotřebí
jestliže pro Vás platí cokoli z následujícího:
- poruchy jater;
- poruchy ledvin;
- potíže s močením;
- ucpání střev;
- krev ve stolici;
- generalizovaná svalová slabost;
- bolest při polykání;
- neschopnost vyprázdnit močový měchýř během močení;
- zadržení potravy v žaludku po jídle;
- j ste starší 65 let;
- chronické sucho v ústech vedoucí k onemocnění dásní nebo plísňovým infekcím dutiny ústní;
- onemocnění nervů postihující mimovolní tělesné funkce včetně srdeční frekvence, krevního tlaku, pocení a trávení;
- potíže s pamětí, vyjadřováním nebo schopností přemýšlet;
- progresivní neurologické onemocnění charakterizované třesem svalů v klidu, ztuhlostí, pomalými pohyby, poruchami rovnováhy a šouravou chůzí;
- zvýšená funkce štítné žlázy, což může vést ke zvýšené chuti k jídlu, úbytku tělesné hmotnosti nebo k pocení;
- zúžení krevních cév, které zásobují srdce krví a kyslíkem;
- srdeční potíže, které mohou způsobit dušnost nebo otok kotníků;
- nepravidelný srdeční rytmus;
- zrychlený srdeční rytmus;
- vysoký krevní tlak;
- zbytnění prostaty.
Protože léčba oxybutyninem může vést ke sníženému pocení, existuje zvýšené riziko horečky a tepelného šoku, budete-li vystaven(a) vysokým teplotám prostředí.
Děti a dospívající
Podávání přípravku Kentera dětem a dospívajícím mladším 18 let se nedoporučuje.
Vzájemné působení s dalšími léčivými přípravky
Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Aplikace přípravku Kentera současně s užíváním jiných léků, které mají podobné nežádoucí účinky, jako např. sucho v ústech, zácpu a ospalost, může zvýšit četnost a závažnost těchto nežádoucích účinků.
Oxybutynin může zpomalit činnost trávicího traktu a tímto ovlivnit vstřebávání jiných perorálních léků nebo narušit působení léků na potíže s vyprazdňováním, a užívání tohoto léku spolu s jinými léky může zvýšit účinek oxybutyninu. Mezi takové léky patří především:
- ketokonazol, itrakonazol nebo flukonazol (užívané k léčbě mykotických infekcí);
- erytromycin, makrolidové antibiotikum (užívané k léčbě bakteriálních infekcí);
- biperiden, levodopa nebo amantadin (užívané k léčbě Parkinsonovy nemoci);
- antihistaminika (užívané k léčbě alergií, jako je např. senná rýma);
- fenothiaziny, butyrofenon nebo klozapin (užívané k léčbě duševních onemocnění);
- tricyklická antidepresiva (užívaná k léčbě deprese);
- chinidin (užívaný k léčbě abnormálních srdečních rytmů);
- dipyridamol (užívaný k léčbě poruch srážení krve);
- atropin a další anticholinergní léky (užívané k léčbě poruch zažívacího ústrojí, jako např. syndrom dráždivého tračníku).
Užívání přípravku Kentera s jídlem a pitím
Oxybutynin může vyvolat ospalost nebo rozmazané vidění. Ospalost může být zvýšena po požití alkoholu.
Těhotenství a kojení
Poraďte se se svým lékařem dříve, než začnete užívat jakýkoliv lék.
Pokud jste těhotná, pokud můžete být těhotná, nebo pokud plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete přípravek Kentera používat. Přípravek Kentera byste neměla užívat, jestliže jste těhotná, pokud Vám to nedoporučil Váš lékař.
Jste -li žena v plodném věku, měl by být před užíváním přípravku Kentera proveden těhotenský test. Během používání přípravku Kentera byste měla používat nějakou formu antikoncepce.
Malé množství perorálně podávaného oxybutyninu se vylučuje do mateřského mléka. Proto se užívání oxybutyninu během kojení nedoporučuje.
Při styku s kojícími ženami nebo kojenci zakryjte místa aplikace oděvem.
Řízení dopravních prostředků a obsluha strojů
Kentera může vyvolat ospalost, spavost nebo rozmazané vidění. Buďte zvláště opatrný/á při řízení nebo obsluze strojů.
3. JAK SE KENTERA POUŽÍVÁ
Vždy používejte přípravek Kentera přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Obvyklá dávka přípravku je jeden sáček aplikovaný jednou denně na suchou, neporušenou kůži břicha, nadloktí/ramen nebo stehen, což dodá 4 mg oxybutyninu za 24 hodin.
Důležité: Přípravek Kentera je určen pouze pro aplikaci na kůži. Kentera se nesmí užívat ústy. Zamezte styku s očima, nosem, otevřenými ranami, čerstvě oholenou kůží a kůží s vyrážkou nebo styku s jinými oblastmi, které nejsou pro aplikaci přípravku Kentera schválené.
Krok 1. Místa schválená pro aplikaci přípravku Kentera jsou vyznačena stínováním na Obrázku A. Jsou to břicho, nadloktí/rameno a stehno.
Zvolte místo schválené pro aplikaci přípravku Kentera. Přípravek Kentera aplikujte pouze na neporušenou kůži.
Místa aplikace je třeba střídat. Neaplikujte přípravek Kentera na stejné místo v po sobě následujících dnech. Střídání schválených míst aplikace při každém použití může pomoci snížit riziko vzniku podráždění kůže. Neaplikujte Kentera v oblasti, která pro to není schválená.
Obrázek A:
Krok 2. Před aplikací přípravku Kentera si umyjte ruce mýdlem a vodou.
Krok 3. Omyjte místo, kam se bude Kentera aplikovat, jemným mýdlem a vodou.
Nechte oblast úplně uschnout.
Krok 4. Jemně vtírejte Kentera do pokožky, dokud gel nezaschne.
Jakmile Kentera zaschne, přestaňte jej vtírat. Pokud aplikujete Kentera na břicho, dbejte na to, abyste se vyhnul(a) oblasti kolem pupku. Viz Obrázek B.
Obrázek B:
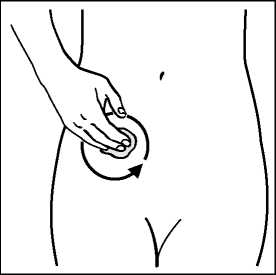
Krok 5. Po aplikaci přípravku Kentera si ihned důkladně umyjte ruce mýdlem a vodou.
Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci.
Po zaschnutí přípravku Kentera můžete místo aplikace zakrýt oděvem.
Jak používat sáčky:
Krok 1. Bezprostředně před použitím sáček roztrhněte v místě zářezu. Viz Obrázek C.
Obrázek C:
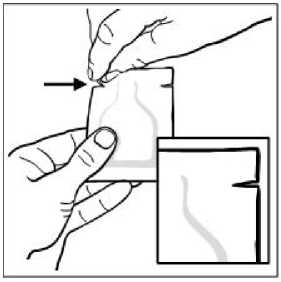
Vytlačte celý obsah sáčku do ruky (do dlaně nebo na špičky prstů) nebo vytlačte přímo na místo aplikace. (Viz Obrázek D.)
Vytlačujte gel ze spodní části sáčku směrem k otevřenému konci. Opakujte, dokud sáček není prázdný. Množství gelu v jednom sáčku bude mít na kůži přibližnou velikost malé mince (o průměru 20 mm).
Obrázek D:
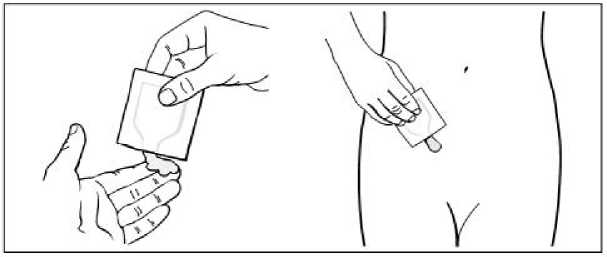
Krok 2. Opatrně otevřený sáček zlikvidujte tak, aby s ním nemohly přijít do styku děti a domácí zvířata.
Jestliže jste použil(a) více přípravku Kentera, než jste měl(a)
Neaplikujte více než jeden sáček během 24 hodin.
Jestliže jste zapomněl(a) použít přípravek Kentera
Aplikujte jednu dávku, jakmile jste si uvědomil(a), že jste vynechal(a) aplikaci.
Jestliže jste přestal(a) používat přípravek Kentera
Jestliže se rozhodnete přestat gel používat, je možné, že u Vás dojde k návratu urgentní inkontinence a že se zvýší frekvence močení. Pokračujte s používáním přípravku Kentera tak dlouho, jak stanoví Váš lékař.
Máte-li jakékoli otázky týkající se užívání tohoto přípravku, poraďte se se svým lékařem nebo lékárníkem.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky, může mít i Kentera nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Četnost výskytu níže uvedených možných nežádoucích účinků je definována pomocí následující konvence:
- Velmi časté (postihují více než 1 uživatele z 10)
- Časté (postihují 1 až 10 uživatelů ze 100)
- Méně časté (postihují 1 až 10 uživatelů z 1 000)
- Vzácné (postihují 1 až 10 uživatelů z 10 000)
- Velmi vzácné (postihují méně než 1 uživatele z 10 000)
- Není známo (z dostupných údajů nelze určit)
Časté nežádoucí účinky
- bolest hlavy
- závrať
- sucho v ústech
- zácpa
- svědění
- svědění, zánět nebo bolest v místě aplikace
Méně časté nežádoucí účinky
- infekce močového měchýře
- nízké hladiny draslíku v krvi, což může vést ke svalové slabosti, záškubům nebo abnormálnímu srdečnímu rytmu
- pocit obav
- spavost, ospalost
- pachuť, změna chuti, abnormální vnímání chuti (tj. kovová chuť v ústech)
- potíže se spaním
- třes
- pocit slepených očí, pocit písku v očích
- pocit závratě nebo točení hlavy
- nepravidelný srdeční rytmus
- rychlý nepravidelný srdeční rytmus
- výrazné zčervenání kůže
- kašel
- zvýšená tvorba sekretu, hlenu
- řídká nebo vodnatá stolice
- nevolnost, pocit na zvracení
- zažívací potíže, pálení žáhy
- zvracení
- otok krevních cév v okolí konečníku
- vyrážka
- suchá kůže
- svědivá vyrážka
- bolest při močení nebo potíže s močením
- krev v moči
- bolest ledvin
- opožděný nebo pomalý nástup močení
- únava, vyčerpání
- otok kotníků, nohou nebo prstů rukou
- pupínky v místě aplikace
- znecitlivění v místě aplikace
- zarudnutí v místě aplikace
- podráždění v místě aplikace
- bolest v místě aplikace
- hnisem naplněné bulky v místě aplikace
- abnormální elektrokardiogram (EKG, vyšetření srdce)
- změny na EKG
- vysoké hladiny chloridů v krvi
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. JAK PŘÍPRAVEK KENTERA UCHOVÁVAT
Uchovávejte mimo dosah a dohled dětí.
Přípravek Kentera nepoužívejte po uplynutí doby použitelnosti, uvedené na sáčku a krabičce za „Použitelné do:“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chraňte před chladem nebo mrazem.
Přípravek Kentera obsahuje alkohol a považuje se za hořlavý. Přípravek by neměl přijít do styku s otevřeným ohněm.
Aplikujte bezprostředně po otevření sáčku. Prázdné sáčky a nepoužitý přípravek zlikvidujte v souladu s místními požadavky.
6. DALŠÍ INFORMACE Co Kentera obsahuje
- Léčivou látkou je oxybutyninum. Jeden sáček s 1 gramem gelu obsahuje 90,7 mg oxybutyninu, což dodává nominální dávku přibližně 4 mg/den.
- Pomocnými látkami jsou: ethanol (96%), glycerol, hydroxypropylcelulóza, hydroxid sodný (na úpravu pH) a čištěná voda.
Jak Kentera vypadá a co obsahuje toto balení
Kentera je rychleschnoucí, čirý, jemný a bezbarvý hydroalkoholový gel bez zápachu, který je balen v sáčku s jednou dávkou. Jeden sáček obsahuje 1 g gelu. Jedna krabička obsahuje 30 sáčků.
Sáček je vyroben z vícevrstvého fóliového laminovaného materiálu na vaky.
Držitel rozhodnutí o registraci a výrobce
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
Tato příbalová informace byla naposledy schválena
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky: http://www.ema.europa.eu
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Kentera 90,7 mg/g gel v dávkovači pumpě
Oxybutyninum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete přípravek Kentera používat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako Vy.
- Pokud se kterýkoli z nežádoucích účinků vyskytne v závažné míře, nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, prosím, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
V příbalové informaci naleznete:
1. Co je Kentera a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Kentera používat
3. Jak se Kentera používá
4. Možné nežádoucí účinky
5. Jak přípravek Kentera uchovávat
6. Další informace
1. CO JE KENTERA A K ČEMU SE POUŽÍVÁ
Kentera obsahuje léčivou látku oxybutynin a používá se u dospělých osob ke kontrole příznaků urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavého nucení na močení.
Kentera působí tím, že umožňuje roztažení močového měchýře, který tak udrží více moči.
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK KENTERA POUŽÍVAT
Nepoužívejte Kentera
- jestliže jste přecitlivělý/á (alergický/á) na oxybutynin nebo na kteroukoli další složku přípravku Kentera.
- jestliže trpíte vzácným onemocněním zvaným myasthenia gravis, které vede k tomu, že svaly v těle oslabují a snadno se unavují.
- jestliže trpíte glaukomem nebo se glaukom vyskytoval ve Vaší rodině, sdělte to svému lékaři.
- jestliže máte potíže s vyprazdňováním močového měchýře.
- jestliže u Vás nedochází k úplnému vyprázdnění stolice.
Zvláštní opatrnosti při použití přípravku Kentera je zapotřebí
jestliže pro Vás platí cokoli z následujícího:
- poruchy jater;
- poruchy ledvin;
- potíže s močením;
- ucpání střev;
- krev ve stolici;
- generalizovaná svalová slabost;
- bolest při polykání;
- neschopnost vyprázdnit močový měchýř během močení;
- zadržení potravy v žaludku po jídle;
- j ste starší 65 let;
- chronické sucho v ústech vedoucí k onemocnění dásní nebo plísňovým infekcím dutiny ústní;
- onemocnění nervů postihující mimovolní tělesné funkce včetně srdeční frekvence, krevního tlaku, pocení a trávení;
- potíže s pamětí, vyjadřováním nebo schopností přemýšlet;
- progresivní neurologické onemocnění charakterizované třesem svalů v klidu, ztuhlostí, pomalými pohyby, poruchami rovnováhy a šouravou chůzí;
- zvýšená funkce štítné žlázy, což může vést ke zvýšené chuti k jídlu, úbytku tělesné hmotnosti nebo k pocení;
- zúžení krevních cév, které zásobují srdce krví a kyslíkem;
- srdeční potíže, které mohou způsobit dušnost nebo otok kotníků;
- nepravidelný srdeční rytmus;
- zrychlený srdeční rytmus;
- vysoký krevní tlak;
- zbytnění prostaty.
Protože léčba oxybutyninem může vést ke sníženému pocení, existuje zvýšené riziko horečky a tepelného šoku, budete-li vystaven(a) vysokým teplotám prostředí.
Děti a dospívající
Podávání přípravku Kentera dětem a dospívajícím mladším 18 let se nedoporučuje.
Vzájemné působení s dalšími léčivými přípravky
Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Aplikace přípravku Kentera současně s užíváním jiných léků, které mají podobné nežádoucí účinky, jako např. sucho v ústech, zácpu a ospalost, může zvýšit četnost a závažnost těchto nežádoucích účinků.
Oxybutynin může zpomalit činnost trávicího traktu a tímto ovlivnit vstřebávání jiných perorálních léků nebo narušit působení léků na potíže s vyprazdňováním, a užívání tohoto léku spolu s jinými léky může zvýšit účinek oxybutyninu. Mezi takové léky patří především:
- ketokonazol, itrakonazol nebo flukonazol (užívané k léčbě mykotických infekcí);
- erytromycin, makrolidové antibiotikum (užívané k léčbě bakteriálních infekcí);
- biperiden, levodopa nebo amantadin (užívané k léčbě Parkinsonovy nemoci);
- antihistaminika (užívané k léčbě alergií, jako je např. senná rýma);
- fenothiaziny, butyrofenon nebo klozapin (užívané k léčbě duševních onemocnění);
- tricyklická antidepresiva (užívaná k léčbě deprese);
- chinidin (užívaný k léčbě abnormálních srdečních rytmů);
- dipyridamol (užívaný k léčbě poruch srážení krve);
- atropin a další anticholinergní léky (užívané k léčbě poruch zažívacího ústrojí, jako např. syndrom dráždivého tračníku).
Užívání přípravku Kentera s jídlem a pitím
Oxybutynin může vyvolat ospalost nebo rozmazané vidění. Ospalost může být zvýšena po požití alkoholu.
Těhotenství a kojení
Poraďte se se svým lékařem dříve, než začnete užívat jakýkoliv lék.
Pokud jste těhotná, pokud můžete být těhotná, nebo pokud plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete přípravek Kentera používat. Přípravek Kentera byste neměla užívat, jestliže jste těhotná, pokud Vám to nedoporučil Váš lékař.
Jste -li žena v plodném věku, měl by být před užíváním přípravku Kentera proveden těhotenský test. Během používání přípravku Kentera byste měla používat nějakou formu antikoncepce.
Malé množství perorálně podávaného oxybutyninu se vylučuje do mateřského mléka. Proto se užívání oxybutyninu během kojení nedoporučuje.
Při styku s kojícími ženami nebo kojenci zakryjte místa aplikace oděvem.
Řízení dopravních prostředků a obsluha strojů
Kentera může vyvolat ospalost, spavost nebo rozmazané vidění. Buďte zvláště opatrný/á při řízení nebo obsluze strojů.
3. JAK SE KENTERA POUŽÍVÁ
Vždy používejte přípravek Kentera přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Obvyklá dávka přípravku je obsah jedné odměřené dávky z dávkovací pumpy aplikovaný jednou denně na suchou, neporušenou kůži břicha, nadloktí/ramen nebo stehen, což dodá 4 mg oxybutyninu za 24 hodin.
Důležité: Přípravek Kentera je určen pouze pro aplikaci na kůži. Kentera se nesmí užívat ústy. Zamezte styku s očima, nosem, otevřenými ranami, čerstvě oholenou kůží a kůží s vyrážkou nebo styku s jinými oblastmi, které nejsou pro aplikaci přípravku Kentera schválené.
Krok 1. Místa schválená pro aplikaci přípravku Kentera jsou vyznačena stínováním na Obrázku A. Jsou to břicho, nadloktí/rameno a stehno.
Zvolte místo schválené pro aplikaci přípravku Kentera. Přípravek Kentera aplikujte pouze na neporušenou kůži.
Místa aplikace je třeba střídat. Neaplikujte přípravek Kentera na stejné místo v po sobě následujících dnech. Střídání schválených míst aplikace při každém použití může pomoci snížit riziko vzniku podráždění kůže. Neaplikujte Kentera v oblasti, která pro to není schválená.
Obrázek A:
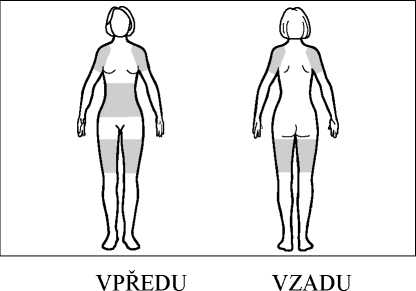
Krok 2. Před aplikací přípravku Kentera si umyjte ruce mýdlem a vodou.
Krok 3. Omyjte místo, kam se bude Kentera aplikovat, jemným mýdlem a vodou.
Nechte oblast úplně uschnout.
Krok 4. Jemně vtírejte Kentera do pokožky, dokud gel nezaschne.
Jakmile Kentera zaschne, přestaňte jej vtírat. Pokud aplikujete Kentera na břicho, dbejte na to, abyste se vyhnul(a) oblasti kolem pupku. Viz Obrázek B.
Obrázek B:
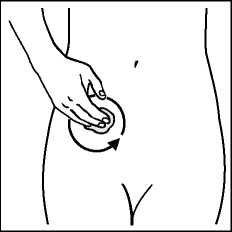
Krok 5. Po aplikaci přípravku Kentera si ihned důkladně umyjte ruce mýdlem a vodou.
Nekoupejte se, neplavte, nesprchujte se, necvičte a neponořujte místo aplikace do vody po dobu jedné hodiny po aplikaci.
Po zaschnutí přípravku Kentera můžete místo aplikace zakrýt oděvem.
Jak používat dávkovací pumpu:
Je důležité, abyste si přečetl(a) a dodržoval(a) tyto pokyny ke správnému používání pumpy Kentera.
Krok 1. Před prvním použitím pumpy Kentera je třeba pumpu naplnit. Pumpu naplňte opakovaným
úplným stlačením pumpovacího mechanismu, dokud se neobjeví gel, poté pumpu ještě jednou stlačte a takto vytlačené množství přípravku zlikvidujte, aby bylo zajištěno přesné odměření dávky. Pumpa je nyní naplněna a připravena k použití. Po ukončení kroku naplnění v pumpě zbývá 30 plných dávek.
Krok 2. Nasměrujte pumpu na ruku (dlaň nebo prsty) nebo přímo na místo aplikace a jednou úplně stlačte. Množství gelu z jednoho stlačení pumpy bude mít na kůži přibližnou velikost malé mince (o průměru 20 mm). Aplikujte podle pokynů výše. Po každém použití vždy pevně nasaďte malý ochranný uzávěr zpět na špičku trysky a velký kryt pumpy na horní část pumpy. Pokud se pumpovací mechanismus během používání vyprázdní (stlačení pumpy nevede k vydání gelu), zopakujte výše popsaný postup, aby se pumpa znovu naplnila. Po 30 dávkách pumpu Kentera zlikvidujte. Pumpu Kentera je třeba vyhodit do domácího odpadu takovým způsobem, aby se zabránilo náhodné aplikaci nebo požití členy domácnosti nebo domácími zvířaty.
Jestliže jste použil(a) více přípravku Kentera, než jste měl(a)
Neaplikujte více než jednu odměřenou dávku během 24 hodin.
Jestliže jste zapomněl(a) použít přípravek Kentera
Aplikujte jednu dávku, jakmile jste si uvědomil(a), že jste vynechal(a) aplikaci.
Jestliže jste přestal(a) používat přípravek Kentera
Jestliže se rozhodnete přestat gel používat, je možné, že u Vás dojde k návratu urgentní inkontinence a že se zvýší frekvence močení. Pokračujte s používáním přípravku Kentera tak dlouho, jak stanoví Váš lékař.
Máte-li jakékoli otázky týkající se užívání tohoto přípravku, poraďte se se svým lékařem nebo lékárníkem.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky, může mít i Kentera nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Četnost výskytu níže uvedených možných nežádoucích účinků je definována pomocí následující konvence:
- Velmi časté (postihují více než 1 uživatele z 10)
- Časté (postihují 1 až 10 uživatelů ze 100)
- Méně časté (postihují 1 až 10 uživatelů z 1 000)
- Vzácné (postihují 1 až 10 uživatelů z 10 000)
- Velmi vzácné (postihují méně než 1 uživatele z 10 000)
- Není známo (z dostupných údajů nelze určit)
Časté nežádoucí účinky
- bolest hlavy
- závrať
- sucho v ústech
- zácpa
- svědění
- svědění, zánět nebo bolest v místě aplikace
Méně časté nežádoucí účinky
- infekce močového měchýře
- nízké hladiny draslíku v krvi, což může vést ke svalové slabosti, záškubům nebo abnormálnímu srdečnímu rytmu
- pocit obav
- spavost, ospalost
- pachuť, změna chuti, abnormální vnímání chuti (tj. kovová chuť v ústech)
- potíže se spaním
- třes
- pocit slepených očí, pocit písku v očích
- pocit závratě nebo točení hlavy
- nepravidelný srdeční rytmus
- rychlý nepravidelný srdeční rytmus
- výrazné zčervenání kůže
- kašel
- zvýšená tvorba sekretu, hlenu
- řídká nebo vodnatá stolice
- nevolnost, pocit na zvracení
- zažívací potíže, pálení žáhy
- zvracení
- otok krevních cév v okolí konečníku
- vyrážka
- suchá kůže
- svědivá vyrážka
- bolest při močení nebo potíže s močením
- krev v moči
- bolest ledvin
- opožděný nebo pomalý nástup močení
- únava, vyčerpání
- otok kotníků, nohou nebo prstů rukou
- pupínky v místě aplikace
- znecitlivění v místě aplikace
- zarudnutí v místě aplikace
- podráždění v místě aplikace
- bolest v místě aplikace
- hnisem naplněné bulky v místě aplikace
- abnormální elektrokardiogram (EKG, vyšetření srdce)
- změny na EKG
- vysoké hladiny chloridů v krvi
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. JAK PŘÍPRAVEK KENTERA UCHOVÁVAT
Uchovávejte mimo dosah a dohled dětí.
Přípravek Kentera nepoužívejte po uplynutí doby použitelnosti, uvedené na dávkovací pumpě a krabičce za „Použitelné do:“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chraňte před chladem nebo mrazem. Uchovávejte pumpu ve svislé poloze.
Přípravek Kentera obsahuje alkohol a považuje se za hořlavý. Přípravek by neměl přijít do styku s otevřeným ohněm.
Aplikujte bezprostředně po vytlačení dávky z dávkovací pumpy. Prázdné dávkovací pumpy zlikvidujte v souladu s místními požadavky.
6. DALŠÍ INFORMACE
Co Kentera obsahuje
- Léčivou látkou je oxybutyninum. Jedna odměřená dávka 1 gramu gelu obsahuje 90,7 mg oxybutyninu, což dodává nominální dávku přibližně 4 mg/den.
- Pomocnými látkami jsou: ethanol (96%), glycerol, hydroxypropylcelulóza, hydroxid sodný (na úpravu pH) a čištěná voda.
Jak Kentera vypadá a co obsahuje tato pumpa
Kentera je rychleschnoucí, čirý, jemný a bezbarvý hydroalkoholový gel bez zápachu, který je balen v dávkovací pumpě. Jedna dávkovací pumpa obsahuje nejméně 30 gramů přípravku Kentera a vydá 30 odměřených dávek po 1 gramu. Jedna krabička obsahuje 1 dávkovací pumpu.
Dávkovací pumpa se skládá ze zevní lahve s vnitřním sáčkem, dávkovací pumpy a uzávěru.
Držitel rozhodnutí o registraci a výrobce
Nicobrand Limited 189 Castleroe Road Coleraine Severní Irsko BT51 3RP
Tato příbalová informace byla naposledy schválena
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky: http://www.ema.europa.eu
70