Izba 30 Mikrogramů/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
IZBA 30 mikrogramů/ml oční kapky, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje 30 mikrogramů travoprostum.
Pomocné látky se známým účinkem:
Jeden ml roztoku obsahuje 7,5 mg propylenglykolu a 2 mg hydrogenricinomakrogolu 2000 (HCO-40) (viz bod 4.4.).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, roztok (oční kapky). Čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Snížení zvýšeného nitroočního tlaku u dospělých pacientů s oční hypertenzí nebo glaukomem s otevřeným úhlem (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Použití u dospělých včetně starší populace
Dávku tvoří jedna kapka travoprostu do spojivkového vaku postiženého oka (postižených očí) jednou denně. Optimálního výsledku se dosahuje při podávání dávky večer.
Doporučuje se použití nasolakrimální okluze nebo zavření očního víčka po podání přípravku. To může snížit systémovou absorpci léčivého přípravku podávaného do oka a vést ke snížení výskytu systémových nežádoucích účinků.
Při použití více než jednoho lokálního očního přípravku je třeba léčivé přípravky podávat s odstupem nejméně 5 minut.
Při vynechání dávky se má v léčbě pokračovat další dávkou podle plánu. Dávka nemá přesáhnout jednu kapku do postiženého oka (očí) denně.
Nahrazuje-li se jiný oční přípravek proti glaukomu léčivým přípravkem IZBA, má se léčba jiným léčivým přípravkem přerušit a léčba přípravkem IZBA zahájit následující den.
Poškození jater a ledvin
S travoprostem 30 ^g/ml nebyly provedeny žádné studie na pacientech s poškozením jater nebo ledvin. Avšak travoprost 40 ^g/ml byl hodnocen na pacientech s mírným až závažným poškozením funkce jater a na pacientech s mírným až závažným poškozením funkce ledvin (clearance kreatininu pouhých 14 ml/min). U těchto pacientů není nutná žádná úprava dávky (viz bod 5.2). Z tohoto důvodu se nepředpokládá nutnost úpravy dávky při nižších koncentracích léčivé látky.
Pediatrická populace
Bezpečnost a účinnost travoprostu u dětí a dospívajících mladších 18 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
K očnímu podání.
Informace pro pacienty používající kontaktní čočky jsou uvedeny v bodě 4.4.
Pacient by měl sejmout ochranný přebal až těsně před prvním použitím. Pokud je po sejmutí víčka bezpečnostní kroužek uvolněný, před použitím léčivého přípravku jej odstraňte. Aby se zabránilo kontaminaci hrotu kapátka a roztoku, je třeba dbát na to, aby se hrot kapátka lahvičky nedotkl očního víčka, okolních tkání nebo jiných povrchů.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Změna barvy oka
Travoprost může postupně měnit barvu oka zvyšováním počtu melanosomů (pigmentových granulí) v melanocytech. Před zahájením léčby musí být pacient informován o možnosti trvalé změny barvy oka. Jednostranná léčba může mít za následek trvalou heterochromii. Dlouhodobé účinky na melanocyty a možné následky nejsou v současné době známy. Ke změně barvy duhovky dochází pomalu a po celé měsíce nebo roky nemusí být patrná. Změna barvy oka byla převážně pozorována u pacientů s duhovkou zbarvenou vícebarevně, např. modrohnědě, šedohnědě, žlutohnědě a zelenohnědě, objevila se však i u pacientů s hnědýma očima. V typickém případě se hnědá pigmentace kolem zornice rozšiřuje u postiženého oka rovnoměrně směrem k periferii, celá duhovka nebo její části však mohou získat nahnědlejší nádech. Po ukončení léčby nebyl pozorován již žádný vzestup hnědého pigmentu duhovky.
Periorbitální změny a změny očního víčka
V kontrolovaných klinických studiích bylo v souvislosti s používáním travoprostu hlášeno u 0,2 % pacientů ztmavnutí kůže kolem oka a/nebo ztmavnutí kůže očního víčka.
U analog prostaglandinu byly pozorovány periorbitální změny a změny víčka zahrnující prohlubování záhybu očního víčka.
Travoprost může postupně měnit oční řasy léčeného oka (očí). Tyto změny byly pozorovány u zhruba poloviny pacientů v klinických studiích a zahrnují: prodloužení, zesílení, zvýšení pigmentace a/nebo počtu řas. Mechanismus změn očních řas a jejich dlouhodobé následky nejsou v současné době známy.
S použitím travoprostu při zánětlivých očních stavech nejsou žádné zkušenosti, stejně jako ani u neovaskulárního glaukomu, glaukomu s uzavřeným či zúženým úhlem nebo vrozeného glaukomu. Pouze omezené jsou zkušenosti při onemocnění oka vyvolaného onemocněním štítné žlázy, u glaukomu s otevřeným úhlem u pseudofakických pacientů a u pigmentového nebo pseudoexfoliativního glaukomu.
Afakičtí pacienti
Při používání travoprostu u afakických pacientů, pseudofakických pacientů s trhlinou v zadním pouzdru čočky nebo s předněkomorovými čočkami, nebo u pacientů se známými rizikovými faktory pro cystoidní makulární otok je třeba postupovat s opatrností.
Iritida/uveitida
U pacientů, u nichž je známo, že disponují rizikovými faktory pro iritidu či uveitidu, se může travoprost používat pouze s opatrností.
Kontakt s kůží
Je nutné zabránit kontaktu travoprostu s kůží, neboť u králíků byla prokázána transdermální absorpce travoprostu.
Prostaglandiny a analoga prostaglandinů j sou biologicky aktivní látky, které mohou být absorbovány kůží. Těhotné ženy nebo ženy, které se pokouší otěhotnět, mají být náležitě opatrné, aby se vyhnuly přímé expozici obsahu lahvičky. Pokud dojde k nežádoucímu kontaktu s větším množstvím obsahu lahvičky, důkladně omyjte okamžitě zasažené místo.
Kontaktní čočky
Pacienti musí být poučeni, aby si před aplikací přípravku IZBA vyjmuli kontaktní čočky a vyčkali po nakapání přípravku 15 minut, než si čočky opět nasadí.
Pomocné látky
Přípravek IZBA obsahuje propylenglykol, který může vyvolávat podráždění kůže.
Přípravek IZBA obsahuje hydrogenricinomakrogol 2000, který může vyvolávat kožní reakce.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku/antikoncepce
Travoprost nesmějí používat ženy ve fertilním věku / ženy, které mohou otěhotnět, pokud nejsou přijata odpovídající antikoncepční opatření (viz bod 5.3).
Travoprost má škodlivé farmakologické účinky na těhotenství a/nebo na plod/novorozence.
Travoprost lze v těhotenství použít pouze tehdy, když je to nezbytně nutné.
Kojení
Není známo, zda se travoprost z očních kapek vylučuje do lidského mateřského mléka. Studie na zvířatech prokázaly vylučování travoprostu a jeho metabolitů do mateřského mléka. Používání travoprostu kojícími ženami se nedoporučuje.
Fertilita
Nejsou k dispozici žádné údaje o účincích travoprostu na lidskou fertilitu. Studie na zvířatech neprokázaly žádný účinek travoprostu na fertilitu při dávkách více než 250krát vyšších než maximální doporučená dávka k očnímu podání u člověka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek IZBA nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Přechodně rozmazané vidění nebo jiné poruchy vidění mohou ovlivnit schopnost řídit nebo obsluhovat stroje. Pokud se po nakapání přípravku objeví rozmazané vidění, musí pacient vyčkat, dokud se vidění neprojasní, a teprve potom může řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
V klinické studii, která trvala 3 měsíce (N = 442), byl přípravek IZBA podáván jako monoterapie. Nejčastěji pozorovaným nežádoucím účinkem byla hyperemie oka (oka nebo spojivky), která byla hlášena u přibližně 12 % pacientů.
Tabulkový přehled nežádoucích účinků
Následující nežádoucí účinky byly vyhodnoceny jako související s monoterapií IZBA a jsou uspořádány podle následující klasifikace: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10 000 až < 1/1000) a velmi vzácné (< 1/10 000).
V každé skupině četnosti v tabulce 1 jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 1: Travoprost 30 pg/ml oční kapky, roztok
|
Třída orgánového systému |
Četnost |
Nežádoucí účinek |
|
Poruchy oka |
Velmi časté |
Oční hyperemie |
|
Časté |
Suché oko, svědění oka, oční diskomfort | |
|
Méně časté |
Keratitis punctata, zánět v přední komoře oční, blefaritida, bolest oka, fotofobie, postižení zraku, rozmazané vidění, konjunktivitida, edém očního víčka, krusty na okraji víčka, sekrece z oka, tmavé kruhy pod očima, růst očních řas, ztluštění očních řas | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Pruritus, vyrážka |
Následující nežádoucí účinky byly vyhodnoceny jako související s přípravkem Travoprost 40 pg/ml oční kapky, roztok (s konzervační látkou BAK nebo Polyquad) a jsou rozděleny podle následující klasifikace: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10 000 až < 1/1000) a velmi vzácné (< 1/10 000) a četnost není známa (z dostupných údajů nelze určit). V každé skupině četnosti v tabulce 2 jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 2: Travoprost 40 pg/ml oční kapky, roztok
|
Třída orgánového systému |
Četnost |
Nežádoucí účinek |
|
Infekce a infestace |
Méně časté |
Herpes simplex, herpetická keratitida |
|
Poruchy imunitního systému |
Méně časté |
Hypersenzitivita, přecitlivělost na lék, sezónní alergie |
|
Poruchy nervového systému |
Časté | |
|
Méně časté |
Dysgeuzie, závratě, poruchy zorného pole | |
|
Poruchy oka |
Velmi časté |
Oční hyperemie, hyperpigmentace duhovky |
|
Časté |
Keratitis punctata, zánět v přední komoře oční, bolest oka, fotofobie, sekrece z oka, oční diskomfort, snížená zraková ostrost, rozmazané vidění, suché oko, svědění oka, zvýšená tvorba slz, erytém očního víčka, edém očního víčka, růst očních řas, změna barvy očních řas | |
|
Méně časté |
Eroze rohovky, uveitida, keratitida, zánět oka, fotopsie, blefaritida, edém spojivky, halo vidění, konjunktivitida, spojivkové váčky, hypestezie oka, meibomianitida, ektropium, pigmentace přední komory oční, mydriáza, katarakta, krusty na okraji víčka, astenopie |
|
Není známo |
Makulární edém, zapadlé oči | |
|
Poruchy ucha a labyrintu |
Není známo |
Vertigo, tinnitus |
|
Srdeční poruchy |
Méně časté |
Nepravidelná srdeční frekvence, palpitace, snížená srdeční frekvence |
|
Není známo |
Bradykardie, tachykardie | |
|
Cévní poruchy |
Méně časté |
Snížený krevní tlak, zvýšený krevní tlak, hypotenze, hypertenze |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté |
Dyspnoe, astma, respirační poruchy, orofaryngeální bolest, kašel, dysfonie, nazální překrvení, podráždění v krku |
|
Není známo |
Zhoršení astmatu | |
|
Gastrointestinální poruchy |
Méně časté |
Exacerbace peptického vředu, sucho v ústech, zažívací potíže, zácpa |
|
Poruchy kůže a podkožní tkáně |
Časté |
Hyperpigmentace kůže (periokulární), kožní diskolorace |
|
Méně časté |
Alergická dermatitida, periorbitální edém, kontaktní dermatitida, erytém, vyrážka, změna barvy vlasů (chlupů), abnormální struktura vlasu, hypertrichóza, madaróza | |
|
Není známo |
Abnormální růst vlasů (chlupů) | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Muskuloskeletální bolest |
|
Celkové poruchy a reakce v místě aplikace |
Méně časté |
Astenie, malátnost |
|
Vyšetření |
Není známo |
Prostatický specifický antigen zvýšený |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Není pravděpodobné lokální předávkování nebo jeho spojení s toxicitou. V případě lokálního předávkování travoprostem lze oko (oči) vypláchnout vlažnou vodou. Při podezření na požití je léčba symptomatická a podpůrná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: oftalmologika; antiglaukomatika a miotika, ATC kód: S01EE04 Mechanismus účinku
Travoprost, analog prostaglandinu F2a, je úplným agonistou, jenž je vysoce selektivní, má vysokou afinitu k receptoru prostaglandinu FP a snižuje nitrooční tlak zvýšením odtoku komorové vody přes trabekulární síť a uveosklerální cesty. Snížení nitroočního tlaku u člověka nastupuje zhruba 2 hodiny po podání a maximálního účinku je dosaženo po 12 hodinách. Významné snížení nitroočního tlaku lze udržet po období přesahující u jedné dávky 24 hodin.
Klinická účinnost a bezpečnost
V klinické studii bylo u pacientů s glaukomem s otevřeným úhlem nebo oční hypertenzí, kteří byli léčeni přípravkem IZBA podávaným jednou denně večer, prokázáno snížení nitroočního tlaku odpovídající přípravku Travoprost 40 pg/ml oční kapky, roztok, při všech návštěvách v rámci léčby ve
všech časových bodech (95% interval spolehlivosti [CI] ±1,0 mmHg). Průměrné snížení nitroočního tlaku (IOP) oproti výchozím hodnotám činilo 7,1 až 8,2 mmHg, jak je uvedeno v tabulce 3. Průměrné procentuální snížení IOP při každé návštěvě a ve všech časových bodech oproti výchozím hodnotám se pohybovalo od 28,4 % do 30,7 %.
Tabulka 3: změna IOP oproti výchozím hodnotám (mmHg) při léčbě přípravkem IZBA
|
Návštěva |
8 hod. |
10 hod. |
16 hod. | |
|
Týden 2 |
Průměrná hodnota |
-8,0 |
-7,3 |
-7,1 |
|
(N = 442) |
95% CI |
(-8,3; -7,7) |
(-7,6; -7,0) |
(-7,4; -6,8) |
|
Týden 6 |
Průměrná hodnota |
-8,1 |
-7,4 |
-7,2 |
|
(N = 440*) |
95% CI |
(-8,4; -7,9) |
(-7,6; -7,1) |
(-7,5; -6,9) |
|
Měsíc 3 |
Průměrná hodnota |
-8,2 |
-7,5 |
-7,1 |
|
(N = 432*) |
95% CI |
(-8,6; -7,9) |
(-7,9; -7,2) |
(-7,4; -6,8) |
*U jednoho subjektu chybí údaje v 8 hod. v týdnu 6. U dalšího subjektu chybí údaje v 16 hod. v měsíci 3.
Zlepšení bezpečnostního profilu bylo pozorováno u přípravku IZBA v porovnání s přípravkem Travoprost 40 pg/ml oční kapky, roztok, dostupném na trhu (s konzervační látkou benzalkonium-chlorid nebo polykvadium-chlorid). Nejčastějším nežádoucím účinkem souvisejícím s podáváním přípravku IZBA i Travoprost 40 pg/ml oční kapky, roztok, je hyperemie. Hyperemie (oka nebo spojivky) byla pozorována u 11,8 % pacientů (N = 442) léčených přípravkem IZBA v porovnání s 14,5 % pacientů léčených přípravkem Travoprost 40 pg/ml oční kapky, roztok, s konzervační látkou benzalkonium-chlorid.
Sekundární farmakologie
Travoprost významně zvyšoval krevní zásobení slepé skvrny u králíků po sedmidenním lokálním očním podávání (1,4 mikrogramu, jednou denně).
Travoprost 40 pg/ml oční kapky, roztok, s konzervační látkou polykvadium-chlorid má minimální toxické účinky na povrchové vrstvy oka v porovnání s očními kapkami s konzervační látkou benzalkonium-chlorid na kultivovaných buňkách lidské rohovky a při lokálním očním podání králíkům.
5.2 Farmakokinetické vlastnosti
Absorpce
Travoprost je esterové proléčivo. Absorbuje se přes rohovku, kde se izopropylester hydrolyzuje na aktivní volnou kyselinu. Studie na králících prokázaly vrcholové koncentrace 20 ng/g volné kyseliny v komorové vodě jednu až dvě hodiny po lokálním podání přípravku Travoprost 40 pg/ml oční kapky, roztok. Koncentrace v komorové vodě klesaly s poločasem přibližně 1,5 hodiny.
Distribuce
Po lokálním očním podání přípravku Travoprost 40 pg/ml oční kapky, roztok, zdravým dobrovolníkům byla prokázána nízká systémová expozice aktivní volnou kyselinou. Nejvyšší koncentrace aktivní volné kyseliny v plazmě ve výši 25 pg/ml nebo méně byla pozorována v době od 10 do 30 minut po podání dávky. Poté plazmatické hladiny rychle klesaly na hodnoty pod kvantitativním limitem analýzy 10 pg/ml dříve než jednu hodinu po podání. Vzhledem k nízkým koncentracím v plazmě a rychlé eliminaci po lokálním podání nemohl být poločas eliminace aktivní volné kyseliny u člověka stanoven.
Biotransformace
Metabolismus je hlavní cestou eliminace jak travoprostu, tak aktivní volné kyseliny. Systémové metabolické cesty jsou paralelní s cestami endogenního prostaglandinu F2a, jež jsou charakterizovány
7
redukcí dvojité vazby C13-C14, oxidací 15-hydroxylu a P-oxidativním štěpením horního postranního řetězce.
Eliminace
Volná kyselina travoprostu a její metabolity se vylučují převážně ledvinami. Studie s přípravkem Travoprost 40 pg/ml oční kapky, roztok, byly prováděny u pacientů s mírným až závažným poškozením jater a u pacientů s mírným až závažným poškozením ledvin (clearance kreatininu pouze 14 ml/min). U těchto pacientů není nutná žádná úprava dávky.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie oční toxicity na opicích prokázaly, že podávání travoprostu v dávce 0,45 mikrogramů dvakrát denně rozšiřuje oční štěrbinu. Lokální oční podávání travoprostu opicím v koncentracích až 0,012 % do pravého oka dvakrát denně po dobu jednoho roku nevykázalo žádnou systémovou toxicitu.
Rozšíření oční štěrbiny pozorované u opic nebylo zjištěno u králíků ani v klinických studiích s přípravky obsahujícími travoprost a je považováno za druhově specifické.
Na potkanech, myších a králících byly provedeny studie reprodukční toxicity po systémovém podání. Výsledky jsou spojeny s agonistickým účinkem na receptor FP v děloze s časnou embryoletalitou, postimplantační ztrátou, fetotoxicitou. U březích potkaních samic mělo systémové podání travoprostu v průběhu organogeneze v dávkách převyšujících více než 200krát klinickou dávku za následek zvýšenou incidenci malformací. V plodové vodě a tkáních plodu březích potkaních samic, jimž byl podán travoprost značený 3H, byly naměřeny nízké hladiny radioaktivity. Reprodukční a vývojové studie prokázaly silný účinek na ztrátu plodu s vysokou četností u potkanů a myší (180 pg/ml, resp.
30 pg/ml plazmy) při expozicích 1,2 až 6krát převyšujících klinickou expozici (až 25 pg/ml).
Údaje pro vyhodnocení potenciálního vlivu na životní prostředí jsou v současné době omezené.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Polykvadium-chlorid Hydrogenricinomakrogol 2000 (HCO-40)
Kyselina boritá (E284)
Mannitol (E421)
Chlorid sodný Propylenglykol (E1520)
Hydroxid sodný a/nebo kyselina chlorovodíková (pro úpravu pH)
Čištěná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Zlikvidujte 4 týdny po prvním otevření.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Přípravek IZBA je balen v 4 ml oválné lahvičce ze syndiotaktického polypropylenu (sPP) s kapací zátkou a uzávěrem z polypropylenu (PP), opatřenou přebalem. Jedna 4 ml lahvička obsahuje 2,5 ml roztoku.
Krabička obsahuje 1 nebo 3 lahvičky.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley, Camberley, Surrey GU16 7SR
Velká Británie
8. REGISTRAČNÍ ČÍSLA
EU/1/13/905/001 -002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
S.A. Alcon Couvreur N.V.
Rijksweg 14 B-2870 Puurs Belgie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
KRABIČKA PRO JEDNU LAHVIČKU 4,0 ml + KRABIČKA PRO 3 LAHVIČKY 4,0 ml
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
IZBA 30 mikrogramů/ml oční kapky, roztok travoprostum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 ml roztoku obsahuje 30 mikrogramů travoprostu.
3. SEZNAM POMOCNÝCH LÁTEK
Polykvadium-chlorid, hydrogenricinomakrogol 2000 (HCO-40), kyselina boritá, mannitol, chlorid sodný, propylenglykol, hydroxid sodný a/nebo kyselina chlorovodíková (k úpravě pH) a čištěná voda.
Podrobnější informace naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok. 1 lahvička 2,5 ml 3 lahvičky 2,5 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. K očnímu podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Zlikvidujte 4 týdny po prvním otevření.
Otevřeno:
Otevřeno (1) Otevřeno (2) Otevřeno (3)
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley, Camberley, Surrey GU16 7SR
Velká Británie
12. REGISTRAČNÍ ČÍSLA
EU/1/13/905/001 1 x 4,0 ml EU/1/13/905/002 3 x 4,0 ml
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
IZBA
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK LAHVIČKY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
IZBA 30 mikrogramů/ml oční kapky travoprostum
K očnímu podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2,5 ml
6. JINÉ
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU PŘEBAL
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
IZBA 30 mikrogramů/ml oční kapky, roztok travoprostum
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP
Zlikvidujte 4 týdny po prvním otevření.
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2,5 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
IZBA 30 mikrogramů/ml oční kapky, roztok
travoprostum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek IZBA a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek IZBA používat
3. Jak se přípravek IZBA používá
4. Možné nežádoucí účinky
5. Jak přípravek IZBA uchovávat
6. Obsah balení a další informace
1. Co je přípravek IZBA a k čemu se používá
Přípravek IZBA obsahuje travoprost, jeden ze skupiny léků zvaných analoga prostaglandinů. Přípravek IZBA se používá ke snížení vysokého nitroočního tlaku u dospělých pacientů. Takový tlak může vést k onemocnění, kterému se říká glaukom (zelený oční zákal).
2. Čemu musíte věnovat pozornost, než začnete přípravek IZBA používat Nepoužívejte přípravek IZBA
• jestliže jste alergický(á) na travoprost nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud se Vás to týká, poraďte se se svým lékařem.
Upozornění a opatření
• Přípravek IZBA může zvětšovat délku, tloušťku, barvu a/nebo počet řas. Rovněž byly pozorovány změny na očních víčkách, včetně růstu neobvyklého ochlupení, nebo na tkáních v blízkosti očí.
Přípravek IZBA může postupně změnit barvu duhovky (barevné části oka). Tato změna může být trvalá.
Jestliže jste podstoupil(a) operaci šedého zákalu, před použitím přípravku IZBA se poraďte se svým lékařem.
• Jestliže máte nebo jste dříve prodělal(a) zánět oka (iritida a uveitida), před použitím přípravku IZBA se poraďte se svým lékařem.
• Travoprost se může vstřebávat přes kůži. Jestliže se léčivý přípravek dostane do kontaktu
s kůží, je třeba kůži okamžitě omýt. To je důležité především u těhotných žen nebo u žen, které se pokouší otěhotnět.
• Jestliže nosíte měkké kontaktní čočky, nepoužívejte kapky, pokud máte čočky nasazené. Po použití kapek vyčkejte 15 minut, než si čočky opět nasadíte.
Před použitím přípravku IZBA se poraďte se svým lékařem nebo lékárníkem.
Děti a dospívající
Použití přípravku IZBA se nedoporučuje u pacientů mladších 18 let. Pokud se Vás to týká, poraďte se se svým lékařem.
Další léčivé přípravky a přípravek IZBA
Informujte svého lékaře nebo lékárníka o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat.
Těhotenství a kojení
Nepoužívejte přípravek IZBA, jestliže jste těhotná. Pokud se domníváte, že můžete být těhotná, poraďte se ihned se svým lékařem. Jestliže byste mohla otěhotnět, musíte během používání přípravku IZBA používat vhodnou antikoncepci.
Nepoužívejte přípravek IZBA, jestliže kojíte. Přípravek IZBA může přecházet do Vašeho mateřského mléka.
Řízení dopravních prostředků a obsluha strojů
Můžete zjistit, že Vaše vidění je po použití přípravku IZBA po určitou dobu rozmazané. Neřiďte a neobsluhujte stroje, dokud tento účinek neodezní.
Přípravek IZBA obsahuje hydrogenricinomakrogol a propylenglykol. Tyto látky mohou způsobovat kožní reakce a podráždění.
3. Jak se přípravek IZBA používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku je
Jedna kapka do postiženého oka nebo postižených očí jednou denně večer.
Přípravek IZBA podávejte do obou očí pouze v případě, že Vám to řekl Váš lékař. Přípravek používejte tak dlouho, jak určil Váš lékař.
Přípravek IZBA lze používat pouze jako oční kapky.
1
2
3
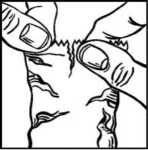
• Bezprostředně před prvním použitím lahvičky roztrhněte přebal, vyjměte z něj lahvičku (obrázek 1) a na vyznačené místo na krabičce si zapište datum otevření.
• Umyjte si ruce.
• Odšroubujte uzávěr.
• Pokud je po sejmutí uzávěru bezpečnostní kroužek uvolněný, před použitím přípravku jej odstraňte.
• Držte lahvičku mezi palcem a prsty dnem vzhůru.
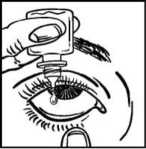
• Zakloňte hlavu. Čistým prstem si stáhněte oční víčko tak, aby se mezi očním víčkem a okem vytvořila „kapsa“, do které budete aplikovat kapku přípravku (obrázek 2).
• Přibližte se hrotem lahvičky k oku. V případě potřeby použijte zrcadlo.
• Nedotýkejte se kapátkem svého oka ani očního víčka, okolních oblastí či jiných povrchů. Mohlo by dojít ke kontaminaci kapek.
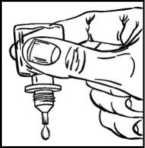
• Jemným zmáčknutím lahvičky vytlačte vždy jen jednu kapku přípravku IZBA (obrázek 3).
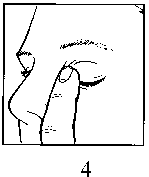
• Po podání přípravku IZBA ponechte oční víčko zavřené a prstem jemně přitlačte do koutku oka u kořene nosu (obrázek 4) a podržte nejméně 1 minutu. Tím můžete zabránit, aby se přípravek IZBA dostal do jiných částí těla.
• Jestliže používáte kapky do obou očí, opakujte postup u druhého oka.
• Ihned po použití lahvičku pevně uzavřete uzávěrem.
• Vždy používejte pouze jednu lahvičku. Neotvírejte přebal dříve, než budete potřebovat lahvičku použít.
Jestliže kapka dopadne mimo Vaše oko, zkuste to znovu.
Jestliže používáte další oční přípravky, jako jsou oční kapky nebo oční mast, počkejte alespoň 5 minut mezi užitím IZBA a dalších očních přípravků.
Jestliže jste použil(a) více přípravku IZBA, než jste měl(a)
Vypláchněte veškerý přípravek teplou vodou. Nepodávejte žádné další kapky, dokud nenastane doba pro Vaši další pravidelnou dávku.
Jestliže jste zapomněl(a) použít přípravek IZBA
Pokračujte další plánovanou dávkou. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku. Nikdy nepoužívejte více než jednu kapku do postiženého oka (očí) za jeden den.
Jestliže jste přestal(a) používat přípravek IZBA
Než přestanete používat přípravek IZBA, nejprve se poraďte se svým lékařem, neboť nekontrolovaný nitrooční tlak by mohl vést ke ztrátě zraku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
U přípravku IZBA byly pozorovány následující nežádoucí účinky:
Velmi časté nežádoucí účinky: mohou postihnout více než 1 osobu z 10
Účinky na oko: zarudlé oko.
Časté nežádoucí účinky: mohou postihnout až 1 osobu z 10
Účinky na oko: nepříjemný pocit v oku, svědící oko a suché oko.
Méně časté nežádoucí účinky: mohou postihnout až 1 osobu ze 100
Účinky na oko: zánět uvnitř oka, zánět na povrchu oka s poškozením nebo bez poškození jeho povrchu, zánět očních víček, zánět spojivek, bolest oka, citlivost na světlo, rozmazané nebo abnormální vidění, otok nebo krusty na očních víčkách, výtok z oka, tmavnutí kůže v okolí oka (očí), růst a změny struktury očních řas.
Celkové nežádoucí účinky: vyrážka nebo svědění kůže.
U jiného silnějšího léku obsahujícího travoprost (40 mikrogramů/ml) byly navíc pozorovány následující nežádoucí účinky:
Velmi časté nežádoucí účinky: mohou postihnout více než 1 osobu z 10
Účinky na oko: zarudlé oko, změna barvy duhovky (barevné části oka).
Časté nežádoucí účinky: mohou postihnout až 1 osobu z 10
Účinky na oko: zánět uvnitř oka, bolest oka, zánět na povrchu oka s poškozením nebo bez poškození jeho povrchu, nepříjemný pocit v oku, výtok z oka, citlivost na světlo, rozmazané nebo abnormální vidění, suché oko, svědění oka, zvýšená tvorba slz, zarudnutí očního víčka, otok očního víčka; změna barvy očních řas, růst očních řas, tmavnutí nebo změna barvy kůže v okolí oka (očí).
Celkové nežádoucí účinky: bolest hlavy.
Méně časté nežádoucí účinky: mohou postihnout až 1 osobu ze 100
Účinky na oko: poškozená rohovka, zánět oka, vnímání blikajícího světla, zánět na povrchu oka s poškozením nebo bez poškození jeho povrchu, zánět očního víčka, otok oka, zánět nebo infekce spojivky, halo vidění, snížení citlivosti oka, pigmentace v oku, šedý zákal, krusty na očních víčkách, unavené oči, zvětšené zornice, abnormální ochablost spodního očního víčka, ztráta očních řas, oční virová infekce.
Celkové nežádoucí účinky: astma, dýchavičnost, zvýšený nebo snížený krevní tlak, nepravidelná, zvýšená nebo snížená srdeční frekvence, závrať, kašel, celková tělesná slabost, zvýšené alergické příznaky, podráždění v krku, ucpaný nos, gastrointestinální diskomfort (nepříjemné pocity při zažívání) nebo vředy, suchá ústa, zácpa, zarudnutí nebo svědění kůže, vyrážka, nadměrný růst nebo změny v barvě nebo struktuře vlasů (chlupů) v okolí oka (očí), bolest svalů, nepříjemná chuť.
Není známo: četnost nelze z dostupných údajů určit
Účinky na oko: zánět v zadní části oka, zapadlé oči.
Celkové nežádoucí účinky: zhoršení astmatu, abnormální růst vlasů (chlupů), zvonění v uších, zvýšený prostatický antigen.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek IZBA uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte přípravek IZBA po uplynutí doby použitelnosti uvedené na lahvičce a krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Lahvičku musíte zlikvidovat 4 týdny po prvním otevření z důvodu rizika kontaminace. Následně použijte novou lahvičku. Na vyznačené místo na krabičce si zapište datum otevření.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek IZBA obsahuje
Léčivou látkou je travoprost. Jeden ml roztoku obsahuje 30 mikrogramů travoprostu.
Dalšími složkami jsou: polykvadium-chlorid, hydrogenricinomakrogol 2000, propylenglykol (viz závěr bodu 2), chlorid sodný, kyselina boritá, mannitol a čištěná voda. Přípravek dále obsahuje malé množství kyseliny chlorovodíkové nebo hydroxidu sodného za účelem udržení normální kyselosti (hodnoty pH).
Jak přípravek IZBA vypadá a co obsahuje toto balení
Přípravek IZBA oční kapky je kapalina (čirý bezbarvý roztok) a prodává se v 4 ml plastových lahvičkách se šroubovacím uzávěrem. Jedna lahvička obsahuje 2,5 ml očních kapek s travoprostem a každá lahvička je opatřena přebalem.
Velikost balení: 1 nebo 3 lahvičky.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley, Camberley Surrey, GU16 7SR Velká Británie
Výrobce
S.A. Alcon-Couvreur N.V. Rijksweg 14 B-2870 Puurs Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Latvija
Alcon Pharmaceuticals Ltd ® + 371 67 321 121
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV
@ + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien)
Eunrapna
Aukoh Eunrapna EOOfl ® + 359 2 950 15 65
Lietuva
Alcon Pharmaceuticals Ltd atstovybé
® + 370 5 2 314 756
|
Česká republika |
Magyarország |
|
Alcon Pharmaceuticals |
Alcon Hungária |
|
(Czech Republic) s.r.o. |
Gyógyszerkereskedelmi Kft |
|
® + 420 225 775 111 |
® + 36-1-463-9080 |
|
Danmark |
Nederland |
|
Alcon Nordic A/S |
Alcon Nederland BV |
|
® + 45 3636 4300 |
® + 31 (0) 183 654321 |
|
Deutschland |
Norge |
|
Alcon Pharma GmbH |
Alcon Nordic A/S |
|
® + 49 (0)761 1304-0 |
® + 45 3636 4300 |
|
EAAáSa/Kónpog |
Osterreich |
|
A^kov Aapnopáxoprg |
Alcon Ophthalmika GmbH |
|
EAAág AEBE ® + 30 210 68 78 300 (EMá5a) |
® + 43 (0)1 596 69 70 |
|
Eesti |
Polska |
|
Alcon Pharmaceuticals Ltd. Eesti filiaal |
Alcon Polska Sp. z o.o. |
|
® + 372 6 313 214 |
® + 48 22 820 3450 |
|
Espana |
Portugal |
|
Alcon Cusí, S.A. |
Alcon Portugal - |
|
® + 34 93 497 7000 |
Produtos e Equipamentos Oftalmológicos, Lda. ® + 351 214 400 300 |
|
France |
Romania |
|
Laboratoires Alcon |
S.C. Alcon Romania S.R.L. |
|
® + 33 (0)1 47 10 47 10 |
® + 40 21 203 93 24 |
|
Hrvatska |
Slovenija |
|
Alcon Farmaceutika d.o.o. |
Alcon d.o.o. |
|
® + 385 1 4611 988 |
® + 386 1 422 5280 |
|
Ireland |
Slovenská republika |
|
Malta |
Alcon Pharmaceuticals Ltd., o.z |
|
United Kingdom Alcon Laboratories (UK) Ltd ® + 44 (0) 871 376 1402 (United Kingdom) |
® + 421 2 5441 0378 |
|
Island |
Suomi/Finland |
|
Alcon Nordic A/S |
Alcon Nordic A/S |
|
® + 45 3636 4300 |
® + 45 3636 4300 |
|
Italia |
Sverige |
|
Alcon Italia S.p.A. |
Alcon Nordic A/S |
|
® + 39 02 81 80 31 |
® + 45 3636 4300 |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
24