Ixiaro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
IXIARO injekční suspenze
Vakcína proti japonské encefalitidě (inaktivovaná, adsorbovaná)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny IXIARO obsahuje:
vaccinum encephalitidis japonicae inactivatum (virus japonské encefalitidy kmen SA14-14-2 (inaktivovaný)1,2) 6 AU3 odpovídá síle < 460 ng ED50
1 Produkovaný v buňkách Vero.
2 Adsorbováno na hydratovaný hydroxid hlinitý (přibližně 0,25 miligramu Al3+).
3 Jednotek antigenu.
Pomocné látky se známým účinkem:
Tento přípravek obsahuje méně než 1 mmol draslíku v jedné dávce a méně než 1 mmol sodíku v jedné dávce.
Fyziologický roztok pufrovaný fosfátem 0,0067 M (ve formě PO4) má následující složení:
NaCl - 9 mg/ml KH2PO4 - 0,144 mg/ml Na2HPO4 - 0,795 mg/ml
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
Čirá tekutina s bílým precipitátem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek IXIARO je určen k aktivní imunizaci proti japonské encefalitidě u dospělých, dospívajících, dětí a kojenců ve věku od 2 měsíců.
Použití vakcíny IXIARO by mělo být zváženo také u jedinců s rizikem expozice během cestování nebo při zaměstnání.
4.2 Dávkování a způsob podání
Dávkování
Dospělí (ve věku 18-65 let)
Základní vakcinační cyklus sestává ze dvou samostatných 0,5ml dávek podaných podle následujícího konvenčního schématu:
První dávka v den 0.
Druhá dávka: 28 dní po první dávce.
Zrychlené schéma
Osoby ve věku 18-65 let mohou být vakcinovány pomocí následujícího zrychleného schématu:
První dávka v den 0.
Druhá dávka: 7 dní po první dávce.
U obou schémat je nutné dokončit primární imunizaci nejméně jeden týden před potenciální expozicí viru japonské encefalitidy (JEV) (viz bod 4.4).
Doporučuje se, aby osoby, kterým byla podána první dávka vakcíny IXIARO, dokončily primární 2dávkový očkovací cyklus vakcínou IXIARO.
Pokud není primární imunizace dvěma injekcemi dokončena, nemusí být zajištěna plná ochrana před onemocněním. Existují údaje o tom, že druhá injekce podaná do 11 měsíců po první dávce vede k vysoké míře sérokonverze (viz bod 5.1).
Posilovací (booster) dávka
Posilovací dávka (třetí dávka) by se měla podat během druhého roku (tzn. 12 - 24 měsíců) po primární imunizaci, před potenciální novou expozicí JEV.
Osoby vystavené trvalému riziku nákazy japonskou encefalitidou (laboratorní personál nebo osoby pobývající v endemických oblastech) by měly dostávat posilovací dávku za 12 měsíců po primární imunizaci (viz bod 5.1).
Dle údajů k dlouhodobé séroprotekci po první posilovací (booster) dávce podané 12-24 měsíců po primární imunizaci je třeba druhou posilovací dávku podat 10 let po první posilovací dávce před potenciální expozicí JEV.
Starší osoby (ve věku > 65 let)
Základní vakcinační cyklus sestává ze dvou samostatných 0,5ml dávek podaných podle následujícího konvenčního schématu:
První dávka v den 0.
Druhá dávka: 28 dní po první dávce.
Primární imunizaci je nutné dokončit nejméně jeden týden před potenciální expozicí viru japonské encefalitidy (JEV) (viz bod 4.4).
Doporučuje se, aby osoby, kterým byla podána první dávka vakcíny IXIARO, dokončily primární 2dávkový očkovací cyklus vakcínou IXIARO.
Pokud není primární imunizace dvěma injekcemi dokončena, nemusí být zajištěna plná ochrana před onemocněním. Existují údaje o tom, že druhá injekce podaná do 11 měsíců po první dávce vede k vysoké míře sérokonverze (viz bod 5.1).
Posilovací (booster) dávka
Stejně jako u mnoha jiných vakcín je imunitní odpověď na vakcínu IXIARO u starších osob nižší než u mladších dospělých. Doba trvání ochrany je u starších osob nejistá, proto je před každou další expozicí viru JE třeba zvážit posilovací dávku (tj. třetí dávku). Dlouhodobá séroprotekce po posilovací dávce je neznámá.
Pediatrická populace
Děti a dospívající ve věku od 3 do < 18 let
Základní vakcinační cyklus sestává ze dvou samostatných 0,5ml dávek podaných podle tohoto schématu: První dávka v den 0.
Druhá dávka: 28 dní po první dávce.
Děti ve věku od 2 měsíců do < 3 let
Základní vakcinační cyklus sestává ze dvou samostatných 0,25ml dávek podaných podle tohoto schématu: První dávka v den 0.
Druhá dávka: 28 dní po první dávce.
Pokyny k přípravě 0,25ml dávky pro děti ve věku od 2 měsíců do < 3 let viz bod 6.6.
Doporučuje se, aby osoby, kterým byla podána první dávka vakcíny IXIARO, dokončily primární 2dávkový očkovací cyklus vakcínou IXIARO.
Posilovači (booster) dávka (děti a dospívající)
Posilovači dávka (třetí dávka) by se měla podat během druhého roku (tzn. 12-24 měsíců) po primární imunizaci, před potenciální novou expozicí JEV.
Děti a dospívající vystavení trvalému riziku nákazy japonskou encefalitidou (pobývající v endemických oblastech) by měli dostávat posilovací dávku za 12 měsíců po primární imunizaci (viz bod 5.1).
Děti a dospívající ve věku od 3 do < 18 let by měli dostat jednu posilovací dávku 0,5 ml. Děti od 14 měsíců do < 3 let by měly dostat jednu posilovací dávku 0,25 ml. Pokyny k přípravě 0,25ml dávky pro děti ve věku od 2 měsíců do < 3 let viz bod 6.6.
U dětí nejsou k dispozici žádné údaje o dlouhodobé séroprotekci více než dva roky po posilovací dávce podané 1 rok po primární imunizaci.
Děti ve věku do 2 měsíců
Bezpečnost a účinnost vakcíny IXIARO u dětí mladších než 2 měsíce nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Vakcína má být podána intramuskulární injekcí do deltového svalu. U kojenců lze vakcínu podat anterolaterálně do stehna. Vakcína IXIARO nikdy nesmí být podána intravaskulárně.
Pokud se vakcína IXIARO podává současně s jinými injekčně aplikovanými vakcínami, je třeba každou vakcínu podat pomocí samostatné stříkačky do opačné části těla.
Výjimečně může být vakcína IXIARO podána také subkutánně, a to pacientům s trombocytopenií nebo poruchami krvácivosti, protože po intramuskulárním podání se u nich může objevit krvácení. Subkutánní podání může vést k nedostatečné odezvě na očkování (viz bod 4.4). Je však třeba upozornit, že neexistují žádné údaje o klinické účinnosti, které by podporovaly subkutánní podání vakcíny.
4.3 Kontraindikace
Hypersenzitivita na léčivou nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na rezidua protamin-sulfátu, formaldehydu, bovinního sérového albuminu, DNA hostitelských buněk, disiřičitanu sodného a bílkoviny hostitelských buněk.
Jedincům, kteří vykazují hypersenzitivní reakce po první dávce vakcíny, nesmí být podána druhá dávka. Podání vakcíny musí být odloženo u osob se závažným akutním horečnatým onemocněním.
4.4 Zvláštní upozornění a opatření pro použití
Stejně jako u všech injekčních vakcín musí být pro případ vzácných anafylaktických reakcí po aplikaci vakcíny vždy k dispozici odpovídající léčebná opatření a dohled.
Za žádných okolností nesmí být vakcína IXIARO podávána intravaskulárně.
Stejně jako u jiných vakcín nemusí očkování vakcínou IXIARO ve všech případech zajistit ochranu proti onemocnění.
Vakcína IXIARO nechrání proti encefalitidě způsobené jinými mikroorganismy.
Stejně jako jiné intramuskulární injekce by ani tato vakcína neměla být podávána intramuskulárně osobám s trombocytopenií, hemofilií nebo jinými poruchami krvácivosti (viz bod 4.2).
U dospělých při použití konvenčního schématu činila míra sérokonverze pozorovaná 10 dní po prvním i.m. očkování 29,4 % a jeden týden po druhém i.m. očkování 97,3 %. Po imunizaci pomocí zrychleného schématu činila míra sérokonverze pozorovaná 7 dní po druhém i.m. očkování 99 %. Základní očkování by proto mělo být ukončeno alespoň jeden týden před potenciální expozicí viru japonské encefalitidy (JEV). Ochrana před japonskou encefalitidou není do obdržení druhé dávky zajištěna.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podání vakcíny IXIARO s jinými vakcínami:
V klinických studiích bylo hodnoceno souběžné podání vakcíny IXIARO s inaktivovanou vakcínou proti hepatitidě A a s inaktivovanou vakcínou proti vzteklině za použití dvou různých schémat. Mezi imunitní odpovědí na vakcínu proti viru japonské encefalitidy (JEV), vakcínu proti hepatitidě A (HAV) a vakcínu proti viru vztekliny nebyly pozorovány žádné interference (viz bod 5.1).
Bezpečnostní profil vakcíny IXIARO a ostatních hodnocených vakcín nebyl souběžným podáním ovlivněn.
U pacientů, kteří podstupují imunosupresivní léčbu, nebo pacientů s imunodeficiencí nemusí být dosaženo adekvátní imunitní odpovědi.
Pediatrická populace
Nebyly provedeny žádné studie interakcí u dětí a dospívajících.
4.6 Fertilita, těhotenství a kojení
O použití vakcíny IXIARO u těhotných žen je k dispozici pouze omezené množství údajů.
Ve studiích na zvířatech byly zjištěny nálezy nejasného klinického významu (viz bod 5.3).
Z preventivních důvodů je třeba se vyvarovat použití vakcíny IXIARO během těhotenství.
Kojení
Není známo, zda se přípravek IXIARO vylučuje do lidského mateřského mléka.
Vzhledem k tomu, že systémová expozice přípravku IXIARO je u kojících žen zanedbatelná, v souvislosti s přípravkem se nepředpokládají žádné účinky na kojené novorozence/kojence. Vzhledem k chybění údajů a z preventivních důvodů se však použití vakcíny IXIARO během kojení nedoporučuje.
Fertilita
Studie u potkanů neodhalily vliv vakcíny na reprodukci samic, hmotnost plodů a přežití a vývoj mláďat.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vakcína IXIARO nemá žádný nebo má zanedbatelný vliv na schopnost řídit vozidla nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Bezpečnost vakcíny IXIARO byla hodnocena v kontrolovaných a nekontrolovaných klinických studiích, do kterých bylo zařazeno 5 021 zdravých dospělých (z neendemických zemí) a 1 559 dětí a dospívajících (většinou z endemických zemí).
Výskyt systémových nežádoucích účinků byl pozorován přibližně u 40 % očkovaných, výskyt reakcí v místě injekce přibližně u 54 % očkovaných. Objevují se obvykle v průběhu prvních tří dnů po očkování, jsou obvykle mírné a do několika dní vymizí. Mezi první a druhou dávkou nebo po podání posilovací dávky nebyl zaznamenán vzestup počtu nežádoucích účinků u dospělých.
Mezi nejčastěji hlášené nežádoucí účinky u dospělých patřily bolest hlavy (20 % pacientů), myalgie (13 %) bolest v místě aplikace (33 %), citlivost v místě aplikace (33 %) a únava (12,9 %).
Nejčastěji hlášené nežádoucí účinky u dětí a dospívajících zahrnovaly pyrexii, průjem, onemocnění podobné chřipce, podrážděnost, bolest v místě aplikace, citlivost v místě aplikace a zarudnutí v místě aplikace (viz tabulka 1).
Nežádoucí účinky jsou uvedeny podle následujících frekvencí výskytu:
Velmi časté: > 1/10 Časté: > 1/100 až < 1/10
Méně časté: > 1/1 000 až < 1/100 Vzácné: > 1/10 000 až < 1/1 000
Populace dospělých a starších dospělých (> 65 let)
Poruchy krve a lymfatického systému Méně časté: lymfadenopatie Vzácné: trombocytopenie
Poruchy nervového systému Velmi časté: bolest hlavy Méně časté: migréna, závratě Vzácné: parestezie, neuritida, dysgeuzie
Poruchy ucha a labyrintu Méně časté: závrať
Poruchy oka
Vzácné: edém očních víček
Srdeční poruchy
Vzácné: palpitace, tachykardie
Respirační, hrudní a mediastinální poruchy Vzácné: dušnost
Gastrointestinální poruchy Časté: nauzea
Méně časté: zvracení, průjem, bolest břicha
Poruchy kůže a podkožní tkáně
Méně časté: vyrážka, pruritus, hyperhidróza
Vzácné: kopřivka, erytém
Poruchy svalové a kosterní soustavy a pojivové tkáně Velmi časté: myalgie
Méně časté: muskuloskeletální ztuhlost, artralgie Vzácné: bolest končetin,
Celkové poruchy a reakce v místě aplikace
Velmi časté: bolest v místě aplikace, citlivost v místě aplikace, únava
Časté: chřipkovité příznaky, pyrexie, jiné reakce v místě aplikace, například zarudnutí, zatvrdnutí, otok, svědění
Méně časté: zimnice, malátnost, astenie Vzácné: periferní otok
Vyšetření
Méně časté: zvýšené hladiny jaterních enzymů Pediatrická populace (ve věku od 2 měsíců do 18 let)
Tabulka 1: Četnost nežádoucích účinků pozorovaných u dětí, kterým byla podána dávka 0,25 ml (ve věku od 2 měsíců do <3 let) a u dětí a dospívajících, kterým byla podána dávka 0,5 ml (ve věku od 3 do <18 let)
|
Četnost nežádoucích účinků (%) podle dávky/věku | ||
|
Třída orgánového systému Preferovaný termín |
0,25 ml N = 783 od 2 měsíců do 3 let |
0,5 ml N = 628 od 3 do 18 let |
|
Poruchy krve a lymfatického systému | ||
|
Lymfadenopatie |
0,1 |
0,0 |
|
Poruchy metabolismu a výživy | ||
|
Snížená chuť k jídlu |
8,2 |
1,9 |
|
Poruchy nervového systému | ||
|
2,9 |
6,1 | |
|
Respirační, hrudní a mediastinální poruchy | ||
|
0,5 |
0,3 | |
|
Gastrointestinální poruchy | ||
|
11,9 |
1,4 | |
|
7,3 |
1,9 | |
|
3,9 |
1,9 | |
|
0,1 |
0,0 | |
|
Poruchy kůže a podkožní tkáně | ||
|
6,3 |
1,4 | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | ||
|
Myalgie |
3,0 |
7,1 |
|
Celkové poruchy a reakce v místě aplikace | ||
|
Pyrexie |
28,5 |
10,4 |
|
Onemocnění podobné chřipce |
10,9 |
2,9 |
|
Dráždivost |
10,9 |
1,9 |
|
Únava |
3,5 |
3,5 |
|
Zarudnutí v místě aplikace |
10,0 |
4,1 |
|
Bolest v místě aplikace |
6,1 |
14,1 |
|
Citlivost v místě aplikace |
4,2 |
14,7 |
|
Otok v místě aplikace |
3,6 |
2,2 |
|
Zatvrdnutí v místě aplikace |
1,2 |
1,9 |
|
Svědění v místě aplikace |
0,6 |
1,6 |
|
Vyšetření | ||
|
Zvýšené hladiny jaterních enzymů |
0,5 |
0,2 |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyly hlášeny žádné symptomy související s předávkováním.
Pediatrická populace:
Nebyl hlášen žádný případ předávkování u pediatrické populace. Neúmyslné podání dávky 0,5 ml vakcíny IXIARO dětem ve věku od 1 do <3 let nepředstavuj e žádné bezpečnostní riziko (viz bod 5.1.).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcíny proti encefalitidě. ATC kód: J07BA02 Mechanismus účinku
Mechanismus účinku vakcín proti japonské encefalitidě (JE) není dosud přesně objasněn. Studie na zvířatech prokázaly, že vakcína stimuluje imunitní systém k produkci protilátek proti viru japonské encefalitidy, které jsou nejčastěji protektivní. Byly provedeny studie provokační expozice (challenge) virem u myší, které byly léčeny lidským antisérem po imunizaci přípravkem IXIARO. Z těchto studií vyplynulo, že téměř všechny myši, které měly v plak-redukčním neutralizačním testu titr protilátek alespoň 1:10, byly po provokační expozici smrtelnou dávkou viru japonské encefalitidy před onemocněním chráněny.
Klinická účinnost a bezpečnost
Nebyly provedeny žádné prospektivní studie účinnosti. Imunogenicita přípravku IXIARO byla zkoumána u přibližně 3 119 zdravých dospělých subjektů zařazených do sedmi randomizovaných kontrolovaných klinických studií a pěti nekontrolovaných studiích fáze 3 a u přibližně 550 zdravých dětí zařazených do dvou randomizovaných kontrolovaných a dvou nekontrolovaných klinických studií fáze 3.
Pivotní studie imunogenicity (dospělí)
Imunogenicita vakcíny byla hodnocena v randomizované zaslepené (hodnotitel) multricentrické klinické studii fáze 3, kontrolované léčivou látkou, do které bylo zařazeno 867 zdravých subjektů mužského i ženského pohlaví, kterým byla podána vakcína IXIARO nebo vakcína proti JEV schválená ve Spojených státech JE-VAX (ve schématu podání v den 0, 7 a 28 subkutánní injekcí). Dva primární cílové parametry byly míra sérokonverze (titr protilátek anti-JEV >1:10) a geometrické střední hodnoty titrů (GMT) 56. den, které byly posuzovány pomocí plak-redukčního neutralizačního testu (PRNT) u celé studované populace.
V den 56 byl podíl subjektů, kteří dosáhli sérokonverze, v obou léčených skupinách podobný (96,4 % v případě vakcíny IXIARO a 93,8 % u vakcíny JE-VAX). GMT se do dne 56 zvýšily na 243,6 u vakcíny IXIARO a na 102,0 u vakcíny JE-VAX. Imunitní odpovědi vyvolané vakcínou IXIARO nebyly horší než odpovědi vyvolané vakcínou JE-VAX (tabulka 2).
Tabulka 2: Míra sérokonverze a geometrické střední hodnoty titrů vakcín IXIARO a JE-VAX u populací
dle protokolu. Titry neutralizačních protilátek proti JEV byly měřeny proti JEV kmeni SA14-14-2.
|
Míra sérokonverze | ||
|
Časový bod |
IXIARO |
JE-VAX |
|
N=365 |
N=370 | |
|
% (n) |
% (n) | |
|
Návštěva 0 (screening) |
0 |
0 |
|
Návštěva 3 (den 28) |
54 (197) |
86,8 (321) |
|
Návštěva 4 (den 56) |
96,4 (352) |
93,8 (347) |
|
Geometrická střední hodnota titru (stanovený plak-redukčním neutralizačním testem) | ||
|
Časový bod |
IXIARO |
JE-VAX |
|
N = 365 |
N = 370 | |
|
GMT (n) |
GMT (n) | |
|
Návštěva 0 (screening) |
5,0 (365) |
5,0 (370) |
|
Návštěva 3 (den 28) |
17,4 (363) |
76,9 (367) |
|
Návštěva 4 (den 56) |
243,6 (361) |
102,0 (364) |
Jako sekundární cílový parametr byl v této studii, kontrolované léčivou látkou, posuzován vliv věku na imunitní odpověď na vakcíny IXIARO a JE-VAX, a to srovnáním subjektů ve věku > 50 let (N = 262, střední věk 59,8) se subjekty ve věku do 50 let (N = 605, střední věk 33,9).
Míra sérokonverze 28. den a 56. den po očkování se u vakcín IXIARO a JE-VAX u subjektů ve věku < 50 let signifikantně nelišila od míry sérokonverze u subjektů ve věku > 50 let. Geometrické střední hodnoty titrů byly 28. den signifikantně vyšší u subjektů ve věku < 50 let ve srovnání se subjekty ve věku > 50 let ve skupině JE-VAX (80,9 oproti 45,9, p = 0,0236), ale 56. den již v této léčebné skupině nebyl žádný signifikantní rozdíl. Ve skupině, které byla podávána vakcína IXIARO, nebyl pozorován žádný signifikantní vliv věku na geometrickou střední hodnotu titru. Míra sérokonverze 28. den a 56. den se u subjektů ve věku < 50 let signifikantně nelišila od míry sérokonverze u subjektů ve věku > 50 let ani v jedné léčebné skupině.
Přetrvávání protilátek (dospělí)
Přetrvávání protilátek bylo hodnoceno v nekontrolované následné klinické studii fáze 3, kam byli zařazeni ti, kteří dokončili dvě pivotní studie a kterým byla podána alespoň jedna dávka vakcíny IXIARO. Dlouhodobá imunogenicita vyvolaná vakcínou IXIARO byla hodnocena u podskupiny sestávající ze 181 subjektů po dobu až 24 měsíců (skupina Intent-To-Treat, ITT) a u 152 subjektů maximálně do 36 měsíců po první vakcinaci přípravkem IXIARO.
Počty subjektů s PRNT50>1:10 a GMT ve 2., 6. 12., 24. a 36. měsíci jsou pro populaci ITT shrnuty v tabulce 3.
Tabulka 3: Počty subjektů s PRNT50>1:10 a geometrické střední hodnoty (GMT) titrů ve 2., 6., 12., 24. a 36. měsíci po očkování vakcínou IXIARO (populace ITT)
|
Podíl subjektů s PR |
NT 50 >1:10 |
GMT | ||
|
Časový bod |
% (n/N) |
95% interval spolehlivosti |
GMT (N) |
95% interval spolehlivosti |
|
2. měsíc |
98,9 (179/181) |
[96,1, 99,7] |
310,8 (181) |
[268,8, 359,4] |
|
6. měsíc |
95,0 (172/181) |
[90,8, 97,4] |
83,5 (181) |
[70,9, 98,4] |
|
12. měsíc |
83,4 (151/181) |
[77,3, 88,1] |
41,2 (181) |
[34,4, 49,3] |
|
24. měsíc |
81,8 (148/181) |
[75,5, 86,7] |
44,3 (181) |
[36,7, 53,4] |
|
36. měsíc |
84,9 (129/152) |
[78,3, 89,7] |
43,8 (152) |
[36,5, 52,6] |
Podle předpokladů tedy dochází k poklesu GMT, který odpovídá údajům o jiných inaktivovaných vakcínách proti JE.
V další otevřené následné studii fáze 3 bylo hodnoceno přetrvávání protilátek po dobu 24 měsíců po primární vakcinaci. Do této kontrolní studie bylo zařazeno celkově 116 subjektů, kterým byly podány primární dávky přípravku IXIARO dle doporučeného schématu. Procento subjektů s PRNT50 >1:10 bylo 82,8 % (95% interval spolehlivosti: 74,9, 88,6, N=116) v 6. měsíci a 58,3 % ve 12. měsíci (95% interval spolehlivosti: 49,1, 66,9, N=115). Ve 24. měsíci byly u 48,3 % (95% interval spolehlivosti: 39,4, 57,3, N=116) subjektů, které dokončily doporučenou primární imunizaci, nadále přítomny titry PRNT50 >1:10. Hodnota GMT u těchto subjektů byla ve 24. měsíci 16,2 (95% interval spolehlivosti: 13,8, 19,0).
Posilovači imunizace (dospělí)
V nekontrolované otevřené studii fáze 3 byla podána jedna 6 gg (0,5 ml) posilovací dávka přípravku IXIARO 15 měsíců po primární imunizaci. Všechny ze 198 léčených subjektů byly zařazeny do populace ITT a bezpečnostní populace.
Procenta subjektů s PRNT50>1:10 a GMT v průběhu sledovaného období jsou shrnuty níže v tabulce 4:
Tabulka 4: Procenta subjektů s PRNT 50 >1:10 a GMT před podáním posilovací dávky a v 1., 6. a 12. měsíci po podání jedné 6 gg (0,5 ml) posilovací dávky, která byla subjektů podána 15 měsíců po doporučené primární imunizaci přípravkem IXIARO (populace ITT)
|
Procenta subjektů s PRNT50>1:10 |
GMT | |||
|
95% CI |
95% CI | |||
|
Před podáním posilovací dávky, den 0 (n=198) |
69,2 % |
[62,4%, 75,2%] |
22,5 |
[19,0, 26,7] |
|
28. den (n=198) |
100,0 % |
[98,1%, 100,0%] |
900,1 |
[742,4, 1091,3] |
|
6. měsíc (n=197) |
98,5 % |
[95,6%, 99,5%] |
487,4 |
[390,7, 608,1] |
|
12. měsíc (n=194) |
98,5 % |
[95,6%, 99,5%] |
361,4 |
[294,5, 443,5] |
Přetrvávání protilátek po posilovací imunizaci (dospělí)
V nekontrolovaném otevřeném prodloužení studie posilovací dávky popsané výše bylo 67 subjektů sledováno s cílem stanovit titr neutralizačních protilátek proti JEV přibližně 6 let po podání posilovací dávky. 96 % subjektů (64/47) mělo pořád ochranné hladiny protilátek (PRNT50 > 1:10), s GMT na úrovni148 (95% interval spolehlivosti: 107; 207). Matematickým modelováním byl proveden odhad průměrného trvání ochrany. Na základě tohoto modelu odhadujeme celkové trvání ochrany v délce 14 let, přičemž 75 % vakcinovaných osob bude mít ochranné hladiny protilátek (PRNT50 > 1:10) po dobu 10 let. Druhou posilovací dávku je tudíž vhodné podat 10 let po první posilovací dávce podané 1 rok po primární imunizaci před potenciální expozicí JEV.
Schéma zrychlené imunizace (dospělí)
Imunogenicita vakcíny IXIARO podané pomocí schématu zrychlené imunizace byla hodnocena v randomizované studii fáze 3 zaslepené pro hodnotitele. Celkem 217 subjektům ve věku 18-65 let byla podána vakcína IXIARO souběžně s inaktivanou vakcínou proti vzteklině (Rabipur) za použití zrychleného schématu v den 0 a den 7 a 56 subjektům byla podána vakcína IXIARO samotná pomocí konvenčního schématu v den 0 a den 28. Podíl subjektů, u nichž došlo k sérokonverzi do 7 a do 28 dnů po poslední imunizaci, byl u obou schémat podobný. Hodnoty míry sérokonverze a titry protilátek zůstaly u obou schémat rovněž srovnatelně vysoké po dobu až 12 měsíců od první imunizace (tabulka 5).
Zrychlené schéma bylo testováno při souběžném podání vakcíny IXIARO a Rabipur, může však být použito i k podání vakcíny IXIARO samotné, protože nebyly pozorovány žádné interference mezi imunitní odpovědí na obě vakcíny (viz bod 4.5).
Tabulka 5: Míra sérokonverze a hodnoty GMT pro neutralizační protilátky proti JEV v den 0, 14, 21,
35, 56 a 365 po imunizaci vakcínou IXIARO a inaktivovanou vakcínou proti vzteklině pomocí zrychleného schématu a vakcíny IXIARO samotné pomocí konvenčního schématu (populace podle protokolu)
|
Míra sérokonverze (podíl subjektů s PRNT50 >1:10) |
GMT (plak-redukční neutralizační test) | |||
|
Zrychlené schéma % (n/N) |
Konvenční schéma % (n/N) |
Zrychlené schéma (N) |
Konvenční schéma (N) | |
|
Vakcinační schéma; |
IXIARO, den 0, 7 Rabipur, den 0,3,7 |
IXIARO, den 0, 28 |
IXIARO, den 0, 7 Rabipur, den 0,3,7 |
IXIARO, den 0, 28 |
|
Den 0 |
6 (13/215) |
9 (5/55) |
5,63 (215) |
5,73 (55) |
|
Den 14 |
99 (206/209) |
NA |
715 (209) |
NA |
|
Den 21 |
100 (207/208) |
NA |
1255 (208) |
NA |
|
Den 35 |
99 (203/206) |
100 (47/47) |
690 (206) |
376 (47) |
|
Den 56 |
98 (200/204) |
100 (49/49) |
372 (204) |
337 (49) |
|
Den 365 |
94 (188/199) |
88 (42/48) |
117 (199) |
39 (48) |
NA = neuplatňuje se
Nekompletní primární imunizace (dospělí)
Imunogenicita posilovacích dávek byla též hodnocena ve studii hodnotící přetrváváni imunity po různých primárních imunizačních režimech (2x6 pg: N=116, 1x12 pg: N=116 nebo 1x6 pg: N=117). Jedna 6pg (0,5 ml) posilovací dávka byla podána v 11. nebo 23. měsíci po první dávce subjektům, u nichž byla zjištěna séronegativita (s titry PRNT50 < 1:10) 6 a/nebo 12 měsíců po primární imunizaci. Výsledky ukazují, že druhá injekce primární imunizační série může být podána až do 11. měsíce po první dávce. Imunitní odpovědi na další dávky v jiných časových bodech po dokončené nebo nedokončené primární imunizaci jsou uvedeny v tabulce 6.
Tabulka 6: SCR a GMT ve čtvrtém týdnu po jedné 6pg posilovači dávce podané subjektům s PRNT50 <1:10 (PRNT50<1:10 znamená, že subjekt není dále již chráněn sérovými protilátkami) 11 měsíců nebo 23 měsíců po doporučené primární imunizaci (2x6 pg) nebo nekompletní (1x6 pg) primární imunizaci přípravkem IXIARO (populace ITT)
|
(n / N) |
SCR |
GMT |
[95% interval spolehlivosti] | |
|
Posilovací dávka po doporučené primární imunizaci (2x6 pg) | ||||
|
Posilovací dávka v 11. měsíci |
(17 / 17) |
100 % |
673,6 |
[378,7, 1198,2] |
|
Posilovací dávka v 23. měsíci |
(27 / 27) |
100 % |
2536,7 |
[1467,7, 4384,4] |
|
Druhá dávka po nekompletní primární imunizaci (1x6 pg) | ||||
|
Druhá dávka v 11. měsíci |
(99 / 100) |
99 % |
504,3 |
[367,3, 692,3] |
|
Druhá dávka ve 23. měsíci |
(5 / 5) |
100 % |
571,4 |
[88,2, 3702,9] |
Souběžné použití (dospělí)
Souběžné podání vakcíny IXIARO s inaktivovanou vakcínou HAVRIX1440 proti viru hepatitidy A (HAV) Jedna klinická studie zkoumala souběžné použití vakcíny IXIARO a inaktivované vakcíny proti viru hepatitidy A (HAV) (HAVRIX 1440). Imunitní reakce na virus JE neovlivňovala imunitní reakci na virus HAV, v tomto pořadí. Bylo prokázáno, že souběžné podání vakcíny IXIARO a inaktivované vakcíny proti hepatitidě A nevykazuje s ohledem na geometrické střední hodnoty titrů (GMT) anti-JEV neutralizačních protilátek a protilátek HAV a na míru sérokonverze horší výsledky v porovnání s podáním těchto vakcín samostatně (tabulka 7).
Tabulka 7: Míry sérokonverze a geometrická střední hodnota titru anti-JEV neutralizačních protilátek
56. den a míry sérokonverze a geometrická střední hodnota titru pro protilátky HAV 28. den u populace dle protokolu_
|
Míry sérokonverze (SCR) a geometrická střední hodnota titru anti-JEV neutralizačních protilátek 56. den | |||
|
% se SCR |
GMT |
95 % CI | |
|
Skupina C: IXIARO + HAVRIX1440 |
100,0 |
202,7 |
[153,7, 261,2] |
|
Skupina A: IXIARO + placebo |
98,2 |
192,2 |
[147,9, 249,8] |
|
Míry sérokonverze a geometrická střední hodnota titru protilátek HAV 28. den | |||
|
% se SCR |
GMT |
95 % CI | |
|
Skupina C: IXIARO + HAVRIX 1440 |
100,0 |
150,0 |
[111,7, 202,3] |
|
Skupina B: HAVRIX + placebo |
96,2 |
124,0 |
[91,4, 168,2] |
Souběžné podání vakcíny IXIARO s inaktivovanou vakcínou proti vzteklině (Rabipur):
Ve studii fáze 3 zaslepené pro hodnotitele bylo hodnoceno souběžné podání vakcín IXIARO a Rabipur u dospělých ve věku 18 až 65 let v porovnání se samostatným podáním příslušných vakcín pomocí konvenčního schématu. Z hlediska geometrické střední hodnoty titru (GMT) a míry sérokonverze pro neutralizační protilátky proti JEV nebyly pozorovány žádné interference (tabulka 8). Zároveň nebyly pozorovány žádné interference s imunitní odpovědí na vakcínu Rabipur.
Tabulka 8: Míra séroknverze (podíl subjektů s PRNT50>1:10) a hodnoty GMT (plak-redukční neutralizační
test) pro neutralizační protilátky proti JEV po podání vakcín IXIARO a Rabipur pomocí konvenčního schématu, populace podle protokolu_
|
Míra sérokonverze a geometrická střední hodnota titru neutralizačních protilátek proti JEV v den 56 | ||
|
SCR [%] (n/N) |
GMT [95% CI] | |
|
(N) | ||
|
IXIARO + Rabipur |
100 |
299 [254-352] |
|
(157/157) |
(157) | |
|
IXIARO |
100 |
337 [252-451] |
|
(49/49) |
(49) | |
Vakcinační schéma: IXIARO: den 0/28, Rabipur: den 0/7/28.
Imunogenicita u starších osob (> 65 let)
Imunogenicita vakcíny IXIARO byla hodnocena v otevřené nekontrolované studii u 200 zdravých starších osob ve věku 65 až 83 let včetně subjektů se stabilním základním onemocněním, například hypercholesterolémií, hypertenzí, kardiovaskulárními onemocněními nebo non-inzulín dependentním diabetem mellitem. Neutralizační protilátky proti JEV byly stanoveny 42 dnů po druhé dávce primárního cyklu imunizace (den 70). Starší osoby mají v porovnání s mladšími dospělými nebo dětmi na vakcinaci slabší imunitní odpověď z hlediska míry sérokonverze (procentuálního podílu subjektů s titrem PRNT50 > 1:10) i geometrické střední hodnoty titru (tabulka 9).
Table 9: Míra sérokonverze a geometrická střední hodnota titru neutralizačních protilátek proti JEV
v den 70 v populaci Intent-To-Treat pro celou hodnocenou populaci a se stratifikací podle věku
|
Míra sérokonverze a geometrická střední hodnota titru pro neutralizační protilátky proti JEV v den 70 | ||||
|
n / N |
SCR |
GMT |
95% CI | |
|
Celková hodnocená populace |
128/197 |
65 % |
37 |
29,2, 47,8 |
|
Věková skupina 65 - < 75 let |
113/173 |
65,3 % |
37,2 |
28,6, 48,3 |
|
Věková skupina > 75 let |
15/23 |
65,2 % |
42,2 |
19,2, 92,7 |
Pediatrická populace
Ve studii fáze 2 se zdravými indickými batolaty ve věku od >1 roku do <3 let bylo očkováno 24 dětí dávkou 0,25 ml vakcíny IXIARO (schválená dávka pro tuto věkovou skupinu) a 24 dětí obdrželo dávku pro dospělé 0,5 ml. Údaje jsou omezené, v této věkové skupině však nebyly zjištěny žádné rozdíly v bezpečnostním profilu dávky 0,25 ml a 0,5 ml.
Imunogenicita a bezpečnost vakcíny IXIARO u dětí a dospívajících ze zemí, kde je JEV endemický Bezpečnost a imunogenicita vakcíny IXIARO byly hodnoceny v randomizované kontrolované otevřené klinické studii na Filipínách, kde je JEV endemický. Bezpečnostní profil vakcíny IXIARO byl srovnáván s kontrolními vakcínami Havrix (vakcína proti hepatitidě A, pediatrické složení 720 EL.U./0,5 ml) a Prevenar (7valentní pneumokoková konjugovaná vakcína [konjugovaná s difterickým proteinem CRM197]).
Hodnocení imunogenicity bylo provedeno na podmnožině studované populace a zahrnovalo stanovení míry sérokonverze (SCR), definované jako titr neutralizačních protilátek anti-JEV >1:10, podíl osob, u kterých došlo k nejméně čtyřnásobnému nárůstu titrů protilátek a geometrickou střední hodnotu titru (GMT) 56. den a 7. měsíc při stratifikaci podle dávky a věkové skupiny. Imunitní odpovědi vyvolané vakcínou IXIARO jsou uvedeny v Tabulce 10.
Tabulka 10: Míry sérokonverze a podíly osob, u kterých došlo k nejméně 4násobnému nárůstu titrů
neutralizačních protilátek anti-JEV a geometrické střední hodnoty titrů (GMT) při výchozím stavu, v 56. dni a v 7. měsíci, stratifikace podle věkové skupiny, populace Intent-To-Treat
|
Dávka vakcíny |
0,25 ml |
0,5 ml | |||
|
Věková skupina |
2 měsíce -<6 měsíců |
6 měsíců -<12 měsíců |
1 rok -< 3 roky |
3 roky -< 12 let |
12 let -< 18 let |
|
Míry sérokonverze v % (n/N) | |||||
|
Před očkováním |
30 % (3/10) |
0 % (0/20) |
3,2 % (4/125) |
16,8 % (17/101) |
45,7 % (64/140) |
|
56. den |
100 % (9/9) |
100 % (19/19) |
99,2 % (119/120) |
100,0 % (100/100) |
100 % (137/137) |
|
7. měsíc |
100 % (10/10) |
100 % (18/18) |
85,5 % (106/124) |
91,0 % (91/100) |
97,1 % (133/137) |
|
Podíl osob, u kterých došlo k >4násobnému nárůstu titrů protilátek anti-JEV v % (n/N) | |||||
|
56. den |
100 (9/9) |
94,7 (18/19) |
96,7 (116/120) |
94,0 (94/100) |
77,4 (106/137) |
|
7. měsíc |
90,0 (9/10) |
83,3 (15/18) |
75,8 (94/124) |
71,0 (71/100) |
65,0 (89/137) |
|
Geometrické střední hodnoty titrů (N) | |||||
|
Před očkováním |
8,42 (10 ) |
5° (20) |
5.52 (124) |
6,54 (101) |
13,08 (140) |
|
56. den |
687,35 (9) |
377,79 (19) |
258,90 (121) |
213,67 (100) |
175,63 (137) |
|
7. měsíc |
159,27 (10) |
64,00 (18) |
38,91 (125) |
43,60 (100) |
86,61 (137) |
◊Negativním titrům před očkováním byla přisouzena hodnota 5.
Bezpečnost a snášenlivost byly vyhodnoceny u celé studované populace. Rodiče nebo subjekty po každém očkování po dobu 7 dní zaznamenávali nežádoucí účinky do deníkové karty. Rodiče nebo subjekty byli dotazováni na jakékoli neuvedené nežádoucí účinky v den druhého očkování a při osobních návštěvách s lékařským vyšetřením za 28 dní (56. den) a 6 měsíců (7. měsíc) po druhé dávce. Bezpečnostní profil vakcíny IXIARO byl srovnatelný s bezpečnostním profilem vakcín Havrix nebo Prevenar.
Přetrvávání protilátek a posilovači dávka u dětí a dospívajících z endemické země pro JEV Přetrvávání neutralizujících protilátek po primární imunizaci a bezpečnost a imunogenicita posilovací dávky vakcíny IXIARO 12 měsíců po primární imunizaci byly hodnoceny v randomizované kontrolované otevřené klinické studii provedené na Filipínách, kde je JEV endemický (300 dětí, průměrný věk 5,3 roku, interval 1,2-17,3 let). 150 dětí bylo sledováno po dobu tří let bez posilovací dávky, dalších 150 dětí dostalo posilovací dávku po 1 roku (0,25 ml u dětí ve věku < 3 roky v době podání posilovací dávky, 0,5 ml u dětí ve věku 3 roky a více). Tyto děti byly následně sledovány další dva roky. Míra séroprotekce (SPR) definována jako titr neutralizačních protilátek > 1:10 a geometrické střední hodnoty (GMT) titrů jsou uvedeny v tabulce 11. Posilovací dávka vedla k významnému zvýšení GMT a míra séroprotekce zůstala na úrovni 100 % dva roky po podání posilovací dávky.
Tabulka 11: Míry séroprotekce a geometrické střední hodnoty titrů s posilovači dávkou vakcíny IXIARO ve 12., 13., 24. a 36. měsíci a bez ní v populaci ITT
|
Bez posilovací dávky N = 150 |
Posilovací dávka 12 měsíců po primární imunizaci N = 149 | ||
|
Časový bod po primární imunizaci |
Posilovací dávka 0,25 ml N = 81 |
Posilovací dávka 0,5 ml N = 67 | |
|
Míra séroprotekce % (n/N) | |||
|
12. měsíc |
89,9 (134/149) |
97,5 (79/81) |
89,6 (60/67) |
|
13. měsíc |
- |
100 (81/81) |
100,0 (67/67) |
|
24. měsíc |
89,0 (130/146) |
100 (80/80) |
100,0 (67/67) |
|
36. měsíc |
90,1 (128/142) |
100,0 (76/76) |
100,0 (67/67) |
|
Geometrická střední hodnota titru | |||
|
12. měsíc |
46 |
67 |
40 |
|
13. měsíc |
- |
2911 |
1366 |
|
24. měsíc |
50 |
572 |
302 |
|
36. měsíc |
59 |
427 |
280 |
- = není k dispozici
Imunogenicita a bezpečnost u dětí a dospívajících z neendemických zemí
Bezpečnost a imunogenicita vakcíny IXIARO byly hodnoceny v nekontrolované otevřené klinické studie, prováděné ve Spojených státech, Evropě a Austrálii u zdravých mužů a žen plánujících cestu do zemí, kde je JEV endemický. Děti a dospívající ve věku od > 3 do < 18 let obdrželi dvě dávky vakcíny po 0,5 ml a děti ve věku od > 2 měsíců do < 3 let obdržely dvě dávky vakcíny po 0,25 ml v den 0 a den 28 ve formě intramuskulární injekce. Údaje o imunogenicitě byly hodnoceny u 64 subjektů. Hodnoty SCR a GMT jsou uvedeny v Tabulce 12.
Tabulka 12: Míry sérokonverze a geometrické střední hodnoty titrů neutralizačních protilátek anti-JEV podle dávky vakcíny a věkové skupiny. Populace Intent-To-Treat.
|
Dávka vakcíny IXIARO |
Časový bod |
SCR n / N |
GMT |
95% CI | |
|
Věková skupina od >2 měsíců do <3 let |
0,25 ml |
56. den |
100 % 5/5 |
216,2 |
106,0; 441,0 |
|
7. měsíc |
100 % 2/2 |
48,0 |
0,0; 3214485,7 | ||
|
Věková skupina od >3 do <18 let |
0,5 ml |
56. den |
100 % 57/57 |
340,7 |
269,8; 430,3 |
|
7. měsíc |
90,6% 29/32 |
57,1 |
38,4; 84,9 |
Přetrvávání protilátek u dětí a dospívajících z neendemických zemí
Přetrvávání protilátek bylo hodnoceno po dobu tří let od primární vakcinace přípravkem IXIARO v nekontrolované otevřené sledovací klinické studii prováděné v USA, Evropě a Austrálii. Údaje o dlouhodobé imunogenicitě byly hodnoceny u 23 dětí, průměrný věk 14,3 let, interval 3-18 let). SPR a GMT j sou uvedeny v tabulce 13.
Tabulka 13: Míry séroprotekce a geometrická střední hodnota titru neutralizujících protilátek proti JEV dle dávky vakcíny a věkové skupiny. Populace ITT
|
Míra seroprotekce (Poměr subjektů s PRNT 50 > 1:10) % (n/N) |
Geometrická střední hodnota titru (plak-redukční neutralizační test) GMT [95% interval spolehlivosti] | |||
|
Po primární imunizaci dávkou 0,25 ml |
Po primární imunizaci dávkou 0,5 ml |
Po primární imunizaci dávkou 0,25 ml |
Po primární imunizaci dávkou 0,5 ml | |
|
12. měsíc |
0 % (0/0) |
89,5% (17/19) |
- |
48 [28; 80] |
|
24. měsíc |
100 % (1/1) |
90,9% (20/22) |
193 [-] |
75 [46; 124] |
|
36. měsíc |
100 % (1/1) |
88,9% (16/18) |
136 [-] |
61 [35; 106] |
- = 95% interval spolehlivosti nebylo možné stanovit (údaje od jednoho subjektu)
5.2 Farmakokinetické vlastnosti
U vakcín se hodnocení farmakokinetických vlastností nevyžaduje.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje o toxicitě jsou omezené.
Ve studii reprodukční toxicity a pre/postnatální toxicity nebyly v souvislosti s vakcínou zaznamenány žádné účinky na reprodukci, hmotnost plodu, přežití a vývoj potomků. Ve skupině, které byly podány 2 dávky, však byla pozorována neúplná osifikace částí kostry, avšak tento účinek nebyl pozorován u skupiny, které byly podány 3 dávky. V současnosti je složité vyjádřit se k tomu, zda tento fenomén vznikl v souvislosti s očkováním, či nikoliv.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Roztok chloridu sodného ve fosfátovém pufru obsahuje: chlorid sodný,
dihydrogenfosforečnan draselný, dodekahydrát hydrogenfosforečnanu sodného, voda na injekci.
Pomocné látky viz bod 2.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a velikost balení
0,5 ml suspenze v předplněné injekční stříkačce (sklo typu I) s pryžovou zátkou (chlorobutylová pryž). Balení obsahuje 1 injekční stříkačku se samostatnou jehlou nebo bez jehly.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Předplněná injekční stříkačka je určena pouze k jednorázovému podání a nesmí být používána pro více než 1 osobu. Předplněnou injekční stříkačku je možné ihned použít. Neobsahuje-li balení jehlu, použijte sterilní jehlu.
Nepoužívejte přípravek, je-li fólie blistru porušena, nebo je balení jinak poškozeno.
Při uchovávání může být patrná jemná bílá usazenina s bezbarvým supernatantem.
Stříkačku je třeba před podáním dobře protřepat, až se vytvoří bílá neprůhledná homogenní suspenze. Jsou-li v přípravku po protřepání přítomny částečky nebo jeví-li změnu barvy anebo se zdá, že je poškozena injekční stříkačka, přípravek nepodávejte.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Informace o podání dávky 0,5 ml vakcíny IXIARO osobám ve věku od 3 let Při podávání plné dávky 0,5 ml dodržujte následující postup:
1. Protřepejte stříkačku, aby vznikla homogenní suspenze.
2. Opatrně kroutivým pohybem sejměte kryt hrotu stříkačky. Nepokoušejte se kryt odlomit ani stáhnout, protože by se mohla poškodit stříkačka.
3. Na předplněnou injekční stříkačku nasaďte jehlu.
Informace o přípravě dávky 0,25 ml vakcíny IXIARO pro použití u dětí ve věku do 3 let Při podávání dávky 0,25 ml dětem ve věku od 2 měsíců do < 3 let dodržujte následující postup:
1. Protřepejte stříkačku, aby vznikla homogenní suspenze.
2. Opatrně kroutivým pohybem sejměte kryt hrotu stříkačky. Nepokoušejte se kryt odlomit ani stáhnout, protože by se mohla poškodit stříkačka.
3. Na předplněnou injekční stříkačku nasaďte jehlu.
4. Držte injekční stříkačku ve svislé poloze.
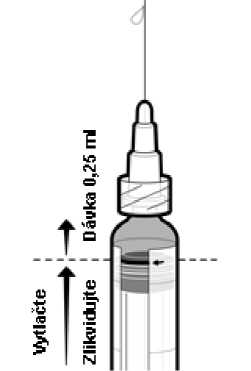
5. Zlikvidujte přebytečný objem vakcíny vytlačením pístu směrem nahoru až po okraj červené čáry na válci stříkačky, který je označen červenou šipkou (viz Obrázek 1)1.
6. Před injekčním podáním zbývajícího objemu nasaďte na injekční stříkačku novou sterilní jehlu.
Obrázek 1: Příprava k podání dávky 0,25 ml
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Valneva Austria GmbH Campus Vienna Biocenter 3 A-1030 Vídeň Rakousko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/501/001
EU/1/08/501/002
9. DATUM REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 31. března 2009
Datum posledního prodloužení registrace: 28. února 2014
10. DATUM REVIZE TEXTU <{MM/RRRR}>
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce/výrobců biologické léčivé látky/biologických léčivých látek
Valneva Scotland Ltd.
Oakbank Park Road,
Livingston EH53 0TG Velká Británie
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
Valneva Scotland Ltd.
Oakbank Park Road,
Livingston EH53 0TG Velká Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis
Úřední propouštění šarží
Úřední propouštění šarží: Podle článku 114 směrnice 2001/83/ES v aktualizovaném znění bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizací RMP..
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou
vést k významným změnám poměru přínosů a rizik, nebo z důvodů dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
Vnější krabička_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
IXIARO injekční suspenze
Vakcína proti japonské encefalitidě (inaktivovaná, adsorbovaná) Balení pro dospělé, dospívající a děti
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 dávka (0,5 ml) IXIARO obsahuje:
6 AU (Jednotek antigenuodpovídající síle < 460 ng ED50) inaktivovaného viru japonské encefalitidy kmene SA14-14-2 (produkovaný v buňkách Vero) adsorbovaný na hydratovaný hydroxid hlinitý (přibližně 0,25 mg Al3+ ).
3. SEZNAM POMOCNÝCH LÁTEK_
Pomocné látky:
Roztok chloridu sodného ve fosfátovém pufru, který se skládá z chloridu sodného, dihydrogenfosforečnanu draselného, dodekahydrátu hydrogenfosforečnanu sodného a vody na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční suspenze.
Jednotlivá dávka 0,5 ml v předplněné injekční stříkačce.
Jednotlivá dávka 0,5 ml v předplněné injekční stříkačce + 1 injekční jehla
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Intramuskulární (i.m.) podání.
Protřepejte, aby se vytvořila stejnorodá suspenze. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Nepodávejte intravaskulárně.
8. POUŽITELNOST
EXP:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Zlikvidujte v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Valneva Austria GmbH Campus Vienna Biocenter 3 A-1030 Vídeň Rakousko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/08/501/001
EU/1/08/501/002
13. ČÍSLO ŠARŽE
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis. 15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH Blistrová fólie
Čistě bílá fólie bez tištěných informací
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Štítek předplněné injekční stříkačky_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
IXIARO injekční suspenze Vakcína proti japonské encefalitidě Intramuskulámí (i.m.) podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
č.š.
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka, 0,5ml
6. JINÉ
Uchovávejte v chladničce. Chraňte před mrazem.
IXIARO injekční suspenze
Vakcína proti japonské encefalitidě (inaktivovaná, adsorbovaná)
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete Vy nebo Vaše dítě tuto vakcínu používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete Vy nebo Vaše dítě potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře.
• Tato vakcína byla předepsána výhradně Vám a/nebo Vašemu dítěti. Nedávejte ji žádné další osobě.
• Pokud se u Vás a/nebo Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek IXIARO a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Vy a/nebo Vaše dítě přípravek IXIARO používat
3. Jak se přípravek IXIARO používá
4. Možné nežádoucí účinky
5. Jak přípravek IXIARO uchovávat
6. Obsah balení a další informace
1. Co je přípravek IXIARO a k čemu se používá
IXIARO je vakcína proti viru japonské encefalitidy.
Tato vakcína způsobuje, že tělo začne vyrábět vlastní ochranu (protilátky) proti tomuto onemocnění.
IXIARO se používá k ochraně před infekcí virem japonské encefalitidy (JEV). Tento virus se vyskytuje zejména v Asii a na lidi je přenášen komáry, kteří předtím sáli krev na nakažených zvířatech (jako např. prasatech). U mnoha nakažených lidí se rozvinou pouze mírné příznaky, nebo nemají příznaky žádné. U lidí, u nichž se rozvine závažné onemocnění, obvykle JE začíná jako onemocnění podobné chřipce, s horečkou, zimnicí, únavou, bolestmi hlavy, pocitem na zvracení a zvracením. V časném stadiu onemocnění se může objevit i zmatenost a podrážděnost.
Vakcína IXIARO by měla být podávána pouze dospělým, dospívajícím, dětem a kojencům ve věku od 2 měsíců cestujícím do zemí, kde je JE endemická nebo s rizikem expozice při zaměstnání.
2. Čemu musíte věnovat pozornost, než začnete Vy a/nebo Vaše dítě přípravek IXIARO používat Přípravek IXIARO nesmí být podán:
• Jestliže jste Vy a/nebo Vaše dítě alergický/á (přecitlivělý/á) na léčivou látku nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• Jestliže se u Vás a/nebo Vašeho dítěte vyskytla alergická reakce po podání předchozí dávky vakcíny IXIARO; příznakem alergické reakce může být svědivá vyrážka, dušnost a otok tváře a jazyka,
• Máte-li Vy a/nebo Vaše dítě vysokou horečku. V takovém případě Váš lékař očkování odloží.
Upozornění a opatření
Vakcína IXIARO nesmí být podána do krevní cévy.
Základní očkování by mělo být dokončeno nejméně jeden týden před možnou expozicí viru JEV.
Informujte svého lékaře:
• Pokud jste dříve po podání jakékoli vakcíny Vy a/nebo Vaše dítě měl/a jakékoli zdravotní potíže,
• Pokud máte Vy a/nebo Vaše dítě jakékoli jiné známé alergie,
• Pokud máte Vy a/nebo Vaše dítě poruchu krvácivosti (nemoc, která způsobuje, že člověk krvácí více, než je obvyklé) nebo pokud máte málo krevních destiček, což zvyšuje riziko krvácení nebo podlitin (trombocytopenie),
• Je-li Vaše dítě mladší 2 než měsíce, protože vakcína IXIARO nebyla zkoušena u kojenců mladších než 2 měsíce,
• Pokud imunitní systém Váš nebo Vašeho dítěte nefunguje správně (imunodeficience), nebo pokud Vy a/nebo Vaše dítě užíváte léčivé přípravky, které ovlivňují Váš imunitní systém (jako je léčivý přípravek kortizon nebo léčivé přípravky užívané při nádorovém onemocnění).
Váš lékař s Vámi probere možná rizika a přínosy očkování vakcínou IXIARO.
Upozorňujeme, že
• Vakcína IXIARO nemůže způsobit onemocnění, proti kterému chrání,
• Vakcína IXIARO nechrání před infekcemi, které jsou způsobeny jinými viry, než je virus japonské encefalitidy,
• Stejně jako u jiné vakcíny očkování vakcínou IXIARO nemusí vést k ochraně ve všech případech,
• I po očkování vakcínou IXIARO byste se Vy a/nebo Vaše dítě měli vhodně chránit, abyste snížili pravděpodobnost bodnutí komárem (vhodný oděv, používání repelentů, sítě proti komárům).
Další léčivé přípravky a přípravek IXIARO
Studie u lidí, které hodnotí účinnost a bezpečnost léčivých přípravků (klinické studie), prokázaly, že vakcína IXIARO může být podávána souběžně s vakcínou proti hepatitidě A a s vakcínou proti vzteklině.
Informujte svého lékaře o všech lécích, které Vy a/nebo Vaše dítě užíváte, které jste v nedávné době užívali nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu, a také o jakémkoli jiném očkování, kterému jste se v nedávné době podrobili.
Těhotenství, kojení a plodnost
O použití vakcíny IXIARO u těhotných nebo kojících žen existuje pouze omezené množství údajů.
Z preventivních důvodů je třeba se použití vakcíny IXIARO během těhotenství nebo kojení vyvarovat.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než Vám bude tato vakcína podána.
Řízení dopravních prostředků a obsluha strojů
Vakcína IXIARO nemá žádný nebo má zanedbatelný vliv na schopnost řídit vozidla nebo obsluhovat stroje.
3. Jak se přípravek IXIARO používá
Doporučené dávkování pro dospělé, dospívající a děti ve věku od 3 let jsou celkem 2 injekce po 0,5 ml:
• První injekci v den 0,
• Druhou injekci 28 dní po první injekci (den 28).
Dospělí ve věku 18 až 65 let mohou být rovněž vakcinováni takto:
• První injekce v den 0
• Druhá injekce 7 dní po první injekci (den 7).
Kojenci a děti ve věku od 2 měsíců do < 3 let
Doporučená dávka pro kojence a děti ve věku od 2 měsíců do < 3 let jsou celkem 2 injekce po 0,25 ml:
• První injekci v den 0,
• Druhou injekci 28 dní po první injekci (den 28).
Pokyny k přípravě 0,25ml dávky vakcíny naleznete na konci této příbalové informace.
Dbejte na to, abyste Vy a/nebo Vaše dítě dokončil(a) celý očkovací cyklus skládající se ze 2 injekcí. Druhou injekci je třeba podat nejméně jeden týden před možnou expozicí Vás a/nebo Vašeho dítěte viru japonské encefalitidy. Pokud se tak nestane, nelze zajistit úplnou ochranu Vás a/nebo Vašeho dítěte proti nemoci.
U dospělých, dospívajících, dětí a kojenců ve věku 1 rok a více je možné posilovací dávku podat v průběhu druhého roku (tzn. 12 - 24 měsíců) po první dávce doporučeného primárního očkování. U dospělých lze podat druhou posilovací dávku 10 let po první posilovací dávce. U starších osob (> 65 let) lze podat první posilovací dávku dříve. Váš lékař rozhodne o nezbytnosti a načasování podání posilovacích dávek.
Podání
Vakcínu IXIARO Vám nebo Vašemu dítěti podá injekcí do svalu horní končetiny (deltový sval) Váš lékař nebo zdravotní sestra. Nesmí být podána do krevní cévy. V případě, že Vy a/nebo Vaše dítě trpíte poruchou krvácivosti, může se Váš lékař rozhodnout podat Vám vakcínu pod kůži (subkutánně).
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
Jestliže jste zapomněl/a použít přípravek IXIARO
Zmeškáte-li Vy a/nebo Vaše dítě naplánovanou injekci, promluvte si se svým lékařem a dohodněte si jiný termín pro podání druhé injekce.
Bez druhé injekce nebudete Vy a/nebo Vaše dítě před tímto onemocněním zcela chráněni. Dostupné údaje prokazují, že druhou injekci lze podat až do 11 měsíců po první injekci.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Většina nežádoucích účinků uvedených níže byla pozorována v průběhu klinických studií. Objevují se obvykle v průběhu prvních 3 dní po očkování, jsou obvykle mírné a do několika dnů vymizí.
Velmi časté (postihují více než 1 uživatele z 10):
bolest hlavy, bolest svalů, bolest v místě aplikace, citlivost v místě aplikace, únava.
Časté (postihují 1 až 10 uživatelů ze 100):
pocit na zvracení, chřipkovité příznaky, horečka, jiné reakce v místě aplikace (například zčervenání, zatvrdnutí, otok, svědění).
Méně časté (postihují 1 až 10 uživatelů z 1000):
zvracení, kožní vyrážka, změny lymfatických uzlin, migréna (pulzující bolest hlavy, často doprovázená pocitem na zvracení a zvracením a přecitlivělostí na světlo), závrať, vertigo (pocit točení hlavy), průjem, bolest břicha, nadměrné pocení, svědění, zimnice, celkový pocit nemoci, ztuhlost svalů a skeletu, bolest kloubů, slabost, abnormální výsledky laboratorního vyšetření jater (zvýšené hodnoty jaterních enzymů).
Vzácné (postihují 1 až 10 uživatelů z 10 000):
bušení srdce, zrychlená srdeční akce, dechové potíže, abnormální pocity na kůži (například mravenčení), kopřivka, zarudnutí kůže, bolest dolní nebo horní končetiny, bolest kloubů, nedostatek krevních destiček, zánět nervu, otok končetin a kotníku, poruchy chuti, otoky očních víček.
Další nežádoucí účinky u dětí ve věku od 2 měsíců do <3 let
U dětí ve věku od 2 měsíců do <3 let byly oproti dětem ve věku od 3 do < 12 let, dospívajícím a dospělým častěji pozorovány následující nežádoucí účinky:
Velmi časté: horečka (28,9 %), průjem (11,8 %), chřipkovité onemocnění (11,2 %), dráždivost (11,0 %) Časté: ztráta chuti k jídlu, zvracení, kožní vyrážka Méně časté: kašel
Hlášení nežádoucích účinků
Pokud Vy nebo Vaše dítě zaznamenáte kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek IXIARO uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte vakcínu po uplynutí doby použitelnosti uvedené na štítku a krabičce za „EXP:“ Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C).
• Chraňte před mrazem. Pokud vakcína zmrzla, nesmí by být použita.
• Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek IXIARO obsahuje
1 dávka (0,5 ml) vakcíny IXIARO obsahuje:
virus japonské encefalitidy kmen SA14-14-2 (inaktivovaný)1,2 6 AU3 odpovídající síle < 460 ng ED50
1 Produkováno v buňkách Vero.
2 Adsorbováno na hydratovaný hydroxid hlinitý, (přibližně 0,25 miligramů Al3+).
3 Jednotek antigenu.
Jako adjuvans (nosič) je v této vakcíně hydroxid hlinitý.
Dalšími pomocnými látkami jsou: chlorid sodný, dihydrogenfosforečnan draselný, dodekahydrát hydrogenfosforečnanu sodného, voda na injekci.
Jak přípravek IXIARO vypadá a co obsahuje toto balení
Vakcína IXIARO je injekční suspenze (0,5 ml ve skleněné injekční stříkačce s nebo bez samostatné jehly, balení obsahuje 1 injekční stříkačku).
Vakcína IXIARO je bílá a slabě mléčná sterilní suspenze, která se při protřepání stává stejnorodou.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Valneva Austria GmbH Campus Vienna Biocenter 3 A-1030 Vídeň Rakousko
E-mail: infoixiaro@valneva.com Výrobce:
Valneva Scotland Ltd.
Oakbank Park Road,
Livingston EH53 0TG, Skotsko,
Velká Británie
Pokud máte zájem o další informace o tomto léku, kontaktujte držitele rozhodnutí o registraci na e-mailové adrese: infoixiaro@valneva.com
Tato příbalová informace byla naposledy revidována .
Další zdroje informací
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/. Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.>
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Předplněná injekční stříkačka je určena pouze k jednorázovému podání a nesmí být používána pro více než 1 osobu. Předplněnou injekční stříkačku je možné ihned použít. Neobsahuje-li balení jehlu, použijte sterilní jehlu.
Nepoužívejte přípravek, je-li fólie blistru porušena, nebo je balení jinak poškozeno.
Při uchovávání může být patrná jemná bílá usazenina s bezbarvým supernatantem.
Stříkačku je třeba před podáním dobře protřepat, až se vytvoří bílá neprůhledná homogenní suspenze. Jsou-li v přípravku po protřepání přítomny částečky nebo jeví-li změnu barvy anebo se zdá, že je poškozena injekční stříkačka, přípravek nepodávejte.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Informace o podání dávky 0,5 ml vakcíny IXIARO osobám ve věku od 3 let Při podávání plné dávky 0,5 ml dodržujte následující postup:
1. Protřepejte stříkačku, aby vznikla homogenní suspenze.
2. Opatrně kroutivým pohybem sejměte kryt hrotu stříkačky. Nepokoušejte se kryt odlomit ani stáhnout, protože by se mohla poškodit stříkačka.
3. Na předplněnou inj ekční stříkačku nasaďte j ehlu.
Informace o přípravě dávky 0,25 ml vakcíny IXIARO pro použití u dětí ve věku do 3 let Při podávání dávky 0,25 ml dětem ve věku od 2 měsíců do < 3 let dodržujte následující postup:
1. Protřepejte stříkačku, aby vznikla homogenní suspenze.
2. Opatrně kroutivým pohybem sejměte kryt hrotu stříkačky. Nepokoušejte se kryt odlomit ani stáhnout, protože by se mohla poškodit stříkačka.
3. Na předplněnou injekční stříkačku nasaďte jehlu.
4. Držte injekční stříkačku ve svislé poloze.
5. Zlikvidujte přebytečný objem vakcíny vytlačením pístu směrem nahoru až po okraj červené čáry na válci stříkačky, který je označen červenou šipkou (viz Obrázek 1)2.
6. Před injekčním podáním zbývajícího objemu nasaďte na injekční stříkačku novou sterilní jehlu.
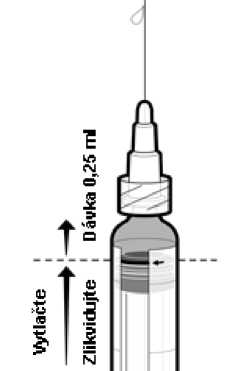
Obrázek 1: Příprava k podání dávky 0,25 ml
33
Jestliže vytlačíte píst za červenou čáru, není jisté, že bude podána dávka 0,25 ml a musíte použít novou stříkačku.
Jestliže vytlačíte píst za červenou čáru, není jisté, že bude podána dávka 0,25 ml a musíte použít novou stříkačku.