Ionsys 40 Mikrogramů/Dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
IONSYS 40 mikrogramů v jedné dávce transdermálního systému
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden systém IONSYS obsahuje fentanyli hydrochloridum odpovídající fentanylum 9,7 mg a uvolňuje 40 mikrogramů fentanylu v jedné dávce, maximálně 80 dávek (3,2 mg/24 hodin).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Transdermální systém
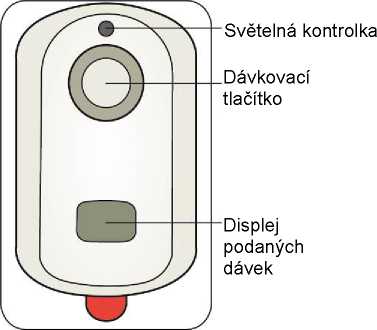
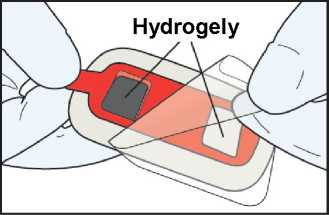
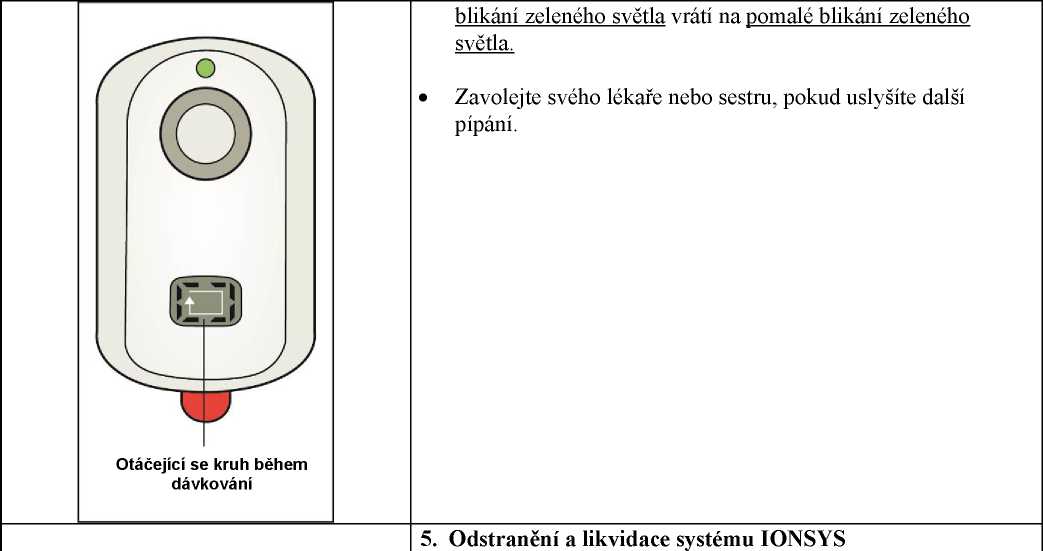
Systém IONSYS se skládá z elektronického řídícího systému a dvou hydrogelových lékových jednotek. Řídící jednotka je bílá s označením „IONSYS®“ a má digitální displej, světlé okénko a zapuštěné tlačítko aktivace dávky. Léková jednotka je modrá na straně, kde se připojuje k řídící jednotce a má červené spodní pouzdro obsahující hydrogely, z nichž jeden obsahuje fentanyl. Sestavený výrobek IONSYS měří 47 mm x 75 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Systém IONSYS je určen k léčbě akutní středně silné až silné pooperační bolesti u dospělých pacientů.
4.2 Dávkování a způsob podání
Systém IONSYS je omezen pouze na nemocniční péči. Léčba má být zahájena a udržována pod vedením lékaře se zkušenostmi s podáváním opioidů. Vzhledem k dobře známému potenciálu pro zneužití fentanylu má lékař prověřit pacientovu anamnézu ohledně zneužívání léků/drog (viz bod 4.4).
Dávkování
Pacienti mají být před použitím systému IONSYS titrováni na přijatelnou úroveň analgezie (viz bod 5.1).
Systém IONSYS má aktivovat pouze pacient.
Jedna dávka ze systému IONSYS uvolňuje 40 mikrogramů fentanylu po dobu 10 minut, maximálně 240 mikrogramů za hodinu (6 dávek, každá trvající 10 minut). Systém IONSYS bude fungovat 24 hodin po sestavení nebo pro 80 dávek, podle toho, co nastane dřív a pak se stane nefunkční.
Po 24 hodinách nebo 80 dávkách musí být použít nový systém, pokud je to potřeba. Každý nový systém má být umístěn na nové místo na kůži. S každou novou aplikací systému IONSYS je možné, že bude pacient využívat systém IONSYS častěji než během zbytku 24hodinového dávkovacího období a to z důvodu nižší absorpce fentanylu ze systému po několik prvních hodin (viz bod 5.2).
Maximální doba léčby je 72 hodin, i když většina pacientů potřebuje pouze jeden systém.
Pacienti nemají mít současně více než jeden systém.
Použitý systém nesmí být pacientovi znovu aplikován.
Systém IONSYS má být před propuštěním pacienta odstraněn.
Starší pacienti
Podobně jako u všech přípravků s obsahem fentanylu může být u starších pacientů clearance fentanylu snížena s následným prodloužením poločasu. U starších pacientů není nutná žádná specifická úprava dávky. Starší pacienti by však měli být sledováni z hlediska nežádoucích účinků fentanylu (viz bod 4.4 a 4.8).
Porucha funkce jater nebo ledvin
Systém IONSYS se má s opatrností používat u pacientů se středně těžkým nebo těžkým poškozením funkce jater nebo ledvin (viz bod 4.4).
Pediatrická populace
Bezpečnost a účinnost systému IONSYS u dětí a dospívajících mladších než 18 let nebyla stanovena. V současnosti dostupné údaje jsou uvedeny v bodě 4.8, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Způsob podání
Systém IONSYS je určen pouze pro transdermální podání.
Opatření, která je nutno učinit před manipulací s léčivým přípravkem nebo před jeho podáním Při manipulaci se systémem IONSYS je nutno nosit rukavice. Aby nedošlo k perorálnímu požití hydrogelu obsahujícího fentanyl, což by mohlo způsobit život ohrožující hypoventilaci nebo smrt, nesmí hydrogel přijít do styku s ústy nebo jinými oblastmi sliznice.
Pacienti nesmí systém IONSYS namočit. Dlouhotrvající kontakt s vodou může ovlivnit funkčnost systému a způsobit jeho odpadnutí.
Příprava místa aplikace
Systém IONSYS musí být aplikován na intaktní, nepodrážděnou a neozářenou kůži. Systém IONSYS nesmí být umístěn na abnormálních místech kůže, jako jsou jizvy, popáleniny, tetování a podobně. IONSYS nesmí být také umístěn na kůži, na které byly použity lokální léky. Ochlupení v místě aplikace má být před aplikací systému sestřiženo (nikoli oholeno). IONSYS nemá být aplikován na dříve použité místo na kůži.
Místo určené k aplikaci má být ošetřeno standardním alkoholovým tamponem a kůže má před aplikací systému IONSYS úplně oschnout. K očištění místa aplikace se nemají používat žádná mýdla, oleje, pleťová mléka nebo jakékoli jiné prostředky, které mohou podráždit kůži nebo narušit její absorpční schopnost.
Sestavení systému IONSYS
IONSYS nemá být používán, pokud jsou víčko zásobníku nebo sáček obsahující lékovou jednotku porušené nebo poškozené.
Při sestavení systému IONSYS mají být používány rukavice. Zásobník se otevře zatažením za víčko. Otevření sáčku obsahujícího lékovou jednotku je nutno zahájit v naříznuté části a dále opatrně odtrhnout vrchní část sáčku. Léková jednotka se vyjme ze sáčku a řídící jednotka se nasadí srovnáním tvaru a silným zatlačením obou částí do sebe.
Po sestavení se na digitálním displeji řídící jednotky provede krátký automatický test, během kterého se ozve pípnutí, červené světlo jednou blikne a na digitálním displeji bude blikat číslo 88. Na konci automatického testu bude na displeji svítit číslo 0 a pomalu bude blikat zelené světlo, které označuje, že je systém IONSYS připraven k použití.
Aplikace systému IONSYS
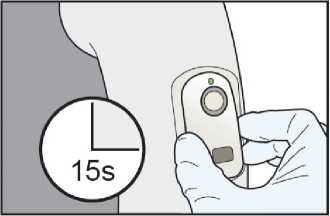
Průhledná plastová folie, která kryje lepivou vrstvu, se opatrně odstraní a vyhodí tak, aby nedošlo ke styku s hydrogelem. Systém IONSYS se má silně přitlačit lepicí plochou na kůži hrudníku nebo homí části paže pacienta po dobu nejméně 15 sekund. Tlak má být veden prsty po zevním okraji systému tak, aby byla zaručena adheze na kůži. Pokud se kdykoli během užívání systém uvolní z kůže, může být k zajištění dokonalého kontaktu s kůží použita hypoalergenní náplast. Při aplikaci náplasti je třeba dbát na to, abyste nepřelepili světelné okénko, digitální displej nebo dávkovací tlačítko. Dávkovací tlačítko se nesmí stisknout.
Další podrobnosti, viz bod 6.6.
Aplikace dávky
Zapuštěné dávkovací tlačítko se nachází na řídící jednotce systému IONSYS. Pro zahájení podávání dávky fentanylu má pacient stisknout a uvolnit dávkovací tlačítko dvakrát během 3 sekund. Systém IONSYS má aktivovat pouze pacient.
Po úspěšném zahájení aplikace dávky systém IONSYS pípne, čímž označuje začátek podávání. Zelené světlo se změní z pomalu blikajícího na rychle blikající a digitální displej bude přepínat mezi rotujícím kruhem a počtem dokončených dávek během celého 10minutového dávkovacího cyklu. Další dávka nemůže být zahájena, dokud není dokončen předchozí 10minutový dávkovací cyklus. Stisknutí tlačítka během aplikace dávky nebude mít za následek podání další dávky fentanylu. Po úplném podání 10minutové dávky bude zelené světlo opět pomalu blikat, na displeji bude zobrazeno číslo počtu podaných dávek a IONSYS bude připraven k dalšímu použití pacientem.
Na konci 24hodinové používání nebo po podání 80 dávek zelené světlo zhasne, a bude střídavě svítit počet podaných dávek. Blikající digitální displej je možno vypnout stisknutím dávkovacího tlačítka po dobu šesti sekund.
Odstranění
Systém IONSYS se odstraní z těla pacienta zvednutím za červené poutko a odloupnutím z místa na kůži. Při odstraňování systému IONSYS z kůže se musí používat rukavice a přijmout taková opatření, aby nedošlo ke kontaktu s hydrogely. Pokud dojde při odstraňování ke kontaktu léčivého přípravku s kůží, kontaktní plocha musí být důkladně opláchnuta vodou bez použití mýdla.
Systém IONSYS může být kdykoliv odstraněn. Jakmile však byl systém jednou odstraněn, nemá se použít znovu. Pokud pacient potřebuje dodatečnou léčbu bolesti, může být aplikován nový systém na nové místo na kůži na horní zevní části paže nebo na hrudníku.
Pro likvidaci je třeba dodržovat zvláštní opatření (viz bod 6.6).
Řešení problémů
Každý systém IONSYS je navržen až pro 80 podání 10minutových dávek fentanylu po dobu 24 hodin. Níže uvedená tabulka představuje různé chybové zprávy, které se mohou objevit, společně s pravděpodobnou příčinou a nutným opatřením.
|
Chybové hlášení / zpětná vazba |
Pravděpodobná příčina |
Nutné opatření |
|
• Žádné světlo • Žádné pípnutí • Žádné údaje na displeji |
Vybitá baterie nebo chyba systému |
1. Nepoužívejte systém 2. Zlikvidujte systém podle pokynů v bodě 6.6 3. Umístěte nový systém na jiné místo na kůži |
|
• Blikání červeného světla po dobu 15 sekund • Pípání po dobu 15 vteřin • Systém není bezpečně přilepený |
Špatný kontakt s pokožkou |
1. Zabezpečte systém na kůži pacienta pevným stiskem okrajů nebo použitím hypoalergenní náplasti 2. Pokud systém znovu pípne, odstraňte jej a zlikvidujte a umístěte nový systém na jiné místo na kůži. |
|
• Nepřetržitě blikající červené světlo • Nepřetržité pípání • Stálé číslo na displeji |
Systémová chyba |
1. Odstraňte systém z těla pacienta 2. Přidržte dávkovací tlačítko, dokud se zvukový signál nevypne a displej nezhasne 3. Zlikvidujte systém podle pokynů v bodě 6.6 4. Umístěte nový systém na jiné místo na kůži |
|
• Žádné světlo • Žádné pípnutí • Blikající číslo na displeji |
Konec použití po 24 hodinách nebo 80 dávkách |
1. Odstraňte systém z těla pacienta 2. Přidržte dávkovací tlačítko, dokud displej nezhasne 3. Zlikvidujte systém podle pokynů v bodě 6.6 4. Umístěte nový systém na jiné místo na kůži |
Pokud je podezření na selhání zařízení nebo na poruchu, měl by být zdravotnickým pracovníkem systém IONSYS okamžitě odstraněn z těla pacienta a ihned kontaktována společnost The Medicines Company.
Zdravotnický pracovník se musí ujistit, že pacient chápe, že v případě podezření na selhání zařízení nebo poruchy musí neprodleně informovat zdravotnického pracovníka.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Závažná respirační deprese nebo cystická fibróza.
4.4 Zvláštní upozornění a opatření pro použití
Před každým chirurgickým zákrokem by se měl zdravotnický pracovník ujistit, že byl pacient řádně informován o používání systému IONSYS po operaci.
Po použití zůstává v systému IONSYS potenciálně nebezpečné množství fentanylu. Pokyny pro likvidaci jsou uvedeny v bodě 6.6.
Systém IONSYS má být odstraněn před vyšetřením magnetickou rezonancí (MRI), kardioverzí, defibrilací, rentgenovým vyšetřením, CT vyšetřením nebo provedením diatermie.
Nadměrné pocení může snížit dodávku fentanylu.
Respirační deprese
Systém IONSYS má být aktivován pouze pacientem, aby se zabránilo možnému předávkování.
Systém IONSYS může vyvolat významnou respirační depresi. Pacienti musí být sledováni z hlediska těchto účinků (viz bod 4.9).
Současné podávání léčivých přípravků působících na CNS může zvýšit riziko respirační deprese (viz bod 4.5).
Chronické plicní onemocnění
U pacientů s chronickou obstrukční plicní nemocí nebo u pacientů s predispozicí k hypoventilaci se mohou vyskytnout mnohem závažnější nežádoucí účinky. U těchto pacientů mohou opioidy snížit respirační úsilí a zvýšit rezistenci dýchacích cest.
Poranění hlavy a zvýšený nitrolební tlak
Fentanyl nesmí být používán u pacientů, kteří mohou být zvláště citliví k intrakraniálním účinkům retence CO2, jako jsou pacienti s prokázaným zvýšením intrakraniálního tlaku, sníženým vědomím nebo bezvědomím. Opioidy mohou maskovat klinický průběh u pacientů s poraněním hlavy. Fentanyl má být používán s opatrností u pacientů s mozkovými nádory nebo jinými významnými expanzivními nitrolebními procesy.
Srdeční onemocnění
Fentanyl může vyvolat bradykardii nebo hypotenzi, a proto má být podáván s opatrností pacientům s bradyarytmiemi nebo jakýmkoli závažným kardiovaskulárním onemocněním.
Paralytický ileus
Systém IONSYS má být používán s opatrností u pacientů s paralytickým ileem.
Možnost zneužívání a závislosti
Fentanyl má dobře známý potenciál ke zneužití. Pacienti s anamnézou drogové závislosti / abúzu alkoholu jsou více ohroženi z hlediska rozvoje závislosti a abúzu při léčbě opioidy. Lékaři mají prověřit pacientovu anamnézu drogové závislosti a tyto pacienty pečlivě sledovat.
Při opakovaném podávání opioidů může dojít ke vzniku tolerance, fyzické závislosti a psychologické závislosti. Iatrogenní závislost po podávání opioidů je vzácná. Fentanyl může být zneužíván způsobem, který je podobný dalším agonistům opioidů. Zneužívání nebo chtěné špatné použití systému IONSYS může vést k předávkování anebo ke smrti.
Onemocnění jater
Fentanyl je metabolizován v játrech na neaktivní metabolity. Onemocnění jater může zpomalit jeho eliminaci. Pacienti s poruchou funkce jater musí být pečlivě sledováni z hlediska příznaků toxicity fentanylu.
Onemocnění ledvin
Ledvinami se v nezměněné formě vylučuje méně než 10 % podaného fentanylu. Na rozdíl od morfinu nejsou ledvinami vylučovány žádné aktivní metabolity fentanylu. Údaje získané po intravenózní
aplikaci fentanylu u pacientů s renálním selháním naznačují, že distribuční objem fentanylu může být pozměněn dialýzou. To může ovlivnit sérové koncentrace. Pokud jsou pacienti s poškozením ledvin léčeni systémem IONSYS, je zapotřebí pečlivě sledovat projevy toxicity fentanylu.
Starší pacienti
Starší pacienti mají být během použití prostředku IONSYS pozorně sledování z hlediska nežádoucích účinků fentanylu (viz bod 4.2 a 4.8).
Obézní pacienti
Celkový profil nežádoucích účinků u morbidně obézních pacientů (BMI > 40) nenaznačuje významný rozdíl v bezpečnosti ve srovnání s pacienty s BMI < 40. Je však třeba opatrnosti při předepisování systému IONSYS morbidně obézním pacientům, protože mohou být vystaveni zvýšenému riziku dalších přidružených respiračních onemocnění (tzn. spánková apnoe) potenciálně predisponujících k hypoventilaci nebo závažnějším nežádoucím účinkům (viz bod 4.8).
Poruchy sluchu
Systém IONSYS musí být používán s opatrností u pacientů s poruchami sluchu, kteří nemusí být schopni slyšet zvukové signály systému.
Operace oblasti hrudníku a horní části dutiny břišní
Údaje o použití u pacientů při operacích v oblasti hrudníku a horní části dutiny břišní jsou pouze omezené. U těchto pacientů by proto měl být systém IONSYS používán s opatrností.
Fyzický stav
Bezpečnost systému IONSYS nebyla stanovena u pacientů s klasifikací funkčního stavu IV podle Americké anesteziologické společnosti (ASA), (to jsou pacienti s těžkým systémovým onemocněním, které je trvalým život ohrožujícím stavem).
Pacienti s genetickým polymorfismem ovlivňujícím CYP3A4 a CYP3A5.
Publikovaná literatura ukazuje potenciál pro zvýšení expozice fentanylu u pacientů s genetickým polymorfismem postihujícím CYP3A4 a CYP3A5 s malou variabilitou koncentrací s transdermálním podáním, proto by se měl systém IONSYS používat u těchto pacientů s opatrností (viz bod 5.2)
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné užívání jiných léků s tlumivým účinkem na centrální nervový systém, včetně dalších opioidů, sedativ nebo hypnotik, celkových anestetik, fenothiazinů, trankvilizérů, myorelaxancií, antihistaminik se sedativním účinkem a alkoholických nápojů, může mít aditivní tlumivý účinek.
Může dojít k hypoventilaci, hypotenzi a hluboké sedaci nebo kómatu. Užívání výše uvedených léčiv v kombinaci se systémem IONSYS proto vyžaduje zvláštní péči a sledování pacienta.
Fentanyl, léčivá látka s vysokou clearance, je rychle a extenzivně metabolizován převážně prostřednictvím CYP3A4. Itrakonazol, silný inhibitor CYP3A4, užívaný perorálně v dávce 200 mg/den po čtyři dny nevykazuje významný účinek na farmakokinetiku intravenózně podaného fentanylu. Perorální ritonavir, jeden z nejsilnějších inhibitorů CYP3A4, redukuje clearance intravenózního fentanylu o dvě třetiny. Současné užívání silných inhibitorů CYP3A4 (např. ritonavir, ketokonazol, itrakonazol, troleandomycin, klaritromycin a nelfinavir) nebo středně silných inhibitorů CYP3A4 (např. amprenavir, aprepitant, diltiazen, erytromycin, flukonazol, fosamprenavir, grapefruitový džus a verapamil) se systémem IONSYS může mít za následek zvýšení plazmatických koncentrací fentanylu, což může zvýšit nebo prodloužit terapeutický účinek i nežádoucí účinky a může způsobit závažnou respirační depresi. V tomto případě musí být pacient podroben mimořádnému dohledu a péči. Současné užívání ritonaviru nebo jiných silných nebo středně silných inhibitorů CYP3A4 a systému IONSYS se nedoporučuje, pokud není pacient pečlivě monitorován.
Současné užívání částečných opioidních agonistů / antagonistů (např. buprenorfin, nalbufin, pentazocin) se nedoporučuje. Mají vysokou afinitu k opioidním receptorům s relativně nízkou vnitřní aktivitou a proto částečně antagonizují analgetický účinek fentanylu a mohou vyvolat abstinenční příznaky u pacientů závislých na opioidech.
Serotoninergní léčivé přípravky
Současné podávání fentanylu se serotoninergní látkou, jako například selektivní inhibitor zpětného vychytávání serotoninu (SSRI) nebo inhibitor zpětného vychytávání serotoninu a norepinefrinu (SNRI) nebo inhibitoru monoaminooxidázy (IMAO), může zvýšit riziko serotoninového syndromu, což je stav potenciálně ohrožující život.
Systém IONSYS se nedoporučuje používat u pacientů, kteří užívali během posledních 14 dnů inhibitory monoaminooxidázy (IMAO), protože se může objevit závažná a nepředvídatelná potenciace opioidních analgetik inhibitory MAO.
Studie interakcí byly provedeny pouze u dospělých.
Topické léčivé přípravky
Je třeba se vyhnout používání systému IONSYS na kůži, na které byl aplikován nějaký jiný topický přípravek. Je třeba zvolit alternativní místo aplikace.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o podávání fentanylu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Systém IONSYS nemá být během těhotenství používán, pokud to není nezbytně nutné.
Podávání během porodu se nedoporučuje, protože fentanyl prochází placentou a fetální dýchací centrum je citlivé na opiáty. Pokud je systém IONSYS v tomto období podáván matce, musí být pro dítě rychle dostupné antidotum. Při dlouhodobé léčbě může fentanyl vyvolat abstinenční příznaky u novorozence.
Kojení
Fentanyl se vylučuje do lidského mateřského mléka. Kojení se nedoporučuje po dobu 24 hodin po odstranění systému IONSYS.
Fertilita
Nejsou k dispozici žádné klinické údaje o účincích fentanylu na plodnost. Studie na potkanech odhalily snížení fertility a zvýšení embryonální mortality (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Opioidní analgetika narušují duševní anebo fyzickou schopnost požadovanou pro provádění potenciálně nebezpečných úkolů (např. řízení vozidla nebo obsluha strojů). Pacienti mají být poučeni, aby neřídili motorová vozidla ani neobsluhovali stroje, pokud zaznamenají ospalost, závratě nebo poruchy zraku.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky byly nauzea, zvracení a reakce v místě aplikace, jako je zarudnutí a svědění. Tyto nežádoucí účinky byly většinou mírné až středně závažné. Nejzávažnějšími nežádoucími účinky byly hypotenze a apnoe a všichni pacienti mají být pečlivě sledováni z hlediska těchto účinků.
Tabulkový přehled nežádoucích účinků
Následující nežádoucí účinky byly hlášeny v průběhu klinických studií použití systému IONSYS nebo po jeho uvedení na trh. Všechny nežádoucí účinky jsou řazeny podle třídy orgánových systémů a četnosti: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10000 až < 1/1000).
|
Třída orgánových systémů |
Velmi časté |
Časté |
Méně časté |
Vzácné |
|
Infekce a infestace | ||||
|
Poruchy krve a lymfatického systému |
Anemie | |||
|
Poruchy metabolismu a výživy |
Snížená chuť k jídlu |
Hypokalcemie Hypoglykemie Hypokalémie | ||
|
Psychiatrické poruchy |
Neobvyklé sny Neklid Úzkost |
Neobvyklé myšlenky | ||
|
Poruchy nervového systému |
Závrať Bolesti hlavy |
Migréna Parestézie Ospalost Synkopa |
Dysgeusie Snížená citlivost | |
|
Poruchy oka |
Rozmazané vidění | |||
|
Poruchy ucha a labyrintu |
Závratě | |||
|
Srdeční poruchy |
Bradykardie | |||
|
Cévní poruchy |
Hypertenze Ortostatická Vazodilatace | |||
|
Respirační, hrudní a mediastinální poruchy |
Hypoxie |
Apnoe Škytavka Hypoventilace |
Plicní onemocnění | |
|
Gastrointestinální poruchy |
Zácpa |
Sucho v ústech Dyspepsie Plynatost Ileus |
Distenze břicha Říhání | |
|
Poruchy kůže a podkožní tkáně |
Pruritus |
Hyperhidróza | ||
|
Poruchy svalové a kosterní soustavy a |
Bolest zad Bolest končetin |
Hypertonie Myalgie |
|
pojivové tkáně | ||||
|
Poruchy ledvin a močových cest |
Retence moči |
Oligurie | ||
|
Celkové poruchy a reakce v místě aplikace |
Zarudnutí v místě aplikace |
Otok v místě aplikace Svědění v místě aplikace Reakce v místě aplikace Puchýřky v místě aplikace |
Bolest v místě aplikace Sucho v místě aplikace Papuly v místě aplikace Astenie Reakce v místě aplikace Bolest |
Parestézie v místě aplikace Otok v místě vpichu Bolestivé místo vpichu Edém |
|
Poranění, otravy a procedurální komplikace |
Komplikace hojení | |||
|
Chirurgické a léčebné postupy |
Léčba gastrointestinální poruchy |
Pediatrická populace
Údaje o systému IONSYS v pediatrii jsou omezeny na informace z jedné klinické studie. V této studii bylo po neadekvátní analgézii při použití systému IONSYS fentanyl 25 mikrogramů léčeno 28 pediatrických pacientů ve věku 6 až 16 let pomocí systému IONSYS fentanyl 40 mikrogramů. Mezi těmito pacienty byl výskyt nauzey podobný jako u dospělých pacientů; zvracení (32,1 %) a horečka (60,7 %) však byly hlášeny s vyšším výskytem u dětských pacientů v porovnání s dospělými. Omezená velikost celkové pediatrické expozice je v souhrnu nedostatečná pro doporučení bezpečného a účinného dávkování systému IONSYS u pacientů mladších než 18 let.
Starší populace
Starší pacienti (> 65 let) tvořili 28 % (499 z 1763) celkové kontrolované expozice systému IONSYS 40 mikrogramů v klinických studiích, s přibližně 10% (174 z 1763) expozicí u pacientů starších 75 let. Pro všechny kontrolované studie nebyly pozorovány žádné zásadní rozdíly v bezpečnosti systému IONSYS 40 mikrogramů u starších pacientů (> 65 let, včetně subpopulace > 75 let) a dospělých pacientů. To znamená, že profil nežádoucích účinků nenaznačuje významný rozdíl v bezpečnosti ve srovnání s pacienty mladšími než 65 let.
Obézní pacienti
Kontrolované klinické studie populace neprokázaly žádný významný rozdíl profilu nežádoucích účinků u pacientů s BMI > 40 (86 z 1436 nebo 6 %) ve srovnání s pacienty s BMI < 40. U těchto pacientů se však doporučuje opatrnost (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Projevem předávkování fentanylem je zesílení jeho farmakologických účinků, z nichž nejvýznamnějším je respirační deprese (viz bod 5.2).
Léčba
Ke zvládnutí respirační deprese je nutné systém IONSYS okamžitě odstranit a fyzicky nebo verbálně pacienta stimulovat. Po těchto opatřeních může následovat podání specifického antagonisty opioidů, jako je naloxon, na základě klinického zhodnocení ošetřujícím zdravotnickým pracovníkem. Respirační deprese po předávkování může přesáhnout dobu účinku antagonisty opioidů. Poločas antagonisty může být krátký, a proto je nezbytné opakované podání nebo infuze antagonisty. Zvrat narkotického účinku může vyústit v akutní propuknutí bolesti a uvolnění katecholaminů.
Vyžaduje-li to klinický stav, je třeba zajistit a udržovat průchodnost dýchacích cest pomocí orofaryngeálního vzduchovodu nebo endotracheální rourky. Měl by být podán kyslík a v případě potřeby zavedena asistovaná nebo řízená ventilace. Dále je nutno zajistit adekvátní tělesnou teplotu a přívod tekutin.
Jestliže dojde k závažné nebo přetrvávající hypotenzi, je třeba uvažovat o hypovolemii a stav upravit vhodným parenterálním přívodem tekutin nebo jiným zásahem dle potřeby na základě klinického zhodnocení ošetřujícím zdravotnickým pracovníkem.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetika; deriváty fenylpiperidinu; ATC kód: N02AB03. Mechanismus účinku
Fentanyl je opioidní analgetikum působící převážně na opioidní p-receptor.
Farmakodynamické účinky
Jeho primárními terapeutickými účinky jsou analgezie a sedace. Jeho sekundárními farmakologickými účinky jsou respirační deprese, bradykardie, hypotermie, zácpa, mióza, fyzická závislost a euforie (viz bod 5.2).
Klinická účinnost a bezpečnost
Účinnost a bezpečnost systému IONSYS k léčbě akutní, středně těžké až těžké pooperační bolesti byla hodnocena v sedmi kontrolovaných studiích u 1763 pacientů se systémem IONSYS: tři placebem kontrolované studie a čtyři aktivně kontrolované studie. V placebem kontrolovaných studiích bylo zahrnuto 791 pacientů, kterými byly převážně ženy (72 %), běloši (82 %), s průměrným věkem od 45 do 54 let (rozmezí 18 až 90 let) a tyto studie byly primárně tvořeny operacemi dolní části břicha (včetně pánve) a ortopedickými zákroky na kostech. Pacienti byli do studie zařazeni krátce po větších chirurgických zákrocích v případě, že neměli toleranci vůči opioidům, pokud se očekávalo nekomplikované zotavení a pokud vyžadovali minimálně 24 hodin parenterální léčby opioidy. Nebyla dovolena analgetika s dlouhotrvajícím účinkem nebo jakákoli neopioidní analgetika. Pacienti byli nejprve titrování na uspokojivou úroveň analgezie nitrožilním fentanylem nebo morfinem a pak byli randomizováni pro systém IONSYS nebo odpovídající systém s placebem. Během prvních 3 hodin po náboru bylo dle potřeby možné použít doplňkový bolus intravenózního fentanylu tak, aby byla dosažena uspokojivá analgezie. Potom zůstalo ve studii 727 pacientů, kteří používali pouze systém IONSYS nebo řídící jednotku a byla hodnocena účinnost.
Primárním cílovým parametrem v každé placebem kontrolované studii byl podíl ukončení z důvodu nedostatečné analgezie v období od 3 do 24 hodin po aplikaci systému IONSYS. Jak je znázorněno v níže uvedené tabulce 1, systém IONSYS (fentanyl hydrochlorid) byl účinnější než placebo ve všech studiích. Další analýzy naznačují, že druh chirurgického zákroku neměl vliv na vývoj u cílových parametrů účinnosti a účinnost systému IONSYS byla podobná v celém rozsahu studovaných indexů tělesné hmotnosti (BMI < 25 až > 40 kg/m2).
|
Tabulka 1: Pacienti v placebem kontrolovaných studiích (N = 727) | |||
|
Procento pacientů (n), kteří byli vyřazeni z důvodu | |||
|
neadekvátní analgezie v |
čase 3 až 24 hodin | ||
|
Studie |
Systém IONSYS n = 454 |
Placebo n = 273 |
p- hodnota |
|
C-2001-011 |
27 % (64/235) |
57 % (116/204) |
<0,0001 |
|
C-2000-008 |
25 % (36/142) |
40 % (19/47) |
0,049 |
|
C-95-016 |
8 % (6/77) |
41 % (9/22) |
0,0001 |
Systém IONSYS byl také hodnocen ve čtyřech aktivně kontrolovaných studiích (převážně ženy (65 %), běloši (85 %), s průměrným věkem 55 let (rozmezí 18 až 91 let) a tyto byly tvořeny zejména operacemi dolní části břicha a ortopedickými zákroky na kostech) s použitím standardní intravenózní pacientem řízené analgezie (PCA) s morfinovým režimem jako srovnávací skupiny. V těchto studiích bylo 1313 pacientů, kteří podstupovali velkou operaci, randomizováno pro PCA s intravenózním morfinem (1 mg morfinu bolus, 5 minut přerušení, celkem 10 mg/h) podávaným prostřednictvím pumpy a 1288 pacientů randomizováno pro systém IONSYS. Podobně jako v placebem kontrolovaných studiích byli pacienti v bezprostředním pooperačním období titrováni na přiměřenou intravenózní analgezii fentanylem nebo morfinem dle nemocničního protokolu. Jakmile byla dosažena uspokojivá analgezie, byli pacienti randomizováni pro systém IONSYS nebo intravenózní léčbu PCA s morfinem. Pacienti byli poučeni, aby používali systém k úlevě od bolesti.
Tyto studie hodnotily systém IONSYS proti intravenózní PCA s morfinem při různých chirurgických zákrocích, které jsou často v klinické praxi prováděné. Studie C-2000-007 hodnotila pacienty po břišní, hrudní nebo ortopedické operaci. Studie CAPSS-319 hodnotila pacienty po totální náhradě kyčelního kloubu. Studie CAPSS-320 hodnotila systém IONSYS u pacientů po břišní a pánevní operaci a studie FEN-PPA-401 hodnotila pacienty po velké břišní nebo ortopedické operaci. Pacienti by mohli setrvat v dané studii až do 72 hodin, pokud po tuto dobu vyžadovali parenterální opioidní analgetika. Nový systém IONSYS byl aplikován každých 24 hodin na různá místa na kůži nebo dříve, pokud byly použity všechny dávky. Doplňková intravenózní opioidní medikace (fentanyl nebo morfin) byla povolena pouze během prvních 3 hodin léčby systémem INOSYS nebo PCA s morfinem. Souběžné použití analgetik nebylo povoleno po 3 hodinách ve studiích C-2000-007 a CAPSS-320. Ve studii CAPSS-319 dostala polovina pacientů v každé skupině rofecoxib perioperačně a ve studii FEN-PPA-401 mohli pacienti používat neopioidní analgetika během období studie. Primárním cílovým parametrem účinnosti bylo globální hodnocení metody kontroly bolesti pacientem za 24 hodin používané pro hodnocení ekvivalence mezi systémem IONSYS a intravenózní PCA s morfinem pomocí předem specifikované meze ekvivalence ± 10 % s 2stranným 95 % intervalem spolehlivosti. Pacienti a zkoušející byli požádáni o hodnocení metody kontroly bolesti pacienta jako špatná, přiměřená, dobrá nebo excelentní. Výsledky účinnosti na konci 24 hodin jsou uvedeny v tabulce 2 níže pro populaci hodnotitelných pacientů. Jak je uvedeno níže, primární cílový parametr, podíl pacientů udávajících hodnocení jako „dobrá nebo excelentní“ pro dvě metody kontroly bolesti ve všech čtyřech studiích, vykázal ekvivalenci s každým 95 % intervalem spolehlivosti obsaženým v předem specifikovaných mezích ekvivalence ± 10 %.
Tabulka 2
Hodnotitelní pacienti ze studií s aktivním komparátorem (n = 2569)
|
Studie č. |
Systém IONSYS (fentanyl) n = 1271 |
IV-PCA (morfin) n = 1298 |
95 % ISa,b |
|
Globální hodnocení metody kontroly bolesti pacientem - 1. 24 hodin (% pacientů s hodnocením dobré nebo excelentní) | |||
|
C-2000-007 |
75 % (232/310) |
78 % (246/316) |
so-S- ©x <> ss 0\ r^. i ^ w cn |
|
CAPSS-319 |
84 % (326/389) |
83 % (331/397) |
(-4,7 %, 5,6 %)a,b |
|
CAPSS-320 |
86 % (214/250) |
85 % (212/251) |
(-5,1 %, 7,4 %)a,b |
|
FEN-PPA- 401 |
87 % (279/322) |
88 % (293/334) |
(-6,2 %, 4,0 %)a,b |
a 95 % Interval spolehlivosti pro rozdíl v poměrech b Předem stanovená hranice ekvivalence byla ± 10 %
V různých aktivně kontrolovaných studiích bylo dávkování systému IONSYS podobné jako intravenózní PCA s použitím morfinové pumpy. Průměrné množství doplňkového opioidu použitého během této doby bylo také podobné mezi pacienty, kteří byli léčeni systémem IONSYS nebo PCA s morfinem, tzn. rozsah mezi 4 studiemi v průměrné dávce 5,0 - 7,5 mg morfinu u pacientů léčených systémem IONSYS ve srovnání s průměrnou dávkou 5,4 mg - 7,7 mg morfinu u pacientů, kteří dostávali PCA s morfinem. Pacienti, kteří dokončili 24 hodin léčby systémem IONSYS v sedmi kontrolovaných studiích, použili širokou škálu dostupných 80 dávek s průměrně 29,0 dávkami/pacienta (rozsah 0-93 dávek) s většinou pacientů (56,5 %) užívajících mezi 11 a 50 dávkami. Jeden systém IONSYS poskytl dostatečný počet dávek pro 99 % hodnocených pacientů během 24 hodin.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií se systémem IONSYS u jedné nebo více podskupin pediatrické populace při léčbě akutní bolesti. Informace o použití u dětí, viz bod 4.2.
5.2 Farmakokinetické vlastnosti
Absorpce
Při zahájení každé dávky přenese elektrický proud kůží do systémové cirkulace předem stanovené množství fentanylu ze zásobníku s obsahem léčivé látky. Systém IONSYS dodá v ustáleném stavu nominální dávku 40 mikrogramů fentanylu během každého 10minutového dávkovacího intervalu. Průměrná systémová biologická dostupnost je 87 %. Po odstranění systému po poslední dávce je pokles koncentrace fentanylu v séru podobný, jako po intravenózní aplikaci fentanylu.
Absorpce fentanylu ze systému IONSYS je stejná při aplikaci do horní zevní části paže nebo hrudníku. Pokud je systém aplikován na dolní vnitřní část paže, množství absorbovaného fentanylu je přibližně o 20 % nižší než na horní vnější části paže nebo hrudníku. Farmakokinetika fentanylu je podobná u jednotlivé tak i u vícenásobné 24hodinové aplikace.
Systémová absorpce fentanylu se zvyšuje jako funkce času nezávisle na frekvenci dávkování, s počáteční dávkou přibližně 16 mikrogramů. Absorpce nominální dávky 40 mikrogramů v ustáleném stavu je dosažena asi 12 hodin po aplikaci, což znamená, že kůže se stává pro fentanyl více propustná v průběhu prvních 12 hodin. Farmakokinetický absorpční profil se opakuje při každé aplikaci na nové místo na kůži, a proto s každou novou aplikací bude absorpce na počátku nižší. V důsledku toho je možné, že bude pacient aktivovat systém IONSYS častěji k udržení hladiny fentanylu v krvi.
Pokud byl systém IONSYS aplikován bez aktivace elektrického proudu, průměrná rychlost absorpce fentanylu během 24 hodin byla 2,3 mikrogramu fentanylu/hodinu, což ukazuje na minimální pasivní přenos.
Průměrné sérové koncentrace pozorované u pacientů po operaci byly v rozmezí 0,4-1,5 ng/ml během 24 hodinového dávkovacího intervalu. Obecně platí, že maximální sérová koncentrace fentanylu je dosažena přibližně za 15 minut po iniciaci dávky.
Po vyžádané dávce fentanylu u systému IONSYS vykázal fentanyl absorpční poločas přibližně 15 minut.
Distribuce
Fentanyl je vysoce lipofilní a dobře se distribuuje cévním systémem s velkým zdánlivým distribučním objemem. Fentanyl vykazuje tříkompartmentovou distribuční farmakokinetiku. Po intravenózní aplikaci činí iniciální distribuční poločas přibližně 6 minut, druhý distribuční poločas je 1 hodina a terminální poločas je 13 hodin. Vazba fentanylu na plazmatické bílkoviny je 80 až 85 %. Hlavní vazebním proteinem je alfa-1 kyselý glykoprotein, ale albumin i lipoproteiny do určité míry přispívají. Volná frakce fentanylu se zvyšuje u acidózy.
Průměrný distribuční objem fentanylu v ustáleném stavu je 6 l/kg, průměrná clearance je 53 l/hodinu. Biotransformace
Fentanyl je metabolizován převážně v játrech na norfentanyl izoformou CYP3A4. Norfentanyl není ve studiích na zvířatech farmakologicky aktivní. Více než 90 % podané dávky fentanylu se eliminuje biotransformací na N-dealkylované a hydroxylované neaktivní metabolity. Nezdá se, že by byl transdermálně aplikovaný fentanyl metabolizován kůží.
Eliminace
Přibližně 75 % fentanylu je vylučováno močí, převážně ve formě metabolitů s méně než 10 % léčivé látky v nezměněné formě. Přibližně 9 % podané dávky se objeví ve stolici, převážně jako metabolity. Celková clearance fentanylu v plazmě po intravenózním podání je přibližně 42 l/hodinu.
Linearita/nelinearita
Proporcionalita dávky byla prokázána v rozmezí 25 až 60 mikrogramů na dávku.
Žádný ze čtyř studovaných demografických faktorů [hmotnost (štíhlí/obézní), věk, rasa nebo pohlaví] neměl signifikantní vliv na expozici (AUC) léčivé látce po použití systému IONSYS.
Farmakokinetický/farmakodynamický vztah
Minimální účinné analgetické sérové koncentrace fentanylu u pacientů dosud neléčených opioidy pro akutní pooperační bolest jsou v rozmezí 0,2-1,2 ng/ml. Frekvence nežádoucích účinků se zvyšuje při sérových hladinách nad 2 ng/ml.
Pacienti s genetickým polymorfismem postihujícím CYP3A4 a CYP3A5
Publikovaná literatura ukázala, že jednonukleotidový polymorfismus CYP3A4*22 a CYP3A5*3 ovlivňuje metabolismus fentanylu na norfentanyl s potenciálním zvýšením expozice fentanylu u pacientů s tímto genetickým polymorfismem. Literatura ukazuje, že genetický polymorfismus se podílí pouze na malé variabilitě koncentrací fentanylu s transdermálním podáním. Další publikovaný článek u 52 starších japonských pacientů po operaci, kteří dostávali kontinuální intravenózní (i.v.) infuzi fentanylu (0,5 - 1,5 pg/kg/h), ukázal zvýšenou expozici u skupiny CYP3A5*3 (3*/3*) proti skupině nosičů 1*. Klinická relevance není z těchto publikovaných článků známá, je však nutná opatrnost při používání systému IONSYS u pacientů s genetickými polymorfismy CYP3A4 a CYP3A5 (viz bod 4.4).
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka.
Standardní studie reprodukční a vývojové toxicity byly provedeny za použití parenterální aplikace fentanylu. Ve studiích na potkanech neovlivnil fentanyl fertilitu samců. Studie u samic potkanů odhalily snížení fertility a zvýšení embryonální mortality.
Účinky na embryo byly způsobeny toxicitou pro matku a ne přímým účinkem látky na vyvíjející se embryo. Ve studiích na dvou zvířecích druzích (potkanech a králících) nebyly zjištěny projevy teratogenního účinku. Ve studiích zaměřených na pre- a postnatální vývoj mláďat došlo k významnému poklesu přežití v dávkách, které mírně snížily hmotnost matek. Tento účinek by mohl být způsoben buď zhoršenou péčí matky nebo přímým účinkem fentanylu na mláďata. Vliv na somatický vývoj a behaviorální aktivitu mláďat nebyl pozorován.
Testování mutagenity na bakteriích a hlodavcích přineslo negativní výsledky. Fentanyl indukuje mutagenní účinky u savčích buněk in vitro, které jsou srovnatelné s jinými opioidními analgetiky. Mutagenní riziko terapeutických dávek se zdá být nepravděpodobné, protože se účinky projevují pouze při vysokých koncentracích.
Studie karcinogenity (denně podkožní injekce fentanyl hydrochloridu po dobu dvou let u potkanů Sprague Dawley) nevedly k žádným nálezům svědčícím o onkogenním potenciálu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Spodní část systému:
- spodní pouzdro : pegoterát
- anodový hydrogel: polakrilin, čištěná voda, hydroxid sodný, polyvinylalkohol
- katodový hydrogel: čištěná voda, chlorid sodný, dihydrát natrium citrátu, polyvinylalkohol, bezvodá kyselina citrónová, monohydrát cetylpyridinium-chloridu
- anodová elektroda: vrstvy ze stříbrné folie a elektricky vodivé adhezívní pásky katodová elektroda: vrstvy kompozitního materiálu z polyisobutenu/chloridu stříbrného/rostlinného uhlí, stříbrná folie a elektricky vodivé adhezivní pásky
- adhezívní vrstva na kůži: polybuten, polyisobuten a ester kalafuny
- ochranná vrstva: silikonizovaná pegoterátová fólie 75 um .
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
Použijte okamžitě po otevření.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25°C.
Chraňte před chladem nebo mrazem.
6.5 Druh obalu a obsah balení
Každý systém IONSYS je zabalen v tepelně zatavené misce. Miska obsahuje jeden řídící systém a jeden sáček obsahující lékovou jednotku. Folie sáčku je složena z vrstev nylonu, hliníkové folie a zatavené vrstvy kopolymeru polyethylenu a polymethakrylové kyseliny.
Každá miska je zabalena ve skládací papírové krabičce. V jedné krabičce je 6 kusů systému.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Kontakt s hydrogelem může být pro člověka nebezpečný. Pokud hydrogel obsahující fentanyl přijde do styku s kůží při aplikaci nebo odstraňování systému, uvedená oblast musí být omyta velkým množstvím vody. Mýdlo, alkohol nebo jiná rozpouštědla pro odstranění hydrogelu se nemají používat, protože mohou zvýšit schopnost léčivé látky penetrovat kůží.
Likvidace
Použitý systém IONSYS obsahuje nebezpečné množství fentanylu v červeném hydrogelovém pouzdře. Při odstraňování systému IONSYS z těla pacienta a během likvidace je nutno nosit rukavice.
S použitým systémem by se mělo zacházet opatrně ze stran a ze shora. Je třeba se vyhnout kontaktu s hydrogelem.
Konstrukce systému umožňuje oddělenou likvidaci hydrogelového pouzdra a řídící jednotky.
Při likvidaci použitého systému IONSYS:
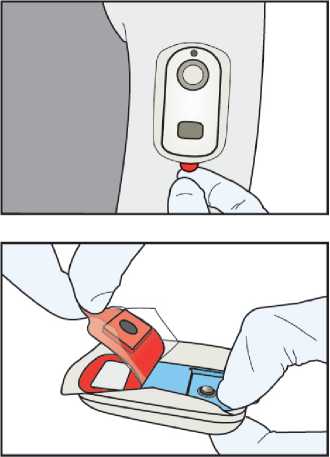
1. Držte řídící jednotku v jedné ruce a druhou rukou zatáhněte za červený štítek pro oddělení hydrogelového pouzdra ze systému.
2. Přeložte hydrogelové pouzdro v polovině lepicí stranou dovnitř.
3. Zlikvidujte složené hydrogelové pouzdro v souladu s místními požadavky na opioidní léčivé přípravky.
4. Zlikvidujte zbytek systému obsahujícího elektroniku podle nemocničních postupů pro likvidaci baterií.
Místní opatření musí být dodržována tak, aby bylo zajištěno, že jsou použité systémy správně vráceny (např. do nemocničních lékáren) k likvidaci reziduálního fentanylu v hydrogelu. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Incline Therapeutics Europe Ltd
21 St. Thomas Street
Bristol
BS1 6JS
Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/15/1050/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží Penn Pharmaceutical Services Ltd 23-24 Tafarnaubach Industrial Estate Tredegar
Gwent, South Wales NP22 3AA Velká Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na zvláštní lékařský předpis a lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelné aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky. Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
• Další opatření k minimalizaci rizik
Před uvedením systému IONSYS na trh v každém členském státě musí držitel rozhodnutí o registraci (MAH) odsouhlasit obsah a formát edukačního programu včetně komunikačních prostředků, distribučních modalit a jakýchkoliv dalších aspektů programu s národním regulačním orgánem.
Držitel rozhodnutí o registraci musí zajistit, že po diskuzi a dohodě s národními regulačními orgány v každém členském státě, kde je systém IONSYS uváděn na trh, budou všichni zdravotničtí pracovníci, kteří budou předepisovat, vydávat a aplikovat systém IONSYS, informováni prostřednictvím informačního letáku o možnosti přístupu k následujícím položkám nebo jim budou přímo poskytnuty:
• Souhrn údajů o přípravku (SPC) a příbalová informace
• Návod k použití a likvidaci systému IONSYS
• Edukační materiál (včetně kontrolního seznamu pro předepisujícího lékaře) pro zdravotnické
pracovníky
Edukační program zdravotnického pracovníka musí obsahovat následující klíčová sdělení:
• Informace o adekvátním použití produktu z hlediska chyb v podávání léku (včetně náhodné expozice), poruchy zařízení nebo jeho selhání, likvidace produktu a nesprávného použití, nadměrného užívání, zneužití, návyku a závislosti.
• Informace zdůrazňující, že je systém IONSYS patentovaný aplikátor určený pouze
k použití v nemocničním prostředí a že zdravotníci mají dodržovat standardní postupy pro monitorování pacientů používajících takové aplikátory.
• Informace pomáhající zdravotnickým pracovníkům ve výběru pacientů vhodných pro léčbu systémem IONSYS.
• Význam toho, aby zdravotník zajistil, že pacient porozumí, jak systém IONSYS funguje a že chápe, že pouze on/ona může stisknout dávkovací tlačítko během použití.
• Význam přečtení „Návodu k použití a likvidaci systému IONSYS“ včetně pokynů pro řešení potíží a zajištění, že pacient chápe, co má dělat v případě selhání aplikátoru anebo jeho špatné funkce.
• Kontrolní seznam pro sledování likvidace produktu, aby bylo zajištěno, že zdravotník rozumí nebezpečí nevhodné manipulace a náhodné expozice systému IONSYS.
PŘÍLOHA III
IONSYS 40 mikrogramů v jedné dávce transdermálního systému fentanylum
Jeden systém obsahuje fentanyli hydrochloridum odpovídající fentanylum 9,7 mg
Jeden systém uvolňuje 40 mikrogramů fentanylu v jedné dávce, maximálně 80 dávek (3,2 mg/24
hodin)
Přípravek obsahuje také glykolem modifikovaný polyethylen tereftalát, čištěnou vodu, hydroxid sodný, polakrilin, polyvinylalkohol, dihydrát natrium citrátu, bezvodou kyselinu citrónovou, monohydrát cetylpyridinium-chloridu, chlorid sodný, stříbrnou fólii, elektricky vodivou adhezivní pásku (ECAT), polyisobutylen/chlorid stříbrný/ rostlinné uhlí, polybuten, polyisobutylen, ester kalafuny, polyester potahovaný na jedné straně silikonem.
6 transdermálních systémů
Před použitím si přečtěte příbalovou informaci.
Transdermální podání
Nepoužívejte, pokud jsou víčko na zásobníku nebo sáček obsahující lékovou jednotku porušené nebo poškozené.
Uchovávejte mimo dohled a dosah dětí.
Použitelné do:
Použijte okamžitě po otevření.
Uchovávejte při teplotě do 25 °C Chraňte před chladem nebo mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po použití zůstává v systému potenciálně nebezpečné množství fentanylu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Incline Therapeutics Europe Ltd
21 St. Thomas Street
Bristol
BS1 6JS
Velká Británie
EU/1/15/1050/001
č.S.
Nevyžaduje se - odůvodnění přijato
IONSYS 40 mikrogramů v jedné dávce transdermálního systému
fentanylum
transdermální podání
Před použitím si přečtěte příbalovou informaci.
Použitelné do:
č.S.
80 dávek
Tento zásobník obsahuje: 1 léková jednotka 1 řídicí jednotka
Nepoužívejte, pokud jsou víčko na zásobníku nebo sáček obsahující lékovou jednotku porušené nebo poSkozené
Uchovávejte při teplotě do 25°C.
Chraňte před chladem nebo mrazem.
Další informace o likvidaci viz příbalovou informaci.
IONSYS 40 mikrogramů v jedné dávce transdermálního systému
fentanylum
transdermální podání
Použitelné do:
Použijte okamžitě po otevření.
c.s.
80 dávek
Další informace o likvidaci viz příbalovou informaci. Roztrhněte v místě zářezu.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU SYSTÉM IONSYS_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Systém IONSYS fentanylum
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
4. ČÍSLO ŠARŽE
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
IONSYS 40 mikrogramů v jedné dávce transdermálního systému
fentanylum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo sestry.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je ION SYS a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek IONSYS používat
3. Jak se IONSYS používá
4. Možné nežádoucí účinky
5. Jak IONSYS uchovávat
6. Obsah balení a další informace
1. Co je IONSYS a k čemu se používá
Co je systém IONSYS
IONSYS je transdermální systém (aplikovaný na neporušenou kůži), který obsahuje silné analgetikum (lék na bolest) nazývané fentanyl.
Na co se systém IONSYS používá
IONSYS se používá k léčbě krátkodobé středně silné až silné bolesti u dospělých po operaci. IONSYS se používá pouze v nemocnici.
Jak IONSYS působí
IONSYS je malé zařízení, které se aplikuje na kůži horní části paže nebo hrudníku. Působí tak, že dodává fentanyl přes vaši kůži a poskytuje úlevu od bolesti.
Pokud se nebudete cítit lépe nebo pokud se Vám přitíží, musíte se poradit s lékařem.
2. Čemu musíte věnovat pozornost, než začnete IONSYS používat Nepoužívejte IONSYS:
• jestliže jste alergický(á) na fentanyl nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• jestliže trpíte závažnými dechovými problémy nebo cystickou fibrózou.
Upozornění a opatření
Před užitím systému IONSYS se poraďte se svým lékařem nebo zdravotní sestrou
• jestliže máte závažné nebo přetrvávající plicní onemocnění nebo jakékoliv dechové problémy.
• jestliže máte velmi pomalou srdeční akci, nízký krevní tlak nebo jiné závažné srdeční problémy.
• jestliže máte problémy s játry nebo ledvinami.
• jestliže máte silné bolesti hlavy, utrpěli jste závažné poranění hlavy nebo máte nádor mozku.
• jestliže máte jakékoliv potíže se sluchem, protože budete muset být schopni slyšet pípnutí zařízení, abyste zjistili, že pracuje správně nebo pokud je to problém.
• jestliže máte abnormálně pomalou pohyblivost střev nebo těžký průjem.
• jestliže jste měli v minulosti operaci hrudníku nebo horní části dutiny břišní.
• jestliže jste velmi obézní nebo trpíte stavem, který se označuje jako spánková apnoe, která způsobuje přerušované dýchání během spánku a který se může objevit u velmi obézních jedinců.
Důležité informace, které je třeba vzít v úvahu
IONSYS se má odstranit před určitými zákroky, jako je kardioverze (elektrický proud používaný k obnově normálního srdečního rytmu), defibrilace (elektrický šok aplikovaný do srdce) nebo diatermie (elektrický proud používaný pro fyzikální terapii nebo chirurgii). IONSYS se má odstranit před provedením magnetického rezonančního zobrazení (MRI), RTG vyšetření nebo CT vyšetření.
Pokud jste někdy zneužíval(a) léky, informujte svého lékaře.
Pokud máte genetické onemocnění (polymorfismus), který postihuje určité enzymy ve vašem těle (CYP3A4 a CYP3A5), informujte svého lékaře.
Pokud jste starší pacient, váš lékař vás bude pečlivě sledovat, protože systém IONSYS vás může ovlivnit více, než mladšího pacienta.
Děti a dospívající
IONSYS se nedoporučuje používat u dětí a dospívajících mladších 18 let vzhledem k nedostatku údajů u těchto pacientů.
Další léčivé přípravky a IONSYS
Informujte svého lékaře nebo sestru o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat. Některé léky mohou ovlivnit funkci systému IONSYS nebo mohou zvýšit pravděpodobnost, že se u vás vyskytnou nežádoucí účinky. Informujte svého lékaře, pokud:
• užíváte léky, které by mohly způsobit ospalost, jako jsou tablety na spaní, léky na uklidnění, léky na úzkost nebo léky na alergie (antihistaminika).
• užíváte léky na uvolnění svalového napětí (předepsané na bolesti zad) nebo pokud podstupujete celkovou anestézii.
• užíváte léky k léčbě HIV infekce (jako je ritonavir, nelfinavir, amprenavir nebo fosamprenavir).
• užíváte léky na plísňové infekce (jako je ketokonazol, itrakonazol nebo flukonazol).
• užíváte léky na bakteriální infekce (jako je troleandomycin, klarithromycin nebo erytromycin).
• užíváte léky, které se používají k léčbě nevolnosti a zvracení (jako je aprepitant).
• užíváte léky, které se používají k léčbě vysokého krevního tlaku a srdečních problémů (jako je diltiazem a verapamil).
• užíváte léky proti bolesti označované jako parciální agonisté, jako je buprenorfin, nalbufin, pentazocin.
• užíváte léky na depresi označované jako inhibitory monoaminooxidázy (IMAO). Informujte svého lékaře nebo sestru, pokud jste je užili během posledních 14 dnů před použitím systému IONSYS.
• užíváte léky pro místní podání (tj.léky, které jste aplikovali na kůži).
IONSYS s jídlem, pitím a alkoholem
Nepijte alkohol ani grapefruitovou šťávu, pokud nosíte systém IONSYS, protože to může zvyšovat riziko vzniku závažných nežádoucích účinků.
Těhotenství a kojení
Musíte informovat svého lékaře před použitím systému IONSYS, pokud jste těhotná nebo plánujete otěhotnět. Váš lékař prodiskutuje možná rizika a potenciální přínosy používání systému IONSYS během vašeho těhotenství.
IONSYS se nemá používat během porodu. Pokud dostanete systém IONSYS během porodu, bude možná vaše dítě potřebovat po narození antidotum (protijed - látka s opačným účinkem). Dlouhodobá léčba fentanylem, léčivou látkou v systému IONSYS, může způsobovat abstinenční příznaky u novorozence.
Neužívejte přípravek IONSYS, pokud kojíte. Fentanyl může přecházet do mateřského mléka a může způsobovat nežádoucí účinky u kojeného dítěte. Neměla byste začít kojit dříve než 24 hodin po odstranění systému IONSYS.
Řízení dopravních prostředků a obsluha strojů
IONSYS může způsobovat pocit ospalosti, závratě nebo rozmazané vidění. Neřiďte, nepoužívejte stroje ani nástroje na pohon, když opustíte nemocnici, pokud se u vás vyskytnou jakékoliv z těchto nežádoucích účinků.
3. Jak se IONSYS používá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo sestry. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo sestrou, jak používat IONSYS nebo pokud zapomenete své instrukce.
Doporučená dávka
Jedna dávka systému IONSYS uvolňuje 40 mikrogramů fentanylu.
Vy kontrolujete svou vlastní léčbu pod dohledem vašeho lékaře nebo sestry v nemocnici. IONSYS aplikuje lék pouze v případě, pokud ho aktivujete, takže kontrolujete množství léku které dostáváte. Můžete si vzít dávku kdykoliv potřebujete bolest utišit nebo těsně před nějakou aktivitou, která může bolest zhoršit (jako je fyzikální léčba, vstávání z lůžka, atd.). Pokaždé, když dostanete nový systém IONSYS, zjistíte, že na začátku budete potřebovat více dávek k úlevě od bolesti než později během léčby.
Trvání léčby
Každý systém IONSYS působí po dobu jednoho dne (24 hodin) a obsahuje 80 dávek. IONSYS přestane působit po jednom dni (24 hodin) nebo po aplikaci 80 dávek, dle toho, co nastane dřív. Zelené světlo se vypne a bude blikat množství aplikovaných dávek. Poté není možné aplikovat žádné další dávky a systém IONSYS vám lékař nebo sestra odstraní.
Váš lékař nebo sestra odstraní systém IONSYS předtím, než opustíte nemocnici. Po odstranění systému IONSYS mohou zůstat malé načervenalé značky na vaší kůži. To je časté a nemusíte se bát. Červená oblast ustoupí během několika dnů až týdne.
Použití systému IONSYS
• Nenechejte svou rodinu ani přátele spouštět systém IONSYS místo vás. Pouze vy znáte sílu bolesti a pouze vy byste měl(a) obsluhovat systém IONSYS pro podání dávky léku. Abyste se ujistili, že dostáváte správné množství léku, stiskněte IONSYS jakmile začnete pociťovat bolest.
• Nedotýkejte se lepivé strany systému IONSYS. Tato strana systému obsahuje materiál označovaný jako „gely“, s nimiž byste za normálních okolností neměli přijít do styku. Polknutí nebo dotek těchto gelů může způsobit život ohrožující dechové potíže nebo smrt, dokonce i když jste přestali užívat systém a byl odstraněn. Zabraňte kontaktu gelů s vašimi ústy nebo očima.
• Pokud se náhodně dotknete těchto gelů na vnitřní straně systému:
- Informujte okamžitě sestru nebo lékaře
- Opláchněte si své ruce velkým množstvím vody
- Nepoužívejte mýdlo, alkohol nebo jiná rozpouštědla pro odstraňování gelů, protože mohou zvyšovat schopnost léku pronikat přes kůži.
• Lékař nebo sestra aplikují systém IONSYS na vaši kůži a odstraní ho nebo ho vymění, pokud to bude potřeba. Nechejte pouze lékaře nebo sestru aplikovat nebo odstraňovat systém IONSYS.
- Nesundávejte si ho sami ani se ho nepokoušejte zpět aplikovat.
- Nenechejte systém IONSYS namočit, protože by mohl přestat fungovat nebo by mohl odpadnout.
Jak se IONSYS používá
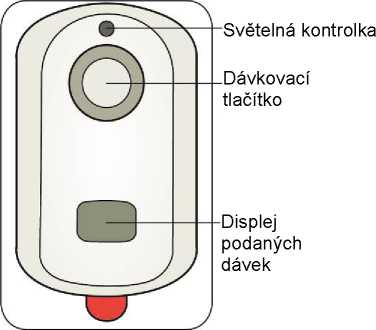
• Lékař nebo sestra připraví systém IONSYS k použití a připevní ho na vaši horní zevní část paže nebo na hrudník.
• Pomalé blikání zeleného světla znamená, že je systém IONSYS připraven k podání dávky.
• Pro aplikaci dávky ze systému IONSYS stiskněte a uvolněte dávkovací tlačítko dvakrát během 3 sekund. O zahájení aplikace dávky se dozvíte, jakmile uslyšíte pípnutí.
- O podávání dávky budete informováni rychlým blikáním zeleného světla.
• Každá dávka bude podávána po dobu 10 minut. Systém IONSYS bude ignorovat další stisknutí tlačítka během těchto 10 minut podávání.
• O dokončení 10 minutového dávkovacího období se dozvíte tím, že rychle blikající zelené světlo se znovu zpomalí.
Digitální displej bude ukazovat počet dávek, které byly aplikovány.
• Systém IONSYS je připraven k opakovanému použití a můžete zahájit podání další dávky kdykoliv to budete potřebovat. Tlačítko však stiskněte jen v případě, že potřebujete ulevit od bolesti.
Uslyšíte jedno pípnutí systému IONSYS pokaždé, když zahájíte podání dávky. Pokud pípne někdy jindy, nebo více než jednou, informujte okamžitě svého lékaře nebo sestru. Provedou kontrolu, zda systém IONSYS funguje správně.
Jestliže jste užil(a) více přípravku IONSYS, než jste měl(a):
Systém IONSYS je navržen tak, abyste ho nemohli používat příliš moc, za předpokladu že ho používáte sami a že ho používáte pouze v případě, kdy potřebujete úlevu od bolesti.
Pokud použijete systém IONSYS více, než byste měl(a), může se u vás vyskytnout dušnost, potíže s dýcháním, rychlé a povrchní dýchání nebo pocit na omdlení. Pokud se u vás vyskytnou jakékoliv z těchto příznaků, okamžitě informujte svého lékaře nebo sestru.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud máte pocit na omdlení nebo potíže s dýcháním při léčbě systémem IONSYS, informujte okamžitě lékaře nebo sestru.
Při použití systému IONSYS mohou nastat následující nežádoucí účinky:
Velmi časté (postihují více než 1 z 10 osob)
• pocit na zvracení (nauzea), zvracení
• zarudnutí kůže v místě náplasti
Časté (mohou postihovat až 1 z 10 osob)
• závratě
• bolest hlavy
• svědění kůže
• nízký krevní tlak
• potíže se spánkem
• zácpa, bolesti břicha
• modrá barva kůže (rty a špičky prstů)
• otok, svědění, podráždění nebo puchýře na kůži v místě náplasti
• neschopnost močit
• horečka
Méně časté (mohou postihovat až 1 ze 100 osob)
• návaly horka
• anemie (nízký počet červených krvinek)
• snížená chuť k jídlu
• úzkost
• abnormální sny nebo halucinace (vidění nebo slyšení věcí, které neexistují)
• pocit zmatenosti nebo agitovanosti
• silné bolesti hlavy (migréna)
• nervozita
• brnění
• ospalost
• rozmazané vidění
• bledost, pocit nízké energie nebo únavy
• rychlá nebo nepravidelná srdeční akce
• dušnost nebo přerušované dýchání
• kašel, škytavka
• vyrážka
• nadměrné pocení
• omdlévání
• suchost v ústech
• méně časté močení než je obvyklé
• poruchy trávení
• odchod plynů, obtížný odchod stolice
• zimnice
• bolesti zad, bolesti paží nebo končetin
• bolesti, hrbolky nebo suchá kůže v místě náplasti
• vysoký krevní tlak
• pokles krevního tlaku při vstávání
• zpomalená činnost střev
• zpomalené dýchání
• tělesné bolesti
Vzácné (mohou postihovat až 1 z 1 000 osob)
• kýchání, svědění nebo ucpaný nos nebo rýma
• nízká hladina vápníku / cukru / draslíku v séru
• deprese, abnormální myšlenky
• narušené vnímání chuti
• snížení vnímání doteku nebo citu
• závrať
• pomalý srdeční rytmus
• onemocnění plic
• tlak nebo napětí svalů, svalové bolesti
• bolesti při močení
• bolesti na hrudi, pocit celkového nepohodlí nebo neklidu
• brnění, píchání, otok nebo bolesti v místě aplikace systému IONSYS
• komplikace hojení rány
• zadržování tekutin/otok těla
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak IONSYS uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce nebo štítku na zásobníku či sáčku za „Použitelné do“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 25 °C.
Chraňte před chladem nebo mrazem.
Nemocniční personál bude uchovávat systém IONSYS. Použitý systém IONSYS zlikviduje zdravotnický personál.
6. Obsah balení a další informace Co systém IONSYS obsahuje
Léčivou látkou v systému IONSYS je fentanyl hydrochlorid. Jeden systém IONSYS obsahuje fentanyli hydrochloridum odpovídající fentanylum 9,7 mg a dodává 40 mikrogramů fentanylu v jedné dávce, maximálně 80 dávek (3,2 mg/24 hodin).
Dalšími složkami jsou: spodní pouzdro : pegoterát
anodový hydrogel: polakrilin, čištěná voda, hydroxid sodný, polyvinylalkohol
katodový hydrogel: čištěná voda, chlorid sodný, dihydrát natrium citrátu, polyvinylalkohol, bezvodá
kyselina citrónová, monohydrát cetylpyridinium-chloridu
anodová elektroda: vrstvy ze stříbrné folie a elektricky vodivé adhezívní pásky
katodová elektroda: vrstvy kompozitního materiálu z polyisobutylenu/chloridu stříbrného/rostlinného
uhlí, stříbrná folie a elektricky vodivé adhezivní pásky
adhezivní vrstva na kůži: polybuten, polyisobutylen a ester kalafuny
ochranná vrstva: silikonizovaná pegoterátová fólie 75 um
Jak IONSYS vypadá a co obsahuje toto balení
Systém IONSYS je transdermální systém a je tvořen elektronickým řídícím prvkem (horní část pouzdra) a lékovou jednotkou (červená spodní část pouzdra). Řídící jednotka je tvořena bílým plastem s identifikátorem „IONSYS“ a má digitální displej, světelnou kontrolku a dávkovací tlačítko. Léková jednotka je modrá na straně, která se připojuje k řídící jednotce a má červené spodní pouzdro obsahující hydrogely, z nichž jeden obsahuje fentanyl hydrochlorid.
Jedna krabička systému IONSYS obsahuje 6 systémů.
Držitel rozhodnutí o registraci
Incline Therapeutics Europe Ltd
21 St. Thomas Street
Bristol
BS1 6JS
Velká Británie
Tel: +44 (0)800 587 4149 or +44 (0)203 684 6344 Email: medical.information@themedco.com
Výrobce
Penn Pharmaceutical Services Ltd 23-24 Tafarnaubach Industrial Estate Tredegar
Gwent, South Wales NP22 3AA Velká Británie
Tato příbalová informace byla naposledy revidována MM/RRRR Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky (EMA): http://www.ema.europa.eu.
Informace pro zdravotníky: Návod pro použití a likvidaci
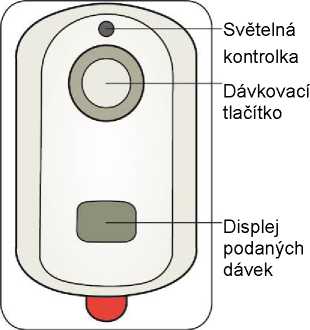
Systém IONSYS (fentanyl 40 mikrogramů v jedné dávce transdermálního systému, maximálně 80 dávek (3,2 mg/24 hodin)).
Pouze k jednorázovému použití.
Systém IONSYS se nemá používat, pokud jsou víčko zásobníku nebo sáček obsahující lékovou jednotku porušené nebo poškozené.
Systém IONSYS bude fungovat 24 hodin po aplikaci systému nebo pro 80 dávek, podle toho, co nastane dříve a pak se stane nefunkční.
Viz souhrn údajů o přípravku (SPC), kde jsou uvedeny další informace o systému IONSYS.
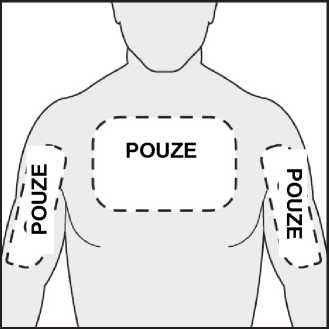
• Pouze 1 systém IONSYS se má aplikovat v jeden okamžik.
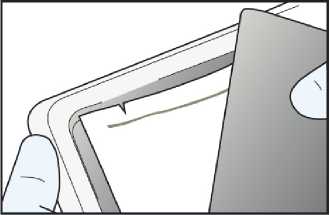
• Zvolte si zdravou a nepoškozenou kůži (nepodrážděnou a neozářenou kůži) na POUZE hrudníku a horní zevní části paže. Systém IONSYS nesmí být umístěn na abnormálních místech kůže, jako jsou jizvy, popáleniny, tetování nebo na kůži, na které byly použity lokální léky.
• Nadměrné množství ochlupení v místě aplikace je třeba před aplikací zasvorkovat (nikoliv oholit, protože to může podráždit kůži). IONSYS se nemá aplikovat na dříve použité místo na kůži.
• Místo určené k aplikaci má být ošetřeno standardním alkoholovým tamponem a kůže má před aplikací systému IONSYS úplně oschnout. K očištění místa aplikace se nemají používat žádná mýdla, oleje, pleťová mléka nebo jakékoli jiné prostředky, které mohou podráždit kůži nebo narušit její absorpční schopnost.
• Při výměně systému IONSYS musí být aplikován nový systém na odlišná místa na hrudníku nebo horní zevní části paže.
2. Sestavení systému IONSYS
Dokončete kroky před aplikací systému IONSYS na pacienta:
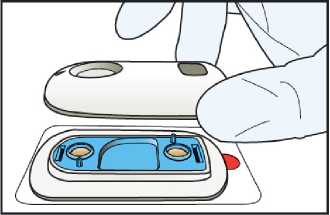
• Při sestavení systému IONSYS a při jeho manipulaci se mají používat rukavice. Otevřete zásobník odlepením jeho víčka. Vyjměte sáček a řídící jednotku. Otevřete sáček obsahující lékovou jednotku v naříznuté části a dále opatrně odtrhněte vrchní část sáčku.
• Vyjměte lékovou jednotku ze sáčku a umístěte ji na tvrdý a rovný povrch.
• Srovnejte odpovídající tvary řídicí jednotky a lékové jednotky a silně zatlačte tyto dvě části dohromady na obou koncích.
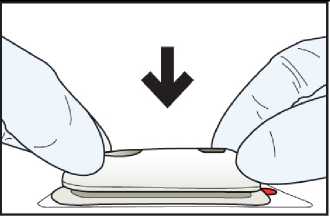
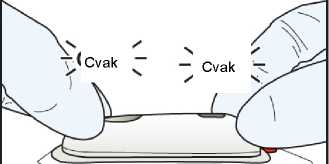
Po sestavení provede digitální displej řídicí jednotky krátký autotest, během něhož se ozve zvukové pípnutí, červené světlo jednou zabliká a na digitálním displeji bude blikat číslo „88“ Na konci autotestu bude displej ukazovat číslo „0“ a bude pomalu blikat zelené světlo, které bude ukazovat, že je systém IONSYS připraven k aplikaci.
• Odstraňte a vyhoďte čirou plastovou folii, která kryje lepivou vrstvu. Dávejte pozor, abyste se nedotkli hydrogelů.
Přitiskněte systém IONSYS silně lepicí plochou na kůži hrudníku nebo horní části paže pacienta po dobu nejméně 15 sekund. Tlak se má vést prsty po zevním okraji systému tak, aby byla zaručena adheze k místu na kůži. Nestlačujte dávkovači tlačítko.
Pokud se kdykoli během užívání systém IONSYS uvolní z kůže, může být k zajištění plného kontaktu okrajů s kůží použita hypoalergenní náplast. Při aplikaci náplasti je třeba dbát na to, abyste nepřelepili světelnou kontrolku, digitální displej nebo dávkovací tlačítko.
Každý systém IONSYS je možné používat po dobu 24 hodin od prvního sestavení nebo do aplikace 80 dávek, dle toho, co je dřív. Systém IONSYS se pak vypne a nebude dodávat žádné další dávky. Pokud je nutná dodatečná opioidní analgezie, je třeba po odstranění a likvidaci předchozího systému IONSYS aplikovat nový systém IONSYS na jiné místo na kůži.
Pacienti nemají mít současně na těle více než jeden systém IONSYS. Použitý systém IONSYS se nemá znovu aplikovat na pacienta.
4. Instrukce pacienta, jak používat systém IONSYS
Pamatujte si, že pouze pacient se může dotýkat dávkovacího
tlačítka. Řekněte svému pacientovi následující:
• Pomalé blikání zeleného světla znamená, že je systém IONSYS připraven k podání dávky.
• Pro aplikaci dávky stiskněte a uvolněte dávkovací tlačítko dvakrát během 3 sekund. Při úspěšném zahájení dávky uslyšíte jedno pípnutí.
• O podávání dávky se dozvíte, když uvidíte rychle blikající zelené světlo.
• Systém IONSYS bude ignorovat další stisknutí tlačítka během 10 minut podávání.
• O dokončení 10minutové dávky se dozvíte, jakmile se rychlé
Viz také pokyny uvedené v SPC v bodě 6.6.
• Při odstraňování systému IONSYS z kůže se musí používat rukavice a přijmout taková opatření, aby nedošlo ke kontaktu s hydrogely. Pokud dojde při odstraňování ke kontaktu hydrogelu s fentanylem s kůží, kontaktní plocha musí být důkladně opláchnuta vodou bez použití mýdla.
• Systém IONSYS může být kdykoliv odstraněn. Jakmile však byl systém jednou odstraněn, nemá se stejný systém IONSYS znovu použit.
• Na konci 24 hodin použití nebo po aplikaci 80 dávek odstraňte systém IONSYS jemným zvednutím červeného štítku a uvolněním z kůže na místě aplikace. Pokud pacient potřebuje dodatečnou nebo pokračující léčbu bolesti, může být aplikován nový systém IONSYS na nové místo na kůži na horní zevní části paže nebo na hrudníku.
• Držte řídící jednotku v jedné ruce a druhou rukou zatáhněte za červený štítek pro oddělení hydrogelového pouzdra ze systému.
• Přeložte hydrogelové pouzdro v polovině lepicí stranou dovnitř.
• Zlikvidujte složené hydrogelové pouzdro v souladu s místními požadavky na opiátové léčivé přípravky.
• Zlikvidujte zbytek systému obsahujícího elektroniku podle nemocničních postupů pro likvidaci baterií.

Řešení potíží se systémem IONSYS
Každý systém IONSYS je navržen až pro 80 podání 10minutových dávek fentanylu po dobu 24 hodin. Níže uvedená tabulka představuje různé chybové zprávy, které se mohou objevit, společně s pravděpodobnou příčinou a nutným opatřením.
Chybové hlášení / zpětná vazba
Bez světla

Displej prázdný
Pravděpodobná příčina
Vybitá baterie nebo chyba systému
Nutné opatření_
1. Nepoužívejte systém.
2. Zlikvidujte systém dle kroku 5 výše -Odstranění a likvidace systému IONSYS.
3. Umístěte nový systém na jiné místo na
kůži.
Špatný kontakt s 1.
pokožkou
2.
3.
|
Bliká červeně 15 sekund | |||
|
/ |
yk ÍO |
Pípání po dobu 15 sekund | |
|
Stálé | |||
|
r |
číslo | ||
Systém IONSYS není dobře přilepený
Pokud se zdá systém IONSYS uvolněný nebo pokud se zvedá od kůže, upevněte ho ke kůži pacienty silným zatlačením okrajů nebo aplikací hypoalergenní pásky.
Pokud používáte pásku, aplikujte ji podél okrajů systému IONSYS a nezakrývejte dávkovací tlačítko ani displej.
Pokud systém znovu pípne, odstraňte jej a zlikvidujte a umístěte nový systém na jiné místo na kůži.

Oblepte páskou po okrajích
Systémová chyba
Bliká červeně
—Kontinuální pípání


Stálé
číslo
3
4.
Odstraňte systém z těla pacienta.
Přidržte dávkovací tlačítko, dokud se zvukový signál nevypne a displej nezhasne.
Zlikvidujte systém dle kroku 5 výše -Odstranění a likvidace systému IONSYS. Umístěte nový systém na jiné místo na
kůži.
Konec použití po 24 hodinách nebo 80 dávkách
Bez světla
Nepípá Blikající číslo
1. Odstraňte systém z těla pacienta.
2. Přidržte dávkovací tlačítko, dokud displej nezhasne.
3. Zlikvidujte systém dle kroku 5 výše -Odstranění a likvidace systému IONSYS.
4. Umístěte nový systém na jiné místo na kůži.
Pokud má zdravotnický pracovník podezření na selhání zařízení nebo na poruchu, měl by se systém IONSYS okamžitě odstranit z těla pacienta a ihned je třeba kontaktovat společnost The Medicines Company.
Zdravotnický pracovník se musí ujistit, že pacient chápe, že v případě podezření na selhání zařízení nebo poruchy musí neprodleně informovat zdravotnického pracovníka.
41